IMM.L (MKap $85 M) Multiple Blockbuster Kandidat kurz vor final P3 Daten (1Q 2018) - 500 Beiträge pro Seite (Seite 3)
eröffnet am 10.05.17 14:44:50 von
neuester Beitrag 02.04.24 14:20:49 von
neuester Beitrag 02.04.24 14:20:49 von
Beiträge: 1.656
ID: 1.252.583
ID: 1.252.583
Aufrufe heute: 6
Gesamt: 222.667
Gesamt: 222.667
Aktive User: 0
ISIN: GB0033711010 · WKN: A0BMC4 · Symbol: 25I
0,0160
EUR
0,00 %
0,0000 EUR
Letzter Kurs 08:09:39 Frankfurt
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,5800 | +54,90 | |
| 233,65 | +11,77 | |
| 36,00 | +11,46 | |
| 490,00 | +10,71 | |
| 50,77 | +10,49 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3,1900 | -15,16 | |
| 16,100 | -15,26 | |
| 0,5150 | -31,33 | |
| 29,21 | -33,60 | |
| 79,70 | -45,37 |
Antwort auf Beitrag Nr.: 58.086.412 von bio-profi am 28.06.18 11:53:21
Denkst du das wird heute noch passieren?
Hat jemand mehr Infos?
"ImmuPharma PLC (LSE:IMM), ("ImmuPharma" or the "Company"), the specialist drug discovery and development company, held its AGM earlier today and is pleased to announce that all resolutions were duly passed."
https://www.investegate.co.uk/immupharma-plc--imm-/rns/resul…
https://www.investegate.co.uk/immupharma-plc--imm-/rns/resul…
Antwort auf Beitrag Nr.: 58.087.549 von boersenkeks am 28.06.18 13:37:01
Ok und jetzt :D?
Alle Beschlüsse sind verabschiedet heißt?
Jetzt warten wir halt auf Details 

Bericht von einem Teilnehmer:Went to AGM. Lasted 90 minutes. Over an hour Q and A session. Chairman made it clear that what their thinking had to be off limits-however grey area in middle of actual plans and possibilities was explored. Couple of guys incredibly well briefed on the science interrogated Zimmer and CEO on the science, the failure of phase 3, lessons which might have been learnt etc,etc. If they contribute to a BB you may learn more. Most of it way above my head. More interested in possible share value. Over 60 recruited to Open label trial. Results H2 (perhaps Q1) next year. 4 or 5 people in Phase 3 in complete remission at end of trial. Still getting trial data-expect all by end July. They were asked which of 2 alternatives they prefer. Doing phase 3 alone, with fund raising along the way (about 30 months from now ish to complete-cost £10/11m) or do do phase 3 in partnership. CEO said both were rational paths but he preferred an unspecified 3rd way. Which my guess is accelerated approval with concurrent phase 3 trial. They will be able to present to regulatory authorities without open label results-hoping for some time later this year. There are somewhere between about 4 and 8 parties they are talking to (not teens or low single figures!) They are possibly looking at Lupozor for other areas of unmet need. They say they are convinced that they have a drug to take to market which will meet high unmet need, is safe and cost effective. Pleased I went. However, was at Summit AGM recently-contrast their mood/attitude with that now! However, I am holding. If it comes off-could be a reasonable bagger from now.
Nabend,
Ich find nichts im Internet über die Hauptversammlung heute.
Da muss doch etwas zu berichten sein?!?!?
Oder gehen wireinfach zur Tagesordnung und warten weiter ab?!?!
Ich find nichts im Internet über die Hauptversammlung heute.
Da muss doch etwas zu berichten sein?!?!?
Oder gehen wireinfach zur Tagesordnung und warten weiter ab?!?!
Antwort auf Beitrag Nr.: 58.092.199 von bio-profi am 28.06.18 20:40:07https://uk.advfn.com/stock-market/london/immupharma-IMM/shar…
http://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM
Da gibts doch genug zum mitlesen wird bestimmt noch ein bißchen mehr kommen.
wird bestimmt noch ein bißchen mehr kommen.
http://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM
Da gibts doch genug zum mitlesen
 wird bestimmt noch ein bißchen mehr kommen.
wird bestimmt noch ein bißchen mehr kommen. wieso ist in ffm
kein handel mehr?
Aber über Tradegate wird noch gehandelt.
Moin zusammen,
der Kurs dümpelt vor sich hin
Tendenz nach unten
wenig Volumen
keine nenneswerte News von der Hauptversammlung
3 Monate nach Veröffentlichung der Ergebnisse, kein Licht am Ende des Tunnels???
Wie geht´s hier weiter????????
der Kurs dümpelt vor sich hin
Tendenz nach unten
wenig Volumen
keine nenneswerte News von der Hauptversammlung
3 Monate nach Veröffentlichung der Ergebnisse, kein Licht am Ende des Tunnels???
Wie geht´s hier weiter????????
Antwort auf Beitrag Nr.: 58.123.046 von bio-profi am 03.07.18 10:15:58Warten und hoffen ob da noch was daraus wird...ich denke aber da kommt noch was 

Auch wenn der Kurs noch nicht erfreulich ist, habe ich hier ein gutes Gefühl. Wie damals bei Ariad, war eine ähnliche Story.
Moin,
Bei Ariad war ich auch dabei! Bei zwei gekauft und dann bei 20 verkauft.
Ich hoffe das hier noch was kommt. Das warten ist echt anstrengend und es sind jetzt 3 Monate nach Bekanntgabe der Ergebnisse verstrichen. Eine Übernahme wäre für die Aktionäre das beste!
Bei Ariad war ich auch dabei! Bei zwei gekauft und dann bei 20 verkauft.
Ich hoffe das hier noch was kommt. Das warten ist echt anstrengend und es sind jetzt 3 Monate nach Bekanntgabe der Ergebnisse verstrichen. Eine Übernahme wäre für die Aktionäre das beste!
Moin, seit 11:24 kein HANDEL in London . Ist die Aktie vom Handel ausgesetzt. Ich habe keine Infos gefunden?!?!!!
Gruß.
Gruß.
Ein Kursziel für Immupharma lag im Februar noch bei 3,50€
Antwort auf Beitrag Nr.: 58.169.540 von Limmin am 09.07.18 14:40:18Der Artikel ist von Feb 2018. alter Hut!
Es ist hier echt ruhig geworden!
Das MM ist ich aktiv,in Sachen Antragstellung oder Verhandlungen oder es wird geschwiegen um dann von heute auf morgen die Bombe platzen zu lassen!
Es ist hier echt ruhig geworden!
Das MM ist ich aktiv,in Sachen Antragstellung oder Verhandlungen oder es wird geschwiegen um dann von heute auf morgen die Bombe platzen zu lassen!
Das Potential welches im Artikel beschrieben ist, ist aktueller denn je: Schätzungen zufolge leiden weltweit etwa fünf Millionen Menschen an Lupus und die Behandlung je Patient kostet in den USA etwa 12600 Dollar jährlich. Bisher scheint es aber auf dem Markt noch keine wirklich guten Medikamente gegen die Krankheit zu geben und Lupuzor von Immupharma könnte wirksame Abhilfe bringen. Würden sich nur zehn Prozent der Erkrankten behandeln lassen, dann hätte die Therapie ein jährliches Marktvolumen von etwa fünf Milliarden Dollar.
Die Rechnung sieht folgendermassen aus: Angenommen Lupuzor hätte einen Marktanteil von zehn Prozent und Immupharma würde das Produkt mit einem grossen Partner vertreiben. Bei einer Lizenzgebühr von 30 Prozent wären das 150 Millionen Dollar Lizenzgebühr pro Jahr für die Briten.
Die Rechnung sieht folgendermassen aus: Angenommen Lupuzor hätte einen Marktanteil von zehn Prozent und Immupharma würde das Produkt mit einem grossen Partner vertreiben. Bei einer Lizenzgebühr von 30 Prozent wären das 150 Millionen Dollar Lizenzgebühr pro Jahr für die Briten.
Antwort auf Beitrag Nr.: 58.170.584 von Limmin am 09.07.18 16:57:52Ja,du hast recht. Aus diesem Grund habe ich auch ständig nachgekauft wie viele andere auch.
3 Monate nach der Veröffentlichung den Zahlen sieht es nicht gut aus. Keine news von Verhandlungen oder Zulassungsanträgen!!!!
Geschweige von Gerüchten! Der Kurs fällt und fällt!
Warum ist kein Interesse vorhanden an dem Unternehmen, bei einer Market cap von ca 30 mio.
Das bezahlt ein big Player aus der Portokasse.
Ich glaube langsam müssen die investierten,es akzeptieren, dass lupuzor gescheitet ist!
Hoffentlich liege ich falsch?!?!
3 Monate nach der Veröffentlichung den Zahlen sieht es nicht gut aus. Keine news von Verhandlungen oder Zulassungsanträgen!!!!
Geschweige von Gerüchten! Der Kurs fällt und fällt!
Warum ist kein Interesse vorhanden an dem Unternehmen, bei einer Market cap von ca 30 mio.
Das bezahlt ein big Player aus der Portokasse.
Ich glaube langsam müssen die investierten,es akzeptieren, dass lupuzor gescheitet ist!
Hoffentlich liege ich falsch?!?!
Deine Bedenken sind gerechtfertigt. Aber ich kann mir nicht vorstellen, dass Lupuzor gescheitert ist. Dafür ist das Medikament zu gut, es gibt nichts vergleichbares am Markt, viele Patienten warten auf eine schnelle Markteinführung. Es dauert einfach ein wenig, ich rechne spätestens im Herbst mit einer richtungsweisenden News. Du kennst es ja noch von Ariad, hier war monatelang stille und dann kam die Übernahme. Seit wann bist du hier dabei?
Antwort auf Beitrag Nr.: 58.170.719 von bio-profi am 09.07.18 17:12:173 Monate sind in dem Geschäft nicht viel Zeit! Natürlich zahlt ein Big die 30 Mio aus der Portokasse. Nur ist Immu überhaupt schon auf dem Radar oder einfach zu unbekannt? Möchte man das Maximum raus holen und keinen überstürzten Deal? Besteht doch noch Hoffnung auf eine Zulassung und erst danach wird man versuchen noch viel besser zu verkaufen? Zumindest könnte man versuchen erst mal abzuklären, ob man dennoch Anträge auf Zulassung stellt. Dann noch das Sommerloch voraus, all das
wird Zeit brauchen und mir ist eine gut überlegte und bestmöglich gewinnbringende Strategie im Moment am liebsten. Ein weiterer Kursverfall wird zum kaufen genutzt, die Gewinnspanne nach oben steigt dadurch stetig und die Fallhöhe nach unten nimmt genauso stetig ab!
Das setzt natürlich voraus, man ist vom Erfolg von Lupuzor überzeugt, was ist nach wie vor bin!
Gruß aaahhh
wird Zeit brauchen und mir ist eine gut überlegte und bestmöglich gewinnbringende Strategie im Moment am liebsten. Ein weiterer Kursverfall wird zum kaufen genutzt, die Gewinnspanne nach oben steigt dadurch stetig und die Fallhöhe nach unten nimmt genauso stetig ab!
Das setzt natürlich voraus, man ist vom Erfolg von Lupuzor überzeugt, was ist nach wie vor bin!
Gruß aaahhh
Antwort auf Beitrag Nr.: 58.171.577 von aaahhh am 09.07.18 18:55:46Nachtrag;
Ich rechne übrigens mit einer überraschenden News,egal welchen Weg man einschlägt, die die Nichtinvestierten dann kalt erwischen wird, da wird im Vorfeld nicht viel kommen.
Gruß aaahhh
Ich rechne übrigens mit einer überraschenden News,egal welchen Weg man einschlägt, die die Nichtinvestierten dann kalt erwischen wird, da wird im Vorfeld nicht viel kommen.
Gruß aaahhh
Antwort auf Beitrag Nr.: 58.171.589 von aaahhh am 09.07.18 18:58:31Ich habe fünf mal nachgekauft und immer wieder ist die noch tiefer gefallen!!
Wer würde bei dem Niveau heute 21 gbx nachkaufen????
Wo ist der Boden??
Wer würde bei dem Niveau heute 21 gbx nachkaufen????
Wo ist der Boden??
Antwort auf Beitrag Nr.: 58.172.795 von bio-profi am 09.07.18 21:20:53Ich weiss nicht wieviel du jeweils gekauft hast, aber bei so vielen Nachkäufen sollte dein EK schon um die 0,5€ sein. Bei positiver News wird es egal sein ob man zu 0,3€ oder 0,5€ gekauft hat. Grün wird man in beiden Fällen sein.
Antwort auf Beitrag Nr.: 58.172.795 von bio-profi am 09.07.18 21:20:53ich habe das Gefühl, dass das zu stark investiert bist. Ansonsten wäre man nicht so fickerig. 
Es gibt noch viele andere Aktien, mit denen mit Spaß haben kann, solange man hier wartet.

Es gibt noch viele andere Aktien, mit denen mit Spaß haben kann, solange man hier wartet.

Was hat die heutige News zu Price Monitoring auf sich? http://www.immupharma.co.uk/investors/regulatory-news/
Hier ein interessanter Artikel über Lupus!
Die Nachfrage nach einem Medikament gegen Lupus ist so groß, dass sich jetzt private Investoren an Studien beteiligen.
Denke Immupharma hat gute Möglichkeiten lupuzor einzusetzen.
https://lupus.org/research-news/entry/major-lupus-stem-cell-…
Die Nachfrage nach einem Medikament gegen Lupus ist so groß, dass sich jetzt private Investoren an Studien beteiligen.
Denke Immupharma hat gute Möglichkeiten lupuzor einzusetzen.
https://lupus.org/research-news/entry/major-lupus-stem-cell-…
Antwort auf Beitrag Nr.: 58.185.554 von bio-profi am 11.07.18 11:54:11
Wenn Lupuor eine Zukunft hat, warum sollten die Investoren dann in ein anderes Medi investieren?
Scheint fast so das Lupuzor abgeschrieben wurde...
Zitat von bio-profi: Hier ein interessanter Artikel über Lupus!
Die Nachfrage nach einem Medikament gegen Lupus ist so groß, dass sich jetzt private Investoren an Studien beteiligen.
Denke Immupharma hat gute Möglichkeiten lupuzor einzusetzen.
Wenn Lupuor eine Zukunft hat, warum sollten die Investoren dann in ein anderes Medi investieren?
Scheint fast so das Lupuzor abgeschrieben wurde...

Antwort auf Beitrag Nr.: 58.217.613 von fleischkas am 15.07.18 13:37:14Hi . Sorry aber nach deiner Logik dürfte auch niemand mehr an neuen HIV oder Krebs Mitteln usw forschen . Was ist besser wie ein Medi das wirkt ? Ein Medi das wirkt und mir gehört ( Geld bringt ) . Des Weiteren will man ja Krankheiten komplett heilen können und das leistet halt Lupuzor eben nicht . Und man kann auch das beste Medi immer noch in irgendeiner Art und weise verbessern . Das soll jetzt nicht heißen das es nicht auch so sein kann wie du sagst . Nur die Herleitung ist halt nicht schlüssig . LG Jano
Antwort auf Beitrag Nr.: 58.218.435 von Jano82 am 15.07.18 17:32:58Genau das Gleiche hab ich auch gedacht beim lesen des posts!
Gruß aaahhh
Gruß aaahhh
Tja, nach dem Finale ist vor dem Finale - hier bleibt es weiter spannend.
Antwort auf Beitrag Nr.: 58.219.059 von Limmin am 15.07.18 20:30:47Ich teile die Meinung von juno im großen und ganzen.
Es ist doch offensichtlich, dass für ein Lupus Medikament die Nachfrage größer ist als das Angebot. Daher stürzen sich auch private Investoren auf diesen Sektor.
Dieser Zustand ist weiter positiv für Lupuzor!
Hier kommen noch weitere News in den nächsten Wochen / Monaten.
Bei the way, wann ist eigentlich die erweiterte Studie der Patienten zu Ende, die Lupuzor freiwillig sechs Monate weiter einnehmen wollten? Müsste doch bald zu Ende sein?
Bis bald.
Es ist doch offensichtlich, dass für ein Lupus Medikament die Nachfrage größer ist als das Angebot. Daher stürzen sich auch private Investoren auf diesen Sektor.
Dieser Zustand ist weiter positiv für Lupuzor!
Hier kommen noch weitere News in den nächsten Wochen / Monaten.
Bei the way, wann ist eigentlich die erweiterte Studie der Patienten zu Ende, die Lupuzor freiwillig sechs Monate weiter einnehmen wollten? Müsste doch bald zu Ende sein?
Bis bald.
Antwort auf Beitrag Nr.: 58.218.435 von Jano82 am 15.07.18 17:32:58
Schon klar, aber ich denke wenn Lupuzor in den Augen der Lupus Foundation eine Zukuft hätte (was ich hoffe da ich ja investiert bin), wäre es nicht sinnvoller alle Ressourcen in Lupuzor zu stecken um dessen Zulassung zu erwirken?
Logisch das weiterhin an weiteren, besseren Medis geforscht wird, aber wie gesagt, wenn Lupuzor erfolgversprechend ist würde ICH zuerst alles an dessen Zulasung setzen. DANN kann man ja weiter forschen wenn die Patienten erstmal bestmöglich versorgt sind, was sie mit dem SoC ja nicht wirklich sind...
Andererseits kann es genauso möglich sein das die Foundation davon ausgeht das Lupuzor zugelassen wird...
Man wird sehen...
Zitat von Jano82: Hi . Sorry aber nach deiner Logik dürfte auch niemand mehr an neuen HIV oder Krebs Mitteln usw forschen . Was ist besser wie ein Medi das wirkt ? Ein Medi das wirkt und mir gehört ( Geld bringt ) . Des Weiteren will man ja Krankheiten komplett heilen können und das leistet halt Lupuzor eben nicht . Und man kann auch das beste Medi immer noch in irgendeiner Art und weise verbessern . Das soll jetzt nicht heißen das es nicht auch so sein kann wie du sagst . Nur die Herleitung ist halt nicht schlüssig . LG Jano
Schon klar, aber ich denke wenn Lupuzor in den Augen der Lupus Foundation eine Zukuft hätte (was ich hoffe da ich ja investiert bin), wäre es nicht sinnvoller alle Ressourcen in Lupuzor zu stecken um dessen Zulassung zu erwirken?
Logisch das weiterhin an weiteren, besseren Medis geforscht wird, aber wie gesagt, wenn Lupuzor erfolgversprechend ist würde ICH zuerst alles an dessen Zulasung setzen. DANN kann man ja weiter forschen wenn die Patienten erstmal bestmöglich versorgt sind, was sie mit dem SoC ja nicht wirklich sind...
Andererseits kann es genauso möglich sein das die Foundation davon ausgeht das Lupuzor zugelassen wird...
Man wird sehen...
Antwort auf Beitrag Nr.: 58.223.433 von fleischkas am 16.07.18 13:43:28man sollte niemals alles auf eine Karte stecken...
Immupharma als potentieller Übernahmekandidat: https://mobile.twitter.com/smallcappick/status/1018823948929…
Antwort auf Beitrag Nr.: 58.223.454 von techinvestor69 am 16.07.18 13:47:34
Wieso kein Handel?
Wieso fande gestern bei Tradegate kein Handel statt ?
"T Cell Surface Glycoprotein CD4 Market research report reveals the effective ways to increase sale of T Cell Surface Glycoprotein CD4 in global and regional market. T Cell Surface Glycoprotein CD4 Market research is conducted for Forigerimod Acetate, HIV Vaccine 2, Ibalizumab, Others types and their major applications including application in Hiv, Aids, Gvhd, Sars, Others. These types are chosen based on their respective demand in mentioned applications and gross margin. the report also explains the reasons behind the success of major manufacturers, their manufacturing bases, geographic focus, product segment in focus along with strengths and weaknesses. The report considers Biotest AG, Bristol-Myers Squibb Co, CEL-SCI Corp, Fountain Biopharma Inc, Immupharma Plc as major manufacturers. Competitive analysis considering increase in gross margin, sales, avg. sales price, and capacity etc. shows different aspects of major players which also points out your competitive advantages over them. It also helps you to plan effective strategies."
https://ittechherald.com/2018/07/23/t-cell-surface-glycoprot…
https://ittechherald.com/2018/07/23/t-cell-surface-glycoprot…
Antwort auf Beitrag Nr.: 58.288.718 von boersenkeks am 24.07.18 14:54:24

Ist ja echt Preiswert ...
"Purchase Market report at $ 2900 (Single User Licence) "
Antwort auf Beitrag Nr.: 58.288.925 von HH-ahoi am 24.07.18 15:10:04 ?
?
Was denkt ihr?
Kommt hier noch was ? Hält hier noch jemand oder bin ich das letzte kleine Licht  ?
?
Antwort auf Beitrag Nr.: 58.290.290 von andilyncon am 24.07.18 17:15:13Solange hier noch die Chance auf eine zufriedenstellendes Ende besteht, bleibe ich dabei, deswegen hab ich ja gekauft.
Gruß aaahhh
Gruß aaahhh
Bleib auch drinne. Die Hoffnung siebt zuletzt.
Wir sind nun auf einem 10 Jahres tief! Mal schauen ob jetzt Schluss ist oder ob es gegen null geht!!!
Wir sind nun auf einem 10 Jahres tief! Mal schauen ob jetzt Schluss ist oder ob es gegen null geht!!!
Immupharma (LON:IMM) says it is in discussion with some pharmaceutical companies
http://www.smallcapnetwork.com/Immupharma-LON-IMM-says-it-is…
http://www.smallcapnetwork.com/Immupharma-LON-IMM-says-it-is…
Antwort auf Beitrag Nr.: 58.290.290 von andilyncon am 24.07.18 17:15:13Ich glimme auch noch fleissig weiter 

Denk wie aaaah, und mit 90% Verlust geh ich sicher nicht raus. Wie schonmal geschrieben, ob 9000 oder 10000 Euro weg sind ist total powidl...und die Hoffnung stirbt zuletzt


Denk wie aaaah, und mit 90% Verlust geh ich sicher nicht raus. Wie schonmal geschrieben, ob 9000 oder 10000 Euro weg sind ist total powidl...und die Hoffnung stirbt zuletzt
interessanter Artikel von boersenkeks. Aufhorchen lässt mich auch, dass nachwievor eine Markteinführung von Lupuzor für 2018 angepeilt ist. Die Frage ist aber auch wie vertrauenswürdig die Quelle ist. Dennoch sagt meine Glaskugel die Geduld wird sich hier lohnen. 

Leider sind das nur Meinungen oder Hoffnungen eines Redakteurs.
Laut meiner Meinung stehen die Chancen genau wie am 17 April 2018,
denn seit das wissen wir, dass lupuzor nicht die Erwartungen erfüllt hat.
Es heißt seit dem, dass mit big Pharma verhandelt wird.
Aber mehr wissen wir alle nicht! Finde es schade das vom MM nicht mehr kommt! Abwarten!
Laut meiner Meinung stehen die Chancen genau wie am 17 April 2018,
denn seit das wissen wir, dass lupuzor nicht die Erwartungen erfüllt hat.
Es heißt seit dem, dass mit big Pharma verhandelt wird.
Aber mehr wissen wir alle nicht! Finde es schade das vom MM nicht mehr kommt! Abwarten!
Leute Schwimmsachen anziehen. Wir tauchen ab!
Antwort auf Beitrag Nr.: 58.344.687 von Limmin am 31.07.18 19:39:06Durchwachsen der Report...aber das Plus im Kurs ist schon mal was :-)
Ob sich hier was andeutet?
Ob sich hier was andeutet?
Moin,
Der Kurs scheint seinen Boden um die 20 gefunden zu haben!
Gibt es von den probaten neue news? Ein Teil hatte je lupuzor freiwillig weiter eingenommen?!?
Gruß.
Der Kurs scheint seinen Boden um die 20 gefunden zu haben!
Gibt es von den probaten neue news? Ein Teil hatte je lupuzor freiwillig weiter eingenommen?!?
Gruß.
Ist zwar schon ein bisschen älter aber spricht an und für sich für Immupharma; 23.04.2018 09:00
Medizin • LupuzorTM: Phase-III-Studie erfolgreich
Marie de Chalup Wissenschaftliche Abteilung
Wissenschaftliche Abteilung, Französische Botschaft in der Bundesrepublik Deutschland
Die klinische Phase-III-Studie zu LupuzorTM wurde gerade erfolgreich abgeschlossen. Dieser Wirkstoffkandidat war bei 68,8% der Patienten wirksam, die bis zum Schluss der Testphase dabei waren. LupuzorTM ist damit das erste nicht immunsuppressiv wirkende Medikament gegen Lupus. Es wurde vom Forscherteam um Sylviane Muller vom Labor für Immunpathologie und therapeutische Chemie des französischen Zentrums für wissenschaftliche Forschung CNRS entwickelt und wurde bereits vom Unternehmen ImmuPharma Frankreich in klinischen Studien der Phasen I und II erfolgreich getestet. Es ist die erste Behandlung für diese Krankheit, die nicht nur die Symptome lindert, sondern auch ihr Fortschreiten eindämmt
Lupus ist eine unheilbare Krankheit, bei der das Immunsystem - dessen Aufgabe darin besteht, den Körper gegen Bedrohungen von außen zu verteidigen - sich nach innen wendet und gesundes Gewebe angreift und ganz normale Abläufe unterbindet. Bisher wurden bei der Behandlung Steroide und Immunsuppressiva eingesetzt. Erstere haben bei langzeitigem Gebrauch erhebliche Nebenwirkungen, letztere hemmen das gesamte Immunsystem und machen den Körper somit anfällig für Infektionen.
LupuzorTM unterdrückt nur die Aktivität sogenannter "T-Zellen", die mit dem Lupus in Zusammenhang stehen. Gesunde Abwehrmechanismen hingegen bleiben dabei intakt. Der Durchbruch gelang den Forschern bereits in den frühen 2000er-Jahren, als sie die Wirkung synthetischer Peptide auf Immunreaktionen untersuchten. Ein Peptid (eine kurze Kette von Aminosäuren), das als P140 bekannt ist, zeigte vielversprechende Eigenschaften: Es wirkte nicht als Immunhemmer, sondern als Immunmodulator, d. h. es veränderte die Immunreaktion des Körpers, und zwar so, dass der Lupus gestoppt wurde. Die Wirkung früherer Medikamente, die das Immunsystem unterdrückten, beruhte darauf, dass sie die Aktivität überstimulierter B-Zellen, die eine Schlüsselrolle bei der Auslösung eines Großteiles der Immunreaktionen des Körpers spielen, hemmten. Das Peptid P140 schaltet ganz gezielt die sogenannten CD4-T-Zellen aus, bevor diese die B-Zellen, die den Lupus verursachen, überstimulieren können. Weitere Untersuchungen zeigten, dass das Peptid den der Krankheit zugrunde liegenden Vorgang der Zellautophagie (Selbstverzehr) abstellt. Anstatt also die sonst gesunde Immunabwehr zu unterdrücken, werden mithilfe von Mullers Entdeckung die T-Zellen ausgeschaltet, wodurch das Immunsystem zwar modifiziert wird, aber intakt bleibt.
Die klinische Phase-III-Studie (letzte Testphase für einen Wirkstoffkandidaten vor seiner eventuellen Marktzulassung) wurde Ende Dezember 2015 mit einem Patienten in den USA begonnen und später auf Europa ausgeweitet. Insgesamt nahmen 202 Patienten teil, die in zwei Gruppen unterteilt waren: die erste Gruppe erhielt LupuzorTM und die zweite Gruppe ein Placebo. Alle Patienten nahmen zusätzlich weitere Medikamente ein wie Steroide, Malariamedikamente, Methotrexate usw.
153 Patienten waren bis zum Schluss der Studie dabei. Trotz der relativ geringen Anzahl an Testpersonen konnte die Wirksamkeit des Peptids nachgewiesen werden. In Verbindung mit Basismedikamenten erwies sich LupuzorTM bei 68,8% der Patienten als effizient, die mit diesem Wirkstoffkandidaten behandelt wurden. Aber auch die mit einem Placebo und den Basismedikamenten behandelten Patienten reagierten positiv (59,2%).
LupuzorTM erweist sich somit als genauso effizient wie die bis heute einzige Behandlungsmethode, jedoch ohne dessen Nebenwirkungen. LupuzorTM wirkt nicht immunsuppressiv, d.h. es unterdrückt nicht die Immunabwehr des Patienten. Die klinische Phase-III-Studie hat somit seine Unbedenklichkeit bestätigt, da keine schwerwiegende Nebenwirkung zu beobachten war. Ein weiteres ermutigendes Ergebnis: LupuzorTM zeigte eine Ansprechquote von 61,5% bei Patienten, die Anti-dsDNA-Autoantikörper (Markerantigene, die beim Systemischen Lupus erythematodes (SLE) auftreten können) aufwiesen, im Gegensatz zu 47,3% der Patienten, die nur ein Placebo erhielten. Bei 7,6% der LupuzorTM-Gruppe mit positiven Anti-dsDNA kam es sogar zu einer vollständigen Heilung (keine Anti-dsDNA und keine klinischen Anzeichen), was bei der Placebo-Gruppe bei keinem Patienten der Fall war.
Diesen positiven Resultaten zufolge könnte LupuzorTM auch zur Behandlung anderer Autoimmunkrankheiten eingesetzt werden, z. B. das Sjögren-Syndrom (Entzündung von Tränen- und Speicheldrüsen, die zum Austrocknen von Schleimhäuten führt) oder Morbus Crohn (chronisch-entzündliche Darmerkrankung).
ImmuPharma vermarktet LupuzorTM (das auch unter den Bezeichnungen Rigerimod, IPP-201101 und P140 bekannt ist). Die Markteinführung in den USA und fünf EU-Ländern ist für 2018 vorgesehen.
Quelle:
Artikel des CNRS, 17/04/2018, http://www2.cnrs.fr/presse/communique/5557.htm
Kontakte:
Sylviane Muller, Forscherin am CNRS, sylviane.muller@unistra.fr
Julien Guillaume, Presseabteilung des CNRS, julien.guillaume@cnrs-dir.fr
Übersetzerin: Jana Ulbricht, jana.ulbricht@diplomatie.gouv.fr
Medizin • LupuzorTM: Phase-III-Studie erfolgreich
Marie de Chalup Wissenschaftliche Abteilung
Wissenschaftliche Abteilung, Französische Botschaft in der Bundesrepublik Deutschland
Die klinische Phase-III-Studie zu LupuzorTM wurde gerade erfolgreich abgeschlossen. Dieser Wirkstoffkandidat war bei 68,8% der Patienten wirksam, die bis zum Schluss der Testphase dabei waren. LupuzorTM ist damit das erste nicht immunsuppressiv wirkende Medikament gegen Lupus. Es wurde vom Forscherteam um Sylviane Muller vom Labor für Immunpathologie und therapeutische Chemie des französischen Zentrums für wissenschaftliche Forschung CNRS entwickelt und wurde bereits vom Unternehmen ImmuPharma Frankreich in klinischen Studien der Phasen I und II erfolgreich getestet. Es ist die erste Behandlung für diese Krankheit, die nicht nur die Symptome lindert, sondern auch ihr Fortschreiten eindämmt
Lupus ist eine unheilbare Krankheit, bei der das Immunsystem - dessen Aufgabe darin besteht, den Körper gegen Bedrohungen von außen zu verteidigen - sich nach innen wendet und gesundes Gewebe angreift und ganz normale Abläufe unterbindet. Bisher wurden bei der Behandlung Steroide und Immunsuppressiva eingesetzt. Erstere haben bei langzeitigem Gebrauch erhebliche Nebenwirkungen, letztere hemmen das gesamte Immunsystem und machen den Körper somit anfällig für Infektionen.
LupuzorTM unterdrückt nur die Aktivität sogenannter "T-Zellen", die mit dem Lupus in Zusammenhang stehen. Gesunde Abwehrmechanismen hingegen bleiben dabei intakt. Der Durchbruch gelang den Forschern bereits in den frühen 2000er-Jahren, als sie die Wirkung synthetischer Peptide auf Immunreaktionen untersuchten. Ein Peptid (eine kurze Kette von Aminosäuren), das als P140 bekannt ist, zeigte vielversprechende Eigenschaften: Es wirkte nicht als Immunhemmer, sondern als Immunmodulator, d. h. es veränderte die Immunreaktion des Körpers, und zwar so, dass der Lupus gestoppt wurde. Die Wirkung früherer Medikamente, die das Immunsystem unterdrückten, beruhte darauf, dass sie die Aktivität überstimulierter B-Zellen, die eine Schlüsselrolle bei der Auslösung eines Großteiles der Immunreaktionen des Körpers spielen, hemmten. Das Peptid P140 schaltet ganz gezielt die sogenannten CD4-T-Zellen aus, bevor diese die B-Zellen, die den Lupus verursachen, überstimulieren können. Weitere Untersuchungen zeigten, dass das Peptid den der Krankheit zugrunde liegenden Vorgang der Zellautophagie (Selbstverzehr) abstellt. Anstatt also die sonst gesunde Immunabwehr zu unterdrücken, werden mithilfe von Mullers Entdeckung die T-Zellen ausgeschaltet, wodurch das Immunsystem zwar modifiziert wird, aber intakt bleibt.
Die klinische Phase-III-Studie (letzte Testphase für einen Wirkstoffkandidaten vor seiner eventuellen Marktzulassung) wurde Ende Dezember 2015 mit einem Patienten in den USA begonnen und später auf Europa ausgeweitet. Insgesamt nahmen 202 Patienten teil, die in zwei Gruppen unterteilt waren: die erste Gruppe erhielt LupuzorTM und die zweite Gruppe ein Placebo. Alle Patienten nahmen zusätzlich weitere Medikamente ein wie Steroide, Malariamedikamente, Methotrexate usw.
153 Patienten waren bis zum Schluss der Studie dabei. Trotz der relativ geringen Anzahl an Testpersonen konnte die Wirksamkeit des Peptids nachgewiesen werden. In Verbindung mit Basismedikamenten erwies sich LupuzorTM bei 68,8% der Patienten als effizient, die mit diesem Wirkstoffkandidaten behandelt wurden. Aber auch die mit einem Placebo und den Basismedikamenten behandelten Patienten reagierten positiv (59,2%).
LupuzorTM erweist sich somit als genauso effizient wie die bis heute einzige Behandlungsmethode, jedoch ohne dessen Nebenwirkungen. LupuzorTM wirkt nicht immunsuppressiv, d.h. es unterdrückt nicht die Immunabwehr des Patienten. Die klinische Phase-III-Studie hat somit seine Unbedenklichkeit bestätigt, da keine schwerwiegende Nebenwirkung zu beobachten war. Ein weiteres ermutigendes Ergebnis: LupuzorTM zeigte eine Ansprechquote von 61,5% bei Patienten, die Anti-dsDNA-Autoantikörper (Markerantigene, die beim Systemischen Lupus erythematodes (SLE) auftreten können) aufwiesen, im Gegensatz zu 47,3% der Patienten, die nur ein Placebo erhielten. Bei 7,6% der LupuzorTM-Gruppe mit positiven Anti-dsDNA kam es sogar zu einer vollständigen Heilung (keine Anti-dsDNA und keine klinischen Anzeichen), was bei der Placebo-Gruppe bei keinem Patienten der Fall war.
Diesen positiven Resultaten zufolge könnte LupuzorTM auch zur Behandlung anderer Autoimmunkrankheiten eingesetzt werden, z. B. das Sjögren-Syndrom (Entzündung von Tränen- und Speicheldrüsen, die zum Austrocknen von Schleimhäuten führt) oder Morbus Crohn (chronisch-entzündliche Darmerkrankung).
ImmuPharma vermarktet LupuzorTM (das auch unter den Bezeichnungen Rigerimod, IPP-201101 und P140 bekannt ist). Die Markteinführung in den USA und fünf EU-Ländern ist für 2018 vorgesehen.
Quelle:
Artikel des CNRS, 17/04/2018, http://www2.cnrs.fr/presse/communique/5557.htm
Kontakte:
Sylviane Muller, Forscherin am CNRS, sylviane.muller@unistra.fr
Julien Guillaume, Presseabteilung des CNRS, julien.guillaume@cnrs-dir.fr
Übersetzerin: Jana Ulbricht, jana.ulbricht@diplomatie.gouv.fr
Antwort auf Beitrag Nr.: 58.479.457 von E301173K am 18.08.18 14:00:38Hallo zusammen,
Ist ja alles bekannt, aber wenn man es liest ist es schon sehr interessant. Leider hat der Markt nicht so viel positiv reagiert.
Der Kurs dümpelt bei 20 vor sich hin und es kommen seit Wochen keine News von Immupharma.
Ich glaube, das hier noch etwas passiert. Ich hatte nach den Ergebnissen gedacht, dass es 2-3 Monate dauert. Nun sind über 4 Monate vergangen.
Vielleicht dauert es noch bis zu einem Jahr, bis etwas konkretes passiert.
Ich bleibe drinne und verfolgen Immupharma.
Ist ja alles bekannt, aber wenn man es liest ist es schon sehr interessant. Leider hat der Markt nicht so viel positiv reagiert.
Der Kurs dümpelt bei 20 vor sich hin und es kommen seit Wochen keine News von Immupharma.
Ich glaube, das hier noch etwas passiert. Ich hatte nach den Ergebnissen gedacht, dass es 2-3 Monate dauert. Nun sind über 4 Monate vergangen.
Vielleicht dauert es noch bis zu einem Jahr, bis etwas konkretes passiert.
Ich bleibe drinne und verfolgen Immupharma.
Antwort auf Beitrag Nr.: 58.480.837 von bio-profi am 18.08.18 20:10:40Ich denke es verlängert sich auch durch den jetzigen Zeitpunkt, Sommerzeit, Urlaubszeit, da werden auch bei vielen Firmen nicht unbedingt wichtige Enscheidungen beschlossen und auch der Zeitpunkt für eine gute News wäre wohl ab Sept., Okt. viel günstiger..
Gruß aaahhh
Gruß aaahhh
Aaahhh, bei allem Respekt.
Ein Medikament für eine unheilbare Krankheit und eine Bewertung von30 mio pfund. Kann mir nicht vorstellen, das es hier die Sommerpause oder Urlaubszeit eine Entscheidung beeinflusst.
Ich denke es die Unsicherheit, ob lupuzor eine Zulassung oder einen positiven Bescheid von der fad bekommt, ist der wahre Grund ist!
Abwarten! Die Entscheidung wird aus heiterem Himmel fallen und ist hoffentlich positiv! Gruß.
Ein Medikament für eine unheilbare Krankheit und eine Bewertung von30 mio pfund. Kann mir nicht vorstellen, das es hier die Sommerpause oder Urlaubszeit eine Entscheidung beeinflusst.
Ich denke es die Unsicherheit, ob lupuzor eine Zulassung oder einen positiven Bescheid von der fad bekommt, ist der wahre Grund ist!
Abwarten! Die Entscheidung wird aus heiterem Himmel fallen und ist hoffentlich positiv! Gruß.
Antwort auf Beitrag Nr.: 58.484.538 von bio-profi am 19.08.18 20:56:18Mein Tipp ist nach wie vor eine Übernahme der kompletten Asset! Deswegen bin ich auch kräftig am verbilligen. Die Pipeline ist einiges Wert . Die Wirksamkeit wurde nachgewiesen, von daher werden hier schon einige mit den Füßen scharren!
Antwort auf Beitrag Nr.: 58.487.958 von swoasik am 20.08.18 12:59:31
schön das du noch dabei bist.
Das verbilligen ist richtig, aber schwer bei den anderen guten Werten.
Wenn diese nach Norden steigen, wirst du nicht mitgenommen, weil nicht investiert!
Der Faktor ist die Zeit für uns, wann kommt der Zeitpunkt vom Quereinsteiger bzw. wann kommt hier die Richtung nach Norden, nur durch Faktoren.
Die Faktoren werden nicht von uns gemacht.
Gruss RS
Immu
Hallo Sowiak,schön das du noch dabei bist.
Das verbilligen ist richtig, aber schwer bei den anderen guten Werten.
Wenn diese nach Norden steigen, wirst du nicht mitgenommen, weil nicht investiert!
Der Faktor ist die Zeit für uns, wann kommt der Zeitpunkt vom Quereinsteiger bzw. wann kommt hier die Richtung nach Norden, nur durch Faktoren.
Die Faktoren werden nicht von uns gemacht.
Gruss RS
Antwort auf Beitrag Nr.: 58.489.380 von Rastelly am 20.08.18 15:37:16Moin Moin
Also ich sehe nur wenige Aktien zur Zeit die mir solch eine Chance wie Immupharm bieten .
Risiko hast du in jeder Aktie , und hier bei den Pfennig-Aktien ist wohl das größte Risiko über Nacht auch mal auf Null gestellt zu werden. Aber bei IMMUPH ist die Pipeline einfach auch noch zu Werthaltig. In meinen Augen , wird hier komplett nach unten Übertrieben. Aber , ist okay , wenn sie dann nach oben auch wieder so Übertreiben.
Natürlich hast du recht , dass auch andere Mütter schöne Töchter haben. Mir fällt nur zur Zeit keine so richtig in die Augen.
Swoasik
Also ich sehe nur wenige Aktien zur Zeit die mir solch eine Chance wie Immupharm bieten .
Risiko hast du in jeder Aktie , und hier bei den Pfennig-Aktien ist wohl das größte Risiko über Nacht auch mal auf Null gestellt zu werden. Aber bei IMMUPH ist die Pipeline einfach auch noch zu Werthaltig. In meinen Augen , wird hier komplett nach unten Übertrieben. Aber , ist okay , wenn sie dann nach oben auch wieder so Übertreiben.
Natürlich hast du recht , dass auch andere Mütter schöne Töchter haben. Mir fällt nur zur Zeit keine so richtig in die Augen.
Swoasik
Antwort auf Beitrag Nr.: 58.495.197 von swoasik am 21.08.18 09:39:59Moin zusammen,
hier die Pipline von Immupharma.
"UNSERE PIPELINE
LUPUZOR ™ ZUR BEHANDLUNG VON LUPUS
IPP-204106 ZUR BEHANDLUNG VON MULTIPLEN KARZINOMEN UND MOLEKÜLEN DERSELBEN CHEMISCHEN FAMILIE FÜR ANDERE INDIKATIONEN
IPP-102199 ZUR BEHANDLUNG VON MÄSSIGEN BIS STARKEN SCHMERZEN
IPP-203101 ZUR BEHANDLUNG VON MRSA UND ANDEREN SCHWEREN INFEKTIONEN
IPP-201007 ZUR BEHANDLUNG VON ENTZÜNDLICHEN ERKRANKUNGEN
BIBLIOTHEK VON ÜBER 300.000 KLEINEN MOLEKÜLEN UND PEPTIDEN (FOLDAMEREN)
PEPTID-LIEFERTECHNOLOGIE
NEUARTIGE PROJEKTE IN ZUSAMMENARBEIT MIT DEM CNRS"
Hab aber leider nichts darüber gefunden, wie weit die Produkte sind und was für ein Potential sie haben. Vielleicht hat jemand mehr infos.
ZU dem Punkt andere Aktien:
Ich finde den NASH Bereich sehr interessant, vor allem VKTX ist hier vielversprechend.
Darüberhinaus lohnt es sich auch PGNX anzuschauen. Aktuell 3 zugelassene Medikamente und im Sep noch ein Phase 3 Termin!
Beste Grüße aus dem Norden!
hier die Pipline von Immupharma.
"UNSERE PIPELINE
LUPUZOR ™ ZUR BEHANDLUNG VON LUPUS
IPP-204106 ZUR BEHANDLUNG VON MULTIPLEN KARZINOMEN UND MOLEKÜLEN DERSELBEN CHEMISCHEN FAMILIE FÜR ANDERE INDIKATIONEN
IPP-102199 ZUR BEHANDLUNG VON MÄSSIGEN BIS STARKEN SCHMERZEN
IPP-203101 ZUR BEHANDLUNG VON MRSA UND ANDEREN SCHWEREN INFEKTIONEN
IPP-201007 ZUR BEHANDLUNG VON ENTZÜNDLICHEN ERKRANKUNGEN
BIBLIOTHEK VON ÜBER 300.000 KLEINEN MOLEKÜLEN UND PEPTIDEN (FOLDAMEREN)
PEPTID-LIEFERTECHNOLOGIE
NEUARTIGE PROJEKTE IN ZUSAMMENARBEIT MIT DEM CNRS"
Hab aber leider nichts darüber gefunden, wie weit die Produkte sind und was für ein Potential sie haben. Vielleicht hat jemand mehr infos.
ZU dem Punkt andere Aktien:
Ich finde den NASH Bereich sehr interessant, vor allem VKTX ist hier vielversprechend.
Darüberhinaus lohnt es sich auch PGNX anzuschauen. Aktuell 3 zugelassene Medikamente und im Sep noch ein Phase 3 Termin!
Beste Grüße aus dem Norden!
Antwort auf Beitrag Nr.: 58.495.572 von bio-profi am 21.08.18 10:13:27da gebe ich Dir gerne Recht mit VKTX und PGNX !
Nur da ich dort noch nicht Investiert bin , hängt mir die Startrampe doch etwas zu hoch.
Da Investiere ich lieber in solche Titel wie IMMUPH auch wenn das Risiko höher ist.
Aber ansonsten gebe ich Dir gerne Recht , es gibt schon einiges an Potential in der BIO-Branche .
Mich würde mal Interessieren was es so im Bereich bis 0,50 Euro- Cent noch gibt ! Oder ihr so im Fokus habt.
Grüße aus dem Süden
Nur da ich dort noch nicht Investiert bin , hängt mir die Startrampe doch etwas zu hoch.
Da Investiere ich lieber in solche Titel wie IMMUPH auch wenn das Risiko höher ist.
Aber ansonsten gebe ich Dir gerne Recht , es gibt schon einiges an Potential in der BIO-Branche .
Mich würde mal Interessieren was es so im Bereich bis 0,50 Euro- Cent noch gibt ! Oder ihr so im Fokus habt.
Grüße aus dem Süden

Hab noch was in Grankreich gefunden das mir so noch nicht bekannt war
Lupuzor: kontroverse Ergebnisse für diesen Medikamentenkandidaten für Lupus Charlène Catalifaud | 2018.06.27 Melden Sie sich für Freefavorite-A + an Lupuzor: kontroverse Ergebnisse für diesen Medikamentenkandidaten für LupusBy Charlène Catalifaud Bildnachweis: PHANIEZoom SCHLÜSSELWÖRTER Krankheit des Systems-LupusCNRS CREATE Ein Alarm Am 20. Juni klammerte die "Chained Duck" an "Le Quotidien" *, weil sie eine Stellungnahme des CNRS weitergeleitet hatte, in der er beschuldigt wird, "gefälschte Droge mit" gefälschten Nachrichten "zu verkünden und einen Interessenkonflikt zu denunzieren. Im Mittelpunkt dieses Falles steht Lupuzor, ein synthetisches Peptid namens P140, das von einem Team CNRS des Instituts für Molekular- und Zellbiologie in Straßburg entdeckt wurde, das von Sylviane Muller geleitet und von ImmuPharma entwickelt wurde. Dieser Medikamentenkandidat für Lupus wurde 2001 ebenfalls vom CNRS patentiert. In einer positiven Phase-IIb-Studie, die im November 2012 in der Zeitschrift "Annals of the Rheumatic Disease" veröffentlicht wurde, schlossen die Autoren, darunter Dr. Robert Zimmer, Präsident von ImmuPharma, und Sylviane Muller über die Wirksamkeit und Sicherheit von Lupuzor (zusätzlich zur Standardpflege) im Vergleich zu Placebo, wodurch der Weg zu Phase III eröffnet wird. Das Hauptergebnis erreichte keine statistische Signifikanz Die ersten Ergebnisse, die am 17. April von der ImmuPharma veröffentlicht wurden, werden sofort vom CNRS aufgegriffen: "Wirksamkeit nachgewiesen für Lupuzor, erste Behandlung gegen Lupus ohne Nebenwirkungen. Eine Interpretation, die von zwanzig Experten, darunter Professor Nathalie Costedoat-Chalumeau vom Cochin-Krankenhaus und dem Referenzzentrum für seltene systemische Autoimmunkrankheiten der Île-de-France, die sich darüber Sorgen machen, zu hastig beurteilt wurde. CNRS. "Ich gehe nicht gegen Lupuzor auf Kreuzzug", erklärt Costedoat-Chalumeau, der besorgt ist, den Patienten falsche Hoffnung zu geben. Die Spezialisten der Lupus-Referenzzentren in Frankreich und in Belgien sind sehr besorgt über die angekündigten Ergebnisse. Auf der ImmuPharma-Website wird angegeben, dass die primäre Analyse von 202 Patienten eine Ansprechrate von Lupuzor gegenüber Placebo zeigte (52,5 gegenüber 44,6% Responder). Und dass "aufgrund einer hohen Ansprechrate in der Placebo - Gruppe diese überlegene Reaktion keine statistische Signifikanz (p = 0,2631) und den primären Endpunkt der Test wurde nicht erreicht, wobei p größer als 0,05 ist. Zwei Ergebnisse werden ebenfalls vorgestellt. Bei den 153 Patienten, die die Studie abgeschlossen haben, zeigt eine höhere Ansprechrate als Placebo (68,8% gegenüber 59,2%, p nicht verfügbar), die andere zeigt an, dass bei Patienten mit dsDNA (ein bekannter Marker für Lupus) war die Ansprechrate 61,5% mit Lupuzor gegenüber 47,3% für Placebo, mit p = 0,09, nicht signifikant. "Das Hauptkriterium ist nicht erfüllt (p = 0,26). Der Test ist daher negativ und es ist wissenschaftlich nicht möglich, dann Sekundäranalysen durchzuführen (28 wurden in der klinischen Studie geplant). Allerdings sind die 2 Sekundäranalysen auch negativ (ein p bei 0,09 und ein p nicht verfügbar) ", bemerken die Experten. Der CNRS zieht einige Tage später seine Freigabe zurück, "um das Hauptergebnis, das keine statistische Signifikanz erreicht hat, nicht zu verwechseln". Warum hat diese öffentliche Forschungseinrichtung diese Ergebnisse veröffentlicht? In Kontakt mit "Le Quotidien" wollte das Management nicht reagieren. ImmuPharma besteht weiter Auf der Seite von ImmuPharma, einem Start-up, das nach der Entdeckung von Lupuzor gegründet wurde, erkennt Dr. Robert Zimmer, sein Präsident, an, dass die Schlussfolgerungen der Veröffentlichung zu verfrüht waren. Aber er beharrt auf einer ergänzenden Analyse, die Ende Mai veröffentlicht wurde. In der Europäischen Kohorte von 130 Patienten wird eine signifikante Reduktion der Krankheitsaktivität mit Lupuzor beobachtet (71.1 im Vergleich zu 48,8%, p = 0,02) in der Subpopulation von 79 Patienten mit der dsDNA-Antikörper. "Ein sehr signifikantes Ergebnis", sagt Dr. Zimmer. Im Gegensatz dazu erzielte die Kohorte von 72 Patienten in den Vereinigten Staaten nicht die gleichen Ergebnisse. Von den 28 Patienten mit Anti-dsDNA-Antikörpern reagierten 35,7% auf Lupuzor gegenüber 42,8% auf Placebo. "Wir verstehen diese abweichenden Ergebnisse nicht: Das Placebo ist besser als das Asset! Es scheint eine Verzerrung in der US-Kohorte zu geben, die wir nicht identifiziert haben ", sagt der Präsident von ImmuPharma. Dennoch sagt er: "Wir haben ein Produkt, das funktioniert, wenn wir Patienten mit Anti-dsDNA-Antikörpern ansprechen, die 60-70% der Patienten mit Lupus ausmachen." "Dies wurde noch nicht mit den Behörden diskutiert, aber falls wir diese Phase III wiederholen wollen, werden wir diese Patienten auswählen, was es erlauben würde, eine Akte für einen MA-Antrag in Europa einzureichen", schließt er .
Lupuzor: kontroverse Ergebnisse für diesen Medikamentenkandidaten für Lupus Charlène Catalifaud | 2018.06.27 Melden Sie sich für Freefavorite-A + an Lupuzor: kontroverse Ergebnisse für diesen Medikamentenkandidaten für LupusBy Charlène Catalifaud Bildnachweis: PHANIEZoom SCHLÜSSELWÖRTER Krankheit des Systems-LupusCNRS CREATE Ein Alarm Am 20. Juni klammerte die "Chained Duck" an "Le Quotidien" *, weil sie eine Stellungnahme des CNRS weitergeleitet hatte, in der er beschuldigt wird, "gefälschte Droge mit" gefälschten Nachrichten "zu verkünden und einen Interessenkonflikt zu denunzieren. Im Mittelpunkt dieses Falles steht Lupuzor, ein synthetisches Peptid namens P140, das von einem Team CNRS des Instituts für Molekular- und Zellbiologie in Straßburg entdeckt wurde, das von Sylviane Muller geleitet und von ImmuPharma entwickelt wurde. Dieser Medikamentenkandidat für Lupus wurde 2001 ebenfalls vom CNRS patentiert. In einer positiven Phase-IIb-Studie, die im November 2012 in der Zeitschrift "Annals of the Rheumatic Disease" veröffentlicht wurde, schlossen die Autoren, darunter Dr. Robert Zimmer, Präsident von ImmuPharma, und Sylviane Muller über die Wirksamkeit und Sicherheit von Lupuzor (zusätzlich zur Standardpflege) im Vergleich zu Placebo, wodurch der Weg zu Phase III eröffnet wird. Das Hauptergebnis erreichte keine statistische Signifikanz Die ersten Ergebnisse, die am 17. April von der ImmuPharma veröffentlicht wurden, werden sofort vom CNRS aufgegriffen: "Wirksamkeit nachgewiesen für Lupuzor, erste Behandlung gegen Lupus ohne Nebenwirkungen. Eine Interpretation, die von zwanzig Experten, darunter Professor Nathalie Costedoat-Chalumeau vom Cochin-Krankenhaus und dem Referenzzentrum für seltene systemische Autoimmunkrankheiten der Île-de-France, die sich darüber Sorgen machen, zu hastig beurteilt wurde. CNRS. "Ich gehe nicht gegen Lupuzor auf Kreuzzug", erklärt Costedoat-Chalumeau, der besorgt ist, den Patienten falsche Hoffnung zu geben. Die Spezialisten der Lupus-Referenzzentren in Frankreich und in Belgien sind sehr besorgt über die angekündigten Ergebnisse. Auf der ImmuPharma-Website wird angegeben, dass die primäre Analyse von 202 Patienten eine Ansprechrate von Lupuzor gegenüber Placebo zeigte (52,5 gegenüber 44,6% Responder). Und dass "aufgrund einer hohen Ansprechrate in der Placebo - Gruppe diese überlegene Reaktion keine statistische Signifikanz (p = 0,2631) und den primären Endpunkt der Test wurde nicht erreicht, wobei p größer als 0,05 ist. Zwei Ergebnisse werden ebenfalls vorgestellt. Bei den 153 Patienten, die die Studie abgeschlossen haben, zeigt eine höhere Ansprechrate als Placebo (68,8% gegenüber 59,2%, p nicht verfügbar), die andere zeigt an, dass bei Patienten mit dsDNA (ein bekannter Marker für Lupus) war die Ansprechrate 61,5% mit Lupuzor gegenüber 47,3% für Placebo, mit p = 0,09, nicht signifikant. "Das Hauptkriterium ist nicht erfüllt (p = 0,26). Der Test ist daher negativ und es ist wissenschaftlich nicht möglich, dann Sekundäranalysen durchzuführen (28 wurden in der klinischen Studie geplant). Allerdings sind die 2 Sekundäranalysen auch negativ (ein p bei 0,09 und ein p nicht verfügbar) ", bemerken die Experten. Der CNRS zieht einige Tage später seine Freigabe zurück, "um das Hauptergebnis, das keine statistische Signifikanz erreicht hat, nicht zu verwechseln". Warum hat diese öffentliche Forschungseinrichtung diese Ergebnisse veröffentlicht? In Kontakt mit "Le Quotidien" wollte das Management nicht reagieren. ImmuPharma besteht weiter Auf der Seite von ImmuPharma, einem Start-up, das nach der Entdeckung von Lupuzor gegründet wurde, erkennt Dr. Robert Zimmer, sein Präsident, an, dass die Schlussfolgerungen der Veröffentlichung zu verfrüht waren. Aber er beharrt auf einer ergänzenden Analyse, die Ende Mai veröffentlicht wurde. In der Europäischen Kohorte von 130 Patienten wird eine signifikante Reduktion der Krankheitsaktivität mit Lupuzor beobachtet (71.1 im Vergleich zu 48,8%, p = 0,02) in der Subpopulation von 79 Patienten mit der dsDNA-Antikörper. "Ein sehr signifikantes Ergebnis", sagt Dr. Zimmer. Im Gegensatz dazu erzielte die Kohorte von 72 Patienten in den Vereinigten Staaten nicht die gleichen Ergebnisse. Von den 28 Patienten mit Anti-dsDNA-Antikörpern reagierten 35,7% auf Lupuzor gegenüber 42,8% auf Placebo. "Wir verstehen diese abweichenden Ergebnisse nicht: Das Placebo ist besser als das Asset! Es scheint eine Verzerrung in der US-Kohorte zu geben, die wir nicht identifiziert haben ", sagt der Präsident von ImmuPharma. Dennoch sagt er: "Wir haben ein Produkt, das funktioniert, wenn wir Patienten mit Anti-dsDNA-Antikörpern ansprechen, die 60-70% der Patienten mit Lupus ausmachen." "Dies wurde noch nicht mit den Behörden diskutiert, aber falls wir diese Phase III wiederholen wollen, werden wir diese Patienten auswählen, was es erlauben würde, eine Akte für einen MA-Antrag in Europa einzureichen", schließt er .
Interessanter Artikel. Danach sieht es nicht gut aus für lupuzor.
Bleibe trotzdem drinne!
Gruß.
Bleibe trotzdem drinne!
Gruß.
Antwort auf Beitrag Nr.: 58.499.763 von E301173K am 21.08.18 17:15:33Danke für die Info
Der Bericht war schon Grundlage einer Diskussion im Englischen Board !
Hier wird ja auch von Immupharm abgeklopft wo diese extremen Unterschiede herkommen.
Auch dies wird wohl ein Grund dafür sein weswegen so lange geschwiegen wird. Bevor sie ihre Hausaufgaben nicht gemacht haben brauchen sie nicht an die Öffentlichkeit .
Swoasik
Der Bericht war schon Grundlage einer Diskussion im Englischen Board !
Hier wird ja auch von Immupharm abgeklopft wo diese extremen Unterschiede herkommen.
Auch dies wird wohl ein Grund dafür sein weswegen so lange geschwiegen wird. Bevor sie ihre Hausaufgaben nicht gemacht haben brauchen sie nicht an die Öffentlichkeit .
Swoasik
Es haben alle Hetsteller ihre Probleme;
Die Analyse von mehr als 1.000 Patienten mit systemischem Lupus erythematodes zeigt die reale Welt Patientenpopulationen sind nicht repräsentativ für klinische Studien Während die systemische Lupus erythematodes (SLE) -Pipeline mit Janssens Stelara, AstraZeneca / MedImmune's Anifrolumab, Neovacs 'INF-K und ImmuPharmas fortgeschritten ist Lupuzor, in der Vergangenheit, die meisten Agenten in der Entwicklung nicht vorbei Phase-III-Studien, was zu einem außergewöhnlich hohen ungedeckten Bedarf. PR Newswire EXTON, Pa., 25. Juli 2018 EXTON, Pennsylvania (USA), 25. Juli 2018 / PRNewswire / - Um besser zu verstehen, wie "echte" SLE-Patienten in Bezug auf Krankheitslast, Arztkontaktpunkte und Behandlungsreisen aussehen, hat Spherix Global Insights mit 201 Rheumatologen in den USA zusammengearbeitet Datensätze von 1.032 SLE-Patienten, die derzeit mit systemischen Behandlungen behandelt werden oder Kandidaten sind. Die Mehrheit der Patienten zeigte trotz ihrer aktuellen Behandlung Gelenk-, Haut- und Nierenmanifestationen, und behandelnde Ärzte berichten in der Regel von einem "fairen" Zustand bei einer Vielzahl von Lebensqualität (Müdigkeit, Schlafqualität, Aktivitäten des täglichen Lebens, Arbeitsleistung) , soziale / Freizeit und Schmerz). Diejenigen, die mehrere Manifestationen haben, haben eine signifikant höhere Medikationsbelastung, erfahren früher Behandlungsänderungen und werden als insgesamt schlechtere Lebensqualität empfunden als Patienten, die nur wenige Manifestationen aufweisen. Patienten, die mit Biologika behandelt werden, weisen häufiger Haut-, Gelenk- und Nierenmanifestationen auf und werden eher mit Kombinationstherapien wie Steroiden und Immunsuppressiva behandelt. Als derzeit einzige zur Behandlung von SLE zugelassene Biologika erzielen geprüfte Benlysta-Patienten in der Regel eine zufriedenstellende Reaktion; Die Mehrzahl der SLE-Patienten war jedoch nie der Marke ausgesetzt, und Rheumatologen schätzen, dass nur 39% ihrer Patienten nicht als Kandidaten für das Medikament gelten. Weniger als 10% der überprüften Bevölkerung wurden zuvor mit Benlysta behandelt und sind seither aufgrund von Versicherungs- und Patientenkosten aus der Tasche entlassen worden. Rheumatologen beschreiben den idealen Benlysta-Patienten als Patienten, bei denen frühere Behandlungen fehlgeschlagen sind, eine aktive Erkrankung aufgetreten ist und nur wenig oder gar keine Nieren betroffen sind. Da Benlysta die einzige von der FDA zugelassene biologische Option ist und ein beträchtlicher Anteil der SLE-Population nicht als Kandidaten in Betracht gezogen wird, sind Patienten auf chronische Steroide sowie auf off-label-Präparate zur Behandlung angewiesen. Von denen, die das Rituxan-Off-Label von Genentech / Biogen verschreiben, ist die Mehrheit mit der Reaktion ihrer Patienten zufrieden, obwohl das Fehlen einer Indikation und eines Versicherungsschutzes häufig als Anwendungshindernisse angeführt werden. Benlysta's Defizite und die Schwierigkeit, Off-Label-Behandlungen zu verschreiben, bieten eine große Chance für Agenten in der Entwicklung. Obwohl die Hälfte der Befragten anzeigte, dass die Populationen klinischer Studien für ihre SLE-Patientenpopulation repräsentativ waren, deutet eine weitere Analyse der Einschluss- / Ausschlusskriterien klinischer Studien für Prüfpräparate darauf hin. Die Mehrheit der geprüften Patienten war nicht für Produkte in klinischen Phase-III-Studien geeignet, was den tatsächlichen Nutzen dieser Wirkstoffe in Frage stellt, sofern sie genehmigt wurden. Patienten, die aus klinischen Studien ausgeschlossen wurden, wurden zu verschiedenen Zeitpunkten mit einer Auswahl von Steroiden, Immunsuppressiva und Biologika behandelt. Diese Patienten erlebten im vergangenen Jahr ebenfalls häufigere und schwerere Flares, erlebten schwerere Manifestationen, schlechtere Bewertungen der Lebensqualität und hatten signifikant mehr Komorbiditäten. Zum Beispiel rekrutiert Janssens Stelara derzeit klinische Phase-III-Studien, und weniger als ein Drittel der geprüften Patienten in dieser Studie hätte aufgrund der Einschluss- / Ausschlusskriterien eine Zulassung erhalten. Unerwünschte Patienten waren in der Vergangenheit auf Biologika, hatten signifikant schwerere Flares und hatten schwere und instabile Manifestationen. Unzulässige Patienten hatten auch signifikant mehr Komorbiditäten wie Hyperlipidämie, Nierenfunktionsstörungen und Schilddrüsenerkrankungen sowie verschiedene Autoimmunerkrankungen. Darüber hinaus erlebten diese Patienten eine schwerwiegendere Bewertung ihrer Lebensqualität, insbesondere im Hinblick auf Müdigkeit, Aktivitäten des täglichen Lebens, Arbeit, Sozialisation und Schlafqualität. Der Prozentsatz der in Frage kommenden Patienten für AstraZenecas Anifrolumab, Neovacs 'INF-K und ImmuPharmas Lupuzor variieren alle im Verhältnis zu den Einschlusskriterien. Die große Zahl von nicht für diese klinischen Studien in Frage kommenden Patienten deutet darauf hin, dass selbst wenn Pipeline-Wirkstoffe es auf den Markt bringen, die Erfahrungen nach der Markteinführung sehr von denen der klinischen Studien abweichen können. Dieses Audit hilft pharmazeutischen Entwicklern, die verschiedenen Patientenprofile zu verstehen und zu verstehen, wie aktuelle Behandlungsregime (von denen viele Off-Label-Verschreibungen beinhalten) genutzt werden und hervorhebt, wo Gelegenheiten bestehen könnten, um einen Wettbewerbsvorteil zu erzielen.
Die Analyse von mehr als 1.000 Patienten mit systemischem Lupus erythematodes zeigt die reale Welt Patientenpopulationen sind nicht repräsentativ für klinische Studien Während die systemische Lupus erythematodes (SLE) -Pipeline mit Janssens Stelara, AstraZeneca / MedImmune's Anifrolumab, Neovacs 'INF-K und ImmuPharmas fortgeschritten ist Lupuzor, in der Vergangenheit, die meisten Agenten in der Entwicklung nicht vorbei Phase-III-Studien, was zu einem außergewöhnlich hohen ungedeckten Bedarf. PR Newswire EXTON, Pa., 25. Juli 2018 EXTON, Pennsylvania (USA), 25. Juli 2018 / PRNewswire / - Um besser zu verstehen, wie "echte" SLE-Patienten in Bezug auf Krankheitslast, Arztkontaktpunkte und Behandlungsreisen aussehen, hat Spherix Global Insights mit 201 Rheumatologen in den USA zusammengearbeitet Datensätze von 1.032 SLE-Patienten, die derzeit mit systemischen Behandlungen behandelt werden oder Kandidaten sind. Die Mehrheit der Patienten zeigte trotz ihrer aktuellen Behandlung Gelenk-, Haut- und Nierenmanifestationen, und behandelnde Ärzte berichten in der Regel von einem "fairen" Zustand bei einer Vielzahl von Lebensqualität (Müdigkeit, Schlafqualität, Aktivitäten des täglichen Lebens, Arbeitsleistung) , soziale / Freizeit und Schmerz). Diejenigen, die mehrere Manifestationen haben, haben eine signifikant höhere Medikationsbelastung, erfahren früher Behandlungsänderungen und werden als insgesamt schlechtere Lebensqualität empfunden als Patienten, die nur wenige Manifestationen aufweisen. Patienten, die mit Biologika behandelt werden, weisen häufiger Haut-, Gelenk- und Nierenmanifestationen auf und werden eher mit Kombinationstherapien wie Steroiden und Immunsuppressiva behandelt. Als derzeit einzige zur Behandlung von SLE zugelassene Biologika erzielen geprüfte Benlysta-Patienten in der Regel eine zufriedenstellende Reaktion; Die Mehrzahl der SLE-Patienten war jedoch nie der Marke ausgesetzt, und Rheumatologen schätzen, dass nur 39% ihrer Patienten nicht als Kandidaten für das Medikament gelten. Weniger als 10% der überprüften Bevölkerung wurden zuvor mit Benlysta behandelt und sind seither aufgrund von Versicherungs- und Patientenkosten aus der Tasche entlassen worden. Rheumatologen beschreiben den idealen Benlysta-Patienten als Patienten, bei denen frühere Behandlungen fehlgeschlagen sind, eine aktive Erkrankung aufgetreten ist und nur wenig oder gar keine Nieren betroffen sind. Da Benlysta die einzige von der FDA zugelassene biologische Option ist und ein beträchtlicher Anteil der SLE-Population nicht als Kandidaten in Betracht gezogen wird, sind Patienten auf chronische Steroide sowie auf off-label-Präparate zur Behandlung angewiesen. Von denen, die das Rituxan-Off-Label von Genentech / Biogen verschreiben, ist die Mehrheit mit der Reaktion ihrer Patienten zufrieden, obwohl das Fehlen einer Indikation und eines Versicherungsschutzes häufig als Anwendungshindernisse angeführt werden. Benlysta's Defizite und die Schwierigkeit, Off-Label-Behandlungen zu verschreiben, bieten eine große Chance für Agenten in der Entwicklung. Obwohl die Hälfte der Befragten anzeigte, dass die Populationen klinischer Studien für ihre SLE-Patientenpopulation repräsentativ waren, deutet eine weitere Analyse der Einschluss- / Ausschlusskriterien klinischer Studien für Prüfpräparate darauf hin. Die Mehrheit der geprüften Patienten war nicht für Produkte in klinischen Phase-III-Studien geeignet, was den tatsächlichen Nutzen dieser Wirkstoffe in Frage stellt, sofern sie genehmigt wurden. Patienten, die aus klinischen Studien ausgeschlossen wurden, wurden zu verschiedenen Zeitpunkten mit einer Auswahl von Steroiden, Immunsuppressiva und Biologika behandelt. Diese Patienten erlebten im vergangenen Jahr ebenfalls häufigere und schwerere Flares, erlebten schwerere Manifestationen, schlechtere Bewertungen der Lebensqualität und hatten signifikant mehr Komorbiditäten. Zum Beispiel rekrutiert Janssens Stelara derzeit klinische Phase-III-Studien, und weniger als ein Drittel der geprüften Patienten in dieser Studie hätte aufgrund der Einschluss- / Ausschlusskriterien eine Zulassung erhalten. Unerwünschte Patienten waren in der Vergangenheit auf Biologika, hatten signifikant schwerere Flares und hatten schwere und instabile Manifestationen. Unzulässige Patienten hatten auch signifikant mehr Komorbiditäten wie Hyperlipidämie, Nierenfunktionsstörungen und Schilddrüsenerkrankungen sowie verschiedene Autoimmunerkrankungen. Darüber hinaus erlebten diese Patienten eine schwerwiegendere Bewertung ihrer Lebensqualität, insbesondere im Hinblick auf Müdigkeit, Aktivitäten des täglichen Lebens, Arbeit, Sozialisation und Schlafqualität. Der Prozentsatz der in Frage kommenden Patienten für AstraZenecas Anifrolumab, Neovacs 'INF-K und ImmuPharmas Lupuzor variieren alle im Verhältnis zu den Einschlusskriterien. Die große Zahl von nicht für diese klinischen Studien in Frage kommenden Patienten deutet darauf hin, dass selbst wenn Pipeline-Wirkstoffe es auf den Markt bringen, die Erfahrungen nach der Markteinführung sehr von denen der klinischen Studien abweichen können. Dieses Audit hilft pharmazeutischen Entwicklern, die verschiedenen Patientenprofile zu verstehen und zu verstehen, wie aktuelle Behandlungsregime (von denen viele Off-Label-Verschreibungen beinhalten) genutzt werden und hervorhebt, wo Gelegenheiten bestehen könnten, um einen Wettbewerbsvorteil zu erzielen.
Wenn man das liest kommt man ja zur Schluss, das die Behandlung von Lupus sehr schwierig ist und somit auch die Medikamenten Forschung.
Die wird bestimmt bei den Zulassungskriterien von der fad berücksichtigt und somit solltendie Chancen für Immupharma steigen!
Wie sieht ihr das?
Die wird bestimmt bei den Zulassungskriterien von der fad berücksichtigt und somit solltendie Chancen für Immupharma steigen!
Wie sieht ihr das?
Antwort auf Beitrag Nr.: 58.520.619 von bio-profi am 23.08.18 19:49:47klar hast du da Recht mit Lupus !
Es gibt meines Wissens nur wenige Medikamente gegen Lupus , und diese haben auch noch viel mehr Nebenwirkungen als das von Immupharm. Allerdings muss Immuph jetzt endlich auch Beweise ins Feld führen , dass das Medikament gegen Lupus wirkt , und nicht nur weniger Nebenwirkung hat.
Sobald Immuph den Nachweis der Wirkung erbringen kann ,sobald wird die Zulassungsbehörde FDA das Medikament durchwinken davon bin ich Überzeugt( schon wegen den geringeren Nebenwirkungen als die zugelassenen Medikamente gegen Lupus ).
Aber genau dieser Nachweis der Wirkung fehlt noch !
Swoasik
Es gibt meines Wissens nur wenige Medikamente gegen Lupus , und diese haben auch noch viel mehr Nebenwirkungen als das von Immupharm. Allerdings muss Immuph jetzt endlich auch Beweise ins Feld führen , dass das Medikament gegen Lupus wirkt , und nicht nur weniger Nebenwirkung hat.
Sobald Immuph den Nachweis der Wirkung erbringen kann ,sobald wird die Zulassungsbehörde FDA das Medikament durchwinken davon bin ich Überzeugt( schon wegen den geringeren Nebenwirkungen als die zugelassenen Medikamente gegen Lupus ).
Aber genau dieser Nachweis der Wirkung fehlt noch !
Swoasik
Guten morgen,
Heute ist bis jetzt kein Handel? Ausgesetzt?
Gruß.
Heute ist bis jetzt kein Handel? Ausgesetzt?
Gruß.
Antwort auf Beitrag Nr.: 58.540.907 von bio-profi am 27.08.18 11:06:30Keine Panik! Heute ist in England Bank holiday.
Hat jemand infos zu folgenden Lupus Drugs?
XTLB XTL Biopharmaceuticals Ltd.
$1.77
+0.00%
5.1 million
$9.1 million
3.24
08/28/2018
Tap to view 1 drug
DRUG INDICATION STAGE NEWS
hCDR1 Systemic Lupus Erythematosus (SLE) Phase 2 Phase 2 planned.
CRBP Corbus Pharmaceuticals Holdings Inc.
$5.45
+0.45 +9.00%
57.2 million
$311.8 million
30.93
08/28/2018
Tap to view 5 drugs
DRUG INDICATION STAGE NEWS
Anabasum (Resunab) Systemic lupus erythematosus (SLE) Phase 2 Phase 2 trial initiation announced December 22, 2017.
KZR Kezar Life Sciences Inc.
$17.20
-0.1 -0.58%
19.1 million
$328.7 million
15.77
08/28/2018
Tap to view 1 drug
DRUG INDICATION STAGE NEWS
KZR-616 Lupus Phase 1/2 Phase 1b/2 trial is enrolling. Initial Phase 1b data due 1H 2019.
XTLB XTL Biopharmaceuticals Ltd.
$1.77
+0.00%
5.1 million
$9.1 million
3.24
08/28/2018
Tap to view 1 drug
DRUG INDICATION STAGE NEWS
hCDR1 Systemic Lupus Erythematosus (SLE) Phase 2 Phase 2 planned.
CRBP Corbus Pharmaceuticals Holdings Inc.
$5.45
+0.45 +9.00%
57.2 million
$311.8 million
30.93
08/28/2018
Tap to view 5 drugs
DRUG INDICATION STAGE NEWS
Anabasum (Resunab) Systemic lupus erythematosus (SLE) Phase 2 Phase 2 trial initiation announced December 22, 2017.
KZR Kezar Life Sciences Inc.
$17.20
-0.1 -0.58%
19.1 million
$328.7 million
15.77
08/28/2018
Tap to view 1 drug
DRUG INDICATION STAGE NEWS
KZR-616 Lupus Phase 1/2 Phase 1b/2 trial is enrolling. Initial Phase 1b data due 1H 2019.
Guten Morgen,
Am 31.08 hat ein Lupus Medikamentkandudat von Astra schlechte Ergebnisse präsentiert:
Ich glaube das immu immer noch gute Chancen hat, da wie man sieht der Lupus Markt unheimlich schwierig ist.
Eure Meinungen ?
https://www.biopharmadive.com/news/astrazenecas-lupus-drug-f…
„AstraZeneca hoffte, dass Anifrolumab gegen Lupus wirken könnte, eine Krankheit, die für Pharmaka in den letzten Jahren besonders schwierig war, wirksame Behandlungen zu finden.
In diesem Frühjahr floppten zwei andere Unternehmen im Raum. Ablynx NV scheiterte im März an einer Phase-2-Studie, die einen Vertrag mit AbbVie, der sich auf bis zu 665 Millionen Dollar belaufen könnte, gefährdet. Dann verpasste die Lupus-Droge von ImmuPharma in einer zulassungsrelevanten Studie im April die Marke, was dazu führte, dass die Aktie des Unternehmens einbrach.
Eli Lilly buchte Tabalumab auch 2014 als Lupustherapie, während das kalifornische Biopharma-Medikament Antihera zwei Jahre später in einer Phase-3-Studie versagte.
Das Medikament von AstraZeneca verlief in Phase-2-Tests gut, wo die Ergebnisse zeigten, dass es die Krankheitsaktivität signifikant reduzierte und die üblichen Lupussymptome wie Hautausschlag und Arthritis verbesserte.
Dieses Versprechen brach in TULIP 1, dem ersten von zwei Phase-3-Studien für Anifrolumab, ins Wanken.
TULIP 1 umfasste 460 Patienten, die alle vier Wochen entweder Placebo- oder intravenöse Infusionen von Anifrolumab in einer Dosis von 150 mg oder 300 mg erhielten. Anifrolumab alle vier Wochen sowie Placebo. Das Ziel, eine statistisch signifikante Krankheitsreduktion zu erreichen, die vom SLE Responder Index 4 nach 12 Monaten gemessen wurde, konnte jedoch nicht erreicht werden. Die vollständigen Ergebnisse werden bei einem zukünftigen medizinischen Meeting bekannt gegeben.
In der zweiten Studie, TULIP 2, wurde für 373 Patienten alle vier Wochen eine fixe Dosis von 300 mg Anifrolumab gegen Placebo verabreicht. Topline Ergebnisse werden später in diesem Jahr erwartet, nach Angaben des Unternehmens.
AstraZeneca hatte zuvor geplant, 2019 für die USA, Europa und Japan Anifolrolab zur Genehmigung einzureichen.„
Am 31.08 hat ein Lupus Medikamentkandudat von Astra schlechte Ergebnisse präsentiert:
Ich glaube das immu immer noch gute Chancen hat, da wie man sieht der Lupus Markt unheimlich schwierig ist.
Eure Meinungen ?
https://www.biopharmadive.com/news/astrazenecas-lupus-drug-f…
„AstraZeneca hoffte, dass Anifrolumab gegen Lupus wirken könnte, eine Krankheit, die für Pharmaka in den letzten Jahren besonders schwierig war, wirksame Behandlungen zu finden.
In diesem Frühjahr floppten zwei andere Unternehmen im Raum. Ablynx NV scheiterte im März an einer Phase-2-Studie, die einen Vertrag mit AbbVie, der sich auf bis zu 665 Millionen Dollar belaufen könnte, gefährdet. Dann verpasste die Lupus-Droge von ImmuPharma in einer zulassungsrelevanten Studie im April die Marke, was dazu führte, dass die Aktie des Unternehmens einbrach.
Eli Lilly buchte Tabalumab auch 2014 als Lupustherapie, während das kalifornische Biopharma-Medikament Antihera zwei Jahre später in einer Phase-3-Studie versagte.
Das Medikament von AstraZeneca verlief in Phase-2-Tests gut, wo die Ergebnisse zeigten, dass es die Krankheitsaktivität signifikant reduzierte und die üblichen Lupussymptome wie Hautausschlag und Arthritis verbesserte.
Dieses Versprechen brach in TULIP 1, dem ersten von zwei Phase-3-Studien für Anifrolumab, ins Wanken.
TULIP 1 umfasste 460 Patienten, die alle vier Wochen entweder Placebo- oder intravenöse Infusionen von Anifrolumab in einer Dosis von 150 mg oder 300 mg erhielten. Anifrolumab alle vier Wochen sowie Placebo. Das Ziel, eine statistisch signifikante Krankheitsreduktion zu erreichen, die vom SLE Responder Index 4 nach 12 Monaten gemessen wurde, konnte jedoch nicht erreicht werden. Die vollständigen Ergebnisse werden bei einem zukünftigen medizinischen Meeting bekannt gegeben.
In der zweiten Studie, TULIP 2, wurde für 373 Patienten alle vier Wochen eine fixe Dosis von 300 mg Anifrolumab gegen Placebo verabreicht. Topline Ergebnisse werden später in diesem Jahr erwartet, nach Angaben des Unternehmens.
AstraZeneca hatte zuvor geplant, 2019 für die USA, Europa und Japan Anifolrolab zur Genehmigung einzureichen.„
Antwort auf Beitrag Nr.: 58.598.505 von bio-profi am 03.09.18 08:48:10Moin Moin
Richtig , Lupus ist extrem schwer zu behandeln. Die wenigen Medikamente welche schon zugelassen sind, sind Teuer und haben enorme Nebenwirkungen.
Und wie man aus Deinem Bericht hier entnehmen kann scheitern auch große Firmen an der Entwicklung für Lupus.
AstraZeneca hat fast genau die gleichen Probleme wie Immuph und zwar im Placebo-Bereich
Ich bin immer noch Überzeugt dass Immuph übernommen werden wird.
Ihre Lupus Entwicklung ist sehr weit fortgeschritten , und die Wirksamkeit ist vorhanden .
Allerding könnten sie so langsam mal wieder was von sich hören lassen!!
Gruß
Richtig , Lupus ist extrem schwer zu behandeln. Die wenigen Medikamente welche schon zugelassen sind, sind Teuer und haben enorme Nebenwirkungen.
Und wie man aus Deinem Bericht hier entnehmen kann scheitern auch große Firmen an der Entwicklung für Lupus.
AstraZeneca hat fast genau die gleichen Probleme wie Immuph und zwar im Placebo-Bereich
Ich bin immer noch Überzeugt dass Immuph übernommen werden wird.
Ihre Lupus Entwicklung ist sehr weit fortgeschritten , und die Wirksamkeit ist vorhanden .
Allerding könnten sie so langsam mal wieder was von sich hören lassen!!
Gruß
Antwort auf Beitrag Nr.: 58.600.692 von swoasik am 03.09.18 12:32:23Sehe ich auch so, jetzt wird es langsam Zeit. Eigentlich rechne ich aber bei der nächsten News schon mit einem finalem Ergebnis bei den Verhandlungen, entweder Übernahme oder einer steigt bei Lupuzor ein. Wird wohl der Grund für die lange Wartezeit sein.
Geuß aaahhh
Geuß aaahhh
sagt mal, die Unternehmenszahlen gibt's bei IMMU nur ein mal im Jahr? Oder bin ich nur zu doof es zu finden?
die Homepage ist nicht hilfreich, da kein Finanzkalender da ist.
die Homepage ist nicht hilfreich, da kein Finanzkalender da ist.
Wo liegt denn euer EK, wenn ich fragen darf?
Antwort auf Beitrag Nr.: 58.612.530 von liquidx am 04.09.18 16:55:18glaube mir, dies möchtest du nicht wissen !
Es sollte doch ein Abend ohne Tränen werden ;
Aber wenn du richtig Traurig sein willst, ja dann kannst mich noch mal darauf ansprechen


Es sollte doch ein Abend ohne Tränen werden ;
Aber wenn du richtig Traurig sein willst, ja dann kannst mich noch mal darauf ansprechen



Antwort auf Beitrag Nr.: 58.612.902 von swoasik am 04.09.18 17:29:53Naja durch die Nachkäufe unten sieht es etwas besser aus 0,57 €. Sollte drin sein( auch mehr), wenn die einen Deal zustande bringen.
Gruß aaahhh
Gruß aaahhh
Bei einem Deal rechnest du bestenfalls mit welchem Kurs?
Antwort auf Beitrag Nr.: 58.623.474 von liquidx am 05.09.18 17:04:36Mein durchschnittlicher Ek liegt bei 49 Euro Cent.
Bei einem Deal oder Übernahme rechne ich minimal 400-500%. Kommt natürlich auf die Eckdaten an. Wenn man bedenkt, dass immu nurnoch mit 30 mio bewertet ist!
Es kann aber schnell in Richtung 200 gehen oder noch höher, wenn die FDA eine Zulassung genehmigt!
Der Lupus Markt ist einfach sehr schwierig aber dafür aber sehr lukrativ!
Gruß.
Bei einem Deal oder Übernahme rechne ich minimal 400-500%. Kommt natürlich auf die Eckdaten an. Wenn man bedenkt, dass immu nurnoch mit 30 mio bewertet ist!
Es kann aber schnell in Richtung 200 gehen oder noch höher, wenn die FDA eine Zulassung genehmigt!
Der Lupus Markt ist einfach sehr schwierig aber dafür aber sehr lukrativ!
Gruß.
Antwort auf Beitrag Nr.: 58.623.474 von liquidx am 05.09.18 17:04:36Das kommt auf den Deal an. Schwer einzuschätzen, aber wenn man sich ähnlich gelagerte Fälle anschaut sollten zumindest so wie es auch Bio-profi schon geschrieben hat 400 bis 500% gut drin sein, also mindestens 1€. Sollte Lupuzor allerdings im Alleingang von Immu doch noch die FDA Zulassung erhalten und erfolgreich vermarktet werden, dann kommen eher wieder die früheren KZ in Betracht. Ich gehe aber eigentlich nicht davon aus, denn sonst müsste man kaum Gespräche mit anderen aus der Branche führen. Aber auch so ist das Potential bei einem erfolgreichen Deal nicht schlecht.
Gruß aaahhh
Gruß aaahhh
dann gebe ich jetzt meinen Senf auch noch dazu!
Moin Moin alle
Wenn einer einsteigt und als Geldgeber fungiert gehe ich von 100-150 % aus !
Würde aber sehr Interessant werden was er dafür von Immuph will.
Kommt eine Übernahme, dann werden wir wohl auch um die 0,60 bis 0,80 E-Cent laufen.
Kommt aber ein Prinz daher , der mit Immuph unbedingt die Zulassungen der FDA haben will , und alles neu durchfinanziert dann Explodiert die Aktie....und dann irgendwann die Zulassung...….. über 2 Stellig vor dem komma
Aber dies ist Zukunft ! Wir wissen ja nicht einmal ob sie den heißen Sommer überlebt haben , da sich keiner mehr von Immuph meldet

Moin Moin alle
Wenn einer einsteigt und als Geldgeber fungiert gehe ich von 100-150 % aus !
Würde aber sehr Interessant werden was er dafür von Immuph will.
Kommt eine Übernahme, dann werden wir wohl auch um die 0,60 bis 0,80 E-Cent laufen.
Kommt aber ein Prinz daher , der mit Immuph unbedingt die Zulassungen der FDA haben will , und alles neu durchfinanziert dann Explodiert die Aktie....und dann irgendwann die Zulassung...….. über 2 Stellig vor dem komma
Aber dies ist Zukunft ! Wir wissen ja nicht einmal ob sie den heißen Sommer überlebt haben , da sich keiner mehr von Immuph meldet


Ob ich meine 0,5 wiedersehe?
Antwort auf Beitrag Nr.: 58.633.101 von Outrage am 06.09.18 16:33:41
Ist da was im Anmarsch?
Was denkt ihr wann mal wieder etwas kommt?
Grade eben kam was rein:
7th September 2018
ImmuPharma PLC
("ImmuPharma" or the "Company")
CORPORATE UPDATE
ImmuPharma PLC (LSE: IMM), the specialist drug discovery and development company today announces a corporate update.
Key highlights:
•Lupuzor™
o Agreement signed to enter Lupuzor™ into a 'Managed Access Programme'
o Open Label extension study completes recruitment
•Nucant (cancer) programme: Clinical Development Collaboration with Incanthera Limited
•Ureka subsidiary: Divestment process to commence
Lupuzor™
Lupuzor™ is the Company's late stage asset for Lupus, a potential life threatening auto-immune disease. Lupuzor™ concluded a pivotal Phase III trial earlier this year. Key announcements providing top line data of the results were announced on 17 April 2018 and 29 May 2018 (please see full announcements on IMM's website - www.immupharma.com).
Managed Access Programme
ImmuPharma has signed an agreement with a specialist provider to distribute Lupuzor™ via a Managed Access Programme ("MAP").
The key objectives of the MAP, based on the clinical and safety data received from the recently announced Phase III trial, are to promote the use of Lupuzor™ by allowing Lupus patients early access to Lupuzor™, whilst continuing to engage with Lupus specialists and practitioners.
This will allow Lupus patients ongoing access to Lupuzor™ prior to any regulatory filing. In addition, the Company will be collecting valuable data from these patients, which the Company believes will add significantly to the existing data package.
It's currently envisaged that up to 500 patients will be recruited for the MAP and that these patients will be granted access to Lupuzor™ for a minimum of two years. Based on these parameters, the programme will be funded from current cash resources.
Further updates will be announced as appropriate.
Extension Study
The Lupuzor™ open label extension study, initially announced on 18 January 2018, has completed enrolment with a total of 62 eligible patients from the original Phase III trial, who were recruited throughout the US and Europe. The study is anticipated to report results in Q2 2019.
Nucant Cancer Programme - Clinical Development Collaboration
A number of options have been under review to develop the Company's Nucant cancer programme, which has demonstrated promising results in two Phase I trials (safety and dose-finding studies).
In order to progress this programme, ImmuPhama has signed Heads of Terms on a clinical development collaboration for the Nucant cancer programme, with Incanthera Limited ("Incanthera"), a specialist oncology development company.
Key highlights of the Heads of Terms are summarised below:
•Incanthera, based on its positive due-diligence on the Company's Nucant technology, will licence in and take up the continued clinical development of the Nucant cancer programme as an integral part of its own cancer development portfolio.
•As an integral part of the collaboration, upon signing the Heads of Terms, ImmuPharma has invested £2m into Incanthera by subscribing for 363,637 new ordinary Incanthera shares at a price of £5.50 per share. This investment values Incanthera at a pre-money valuation of approximately £10m and is consistent with the most recent funding round that Incanthera completed in March 2018. Following this investment, ImmuPharma will have a circa 16% shareholding in Incanthera.
•ImmuPharma has granted Incanthera a period of exclusivity until 31st December 2018, during which the Company and Incanthera will finalise the terms of a Definitive Licence Agreement for the Nucant technology. These terms are expected to include, but will not be limited to the following:
o Incanthera will pay a licence payment to ImmuPharma of £1m, with this payment to be made via the issuance of new ordinary shares in Incanthera. This payment in shares is separate and will be in addition to the shareholding which Immupharma currently holds as described above;
o Incanthera will be responsible for all of the development costs for the Nucant programme; and
o All future commercialisation revenues will be shared equally between the two companies.
Tim McCarthy, the Company's Chairman, is also Chairman and minority shareholder in Incanthera. As such, Tim McCarthy is precluded from voting on any matters relating to the Heads of Terms between ImmuPharma and Incanthera and will be precluded from voting on any matters relating to the future Definitive Licence Agreement between the two companies.
Further updates will be announced as appropriate.
Ureka : Divestment Process
Ureka, ImmuPharma's wholly owned subsidiary, based in Bordeaux, which is carrying out research into treatments for Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis) has recently demonstrated success in recognised preclinical studies.
Following an extensive review by ImmuPharma's Board of directors, it has been decided that Ureka, whilst having exciting and innovative technologies, is not part of the ongoing strategy of ImmuPharma, which is now fully focused on utilising its resources to develop late stage assets.
Hence, ImmuPharma, with its advisors, will now commence a process of considering all opportunities to divest Ureka. The intention is to allow ImmuPharma to divest Ureka, whilst still retaining an interest in any future commercial success.
Further updates will be announced as appropriate.
Commenting, Tim McCarthy, Chairman, said:
"The Board has been focused on delivering a business strategy which provides the optimum route forward for ImmuPharma and its shareholders, based on its current assets, resources and knowhow. We believe that the strategy outlined today provides the most effective route to create shareholder value going forward.
"We are excited as a team to be progressing the MAP programme which allows Lupus patients early access to Lupuzor™. In the medium term, we remain focussed on achieving the full regulatory approval of Lupuzor™ which we believe has the potential to be a ground breaking drug for Lupus patients and in turn has blockbuster potential in commercial terms.
"Our Nucant programme and Ureka subsidiary have been part of our portfolio for a number of years. We are equally excited by the potential of both. We believe the strategy we have announced today for both, will create enhanced value for shareholders going forward.
"As part of our continued proactive investor relations communications, we look forward to further updating the market and shareholders as and when appropriate."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
7th September 2018
ImmuPharma PLC
("ImmuPharma" or the "Company")
CORPORATE UPDATE
ImmuPharma PLC (LSE: IMM), the specialist drug discovery and development company today announces a corporate update.
Key highlights:
•Lupuzor™
o Agreement signed to enter Lupuzor™ into a 'Managed Access Programme'
o Open Label extension study completes recruitment
•Nucant (cancer) programme: Clinical Development Collaboration with Incanthera Limited
•Ureka subsidiary: Divestment process to commence
Lupuzor™
Lupuzor™ is the Company's late stage asset for Lupus, a potential life threatening auto-immune disease. Lupuzor™ concluded a pivotal Phase III trial earlier this year. Key announcements providing top line data of the results were announced on 17 April 2018 and 29 May 2018 (please see full announcements on IMM's website - www.immupharma.com).
Managed Access Programme
ImmuPharma has signed an agreement with a specialist provider to distribute Lupuzor™ via a Managed Access Programme ("MAP").
The key objectives of the MAP, based on the clinical and safety data received from the recently announced Phase III trial, are to promote the use of Lupuzor™ by allowing Lupus patients early access to Lupuzor™, whilst continuing to engage with Lupus specialists and practitioners.
This will allow Lupus patients ongoing access to Lupuzor™ prior to any regulatory filing. In addition, the Company will be collecting valuable data from these patients, which the Company believes will add significantly to the existing data package.
It's currently envisaged that up to 500 patients will be recruited for the MAP and that these patients will be granted access to Lupuzor™ for a minimum of two years. Based on these parameters, the programme will be funded from current cash resources.
Further updates will be announced as appropriate.
Extension Study
The Lupuzor™ open label extension study, initially announced on 18 January 2018, has completed enrolment with a total of 62 eligible patients from the original Phase III trial, who were recruited throughout the US and Europe. The study is anticipated to report results in Q2 2019.
Nucant Cancer Programme - Clinical Development Collaboration
A number of options have been under review to develop the Company's Nucant cancer programme, which has demonstrated promising results in two Phase I trials (safety and dose-finding studies).
In order to progress this programme, ImmuPhama has signed Heads of Terms on a clinical development collaboration for the Nucant cancer programme, with Incanthera Limited ("Incanthera"), a specialist oncology development company.
Key highlights of the Heads of Terms are summarised below:
•Incanthera, based on its positive due-diligence on the Company's Nucant technology, will licence in and take up the continued clinical development of the Nucant cancer programme as an integral part of its own cancer development portfolio.
•As an integral part of the collaboration, upon signing the Heads of Terms, ImmuPharma has invested £2m into Incanthera by subscribing for 363,637 new ordinary Incanthera shares at a price of £5.50 per share. This investment values Incanthera at a pre-money valuation of approximately £10m and is consistent with the most recent funding round that Incanthera completed in March 2018. Following this investment, ImmuPharma will have a circa 16% shareholding in Incanthera.
•ImmuPharma has granted Incanthera a period of exclusivity until 31st December 2018, during which the Company and Incanthera will finalise the terms of a Definitive Licence Agreement for the Nucant technology. These terms are expected to include, but will not be limited to the following:
o Incanthera will pay a licence payment to ImmuPharma of £1m, with this payment to be made via the issuance of new ordinary shares in Incanthera. This payment in shares is separate and will be in addition to the shareholding which Immupharma currently holds as described above;
o Incanthera will be responsible for all of the development costs for the Nucant programme; and
o All future commercialisation revenues will be shared equally between the two companies.
Tim McCarthy, the Company's Chairman, is also Chairman and minority shareholder in Incanthera. As such, Tim McCarthy is precluded from voting on any matters relating to the Heads of Terms between ImmuPharma and Incanthera and will be precluded from voting on any matters relating to the future Definitive Licence Agreement between the two companies.
Further updates will be announced as appropriate.
Ureka : Divestment Process
Ureka, ImmuPharma's wholly owned subsidiary, based in Bordeaux, which is carrying out research into treatments for Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis) has recently demonstrated success in recognised preclinical studies.
Following an extensive review by ImmuPharma's Board of directors, it has been decided that Ureka, whilst having exciting and innovative technologies, is not part of the ongoing strategy of ImmuPharma, which is now fully focused on utilising its resources to develop late stage assets.
Hence, ImmuPharma, with its advisors, will now commence a process of considering all opportunities to divest Ureka. The intention is to allow ImmuPharma to divest Ureka, whilst still retaining an interest in any future commercial success.
Further updates will be announced as appropriate.
Commenting, Tim McCarthy, Chairman, said:
"The Board has been focused on delivering a business strategy which provides the optimum route forward for ImmuPharma and its shareholders, based on its current assets, resources and knowhow. We believe that the strategy outlined today provides the most effective route to create shareholder value going forward.
"We are excited as a team to be progressing the MAP programme which allows Lupus patients early access to Lupuzor™. In the medium term, we remain focussed on achieving the full regulatory approval of Lupuzor™ which we believe has the potential to be a ground breaking drug for Lupus patients and in turn has blockbuster potential in commercial terms.
"Our Nucant programme and Ureka subsidiary have been part of our portfolio for a number of years. We are equally excited by the potential of both. We believe the strategy we have announced today for both, will create enhanced value for shareholders going forward.
"As part of our continued proactive investor relations communications, we look forward to further updating the market and shareholders as and when appropriate."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
Antwort auf Beitrag Nr.: 58.638.660 von Twohybrid am 07.09.18 08:25:58
Gruß andi
Das hört sich doch gut an :)
Also ich finde die Neuigkeiten hören sich gut an. Es werden neue 30 Patienten "rekrutiert" um Luzifer weiter zu testen und die Ergebnisse aus der ersten Studie stehen auch noch aus. Hätten Sie keine Erfolge zu verzeichnen, dann würden vermutlich keine neuen Patienten getestet. ´Gruß andi
Der Kurs scheint nach oben zu gehen...
Antwort auf Beitrag Nr.: 58.638.972 von Outrage am 07.09.18 08:49:19... nicht.
Antwort auf Beitrag Nr.: 58.638.843 von andilyncon am 07.09.18 08:40:26Das hört sich aber weder nach Übernahme noch nach einer baldigen Lösung mit Lupuzor an. Das wird also eine längere Wartezeit werden. Eine baldige Kursexplosion durch Übernahme oder Nachrichten zu Lupuzor wird damit zumindest für mich eher unwahrscheinlich. Meinungen?
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 58.638.843 von andilyncon am 07.09.18 08:40:26Wieso 30 Patienten? Bis zu 500 für das MAP steht in der Meldung. Das werte ich auch als positiv für das Medikament! Den Kurs wird das wahrscheinlich gar nicht interessieren. Der geht nur noch hoch, wenn mal die Meldung kommt, dass Lupuzor bei der FDA/EMA eingereicht wurde und vermutlich bald Kohle in die Kassen gespült wird.
Aber trotzdem ein Lichtblick für alle Lupus-Patienten, das ist das Wichtige. Der Kurs ist (mir persönlich) erstmal zweitrangig. Ich werde schauen, ob ich meine Freundin nicht vielleicht in das MAP reinkriege...
Aber trotzdem ein Lichtblick für alle Lupus-Patienten, das ist das Wichtige. Der Kurs ist (mir persönlich) erstmal zweitrangig. Ich werde schauen, ob ich meine Freundin nicht vielleicht in das MAP reinkriege...
INVESTITIONSÜBERSICHT
Das Flaggschiff-Lupus-Medikament von ImmuPharma wird den Patienten vor der Registrierung zur Verfügung gestellt
Aktie
08:05 07 Sep 2018
Normalerweise müssen Patienten warten, bis die Behörden ein Medikament genehmigt haben, bevor sie Zugang dazu erhalten, aber bis zu 500 Lupuspatienten erhalten Lupuzor als Teil eines Managed Access Programms
INVESTMENTÜBERSICHT: IM BIGPICTURE
ImmuPharma plant, seine Ureka-Diabetes-Tochter zu veräußern
Einige Lupus-Patienten werden in Kürze Zugang zu einer potenziell "bahnbrechenden" neuen Behandlung erhalten, nachdem die Immupharma PLC (LON: IMM) eine Vereinbarung unterzeichnet hat, die ein Managed-Access-Programm (MAP) vorantreiben wird.
Der Vertrag mit einem Spezialanbieter ermöglicht bis zu 500 Patienten einen dauerhaften Zugang zu Lupuzor, dem Flaggschiff-Medikament von Immupharma, für mindestens zwei Jahre.
Der AIM-quote Medikamentenentwickler wird nicht nur den Patienten helfen, sondern auch mehr wertvolle Daten über Lupuzor sammeln, was nützlich sein wird, wenn und wenn es beschließt, regulatorische Einreichungen voranzutreiben.
READ: Der ImmuPharma Stuhl ist nach der Phase-III-Datenanalyse für Lupuzor optimistisch
Anfang des Jahres verpasste das Medikament seinen primären Endpunkt in einer Studie im Spätstadium, aber das Ergebnis war nuancierter als die Top-Line-Ergebnisse nahelegten und tatsächlich zeigten, dass Lupuzor bei bestimmten Patienten gut funktionierte, hauptsächlich bei denen, die antikörperpositiv waren.
Nach Abschluss der Phase-III-Studie nahmen 62 Patienten an einer "Follow-up" -Studie teil - einer Open-Label-Verlängerungsstudie. Ergebnisse davon werden im zweiten Quartal 2019 erwartet.
READ: ImmuPharma sagt, vorklinische Studie weist auf andere Indikationen für Lupuzor
"Der Vorstand hat sich darauf konzentriert, eine Geschäftsstrategie zu entwickeln, die der ImmuPharma und ihren Aktionären auf der Grundlage ihrer derzeitigen Vermögenswerte, Ressourcen und ihres Know-how den optimalen Weg bietet", sagte der Vorsitzende Tim McCarthy.
"Wir freuen uns als Team, das MAP-Programm voranzutreiben, das Lupus-Patienten einen frühzeitigen Zugang zu Lupuzor ermöglicht.
"Mittelfristig konzentrieren wir uns weiterhin darauf, die volle regulatorische Zulassung von Lupuzor zu erreichen, von dem wir glauben, dass es das Potenzial hat, ein bahnbrechendes Medikament für Lupus-Patienten zu sein, und im Gegenzug Blockbuster-Potenzial in kommerzieller Hinsicht hat."
Nucant-Krebs-Programm macht Fortschritte
Lupuzor ist nicht das einzige Medikament von ImmuPharma, das durch die Klinik geht. Die Behandlung mit Nucant-Krebs hat in zwei Phase-I-Studien zur Sicherheit und Dosisfindung "vielversprechende Ergebnisse" erbracht.
Das Unternehmen hat Vertragsbedingungen für eine klinische Entwicklungszusammenarbeit mit dem Onkologie-Spezialisten Incanthera unterzeichnet, an der ImmuPharma einen Anteil von £ 2 Mio. erworben hat.
Eine Lizenzvereinbarung zwischen den beiden wird voraussichtlich bis Ende des Jahres unterzeichnet werden, wobei Incanthera voraussichtlich eine Vorablizenzgebühr in Höhe von £ 1 Mio. in Aktien entrichten und alle Entwicklungskosten für das Nucant-Programm abdecken wird.
Alle zukünftigen Kommerzialisierungserlöse werden gleichmäßig verteilt, sagte ImmuPharma.
Ureka wird ausgegliedert
Was die Ureka-Tochter des Unternehmens betrifft, die Behandlungen für Diabetes Typ II und NASH entwickeln will, wurde die Entscheidung getroffen, sie zu verkaufen.
Trotz "spannender und innovativer Technologien" sieht der Vorstand nicht als Teil der langfristigen Strategie.
Aus diesem Grund ist geplant, die in Bordeaux ansässige Tochtergesellschaft zu veräußern und dabei weiterhin an einem Interesse zu partizipieren, sollte eines seiner Medikamente später einen kommerziellen Erfolg erzielen.
"Unser Nucant-Programm und unsere Ureka-Tochter sind seit einigen Jahren Teil unseres Portfolios", fügte McCarthy hinzu.
"Wir sind gleichermaßen von dem Potenzial beider Seiten begeistert. Wir glauben, dass die Strategie, die wir heute für beide angekündigt haben, für die Aktionäre in Zukunft einen Mehrwert schaffen wird. "
Das Flaggschiff-Lupus-Medikament von ImmuPharma wird den Patienten vor der Registrierung zur Verfügung gestellt
Aktie
08:05 07 Sep 2018
Normalerweise müssen Patienten warten, bis die Behörden ein Medikament genehmigt haben, bevor sie Zugang dazu erhalten, aber bis zu 500 Lupuspatienten erhalten Lupuzor als Teil eines Managed Access Programms
INVESTMENTÜBERSICHT: IM BIGPICTURE
ImmuPharma plant, seine Ureka-Diabetes-Tochter zu veräußern
Einige Lupus-Patienten werden in Kürze Zugang zu einer potenziell "bahnbrechenden" neuen Behandlung erhalten, nachdem die Immupharma PLC (LON: IMM) eine Vereinbarung unterzeichnet hat, die ein Managed-Access-Programm (MAP) vorantreiben wird.
Der Vertrag mit einem Spezialanbieter ermöglicht bis zu 500 Patienten einen dauerhaften Zugang zu Lupuzor, dem Flaggschiff-Medikament von Immupharma, für mindestens zwei Jahre.
Der AIM-quote Medikamentenentwickler wird nicht nur den Patienten helfen, sondern auch mehr wertvolle Daten über Lupuzor sammeln, was nützlich sein wird, wenn und wenn es beschließt, regulatorische Einreichungen voranzutreiben.
READ: Der ImmuPharma Stuhl ist nach der Phase-III-Datenanalyse für Lupuzor optimistisch
Anfang des Jahres verpasste das Medikament seinen primären Endpunkt in einer Studie im Spätstadium, aber das Ergebnis war nuancierter als die Top-Line-Ergebnisse nahelegten und tatsächlich zeigten, dass Lupuzor bei bestimmten Patienten gut funktionierte, hauptsächlich bei denen, die antikörperpositiv waren.
Nach Abschluss der Phase-III-Studie nahmen 62 Patienten an einer "Follow-up" -Studie teil - einer Open-Label-Verlängerungsstudie. Ergebnisse davon werden im zweiten Quartal 2019 erwartet.
READ: ImmuPharma sagt, vorklinische Studie weist auf andere Indikationen für Lupuzor
"Der Vorstand hat sich darauf konzentriert, eine Geschäftsstrategie zu entwickeln, die der ImmuPharma und ihren Aktionären auf der Grundlage ihrer derzeitigen Vermögenswerte, Ressourcen und ihres Know-how den optimalen Weg bietet", sagte der Vorsitzende Tim McCarthy.
"Wir freuen uns als Team, das MAP-Programm voranzutreiben, das Lupus-Patienten einen frühzeitigen Zugang zu Lupuzor ermöglicht.
"Mittelfristig konzentrieren wir uns weiterhin darauf, die volle regulatorische Zulassung von Lupuzor zu erreichen, von dem wir glauben, dass es das Potenzial hat, ein bahnbrechendes Medikament für Lupus-Patienten zu sein, und im Gegenzug Blockbuster-Potenzial in kommerzieller Hinsicht hat."
Nucant-Krebs-Programm macht Fortschritte
Lupuzor ist nicht das einzige Medikament von ImmuPharma, das durch die Klinik geht. Die Behandlung mit Nucant-Krebs hat in zwei Phase-I-Studien zur Sicherheit und Dosisfindung "vielversprechende Ergebnisse" erbracht.
Das Unternehmen hat Vertragsbedingungen für eine klinische Entwicklungszusammenarbeit mit dem Onkologie-Spezialisten Incanthera unterzeichnet, an der ImmuPharma einen Anteil von £ 2 Mio. erworben hat.
Eine Lizenzvereinbarung zwischen den beiden wird voraussichtlich bis Ende des Jahres unterzeichnet werden, wobei Incanthera voraussichtlich eine Vorablizenzgebühr in Höhe von £ 1 Mio. in Aktien entrichten und alle Entwicklungskosten für das Nucant-Programm abdecken wird.
Alle zukünftigen Kommerzialisierungserlöse werden gleichmäßig verteilt, sagte ImmuPharma.
Ureka wird ausgegliedert
Was die Ureka-Tochter des Unternehmens betrifft, die Behandlungen für Diabetes Typ II und NASH entwickeln will, wurde die Entscheidung getroffen, sie zu verkaufen.
Trotz "spannender und innovativer Technologien" sieht der Vorstand nicht als Teil der langfristigen Strategie.
Aus diesem Grund ist geplant, die in Bordeaux ansässige Tochtergesellschaft zu veräußern und dabei weiterhin an einem Interesse zu partizipieren, sollte eines seiner Medikamente später einen kommerziellen Erfolg erzielen.
"Unser Nucant-Programm und unsere Ureka-Tochter sind seit einigen Jahren Teil unseres Portfolios", fügte McCarthy hinzu.
"Wir sind gleichermaßen von dem Potenzial beider Seiten begeistert. Wir glauben, dass die Strategie, die wir heute für beide angekündigt haben, für die Aktionäre in Zukunft einen Mehrwert schaffen wird. "
Für mich ist das keine gute Nachricht!
Sie haben keinen Partner bekommen oder keiner wollte einsteigen und daher kommt jetzt so ein Programm mit 500 Patienten um Zeit zu gewinnen! Es wird bis zu 2 Jahren dauern und hoffen wir das die finanziellen Mittel ausreichen!
Jetzt auszusteigen macht für mich keinen Sinn, ob ich 90% oder 100% verliere ist egal. Daher bleibe ich drinne, aber Grosse Hoffnungen habe ich nicht mehr !!!!!
Sie haben keinen Partner bekommen oder keiner wollte einsteigen und daher kommt jetzt so ein Programm mit 500 Patienten um Zeit zu gewinnen! Es wird bis zu 2 Jahren dauern und hoffen wir das die finanziellen Mittel ausreichen!
Jetzt auszusteigen macht für mich keinen Sinn, ob ich 90% oder 100% verliere ist egal. Daher bleibe ich drinne, aber Grosse Hoffnungen habe ich nicht mehr !!!!!
Antwort auf Beitrag Nr.: 58.641.576 von bio-profi am 07.09.18 12:35:20
Es gibt dann doch weitaus mehr Möglichkeiten als nur diese zwei...
Zitat von bio-profi: Sie haben keinen Partner bekommen oder keiner wollte einsteigen [...]
Es gibt dann doch weitaus mehr Möglichkeiten als nur diese zwei...
Antwort auf Beitrag Nr.: 58.641.576 von bio-profi am 07.09.18 12:35:20 bis zu 500 Lupuspatienten erhalten Lupuzor als Teil eines Managed Access Programms
Das ist eine Hausnummer! Diese 500 Patienten stehen nicht nur bei Immuph unter Beobachtung , sondern bei allen anderen Unternehmen die nur Entfernt mit dieser Materie zu tun haben .
Der Vertrag mit einem Spezialanbieter ermöglicht bis zu 500 Patienten einen dauerhaften Zugang zu Lupuzor, dem Flaggschiff-Medikament von Immupharma, für mindestens zwei Jahre. Der AIM-quote Medikamentenentwickler wird nicht nur den Patienten helfen, sondern auch mehr wertvolle Daten über Lupuzor sammeln, was nützlich sein wird, wenn und wenn es beschließt, regulatorische Einreichungen voranzutreiben.
Sollte sich also schon früher eine Wirksamkeit des Medikamentes bei den 500 Personen abzeichnen ist dies schneller bei der FDA als wir erfahren.
Aber noch schneller wird die Konkurrenz mit den dicken Geldbeutel sein sollte sich die Wirksamkeit abzeichnen.
Ich für meinen Teil werde halten.....
Gruß
Das ist eine Hausnummer! Diese 500 Patienten stehen nicht nur bei Immuph unter Beobachtung , sondern bei allen anderen Unternehmen die nur Entfernt mit dieser Materie zu tun haben .
Der Vertrag mit einem Spezialanbieter ermöglicht bis zu 500 Patienten einen dauerhaften Zugang zu Lupuzor, dem Flaggschiff-Medikament von Immupharma, für mindestens zwei Jahre. Der AIM-quote Medikamentenentwickler wird nicht nur den Patienten helfen, sondern auch mehr wertvolle Daten über Lupuzor sammeln, was nützlich sein wird, wenn und wenn es beschließt, regulatorische Einreichungen voranzutreiben.
Sollte sich also schon früher eine Wirksamkeit des Medikamentes bei den 500 Personen abzeichnen ist dies schneller bei der FDA als wir erfahren.
Aber noch schneller wird die Konkurrenz mit den dicken Geldbeutel sein sollte sich die Wirksamkeit abzeichnen.
Ich für meinen Teil werde halten.....
Gruß
Antwort auf Beitrag Nr.: 58.641.576 von bio-profi am 07.09.18 12:35:20Vor allem steigen sie de facto aus den anderen Programmen aus. Das heißt man setzt alles auf Lupus.
Und der Deal bzgl Nucant mit Incanthera hat doch ein Geschmäckle, da Mr. McCarthy chairman sowohl von immupharma als auch von incanthera ist.
Und der Deal bzgl Nucant mit Incanthera hat doch ein Geschmäckle, da Mr. McCarthy chairman sowohl von immupharma als auch von incanthera ist.
Aber es kann doch sein, dass die Lizenzvereinbarung mit Incanthera gegen Ende des Jahres sich als Kursbooster erweist, meint ihr nicht?
Leute, ich bin auch investiert in immu und hätte mir auch bessere news gewünscht. Wenn das so eine gute Nachricht wäre, hätten wir einen Kurs um die 30. Der Markt sieht leider diese news genau wie ich, negativ! Was jetzt kommt ist, dass immu Zeit und Geld benötigt.
Es gibt keinen Partner oder sogar eine Übernahme und da ist die schlecht Nachricht. Es muss weiter geforscht werden und das ist nicht gern gesehen an der Börse!!
Es gibt keinen Partner oder sogar eine Übernahme und da ist die schlecht Nachricht. Es muss weiter geforscht werden und das ist nicht gern gesehen an der Börse!!
Und noch was: heute haben die ein 52 Wochentage bei 18,37 gesehen!
Schade schade!
Schade schade!
Der Kurs taucht jetzt unter 20 Cent, echt schade. Mal sehen, wie es nächste Woche weitergeht.
Die Frage ist jetzt: Aufstocken oder flüchten? Ich bin noch unentschlossen...
das wird jetzt zäh und lange bis etwas rauskommt
Ich werde nicht aufstocken! Es ist ein langer und schwieriger Weg bis zu positiven news!
Immupharma wusste schon dass die heutige news negativ aufgenommen wird und hat sie daher am Freitag veröffentlicht. Bei Good news wäre es bestimmt Anfang de der Woche gewesen!
Immupharma wusste schon dass die heutige news negativ aufgenommen wird und hat sie daher am Freitag veröffentlicht. Bei Good news wäre es bestimmt Anfang de der Woche gewesen!
Es ist glaub besser die Reißleine zu ziehen, der Kurs gibt immer mehr nach, keine Ahnung, wo ein Boden ist.
Kurz vor der News letzte Woche auch leider nochmals nachgekauft. Werde auf jeden Fall hier aussitzen.
Glaube weiterhin, daß das Medikament über kurz odee lang zugelassen wird. Und wenn das erst in 2-3 Jahren der Fall ist auch gut... ;-)
Auch wünschenswert für die Betroffenen!
Glaube weiterhin, daß das Medikament über kurz odee lang zugelassen wird. Und wenn das erst in 2-3 Jahren der Fall ist auch gut... ;-)
Auch wünschenswert für die Betroffenen!
Antwort auf Beitrag Nr.: 58.661.577 von Stoxtrayder am 10.09.18 15:47:45Werde auf keinen Fall verkaufen , sondern eher das Gegenteil.
Immuph hat einen Wert der hier nicht mal annähernd eingeflossen ist.
Ob die jetzt noch ein Jahr oder 2 Jahre brauchen ist mir auch egal.
Fakt ist; Immuph sind mit Lupus sehr weit gekommen, lediglich auf die letzten Meter ausgebremst . Dadurch wissen sie jetzt auch sehr genau wo sie ansetzen müssen um weiter zu kommen.
Das was jetzt einfach noch extrem verunsichert sind die Finanzen , wo keiner weis wo sie hier stehen und was noch vorh. ist.
Was bringt der angekündigte Verkauf ? Wieviel benötigen sie die nächsten 2 Jahre noch ?
Wie verhalten sie sich wenn ein Ritter kommt ? …............USW USW = der Kurs von 0,16 Euro-Cent.
Gruß
Immuph hat einen Wert der hier nicht mal annähernd eingeflossen ist.
Ob die jetzt noch ein Jahr oder 2 Jahre brauchen ist mir auch egal.
Fakt ist; Immuph sind mit Lupus sehr weit gekommen, lediglich auf die letzten Meter ausgebremst . Dadurch wissen sie jetzt auch sehr genau wo sie ansetzen müssen um weiter zu kommen.
Das was jetzt einfach noch extrem verunsichert sind die Finanzen , wo keiner weis wo sie hier stehen und was noch vorh. ist.
Was bringt der angekündigte Verkauf ? Wieviel benötigen sie die nächsten 2 Jahre noch ?
Wie verhalten sie sich wenn ein Ritter kommt ? …............USW USW = der Kurs von 0,16 Euro-Cent.
Gruß
Ich werde auch nicht verkaufen, aber meine Hoffnungen sind extrem gesunken. Wie tief geht es noch!?!?!
Jedesmal denke ich den Boden ist erreicht und dann rutscht die Aktie nochmal ab. Jetzt schon mit einer market cap von unter 20 mio!
Wieviel Geld hat das Unternehmen?
Burn rate pro Jahr ?
Entwicklungskosten für Medikamente?
Hat jemand antworten auf diese Fragen??
Jedesmal denke ich den Boden ist erreicht und dann rutscht die Aktie nochmal ab. Jetzt schon mit einer market cap von unter 20 mio!
Wieviel Geld hat das Unternehmen?
Burn rate pro Jahr ?
Entwicklungskosten für Medikamente?
Hat jemand antworten auf diese Fragen??
man sollte hier auf jeden fall erstmal komplett den boden finden lassen bevor man nachkäufe startet...
ich versuche mal zum wochenende hin mal ein paar fakten zusammenzusuchen, falls nicht jemand schon ein paar daten parat hat.
ich versuche mal zum wochenende hin mal ein paar fakten zusammenzusuchen, falls nicht jemand schon ein paar daten parat hat.
Antwort auf Beitrag Nr.: 58.668.873 von walle1fc am 11.09.18 11:29:36Wichtiger Passus in der letzen News war für mich , das Sie die neue Phase aus eigenen Mitteln bzw. Vorhandenem Cash durchbringen.
Das lässt Raum für Spekulationen. Ich gehe davon aus , dass Immu Lupuzor nicht unter Wert verkaufen möchte und sie die Angebote nach der gescheiterten P3 alle abgelehnt haben und nach wie vor von Lupuzor überzeugt sind - so wie ich auch 😎 Fakt nochmal als Erinnerung ! Lupuzor hat gut gewirkt nur halt Placebo im Vergleich auch .... der Weg ist gut !
Das lässt Raum für Spekulationen. Ich gehe davon aus , dass Immu Lupuzor nicht unter Wert verkaufen möchte und sie die Angebote nach der gescheiterten P3 alle abgelehnt haben und nach wie vor von Lupuzor überzeugt sind - so wie ich auch 😎 Fakt nochmal als Erinnerung ! Lupuzor hat gut gewirkt nur halt Placebo im Vergleich auch .... der Weg ist gut !
Immupharma zeigt Fortschritte bei der Einführung der Lupus-Therapie
7. September 2018 10:32 | ImmuPharma PLC
Das Pharmaunternehmen Immupharma sagte am Freitag, dass es eine Vereinbarung mit einem spezialisierten Anbieter getroffen habe, um die Lupus-Behandlung des Unternehmens über ein Managed-Access-Programm zu vertreiben.
Die Hauptziele des Managed-Access-Programms, das auf den klinischen und sicherheitsrelevanten Daten der kürzlich angekündigten Phase-III-Studie basiert, sind die Förderung der Lupus-Behandlung durch den Lupus-Patienten, indem Lupus-Patienten frühzeitig Zugang zu der Behandlung erhalten.
Das Unternehmen bestätigte außerdem, dass die am 18. Januar 2018 angekündigte Lupuzoropen-Label-Extension-Studie die Aufnahme von insgesamt 62 teilnahmeberechtigten Patienten aus der ursprünglichen Phase-III-Studie, die in den USA und Europa rekrutiert wurden, abgeschlossen hatte.
Die Studie soll Ergebnisse im zweiten Quartal 2019 vorlegen.
Das Unternehmen gab bekannt, dass es eine Reihe von Optionen zur Entwicklung seines Nucant-Krebsprogramms überprüft und mit Incanthera Limited, einem Spezialisten für Onkologie-Entwicklung, Bedingungen für eine klinische Entwicklungskooperation für das Nucant-Krebsprogramm unterzeichnet hat.
Gemäß den Bedingungen der Zusammenarbeit würde Incanthera eine Lizenzzahlung an ImmuPharma in Höhe von £ 1 Mio. in Aktien bezahlen und für die gesamten Entwicklungskosten für das Nucant-Programm verantwortlich sein. Alle zukünftigen Kommerzialisierungserlöse würden zu gleichen Teilen zwischen den beiden Unternehmen aufgeteilt.
Um 10:32 Uhr: (LON: IMM) Der Aktienkurs der ImmuPharma PLC lag bei + 0,13p bei 20,4p.
Story von StockMarketWire.com
7. September 2018 10:32 | ImmuPharma PLC
Das Pharmaunternehmen Immupharma sagte am Freitag, dass es eine Vereinbarung mit einem spezialisierten Anbieter getroffen habe, um die Lupus-Behandlung des Unternehmens über ein Managed-Access-Programm zu vertreiben.
Die Hauptziele des Managed-Access-Programms, das auf den klinischen und sicherheitsrelevanten Daten der kürzlich angekündigten Phase-III-Studie basiert, sind die Förderung der Lupus-Behandlung durch den Lupus-Patienten, indem Lupus-Patienten frühzeitig Zugang zu der Behandlung erhalten.
Das Unternehmen bestätigte außerdem, dass die am 18. Januar 2018 angekündigte Lupuzoropen-Label-Extension-Studie die Aufnahme von insgesamt 62 teilnahmeberechtigten Patienten aus der ursprünglichen Phase-III-Studie, die in den USA und Europa rekrutiert wurden, abgeschlossen hatte.
Die Studie soll Ergebnisse im zweiten Quartal 2019 vorlegen.
Das Unternehmen gab bekannt, dass es eine Reihe von Optionen zur Entwicklung seines Nucant-Krebsprogramms überprüft und mit Incanthera Limited, einem Spezialisten für Onkologie-Entwicklung, Bedingungen für eine klinische Entwicklungskooperation für das Nucant-Krebsprogramm unterzeichnet hat.
Gemäß den Bedingungen der Zusammenarbeit würde Incanthera eine Lizenzzahlung an ImmuPharma in Höhe von £ 1 Mio. in Aktien bezahlen und für die gesamten Entwicklungskosten für das Nucant-Programm verantwortlich sein. Alle zukünftigen Kommerzialisierungserlöse würden zu gleichen Teilen zwischen den beiden Unternehmen aufgeteilt.
Um 10:32 Uhr: (LON: IMM) Der Aktienkurs der ImmuPharma PLC lag bei + 0,13p bei 20,4p.
Story von StockMarketWire.com
Antwort auf Beitrag Nr.: 58.668.615 von bio-profi am 11.09.18 11:05:36Hast schon bei Viking rein geschaut?
Gruß aaahhh
Gruß aaahhh
Ernennung von Joint Brokers
ImmuPharma PLC (AIM: IMM.L), das auf die Entdeckung und Entwicklung von Arzneimitteln spezialisierte Unternehmen, freut sich bekannt zu geben, dass es ab sofort Stanford Capital Partners und SI Capital als gemeinsame Broker ernannt hat. Sie arbeiten mit Northland Capital Partners zusammen, die NOMAD und Broker des Unternehmens sind.
Tim McCarthy, Vorsitzender von ImmuPharma, sagte zur Ankündigung:
"Wir freuen uns auf die Fortschritte der ImmuPharma im Rahmen unserer kürzlich angekündigten Unternehmensaktualisierung. Im Rahmen unserer kontinuierlichen proaktiven Investor-Relations-Strategie freuen wir uns auch auf die Zusammenarbeit mit Stanford Capital und SI Capital als Teil unserer Unternehmensberatung Mannschaft.
ImmuPharma PLC (AIM: IMM.L), das auf die Entdeckung und Entwicklung von Arzneimitteln spezialisierte Unternehmen, freut sich bekannt zu geben, dass es ab sofort Stanford Capital Partners und SI Capital als gemeinsame Broker ernannt hat. Sie arbeiten mit Northland Capital Partners zusammen, die NOMAD und Broker des Unternehmens sind.
Tim McCarthy, Vorsitzender von ImmuPharma, sagte zur Ankündigung:
"Wir freuen uns auf die Fortschritte der ImmuPharma im Rahmen unserer kürzlich angekündigten Unternehmensaktualisierung. Im Rahmen unserer kontinuierlichen proaktiven Investor-Relations-Strategie freuen wir uns auch auf die Zusammenarbeit mit Stanford Capital und SI Capital als Teil unserer Unternehmensberatung Mannschaft.
ImmuPharma hat sich Lupuzor vor dem Managed-Access-Programm fest verpflichtet
Aktie
14:31 18. September 2018
Tim McCarthy, Chairman von ImmuPharma PLC ( LON: IMM ), sagt Lupus-Behandlung Lupuzor wird in Managed Access-Programm eingegeben werden, um Patienten, deren Ärzte es empfehlen, zu ermöglichen.
Immupharma wird Daten aus dem MAP mit bis zu 500 Patienten erhalten, um das Medikament für zwei Jahre kostenlos zu erhalten.
Das ist mehr als doppelt so viele Patienten, die bisher in allen klinischen Studien für Lupuzor untersucht wurden.
Ein großer Vorteil besteht darin, dass Daten aus der "echten Welt" dazu verwendet werden können, eine regulatorische Einreichung zu ergänzen.
Mercks Keytruda-I / O-Krebsbehandlung setzte zum Beispiel MAP intensiv ein.
Eine Erweiterungsstudie zu Lupozors Phase-III-Studie werde auch nächstes Jahr berichten, sagte McCarthy.
Treffen Sie Arix Bioscience Plc, Avacta Group Plc und Silence Therapeutics plc auf unserer Veranstaltung in London, 4. Oktober 2018. Hieranmelden »
Aktie
Andrew Scott
WARUM IN DIE INVUPHARMA PLC INVESTIEREN? LESEN SIE MEHR HIER
REGISTRIEREN SIE SICH HIER, UM ÜBER ZUKÜNFTIGE PRODUKTE VON IMMUPHARMA PLC INFORMIERT ZU WERDEN
VERWANDTE BELIEBTE VIDEOS

Der Vorsitzende von ImmuPharma ist optimistischer für die Ergebnisse seiner Droge Lupuzor
29. Mai 2018
Tim McCarthy, Vorsitzender von ImmuPharma PLC (LON: IMM), teilt Proactive mit, dass es starke Anzeichen dafür gibt, dass in bestimmten Populationen von Lupus-Patienten seine Lupuzor-Droge sehr effektiv wirkt. McCarthy sprach nach einem tieferen Eintauchen in die Daten, die durch die Phase-III-Studie der Firma ...

Die Firma Immupharma PLC ist weiterhin zuversichtlich in die Zukunft von Lupuzor
19. April 2018
Der CEO der ImmuPharma PLC (LON: IMM) Dimitri Dimitriou und der Vorsitzende Tim McCarthy diskutieren mit Proactive Investors die Top-Ergebnisse ihrer Phase-III-Studie mit dem Medikament Lupuzor. Die Daten zeigten, dass Lupuzor wirksamer war als das Placebo (52,5% gegenüber 44,6%), da die Ansprechrate für diejenigen, die ...

ImmuPharma Droge könnte immer noch eine Rolle bei der Behandlung von Lupus - City-Analyst spielen
17. April 2018
ImmuPharma PLC (LON: IMM) Droge Lupuzor braucht weitere Analyse und ist sicherlich keine Pleite, nach Vadim Alexandre, Analyst bei Northland Capital. Bei stark rückläufigen Anteilen war die Reaktion auf die Phase-III-Studienergebnisse für das Lupus-Medikament "reflexartig" und spiegelt wahrscheinlich nicht vollständig die Aussichten für die ...
IMMUPHARMA PLC
Markt:ZIELEPOS:IMMMarktkapitalisierung:18.86MLetzter Preis:13.53p (3.84 % )52-week H/L:193.00p / 12.00pSector:Pharma & Biotech
1day
6months
1year
AprMayJunJulAugSep050100150200
VIEW FULL IMM PROFILE VIEW PROFILE
IMMUPHARMA PLC TIMELINE
ARTICLE
Thu
MANAGED ACCESS PROGRAMMES OFFER AN ALTERNATIVE WAY FORWARD FOR DRUG COMPANIES
VIDEO
Tue
IMMUPHARMA FIRMLY COMMITTED TO LUPUZOR AHEAD OF MANAGED ACCESS PROGRAMME
BIG PICTURE
September 07 2018
IMMUPHARMA’S FLAGSHIP LUPUS DRUG TO BE MADE AVAILABLE TO PATIENTS AHEAD OF REGULATORY FILING
NEWSWIRE
June 14 2018
IMMUPHARMA SAYS PRE-CLINICAL STUDY POINTS TO OTHER INDICATIONS FOR LEAD DRUG
VIDEO
May 29 2018
IMMUPHARMA CHAIRMAN MORE OPTIMISTIC ON RESULTS FOR ITS LUPUZOR DRUG
ARTICLE
May 29 2018
IMMUPHARMA SHARES JUMP AS CHAIRMAN UPBEAT AFTER PHASE III DATA REVIEW FOR FLAGSHIP DRUG
ARTICLE
April 23 2018
IMMUPHARMA CHAIRMAN AND CHIEF EXECUTIVE UPBEAT ON LUPUZOR; INDUSTRY INTEREST REMAINS STRONG
VIDEO
April 19 2018
IMMUPHARMA PLC STILL CONFIDENT ON LUPUZOR'S FUTURE
ARTICLE
April 18 2018
IMMUPHARMA DRUG NEEDS FURTHER ANALYSIS; IT COULD STILL HAVE A ROLE IN TREATING LUPUS – CITY ANALYST
VIDEO
April 17 2018
IMMUPHARMA DRUG COULD STILL HAVE A ROLE IN TREATING LUPUS – CITY ANALYST
VIEW ALL STORIES
NO INVESTMENT ADVICE
The Company is a publisher. You understand and agree that no content published on the Site constitutes a recommendation that any particular security, portfolio of securities, transaction, or investment strategy is suitable or advisable for any specific person. You further understand that none of the information providers or their affiliates will advise you personally concerning the nature, potential, advisability, value or suitability of any particular security, portfolio of securities, transaction, investment strategy, or other matter.
You understand that the Site may contain opinions from time to time with regard to securities mentioned in other products, including company related products, and that those opinions may be different from those obtained by using another product related to the Company. You understand and agree that contributors may write about securities in which they or their firms have a position, and that they may trade such securities for their own account. In cases where the position is held at the time of publication and such position is known to the Company, appropriate disclosure is made. However, you understand and agree that at the time of any transaction that you make, one or more contributors may have a position in the securities written about. You understand that price and other data is supplied by sources believed to be reliable, that the calculations herein are made using such data, and that neither such data nor such calculations are guaranteed by these sources, the Company, the information providers or any other person or entity, and may not be complete or accurate.
From time to time, reference may be made in our marketing materials to prior articles and opinions we have published. These references may be selective, may reference only a portion of an article or recommendation, and are likely not to be current. As markets change continuously, previously published information and data may not be current and should not be relied upon.
International: NA AU CA DE CN
OUR COMPANY
TERM & CONDITIONS
THE TEAM
CONTACT US
NEWSLETTER
SITEMAP
COOKIES
WORK FOR US
© Proactive Investors 2018
Proactive Investors Limited, die als "Proactive Investors United Kingdom" gehandelt wird, ist von der Financial Conduct Authority zugelassen und wird von dieser reguliert.
Registriert in England mit der Firmenregistrierungsnummer 05639690. Gruppe USt-IdNr. 872070825 FCA Registrierungsnummer 559082. Sie können uns hier erreichen .
Markt-Indizes, Rohstoffe und regulatorische Neuigkeiten Schlagzeilen copyright © Morningstar. Daten verzögern 15 Minuten, wenn nicht anders angegeben. Nutzungsbedingungen
Aktie
14:31 18. September 2018
Tim McCarthy, Chairman von ImmuPharma PLC ( LON: IMM ), sagt Lupus-Behandlung Lupuzor wird in Managed Access-Programm eingegeben werden, um Patienten, deren Ärzte es empfehlen, zu ermöglichen.
Immupharma wird Daten aus dem MAP mit bis zu 500 Patienten erhalten, um das Medikament für zwei Jahre kostenlos zu erhalten.
Das ist mehr als doppelt so viele Patienten, die bisher in allen klinischen Studien für Lupuzor untersucht wurden.
Ein großer Vorteil besteht darin, dass Daten aus der "echten Welt" dazu verwendet werden können, eine regulatorische Einreichung zu ergänzen.
Mercks Keytruda-I / O-Krebsbehandlung setzte zum Beispiel MAP intensiv ein.
Eine Erweiterungsstudie zu Lupozors Phase-III-Studie werde auch nächstes Jahr berichten, sagte McCarthy.
Treffen Sie Arix Bioscience Plc, Avacta Group Plc und Silence Therapeutics plc auf unserer Veranstaltung in London, 4. Oktober 2018. Hieranmelden »
Aktie
Andrew Scott
WARUM IN DIE INVUPHARMA PLC INVESTIEREN? LESEN SIE MEHR HIER
REGISTRIEREN SIE SICH HIER, UM ÜBER ZUKÜNFTIGE PRODUKTE VON IMMUPHARMA PLC INFORMIERT ZU WERDEN
VERWANDTE BELIEBTE VIDEOS

Der Vorsitzende von ImmuPharma ist optimistischer für die Ergebnisse seiner Droge Lupuzor
29. Mai 2018
Tim McCarthy, Vorsitzender von ImmuPharma PLC (LON: IMM), teilt Proactive mit, dass es starke Anzeichen dafür gibt, dass in bestimmten Populationen von Lupus-Patienten seine Lupuzor-Droge sehr effektiv wirkt. McCarthy sprach nach einem tieferen Eintauchen in die Daten, die durch die Phase-III-Studie der Firma ...

Die Firma Immupharma PLC ist weiterhin zuversichtlich in die Zukunft von Lupuzor
19. April 2018
Der CEO der ImmuPharma PLC (LON: IMM) Dimitri Dimitriou und der Vorsitzende Tim McCarthy diskutieren mit Proactive Investors die Top-Ergebnisse ihrer Phase-III-Studie mit dem Medikament Lupuzor. Die Daten zeigten, dass Lupuzor wirksamer war als das Placebo (52,5% gegenüber 44,6%), da die Ansprechrate für diejenigen, die ...

ImmuPharma Droge könnte immer noch eine Rolle bei der Behandlung von Lupus - City-Analyst spielen
17. April 2018
ImmuPharma PLC (LON: IMM) Droge Lupuzor braucht weitere Analyse und ist sicherlich keine Pleite, nach Vadim Alexandre, Analyst bei Northland Capital. Bei stark rückläufigen Anteilen war die Reaktion auf die Phase-III-Studienergebnisse für das Lupus-Medikament "reflexartig" und spiegelt wahrscheinlich nicht vollständig die Aussichten für die ...
IMMUPHARMA PLC
Markt:ZIELEPOS:IMMMarktkapitalisierung:18.86MLetzter Preis:13.53p (3.84 % )52-week H/L:193.00p / 12.00pSector:Pharma & Biotech
1day
6months
1year
AprMayJunJulAugSep050100150200
VIEW FULL IMM PROFILE VIEW PROFILE
IMMUPHARMA PLC TIMELINE
ARTICLE
Thu
MANAGED ACCESS PROGRAMMES OFFER AN ALTERNATIVE WAY FORWARD FOR DRUG COMPANIES
VIDEO
Tue
IMMUPHARMA FIRMLY COMMITTED TO LUPUZOR AHEAD OF MANAGED ACCESS PROGRAMME
BIG PICTURE
September 07 2018
IMMUPHARMA’S FLAGSHIP LUPUS DRUG TO BE MADE AVAILABLE TO PATIENTS AHEAD OF REGULATORY FILING
NEWSWIRE
June 14 2018
IMMUPHARMA SAYS PRE-CLINICAL STUDY POINTS TO OTHER INDICATIONS FOR LEAD DRUG
VIDEO
May 29 2018
IMMUPHARMA CHAIRMAN MORE OPTIMISTIC ON RESULTS FOR ITS LUPUZOR DRUG
ARTICLE
May 29 2018
IMMUPHARMA SHARES JUMP AS CHAIRMAN UPBEAT AFTER PHASE III DATA REVIEW FOR FLAGSHIP DRUG
ARTICLE
April 23 2018
IMMUPHARMA CHAIRMAN AND CHIEF EXECUTIVE UPBEAT ON LUPUZOR; INDUSTRY INTEREST REMAINS STRONG
VIDEO
April 19 2018
IMMUPHARMA PLC STILL CONFIDENT ON LUPUZOR'S FUTURE
ARTICLE
April 18 2018
IMMUPHARMA DRUG NEEDS FURTHER ANALYSIS; IT COULD STILL HAVE A ROLE IN TREATING LUPUS – CITY ANALYST
VIDEO
April 17 2018
IMMUPHARMA DRUG COULD STILL HAVE A ROLE IN TREATING LUPUS – CITY ANALYST
VIEW ALL STORIES
NO INVESTMENT ADVICE
The Company is a publisher. You understand and agree that no content published on the Site constitutes a recommendation that any particular security, portfolio of securities, transaction, or investment strategy is suitable or advisable for any specific person. You further understand that none of the information providers or their affiliates will advise you personally concerning the nature, potential, advisability, value or suitability of any particular security, portfolio of securities, transaction, investment strategy, or other matter.
You understand that the Site may contain opinions from time to time with regard to securities mentioned in other products, including company related products, and that those opinions may be different from those obtained by using another product related to the Company. You understand and agree that contributors may write about securities in which they or their firms have a position, and that they may trade such securities for their own account. In cases where the position is held at the time of publication and such position is known to the Company, appropriate disclosure is made. However, you understand and agree that at the time of any transaction that you make, one or more contributors may have a position in the securities written about. You understand that price and other data is supplied by sources believed to be reliable, that the calculations herein are made using such data, and that neither such data nor such calculations are guaranteed by these sources, the Company, the information providers or any other person or entity, and may not be complete or accurate.
From time to time, reference may be made in our marketing materials to prior articles and opinions we have published. These references may be selective, may reference only a portion of an article or recommendation, and are likely not to be current. As markets change continuously, previously published information and data may not be current and should not be relied upon.
International: NA AU CA DE CN
OUR COMPANY
TERM & CONDITIONS
THE TEAM
CONTACT US
NEWSLETTER
SITEMAP
COOKIES
WORK FOR US
© Proactive Investors 2018
Proactive Investors Limited, die als "Proactive Investors United Kingdom" gehandelt wird, ist von der Financial Conduct Authority zugelassen und wird von dieser reguliert.
Registriert in England mit der Firmenregistrierungsnummer 05639690. Gruppe USt-IdNr. 872070825 FCA Registrierungsnummer 559082. Sie können uns hier erreichen .
Markt-Indizes, Rohstoffe und regulatorische Neuigkeiten Schlagzeilen copyright © Morningstar. Daten verzögern 15 Minuten, wenn nicht anders angegeben. Nutzungsbedingungen
Sorry, die Tabellen hat es beim Copy&Paste zerschlagen:
26 SEPTEMBER 2018
ImmuPharma PLC
("ImmuPharma" or the "Company")
INTERIM RESULTS ANNOUNCEMENT
for the six months ended 30 June 2018
ImmuPharma PLC (LSE:IMM), ("ImmuPharma" or the "Company"), the specialist drug discovery and development company, is pleased to announce its interim results for the six months ended 30 June 2018 (the "Period").
Key Highlights
LupuzorTM
•Lupuzor™ demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients. However, due to the high response rate in the placebo group, this superior response did not allow statistical significance to be reached (p = 0.2631) and the trial's primary end point was not met.
•Across the whole study population, in those patients who had anti-dsDNA autoantibodies, LupuzorTM demonstrated a superior response rate over placebo (61.5% vs 47.3%, p = 0.0967). Although these results were not statistically significant, further data analysis demonstrated that in the Europe cohort (130 patients) LupuzorTM plus standard of care showed statistically significant reductions in disease activity compared to placebo plus standard of care in 79 patients who were anti-dsDNA autoantibody positive (71.1% vs 48.8%, p = 0.0218).
•The study confirmed the outstanding safety profile of LupuzorTM, with no serious adverse events reported.
•As announced on 7 September 2018, agreement signed with a specialist provider to enter LupuzorTM into a 'Managed Access Programme'.
•Open label extension study completes recruitment.
Other programs
•Nucant (cancer) program - Clinical Development Collaboration with Incanthera Limited.
•Peptide platform program / Ureka subsidiary - ImmuPharma to begin divestment process.
Financial Position
•£10 million fundraising (before expenses) successfully completed in January 2018.
•Stable financial performance over the Period, in line with market expectations
o Net assets of £9.9 million (31 December 2017: £3.6 million)
o Loss for the period of £4.1 million (H1 2017: £3.0 million)
Research and Development expenses of £2.5 million (H1 2017: £2.3 million)
o Basic and diluted loss per share of 2.94p (H1 2017: 2.34p)
Appointment of new joint brokers
•Stanford Capital Partners and SI Capital appointed as joint brokers, working in conjunction with current NOMAD and broker, Northland Capital Partners.
Commenting on the Interims and outlook Tim McCarthy, Chairman, said:
"The Board is pleased to announce the interim results for the six months ended 30 June 2018. It has been a busy period for the Board following the announcement of the Phase III trial results for Lupuzor in April 2018. We remain focused on delivering a business strategy which provides the optimum route forward for ImmuPharma and its shareholders, based on its current assets, resources and knowhow. We were obviously disappointed with the outcome of the Phase III trial results but are excited to be progressing the Managed Access Programme with a new strategic partner, which allows lupus patients early access to LupuzorTM. In the medium term, we remain focussed on achieving the full regulatory approval of LupuzorTM which we believe has the potential to be a ground breaking drug for lupus patients with blockbuster potential in commercial terms.
Our Nucant programme and Ureka subsidiary have been part of our portfolio for a number of years. We are equally excited by the potential of both. We believe the strategy we announced earlier this month, together with a robust financial position, will create enhanced value for shareholders going forward."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
For further information please contact:
ImmuPharma PLC + 44 (0) 20 7152 4080
Tim McCarthy, Chairman
Dimitri Dimitriou, Chief Executive Officer
Tracy Weimar, Vice President, Operations and Finance
Lisa Baderoon, Head of Investor Relations + 44 (0) 7721 413496
Northland Capital Partners Limited, Nomad & Joint Broker +44 (0) 20 3861 6625
David Hignell, Jamie Spotswood, Dugald Carlean, Corporate Finance
Rob Rees, Corporate Broking
Stanford Capital Partners, Joint Broker
Patrick Claridge
Chris Coleman
+44 (0) 20 3815 8880
SI Capital, Joint Broker
Nick Emerson +44 (0) 1483 413500
CHAIRMAN'S STATEMENT
INTERIM HIGHLIGHTS
The first half of 2018 saw the completion of our pivotal Phase III trial for LupuzorTM, our candidate for the treatment of lupus. Top-line results were announced on 17 April 2018 with further analysis provided on 29 May 2018. Following these results, ImmuPharma has recently signed an agreement with a specialist provider to distribute LupuzorTM via a Managed Access Programme. This will allow lupus patients early access to LupuzorTM prior to any regulatory filing.
ImmuPharma has, on 6 September 2018, signed a Heads of Terms on a clinical development collaboration for the Nucant cancer programme with Incanthera Limited, a specialist oncology development company. Further, following an extensive review, it has been decided that the Company's Ureka subsidiary which focuses on peptide treatments for metabolic disorders is not part of the ongoing strategy of ImmuPharma which is now fully focused on utilising its resources to develop late stage assets. Consequently, we are beginning the process of divesting Ureka.
In other developments, we were pleased to have completed a successful fund raising of £10 million (before expenses) in January 2018. The fund raising was supported by long term shareholders and the addition of new institutional and private investors.
LupuzorTM Phase III results and next steps
The Phase III trial was a double-blind, randomised, placebo-controlled trial. The study involved patients being dosed for one year, receiving 0.2mg once per month subcutaneously. 293 patients were screened illustrating the demand from physicians for a new, safe and effective treatment for lupus. Of these, the required 202 patients were successfully recruited and randomised (dosed). Patients participated in the trial in 7 countries across 28 sites.
The clinical trial was undertaken primarily by Simbec-Orion, an international clinical research organisation, who specialises in rare and orphan conditions and has previous direct experience in lupus trials. This was a pivotal study designed to demonstrate the safety and efficacy of Lupuzor™.
Lupuzor™ demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients. However, due to the high response rate in the placebo group, this superior response did not allow statistical significance to be reached (p = 0.2631) and the trial's primary end point was not met.
Across the whole study population, in those patients who had anti-dsDNA autoantibodies, LupuzorTM demonstrated a superior response rate over placebo (61.5% vs 47.3%, p = 0.0967). Although these results were not statistically significant, further data analysis demonstrated that in the Europe cohort (130 patients) LupuzorTM plus standard of care showed statistically significant reductions in disease activity compared to placebo plus standard of care in 79 patients who were anti-dsDNA autoantibody positive (71.1% vs 48.8%, p = 0.0218).
The study confirmed the outstanding safety profile of LupuzorTM, with no serious adverse events reported.
Scientific literature indicates that approximately 60% - 70% of patients diagnosed for lupus are anti-dsDNA autoantibody positive. These proportions were seen in the Europe cohort (60.8% of patients) and could therefore be considered as representative of the overall lupus population.
In those patients who were anti-dsDNA autoantibody negative, there was almost no difference in disease activity reduction between the active group and the comparator group. Anti-dsDNA autoantibodies are a recognised biomarker for Systemic Lupus Erythematosus.
This finding indicates that the activity of LupuzorTM could be correlated with the presence of anti-dsDNA autoantibodies in lupus patients. ImmuPharma believes that predictive biomarkers, such as anti-dsDNA autoantibodies, could allow identification of patients that are more likely to respond positively to treatment with LupuzorTM.
LupuzorTM next steps - Managed Access Program
ImmuPharma is planning to move forward with a Managed Access Program for LupuzorTM. Recognising that lupus is a disease with significant unmet medical need and given the advanced level of clinical trial investigation completed, ImmuPharma would like to meet demand for access to LupuzorTM by lupus patients who, together with their physicians, request it.
Extension study
The LupuzorTM extension study, which was announced on 18 January 2018, is continuing and recruitment is now complete with a total of 62 patients eligible from the original Phase III trial. We believe that this will provide more valuable information on the potential efficacy and safety of LupuzorTM. The study is anticipated to report results in Q2 2019.
Nucant Platform
A number of options have been under review to develop the Company's Nucant cancer programme, which has demonstrated promising results in two Phase I trials (safety and dose-finding studies).
In order to progress the programme, on 6 September 2018 ImmuPharma signed Heads of Terms on a clinical development collaboration for the Nucant cancer programme, with Incanthera Limited ("Incanthera"), a specialist oncology development company.
Key highlights of the Heads of Terms are summarised below:
•Incanthera, based on its positive due-diligence on the Company's Nucant technology, will license in and take up the continued clinical development of the Nucant cancer programme as an integral part of its own cancer development portfolio.
•As an integral part of the collaboration, upon signing the Heads of Terms, ImmuPharma has invested £2m into Incanthera by subscribing for 363,637 new ordinary Incanthera shares at a price of £5.50 per share. This investment values Incanthera at a pre-money valuation of approximately £10m and is consistent with the most recent funding round that Incanthera completed in March 2018. Following this investment, ImmuPharma will have a circa 16% shareholding in Incanthera.
•ImmuPharma has granted Incanthera a period of exclusivity until 31 December 2018, during which the Company and Incanthera will finalise the terms of a Definitive Licence Agreement for the Nucant technology. These terms are expected to include, but will not be limited to the following:
o Incanthera will pay a licence payment to ImmuPharma of £1 million, with this payment to be made via the issuance of new ordinary shares in Incanthera. This payment in shares is separate and will be in addition to the shareholding which Immupharma currently holds as described above;
o Incanthera will be responsible for all of the development costs for the Nucant programme; and,
o All future commercialisation revenues will be shared equally between the two companies.
Ureka - Divestment process
Ureka, ImmuPharma's wholly owned subsidiary, based in Bordeaux, which is carrying out research into treatments for Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis) has recently demonstrated success in recognised preclinical studies.
Following an extensive review by ImmuPharma's Board of directors, it has been decided that Ureka, whilst having exciting and innovative technologies, is not part of the ongoing strategy of ImmuPharma, which is now fully focused on utilising its resources to develop late stage assets.
As such, ImmuPharma, with its advisors, will now commence a process of considering all opportunities to divest Ureka. The intention is to allow ImmuPharma to divest Ureka, whilst still retaining an interest in any future commercial success.
Financial Review
ImmuPharma's cash balance at 30 June 2018 was £9.02 million (£2.73 million at 31 December 2017, £3.13 million at 30 June 2017). Basic and diluted loss per share were 2.94p and 2.94p respectively (30 June 2017: 2.34p and 2.34p). In line with the Company's current policy, no interim dividend is proposed.
Operating loss for the Period was £4.1 million (£3.2 million for the six months ended 30 June 2017). Research and development expenditure in the Period was £2.5 million (£2.3 million for the six months ended 30 June 2017) reflecting primarily the expenditure related to the LupuzorTM Phase III clinical trial. Administrative expenses were £1.0 million during the Period (£0.8 million for the six months ended 30 June 2017). The share based expense was £775k (£131k for the period ended 30 June 2017) which includes a reduction for the National Insurance provision which was nil due to the decrease in share price from 31 December 2017 to 30 June 2018.
Given the stage of ImmuPharma's development, the fact that losses have continued to be made is to be expected since there is minimal revenue and business activity is concerned with significant investment in the form of clinical development expenditure, in addition to maintaining the infrastructure of the Company.
Current Activities and Outlook
The Board has been focused on delivering a business strategy which provides the optimum route forward for ImmuPharma and its shareholders, based on its current assets, resources and knowhow. We are excited to be progressing the Managed Access Programme which allows lupus patients early access to LupuzorTM. In the medium term, we remain focussed on achieving the full regulatory approval of LupuzorTM which we believe has the potential to be a ground breaking drug for lupus patients with blockbuster potential in commercial terms.
Our Nucant programme and Ureka subsidiary have been part of our portfolio for a number of years. We are equally excited by the potential of both. We believe the strategy we are pursuing with the collaboration with Incanthera Limited for the Nucant and for divestment of Ureka will create enhance value for shareholders going forward.
The Board would like to thank its shareholders, both longstanding and those who participated in the January 2018 fundraising, for their support as well as its staff, corporate and scientific advisers including Simbec-Orion and the CNRS (Centre Nationale de la Recherche Scientifique) for their continued collaboration.
Tim McCarthy
Chairman
ImmuPharma PLC
CONSOLIDATED INCOME STATEMENT
FOR THE PERIOD ENDED 30 JUNE 2018
Note Unaudited
6 months ended
30 June 2018 Audited
Year
ended 31 December
2017 Unaudited
6 months ended
30 June 2017
£ £ £
Continuing operations
Revenue 1 73,392 150,462 86,504
Research and development expenses (2,455,490) (5,121,388) (2,345,815)
Administrative expenses (992,085) (1,520,356) (796,403)
Share based expense (775,135) (742,752) (131,237)
Operating loss (4,149,318) (7,234,034) (3,186,951)
Finance costs (29,425) (3,858) (375)
Finance income 6,077 240,447 153,915
Loss before taxation (4,172,666) (6,997,445) (3,033,411)
Tax 110,237 774,244 (485)
Loss for the period (4,062,429) (6,223,201) (3,033,896)
Attributable to:
Equity holders of the parent company (4,062,429) (6,223,201) (3,033,896)
Loss per ordinary share
Basic and diluted 2 (2.94)p (4.75)p (2.34)p
ImmuPharma PLC
CONSOLIDATED STATEMENT OF COMPREHENSIVE INCOME
FOR THE PERIOD ENDED 30 JUNE 2018
Unaudited
6 months ended
30 June
2018 Audited
Year
ended 31 December
2017 Unaudited
6 months ended
30 June
2017
£ £ £
Loss for the financial period (4,062,429) (6,223,201) (3,033,896)
Other comprehensive income
Items that may be reclassified subsequently to profit or loss:
Exchange differences on translation of foreign operations
29,459
(91,568)
(56,133)
Total items that may be reclassified subsequently to profit or loss 29,459 (91,568) (56,133)
Other comprehensive loss for the period
29,459
(91,568)
(56,133)
Total comprehensive loss for the period (4,032,970) (6,314,769) (3,090,029)
ImmuPharma PLC
CONSOLIDATED STATEMENT OF FINANCIAL POSITION
AS AT 30 JUNE 2018
Note Unaudited
30 June
2018 Audited
31 December
2017 Unaudited
30 June 2017
£ £ £
Non-current assets
Intangible assets 481,667 482,268 497,585
Property, plant and equipment 120,675 161,399 192,573
Total non-current assets 602,342 643,667 690,158
Current assets
Trade and other receivables 1,174,720 1,644,128 2,439,143
Derivative financial asset - - 943,861
Cash and cash equivalents 9,015,630 2,729,468 3,131,595
Total current assets 10,190,350 4,373,596 6,514,599
Current liabilities
Financial liabilities - borrowings 138,214 142,393 119,430
Trade and other payables 737,035 929,569 473,867
Provisions - 57,517 33,162
Total current liabilities 875,249 1,129,479 626,459
Net current assets 9,315,101 3,244,117 5,888,140
Non-current liabilities
Financial liabilities - borrowings 61,209 117,297 170,232
Provisions - 195,989 -
Net assets 9,856,234 3,574,498 6,480,066
EQUITY
Ordinary shares 13,946,744 13,252,299 13,252,298
Share premium 27,320,143 18,728,519 18,728,519
Merger reserve 106,148 106,148 106,148
Other reserves (1,902,921) (2,961,017) (3,316,753)
Retained earnings (29,613,880) (25,551,451) (22,362,146)
Total equity 9,856,234 3,574,498 6,408,066
ImmuPharma PLC
CONSOLIDATED STATEMENT OF CHANGES IN EQUITY
FOR THE PERIOD ENDED 30 JUNE 2018
Share capital Share premium
Merger
reserve Other reserves -
Acquisition
reserve Other reserves -
Translation
Reserve Other reserves -
Equity shares
to be issued
Retained
Earnings Total
equity
£ £ £ £ £ £ £ £
At 1 January 2017
12,463,836 15,678,054 106,148 (3,541,203) (1,609.673) 1,777,131 (19.328.250) 5,546,043
Loss for the financial period - - - - - - (3,033,896) (3,033,896)
Exchange differences on translation
of foreign operations - - - - (56,133) - - (56,133)
New issue of equity capital 788,462 3,311,542 - - - - - 4,100,004
Cost of new issue of equity capital - (261,077) - - - - - (261,077)
Share based payments - - - - - 113,125 - 113,125
At 30 June 2017 13,252,298 18,728,519 106,148 (3,541,203) (1,665,806) 1,890,256 (22,362,146) 6,408,066
At 1 January 2017 12,463,836 15,678,054 106,148 (3,541,203) (1,609,673) 1,777,131 (19,328,250) 5,546,043
Loss for the financial year - - - - - - (6,223,201) (6,223,201)
Exchange differences on translation
of foreign operations - - - - (91,568) - - (91,568)
New issue of equity capital 788,463 3,311,542 - - - - - 4,100,005
Cost of new issue of equity capital - (261,077) - - - - - (261,077)
Share based payments - - - - - 504,296 - 504,296
At 31 December 2017 & 1 January 2018 13,252,299 18,728,519 106,148 (3,541,203) (1,701,241) 2,281,427 (25,551,451) 3,574,498
Loss for the financial period - - - - - - (4,062,429) (4,062,429)
Exchange differences on translation
of foreign operations - - - - 29,459 - - 29,459
New issue of equity capital 694,445 9,305,555 - - - - - 10,000,000
Cost of new issue of equity capital - (713,931) - - - - - (713,931)
Share based payments - - - - - 1,028,637 - 1,028,637
At 30 June 2018 13,946,744 27,320,143 106,148 (3,541,203) (1,671,782) 3,310,064 (29,613,880) 9,856,234
Attributable to:-
Equity holders of the parent company 13,946,744 27,320,143 106,148 (3,541,203) (1,671,782) 3,310,064 (29,613,880) 9,856,234
ImmuPharma PLC
CONSOLIDATED STATEMENT OF CASHFLOWS
FOR THE PERIOD ENDED 30 JUNE 2018
Note Unaudited
6 months ended
30 June 2018 Audited
Year
ended
31 December
2017 Unaudited
6 months ended
30 June
2017
£ £ £
Cash flows from operating activities
Cash used in operations 3 (3,150,500) (5,439,079) (3,200,329)
Tax 213,724 1,021,915 6,680
Interest paid (2,423) (3,858) (375)
Net cash used in operating activities (2,939,199)
(4,421,022) (3,194,024)
Investing activities
Purchase of property, plant and equipment (7,946) (25,491) (1,595)
Interest received 6,077 772 170
Net cash used in investing activities (1,869) (24,719) (1,425)
Financing activities
(Decrease)/increase in bank overdraft (122) (290) (138)
Loan repayments (58,615) (114,386) (80,447)
Gross proceeds from issue of new share capital 10,000,000 4,100,005 4,100,004
Settlements from sharing agreement - 1,667,380 682,360
Share capital issue costs (713,931) (261,077) (261,077)
Net cash generated from financing activities 9,227,332 5,391,632 4,440,702
Net increase in cash and cash equivalents
6,286,264 945,891 1,245,253
Cash and cash equivalents at start of period 2,729,468 1,876,718 1,876,718
Effects of exchange rates on cash and
cash equivalents
(102)
(93,141)
9,624
Cash and cash equivalents at end of period
9,015,630 2,729,468
3,131,595
ImmuPharma PLC
NOTES TO THE CONSOLIDATED INTERIM ACCOUNTS FOR THE PERIOD ENDED 30 JUNE 2018
1 ACCOUNTING POLICIES
Basis of preparation
The interim financial information in this report has been prepared using accounting policies consistent with IFRS as adopted by the European Union. IFRS is subject to amendment and interpretation by the International Accounting Standards Board (IASB) and the IFRS Interpretations Committee and there is an ongoing process of review and endorsement by the European Commission. The financial information has been prepared on the basis of IFRS to be adopted by the European Union and applicable as at 31 December 2018. The Group has chosen not to adopt IAS 34 "Interim Financial Statements" in preparing the interim financial information.
The accounting policies applied are consistent with those that were applied to the financial statements for the year ending 31 December 2017, with the exception of IFRS 9 "Financial Instruments" and IFRS 15 "Revenue from Contracts with Customers" which are new standards applicable mandatory for the year ended 31 December 2018. These new standards will not have a material impact on the financial statements.
Non-Statutory accounts
The financial information set out in this interim report does not constitute the Group's statutory accounts, within the meaning of Section 434 of the Companies Act 2006. The statutory accounts for the year ended 31 December 2017 have been filed with Registrar of Companies. The auditors reported on those accounts; their report was unqualified, did not contain a statement under either Section 498 (2) or Section 498 (3) of the Companies Act 2006 and did not include references to any matters to which the auditor drew attention by way of emphasis. The financial information for the 6 months ended 30 June 2018 and 30 June 2017 is unaudited.
Copies of this statement will be available on the Company's website - www.immupharma.com.
2 LOSS PER SHARE
Unaudited
6 months ended 30 June 2018 Audited
Year ended 31 December
2017 Unaudited
6 months ended 30 June 2017
£ £ £
Loss
Loss for the purposes of basic and diluted loss per share being net loss attributable to equity shareholders (4,062,429)
(6,223,201) (3,033,896)
Number of shares
Weighted average number of ordinary shares for the purposes of basic loss per share 138,201,316 130,902,857 129,517,245
Basic loss per share (2.94)p (4.75)p
(2.34)p
Diluted loss per share (2.94)p (4.75)p (2.34)p
There is no difference between basic loss per share and diluted loss per share as the share options and warrants are anti-dilutive.
The ImmuPharma group has granted share options in respect of shares to be issued.
3 CASH USED IN OPERATIONS
Unaudited
6 months ended
30 June 2018 Audited
Year ended 31 December 2017 Unaudited
6 months
ended
30 June 2017
£ £ £
Operating loss (4,149,318) (7,234,034) (3,186,951)
Depreciation & amortisation 81,424 138,198 61,954
Share based payments 1,028,637 504,296 113,125
Decrease in trade & other receivables 358,921 643,466 34,004
(Decrease)/increase in trade & other payables (189,656) 143,378 (322,963)
(Decrease)/increase in provisions (253,506) 238,456 18,112
Gain/(loss) on foreign exchange (27,002) 127,161 82,390
Cash used in operations
(3,150,500)
(5,439,079)
(3,200,329)
4 SUBSEQUENT EVENTS
On 7 September 2018, ImmuPharma announced that a Heads of Terms agreement was signed with Incanthera Limited. Under the Heads of Terms agreement, Incanthera Limited will license in and take up the continued clinical development of the Nucant cancer programme as an integral part of its own cancer development portfolio. As part of the Heads of Terms, ImmuPharma has invested £2 million into Incanthera Limited by subscribing for 363,637 new ordinary Incanthera shares at a price of £5.50 per share. Following this investment, ImmuPharma will have approximately 16% shareholding in Incanthera Limited. Under the Heads of Terms, ImmuPharma has granted Incanthera Limited a period of exclusivity until 31 December 2018, during which the two companies will finalise terms of a Definitive License Agreement for the Nucant technology. These terms are expected to include, but will not be limited to Incanthera Limited paying a license payment to ImmuPharma of £1 million, with this payment being made via the issuance of new ordinary shares in Incanthera Limited. It is also planned to include confirmation that Incanthera Limited will be responsible for all of the development costs of the Nucant programme and confirmation that all future commercialisation revenues will be shared equally between the two companies.
This information is provided by RNS, the news service of the London Stock Exchange. RNS is approved by the Financial Conduct Authority to act as a Primary Information Provider in the United Kingdom. Terms and conditions relating to the use and distribution of this information may apply. For further information, please contact rns@lseg.com or visit www.rns.com.
END
26 SEPTEMBER 2018
ImmuPharma PLC
("ImmuPharma" or the "Company")
INTERIM RESULTS ANNOUNCEMENT
for the six months ended 30 June 2018
ImmuPharma PLC (LSE:IMM), ("ImmuPharma" or the "Company"), the specialist drug discovery and development company, is pleased to announce its interim results for the six months ended 30 June 2018 (the "Period").
Key Highlights
LupuzorTM
•Lupuzor™ demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients. However, due to the high response rate in the placebo group, this superior response did not allow statistical significance to be reached (p = 0.2631) and the trial's primary end point was not met.
•Across the whole study population, in those patients who had anti-dsDNA autoantibodies, LupuzorTM demonstrated a superior response rate over placebo (61.5% vs 47.3%, p = 0.0967). Although these results were not statistically significant, further data analysis demonstrated that in the Europe cohort (130 patients) LupuzorTM plus standard of care showed statistically significant reductions in disease activity compared to placebo plus standard of care in 79 patients who were anti-dsDNA autoantibody positive (71.1% vs 48.8%, p = 0.0218).
•The study confirmed the outstanding safety profile of LupuzorTM, with no serious adverse events reported.
•As announced on 7 September 2018, agreement signed with a specialist provider to enter LupuzorTM into a 'Managed Access Programme'.
•Open label extension study completes recruitment.
Other programs
•Nucant (cancer) program - Clinical Development Collaboration with Incanthera Limited.
•Peptide platform program / Ureka subsidiary - ImmuPharma to begin divestment process.
Financial Position
•£10 million fundraising (before expenses) successfully completed in January 2018.
•Stable financial performance over the Period, in line with market expectations
o Net assets of £9.9 million (31 December 2017: £3.6 million)
o Loss for the period of £4.1 million (H1 2017: £3.0 million)
Research and Development expenses of £2.5 million (H1 2017: £2.3 million)
o Basic and diluted loss per share of 2.94p (H1 2017: 2.34p)
Appointment of new joint brokers
•Stanford Capital Partners and SI Capital appointed as joint brokers, working in conjunction with current NOMAD and broker, Northland Capital Partners.
Commenting on the Interims and outlook Tim McCarthy, Chairman, said:
"The Board is pleased to announce the interim results for the six months ended 30 June 2018. It has been a busy period for the Board following the announcement of the Phase III trial results for Lupuzor in April 2018. We remain focused on delivering a business strategy which provides the optimum route forward for ImmuPharma and its shareholders, based on its current assets, resources and knowhow. We were obviously disappointed with the outcome of the Phase III trial results but are excited to be progressing the Managed Access Programme with a new strategic partner, which allows lupus patients early access to LupuzorTM. In the medium term, we remain focussed on achieving the full regulatory approval of LupuzorTM which we believe has the potential to be a ground breaking drug for lupus patients with blockbuster potential in commercial terms.
Our Nucant programme and Ureka subsidiary have been part of our portfolio for a number of years. We are equally excited by the potential of both. We believe the strategy we announced earlier this month, together with a robust financial position, will create enhanced value for shareholders going forward."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
For further information please contact:
ImmuPharma PLC + 44 (0) 20 7152 4080
Tim McCarthy, Chairman
Dimitri Dimitriou, Chief Executive Officer
Tracy Weimar, Vice President, Operations and Finance
Lisa Baderoon, Head of Investor Relations + 44 (0) 7721 413496
Northland Capital Partners Limited, Nomad & Joint Broker +44 (0) 20 3861 6625
David Hignell, Jamie Spotswood, Dugald Carlean, Corporate Finance
Rob Rees, Corporate Broking
Stanford Capital Partners, Joint Broker
Patrick Claridge
Chris Coleman
+44 (0) 20 3815 8880
SI Capital, Joint Broker
Nick Emerson +44 (0) 1483 413500
CHAIRMAN'S STATEMENT
INTERIM HIGHLIGHTS
The first half of 2018 saw the completion of our pivotal Phase III trial for LupuzorTM, our candidate for the treatment of lupus. Top-line results were announced on 17 April 2018 with further analysis provided on 29 May 2018. Following these results, ImmuPharma has recently signed an agreement with a specialist provider to distribute LupuzorTM via a Managed Access Programme. This will allow lupus patients early access to LupuzorTM prior to any regulatory filing.
ImmuPharma has, on 6 September 2018, signed a Heads of Terms on a clinical development collaboration for the Nucant cancer programme with Incanthera Limited, a specialist oncology development company. Further, following an extensive review, it has been decided that the Company's Ureka subsidiary which focuses on peptide treatments for metabolic disorders is not part of the ongoing strategy of ImmuPharma which is now fully focused on utilising its resources to develop late stage assets. Consequently, we are beginning the process of divesting Ureka.
In other developments, we were pleased to have completed a successful fund raising of £10 million (before expenses) in January 2018. The fund raising was supported by long term shareholders and the addition of new institutional and private investors.
LupuzorTM Phase III results and next steps
The Phase III trial was a double-blind, randomised, placebo-controlled trial. The study involved patients being dosed for one year, receiving 0.2mg once per month subcutaneously. 293 patients were screened illustrating the demand from physicians for a new, safe and effective treatment for lupus. Of these, the required 202 patients were successfully recruited and randomised (dosed). Patients participated in the trial in 7 countries across 28 sites.
The clinical trial was undertaken primarily by Simbec-Orion, an international clinical research organisation, who specialises in rare and orphan conditions and has previous direct experience in lupus trials. This was a pivotal study designed to demonstrate the safety and efficacy of Lupuzor™.
Lupuzor™ demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients. However, due to the high response rate in the placebo group, this superior response did not allow statistical significance to be reached (p = 0.2631) and the trial's primary end point was not met.
Across the whole study population, in those patients who had anti-dsDNA autoantibodies, LupuzorTM demonstrated a superior response rate over placebo (61.5% vs 47.3%, p = 0.0967). Although these results were not statistically significant, further data analysis demonstrated that in the Europe cohort (130 patients) LupuzorTM plus standard of care showed statistically significant reductions in disease activity compared to placebo plus standard of care in 79 patients who were anti-dsDNA autoantibody positive (71.1% vs 48.8%, p = 0.0218).
The study confirmed the outstanding safety profile of LupuzorTM, with no serious adverse events reported.
Scientific literature indicates that approximately 60% - 70% of patients diagnosed for lupus are anti-dsDNA autoantibody positive. These proportions were seen in the Europe cohort (60.8% of patients) and could therefore be considered as representative of the overall lupus population.
In those patients who were anti-dsDNA autoantibody negative, there was almost no difference in disease activity reduction between the active group and the comparator group. Anti-dsDNA autoantibodies are a recognised biomarker for Systemic Lupus Erythematosus.
This finding indicates that the activity of LupuzorTM could be correlated with the presence of anti-dsDNA autoantibodies in lupus patients. ImmuPharma believes that predictive biomarkers, such as anti-dsDNA autoantibodies, could allow identification of patients that are more likely to respond positively to treatment with LupuzorTM.
LupuzorTM next steps - Managed Access Program
ImmuPharma is planning to move forward with a Managed Access Program for LupuzorTM. Recognising that lupus is a disease with significant unmet medical need and given the advanced level of clinical trial investigation completed, ImmuPharma would like to meet demand for access to LupuzorTM by lupus patients who, together with their physicians, request it.
Extension study
The LupuzorTM extension study, which was announced on 18 January 2018, is continuing and recruitment is now complete with a total of 62 patients eligible from the original Phase III trial. We believe that this will provide more valuable information on the potential efficacy and safety of LupuzorTM. The study is anticipated to report results in Q2 2019.
Nucant Platform
A number of options have been under review to develop the Company's Nucant cancer programme, which has demonstrated promising results in two Phase I trials (safety and dose-finding studies).
In order to progress the programme, on 6 September 2018 ImmuPharma signed Heads of Terms on a clinical development collaboration for the Nucant cancer programme, with Incanthera Limited ("Incanthera"), a specialist oncology development company.
Key highlights of the Heads of Terms are summarised below:
•Incanthera, based on its positive due-diligence on the Company's Nucant technology, will license in and take up the continued clinical development of the Nucant cancer programme as an integral part of its own cancer development portfolio.
•As an integral part of the collaboration, upon signing the Heads of Terms, ImmuPharma has invested £2m into Incanthera by subscribing for 363,637 new ordinary Incanthera shares at a price of £5.50 per share. This investment values Incanthera at a pre-money valuation of approximately £10m and is consistent with the most recent funding round that Incanthera completed in March 2018. Following this investment, ImmuPharma will have a circa 16% shareholding in Incanthera.
•ImmuPharma has granted Incanthera a period of exclusivity until 31 December 2018, during which the Company and Incanthera will finalise the terms of a Definitive Licence Agreement for the Nucant technology. These terms are expected to include, but will not be limited to the following:
o Incanthera will pay a licence payment to ImmuPharma of £1 million, with this payment to be made via the issuance of new ordinary shares in Incanthera. This payment in shares is separate and will be in addition to the shareholding which Immupharma currently holds as described above;
o Incanthera will be responsible for all of the development costs for the Nucant programme; and,
o All future commercialisation revenues will be shared equally between the two companies.
Ureka - Divestment process
Ureka, ImmuPharma's wholly owned subsidiary, based in Bordeaux, which is carrying out research into treatments for Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis) has recently demonstrated success in recognised preclinical studies.
Following an extensive review by ImmuPharma's Board of directors, it has been decided that Ureka, whilst having exciting and innovative technologies, is not part of the ongoing strategy of ImmuPharma, which is now fully focused on utilising its resources to develop late stage assets.
As such, ImmuPharma, with its advisors, will now commence a process of considering all opportunities to divest Ureka. The intention is to allow ImmuPharma to divest Ureka, whilst still retaining an interest in any future commercial success.
Financial Review
ImmuPharma's cash balance at 30 June 2018 was £9.02 million (£2.73 million at 31 December 2017, £3.13 million at 30 June 2017). Basic and diluted loss per share were 2.94p and 2.94p respectively (30 June 2017: 2.34p and 2.34p). In line with the Company's current policy, no interim dividend is proposed.
Operating loss for the Period was £4.1 million (£3.2 million for the six months ended 30 June 2017). Research and development expenditure in the Period was £2.5 million (£2.3 million for the six months ended 30 June 2017) reflecting primarily the expenditure related to the LupuzorTM Phase III clinical trial. Administrative expenses were £1.0 million during the Period (£0.8 million for the six months ended 30 June 2017). The share based expense was £775k (£131k for the period ended 30 June 2017) which includes a reduction for the National Insurance provision which was nil due to the decrease in share price from 31 December 2017 to 30 June 2018.
Given the stage of ImmuPharma's development, the fact that losses have continued to be made is to be expected since there is minimal revenue and business activity is concerned with significant investment in the form of clinical development expenditure, in addition to maintaining the infrastructure of the Company.
Current Activities and Outlook
The Board has been focused on delivering a business strategy which provides the optimum route forward for ImmuPharma and its shareholders, based on its current assets, resources and knowhow. We are excited to be progressing the Managed Access Programme which allows lupus patients early access to LupuzorTM. In the medium term, we remain focussed on achieving the full regulatory approval of LupuzorTM which we believe has the potential to be a ground breaking drug for lupus patients with blockbuster potential in commercial terms.
Our Nucant programme and Ureka subsidiary have been part of our portfolio for a number of years. We are equally excited by the potential of both. We believe the strategy we are pursuing with the collaboration with Incanthera Limited for the Nucant and for divestment of Ureka will create enhance value for shareholders going forward.
The Board would like to thank its shareholders, both longstanding and those who participated in the January 2018 fundraising, for their support as well as its staff, corporate and scientific advisers including Simbec-Orion and the CNRS (Centre Nationale de la Recherche Scientifique) for their continued collaboration.
Tim McCarthy
Chairman
ImmuPharma PLC
CONSOLIDATED INCOME STATEMENT
FOR THE PERIOD ENDED 30 JUNE 2018
Note Unaudited
6 months ended
30 June 2018 Audited
Year
ended 31 December
2017 Unaudited
6 months ended
30 June 2017
£ £ £
Continuing operations
Revenue 1 73,392 150,462 86,504
Research and development expenses (2,455,490) (5,121,388) (2,345,815)
Administrative expenses (992,085) (1,520,356) (796,403)
Share based expense (775,135) (742,752) (131,237)
Operating loss (4,149,318) (7,234,034) (3,186,951)
Finance costs (29,425) (3,858) (375)
Finance income 6,077 240,447 153,915
Loss before taxation (4,172,666) (6,997,445) (3,033,411)
Tax 110,237 774,244 (485)
Loss for the period (4,062,429) (6,223,201) (3,033,896)
Attributable to:
Equity holders of the parent company (4,062,429) (6,223,201) (3,033,896)
Loss per ordinary share
Basic and diluted 2 (2.94)p (4.75)p (2.34)p
ImmuPharma PLC
CONSOLIDATED STATEMENT OF COMPREHENSIVE INCOME
FOR THE PERIOD ENDED 30 JUNE 2018
Unaudited
6 months ended
30 June
2018 Audited
Year
ended 31 December
2017 Unaudited
6 months ended
30 June
2017
£ £ £
Loss for the financial period (4,062,429) (6,223,201) (3,033,896)
Other comprehensive income
Items that may be reclassified subsequently to profit or loss:
Exchange differences on translation of foreign operations
29,459
(91,568)
(56,133)
Total items that may be reclassified subsequently to profit or loss 29,459 (91,568) (56,133)
Other comprehensive loss for the period
29,459
(91,568)
(56,133)
Total comprehensive loss for the period (4,032,970) (6,314,769) (3,090,029)
ImmuPharma PLC
CONSOLIDATED STATEMENT OF FINANCIAL POSITION
AS AT 30 JUNE 2018
Note Unaudited
30 June
2018 Audited
31 December
2017 Unaudited
30 June 2017
£ £ £
Non-current assets
Intangible assets 481,667 482,268 497,585
Property, plant and equipment 120,675 161,399 192,573
Total non-current assets 602,342 643,667 690,158
Current assets
Trade and other receivables 1,174,720 1,644,128 2,439,143
Derivative financial asset - - 943,861
Cash and cash equivalents 9,015,630 2,729,468 3,131,595
Total current assets 10,190,350 4,373,596 6,514,599
Current liabilities
Financial liabilities - borrowings 138,214 142,393 119,430
Trade and other payables 737,035 929,569 473,867
Provisions - 57,517 33,162
Total current liabilities 875,249 1,129,479 626,459
Net current assets 9,315,101 3,244,117 5,888,140
Non-current liabilities
Financial liabilities - borrowings 61,209 117,297 170,232
Provisions - 195,989 -
Net assets 9,856,234 3,574,498 6,480,066
EQUITY
Ordinary shares 13,946,744 13,252,299 13,252,298
Share premium 27,320,143 18,728,519 18,728,519
Merger reserve 106,148 106,148 106,148
Other reserves (1,902,921) (2,961,017) (3,316,753)
Retained earnings (29,613,880) (25,551,451) (22,362,146)
Total equity 9,856,234 3,574,498 6,408,066
ImmuPharma PLC
CONSOLIDATED STATEMENT OF CHANGES IN EQUITY
FOR THE PERIOD ENDED 30 JUNE 2018
Share capital Share premium
Merger
reserve Other reserves -
Acquisition
reserve Other reserves -
Translation
Reserve Other reserves -
Equity shares
to be issued
Retained
Earnings Total
equity
£ £ £ £ £ £ £ £
At 1 January 2017
12,463,836 15,678,054 106,148 (3,541,203) (1,609.673) 1,777,131 (19.328.250) 5,546,043
Loss for the financial period - - - - - - (3,033,896) (3,033,896)
Exchange differences on translation
of foreign operations - - - - (56,133) - - (56,133)
New issue of equity capital 788,462 3,311,542 - - - - - 4,100,004
Cost of new issue of equity capital - (261,077) - - - - - (261,077)
Share based payments - - - - - 113,125 - 113,125
At 30 June 2017 13,252,298 18,728,519 106,148 (3,541,203) (1,665,806) 1,890,256 (22,362,146) 6,408,066
At 1 January 2017 12,463,836 15,678,054 106,148 (3,541,203) (1,609,673) 1,777,131 (19,328,250) 5,546,043
Loss for the financial year - - - - - - (6,223,201) (6,223,201)
Exchange differences on translation
of foreign operations - - - - (91,568) - - (91,568)
New issue of equity capital 788,463 3,311,542 - - - - - 4,100,005
Cost of new issue of equity capital - (261,077) - - - - - (261,077)
Share based payments - - - - - 504,296 - 504,296
At 31 December 2017 & 1 January 2018 13,252,299 18,728,519 106,148 (3,541,203) (1,701,241) 2,281,427 (25,551,451) 3,574,498
Loss for the financial period - - - - - - (4,062,429) (4,062,429)
Exchange differences on translation
of foreign operations - - - - 29,459 - - 29,459
New issue of equity capital 694,445 9,305,555 - - - - - 10,000,000
Cost of new issue of equity capital - (713,931) - - - - - (713,931)
Share based payments - - - - - 1,028,637 - 1,028,637
At 30 June 2018 13,946,744 27,320,143 106,148 (3,541,203) (1,671,782) 3,310,064 (29,613,880) 9,856,234
Attributable to:-
Equity holders of the parent company 13,946,744 27,320,143 106,148 (3,541,203) (1,671,782) 3,310,064 (29,613,880) 9,856,234
ImmuPharma PLC
CONSOLIDATED STATEMENT OF CASHFLOWS
FOR THE PERIOD ENDED 30 JUNE 2018
Note Unaudited
6 months ended
30 June 2018 Audited
Year
ended
31 December
2017 Unaudited
6 months ended
30 June
2017
£ £ £
Cash flows from operating activities
Cash used in operations 3 (3,150,500) (5,439,079) (3,200,329)
Tax 213,724 1,021,915 6,680
Interest paid (2,423) (3,858) (375)
Net cash used in operating activities (2,939,199)
(4,421,022) (3,194,024)
Investing activities
Purchase of property, plant and equipment (7,946) (25,491) (1,595)
Interest received 6,077 772 170
Net cash used in investing activities (1,869) (24,719) (1,425)
Financing activities
(Decrease)/increase in bank overdraft (122) (290) (138)
Loan repayments (58,615) (114,386) (80,447)
Gross proceeds from issue of new share capital 10,000,000 4,100,005 4,100,004
Settlements from sharing agreement - 1,667,380 682,360
Share capital issue costs (713,931) (261,077) (261,077)
Net cash generated from financing activities 9,227,332 5,391,632 4,440,702
Net increase in cash and cash equivalents
6,286,264 945,891 1,245,253
Cash and cash equivalents at start of period 2,729,468 1,876,718 1,876,718
Effects of exchange rates on cash and
cash equivalents
(102)
(93,141)
9,624
Cash and cash equivalents at end of period
9,015,630 2,729,468
3,131,595
ImmuPharma PLC
NOTES TO THE CONSOLIDATED INTERIM ACCOUNTS FOR THE PERIOD ENDED 30 JUNE 2018
1 ACCOUNTING POLICIES
Basis of preparation
The interim financial information in this report has been prepared using accounting policies consistent with IFRS as adopted by the European Union. IFRS is subject to amendment and interpretation by the International Accounting Standards Board (IASB) and the IFRS Interpretations Committee and there is an ongoing process of review and endorsement by the European Commission. The financial information has been prepared on the basis of IFRS to be adopted by the European Union and applicable as at 31 December 2018. The Group has chosen not to adopt IAS 34 "Interim Financial Statements" in preparing the interim financial information.
The accounting policies applied are consistent with those that were applied to the financial statements for the year ending 31 December 2017, with the exception of IFRS 9 "Financial Instruments" and IFRS 15 "Revenue from Contracts with Customers" which are new standards applicable mandatory for the year ended 31 December 2018. These new standards will not have a material impact on the financial statements.
Non-Statutory accounts
The financial information set out in this interim report does not constitute the Group's statutory accounts, within the meaning of Section 434 of the Companies Act 2006. The statutory accounts for the year ended 31 December 2017 have been filed with Registrar of Companies. The auditors reported on those accounts; their report was unqualified, did not contain a statement under either Section 498 (2) or Section 498 (3) of the Companies Act 2006 and did not include references to any matters to which the auditor drew attention by way of emphasis. The financial information for the 6 months ended 30 June 2018 and 30 June 2017 is unaudited.
Copies of this statement will be available on the Company's website - www.immupharma.com.
2 LOSS PER SHARE
Unaudited
6 months ended 30 June 2018 Audited
Year ended 31 December
2017 Unaudited
6 months ended 30 June 2017
£ £ £
Loss
Loss for the purposes of basic and diluted loss per share being net loss attributable to equity shareholders (4,062,429)
(6,223,201) (3,033,896)
Number of shares
Weighted average number of ordinary shares for the purposes of basic loss per share 138,201,316 130,902,857 129,517,245
Basic loss per share (2.94)p (4.75)p
(2.34)p
Diluted loss per share (2.94)p (4.75)p (2.34)p
There is no difference between basic loss per share and diluted loss per share as the share options and warrants are anti-dilutive.
The ImmuPharma group has granted share options in respect of shares to be issued.
3 CASH USED IN OPERATIONS
Unaudited
6 months ended
30 June 2018 Audited
Year ended 31 December 2017 Unaudited
6 months
ended
30 June 2017
£ £ £
Operating loss (4,149,318) (7,234,034) (3,186,951)
Depreciation & amortisation 81,424 138,198 61,954
Share based payments 1,028,637 504,296 113,125
Decrease in trade & other receivables 358,921 643,466 34,004
(Decrease)/increase in trade & other payables (189,656) 143,378 (322,963)
(Decrease)/increase in provisions (253,506) 238,456 18,112
Gain/(loss) on foreign exchange (27,002) 127,161 82,390
Cash used in operations
(3,150,500)
(5,439,079)
(3,200,329)
4 SUBSEQUENT EVENTS
On 7 September 2018, ImmuPharma announced that a Heads of Terms agreement was signed with Incanthera Limited. Under the Heads of Terms agreement, Incanthera Limited will license in and take up the continued clinical development of the Nucant cancer programme as an integral part of its own cancer development portfolio. As part of the Heads of Terms, ImmuPharma has invested £2 million into Incanthera Limited by subscribing for 363,637 new ordinary Incanthera shares at a price of £5.50 per share. Following this investment, ImmuPharma will have approximately 16% shareholding in Incanthera Limited. Under the Heads of Terms, ImmuPharma has granted Incanthera Limited a period of exclusivity until 31 December 2018, during which the two companies will finalise terms of a Definitive License Agreement for the Nucant technology. These terms are expected to include, but will not be limited to Incanthera Limited paying a license payment to ImmuPharma of £1 million, with this payment being made via the issuance of new ordinary shares in Incanthera Limited. It is also planned to include confirmation that Incanthera Limited will be responsible for all of the development costs of the Nucant programme and confirmation that all future commercialisation revenues will be shared equally between the two companies.
This information is provided by RNS, the news service of the London Stock Exchange. RNS is approved by the Financial Conduct Authority to act as a Primary Information Provider in the United Kingdom. Terms and conditions relating to the use and distribution of this information may apply. For further information, please contact rns@lseg.com or visit www.rns.com.
END
Dem Kurs hilft das Leider nicht. Fast allzeittief bei 12 !😡😡😡😡😡
Wenn jetzt genug Patienten sich bei der 500 Program regestrieren und falls die Nachzügler von der Phase 3 gute erbenisse vermelden, geht es wieder hoch. Die nächste news wird suf jedenfall positiv ausfallen. Glaube tiefer wird es nicht gehen!!
IMM.L (MKap $85 M) Multiple Blockbuster Kandidat kurz vor final P3 Daten (1Q 2018) | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/1252583-1111-112…
IMM.L (MKap $85 M) Multiple Blockbuster Kandidat kurz vor final P3 Daten (1Q 2018) | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/1252583-1111-112…
Antwort auf Beitrag Nr.: 58.893.537 von bio-profi am 08.10.18 12:05:13Na ja , die möglichen Alternativen schwinden immer mehr ! Ich glaube immu ist der einzige der es die letzten Jahre durch eine P3 geschafft hat. Mit zufriedenen Studienteilnehmern trotz Bürokratischen Fail der Studie.
Hallo,
Leider geht es hier nur in eine Richtung! Neues allzeit tief erreicht heute!?
Wie geht es hier weiter? Immer wenn ich denke der Boden ist erreicht, dann fällst sie nochmal! Leider kommen vom MM auch keine unterstützenden Maßnahmen!
Meinungen?
Leider geht es hier nur in eine Richtung! Neues allzeit tief erreicht heute!?
Wie geht es hier weiter? Immer wenn ich denke der Boden ist erreicht, dann fällst sie nochmal! Leider kommen vom MM auch keine unterstützenden Maßnahmen!
Meinungen?
Antwort auf Beitrag Nr.: 58.927.104 von bio-profi am 11.10.18 10:19:07Denke man muss abwarten was sich in den nächsten 2 Jahren ergibt, leider! Da kann immer mal was kommen, aber die Zeit wird es wohl brauchen und so wie es aussieht, sind da nicht alle bereit zu warten. Ist ja auch immer noch viel Risiko dabei. De Kurs wird ohne News vermutlich weiter nach geben. Weiter unten werden sich dann wohl wieder Einige trauen und die günstigen Kurse nutzen und auf eine Zulassung spekulieren. Aber das wird noch dauern. Außer irgendwer greift sich den Laden, kann auch immer noch passieren.
Gruß aaahhh
Gruß aaahhh
Kein Handel heute??
Ausgestetzt?
Übernahme?
Ausgestetzt?
Übernahme?
Antwort auf Beitrag Nr.: 58.941.270 von bio-profi am 12.10.18 11:54:28Ist das Deine einzige Aktie oder hast Du hier zuviel Geld drin?
Du bist viel zu unentspannt...
Du bist viel zu unentspannt...
kam grad per E-Mail rein
ImmuPharma PLC
("ImmuPharma" or the "Company")
Nominated Adviser Status
ImmuPharma PLC (AIM: IMM.L), the specialist drug discovery and development company, announces that the Directors are aware of the proposed merger of its current nominated adviser ("NOMAD"), Northland Capital Partners ("Northland") with SP Angel Corporate Finance LLP. The Directors have also been informed that Northland has voluntarily agreed to relinquish its NOMAD status and will be removed from the register of NOMADs with effect from 7am (GMT) on 1 February 2019.
In accordance with AIM Rule 1, the Company is required to appoint a new NOMAD by 1 February 2019, if not, the Exchange will suspend trading in the Company's AIM Securities. If the Company does not appoint a replacement NOMAD by 4 March 2019, the admission of its AIM Securities will be cancelled.
The Company has commenced the process to appoint a new NOMAD and will make a further announcement in due course.
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) No 596/2014 ("MAR").
ImmuPharma PLC
("ImmuPharma" or the "Company")
Nominated Adviser Status
ImmuPharma PLC (AIM: IMM.L), the specialist drug discovery and development company, announces that the Directors are aware of the proposed merger of its current nominated adviser ("NOMAD"), Northland Capital Partners ("Northland") with SP Angel Corporate Finance LLP. The Directors have also been informed that Northland has voluntarily agreed to relinquish its NOMAD status and will be removed from the register of NOMADs with effect from 7am (GMT) on 1 February 2019.
In accordance with AIM Rule 1, the Company is required to appoint a new NOMAD by 1 February 2019, if not, the Exchange will suspend trading in the Company's AIM Securities. If the Company does not appoint a replacement NOMAD by 4 March 2019, the admission of its AIM Securities will be cancelled.
The Company has commenced the process to appoint a new NOMAD and will make a further announcement in due course.
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) No 596/2014 ("MAR").
ist das eine gute oder eine schlechte Nachricht? Zum Grund der Aufgabe keine Infos 

Antwort auf Beitrag Nr.: 59.114.930 von E_Nichtlustig am 01.11.18 15:26:17ein non-event
Status des nominierten Beraters
ImmuPharma PLC (AIM: IMM.L), das auf die Entdeckung und Entwicklung von Medikamenten spezialisierte Unternehmen, gibt bekannt, dass der Verwaltungsrat die geplante Fusion seines derzeit benannten Beraters ("NOMAD"), Northland Capital Partners ("Northland"), mit SP Angel kennt Unternehmensfinanzierung LLP. Die Verwaltungsratsmitglieder wurden auch darüber informiert, dass Northland freiwillig zugestimmt hat, seinen NOMAD-Status aufzugeben, und werden am 1. Februar 2019 ab 7 Uhr (GMT) aus dem Register der NOMADs entfernt.
Gemäß AIM-Regel 1 muss die Gesellschaft bis zum 1. Februar 2019 einen neuen NOMAD benennen. Andernfalls stellt die Börse den Handel mit den AIM-Wertpapieren der Gesellschaft ein. Wenn die Gesellschaft bis zum 4. März 2019 keinen Ersatz für NOMAD bestellt, wird die Zulassung ihrer AIM-Wertpapiere aufgehoben.
Das Unternehmen hat mit dem Verfahren zur Ernennung eines neuen NOMAD begonnen und wird zu gegebener Zeit eine weitere Ankündigung vornehmen.
Diese Mitteilung enthält Insider-Informationen im Sinne von Artikel 7 der Verordnung (EU) Nr. 596/2014 ("MAR").
Für weitere Informationen kontaktieren Sie bitte:
ImmuPharma plc (www.immupharma.co.uk)
+ 44 (0) 20 7152 4080
Tim McCarthy, Vorsitzender
Lisa Baderoon, Leiterin Investor Relations
+ 44 (0) 7721 413496
Northland Capital Partners Limited (NOMAD & Joint Broker)
David Hignell, Dugald Carlean, Jamie Spotswood, Unternehmensfinanzierung
Rob Rees, Unternehmensmakler
Stanford Capital Partners (gemeinsamer Broker)
Patrick Claridge
Chris Coleman
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 20 3861 6625
ImmuPharma PLC (AIM: IMM.L), das auf die Entdeckung und Entwicklung von Medikamenten spezialisierte Unternehmen, gibt bekannt, dass der Verwaltungsrat die geplante Fusion seines derzeit benannten Beraters ("NOMAD"), Northland Capital Partners ("Northland"), mit SP Angel kennt Unternehmensfinanzierung LLP. Die Verwaltungsratsmitglieder wurden auch darüber informiert, dass Northland freiwillig zugestimmt hat, seinen NOMAD-Status aufzugeben, und werden am 1. Februar 2019 ab 7 Uhr (GMT) aus dem Register der NOMADs entfernt.
Gemäß AIM-Regel 1 muss die Gesellschaft bis zum 1. Februar 2019 einen neuen NOMAD benennen. Andernfalls stellt die Börse den Handel mit den AIM-Wertpapieren der Gesellschaft ein. Wenn die Gesellschaft bis zum 4. März 2019 keinen Ersatz für NOMAD bestellt, wird die Zulassung ihrer AIM-Wertpapiere aufgehoben.
Das Unternehmen hat mit dem Verfahren zur Ernennung eines neuen NOMAD begonnen und wird zu gegebener Zeit eine weitere Ankündigung vornehmen.
Diese Mitteilung enthält Insider-Informationen im Sinne von Artikel 7 der Verordnung (EU) Nr. 596/2014 ("MAR").
Für weitere Informationen kontaktieren Sie bitte:
ImmuPharma plc (www.immupharma.co.uk)
+ 44 (0) 20 7152 4080
Tim McCarthy, Vorsitzender
Lisa Baderoon, Leiterin Investor Relations
+ 44 (0) 7721 413496
Northland Capital Partners Limited (NOMAD & Joint Broker)
David Hignell, Dugald Carlean, Jamie Spotswood, Unternehmensfinanzierung
Rob Rees, Unternehmensmakler
Stanford Capital Partners (gemeinsamer Broker)
Patrick Claridge
Chris Coleman
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 20 3861 6625
Hallo zusammen,
Es ist sehr schade wie Immupharma hier abgeschlachtet wird. Ok lupzor hat schlechte Ergebnisse geliefert, aber es wird weiter versucht und zu 100% ist es auch noch nicht verloren.
Aber was hier passiert ist einfach unrealistisch. 95% Abschlag ist einfach brutal. Vergleicht das man Nasdaq bios, die nur ein Medikament haben und schlechte Ergebnisse melden, sind die Abschläge bei weitem nicht so heftig.
Ich hoffe das wir hier bald auch mal positive news bekommen und dann sollte es auch paar hundert Prozent hoch gehen. Auch andere companys, die Lupus erforschen, vermelden keine Positiven Meldungen.
Abwarten und Tee trinken. Gruß.
Es ist sehr schade wie Immupharma hier abgeschlachtet wird. Ok lupzor hat schlechte Ergebnisse geliefert, aber es wird weiter versucht und zu 100% ist es auch noch nicht verloren.
Aber was hier passiert ist einfach unrealistisch. 95% Abschlag ist einfach brutal. Vergleicht das man Nasdaq bios, die nur ein Medikament haben und schlechte Ergebnisse melden, sind die Abschläge bei weitem nicht so heftig.
Ich hoffe das wir hier bald auch mal positive news bekommen und dann sollte es auch paar hundert Prozent hoch gehen. Auch andere companys, die Lupus erforschen, vermelden keine Positiven Meldungen.
Abwarten und Tee trinken. Gruß.
Erste kleine Gegenreaktion seit Monaten(?) in UK. 16% Plus bei knapp 1 Mio gehandelteter Aktien...
...und weiter geht die Erholung.
Jetzt schon 50% seit dem Tief aufgeholt. Wurde ja auchmal Zeit für eine technische Gegenreaktion.
Jetzt schon 50% seit dem Tief aufgeholt. Wurde ja auchmal Zeit für eine technische Gegenreaktion.
...auch heute wieder relativ hohes Volumem mit 2 Mio gehandelten Stücken. In der Spitze sogar schon auf 15 gewesen...
Sieht gut aus heute,

https://de.advfn.com/p.php?pid=staticchart&s=L%5EIMM&t=37&p=…
Vielleicht kommt übers Wochenende eine kustreibende News?
https://de.advfn.com/p.php?pid=staticchart&s=L%5EIMM&t=37&p=…
Vielleicht kommt übers Wochenende eine kustreibende News?
Sehr schön 🙌
Haben sich die Nachkäufe doch gelohnt. Ich glaube auch, daß hier News anstehen und das mittlerweile mehr wie ‘ne technische Gegenreaktion ist...
Haben sich die Nachkäufe doch gelohnt. Ich glaube auch, daß hier News anstehen und das mittlerweile mehr wie ‘ne technische Gegenreaktion ist...
Hui, jetzt gehts aber gut ab 🧨
Da wollen einige noch um jeden Preis rein. 40% Plus bei 17,80.
Is hier sonst keiner mehr mit dabei? 😉
Da wollen einige noch um jeden Preis rein. 40% Plus bei 17,80.
Is hier sonst keiner mehr mit dabei? 😉
Antwort auf Beitrag Nr.: 59.234.956 von Stoxtrayder am 16.11.18 17:25:19Die Nachkäufe sind noch da und noch etwas aufgestockt. Der Kurs macht fast 100% vom Tief, da muss mehr dahinter sein, als bisher bekannt! Für eine technische Reaktion ist mir das zu heftig. Da kommt noch mehr!
Gruß aaahhh
Gruß aaahhh
Schönes Volumen heute. Könnte was kommen.
Antwort auf Beitrag Nr.: 59.234.956 von Stoxtrayder am 16.11.18 17:25:19Nach wie vor noch dabei. Bin nur noch etwas vorsichtig, ob hier nicht wieder irgendwelche Spielchen mit uns getrieben werden...
17.11.2018:
Immupharma (LON:IMM) new drug against lupus whose side effects are virtually nil
"CNRS highlighted that the LupuzorTM is the " first non-immunosuppressive specific treatment " with virtually no side effects. Contrary to the existing medication on the market, the LupuzorTM "does not diminish the immune defenses of patients," said the CNRS. The specialist explained that her medication is not administered in large doses and "probably" will be enough with a monthly injection. The CNRS referred that it is looking to market the LupuzorTM, so "has started discussions with several large pharmaceutical companies.""
http://www.smallcapnetwork.com/Immupharma-LON-IMM-new-drug-a…
Immupharma (LON:IMM) new drug against lupus whose side effects are virtually nil
"CNRS highlighted that the LupuzorTM is the " first non-immunosuppressive specific treatment " with virtually no side effects. Contrary to the existing medication on the market, the LupuzorTM "does not diminish the immune defenses of patients," said the CNRS. The specialist explained that her medication is not administered in large doses and "probably" will be enough with a monthly injection. The CNRS referred that it is looking to market the LupuzorTM, so "has started discussions with several large pharmaceutical companies.""
http://www.smallcapnetwork.com/Immupharma-LON-IMM-new-drug-a…
Interessanter Fund, boersenkeks, Danke 👍
Wie gesagt, ich glaube auch daß hinter dem Kursanstieg was steht, und kein Gezocke, Spielchen bzw. ‘nur’ eine technische Gegenreaktion...
Mal gespannt, was so die nächsten Wochen verkündet wird.
Falls eine Partnerschaft mit Big Pharma beschlossen wird (s.Artikel), gibts imho wieder Kurse zw. 50-100 Pence. 😏
Wie gesagt, ich glaube auch daß hinter dem Kursanstieg was steht, und kein Gezocke, Spielchen bzw. ‘nur’ eine technische Gegenreaktion...
Mal gespannt, was so die nächsten Wochen verkündet wird.
Falls eine Partnerschaft mit Big Pharma beschlossen wird (s.Artikel), gibts imho wieder Kurse zw. 50-100 Pence. 😏
Der Morgen starte mit einigen Gewinnmitnahmen, was aber nachvollziehbar ist. Dennoch ist der Kurs wieder ins Plus gelaufen, Stand jetzt.
Mal schauen, ob wir uns gegenüber der Seller behaupten können. Volumen ist in London schon beachtlich. Das vom Freitag werden wir heute wohl toppen.
Interesse ist also da.
Mal schauen, ob wir uns gegenüber der Seller behaupten können. Volumen ist in London schon beachtlich. Das vom Freitag werden wir heute wohl toppen.
Interesse ist also da.
researcher Sylviane Muller discovered a new drug against lupus whose side effects are virtually nil , the National Center for Scientific Research (CNRS) in France reported. "The drug candidate LupuzorTM has been proven effective in 68.8% of patients who received it," the agency said.
CNRS highlighted that the LupuzorTM is the " first non-immunosuppressive specific treatment " with virtually no side effects. Contrary to the existing medication on the market, the LupuzorTM "does not diminish the immune defenses of patients," said the CNRS. The specialist explained that her medication is not administered in large doses and "probably" will be enough with a monthly injection. The CNRS referred that it is looking to market the LupuzorTM, so "has started discussions with several large pharmaceutical companies."
It is an autoimmune, chronic and inflammatory disease that can cause irreversible organic damage over time.
World May Day of Lupus is celebrated on May 10 , a day of awareness and call for attention to this autoimmune, chronic and inflammatory disease, which can cause irreversible organic damage over time, affecting more than five million people. of people all over the world, said Teresa G. Cattoni, President of the Asociación Lupus Argentina (ALUA).
Emotional and physical impact
There are no limits to the physical, emotional and economic impact of lupus. The disease affects people of all nationalities, races, ethnic groups, sexes and ages. Lupus can affect any part of the body in any way, at any time, often with unpredictable results .
Symptoms, diagnosis and treatment at present
It is potentially disabling , and requires ongoing medical monitoring. It is difficult to diagnose, complex their coexistence and a challenge to deal with properly.
Lupus has a series of symptoms that come and go without warning. They can vary from one person to another. The most common include joint and muscle pain, extreme fatigue, rashes, fever and hair loss. While there is currently no cure for lupus, early diagnosis and early treatment can help control its impact.
Lupus affects not only the person who suffers it; It also affects your family, friends and work relationships . However, it is little recognized as a global public health problem, both at the level of the general public, and at the level of health professionals and governments, Cattoni argues.
Advances in medicines
A team led by French researcher Sylviane Muller discovered a new drug against lupus whose side effects are virtually nil , the National Center for Scientific Research (CNRS) in France reported. "The drug candidate LupuzorTM has been proven effective in 68.8% of patients who received it," the agency said.
CNRS highlighted that the LupuzorTM is the " first non-immunosuppressive specific treatment " with virtually no side effects. Contrary to the existing medication on the market, the LupuzorTM "does not diminish the immune defenses of patients," said the CNRS. The specialist explained that her medication is not administered in large doses and "probably" will be enough with a monthly injection. The CNRS referred that it is looking to market the LupuzorTM, so "has started discussions with several large pharmaceutical companies."
Little knowledge of the disease
An international survey carried out on a large scale reveals that there is low knowledge about lupus at the level of society in general, which leads to misconceptions and contributes to the stigmatization of the affected people. Lupus is not a contagious disease, nor is it related to cancer or to HIV-AIDS.
The head of ALUA argues that "it is necessary to join effortsso that research projects on lupus that are underway, can be realized in the near future and new and better treatments can be achieved to control lupus, and one day perhaps, achieve his cure. " Within the framework of this commemoration, the Lupus Argentina Association will hold its 56th Informative Medical Symposium on lupus, open to the community, with free admission, starting at 5.30 pm in the Auditorium of the Bank of the City of Bs. As. (Esmeralda 660 3rd Floor)
CNRS highlighted that the LupuzorTM is the " first non-immunosuppressive specific treatment " with virtually no side effects. Contrary to the existing medication on the market, the LupuzorTM "does not diminish the immune defenses of patients," said the CNRS. The specialist explained that her medication is not administered in large doses and "probably" will be enough with a monthly injection. The CNRS referred that it is looking to market the LupuzorTM, so "has started discussions with several large pharmaceutical companies."
It is an autoimmune, chronic and inflammatory disease that can cause irreversible organic damage over time.
World May Day of Lupus is celebrated on May 10 , a day of awareness and call for attention to this autoimmune, chronic and inflammatory disease, which can cause irreversible organic damage over time, affecting more than five million people. of people all over the world, said Teresa G. Cattoni, President of the Asociación Lupus Argentina (ALUA).
Emotional and physical impact
There are no limits to the physical, emotional and economic impact of lupus. The disease affects people of all nationalities, races, ethnic groups, sexes and ages. Lupus can affect any part of the body in any way, at any time, often with unpredictable results .
Symptoms, diagnosis and treatment at present
It is potentially disabling , and requires ongoing medical monitoring. It is difficult to diagnose, complex their coexistence and a challenge to deal with properly.
Lupus has a series of symptoms that come and go without warning. They can vary from one person to another. The most common include joint and muscle pain, extreme fatigue, rashes, fever and hair loss. While there is currently no cure for lupus, early diagnosis and early treatment can help control its impact.
Lupus affects not only the person who suffers it; It also affects your family, friends and work relationships . However, it is little recognized as a global public health problem, both at the level of the general public, and at the level of health professionals and governments, Cattoni argues.
Advances in medicines
A team led by French researcher Sylviane Muller discovered a new drug against lupus whose side effects are virtually nil , the National Center for Scientific Research (CNRS) in France reported. "The drug candidate LupuzorTM has been proven effective in 68.8% of patients who received it," the agency said.
CNRS highlighted that the LupuzorTM is the " first non-immunosuppressive specific treatment " with virtually no side effects. Contrary to the existing medication on the market, the LupuzorTM "does not diminish the immune defenses of patients," said the CNRS. The specialist explained that her medication is not administered in large doses and "probably" will be enough with a monthly injection. The CNRS referred that it is looking to market the LupuzorTM, so "has started discussions with several large pharmaceutical companies."
Little knowledge of the disease
An international survey carried out on a large scale reveals that there is low knowledge about lupus at the level of society in general, which leads to misconceptions and contributes to the stigmatization of the affected people. Lupus is not a contagious disease, nor is it related to cancer or to HIV-AIDS.
The head of ALUA argues that "it is necessary to join effortsso that research projects on lupus that are underway, can be realized in the near future and new and better treatments can be achieved to control lupus, and one day perhaps, achieve his cure. " Within the framework of this commemoration, the Lupus Argentina Association will hold its 56th Informative Medical Symposium on lupus, open to the community, with free admission, starting at 5.30 pm in the Auditorium of the Bank of the City of Bs. As. (Esmeralda 660 3rd Floor)
Die Forscherin Sylviane Muller entdeckte ein neues Medikament gegen Lupus, dessen Nebenwirkungen praktisch gleich Null sind, berichtete das Nationale Zentrum für wissenschaftliche Forschung (CNRS) in Frankreich. "Der Medikamentenkandidat LupuzorTM hat sich bei 68,8% der Patienten als wirksam erwiesen", sagte die Behörde.
CNRS hob hervor, dass LupuzorTM die "erste nicht immunsuppressive spezifische Behandlung" ist, die praktisch keine Nebenwirkungen aufweist. Im Gegensatz zu den auf dem Markt befindlichen Medikamenten verringert der LupuzorTM "die Immunabwehr der Patienten nicht", sagte der CNRS. Die Spezialistin erklärte, dass ihre Medikamente nicht in großen Dosen verabreicht werden und "wahrscheinlich" mit einer monatlichen Injektion ausreichen wird. Das CNRS wies darauf hin, dass es den LupuzorTM auf den Markt bringen wolle, und "hat Gespräche mit mehreren großen Pharmaunternehmen aufgenommen".
Es ist eine Autoimmunerkrankung, eine chronische und entzündliche Erkrankung, die im Laufe der Zeit zu irreversiblen organischen Schäden führen kann.
Der Welt-Maitag von Lupus wird am 10. Mai gefeiert, einem Tag des Bewusstseins, und fordert die Aufmerksamkeit auf diese autoimmune, chronische und entzündliche Erkrankung, die im Laufe der Zeit zu irreversiblen organischen Schäden führen kann und mehr als fünf Millionen Menschen betrifft. von Menschen auf der ganzen Welt, sagte Teresa G. Cattoni, Präsidentin der Asociación Lupus Argentina (ALUA).
Emotionale und körperliche Auswirkungen
Den körperlichen, emotionalen und wirtschaftlichen Auswirkungen von Lupus sind keine Grenzen gesetzt. Die Krankheit betrifft Menschen aller Nationalitäten, Rassen, ethnischen Gruppen, Geschlechter und Altersgruppen. Lupus kann jeden Teil des Körpers zu jeder Zeit beeinflussen, oft mit unvorhersehbaren Ergebnissen.
Symptome, Diagnose und Behandlung derzeit
Es ist möglicherweise deaktiviert und erfordert eine laufende medizinische Überwachung. Es ist schwierig zu diagnostizieren, kompliziert ihr Zusammenleben und eine Herausforderung, richtig damit umzugehen.
Lupus hat eine Reihe von Symptomen, die ohne Vorwarnung kommen und gehen. Sie können von Person zu Person variieren. Zu den häufigsten gehören Gelenk- und Muskelschmerzen, extreme Müdigkeit, Hautausschläge, Fieber und Haarausfall. Zwar gibt es derzeit keine Heilung für Lupus, aber eine frühzeitige Diagnose und frühzeitige Behandlung können dazu beitragen, die Auswirkungen zu kontrollieren.
Lupus betrifft nicht nur die Person, die darunter leidet. Dies betrifft auch Ihre Familie, Freunde und Arbeitsbeziehungen. Es wird jedoch wenig als ein globales Problem der öffentlichen Gesundheit anerkannt, sowohl auf der Ebene der Öffentlichkeit als auch auf der Ebene der Angehörigen der Gesundheitsberufe und der Regierungen, argumentiert Cattoni.
Fortschritte bei Arzneimitteln
Ein Team um die französische Forscherin Sylviane Muller entdeckte ein neues Medikament gegen Lupus, dessen Nebenwirkungen praktisch gleich Null sind, berichtete das Nationale Zentrum für wissenschaftliche Forschung (CNRS) in Frankreich. "Der Medikamentenkandidat LupuzorTM hat sich bei 68,8% der Patienten als wirksam erwiesen", sagte die Behörde.
CNRS hob hervor, dass LupuzorTM die "erste nicht immunsuppressive spezifische Behandlung" ist, die praktisch keine Nebenwirkungen aufweist. Im Gegensatz zu den auf dem Markt befindlichen Medikamenten verringert der LupuzorTM "die Immunabwehr der Patienten nicht", sagte der CNRS. Die Spezialistin erklärte, dass ihre Medikamente nicht in großen Dosen verabreicht werden und "wahrscheinlich" mit einer monatlichen Injektion ausreichen wird. Das CNRS wies darauf hin, dass es den LupuzorTM auf den Markt bringen wolle, und "hat Gespräche mit mehreren großen Pharmaunternehmen aufgenommen".
Wenig Wissen über die Krankheit
Eine im großen Stil durchgeführte internationale Umfrage zeigt, dass auf der Ebene der Gesellschaft im Allgemeinen wenig Wissen über Lupus vorhanden ist, was zu Missverständnissen führt und zur Stigmatisierung der betroffenen Menschen beiträgt. Lupus ist keine ansteckende Krankheit und steht auch nicht im Zusammenhang mit Krebs oder HIV-AIDS.
Der Chef von ALUA argumentiert, dass "es notwendig ist, sich zusammenzuschließen, so dass Forschungsprojekte zu Lupus, die im Gange sind, in naher Zukunft realisiert werden können, und dass neue und bessere Behandlungen zur Bekämpfung von Lupus erzielt werden können und eines Tages vielleicht seine Heilung erreicht wird. "Im Rahmen dieser Gedenkfeier veranstaltet der Verein Lupus Argentina sein 56. Informatives Medizinisches Symposium über Lupus, das der Gemeinde kostenlos zugänglich ist, ab 17.30 Uhr im Auditorium der Bank der Stadt Bs. Wie. (Esmeralda 660 3. Etage)
CNRS hob hervor, dass LupuzorTM die "erste nicht immunsuppressive spezifische Behandlung" ist, die praktisch keine Nebenwirkungen aufweist. Im Gegensatz zu den auf dem Markt befindlichen Medikamenten verringert der LupuzorTM "die Immunabwehr der Patienten nicht", sagte der CNRS. Die Spezialistin erklärte, dass ihre Medikamente nicht in großen Dosen verabreicht werden und "wahrscheinlich" mit einer monatlichen Injektion ausreichen wird. Das CNRS wies darauf hin, dass es den LupuzorTM auf den Markt bringen wolle, und "hat Gespräche mit mehreren großen Pharmaunternehmen aufgenommen".
Es ist eine Autoimmunerkrankung, eine chronische und entzündliche Erkrankung, die im Laufe der Zeit zu irreversiblen organischen Schäden führen kann.
Der Welt-Maitag von Lupus wird am 10. Mai gefeiert, einem Tag des Bewusstseins, und fordert die Aufmerksamkeit auf diese autoimmune, chronische und entzündliche Erkrankung, die im Laufe der Zeit zu irreversiblen organischen Schäden führen kann und mehr als fünf Millionen Menschen betrifft. von Menschen auf der ganzen Welt, sagte Teresa G. Cattoni, Präsidentin der Asociación Lupus Argentina (ALUA).
Emotionale und körperliche Auswirkungen
Den körperlichen, emotionalen und wirtschaftlichen Auswirkungen von Lupus sind keine Grenzen gesetzt. Die Krankheit betrifft Menschen aller Nationalitäten, Rassen, ethnischen Gruppen, Geschlechter und Altersgruppen. Lupus kann jeden Teil des Körpers zu jeder Zeit beeinflussen, oft mit unvorhersehbaren Ergebnissen.
Symptome, Diagnose und Behandlung derzeit
Es ist möglicherweise deaktiviert und erfordert eine laufende medizinische Überwachung. Es ist schwierig zu diagnostizieren, kompliziert ihr Zusammenleben und eine Herausforderung, richtig damit umzugehen.
Lupus hat eine Reihe von Symptomen, die ohne Vorwarnung kommen und gehen. Sie können von Person zu Person variieren. Zu den häufigsten gehören Gelenk- und Muskelschmerzen, extreme Müdigkeit, Hautausschläge, Fieber und Haarausfall. Zwar gibt es derzeit keine Heilung für Lupus, aber eine frühzeitige Diagnose und frühzeitige Behandlung können dazu beitragen, die Auswirkungen zu kontrollieren.
Lupus betrifft nicht nur die Person, die darunter leidet. Dies betrifft auch Ihre Familie, Freunde und Arbeitsbeziehungen. Es wird jedoch wenig als ein globales Problem der öffentlichen Gesundheit anerkannt, sowohl auf der Ebene der Öffentlichkeit als auch auf der Ebene der Angehörigen der Gesundheitsberufe und der Regierungen, argumentiert Cattoni.
Fortschritte bei Arzneimitteln
Ein Team um die französische Forscherin Sylviane Muller entdeckte ein neues Medikament gegen Lupus, dessen Nebenwirkungen praktisch gleich Null sind, berichtete das Nationale Zentrum für wissenschaftliche Forschung (CNRS) in Frankreich. "Der Medikamentenkandidat LupuzorTM hat sich bei 68,8% der Patienten als wirksam erwiesen", sagte die Behörde.
CNRS hob hervor, dass LupuzorTM die "erste nicht immunsuppressive spezifische Behandlung" ist, die praktisch keine Nebenwirkungen aufweist. Im Gegensatz zu den auf dem Markt befindlichen Medikamenten verringert der LupuzorTM "die Immunabwehr der Patienten nicht", sagte der CNRS. Die Spezialistin erklärte, dass ihre Medikamente nicht in großen Dosen verabreicht werden und "wahrscheinlich" mit einer monatlichen Injektion ausreichen wird. Das CNRS wies darauf hin, dass es den LupuzorTM auf den Markt bringen wolle, und "hat Gespräche mit mehreren großen Pharmaunternehmen aufgenommen".
Wenig Wissen über die Krankheit
Eine im großen Stil durchgeführte internationale Umfrage zeigt, dass auf der Ebene der Gesellschaft im Allgemeinen wenig Wissen über Lupus vorhanden ist, was zu Missverständnissen führt und zur Stigmatisierung der betroffenen Menschen beiträgt. Lupus ist keine ansteckende Krankheit und steht auch nicht im Zusammenhang mit Krebs oder HIV-AIDS.
Der Chef von ALUA argumentiert, dass "es notwendig ist, sich zusammenzuschließen, so dass Forschungsprojekte zu Lupus, die im Gange sind, in naher Zukunft realisiert werden können, und dass neue und bessere Behandlungen zur Bekämpfung von Lupus erzielt werden können und eines Tages vielleicht seine Heilung erreicht wird. "Im Rahmen dieser Gedenkfeier veranstaltet der Verein Lupus Argentina sein 56. Informatives Medizinisches Symposium über Lupus, das der Gemeinde kostenlos zugänglich ist, ab 17.30 Uhr im Auditorium der Bank der Stadt Bs. Wie. (Esmeralda 660 3. Etage)
Kleine Verschnauspause heute unter sehr hohem Volumen...
Wenn die 15 für‘s Erste halten (ohne News) hätt ich nix dagegen. Mit (hamdfesten) News gehts ein paar Etagen höher...
Wenn die 15 für‘s Erste halten (ohne News) hätt ich nix dagegen. Mit (hamdfesten) News gehts ein paar Etagen höher...
ich habe bisher keine neue/unbekannte News gesehen. aber natürlich freut es mich trotzdem, wenn der Kurs steigt.
Antwort auf Beitrag Nr.: 59.251.705 von E_Nichtlustig am 19.11.18 18:46:18Das war wohl nix, bald wieder am Ausgangspunkt. Solange hier keine gute News kommt bezgl. Lupuzor
wird es vermutlich nichts mit einer nachhaltigen Erholung, Gespräche oder Gerüchte helfen da nur kurz.
Gruß aaahhh
wird es vermutlich nichts mit einer nachhaltigen Erholung, Gespräche oder Gerüchte helfen da nur kurz.
Gruß aaahhh
Ja, leider...
Immerhin heute bei 15 geschlossen. Zum Schluß kam nochmals eine 300k-Order.
Immerhin heute bei 15 geschlossen. Zum Schluß kam nochmals eine 300k-Order.
Update on Corporate Activities
Commenting, Tim McCarthy, Chairman, said:
"We are delighted to be progressing the necessary activities for the Managed Access Programme, allowing Lupus patients early access to Lupuzor™. In conjunction, in the medium term we remain focussed on achieving the full regulatory approval of Lupuzor™, which we are confident has the potential to be a ground breaking drug for Lupus patients.
"Our Nucant programme and Ureka subsidiary continue to progress with their separate strategies, both having the ultimate goal of achieving value for all stakeholders going forward.
"With active discussions ongoing regarding the appointment of a new NOMAD, we look forward to updating the market and shareholders again in the near future."
https://www.investegate.co.uk/immupharma-plc--imm-/rns/updat…
Commenting, Tim McCarthy, Chairman, said:
"We are delighted to be progressing the necessary activities for the Managed Access Programme, allowing Lupus patients early access to Lupuzor™. In conjunction, in the medium term we remain focussed on achieving the full regulatory approval of Lupuzor™, which we are confident has the potential to be a ground breaking drug for Lupus patients.
"Our Nucant programme and Ureka subsidiary continue to progress with their separate strategies, both having the ultimate goal of achieving value for all stakeholders going forward.
"With active discussions ongoing regarding the appointment of a new NOMAD, we look forward to updating the market and shareholders again in the near future."
https://www.investegate.co.uk/immupharma-plc--imm-/rns/updat…
Ein weiterer Beitrag dazu:
The AIM-listed firm said that following analysis of the regulatory processes in EU countries, it is planned to begin patient recruitment for the programme in France and UK
https://www.proactiveinvestors.co.uk/companies/news/210762/i…
The AIM-listed firm said that following analysis of the regulatory processes in EU countries, it is planned to begin patient recruitment for the programme in France and UK
https://www.proactiveinvestors.co.uk/companies/news/210762/i…
Tja, Tagesgewinne von 10% leider wieder abgegeben...
PLC
("ImmuPharma" oder das "Unternehmen")
AKTUALISIERUNG DER UNTERNEHMENSAKTIVITÄTEN
ImmuPharma PLC (LSE: IMM), das Spezialforschungsunternehmen für die Entdeckung und Entwicklung von Medikamenten, freut sich, ein Update über die laufenden Aktivitäten anbieten zu können.
Schlüssel-Höhepunkte:
· Lupuzor ™
o Lupuzor ™ 'Managed Access Program'
o Phase III "Open Label Extension"
· Nucant (Krebs) -Programm: Klinische Entwicklungszusammenarbeit mit Incanthera Limited
· Ureka-Tochtergesellschaft
· Nominierter Beraterstatus
Lupuzor ™ Managed Access-Programm
Lupuzor ™ ist die Spätphase von ImmuPharma für Lupus, eine potenziell lebensbedrohliche Autoimmunerkrankung. Wie im „Corporate Update“ am 7. September 2018 angekündigt, hat ImmuPharma bestätigt, dass Lupuzor ™ derzeit Patienten über ein Managed Access-Programm („MAP“) zur Behandlung zur Verfügung stellt.
Der MAP schreitet voran, einschließlich der Vorbereitung von Verwaltungsdokumenten und der Bewertung der Logistik in Bezug auf den Regulierungsprozess in jedem Land. Nach einer Analyse der Regulierungsprozesse in den EU-Ländern ist geplant, mit der Patientenrekrutierung für das Programm in Frankreich und dem Vereinigten Königreich zu beginnen und dann in andere EU-Länder einzuführen. Weitere Updates werden bei Bedarf zur Verfügung gestellt.
Lupuzor ™ Erweiterungsstudie
Die Lupuzor ™ Open-Label-Erweiterungsstudie schreitet planmäßig voran. Insgesamt 62 in Frage kommende Patienten aus der ursprünglichen Phase-III-Studie, die in den USA und Europa rekrutiert wurde, sind im Gange. Diese Studie ist weiterhin auf Erfolgskurs, um die Ergebnisse im zweiten Quartal 2019 zu melden.
Nucant Cancer Program - Klinische Entwicklungszusammenarbeit
Wie am 7. September 2018 angekündigt, unterzeichnete ImmuPhama mit dem Incanthera Limited ("Incanthera"), einem auf Onkologie spezialisierten Entwicklungsunternehmen, ein "Heads of Terms" für eine klinische Entwicklungszusammenarbeit für sein Nucant-Krebsprogramm.
Die beiden Unternehmen machen gute Fortschritte beim Abschluss der „endgültigen Lizenzvereinbarung“ innerhalb der Exklusivitätsfrist bis zum 31. Dezember 2018, die Incanthera von ImmuPharma gewährt wird. Für diesen Ausschließlichkeitszeitraum wurden ImmuPharma Warrants zum Bezug von 363.637 Stammaktien von Incanthera jederzeit über einen Zeitraum von fünf Jahren gewährt. Die Optionsscheine haben einen Ausübungspreis von 5,50 GBP pro Aktie bei einem Gesamtausübungswert von 2 Mio. GBP. Weitere Updates zu dieser Zusammenarbeit werden zu gegebener Zeit bekannt gegeben.
Ureka
Die 100% ige Tochtergesellschaft von ImmuPharma, Ureka Sarl ("Ureka") mit Sitz in Bordeaux, konzentriert sich auf die Umwandlung von Peptiden zu wirksamen Medikamenten für Behandlungen in einer Reihe von therapeutischen Bereichen, einschließlich Typ-II-Diabetes und NASH (Alkoholfreie Steato-Hepatitis).
In der Ankündigung des Unternehmens vom 7. September 2018 erklärte ImmuPharma, es werde ein Verfahren zur Prüfung aller Möglichkeiten einer Veräußerung von Ureka beginnen. Im Anschluss an diesen Überprüfungszeitraum beabsichtigt ImmuPharma, die Dienste eines führenden spezialisierten Forschungs- und Beratungsunternehmens in diesem Sektor in Anspruch zu nehmen, um die Bewertung der Technologien und Wirkstoffkandidaten von Ureka und die Entwicklungsaktivitäten für die Entwicklung ihrer Vermögenswerte und des Geschäfts zu unterstützen. Dieser Prozess ist noch nicht abgeschlossen und weitere Updates werden entsprechend angekündigt.
Status des nominierten Beraters (NOMAD)
ImmuPharma gab am 1. November 2018 bekannt, dass Northland Capital Partners, der aktuelle NOMAD, freiwillig zugestimmt hatte, seinen NOMAD-Status aufzugeben, der ihn am 1. Februar 2019 ab 7.00 Uhr (GMT) aus dem Register der NOMADs streichen wird.
ImmuPharma ist im Begriff, sich mit einem Ersatz-NOMAD zu befassen und erwartet, in naher Zukunft einen Termin bekannt zu geben.
Tim McCarthy, Vorsitzender, sagte:
"Wir freuen uns, die notwendigen Aktivitäten für das Managed Access-Programm voranzutreiben und Lupus-Patienten einen frühzeitigen Zugang zu Lupuzor ™ zu ermöglichen. Gleichzeitig werden wir uns auf mittlere Sicht darauf konzentrieren, die volle behördliche Zulassung von Lupuzor ™ zu erhalten, die wir zuversichtlich sind das Potenzial, ein bahnbrechendes Medikament für Lupus-Patienten zu sein.
"Unser Nucant-Programm und unsere Tochtergesellschaft Ureka entwickeln ihre separaten Strategien weiter. Beide haben das ultimative Ziel, für alle künftigen Interessengruppen einen Mehrwert zu erzielen.
"Mit den laufenden Diskussionen über die Ernennung eines neuen NOMAD freuen wir uns darauf, den Markt und die Aktionäre in naher Zukunft wieder zu aktualisieren."
("ImmuPharma" oder das "Unternehmen")
AKTUALISIERUNG DER UNTERNEHMENSAKTIVITÄTEN
ImmuPharma PLC (LSE: IMM), das Spezialforschungsunternehmen für die Entdeckung und Entwicklung von Medikamenten, freut sich, ein Update über die laufenden Aktivitäten anbieten zu können.
Schlüssel-Höhepunkte:
· Lupuzor ™
o Lupuzor ™ 'Managed Access Program'
o Phase III "Open Label Extension"
· Nucant (Krebs) -Programm: Klinische Entwicklungszusammenarbeit mit Incanthera Limited
· Ureka-Tochtergesellschaft
· Nominierter Beraterstatus
Lupuzor ™ Managed Access-Programm
Lupuzor ™ ist die Spätphase von ImmuPharma für Lupus, eine potenziell lebensbedrohliche Autoimmunerkrankung. Wie im „Corporate Update“ am 7. September 2018 angekündigt, hat ImmuPharma bestätigt, dass Lupuzor ™ derzeit Patienten über ein Managed Access-Programm („MAP“) zur Behandlung zur Verfügung stellt.
Der MAP schreitet voran, einschließlich der Vorbereitung von Verwaltungsdokumenten und der Bewertung der Logistik in Bezug auf den Regulierungsprozess in jedem Land. Nach einer Analyse der Regulierungsprozesse in den EU-Ländern ist geplant, mit der Patientenrekrutierung für das Programm in Frankreich und dem Vereinigten Königreich zu beginnen und dann in andere EU-Länder einzuführen. Weitere Updates werden bei Bedarf zur Verfügung gestellt.
Lupuzor ™ Erweiterungsstudie
Die Lupuzor ™ Open-Label-Erweiterungsstudie schreitet planmäßig voran. Insgesamt 62 in Frage kommende Patienten aus der ursprünglichen Phase-III-Studie, die in den USA und Europa rekrutiert wurde, sind im Gange. Diese Studie ist weiterhin auf Erfolgskurs, um die Ergebnisse im zweiten Quartal 2019 zu melden.
Nucant Cancer Program - Klinische Entwicklungszusammenarbeit
Wie am 7. September 2018 angekündigt, unterzeichnete ImmuPhama mit dem Incanthera Limited ("Incanthera"), einem auf Onkologie spezialisierten Entwicklungsunternehmen, ein "Heads of Terms" für eine klinische Entwicklungszusammenarbeit für sein Nucant-Krebsprogramm.
Die beiden Unternehmen machen gute Fortschritte beim Abschluss der „endgültigen Lizenzvereinbarung“ innerhalb der Exklusivitätsfrist bis zum 31. Dezember 2018, die Incanthera von ImmuPharma gewährt wird. Für diesen Ausschließlichkeitszeitraum wurden ImmuPharma Warrants zum Bezug von 363.637 Stammaktien von Incanthera jederzeit über einen Zeitraum von fünf Jahren gewährt. Die Optionsscheine haben einen Ausübungspreis von 5,50 GBP pro Aktie bei einem Gesamtausübungswert von 2 Mio. GBP. Weitere Updates zu dieser Zusammenarbeit werden zu gegebener Zeit bekannt gegeben.
Ureka
Die 100% ige Tochtergesellschaft von ImmuPharma, Ureka Sarl ("Ureka") mit Sitz in Bordeaux, konzentriert sich auf die Umwandlung von Peptiden zu wirksamen Medikamenten für Behandlungen in einer Reihe von therapeutischen Bereichen, einschließlich Typ-II-Diabetes und NASH (Alkoholfreie Steato-Hepatitis).
In der Ankündigung des Unternehmens vom 7. September 2018 erklärte ImmuPharma, es werde ein Verfahren zur Prüfung aller Möglichkeiten einer Veräußerung von Ureka beginnen. Im Anschluss an diesen Überprüfungszeitraum beabsichtigt ImmuPharma, die Dienste eines führenden spezialisierten Forschungs- und Beratungsunternehmens in diesem Sektor in Anspruch zu nehmen, um die Bewertung der Technologien und Wirkstoffkandidaten von Ureka und die Entwicklungsaktivitäten für die Entwicklung ihrer Vermögenswerte und des Geschäfts zu unterstützen. Dieser Prozess ist noch nicht abgeschlossen und weitere Updates werden entsprechend angekündigt.
Status des nominierten Beraters (NOMAD)
ImmuPharma gab am 1. November 2018 bekannt, dass Northland Capital Partners, der aktuelle NOMAD, freiwillig zugestimmt hatte, seinen NOMAD-Status aufzugeben, der ihn am 1. Februar 2019 ab 7.00 Uhr (GMT) aus dem Register der NOMADs streichen wird.
ImmuPharma ist im Begriff, sich mit einem Ersatz-NOMAD zu befassen und erwartet, in naher Zukunft einen Termin bekannt zu geben.
Tim McCarthy, Vorsitzender, sagte:
"Wir freuen uns, die notwendigen Aktivitäten für das Managed Access-Programm voranzutreiben und Lupus-Patienten einen frühzeitigen Zugang zu Lupuzor ™ zu ermöglichen. Gleichzeitig werden wir uns auf mittlere Sicht darauf konzentrieren, die volle behördliche Zulassung von Lupuzor ™ zu erhalten, die wir zuversichtlich sind das Potenzial, ein bahnbrechendes Medikament für Lupus-Patienten zu sein.
"Unser Nucant-Programm und unsere Tochtergesellschaft Ureka entwickeln ihre separaten Strategien weiter. Beide haben das ultimative Ziel, für alle künftigen Interessengruppen einen Mehrwert zu erzielen.
"Mit den laufenden Diskussionen über die Ernennung eines neuen NOMAD freuen wir uns darauf, den Markt und die Aktionäre in naher Zukunft wieder zu aktualisieren."
Bin mal wieder dabei und lass die guten Stücke jetzt mal 1
- 2 Jahre liegen. Auf dem aktuellen Niveau kann man nichts verkehrt machen .
- 2 Jahre liegen. Auf dem aktuellen Niveau kann man nichts verkehrt machen .
RNS-Nummer: 5484K
Immupharma PLC
17. Dezember 2018
17. Dezember 2018
ImmuPharma PLC
("ImmuPharma" oder das "Unternehmen")
ERNENNUNG EINES Nominierten Beraters
ImmuPharma PLC (LSE: IMM), das auf die Entdeckung und Entwicklung von Medikamenten spezialisierte Unternehmen, freut sich, mit sofortiger Wirkung die Ernennung von SPARK Advisory Partners Limited ("SPARK") zum Nominierten Berater des Unternehmens ("NOMAD") bekannt zu geben.
Tim McCarthy, der Vorsitzende von ImmuPharma, sagte zu der Ernennung:
"Ich freue mich sehr, die Ernennung von SPARK zum NOMAD des Unternehmens bekannt zu geben. Wir freuen uns auf die zukünftige Zusammenarbeit mit dem Team neben unseren gemeinsamen Brokern Stanford Capital Partners und SI Capital."
Diese Mitteilung enthält Insiderinformationen im Sinne von Artikel 7 der Verordnung (EU) Nr. 596/2014. ("BESCHÄDIGEN")
Für weitere Informationen kontaktieren Sie bitte:
ImmuPharma plc (www.immupharma.com)
+ 44 (0) 207 152 4080
Tim McCarthy, Vorsitzender
Lisa Baderoon, Leiterin Investor Relations
+ 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (gemeinsamer Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
Über SPARK Advisory Partners Limited
SPARK Advisory Partners wurde im Januar 2012 von seinen Gründungspartnern gegründet, um mittelständischen Unternehmen, Eigentümern und Anteilseignern produktunabhängige Unternehmensfinanzierungsberatung zukommen zu lassen.
SPARK ist im Besitz seiner Partner, die seit vielen Jahren zusammenarbeiten. Das Team verfügt über ein breites Spektrum an Fähigkeiten und Transaktionserfahrung, darunter M & A, Private Equity, Kapitalaufbringung und Schuldnerberatung. Weitere Informationen finden Sie unter: www.sparkadvisorypartners.com
Immupharma PLC
17. Dezember 2018
17. Dezember 2018
ImmuPharma PLC
("ImmuPharma" oder das "Unternehmen")
ERNENNUNG EINES Nominierten Beraters
ImmuPharma PLC (LSE: IMM), das auf die Entdeckung und Entwicklung von Medikamenten spezialisierte Unternehmen, freut sich, mit sofortiger Wirkung die Ernennung von SPARK Advisory Partners Limited ("SPARK") zum Nominierten Berater des Unternehmens ("NOMAD") bekannt zu geben.
Tim McCarthy, der Vorsitzende von ImmuPharma, sagte zu der Ernennung:
"Ich freue mich sehr, die Ernennung von SPARK zum NOMAD des Unternehmens bekannt zu geben. Wir freuen uns auf die zukünftige Zusammenarbeit mit dem Team neben unseren gemeinsamen Brokern Stanford Capital Partners und SI Capital."
Diese Mitteilung enthält Insiderinformationen im Sinne von Artikel 7 der Verordnung (EU) Nr. 596/2014. ("BESCHÄDIGEN")
Für weitere Informationen kontaktieren Sie bitte:
ImmuPharma plc (www.immupharma.com)
+ 44 (0) 207 152 4080
Tim McCarthy, Vorsitzender
Lisa Baderoon, Leiterin Investor Relations
+ 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (gemeinsamer Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
Über SPARK Advisory Partners Limited
SPARK Advisory Partners wurde im Januar 2012 von seinen Gründungspartnern gegründet, um mittelständischen Unternehmen, Eigentümern und Anteilseignern produktunabhängige Unternehmensfinanzierungsberatung zukommen zu lassen.
SPARK ist im Besitz seiner Partner, die seit vielen Jahren zusammenarbeiten. Das Team verfügt über ein breites Spektrum an Fähigkeiten und Transaktionserfahrung, darunter M & A, Private Equity, Kapitalaufbringung und Schuldnerberatung. Weitere Informationen finden Sie unter: www.sparkadvisorypartners.com
Hmmm....Unternehmungsfinanzierung...M&A...nur die Frage, was von beiden...😉
Die Ersten spekulieren heute wohl auf M&A...
Die Ersten spekulieren heute wohl auf M&A...
RNS-Nummer: 7735L
Immupharma PLC
31. Dezember 2018
31. Dezember 2018
ImmuPharma PLC
("ImmuPharma" oder das "Unternehmen")
AKTUALISIERUNG DES NUCANT-KREBSPROGRAMMS
Klinische Entwicklungszusammenarbeit mit Incanthera
ImmuPharma PLC (LSE: IMM), das auf die Entdeckung und Entwicklung von Medikamenten spezialisierte Unternehmen, informiert mit Incanthera Limited ("Incanthera"), einem auf Onkologie spezialisierten Entwicklungsunternehmen, über ein aktuelles Abkommen über die klinische Entwicklungszusammenarbeit.
Wie am 7. Dezember 2018 angekündigt, macht ImmuPharma gemeinsam mit Incanthera gute Fortschritte beim Abschluss der „endgültigen Lizenzvereinbarung“. Es wurde zwischen beiden Unternehmen vereinbart, den ursprünglich bis 31. Dezember 2018 gewährten Ausschließlichkeitszeitraum bis 31. März 2019 zu verlängern, um die verbleibenden Teile der Vereinbarung abzuschließen.
Es ist nun beabsichtigt, dass die „endgültige Lizenzvereinbarung“ im ersten Quartal 2019 abgeschlossen wird. Daher wird zu gegebener Zeit ein weiteres Update dieser Zusammenarbeit bekannt gegeben.
Dimitri Dimitriou, Chief Executive Officer von ImmuPharma, kommentierte:
"Wir arbeiten sorgfältig mit dem Managementteam von Incanthera zusammen, um die letzten verbleibenden Teile der 'Definitiven Lizenzvereinbarung' abzuschließen und freuen uns darauf, den Markt und die Aktionäre im ersten Quartal 2019 zu aktualisieren."
Diese Mitteilung enthält Insiderinformationen im Sinne von Artikel 7 der Verordnung (EU) Nr. 596/2014. ("BESCHÄDIGEN")
Für weitere Informationen kontaktieren Sie bitte:
ImmuPharma plc (www.immupharma.com)
+ 44 (0) 207 152 4080
Dimitri Dimitriou, Vorstandsvorsitzender
Lisa Baderoon, Leiterin Investor Relations
+ 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (gemeinsamer Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
Über Incanthera Limited
Incanthera Limited wurde 2010 als Spin-out des Institute of Cancer Therapeutics der Bradford University gegründet und zielt mit einem Portfolio einzigartiger Technologien auf die Behandlung von Krebs ab. Nachdem es 2017 sein Hauptprodukt erfolgreich vermarktet hatte, erwirbt es aktiv Technologien, um sein Portfolio an Krebstherapeutika weiter zu verbessern. Weitere Informationen finden Sie unter: www.incanthera.com
Immupharma PLC
31. Dezember 2018
31. Dezember 2018
ImmuPharma PLC
("ImmuPharma" oder das "Unternehmen")
AKTUALISIERUNG DES NUCANT-KREBSPROGRAMMS
Klinische Entwicklungszusammenarbeit mit Incanthera
ImmuPharma PLC (LSE: IMM), das auf die Entdeckung und Entwicklung von Medikamenten spezialisierte Unternehmen, informiert mit Incanthera Limited ("Incanthera"), einem auf Onkologie spezialisierten Entwicklungsunternehmen, über ein aktuelles Abkommen über die klinische Entwicklungszusammenarbeit.
Wie am 7. Dezember 2018 angekündigt, macht ImmuPharma gemeinsam mit Incanthera gute Fortschritte beim Abschluss der „endgültigen Lizenzvereinbarung“. Es wurde zwischen beiden Unternehmen vereinbart, den ursprünglich bis 31. Dezember 2018 gewährten Ausschließlichkeitszeitraum bis 31. März 2019 zu verlängern, um die verbleibenden Teile der Vereinbarung abzuschließen.
Es ist nun beabsichtigt, dass die „endgültige Lizenzvereinbarung“ im ersten Quartal 2019 abgeschlossen wird. Daher wird zu gegebener Zeit ein weiteres Update dieser Zusammenarbeit bekannt gegeben.
Dimitri Dimitriou, Chief Executive Officer von ImmuPharma, kommentierte:
"Wir arbeiten sorgfältig mit dem Managementteam von Incanthera zusammen, um die letzten verbleibenden Teile der 'Definitiven Lizenzvereinbarung' abzuschließen und freuen uns darauf, den Markt und die Aktionäre im ersten Quartal 2019 zu aktualisieren."
Diese Mitteilung enthält Insiderinformationen im Sinne von Artikel 7 der Verordnung (EU) Nr. 596/2014. ("BESCHÄDIGEN")
Für weitere Informationen kontaktieren Sie bitte:
ImmuPharma plc (www.immupharma.com)
+ 44 (0) 207 152 4080
Dimitri Dimitriou, Vorstandsvorsitzender
Lisa Baderoon, Leiterin Investor Relations
+ 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (gemeinsamer Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
Über Incanthera Limited
Incanthera Limited wurde 2010 als Spin-out des Institute of Cancer Therapeutics der Bradford University gegründet und zielt mit einem Portfolio einzigartiger Technologien auf die Behandlung von Krebs ab. Nachdem es 2017 sein Hauptprodukt erfolgreich vermarktet hatte, erwirbt es aktiv Technologien, um sein Portfolio an Krebstherapeutika weiter zu verbessern. Weitere Informationen finden Sie unter: www.incanthera.com
Und (leider) wieder zurück auf ‚Los‘...😌
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Spam, Werbung
Meine Depotleiche zuckt mal wieder...😉
Antwort auf Beitrag Nr.: 59.910.971 von Stoxtrayder am 19.02.19 16:17:30Wird allmählich auch echt Zeit, dass hier mal wieder was zuckt...
...und weiter geht das Zucken. 😉
Schon 1 Mio Aktien bis Mittag gehandelt.
Vielleicht ist was im Busch? Hätte nix dagegen...
Schon 1 Mio Aktien bis Mittag gehandelt.
Vielleicht ist was im Busch? Hätte nix dagegen...
Antwort auf Beitrag Nr.: 59.919.395 von Stoxtrayder am 20.02.19 12:38:42Schon auffällig die letzten Tage wie sich der "eingefrorene" Kurs nach oben bewegt. Das ist bestimmt nicht grundlos. Hat jemand Einblick in Insideraktivitäten?
Gruß aaahhh
Gruß aaahhh
...und weiter gehts nach oben. 16 Pence, schon 1,5 Mio Anteile gehandelt. Mir soll‘s recht sein...
Ist jemand gut informiert über IMML?
- Was sind die nächsten Schritte für Lupozor?
- Wie weit ist man mit den potenziellen Onkologie & Diabetes Meds?
- Wie sieht es finanziell aus derzeit?
Gruss
- Was sind die nächsten Schritte für Lupozor?
- Wie weit ist man mit den potenziellen Onkologie & Diabetes Meds?
- Wie sieht es finanziell aus derzeit?
Gruss
Antwort auf Beitrag Nr.: 59.930.228 von techxxnine am 21.02.19 11:22:01woher auch?
es kommen ja keine Nachrichten raus
es kommen ja keine Nachrichten raus
Antwort auf Beitrag Nr.: 59.930.657 von E_Nichtlustig am 21.02.19 12:02:26erste Bürgerpflicht bei Biotech-Aktien !!
" viel Luft zum Atmen mitbringen , da man sie bei 90% der Biotechs benödigt ..eben auch bei IMM
Von daher , nur bei Bios Investieren wenn die Lungen gut trainiert sind
Gruß an die alten Langstreck'ler hier ;
" viel Luft zum Atmen mitbringen , da man sie bei 90% der Biotechs benödigt ..eben auch bei IMM

Von daher , nur bei Bios Investieren wenn die Lungen gut trainiert sind

Gruß an die alten Langstreck'ler hier ;
Hui, jetzt kommt ja richtig Schwung rein. Schon an der 18 Pence-Marke gekratzt mit knapp 5 Mio gehandelten Stücken.
Hier muß was dahinterstecken, nochmals so ‚ne Aktion wie im November will ich nicht sehen...🤔
Hier muß was dahinterstecken, nochmals so ‚ne Aktion wie im November will ich nicht sehen...🤔
Antwort auf Beitrag Nr.: 59.932.742 von Stoxtrayder am 21.02.19 15:19:55An der Stock in London sind sie auch alle durcheinander wegen dem Anstieg !! Mein Tipp 😎
Sie haben wieder Bargeld 😇 ohne Moooos auch bei IMM nichts los.
Sie haben wieder Bargeld 😇 ohne Moooos auch bei IMM nichts los.
Antwort auf Beitrag Nr.: 59.933.645 von swoasik am 21.02.19 16:23:00Oder es tut sich doch noch was in Sachen Lupuzor.
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 59.933.843 von aaahhh am 21.02.19 16:34:30Klar , kann genauso sein. Wobei das große Probleme das nicht mehr vorhandene geld war.
Aber natürlich kann auch Lupzor der Grund sein ....
Wir werden sehen...
Aber natürlich kann auch Lupzor der Grund sein ....
Wir werden sehen...
Antwort auf Beitrag Nr.: 59.933.975 von swoasik am 21.02.19 16:42:57Dann wäre cash für Lupuzor ja die ideale Lösung für unsere Vermutungen
Gruß aaahhh

Gruß aaahhh
Danke aaahhh, für deinen Beitrag im Rohstoffforum. Wäre sonst nicht so frühzeitig drauf aufmerksam geworden. Bin gespannt was der Grund für diesen Anstieg ist.
Antwort auf Beitrag Nr.: 59.934.737 von sirlacoura am 21.02.19 17:40:49Bin seit heute auch mit ner kleinen Position drin. Bin gespannt wieso die Aktie so ohne News steigt!
Welches Rohstoffeforum? Wäre auch interessiert. Danke
Welches Rohstoffeforum? Wäre auch interessiert. Danke
Wow, die Posi ist nun tatsächlich schwarz. Vlt. lade ich hier nochmals auf demnächst. Zuerst aber nochmals mit Immupharma auseinandersetzen.
Antwort auf Beitrag Nr.: 59.936.492 von Badenfinke am 21.02.19 20:22:42
Bitte!
https://www.wallstreet-online.de/diskussion/1170870-neusteb…
Gruß aaahhh
Zitat von Badenfinke: Bin seit heute auch mit ner kleinen Position drin. Bin gespannt wieso die Aktie so ohne News steigt!
Welches Rohstoffeforum? Wäre auch interessiert. Danke
Bitte!
https://www.wallstreet-online.de/diskussion/1170870-neusteb…
Gruß aaahhh
Antwort auf Beitrag Nr.: 59.933.975 von swoasik am 21.02.19 16:42:57Ich meine eigentlich nicht, dass das Geld ein Problem war. Wenn ich mich recht erinnere, war der letzte Stand, der von TimMcCarthy verkündet wurde, etwas um die 9 oder 10 Mio GBP, wobei ja 2 davon in Incanthera gesteckt wurden. Der größte Teil der R&D-Kosten für Lupuzor ist bereits durch und es ging letztlich nur noch um die Finanzierung der Extensionstudie und des MAP. Abzüglich dieser Kosten und der Gehälter sollte IMM eigentlich noch ein paar Mio übrig haben. Ich hoffe es zumindest! Und ich hoffe auch, dass dieser Anstieg endlich bevorstehenden positiven News zu Lupuzor zu verdanken ist. Wobei ich dem ganzen noch nicht traue. Klar, es heißt immer irgendjemand weiß irgendwas, leaky leaky und blabla, aber mal ehrlich: mittlerweile wird das alles so streng kontrolliert und Fehlverstöße hart geahndet, da wird es doch eine so kleine Firma wie IMM nicht riskieren irgendjemand vorher etwas zu verraten? Ich verbuche den Anstieg erstmal immer noch unter "Spielchen" von Leuten, die mit viel Geld viel bewegen können, nur um dann hinterher noch mehr Geld haben... (wie bereits schon einmal Mitte November geschehen)
Ist leider kein Volumen dahinter...
Antwort auf Beitrag Nr.: 59.939.601 von E301173K am 22.02.19 09:40:32Innerhalb von ein paar Tagen über 60% und vom Jahrestief 100% geschieht auch hier nicht grundlos. Spielerei? Denke wenn jetzt auch noch das Volumen anziehen sollte, dann dürfte auch bald eine News kommen.
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 59.939.661 von aaahhh am 22.02.19 09:49:20War es das schon wieder? Das Teil kann einen echt ratlos machen.
Gruß aaahhh
Gruß aaahhh
Technology review published-Nature Communications
https://www.investegate.co.uk/immupharma-plc--imm-/rns/techn…
ImmuPharma continues to build data package for flagship lupus treatment
https://www.proactiveinvestors.co.uk/companies/news/215247/i…
https://www.investegate.co.uk/immupharma-plc--imm-/rns/techn…
ImmuPharma continues to build data package for flagship lupus treatment
https://www.proactiveinvestors.co.uk/companies/news/215247/i…
RNS-Nummer: 0641R
Immupharma PLC
26. Februar 2019
RNS REACH 26. Februar 2019
ImmuPharma PLC
("ImmuPharma" oder das "Unternehmen")
Technologieüberprüfung in Nature Communications veröffentlicht
ImmuPharma PLC (LSE: IMM), das Spezialforschungsunternehmen für Entdeckung und Entwicklung von Medikamenten, freut sich bekannt zu geben, dass das von Experten geprüfte Forschungsjournal "Nature Communications" am 25. Februar 2019 eine grundlegende wissenschaftliche Veröffentlichung über die proprietäre Technologie Urelix ™ von UREkA Sarl (" Ureka "), der Tochtergesellschaft von ImmuPharma.
Ureka, an der IECB in Bordeaux, Frankreich, ansässig, erforscht neuartige Peptidmoleküle, um Wirkstoffkandidaten für viele Krankheiten zu generieren. Die Veröffentlichung beschreibt zum ersten Mal die einzigartigen Eigenschaften von Oligoharnstoff-Foldameren als Mittel zur Verbesserung der pharmazeutischen Eigenschaften von Peptiden. Weitere Verbesserungen, die hier noch nicht beschrieben wurden, beziehen sich auf gezieltere medizinische Indikationen. Ein erster Schwerpunkt lag auf GLP-1-Analoga zur Behandlung von Typ-II-Diabetes und NASH (Alcoholic-Steato-Hepatitis) als Konzeptnachweis für die Technologie von Ureka.
Weitere Anwendungen der Urelix ™ -Technologie umfassen Protein / Protein-Wechselwirkungen, insbesondere bei Krebs, und die Verbesserung der auf dem Markt befindlichen wirksamen Peptide, die einen zusätzlichen dauerhaften Patentschutz ermöglichen und den Weg für ein Life-Cycle-Management-Franchise ebnen. Derzeit werden neuartige patentierte Technologien implementiert, um andere Aspekte der Verbesserung von Peptiden einschließlich der potenziellen oralen Abgabe abzudecken.
Die Publikation hatte den Titel: "Peptid-Oligoharnstoff-Hybride-Analogon von GLP-1 mit verbesserter Wirkung in vivo" und wurde von einer Reihe von Forschern bei Ureka verfasst, darunter Dr. Robert Zimmer, Chief Scientific Officer von ImmuPharma, und Dr. Sébastien R. Goudreau, Leiter von Forschung in Ureka.
Einführung in die Publikation
Peptide haben im letzten Jahrzehnt so viel Aufmerksamkeit auf sich gezogen, dass sie nun zu den Hauptstrategien für die Entwicklung neuer Arzneimittel mit kleinen Molekülen und Biologika gehören. Trotz erheblicher Fortschritte erfordert die erfolgreiche Entwicklung von Peptiden als Arzneimittel immer noch eine Reihe von Einschränkungen, einschließlich kurzer In-vivo-Halbwertszeiten und schlechter Membranpermeabilität.
Dr. Robert Zimmer, Chief Scientific Officer von ImmuPharma, sagte dazu: "Ich bin sehr stolz auf die Leistung des Forschungsteams in Ureka seit seinem Start im Jahr 2014, nachdem wir ein Team von qualifizierten Mitarbeitern aufgebaut und unsere Zusammenarbeit mit dem CNRS ausgebaut und ein Team entwickelt haben Eine aufregende Technologie, die durch ein starkes Patentportfolio unterstützt wird. Dies ist eine erfreuliche Bestätigung jahrelanger Forschung durch unser wissenschaftliches Team und unsere Mitarbeiter, die uns weiteres Vertrauen in das langfristige Potenzial unserer Ureka-Plattform gibt. "
Dimitri Dimitriou, Chief Executive Officer von ImmuPharma, kommentierte: "Natürliche Peptide spielen eine Schlüsselrolle in biologischen Prozessen des Menschen und sind wirksame und selektive Signalmoleküle, die an spezifische Rezeptoren auf Zellen binden. Die Verwendung natürlicher Peptide als Arzneimittel ist nicht so effektiv, weil sie schnell sind Kurz gesagt: Unsere Technologie überwindet diese Herausforderungen und stellt einen intelligenten Weg für die Entwicklung neuartiger Arzneimittel dar. Der weltweite Markt für Peptidtherapeutika erzielte 2018 einen Umsatz von 30 Milliarden US-Dollar. "
Das vollständige Dokument kann jetzt von folgender Website heruntergeladen werden: http://dx.doi.org/10.1038/s41467-019-08793-y oder über die Website von Nature Communications: https://www.nature.com/search?q=immupharma .
Immupharma PLC
26. Februar 2019
RNS REACH 26. Februar 2019
ImmuPharma PLC
("ImmuPharma" oder das "Unternehmen")
Technologieüberprüfung in Nature Communications veröffentlicht
ImmuPharma PLC (LSE: IMM), das Spezialforschungsunternehmen für Entdeckung und Entwicklung von Medikamenten, freut sich bekannt zu geben, dass das von Experten geprüfte Forschungsjournal "Nature Communications" am 25. Februar 2019 eine grundlegende wissenschaftliche Veröffentlichung über die proprietäre Technologie Urelix ™ von UREkA Sarl (" Ureka "), der Tochtergesellschaft von ImmuPharma.
Ureka, an der IECB in Bordeaux, Frankreich, ansässig, erforscht neuartige Peptidmoleküle, um Wirkstoffkandidaten für viele Krankheiten zu generieren. Die Veröffentlichung beschreibt zum ersten Mal die einzigartigen Eigenschaften von Oligoharnstoff-Foldameren als Mittel zur Verbesserung der pharmazeutischen Eigenschaften von Peptiden. Weitere Verbesserungen, die hier noch nicht beschrieben wurden, beziehen sich auf gezieltere medizinische Indikationen. Ein erster Schwerpunkt lag auf GLP-1-Analoga zur Behandlung von Typ-II-Diabetes und NASH (Alcoholic-Steato-Hepatitis) als Konzeptnachweis für die Technologie von Ureka.
Weitere Anwendungen der Urelix ™ -Technologie umfassen Protein / Protein-Wechselwirkungen, insbesondere bei Krebs, und die Verbesserung der auf dem Markt befindlichen wirksamen Peptide, die einen zusätzlichen dauerhaften Patentschutz ermöglichen und den Weg für ein Life-Cycle-Management-Franchise ebnen. Derzeit werden neuartige patentierte Technologien implementiert, um andere Aspekte der Verbesserung von Peptiden einschließlich der potenziellen oralen Abgabe abzudecken.
Die Publikation hatte den Titel: "Peptid-Oligoharnstoff-Hybride-Analogon von GLP-1 mit verbesserter Wirkung in vivo" und wurde von einer Reihe von Forschern bei Ureka verfasst, darunter Dr. Robert Zimmer, Chief Scientific Officer von ImmuPharma, und Dr. Sébastien R. Goudreau, Leiter von Forschung in Ureka.
Einführung in die Publikation
Peptide haben im letzten Jahrzehnt so viel Aufmerksamkeit auf sich gezogen, dass sie nun zu den Hauptstrategien für die Entwicklung neuer Arzneimittel mit kleinen Molekülen und Biologika gehören. Trotz erheblicher Fortschritte erfordert die erfolgreiche Entwicklung von Peptiden als Arzneimittel immer noch eine Reihe von Einschränkungen, einschließlich kurzer In-vivo-Halbwertszeiten und schlechter Membranpermeabilität.
Dr. Robert Zimmer, Chief Scientific Officer von ImmuPharma, sagte dazu: "Ich bin sehr stolz auf die Leistung des Forschungsteams in Ureka seit seinem Start im Jahr 2014, nachdem wir ein Team von qualifizierten Mitarbeitern aufgebaut und unsere Zusammenarbeit mit dem CNRS ausgebaut und ein Team entwickelt haben Eine aufregende Technologie, die durch ein starkes Patentportfolio unterstützt wird. Dies ist eine erfreuliche Bestätigung jahrelanger Forschung durch unser wissenschaftliches Team und unsere Mitarbeiter, die uns weiteres Vertrauen in das langfristige Potenzial unserer Ureka-Plattform gibt. "
Dimitri Dimitriou, Chief Executive Officer von ImmuPharma, kommentierte: "Natürliche Peptide spielen eine Schlüsselrolle in biologischen Prozessen des Menschen und sind wirksame und selektive Signalmoleküle, die an spezifische Rezeptoren auf Zellen binden. Die Verwendung natürlicher Peptide als Arzneimittel ist nicht so effektiv, weil sie schnell sind Kurz gesagt: Unsere Technologie überwindet diese Herausforderungen und stellt einen intelligenten Weg für die Entwicklung neuartiger Arzneimittel dar. Der weltweite Markt für Peptidtherapeutika erzielte 2018 einen Umsatz von 30 Milliarden US-Dollar. "
Das vollständige Dokument kann jetzt von folgender Website heruntergeladen werden: http://dx.doi.org/10.1038/s41467-019-08793-y oder über die Website von Nature Communications: https://www.nature.com/search?q=immupharma .
Behandlung
Aktie
15:30 25 Feb 2019
Die Ergebnisse einer 62-Patienten-Follow-up-Studie sind in Kürze fällig, während die Daten eines 500-Personen-Managed-Access-Programms bis Ende nächsten Jahres verfügbar sein sollten.
Trotz des Rückschlags von letztem Jahr bleibt ImmuPharma zuversichtlich, dass Lupuzor ein "Blockbuster-Potenzial" hat
Flaggschiff-Medikament ist Lupuzor - eine Behandlung für LupusErgebnisse aus Follow-up-Studie, die in den nächsten Monaten ansteht. Die Krebserkrankung wird ebenfalls durch die Tochterfirma ClinicUreka veräußert
Was es macht
Die ImmuPharma PLC (LON: IMM) ist auf die Entwicklung von Medikamenten für ernste Erkrankungen spezialisiert, bei denen es an bestehenden Behandlungsmöglichkeiten mangelt.
Sein Flaggschiff heißt Lupuzor - eine Behandlung für die Autoimmunerkrankung Lupus.
Das Medikament hatte seinen primären Endpunkt in einer Phase-II-Studie im vergangenen Jahr verfehlt, aber das Ergebnis war differenzierter als die vorgeschlagenen Ergebnisse und zeigten, dass Lupuzor bei bestimmten Patienten gut funktionierte, vor allem bei Patienten, die Antikörper-positiv waren.
Die Ergebnisse haben ImmuPharma oder sein Top-Medikament sicherlich nicht behindert. Chef Tim McCarthy sagte sogar, dass Lupuzor immer noch ein „Blockbuster-Potenzial“ besitzt, was bedeutet, dass es einen Jahresumsatz von über 1 Milliarde US-Dollar erzielen könnte.
Nach dem Ende der Phase-III-Studie nahmen 62 Patienten an einer Follow-up-Studie teil, einer so genannten offenen Verlängerungsstudie. Ergebnisse hiervon werden zwischen April und Juni erwartet.
Darüber hinaus erhalten weitere 500 Lupus-Patienten im Rahmen eines Managed Access-Programms für die nächsten zwei Jahre Zugang zu Lupuzor.
Neben der Unterstützung der Patienten erwartet der von AIM notierte Arzneimittelentwickler, weitere wertvolle Daten zu Lupuzor zu sammeln, was nützlich sein wird, wenn er sich dazu entscheidet, die Zulassungsanträge voranzutreiben.
Blauer Himmel
In naher Zukunft sollen die Ergebnisse der Lupuzor-Folgestudie Ende Juni vorliegen, während das Managed-Access-Programm gegen Ende 2020 abgeschlossen sein soll.
Sollte sich Lupuzor in diesen beiden Tests bewähren, wird ImmuPharma die Daten verwenden, um zu versuchen, die vollständige Zulassung des Arzneimittels zu erhalten, etwas, das die Chefs „mittelfristig“ erreichen wollen.
Lupuzor ist nicht das einzige Medikament von ImmuPharma, das die Klinik durchläuft. Seine Behandlung mit Nucant-Krebs hat in zwei Phase-I-Sicherheits- und Dosisfindungsstudien "vielversprechende Ergebnisse" ergeben.
Das Unternehmen hat mit dem Onkologiespezialisten Incanthera eine klinische Entwicklungszusammenarbeit unterzeichnet, an der ImmuPharma einen Betrag von £ 2 Mio. beteiligt hat.
Eine Lizenzvereinbarung zwischen den beiden wird voraussichtlich bis Ende März unterzeichnet, ein Abkommen, bei dem Incanthera voraussichtlich eine Vorablizenzgebühr von £ 1 Mio. in Aktien zahlen wird und alle Entwicklungskosten für das Nucant-Programm abdeckt.
Alle künftigen Vermarktungserlöse werden zu gleichen Teilen geteilt, so ImmuPharma
Aktie
15:30 25 Feb 2019
Die Ergebnisse einer 62-Patienten-Follow-up-Studie sind in Kürze fällig, während die Daten eines 500-Personen-Managed-Access-Programms bis Ende nächsten Jahres verfügbar sein sollten.
Trotz des Rückschlags von letztem Jahr bleibt ImmuPharma zuversichtlich, dass Lupuzor ein "Blockbuster-Potenzial" hat
Flaggschiff-Medikament ist Lupuzor - eine Behandlung für LupusErgebnisse aus Follow-up-Studie, die in den nächsten Monaten ansteht. Die Krebserkrankung wird ebenfalls durch die Tochterfirma ClinicUreka veräußert
Was es macht
Die ImmuPharma PLC (LON: IMM) ist auf die Entwicklung von Medikamenten für ernste Erkrankungen spezialisiert, bei denen es an bestehenden Behandlungsmöglichkeiten mangelt.
Sein Flaggschiff heißt Lupuzor - eine Behandlung für die Autoimmunerkrankung Lupus.
Das Medikament hatte seinen primären Endpunkt in einer Phase-II-Studie im vergangenen Jahr verfehlt, aber das Ergebnis war differenzierter als die vorgeschlagenen Ergebnisse und zeigten, dass Lupuzor bei bestimmten Patienten gut funktionierte, vor allem bei Patienten, die Antikörper-positiv waren.
Die Ergebnisse haben ImmuPharma oder sein Top-Medikament sicherlich nicht behindert. Chef Tim McCarthy sagte sogar, dass Lupuzor immer noch ein „Blockbuster-Potenzial“ besitzt, was bedeutet, dass es einen Jahresumsatz von über 1 Milliarde US-Dollar erzielen könnte.
Nach dem Ende der Phase-III-Studie nahmen 62 Patienten an einer Follow-up-Studie teil, einer so genannten offenen Verlängerungsstudie. Ergebnisse hiervon werden zwischen April und Juni erwartet.
Darüber hinaus erhalten weitere 500 Lupus-Patienten im Rahmen eines Managed Access-Programms für die nächsten zwei Jahre Zugang zu Lupuzor.
Neben der Unterstützung der Patienten erwartet der von AIM notierte Arzneimittelentwickler, weitere wertvolle Daten zu Lupuzor zu sammeln, was nützlich sein wird, wenn er sich dazu entscheidet, die Zulassungsanträge voranzutreiben.
Blauer Himmel
In naher Zukunft sollen die Ergebnisse der Lupuzor-Folgestudie Ende Juni vorliegen, während das Managed-Access-Programm gegen Ende 2020 abgeschlossen sein soll.
Sollte sich Lupuzor in diesen beiden Tests bewähren, wird ImmuPharma die Daten verwenden, um zu versuchen, die vollständige Zulassung des Arzneimittels zu erhalten, etwas, das die Chefs „mittelfristig“ erreichen wollen.
Lupuzor ist nicht das einzige Medikament von ImmuPharma, das die Klinik durchläuft. Seine Behandlung mit Nucant-Krebs hat in zwei Phase-I-Sicherheits- und Dosisfindungsstudien "vielversprechende Ergebnisse" ergeben.
Das Unternehmen hat mit dem Onkologiespezialisten Incanthera eine klinische Entwicklungszusammenarbeit unterzeichnet, an der ImmuPharma einen Betrag von £ 2 Mio. beteiligt hat.
Eine Lizenzvereinbarung zwischen den beiden wird voraussichtlich bis Ende März unterzeichnet, ein Abkommen, bei dem Incanthera voraussichtlich eine Vorablizenzgebühr von £ 1 Mio. in Aktien zahlen wird und alle Entwicklungskosten für das Nucant-Programm abdeckt.
Alle künftigen Vermarktungserlöse werden zu gleichen Teilen geteilt, so ImmuPharma
geht aber böse zurück der Kurs
Hoffentlich kommen die Ergebnisse einer 62-Patienten-Follow-up-Studie bald online
Antwort auf Beitrag Nr.: 60.024.278 von liquidx am 05.03.19 14:35:15Das wird sich vermutlich noch bis Juni ziehen. Aber Neuigkeiten bzgl des Incanthera-Deals sollten bis Ende März veröffentlicht werden
okay vielleicht liefert eine Meldung zu dem Deal ja schon ein gutes UP
Schöner Endspurt heute in London.
Mal sehen, ob’s demnächst endlich mal handfeste News gibt...
Mal sehen, ob’s demnächst endlich mal handfeste News gibt...
Antwort auf Beitrag Nr.: 60.081.969 von Stoxtrayder am 12.03.19 19:40:54Ja, die werden dringend benötigt, sonst wird auch dieser kleine Anstieg direkt wieder abverkauft. Wenn in diese Aktie Bewegung ohne zugehörige News kommt, dann ist das in der Regel nicht von Dauer...
CORPORATE UPDATE
Commenting on the announcement, Tim McCarthy, ImmuPharma's Chairman said: "We remain focused on creating long term value throughout our portfolio through initiatives including the Managed Access Program for Lupuzor™, whilst the Company continues to engage with industry partners for potential collaboration opportunities on its projects."
https://www.investegate.co.uk/immupharma-plc--imm-/rns/corpo…
Commenting on the announcement, Tim McCarthy, ImmuPharma's Chairman said: "We remain focused on creating long term value throughout our portfolio through initiatives including the Managed Access Program for Lupuzor™, whilst the Company continues to engage with industry partners for potential collaboration opportunities on its projects."
https://www.investegate.co.uk/immupharma-plc--imm-/rns/corpo…
RNS Number : 8100S
Immupharma PLC
14 March 2019
14 March 2019
ImmuPharma PLC
("ImmuPharma" or the "Company")
CORPORATE UPDATE
ImmuPharma PLC (LSE: IMM), the specialist drug discovery and development company provides an update on ongoing activities.
Key highlights:
•Lupuzor™
o Lupuzor™ 'Managed Access Program'
o Phase III 'open label extension'
•Nucant (cancer) program: Clinical development collaboration with Incanthera Limited
•Urelix technology
Lupuzor™
Lupuzor™ is the Company's late stage asset for Lupus, a potential life threatening auto-immune disease. Following the conclusion of the pivotal Phase III trial earlier in 2018, ImmuPharma continues to look at opportunities which over the longer term have the potential of bringing Lupuzor™ to market. As part of this strategy, the Company continues to engage with potential corporate partners as well as commencing a Managed Access Program for Lupuzor™.
Lupuzor™ Managed Access Program
ImmuPharma, together with its partner, is in the final preparations for its Managed Access Program ('MAP') being open to eligible patients in Europe. Further updates will be provided to the market in due course.
Lupuzor™ Extension Study
The Lupuzor™ open label extension study, from the original Phase III trial, with a total of 62 eligible patients recruited throughout the US and Europe, remains on track to report results in Q2 2019.
Nucant Cancer Programme - Clinical Development Collaboration
As announced on 31 December 2018, the exclusivity period was extended to 31 March 2019. Discussions continue on this collaboration and an update will be provided in due course.
Ureka
ImmuPharma's subsidiary, Ureka Sarl ("Ureka") based in Bordeaux, is focusing on transforming peptides into efficient drugs for treatments in a number of therapeutic areas including Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis). Recently, a fundamental research paper on Ureka' proprietary technology 'Urelix™' was published in the peer reviewed research journal 'Nature Communications'.
ImmuPharma continues to look at all options regarding progression of Ureka's assets. This process is ongoing and further updates will be announced as appropriate.
Commenting on the announcement, Tim McCarthy, ImmuPharma's Chairman said: "We remain focused on creating long term value throughout our portfolio through initiatives including the Managed Access Program for Lupuzor™, whilst the Company continues to engage with industry partners for potential collaboration opportunities on its projects."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
For further information please contact:
ImmuPharma plc (https://clicktime.symantec.com/3RjzXudDQD89ACK4z1iciFZ6H2?u=…
+ 44 (0) 207 152 4080
Tim McCarthy, Chairman
Lisa Baderoon, Head of Investor Relations + 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (Joint Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
This information is provided by RNS, the news service of the London Stock Exchange. RNS is approved by the Financial Conduct Authority to act as a Primary Information Provider in the United Kingdom. Terms and conditions relating to the use and distribution of this information may apply. For further information, please contact rns@lseg.com or visit www.rns.com.
END
Immupharma PLC
14 March 2019
14 March 2019
ImmuPharma PLC
("ImmuPharma" or the "Company")
CORPORATE UPDATE
ImmuPharma PLC (LSE: IMM), the specialist drug discovery and development company provides an update on ongoing activities.
Key highlights:
•Lupuzor™
o Lupuzor™ 'Managed Access Program'
o Phase III 'open label extension'
•Nucant (cancer) program: Clinical development collaboration with Incanthera Limited
•Urelix technology
Lupuzor™
Lupuzor™ is the Company's late stage asset for Lupus, a potential life threatening auto-immune disease. Following the conclusion of the pivotal Phase III trial earlier in 2018, ImmuPharma continues to look at opportunities which over the longer term have the potential of bringing Lupuzor™ to market. As part of this strategy, the Company continues to engage with potential corporate partners as well as commencing a Managed Access Program for Lupuzor™.
Lupuzor™ Managed Access Program
ImmuPharma, together with its partner, is in the final preparations for its Managed Access Program ('MAP') being open to eligible patients in Europe. Further updates will be provided to the market in due course.
Lupuzor™ Extension Study
The Lupuzor™ open label extension study, from the original Phase III trial, with a total of 62 eligible patients recruited throughout the US and Europe, remains on track to report results in Q2 2019.
Nucant Cancer Programme - Clinical Development Collaboration
As announced on 31 December 2018, the exclusivity period was extended to 31 March 2019. Discussions continue on this collaboration and an update will be provided in due course.
Ureka
ImmuPharma's subsidiary, Ureka Sarl ("Ureka") based in Bordeaux, is focusing on transforming peptides into efficient drugs for treatments in a number of therapeutic areas including Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis). Recently, a fundamental research paper on Ureka' proprietary technology 'Urelix™' was published in the peer reviewed research journal 'Nature Communications'.
ImmuPharma continues to look at all options regarding progression of Ureka's assets. This process is ongoing and further updates will be announced as appropriate.
Commenting on the announcement, Tim McCarthy, ImmuPharma's Chairman said: "We remain focused on creating long term value throughout our portfolio through initiatives including the Managed Access Program for Lupuzor™, whilst the Company continues to engage with industry partners for potential collaboration opportunities on its projects."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
For further information please contact:
ImmuPharma plc (https://clicktime.symantec.com/3RjzXudDQD89ACK4z1iciFZ6H2?u=…
+ 44 (0) 207 152 4080
Tim McCarthy, Chairman
Lisa Baderoon, Head of Investor Relations + 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (Joint Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
This information is provided by RNS, the news service of the London Stock Exchange. RNS is approved by the Financial Conduct Authority to act as a Primary Information Provider in the United Kingdom. Terms and conditions relating to the use and distribution of this information may apply. For further information, please contact rns@lseg.com or visit www.rns.com.
END
Antwort auf Beitrag Nr.: 60.097.080 von Twohybrid am 14.03.19 10:04:04News, die keine News sind...
Sowas verstehe ich nicht, dass so etwas Nichtssagendes ohne Not veröffentlicht wird. Gerade wenn sie ja sowieso in nächster Zeit (innerhalb der nächsten zwei Wochen) eine "echte" News wegen dem Incanthera-Deal herausgeben müssen...
Sowas verstehe ich nicht, dass so etwas Nichtssagendes ohne Not veröffentlicht wird. Gerade wenn sie ja sowieso in nächster Zeit (innerhalb der nächsten zwei Wochen) eine "echte" News wegen dem Incanthera-Deal herausgeben müssen...
jo, sehe ich genauso - sieht eher nach einer Position der Schwäche aus ... und was ist bei Lupuzor mit Partner gemeint? Vor Weihnachten hat Tim doch ein Interview gegeben und ausgesagt voll finanziert bis Abschluss Managed Access Programm ...
Warum etwas herausposaunen ohne Inhalt, ohne wirkliche news?
Warum etwas herausposaunen ohne Inhalt, ohne wirkliche news?
Im LSE-Forum ist die Lesart der RNS ja durchaus eine positive, nach dem Motto "Wenn schlechte News anstehen würden, warum sollte man kurz vorher nochmal Erwartungen wecken, indem man alle ausstehenden Sachen auflistet?"
Klingt plausibel, andererseits sehe ich auch keinen Grund alle ausstehenden Punkte noch einmal aufzulisten, wenn positive News anstehen würden?
Klingt plausibel, andererseits sehe ich auch keinen Grund alle ausstehenden Punkte noch einmal aufzulisten, wenn positive News anstehen würden?
Antwort auf Beitrag Nr.: 60.100.290 von Twohybrid am 14.03.19 15:05:59Vielleicht kommt alles anders als man denkt man kann es nicht sagen. Wenn man wirklich was erreicht hat man einen Blockbuster wenn es natürlich nix wird hat man einen haufen Müll.
Man kann doch jetzt ganz ruhig abwarten bis Q2 2019 ca. Okt.2019 .
Ich warte Gedult muss man haben. Es ist doch jetzt so gut wie alles einpreist keiner mehr wirklich da und dann kommt der große durchbruch ?
Man kann doch jetzt ganz ruhig abwarten bis Q2 2019 ca. Okt.2019 .
Ich warte Gedult muss man haben. Es ist doch jetzt so gut wie alles einpreist keiner mehr wirklich da und dann kommt der große durchbruch ?
Antwort auf Beitrag Nr.: 60.127.386 von dig101 am 18.03.19 10:04:47ich bin noch da 

 und ja , ich kaufe auch noch zu
und ja , ich kaufe auch noch zu 
Bin Überzeugt, dass Immuph immer noch auf dem Zettel großer Investoren und Pharmaherstellern steht. Das was hier entwickelt wurde die letzten Jahre, wird nicht einfach so im Nirvana verschwinden.
Also , bleiben wir locker.....


 und ja , ich kaufe auch noch zu
und ja , ich kaufe auch noch zu 
Bin Überzeugt, dass Immuph immer noch auf dem Zettel großer Investoren und Pharmaherstellern steht. Das was hier entwickelt wurde die letzten Jahre, wird nicht einfach so im Nirvana verschwinden.
Also , bleiben wir locker.....
Antwort auf Beitrag Nr.: 60.127.710 von swoasik am 18.03.19 10:46:35Warten wir jetzt einfach auf Q 2 ab und die 500 Patienten laufen weiter nebenbei.
Es sieht so aus als wenn alles in die richtige Richtung läuft .
An der Börse wird die Zukunft gehandelt und 6 Mon. wo davon 2 Mon Ferien sind ist nicht viel.
Es sieht so aus als wenn alles in die richtige Richtung läuft .
An der Börse wird die Zukunft gehandelt und 6 Mon. wo davon 2 Mon Ferien sind ist nicht viel.
Antwort auf Beitrag Nr.: 60.127.710 von swoasik am 18.03.19 10:46:35Falls sich doch ein großer Partner finden sollte wo würde dann der Kurs stehen ?
So was dauert seine Zeit und alle beobachten die Ergebnisse die Zugang haben oder fragen nach den Daten.
So was dauert seine Zeit und alle beobachten die Ergebnisse die Zugang haben oder fragen nach den Daten.
Investieren in Immupharma als Neuling würde ich nicht mehr - da ist ja nix ... Meine Gedanken zu Immupharma könnt ihr auf ariva nachlesen. Da bin ich Alleinunterhalter. Mein (persönlich!!!) größter Wunsch wäre hier 1,40 GBP (letzte KE) ...
Tim Mc C. glaube ich garnix mehr und alleine können sie nichts schaffen. Sind denn die Berater (Gesellschaft) noch aktiv und verpflichtet, die man vor Lupuzor beauftragt hatte? Es gab ja keine news, dass das Engagement beendet wurde.
Ich hoffe nur, dass ein Pharmariese Interesse zeigt für die P 140 ... aber die kaufen auch nicht jeden Schrott, d. h. ein Unternehmen mit nicht überzeugenden Daten. Das riskiert kein verantwortlicher Angestellter. Und wenn es damals auch viele Interessenten gegeben hat, die ein Stillscheigeabkommen unterzeichnet haben, so heißt es nicht, dass auch einer kaufen wird. Man will halt up to date sein mit den Infos zu Lupuzor. Leider waren die Daten grau, es gab keine news mehr zu einer Subruppe (das wäre eine Rettung gewesen) usw.
Vielleicht zieht ja NASH, was man auslizensieren will ...
Tim Mc C. glaube ich garnix mehr und alleine können sie nichts schaffen. Sind denn die Berater (Gesellschaft) noch aktiv und verpflichtet, die man vor Lupuzor beauftragt hatte? Es gab ja keine news, dass das Engagement beendet wurde.
Ich hoffe nur, dass ein Pharmariese Interesse zeigt für die P 140 ... aber die kaufen auch nicht jeden Schrott, d. h. ein Unternehmen mit nicht überzeugenden Daten. Das riskiert kein verantwortlicher Angestellter. Und wenn es damals auch viele Interessenten gegeben hat, die ein Stillscheigeabkommen unterzeichnet haben, so heißt es nicht, dass auch einer kaufen wird. Man will halt up to date sein mit den Infos zu Lupuzor. Leider waren die Daten grau, es gab keine news mehr zu einer Subruppe (das wäre eine Rettung gewesen) usw.
Vielleicht zieht ja NASH, was man auslizensieren will ...
Antwort auf Beitrag Nr.: 60.129.129 von ViVega am 18.03.19 13:17:15Die grossen können wahscheinlich täglich auf die akt. Daten zugreifen .
Der Boden ist soweit ausgebildet die Frage ist was passiert jetzt . Der Kurs sollte langsam zeigen wo es hingeht oder eben ein großer schnappt sich das ding vorher .
Die Frage ist nur wann geschieht das oder eben überhaupt.
Der Boden ist soweit ausgebildet die Frage ist was passiert jetzt . Der Kurs sollte langsam zeigen wo es hingeht oder eben ein großer schnappt sich das ding vorher .
Die Frage ist nur wann geschieht das oder eben überhaupt.
ganz persönlich denke ich, dass hier kein großer investieren wird, bevor man nicht weiß ob die neue studie gewirkt hat oder nicht...
habe auch nur noch ein paar peanuts hier investiert...
habe auch nur noch ein paar peanuts hier investiert...
Antwort auf Beitrag Nr.: 60.129.414 von walle1fc am 18.03.19 13:44:25Wenn man das nur wüsste . Man muss hier einfach abwarten und schauen . Es kann gut gehen oder eben nicht. 50 50
Antwort auf Beitrag Nr.: 60.129.414 von walle1fc am 18.03.19 13:44:25Wenn man jetzt zugreift wird es auf jedenfall sehr günstig ob es natürlich klappt steht zur Zulassung steht auf einem anderen Blatt . Aber falls die Daten extrem pos. sind wird es sehr viel teurer.
Die Frage ist was macht man
?
Die Frage ist was macht man
?
Antwort auf Beitrag Nr.: 60.129.975 von dig101 am 18.03.19 14:38:38Ich habe meine Posi aufgestockt weil ich finde, dass das ein Zock wert ist😉
Antwort auf Beitrag Nr.: 60.130.236 von BTRRR am 18.03.19 15:01:38Das Mang. steht dahinter ich dahinter . Ich denke man sieht hier noch chancen.
Wenn es keine Möglichkeit gäbe hätte man das Ding eingestampft und dann wäre die Story erledigt .
Es ist auf jedenfall sehr ruhig hier .
Wenn es keine Möglichkeit gäbe hätte man das Ding eingestampft und dann wäre die Story erledigt .
Es ist auf jedenfall sehr ruhig hier .
Antwort auf Beitrag Nr.: 60.130.236 von BTRRR am 18.03.19 15:01:38Hier wird es auf jedenfall einen Endzockt geben warum sollte man das alles tun ?
Die Frage ist nur wann startet er und was kommt
Die Frage ist nur wann startet er und was kommt
Im Moment laufen die Aktivitäten des Unternehmens hinsichtlich Lupuzor ja noch im vollem Gange weiter, was ja eigentlich klar sein müsste, denn letztendlich hat Lupuzor ja nicht unwirksam, es gab nur genauso viele positive Placebo Probanden, wie mit Lupuzor. Mann könnte also fast sagen, alles noch offen hier. Das hier nichts ist, wie oben einer geschrieben hat, sehe ich nicht so. Im Prinzip könnte man sagen wir, sind im Moment genauso weit wie vor der letzten Studie.
Bin auf jeden Fall auf die nächsten Ergebnisse gespannt und positioniert.
Bin auf jeden Fall auf die nächsten Ergebnisse gespannt und positioniert.
Antwort auf Beitrag Nr.: 60.131.844 von Richie-Rich am 18.03.19 17:51:57Ich Vermute die 68 Leute Studie wird gemacht um die 50 Leute zu ersetzen die abgesprungen sind und jetzt ergänzt werden.
Wenn das so wäre könnte es sehr schnell sehr hoch gehen Okt. 2019 ist nicht mehr weit und das letzt mal stand man bei 2€ .
https://www.immupharma.co.uk/folio/lupuzor/
Was ist wenn die Studie nur wegen den 50 Leuten gescheitert ist ?
Wenn das so wäre könnte es sehr schnell sehr hoch gehen Okt. 2019 ist nicht mehr weit und das letzt mal stand man bei 2€ .
https://www.immupharma.co.uk/folio/lupuzor/
Was ist wenn die Studie nur wegen den 50 Leuten gescheitert ist ?
Antwort auf Beitrag Nr.: 60.136.059 von dig101 am 19.03.19 08:00:54Wie gesagt, gescheitert ist die Studie nicht, es war nur halt ein 50:50 Ergebnis. Wer weiß, vielleicht hat der Blödheini von Praktikant auch versehentlich das richtige Mittel gegeben, anstatt das Placebo. (Scherz)
Abwarten, man wird sehen.
Abwarten, man wird sehen.
Antwort auf Beitrag Nr.: 60.136.347 von Richie-Rich am 19.03.19 08:31:10Ich vermute mal das uns hier bald ein Anstieg bevor steht wenn sich wirklich heraus stellt das das Mittel wirkt .
Es bleibt auf jedenfall sehr spannend und ein Anstieg wir noch vor Juni Juli kommen dann ferien und dann haben wir auch schon Okt.
Es bleibt auf jedenfall sehr spannend und ein Anstieg wir noch vor Juni Juli kommen dann ferien und dann haben wir auch schon Okt.
Antwort auf Beitrag Nr.: 60.136.347 von Richie-Rich am 19.03.19 08:31:10Der chart sieht doch super aus . In sechs Mon kommt das Ergebnis der 68 Leute wenn das überzeugt kann man es mit der Zulassung versuchen ob es klapp ist ja dann erst mal egal aber man wird es versuchen.
"Zusammen bleiben wir mittelfristig auf die vollständige behördliche Zulassung von Lupuzor fokussiert, von der wir überzeugt sind, dass sie das Potenzial hat, ein richtungsweisendes Medikament für Lupus-Patienten zu sein."
https://www.proactiveinvestors.co.uk/companies/news/210762/i…
Also ist doch der Weg vorgegeben und mit dem Mana. Pro. kann man dann auch die FDA überzeugen wenn es natürlich pos. läuft.
"Zusammen bleiben wir mittelfristig auf die vollständige behördliche Zulassung von Lupuzor fokussiert, von der wir überzeugt sind, dass sie das Potenzial hat, ein richtungsweisendes Medikament für Lupus-Patienten zu sein."
https://www.proactiveinvestors.co.uk/companies/news/210762/i…
Also ist doch der Weg vorgegeben und mit dem Mana. Pro. kann man dann auch die FDA überzeugen wenn es natürlich pos. läuft.
Ich hab 50K, von mir aus kanns ordentlich raufgehen. Und die Ergebnisse kommen im 2 Quartal. Und vorher noch ne news bis ende März wahrscheinlich.
Antwort auf Beitrag Nr.: 60.156.597 von Richie-Rich am 21.03.19 05:06:24So Langsam muss man ja auch wieder nach vorne schauen und es ist nicht mehr viel Zeit bis 10.2019.
Wenn die Zusatzstudie gut ist wird man erklären das man doch Erfolg hatte und den Antrag einreichen bei der FDA.
Hier ist doch jetzt die Ruhe vor dem Sturm . Also einfach abwarten
Wenn die Zusatzstudie gut ist wird man erklären das man doch Erfolg hatte und den Antrag einreichen bei der FDA.
Hier ist doch jetzt die Ruhe vor dem Sturm . Also einfach abwarten
Antwort auf Beitrag Nr.: 60.156.597 von Richie-Rich am 21.03.19 05:06:24Es hat sich doch nix geändert. Man will Lup. immer noch zur Zulassung bringen und die Zahlen der 68 Leuten kann dies ändern dazu laufen nebenbei noch die 500 und der Kurs steht so tief wie noch nie.
Antwort auf Beitrag Nr.: 60.159.297 von dig101 am 21.03.19 10:49:22Kein wunder warum das Man. so pos. ist die Chancen waren noch nie besser . Aber der Kurs hat es noch nicht gemerkt aber er wird es noch merken 

Antwort auf Beitrag Nr.: 57.604.194 von hamitc am 23.04.18 09:31:34Ich denke der Abbruch der 50 Leute hat das Ergebnis verwässert vielleicht waren es ja auch die die LUP. genommen haben und somit ausschlaggebend.
Es bleibt spannend
Die klinische Phase-III-Studie (letzte Testphase für einen Wirkstoffkandidaten vor seiner eventuellen Marktzulassung) wurde Ende Dezember 2015 mit einem Patienten in den USA begonnen und später auf Europa ausgeweitet. Insgesamt nahmen 202 Patienten teil, die in zwei Gruppen unterteilt waren: die erste Gruppe erhielt LupuzorTM und die zweite Gruppe ein Placebo. Alle Patienten nahmen zusätzlich weitere Medikamente ein wie Steroide, Malariamedikamente, Methotrexate usw. 153 Patienten waren bis zum Schluss der Studie dabei. Trotz der relativ geringen Anzahl an Testpersonen konnte die Wirksamkeit des Peptids nachgewiesen werden. In Verbindung mit Basismedikamenten erwies sich LupuzorTM bei 68,8% der Patienten als effizient, die mit diesem Wirkstoffkandidaten behandelt wurden. Aber auch die mit einem Placebo und den Basismedikamenten behandelten Patienten reagierten positiv (59,2%).
IMM.L (MKap $85 M) Multiple Blockbuster Kandidat kurz vor final P3 Daten (1Q 2018) | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/500-beitraege/12…
Es bleibt spannend

Die klinische Phase-III-Studie (letzte Testphase für einen Wirkstoffkandidaten vor seiner eventuellen Marktzulassung) wurde Ende Dezember 2015 mit einem Patienten in den USA begonnen und später auf Europa ausgeweitet. Insgesamt nahmen 202 Patienten teil, die in zwei Gruppen unterteilt waren: die erste Gruppe erhielt LupuzorTM und die zweite Gruppe ein Placebo. Alle Patienten nahmen zusätzlich weitere Medikamente ein wie Steroide, Malariamedikamente, Methotrexate usw. 153 Patienten waren bis zum Schluss der Studie dabei. Trotz der relativ geringen Anzahl an Testpersonen konnte die Wirksamkeit des Peptids nachgewiesen werden. In Verbindung mit Basismedikamenten erwies sich LupuzorTM bei 68,8% der Patienten als effizient, die mit diesem Wirkstoffkandidaten behandelt wurden. Aber auch die mit einem Placebo und den Basismedikamenten behandelten Patienten reagierten positiv (59,2%).
IMM.L (MKap $85 M) Multiple Blockbuster Kandidat kurz vor final P3 Daten (1Q 2018) | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/500-beitraege/12…
Man dig101, die open label Studie (65?) wird n i e m a l s zu einer Zulassung führen. Das sagt Tim auch in seinem letzten Interview auf proactive im Dezember 2018 ausdrücklich und explizit. Mit den 500 zuätzlichen versucht man dann in einem weiteren Schritt auf Nebenwegen zu einer Zulassung zu kommen, wobei sich mir nicht unbedingt erschließt wie. Es wurde immer wieder die Sicherheit von Lupuzor betont. Warum wohl? Nur so gibt es überhaupt eine zusätzliche offene Studie ohne Plazebo. Und Tim glaube ich sowieso nix mehr. Mal sehen, ob der incanthera Deal zumindest klappt bis Ende März.
Meine Hoffnung besteht darin, dass ein Pharmawert (vielleicht aus Frankreich) den Wert und das Potential von P140 erkennt mit Patenten und bereits geleisteter Vorarbeit und den Laden übernimmt im ganzen. Nucant ist da eh Nebensache. Und schau dir mal an, was biohero vor langer Zeit hier irgendwann gepostet hat - die restlichen Produkte aus der Pipeline sind ... (da fehlt mir der Wortlaut und ich will nicht zurückblättern).
Und damit wir uns hier nicht vertun, ich bin investiert, ähnlich wie Richie-Rich ...
War die Placebo-Gruppe so irreführend oder war Lupuzor so schlecht/gut wie Placebo? Lupus ist halt eine Kranheit mit Schwankungen und deshalb so schwer zu einem befriedigenden Ergebnis zu führen. Warum hat denn die angekündigte Auswertung insbesondere in Bezug auf die Subgruppe zu keinem Ergebnis geführt? Warum hat keiner der Pharmaunternehmen, die eine Verschwiegenheitserklärung unterzeichnet hat, zugeschlagen? Arbeitet diese Beratergesellschaft noch für Immupharma, welche speziell angeheuert wurde für einen Deal?
Ich würde mir auch wünschen, dass hier etwas positives kommt, insbesondere für die an einer Autoimmunerkrankung leidenden!
Das soll es erst einmal sein von meiner Seite aus ...
Meine Hoffnung besteht darin, dass ein Pharmawert (vielleicht aus Frankreich) den Wert und das Potential von P140 erkennt mit Patenten und bereits geleisteter Vorarbeit und den Laden übernimmt im ganzen. Nucant ist da eh Nebensache. Und schau dir mal an, was biohero vor langer Zeit hier irgendwann gepostet hat - die restlichen Produkte aus der Pipeline sind ... (da fehlt mir der Wortlaut und ich will nicht zurückblättern).
Und damit wir uns hier nicht vertun, ich bin investiert, ähnlich wie Richie-Rich ...
War die Placebo-Gruppe so irreführend oder war Lupuzor so schlecht/gut wie Placebo? Lupus ist halt eine Kranheit mit Schwankungen und deshalb so schwer zu einem befriedigenden Ergebnis zu führen. Warum hat denn die angekündigte Auswertung insbesondere in Bezug auf die Subgruppe zu keinem Ergebnis geführt? Warum hat keiner der Pharmaunternehmen, die eine Verschwiegenheitserklärung unterzeichnet hat, zugeschlagen? Arbeitet diese Beratergesellschaft noch für Immupharma, welche speziell angeheuert wurde für einen Deal?
Ich würde mir auch wünschen, dass hier etwas positives kommt, insbesondere für die an einer Autoimmunerkrankung leidenden!
Das soll es erst einmal sein von meiner Seite aus ...
Antwort auf Beitrag Nr.: 60.170.268 von ViVega am 22.03.19 11:36:28Biogen braucht doch was neues 
Von Ende März erwarte ich nicht viel ja es kommt vielleicht was . Wichtiger wäre es das man LUP zum erfolg bringt wie auch immer.
Warten wir es einfach Q2 2019 wird es vielleicht zeigen und die 500 Studie läuft auch .

Von Ende März erwarte ich nicht viel ja es kommt vielleicht was . Wichtiger wäre es das man LUP zum erfolg bringt wie auch immer.
Warten wir es einfach Q2 2019 wird es vielleicht zeigen und die 500 Studie läuft auch .
Antwort auf Beitrag Nr.: 60.170.268 von ViVega am 22.03.19 11:36:28Es wird einen weg geben Lup zuzulassen sonst würde man es nicht andauern sagen . Eben aber nur wenn die Ergebnisse stimmen.
Man hat nie gesagt welche 50 Leute es aus welche Gruppe waren ich vermute eben die LUP Gruppe und somit eine Verzerrung des Ergebnisses .
Man hat nie gesagt welche 50 Leute es aus welche Gruppe waren ich vermute eben die LUP Gruppe und somit eine Verzerrung des Ergebnisses .
Es sieht so aus als wenn wir noch bis 10.2019 warten müssen. Oder es Kommt eben ein großer und kauft das ding weg.
https://www.proactiveinvestors.co.uk/companies/news/217602/i…
https://www.proactiveinvestors.co.uk/companies/news/217602/i…
Scheint dem Kurs leider nicht zu jucken...knapp vor’m All-Zeit-Tief 😌
Bei Stuttgart derzeit minus 30, ach du Kacke
Antwort auf Beitrag Nr.: 60.355.372 von liquidx am 15.04.19 09:19:19Wurde kein Stück zu dem Kurs gehandelt, war nur der Taxe und dem hohen Spread geschuldet.
Also ganz bleiben...
bleiben...
Also ganz
 bleiben...
bleiben...
Glück gehabt
oh weh, bei dem Kurs wird mir ganz schlecht... noch ne Etage tiefer hätte bei dem Niveau nicht sein müssen
24 MAY 2019
ImmuPharma PLC
("ImmuPharma" or the "Company")
FINAL RESULTS ANNOUNCEMENT
for the twelve months ended 31 December 2018
ImmuPharma PLC (LSE:IMM), ("ImmuPharma" or the "Company"), the specialist drug discovery and development company, is pleased to announce its final results for the twelve months ended 31 December 2018 (the "Period").
Key Highlights (including post Period review)
•Stable financial performance over the Period
o Cash balance of £4.9 million (31 December 2017: £2.7 million)
o Loss for the period of £7.2 million (31 December 2017: £6.2 million)
o Research and development expenses of £4.7 million (31 December 2017: £5.1 million)
o Basic and diluted loss per share of 5.19p (31 December 2017: 4.75p)
o A successful, £10 million (gross) fundraising completed in January 2018
o Acquired a 15% stake in Incanthera Limited for £2 million
LupuzorTM
•Top line results of the Company's pivotal Phase III trial of LupuzorTM were announced on 17 April 2018- key highlights include:
•Lupuzor™ demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients. However, due to the high response rate in the placebo group, this superior response did not allow statistical significance to be reached (p = 0.2631) and the trial's primary end point was not met
•Across the whole study population, in those patients who had anti-dsDNA autoantibodies, LupuzorTM demonstrated a superior response rate over placebo (61.5% vs 47.3%, p = 0.0967). Although these results were not statistically significant, further data analysis demonstrated that in the Europe cohort (130 patients) LupuzorTM plus standard of care showed statistically significant reductions in disease activity compared to placebo plus standard of care in 79 patients who were anti-dsDNA autoantibody positive (71.1% vs 48.8%, p = 0.0218)
•The study confirmed the outstanding safety profile of LupuzorTM, with no serious adverse events reported
•Follow-on 'extension' open label study
o A total of 62 eligible patients from the original Phase III trial recruited
o The study is anticipated to report results in Q2 2019
•Discussions continue with potential corporate partners as well as consulting with regulatory advisors on potential pathways to market. Whilst these activities continue, the commencement of the Managed Access Program for Lupuzor™ is postponed, until further clarification on these activities gained
•As announced on 7 May 2019, a renewed focus on developing the P140 platform within different auto-immune indications outside of lupus - following encouraging pre-clinical data
Other program developments
•Within our two further platforms, Elro Pharma (Nucant) and Ureka Sarl (Peptide), ImmuPharma is exploring options to license, divest or 'spin-off' the technologies of both of these subsidiaries to unlock future potential and enhance value to shareholders - as announced on 7 May 2019
•All negotiations with Incanthera Limited on the Nucant cancer programme and broader collaboration discussions have now terminated - as announced on 7 May 2019
•Advisors appointments
o Spark Advisory Partners Limited appointed as Nominated Advisor in December 2018
o Stanford Capital Partners and SI Capital appointed as Join Brokers in September 2018
Commenting on the statement and outlook Tim McCarthy, Chairman, said: 'We are pleased to report our results for 2018 as well as the key highlights for our programs. Following on from the Phase III results, we are focused on progressing LupuzorTM and the P140 autoimmune platform. Our plans to combine and either divest, spin off or license Elro Pharma (Nucant) and Ureka (Peptide Platform) are planned to unlock value for shareholders. We look forward to reporting on these developments in the coming months. We would also like to take this opportunity to thank our shareholders, scientific advisors, corporate collaborators and the CNRS.'
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
For further information please contact:
ImmuPharma PLC (https://clicktime.symantec.com/3WTo1y9YBMrzgm37igYL34w6H2?u=…
+ 44 (0) 207 152 4080
Tim McCarthy
Dimitri Dimitriou, Chief Executive Officer
Lisa Baderoon, Head of Investor Relations + 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (Joint Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
ImmuPharma plc
Chairman's Report
The first half of 2018 saw the completion and reporting of results of the Company's pivotal phase III clinical trial for LupuzorTM. Whilst it was disappointing not to have achieved overall statistical significance in the full set of patients, it was promising to see that LupuzorTM plus Standard of Care demonstrated a superior response rate over placebo plus Standard of Care and an even more superior response in patients with positive anti-dsDNA biomarkers which reached statistical significance in the Europe cohort. For the remainder of 2018, our focus for LupuzorTM was on the Open Label Extension study, the planning of a Managed Access Program as well as discussions with potential partners. Further, we were pleased with the successful completion of a £10 million (before expenses) fundraising in January 2018.
Lupuzor™
LupuzorTM, ImmuPharma's lead program for the treatment of lupus completed its Phase III clinical trial in January 2018 which involved patients in the US, Europe and Mauritius.
The Phase III trial was a double-blind, randomised, placebo-controlled trial. The study involved patients being dosed for one year, receiving 0.2mg once per month subcutaneously. 293 patients were screened illustrating the demand from physicians for a new, safe and effective treatment for lupus. Of these, the required 202 patients were successfully recruited and randomised (dosed). Patients participated in the trial in seven countries across 28 sites.
The clinical trial was undertaken primarily by Simbec-Orion, an international clinical research organisation, which specialises in rare and orphan conditions and has previous direct experience in lupus trials. This was a pivotal study designed to demonstrate the safety and efficacy of Lupuzor™ as part of the Special Protocol Assessment (SPA) from the US Food and Drug Administration (FDA).
Lupuzor™ Phase III Top Line Results
LupuzorTM demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients and an even more superior response in the 153 patients who completed the study (68.8% vs 59.2%). However, due to the high response rate in the placebo plus Standard of Care group, this superior response did not allow statistical significance to be reached, and the trial's primary end point was not met. Importantly, in patients who were anti-dsDNA autoantibody positive (a recognised biomarker for Systemic Lupus Erythematosus ('SLE'), LupuzorTM plus Standard of Care demonstrated a higher superior response rate over placebo plus Standard of Care (61.5% vs 47.3%). In the European cohort (Europe and Mauritius), the difference was higher (71.1% vs 48.8%) and reached statistical significance (p=0.218). In addition, 7.5% of the patients in the LupuzorTM plus Standard of Care group went into full remission versus none in the placebo plus Standard of Care group. The study confirmed the outstanding safety profile of LupuzorTM, with zero drug-related serious adverse events reported in the LupuzorTM plus Standard of Care group.
It is important to note that when reference is made to placebo, there are no patients who were treated just with placebo, but all were receiving other drug treatments. Based on the protocol and the commonly accepted study design, there were two groups of patients: (1) patients receiving LupuzorTM plus 'Standard of Care' and (2) patients receiving placebo plus 'Standard of Care'. 'Standard of Care' includes treatment with other drugs such as steroids, anti-malarials, methotrexate, etc. The definition of a 'responder' is based on the SLE Responder Index (SRI-4) score, which requires a reduction of at least four points in this score. Therefore, patients who improve by less than four points are counted as non-responders, but also no distinction is made between patients who improve by more than four points, all being equal 'responders'.
Extension Open Label Study
Following requests from both investigators and patients involved in the Phase III trial, ImmuPharma initiated an additional clinical trial permitting patients who participated in the Phase III study, to receive Lupuzor™ plus Standard of Care for six months in an open label study. The results will be gathered as an "extension" open label study, independent of the pivotal Phase III trial and will provide additional data on the safety and efficacy of LupuzorTM. The study has now been completed with results anticipated in Q2 2019.
ImmuPharma plc
Chairman's Report (continued)
LupuzorTM - Opportunity and Next Steps
There are an estimated five million people globally suffering from lupus, with approximately 1.5 million patients in the US, Europe and Japan (Source: Lupus Foundation of America). Current 'standard of care' treatments, including steroids and immunosuppressants, can potentially have either serious side effects for patients or limited effectiveness, with over 60 per cent of patients not adequately treated.
The Company believes Lupuzor™ has the potential to be a novel specific drug therapy for the treatment of Lupus by specifically modulating the immune system and halting disease progression in a substantial proportion of patients. Lupuzor™ has a unique mechanism of action that modulates the activity of CD4 T-cells which are involved in the cell-mediated immune response which leads to the lupus disease. Lupuzor™, taken over the long term, as indicated in earlier stage clinical trials, has the potential to prevent the progression of lupus rather than just treating its symptoms, with the rest of the immune system retaining the ability to work normally.
The Board believes there are still a number of routes to market for Lupuzor™, including potential corporate collaborations. The Company also continues to consult with regulatory advisors on potential pathways to market. The prime objective of any strategy would be to maximise shareholder return.
LupuzorTM is also being prepared for entry into a Managed Access Programme ('MAP') which would also allow lupus patients early access to LupzuorTM. The commencement of the MAP is dependent on the outcome of ongoing activities surrounding discussions with potential partners and regulatory advisors.
Centre National de la Recherché Scientifique (CNRS)
ImmuPharma continues to have important collaboration arrangements with the Centre National de la Recherché Scientifique (CNRS), the French National Council for Scientific Research and the largest basic research organisation in Europe. This is where Lupuzor™ was invented by Prof. Sylviane Muller, Research Director at the CNRS. This successful and longstanding relationship plays an important role in the progress of ImmuPharma's development pipeline.
Pipeline Overview
LupuzorTM / Forigerimod / P140 in autoimmune indications
Lupuzor™, is also known by its chemical name 'Forigerimod' or P140. ImmuPharma in conjunction with the CNRS are exploring opportunities on expanding into other autoimmune indications, as demonstrated by Lupuzor™'s strong efficacy and safety profile and by its mechanism of action.
Certain autoimmune indications, outside of lupus, have the potential for Orphan Drug designation. Further assessment continues with the objective of further indications moving into the clinic in due course.
Nucant Program
ImmuPharma's subsidiary Elro SARL ('Elro') holds our cancer Nucant program, IPP-204106, which is focused on combination therapy approaches. ImmuPharma has reviewed different options for progressing this program and is now pursuing a divestment strategy in combination with the Group's Ureka subsidiary. A grant was awarded by the EU to different EU partners (€7 million total with €430k awarded to ImmuPharma) to develop the Nucants in combination with cytotoxic drugs linked to a solid support. The molecule has also shown promising results in ophthalmology (age-related macular degeneration) models.
Peptide Platform
ImmuPharma's subsidiary Ureka SARL ('Ureka') has been developing lead compounds from its novel and patented peptide technology platform UrelixTM. Ureka is based at the Institut Europeen de Chimie et Biologie (IECB) in Bordeaux, France which is under the joint authority of the CNRS, Inserm and the University of Bordeaux.
ImmuPharma plc
Chairman's Report (continued)
Pipeline Overview (continued)
UrelixTM is focusing on oligourea foldamers as a tool to improve the pharmaceutical properties of peptides. One of the first focus areas of Ureka has been GLP-1 analogues for the treatment of Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis) as proof of concept for its technology. In February 2019, the peer reviewed scientific research journal 'Nature Communications' published a paper on Ureka's technology.
Further applications of the UrelixTM technology include protein/protein interactions, notably in cancer, and improvement of marketed efficacious peptides allowing additional long lasting patent protection paving the way for a life cycle management franchise. Novel patented technologies are also currently implemented to cover other aspects of the improvement of peptides including potential oral delivery. Peptides have gained so much attention in the last decade that they are now part of the main strategies, along with small molecules and biologics, for developing new medicines.
£10 million Fund Raising
In January 2018, the Company announced the completion of a placing of 6,944,445 new ordinary shares of 10p each at a placing price of 144p raising a total of £10 million before expenses. The Company raised the funds in order to further strengthen the Company's financial position as negotiations continue with potential partners for Lupuzor™ and to support further investment in ImmuPharma's earlier stage portfolio.
Incanthera Limited
In September 2018, the Company signed a Heads of Terms agreement with Incanthera Limited regarding a potential collaboration on the Nucant program. At the same time, ImmuPharma invested £2 million to purchase 363,637 shares at £5.50 per share in Incanthera Limited and received warrants for a further 363,637 shares at £5.50. This investment represents a holding of approximately 15% in Incanthera Limited. In May 2019, the Company announced that discussions with Incanthera Limited regarding a potential collaboration had terminated. ImmuPharma remain supportive of Incanthera Limited and its programs and abilities.
Current Activities and Outlook
As a Board, we continue to be excited by ImmuPharma's future potential. Looking at the Lupuzor™ top line data announced in April 2018, the drug demonstrated a superior response rate over placebo with an exceptional safety profile, giving it, we believe, a compelling product profile. We believe Lupuzor™ has the potential to bring a much needed safe treatment to the millions of lupus sufferers around the world. We continue to engage with potential partners and, although no guarantees of a successful outcome can be given at present, we are focused on moving forward with the development and commercialisation of Lupuzor™.
The Company has been exploring its options to license, divest or 'spin-off' the technologies of both Elro and Ureka to unlock their future potential and enhance value to shareholders. The Company's intention is to merge these two subsidiaries, in order to create a stronger combined company with a platform technology together with a drug candidate in clinical development, with a view to securing external investment either from private equity or through a public listing on a European stock exchange or licensing. This, in turn, would allow ImmuPharma to focus on LupuzorTM and the overall P140 platform for different autoimmune indications. We look forward to providing our shareholders with further updates in due course.
The Board would like to thank its shareholders, both long standing and new for their support as well as its staff, scientific and corporate collaborators including the CNRS, Simbec-Orion and CAP Research.
Tim McCarthy
Non-Executive Chairman
ImmuPharma plc
Financial Review
2018 started with a successful share placing which raised £10 million before expenses. LupuzorTM, ImmuPharma's lead drug candidate for the treatment of lupus completed its pivotal Phase III clinical trial and began an Open Label Extension Study.
Income Statement
The operating loss for the year ended 31 December 2018 was £8.1 million, up from £7.2 million for the year ended 31 December 2017. The increase in overall loss was mainly attributable to share-based expense of £1.8 million (2017: £743k) which was attributable to the number of share options granted in 2017. Research and development expenditure was £4.7 million down slightly from £5.1 million in 2017. This reflects the front-loading of a portion of the Lupuzor clinical trial expenses. Administrative expenses were £1.7 million, up from £1.5 million in the year ended 31 December 2017. Finance income was £130k for 2018 which was down from £240k for 2017. For 2017, finance income is mainly attributable to a gain in fair value on the derivative financial asset. Total comprehensive loss for the year was £7.2 million, an increase from £6.2 million in 2017.
Statement of Financial Position
Cash and cash equivalents at 31 December 2018 amounted to £4.9 million (2017: £2.7 million). Financial borrowings were £121k (2017: £260k). This balance is primarily the conditional advance from the French Government for use in the development of our cancer program. No interest is payable. In January 2018, ImmuPharma successfully completed a share placing raising £10 million before expenses.
In September 2018, the Company invested £2.0 million (2017: £nil) in Incanthera Limited (Incanthera) with whom it also entered discussions on a potential collaboration on the Nucant program. The Company purchased 363,637 shares in Incanthera at a price of £5.50 per share. This represents a holding of approximately 15% in Incanthera. The Company was also granted warrants for a further 363,637 shares at £5.50 per share.
As described and emphasised in the auditor's report the carrying value of the Company's interest in its subsidiaries and the group's interest in Incanthera are subject to uncertainty relating to the future development of their underlying assets.
Results
The Group recorded a loss for the year of £7.2 million (2017: £6.2 million). Basic and diluted loss per share was 5.19p (2017: 4.75p). In accordance with the Group's loss making position no dividend is proposed.
January 2018 Placing - £10 million before expenses raised
ImmuPharma strengthened its financial position through a fundraising in January 2018. The Company announced the completion of a placing of 6,944,445 new ordinary shares of 10p each at a placing price of 144p raising a total of £10 million before expenses. The Company raised the funds in order to further strengthen the Company's Statement of Financial Position as negotiations continue with potential partners for Lupuzor™ and to support further investment in ImmuPharma's earlier stage portfolio.
Total Voting Rights
Following the admission of the shares placed in January 2018 to trading on AIM, the Company has a total of 139,467,430 ordinary shares in issue at 31 December 2018 with each share carrying the right of one vote.
ImmuPharma plc
Financial Review (continued)
Treasury Policy
The policy continues to be that surplus funds of the Group are held in interest-bearing bank accounts on short or medium maturities, until commitments to future expenditure are made, when adequate funds are released to enable future expenditure to be incurred. The Group's Treasury Policy and controls are straightforward and approved by the Board.
Financial Strategy
The overall strategy is to maintain a tight control over cash resources whilst enabling continued progress of the Company's development assets.
Tracy Weimar
Vice President, Operations and Finance
ImmuPharma plc
CONSOLIDATED INCOME STATEMENT
FOR THE YEAR ENDED 31 DECEMBER 2018
Notes Year ended
31 December 2018 Year ended
31 December 2017
£ £
Continuing operations
Revenue 81,281 150,462
Research and development expenses (4,697,284) (5,121,388)
Administrative expenses (1,660,408) (1,520,356)
Share based expense (1,803,769) (742,752)
Operating loss (8,080,180) (7,234,034)
Finance costs (4,783) (3,858)
Finance income 129,808 240,447
Loss before taxation (7,955,155) (6,997,445)
Tax 748,606 774,244
Loss for the year (7,206,549) (6,223,201)
Attributable to:
Equity holders of the parent company (7,206,549) (6,223,201)
Loss per ordinary share
Basic and diluted 2 (5.19p) (4.75p)
ImmuPharma plc
CONSOLIDATED STATEMENT OF COMPREHENSIVE INCOME
FOR THE YEAR ENDED 31 DECEMBER 2018
Year ended
31 December 2018 Year ended
31 December 2017
£ £
Loss for the financial year (7,206,549) (6,223,201)
Other comprehensive income
Items that may be reclassified subsequently to profit or loss:
Exchange differences on translation of foreign operations (88,256) (91,568)
Other comprehensive loss for the year, net of tax (88,256) (91,568)
Total comprehensive loss for the year (7,294,805) (6,314,769)
ImmuPharma plc
CONSOLIDATED STATEMENT OF FINANCIAL POSITION
AS AT 31 DECEMBER 2018
31 December 2018 31 December 2017
Notes £ £
Non-current assets
Intangible assets 483,039 482,268
Property, plant and equipment 164,661 161,399
Financial asset 2,000,000 -
Total non-current assets 2,647,700 643,667
Current assets
Trade and other receivables 331,487 736,212
Cash and cash equivalents 4,911,448 2,729,468
Current tax asset 767,121 907,916
Total current assets 6,010,056 4,373,596
Current liabilities
Financial liabilities - borrowings (98,340) (142,393)
Trade and other payables (913,907) (929,569)
Provisions - (57,517)
Total current liabilities (1,012,247) (1,129,479)
Net current assets 4,997,809 3,244,117
Non-current liabilities
Financial liabilities - borrowings (22,470) (117,297)
Provisions - (195,989)
Net assets 7,623,039 3,574,498
EQUITY
Ordinary shares 13,946,744 13,252,299
Share premium 27,320,145 18,728,519
Merger reserve 106,148 106,148
Other reserves (991,998) (2,961,017)
Retained earnings (32,758,000) (25,551,451)
Total equity 7,623,039 3,574,498
ImmuPharma plc
CONSOLIDATED STATEMENT OF CHANGES IN EQUITY
FOR THE YEAR ENDED 31 DECEMBER 2018
Share capital Share premium
Merger
reserve
Other reserves -
Acquisition
reserve
Other reserves -
Translation
reserve Other reserves-
Equity shares
to be issued
Retained
earnings Total
equity
£ £ £ £ £ £ £ £
At 1 January 2017 12,463,836 15,678,054 106,148 (3,541,203) (1,609,673) 1,777,131 (19,328,250) 5,546,043
Loss for the financial year - - - - - - (6,223,201) (6,223,201)
Exchange differences on translation
of foreign operation
-
-
-
-
(91,568)
-
-
(91,568)
Transactions with owners:
Share based payments
-
-
-
-
-
504,296
-
504,296
New issue of equity capital 788,463 3,311,542 - - - - - 4,100,005
Costs of new issue of equity capital - (261,077) - - - - - (261,077)
At 31 December 2017 13,252,299 18,728,519 106,148 (3,541,203) (1,701,241) 2,281,427 (25,551,451) 3,574,498
Loss for the financial year
- - - - - - (7,206,549) (7,206,549)
Exchange differences on translation
of foreign operations
-
-
-
-
(88,256)
-
-
(88,256)
Transactions with owners:
Share based payments
-
-
-
-
-
2,057,275
-
2,057,275
New issue of equity capital 694,445 9,305,555 - - - - - 10,000,000
Costs of new issue of equity capital - (713,929) - - - - - (713,929)
At 31 December 2018 13,946,744 27,320,145 106,148 (3,541,203) (1,789,497) 4,338,702 (32,758,000) 7,623,039
Attributable to:-
Equity holders of the parent company 13,946,744 27,320,145 106,148 (3,541,203) (1,789,497) 4,338,702 (32,758,000) 7,623,039
ImmuPharma plc
CONSOLIDATED STATEMENT OF CASH FLOWS
FOR THE YEAR ENDED 31 DECEMBER 2018
Notes Year ended
31 December 2018 Year ended
31 December 2017
£ £
Cash flows from operating activities
Cash used in operations 3 (5,606,138) (5,439,079)
Tax received 889,787 1,021,915
Interest paid (4,783) (3,858)
Net cash used in operating activities (4,721,134) (4,421,022)
Investing activities
Purchase of property, plant and equipment (102,880) (25,491)
Purchase of investments (2,000,000) -
Interest received 12,491 772
Net cash used in investing activities (2,090,389) (24,719)
Financing activities
(Decrease)/increase in bank overdraft (72) (290)
Loan repayments (138,809) (114,386)
Settlements from Sharing Agreement - 1,667,380
Gross proceeds from issue of new share capital 10,000,000 4,100,005
Share capital issue costs (713,929) (261,077)
Net cash generated from financing activities 9,147,190 5,391,632
Net increase in cash and cash equivalents 2,335,667 945,891
Cash and cash equivalents at beginning of year 2,729,468 1,876,718
Effects of exchange rates on cash and cash equivalents (153,687) (93,141)
Cash and cash equivalents at end of year 4,911,448 2,729,468
ImmuPharma plc
1 BASIS OF PREPARATION
The financial information set out in this announcement does not comprise the Group's statutory accounts as defined in section 434 of the Companies Act 2006 for the year ended 31 December 2018 or 31 December 2017.
The financial information has been extracted from the statutory accounts for the years ended 31 December 2018 and 31 December 2017. The auditors reported on those accounts; their reports were unqualified and did not contain a statement under either Section 498(2) or Section 498(3) of the Companies Act 2006 in respect of the years ended 31 December 2018 and 31 December 2017 but for the year ended 31 December 2018 did include an emphasis of matter paragraph relating to the uncertainty over the fair value of the investment in Incanthera Limited.
The Group's statutory accounts for the year ended 31 December 2017 have been delivered to the Registrar of Companies, whereas those for the year ended 31 December 2018 will be delivered to the Registrar of Companies following the Company's Annual General Meeting.
The accounting policies are consistent with those applied in the preparation of the interim results for the period ended 30 June 2018, which have been prepared in accordance with International Financial Reporting Standards ('IFRS'). The accounting policies are also consistent with the statutory accounts for the year ended 31 December 2017, with the exception of IFRS 9 "Financial Instruments" and IFRS 15 "Revenue from Contracts with Customers" which are new standards applicable and mandatory for the year ended 31 December 2018. The new standards did not have a material impact on the statutory accounts for the year ended 31 December 2018.
The financial information is for the year ended 31 December 2018 and the comparatives are for the year ended 31 December 2017.
The Group's statutory accounts incorporate the financial statements of ImmuPharma plc and other entities controlled by the company ("the subsidiaries"). Control is achieved where the company has the power to govern the financial and operating policies of an investee entity so as to obtain benefits from its activities.
ImmuPharma plc
2 LOSS PER SHARE
- Group Year ended 31 December 2018 Year ended 31 December 2017
£ £
Loss
Loss for the purposes of basic loss per share being net loss after tax attributable to equity shareholders
(7,206,549)
(6,223,201)
Number of shares
Weighted average number of ordinary shares for the purposes of basic earnings per share
138,839,576
130,902,857
Basic loss per share (5.19)p (4.75)p
Diluted loss per share (5.19)p (4.75)p
There is no difference between basic loss per share and diluted loss per share as the share options are anti-dilutive.
ImmuPharma plc
3 CASH USED IN OPERATIONS
Group
31 December 2018 Group
31 December 2017
£ £
Operating loss (8,080,180) (7,234,034)
Depreciation and amortisation 133,080 138,198
Share-based payments 2,057,275 504,296
(Increase)/decrease in trade and other receivables
404,725 643,466
Increase in trade and other payables
15,151 143,378
Increase/(decrease) in provisions (253,506) 238,456
Gain on foreign exchange 117,317 127,161
Cash used in operations
(5,606,138)
(5,439,079)
ImmuPharma plc
4 SUBSEQUENT EVENTS
There have been no subsequent events.
This information is provided by RNS, the news service of the London Stock Exchange. RNS is approved by the Financial Conduct Authority to act as a Primary Information Provider in the United Kingdom. Terms and conditions relating to the use and distribution of this information may apply. For further information, please contact rns@lseg.com or visit www.rns.com.
END
ImmuPharma PLC
("ImmuPharma" or the "Company")
FINAL RESULTS ANNOUNCEMENT
for the twelve months ended 31 December 2018
ImmuPharma PLC (LSE:IMM), ("ImmuPharma" or the "Company"), the specialist drug discovery and development company, is pleased to announce its final results for the twelve months ended 31 December 2018 (the "Period").
Key Highlights (including post Period review)
•Stable financial performance over the Period
o Cash balance of £4.9 million (31 December 2017: £2.7 million)
o Loss for the period of £7.2 million (31 December 2017: £6.2 million)
o Research and development expenses of £4.7 million (31 December 2017: £5.1 million)
o Basic and diluted loss per share of 5.19p (31 December 2017: 4.75p)
o A successful, £10 million (gross) fundraising completed in January 2018
o Acquired a 15% stake in Incanthera Limited for £2 million
LupuzorTM
•Top line results of the Company's pivotal Phase III trial of LupuzorTM were announced on 17 April 2018- key highlights include:
•Lupuzor™ demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients. However, due to the high response rate in the placebo group, this superior response did not allow statistical significance to be reached (p = 0.2631) and the trial's primary end point was not met
•Across the whole study population, in those patients who had anti-dsDNA autoantibodies, LupuzorTM demonstrated a superior response rate over placebo (61.5% vs 47.3%, p = 0.0967). Although these results were not statistically significant, further data analysis demonstrated that in the Europe cohort (130 patients) LupuzorTM plus standard of care showed statistically significant reductions in disease activity compared to placebo plus standard of care in 79 patients who were anti-dsDNA autoantibody positive (71.1% vs 48.8%, p = 0.0218)
•The study confirmed the outstanding safety profile of LupuzorTM, with no serious adverse events reported
•Follow-on 'extension' open label study
o A total of 62 eligible patients from the original Phase III trial recruited
o The study is anticipated to report results in Q2 2019
•Discussions continue with potential corporate partners as well as consulting with regulatory advisors on potential pathways to market. Whilst these activities continue, the commencement of the Managed Access Program for Lupuzor™ is postponed, until further clarification on these activities gained
•As announced on 7 May 2019, a renewed focus on developing the P140 platform within different auto-immune indications outside of lupus - following encouraging pre-clinical data
Other program developments
•Within our two further platforms, Elro Pharma (Nucant) and Ureka Sarl (Peptide), ImmuPharma is exploring options to license, divest or 'spin-off' the technologies of both of these subsidiaries to unlock future potential and enhance value to shareholders - as announced on 7 May 2019
•All negotiations with Incanthera Limited on the Nucant cancer programme and broader collaboration discussions have now terminated - as announced on 7 May 2019
•Advisors appointments
o Spark Advisory Partners Limited appointed as Nominated Advisor in December 2018
o Stanford Capital Partners and SI Capital appointed as Join Brokers in September 2018
Commenting on the statement and outlook Tim McCarthy, Chairman, said: 'We are pleased to report our results for 2018 as well as the key highlights for our programs. Following on from the Phase III results, we are focused on progressing LupuzorTM and the P140 autoimmune platform. Our plans to combine and either divest, spin off or license Elro Pharma (Nucant) and Ureka (Peptide Platform) are planned to unlock value for shareholders. We look forward to reporting on these developments in the coming months. We would also like to take this opportunity to thank our shareholders, scientific advisors, corporate collaborators and the CNRS.'
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
For further information please contact:
ImmuPharma PLC (https://clicktime.symantec.com/3WTo1y9YBMrzgm37igYL34w6H2?u=…
+ 44 (0) 207 152 4080
Tim McCarthy
Dimitri Dimitriou, Chief Executive Officer
Lisa Baderoon, Head of Investor Relations + 44 (0) 7721 413496
SPARK Advisory Partners Limited (NOMAD)
Neil Baldwin
Vassil Kirtchev
Stanford Capital Partners (Joint Broker)
Patrick Claridge, John Howes
SI Capital (Joint Broker)
Nick Emerson
+44 (0) 203 368 8974
+44 (0) 203 815 8880
+44 (0) 1483 413500
ImmuPharma plc
Chairman's Report
The first half of 2018 saw the completion and reporting of results of the Company's pivotal phase III clinical trial for LupuzorTM. Whilst it was disappointing not to have achieved overall statistical significance in the full set of patients, it was promising to see that LupuzorTM plus Standard of Care demonstrated a superior response rate over placebo plus Standard of Care and an even more superior response in patients with positive anti-dsDNA biomarkers which reached statistical significance in the Europe cohort. For the remainder of 2018, our focus for LupuzorTM was on the Open Label Extension study, the planning of a Managed Access Program as well as discussions with potential partners. Further, we were pleased with the successful completion of a £10 million (before expenses) fundraising in January 2018.
Lupuzor™
LupuzorTM, ImmuPharma's lead program for the treatment of lupus completed its Phase III clinical trial in January 2018 which involved patients in the US, Europe and Mauritius.
The Phase III trial was a double-blind, randomised, placebo-controlled trial. The study involved patients being dosed for one year, receiving 0.2mg once per month subcutaneously. 293 patients were screened illustrating the demand from physicians for a new, safe and effective treatment for lupus. Of these, the required 202 patients were successfully recruited and randomised (dosed). Patients participated in the trial in seven countries across 28 sites.
The clinical trial was undertaken primarily by Simbec-Orion, an international clinical research organisation, which specialises in rare and orphan conditions and has previous direct experience in lupus trials. This was a pivotal study designed to demonstrate the safety and efficacy of Lupuzor™ as part of the Special Protocol Assessment (SPA) from the US Food and Drug Administration (FDA).
Lupuzor™ Phase III Top Line Results
LupuzorTM demonstrated a superior response rate over placebo (52.5% vs 44.6% "responders") in the primary analysis on the Full Analysis Set of all 202 patients and an even more superior response in the 153 patients who completed the study (68.8% vs 59.2%). However, due to the high response rate in the placebo plus Standard of Care group, this superior response did not allow statistical significance to be reached, and the trial's primary end point was not met. Importantly, in patients who were anti-dsDNA autoantibody positive (a recognised biomarker for Systemic Lupus Erythematosus ('SLE'), LupuzorTM plus Standard of Care demonstrated a higher superior response rate over placebo plus Standard of Care (61.5% vs 47.3%). In the European cohort (Europe and Mauritius), the difference was higher (71.1% vs 48.8%) and reached statistical significance (p=0.218). In addition, 7.5% of the patients in the LupuzorTM plus Standard of Care group went into full remission versus none in the placebo plus Standard of Care group. The study confirmed the outstanding safety profile of LupuzorTM, with zero drug-related serious adverse events reported in the LupuzorTM plus Standard of Care group.
It is important to note that when reference is made to placebo, there are no patients who were treated just with placebo, but all were receiving other drug treatments. Based on the protocol and the commonly accepted study design, there were two groups of patients: (1) patients receiving LupuzorTM plus 'Standard of Care' and (2) patients receiving placebo plus 'Standard of Care'. 'Standard of Care' includes treatment with other drugs such as steroids, anti-malarials, methotrexate, etc. The definition of a 'responder' is based on the SLE Responder Index (SRI-4) score, which requires a reduction of at least four points in this score. Therefore, patients who improve by less than four points are counted as non-responders, but also no distinction is made between patients who improve by more than four points, all being equal 'responders'.
Extension Open Label Study
Following requests from both investigators and patients involved in the Phase III trial, ImmuPharma initiated an additional clinical trial permitting patients who participated in the Phase III study, to receive Lupuzor™ plus Standard of Care for six months in an open label study. The results will be gathered as an "extension" open label study, independent of the pivotal Phase III trial and will provide additional data on the safety and efficacy of LupuzorTM. The study has now been completed with results anticipated in Q2 2019.
ImmuPharma plc
Chairman's Report (continued)
LupuzorTM - Opportunity and Next Steps
There are an estimated five million people globally suffering from lupus, with approximately 1.5 million patients in the US, Europe and Japan (Source: Lupus Foundation of America). Current 'standard of care' treatments, including steroids and immunosuppressants, can potentially have either serious side effects for patients or limited effectiveness, with over 60 per cent of patients not adequately treated.
The Company believes Lupuzor™ has the potential to be a novel specific drug therapy for the treatment of Lupus by specifically modulating the immune system and halting disease progression in a substantial proportion of patients. Lupuzor™ has a unique mechanism of action that modulates the activity of CD4 T-cells which are involved in the cell-mediated immune response which leads to the lupus disease. Lupuzor™, taken over the long term, as indicated in earlier stage clinical trials, has the potential to prevent the progression of lupus rather than just treating its symptoms, with the rest of the immune system retaining the ability to work normally.
The Board believes there are still a number of routes to market for Lupuzor™, including potential corporate collaborations. The Company also continues to consult with regulatory advisors on potential pathways to market. The prime objective of any strategy would be to maximise shareholder return.
LupuzorTM is also being prepared for entry into a Managed Access Programme ('MAP') which would also allow lupus patients early access to LupzuorTM. The commencement of the MAP is dependent on the outcome of ongoing activities surrounding discussions with potential partners and regulatory advisors.
Centre National de la Recherché Scientifique (CNRS)
ImmuPharma continues to have important collaboration arrangements with the Centre National de la Recherché Scientifique (CNRS), the French National Council for Scientific Research and the largest basic research organisation in Europe. This is where Lupuzor™ was invented by Prof. Sylviane Muller, Research Director at the CNRS. This successful and longstanding relationship plays an important role in the progress of ImmuPharma's development pipeline.
Pipeline Overview
LupuzorTM / Forigerimod / P140 in autoimmune indications
Lupuzor™, is also known by its chemical name 'Forigerimod' or P140. ImmuPharma in conjunction with the CNRS are exploring opportunities on expanding into other autoimmune indications, as demonstrated by Lupuzor™'s strong efficacy and safety profile and by its mechanism of action.
Certain autoimmune indications, outside of lupus, have the potential for Orphan Drug designation. Further assessment continues with the objective of further indications moving into the clinic in due course.
Nucant Program
ImmuPharma's subsidiary Elro SARL ('Elro') holds our cancer Nucant program, IPP-204106, which is focused on combination therapy approaches. ImmuPharma has reviewed different options for progressing this program and is now pursuing a divestment strategy in combination with the Group's Ureka subsidiary. A grant was awarded by the EU to different EU partners (€7 million total with €430k awarded to ImmuPharma) to develop the Nucants in combination with cytotoxic drugs linked to a solid support. The molecule has also shown promising results in ophthalmology (age-related macular degeneration) models.
Peptide Platform
ImmuPharma's subsidiary Ureka SARL ('Ureka') has been developing lead compounds from its novel and patented peptide technology platform UrelixTM. Ureka is based at the Institut Europeen de Chimie et Biologie (IECB) in Bordeaux, France which is under the joint authority of the CNRS, Inserm and the University of Bordeaux.
ImmuPharma plc
Chairman's Report (continued)
Pipeline Overview (continued)
UrelixTM is focusing on oligourea foldamers as a tool to improve the pharmaceutical properties of peptides. One of the first focus areas of Ureka has been GLP-1 analogues for the treatment of Type II diabetes and NASH (Non-Alcoholic-Steato-Hepatitis) as proof of concept for its technology. In February 2019, the peer reviewed scientific research journal 'Nature Communications' published a paper on Ureka's technology.
Further applications of the UrelixTM technology include protein/protein interactions, notably in cancer, and improvement of marketed efficacious peptides allowing additional long lasting patent protection paving the way for a life cycle management franchise. Novel patented technologies are also currently implemented to cover other aspects of the improvement of peptides including potential oral delivery. Peptides have gained so much attention in the last decade that they are now part of the main strategies, along with small molecules and biologics, for developing new medicines.
£10 million Fund Raising
In January 2018, the Company announced the completion of a placing of 6,944,445 new ordinary shares of 10p each at a placing price of 144p raising a total of £10 million before expenses. The Company raised the funds in order to further strengthen the Company's financial position as negotiations continue with potential partners for Lupuzor™ and to support further investment in ImmuPharma's earlier stage portfolio.
Incanthera Limited
In September 2018, the Company signed a Heads of Terms agreement with Incanthera Limited regarding a potential collaboration on the Nucant program. At the same time, ImmuPharma invested £2 million to purchase 363,637 shares at £5.50 per share in Incanthera Limited and received warrants for a further 363,637 shares at £5.50. This investment represents a holding of approximately 15% in Incanthera Limited. In May 2019, the Company announced that discussions with Incanthera Limited regarding a potential collaboration had terminated. ImmuPharma remain supportive of Incanthera Limited and its programs and abilities.
Current Activities and Outlook
As a Board, we continue to be excited by ImmuPharma's future potential. Looking at the Lupuzor™ top line data announced in April 2018, the drug demonstrated a superior response rate over placebo with an exceptional safety profile, giving it, we believe, a compelling product profile. We believe Lupuzor™ has the potential to bring a much needed safe treatment to the millions of lupus sufferers around the world. We continue to engage with potential partners and, although no guarantees of a successful outcome can be given at present, we are focused on moving forward with the development and commercialisation of Lupuzor™.
The Company has been exploring its options to license, divest or 'spin-off' the technologies of both Elro and Ureka to unlock their future potential and enhance value to shareholders. The Company's intention is to merge these two subsidiaries, in order to create a stronger combined company with a platform technology together with a drug candidate in clinical development, with a view to securing external investment either from private equity or through a public listing on a European stock exchange or licensing. This, in turn, would allow ImmuPharma to focus on LupuzorTM and the overall P140 platform for different autoimmune indications. We look forward to providing our shareholders with further updates in due course.
The Board would like to thank its shareholders, both long standing and new for their support as well as its staff, scientific and corporate collaborators including the CNRS, Simbec-Orion and CAP Research.
Tim McCarthy
Non-Executive Chairman
ImmuPharma plc
Financial Review
2018 started with a successful share placing which raised £10 million before expenses. LupuzorTM, ImmuPharma's lead drug candidate for the treatment of lupus completed its pivotal Phase III clinical trial and began an Open Label Extension Study.
Income Statement
The operating loss for the year ended 31 December 2018 was £8.1 million, up from £7.2 million for the year ended 31 December 2017. The increase in overall loss was mainly attributable to share-based expense of £1.8 million (2017: £743k) which was attributable to the number of share options granted in 2017. Research and development expenditure was £4.7 million down slightly from £5.1 million in 2017. This reflects the front-loading of a portion of the Lupuzor clinical trial expenses. Administrative expenses were £1.7 million, up from £1.5 million in the year ended 31 December 2017. Finance income was £130k for 2018 which was down from £240k for 2017. For 2017, finance income is mainly attributable to a gain in fair value on the derivative financial asset. Total comprehensive loss for the year was £7.2 million, an increase from £6.2 million in 2017.
Statement of Financial Position
Cash and cash equivalents at 31 December 2018 amounted to £4.9 million (2017: £2.7 million). Financial borrowings were £121k (2017: £260k). This balance is primarily the conditional advance from the French Government for use in the development of our cancer program. No interest is payable. In January 2018, ImmuPharma successfully completed a share placing raising £10 million before expenses.
In September 2018, the Company invested £2.0 million (2017: £nil) in Incanthera Limited (Incanthera) with whom it also entered discussions on a potential collaboration on the Nucant program. The Company purchased 363,637 shares in Incanthera at a price of £5.50 per share. This represents a holding of approximately 15% in Incanthera. The Company was also granted warrants for a further 363,637 shares at £5.50 per share.
As described and emphasised in the auditor's report the carrying value of the Company's interest in its subsidiaries and the group's interest in Incanthera are subject to uncertainty relating to the future development of their underlying assets.
Results
The Group recorded a loss for the year of £7.2 million (2017: £6.2 million). Basic and diluted loss per share was 5.19p (2017: 4.75p). In accordance with the Group's loss making position no dividend is proposed.
January 2018 Placing - £10 million before expenses raised
ImmuPharma strengthened its financial position through a fundraising in January 2018. The Company announced the completion of a placing of 6,944,445 new ordinary shares of 10p each at a placing price of 144p raising a total of £10 million before expenses. The Company raised the funds in order to further strengthen the Company's Statement of Financial Position as negotiations continue with potential partners for Lupuzor™ and to support further investment in ImmuPharma's earlier stage portfolio.
Total Voting Rights
Following the admission of the shares placed in January 2018 to trading on AIM, the Company has a total of 139,467,430 ordinary shares in issue at 31 December 2018 with each share carrying the right of one vote.
ImmuPharma plc
Financial Review (continued)
Treasury Policy
The policy continues to be that surplus funds of the Group are held in interest-bearing bank accounts on short or medium maturities, until commitments to future expenditure are made, when adequate funds are released to enable future expenditure to be incurred. The Group's Treasury Policy and controls are straightforward and approved by the Board.
Financial Strategy
The overall strategy is to maintain a tight control over cash resources whilst enabling continued progress of the Company's development assets.
Tracy Weimar
Vice President, Operations and Finance
ImmuPharma plc
CONSOLIDATED INCOME STATEMENT
FOR THE YEAR ENDED 31 DECEMBER 2018
Notes Year ended
31 December 2018 Year ended
31 December 2017
£ £
Continuing operations
Revenue 81,281 150,462
Research and development expenses (4,697,284) (5,121,388)
Administrative expenses (1,660,408) (1,520,356)
Share based expense (1,803,769) (742,752)
Operating loss (8,080,180) (7,234,034)
Finance costs (4,783) (3,858)
Finance income 129,808 240,447
Loss before taxation (7,955,155) (6,997,445)
Tax 748,606 774,244
Loss for the year (7,206,549) (6,223,201)
Attributable to:
Equity holders of the parent company (7,206,549) (6,223,201)
Loss per ordinary share
Basic and diluted 2 (5.19p) (4.75p)
ImmuPharma plc
CONSOLIDATED STATEMENT OF COMPREHENSIVE INCOME
FOR THE YEAR ENDED 31 DECEMBER 2018
Year ended
31 December 2018 Year ended
31 December 2017
£ £
Loss for the financial year (7,206,549) (6,223,201)
Other comprehensive income
Items that may be reclassified subsequently to profit or loss:
Exchange differences on translation of foreign operations (88,256) (91,568)
Other comprehensive loss for the year, net of tax (88,256) (91,568)
Total comprehensive loss for the year (7,294,805) (6,314,769)
ImmuPharma plc
CONSOLIDATED STATEMENT OF FINANCIAL POSITION
AS AT 31 DECEMBER 2018
31 December 2018 31 December 2017
Notes £ £
Non-current assets
Intangible assets 483,039 482,268
Property, plant and equipment 164,661 161,399
Financial asset 2,000,000 -
Total non-current assets 2,647,700 643,667
Current assets
Trade and other receivables 331,487 736,212
Cash and cash equivalents 4,911,448 2,729,468
Current tax asset 767,121 907,916
Total current assets 6,010,056 4,373,596
Current liabilities
Financial liabilities - borrowings (98,340) (142,393)
Trade and other payables (913,907) (929,569)
Provisions - (57,517)
Total current liabilities (1,012,247) (1,129,479)
Net current assets 4,997,809 3,244,117
Non-current liabilities
Financial liabilities - borrowings (22,470) (117,297)
Provisions - (195,989)
Net assets 7,623,039 3,574,498
EQUITY
Ordinary shares 13,946,744 13,252,299
Share premium 27,320,145 18,728,519
Merger reserve 106,148 106,148
Other reserves (991,998) (2,961,017)
Retained earnings (32,758,000) (25,551,451)
Total equity 7,623,039 3,574,498
ImmuPharma plc
CONSOLIDATED STATEMENT OF CHANGES IN EQUITY
FOR THE YEAR ENDED 31 DECEMBER 2018
Share capital Share premium
Merger
reserve
Other reserves -
Acquisition
reserve
Other reserves -
Translation
reserve Other reserves-
Equity shares
to be issued
Retained
earnings Total
equity
£ £ £ £ £ £ £ £
At 1 January 2017 12,463,836 15,678,054 106,148 (3,541,203) (1,609,673) 1,777,131 (19,328,250) 5,546,043
Loss for the financial year - - - - - - (6,223,201) (6,223,201)
Exchange differences on translation
of foreign operation
-
-
-
-
(91,568)
-
-
(91,568)
Transactions with owners:
Share based payments
-
-
-
-
-
504,296
-
504,296
New issue of equity capital 788,463 3,311,542 - - - - - 4,100,005
Costs of new issue of equity capital - (261,077) - - - - - (261,077)
At 31 December 2017 13,252,299 18,728,519 106,148 (3,541,203) (1,701,241) 2,281,427 (25,551,451) 3,574,498
Loss for the financial year
- - - - - - (7,206,549) (7,206,549)
Exchange differences on translation
of foreign operations
-
-
-
-
(88,256)
-
-
(88,256)
Transactions with owners:
Share based payments
-
-
-
-
-
2,057,275
-
2,057,275
New issue of equity capital 694,445 9,305,555 - - - - - 10,000,000
Costs of new issue of equity capital - (713,929) - - - - - (713,929)
At 31 December 2018 13,946,744 27,320,145 106,148 (3,541,203) (1,789,497) 4,338,702 (32,758,000) 7,623,039
Attributable to:-
Equity holders of the parent company 13,946,744 27,320,145 106,148 (3,541,203) (1,789,497) 4,338,702 (32,758,000) 7,623,039
ImmuPharma plc
CONSOLIDATED STATEMENT OF CASH FLOWS
FOR THE YEAR ENDED 31 DECEMBER 2018
Notes Year ended
31 December 2018 Year ended
31 December 2017
£ £
Cash flows from operating activities
Cash used in operations 3 (5,606,138) (5,439,079)
Tax received 889,787 1,021,915
Interest paid (4,783) (3,858)
Net cash used in operating activities (4,721,134) (4,421,022)
Investing activities
Purchase of property, plant and equipment (102,880) (25,491)
Purchase of investments (2,000,000) -
Interest received 12,491 772
Net cash used in investing activities (2,090,389) (24,719)
Financing activities
(Decrease)/increase in bank overdraft (72) (290)
Loan repayments (138,809) (114,386)
Settlements from Sharing Agreement - 1,667,380
Gross proceeds from issue of new share capital 10,000,000 4,100,005
Share capital issue costs (713,929) (261,077)
Net cash generated from financing activities 9,147,190 5,391,632
Net increase in cash and cash equivalents 2,335,667 945,891
Cash and cash equivalents at beginning of year 2,729,468 1,876,718
Effects of exchange rates on cash and cash equivalents (153,687) (93,141)
Cash and cash equivalents at end of year 4,911,448 2,729,468
ImmuPharma plc
1 BASIS OF PREPARATION
The financial information set out in this announcement does not comprise the Group's statutory accounts as defined in section 434 of the Companies Act 2006 for the year ended 31 December 2018 or 31 December 2017.
The financial information has been extracted from the statutory accounts for the years ended 31 December 2018 and 31 December 2017. The auditors reported on those accounts; their reports were unqualified and did not contain a statement under either Section 498(2) or Section 498(3) of the Companies Act 2006 in respect of the years ended 31 December 2018 and 31 December 2017 but for the year ended 31 December 2018 did include an emphasis of matter paragraph relating to the uncertainty over the fair value of the investment in Incanthera Limited.
The Group's statutory accounts for the year ended 31 December 2017 have been delivered to the Registrar of Companies, whereas those for the year ended 31 December 2018 will be delivered to the Registrar of Companies following the Company's Annual General Meeting.
The accounting policies are consistent with those applied in the preparation of the interim results for the period ended 30 June 2018, which have been prepared in accordance with International Financial Reporting Standards ('IFRS'). The accounting policies are also consistent with the statutory accounts for the year ended 31 December 2017, with the exception of IFRS 9 "Financial Instruments" and IFRS 15 "Revenue from Contracts with Customers" which are new standards applicable and mandatory for the year ended 31 December 2018. The new standards did not have a material impact on the statutory accounts for the year ended 31 December 2018.
The financial information is for the year ended 31 December 2018 and the comparatives are for the year ended 31 December 2017.
The Group's statutory accounts incorporate the financial statements of ImmuPharma plc and other entities controlled by the company ("the subsidiaries"). Control is achieved where the company has the power to govern the financial and operating policies of an investee entity so as to obtain benefits from its activities.
ImmuPharma plc
2 LOSS PER SHARE
- Group Year ended 31 December 2018 Year ended 31 December 2017
£ £
Loss
Loss for the purposes of basic loss per share being net loss after tax attributable to equity shareholders
(7,206,549)
(6,223,201)
Number of shares
Weighted average number of ordinary shares for the purposes of basic earnings per share
138,839,576
130,902,857
Basic loss per share (5.19)p (4.75)p
Diluted loss per share (5.19)p (4.75)p
There is no difference between basic loss per share and diluted loss per share as the share options are anti-dilutive.
ImmuPharma plc
3 CASH USED IN OPERATIONS
Group
31 December 2018 Group
31 December 2017
£ £
Operating loss (8,080,180) (7,234,034)
Depreciation and amortisation 133,080 138,198
Share-based payments 2,057,275 504,296
(Increase)/decrease in trade and other receivables
404,725 643,466
Increase in trade and other payables
15,151 143,378
Increase/(decrease) in provisions (253,506) 238,456
Gain on foreign exchange 117,317 127,161
Cash used in operations
(5,606,138)
(5,439,079)
ImmuPharma plc
4 SUBSEQUENT EVENTS
There have been no subsequent events.
This information is provided by RNS, the news service of the London Stock Exchange. RNS is approved by the Financial Conduct Authority to act as a Primary Information Provider in the United Kingdom. Terms and conditions relating to the use and distribution of this information may apply. For further information, please contact rns@lseg.com or visit www.rns.com.
END
Wie ist eure Meinung zum Bericht?
Antwort auf Beitrag Nr.: 60.647.667 von liquidx am 24.05.19 09:08:48Grob geschätzt, noch Cash für 2 Jahre, das sollte doch reichen... Sie sind immer noch positiv gestimmt Lupuzor an den Markt zu kriegen und stehen auch noch immer in Verhandlungen mit potentiellen Partnern. Ganz offensichtlich waren die Daten vom April '18 also nicht so schlecht wie von sämtlichen Bashern behauptet, sonst wären keine Partner interessiert. Mittlerweile interpretiere ich auch das Anhalten des MAP positiv. Ich hatte zuerst Sorge, dass es aufgrund fehlender Finanzierung sein könnte, aber mit 4 Mio würde man da schon ein Stückchen weit kommen, das ist also nicht der Grund, warum das MAP angehalten wurde. Ich tippe jetzt auch darauf, dass die Daten der open label study schon soweit so gut aussehen, dass die Zusammenarbeit mit einem Partner jetzt mehr als wahrscheinlich ist und das MAP daher erstmal nicht mehr benötigt wird.
Ansonsten hat man mit Incanthera und dem Merge von Ureka und Elro noch zwei potentielle Eisen im Feuer. Sehe wieder positiver gestimmt in die Zukunft. Aber wie immer sehe ich es anscheinend anders als der Markt, denn Kurs geht ja wieder nach unten ^^ was weiß ich also schon?
In spätestens vier Wochen haben wir, denke ich, dann die absolute Klarheit und es entscheidet sich, ob die Reise nach Norden oder ins Nirwana geht
Ansonsten hat man mit Incanthera und dem Merge von Ureka und Elro noch zwei potentielle Eisen im Feuer. Sehe wieder positiver gestimmt in die Zukunft. Aber wie immer sehe ich es anscheinend anders als der Markt, denn Kurs geht ja wieder nach unten ^^ was weiß ich also schon?
In spätestens vier Wochen haben wir, denke ich, dann die absolute Klarheit und es entscheidet sich, ob die Reise nach Norden oder ins Nirwana geht
Antwort auf Beitrag Nr.: 60.651.119 von Twohybrid am 24.05.19 13:54:40 o Insgesamt 62 in Frage kommende Patienten aus der ursprünglichen Phase-III-Studie wurden rekrutiert
o Die Studie wird voraussichtlich im zweiten Quartal 2019 veröffentlicht
Ob das noch im 2Q was wird? Vorsichtshalber schreiben sie ja " voraussichtlich" dazu, damit man noch Spielraum hat. Sollte es sich ins 3Q verzögern, sehen wir hier nochmal niedrigere Einkaufskurse.
Ansonsten ist man besser schon drin, wenn man auf die Zulassung spekuliert. Eigentlich müsste jetzt ein
Vorlauf bis zur Veröffentlichung statt finden, verwundert schon ein bisschen, dass hier noch immer keine Reaktion des Kurses erfolgt. Da scheint die Verunsicherung nach dem letzten Desaster noch tief zu sitzen. Sollte es jetzt endlich klappen, dann ist der Ausbruch dafür umso radikaler!
Gruß aaahhh
o Die Studie wird voraussichtlich im zweiten Quartal 2019 veröffentlicht
Ob das noch im 2Q was wird? Vorsichtshalber schreiben sie ja " voraussichtlich" dazu, damit man noch Spielraum hat. Sollte es sich ins 3Q verzögern, sehen wir hier nochmal niedrigere Einkaufskurse.
Ansonsten ist man besser schon drin, wenn man auf die Zulassung spekuliert. Eigentlich müsste jetzt ein
Vorlauf bis zur Veröffentlichung statt finden, verwundert schon ein bisschen, dass hier noch immer keine Reaktion des Kurses erfolgt. Da scheint die Verunsicherung nach dem letzten Desaster noch tief zu sitzen. Sollte es jetzt endlich klappen, dann ist der Ausbruch dafür umso radikaler!
Gruß aaahhh
Antwort auf Beitrag Nr.: 60.651.599 von aaahhh am 24.05.19 15:11:09Ein bisschen träumen darf man ja, daher die Frage:
Wie "radikal" kannst du dir den Ausbruch nach heutigem Stand vorstellen?
Wie "radikal" kannst du dir den Ausbruch nach heutigem Stand vorstellen?
Antwort auf Beitrag Nr.: 60.651.663 von liquidx am 24.05.19 15:14:19Da der Kurs bei dem letzten Zulassungshype auf die 2€ lief und man da bei positivem Bescheid mit mindestens 3 € gerechnet hat, sollten wir auch diesmal in die Regionen laufen können. Wäre natürlich der Jackpot. Allerdings rechne ich jetzt eher nicht mit völlig anderen Ergebnissen der Studie, so dass es wohl eher irgendwo dazwischen liegen dürfte, Hauptsache es erfolgt das ok.
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 60.651.791 von aaahhh am 24.05.19 15:24:52Sehe ich auch so ! Warum soll sie auch nicht wieder so hoch laufen ? Ist alleine eine Sache des Ergebnisses.
Also ich bin , und bleibe Investiert.
Gruß 👍
Also ich bin , und bleibe Investiert.
Gruß 👍
Und ich will mein Geld zurück 🙂
Antwort auf Beitrag Nr.: 60.653.747 von Maggi110 am 24.05.19 18:11:38Die letzte die das gesagt hat , hatte eine kleine Tasche und war Angel-Sachse 👍😎
The Life Sciences Division Initiates Coverage on ImmuPharma Plc With a BUY/Corporate Rating
https://www.finanznachrichten.de/nachrichten-2019-05/4681530…
https://www.finanznachrichten.de/nachrichten-2019-05/4681530…
Antwort auf Beitrag Nr.: 60.677.888 von boersenkeks am 28.05.19 11:54:48Finde das ist mal eine positive News, der Kurs ignoriert sie allerdings bis jetzt.
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 60.677.975 von aaahhh am 28.05.19 12:01:30Naja, Immu hat natürlich auch nicht unbedingt vertrauensbildend agiert in den letzten Monaten. Kurs schmolz immer weiter ab und viele haben das Projekt vielleicht auch ganz als Invest abgeschrieben. Ich denke mir, es könnte aber noch etwas draus werden und tiefer fallen ist kaum mehr möglich. Schauen wir mal.
Antwort auf Beitrag Nr.: 60.677.975 von aaahhh am 28.05.19 12:01:30
die Frage: wie ist dieser Bericht zu werten?!
Nach den ersten grösseren Order könnte sich die Stimmung / Phantasie wandeln.
weiter aufpassen.
Gruss RS
Immuoharma
@aaahh,die Frage: wie ist dieser Bericht zu werten?!
Nach den ersten grösseren Order könnte sich die Stimmung / Phantasie wandeln.
weiter aufpassen.
Gruss RS
Ich werde hier weiter Investiert bleiben! , Und bei diesen Kurs vorsichtig , aber stetig Nachkaufen. ( da sich heute eine andere Aktie auf meinen Nachkauf - Zettel verabschiedet hat 🤫.
Gruß
Gruß
Antwort auf Beitrag Nr.: 60.707.798 von swoasik am 31.05.19 15:44:34
AQSV?
Zitat von swoasik: Ich werde hier weiter Investiert bleiben! , Und bei diesen Kurs vorsichtig , aber stetig Nachkaufen. ( da sich heute eine andere Aktie auf meinen Nachkauf - Zettel verabschiedet hat 🤫.
Gruß
AQSV?

Antwort auf Beitrag Nr.: 60.719.538 von techxxnine am 03.06.19 10:26:40Yes 👍 allerdings nur vorläufig , da ich immernoch sehr viel von dem Unternehmen halte.
Antwort auf Beitrag Nr.: 60.720.048 von swoasik am 03.06.19 11:29:26
Lustig, ich habe meine Stücke zu 0.16 verkauft und bin hier wieder eingestiegen. Erhoffe mir kurzfristig mehr von IMMU als von AQSV.
Zitat von swoasik: Yes 👍 allerdings nur vorläufig , da ich immernoch sehr viel von dem Unternehmen halte.
Lustig, ich habe meine Stücke zu 0.16 verkauft und bin hier wieder eingestiegen. Erhoffe mir kurzfristig mehr von IMMU als von AQSV.
Ich erhoffe mir von beiden einiges ! Aber ich denke hier kann es wirklich Zeitnah knallen . Bei AQSV brauchen wir noch etwas mehr Luft .
👍
👍
Antwort auf Beitrag Nr.: 60.720.066 von techxxnine am 03.06.19 11:31:21
Ihr wißt aber schon, dass diese Interviews bei Proactive Investors mit Tim MC wohl abgesprochen sind; warum sonst kam keine Frage zu den 2 Millionen Pfund, die er versenkt hat in Incanthera o h n e eine Gegenleistung! Und das Immupharma nicht mehr viel liquide Mittel hat, also bald wieder an die Tränke muss (mit Vorlauf). Zudem hat er immer die Sicherheit von Lupuzor betont, die aber nix nutzt, wenn das Mittelchen keine Signifikanz aufweist gegenüber Placebo. Und er hat geredet von einem Deal in den nächsten Monaten wahrscheinlich.
Man munkelt schon, dass sie die Extension Studie gestoppt haben wegen der finanziellen Engpasssituation.
Das Schöne an Immupharma ist, dass der Wert langzeit rumdümpelt, um dann stark auszuschlagen und der alte Chief hat ne ganze Menge Aktien von Immupharma. Zudem setze ich auf SI Capital (Joint Broker); bestimmt nicht auf Tim oder Dimitri. Dann schon lieber auf Robert, die graue Eminenz.
Good Luck!
Zwei Dumme ein Gedanke!
Konnte mich noch nicht entscheiden meine AE.... zu verkaufen mit hohem Verlust. Aber genau diesen Wechselgedanken hatte ich auch.Ihr wißt aber schon, dass diese Interviews bei Proactive Investors mit Tim MC wohl abgesprochen sind; warum sonst kam keine Frage zu den 2 Millionen Pfund, die er versenkt hat in Incanthera o h n e eine Gegenleistung! Und das Immupharma nicht mehr viel liquide Mittel hat, also bald wieder an die Tränke muss (mit Vorlauf). Zudem hat er immer die Sicherheit von Lupuzor betont, die aber nix nutzt, wenn das Mittelchen keine Signifikanz aufweist gegenüber Placebo. Und er hat geredet von einem Deal in den nächsten Monaten wahrscheinlich.
Man munkelt schon, dass sie die Extension Studie gestoppt haben wegen der finanziellen Engpasssituation.
Das Schöne an Immupharma ist, dass der Wert langzeit rumdümpelt, um dann stark auszuschlagen und der alte Chief hat ne ganze Menge Aktien von Immupharma. Zudem setze ich auf SI Capital (Joint Broker); bestimmt nicht auf Tim oder Dimitri. Dann schon lieber auf Robert, die graue Eminenz.
Good Luck!
Antwort auf Beitrag Nr.: 60.722.112 von ViVega am 03.06.19 15:27:01Sehr gut , alle Achtung !
So in etwa sind auch meine Gedanken zu Immuph . Wobei ich aber sagen möchte , dass sie noch 2 oder 3 Pfeile mehr im Köcher haben als hier geschrieben. Den CEO kannste vergessen , das ist eine Pfeife durch und durch. Aber der entwickelte Wirkstoffes gegen Lupos ist hier nicht ansatzweise eingepreist. Sobald die ersten Ergebnisse Wiedererwarten positiv sind wird auch Geld fließen. Nö, ich kann nicht glauben das Benlysta trotz schlechter Wirkung und brutaler Nebenwirkungen mehr Wert sein soll. .....Ich bleib an Board 👍😎
So in etwa sind auch meine Gedanken zu Immuph . Wobei ich aber sagen möchte , dass sie noch 2 oder 3 Pfeile mehr im Köcher haben als hier geschrieben. Den CEO kannste vergessen , das ist eine Pfeife durch und durch. Aber der entwickelte Wirkstoffes gegen Lupos ist hier nicht ansatzweise eingepreist. Sobald die ersten Ergebnisse Wiedererwarten positiv sind wird auch Geld fließen. Nö, ich kann nicht glauben das Benlysta trotz schlechter Wirkung und brutaler Nebenwirkungen mehr Wert sein soll. .....Ich bleib an Board 👍😎
Heute geht es aber ab, gibt es News?
Antwort auf Beitrag Nr.: 60.722.856 von swoasik am 03.06.19 16:51:21Langsam kommt wieder Schwung in Immu, hangelt sich still und heimlich höher. Mal sehen wann wir den Grund erfahren.
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 60.741.147 von aaahhh am 05.06.19 15:56:09Das erzählt mir einfach keiner dass die Pipeline von Immuph nichts wert ist bzw.nur ein paar Eurocent!
Na also, geht doch...endlich mal wieder ein Lebenszeichen. 👍
Kann mir gut vorstellen, daß die nächsten Wochen das Ergebnis der erweiterten Studie eintrudelt. Und/oder (einhergehend) ein Lizenzdeal mit Big Pharma (s. Interview mit McCarthy)...
Kann mir gut vorstellen, daß die nächsten Wochen das Ergebnis der erweiterten Studie eintrudelt. Und/oder (einhergehend) ein Lizenzdeal mit Big Pharma (s. Interview mit McCarthy)...
Auch wenn es noch einen guten Sprung braucht, bis ich meinen EK erreiche, freue ich mich natürlich schon jetzt, wenn es endlich mal wieder bergauf geht...
Hab ‚nen EK von 50 Pence und nach dem Kurssturz nur 1x nachgekauft um den EK etwas zu verringern. Hätte auch nie gedacht, daß die Aktie nochmals unter 10 Pence fallen würde.
Schlusskurs auf Tageshoch läßt Gutes erahnen für Morgen...
Schlusskurs auf Tageshoch läßt Gutes erahnen für Morgen...
Antwort auf Beitrag Nr.: 60.742.803 von Stoxtrayder am 05.06.19 18:47:56Wurde halt schon 2mal auf die 0,20€ hochgezogen, hoffen wir mal, dass es dieses mal einen triftigen Grund gibt und wir darüber laufen. Volumen ist halt noch etwas bescheiden, müsste bei anstehenden "breaking news" eigentlich mehr sein.
Gruß aaahhh
Gruß aaahhh
Buyout zu 1,44 GBP ...
das wäre mal was! Über 20 Pence schließen und dann 700 Prozent Aufschlag. War nicht diese Biotechaktie Tor??? mal, die den höchsten Aufschlag bei einem Buyout bekommen hat?
Warum nicht (tuto kompletto mit Ureca usw.)? Hatte Immupharma nicht mindestens 7 Interessenten mit Stillschweigeabkommen, die sich die Daten angesehen haben P III. Warum auch immer (vielleicht ja auch nur, um zu wissen was die Konkurrenz kann oder nicht kann) ...
Nur Zimmermann wird nicht verkaufen zu dem Preis.
Wollte schon immer mal einer von diesen gnadenlosen Pumpern sein!!! Allein daran glauben tu ich nicht. Was mich stört ist, warum es jetzt eine positive Subgruppenanalyse geben soll bei der Extension Studie und dies nicht schon bei der Auswertung der P III aufgetaucht ist.
Mal sehen, was passiert, aber die Marktkapitalisierung bei ca. 22 Millionen Pfund aktuell ist im Vergleich zum möglichen Potential schon gering. Bin mal gespannt. Erst mal die 20 Pence ansteuern, dann die 50 Pence ...
das wäre mal was! Über 20 Pence schließen und dann 700 Prozent Aufschlag. War nicht diese Biotechaktie Tor??? mal, die den höchsten Aufschlag bei einem Buyout bekommen hat?
Warum nicht (tuto kompletto mit Ureca usw.)? Hatte Immupharma nicht mindestens 7 Interessenten mit Stillschweigeabkommen, die sich die Daten angesehen haben P III. Warum auch immer (vielleicht ja auch nur, um zu wissen was die Konkurrenz kann oder nicht kann) ...
Nur Zimmermann wird nicht verkaufen zu dem Preis.
Wollte schon immer mal einer von diesen gnadenlosen Pumpern sein!!! Allein daran glauben tu ich nicht. Was mich stört ist, warum es jetzt eine positive Subgruppenanalyse geben soll bei der Extension Studie und dies nicht schon bei der Auswertung der P III aufgetaucht ist.
Mal sehen, was passiert, aber die Marktkapitalisierung bei ca. 22 Millionen Pfund aktuell ist im Vergleich zum möglichen Potential schon gering. Bin mal gespannt. Erst mal die 20 Pence ansteuern, dann die 50 Pence ...
Schade schade, heute wird wieder alles abgeben, d.h. morgen ist die Aktie wieder zu 0,12-0,13 € zu haben.
Antwort auf Beitrag Nr.: 60.749.478 von liquidx am 06.06.19 14:32:16Analyst sees 'clear rationale' for ImmuPharma to move forward with Lupuzor
https://www.proactiveinvestors.co.uk/companies/stocktube/136…
https://www.proactiveinvestors.co.uk/companies/stocktube/136…
Antwort auf Beitrag Nr.: 60.752.274 von Semira am 06.06.19 18:14:20Sehr gut, danke für die Info, das war also der Grund für den gestrigen Ausbruch.
Gruß aaahhh
Gruß aaahhh
Na wenigstens bröckelt der Kurs heute nicht weiter ab und kann sich oberhalb der 14 Pence-Marke stabilisieren...
Gerade im UK-Forum gelesen, daß bei der Auswertung der PIII die US-Patienten, die mit Lupuzor behandelt wurden, zw. 40-60% eine Wirksamkeit zeigte und bei den Europäern 70%...
Gerade im UK-Forum gelesen, daß bei der Auswertung der PIII die US-Patienten, die mit Lupuzor behandelt wurden, zw. 40-60% eine Wirksamkeit zeigte und bei den Europäern 70%...
Antwort auf Beitrag Nr.: 60.760.011 von Stoxtrayder am 07.06.19 15:28:40Hatten die die gleiche Dosierung , oder eine andere.
Gruß aaahhh
Gruß aaahhh
Antwort auf Beitrag Nr.: 60.760.026 von aaahhh am 07.06.19 15:30:25
Das mit der Dosierung wird immer wieder vom User Nolupus angeführt. Bei Adaptimmune habe ich aber mal gelesen, dass sie es geschafft haben, die Lebensdauer von Peptiden zu verlängern. Keine Ahnung, ob das auch hier sein könnte, bin totaler medizinischer Laie. Aber ich halte das Argument von Nolupus oder Nobbygnome für quatsch, sollte tatsächlich Sylvaine Muller dies nicht alles ergründet haben vor PII?
Wenn alles so toll ist, warum wird der Laden nicht zu 1,44 Pfund übernommen, wären vielleicht 150 Millionen Pfund (???) Marktkapitalisierung? Zimmermann ist bestimmt dagegen,aber auch nicht mehr der jüngste.
Tim MC würde ich garnichts mehr glauben. Vielleicht ja auch ein abgekartetes Spiel mit seinm "Kumpel" auf proactiveinvestors. Wer weiß?
Aber einst steht auch fest, trifft irgendetwas ein von den drei Möglichkeiten (Divest, Deal, Buyout) gibt es dicke Aufschläge. Zunächst 20 Pence, dann 50 Pence ... höchstes Risiko, da Immupharma mit dem Rücken zur Wand steht, kein Geld mehr ...
nmM
Anti Body DNS...
darum ging es bei den Europäern, dass man dort vielleicht eine Subgruppe hat, die im Vergleich mit Placebo gut reagiert. Aber immer bedenken, dass Big Pharma und andere seit letzten Sommer Zugriff auf die Daten hatte, Zimmermanns Ausweg auch die Subgruppe war (verkündet im letzten Jahr), bisher aber nichts kam. Es ist ein Rennen im Dunkeln hier. Was ich damit meine: es kann gut sein, dass es alles ein wenig instrumentalisiert wird, um die KE verträglicher zu machen oder die Vertragsverhandlungen zu einem Lizenzdeal. Das mit der Dosierung wird immer wieder vom User Nolupus angeführt. Bei Adaptimmune habe ich aber mal gelesen, dass sie es geschafft haben, die Lebensdauer von Peptiden zu verlängern. Keine Ahnung, ob das auch hier sein könnte, bin totaler medizinischer Laie. Aber ich halte das Argument von Nolupus oder Nobbygnome für quatsch, sollte tatsächlich Sylvaine Muller dies nicht alles ergründet haben vor PII?
Wenn alles so toll ist, warum wird der Laden nicht zu 1,44 Pfund übernommen, wären vielleicht 150 Millionen Pfund (???) Marktkapitalisierung? Zimmermann ist bestimmt dagegen,aber auch nicht mehr der jüngste.
Tim MC würde ich garnichts mehr glauben. Vielleicht ja auch ein abgekartetes Spiel mit seinm "Kumpel" auf proactiveinvestors. Wer weiß?
Aber einst steht auch fest, trifft irgendetwas ein von den drei Möglichkeiten (Divest, Deal, Buyout) gibt es dicke Aufschläge. Zunächst 20 Pence, dann 50 Pence ... höchstes Risiko, da Immupharma mit dem Rücken zur Wand steht, kein Geld mehr ...
nmM
Antwort auf Beitrag Nr.: 60.771.352 von ViVega am 10.06.19 10:35:34ja , dies muß hier jeden bewusst sein , hier geht es nur um Schwarz oder Rot.
Die Chancen sind da , aber das Risiko ist noch größer.
Wobei ich mir nicht Vorstellen kann, dass Sylvaine Muller wirklich so schlecht geforscht hat!
Sie ist eine der größten Fachfrauen in diesem Umfeld von Lupus , kann ich mir einfach nicht vorstellen.
Den Rest des Stalles kann man getrost Vergessen , alles " möchte gern Wissenschaftler und CEO's" )
Aber , es wurde trotzdem ein Wert erschaffen , über den der Markt nicht einfach so Hinweg gehen kann.
Die Chancen sind da , aber das Risiko ist noch größer.
Wobei ich mir nicht Vorstellen kann, dass Sylvaine Muller wirklich so schlecht geforscht hat!
Sie ist eine der größten Fachfrauen in diesem Umfeld von Lupus , kann ich mir einfach nicht vorstellen.
Den Rest des Stalles kann man getrost Vergessen , alles " möchte gern Wissenschaftler und CEO's" )
Aber , es wurde trotzdem ein Wert erschaffen , über den der Markt nicht einfach so Hinweg gehen kann.
Antwort auf Beitrag Nr.: 60.772.069 von swoasik am 10.06.19 12:35:01@swoasik
ja, dies muss hier jeden bewusst sein, hier geht es nur um Schwarz oder Rot.
Schön, dass du noch dabei bist - du schreibst also noch investiert, - ebenso!!
Nach meiner Meinung fehlt der grosse Player „also Big Pharmaka „ nicht nur für den Hintergrund.
Allerdings stehen diese am Rande und nach meiner Beobachtung tätigen diese immer erst bei Erfolg den ersten Schritt nach der Zulassung. natürlich zum anderen Preis!!
Das ist unser Risiko, sie können oder wollen sich kein Fiasko erlauben, der Name macht’s.
Gruss RS
ja, dies muss hier jeden bewusst sein, hier geht es nur um Schwarz oder Rot.
Schön, dass du noch dabei bist - du schreibst also noch investiert, - ebenso!!
Nach meiner Meinung fehlt der grosse Player „also Big Pharmaka „ nicht nur für den Hintergrund.
Allerdings stehen diese am Rande und nach meiner Beobachtung tätigen diese immer erst bei Erfolg den ersten Schritt nach der Zulassung. natürlich zum anderen Preis!!
Das ist unser Risiko, sie können oder wollen sich kein Fiasko erlauben, der Name macht’s.
Gruss RS
Antwort auf Beitrag Nr.: 60.772.633 von Rastelly am 10.06.19 14:18:03Ja , immernoch dabei und Investiert.
Wie ich geschrieben habe , kann mir nicht vorstellen dass die ganzen Entwicklungen welche bei Immuph gemacht wurden, einfach nur wertlos sind.
Bin mir ( fast ) sicher dass hier noch ein Zugriff kommt.
Aber trotzdem , das Risiko ist hier Extrem hoch, aber auch extrem verlockend zu diesem Kurs.
Schönes Pfingsten noch ...👍
Wie ich geschrieben habe , kann mir nicht vorstellen dass die ganzen Entwicklungen welche bei Immuph gemacht wurden, einfach nur wertlos sind.
Bin mir ( fast ) sicher dass hier noch ein Zugriff kommt.
Aber trotzdem , das Risiko ist hier Extrem hoch, aber auch extrem verlockend zu diesem Kurs.
Schönes Pfingsten noch ...👍
...schöner Endspurt heute in London. 👍
tippe auf immupharma alerting service für morgen früh ... dann kommen vielleicht die Ergebnisse zur Extension open label Studie, da am 27.06.2019 (?) AGM ist und die Zeit knapp wird bis dahin. Zudem hies es ja, bis zum Ende Q2!
Big Pharma liebt wahrlich die Sicherheit, leider. Wäre doch eine tolle Win-Win-Situation.
GSK soll mal in die Pushen kommen ...
Big Pharma liebt wahrlich die Sicherheit, leider. Wäre doch eine tolle Win-Win-Situation.
GSK soll mal in die Pushen kommen ...
Oh weh, wissen da schon einige mehr? Der Kurs rauscht gen Süden mit größerem Volumen als sonst.
Antwort auf Beitrag Nr.: 60.892.674 von liquidx am 26.06.19 09:17:03
https://www.investegate.co.uk/immupharma-plc--imm-/rns/subsc…
Zitat von liquidx: Oh weh, wissen da schon einige mehr? Der Kurs rauscht gen Süden mit größerem Volumen als sonst.
https://www.investegate.co.uk/immupharma-plc--imm-/rns/subsc…
https://www.investegate.co.uk/immupharma-plc--imm-/rns/subsc…
Hier der Grund für den Kursverfall von heute Morgen
Hier der Grund für den Kursverfall von heute Morgen
Ich hatte über einen Einstieg heute nachgedacht. Hat sich nun erledigt. Die Ergebnisse werden morgen wahrscheinlich auch nicht berauschend sein, sonst hätte man mit der KE noch einige Wochen warten können um dann zu ganz anderen Kursen Kapital einzusammeln. Wird wohl in den nächsten Wochen Richtung 7-8 Pence gehen. Schade.
Antwort auf Beitrag Nr.: 60.893.337 von DoktorHolliday am 26.06.19 10:14:20
Wird variabel pro Monat nach Kurs ausbezahlt.
Zitat von DoktorHolliday: Ich hatte über einen Einstieg heute nachgedacht. Hat sich nun erledigt. Die Ergebnisse werden morgen wahrscheinlich auch nicht berauschend sein, sonst hätte man mit der KE noch einige Wochen warten können um dann zu ganz anderen Kursen Kapital einzusammeln. Wird wohl in den nächsten Wochen Richtung 7-8 Pence gehen. Schade.
Wird variabel pro Monat nach Kurs ausbezahlt.
Dann kann man schon mal Kauforder bei 0,1 € platzieren für die nächsten Wochen 

😣
Wenn die erweiterte Studie wieder keine statistische Signifikanz zeigen sollte, dürften hier über kurz oder lang leider die Lichter ausgehen...
Wenn die erweiterte Studie wieder keine statistische Signifikanz zeigen sollte, dürften hier über kurz oder lang leider die Lichter ausgehen...
Antwort auf Beitrag Nr.: 60.893.337 von DoktorHolliday am 26.06.19 10:14:20
Sehe ich leider auch so! Erst KE, dann Kursverluste, ein Vorlauf bei guten Studiendaten sieht in der Regel meist völlig gegenteilig aus. Bringt auch nichts, sich hier nochmal niedriger zu positionieren, denn wenn es jetzt auch nichts wird mit guten Resultaten, dann wars das wohl für lange Zeit, vielleicht auch für immer, Biorisiko eben.
Gruß aaahhh
Zitat von DoktorHolliday: Ich hatte über einen Einstieg heute nachgedacht. Hat sich nun erledigt. Die Ergebnisse werden morgen wahrscheinlich auch nicht berauschend sein, sonst hätte man mit der KE noch einige Wochen warten können um dann zu ganz anderen Kursen Kapital einzusammeln. Wird wohl in den nächsten Wochen Richtung 7-8 Pence gehen. Schade.
Sehe ich leider auch so! Erst KE, dann Kursverluste, ein Vorlauf bei guten Studiendaten sieht in der Regel meist völlig gegenteilig aus. Bringt auch nichts, sich hier nochmal niedriger zu positionieren, denn wenn es jetzt auch nichts wird mit guten Resultaten, dann wars das wohl für lange Zeit, vielleicht auch für immer, Biorisiko eben.
Gruß aaahhh
Ja die Kohle is weg,shit happens....
Ich habe mich jetzt heute auch von 80 % der Anteile getrennt, da ich vermute, dass es zum 1.7. hin weiter abwärts geht in Richtung 10 Pence....


Noch keine Meldung... Also morgen.
Antwort auf Beitrag Nr.: 60.901.620 von techxxnine am 27.06.19 09:44:48Was ist morgen? Was machst du da?
Antwort auf Beitrag Nr.: 60.901.704 von liquidx am 27.06.19 09:53:03
Die Daten sollen Ende Q2 kommen. Das AGM wäre eigentlich heute...11:30
Zitat von liquidx: Was ist morgen? Was machst du da?
Die Daten sollen Ende Q2 kommen. Das AGM wäre eigentlich heute...11:30
Ah, stimmt, ja ....
Bist du noch dabei oder auch raus aufgrund der anstehenden KE?
Bist du noch dabei oder auch raus aufgrund der anstehenden KE?
Antwort auf Beitrag Nr.: 60.901.803 von liquidx am 27.06.19 10:04:18
Ich bin noch dabei, ich habe meine Hälfte bereits letzte Woche verkauft und gehe mit dem Rest noch durch die Daten. Ich finde die KE nicht so tragisch, kam einfach unerwartet.
Zitat von liquidx: Ah, stimmt, ja ....
Bist du noch dabei oder auch raus aufgrund der anstehenden KE?
Ich bin noch dabei, ich habe meine Hälfte bereits letzte Woche verkauft und gehe mit dem Rest noch durch die Daten. Ich finde die KE nicht so tragisch, kam einfach unerwartet.
Ja, aber die wissen doch, wie die Daten ausfallen, warum haben Sie dann mit der KE nicht noch ein paar Wochen gewartet. Bei guten Daten sollte der Kurs ja auf einem höheren Niveau sein und somit besser für eine KE....
Antwort auf Beitrag Nr.: 60.901.884 von liquidx am 27.06.19 10:13:08
Eine KE lässt sich halt nicht von heute auf Morgen organisieren. Ich würde da keine voreiligen Schlüsse daraus ziehen.
Zitat von liquidx: Ja, aber die wissen doch, wie die Daten ausfallen, warum haben Sie dann mit der KE nicht noch ein paar Wochen gewartet. Bei guten Daten sollte der Kurs ja auf einem höheren Niveau sein und somit besser für eine KE....
Eine KE lässt sich halt nicht von heute auf Morgen organisieren. Ich würde da keine voreiligen Schlüsse daraus ziehen.
Ich bin auch noch dabei . Das wird jetzt einfach mitgenommen. Es gibt Dinge im Leben , da ist es besser man bleibt einfach ruhig mit dem Rücken zur Wand stehen . Ich hoffe dass die Brocken welche vom Himmel kommen nicht zu groß werden , wegen dem ausweichen.
Ja, sehe ich auch so...
Auch 90% in den Miesen...und wenn’s ein Totalverlust wird, isses halt so. Ich bleibe bis zum bitteren Ende investiert, ein Funken Hoffnung ist ja noch da...
Wenn man sich heute den Kurs ansieht, glaubt allerdings niemand mehr dran, daß das hier noch was werden könnte...
Kann mich noch gut erinnern, wie sie letztes Jahr auch kurz vor Bekanntgabe der Daten Geld eingesammelt haben...
Auch 90% in den Miesen...und wenn’s ein Totalverlust wird, isses halt so. Ich bleibe bis zum bitteren Ende investiert, ein Funken Hoffnung ist ja noch da...
Wenn man sich heute den Kurs ansieht, glaubt allerdings niemand mehr dran, daß das hier noch was werden könnte...
Kann mich noch gut erinnern, wie sie letztes Jahr auch kurz vor Bekanntgabe der Daten Geld eingesammelt haben...
Der Kurs zieht gerade an, ihr hatte wohl recht...
Gibt es News??
Gibt es News??
Evtl. was vom AGM durchgesickert? 🧐
Antwort auf Beitrag Nr.: 60.904.920 von Stoxtrayder am 27.06.19 15:41:46
Es wurde zumindest alles durchgewunken. Das kann man jetzt positiv betrachten, aber ich wäre weiterhin vorsichtig was als nächstes passiert.
Zitat von Stoxtrayder: Evtl. was vom AGM durchgesickert? 🧐
Es wurde zumindest alles durchgewunken. Das kann man jetzt positiv betrachten, aber ich wäre weiterhin vorsichtig was als nächstes passiert.
War mit meinem Ausstieg leider zu voreilig, sieht jetzt alles nicht so schlimm aus.... Jetzt noch gute News und ich darf sehr teuer nachlegen...
Hohes Handelsvolumen zum Schluß hin...30% Intraday-Reversal 👌
Lt. UK-Forum hätte die IR auf twitter gepostet, daß die Studiendaten morgen veröffentlicht werden...
Lt. UK-Forum hätte die IR auf twitter gepostet, daß die Studiendaten morgen veröffentlicht werden...
Primary endpoint successfully met from the open label extension study evaluating safety and tolerability from the Pivotal Phase III trial of Lupuzor™ in patients with Systemic Lupus Erythematosus ("Lupus")
Study demonstrates robust safety profile of Lupuzor™ with no 'serious adverse events' reported
...
https://www.investegate.co.uk/article.aspx?id=20190628070005…
Study demonstrates robust safety profile of Lupuzor™ with no 'serious adverse events' reported
...
https://www.investegate.co.uk/article.aspx?id=20190628070005…
Was seht ihr aufgrund der News als realistischen Tagesschlusskurs?
Antwort auf Beitrag Nr.: 60.909.840 von liquidx am 28.06.19 08:29:03Völlig unmöglich zu sagen, da sie wichtige Infos nicht gegeben haben, die aber nötig wären, um diese News interpretieren zu können. Solange wir beispielsweise nicht wissen wie der Anteil an Patienten mit anti dsDNA Autoantikörpern waren, sind diese Zahlen erst mal nichts wert und keiner wird so recht wissen, was er damit anfangen soll. Sprich, der Markt wird "raten", daher keine Ahnung, wo der Preis hingeht.
Ich bin jedoch vorsichtig optimistisch gestimmt: 32% remission ist schon ein Wort, egal wie hoch der Anteil an entsprechenden Patienten war...
Ich bin jedoch vorsichtig optimistisch gestimmt: 32% remission ist schon ein Wort, egal wie hoch der Anteil an entsprechenden Patienten war...
Warten ist ein hohes Gut bei Biotech's .
Das haben wir ja jetzt schon bei einigen mitbekommen , nicht nur bei Sirona . Also , auch hier gilt erst Mal Meldungen an warten und sehen was daraus gemacht wird.
Das haben wir ja jetzt schon bei einigen mitbekommen , nicht nur bei Sirona . Also , auch hier gilt erst Mal Meldungen an warten und sehen was daraus gemacht wird.
28. Juni 2019
ImmuPharma PLC
("ImmuPharma" oder die "Firma")
Der primäre Endpunkt wurde in der offenen Verlängerungsstudie zur Bewertung der Sicherheit und Verträglichkeit der Pivotal-Phase-III-Studie mit Lupuzor ™ bei Patienten mit erfolgreich erreicht
Systemischer Lupus erythematodes ("Lupus")
Die Studie zeigt ein robustes Sicherheitsprofil von Lupuzor ™, ohne dass schwerwiegende unerwünschte Ereignisse gemeldet wurden
ImmuPharma PLC (LSE: IMM), das auf Arzneimittelforschung und -entwicklung spezialisierte Unternehmen, freut sich, die Analyse der Ergebnisse der sechsmonatigen Open-Label-Verlängerungsstudie aus seiner ursprünglichen Phase-III-Studie mit Lupuzor ™, dem Hauptprogramm für den möglichen Durchbruch, bekannt zu geben Mittel gegen Lupus, eine potenziell lebensbedrohliche Autoimmunerkrankung.
Schlüssel-Höhepunkte:
· 62 teilnahmeberechtigte Patienten in den USA und Europa nahmen an einer 24-wöchigen Behandlung teil
· Der primäre Endpunkt wurde erfolgreich erreicht und bestätigt das Sicherheitsprofil von Lupuzor ™
· Es wurden keine schwerwiegenden unerwünschten Ereignisse im Zusammenhang mit Lupuzor ™ gemeldet
· Da es sich bei der Studie um eine offene Studie handelt, werden nur deskriptive Wirksamkeitsdaten erstellt
Hintergrund
Auf Ersuchen von Prüfärzten und Patienten, die an der Pivotal - Phase - III - Studie beteiligt waren, leitete ImmuPharma im Januar 2018 eine zusätzliche Studie ein, in der Patienten, die an der Phase - III - Studie teilgenommen hatten, sechs Monate lang Lupuzor ™ (plus "Standard of Care") erhalten konnten ein Open-Label-Schema. Die Ergebnisse wurden unabhängig von der Pivotal-Phase-III-Studie als Open-Label-Studie zur „Erweiterung“ gesammelt. Der primäre Endpunkt bestand in der Bewertung der Sicherheit und Verträglichkeit.
Lernziele
Primäres Ziel: Das primäre Ziel der Studienerweiterung bestand in der Bewertung der Sicherheit und Verträglichkeit einer 200-Mikrogramm-Dosis ("mcg") alle 4 Wochen für 24 Wochen Lupuzor ™ bei Patienten mit Lupus, die an der Pivotal-Phase-III-Studie teilgenommen hatten.
Ergebnis: Der primäre Endpunkt wurde erfolgreich erreicht und bestätigte das herausragende und robuste Sicherheitsprofil von Lupuzor ™, während keine schwerwiegenden unerwünschten Ereignisse gemeldet wurden.
Sekundäre Ziele: Die sekundären Wirksamkeitsziele der Studienerweiterung waren die Bewertung folgender Punkte:
· Die Wirkung von Lupuzor ™ im klinischen SLEDAI-2K-Gesamtscore beim letzten Besuch im Vergleich zum ersten Besuch
· Remission der Krankheit (d. H. Reduktion des klinischen SLEDAI-2K-Scores auf 0)
Ergebnis:
· 36% der Patienten sprachen auf das klinische Ansprechen an, wenn ein klinischer SLEDAI-2K-Score von 0 oder eine Verringerung des klinischen SLEDAI-2K-Scores um mindestens 4 Punkte ermittelt wurde.
· 32% der Patienten befanden sich in Remission, wenn ein klinisches Ansprechen als klinischer SLEDAI-2K-Score von 0 bewertet wurde
* Ein klinischer SLEDAI-2K-Wert ist definiert als SLEDAI-2K-Wert ohne Eingabe von Anti-dsDNA und Komplement (Blutanalyse).
Weitere Ankündigungen erfolgen entsprechend.
Dr. Robert Zimmer, PhD, Chief Scientific Officer, kommentierte die Ergebnisse wie folgt: "Mit dem positiven Ergebnis dieser Open-Label-Verlängerungsstudie mit Lupuzor ™, das seinen primären Endpunkt erreicht und das robuste Sicherheitsprofil des Arzneimittels bestätigt hat, setzen wir unsere Arbeit fort Gespräche mit unseren Aufsichtsexperten und potenziellen Partnern mit dem Schwerpunkt, Lupuzor ™ voranzutreiben. "
Tim McCarthy, Vorsitzender, fügte hinzu: "Wir freuen uns, dass Lupuzor ™ sein robustes Sicherheitsprofil erneut bestätigt hat, und wir sind zuversichtlich, dass Lupuzor ™ das Potenzial hat, Lupuskranken auf der ganzen Welt eine dringend benötigte Behandlung zu bieten. Wir freuen uns darauf, unsere Aktionäre zu gegebener Zeit über weitere Aktualisierungen zu informieren. "
Diese Ankündigung enthält Insiderinformationen für die Zwecke von Artikel 7 der Verordnung (EU) Nr. 596/2014. ("BESCHÄDIGEN")
ImmuPharma PLC
("ImmuPharma" oder die "Firma")
Der primäre Endpunkt wurde in der offenen Verlängerungsstudie zur Bewertung der Sicherheit und Verträglichkeit der Pivotal-Phase-III-Studie mit Lupuzor ™ bei Patienten mit erfolgreich erreicht
Systemischer Lupus erythematodes ("Lupus")
Die Studie zeigt ein robustes Sicherheitsprofil von Lupuzor ™, ohne dass schwerwiegende unerwünschte Ereignisse gemeldet wurden
ImmuPharma PLC (LSE: IMM), das auf Arzneimittelforschung und -entwicklung spezialisierte Unternehmen, freut sich, die Analyse der Ergebnisse der sechsmonatigen Open-Label-Verlängerungsstudie aus seiner ursprünglichen Phase-III-Studie mit Lupuzor ™, dem Hauptprogramm für den möglichen Durchbruch, bekannt zu geben Mittel gegen Lupus, eine potenziell lebensbedrohliche Autoimmunerkrankung.
Schlüssel-Höhepunkte:
· 62 teilnahmeberechtigte Patienten in den USA und Europa nahmen an einer 24-wöchigen Behandlung teil
· Der primäre Endpunkt wurde erfolgreich erreicht und bestätigt das Sicherheitsprofil von Lupuzor ™
· Es wurden keine schwerwiegenden unerwünschten Ereignisse im Zusammenhang mit Lupuzor ™ gemeldet
· Da es sich bei der Studie um eine offene Studie handelt, werden nur deskriptive Wirksamkeitsdaten erstellt
Hintergrund
Auf Ersuchen von Prüfärzten und Patienten, die an der Pivotal - Phase - III - Studie beteiligt waren, leitete ImmuPharma im Januar 2018 eine zusätzliche Studie ein, in der Patienten, die an der Phase - III - Studie teilgenommen hatten, sechs Monate lang Lupuzor ™ (plus "Standard of Care") erhalten konnten ein Open-Label-Schema. Die Ergebnisse wurden unabhängig von der Pivotal-Phase-III-Studie als Open-Label-Studie zur „Erweiterung“ gesammelt. Der primäre Endpunkt bestand in der Bewertung der Sicherheit und Verträglichkeit.
Lernziele
Primäres Ziel: Das primäre Ziel der Studienerweiterung bestand in der Bewertung der Sicherheit und Verträglichkeit einer 200-Mikrogramm-Dosis ("mcg") alle 4 Wochen für 24 Wochen Lupuzor ™ bei Patienten mit Lupus, die an der Pivotal-Phase-III-Studie teilgenommen hatten.
Ergebnis: Der primäre Endpunkt wurde erfolgreich erreicht und bestätigte das herausragende und robuste Sicherheitsprofil von Lupuzor ™, während keine schwerwiegenden unerwünschten Ereignisse gemeldet wurden.
Sekundäre Ziele: Die sekundären Wirksamkeitsziele der Studienerweiterung waren die Bewertung folgender Punkte:
· Die Wirkung von Lupuzor ™ im klinischen SLEDAI-2K-Gesamtscore beim letzten Besuch im Vergleich zum ersten Besuch
· Remission der Krankheit (d. H. Reduktion des klinischen SLEDAI-2K-Scores auf 0)
Ergebnis:
· 36% der Patienten sprachen auf das klinische Ansprechen an, wenn ein klinischer SLEDAI-2K-Score von 0 oder eine Verringerung des klinischen SLEDAI-2K-Scores um mindestens 4 Punkte ermittelt wurde.
· 32% der Patienten befanden sich in Remission, wenn ein klinisches Ansprechen als klinischer SLEDAI-2K-Score von 0 bewertet wurde
* Ein klinischer SLEDAI-2K-Wert ist definiert als SLEDAI-2K-Wert ohne Eingabe von Anti-dsDNA und Komplement (Blutanalyse).
Weitere Ankündigungen erfolgen entsprechend.
Dr. Robert Zimmer, PhD, Chief Scientific Officer, kommentierte die Ergebnisse wie folgt: "Mit dem positiven Ergebnis dieser Open-Label-Verlängerungsstudie mit Lupuzor ™, das seinen primären Endpunkt erreicht und das robuste Sicherheitsprofil des Arzneimittels bestätigt hat, setzen wir unsere Arbeit fort Gespräche mit unseren Aufsichtsexperten und potenziellen Partnern mit dem Schwerpunkt, Lupuzor ™ voranzutreiben. "
Tim McCarthy, Vorsitzender, fügte hinzu: "Wir freuen uns, dass Lupuzor ™ sein robustes Sicherheitsprofil erneut bestätigt hat, und wir sind zuversichtlich, dass Lupuzor ™ das Potenzial hat, Lupuskranken auf der ganzen Welt eine dringend benötigte Behandlung zu bieten. Wir freuen uns darauf, unsere Aktionäre zu gegebener Zeit über weitere Aktualisierungen zu informieren. "
Diese Ankündigung enthält Insiderinformationen für die Zwecke von Artikel 7 der Verordnung (EU) Nr. 596/2014. ("BESCHÄDIGEN")
Ich bin erstmal komplett raus.
Antwort auf Beitrag Nr.: 60.909.840 von liquidx am 28.06.19 08:29:03
Diese ganzen Interviews mit ihm und dem "Inder" auf Proactive Investor könnten auch aus meiner Sicht getürkt gewesen sein, um diesen Szenario zu ermöglichen.
Mit Lupus gibt das aus meiner Sicht nix mehr. Aber auch keine andere Wirksamkeit abgefallen. Wie schade auch für Sylvaine Muller. P 140 halte ich für gut, nur lässt es sich nicht validieren.
Schade, Schade ...
dito, bin heute morgen raus,
der Preis augenblicklich viel zu hoch mit dem Lanstead Deal im Nacken (10 Prozent Discount) ... Tim wollte mit dem Lanstead Deal Zeit gewinnen. Die hat er jetzt.Diese ganzen Interviews mit ihm und dem "Inder" auf Proactive Investor könnten auch aus meiner Sicht getürkt gewesen sein, um diesen Szenario zu ermöglichen.
Mit Lupus gibt das aus meiner Sicht nix mehr. Aber auch keine andere Wirksamkeit abgefallen. Wie schade auch für Sylvaine Muller. P 140 halte ich für gut, nur lässt es sich nicht validieren.
Schade, Schade ...
Gibt es irgendwelche Termine, die man sich vormerken sollte hier oder ist jetzt für lange Zeit tote Hose?
Interview von McCarthy mit Details zum Landstead Deal und zur open-label extension Studie
https://www.proactiveinvestors.co.uk/companies/stocktube/139…
https://www.proactiveinvestors.co.uk/companies/stocktube/139…
Jetzt sind die 10 Cent auch noch gefallen, na toll.
Moin, hat man hier mal eben einen Resplit vollzogen 🙄
Antwort auf Beitrag Nr.: 61.101.145 von lobberland am 25.07.19 09:11:34Hmm....scheinbar doch kein Resplitt..
was sind das für Kurse die über Tradegate angezeigt werden?
Kann zwar nix verkaufen, aber sieht geil aus im Depot
was sind das für Kurse die über Tradegate angezeigt werden?
Kann zwar nix verkaufen, aber sieht geil aus im Depot

Antwort auf Beitrag Nr.: 61.103.374 von lobberland am 25.07.19 12:47:13
Boa, drei Sekunden Atemstillstand. Leider nur ein Fehler in der Anzeige. Sch...ade.
Schlagartig reich
heute früh bei Consors sind aus meinen 10.000 Shares über 100.000 EUR geworden 😂😂😂Boa, drei Sekunden Atemstillstand. Leider nur ein Fehler in der Anzeige. Sch...ade.
Antwort auf Beitrag Nr.: 61.105.357 von HH-ahoi2 am 25.07.19 16:04:36Ja 😋 mir ist auch nur ein Screenshot übrig geblieben von der ganzen Kohle
Antwort auf Beitrag Nr.: 61.105.408 von lobberland am 25.07.19 16:08:59
Screenshot ....
Genau den musste ich auch zwanghaft machen, sooooo ein schöner Anblick 😎
Antwort auf Beitrag Nr.: 61.105.357 von HH-ahoi2 am 25.07.19 16:04:36Knapp 100000 steht bei mir auch. Leider in der falschen Farbe :-(
Heute mal wieder mit relativ hohem Volumen ein kleines Lebenszeichen...
Allerdings habe ich meine Stücke so gut wie schon abgeschrieben, was soll noch passieren bei dem Schuppen...🙄
Allerdings habe ich meine Stücke so gut wie schon abgeschrieben, was soll noch passieren bei dem Schuppen...🙄
das zeug von merk
soll angeblich brandgefährlich sein..haben die ihre finger mit im spiel?
Antwort auf Beitrag Nr.: 61.393.016 von lamaro am 02.09.19 15:50:15
Merck
Welches Produkt ist gemeint?
ImmuPharma and Avion Pharmaceuticals sign exclusive licence and development agreement and trademark agreement for Lupuzor™ with Avion to fund new international Phase III trial and commercialise in the US!!!!
Antwort auf Beitrag Nr.: 62.031.266 von techinvestor69 am 28.11.19 08:16:13Hast en link zur meldung?thanks
Ui, doch nicht tot Lupuzor 😏
Neue PIII nächstes Jahr.
Wollte meine Anteile fast schon die Tage über verkaufen wg. steuerlichen Gründen.
Mal gespannt, was der Kurs heute macht...
Neue PIII nächstes Jahr.
Wollte meine Anteile fast schon die Tage über verkaufen wg. steuerlichen Gründen.
Mal gespannt, was der Kurs heute macht...
50-100% Plus sollte die Meldung über kurz oder lang drin sein, was meint ihr?
Antwort auf Beitrag Nr.: 62.031.950 von Stoxtrayder am 28.11.19 09:13:52
Ist bereits +100%
Zitat von Stoxtrayder: 50-100% Plus sollte die Meldung über kurz oder lang drin sein, was meint ihr?
Ist bereits +100%
Just in dem Moment meines Postings wurde der erste Kurs bei Tradegate mit 0,149 gestellt...😉
Richtig gut Volumen & jetzt schon bei 16 Pence...
200% nun. Nicht schlecht. Ich investiere vorerst nicht und warte 2020 2H ab.
25 Pence, Wahnsinn 💪
Wenn’s so weitergeht bin ich meinem durchschnittlichen EK von 0,56 Euro heute noch im Plus...😜
Wenn’s so weitergeht bin ich meinem durchschnittlichen EK von 0,56 Euro heute noch im Plus...😜
Antwort auf Beitrag Nr.: 62.033.543 von techxxnine am 28.11.19 11:27:37In der Spitze fast 300% !
So wie die ungerechtfertig abgestraft wurden ist das auch fast zu erwarten gewesen bei der richtigen News. Leider hab auch ich die Geduld verloren und keine Hoffnung mehr gehabt. Schade hätte sich echt gelohnt!
Gruß aaahhh
So wie die ungerechtfertig abgestraft wurden ist das auch fast zu erwarten gewesen bei der richtigen News. Leider hab auch ich die Geduld verloren und keine Hoffnung mehr gehabt. Schade hätte sich echt gelohnt!
Gruß aaahhh
Ich brauch noch ein bißchen zum EK,dann hoffe ich verlustfrei verkaufen zu können :-)!
Auch wenn es super währe , bis 0,56 dauert wohl noch eine ganze Weile .
Aber immerhin besteht jetzt wieder Hoffnung
Aber immerhin besteht jetzt wieder Hoffnung
Tageshoch wird wieder in Angriff genommen...es wird gekauft, als gäbe es keinen morgen...
Wo meint ihr denn führt die Reise hin? Lohnt sich der Einstieg noch, war mir bis vor 5 Minuten nicht bekannt! Danke euch
Jetzt, da man weiß, es gibt noch Lebenszeichen im Lupuzor, jetzt kann man wieder einsteigen oder versuchen alte Depot-Leichen zu verbilligen.
Bis wohin der Preis gehen kann zeigt die Geschichte. Vor 2 Jahren hing auch alles nur am Lupusor.
Bis wohin der Preis gehen kann zeigt die Geschichte. Vor 2 Jahren hing auch alles nur am Lupusor.
Antwort auf Beitrag Nr.: 62.034.035 von aaahhh am 28.11.19 12:21:26Bist du noch rein? Wann ist hier denn mit Daten zu rechnen?
Antwort auf Beitrag Nr.: 62.036.384 von E_Nichtlustig am 28.11.19 16:20:25Naja Leichen habe ich woanders aber zum Glück nicht hier! Danke für die Infos und wie lange kann das alles noch dauern? Gibt es Termine?
https://www.proactiveinvestors.co.uk/companies/news/908096/i…
Hm, ob ich jetzt noch einsteigen würde?! Gute Frage...
Ich bin froh, daß meine Anteile seit heute wieder was wert sind, der Kurs so explodiert ist mit dieser News. Wobei ich fast heute nachmittag daran gedacht habe, bei 30 Pence zu verkaufen...🤔
Bis eine Zulassung kommen sollte, vergehen ja wieder mind. 2 Jahre...
Wobei wir dann schon beim Thema ‘sollte’ wären...
ImmuPharma & Avion sind wohl weiterhin sehr überzeugt von Lupozor, sonst hätte es die heutige Meldung nicht gegeben.
Aber warum ist man so überzeugt? PIII & Open Label Studie sind gescheitert. Will man die Dosierung erhöhen? Das würde mich brennend interessieren und auch wie man das Studiendesign in Q1/20 angehen wird...
Hm, ob ich jetzt noch einsteigen würde?! Gute Frage...
Ich bin froh, daß meine Anteile seit heute wieder was wert sind, der Kurs so explodiert ist mit dieser News. Wobei ich fast heute nachmittag daran gedacht habe, bei 30 Pence zu verkaufen...🤔
Bis eine Zulassung kommen sollte, vergehen ja wieder mind. 2 Jahre...
Wobei wir dann schon beim Thema ‘sollte’ wären...
ImmuPharma & Avion sind wohl weiterhin sehr überzeugt von Lupozor, sonst hätte es die heutige Meldung nicht gegeben.
Aber warum ist man so überzeugt? PIII & Open Label Studie sind gescheitert. Will man die Dosierung erhöhen? Das würde mich brennend interessieren und auch wie man das Studiendesign in Q1/20 angehen wird...
War das nicht so das man eine bestimmte Gruppe ausmachen konnte bei der es gut wirkt ? Evtl dann speziell auf diese zuschneiden ? Sorry bin nicht so richtig drin
Sauber danke erstmal für die Info, der Laden war mir halt neu und bei 300% wird man einfach neugierig. Klar kann keiner hellsehen aber ab und zu weghaben wir alle zusammen ja auch mal Glück nä 🤗💰💰💰
Soooo isses, Glück haben gehört an der Börse auch dazu 🙂
Auch wenn ich noch 40% im Minus bin, genehme ich mir auf die knapp 300% Kursgewinn heute ‘nen Rotling 🍷
Viele im UK-Board gehen morgen von weiteren Kursgewinnen aus, wenn sich die heutige News noch weiter verbreitet. Evtl. werden auch paar US-Boys zugreifen?!
Kursprognose ist natürlich weiterhin schwierig, jedoch glaub ich nicht, daß die Aktie nochmals unter 20 Pence fällt. Falls die weitere Finanzierung von Immupharma die nächsten 2 Jahre gesichert ist, gehe ich bis zur Auswertung (Mitte/Ende 2021?) der neuen PIII von Kursen zw. 50-100 Pence aus. Die Chance auf den Jackpot will sich keiner entgehen lassen. Allein 1,5 Mio Lupus-Patienten in den USA würden bei geschätzten 20k Kosten p.a. locker Blockbusterpotential bieten.
Auch wenn ich noch 40% im Minus bin, genehme ich mir auf die knapp 300% Kursgewinn heute ‘nen Rotling 🍷
Viele im UK-Board gehen morgen von weiteren Kursgewinnen aus, wenn sich die heutige News noch weiter verbreitet. Evtl. werden auch paar US-Boys zugreifen?!
Kursprognose ist natürlich weiterhin schwierig, jedoch glaub ich nicht, daß die Aktie nochmals unter 20 Pence fällt. Falls die weitere Finanzierung von Immupharma die nächsten 2 Jahre gesichert ist, gehe ich bis zur Auswertung (Mitte/Ende 2021?) der neuen PIII von Kursen zw. 50-100 Pence aus. Die Chance auf den Jackpot will sich keiner entgehen lassen. Allein 1,5 Mio Lupus-Patienten in den USA würden bei geschätzten 20k Kosten p.a. locker Blockbusterpotential bieten.
Antwort auf Beitrag Nr.: 62.038.238 von Stoxtrayder am 28.11.19 19:46:30 " Aber warum ist man so überzeugt? PIII & Open Label Studie sind gescheitert. Will man die Dosierung erhöhen? Das würde mich brennend interessieren und auch wie man das Studiendesign in Q1/20 angehen wird.. "
Gescheitert würde ich jetzt nicht unbedingt sagen, die statistische Signifikanz wegen der hohen Ansprechrate in der Plazebogruppe war das Problem.
Hier mal die Übersetzung der News von den Ph 3 Daten vom April 2018:
ImmuPharma PLC ("ImmuPharma" oder das "Unternehmen") Wichtigste Ergebnisse der Phase-III-Studie zu Lupuzor ImmuPharma PLC (LSE: IMM), das auf Arzneimittelforschung und -entwicklung spezialisierte Unternehmen, gibt die Ergebnisse seiner entscheidenden Phase-III-Studie zu Lupuzor bekannt Programm für die potenzielle bahnbrechende Verbindung für Lupus. Wichtige Highlights: · Lupuzor zeigte in der primären Analyse des vollständigen Analysesets aller 202 Patienten (einschließlich Entnahmen, die als Non-Responder gelten) eine überlegene Ansprechrate gegenüber Placebo * (52,5% gegenüber 44,6% "Responder" **). Aufgrund der hohen Ansprechrate in der Placebo-Gruppe konnte aufgrund dieser überlegenen Ansprechrate keine statistische Signifikanz erreicht werden (p = 0,2631) und der primäre Endpunkt der Studie wurde nicht erreicht. · Lupuzor zeigte auch eine überlegene Ansprechrate gegenüber Placebo (68,8% gegenüber 59,2%) bei 153 Patienten, die die Studie abgeschlossen hatten (p-Wert derzeit nicht verfügbar). · Wichtig ist, dass Lupuzor bei Patienten mit Anti-dsDNA-Autoantikörpern (ein anerkannter Biomarker für systemischen Lupus erythematodes (SLE)) eine überlegene Ansprechrate gegenüber Placebo aufwies (61,5% gegenüber 47,3%, p = 0,0967). Darüber hinaus gingen 7,6% dieser Patienten in der Lupuzor-Gruppe zu einer vollständigen Remission über, während es in der Placebo-Gruppe keine waren. · Die Studie bestätigte das hervorragende Sicherheitsprofil von Lupuzor, wobei keine schwerwiegenden unerwünschten Ereignisse gemeldet wurden. · Das Unternehmen ist der Ansicht, dass diese wichtigsten Ergebnisse Belege für die weitere Untersuchung der Entwicklung und Vermarktung von Lupuzor sind, da es Patienten und Ärzten die dringend benötigte wirksame und sichere Behandlung von Lupus anbieten kann. * Basierend auf dem Protokoll und dem allgemein akzeptierten Studiendesign gab es zwei Gruppen von Patienten: (1) Patienten, die Lupuzor plus "Standard of Care" erhielten, und (2) Patienten, die Placebo plus "Standard of Care" erhielten. "Standard of Care" umfasst die Behandlung mit anderen Arzneimitteln wie Steroiden, Malariamitteln, Methotrexat usw. Es ist wichtig zu beachten, dass es keine Patienten gibt, die nur mit Placebo behandelt wurden, sondern alle andere erhielten medikamentöse Behandlungen. ** Die Definition eines "Responders" basiert auf dem SLE-Responder-Index (SRI-4), für den eine Reduzierung um mindestens vier Punkte erforderlich ist. Daher werden Patienten, die sich um weniger als vier Punkte verbessern, als Non-Responder gezählt, es wird jedoch auch kein Unterschied zwischen Patienten gemacht, die sich um mehr als 4 Punkte verbessern, wobei alle gleich "Responder" sind. Wie bereits angekündigt, hat ImmuPharma auf Anfrage von Prüfärzten und Patienten, die an der Phase-III-Studie beteiligt sind, eine zusätzliche Studie gestartet, in der allen Patienten, die an der Phase-III-Studie teilgenommen haben, die Einnahme von Lupuzor (plus "Standard of Care") für sechs Jahre gestattet wird Monate in einem Open-Label-System. Die Ergebnisse werden unabhängig von der entscheidenden Phase-III-Studie als offene "Extension" -Studie gesammelt. Das Unternehmen freut sich darauf, zu gegebener Zeit weitere Informationen zu dieser Studie zur Verfügung zu stellen.
Gruß aaahhh
Gescheitert würde ich jetzt nicht unbedingt sagen, die statistische Signifikanz wegen der hohen Ansprechrate in der Plazebogruppe war das Problem.
Hier mal die Übersetzung der News von den Ph 3 Daten vom April 2018:
ImmuPharma PLC ("ImmuPharma" oder das "Unternehmen") Wichtigste Ergebnisse der Phase-III-Studie zu Lupuzor ImmuPharma PLC (LSE: IMM), das auf Arzneimittelforschung und -entwicklung spezialisierte Unternehmen, gibt die Ergebnisse seiner entscheidenden Phase-III-Studie zu Lupuzor bekannt Programm für die potenzielle bahnbrechende Verbindung für Lupus. Wichtige Highlights: · Lupuzor zeigte in der primären Analyse des vollständigen Analysesets aller 202 Patienten (einschließlich Entnahmen, die als Non-Responder gelten) eine überlegene Ansprechrate gegenüber Placebo * (52,5% gegenüber 44,6% "Responder" **). Aufgrund der hohen Ansprechrate in der Placebo-Gruppe konnte aufgrund dieser überlegenen Ansprechrate keine statistische Signifikanz erreicht werden (p = 0,2631) und der primäre Endpunkt der Studie wurde nicht erreicht. · Lupuzor zeigte auch eine überlegene Ansprechrate gegenüber Placebo (68,8% gegenüber 59,2%) bei 153 Patienten, die die Studie abgeschlossen hatten (p-Wert derzeit nicht verfügbar). · Wichtig ist, dass Lupuzor bei Patienten mit Anti-dsDNA-Autoantikörpern (ein anerkannter Biomarker für systemischen Lupus erythematodes (SLE)) eine überlegene Ansprechrate gegenüber Placebo aufwies (61,5% gegenüber 47,3%, p = 0,0967). Darüber hinaus gingen 7,6% dieser Patienten in der Lupuzor-Gruppe zu einer vollständigen Remission über, während es in der Placebo-Gruppe keine waren. · Die Studie bestätigte das hervorragende Sicherheitsprofil von Lupuzor, wobei keine schwerwiegenden unerwünschten Ereignisse gemeldet wurden. · Das Unternehmen ist der Ansicht, dass diese wichtigsten Ergebnisse Belege für die weitere Untersuchung der Entwicklung und Vermarktung von Lupuzor sind, da es Patienten und Ärzten die dringend benötigte wirksame und sichere Behandlung von Lupus anbieten kann. * Basierend auf dem Protokoll und dem allgemein akzeptierten Studiendesign gab es zwei Gruppen von Patienten: (1) Patienten, die Lupuzor plus "Standard of Care" erhielten, und (2) Patienten, die Placebo plus "Standard of Care" erhielten. "Standard of Care" umfasst die Behandlung mit anderen Arzneimitteln wie Steroiden, Malariamitteln, Methotrexat usw. Es ist wichtig zu beachten, dass es keine Patienten gibt, die nur mit Placebo behandelt wurden, sondern alle andere erhielten medikamentöse Behandlungen. ** Die Definition eines "Responders" basiert auf dem SLE-Responder-Index (SRI-4), für den eine Reduzierung um mindestens vier Punkte erforderlich ist. Daher werden Patienten, die sich um weniger als vier Punkte verbessern, als Non-Responder gezählt, es wird jedoch auch kein Unterschied zwischen Patienten gemacht, die sich um mehr als 4 Punkte verbessern, wobei alle gleich "Responder" sind. Wie bereits angekündigt, hat ImmuPharma auf Anfrage von Prüfärzten und Patienten, die an der Phase-III-Studie beteiligt sind, eine zusätzliche Studie gestartet, in der allen Patienten, die an der Phase-III-Studie teilgenommen haben, die Einnahme von Lupuzor (plus "Standard of Care") für sechs Jahre gestattet wird Monate in einem Open-Label-System. Die Ergebnisse werden unabhängig von der entscheidenden Phase-III-Studie als offene "Extension" -Studie gesammelt. Das Unternehmen freut sich darauf, zu gegebener Zeit weitere Informationen zu dieser Studie zur Verfügung zu stellen.
Gruß aaahhh
Yep, stimmt aaahh!
Ich darf mal aus den UK-Forum zitieren: 😉
Everything you touch go to pieces, but if you still want to try again, look at the chart of last Year IMM did reach over 180p on expectations of what is happening now, and Avion is not a second class pharma. You need to read more and less ask. What the CEO said Chief executive Dimitri Dimitriou said Avion had a strong track record of taking late stage drugs through the regulatory process and onto commercialisation. “Importantly, [its] specialist sales team is well respected within the rheumatologist community, whose focus is on prescribing safe and efficacious treatments for auto-immune diseases such as lupus. This makes it a perfect fit for Lupuzor.” Important validation The Avion deal has effectively vindicated management’s faith in the drug, which missed its primary endpoint in a phase III study last year. Experts and those who had followed ImmuPharma for some time said the outcome of the phase III was far more nuanced than the top-line results suggested and showed that Lupuzor worked well in certain patients, chiefly those who were antibody-positive. After the end of the trial, 62 patients took part in a follow-up study – called an open-label extension study. Results released in July confirmed Lupuzor’s “outstanding and robust safety profile”, with no serious adverse events reported. On top of that, ImmuPharma was also able to show a third of the patients taking the drug were in remission at the end of the assessment. Another 500 lupus sufferers are being given access to Lupuzor for the next two years as part of a managed access programme.
Btw. hat Benlysta mittlerweile Umsätze von 900 Mio. $ auf’s Jahr hochgerechnet. Jedoch hat dies bei Lupus-Patienten teilweise sehr schlechte Nebenwirkungen...
Je mehr ich darüber nachdenke & recherchiere, kann ich mir gut vorstellen, daß der Kurs in nächster Zeit recht schnell Richtung 50 Pence marschieren könnte...
Ich darf mal aus den UK-Forum zitieren: 😉
Everything you touch go to pieces, but if you still want to try again, look at the chart of last Year IMM did reach over 180p on expectations of what is happening now, and Avion is not a second class pharma. You need to read more and less ask. What the CEO said Chief executive Dimitri Dimitriou said Avion had a strong track record of taking late stage drugs through the regulatory process and onto commercialisation. “Importantly, [its] specialist sales team is well respected within the rheumatologist community, whose focus is on prescribing safe and efficacious treatments for auto-immune diseases such as lupus. This makes it a perfect fit for Lupuzor.” Important validation The Avion deal has effectively vindicated management’s faith in the drug, which missed its primary endpoint in a phase III study last year. Experts and those who had followed ImmuPharma for some time said the outcome of the phase III was far more nuanced than the top-line results suggested and showed that Lupuzor worked well in certain patients, chiefly those who were antibody-positive. After the end of the trial, 62 patients took part in a follow-up study – called an open-label extension study. Results released in July confirmed Lupuzor’s “outstanding and robust safety profile”, with no serious adverse events reported. On top of that, ImmuPharma was also able to show a third of the patients taking the drug were in remission at the end of the assessment. Another 500 lupus sufferers are being given access to Lupuzor for the next two years as part of a managed access programme.
Btw. hat Benlysta mittlerweile Umsätze von 900 Mio. $ auf’s Jahr hochgerechnet. Jedoch hat dies bei Lupus-Patienten teilweise sehr schlechte Nebenwirkungen...
Je mehr ich darüber nachdenke & recherchiere, kann ich mir gut vorstellen, daß der Kurs in nächster Zeit recht schnell Richtung 50 Pence marschieren könnte...
Antwort auf Beitrag Nr.: 62.039.780 von Stoxtrayder am 29.11.19 02:05:41Der Preis wird definitiv noch steigen, aber bei all der momentanen Euphorie darf man nicht vergessen, dass die ganzen Gelder und Milestone-Zahlungen durch Avion erst in 2-3 Jahren eintreffen werden (wenn überhaupt) und bis dahin muss sich Immupharma selbst noch über Wasser halten, die Mitarbeiter und das Management zahlen usw. Ende Juni waren noch 2,3 Mio GBP übrig, Cash dürfte also mittlerweile knapp werden. Wo kommt frisches Geld her? Divest von Ureka oder Elro? Aus dem Incanthera-Deal? Nachtigall, ick hör dir trapsen: KE ist nicht sehr unwahrscheinlich.
Wie auch immer, ich bin erstmal sehr froh, dass sich endlich wieder was tut, nachdem ich seit 2 Jahren durch das Tal der Tränen mit diesem Invest wandere...
Wie auch immer, ich bin erstmal sehr froh, dass sich endlich wieder was tut, nachdem ich seit 2 Jahren durch das Tal der Tränen mit diesem Invest wandere...
Ich warte.
- Evtl. KE
- P3 muss positiv sein
- 1x P3 muss ausreichen / NDA muss akzeptiert werden
- PDUFA positiv
Wenn alles glatt läuft, wäre das Ding in 2021 genehmigt. Wenn hier noch mehr Studien gefordert werden oder NDA not accepted / CRL, kann es gut und gerne bis 2023 / 24 gehen.
Wenn die FDA Immupharma genug Steine in den Weg legt, könnte Avion ganz einfach vom Vertrag zurücktreten bzw. nur die P3 bezahlen.
- Evtl. KE
- P3 muss positiv sein
- 1x P3 muss ausreichen / NDA muss akzeptiert werden
- PDUFA positiv
Wenn alles glatt läuft, wäre das Ding in 2021 genehmigt. Wenn hier noch mehr Studien gefordert werden oder NDA not accepted / CRL, kann es gut und gerne bis 2023 / 24 gehen.
Wenn die FDA Immupharma genug Steine in den Weg legt, könnte Avion ganz einfach vom Vertrag zurücktreten bzw. nur die P3 bezahlen.
Antwort auf Beitrag Nr.: 62.042.576 von techxxnine am 29.11.19 12:49:22Vermutlich orientieren sich im Moment viele an dem Kurs im Vorlauf der Daten für Ph 3 in 2017. Der lag so zw. 50p und 60 p , bevor dann die steigende Euphorie für noch deutlichere Kurststeigerungen sorgte.
Aber bis zu diesem Punkt ist es ja noch ein Stück, wie du richtig bemerkt hast. Denke man kann mit einem neuerlichen Invest in Immu noch warten und weiter beobachten. Ob die 300% jetzt bröckeln oder der Kurs bis zu den 50p oder 60p rennt ist schwer einzuschätzen, hängt auch davon ab, wann eine KE ansteht. Ich vermute eher ein Bröckeln, vielleicht auch Wunschdenken, weil ich gerade nicht investiert bin.
Gruß aaahhh
Aber bis zu diesem Punkt ist es ja noch ein Stück, wie du richtig bemerkt hast. Denke man kann mit einem neuerlichen Invest in Immu noch warten und weiter beobachten. Ob die 300% jetzt bröckeln oder der Kurs bis zu den 50p oder 60p rennt ist schwer einzuschätzen, hängt auch davon ab, wann eine KE ansteht. Ich vermute eher ein Bröckeln, vielleicht auch Wunschdenken, weil ich gerade nicht investiert bin.
Gruß aaahhh
Naja, wo soll sie denn bröckeln, wieder Richtung 10 Pence? Glaub ich wie gesagt, auf Dauer nicht...
Was ist eigentlich wenn man mit Big Pharma einen ähnlichen Deal für die Lizenzrechte EU/Rest of World aushandelt? Hat dann wohl auch keiner auf den Schirm...
Was ist eigentlich wenn man mit Big Pharma einen ähnlichen Deal für die Lizenzrechte EU/Rest of World aushandelt? Hat dann wohl auch keiner auf den Schirm...
50%iges Intraday-Reversal heute.
Wie gesagt, unter 20 Pence wird es imho über kurz oder lang keine Anteile mehr geben...
Upside-Potential mehrere 100% Plus bis 2022ff.
Wie gesagt, unter 20 Pence wird es imho über kurz oder lang keine Anteile mehr geben...
Upside-Potential mehrere 100% Plus bis 2022ff.
Antwort auf Beitrag Nr.: 62.049.098 von Stoxtrayder am 30.11.19 14:30:47Naja, wo soll sie denn bröckeln, wieder Richtung 10 Pence? Glaub ich wie gesagt, auf Dauer nicht...
Auf Dauer nicht, aber dass 300% abverkauft werden, wenigstens zum Teil, ist eigentlich zu erwarten gewesen. Noch haben die 19 P gehalten, für heute.
Gruß aaahhh
Auf Dauer nicht, aber dass 300% abverkauft werden, wenigstens zum Teil, ist eigentlich zu erwarten gewesen. Noch haben die 19 P gehalten, für heute.
Gruß aaahhh
Antwort auf Beitrag Nr.: 62.087.105 von Stoxtrayder am 05.12.19 13:43:33Danke für den Link. Das Interview liest sich doch ganz optimistisch.
Schöne RNS. Damit sind meine Bedenken erstmal zerstreut. Bin gespannt, ob das dem Kurs nachhaltig hilft
Antwort auf Beitrag Nr.: 62.132.459 von Twohybrid am 11.12.19 14:15:23Wie schon vermutet bröckelt der Kurs weiter, läuft auf eine 50% oder 60% Korrektur des Anstieges hinaus. Erste Order bei 16,xx wäre nicht verkehrt.
Gruß aaahhh
Gruß aaahhh
RNS: Duales Listing bei Euronext. Auch jetzt nicht gerade eine Nachricht zum Trauern... :-D
Antwort auf Beitrag Nr.: 62.141.009 von aaahhh am 12.12.19 11:40:31
Limitorder hat gegriffen, ging zwar leicht unter die 16p, aber ok. Mal sehen wie weit sie diesmal läuft.
Gruß aaahhh
Zitat von aaahhh: Wie schon vermutet bröckelt der Kurs weiter, läuft auf eine 50% oder 60% Korrektur des Anstieges hinaus. Erste Order bei 16,xx wäre nicht verkehrt.
Gruß aaahhh
Limitorder hat gegriffen, ging zwar leicht unter die 16p, aber ok. Mal sehen wie weit sie diesmal läuft.
Gruß aaahhh
Moin @aaahhh Ich bin nach wie vor hier Investiert , habe nichts verkauft . Allerdings habe ich zwischen 0,13 und 0,15 beim ersten Abtauchen auch kräftig verbilligt. Ich kann mir einfach immer noch nicht vorstellen , dass Lupuzor keinen Wert mehr da stellen soll.
Ich vergleiche Immu gerne mit Sirona , auf die auch keiner mehr ein Pfifferling gegeben hat , aber wie Phönix aus der Asche gekrochen sind.
So nun wünsche ich Dir , und allen anderen ein schönes Fest und guten Rutsch ins 2020 ....man begegnet Sich👍
Ich vergleiche Immu gerne mit Sirona , auf die auch keiner mehr ein Pfifferling gegeben hat , aber wie Phönix aus der Asche gekrochen sind.
So nun wünsche ich Dir , und allen anderen ein schönes Fest und guten Rutsch ins 2020 ....man begegnet Sich👍
Antwort auf Beitrag Nr.: 62.219.021 von swoasik am 23.12.19 09:28:58Hi,
ja das wünsche ich dir/uns allen auch! Leider vergessen viele hier bei WO allzuoft dass wir doch alle im gleichen Boot sitzen und das Gleiche wollen,nämlich steigende Kurse und gute Gewinne. Du gehörst definitiv zu jenen, die ich immer wieder gerne lese! Vielleicht kapieren das auch mal die ganzen WO Trolle, wäre ein schöner Wunsch fürs neue Jahr!
Gruß aaahhh 🎄🎅🎁
ja das wünsche ich dir/uns allen auch! Leider vergessen viele hier bei WO allzuoft dass wir doch alle im gleichen Boot sitzen und das Gleiche wollen,nämlich steigende Kurse und gute Gewinne. Du gehörst definitiv zu jenen, die ich immer wieder gerne lese! Vielleicht kapieren das auch mal die ganzen WO Trolle, wäre ein schöner Wunsch fürs neue Jahr!
Gruß aaahhh 🎄🎅🎁
Antwort auf Beitrag Nr.: 62.219.021 von swoasik am 23.12.19 09:28:58Na dann möchte ich mich den beiden Vorrednern anschliessen und meinen Bestand seit Ende 2016 mit jetziger Aufstockung (EK jetzt um die 16 GBp) mitteilen.
Habe zwar überlegt beim kurzfristigen Anstieg, Teile zu verkaufen, war aber zu spät dran.
Ihr seid nicht allein und ich kann mir die FDA nicht vorstellen mit einer weiteren Ablehnung.
Der damalige Antrag war ohne „grossen Bruder in den USA“ gestellt worden und war zu provinziell.
Jetzt sollte es anders angepackt werden mit Mut und etwas frischen Wind und den richtigen Fakten lässt sich der Weg zum Ziel beenden.
In diesem Sinne besinnliche und frohe Tage wünscht RS😎
Habe zwar überlegt beim kurzfristigen Anstieg, Teile zu verkaufen, war aber zu spät dran.
Ihr seid nicht allein und ich kann mir die FDA nicht vorstellen mit einer weiteren Ablehnung.
Der damalige Antrag war ohne „grossen Bruder in den USA“ gestellt worden und war zu provinziell.
Jetzt sollte es anders angepackt werden mit Mut und etwas frischen Wind und den richtigen Fakten lässt sich der Weg zum Ziel beenden.
In diesem Sinne besinnliche und frohe Tage wünscht RS😎
06 February 2020
ImmuPharma PLC
("ImmuPharma" or the "Company")
ImmuPharma provides an update on the Avion Agreement in relation to
Lupuzor™'s new international Phase III trial
ImmuPharma PLC (LSE AIM: IMM - Euronext Growth: ALIMM), a specialist drug discovery and development company, announces an update on activities with Avion Pharmaceuticals LLC ("Avion") following the successful licence and development agreement signed with Avion in November 2019 for the exclusive rights to Lupuzor™ in North America (United States).
A summary of key activities completed since November 2019
•First joint steering committee ("JSC") completed in December 2019 to identify and agree the optimised Phase III study design for Lupuzor™ including a focus on those patients presenting with the biomarker anti-dsDNA autoantibody positive
•Confirmation that the JSC wish to progress Lupuzor™ into its second international Phase III clinical trial as soon as possible this year
•Avion and ImmuPharma to meet with the FDA in Q1 2020 to discuss guidance on a new optimised international Phase III trial protocol
•Positive discussions with a number of potential commercial partners of Lupuzor™ outside of the US
Summary of the Avion Agreement
•ImmuPharma retains all the rights to commercialise Lupuzor™, outside of the US, either through distribution partnerships or directly by ImmuPharma
•Avion will fund the full expected costs of the new Phase III trial up to $25 million
•ImmuPharma will receive milestone payments of up to $70 million. A $5 million milestone payment will be paid on regulatory approval of Lupuzor™ in lupus, and $65 million will be based on achievement of overall sales targets
•ImmuPharma will also receive $5 million for each additional approval, other than lupus, as Avion also has the rights, for the US, to explore further opportunities within Lupuzor™'s peptide platform for other auto-immune indications outside of lupus
•ImmuPharma will receive from Avion tiered double-digit royalties up to 17 percent, according to pre-specified annual US sales targets
•Avion has the right to use relevant trademarks for the development, manufacture and commercialisation of products
Commenting on the announcement, Dimitri Dimitriou, ImmuPharma's Chief Executive Officer and Robert Zimmer, President & Chief Scientific Officer, said: "We are delighted with the positive and proactive progress made since entering into this partnership with Avion in November last year. Both companies are focused on expediting Lupuzor™ into a new optimised international Phase III study as soon as possible this year after discussions with the FDA over the next period. In parallel, we have entered into positive discussions with a number of potential commercial partners for Lupuzor™ outside of the US. We are in a new chapter within ImmuPharma's history, with the investment thesis for the Company and specifically Lupuzor™ being repositioned and we look forward to providing further updates on progress with shareholders over the next period."
Art Deas, Chief Executive Officer, Avion Pharmaceuticals added: "Avion is extremely pleased with the partnership with ImmuPharma. We believe that Lupuzor™ has a unique position within lupus that sets it apart from competition, and we are delighted to be extending our footprint within this therapeutic area. We are committed on moving Lupuzor™ into a new Phase III trial as quickly as possible this year. We look forward to continuing to make successful strides in the relationship with ImmuPharma going forward."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
ImmuPharma PLC
("ImmuPharma" or the "Company")
ImmuPharma provides an update on the Avion Agreement in relation to
Lupuzor™'s new international Phase III trial
ImmuPharma PLC (LSE AIM: IMM - Euronext Growth: ALIMM), a specialist drug discovery and development company, announces an update on activities with Avion Pharmaceuticals LLC ("Avion") following the successful licence and development agreement signed with Avion in November 2019 for the exclusive rights to Lupuzor™ in North America (United States).
A summary of key activities completed since November 2019
•First joint steering committee ("JSC") completed in December 2019 to identify and agree the optimised Phase III study design for Lupuzor™ including a focus on those patients presenting with the biomarker anti-dsDNA autoantibody positive
•Confirmation that the JSC wish to progress Lupuzor™ into its second international Phase III clinical trial as soon as possible this year
•Avion and ImmuPharma to meet with the FDA in Q1 2020 to discuss guidance on a new optimised international Phase III trial protocol
•Positive discussions with a number of potential commercial partners of Lupuzor™ outside of the US
Summary of the Avion Agreement
•ImmuPharma retains all the rights to commercialise Lupuzor™, outside of the US, either through distribution partnerships or directly by ImmuPharma
•Avion will fund the full expected costs of the new Phase III trial up to $25 million
•ImmuPharma will receive milestone payments of up to $70 million. A $5 million milestone payment will be paid on regulatory approval of Lupuzor™ in lupus, and $65 million will be based on achievement of overall sales targets
•ImmuPharma will also receive $5 million for each additional approval, other than lupus, as Avion also has the rights, for the US, to explore further opportunities within Lupuzor™'s peptide platform for other auto-immune indications outside of lupus
•ImmuPharma will receive from Avion tiered double-digit royalties up to 17 percent, according to pre-specified annual US sales targets
•Avion has the right to use relevant trademarks for the development, manufacture and commercialisation of products
Commenting on the announcement, Dimitri Dimitriou, ImmuPharma's Chief Executive Officer and Robert Zimmer, President & Chief Scientific Officer, said: "We are delighted with the positive and proactive progress made since entering into this partnership with Avion in November last year. Both companies are focused on expediting Lupuzor™ into a new optimised international Phase III study as soon as possible this year after discussions with the FDA over the next period. In parallel, we have entered into positive discussions with a number of potential commercial partners for Lupuzor™ outside of the US. We are in a new chapter within ImmuPharma's history, with the investment thesis for the Company and specifically Lupuzor™ being repositioned and we look forward to providing further updates on progress with shareholders over the next period."
Art Deas, Chief Executive Officer, Avion Pharmaceuticals added: "Avion is extremely pleased with the partnership with ImmuPharma. We believe that Lupuzor™ has a unique position within lupus that sets it apart from competition, and we are delighted to be extending our footprint within this therapeutic area. We are committed on moving Lupuzor™ into a new Phase III trial as quickly as possible this year. We look forward to continuing to make successful strides in the relationship with ImmuPharma going forward."
This announcement contains inside information for the purposes of Article 7 of Regulation (EU) 596/2014. ("MAR")
Antwort auf Beitrag Nr.: 62.602.381 von Twohybrid am 06.02.20 13:48:42hallo, hier nochmal übersetzt. Hört sich gut an. wann wird dieses treffen im 1Q mit der FDA genau sein?
"2020 ImmuPharma PLC ("ImmuPharma" oder das "Unternehmen") ImmuPharma bietet ein Update zum Avion-Abkommen in Bezug auf Die neue internationale Phase III-Studie von Lupuzor ™ ImmuPharma PLC (LSE ZIEL: IMM - Euronext Wachstum: ALIMM), ein Spezialist für die Entdeckung von Arzneimitteln und Entwicklungsunternehmen gibt Aktualisierung der Aktivitäten mit Avion Pharmaceuticals LLC („Avion“) bekannt Nach der erfolgreichen Lizenz- und Entwicklungsvereinbarung mit Avion im November 2019 für die exklusiven Rechte für Lupuzor ™ in Nordamerika (USA). Eine Zusammenfassung der wichtigsten Aktivitäten, die seit November 2019 abgeschlossen wurden • Erster gemeinsamer Lenkungsausschuss (Joint Steering Committee, JSC), der im Dezember 2019 abgeschlossen wurde, um zu ermitteln und zuzustimmen das optimierte Phase-III-Studiendesign für Lupuzor ™ mit Schwerpunkt auf diesen Patienten Präsentation mit dem Biomarker anti-dsDNA Autoantikörper positiv • Bestätigung, dass das JSC Lupuzor ™ in seine zweite internationale Phase III einführen möchte klinische Studie so bald wie möglich in diesem Jahr • Avion und ImmuPharma treffen sich im ersten Quartal 2020 mit der FDA, um Leitlinien für eine neue zu erörtern optimiertes internationales Phase-III-Studienprotokoll • Positive Gespräche mit einer Reihe potenzieller Handelspartner von Lupuzor ™ außerhalb der USA Zusammenfassung des Avion-Abkommens • ImmuPharma behält sich alle Rechte vor, Lupuzor ™ außerhalb der USA zu kommerzialisieren, entweder durch Vertriebspartnerschaften oder direkt von ImmuPharma • Avion wird die vollen erwarteten Kosten der neuen Phase-III-Studie mit bis zu 25 Mio. USD finanzieren • ImmuPharma erhält Meilensteinzahlungen von bis zu 70 Millionen US-Dollar. Eine Meilensteinzahlung in Höhe von 5 Millionen US-Dollar wird nach der behördlichen Zulassung von Lupuzor ™ in Lupus gezahlt und basiert auf 65 Millionen US-Dollar Erreichung der Gesamtumsatzziele • ImmuPharma erhält zusätzlich zu Lupus als Avion 5 Millionen US-Dollar für jede weitere Zulassung Darüber hinaus haben die USA das Recht, weitere Möglichkeiten innerhalb der Peptidplattform von Lupuzor ™ zu erkunden für andere Autoimmunindikationen außerhalb von Lupus • ImmuPharma erhält von Avion gestaffelte zweistellige Lizenzgebühren von bis zu 17 Prozent im Voraus festgelegte jährliche Umsatzziele für die USA • Avion ist berechtigt, relevante Marken für die Entwicklung, Herstellung und Verwendung von Kommerzialisierung von Produkten Zu der Ankündigung äußerten sich Dimitri Dimitriou, Chief Executive Officer von ImmuPharma, und Robert Zimmer, President & Chief Scientific Officer, sagte: „Wir freuen uns über das positive und positive Ergebnis proaktive Fortschritte seit dem Abschluss dieser Partnerschaft mit Avion im November letzten Jahres. Beide Unternehmen konzentrieren sich darauf, Lupuzor ™ in eine neue, optimierte internationale Phase-III-Studie zu integrieren bald wie möglich in diesem Jahr nach Gesprächen mit der FDA in der nächsten Zeit. Parallel dazu haben wir mit einer Reihe potenzieller Handelspartner für Lupuzor ™ außerhalb positive Gespräche aufgenommen der USA. Mit der Investitionsthese für die ImmuPharma schlagen wir ein neues Kapitel in der Geschichte der ImmuPharma auf Das Unternehmen und insbesondere Lupuzor ™ werden neu positioniert, und wir freuen uns darauf, weitere Informationen bereitzustellen Aktuelle Informationen zu den Fortschritten mit den Aktionären in der nächsten Periode"
"2020 ImmuPharma PLC ("ImmuPharma" oder das "Unternehmen") ImmuPharma bietet ein Update zum Avion-Abkommen in Bezug auf Die neue internationale Phase III-Studie von Lupuzor ™ ImmuPharma PLC (LSE ZIEL: IMM - Euronext Wachstum: ALIMM), ein Spezialist für die Entdeckung von Arzneimitteln und Entwicklungsunternehmen gibt Aktualisierung der Aktivitäten mit Avion Pharmaceuticals LLC („Avion“) bekannt Nach der erfolgreichen Lizenz- und Entwicklungsvereinbarung mit Avion im November 2019 für die exklusiven Rechte für Lupuzor ™ in Nordamerika (USA). Eine Zusammenfassung der wichtigsten Aktivitäten, die seit November 2019 abgeschlossen wurden • Erster gemeinsamer Lenkungsausschuss (Joint Steering Committee, JSC), der im Dezember 2019 abgeschlossen wurde, um zu ermitteln und zuzustimmen das optimierte Phase-III-Studiendesign für Lupuzor ™ mit Schwerpunkt auf diesen Patienten Präsentation mit dem Biomarker anti-dsDNA Autoantikörper positiv • Bestätigung, dass das JSC Lupuzor ™ in seine zweite internationale Phase III einführen möchte klinische Studie so bald wie möglich in diesem Jahr • Avion und ImmuPharma treffen sich im ersten Quartal 2020 mit der FDA, um Leitlinien für eine neue zu erörtern optimiertes internationales Phase-III-Studienprotokoll • Positive Gespräche mit einer Reihe potenzieller Handelspartner von Lupuzor ™ außerhalb der USA Zusammenfassung des Avion-Abkommens • ImmuPharma behält sich alle Rechte vor, Lupuzor ™ außerhalb der USA zu kommerzialisieren, entweder durch Vertriebspartnerschaften oder direkt von ImmuPharma • Avion wird die vollen erwarteten Kosten der neuen Phase-III-Studie mit bis zu 25 Mio. USD finanzieren • ImmuPharma erhält Meilensteinzahlungen von bis zu 70 Millionen US-Dollar. Eine Meilensteinzahlung in Höhe von 5 Millionen US-Dollar wird nach der behördlichen Zulassung von Lupuzor ™ in Lupus gezahlt und basiert auf 65 Millionen US-Dollar Erreichung der Gesamtumsatzziele • ImmuPharma erhält zusätzlich zu Lupus als Avion 5 Millionen US-Dollar für jede weitere Zulassung Darüber hinaus haben die USA das Recht, weitere Möglichkeiten innerhalb der Peptidplattform von Lupuzor ™ zu erkunden für andere Autoimmunindikationen außerhalb von Lupus • ImmuPharma erhält von Avion gestaffelte zweistellige Lizenzgebühren von bis zu 17 Prozent im Voraus festgelegte jährliche Umsatzziele für die USA • Avion ist berechtigt, relevante Marken für die Entwicklung, Herstellung und Verwendung von Kommerzialisierung von Produkten Zu der Ankündigung äußerten sich Dimitri Dimitriou, Chief Executive Officer von ImmuPharma, und Robert Zimmer, President & Chief Scientific Officer, sagte: „Wir freuen uns über das positive und positive Ergebnis proaktive Fortschritte seit dem Abschluss dieser Partnerschaft mit Avion im November letzten Jahres. Beide Unternehmen konzentrieren sich darauf, Lupuzor ™ in eine neue, optimierte internationale Phase-III-Studie zu integrieren bald wie möglich in diesem Jahr nach Gesprächen mit der FDA in der nächsten Zeit. Parallel dazu haben wir mit einer Reihe potenzieller Handelspartner für Lupuzor ™ außerhalb positive Gespräche aufgenommen der USA. Mit der Investitionsthese für die ImmuPharma schlagen wir ein neues Kapitel in der Geschichte der ImmuPharma auf Das Unternehmen und insbesondere Lupuzor ™ werden neu positioniert, und wir freuen uns darauf, weitere Informationen bereitzustellen Aktuelle Informationen zu den Fortschritten mit den Aktionären in der nächsten Periode"
Antwort auf Beitrag Nr.: 62.663.884 von lobberland am 12.02.20 23:49:33@lobberland
Ein sehr inhaltsreicher Bericht, lesenswert!
Wir haben jetzt einen grossen Bruder, welcher das Geschick in die Hände nimmt und du die Lobby lenkt.
Allerdings sollten wir die Zeitachse nicht aus den Augen verlieren.
Gruss RS😎
Ein sehr inhaltsreicher Bericht, lesenswert!
Wir haben jetzt einen grossen Bruder, welcher das Geschick in die Hände nimmt und du die Lobby lenkt.
Allerdings sollten wir die Zeitachse nicht aus den Augen verlieren.
Gruss RS😎
Q1/2020 ist nun vorbei, hat jemand Infos?
Antwort auf Beitrag Nr.: 63.325.393 von lobberland am 14.04.20 17:46:48Ich hoffe bald macht’s hier Bäm und sie zieht ab 😊
Aus der Q&A session von letzter Woche bei Investor meet company:
Q1: My understanding was that the Company didn't need to raise further capital.....what has changed?
ImmuPharma has expanded its R&D therapy pipeline as announced last week into new areas including programs for CIDP in Lupuzor, BioGlucagon and expanding into anti-infectives with an anti-viral program and also BioAMP-B. This is in line with our long-terms strategy to build a successful and profitable company through enlarging our pipeline. Lanstead Capital, one of our major shareholders together with our Chief Scientific Officer, Dr Robert Zimmer have realised the potential in supporting these advancements, with the recent Subscription, whilst we now engage in partnering opportunities . The Lanstead 'Sharing Agreement' can also provide further support, as illustrated in the 2016 and 2019 subscriptions, as we progress these programs, which should result in an increased payments in parallel with any increase in the share price.
Q2: All being well what would a realistic Lupuzor™ launch date be?
Today in the presentation we gave guidance that the Lupuzor™ Phase III trial, being funded by our US partner, Avion Pharmaceuticals, is expected to commence by the end of this year (2020). It is difficult to predict a launch date but in our previous experience the Phase III trial of Lupuzor lasted approximately 2 years. Lupuzor™ has also Fast Track status so will be reviewed in priority.
Q3: Has the FDA meeting taken place?
As highlighted in the announcement ImmuPharma shared with the market last week and in today's presentation, a number of key activities have happened over the last period. Avion has now signed a collaboration agreement with a leading Lupus patient group and a Board of Key Opinion Leaders has been established. Key decisions/next steps will now be agreed prior to meeting with the FDA. These include:
Structure of optimised intl. Phase III Lupuzor™ trial | Demographics and patient inclusion criteria | Guidance on key territories where trial to be conducted.
It is important to clarify that the meeting with the FDA is expected to only provide further guidance on the structure of the optimised Phase III trial.
Q4: How much have you learnt from the previous Phase 3 and what will be different this time?
As discussed in many presentations and since we announced the Phase III data in April and May of 2018, the key findings regarding the outcome of the trial were based on patient profile. Those lupus patients on active drug, who were anti-dsDNA autoantibody positive showed statistically significant reductions in disease activity than those in the placebo group primarily within the European cohort of the trial. Lessons learned from the previous Phase III trial include patient selection based on profile, the severity of disease and number of patients in the study.
Q5: Why is the Board 'particularly excited' at the potential 'near term commercialisation of Incanthera's lead product Sol for skin cancer and other topical indications?
Just as background, ImmuPharma is a 11.9% shareholder in Incanthera, an oncology specialist which has recently listed on the Acquis Growth Market. Incanthera's lead product Sol” has the potential for near-term revenues in relation to Incanthera’s strategy of commercialising Sol firstly as a cosmetic product (e.g. sun cream including the active ingredient for skin cancer) through a partner and does not require approval by any of the pharmaceutical regulatory agencies (e.g. FDA). Incanthera’s medium term strategy is to follow on (again with a partner) with an application for a pharmaceutical licence, which will require approval by pharmaceutical regulators. So in essence, if Incanthera can secure a licencing deal with a partner firstly as a cosmetic product and very quickly after that be in receipt of royalties from sales of Sol, this would be a key milestone for the business.
Q6: What are the regulatory approval requirements for the BioGlucagon product and progress with the bio equivalence study and related commercial arrangements leading to potential market launch in 2022?
BioGlucagon is progressing through final preparatory work prior to commencing the bio equivalence study in early 2021. As the bio equivalence study is based on the reformulation of the drug including improving solubility and delivery of the drug, it does not need to go through the full Phase I, II, III clinical development. This means that the number of patients will be much smaller and the trial itself will be shorter. Taking these activities into account, we are focused on progressing BioGlucagon through this clinical program. In parallel, due to the improved competitive profile of the drug compared to existing glucagon products in the market, we will also pursue partnering discussions.
Q7: What value-points do the Board expect will generate cash, in the near-term, to adequately support both the R&D strategy and administration costs?
The recent deal with Avion Pharmaceuticals for the US provides the funding for Lupuzor™ and also is linked to substantial cash milestone payments and royalties in the future. We have other partnering opportunities which we are pursuing and positive news flow would increase the financial contribution from our Lanstead deal.
Q8: We had expected the meeting with the FDA to take place in Q1 of 2020. Can you give us a time line for a Meeting with FDA? Start and finish of enrolment for the Phase 111 trial? Completion of Phase III trial? Announcement of results of Phase III? Start of marketing of Lupuzor in North America? It would be good to be told when agreements with other Pharma’s outside the USA will be reached.
We expect that the Lupuzor™ Phase III trial, being funded by our US partner, Avion Pharmaceuticals, should commence by the end of this year (2020), although there may uncertainty due the COVID-19 situation. Further updates on the Phase III trial progress will be shared with the market and shareholders where appropriate over the coming months. Please also see answers to questions 2 & 3.
Outside of the US agreement with Avion, ImmuPharma will provide updates to the market and shareholders on any progress made in respect to securing collaboration agreements with partners in other key territories.
Q9: For CIDP, what is the time line from Proof of Concept to Orphan Drug Approval and to Fast Track approval? From there, when does Phase III take place and for how long? What is the aim for final FDA and European approvals?
Outside of lupus the unique mechanism of action of Lupuzor™ (also known as Forigerimod or P140) has demonstrated in a number of pre-clinical trials that it has the potential to also be effective within other auto-immune diseases. One disease of key interest to ImmuPharma is Chronic Inflammatory Demyelinating Polyneuropathy (“CIDP”) where compelling pre-clinical data has been generated. CIDP is an orphan disease and with ‘Orphan Drug Designation’ provide a fast approval process.
ImmuPharma is planning to commence a Proof of Concept (POC) study in CIDP patients based on the strong data already gained within the Company’s lupus dossier. We are currently targeting the commencement of the POC study for CIDP in 2021. Further updates regarding this trial will be shared with the market and shareholders in due course.
Q10: Who is paying for the Consortium study involving ImmuPharma's subsidiary UREKA? The UK Govt, perhaps? How important a role will Urelix play in this study? What is the target date for conclusion of the study? Is this one in which IMM’s peptide P140 is involved? Is it too early to speculate what the financial benefit to Immupharma might be?
As announced in our update on 30 March 2020, the Company through its subsidiary UREkA Pharma has recently become a partner in a consortium dedicated to the development of novel peptides intended to block the fusion of COVID-19 and other viruses to the target cell, an approach similar to Fuzeon (enfuvirtide) by Roche. The goal is to design new peptides which can block the entry of viruses in the cell. The consortium is funded by the French state.
Drugs that target viral entry into the host cell have been proven effective against a wide range of viral diseases. The aim is to apply the results of fundamental research to the development of novel inhibitors of SARS-CoV-2 entry into target cells using the Urelix™ patented technology of UREkA Pharma together with contributions from the other members of the consortium.
Q11: Lead candidate optimisation; what exactly does that mean and how long until the peptide BioAMP-B attains that designation? What are the further steps needed to obtain drug approval and how long is it likely to take?
Lead optimisation is the process by which a drug candidate is designed after an initial lead compound is identified. Further updates regarding this trial will be shared with the market and shareholders in due course.
Q12: Lead candidate optimisation - Peptide IPP - 203101. How long a process to that point? what is the process thereafter?
IPP-203101 is ImmuPharma’s novel peptide-based antibiotic for the treatment of MRSA (“methicillin-resistant Staphylococcus aureus” or “superbug”) and other severe and hospital acquired multi-resistant infections. MRSA infections are increasingly resistant to even the last lines of drug defence such as ‘vancomycin’ and ‘teicoplanin’, which are two commonly used antibiotics. IPP-203101 causes bacterial cell death by a two-step mechanism involving interaction with the lipid component of the membrane followed by membrane breakdown. IPP-203101’s target profile is to be as efficacious as vancomycin, but with a better safety profile, weekly administration, less susceptible resistance and a better efficacy profile for certain strains. Next step is lead candidate optimisation.
Q1: My understanding was that the Company didn't need to raise further capital.....what has changed?
ImmuPharma has expanded its R&D therapy pipeline as announced last week into new areas including programs for CIDP in Lupuzor, BioGlucagon and expanding into anti-infectives with an anti-viral program and also BioAMP-B. This is in line with our long-terms strategy to build a successful and profitable company through enlarging our pipeline. Lanstead Capital, one of our major shareholders together with our Chief Scientific Officer, Dr Robert Zimmer have realised the potential in supporting these advancements, with the recent Subscription, whilst we now engage in partnering opportunities . The Lanstead 'Sharing Agreement' can also provide further support, as illustrated in the 2016 and 2019 subscriptions, as we progress these programs, which should result in an increased payments in parallel with any increase in the share price.
Q2: All being well what would a realistic Lupuzor™ launch date be?
Today in the presentation we gave guidance that the Lupuzor™ Phase III trial, being funded by our US partner, Avion Pharmaceuticals, is expected to commence by the end of this year (2020). It is difficult to predict a launch date but in our previous experience the Phase III trial of Lupuzor lasted approximately 2 years. Lupuzor™ has also Fast Track status so will be reviewed in priority.
Q3: Has the FDA meeting taken place?
As highlighted in the announcement ImmuPharma shared with the market last week and in today's presentation, a number of key activities have happened over the last period. Avion has now signed a collaboration agreement with a leading Lupus patient group and a Board of Key Opinion Leaders has been established. Key decisions/next steps will now be agreed prior to meeting with the FDA. These include:
Structure of optimised intl. Phase III Lupuzor™ trial | Demographics and patient inclusion criteria | Guidance on key territories where trial to be conducted.
It is important to clarify that the meeting with the FDA is expected to only provide further guidance on the structure of the optimised Phase III trial.
Q4: How much have you learnt from the previous Phase 3 and what will be different this time?
As discussed in many presentations and since we announced the Phase III data in April and May of 2018, the key findings regarding the outcome of the trial were based on patient profile. Those lupus patients on active drug, who were anti-dsDNA autoantibody positive showed statistically significant reductions in disease activity than those in the placebo group primarily within the European cohort of the trial. Lessons learned from the previous Phase III trial include patient selection based on profile, the severity of disease and number of patients in the study.
Q5: Why is the Board 'particularly excited' at the potential 'near term commercialisation of Incanthera's lead product Sol for skin cancer and other topical indications?
Just as background, ImmuPharma is a 11.9% shareholder in Incanthera, an oncology specialist which has recently listed on the Acquis Growth Market. Incanthera's lead product Sol” has the potential for near-term revenues in relation to Incanthera’s strategy of commercialising Sol firstly as a cosmetic product (e.g. sun cream including the active ingredient for skin cancer) through a partner and does not require approval by any of the pharmaceutical regulatory agencies (e.g. FDA). Incanthera’s medium term strategy is to follow on (again with a partner) with an application for a pharmaceutical licence, which will require approval by pharmaceutical regulators. So in essence, if Incanthera can secure a licencing deal with a partner firstly as a cosmetic product and very quickly after that be in receipt of royalties from sales of Sol, this would be a key milestone for the business.
Q6: What are the regulatory approval requirements for the BioGlucagon product and progress with the bio equivalence study and related commercial arrangements leading to potential market launch in 2022?
BioGlucagon is progressing through final preparatory work prior to commencing the bio equivalence study in early 2021. As the bio equivalence study is based on the reformulation of the drug including improving solubility and delivery of the drug, it does not need to go through the full Phase I, II, III clinical development. This means that the number of patients will be much smaller and the trial itself will be shorter. Taking these activities into account, we are focused on progressing BioGlucagon through this clinical program. In parallel, due to the improved competitive profile of the drug compared to existing glucagon products in the market, we will also pursue partnering discussions.
Q7: What value-points do the Board expect will generate cash, in the near-term, to adequately support both the R&D strategy and administration costs?
The recent deal with Avion Pharmaceuticals for the US provides the funding for Lupuzor™ and also is linked to substantial cash milestone payments and royalties in the future. We have other partnering opportunities which we are pursuing and positive news flow would increase the financial contribution from our Lanstead deal.
Q8: We had expected the meeting with the FDA to take place in Q1 of 2020. Can you give us a time line for a Meeting with FDA? Start and finish of enrolment for the Phase 111 trial? Completion of Phase III trial? Announcement of results of Phase III? Start of marketing of Lupuzor in North America? It would be good to be told when agreements with other Pharma’s outside the USA will be reached.
We expect that the Lupuzor™ Phase III trial, being funded by our US partner, Avion Pharmaceuticals, should commence by the end of this year (2020), although there may uncertainty due the COVID-19 situation. Further updates on the Phase III trial progress will be shared with the market and shareholders where appropriate over the coming months. Please also see answers to questions 2 & 3.
Outside of the US agreement with Avion, ImmuPharma will provide updates to the market and shareholders on any progress made in respect to securing collaboration agreements with partners in other key territories.
Q9: For CIDP, what is the time line from Proof of Concept to Orphan Drug Approval and to Fast Track approval? From there, when does Phase III take place and for how long? What is the aim for final FDA and European approvals?
Outside of lupus the unique mechanism of action of Lupuzor™ (also known as Forigerimod or P140) has demonstrated in a number of pre-clinical trials that it has the potential to also be effective within other auto-immune diseases. One disease of key interest to ImmuPharma is Chronic Inflammatory Demyelinating Polyneuropathy (“CIDP”) where compelling pre-clinical data has been generated. CIDP is an orphan disease and with ‘Orphan Drug Designation’ provide a fast approval process.
ImmuPharma is planning to commence a Proof of Concept (POC) study in CIDP patients based on the strong data already gained within the Company’s lupus dossier. We are currently targeting the commencement of the POC study for CIDP in 2021. Further updates regarding this trial will be shared with the market and shareholders in due course.
Q10: Who is paying for the Consortium study involving ImmuPharma's subsidiary UREKA? The UK Govt, perhaps? How important a role will Urelix play in this study? What is the target date for conclusion of the study? Is this one in which IMM’s peptide P140 is involved? Is it too early to speculate what the financial benefit to Immupharma might be?
As announced in our update on 30 March 2020, the Company through its subsidiary UREkA Pharma has recently become a partner in a consortium dedicated to the development of novel peptides intended to block the fusion of COVID-19 and other viruses to the target cell, an approach similar to Fuzeon (enfuvirtide) by Roche. The goal is to design new peptides which can block the entry of viruses in the cell. The consortium is funded by the French state.
Drugs that target viral entry into the host cell have been proven effective against a wide range of viral diseases. The aim is to apply the results of fundamental research to the development of novel inhibitors of SARS-CoV-2 entry into target cells using the Urelix™ patented technology of UREkA Pharma together with contributions from the other members of the consortium.
Q11: Lead candidate optimisation; what exactly does that mean and how long until the peptide BioAMP-B attains that designation? What are the further steps needed to obtain drug approval and how long is it likely to take?
Lead optimisation is the process by which a drug candidate is designed after an initial lead compound is identified. Further updates regarding this trial will be shared with the market and shareholders in due course.
Q12: Lead candidate optimisation - Peptide IPP - 203101. How long a process to that point? what is the process thereafter?
IPP-203101 is ImmuPharma’s novel peptide-based antibiotic for the treatment of MRSA (“methicillin-resistant Staphylococcus aureus” or “superbug”) and other severe and hospital acquired multi-resistant infections. MRSA infections are increasingly resistant to even the last lines of drug defence such as ‘vancomycin’ and ‘teicoplanin’, which are two commonly used antibiotics. IPP-203101 causes bacterial cell death by a two-step mechanism involving interaction with the lipid component of the membrane followed by membrane breakdown. IPP-203101’s target profile is to be as efficacious as vancomycin, but with a better safety profile, weekly administration, less susceptible resistance and a better efficacy profile for certain strains. Next step is lead candidate optimisation.
ImmuPharma's efforts in the fight against Covid-19 with Lupuzor™ and Ureka
ImmuPharma PLC (LSE:IMM), (Euronext Growth Brussels: ALIMM), the specialist drug discovery and development company provides a progress update on activities around Covid-19.
On 30 March 2020, ImmuPharma announced that it had expanded its pipeline to include three new 'Anti-Infective' programs, one of which was in 'Antivirals'. Investigation of the application of the Ureka peptide technologies within this Antivirals program suggests the potential to create effective anti-fusion peptides with the goal to prevent virus entry into the host cells, which may lead to novel peptide based antiviral therapies. Further exploratory work continues on this program.
As part of an overall evaluation of how we might apply our patented technologies to the fight against the Covid-19 epidemic, within our 'Autoimmunity' therapy area, we have also been considering the unique way that Lupuzor ™ interacts with the immune system and any potential application to Covid-19.
In this respect we note the results* of a recent study conducted at Emory University Atlanta GA, suggesting that Covid-19 (SARS-COV-2) patients and systemic lupus erythematosus (SLE) patients experiencing flares might share similar inflammatory symptoms, underpinned by similar mechanisms (role of cytokines). Lupuzor ™ is a modulator of the immune response and an anti-inflammatory agent, which has activity against SLE (lupus), an autoimmune disease, as well as against other inflammatory diseases. ImmuPharma, together with its US licencing partner, Avion Pharmaceuticals, will be progressing Lupuzor ™ into a new optimised international Phase III trial this year in lupus patients.
*"Critically ill SARS-CoV-2 patients display lupus-like hallmarks of extraordinary B cell activation" - https://doi.org/10.1101/2020.04.29.20083717 .
Given the findings of the Atlanta research group, we postulate that Lupuzor ™ may help to reduce or perhaps prevent the occurrence of the cytokine storm seen in Covid-19 patients. Further exploratory work is ongoing to assess Lupuzor's ™ possible potential and clinical program in Covid-19 patients.
Commenting on the announcement, Dimitri Dimitriou, CEO and Dr Robert Zimmer, President & CSO of ImmuPharma said: " As the Covid-19 pandemic has unfolded, ImmuPharma has been evaluating how it can best contribute its expertise and resources to help in the global response. Using our longstanding knowledge of peptide based technology, provides us with a number of opportunities, to help bring together a therapy that could be effective against the inflammation that causes the serious complications of Covid-19. We look forward to providing further updates when appropriate".
https://www.investegate.co.uk/immupharma-plc--imm-/rns/effor…
ImmuPharma PLC (LSE:IMM), (Euronext Growth Brussels: ALIMM), the specialist drug discovery and development company provides a progress update on activities around Covid-19.
On 30 March 2020, ImmuPharma announced that it had expanded its pipeline to include three new 'Anti-Infective' programs, one of which was in 'Antivirals'. Investigation of the application of the Ureka peptide technologies within this Antivirals program suggests the potential to create effective anti-fusion peptides with the goal to prevent virus entry into the host cells, which may lead to novel peptide based antiviral therapies. Further exploratory work continues on this program.
As part of an overall evaluation of how we might apply our patented technologies to the fight against the Covid-19 epidemic, within our 'Autoimmunity' therapy area, we have also been considering the unique way that Lupuzor ™ interacts with the immune system and any potential application to Covid-19.
In this respect we note the results* of a recent study conducted at Emory University Atlanta GA, suggesting that Covid-19 (SARS-COV-2) patients and systemic lupus erythematosus (SLE) patients experiencing flares might share similar inflammatory symptoms, underpinned by similar mechanisms (role of cytokines). Lupuzor ™ is a modulator of the immune response and an anti-inflammatory agent, which has activity against SLE (lupus), an autoimmune disease, as well as against other inflammatory diseases. ImmuPharma, together with its US licencing partner, Avion Pharmaceuticals, will be progressing Lupuzor ™ into a new optimised international Phase III trial this year in lupus patients.
*"Critically ill SARS-CoV-2 patients display lupus-like hallmarks of extraordinary B cell activation" - https://doi.org/10.1101/2020.04.29.20083717 .
Given the findings of the Atlanta research group, we postulate that Lupuzor ™ may help to reduce or perhaps prevent the occurrence of the cytokine storm seen in Covid-19 patients. Further exploratory work is ongoing to assess Lupuzor's ™ possible potential and clinical program in Covid-19 patients.
Commenting on the announcement, Dimitri Dimitriou, CEO and Dr Robert Zimmer, President & CSO of ImmuPharma said: " As the Covid-19 pandemic has unfolded, ImmuPharma has been evaluating how it can best contribute its expertise and resources to help in the global response. Using our longstanding knowledge of peptide based technology, provides us with a number of opportunities, to help bring together a therapy that could be effective against the inflammation that causes the serious complications of Covid-19. We look forward to providing further updates when appropriate".
https://www.investegate.co.uk/immupharma-plc--imm-/rns/effor…
Die Leiche zuckt
Antwort auf Beitrag Nr.: 63.673.615 von tammo666 am 14.05.20 09:20:03Liest sich interessant, schon alleine wenn Covid-19 im Spiel ist geht es hoch, aber zuviel für meinen Geschmack. Da geht auch noch Zeit ins Land und vermutlich der Kurs wieder etwas down .
Gruß aaahhh
Gruß aaahhh
Sehe ich auch so!
Evtl. auch bisschen Kurspflege für eine bevorstehende KE...?! 🙄
Evtl. auch bisschen Kurspflege für eine bevorstehende KE...?! 🙄
Antwort auf Beitrag Nr.: 63.678.028 von aaahhh am 14.05.20 13:26:58Ich (und vermutlich wir alle) hätten kein Problem damit, auf den präsenten Covid-Zug aufzuspringen und einfach mal so auf 2€ zu schießen...
Ja, Wunschdenken
Ja, Wunschdenken

11 JUNE 2020
ImmuPharma PLC
("ImmuPharma" or the "Company")
STRATEGIC INVESTMENTS FROM TWO SPECIALIST US HEALTHCARE INVESTORS
for continued development of ImmuPharma's therapeutic pipeline
ImmuPharma PLC (LSE AIM: IMM - Euronext Growth: ALIMM), the specialist drug discovery and development company, is pleased to announce that it has entered into agreements with two specialist US healthcare investors for a total investment of up to $6.30 million (£4.94 million) comprising an issue of unsecured convertible securities ("Securities") and associated options ("Options").
Highlights
· ImmuPharma is to issue $3 million (£2.35 million) in face value of Securities to two US specialist healthcare investors, L1 Capital Global Opportunities Master Fund and Lind Global Macro Fund LP, managed by The Lind Partners, LLC ("the Investors") with a maturity period of 18 months.
· At any time, during the maturity period, the Investors may convert their Securities (in whole or in part) to 13,086,619 ordinary shares in the Company, in aggregate, at a price of 17.96p ("Conversion Price") which is equivalent to 120% of the Volume Weighted Average Price ("VWAP") of the ordinary shares for 09 June 2020.
· During the maturity period, the Company may require the investors to convert their securities to ordinary shares, if the VWAP on each of at least 20 consecutive trading days shall be equal to or have exceeded 35.92p (200% of the Conversion Price).
· Should any securities remain unconverted on 10 December 2021 the Company will repurchase, from the Investors, the outstanding face value of the unconverted Securities.
· In addition, the Investors have been granted 15,703,942 Options in the Company, which may be exercised at any time up to 3 years, with an exercise price the same as the Conversion Price, which, if all exercised, would amount to $3.60 million (£2.82 million).
· The initial net proceeds of the Securities (after subscription and expenses) received by the Company of $2.39 million (£1.87 million) and any additional funds received of up to $3.60 million (£2.82 million), following exercise of the Options, will be used primarily to fund:
o Continued expansion of the Company's R&D programmes; and
o General working capital.
Commenting, ImmuPharma's Chairman, Tim McCarthy, said:
"We are delighted to welcome L1 Capital Global Opportunities Master Fund and Lind Global Macro Fund LP as new investors into ImmuPharma. This is the first significant investment from specialist US healthcare funds and illustrates the attention we are now receiving from knowledgeable global investors. It particularly exemplifies the strengthened investment thesis of ImmuPharma, as we continue to strengthen and progress our recently expanded development pipeline to value inflexion points, including Lupuzor™ and the partnership with Avion Pharmaceuticals, as we prepare for the start of a new international optimised Phase III trial, in lupus patients"
ImmuPharma PLC
("ImmuPharma" or the "Company")
STRATEGIC INVESTMENTS FROM TWO SPECIALIST US HEALTHCARE INVESTORS
for continued development of ImmuPharma's therapeutic pipeline
ImmuPharma PLC (LSE AIM: IMM - Euronext Growth: ALIMM), the specialist drug discovery and development company, is pleased to announce that it has entered into agreements with two specialist US healthcare investors for a total investment of up to $6.30 million (£4.94 million) comprising an issue of unsecured convertible securities ("Securities") and associated options ("Options").
Highlights
· ImmuPharma is to issue $3 million (£2.35 million) in face value of Securities to two US specialist healthcare investors, L1 Capital Global Opportunities Master Fund and Lind Global Macro Fund LP, managed by The Lind Partners, LLC ("the Investors") with a maturity period of 18 months.
· At any time, during the maturity period, the Investors may convert their Securities (in whole or in part) to 13,086,619 ordinary shares in the Company, in aggregate, at a price of 17.96p ("Conversion Price") which is equivalent to 120% of the Volume Weighted Average Price ("VWAP") of the ordinary shares for 09 June 2020.
· During the maturity period, the Company may require the investors to convert their securities to ordinary shares, if the VWAP on each of at least 20 consecutive trading days shall be equal to or have exceeded 35.92p (200% of the Conversion Price).
· Should any securities remain unconverted on 10 December 2021 the Company will repurchase, from the Investors, the outstanding face value of the unconverted Securities.
· In addition, the Investors have been granted 15,703,942 Options in the Company, which may be exercised at any time up to 3 years, with an exercise price the same as the Conversion Price, which, if all exercised, would amount to $3.60 million (£2.82 million).
· The initial net proceeds of the Securities (after subscription and expenses) received by the Company of $2.39 million (£1.87 million) and any additional funds received of up to $3.60 million (£2.82 million), following exercise of the Options, will be used primarily to fund:
o Continued expansion of the Company's R&D programmes; and
o General working capital.
Commenting, ImmuPharma's Chairman, Tim McCarthy, said:
"We are delighted to welcome L1 Capital Global Opportunities Master Fund and Lind Global Macro Fund LP as new investors into ImmuPharma. This is the first significant investment from specialist US healthcare funds and illustrates the attention we are now receiving from knowledgeable global investors. It particularly exemplifies the strengthened investment thesis of ImmuPharma, as we continue to strengthen and progress our recently expanded development pipeline to value inflexion points, including Lupuzor™ and the partnership with Avion Pharmaceuticals, as we prepare for the start of a new international optimised Phase III trial, in lupus patients"
Kommt hier jetzt auch Covid-Phantasie auf oder was geht ab?
Schade, es werden neue Aktien ausgegeben zu 11pence.
https://markets.ft.com/data/announce/detail?dockey=1323-1467…
https://markets.ft.com/data/announce/detail?dockey=1323-1467…
Antwort auf Beitrag Nr.: 64.959.576 von pharma-trader am 02.09.20 09:23:19bis 11.09 sollte sich auch die FDA melden kann natürlich auch früher passieren . War wahrscheinlich so gewollt .
ImmuPharma said the review period for such an assessment request was up to 45 days.
https://www.sharecast.com/news/aim-bulletin/immupharma-clear…
ImmuPharma said the review period for such an assessment request was up to 45 days.
https://www.sharecast.com/news/aim-bulletin/immupharma-clear…
Antwort auf Beitrag Nr.: 64.959.576 von pharma-trader am 02.09.20 09:23:19Schade das hier nur news zu ke kommen .Es wird langsam Zeit das man zum Produkt news kommen
Und ich hatte mir gestern noch überlegt zu verkaufen, da bei Tradegate schöne VKs waren...
Naja jetzt ist wieder warten angesagt
Naja jetzt ist wieder warten angesagt

Antwort auf Beitrag Nr.: 64.967.235 von liquidx am 02.09.20 17:29:11Die 45 tage sind am fraitag um bis dahin muss sich die fda zu Lupus melden .
Die weitere frage ist ob jemand vielleich auch immo heimlich durch eine ke übernehmen möchte.
Es wird nur wenige Gewinner geben da keiner immo auf dem schirm hat.
1430 kommen gerne news der Umsatz passt heute auch also lassen wir uns überraschen.
Die weitere frage ist ob jemand vielleich auch immo heimlich durch eine ke übernehmen möchte.
Es wird nur wenige Gewinner geben da keiner immo auf dem schirm hat.
1430 kommen gerne news der Umsatz passt heute auch also lassen wir uns überraschen.
Noch keine News von der FDA
https://otp.investis.com/clients/uk/immu_pharma/rns/regulato…
Antwort auf Beitrag Nr.: 65.050.845 von Schuro am 11.09.20 09:37:57Wir haben jetzt schon den 47 tag so langsam sollte was kommen.
Das kenne ich eigentlich nicht von der fda.
Das kenne ich eigentlich nicht von der fda.
Antwort auf Beitrag Nr.: 65.051.595 von dig101 am 11.09.20 10:35:58Kurs ist schon mal in Deckung gegangen....
Gibt es hier immer noch keine News eigentlich?
Bin sei gestern auch wieder dabei, der Bericht liest sich doch ganz gut. Grüsse florfliege
Ich scheine vielleicht den richtigen Einstieg erwischt zu haben.....An der Heimatbörse schon 15% plus heute....Mal sehen Grüsse florfliege
Der Termin war Anfang Dezember. Eigentlich sollten doch mal Neuigkeiten eintrudeln oder?
Antwort auf Beitrag Nr.: 66.234.153 von dabertomalos am 30.12.20 09:15:03
SPA Phase III Lupuzor
Morgen läuft die 30 Tage Frist ab, für die Antwort der FDA auf das Type A Meeting am 4. Dezember. Insofern könnte es in der nächsten Woche Neuigkeiten geben. Mal sehen, was sie zum conditional approval sagen?
So, die Covid-Impfstoffe wurden durchgewunken. Jetzt können bei der FDA alle mal an ihre angestammten Arbeitsplätze gehen und unsere meeting minutes zu Papier bringen. Kann ja so schwer nicht sein.
Mann, das Warten nervt bei Biotechs am meisten. Mal abgesehen von den -75%-Tagen 😭
Mann, das Warten nervt bei Biotechs am meisten. Mal abgesehen von den -75%-Tagen 😭
Ich denke das hier wird auch ein Rohrkrepierer.... Da kommt nichts mehr....
Verabschiede mich hier.
Verabschiede mich hier.
Ich bleibe und hoffe auf den nächsten, kleinen Zock Richtung 0,20 €. Die ein oder andere News wird noch kommen.
Ich warte, hab ja Zeit....Geduld lohnt sich meistens an der Börse
Vielleicht lässt die Antwort der FDA auch deshalb auf sich warten, weil noch an den Bedingungen für das conditional approval von Lupuzor gearbeitet wird. Falls sich da ein Weg auftut, könnte man natürlich auch für Europa eine bedingte Zulassung beantragen (war ja schon mal angedacht, in der Zeit vor dem Avion deal). Wir werden es bald erfahren. Ich kann mir allerdings kaum vorstellen, dass nur das SPA soviel Zeit in Anspruch nimmt.
Außerdem erwarte ich noch weitere Lizensverträge ROW und news zu der übrigen pipeline.
Neue Woche, neues Glück.
Außerdem erwarte ich noch weitere Lizensverträge ROW und news zu der übrigen pipeline.
Neue Woche, neues Glück.
Teilnahme an der Biotech Showcase Digital 2021
ImmuPharma`s COO Tim Franklin präsentiert in dieser Woche auf der Biotech Showcase Digital 2021 (11.01. - 15.01.20121).
Ungewöhnlich hohes Tagesvolumen an der Börse Stuttgart und auf Tradegate. Wer weiß mehr?
Antwort auf Beitrag Nr.: 66.417.347 von Getsbio am 13.01.21 12:29:10Nichts gehört,werde aber aufstocken!!
Antwort auf Beitrag Nr.: 66.417.347 von Getsbio am 13.01.21 12:29:10@Getbio
Umsätze in Old Germany sind belanglos, nur das Mutterland zählt.
Aus dem englischen Forum: https://uk.advfn.com
ImmuPharma gab am 28. November 2019 einen wichtigen US-Lizenzvertrag mit Avion Pharmaceuticals („Avion“) bekannt.), ein US-Spezialgeschäft mit Schwerpunkt auf Rheumatologie, Frauengesundheit (Lupus betrifft Frauen mehr), Dermatologie und anderen therapeutischen Bereichen. Avion verfügt über ein starkes Marketing- und Vermarktungsgeschäft (mit über 100 spezialisierten Vertriebsmitarbeitern).
Avion hat Lupuzor ™ exklusiv für den US-Markt für Lupus (SLE) und andere Indikationen lizenziert und sich bereit erklärt, eine internationale klinische Phase-III-Studie für bis zu 25 Mio. USD zu finanzieren. Darüber hinaus zahlt Avion Meilensteine in Höhe von bis zu 70 Mio. USD, und es wurde ein Lizenzgebührenstrom von 17% vereinbart.
Wir haben immer geglaubt, dass ImmuPharma ein so erfolgreiches Geschäft für den US-Markt liefern könnte. Dieser Deal mit Avion wurde durch die Stärke der klinischen Daten (und des Sicherheitsprofils) aus der im letzten Jahr angekündigten Phase-III-Studie unterstützt. Unsere detaillierte Analyse der jeweiligen Kohortendaten, Aufgrund der Leistung des Peptids bei Patienten mit positivem Auto-ds-DNA-Antikörper bestätigten wir unsere Annahmen über den Wert von Lupuzor ™.
Wir sehen Lupuzor ™ nun in der Lage, Blockbuster-Verkäufe allein in den USA (über 1 Mrd. GBP) zu generieren (zuvor in den USA und in der EU zusammen) - was in Verbindung mit einem Lizenzstrom von bis zu 17% des Umsatzes eine jährliche Lizenzgebühr von bis zu 17% bedeuten könnte Das Endergebnis von ImmuPharma beträgt 170 Mio. GBP pro Jahr. Besonders beeindruckend an diesem Geschäft ist nicht nur die Fähigkeit von ImmuPharma, einen neuen Lizenzpartner für Lupuzor ™ zu identifizieren und auszuführen, sondern auch die Möglichkeit für ImmuPharma, neue Vertriebs- und Marketingpartner außerhalb der USA für Lupuzor ™ zu finden, z. B. in Europa, wo Ein neuer Versuch wäre angesichts der Finanzierungszusage von Avion nicht einmal erforderlich.
Dies bedeutet, dass die Möglichkeit besteht, dass weitere Lizenzvereinbarungen folgen, die einen attraktiven zusätzlichen Lizenzgebührenstrom sowie zusätzliche Voraus- und Meilensteinzahlungen einbringen. Außerhalb von Lupuzor ™ glauben wir, dass ImmuPharma das Potenzial hat, Nachrichtenfluss für seine anderen Pipeline-Assets, einschließlich Nucant und UreKa, zu generieren. Basierend auf den finanziellen Annahmen für diesen Deal und einem niedrigeren Risikoprofil (Reduzierung der Risikoprämie in unserem DCF-Modell) erhöhen wir unser Kursziel (50% abgezinst) von 176 Pence auf 200 Pence / Aktie.
Vielleicht hängt es damit zusammen?
Gruss RS😎
Umsätze in Old Germany sind belanglos, nur das Mutterland zählt.
Aus dem englischen Forum: https://uk.advfn.com
ImmuPharma gab am 28. November 2019 einen wichtigen US-Lizenzvertrag mit Avion Pharmaceuticals („Avion“) bekannt.), ein US-Spezialgeschäft mit Schwerpunkt auf Rheumatologie, Frauengesundheit (Lupus betrifft Frauen mehr), Dermatologie und anderen therapeutischen Bereichen. Avion verfügt über ein starkes Marketing- und Vermarktungsgeschäft (mit über 100 spezialisierten Vertriebsmitarbeitern).
Avion hat Lupuzor ™ exklusiv für den US-Markt für Lupus (SLE) und andere Indikationen lizenziert und sich bereit erklärt, eine internationale klinische Phase-III-Studie für bis zu 25 Mio. USD zu finanzieren. Darüber hinaus zahlt Avion Meilensteine in Höhe von bis zu 70 Mio. USD, und es wurde ein Lizenzgebührenstrom von 17% vereinbart.
Wir haben immer geglaubt, dass ImmuPharma ein so erfolgreiches Geschäft für den US-Markt liefern könnte. Dieser Deal mit Avion wurde durch die Stärke der klinischen Daten (und des Sicherheitsprofils) aus der im letzten Jahr angekündigten Phase-III-Studie unterstützt. Unsere detaillierte Analyse der jeweiligen Kohortendaten, Aufgrund der Leistung des Peptids bei Patienten mit positivem Auto-ds-DNA-Antikörper bestätigten wir unsere Annahmen über den Wert von Lupuzor ™.
Wir sehen Lupuzor ™ nun in der Lage, Blockbuster-Verkäufe allein in den USA (über 1 Mrd. GBP) zu generieren (zuvor in den USA und in der EU zusammen) - was in Verbindung mit einem Lizenzstrom von bis zu 17% des Umsatzes eine jährliche Lizenzgebühr von bis zu 17% bedeuten könnte Das Endergebnis von ImmuPharma beträgt 170 Mio. GBP pro Jahr. Besonders beeindruckend an diesem Geschäft ist nicht nur die Fähigkeit von ImmuPharma, einen neuen Lizenzpartner für Lupuzor ™ zu identifizieren und auszuführen, sondern auch die Möglichkeit für ImmuPharma, neue Vertriebs- und Marketingpartner außerhalb der USA für Lupuzor ™ zu finden, z. B. in Europa, wo Ein neuer Versuch wäre angesichts der Finanzierungszusage von Avion nicht einmal erforderlich.
Dies bedeutet, dass die Möglichkeit besteht, dass weitere Lizenzvereinbarungen folgen, die einen attraktiven zusätzlichen Lizenzgebührenstrom sowie zusätzliche Voraus- und Meilensteinzahlungen einbringen. Außerhalb von Lupuzor ™ glauben wir, dass ImmuPharma das Potenzial hat, Nachrichtenfluss für seine anderen Pipeline-Assets, einschließlich Nucant und UreKa, zu generieren. Basierend auf den finanziellen Annahmen für diesen Deal und einem niedrigeren Risikoprofil (Reduzierung der Risikoprämie in unserem DCF-Modell) erhöhen wir unser Kursziel (50% abgezinst) von 176 Pence auf 200 Pence / Aktie.
Vielleicht hängt es damit zusammen?
Gruss RS😎
Diese Analyse scheint mir nicht mehr ganz taufrisch zu sein. Eher aus 2019 denn 2020. Außerdem nicht ersichtlich von wem sie stammt.
Wir brauchen die erlösende, positive news von der FDA.
Wir brauchen die erlösende, positive news von der FDA.
Von wann ist denn nun der Bericht?
Die Tage über mal mit ‘ner Zockerposition eingestiegen.
Falls wir positives vom FDA-Meeting demnächst höhren, sollte da gut was drin sein...
Falls wir positives vom FDA-Meeting demnächst höhren, sollte da gut was drin sein...
Wie hoch ist denn bei dir eine Zockerposition?
1% Depotgewichtung 😉
Wie gesagt, bei positiver Rückmeldung von der FDA Vervielfachungspotential bei der niedrigen Marktkapitalisierung, bei negativer Rückmeldung gehts wohl (dauerhaft) unter 10 Pence.
Wie gesagt, bei positiver Rückmeldung von der FDA Vervielfachungspotential bei der niedrigen Marktkapitalisierung, bei negativer Rückmeldung gehts wohl (dauerhaft) unter 10 Pence.
Also 10.000 Euro? ;-)
Wieviel Geld müsste man deiner Meinung nach hier einsetzen um in ca. 5 Jahren bei positiver Nachrichtenflut Millionär werden zu können?
Wieviel Geld müsste man deiner Meinung nach hier einsetzen um in ca. 5 Jahren bei positiver Nachrichtenflut Millionär werden zu können?

Antwort auf Beitrag Nr.: 66.437.885 von dabertomalos am 14.01.21 13:53:00Wenn das dein Ziel ist,bist du falsch hier 

Wie schätzt ihr hier die Chancen im Gegensatz zu anderen Lupus Aktie ein?
Immupharma ist mit gerademal 35 Mio bewertet und hat tolle Ergebnisse in einer verlängerten Phase3 gezeigt.
Zur Erinnerung ImmuPharma WKN: A0BMC4 ISIN: GB0033711010
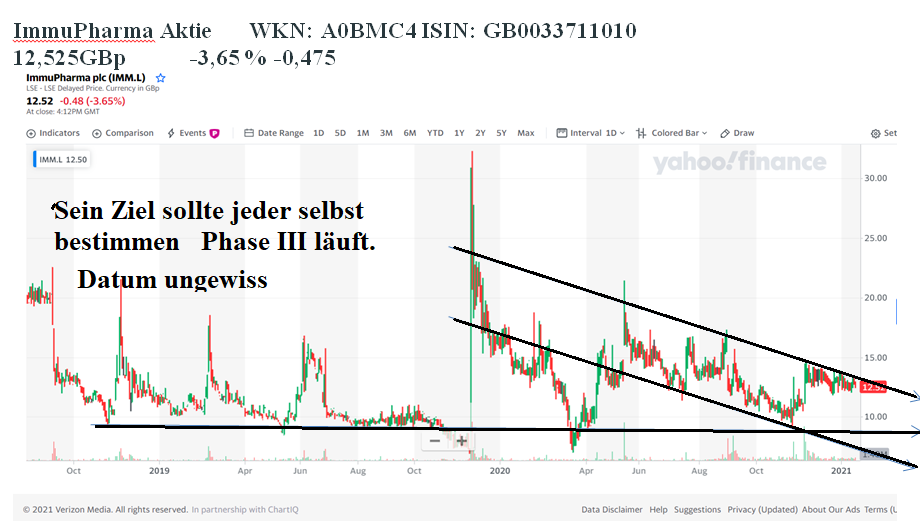
Ausdem https://uk.advfn.com
ImmuPharma gab am 28. November 2019 einen wichtigen US-Lizenzvertrag mit Avion Pharmaceuticals („Avion“) bekannt.), ein US-Spezialgeschäft mit Schwerpunkt auf Rheumatologie, Frauengesundheit (Lupus betrifft Frauen mehr), Dermatologie und anderen therapeutischen Bereichen. Avion verfügt über ein starkes Marketing- und Vermarktungsgeschäft (mit über 100 spezialisierten Vertriebsmitarbeitern).
Avion hat Lupuzor ™ exklusiv für den US-Markt für Lupus (SLE) und andere Indikationen lizenziert und sich bereit erklärt, eine internationale klinische Phase-III-Studie für bis zu 25 Mio. USD zu finanzieren. Darüber hinaus zahlt Avion Meilensteine in Höhe von bis zu 70 Mio. USD, und es wurde ein Lizenzgebührenstrom von 17% vereinbart.
Immupharma kann es nur mit einem US Partner mit Beziehungen schaffen!
Gruss RS

Ausdem https://uk.advfn.com
ImmuPharma gab am 28. November 2019 einen wichtigen US-Lizenzvertrag mit Avion Pharmaceuticals („Avion“) bekannt.), ein US-Spezialgeschäft mit Schwerpunkt auf Rheumatologie, Frauengesundheit (Lupus betrifft Frauen mehr), Dermatologie und anderen therapeutischen Bereichen. Avion verfügt über ein starkes Marketing- und Vermarktungsgeschäft (mit über 100 spezialisierten Vertriebsmitarbeitern).
Avion hat Lupuzor ™ exklusiv für den US-Markt für Lupus (SLE) und andere Indikationen lizenziert und sich bereit erklärt, eine internationale klinische Phase-III-Studie für bis zu 25 Mio. USD zu finanzieren. Darüber hinaus zahlt Avion Meilensteine in Höhe von bis zu 70 Mio. USD, und es wurde ein Lizenzgebührenstrom von 17% vereinbart.
Immupharma kann es nur mit einem US Partner mit Beziehungen schaffen!
Gruss RS
Denkst du Avion hat gute Beziehung oder sind die dafür zu klein?
Wie schätzt ihr die Lage da bisher keine Info kam von dem Treffen mit der FDA? Oder könnte das wegen Corona solange dauern?
Welche starken Mitbewerber gibt es genau in dieser Indikation von Lupus und wie weit sind diese?
Wie schätzt ihr die Lage da bisher keine Info kam von dem Treffen mit der FDA? Oder könnte das wegen Corona solange dauern?
Welche starken Mitbewerber gibt es genau in dieser Indikation von Lupus und wie weit sind diese?
Antwort auf Beitrag Nr.: 66.494.375 von Rastelly am 18.01.21 20:37:31
Hi RS
Sein Zeil sollte jeder selbst bestimmen.
Wie meinst du das?
Mit dem nach unten gerichteten Chart zusammen, tönt das eher so, dass du nicht dran glaubst. Korrekt?
Zitat von Rastelly: Zur Erinnerung ImmuPharma WKN: A0BMC4 ISIN: GB0033711010
Gruss RS
Hi RS
Sein Zeil sollte jeder selbst bestimmen.
Wie meinst du das?
Mit dem nach unten gerichteten Chart zusammen, tönt das eher so, dass du nicht dran glaubst. Korrekt?
Antwort auf Beitrag Nr.: 66.501.002 von 2brix am 19.01.21 11:08:49@2brix
der Glaube hängt mit Kreuz zusammen und dieses steht meistens auf der Kirche!
Einfach zurückblättern, dann siehst du wie ich investiert bin.
Der Chart vom Boden gibt oder sollte eine Kaufgelegenheit wiedergeben.
Das Ziel gibt jeder nach seinem Gierindex wieder = also die Gewinnschwelle.
Die Aktie konnte an Boden gekauft werden, mindestens 2 x im Kanal.
Sehe Dir den Chart an, dann weist du wo die Aktie schon stand!
Weiterhin viel Glück, Gruss RS 😎
der Glaube hängt mit Kreuz zusammen und dieses steht meistens auf der Kirche!
Einfach zurückblättern, dann siehst du wie ich investiert bin.
Der Chart vom Boden gibt oder sollte eine Kaufgelegenheit wiedergeben.
Das Ziel gibt jeder nach seinem Gierindex wieder = also die Gewinnschwelle.
Die Aktie konnte an Boden gekauft werden, mindestens 2 x im Kanal.
Sehe Dir den Chart an, dann weist du wo die Aktie schon stand!
Weiterhin viel Glück, Gruss RS 😎
Danke RS
Wollte nur sicher gehen, dass ich es korrekt interpretiere. Ist ja manchmal nciht ganz so einfach, was der Schreiber genau gemeint hat bzw wie der Leser es interpretiert.
Wollte nur sicher gehen, dass ich es korrekt interpretiere. Ist ja manchmal nciht ganz so einfach, was der Schreiber genau gemeint hat bzw wie der Leser es interpretiert.
Soweit ich das sehe gibt es von Seiten der Konkurrenz anhand der Zeitachse bisher noch keine Konkurrenz die bei SLE auf Augenhöhe ist.
Noch nicht... Kommt drauf an wie lange die noch für den Start der zweiten Phase 3 benötigen....
Noch nicht... Kommt drauf an wie lange die noch für den Start der zweiten Phase 3 benötigen....
Gib es irgendwelche News, dass Lupus besser anspricht, als der erste FDA Versuch im April?
Vielen Dank
Vielen Dank
Antwort auf Beitrag Nr.: 66.533.084 von puttyfly am 20.01.21 23:04:44Die erste Phase III war ja im April 2018 gescheitert. Allerdings wurde beobachtet, dass Patienten mit ds DNA Antikörpern signifikant von der Therapie mit Lupuzor profitierten. Diese Gruppe macht wohl die Mehrheit der Patienten aus. Die neue Phase III Studie berücksichtigt diese Erkenntnisse und könnte damit erfolgreicher verlaufen. Bei der FDA wurde mit dem Partner Avion ein entsprechendes Studienprotokoll in Verbindung mit einem SPA Antrag eingereicht. Ein Abstimmungsmeeting mit der FDA fand am 04. Dezember 2020 statt. Jetzt geht es um die Wurst, das Feedback der FDA und deren Zustimmung zum neuen Studiendesign.
Danke für die Antwort.
An sich probiert man es nochmals mit dem gleichen Wirkstoff, hatte gehofft, vielleicht, dass es leichte Adaptationen gegeben hätte. Dennoch bin ich nicht negativ eingestellt.
Erster Schritt wäre dann das Recht auf eine weitere Phase 3 Studie. Denke das alleine dürfte den Kurs schon treiben.
An sich probiert man es nochmals mit dem gleichen Wirkstoff, hatte gehofft, vielleicht, dass es leichte Adaptationen gegeben hätte. Dennoch bin ich nicht negativ eingestellt.
Erster Schritt wäre dann das Recht auf eine weitere Phase 3 Studie. Denke das alleine dürfte den Kurs schon treiben.
Aurinia Zulassung für Lupus Nephritis seit Samstag erhalten.
Somit fällt schon ein großes Kuchenstück für Immupharma weg oder?
Somit fällt schon ein großes Kuchenstück für Immupharma weg oder?
Jemand was neues gehört?
nein, dass die FDA mit der Antwort so lange braucht, nicht unbedingt positiv.
Dachte der Zeitraum wäre ein Monat, dieses Datum haben wir trotz der Feiertage nun doch ordentlich überschritten.
Dachte der Zeitraum wäre ein Monat, dieses Datum haben wir trotz der Feiertage nun doch ordentlich überschritten.
SPA Request
Es ist schon ungewöhnlich. Allerdings kann es sich immer noch um eine ausschließlich "Corona-bedingte" Verzögerung handeln, wenn man sich die Abläufe aus 2020 vor Augen führt:Am 27.07. beantragte Avion bei der FDA eine SPA Übereinkunft für Lupuzor. Üblicherweise beträgt die Bearbeitungszeit 45 Tage. Erstmalig gemeldet hat sich die FDA jedoch erst am 10.11., also nach mehr als einer zweifachen Überschreitung der Frist. Und auch dann kam es zu keiner Entscheidung sondern es wurde lediglich Avion zugestanden, ein sog. Type A meeting zu beantragen. So nervtötend es auch ist, es lässt sich wahrscheinlich nichts aus der aktuelle Verzögerung herauslesen.
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Tatsachenbehauptung ohne Quellennachweis, bitte formulieren Sie ihre Aussagen so, dass sie als Mutmaßung erkennbar sind oder fügen Sie eine Quelle hinzu
Quelle: https://www.regulations.gov/document?D=FDA-2016-D-1174-0015
Zitat aus dieser Quelle: "In rare cases, FDA may rescind an SPA agreement. Since the Food and Drug Administration
Modernization Act of 1997 was enacted through 2016, CDER has issued more than 1,000 SPA
agreements; less than 1 percent of those SPAs have been rescinded."
Zitat aus dieser Quelle: "In rare cases, FDA may rescind an SPA agreement. Since the Food and Drug Administration
Modernization Act of 1997 was enacted through 2016, CDER has issued more than 1,000 SPA
agreements; less than 1 percent of those SPAs have been rescinded."
Das klingt nicht besonders ermutigend!
Diese Verlinkung hat eigentlich überhaupt keine Bedeutung für Immupharma…..
Ich denke mit 1-5% Depotgewichtung kann man nix falsch machen. Wenn man Glück hat gibt's in kurzer Zeit einen 3-10 facher…..
Ich denke mit 1-5% Depotgewichtung kann man nix falsch machen. Wenn man Glück hat gibt's in kurzer Zeit einen 3-10 facher…..
Antwort auf Beitrag Nr.: 66.785.344 von puttyfly am 02.02.21 23:01:54
Wieso, wie meinst du das genau?
LG
Zitat von puttyfly: Das klingt nicht besonders ermutigend!
Wieso, wie meinst du das genau?
LG
Ohne mit genau auszukennen, aber wenn nur ein 1% der SPAs aufgehoben werden, ist das nicht gerade eine tolle Quote.
Natürlich steht jedes für sich allein und man kann nicht verallgemeiern.
Hoffen wir das Beste, die Fachleute sind ja davon überzeugt, sonst hätte Avion ja nicht Millionen in die Hand genommen
Natürlich steht jedes für sich allein und man kann nicht verallgemeiern.
Hoffen wir das Beste, die Fachleute sind ja davon überzeugt, sonst hätte Avion ja nicht Millionen in die Hand genommen
Antwort auf Beitrag Nr.: 66.433.997 von Stoxtrayder am 14.01.21 10:33:50
Me too
... Und zwar schon vor einigen Monaten ...
Bin gespannt.
Zitat von Stoxtrayder: Die Tage über mal mit ‘ner Zockerposition eingestiegen.
Falls wir positives vom FDA-Meeting demnächst höhren, sollte da gut was drin sein...
Me too

... Und zwar schon vor einigen Monaten ...
Bin gespannt.
Antwort auf Beitrag Nr.: 66.783.469 von Getsbio am 02.02.21 21:36:56
Das zeigt doch nur, dass es eine hohe Wahrscheinlichkeit gibt, mit der FDA ein SPA Agreement zu erzielen. Weniger als 1% der Anträge werden abgelehnt.
ImmuPharma/Avion schaffen das.
SPA Agreement
Zitat von Getsbio: Quelle: https://www.regulations.gov/document?D=FDA-2016-D-1174-0015
Zitat aus dieser Quelle: "In rare cases, FDA may rescind an SPA agreement. Since the Food and Drug Administration
Modernization Act of 1997 was enacted through 2016, CDER has issued more than 1,000 SPA
agreements; less than 1 percent of those SPAs have been rescinded."
Das zeigt doch nur, dass es eine hohe Wahrscheinlichkeit gibt, mit der FDA ein SPA Agreement zu erzielen. Weniger als 1% der Anträge werden abgelehnt.
ImmuPharma/Avion schaffen das.
Aus dem englischen Forum:
https://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM&share=Im…
Aktuelle Analyse von Invest Securities zu ImmuPharma mit Kursziel 0,90€!
https://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM&share=Im…
https://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM&share=Im…
Aktuelle Analyse von Invest Securities zu ImmuPharma mit Kursziel 0,90€!
https://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM&share=Im…
Antwort auf Beitrag Nr.: 66.855.742 von Getsbio am 06.02.21 10:41:35 Ich bin hier schon lange dabei und bleibe auch noch dabei und gehe auch davon aus, dass für diese Krankheit, dieses Medikament durchgebracht wird
Antwort auf Beitrag Nr.: 66.855.742 von Getsbio am 06.02.21 10:41:35Danke,
ich hatte es umgedreht gelesen. English wohl nicht meine Stärke.
Danke!
ich hatte es umgedreht gelesen. English wohl nicht meine Stärke.
Danke!
E-Mail Newsletter
9 February 2021ImmuPharma PLC
("ImmuPharma" or the "Company")
Lupuzor™ scheduled to commence international Phase 3 trial in Lupus patients in H2 2021
ImmuPharma PLC (LSE:IMM) (Euronext Growth Brussels: ALIMM), the specialist drug discovery and development company, announces an update in respect to the new optimised international Phase 3 trial of Lupuzor™ in systemic lupus erythematosus ("SLE"), a potentially life-threatening auto-immune disease.
As indicated in the 20 November 2020 announcement, Avion Pharmaceuticals ("Avion"), ImmuPharma's licensing partner for Lupuzor™, met with the US Food & Drug Administration ("FDA") on 4 December 2020 for a Type 'A' Meeting Request.
Avion has received feedback from the FDA, and has now advised ImmuPharma of the programme of activities in respect to its commitment to schedule next steps.
In response to the FDA input, Avion, in partnership with ImmuPharma, has plans to develop and validate a bioanalytical assay, to confirm the clinical pharmacology and pharmacokinetic ("PK") characterizations of Lupuzor™, prior to commencement of the Phase 3 trial.
A final guidance meeting between Avion and the FDA is being planned at which Avion will submit the methodology for assessing PK as part of the Phase 3 trial. This meeting, which is expected to take place in Q2, will also confirm previous submissions to FDA on the study design, clinical end points and approval process.
As indicated in the 20 November 2020 announcement, ImmuPharma initiated the production of a new batch of Lupuzor™ clinical trial material specifically for the Phase 3 trial and it can be confirmed that this will be ready for the start of the trial.
As part of the FDA feedback from the meeting on 4 December 2020, it has been clarified that a Special Protocol Assessment ("SPA") will not be applicable and a conditional approval of Lupuzor™, whilst the Phase 3 trial is underway, has not been confirmed at this time.
Commenting on the announcement, Dimitri Dimitriou, CEO of ImmuPharma said:
"We are extremely pleased to see the positive progress of Lupuzor™ towards the commencement of the international Phase 3 trial with Avion. We will continue to work closely with Avion over the next period to ensure the start of the Phase 3 study remains on schedule for H2 2021."
Art Deas, Chief Executive Officer, Avion Pharmaceuticals added: "Following continued positive dialogue with the FDA and with an agreed clinical and regulatory pathway over the next period, we look forward to moving Lupuzor™ ahead later this year."
Antwort auf Beitrag Nr.: 66.895.205 von Schuro am 09.02.21 08:25:16
Danke fürs posten.
wie interpretiert ihr diese Aussage?
Zitat von Schuro: 9 February 2021
As part of the FDA feedback from the meeting on 4 December 2020, it has been clarified that a Special Protocol Assessment ("SPA") will not be applicable and a conditional approval of Lupuzor™, whilst the Phase 3 trial is underway, has not been confirmed at this time.
Danke fürs posten.
wie interpretiert ihr diese Aussage?
Antwort auf Beitrag Nr.: 66.895.805 von 2brix am 09.02.21 08:55:04es wird eine never-ending-story...leider
Hab heute nachgekauft. Noch ist nichts verloren...
Ich sehe hier keine Sonne mehr... ich denke das war’s...
Wie wird auch bald die Kohle am Ende sein denke ich
Wie wird auch bald die Kohle am Ende sein denke ich
wie immer, es dauert länger als gedacht
Antwort auf Beitrag Nr.: 67.318.857 von 2brix am 05.03.21 07:46:54Aber es bewegt sich wieder was
💪
💪
Hallo zusammen,
nachdem ich auch ein leidgeprüfter Investor bin (-85%) habe ich heute bei IR angerufen und mit der zuständigen Dame eine Viertelstunde geplaudert.
Was waren die wichtigsten Aussagen: Im April/Anfang Mai sollten neue Infos von der FDA kommen. Aktuell laufen wohl alle Maßnahmen über Avion, was den Zulassungsvorgang und den Schritt in die nächste Studie doch stark verzögert. Es stehen auch keine KE an, das Unternehmen ist durchfinanziert. Grundlegend ist man vom Potenzial überzeugt "be patient" meinte die sehr nette IR-Dame die auch Aktien hält... Na dann sind wir mal geduldig, ich hab ein paar Stück nachgekauft, was soll's... Viele Glück allen!
nachdem ich auch ein leidgeprüfter Investor bin (-85%) habe ich heute bei IR angerufen und mit der zuständigen Dame eine Viertelstunde geplaudert.
Was waren die wichtigsten Aussagen: Im April/Anfang Mai sollten neue Infos von der FDA kommen. Aktuell laufen wohl alle Maßnahmen über Avion, was den Zulassungsvorgang und den Schritt in die nächste Studie doch stark verzögert. Es stehen auch keine KE an, das Unternehmen ist durchfinanziert. Grundlegend ist man vom Potenzial überzeugt "be patient" meinte die sehr nette IR-Dame die auch Aktien hält... Na dann sind wir mal geduldig, ich hab ein paar Stück nachgekauft, was soll's... Viele Glück allen!
Danke für die Info 🙏
Hallo, die Warterei auf Neuigkeiten dürfte ja bald zu Ende sein. Wir haben Mitte April.....Habe mal wieder welche gekauft......vielleicht kommt ja bald eine gute Nachricht. Wer wartet noch ?? Grüne Grüße florfliege
Servus, ich warte auch noch
Und gehe hier auch weiterhin von einem positiven Ergebnis aus
Das Teil ist so ausgetrocknet, dass wir mit einer guten News, so hoffe ich, gleich über 1€ fliegen
Und gehe hier auch weiterhin von einem positiven Ergebnis aus
Das Teil ist so ausgetrocknet, dass wir mit einer guten News, so hoffe ich, gleich über 1€ fliegen
Antwort auf Beitrag Nr.: 67.847.369 von lobberland am 16.04.21 16:11:55Hallo, das Teil verlangt von einem, daß man gute Nerven hat.............Ich bin auch wieder mit einer verschmerzbaren Anzahl dabei, wobei ich überlege, nochmals ein bißchen aufzustocken. Mal sehen.
Habe eben nachgeschaut, 14.KW 2018 war das Hoch mit 2,20. Ist jetzt 3 Jahre her. Werde doch nicht aufstocken, entweder fliegt sie oder......Daumendrücke, Grüße florfliege
Habe eben nachgeschaut, 14.KW 2018 war das Hoch mit 2,20. Ist jetzt 3 Jahre her. Werde doch nicht aufstocken, entweder fliegt sie oder......Daumendrücke, Grüße florfliege
Antwort auf Beitrag Nr.: 67.987.691 von bmuesli am 29.04.21 11:48:15
https://translate.google.com/translate?sl=auto&tl=de&u=https…
Zitat von bmuesli: https://www.investegate.co.uk/immupharma-plc--imm-/rns/final-results/202104290700089689W/
https://translate.google.com/translate?sl=auto&tl=de&u=https…
Der Mai ist bald um und noch immer keine News.

Antwort auf Beitrag Nr.: 67.463.396 von ChristianSchramm am 15.03.21 15:32:57
Christian, könntest du dich bei IR nochmal melden? Avion scheint vergessen zu haben, was die FDA angefordert hat😴
Wake Up Call
April/Anfang Mai ist definitiv um!Christian, könntest du dich bei IR nochmal melden? Avion scheint vergessen zu haben, was die FDA angefordert hat😴
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Spam, Werbung
Immerhin. Substantielle news liegen allerdings schon länger zurück 🤔
Lupuzor Phase III Studie
Wer glaubt an ein update im Mai?🙄
Antwort auf Beitrag Nr.: 68.311.154 von Getsbio am 26.05.21 18:25:58Moin,
Die Studie wird kommen ob im Mai oder Juni ist zweitrangig. Wenn die News kommt, sind meiner Meinung hier 100 % plus x drinne!
Warten wir es ab. Ich überlege nochmal aufzustocken!?!?
Gruß.
Die Studie wird kommen ob im Mai oder Juni ist zweitrangig. Wenn die News kommt, sind meiner Meinung hier 100 % plus x drinne!
Warten wir es ab. Ich überlege nochmal aufzustocken!?!?
Gruß.
Antwort auf Beitrag Nr.: 68.311.772 von pharma-trader am 26.05.21 19:03:06Ich hoffe auch auf das kleine Kursfeuerwerk nach dem OK der FDA. Daran könnten sich weitere Erfolge anschließen wie z.B. die Gewinnung neuer Lizenspartnerschaften.
Risiken sind vielleicht weitere Nachforderungen oder gar Ablehnung der Studie durch die FDA bzw. Avion springt ab und investiert nicht weiter in Lupuzor.
Risiken sind vielleicht weitere Nachforderungen oder gar Ablehnung der Studie durch die FDA bzw. Avion springt ab und investiert nicht weiter in Lupuzor.
Antwort auf Beitrag Nr.: 68.311.772 von pharma-trader am 26.05.21 19:03:06Da erwarte ich aber mind. 5x vom jetzigen Level
So ausgetrocknet der Kurs
So ausgetrocknet der Kurs
Gibt es schon News bzw. erwartet ihr News im Juni?
Antwort auf Beitrag Nr.: 68.371.109 von liquidx am 01.06.21 18:33:07Im Juni gibt es ein update. Davon gehe ich fest aus!
Ok, dann drücken wir die Daumen für gute News...
Mittagsruhe
Aus einem englischen Forum:"Imm is quieter than a monastery at lunch time...."
Die Ruhe vor dem Sturm? Noch gut zwei Wochen im Juni...
Gespenstig diese Ruhe hier, wann erwartet man die Ergebnisse?
Antwort auf Beitrag Nr.: 68.547.858 von Dreegsagg am 18.06.21 11:12:57Zumindest angekündigt ist das Treffen mit der FDA für Q2/21. Ein update sollte also demnächst erfolgen. Mehr kann man dazu wohl nicht sagen, außer dass das Warten und der ausgetrocknete newsflow nerven.
Die Woche der Wahrheit beginnt. Ich habe mir nochmals die Homepage von Immupharma genau angeschaut und beschlossen, dass der Auftritt für mich vertrauenswürdig ist. Also hop oder top: noch ein bisserl nachgelegt  .
.
 .
.
Moinsen,
das mit den Timeline Q2 ist so ne Sache. Das keine News bis heute gekommen ist, ist für mich kein gutes Zeichen. In Zeiten mit gab es schon einige Verzögerungen seitens von der FDA.
Warten wir mal ab.
das mit den Timeline Q2 ist so ne Sache. Das keine News bis heute gekommen ist, ist für mich kein gutes Zeichen. In Zeiten mit gab es schon einige Verzögerungen seitens von der FDA.
Warten wir mal ab.
Antwort auf Beitrag Nr.: 68.578.081 von pharma-trader am 22.06.21 12:24:52
Ich meinte "in Zeiten mit Corona"
Zitat von pharma-trader: Moinsen,
das mit den Timeline Q2 ist so ne Sache. Das keine News bis heute gekommen ist, ist für mich kein gutes Zeichen. In Zeiten mit gab es schon einige Verzögerungen seitens von der FDA.
Warten wir mal ab.
Ich meinte "in Zeiten mit Corona"
ImmuPharma plc email alerting service
ImmuPharma PLC("ImmuPharma" or the "Company")
FDA to agree on the Lupzuor™ PK study via a written response to "Type C" meeting as Avion prepares for international Phase 3 trial
ImmuPharma PLC (LSE:IMM) (Euronext Growth Brussels: ALIMM), the specialist drug discovery and development company, announces that its US Lupuzor™ partner, Avion Pharmaceuticals ("Avion") has received a positive response from the US Food & Drug Administration ("FDA") for a "Type C" meeting. The FDA has advised that they do not require a formal face to face meeting and will provide their written response to Avion approximately by the end of July 2021.
As noted in our previous announcement of 9 February, this is the final guidance meeting at which the FDA will review the proposed methodology of the pharmacokinetic ("PK") study. This study was requested by the FDA as part of the new optimised international Phase 3 trial of Lupuzor™ in systemic lupus erythematosus ("SLE"), a potentially life-threatening autoimmune disease.
ImmuPharma will provide an update as soon as Avion has received the written response from the FDA and advised ImmuPharma of the next steps and timetable towards commencing the Phase 3 trial this year.
Commenting on the announcement, Tim Franklin, COO of ImmuPharma said:
"We continue to acknowledge the FDA's support following constructive meetings and feedback this year with our partner Avion. ImmuPharma and Avion are fully committed to commencing the Lupuzor™ Phase 3 trial in Lupus patients this year. Again, we reiterate Lupuzor's™ unique mechanism of action and robust safety profile to date, which we believe will position Lupuzor™ as a first line therapy to many Lupus sufferers globally."
Mittelmäßige News und so reagiert der auch. Jetzt heißt es bis Ende Juli warten. Meiner Meinung nach wird das dieses Jahr nichts mit dem Start der Studie!?!?
Bleibe aber drinne, mit der Hoffnung, dass die Studie doch irgendwann beginnt.
Gruß.
Bleibe aber drinne, mit der Hoffnung, dass die Studie doch irgendwann beginnt.
Gruß.
Mühsam ernährt sich das Eichhörnchen. Immerhin es geht weiter.
Ich interpretiere die Meldung als positiv und bleibe auch investiert  .
.
 .
.
Ich rechne mit dem Bescheid der FDA am 23.07.2021. 30 Tage nach der letzten news. Und bis dahin hoffentlich ansteigende Kurse...
Na dann hoffen wir mal, dass du recht behältst. Ich finde nach wie vor, dass lupuzor ein mega Potential hat.
Hoffe das avion die 3 Studie Professioneller gestalten und zur Zulassung bringen kann.
Bleibe drinne!
Hoffe das avion die 3 Studie Professioneller gestalten und zur Zulassung bringen kann.
Bleibe drinne!
General Meeting 28 Juni 2012
[
[
Antwort auf Beitrag Nr.: 68.669.872 von bmuesli am 02.07.21 08:45:38Insgesamt beruhigend, was Tim McCarthy im Rahmen der Q&A Session sagte. Anscheinend gibt es eine verlässliche und zielführende Zusammenarbeit mit Avion. Jetzt muss noch die FDA mitspielen und Ende Juli liefern:
"From the AGM on Monday this week, the Chairman stated:
"So there are absolutely no misunderstandings, we're committed, they're committed [Avion]. Our target is to get the Phase 3 started before the end of this year. We actually see no reason why it shouldn't. We don't see any hurdles. We are actually going through a process with the FDA at the moment, which is a process. We have to go through it, it's regulatory, but it shouldn't send any negative signals to anybody at all, quite the opposite. We are getting really, really good feedback from the FDA in the very, very supportive, meetings that we are having. So I hope if anything I can alleviate people's concerns on that""
https://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM&share=Im…
"From the AGM on Monday this week, the Chairman stated:
"So there are absolutely no misunderstandings, we're committed, they're committed [Avion]. Our target is to get the Phase 3 started before the end of this year. We actually see no reason why it shouldn't. We don't see any hurdles. We are actually going through a process with the FDA at the moment, which is a process. We have to go through it, it's regulatory, but it shouldn't send any negative signals to anybody at all, quite the opposite. We are getting really, really good feedback from the FDA in the very, very supportive, meetings that we are having. So I hope if anything I can alleviate people's concerns on that""
https://www.lse.co.uk/ShareChat.asp?ShareTicker=IMM&share=Im…
Bin auch mal gespannt, wann es eine Meldung zu der geplanten Lupuzor CIDP Studie gibt. MMn könnte das ein wenig Dynamik in die Sache bringen.
Aus dem Jahresbericht 2020 vom 29.04.2021:
"Proof of Concept study planned for Lupuzor™ in CIDP patients – potential Orphan Drug designation"
Aus dem Jahresbericht 2020 vom 29.04.2021:
"Proof of Concept study planned for Lupuzor™ in CIDP patients – potential Orphan Drug designation"
Wenn ich es richtig sehe, ist eine beschleunigte Zulassung von Lupuzor nicht ausgeschlossen worden. Vielleicht erfahren wir auch dazu Ende Juli mehr.
Aus der Pressemitteilung vom 09.02.2021:
"As part of the FDA feedback from the meeting on 4 December 2020, it has been clarified that a Special Protocol Assessment (“SPA”) will not be applicable and a conditional approval of Lupuzor™, whilst the Phase 3 trial is underway, has not been confirmed at this time."
Aus der Pressemitteilung vom 09.02.2021:
"As part of the FDA feedback from the meeting on 4 December 2020, it has been clarified that a Special Protocol Assessment (“SPA”) will not be applicable and a conditional approval of Lupuzor™, whilst the Phase 3 trial is underway, has not been confirmed at this time."
Bei welchem Handelsplatz oder Plattform prüft ihr denn den Kurs hier ?
Dieser ist bei W immer stark zeitversetzt abgebildet.
immer stark zeitversetzt abgebildet.
Dieser ist bei W
 immer stark zeitversetzt abgebildet.
immer stark zeitversetzt abgebildet.
16 July 2021
ImmuPharma PLC
("ImmuPharma" or the "Company")
BOARD APPOINTMENT
ImmuPharma PLC (LSE:IMM) | Euronext Growth Brussels: ALIMM), the specialist drug discovery and development company, is delighted to announce the appointment of Dr Tim Franklin, Chief Operating Officer, to the Board of Directors.
Tim has worked with ImmuPharma for over three years, initially as a consultant and more recently was appointed as Chief Operating Officer in November 2020. Tim's key responsibilities include working closely with ImmuPharma's clinical team and scientific advisors, as the Company looks to further progress its wider drug development portfolio, both through clinical development and partnering opportunities.
In addition, Tim will lead the relationship with Avion Pharmaceuticals, as the Company advances Lupuzor™ through its Phase 3 trial and regulatory processes involved in the ultimate approval of the drug.
Tim has over 30 years' experience in the biopharmaceutical industry. He worked in clinical research, sales & marketing, and global strategic marketing for Warner Lambert, Wellcome and SmithKline Beecham. He later moved to the capital markets where he became a top-ranked pharmaceuticals analyst at Dresdner Kleinwort investment bank. He applied his experience to stock selection at hedge funds and advised several small biotechnology companies on corporate and commercial strategy and access to capital. He holds a BSc in Medicinal Chemistry and a PhD in Pharmacology from Loughborough University and an MBA from Warwick Business School.
Commenting on the appointment, Tim McCarthy, Chairman said: "It is a pleasure to welcome Tim onto the Board of Directors. Tim has made an invaluable contribution to ImmuPharma over the last three years. During this time, he played a key role in negotiations, which resulted in the successful conclusion of the licensing deal with Avion Pharmaceuticals, our partner for Lupuzor™, which is now close to embarking on its international Phase 3 trial. His extensive pharmaceutical and capital markets experience will contribute enormously to the team as we look to move into the next phase of our journey for the Company."
End
ImmuPharma PLC
("ImmuPharma" or the "Company")
BOARD APPOINTMENT
ImmuPharma PLC (LSE:IMM) | Euronext Growth Brussels: ALIMM), the specialist drug discovery and development company, is delighted to announce the appointment of Dr Tim Franklin, Chief Operating Officer, to the Board of Directors.
Tim has worked with ImmuPharma for over three years, initially as a consultant and more recently was appointed as Chief Operating Officer in November 2020. Tim's key responsibilities include working closely with ImmuPharma's clinical team and scientific advisors, as the Company looks to further progress its wider drug development portfolio, both through clinical development and partnering opportunities.
In addition, Tim will lead the relationship with Avion Pharmaceuticals, as the Company advances Lupuzor™ through its Phase 3 trial and regulatory processes involved in the ultimate approval of the drug.
Tim has over 30 years' experience in the biopharmaceutical industry. He worked in clinical research, sales & marketing, and global strategic marketing for Warner Lambert, Wellcome and SmithKline Beecham. He later moved to the capital markets where he became a top-ranked pharmaceuticals analyst at Dresdner Kleinwort investment bank. He applied his experience to stock selection at hedge funds and advised several small biotechnology companies on corporate and commercial strategy and access to capital. He holds a BSc in Medicinal Chemistry and a PhD in Pharmacology from Loughborough University and an MBA from Warwick Business School.
Commenting on the appointment, Tim McCarthy, Chairman said: "It is a pleasure to welcome Tim onto the Board of Directors. Tim has made an invaluable contribution to ImmuPharma over the last three years. During this time, he played a key role in negotiations, which resulted in the successful conclusion of the licensing deal with Avion Pharmaceuticals, our partner for Lupuzor™, which is now close to embarking on its international Phase 3 trial. His extensive pharmaceutical and capital markets experience will contribute enormously to the team as we look to move into the next phase of our journey for the Company."
End
Angekündigte Genehmigung der Phase III Studie Ende Juli. Noch 7 verbleibende Handelstage. Ich warte auf die Imm-Kursrakete 📈
Ich warte auch.
Was ich aber nicht nachvollziehen an dem Deal mit avion ist,
Wiese haben die Immupharma nicht einfach übernommen??
Die firma ist momentan schlappe 22 mio wert!?!
Die fda ist unberechenbar, Siehe Ardx, da haben sie diese Woche keine Anhörung der Firma zugelassen.
Warten wir ab.
Gruß
Was ich aber nicht nachvollziehen an dem Deal mit avion ist,
Wiese haben die Immupharma nicht einfach übernommen??
Die firma ist momentan schlappe 22 mio wert!?!
Die fda ist unberechenbar, Siehe Ardx, da haben sie diese Woche keine Anhörung der Firma zugelassen.
Warten wir ab.
Gruß
Verzögerungen und Ablehnungen sind jederzeit drin. Da ist die FDA eine black box. Interessant ist, dass die FDA selbst ihre Antwort für Ende Juli angekündigt hat und die finale guidance erwartet wird.
Avion ist wahrscheinlich den für sie lukrativsten Deal eingegangen und hat sich den weltweit größten Lupusmarkt gesichert.
Avion ist wahrscheinlich den für sie lukrativsten Deal eingegangen und hat sich den weltweit größten Lupusmarkt gesichert.
Recht erstaunlich finde ich, dass so wenige Tage vor dem zu erwartenden Rollout praktisch kein Handel stattfindet. Es wird weder dagegen, noch dafür spekuliert, dass das hier etwas wird. Es scheint so zu sein, dass die Enttäutschten längst weg sind und die Übriggebliebenen für sich getrost den Titel "Letzte Mohikaner" anheften dürfen. Nun denn. Ich bin seit einiger Zeit auch so einer und frohen Mutes, dass wir weiterkommen. Im Misserfolgsfall geht wahrscheinlich alles sehr schnell. Ob sich im Erfolgsfall eine positive FDA-Entscheidung schnell herumsprechen wird, wird sich dann weisen 💕☕💕...
Antwort auf Beitrag Nr.: 68.839.650 von Millionenbaby am 21.07.21 18:02:30Gute Beobachtung. Aus moralischen Gründen, finde ich, sind jetzt jedoch die, nach endlosem Warten, ausgelaugten Mohikaner dran. Am Tag der Erfolgsmeldung werde ich bei einer 💕☕💕 am Bildschirm sitzen und für die ein oder andere Imm-Aktie den Verkaufsbutton drücken🙂
Antwort auf Beitrag Nr.: 68.839.911 von Getsbio am 21.07.21 18:29:27
Aber bitte nicht unter 1,00 €
Zitat von Getsbio: Gute Beobachtung. Aus moralischen Gründen, finde ich, sind jetzt jedoch die, nach endlosem Warten, ausgelaugten Mohikaner dran. Am Tag der Erfolgsmeldung werde ich bei einer 💕☕💕 am Bildschirm sitzen und für die ein oder andere Imm-Aktie den Verkaufsbutton drücken🙂
Aber bitte nicht unter 1,00 €

Vielleicht hat die FDA ihr Antwortschreiben schon rausgeschickt und wir Mohikaner bekommen die Entscheidung morgen früh zum ersten Kaffee serviert. 

Antwort auf Beitrag Nr.: 68.848.719 von Getsbio am 22.07.21 16:21:27Das würde ich nicht ausschließen. Hier kann jeden Tag die Meldung kommen 💕☕💕... Ich vermute, dass die Nachricht zuerst bei Avion eintrifft.
Antwort auf Beitrag Nr.: 68.849.028 von Millionenbaby am 22.07.21 16:48:05da gab es seit Januar keine News mehr. 
https://avionrx.com/news/

https://avionrx.com/news/
Antwort auf Beitrag Nr.: 68.838.363 von Getsbio am 21.07.21 16:11:14
Ob das was wird mit dem Raketenstart? Der Biotech Sektor ist momentan in der Korrektur (Siehe NBI)
Da müssten wir schon Glück haben, wenn die erwartete PR dafür reichen würde. Allerdings ist der Kurs
natürlich auch ganz am Boden. Lass mich überraschen.
Gruß aaahhh
Zitat von Getsbio: Angekündigte Genehmigung der Phase III Studie Ende Juli. Noch 7 verbleibende Handelstage. Ich warte auf die Imm-Kursrakete 📈
Ob das was wird mit dem Raketenstart? Der Biotech Sektor ist momentan in der Korrektur (Siehe NBI)
Da müssten wir schon Glück haben, wenn die erwartete PR dafür reichen würde. Allerdings ist der Kurs
natürlich auch ganz am Boden. Lass mich überraschen.
Gruß aaahhh
Unheimlich viele Besucher hier, für einen Samstag ohne Nachrichten. Wahrscheinlich weil aaahhh geschrieben hat...
Dann nutze ich mal die Gelegenheit, allen ein schönes Wochenende zu wünschen. Auf eine erfolgreiche Börsenwoche. Nach all den Verzögerungen und Hindernissen, ist die Zeit reif für eine klare, positive Botschaft der FDA zum Start der Lupuzor Phase III Studie!
Dann nutze ich mal die Gelegenheit, allen ein schönes Wochenende zu wünschen. Auf eine erfolgreiche Börsenwoche. Nach all den Verzögerungen und Hindernissen, ist die Zeit reif für eine klare, positive Botschaft der FDA zum Start der Lupuzor Phase III Studie!
Antwort auf Beitrag Nr.: 68.863.950 von Getsbio am 24.07.21 12:42:26sollten positive News kommen dann werden sicherlich auch User Biohero der den Thread eröffnet und auch Malecon hier wieder an Bord sein.
Antwort auf Beitrag Nr.: 58.059.868 von Schwirtzl_Dane am 25.06.18 12:34:18Mein Lieblingsbeitrag. Könnte sich auch mal wieder melden, leider seit 2 Jahren offline.
Zitat von Schwirtzl_Dane: Ich melde mich jetzt nach langem mitlesen im Forum auch mal zu Wort: Als Physiker der jahrelang in der Forschungsabteilung eines großen Pharmakonzerns gearbeitet hat kann ich auf diesem Gebiet einiges an Expertise vorweisen und ich sage euch dass ImmuPharma die besten Zeiten noch vor sich hat und die Chancen hier das Risiko um ein Vielfaches überwiegen. Bei der Gruppe der Polypeptid-Proteine besteht enormes Wirkungspotential. Wie bereits geschrieben endete die Phase III der Lupus Studie mit einer Wirksamkeit von 68,8% der Patienten!!! Das ist phänomenal!!! Lediglich die hohe Ansprechrate der Placebogruppe und dadurch die Nichterreichung des selbst gesteckten Zieles ließen den Kurs abstürzen. Dies ist meiner Meinung nach nicht gerechtfertigt. Die Leute sahen einfach „Ziel nicht erreicht“ und schon wurde verkauft. Das ist auch logisch und nachvollziehbar. Allerdings bestätigt die Studie auch das hervorragende Sicherheitspotential des Medikaments, es wurde über keine schwerwiegenden unerwünschten Ergebnisse berichtet. Auch ich habe dem jetzigen Kurs nochmal einiges nachgekauft. Hinzu kommt die Meldung über P140 mit denen bereits im Mäusemodell die Expansion von P140 in einer Autoimmunindikation mit "Orphan Drug Designation“ belegt wurden. Also auch hier werden Peptidproteine erfolgversprechende Zukunftsaussichten haben.
Ich bin auf alle Fälle dabei wenn die ersten positiven Meldungen eintreffen und wir die erhofften 2-stelligen Kurse sehen werden, auch wenn dies noch einiges an Zeit in Anspruch nehmen wird.
Kurs
Hallo mich würde eure Einschätzung interessieren wo ihr den Kurs sieht nach positiver Vermeidung das die Phase 3 in naher Zukunft startet? Und wo sieht ihr den Kurs bei erfolgtem Start der Phase 3? Und wo den Kurs nach Zulassung?
Antwort auf Beitrag Nr.: 68.883.777 von dabertomalos am 27.07.21 13:51:12Nach positiver Vermeidung erwarte ich nichts Gutes 😂
Ansonsten:
1) 0,20€
2) 0,30€
3) 3,00€
Ansonsten:
1) 0,20€
2) 0,30€
3) 3,00€
Kurs
Wie kommst du denn auf so niedrige Werte? Nach Bekanntgabe des Vertrages mit Avion war der Kurs doch schon bei 27 Cent und kurz vor den Ergebnissen der Phase 3 bei 200 Cent. Wieso sollte denn nun bei neuem Start der Phase 3 bei viel höheren Chancen der Zulassung der Kurs niedriger sein?Meine Werte
1. 40-60 Cent
2. 80-100 Cent
3. 500 Cent
Antwort auf Beitrag Nr.: 68.888.658 von Getsbio am 27.07.21 20:20:57Mit latenter Phantasie waren wir schon mal bei 2 Euro
Und da geht die Reise auch wieder hin
Und da geht die Reise auch wieder hin
Antwort auf Beitrag Nr.: 68.889.048 von dabertomalos am 27.07.21 20:55:39Ein Teil der Begründung liegt in der Verwässerung die seit der Verkündung der letzten Phase III Ergebnisse stattgefunden hat.
30.01.2018: 140 Mio shares
27.07.2021: 250 Mio shares
30.01.2018: 140 Mio shares
27.07.2021: 250 Mio shares
Kurs
Wo sieht ihr denn aktuell die grösste Kunkurrenz? Bzw. gibt es überhaupt welche?
Aurinia Produkte hat ja die FDA Genehmigung erhalten, aber ist dieses gleichwertig?
Antwort auf Beitrag Nr.: 68.890.035 von Getsbio am 27.07.21 22:32:26Ich dachte es gibt insgesamt nur 250,22 Mio. Anteile davon im Umlauf? 

Antwort auf Beitrag Nr.: 68.896.725 von Turnover15 am 28.07.21 16:52:50Das ist richtig. Die aktuelle Anzahl der ausgegebenen Aktien beträgt 250,22 Mio. Anfang 2018 waren es ca. 140 Mio. Es sind also seither 110 Mio Aktien im Rahmen von Kapitalerhöhungen hinzugekommen. Das meinte ich mit Verwässerung.
Und jetzt warte ich dringend auf DIE NACHRICHT!
Und jetzt warte ich dringend auf DIE NACHRICHT!
Kurs
Kann bzw will denn keiner etwas zur Konkurrenz sagen?
Antwort auf Beitrag Nr.: 68.898.690 von dabertomalos am 28.07.21 20:00:16Aurinia Pharmaceuticals hat im Januar von der FDA die Zulassung für Lupkynis zur Behandlung von Patienten mit aktiver Lupus Nephritis erhalten. Lupus Nephritis ist eine Komplikation der Erkrankung Systemischer Lupus Erythematosus. Inwieweit der Markt für Lupuzor davon betroffen ist, vermag ich nicht zu sagen. Lupuzor würde im Erfolgsfall eine breitere Indikation erhalten, könnte ähnliche Effekte erzielen wie Lupkynis oder sogar in einer Kombinationstherapie Anwendung finden. Potential hat die Geschichte, Aurinia mit einem Produkt kommt aktuell auf eine MK von 1,5 Milliarden Euro.
Kurs
Wow.Neuer CEO bei IMMUPHARMA!!
Wie schätzt ihr dies ein? Deutet eher auf positive Rückmeldung der FDA hin oder eher das Gegenteil??
VERÄNDERUNGEN DES VORSTANDS
ImmuPharma PLC (LSE:IMM; Euronext Growth Brüssel: ALIMM), das auf Wirkstoffforschung und -entwicklung spezialisierte Unternehmen, teilt dem Verwaltungsrat Änderungen mit.
Im letzten Jahr hat ImmuPharma zusammen mit seinem Partner Avion Pharmaceuticals Lupuzor™ in Richtung seiner internationalen Phase-3-Studie vorangetrieben. Darüber hinaus war das Unternehmen aktiv bei der Neupositionierung und Weiterentwicklung seiner wichtigsten Vermögenswerte im Portfolio der früheren Entwicklungsphase, einschließlich der Programme, die in seiner hundertprozentigen Tochtergesellschaft Ureka Pharma SAS durchgeführt werden.
Zu diesem Zeitpunkt hat Dimitri Dimitriou, Chief Executive Officer ('CEO'), dem Verwaltungsrat mitgeteilt, dass er sein Amt niederlegen möchte, um eine Reihe anderer externer Möglichkeiten wahrzunehmen.
Der Verwaltungsrat dankt Dimitri für seine 16-jährige Tätigkeit und wünscht ihm für die Zukunft alles Gute.
Tim McCarthy, Chairman, wurde zum CEO ernannt. Das Unternehmen hat einen Prozess eingeleitet, um eine geeignete Person für die Übernahme des nicht geschäftsführenden Vorstandsvorsitzenden des Unternehmens zu ermitteln, und während dieser Übergangszeit wird Tim Vorsitzender bleiben.
Darüber hinaus haben Dr. Franco di Muzio, Senior Non-Executive Director ('NED') und Dr. Stéphane Méry, ('NED'), entschieden, dass jetzt für jeden von ihnen ein angemessener Zeitpunkt ist, nach 14 und 6 Jahre in diesen Rollen bzw.
Der Vorstand spricht Franco und Stéphane seinen Dank aus und wünscht beiden alles Gute für die Zukunft.
Als Folge des Rücktritts von Franco und Stéphane hat das Unternehmen die Notwendigkeit erkannt, neue NEDs zu identifizieren, um das Unternehmen durch die nächste Entwicklungsstufe zu führen, mit direkter Erfahrung im Aufbau eines diversifizierteren Arzneimittelentwicklungsgeschäfts zusammen mit aktueller öffentlicher Markterfahrung.
Wir freuen uns daher, heute die Ernennung von Dr. Sanjeev Pandya zum leitenden unabhängigen NED bekannt zu geben. Sanjeev verfügt über mehr als 25 Jahre Erfahrung im Gesundheitswesen und im internationalen Management. Sanjeev war zuvor CEO von Advanced Oncotherapy Plc, einem an der AIM notierten Spezialunternehmen für Krebsbestrahlung. Während seiner Führung sammelte Sanjeev über 100 Millionen US-Dollar und entwickelte und sicherte Partnerschaften in den USA, der EU, China, Singapur, Indien, Australien, Asien und Südamerika. Zuvor hatte Sanjeev eine Reihe von Führungspositionen in mehreren globalen klinischen Studien bei Pfizer inne und war Leiter von Europe Regulatory and Medical bei Reckitt Benckiser. Die Erfahrung, die Sanjeev in wachsende Arzneimittelentwicklungsunternehmen und die Betreuung kommerzieller und klinischer Teams einbringt, wird für ImmuPharma von unschätzbarem Wert sein, während wir unsere nächste Entwicklungsphase durchlaufen.
Darüber hinaus wurde Lisa Baderoon als NED in den Vorstand berufen. Lisa berät ImmuPharma seit dem Börsengang an AIM im Jahr 2006 und wurde 2012 zum Head of Investor Relations ernannt. Lisas Haupttätigkeiten in der letzten Zeit waren die strategische Beratung des Verwaltungsrats und die Zusammenarbeit mit Investoren, Stakeholdern und Beratern des Unternehmens. Bei ihrem Eintritt in den Verwaltungsrat wird Lisa sicherstellen, dass die Ansichten und Interessen der Aktionäre weiterhin vollständig vertreten sind. Zuvor war Lisa langjährige Partnerin bei Buchanan Communications mit Sitz in London, einer der führenden Finanz-PR-Agenturen und Teil von WPP plc, und leitete den Geschäftsbereich Healthcare. Lisa ist auch die Gründerin von Just B Communications Ltd, einem maßgeschneiderten Beratungsunternehmen für private und öffentliche Unternehmen.
Das Unternehmen hat einen Prozess eingeleitet, um einen weiteren neuen NED mit den entsprechenden Fähigkeiten und Erfahrungen zu identifizieren, der zu gegebener Zeit in den Vorstand eintreten wird.
Alle Vorstandsänderungen erfolgen mit sofortiger Wirkung.
Zu den Veränderungen im Vorstand sagte Tim McCarthy, Chief Executive Officer: „Wir möchten diese Gelegenheit nutzen, Dimitri, Franco und Stéphane für ihre harte Arbeit während ihrer Zeit im Geschäft zu danken , Dimitri hat eine beträchtliche Amtszeit als CEO mit den verschiedenen Erfolgen und Herausforderungen hinter sich, denen sich das Unternehmen im Laufe der Jahre gegenübersieht.Wir wünschen Dimitri viel Erfolg für seine zukünftigen Bemühungen.
Ich freue mich, Sanjeev im Vorstand begrüßen zu dürfen. Sanjeevs Erfahrung sowohl bei der operativen Skalierung von Arzneimittelentwicklungsgeschäften als auch seine direkte Erfahrung in der Zusammenarbeit mit Investoren sowohl in Großbritannien als auch international wird uns die entsprechenden Fähigkeiten und Kenntnisse vermitteln, die wir für die nächste Phase unserer Reise mit ImmuPharma benötigen, und er wird eine hervorragende Ergänzung zu Dr. Tim Franklin, COO, der kürzlich in den Vorstand berufen wurde.
Außerdem freue ich mich sehr, Lisa im Vorstand begrüßen zu dürfen. Da ich über mehrere Jahre mit Lisa zusammengearbeitet habe, bin ich immer wieder von ihren Führungsqualitäten und ihrer Arbeitsmoral beeindruckt. Lisa kennt die Arbeitsweise von ImmuPharma genau und ist ein wesentlicher Bestandteil der Aktionärskommunikation und -vertretung und sie wird einen enormen Beitrag zur Qualität des Verwaltungsrats leisten.
Mit meiner Ernennung zum CEO, der ImmuPharma durch diese nächste bedeutende Phase führt, bin ich fest entschlossen,
https://www.investegate.co.uk/immupharma-plc--imm-/rns/board…
ImmuPharma PLC (LSE:IMM; Euronext Growth Brüssel: ALIMM), das auf Wirkstoffforschung und -entwicklung spezialisierte Unternehmen, teilt dem Verwaltungsrat Änderungen mit.
Im letzten Jahr hat ImmuPharma zusammen mit seinem Partner Avion Pharmaceuticals Lupuzor™ in Richtung seiner internationalen Phase-3-Studie vorangetrieben. Darüber hinaus war das Unternehmen aktiv bei der Neupositionierung und Weiterentwicklung seiner wichtigsten Vermögenswerte im Portfolio der früheren Entwicklungsphase, einschließlich der Programme, die in seiner hundertprozentigen Tochtergesellschaft Ureka Pharma SAS durchgeführt werden.
Zu diesem Zeitpunkt hat Dimitri Dimitriou, Chief Executive Officer ('CEO'), dem Verwaltungsrat mitgeteilt, dass er sein Amt niederlegen möchte, um eine Reihe anderer externer Möglichkeiten wahrzunehmen.
Der Verwaltungsrat dankt Dimitri für seine 16-jährige Tätigkeit und wünscht ihm für die Zukunft alles Gute.
Tim McCarthy, Chairman, wurde zum CEO ernannt. Das Unternehmen hat einen Prozess eingeleitet, um eine geeignete Person für die Übernahme des nicht geschäftsführenden Vorstandsvorsitzenden des Unternehmens zu ermitteln, und während dieser Übergangszeit wird Tim Vorsitzender bleiben.
Darüber hinaus haben Dr. Franco di Muzio, Senior Non-Executive Director ('NED') und Dr. Stéphane Méry, ('NED'), entschieden, dass jetzt für jeden von ihnen ein angemessener Zeitpunkt ist, nach 14 und 6 Jahre in diesen Rollen bzw.
Der Vorstand spricht Franco und Stéphane seinen Dank aus und wünscht beiden alles Gute für die Zukunft.
Als Folge des Rücktritts von Franco und Stéphane hat das Unternehmen die Notwendigkeit erkannt, neue NEDs zu identifizieren, um das Unternehmen durch die nächste Entwicklungsstufe zu führen, mit direkter Erfahrung im Aufbau eines diversifizierteren Arzneimittelentwicklungsgeschäfts zusammen mit aktueller öffentlicher Markterfahrung.
Wir freuen uns daher, heute die Ernennung von Dr. Sanjeev Pandya zum leitenden unabhängigen NED bekannt zu geben. Sanjeev verfügt über mehr als 25 Jahre Erfahrung im Gesundheitswesen und im internationalen Management. Sanjeev war zuvor CEO von Advanced Oncotherapy Plc, einem an der AIM notierten Spezialunternehmen für Krebsbestrahlung. Während seiner Führung sammelte Sanjeev über 100 Millionen US-Dollar und entwickelte und sicherte Partnerschaften in den USA, der EU, China, Singapur, Indien, Australien, Asien und Südamerika. Zuvor hatte Sanjeev eine Reihe von Führungspositionen in mehreren globalen klinischen Studien bei Pfizer inne und war Leiter von Europe Regulatory and Medical bei Reckitt Benckiser. Die Erfahrung, die Sanjeev in wachsende Arzneimittelentwicklungsunternehmen und die Betreuung kommerzieller und klinischer Teams einbringt, wird für ImmuPharma von unschätzbarem Wert sein, während wir unsere nächste Entwicklungsphase durchlaufen.
Darüber hinaus wurde Lisa Baderoon als NED in den Vorstand berufen. Lisa berät ImmuPharma seit dem Börsengang an AIM im Jahr 2006 und wurde 2012 zum Head of Investor Relations ernannt. Lisas Haupttätigkeiten in der letzten Zeit waren die strategische Beratung des Verwaltungsrats und die Zusammenarbeit mit Investoren, Stakeholdern und Beratern des Unternehmens. Bei ihrem Eintritt in den Verwaltungsrat wird Lisa sicherstellen, dass die Ansichten und Interessen der Aktionäre weiterhin vollständig vertreten sind. Zuvor war Lisa langjährige Partnerin bei Buchanan Communications mit Sitz in London, einer der führenden Finanz-PR-Agenturen und Teil von WPP plc, und leitete den Geschäftsbereich Healthcare. Lisa ist auch die Gründerin von Just B Communications Ltd, einem maßgeschneiderten Beratungsunternehmen für private und öffentliche Unternehmen.
Das Unternehmen hat einen Prozess eingeleitet, um einen weiteren neuen NED mit den entsprechenden Fähigkeiten und Erfahrungen zu identifizieren, der zu gegebener Zeit in den Vorstand eintreten wird.
Alle Vorstandsänderungen erfolgen mit sofortiger Wirkung.
Zu den Veränderungen im Vorstand sagte Tim McCarthy, Chief Executive Officer: „Wir möchten diese Gelegenheit nutzen, Dimitri, Franco und Stéphane für ihre harte Arbeit während ihrer Zeit im Geschäft zu danken , Dimitri hat eine beträchtliche Amtszeit als CEO mit den verschiedenen Erfolgen und Herausforderungen hinter sich, denen sich das Unternehmen im Laufe der Jahre gegenübersieht.Wir wünschen Dimitri viel Erfolg für seine zukünftigen Bemühungen.
Ich freue mich, Sanjeev im Vorstand begrüßen zu dürfen. Sanjeevs Erfahrung sowohl bei der operativen Skalierung von Arzneimittelentwicklungsgeschäften als auch seine direkte Erfahrung in der Zusammenarbeit mit Investoren sowohl in Großbritannien als auch international wird uns die entsprechenden Fähigkeiten und Kenntnisse vermitteln, die wir für die nächste Phase unserer Reise mit ImmuPharma benötigen, und er wird eine hervorragende Ergänzung zu Dr. Tim Franklin, COO, der kürzlich in den Vorstand berufen wurde.
Außerdem freue ich mich sehr, Lisa im Vorstand begrüßen zu dürfen. Da ich über mehrere Jahre mit Lisa zusammengearbeitet habe, bin ich immer wieder von ihren Führungsqualitäten und ihrer Arbeitsmoral beeindruckt. Lisa kennt die Arbeitsweise von ImmuPharma genau und ist ein wesentlicher Bestandteil der Aktionärskommunikation und -vertretung und sie wird einen enormen Beitrag zur Qualität des Verwaltungsrats leisten.
Mit meiner Ernennung zum CEO, der ImmuPharma durch diese nächste bedeutende Phase führt, bin ich fest entschlossen,
https://www.investegate.co.uk/immupharma-plc--imm-/rns/board…
Kurs
Irgendwie scheint sich mit dem Wert hier ja niemand so wirklich auszukennen bzw. mit dem Thema Lupus....
Moin, bin schon seit ca. 4 Jahren investiert.
Ich finde den lupus Markt unheimlich interessant und spannend.
Nur es gibt nichts zu schreiben, es ist schon soviel geschrieben und diskutiert worden.
Wir brachen hier die Scheiß News, das die Phase 3 losgeht, dann geht hier auch wieder was und dann wird auch wieder Immupharma interessant für neue Anleger.
Bis dahin heißt es antworten !
Schönes WE!
Ich finde den lupus Markt unheimlich interessant und spannend.
Nur es gibt nichts zu schreiben, es ist schon soviel geschrieben und diskutiert worden.
Wir brachen hier die Scheiß News, das die Phase 3 losgeht, dann geht hier auch wieder was und dann wird auch wieder Immupharma interessant für neue Anleger.
Bis dahin heißt es antworten !
Schönes WE!
Darüber hinaus war das Unternehmen aktiv bei der Neupositionierung und Weiterentwicklung seiner wichtigsten Vermögenswerte im Portfolio der früheren Entwicklungsphase, einschließlich der Programme, die in seiner hundertprozentigen Tochtergesellschaft Ureka Pharma SAS durchgeführt werden.
https://urekapharma.com/pipeline/
https://urekapharma.com/pipeline/
Antwort auf Beitrag Nr.: 68.926.614 von bmuesli am 01.08.21 08:18:26Das war mir noch garnicht bekannt, dass dies eine 100% Beteiligung ist 👍🏻
Kurs
Das wundert mich jetzt, dass keine einzige Person auf den Wechsel des CEO eingeht.... Als wenn es nix wäre... Des weiteren ebenfalls kein Wort zur Konkurrenz GSK bzw. Aurinia…. oder ggf weiterer Konkurrenz die sich ebenfalls in fortgeschrittenen Phasen befindet....
Sehr seltsam....
Kurs
Sind die Phase3 Daten von Aurinia, AstraZeneca oder Immupharma (in der angepeilten Patiengruppe der neuen Phase 3) besser?
Die Daten der unterschiedlichen Phase III Studien miteinander vergleichen zu wollen, dürfte ein schwieriges, wenn nicht gar unmögliches Unterfangen darstellen (lasse mich aber gerne vom Gegenteil überzeugen), da die Hersteller unterschiedliche scores einsetzen bzw. von den Zulassungsbehörden genehmigt wurden.
Astra Zeneca (TULIP 2) primary endpoint: British Isles Lupus Assessment Group–based Composite Lupus Assessment (BICLA).
Immupharma primary endpoint: SLE Responder Index (SRI-4)
Astra Zeneca (TULIP 2) primary endpoint: British Isles Lupus Assessment Group–based Composite Lupus Assessment (BICLA).
Immupharma primary endpoint: SLE Responder Index (SRI-4)
In diesem Zusammenhang wird es interessant sein, zu sehen, wie das Studiendesign der neuen ImmuPharma Phase III Studie adaptiert wurde. Hoffentlich eine Frage von Stunden, Tagen, ...😂
333 Aufrufe heute. Unsere ImmuPharma kommt noch groß raus💕. Mal sehen, was der Rest der Woche einbringt. Fingers crossed und 👍
Kurs
Irgendwie kommt nichts ...... Board Changes - 30th July 2021
Es macht mich zuversichtlich, dass ImmuPharma das Management Team hochkarätig nachbesetzen konnte:"We are therefore pleased to announce today the appointment of Dr Sanjeev Pandya as Senior independent NED. Sanjeev has over 25 years of healthcare and international management experience. Sanjeev was formerly CEO of Advanced Oncotherapy Plc, a specialist cancer radiotherapy business listed on AIM. During his leadership, Sanjeev raised over $100m and developed and secured partnerships in the USA, EU, China, Singapore, India, Australia, Asia and South America. Formerly, Sanjeev had a number of leadership roles in several global clinical trials at Pfizer and was head of Europe Regulatory and Medical at Reckitt Benckiser. The experience Sanjeev brings in growing drug development businesses and mentoring commercial and clinical teams, will be hugely invaluable to ImmuPharma, as we move through our next phase of development."
Kurs
Werden die vereinbarten bis zu 17 Prozent Lizenzgebühren eigentlich vom Umsatz oder Gewinn berechnet? Beitrag zu dieser Diskussion schreiben
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +2,07 | |
| 0,00 | |
| -0,79 | |
| 0,00 | |
| +0,90 | |
| -0,79 | |
| 0,00 | |
| +0,11 | |
| +2,52 | |
| +2,45 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 212 | ||
| 133 | ||
| 88 | ||
| 71 | ||
| 50 | ||
| 35 | ||
| 31 | ||
| 28 | ||
| 25 | ||
| 24 |





















