Biotech Depot - verschiede Werte und Strategien - 500 Beiträge pro Seite (Seite 2)
eröffnet am 06.04.12 20:55:15 von
neuester Beitrag 15.12.21 20:44:42 von
neuester Beitrag 15.12.21 20:44:42 von
Beiträge: 2.765
ID: 1.173.523
ID: 1.173.523
Aufrufe heute: 0
Gesamt: 306.557
Gesamt: 306.557
Aktive User: 0
Top-Diskussionen
| Titel | letzter Beitrag | Aufrufe |
|---|---|---|
| vor 46 Minuten | 3181 | |
| gestern 11:20 | 2019 | |
| gestern 18:31 | 1986 | |
| gestern 19:39 | 1786 | |
| vor 1 Stunde | 1602 | |
| gestern 15:11 | 1424 | |
| gestern 09:52 | 1242 | |
| vor 28 Minuten | 1051 |
Meistdiskutierte Wertpapiere
| Platz | vorher | Wertpapier | Kurs | Perf. % | Anzahl | ||
|---|---|---|---|---|---|---|---|
| 1. | 1. | 18.161,01 | +1,36 | 217 | |||
| 2. | 3. | 0,1885 | -0,26 | 90 | |||
| 3. | 2. | 1,1800 | -14,49 | 77 | |||
| 4. | 5. | 9,3500 | +1,14 | 60 | |||
| 5. | 4. | 168,29 | -1,11 | 50 | |||
| 6. | Neu! | 0,4400 | +3,53 | 36 | |||
| 7. | Neu! | 4,7950 | +6,91 | 34 | |||
| 8. | Neu! | 11,905 | +14,97 | 31 |
Antwort auf Beitrag Nr.: 45.517.921 von ipollit am 25.09.13 23:28:28da könntest du recht haben. in Sachen biotech funtioniert seit ca. zwei jahren so gut wie alles. der klare outperformer seit der Finanzkrise, zusammen mit dem healthcare-bereich.
meine größten gewinner waren seit 2011 durchgehend biotechs oder healthcare Aktien.(2011 qcor, 2012 pcyc, mdvn, 2013 snts, adus und seit neuestem acad.
momentan schöne Konsolidierungsphasen von Aktien, bei denen sich ausbruchtrades anbieten sind z. b.
aegr, aiq, lgnd, amri
meine größten gewinner waren seit 2011 durchgehend biotechs oder healthcare Aktien.(2011 qcor, 2012 pcyc, mdvn, 2013 snts, adus und seit neuestem acad.
momentan schöne Konsolidierungsphasen von Aktien, bei denen sich ausbruchtrades anbieten sind z. b.
aegr, aiq, lgnd, amri
Antwort auf Beitrag Nr.: 45.517.921 von ipollit am 25.09.13 23:28:28 Gibt es noch interessante Werte, die nicht Mrd MKs haben?
Alleine diese Frage deutet ja doch eine gewisse Überbewertung an. Bei den letzten IPOs war ja auch die eine oder andere ambitionierte Bewertung dabei. Die Konsolidierung wird natürlich kommen - die Frage ist nur wann. Ich glaube, dass dann mal wieder alle Biotechs mehr oder weniger abverkauft werden. Aber man kann ja nie wissen...vielleicht ist es schonmal eine gute Strategie Teilgewinne mitzunehmen.
Auch wenn es nichts mit Biotech zu tun hat - oder vielleicht genau deswegen möchte ich an dieser Stelle auf den Gebert-Indikator aufmerksam machen. Der hat bisher erstaunlich gut beim Dax funktioniert. Nach gewissen Faktoren wird hier entweder Dax long gekauft (grün) oder in den Geldmarkt investiert (rot). Eventuell geht der im Frühjahr auf verkaufen. Bisher war das Timing hier erstaunlich gut. Auf den ersten Blick scheinen durchaus Parallelen zum NBI erkennbar.
http://www.gebert-börsenindikator.de/


SG kmastra
Alleine diese Frage deutet ja doch eine gewisse Überbewertung an. Bei den letzten IPOs war ja auch die eine oder andere ambitionierte Bewertung dabei. Die Konsolidierung wird natürlich kommen - die Frage ist nur wann. Ich glaube, dass dann mal wieder alle Biotechs mehr oder weniger abverkauft werden. Aber man kann ja nie wissen...vielleicht ist es schonmal eine gute Strategie Teilgewinne mitzunehmen.
Auch wenn es nichts mit Biotech zu tun hat - oder vielleicht genau deswegen möchte ich an dieser Stelle auf den Gebert-Indikator aufmerksam machen. Der hat bisher erstaunlich gut beim Dax funktioniert. Nach gewissen Faktoren wird hier entweder Dax long gekauft (grün) oder in den Geldmarkt investiert (rot). Eventuell geht der im Frühjahr auf verkaufen. Bisher war das Timing hier erstaunlich gut. Auf den ersten Blick scheinen durchaus Parallelen zum NBI erkennbar.
http://www.gebert-börsenindikator.de/

SG kmastra
Antwort auf Beitrag Nr.: 45.524.425 von kmastra am 26.09.13 21:39:32na dann haben wir ja noch ein halbes jahr Galgenfrist






Antwort auf Beitrag Nr.: 45.531.413 von steven_trader am 27.09.13 22:10:29Galgenfrist
Aber ewig wird es so nicht weiter gehen - klar.
Der CEO von Array trat jetzt bei Cramer auf.
http://video.cnbc.com/gallery/?video=3000202773&__source=yah…

Aber ewig wird es so nicht weiter gehen - klar.
Der CEO von Array trat jetzt bei Cramer auf.
http://video.cnbc.com/gallery/?video=3000202773&__source=yah…
SNTA, INFI
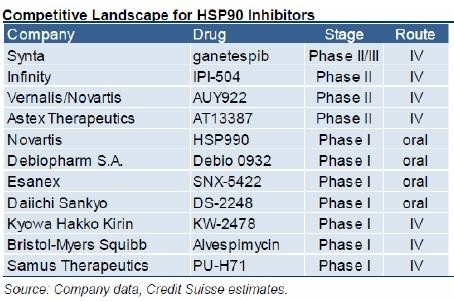
vor ein paar Tagen kamen negative PII-Ergebnisse zu INFIs Hsp90 Retaspimycin, einem Inhibitor der ersten Generation. Die Indikation war ähnlich wie die von SNTAs PIII... NSCLC in Kombination mit Docetaxel. Allerdings gab es auch einen größeren Unterschied, denn INFI hat speziell nur squamous NSCLC getestet, während SNTA genau diese Gruppe ausgeschlossen hat ("Ganetespib is also being tested in combination with docetaxel in NSCLC, but in non-squamous patients."). Dies war immer schon etwas merkwürdig gewesen. Interessant fand ich zudem die Kombi mit einem mTOR-Hemmer ("A second study is testing retaspimycin in combination with everolimus in NSCLC patients with KRAS activating mutations. Approximately 30% of NSCLC patients have a KRAS mutation")... diese PI-Studie führt INFI noch fort, die weiter Entwicklung ist aber momentan auf Eis gelegt.
http://online.wsj.com/article/PR-CO-20130925-904870.html
Retaspimycin HCl did not meet its pre-specified efficacy endpoints for demonstrating an improvement in overall survival in the total patient population or in patients with squamous cell carcinoma. In addition, the combination did not show a treatment benefit in patient populations defined by pre-specified biomarkers, including KRAS, p53 and plasma levels of Hsp90-alpha. The safety profile of retaspimycin HCl plus docetaxel was comparable to docetaxel and placebo.
https://www.chimeraresearchgroup.com/2012/05/heat-shock-prot…
...
The HSP90 protein is a molecular chaperone, and as such is responsible for the folding, activation, and/or stability of scores of “client” proteins in the cell. While active in normal cells, HSP90 is over-expressed in cancer cells and plays a critical role in maintaining the activation of oncogenic proteins, managing cell stress, and promoting malignant transformation and tumor progression.
The critical involvement of HSP90 in a diverse group of cellular functions allows these drugs to hold promise in cancer therapy via a variety of mechanisms. Virtually all of these applications for HSP90 inhibition have been validated in preclinical studies, but few clinical results are available to date. HSP90 inhibitors may be able to:
- Sensitize cancer cells to treatment with traditional cytotoxic chemotherapy agents
- Overcome resistance to targeted kinase inhibitors (TKIs) that occurs via either mutations or activation of bypass pathways
- Exhibit single agent anti-tumor activity in cancers driven by a predominant, HSP90-addicted oncoprotein such as HER2, ALK, or BRAF.
- Block the accumulation of multiple mutated forms of signaling and regulatory proteins
- Resist resistance – no mutation has ever been described that conferred resistance to an HSP90 inhibitor
Initial clinical studies failed to deliver on the rationale for targeting HSP90. First-generation inhibitors derived from the natural product geldanamycin (**see note below) displayed insufficient potency and unacceptable toxicity. Then, a number of potent second-generation HSP90 inhibitors with “improvements” in medicinal chemistry properties such as solubility and oral bioavailability were found to cause significant ocular toxicity. The HSP90 inhibitor field has survived these major setbacks and stands ready for its next (perhaps last) chance at success.
...
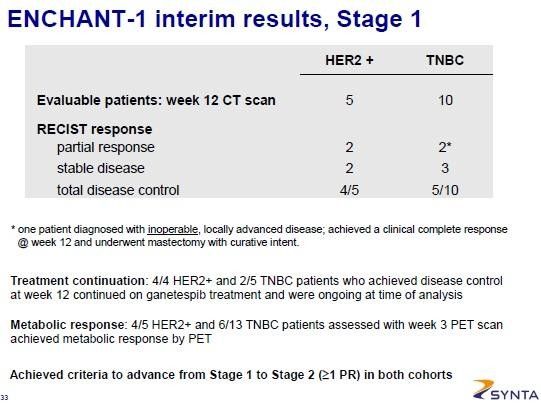
SNTA müsste an diesem Wochenende auf der ESMO noch detailierte Daten zur Galaxy1 PII liefern (Ergebnisse als solche sind schon bekannt):

Jemand auf Twitter meinte, dass TNBC (Brustkrebs) eine interessantere Indikation für Hsp90 wäre... hierzu hat SNTA auch Studien. Einen CR (n=10) gab es in ENCHANT-1:
Gruß
ipollit
vor ein paar Tagen kamen negative PII-Ergebnisse zu INFIs Hsp90 Retaspimycin, einem Inhibitor der ersten Generation. Die Indikation war ähnlich wie die von SNTAs PIII... NSCLC in Kombination mit Docetaxel. Allerdings gab es auch einen größeren Unterschied, denn INFI hat speziell nur squamous NSCLC getestet, während SNTA genau diese Gruppe ausgeschlossen hat ("Ganetespib is also being tested in combination with docetaxel in NSCLC, but in non-squamous patients."). Dies war immer schon etwas merkwürdig gewesen. Interessant fand ich zudem die Kombi mit einem mTOR-Hemmer ("A second study is testing retaspimycin in combination with everolimus in NSCLC patients with KRAS activating mutations. Approximately 30% of NSCLC patients have a KRAS mutation")... diese PI-Studie führt INFI noch fort, die weiter Entwicklung ist aber momentan auf Eis gelegt.
http://online.wsj.com/article/PR-CO-20130925-904870.html
Retaspimycin HCl did not meet its pre-specified efficacy endpoints for demonstrating an improvement in overall survival in the total patient population or in patients with squamous cell carcinoma. In addition, the combination did not show a treatment benefit in patient populations defined by pre-specified biomarkers, including KRAS, p53 and plasma levels of Hsp90-alpha. The safety profile of retaspimycin HCl plus docetaxel was comparable to docetaxel and placebo.

https://www.chimeraresearchgroup.com/2012/05/heat-shock-prot…
...
The HSP90 protein is a molecular chaperone, and as such is responsible for the folding, activation, and/or stability of scores of “client” proteins in the cell. While active in normal cells, HSP90 is over-expressed in cancer cells and plays a critical role in maintaining the activation of oncogenic proteins, managing cell stress, and promoting malignant transformation and tumor progression.
The critical involvement of HSP90 in a diverse group of cellular functions allows these drugs to hold promise in cancer therapy via a variety of mechanisms. Virtually all of these applications for HSP90 inhibition have been validated in preclinical studies, but few clinical results are available to date. HSP90 inhibitors may be able to:
- Sensitize cancer cells to treatment with traditional cytotoxic chemotherapy agents
- Overcome resistance to targeted kinase inhibitors (TKIs) that occurs via either mutations or activation of bypass pathways
- Exhibit single agent anti-tumor activity in cancers driven by a predominant, HSP90-addicted oncoprotein such as HER2, ALK, or BRAF.
- Block the accumulation of multiple mutated forms of signaling and regulatory proteins
- Resist resistance – no mutation has ever been described that conferred resistance to an HSP90 inhibitor
Initial clinical studies failed to deliver on the rationale for targeting HSP90. First-generation inhibitors derived from the natural product geldanamycin (**see note below) displayed insufficient potency and unacceptable toxicity. Then, a number of potent second-generation HSP90 inhibitors with “improvements” in medicinal chemistry properties such as solubility and oral bioavailability were found to cause significant ocular toxicity. The HSP90 inhibitor field has survived these major setbacks and stands ready for its next (perhaps last) chance at success.
...
SNTA müsste an diesem Wochenende auf der ESMO noch detailierte Daten zur Galaxy1 PII liefern (Ergebnisse als solche sind schon bekannt):

Jemand auf Twitter meinte, dass TNBC (Brustkrebs) eine interessantere Indikation für Hsp90 wäre... hierzu hat SNTA auch Studien. Einen CR (n=10) gab es in ENCHANT-1:

Gruß
ipollit
SNTA
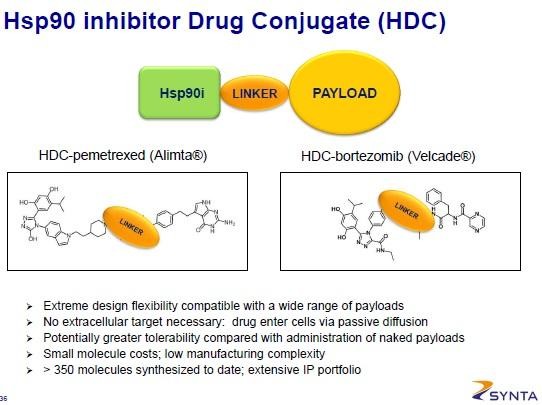
In Twitter wurde sich zuletzt etwas über die neue "HDC"-Technologie von SNTA lustig gemacht... insbesondere die SNTAs Aussage, man hätte dadurch hunderte neue Pipeline-Kandiaten anhängig vom verwendeten Payload kam nicht gut an.
Ich finde die Idee aber alles andere als schlecht. Es basiert im Prinzip auf den ADCs, die ja an einem bestimmtes Zielmolekül auf den Krebszellen (soweit es nur auf diesen vorhanden ist) per AK andocken, um dort das Toxin (z.B. ein Chemo) abzuladen. Dadurch sollen diese Stoffe noch gezielter am Krebs ankommen. Bei HDC wird nun der AK durch den HSP90-Hemmer ersetzt. Dieser wird in hohem Maße von Krebszellen aufgenommen, da diese damit alle möglichen Onkogene transportieren. Es hängt also nicht von einem Zielmolekül wie z.B. HER3 ab, sondern betrifft im Prinzip alle Krebszellen. Normale Zellen nehmen HSP90 nur kurz auf... ist der Linker stabil, so wird der Payload hauptsächlich im Tumor freigelassen, da hier HSP90 sehr lange verbleibt. Zudem wird es in die Zelle aufgenommen und angeblich anders als bei ADCs sollen beliebige Payloads so in die Zelle transportiert werden können.
SN-38 wird auch von IMMUs ADC Labetuzumab-SN-38. Die ADCs von IMMU hat Hammer als aussichtsreich hervorgehoben.
http://www.immunomedics.com/pdfs/news/2013/pr04092013.pdf
Labetuzumab-SN-38 is one of three agents from the Company’s robust ADC program that are in
clinical development. Labetuzumab is a slowly-internalizing antibody that recognizes the
carcinoembryonic antigen (CEA; CEACAM5 or CD66e), which is expressed in many solid
cancers, including more than 80% of colorectal cancer. In prior clinical trials, the antibody was
shown to be safe when administered unconjugated or bound to the radioisotope, iodine-131, for
radioimmunotherapy.
SN-38 is the active metabolite of irinotecan, which is a standard therapy for patients with
metastatic colorectal cancer, but has major gastrointestinal and hematologic toxicity. By targeting
SN-38 directly to CEA-expressing tumors, delivery of SN-38 may be increased while mitigating
systemic toxicity. Preclinical studies have shown that the antibody-drug linkage was susceptible to
cleavage in serum, with 50% of SN-38 released in ~1.0 day, leading to a locally enhanced
concentration within the tumor site.
Der HDC von SNTA wäre ähnlich...
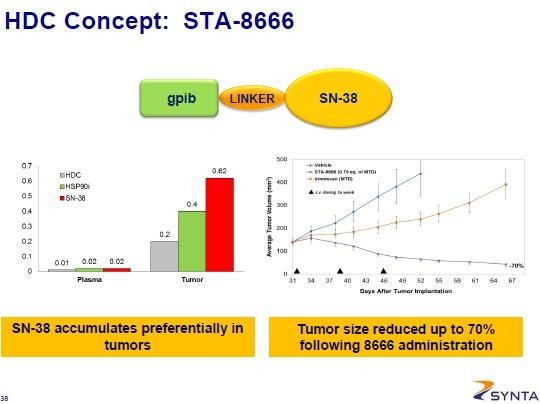
Gruß
ipollit
In Twitter wurde sich zuletzt etwas über die neue "HDC"-Technologie von SNTA lustig gemacht... insbesondere die SNTAs Aussage, man hätte dadurch hunderte neue Pipeline-Kandiaten anhängig vom verwendeten Payload kam nicht gut an.
Ich finde die Idee aber alles andere als schlecht. Es basiert im Prinzip auf den ADCs, die ja an einem bestimmtes Zielmolekül auf den Krebszellen (soweit es nur auf diesen vorhanden ist) per AK andocken, um dort das Toxin (z.B. ein Chemo) abzuladen. Dadurch sollen diese Stoffe noch gezielter am Krebs ankommen. Bei HDC wird nun der AK durch den HSP90-Hemmer ersetzt. Dieser wird in hohem Maße von Krebszellen aufgenommen, da diese damit alle möglichen Onkogene transportieren. Es hängt also nicht von einem Zielmolekül wie z.B. HER3 ab, sondern betrifft im Prinzip alle Krebszellen. Normale Zellen nehmen HSP90 nur kurz auf... ist der Linker stabil, so wird der Payload hauptsächlich im Tumor freigelassen, da hier HSP90 sehr lange verbleibt. Zudem wird es in die Zelle aufgenommen und angeblich anders als bei ADCs sollen beliebige Payloads so in die Zelle transportiert werden können.


SN-38 wird auch von IMMUs ADC Labetuzumab-SN-38. Die ADCs von IMMU hat Hammer als aussichtsreich hervorgehoben.
http://www.immunomedics.com/pdfs/news/2013/pr04092013.pdf
Labetuzumab-SN-38 is one of three agents from the Company’s robust ADC program that are in
clinical development. Labetuzumab is a slowly-internalizing antibody that recognizes the
carcinoembryonic antigen (CEA; CEACAM5 or CD66e), which is expressed in many solid
cancers, including more than 80% of colorectal cancer. In prior clinical trials, the antibody was
shown to be safe when administered unconjugated or bound to the radioisotope, iodine-131, for
radioimmunotherapy.
SN-38 is the active metabolite of irinotecan, which is a standard therapy for patients with
metastatic colorectal cancer, but has major gastrointestinal and hematologic toxicity. By targeting
SN-38 directly to CEA-expressing tumors, delivery of SN-38 may be increased while mitigating
systemic toxicity. Preclinical studies have shown that the antibody-drug linkage was susceptible to
cleavage in serum, with 50% of SN-38 released in ~1.0 day, leading to a locally enhanced
concentration within the tumor site.
Der HDC von SNTA wäre ähnlich...

Gruß
ipollit
ARQL
ESMO-Daten zur Tivantinib's NSCLC PIII: Met+ vs. Met-
man sieht schon deutlich bessere Ergebnisse für Met+... wie das allerdings konkret zu bewerten ist, weiß ich nicht. Momentan ist diese Indikation gestoppt.
http://files.shareholder.com/downloads/ARQL/2650277388x0x693…
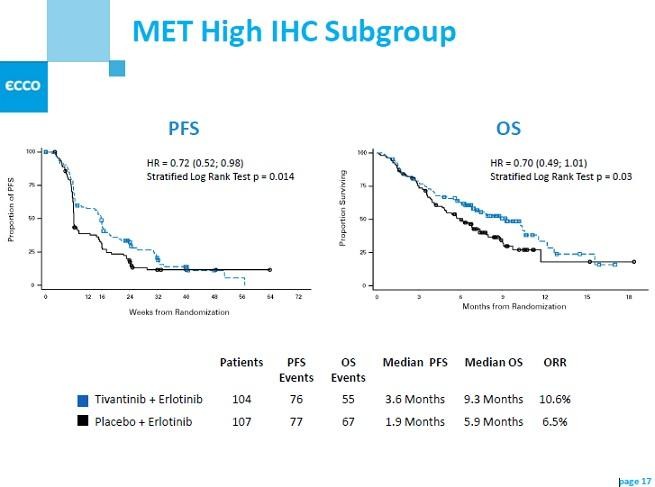
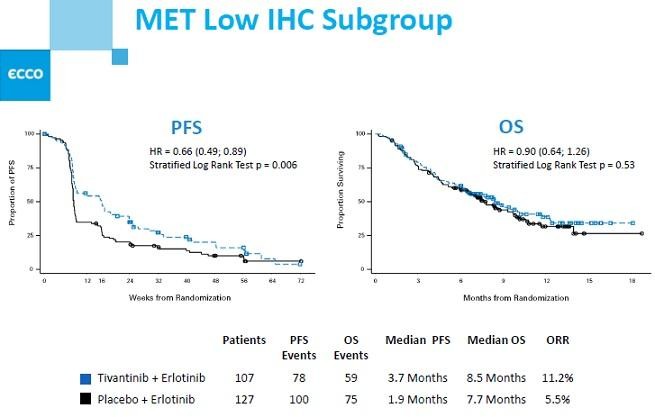
Gruß
ipollit
ESMO-Daten zur Tivantinib's NSCLC PIII: Met+ vs. Met-
man sieht schon deutlich bessere Ergebnisse für Met+... wie das allerdings konkret zu bewerten ist, weiß ich nicht. Momentan ist diese Indikation gestoppt.
http://files.shareholder.com/downloads/ARQL/2650277388x0x693…


Gruß
ipollit
Antwort auf Beitrag Nr.: 45.535.851 von ipollit am 29.09.13 16:44:53ARQL
Ohad Hammer hatte zumindest vorher gemeint: "Basically I agree, with the caveat of relying on a retrospective analysis. If magnitude of the survival effect is 3+ months and stat. significant then this should be viewed as a positive indication for the p3 liver cancer trial.
Not sure if ARQL and Daiichi will pursue lung cancer again due to competition (Metmab). Still, if the signal is very clear I would consider re-opening the p3 for MET+ tumors assuming it will require a small sample size. It’s a gamble because they don’t what the survival difference will be with Metmab if successful."
Met+ ist OS 9.3 vs 5.9 (HR=0.7), p=0.03... gilt hier auch 0.05 als signifikant?
Gruß
ipollit
Ohad Hammer hatte zumindest vorher gemeint: "Basically I agree, with the caveat of relying on a retrospective analysis. If magnitude of the survival effect is 3+ months and stat. significant then this should be viewed as a positive indication for the p3 liver cancer trial.
Not sure if ARQL and Daiichi will pursue lung cancer again due to competition (Metmab). Still, if the signal is very clear I would consider re-opening the p3 for MET+ tumors assuming it will require a small sample size. It’s a gamble because they don’t what the survival difference will be with Metmab if successful."
Met+ ist OS 9.3 vs 5.9 (HR=0.7), p=0.03... gilt hier auch 0.05 als signifikant?
Gruß
ipollit
Da CLDX nun doch einen größeren Teil meines Depots einnimmt, habe ich es etwas reduziert... dafür zwei kleinere neue Positionen KBIO und XLRN:
Acceleron(XLRN) hat mit Sotatercept und ACE-536 etwas Epo-ähnliches gegen Blutarmut... verpartnert mit CELG. Indikationen sowohl für die breite Anwendung als auch für seltene Erkrankungen.
If the challengers are successful, they will prove to physicians that they can boost the body’s production of oxygen-carrying red blood cells to help patients fight anemia, without some of the safety concerns that have dogged Amgen’s products the past five years. And if that can be proven, the rivals will be in position to grab a piece of a market that, despite the safety worries, still generated $5 billion in worldwide sales for Amgen last year. http://www.xconomy.com/boston/2011/08/05/acceleron-celgene-t…
Zudem mit Dalantercept eine Angiogenese-Hemmer wie z.B. Avastin... allerdings ein anderes Target mit ALK1.
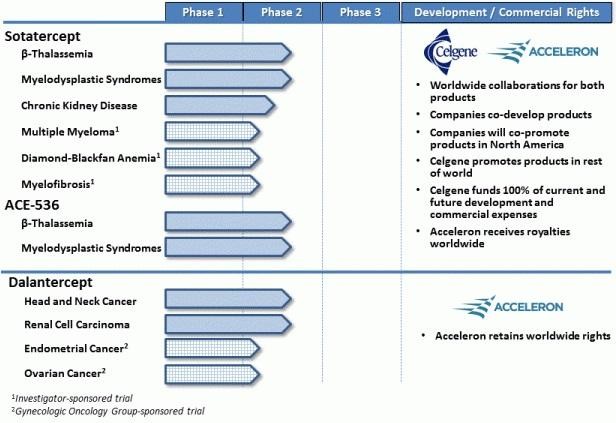
MK 600 Mio USD

KaloBios(KBIO) ist recht niedrig bewertet mit einer MK von ca. 140 Mio USD:
http://files.shareholder.com/downloads/AMDA-1EBKUT/270216610…
- GM-CSF AK KB003... soetwas wie MORs MOR103, nur statt RA hier Athma als Indikation
- KB001/A verpartnert mit Sanofi ist ein AK, der eine Alternative oder Kombi mit Antibiotika z.B. bei Lungenentzündung sein. Ein Vorteil könnte sein, dass das Bakterium dagegen keine Resistenz entwickeln kann. Die Entwicklung könnte wie neue Antibiotika staatlich gefördert/beschleunigt werden.
- KB004 ist ein AK, der u.a. gegen AML oder andere Blutkrebsarten eingesetzt werden könnte. U.a. sollen über das Target EphA3 auch Krebsstammzellen zerstört werden können, allerdings ist es ein reiner AK, nicht wie z.B. STMLs SL-401 etwas mit Toxin.
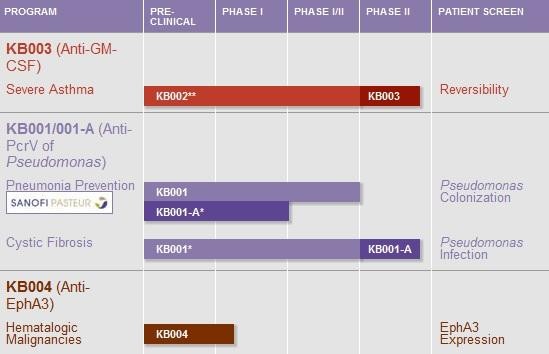
MK 140 Mio USD

Gruß
ipollit
Acceleron(XLRN) hat mit Sotatercept und ACE-536 etwas Epo-ähnliches gegen Blutarmut... verpartnert mit CELG. Indikationen sowohl für die breite Anwendung als auch für seltene Erkrankungen.
If the challengers are successful, they will prove to physicians that they can boost the body’s production of oxygen-carrying red blood cells to help patients fight anemia, without some of the safety concerns that have dogged Amgen’s products the past five years. And if that can be proven, the rivals will be in position to grab a piece of a market that, despite the safety worries, still generated $5 billion in worldwide sales for Amgen last year. http://www.xconomy.com/boston/2011/08/05/acceleron-celgene-t…
Zudem mit Dalantercept eine Angiogenese-Hemmer wie z.B. Avastin... allerdings ein anderes Target mit ALK1.

MK 600 Mio USD
KaloBios(KBIO) ist recht niedrig bewertet mit einer MK von ca. 140 Mio USD:
http://files.shareholder.com/downloads/AMDA-1EBKUT/270216610…
- GM-CSF AK KB003... soetwas wie MORs MOR103, nur statt RA hier Athma als Indikation
- KB001/A verpartnert mit Sanofi ist ein AK, der eine Alternative oder Kombi mit Antibiotika z.B. bei Lungenentzündung sein. Ein Vorteil könnte sein, dass das Bakterium dagegen keine Resistenz entwickeln kann. Die Entwicklung könnte wie neue Antibiotika staatlich gefördert/beschleunigt werden.
- KB004 ist ein AK, der u.a. gegen AML oder andere Blutkrebsarten eingesetzt werden könnte. U.a. sollen über das Target EphA3 auch Krebsstammzellen zerstört werden können, allerdings ist es ein reiner AK, nicht wie z.B. STMLs SL-401 etwas mit Toxin.

MK 140 Mio USD
Gruß
ipollit
Habe mir bei dem gestrigen Bio Sell-off ein Herz gefasst und XLRN und ECYT abgefischt.
Während XLRN mit der Pipeline und der Partnerschaft mit Celgene glänzt, hat mich eine mögliche EMA-Entscheidung im 4. Quartal zum Kauf von ECYT getrieben.
Ist schwer momentan günstige Werte auszumachen...
Während XLRN mit der Pipeline und der Partnerschaft mit Celgene glänzt, hat mich eine mögliche EMA-Entscheidung im 4. Quartal zum Kauf von ECYT getrieben.
Ist schwer momentan günstige Werte auszumachen...
MGNX
In den letzten Tage ging es bei den Biotechs recht deutlich abwärts... hoffentlich fängt der Markt sich wieder.

Heute gab es einen weiter IPO, der meiner Meinung nach interessant sein könnte... Macrogenics (MGNX). Bei aktuellen 24,5 USD müsste die MK etwa bei 650 Mio USD liegen.

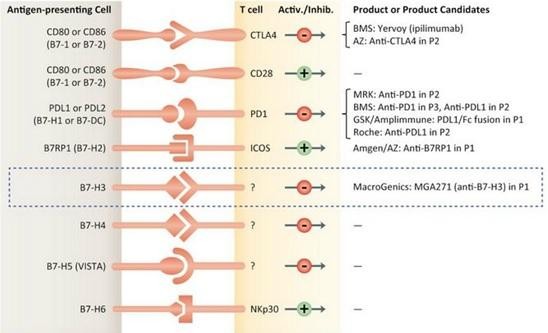
Interessant finde ich weniger den Lead-Kandidaten MGAH22, ein Fc-optimierter HER2-AK, als viel mehr den Anti-B7-H3 AK MGA271 in PI sowie die DART-Technologie.
Anti-B7-H3 könnte soeetwas ähnliches wie PD-1 sein... Partner ist Servier, MGNX hält aber die US-Rechte.
Die DART-Technologie (Dual-Affinity Re-Targeting) ist soetwas wie Bite von Micromet. Es ist zwar kein echter AK, kann aber wie Bi- oder multispezifische AKs verschiedene Targets binden, wobei DART dies sehr kompakt macht.
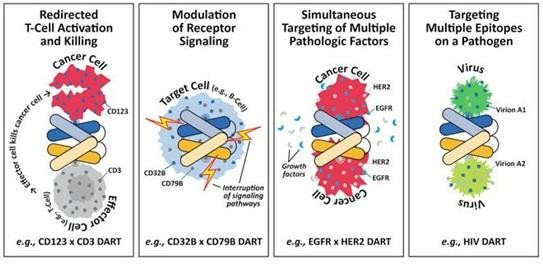
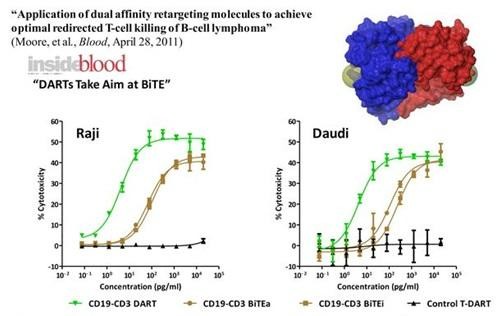
Eine Anwendung ist die Kombination mit CD3, das T-Zellen binden kann. So wird wie bei Micromets Blinatumomab eine Krebszelle, die CD19 expressioniert, über einen DART sehr nah an eine T-Zelle mit CD3 gebunden. Angeblich soll aufgrund der Kompaktheit der DART wirksamer als der Bite Blinatumomab sein, da die T-Zelle sehr nah an die Krebszelle kommen muss, damit sie aktiv wird. Ich meine, dass es bei Blinatumomab nicht optimal war, dass es als permanente Infusion verabreicht werden musste. Wie es da mit DART aussieht, weiß ich bisher nicht.
MGNX hat ebenfalls mit Servier einen CD123-CD3 DART MGD006 in der Pipeline. CD123 ist IL3Ra... dasselbe Target, dass auch STMLs SL-401 als Immun-Toxin Konjugat hat. Unter anderem befindet es sich auch auf Krebsstammzellen. SL-401 soll die Krebszellen über das Toxin zerstören, MGD006 lenkt dagegen T-Zellen auf diese Krebszellen. MGNX hat angeblich auch weitere Krebsstammzell-Programme in der Entwicklung.
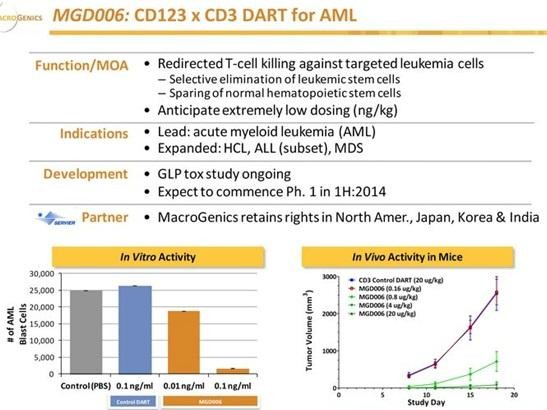
Gruß
ipollit
In den letzten Tage ging es bei den Biotechs recht deutlich abwärts... hoffentlich fängt der Markt sich wieder.
Heute gab es einen weiter IPO, der meiner Meinung nach interessant sein könnte... Macrogenics (MGNX). Bei aktuellen 24,5 USD müsste die MK etwa bei 650 Mio USD liegen.
Interessant finde ich weniger den Lead-Kandidaten MGAH22, ein Fc-optimierter HER2-AK, als viel mehr den Anti-B7-H3 AK MGA271 in PI sowie die DART-Technologie.
Anti-B7-H3 könnte soeetwas ähnliches wie PD-1 sein... Partner ist Servier, MGNX hält aber die US-Rechte.

Die DART-Technologie (Dual-Affinity Re-Targeting) ist soetwas wie Bite von Micromet. Es ist zwar kein echter AK, kann aber wie Bi- oder multispezifische AKs verschiedene Targets binden, wobei DART dies sehr kompakt macht.

Eine Anwendung ist die Kombination mit CD3, das T-Zellen binden kann. So wird wie bei Micromets Blinatumomab eine Krebszelle, die CD19 expressioniert, über einen DART sehr nah an eine T-Zelle mit CD3 gebunden. Angeblich soll aufgrund der Kompaktheit der DART wirksamer als der Bite Blinatumomab sein, da die T-Zelle sehr nah an die Krebszelle kommen muss, damit sie aktiv wird. Ich meine, dass es bei Blinatumomab nicht optimal war, dass es als permanente Infusion verabreicht werden musste. Wie es da mit DART aussieht, weiß ich bisher nicht.

MGNX hat ebenfalls mit Servier einen CD123-CD3 DART MGD006 in der Pipeline. CD123 ist IL3Ra... dasselbe Target, dass auch STMLs SL-401 als Immun-Toxin Konjugat hat. Unter anderem befindet es sich auch auf Krebsstammzellen. SL-401 soll die Krebszellen über das Toxin zerstören, MGD006 lenkt dagegen T-Zellen auf diese Krebszellen. MGNX hat angeblich auch weitere Krebsstammzell-Programme in der Entwicklung.

Gruß
ipollit
ARIA
Gestern hat sich der Kurs von ARIA fast geviertelt, weil Iclusig mehr Nebenwirkungen zeigt, als gedacht. Letztes Jahr wurde Iclusig/Ponatinib noch als ein besseres Gleveec und möglicher Blockbuster gefeiert. In den ersten Monaten auf dem Markt, sah es eigentlich nicht schlecht aus. Mir ist noch nicht ganz klar, ob Iclusig nicht doch noch ein wenig erfolgreich werden kann. Zumindest hat die FDA die wichtige PIII für die 1st-line Zulassung gegen Gleevec erstmal gestoppt und die Dosis soll reduziert werden. Wenn die PIII nicht weitergeführt werden kann, dürfte Iclusig langfristig nur 3rd-line bleiben... das Marktpotential wäre dann deutlich begrenzt.
Das zeigt mal wieder, dass man sich, egal wie gut etwas aussieht, nie sicher sein kann, dass eine Biotech-Aktie nicht plötzlich extrem einbricht. Das einzige, was mich dagegen etwas schützt, ist das Streuen auf mehrerer Werte. Meistes halte ich nur Positionen, die maximal ein paar Prozent von meinem Gesamtdepot ausmachen... bei ARIA waren es 2,5%... trotzdem ärgerlich!

Gruß
ipollit
Gestern hat sich der Kurs von ARIA fast geviertelt, weil Iclusig mehr Nebenwirkungen zeigt, als gedacht. Letztes Jahr wurde Iclusig/Ponatinib noch als ein besseres Gleveec und möglicher Blockbuster gefeiert. In den ersten Monaten auf dem Markt, sah es eigentlich nicht schlecht aus. Mir ist noch nicht ganz klar, ob Iclusig nicht doch noch ein wenig erfolgreich werden kann. Zumindest hat die FDA die wichtige PIII für die 1st-line Zulassung gegen Gleevec erstmal gestoppt und die Dosis soll reduziert werden. Wenn die PIII nicht weitergeführt werden kann, dürfte Iclusig langfristig nur 3rd-line bleiben... das Marktpotential wäre dann deutlich begrenzt.
Das zeigt mal wieder, dass man sich, egal wie gut etwas aussieht, nie sicher sein kann, dass eine Biotech-Aktie nicht plötzlich extrem einbricht. Das einzige, was mich dagegen etwas schützt, ist das Streuen auf mehrerer Werte. Meistes halte ich nur Positionen, die maximal ein paar Prozent von meinem Gesamtdepot ausmachen... bei ARIA waren es 2,5%... trotzdem ärgerlich!
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.607.075 von ipollit am 10.10.13 22:23:23dürfte Iclusig langfristig nur 3rd-line bleiben
Davon würde ich derzeit ausgehen. Es stellt sich allerdings die Frage, ob hier doch langsam Kaufkurse gekommen sind. Iclusig wird meiner Meinung nach als 3rd-line erhalten bleiben. Es wird kein Blockbuster, aber mehrere hundert Mio. sind langfristig immer noch drin. Und es gibt ja nicht nur Iclusig.
MGNX finde ich auch sehr spannend. Habe da langfristig ein richtig gutes Gefühl. Die Marktkap. zeigt allerdings, dass wir immer noch in einer Art Blasenmodus sind. Der Markt nimmt derzeit einfach zu viel Zukunft vorweg und bewertet Biotechs anhand des Jahres 2017, wo er maximal 2015 ins Auge fassen sollte (das ist wirklich genau meine Ansicht, dass die Marktkap. vieler Biotechs derzeit das Jahr 2017 widerspiegelt).
Gruß
Davon würde ich derzeit ausgehen. Es stellt sich allerdings die Frage, ob hier doch langsam Kaufkurse gekommen sind. Iclusig wird meiner Meinung nach als 3rd-line erhalten bleiben. Es wird kein Blockbuster, aber mehrere hundert Mio. sind langfristig immer noch drin. Und es gibt ja nicht nur Iclusig.
MGNX finde ich auch sehr spannend. Habe da langfristig ein richtig gutes Gefühl. Die Marktkap. zeigt allerdings, dass wir immer noch in einer Art Blasenmodus sind. Der Markt nimmt derzeit einfach zu viel Zukunft vorweg und bewertet Biotechs anhand des Jahres 2017, wo er maximal 2015 ins Auge fassen sollte (das ist wirklich genau meine Ansicht, dass die Marktkap. vieler Biotechs derzeit das Jahr 2017 widerspiegelt).
Gruß
Antwort auf Beitrag Nr.: 45.608.405 von SLGramann am 11.10.13 09:10:22ARIA:
Weiter im freien Fall. Die Marktkap. beträgt jetzt wohl ca. 800 Mio.
Kann man sich denn vorstellen, dass Iclusig die Zulassung ganz verliert? Zumindest für die T315I-Mutation kann ich mir das nicht vorstellen! Diese Patienten haben sonst nichts.
Fraglich ist, wie viele Fälle es da gibt. Hammer hatte früher mal geschrieben, es kämen jedes Jahr einige 100 hinzu. Iclusig kostet 130.000 Dollar / Jahr. Bei nur 1.000 Patienten wären wir bei 130 Mio. Umsatz.
Dann sieht es für AP26113 bei ALK-mutiertem Lungenkrebs gut aus. Eine pivotal-Studie steht unmittelbar bevor. Ich weiß leider nicht, welches Marktpotential da drin stecken könnte. Wir hatten da mal diese Aussage: "Although the ALK mutation is rare, Xalkori is expected generate $1.5B in sales based on its current label alone due to several reasons." Wenn AP26113 eine 2line-Behandlung wird, mag der Umsatz um einiges niedriger liegen, aber sollte man nicht auch hier einiges mehr als 100 Mio. veranschlagen?
Und damit wären beide Schätzungen wohl sehr konservativ, oder?
Weiter im freien Fall. Die Marktkap. beträgt jetzt wohl ca. 800 Mio.
Kann man sich denn vorstellen, dass Iclusig die Zulassung ganz verliert? Zumindest für die T315I-Mutation kann ich mir das nicht vorstellen! Diese Patienten haben sonst nichts.
Fraglich ist, wie viele Fälle es da gibt. Hammer hatte früher mal geschrieben, es kämen jedes Jahr einige 100 hinzu. Iclusig kostet 130.000 Dollar / Jahr. Bei nur 1.000 Patienten wären wir bei 130 Mio. Umsatz.
Dann sieht es für AP26113 bei ALK-mutiertem Lungenkrebs gut aus. Eine pivotal-Studie steht unmittelbar bevor. Ich weiß leider nicht, welches Marktpotential da drin stecken könnte. Wir hatten da mal diese Aussage: "Although the ALK mutation is rare, Xalkori is expected generate $1.5B in sales based on its current label alone due to several reasons." Wenn AP26113 eine 2line-Behandlung wird, mag der Umsatz um einiges niedriger liegen, aber sollte man nicht auch hier einiges mehr als 100 Mio. veranschlagen?
Und damit wären beide Schätzungen wohl sehr konservativ, oder?
die letzte Woche war ernüchternd. biotechs führten die verliererliste an. verhält sich so eine absolute leaderbranche?
ich glaube nicht.
hier der nasdaq-biotech-index:

der Chart sieht verdammt gefährlich aus. eine abwärtswoche mit einem mit abstand höchstem Volumen seit über zwei jahren. und das nach einer langen Aufwärtsbewegung.
so enden Aufwärtstrends.
ich glaube nicht.
hier der nasdaq-biotech-index:
der Chart sieht verdammt gefährlich aus. eine abwärtswoche mit einem mit abstand höchstem Volumen seit über zwei jahren. und das nach einer langen Aufwärtsbewegung.
so enden Aufwärtstrends.
ist es nicht natürlich, dass es bei bereits gut gelaufenden Werten zu Korrekturen kommt, wenn die Unsicherheiten im Markt steigen? Ich denke schon, dass eine mögliche US-Pleite nächste Woche ein gewisses Risiko darstellt. Die Märkte halten diese anscheinend für recht unwahrscheinlich, eine US-Pleite wäre wahrscheinlich fatal und hätte unkalkulierbare Folgen... der breite Markt verhält sich dagegen noch recht ruhig. Der NBI liegt dieses Jahr immer noch fast 50% im Plus. Wahrscheinlich sind auch einige hier investiert, die nicht langfristig auf diesem Bereich setzen, sondern einfach einem Trend folgen... die steigen auch schnell wieder aus.
Noch ist der Chart nicht angeschlagen. Wenn sich die Probleme in Amerika nicht kurzfristig lösen lassen oder andere Krisen kommen, die den Gesamtmarkt drücken, was spricht dann dagegen, dass es auch noch weiter aufwärts geht? Oder glaubst du, dass der Gesamtmarkt steigt und gleichzeitig die Biotechs massiv einbrechen?
Meiner Meinung ist in diesem Bereich fundamental auch viel passiert, z.B. bei HCV können Menschen bald in relativ kurzer Zeit geheilt werden, die zuvor kaum behandelt werden konnten. Oder was sich im Krebsbereich tut... da kann man zwar noch nicht von Heilung sprechen... aber Indikation wie z.B. CLL verändern sich grundlegend wie seit Jahrzehnten nicht. Kann soetwas nicht auch hohe Bewertungen unterstützen? Ob wir jetzt wirklich schon am Ende dieser Bewegung angelangt sind?

Gruß
ipollit
Noch ist der Chart nicht angeschlagen. Wenn sich die Probleme in Amerika nicht kurzfristig lösen lassen oder andere Krisen kommen, die den Gesamtmarkt drücken, was spricht dann dagegen, dass es auch noch weiter aufwärts geht? Oder glaubst du, dass der Gesamtmarkt steigt und gleichzeitig die Biotechs massiv einbrechen?
Meiner Meinung ist in diesem Bereich fundamental auch viel passiert, z.B. bei HCV können Menschen bald in relativ kurzer Zeit geheilt werden, die zuvor kaum behandelt werden konnten. Oder was sich im Krebsbereich tut... da kann man zwar noch nicht von Heilung sprechen... aber Indikation wie z.B. CLL verändern sich grundlegend wie seit Jahrzehnten nicht. Kann soetwas nicht auch hohe Bewertungen unterstützen? Ob wir jetzt wirklich schon am Ende dieser Bewegung angelangt sind?
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.619.847 von ipollit am 13.10.13 20:49:07Ja, der Markt ist momentan einfach sehr nervös. Das man mittlerweile offen über eine Blase spricht bzw. darüber ob es nun schon eine ist oder nicht, steigert da mit Sicherheit noch die Nervosität der Anleger. Viele sitzen auf fetten Gewinnen und da steigt dann natürlich auch die Angst jetzt den Ausstieg zu verpassen. M.E. gibt es durchaus Anzeichen für eine Blase:
Der Boom bei den IPOs, die teilweise extrem hoch bewertet sind und noch gar keine Studienergebnisse vorzuweisen haben.
Das einige Biotechs auf die Idee kommen, sich zum Verkauf zu stellen.
Viele Bewertungen nehmen eine positive Entwicklung der nächsten Jahre schon voraus...
Aber es gibt auch Argumente, dass die Bewertung fundamental gerechtfertigt ist. Vor allem die großen Biotechs werden mit akzeptablen KGVs gehandelt.

Die von dir geschilderten Durchbrüche bei einzelnen Indikationen sind einerseits natürlich gut andererseits wird es auch nur wenige Medikamente geben, die sich dann durchsetzen werden. Die meisten werden (wie immer) scheitern oder eben kaum eine Rolle spielen.
Eine Frage die sich mir noch stellt ist, wie lange sich die Gesellschaft die doch saftigen Preise der Medikamente noch leisten will. Gerade wenn einige Krebserkrankungen demnächst wirklich zu chronischen Erkrankungen werden, muss was an der Preisgestaltung passieren.
zu chronischen Erkrankungen werden, muss was an der Preisgestaltung passieren.
Für den Moment habe ich mich jedenfalls dazu entschieden, den Cashbestand moderat zu erhöhen. Ansonsten bleibe ich bei Unternehmen, von denen ich überzeugt bin (teil)-investiert. Das muss aber jeder selber wissen.
SG kmastra
Der Boom bei den IPOs, die teilweise extrem hoch bewertet sind und noch gar keine Studienergebnisse vorzuweisen haben.
Das einige Biotechs auf die Idee kommen, sich zum Verkauf zu stellen.
Viele Bewertungen nehmen eine positive Entwicklung der nächsten Jahre schon voraus...
Aber es gibt auch Argumente, dass die Bewertung fundamental gerechtfertigt ist. Vor allem die großen Biotechs werden mit akzeptablen KGVs gehandelt.

Die von dir geschilderten Durchbrüche bei einzelnen Indikationen sind einerseits natürlich gut andererseits wird es auch nur wenige Medikamente geben, die sich dann durchsetzen werden. Die meisten werden (wie immer) scheitern oder eben kaum eine Rolle spielen.
Eine Frage die sich mir noch stellt ist, wie lange sich die Gesellschaft die doch saftigen Preise der Medikamente noch leisten will. Gerade wenn einige Krebserkrankungen demnächst wirklich
 zu chronischen Erkrankungen werden, muss was an der Preisgestaltung passieren.
zu chronischen Erkrankungen werden, muss was an der Preisgestaltung passieren. Für den Moment habe ich mich jedenfalls dazu entschieden, den Cashbestand moderat zu erhöhen. Ansonsten bleibe ich bei Unternehmen, von denen ich überzeugt bin (teil)-investiert. Das muss aber jeder selber wissen.
SG kmastra
Antwort auf Beitrag Nr.: 45.619.847 von ipollit am 13.10.13 20:49:07korrekturen sind völlig in Ordnung, besonders nach diesem Aufwärtstrend.
ich sage auch nicht, dass die biotechs keine Chance mehr haben weiterzusteigen. ich glaube aber nicht, dass im falle eines weiteren anstiegs des gesamtmarkts der biotechbereich weiterhin performancemäßig die leaderfunktion beibehält.
das Problem liegt darin, dass langfristige Trends sehr oft mit abrupten Abwärtsbewegungen unter rekordvolumen enden. am besten ersichtlich ist das im wochenchart.
genau so ein rekordvolumen gibt es momentan im ibb-chart. vielleicht ist diese Beobachtung bei einzelaktien auch nicht auf einen index wie den ibb übertragbar. das wäre dann natürlich wieder positiv.
ich jedenfalls habe meine biotechs verkauft. ich traue den braten nicht.
lediglich adus halte ich aus dem healthcare Bereich weiter.
ich sage auch nicht, dass die biotechs keine Chance mehr haben weiterzusteigen. ich glaube aber nicht, dass im falle eines weiteren anstiegs des gesamtmarkts der biotechbereich weiterhin performancemäßig die leaderfunktion beibehält.
das Problem liegt darin, dass langfristige Trends sehr oft mit abrupten Abwärtsbewegungen unter rekordvolumen enden. am besten ersichtlich ist das im wochenchart.
genau so ein rekordvolumen gibt es momentan im ibb-chart. vielleicht ist diese Beobachtung bei einzelaktien auch nicht auf einen index wie den ibb übertragbar. das wäre dann natürlich wieder positiv.
ich jedenfalls habe meine biotechs verkauft. ich traue den braten nicht.
lediglich adus halte ich aus dem healthcare Bereich weiter.
"Eine Frage die sich mir noch stellt ist, wie lange sich die Gesellschaft die doch saftigen Preise der Medikamente noch leisten will."
Mag sein, dass einzelne neue Medikamente recht teuer sind. Andererseits sind die Patentlaufzeiten ja auch deutlich begrenzt. So bleiben diese Medikamente immer nur wenige Jahre sehr teuer, bis Generika-Hersteller diese nachahmen können. So ganz ok ist das Geschäft ja auch nicht... fährt ein Unternehmen mit seinem Medikament vor die Wand, wie z.B. zuletzt ARIA, kümmert das bestenfalls niemanden oder es werden hohe Entschädigungen gefordert. Ist das Medikament gut und gefragt, wird von der Gesellschaft der Patentschutz entzogen und es kann einfach von jedem kopiert werden, was wie z.B. beim Kopieren eines Buches oder einer Software meistens mit sehr geringem Kosten für den Nachahmer verbunden ist. Ich denke, das System muss sich die Waage halten... es müssen auch hohe Gewinne möglich sein, damit auch entsprechende Risiken eingegangen werden. Das ist der Preis für Innovation. Andererseits muss dieser Preis für die Gesellschaft tragbar sein... Unternehmen dürfen nicht als Monopolist beliebige Preise verlangen, schon garnicht, wenn auf der anderen Seite Menschen stehen, deren Leben u.U. von einem Medikament abhängt.
Ich weiß nicht, wie sehr die Gesellschaft momentan durch Pharmafirmen&Co belastet werden. In Amerika, dem größten Pharmamarkt der Welt, scheinen die Ausgaben für Medikamente im letzten Jahr insgesamt eher um 1% gefallen zu sein: http://www.fiercepharma.com/story/behold-patent-cliff-us-dru… Dabei gab es einen deutlichen Einbruch bei den teuren Originalmedikamenten, da nach und nach deren Patentschutz ausläuft. Zugelegt haben dagegen die billigen Nachahmer, die gemessen an der Anzahl der Verschreibungen auch den größten Anteil ausmachen. Die Pharmaunternehmen müssen also entweder auf Generika setzen, bei denen ein extremer Preiskampf herrscht oder etwas neues finden. Unter den 5 neuen Medikamenten, deren Umsatz am meisten gestiegen ist, sind 3 direkt von Biotechs und ein weiteres von einem Biotech-Unternehmen, das dann von einem Pharma übernommen worden ist. Nur eines wurde von einem Pharmaunternehmen selber entwickelt. Ich denke, dass die Preise von Biotechs auch dadurch getrieben werden, dass Pharmaunternehmen mittelfristig weitere Produkte brauchen, um die wegbrechenden Umsätze ausgleichen zu können. Gleichzeitig haben die Pharmas recht viel Geld zur Verfügung, um aussichtsreiche Kandidaten kaufen zu können.
Der Medikamentenmarkt wird langfristig wahrscheinlich auch dadurch größer werden, weil die Menschen immer älter werden und viele Erkrankungen erst in höherem Alter auftreten... so bei manchen Erkrankungen heute schon absehbar, dass sie mittelfristig doppelt so häufig auftreten.
Eigentlich fände ich aber das wichtigste, ganz unabhängig von Geld, Börse, Pharmas usw, dass man möglichst jedem Menschen, der krank wird, so gut es geht helfen kann. Wenn man krank ist, ist es erstmal wichtig, etwas zu haben, was hilft. Je mehr man helfen kann, umso besser!
Gruß
ipollit
Mag sein, dass einzelne neue Medikamente recht teuer sind. Andererseits sind die Patentlaufzeiten ja auch deutlich begrenzt. So bleiben diese Medikamente immer nur wenige Jahre sehr teuer, bis Generika-Hersteller diese nachahmen können. So ganz ok ist das Geschäft ja auch nicht... fährt ein Unternehmen mit seinem Medikament vor die Wand, wie z.B. zuletzt ARIA, kümmert das bestenfalls niemanden oder es werden hohe Entschädigungen gefordert. Ist das Medikament gut und gefragt, wird von der Gesellschaft der Patentschutz entzogen und es kann einfach von jedem kopiert werden, was wie z.B. beim Kopieren eines Buches oder einer Software meistens mit sehr geringem Kosten für den Nachahmer verbunden ist. Ich denke, das System muss sich die Waage halten... es müssen auch hohe Gewinne möglich sein, damit auch entsprechende Risiken eingegangen werden. Das ist der Preis für Innovation. Andererseits muss dieser Preis für die Gesellschaft tragbar sein... Unternehmen dürfen nicht als Monopolist beliebige Preise verlangen, schon garnicht, wenn auf der anderen Seite Menschen stehen, deren Leben u.U. von einem Medikament abhängt.
Ich weiß nicht, wie sehr die Gesellschaft momentan durch Pharmafirmen&Co belastet werden. In Amerika, dem größten Pharmamarkt der Welt, scheinen die Ausgaben für Medikamente im letzten Jahr insgesamt eher um 1% gefallen zu sein: http://www.fiercepharma.com/story/behold-patent-cliff-us-dru… Dabei gab es einen deutlichen Einbruch bei den teuren Originalmedikamenten, da nach und nach deren Patentschutz ausläuft. Zugelegt haben dagegen die billigen Nachahmer, die gemessen an der Anzahl der Verschreibungen auch den größten Anteil ausmachen. Die Pharmaunternehmen müssen also entweder auf Generika setzen, bei denen ein extremer Preiskampf herrscht oder etwas neues finden. Unter den 5 neuen Medikamenten, deren Umsatz am meisten gestiegen ist, sind 3 direkt von Biotechs und ein weiteres von einem Biotech-Unternehmen, das dann von einem Pharma übernommen worden ist. Nur eines wurde von einem Pharmaunternehmen selber entwickelt. Ich denke, dass die Preise von Biotechs auch dadurch getrieben werden, dass Pharmaunternehmen mittelfristig weitere Produkte brauchen, um die wegbrechenden Umsätze ausgleichen zu können. Gleichzeitig haben die Pharmas recht viel Geld zur Verfügung, um aussichtsreiche Kandidaten kaufen zu können.
Der Medikamentenmarkt wird langfristig wahrscheinlich auch dadurch größer werden, weil die Menschen immer älter werden und viele Erkrankungen erst in höherem Alter auftreten... so bei manchen Erkrankungen heute schon absehbar, dass sie mittelfristig doppelt so häufig auftreten.
Eigentlich fände ich aber das wichtigste, ganz unabhängig von Geld, Börse, Pharmas usw, dass man möglichst jedem Menschen, der krank wird, so gut es geht helfen kann. Wenn man krank ist, ist es erstmal wichtig, etwas zu haben, was hilft. Je mehr man helfen kann, umso besser!
Gruß
ipollit
Schön, mal etwas zu lesen von jemandem, der/die sich Gedanken macht und über Kenntnisse verfügt im Bereich BioPharma.
Meine Investitionen (nein, ich bin kein Trader in dem Bereich sind:
Abcam
Alkermes
Alexion
Arena
Biogen Idec
Biomarin
Cubist
Evotec
Gilead
Halozymes
Jazz
MorphoSys
Myriad
PDLI
Questcor
Santarus
Seatle Genetics
Shire
Stallergenes
United Therapeuctic
Vertex
Mein größer Flop: Nastech
Mein teuerste Fehlentscheidung: Celgene nach weniger als Verdopplung zu verkaufen und mitansehen zu müssen, daß der Kurs sich dann vervierzigfacht
Meine Investitionen (nein, ich bin kein Trader in dem Bereich sind:
Abcam
Alkermes
Alexion
Arena
Biogen Idec
Biomarin
Cubist
Evotec
Gilead
Halozymes
Jazz
MorphoSys
Myriad
PDLI
Questcor
Santarus
Seatle Genetics
Shire
Stallergenes
United Therapeuctic
Vertex
Mein größer Flop: Nastech
Mein teuerste Fehlentscheidung: Celgene nach weniger als Verdopplung zu verkaufen und mitansehen zu müssen, daß der Kurs sich dann vervierzigfacht
Antwort auf Beitrag Nr.: 45.620.173 von steven_trader am 13.10.13 22:41:40Vielleicht ist deine Entscheidung, jetzt auszusteigen, die richtige. Ich bin mir da noch nicht sicher genug... solange der Gesamtmarkt noch stabil ist, warte ich lieber ab. Schließlich ist es ja auch eine grundsätzliche Entscheidung... was machst du, wenn der Markt doch weiter nach oben geht? Wenn man aussteigt, wartet man ja auch auf einen deutlichen Einbruch oder man hat Alternativen in einem ganz anderen Bereich als Biotechs, wo man alternativ investiert.
Ist der IBB wirklich so eindeutig? Wenn du in deinen Wochenchart weiter zurückgehst, dann gab es zuletzt Mitte 2011 einen Einbruch, der noch schärfer war, als der von letzter Woche und mit höherem Volumen. Dieser war aber nicht das Ende, sondern der Anfang der Aufwärtsbewegung. Anfang 2009 ähnlich... im Frühjahr 2010 folgten dem scharfen Einbruch dagegen ein paar Monate Korrektur.
Bei Biotechs ist gefühlt die Zeit zum Jahresende bis ins Frühjahr hinein die beste... diese Zeit kommt ja bald. Soll es da diesmal genau andersherum sein?

Der Chart heute sieht für mich anders aus, als z.B. 2000...

Gruß
ipollit
Ist der IBB wirklich so eindeutig? Wenn du in deinen Wochenchart weiter zurückgehst, dann gab es zuletzt Mitte 2011 einen Einbruch, der noch schärfer war, als der von letzter Woche und mit höherem Volumen. Dieser war aber nicht das Ende, sondern der Anfang der Aufwärtsbewegung. Anfang 2009 ähnlich... im Frühjahr 2010 folgten dem scharfen Einbruch dagegen ein paar Monate Korrektur.
Bei Biotechs ist gefühlt die Zeit zum Jahresende bis ins Frühjahr hinein die beste... diese Zeit kommt ja bald. Soll es da diesmal genau andersherum sein?
Der Chart heute sieht für mich anders aus, als z.B. 2000...
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.620.363 von Ulf-Imat am 13.10.13 23:55:48JAZZ habe ich sicherheitshalber in 10/2010 mit einem kleinen Verlust zu 10 verkauft  ...allerdings ist es in den letzten beiden Jahren bei meinen Biotechs insgesamt deutlich besser gelaufen, als ich erwartet habe
...allerdings ist es in den letzten beiden Jahren bei meinen Biotechs insgesamt deutlich besser gelaufen, als ich erwartet habe

bei mir sieht es momentan so aus...
13,3% Celldex
11,1% Pharmacyclics
7,8% Incyte
7,0% Array
5,2% Regeneron
5,1% Genmab
4,6% Synta
4,3% Exelixis
4,0% Cubist
3,9% Isis
3,3% Clovis
3,2% Infinity
3,1% Alnylam
3,0% ArQule
2,8% Stemline
2,7% Curis
2,5% Ambit
2,2% Immunomedics
2,1% Enanta
2,0% Seattle Genetics
1,5% Verastem
1,1% AVEO
0,8% Innate
0,7% Ariad
Gruß
ipollit
 ...allerdings ist es in den letzten beiden Jahren bei meinen Biotechs insgesamt deutlich besser gelaufen, als ich erwartet habe
...allerdings ist es in den letzten beiden Jahren bei meinen Biotechs insgesamt deutlich besser gelaufen, als ich erwartet habebei mir sieht es momentan so aus...
13,3% Celldex
11,1% Pharmacyclics
7,8% Incyte
7,0% Array
5,2% Regeneron
5,1% Genmab
4,6% Synta
4,3% Exelixis
4,0% Cubist
3,9% Isis
3,3% Clovis
3,2% Infinity
3,1% Alnylam
3,0% ArQule
2,8% Stemline
2,7% Curis
2,5% Ambit
2,2% Immunomedics
2,1% Enanta
2,0% Seattle Genetics
1,5% Verastem
1,1% AVEO
0,8% Innate
0,7% Ariad
Gruß
ipollit
"Eigentlich fände ich aber das wichtigste, ganz unabhängig von Geld, Börse, Pharmas usw, dass man möglichst jedem Menschen, der krank wird, so gut es geht helfen kann. Wenn man krank ist, ist es erstmal wichtig, etwas zu haben, was hilft. Je mehr man helfen kann, umso besser!"
100% Zustimmung. Das ist auch mit ein Grund warum ich in den Bereich investiere. Das mit dem Preis wird sich mit der Masse regeln. Das bisher trotz zum Teil enorm hoher Kosten für einzelne Medikamente noch kein Problem für die Finanzierung entstanden ist, lässt sich an den Chartentwicklungen der amerikanischen Gesundheitsversicherer ablesen.
Ein Beispiel Cigna:

Aber dafür ist die "Belastung" der Versicherten auch schon ziemlich hoch.
Langfristig muss man darauf vertrauen, dass auch die Medikamentenentwickler ihrer Pflicht nachkommen und ggf. die Preise anpassen - gerade dann, wenn sie vom Nischenprodukt zum Massenprodukt werden und dann hoffentlich lange vom Einzelnen genommen werden.
Persönlich könnte ich mir auch vorstellen, dass es noch eine Weile weiter bergauf geht. Im Dezember ist ja auch noch die ASH. Ich glaube aber auch, dass es immer mehr darauf ankommt, auf die richtigen Aktien zu setzen.
100% Zustimmung. Das ist auch mit ein Grund warum ich in den Bereich investiere. Das mit dem Preis wird sich mit der Masse regeln. Das bisher trotz zum Teil enorm hoher Kosten für einzelne Medikamente noch kein Problem für die Finanzierung entstanden ist, lässt sich an den Chartentwicklungen der amerikanischen Gesundheitsversicherer ablesen.
Ein Beispiel Cigna:
Aber dafür ist die "Belastung" der Versicherten auch schon ziemlich hoch.
Langfristig muss man darauf vertrauen, dass auch die Medikamentenentwickler ihrer Pflicht nachkommen und ggf. die Preise anpassen - gerade dann, wenn sie vom Nischenprodukt zum Massenprodukt werden und dann hoffentlich lange vom Einzelnen genommen werden.
Persönlich könnte ich mir auch vorstellen, dass es noch eine Weile weiter bergauf geht. Im Dezember ist ja auch noch die ASH. Ich glaube aber auch, dass es immer mehr darauf ankommt, auf die richtigen Aktien zu setzen.
Antwort auf Beitrag Nr.: 45.620.425 von ipollit am 14.10.13 00:25:01Meine Biotonne sieht natürlich konservativer aus, zumal etwa die Hälfte 10 Jahre und mehr es mit mir ausgehalten haben. Demensprechend sind wegen der Entwicklung Gilead und Alexion meine Dickschiffe, zudem Biogen Idec,
die zwar nicht soo gestiegen sind, ich aber von beiden Firmen schon Aktien hatte, als sie sich zusammengeschlossen haben. Vielleicht so 20 meiner früheren Positionen sind in den letzten 15 Jahren übernommen worden, u.a. Immunex (war wohl die termlich erste, 2002, von Amgen),Icos,Medimmune,Millennium,OSI,Medarex,Sepracor,Ivax,Cor,CV,Genentech,Genzyme,Celltech,HSCI,Andrx,Chiron
und gerade Celgene habe ich aus freien Stücken vor 10 Jahren verkauft....
die zwar nicht soo gestiegen sind, ich aber von beiden Firmen schon Aktien hatte, als sie sich zusammengeschlossen haben. Vielleicht so 20 meiner früheren Positionen sind in den letzten 15 Jahren übernommen worden, u.a. Immunex (war wohl die termlich erste, 2002, von Amgen),Icos,Medimmune,Millennium,OSI,Medarex,Sepracor,Ivax,Cor,CV,Genentech,Genzyme,Celltech,HSCI,Andrx,Chiron
und gerade Celgene habe ich aus freien Stücken vor 10 Jahren verkauft....
nochmal ARIA:
Der EPIC-Trial wurde abgebrochen und der Kurs ist weitere 40% gefallen.
So langsam preist der Markt ein, dass Iclusig die Zulassung komplett verliert. Ich kann das nach wie vor nicht glauben. Deshalb habe ich jetzt eine Position eröffnet. Ist natürlich psychologisch schwierig in so ein Katastrophenszenario zu kaufen. Und vielleicht ist es auch einfach nur ein dummer Fehler.
Der Abbruch des Trials ist an sich ja richtig, denn Iclusig wird niemals ein front-line-Medi werden. Es ist offensichtlich ein "schmutziger Wirkstoff", der nur als last-line Therapie zur Anwendung kommen sollte. Aber dort dann eben schon, oder nicht?
Ariad muss jetzt auch massiv auf die Kostenbremse treten und sollte alle Trials einstellen, die nicht den Einsatz als third-line-Wirkstoff unterstützen, sondern auf weitere Ziele gerichtet sind. Die sind eh nicht mehr zu erreichen.
Das - deutlich zu schrumpfende - R&D-Budget sollte ab nächstes Jahr auf AP26113 konzentriert werden.
Der EPIC-Trial wurde abgebrochen und der Kurs ist weitere 40% gefallen.
So langsam preist der Markt ein, dass Iclusig die Zulassung komplett verliert. Ich kann das nach wie vor nicht glauben. Deshalb habe ich jetzt eine Position eröffnet. Ist natürlich psychologisch schwierig in so ein Katastrophenszenario zu kaufen. Und vielleicht ist es auch einfach nur ein dummer Fehler.
Der Abbruch des Trials ist an sich ja richtig, denn Iclusig wird niemals ein front-line-Medi werden. Es ist offensichtlich ein "schmutziger Wirkstoff", der nur als last-line Therapie zur Anwendung kommen sollte. Aber dort dann eben schon, oder nicht?
Ariad muss jetzt auch massiv auf die Kostenbremse treten und sollte alle Trials einstellen, die nicht den Einsatz als third-line-Wirkstoff unterstützen, sondern auf weitere Ziele gerichtet sind. Die sind eh nicht mehr zu erreichen.
Das - deutlich zu schrumpfende - R&D-Budget sollte ab nächstes Jahr auf AP26113 konzentriert werden.
Antwort auf Beitrag Nr.: 45.656.709 von SLGramann am 19.10.13 08:12:25Hallo SLGramann,
dein Mut bei Ariad scheint sich kurzfristig zumindest auszuzahlen. Ich persönlich finde die Aktie trotz des Rückgangs nicht gerade billig. Ob sie es schaffen werden, mit Iclusig jemals ein "Geschäft" zu machen, muss man abwarten.
Im Biotech Values Board wurde darüber spekuliert, ob man evtl. durch die Gabe eines Antiplatlet Medikaments die Nebenwirkungen in den Griff kriegen könnte.
Spannend bleibt es bei ARRY, die nochmal zurückgekommen sind. Hammer hat sich da in letzter Zeit häufiger - auf Fragen hin - zu geäußert. Er findet den Wert attraktiv bewertet- würde aber nicht mehr als 10% seines Depots investieren. Andereseits schreibt er jetzt, dass es sich fast um ein ETF handelt.
Ich habe unabhängig davon nochmals nachgelegt, weil es rein von der wahrscheinlichkeit einfach unwahrscheinlich ist, dass alle 4 Kandidaten (und es gibt ja noch mehr) scheitern. Von daher halte ich es auch für logisch, dass man hier mehr investieren kann als bei einem Wert, der nur ein Medikament hat. Es geht ja letztlich darum, das Risiko zu minimieren. Hat jemand eine Idee wann genau mit den Ergebnissen (ASH) zu rechnen ist?
Bei Astex wird es ja dann auch nochmal spannend. LEE011 von Novartis entwickelt sich immer mehr zum Hoffnungsträger:
http://www.fiercebiotech.com/story/novartis-advances-rival-c…
Bin gespannt auf die SGI110 Daten. Werde mich ärgern, wenn sie gut sind und wenn sie nicht so gut sind - will ich nichts gesagt haben
SG kmastra
dein Mut bei Ariad scheint sich kurzfristig zumindest auszuzahlen. Ich persönlich finde die Aktie trotz des Rückgangs nicht gerade billig. Ob sie es schaffen werden, mit Iclusig jemals ein "Geschäft" zu machen, muss man abwarten.
Im Biotech Values Board wurde darüber spekuliert, ob man evtl. durch die Gabe eines Antiplatlet Medikaments die Nebenwirkungen in den Griff kriegen könnte.
Spannend bleibt es bei ARRY, die nochmal zurückgekommen sind. Hammer hat sich da in letzter Zeit häufiger - auf Fragen hin - zu geäußert. Er findet den Wert attraktiv bewertet- würde aber nicht mehr als 10% seines Depots investieren. Andereseits schreibt er jetzt, dass es sich fast um ein ETF handelt.
Ich habe unabhängig davon nochmals nachgelegt, weil es rein von der wahrscheinlichkeit einfach unwahrscheinlich ist, dass alle 4 Kandidaten (und es gibt ja noch mehr) scheitern. Von daher halte ich es auch für logisch, dass man hier mehr investieren kann als bei einem Wert, der nur ein Medikament hat. Es geht ja letztlich darum, das Risiko zu minimieren. Hat jemand eine Idee wann genau mit den Ergebnissen (ASH) zu rechnen ist?
Bei Astex wird es ja dann auch nochmal spannend. LEE011 von Novartis entwickelt sich immer mehr zum Hoffnungsträger:
http://www.fiercebiotech.com/story/novartis-advances-rival-c…
Bin gespannt auf die SGI110 Daten. Werde mich ärgern, wenn sie gut sind und wenn sie nicht so gut sind - will ich nichts gesagt haben

SG kmastra
Antwort auf Beitrag Nr.: 45.667.049 von kmastra am 21.10.13 19:29:55Ob sie es schaffen werden, mit Iclusig jemals ein "Geschäft" zu machen, muss man abwarten.
Ganz genau. Nur die Zeit wird zeigen, ob Iclusig einen relevanten Umsatz machen wird. Es wird sich ganz langsam entwickeln - es sein denn, sie verlieren die Zulassung.
Ich glaube daran, dass die Patienten Iclusig brauchen und dass die, die auf Gleevec und Sprycel nicht (mehr) ansprechen. Doch wie viele sind das pro Jahr? Und wie viele können es werden, wenn sich das aufaddiert?
Ehrlich gesagt, ich weiß es nicht. Ich glaube nicht, dass Iclusig auf mittlere Sicht weniger als 100 Mio. Umsatz macht, wenn sie die Zulassung behalten. Ich rechne eher mit 200 und hoffe auf 300 Mio. Aber das kann ich nicht gut begründen.
Welche Wert hat AP26113? Kann das nicht noch der "best-in-class" ALK-Inhibitor werden?
Manchmal sieht man bei Unternehmen alles rosarot (Ariad vor einem Monat) und dann ist plötzlich alles, aber auch alles, scheiße und wertlos (Ariad heute). Position 1 war falsch. Kann sein, dass Position 2 auch falsch ist. Darauf setze ich mal.
Ganz genau. Nur die Zeit wird zeigen, ob Iclusig einen relevanten Umsatz machen wird. Es wird sich ganz langsam entwickeln - es sein denn, sie verlieren die Zulassung.
Ich glaube daran, dass die Patienten Iclusig brauchen und dass die, die auf Gleevec und Sprycel nicht (mehr) ansprechen. Doch wie viele sind das pro Jahr? Und wie viele können es werden, wenn sich das aufaddiert?
Ehrlich gesagt, ich weiß es nicht. Ich glaube nicht, dass Iclusig auf mittlere Sicht weniger als 100 Mio. Umsatz macht, wenn sie die Zulassung behalten. Ich rechne eher mit 200 und hoffe auf 300 Mio. Aber das kann ich nicht gut begründen.
Welche Wert hat AP26113? Kann das nicht noch der "best-in-class" ALK-Inhibitor werden?
Manchmal sieht man bei Unternehmen alles rosarot (Ariad vor einem Monat) und dann ist plötzlich alles, aber auch alles, scheiße und wertlos (Ariad heute). Position 1 war falsch. Kann sein, dass Position 2 auch falsch ist. Darauf setze ich mal.
ARRY:
Selumetinib ist endlich PIII:
AstraZeneca Initiates Phase 3 Clinical Trial For Selumetinib In Non-Small Cell Lung Cancer
New Trial Triggers Milestone Payment to Array
BOULDER, Colo., Oct. 22, 2013 /PRNewswire/ -- AstraZeneca today announced the first patient randomized in a Phase 3 clinical trial for selumetinib, an oral, potent, selective MEK inhibitor, being investigated as second-line therapy in patients with advanced or metastatic non-small-cell lung cancer (NSCLC) whose tumors are KRAS mutation-positive.
http://phx.corporate-ir.net/phoenix.zhtml?c=123810&p=irol-ne…
Selumetinib ist endlich PIII:
AstraZeneca Initiates Phase 3 Clinical Trial For Selumetinib In Non-Small Cell Lung Cancer
New Trial Triggers Milestone Payment to Array
BOULDER, Colo., Oct. 22, 2013 /PRNewswire/ -- AstraZeneca today announced the first patient randomized in a Phase 3 clinical trial for selumetinib, an oral, potent, selective MEK inhibitor, being investigated as second-line therapy in patients with advanced or metastatic non-small-cell lung cancer (NSCLC) whose tumors are KRAS mutation-positive.
http://phx.corporate-ir.net/phoenix.zhtml?c=123810&p=irol-ne…
Aus der Biotech-Blase entweicht allmählich etwas Luft (aktuelles Beispiel: Stemline). Die Aktienkurse müßten dringend weiter konsolidieren. Der Markt hat in letzter Zeit nur noch Chancen gesehen, nicht aber die Risiken.
Antwort auf Beitrag Nr.: 45.672.215 von SLGramann am 22.10.13 15:26:30Noch ein Gedanke zu Array:
Die Marktkapitalisierung liegt bei ungefähr 645 Mio. Dollar.
Allein Selumetinib könnte - Erfolg natürlich vorausgesetzt - doppelt bis dreifach so viel wert sein.
Das Umsatzpotential bei KRAS-mutiertem NSCLC liegt nach Aussage von AstraZeneca wie auch von Analysten im Blockbusterbereich (ca. 1,5 Mrd. Dollar?).
Array hat Royaltie-Ansprüche im double digit-Bereich. Selbst wenn man hier nur 10% unterstellt (ich würde eher von 12 bis 15% ausgehen), sind das 150 Mio. Vorsteuergewinn, der mit Faktor 8 bis 10 in die Marktkapitalisierung einfließen sollte.
Kurz und gut: Allein Selumetinib kann für Array mehr als eine Milliarde an Marktkapitalisierung wert werden.
Und die P II-Daten waren auf jeden Fall vielversprechend:
AstraZeneca's decision to progress selumetinib to Phase 3 in NSCLC followed the results from a randomized Phase 2 study evaluating the combination of selumetinib with docetaxel against docetaxel alone in KRAS-mutation positive NSCLC. This study demonstrated a high and durable response rate of 37.2% vs 0% (p<0.0001), translating into a statistically significant improvement in PFS of 5.3 vs 2.1 months (HR 0.58, p<0.014).
Die Marktkapitalisierung liegt bei ungefähr 645 Mio. Dollar.
Allein Selumetinib könnte - Erfolg natürlich vorausgesetzt - doppelt bis dreifach so viel wert sein.
Das Umsatzpotential bei KRAS-mutiertem NSCLC liegt nach Aussage von AstraZeneca wie auch von Analysten im Blockbusterbereich (ca. 1,5 Mrd. Dollar?).
Array hat Royaltie-Ansprüche im double digit-Bereich. Selbst wenn man hier nur 10% unterstellt (ich würde eher von 12 bis 15% ausgehen), sind das 150 Mio. Vorsteuergewinn, der mit Faktor 8 bis 10 in die Marktkapitalisierung einfließen sollte.
Kurz und gut: Allein Selumetinib kann für Array mehr als eine Milliarde an Marktkapitalisierung wert werden.
Und die P II-Daten waren auf jeden Fall vielversprechend:
AstraZeneca's decision to progress selumetinib to Phase 3 in NSCLC followed the results from a randomized Phase 2 study evaluating the combination of selumetinib with docetaxel against docetaxel alone in KRAS-mutation positive NSCLC. This study demonstrated a high and durable response rate of 37.2% vs 0% (p<0.0001), translating into a statistically significant improvement in PFS of 5.3 vs 2.1 months (HR 0.58, p<0.014).
Antwort auf Beitrag Nr.: 45.677.189 von SLGramann am 23.10.13 09:16:09Da sprichst du mir aus der Investor-Seele.
AZ steckt ja zudem auch viel Geld in die Entwicklung von Selumetinib - was als weiteres Indiz für ein vorhandenes Marktpotenzial (und deren Ausschöpfung) gesehen werden kann:
http://clinicaltrials.gov/ct2/results/displayOpt?flds=a&flds…
Dazu noch MEK162 (das ja zu noch viel besseren Konditionen verpartnert ist), usw. - will mich da jetzt nicht wiederholen.
Von einer Biotech-Blase würde ich von daher nicht unbedingt sprechen, weil es eben auch noch einigen Werte gibt, die in ein/zwei Jahren noch ganz andere Bewertungen haben könnten. Allerdings sind bei vielen Werten die Bewertungen doch nicht mehr so ganz nachvollziehbar. Ich habe auch schon bei einigen deshalb verkauft.
AZ steckt ja zudem auch viel Geld in die Entwicklung von Selumetinib - was als weiteres Indiz für ein vorhandenes Marktpotenzial (und deren Ausschöpfung) gesehen werden kann:
http://clinicaltrials.gov/ct2/results/displayOpt?flds=a&flds…
Dazu noch MEK162 (das ja zu noch viel besseren Konditionen verpartnert ist), usw. - will mich da jetzt nicht wiederholen.

Von einer Biotech-Blase würde ich von daher nicht unbedingt sprechen, weil es eben auch noch einigen Werte gibt, die in ein/zwei Jahren noch ganz andere Bewertungen haben könnten. Allerdings sind bei vielen Werten die Bewertungen doch nicht mehr so ganz nachvollziehbar. Ich habe auch schon bei einigen deshalb verkauft.
Antwort auf Beitrag Nr.: 45.679.259 von kmastra am 23.10.13 13:10:06Array hat die weitere Planung für 520 offen gelegt:
http://phx.corporate-ir.net/phoenix.zhtml?c=123810&p=irol-ne…
Ich weiß nicht, was ich davon halten soll. Eine massive P III (hunderte Patienten) als Kombitherapie mit Kyprolis und das ohne dass 520 verpartnert ist.
Eine (möglicherweise zulassungsrelevante?) Monotherapie-P II soll dann viel später starten (Mitte 2014!).
Weiterhin keine klare Fokussierung auf AAG-Patienten.
Das ist nicht das, was ich erwartet habe und ich kann nicht sagen, dass mir das besonders gefällt. Aber vielleicht werde ich eines besseren belehrt.
http://phx.corporate-ir.net/phoenix.zhtml?c=123810&p=irol-ne…
Ich weiß nicht, was ich davon halten soll. Eine massive P III (hunderte Patienten) als Kombitherapie mit Kyprolis und das ohne dass 520 verpartnert ist.
Eine (möglicherweise zulassungsrelevante?) Monotherapie-P II soll dann viel später starten (Mitte 2014!).
Weiterhin keine klare Fokussierung auf AAG-Patienten.
Das ist nicht das, was ich erwartet habe und ich kann nicht sagen, dass mir das besonders gefällt. Aber vielleicht werde ich eines besseren belehrt.
Antwort auf Beitrag Nr.: 45.733.307 von SLGramann am 31.10.13 15:24:42So richtig punkten können sie an der Börse damit nicht. Array ist in letzter Zeit eh gehörig unter Druck geraten. Wahrscheinlich ist es nicht so klug, das Vorhaben ohne die Untermauerung von Studienergebnissen rauszuhauen. So kann man da jetzt wenig mit anfangen, zumal es immer so kommuniziert wurde, dass erst die ASH Ergebnisse kommen und dann der Plan veröffentlicht wird. Oder hab ich das falsch verstanden? Bin gespannt auf den CC.
Warum jetzt also so?
Warum jetzt nochmal eine PII zur Kombinierbarkeit mit Kyprolis? Dachte das wäre dann erledigt.
Reicht das vorhandene Geld aus?
Würde die PIII in Kombination mit der neuen PII zur Einreichung bei AAG-low Patienten als singleagent reichen oder müsste dann noch eine weitere PIII getartet werden?
...
 kmastra
kmastra
Warum jetzt also so?
Warum jetzt nochmal eine PII zur Kombinierbarkeit mit Kyprolis? Dachte das wäre dann erledigt.
Reicht das vorhandene Geld aus?
Würde die PIII in Kombination mit der neuen PII zur Einreichung bei AAG-low Patienten als singleagent reichen oder müsste dann noch eine weitere PIII getartet werden?
...
 kmastra
kmastra
Antwort auf Beitrag Nr.: 45.667.049 von kmastra am 21.10.13 19:29:55"Hallo SLGramann,
dein Mut bei Ariad scheint sich kurzfristig zumindest auszuzahlen. Ich persönlich finde die Aktie trotz des Rückgangs nicht gerade billig."
Hallo kmastra,
mehr Vorsicht wäre besser gewesen. Iclusig ist nicht mehr am Markt. Das habe ich nicht erwartet. Jetzt wird gesagt, dass sie unter sehr restriktiven Auflagen vielleicht zurückkommen werden. Aber...
Ich werde jetzt dabei bleiben, zumindest bis klar ist, was aus 26113 wird.
VG
dein Mut bei Ariad scheint sich kurzfristig zumindest auszuzahlen. Ich persönlich finde die Aktie trotz des Rückgangs nicht gerade billig."
Hallo kmastra,
mehr Vorsicht wäre besser gewesen. Iclusig ist nicht mehr am Markt. Das habe ich nicht erwartet. Jetzt wird gesagt, dass sie unter sehr restriktiven Auflagen vielleicht zurückkommen werden. Aber...
Ich werde jetzt dabei bleiben, zumindest bis klar ist, was aus 26113 wird.
VG
Antwort auf Beitrag Nr.: 45.737.719 von SLGramann am 01.11.13 07:28:00Ja hatte ich schon gesehen. Jetzt würde ich auch nicht mehr verkaufen.
Hatte mir gestern noch den CC von Array angehört und - es ist irgendwie kompliziert. Gerade in der Indikation ist doch sehr viel "Bewegung" drin. Wie es dann in 3 Jahren aussehen wird, wenn die P III zu Ende ist, lässt sich schwer sagen. Das Array jetzt viel auf Kyprolis setzt ist natürlich nicht ohne Risiko, da es ja z.B. noch gar nicht richtig und überall zugelassen ist. Zudem kam Kyprolis durch Pomalyst in Bedrängnis und ist in letzter Zeit kaum noch gewachsen. Bleibt nicht viel mehr als abzuwarten, ob das eine gute Entscheidung war. Und ich befürchte man braucht da einen langen Atem...
SG kmastra
Hatte mir gestern noch den CC von Array angehört und - es ist irgendwie kompliziert. Gerade in der Indikation ist doch sehr viel "Bewegung" drin. Wie es dann in 3 Jahren aussehen wird, wenn die P III zu Ende ist, lässt sich schwer sagen. Das Array jetzt viel auf Kyprolis setzt ist natürlich nicht ohne Risiko, da es ja z.B. noch gar nicht richtig und überall zugelassen ist. Zudem kam Kyprolis durch Pomalyst in Bedrängnis und ist in letzter Zeit kaum noch gewachsen. Bleibt nicht viel mehr als abzuwarten, ob das eine gute Entscheidung war. Und ich befürchte man braucht da einen langen Atem...
SG kmastra
Antwort auf Beitrag Nr.: 45.739.255 von kmastra am 01.11.13 10:17:54Und ich befürchte man braucht da einen langen Atem...
Ja, eine PIII-Kombistudie dauert (Mitte 2017) und kostet...
Ich denke derzeit nicht mehr, dass wir 520 als "last-line-single-agent" auf Basis einer P II mit ORR als Endpunkt bei AAG-low-Patienten sehen werden, was bisher meine Hoffnung war.
Natürlich eignet sich 520 als Kombipräparat ganz ausgezeichnet und ich glaube, man sollte und wird es später auch mit Pomalyst kombinieren.
Aber die gesamte Entwicklung wird damit kompliziert, teuer und langwierig.
Array ist meiner Meinung nach auf einen Partner angewiesen, den sie nach den hoffentlich guten Daten der neuen PII-520/Kyprolis-Kombistudie gewinnen müssen, die in in nächsten Wochen starten soll.
Das würde bedeuten, dass man (spätestens) zwischen Herbst 2014 und Frühjahr 2015 verpartnern muss.
Bin gespannt, welche konkreten Daten zur ASH kommen. Ein neues Kyprolis ist 520 aber wohl leider nicht...
Ja, eine PIII-Kombistudie dauert (Mitte 2017) und kostet...
Ich denke derzeit nicht mehr, dass wir 520 als "last-line-single-agent" auf Basis einer P II mit ORR als Endpunkt bei AAG-low-Patienten sehen werden, was bisher meine Hoffnung war.
Natürlich eignet sich 520 als Kombipräparat ganz ausgezeichnet und ich glaube, man sollte und wird es später auch mit Pomalyst kombinieren.
Aber die gesamte Entwicklung wird damit kompliziert, teuer und langwierig.
Array ist meiner Meinung nach auf einen Partner angewiesen, den sie nach den hoffentlich guten Daten der neuen PII-520/Kyprolis-Kombistudie gewinnen müssen, die in in nächsten Wochen starten soll.
Das würde bedeuten, dass man (spätestens) zwischen Herbst 2014 und Frühjahr 2015 verpartnern muss.
Bin gespannt, welche konkreten Daten zur ASH kommen. Ein neues Kyprolis ist 520 aber wohl leider nicht...
Antwort auf Beitrag Nr.: 45.740.051 von SLGramann am 01.11.13 11:34:10Auch wenn ich eine gewisse Enttäuschung bei 520 nicht verhelen kann, darf man natürlich nicht außer acht lassen, dass die Daten zumindest so sind, dass man überhaupt in die PIII geht. Wir werden sehen, welche Daten zur ASH kommen, aber 520 ist sehr wahrscheinlich ein ziemlich werthaltiges Asset.
Die MEKs bilden den Backbone der Unternehmensbewertung.
614 ist eine free call-option und es scheint so zu sein, dass sie ihren Asthma-Kandidaten vielleicht wirklich innerhalb der nächsten 6 Monate verpartnert bekommen.
Alles in allem bleibt Array für mich ein Top-Investment mit starker Übergewichtung im Depot.
Die MEKs bilden den Backbone der Unternehmensbewertung.
614 ist eine free call-option und es scheint so zu sein, dass sie ihren Asthma-Kandidaten vielleicht wirklich innerhalb der nächsten 6 Monate verpartnert bekommen.
Alles in allem bleibt Array für mich ein Top-Investment mit starker Übergewichtung im Depot.
Antwort auf Beitrag Nr.: 45.745.977 von SLGramann am 02.11.13 09:57:36Hallo SLGramann,
hab mir auch noch mal in Ruhe so meine Gedanken gemacht:
Ein Vorteil scheint ja auch die gute Sicherheit zu sein, weswegen sich 520 grundsätzlich vielleicht zur Kombination sehr gut eignet. Was die Entscheidung zur PIII verständlich macht.
Array muss sich natürlich entscheiden, ob die die PIII als Singleagent oder eben in Kombination und dann womit durchführen. Das liegt natürlich vor allem an den Kosten. Insofern muss man die Entscheidung auch klar vor diesem Hintergrund sehen und das heißt nicht, dass es als alleine nicht auch potent wäre. Aber wäre eine PIII nur als Singleagent bei dieser "Konkurrenz" eine bessere Entscheidung? Oder eine PIII mit einem anderen Kandidaten als Kyprolis?
Zudem hat Array ja auch vor, eine PII zu starten mit AAG als Kriterium. Hält sich die Option also auch offen.
Das Array jetzt die P III alleine startet, bedeutet ja hoffentlich nicht, dass sie sich nicht noch einen Partner an Bord holen. Das wäre ganz klar mein Wunsch, denn dann könnte man eben mehr Studien machen. Klar würden sich hier Amgen und Celgene anbieten. Gerade Amgen, die ja sehr viel Geld für Kyprolis bezahlt haben, würden sich doch anbieten, zumal sie strategisch diesen Bereich ausbauen wollen.
Was das Ganze so schwierig macht, ist die fehlende Sicherheit darüber, wie es bei MM in drei Jahren aussieht. Und Unsicherheit ist an der Börse bekanntlich ja so beliebt wie ein chinesicher Koch in Entenhausen. Ich glaube aber schon, dass es Patienten geben wird, die von 520 profitieren.
Ob die Entscheidung bei 520 richtig war, wird man sehen. Tatsache ist eben auch, dass Array ja so breit aufgestellt ist, dass selbts ein Flop bei 520 durch Erfolge bei den MEKs oder einem der zahlreichen anderen Kandidaten (die ja eben voll finanziert verpartnert sind) wieder ausgeglichen werden kann. Zudem gibt es ja noch einige Möglichkeiten der Auslizensierung.
Für mich belibt Array zudem auch ganz klar ein Übernahmekandidat.
Lange Rede kurzer Sinn: Ich habe gestern nochmals moderat nachgekauft.
SG kmastra
hab mir auch noch mal in Ruhe so meine Gedanken gemacht:
Ein Vorteil scheint ja auch die gute Sicherheit zu sein, weswegen sich 520 grundsätzlich vielleicht zur Kombination sehr gut eignet. Was die Entscheidung zur PIII verständlich macht.
Array muss sich natürlich entscheiden, ob die die PIII als Singleagent oder eben in Kombination und dann womit durchführen. Das liegt natürlich vor allem an den Kosten. Insofern muss man die Entscheidung auch klar vor diesem Hintergrund sehen und das heißt nicht, dass es als alleine nicht auch potent wäre. Aber wäre eine PIII nur als Singleagent bei dieser "Konkurrenz" eine bessere Entscheidung? Oder eine PIII mit einem anderen Kandidaten als Kyprolis?
Zudem hat Array ja auch vor, eine PII zu starten mit AAG als Kriterium. Hält sich die Option also auch offen.
Das Array jetzt die P III alleine startet, bedeutet ja hoffentlich nicht, dass sie sich nicht noch einen Partner an Bord holen. Das wäre ganz klar mein Wunsch, denn dann könnte man eben mehr Studien machen. Klar würden sich hier Amgen und Celgene anbieten. Gerade Amgen, die ja sehr viel Geld für Kyprolis bezahlt haben, würden sich doch anbieten, zumal sie strategisch diesen Bereich ausbauen wollen.
Was das Ganze so schwierig macht, ist die fehlende Sicherheit darüber, wie es bei MM in drei Jahren aussieht. Und Unsicherheit ist an der Börse bekanntlich ja so beliebt wie ein chinesicher Koch in Entenhausen. Ich glaube aber schon, dass es Patienten geben wird, die von 520 profitieren.
Ob die Entscheidung bei 520 richtig war, wird man sehen. Tatsache ist eben auch, dass Array ja so breit aufgestellt ist, dass selbts ein Flop bei 520 durch Erfolge bei den MEKs oder einem der zahlreichen anderen Kandidaten (die ja eben voll finanziert verpartnert sind) wieder ausgeglichen werden kann. Zudem gibt es ja noch einige Möglichkeiten der Auslizensierung.
Für mich belibt Array zudem auch ganz klar ein Übernahmekandidat.
Lange Rede kurzer Sinn: Ich habe gestern nochmals moderat nachgekauft.
SG kmastra
ARRY
wenn ich es richtig verstehe, ist dies bisher nur die grobe Richtung der weiteren 520-Entwicklung. Wie konkret die PIII/PIIs ausgestaltet werden, steht doch noch nicht fest, oder? Wurde bei CC nicht auch gesagt, dass man weitere Expertise einholen will, bevor man konkret werden möchte?
Eine große PIII braucht es immer für eine volle Zulassung. So hat z.B. Kyprolis bisher ja auch nur eine vorzeitige Zulassung, die durch entsprechende PIIIs untermauert werden muss. PCYC hat für Ibrutinib soweit ich mich erinnere auch zunächst längere PIIIs begonnen und parallel dazu etwas später PIIs, deren Ergebnisse nun für die vorzeitige Zulassung eingereicht worden sind. ARRY schließt eine vorzeitige Zulassung ja nicht aus: "Potential for interim ORR analysis to support U.S. accelerated filing".
Was wären die Alternativen? Eine kleine einarmige Studie nur mit 520 und ORR... ist soetwas aber nicht nur als last-line möglich? Jetzt steht Kyprolis gut da... aber vor über einem Jahr war meiner Meinung nach die Stimmung eher so, dass Kyprolis mit dieser kleinen ORR-Studie keine Chance hat. Die meisten waren eher überrascht, dass Kyprolis dennoch zugelassen wurde. Das zeigt doch auch, dass dieser Weg alles andere als risikolos wäre. Wie gesagt, ist es meines Wissens nach für die Zulassung auf Basis einer PII/eine einarmige Studie/ORR-Endpunkt notwendig, dass die Patienten austherapiert sind und keine wirklichen Alternativen besitzen. Vielleicht ist es bei MM, wo gerade neue Optionen wie Kyprolis oder Pomalyst auf den Markt kommen, schwierig, diese letzte Linie klar zu bestimmen. In Europa ist Kyprolis noch nicht zugelassen, in Amerika schon... wie ist es dann zu bewerten, wenn ARRY eine multinationale PII durchführt mit Patienten, die teilweise auf Kyprolis ansprechen, teilweise nicht. Könnte da die FDA nicht am Ende sagen, dass die Ergebnisse für Amerika nicht aussagekräftig sind?
Ein Argument für die Kyprolis-PIII, ist, dass man so schneller und einfacher in Europa Patienten für die PIII gewinnen könnte, indem diese darüber auch Zugang zu Kyprolis erhalten.
Eine weitere Alternative wäre 520 + dex... diese Kombination scheint ARRY aber nicht erfolgversprechend zu sein, denn es wurde mehrmals betont, dass die dex-Kombi kaum besser als 520-Mono ist.
Setzt ARRY wirklich auf AAG? In der PIII wird zwar der Einfluss gemessen und ARRY erwartet, dass low-AAG besser abschneidet, aber es ist offensichtlich kein Aufnahme-Kriterium. Ist AAG ein unproblematischer Marker?... wie ARRY selber sagt, bindet AAG 520, so dass mehr AAG die freie Menge an 520 reduziert. Nur diese freie Menge kann letztlich wirken. Gleichzeitig kann AAG aber u.U. auch direkt durch den Krankheitsverlauf beeinflusst werden. Es wäre doch unschön, wenn der Krebs z.B. aggressiver wird, dadurch mehr AAG gebildet wird, dass dann auch noch 520 unwirksamer macht. Vielleicht ist ja eine passende Kombination auch hilfreich, um AAG zu senken?
Gruß
ipollit
wenn ich es richtig verstehe, ist dies bisher nur die grobe Richtung der weiteren 520-Entwicklung. Wie konkret die PIII/PIIs ausgestaltet werden, steht doch noch nicht fest, oder? Wurde bei CC nicht auch gesagt, dass man weitere Expertise einholen will, bevor man konkret werden möchte?
Eine große PIII braucht es immer für eine volle Zulassung. So hat z.B. Kyprolis bisher ja auch nur eine vorzeitige Zulassung, die durch entsprechende PIIIs untermauert werden muss. PCYC hat für Ibrutinib soweit ich mich erinnere auch zunächst längere PIIIs begonnen und parallel dazu etwas später PIIs, deren Ergebnisse nun für die vorzeitige Zulassung eingereicht worden sind. ARRY schließt eine vorzeitige Zulassung ja nicht aus: "Potential for interim ORR analysis to support U.S. accelerated filing".
Was wären die Alternativen? Eine kleine einarmige Studie nur mit 520 und ORR... ist soetwas aber nicht nur als last-line möglich? Jetzt steht Kyprolis gut da... aber vor über einem Jahr war meiner Meinung nach die Stimmung eher so, dass Kyprolis mit dieser kleinen ORR-Studie keine Chance hat. Die meisten waren eher überrascht, dass Kyprolis dennoch zugelassen wurde. Das zeigt doch auch, dass dieser Weg alles andere als risikolos wäre. Wie gesagt, ist es meines Wissens nach für die Zulassung auf Basis einer PII/eine einarmige Studie/ORR-Endpunkt notwendig, dass die Patienten austherapiert sind und keine wirklichen Alternativen besitzen. Vielleicht ist es bei MM, wo gerade neue Optionen wie Kyprolis oder Pomalyst auf den Markt kommen, schwierig, diese letzte Linie klar zu bestimmen. In Europa ist Kyprolis noch nicht zugelassen, in Amerika schon... wie ist es dann zu bewerten, wenn ARRY eine multinationale PII durchführt mit Patienten, die teilweise auf Kyprolis ansprechen, teilweise nicht. Könnte da die FDA nicht am Ende sagen, dass die Ergebnisse für Amerika nicht aussagekräftig sind?
Ein Argument für die Kyprolis-PIII, ist, dass man so schneller und einfacher in Europa Patienten für die PIII gewinnen könnte, indem diese darüber auch Zugang zu Kyprolis erhalten.
Eine weitere Alternative wäre 520 + dex... diese Kombination scheint ARRY aber nicht erfolgversprechend zu sein, denn es wurde mehrmals betont, dass die dex-Kombi kaum besser als 520-Mono ist.
Setzt ARRY wirklich auf AAG? In der PIII wird zwar der Einfluss gemessen und ARRY erwartet, dass low-AAG besser abschneidet, aber es ist offensichtlich kein Aufnahme-Kriterium. Ist AAG ein unproblematischer Marker?... wie ARRY selber sagt, bindet AAG 520, so dass mehr AAG die freie Menge an 520 reduziert. Nur diese freie Menge kann letztlich wirken. Gleichzeitig kann AAG aber u.U. auch direkt durch den Krankheitsverlauf beeinflusst werden. Es wäre doch unschön, wenn der Krebs z.B. aggressiver wird, dadurch mehr AAG gebildet wird, dass dann auch noch 520 unwirksamer macht. Vielleicht ist ja eine passende Kombination auch hilfreich, um AAG zu senken?
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.748.811 von ipollit am 02.11.13 23:48:23Hallo ipollit,
wie immer hast Du viel bedenkenswertes geschrieben. Die vorläufige Zulassung von Kyprolis war in der Tat nicht unbedingt erwartet worden und sie war auch nicht eingepreist.
Dass sie erfolgt ist, hat aber zumindest bei mir zu der Hoffnung geführt, dass 520 den selben Weg gehen könnte: Vorläufige Zulassung auf Basis einer PII bei austherapierten Patienten mit ORR als Endpunkt.
Array hat diese Möglichkeit nicht ganz ausgeschlossen und Mitte 2014 soll ja auch eine entsprechende Studie beginnen, aber ich sehe es schon so, dass sie den Schwerpunkt auf die 520/Kyprolis-Kombistudie legen.
Es wird gewiss so sein, dass das angesichts alles Umstände auch der beste Weg ist, aber dass das der beste Weg ist, enttäuscht mich eben etwas. Ich hatte da eine überzogene Hoffnung, wollte einfacher und schneller zum Ziel kommen.
Ich war wahrscheinlich nicht der einzige, mit einer zu großen Erwartungshaltung. Auf mittlere Sicht wird sich aber vermutlich ein positiver Blick auf 520 durchsetzen (auch abhängig von den konkreten Daten zur ASH). Bis heute ist 520 kaum im Kurs von Array eingepreist, würde ich meinen. Das kann schon noch interessant werden.
Vermutlich wird die Zukunft von 520 in verschiedenen Kombi-Therapien liegen. Da es sich um einen ganz eigenen Wirkansatz handelt und das Nebenwirkungsprofil erträglich ist, ist es meine Hoffnung, dass wir die verschiedensten Kombinationen sehen werden. Mit Kyprolis anzufangen, macht ganz sicher Sinn (Nebenwirkungen, Fokussierung auf RRMM-Patienten). Man sollte auch eine Kombi mit Pomalyst testen.
Auch von daher sollte eine Verpartnerung angestrebt werden. Man kann dafür auf weitere Daten warten, aber in 12 bis 18 Monaten sollte man einen Partner haben.
Gruß
SLG
wie immer hast Du viel bedenkenswertes geschrieben. Die vorläufige Zulassung von Kyprolis war in der Tat nicht unbedingt erwartet worden und sie war auch nicht eingepreist.
Dass sie erfolgt ist, hat aber zumindest bei mir zu der Hoffnung geführt, dass 520 den selben Weg gehen könnte: Vorläufige Zulassung auf Basis einer PII bei austherapierten Patienten mit ORR als Endpunkt.
Array hat diese Möglichkeit nicht ganz ausgeschlossen und Mitte 2014 soll ja auch eine entsprechende Studie beginnen, aber ich sehe es schon so, dass sie den Schwerpunkt auf die 520/Kyprolis-Kombistudie legen.
Es wird gewiss so sein, dass das angesichts alles Umstände auch der beste Weg ist, aber dass das der beste Weg ist, enttäuscht mich eben etwas. Ich hatte da eine überzogene Hoffnung, wollte einfacher und schneller zum Ziel kommen.
Ich war wahrscheinlich nicht der einzige, mit einer zu großen Erwartungshaltung. Auf mittlere Sicht wird sich aber vermutlich ein positiver Blick auf 520 durchsetzen (auch abhängig von den konkreten Daten zur ASH). Bis heute ist 520 kaum im Kurs von Array eingepreist, würde ich meinen. Das kann schon noch interessant werden.
Vermutlich wird die Zukunft von 520 in verschiedenen Kombi-Therapien liegen. Da es sich um einen ganz eigenen Wirkansatz handelt und das Nebenwirkungsprofil erträglich ist, ist es meine Hoffnung, dass wir die verschiedensten Kombinationen sehen werden. Mit Kyprolis anzufangen, macht ganz sicher Sinn (Nebenwirkungen, Fokussierung auf RRMM-Patienten). Man sollte auch eine Kombi mit Pomalyst testen.
Auch von daher sollte eine Verpartnerung angestrebt werden. Man kann dafür auf weitere Daten warten, aber in 12 bis 18 Monaten sollte man einen Partner haben.
Gruß
SLG
Antwort auf Beitrag Nr.: 45.656.709 von SLGramann am 19.10.13 08:12:25Nach dem Wiederanstieg des Kurses von Ariad habe ich meine Position wieder (beinahe verlustfrei) geschlossen. Jetzt, wo Iclusig nicht mehr am Markt ist - vorläufig oder nicht - stimmt für mich die Story einfach nicht mehr.
SNTA
Die Galaxy-I PII-Ergebnisse haben sich zwar schlechter entwickelt, doch finde ich nicht plausibel, dass Hammer die Erfolgswahrscheinlichkeit der PIII daraufhin auf 10%-15% senkt: "The update is negative because the effect appears to be diluted with time. Hazard ratio for non-rapid progressors increased from 0.61 to 0.73. In the ITT population the HR increased to 0.9! This adds to the concern around demonstrating a survival benefit in GALAXI-2. I now model only a 15% probability of success, which translates to a valuation of ~$270M, excluding value in other indications."
Die regionalen Differenzen, die SNTA anführt, sind meiner Meinung nach schon auffällig. Wenn ich z.B. an AVEO denke, so sind Studien in Osteuropa oft problematisch, wenn die dortigen Ergebnisse z.B. auf die USA verallgemeinert werden sollen. Die PII wurde zu 2/3 in Osteuropa durchgeführt, das HR ist dort am schlechtesten. Insbesondere sollen sich die Patienten in Russland und der Ukraine vom Rest der Studie unterscheiden. SNTA hat daraufhin die Patientenaufnahme in die PIII in diesen beiden Ländern gestoppt.
Die orangen Markierungen sind die Zwischenergebnisse von vor einem halben Jahr. In den USA und Westeuropa haben sich die Ergebnisse seitdem nicht wesentlich geändert, sehr wohl aber in Osteuropa.
Positiv finde ich es, dass die PIII nur zu 1/3 in Osteuropa durchgeführt wird. Gegebenenfalls wird SNTA abhängig von der PII noch die Größe der PIII auf 700 erhöhen. Negativ ist, dass sie in absehbarer Zukunft weitere finanzielle Mittel benötigen.

Gruß
ipollit
Die Galaxy-I PII-Ergebnisse haben sich zwar schlechter entwickelt, doch finde ich nicht plausibel, dass Hammer die Erfolgswahrscheinlichkeit der PIII daraufhin auf 10%-15% senkt: "The update is negative because the effect appears to be diluted with time. Hazard ratio for non-rapid progressors increased from 0.61 to 0.73. In the ITT population the HR increased to 0.9! This adds to the concern around demonstrating a survival benefit in GALAXI-2. I now model only a 15% probability of success, which translates to a valuation of ~$270M, excluding value in other indications."
Die regionalen Differenzen, die SNTA anführt, sind meiner Meinung nach schon auffällig. Wenn ich z.B. an AVEO denke, so sind Studien in Osteuropa oft problematisch, wenn die dortigen Ergebnisse z.B. auf die USA verallgemeinert werden sollen. Die PII wurde zu 2/3 in Osteuropa durchgeführt, das HR ist dort am schlechtesten. Insbesondere sollen sich die Patienten in Russland und der Ukraine vom Rest der Studie unterscheiden. SNTA hat daraufhin die Patientenaufnahme in die PIII in diesen beiden Ländern gestoppt.


Die orangen Markierungen sind die Zwischenergebnisse von vor einem halben Jahr. In den USA und Westeuropa haben sich die Ergebnisse seitdem nicht wesentlich geändert, sehr wohl aber in Osteuropa.

Positiv finde ich es, dass die PIII nur zu 1/3 in Osteuropa durchgeführt wird. Gegebenenfalls wird SNTA abhängig von der PII noch die Größe der PIII auf 700 erhöhen. Negativ ist, dass sie in absehbarer Zukunft weitere finanzielle Mittel benötigen.
Gruß
ipollit
Santarus-Aktionäre werden ausgezahlt mit 32$/Aktie für den Zusammenschluß mit Salix Pharmaceuticals.
CDLX
Die ersten CDX-1127 PI-Daten finde ich sehr ermutigend: http://ir.celldex.com/common/download/download.cfm?companyid…
Bereits in diesem frühen Stadium zeigt es Wirkung als Monotherapie. Wichtig für Combi-Therapien ist die bisher sehr gute Verträglichkeit. Die Aktivierierung von T-Zellen ist nicht unproblematisch, da hierdurch theoretisch eine extreme Immunreaktion hervorgerufen werden kann, die u.U. tötlich sein kann. Umso erfreulicher ist es, dass CDX-1127 kaum Nebenwirkungen zeigt:
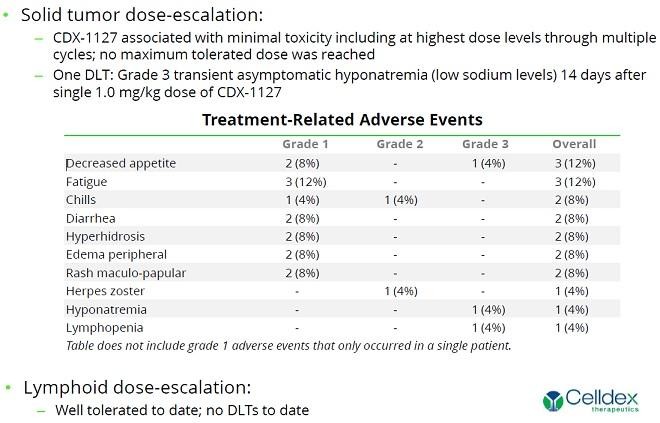
CDX-1127 hat als CD27-AK zwei Wirkmechanismen... zum einen werden Krebszellen, die CD27 expressionieren, direkt angegriffen, zum anderen werden über CD27 die T-Zellen des Immunsystems aktiviert, die ihrerseits Krebszellen erkennen und zerstören können.
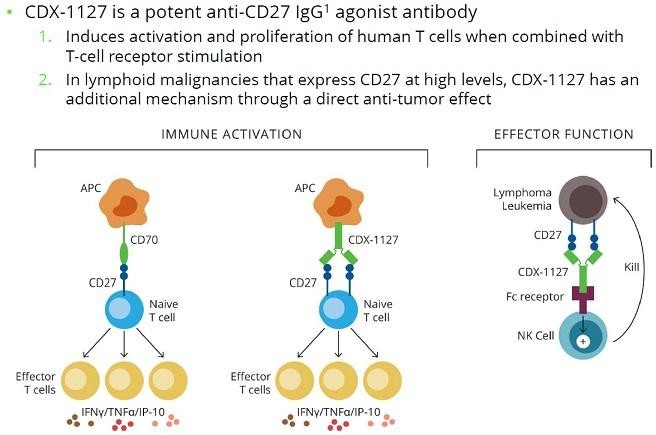
CLDX testet in der PI daher sowohl solide Tumore wie CRC, die kein CD27 expressionieren, als auch Blutkrebsarten, die CD27 besitzen. Beide sprechen teilweise auf CDX-1127 an, darunter auch ein anhaltender CR in HL (Blutkrebs):

Die meisten Patienten haben zuvor bereits erfolglos 4-5 Therapien erhalten. Interessant ist auch das Ansprechen eines CRC-Patienten, da hier normalerweise PD-1&Co nur geringe oder keine Wirkung zeigen.
Spannend finde ich eine Kombination von CDX-1127 und PD-1. In Tierversuchen zeigt es eine synergetische Wirkung:
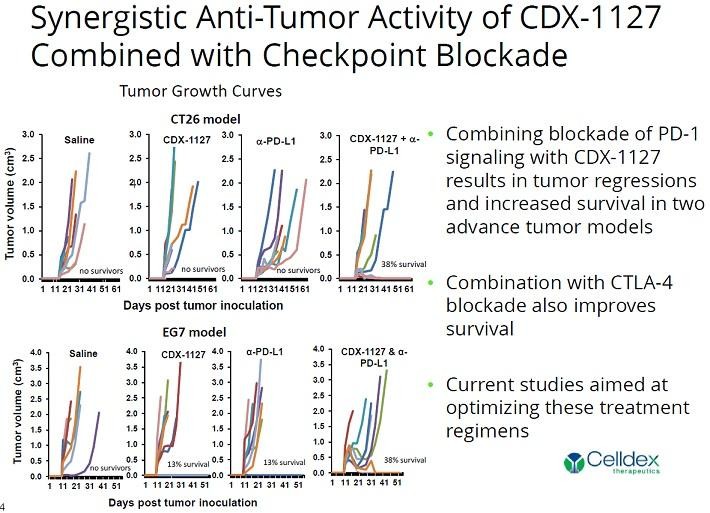
***
While there have been more data on dual checkpoint blockage (like inhibitors of PD-1 and CTLA4), one KOL stated that it does not necessarily mean that it is a better approach. The other KOL believes that the mix and match approach of combining an inhibitor of checkpoint and an agonist is better. While there are currently limited data, we would note that these two approaches may not necessarily be mutually exclusive.
The field of co-stimulatory agonists looks wide open. CD137 is a major target toward T-cells, and clinical data are available for Bristol-Myers' anti-CD137 antibody (urelumab), which was developed in the same way as chemotherapy. It has shown activity but also liver toxicity. On the other hand, the KOLs were less enthusiastic about CD40 inhibitor, which is expressed at antigen presenting cells and its broad expression resulted in toxicity issues. For OX-40, one KOL is skeptical of the yet unpublished clinical activity, but the issue could be that the initial clinical trial used mouse antibody. For GITR, there was also reservation with the approach of using a humanized antibody (instead of a human antibody). Therefore, if single-agent activity is demonstrated for CD27 antibody (CDX-1127), we believe it could be among the most advanced co-stimulatory agonist assets ready for combination.
***
Data from the PI trial evaluating CDX-1127 in the solid tumor/hematological malignancies cohorts were released earlier today (11/7). In the hematological malignancies cohort, CDX-1127 achieved 1 CR and 3 SD out of 17 patients, with a clinical benefit rate (CBR) ~24%. In the solid tumor cohort, there were 4 SD out of 25 patients (CBR ~16%). We view this as a very promising debut for CDX-1127 given our expectations for CBR in the high-teens. The phase I data from the dose-escalation cohort of patients with solid tumors/hematological malignancies will be presented at the Society of Immunotherapy of Cancer meeting (Nov. 7-10).
How does the data compare to Yervoy? The CDX-1127 clinical benefit rates of 24% and 16% in hematological malignancies and solid tumors, respectively, are in-line to our high-teens stable disease rate. However, the 1 CR in hematological malignancies was a positive. In Yervoy's PI trial, 5% OR and 16% stable disease (SDs was observed in melanoma, and 12% OR and no SDs was observed in NHL. Also, a Pfizer compound, CP-870,893 which is a fully human agonist anti-CD40 Ab, reported 26% (7/27) SDs in patients with solid tumors. Of the 7 patients, 4 of them had melanoma and RCC. As the CDX-1127 data from the dose-escalation study matures, we could see an even greater CBR.
Gruß
ipollit
Die ersten CDX-1127 PI-Daten finde ich sehr ermutigend: http://ir.celldex.com/common/download/download.cfm?companyid…
Bereits in diesem frühen Stadium zeigt es Wirkung als Monotherapie. Wichtig für Combi-Therapien ist die bisher sehr gute Verträglichkeit. Die Aktivierierung von T-Zellen ist nicht unproblematisch, da hierdurch theoretisch eine extreme Immunreaktion hervorgerufen werden kann, die u.U. tötlich sein kann. Umso erfreulicher ist es, dass CDX-1127 kaum Nebenwirkungen zeigt:

CDX-1127 hat als CD27-AK zwei Wirkmechanismen... zum einen werden Krebszellen, die CD27 expressionieren, direkt angegriffen, zum anderen werden über CD27 die T-Zellen des Immunsystems aktiviert, die ihrerseits Krebszellen erkennen und zerstören können.

CLDX testet in der PI daher sowohl solide Tumore wie CRC, die kein CD27 expressionieren, als auch Blutkrebsarten, die CD27 besitzen. Beide sprechen teilweise auf CDX-1127 an, darunter auch ein anhaltender CR in HL (Blutkrebs):

Die meisten Patienten haben zuvor bereits erfolglos 4-5 Therapien erhalten. Interessant ist auch das Ansprechen eines CRC-Patienten, da hier normalerweise PD-1&Co nur geringe oder keine Wirkung zeigen.
Spannend finde ich eine Kombination von CDX-1127 und PD-1. In Tierversuchen zeigt es eine synergetische Wirkung:

***
While there have been more data on dual checkpoint blockage (like inhibitors of PD-1 and CTLA4), one KOL stated that it does not necessarily mean that it is a better approach. The other KOL believes that the mix and match approach of combining an inhibitor of checkpoint and an agonist is better. While there are currently limited data, we would note that these two approaches may not necessarily be mutually exclusive.
The field of co-stimulatory agonists looks wide open. CD137 is a major target toward T-cells, and clinical data are available for Bristol-Myers' anti-CD137 antibody (urelumab), which was developed in the same way as chemotherapy. It has shown activity but also liver toxicity. On the other hand, the KOLs were less enthusiastic about CD40 inhibitor, which is expressed at antigen presenting cells and its broad expression resulted in toxicity issues. For OX-40, one KOL is skeptical of the yet unpublished clinical activity, but the issue could be that the initial clinical trial used mouse antibody. For GITR, there was also reservation with the approach of using a humanized antibody (instead of a human antibody). Therefore, if single-agent activity is demonstrated for CD27 antibody (CDX-1127), we believe it could be among the most advanced co-stimulatory agonist assets ready for combination.
***
Data from the PI trial evaluating CDX-1127 in the solid tumor/hematological malignancies cohorts were released earlier today (11/7). In the hematological malignancies cohort, CDX-1127 achieved 1 CR and 3 SD out of 17 patients, with a clinical benefit rate (CBR) ~24%. In the solid tumor cohort, there were 4 SD out of 25 patients (CBR ~16%). We view this as a very promising debut for CDX-1127 given our expectations for CBR in the high-teens. The phase I data from the dose-escalation cohort of patients with solid tumors/hematological malignancies will be presented at the Society of Immunotherapy of Cancer meeting (Nov. 7-10).
How does the data compare to Yervoy? The CDX-1127 clinical benefit rates of 24% and 16% in hematological malignancies and solid tumors, respectively, are in-line to our high-teens stable disease rate. However, the 1 CR in hematological malignancies was a positive. In Yervoy's PI trial, 5% OR and 16% stable disease (SDs was observed in melanoma, and 12% OR and no SDs was observed in NHL. Also, a Pfizer compound, CP-870,893 which is a fully human agonist anti-CD40 Ab, reported 26% (7/27) SDs in patients with solid tumors. Of the 7 patients, 4 of them had melanoma and RCC. As the CDX-1127 data from the dose-escalation study matures, we could see an even greater CBR.
Gruß
ipollit
ARQL... CC notes von mcbio
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARQL 3Q13 CC notes
Interesting part of the CC for me occurred around the 45 minute mark during Q&A. A few notes on that part of CC:
1. Exposure of tivantinib in HCC patients is 2-3 fold higher than in non-HCC patients.
2. There is difference in exposure between capsule form used in P2 and tablet form now being used in P3.
3. ARQL believes the phenomenon of greater drug exposure in HCC patients is due to HCC patients having poor clearance of the drug and being poor metabolizers.
4. ARQL believes that the exposure of 120mg tablet dose now being used in P3 HCC is similar to range seen in 240mg capsule dose that was used in P2 HCC trial.
Also, it was noted earlier in CC that tivantinib patent life runs to about 2030.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARQL 3Q13 CC notes
Interesting part of the CC for me occurred around the 45 minute mark during Q&A. A few notes on that part of CC:
1. Exposure of tivantinib in HCC patients is 2-3 fold higher than in non-HCC patients.
2. There is difference in exposure between capsule form used in P2 and tablet form now being used in P3.
3. ARQL believes the phenomenon of greater drug exposure in HCC patients is due to HCC patients having poor clearance of the drug and being poor metabolizers.
4. ARQL believes that the exposure of 120mg tablet dose now being used in P3 HCC is similar to range seen in 240mg capsule dose that was used in P2 HCC trial.
Also, it was noted earlier in CC that tivantinib patent life runs to about 2030.
Antwort auf Beitrag Nr.: 45.788.288 von Ulf-Imat am 07.11.13 22:51:31Bin dabei. Hab keine Erfahrung mit dieser Situation, Wie jetzt verhalten? Gleich verkaufen zu knapp unter 32$, das Kauf-Angebot von Salix annehmen (wie läuft das?), oder auf höhere Kurse für den verbleibenden free float spekulieren??? Für jeden Tipp dankbar ...
http://www.nasdaq.com/article/salix-pharma-to-buy-santarus-i…
http://www.nasdaq.com/article/salix-pharma-to-buy-santarus-i…
ARRAY:
Das Abstract zu 520 als Monotherapie bzw. + low dose dex:
https://ash.confex.com/ash/2013/webprogram/Paper60455.html
Unabhängig von der zusätzlichen Verabreichnung von dexamethasone liegt die ORR über alle Patienten gesehen bei 16%.
Das ist wohl nicht ausreichend, um das als Monotherapie weiter zu entwickeln.
Aber:
In beiden Patientengruppen (mit oder ohne LoDex) lag die ORR bei den Patienten mit hohem AAG-Level bei 0%, während sie bei den Patienten mit niedrigem AAG-Level bei 24% bzw. 23% lag - und das ist eine andere Hausnummer. Es sind also allein die high-AAG-Patienten, welche die ORR nach unten drücken. 0% ist eben nicht richtig viel...
Es ist theoretisch erklärt, warum dies so ist und man auch nichts anderes erwarten kann. Bisherige klinische Daten passen vollkommen zu der Erwartung, dass 520 bei high-AAG-Patienten schlechter oder gar nicht wirkt.
Ich bin sicher, dass man am Ende die Entwicklung von 520 an diesem Marker ausrichten muss. Alles andere scheint doch nun wirklich keinen Sinn zu ergeben. Warum soll man Patienten einen - immer auch toxischen - Wirkstoff verabreichen, der bei ihnen gar nicht wirken kann?
Das Abstract zu 520 als Monotherapie bzw. + low dose dex:
https://ash.confex.com/ash/2013/webprogram/Paper60455.html
Unabhängig von der zusätzlichen Verabreichnung von dexamethasone liegt die ORR über alle Patienten gesehen bei 16%.
Das ist wohl nicht ausreichend, um das als Monotherapie weiter zu entwickeln.
Aber:
In beiden Patientengruppen (mit oder ohne LoDex) lag die ORR bei den Patienten mit hohem AAG-Level bei 0%, während sie bei den Patienten mit niedrigem AAG-Level bei 24% bzw. 23% lag - und das ist eine andere Hausnummer. Es sind also allein die high-AAG-Patienten, welche die ORR nach unten drücken. 0% ist eben nicht richtig viel...
Es ist theoretisch erklärt, warum dies so ist und man auch nichts anderes erwarten kann. Bisherige klinische Daten passen vollkommen zu der Erwartung, dass 520 bei high-AAG-Patienten schlechter oder gar nicht wirkt.
Ich bin sicher, dass man am Ende die Entwicklung von 520 an diesem Marker ausrichten muss. Alles andere scheint doch nun wirklich keinen Sinn zu ergeben. Warum soll man Patienten einen - immer auch toxischen - Wirkstoff verabreichen, der bei ihnen gar nicht wirken kann?
Nach meinen Erfahrungen wird sich nichts am Preis von 32$ ändern, da es ja eine Übereinstimmung zwischen den beiden Firmen gibt. Mich wundert etwas, daß es keinen Aktientausch gibt, zumal es sich ja wohl um einen merger (Zusammenschluß) handelt. Daß da jetzt ein großer weißer Ritter kommt, halte ich für unwahrscheinlich, worauf man bei einer beabsichteten feindlichen Übernahme zumindest noch hoffen könnte. Wenn man das Geld nun nicht unbedingt jetzt gleich neu investieren will, dann kann man natürlich noch warten und sich die 32$ auszahlen lassen, was sicherlich bis zum nächsten Jahr dauert.
AMBI
Ambit wird auf der ASH nächsten Monat die Ergebnisse der Quizartinib PIIb vorstellen, die eine niedrigere Dosierung in 2nd-line AML testet. Die Ergebnisse aus dem Abstract (https://ash.confex.com/ash/2013/webprogram/Paper60747.html)sehen meiner Meinung nach recht gut aus. Die vorherige höhere Dosierung hat laut Ohad Hammer bei 17% zu deutlichen Veränderungem im EKG (Grad 3) geführt, was nicht unproblematisch ist. Mit der niedrigeren Dosierung ist das nur noch bei 3% der Fall. Gleichzeitig verringert sich die Wirkung kaum mit CRc von 50% und PR von 18% bei 60 mg. 37% erhielten danach eine Knochenmarks-Transplantation, die u.U. den Krebs heilen kann.
Unklarheit besteht noch bezüglich des Unterschieds von CR und CRi (CRc = CR + CRp + CRi)... CR liegt nur bei 3-6%. CRi wurde bisher von der FDA eher kritisch gesehen. Ambit sagt aber, dass es inzwischen Daten gibt, die darauf hinweisen, dass CRi ebenfalls das Überlegen verlängert und somit auch relevant ist.
In den nächsten Wochen will Ambit mir der FDA sprechen, ob aufgrund der PIIb (ASH-Ergebnisse) eine vorzeitige Zulassung beantragt werden kann. Immerhin gibt es meines Wissens nach keine Alternative bei 2nd-line AML. Auf jeden Fall wird Ambit nächstes Jahr eine entsprechende Monotherapie-PIII in 2nd-line starten... Ergebnisse sollen Ende 2015 vorliegen. Eine akademische Einrichtung wird zur ASH zudem 1st-line PII-Ergebnisse in Kombination mit Chemo veröffentlichen und eventuell eine eigene 1st-line PIII starten.
Mit der aktuellen MK von 240 Mio USD bei 75 Mio Cash ist AMBI meiner Meinung nach nicht teuer. Der Markt ist recht negativ, da weder CRi als relevant angesehen, eine vorzeitige Zulassung eher ausgeschlossen und überhaupt Quizartinib als wenig differenzierter FLT3-Hemmer bezeichnet wird. Mir kommt es vor, dass diese Meinungenen auf einer eher flüchtigen Betrachtung basieren.

Gruß
ipollit
Ambit wird auf der ASH nächsten Monat die Ergebnisse der Quizartinib PIIb vorstellen, die eine niedrigere Dosierung in 2nd-line AML testet. Die Ergebnisse aus dem Abstract (https://ash.confex.com/ash/2013/webprogram/Paper60747.html)sehen meiner Meinung nach recht gut aus. Die vorherige höhere Dosierung hat laut Ohad Hammer bei 17% zu deutlichen Veränderungem im EKG (Grad 3) geführt, was nicht unproblematisch ist. Mit der niedrigeren Dosierung ist das nur noch bei 3% der Fall. Gleichzeitig verringert sich die Wirkung kaum mit CRc von 50% und PR von 18% bei 60 mg. 37% erhielten danach eine Knochenmarks-Transplantation, die u.U. den Krebs heilen kann.
Unklarheit besteht noch bezüglich des Unterschieds von CR und CRi (CRc = CR + CRp + CRi)... CR liegt nur bei 3-6%. CRi wurde bisher von der FDA eher kritisch gesehen. Ambit sagt aber, dass es inzwischen Daten gibt, die darauf hinweisen, dass CRi ebenfalls das Überlegen verlängert und somit auch relevant ist.
In den nächsten Wochen will Ambit mir der FDA sprechen, ob aufgrund der PIIb (ASH-Ergebnisse) eine vorzeitige Zulassung beantragt werden kann. Immerhin gibt es meines Wissens nach keine Alternative bei 2nd-line AML. Auf jeden Fall wird Ambit nächstes Jahr eine entsprechende Monotherapie-PIII in 2nd-line starten... Ergebnisse sollen Ende 2015 vorliegen. Eine akademische Einrichtung wird zur ASH zudem 1st-line PII-Ergebnisse in Kombination mit Chemo veröffentlichen und eventuell eine eigene 1st-line PIII starten.
Mit der aktuellen MK von 240 Mio USD bei 75 Mio Cash ist AMBI meiner Meinung nach nicht teuer. Der Markt ist recht negativ, da weder CRi als relevant angesehen, eine vorzeitige Zulassung eher ausgeschlossen und überhaupt Quizartinib als wenig differenzierter FLT3-Hemmer bezeichnet wird. Mir kommt es vor, dass diese Meinungenen auf einer eher flüchtigen Betrachtung basieren.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.760.249 von ipollit am 04.11.13 23:14:01SNTA
Die Galaxy-I PII-Ergebnisse haben sich zwar schlechter entwickelt, doch finde ich nicht plausibel, dass Hammer die Erfolgswahrscheinlichkeit der PIII daraufhin auf 10%-15% senkt
Hallo ipollit, ich kann nicht beurteilen, ob das plausibel ist. Was ich aber nicht verstehe, ist, wie er dann SNTA im Depot lassen kann. Wenn Galaxy endgültig scheitert, wird die Aktie noch mal deutlich billiger bzw. wird sie Stück für Stück schon jetzt billiger. Wenn man dann trotzdem weiter an Ganetespib glaubt, wofür es gute Gründe geben mag, kann man zurück kaufen, wenn das Scheitern bei NSCLC offiziell ist. Hammer ist kein Trader (zum Glück!), aber sehenden Auges in ein Desaster laufen, das eine 90%-Eintrittswahrscheinlichkeit hat? Warum?
Die Galaxy-I PII-Ergebnisse haben sich zwar schlechter entwickelt, doch finde ich nicht plausibel, dass Hammer die Erfolgswahrscheinlichkeit der PIII daraufhin auf 10%-15% senkt
Hallo ipollit, ich kann nicht beurteilen, ob das plausibel ist. Was ich aber nicht verstehe, ist, wie er dann SNTA im Depot lassen kann. Wenn Galaxy endgültig scheitert, wird die Aktie noch mal deutlich billiger bzw. wird sie Stück für Stück schon jetzt billiger. Wenn man dann trotzdem weiter an Ganetespib glaubt, wofür es gute Gründe geben mag, kann man zurück kaufen, wenn das Scheitern bei NSCLC offiziell ist. Hammer ist kein Trader (zum Glück!), aber sehenden Auges in ein Desaster laufen, das eine 90%-Eintrittswahrscheinlichkeit hat? Warum?
PCYC
Imbruvica (Ibrutinib) hat die Zulassung der FDA für MCL erhalten... CLL aber offensichtlich (noch) nicht. Gut oder schlecht? Ich hätte gedacht, dass eine Zulassung erstmal reicht, da alles andere dann auch offlabel möglich ist.
der Handel ist im Moment noch angehalten...

Gruß
ipollit
Imbruvica (Ibrutinib) hat die Zulassung der FDA für MCL erhalten... CLL aber offensichtlich (noch) nicht. Gut oder schlecht? Ich hätte gedacht, dass eine Zulassung erstmal reicht, da alles andere dann auch offlabel möglich ist.
der Handel ist im Moment noch angehalten...
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.826.752 von ipollit am 13.11.13 18:43:40
Antwort auf Beitrag Nr.: 45.826.762 von ipollit am 13.11.13 18:44:47für CLL könnte aber in Kürze noch die Zulassung erfolgen... die FDA hat sich hierzu noch nicht geäußert. Auf jeden Fall ist Imbruvica nun auf dem Markt...
Gruß
ipollit

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.826.808 von ipollit am 13.11.13 18:49:19(per twitter)
- mgmt said NDA was split into MCL and CLL, both have same PDUFA but under separate reviews
- r/r CLL NDA still being reviewed, Ph3 interim prior to end of Jan'14
- Imbruvica priced at $130,000 per year for MCL!!!
- Ibrutinib Price $10900/30 days supply in MCL translates to $8200 in CLL (low dose)
- Imbruvica pricing will be $8200/ month or $98k/ yr in CLL
- mgmt said NDA was split into MCL and CLL, both have same PDUFA but under separate reviews
- r/r CLL NDA still being reviewed, Ph3 interim prior to end of Jan'14
- Imbruvica priced at $130,000 per year for MCL!!!
- Ibrutinib Price $10900/30 days supply in MCL translates to $8200 in CLL (low dose)
- Imbruvica pricing will be $8200/ month or $98k/ yr in CLL
Immunotherapien gegen Krebs sind momentan sehr aussichtsreich, da sie sehr langanhaltende Wirkungen erzielen können.
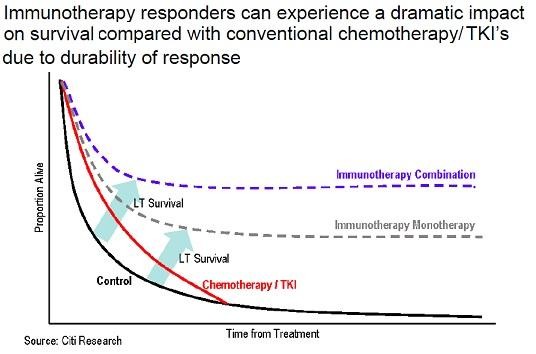
PD-1 AKs bilden bisher dafür die Basis. Allerdings wirkt PD-1 nicht bei allen Krebsarten und dort wo es wirkt, profitieren auch nicht alle Patienten davon... nur bei einem Teil spricht wirklich und dann auch deutlich an. Also sind auch Kombinationen von PD-1 mit anderen Mitteln interessant... oder grundsätzlich andere Ansätze. Was ist da aussichtsreich und welche beteiligten Firmen sind an der Börse?
Hier sind ein paar Targets zu finden... ich denke, es gibt aber auch ein ganze Reihe mehr
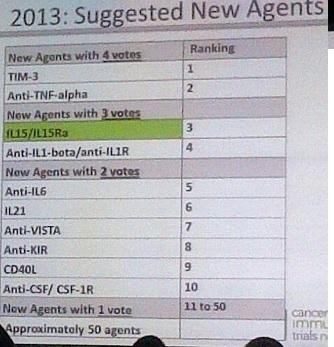
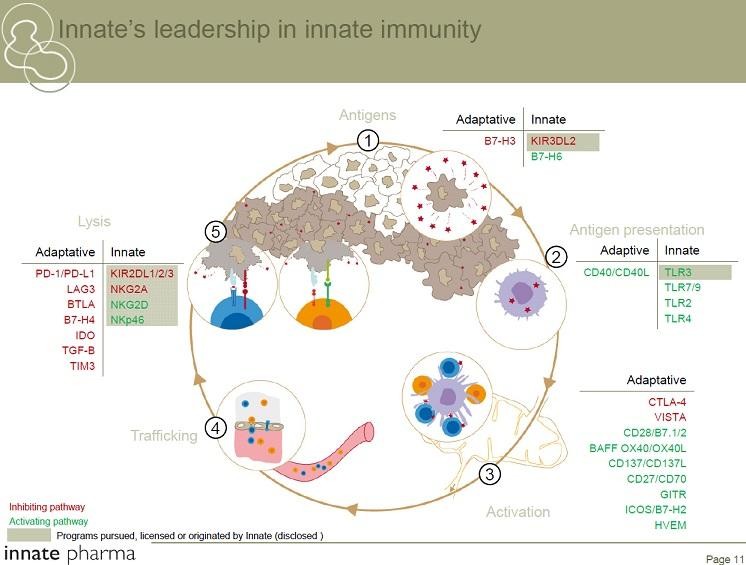
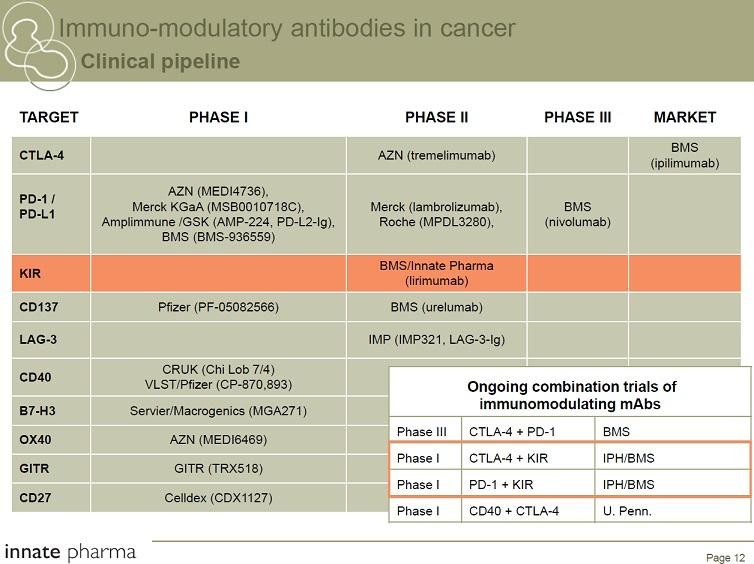
http://www.innate-pharma.com/sites/default/files/1310_iph_co…
Ich bin im Moment in Celldex mit dem CD27-AK CDX-1127, einem T-Cell Stimmulator, in Incyte mit dem IDO-Hemmer INCB24360, einem Checkpoint-Inhibitor, Macrogenics mit dem B7-H3-AK MGA271, auch ein Checkpoint-Inhibitor(?), und Innate Pharma mit dem KIR-AK Lirilumab, einem NK-Checkpoint-Inhibitor, investiert. Gibt es noch weitere?
Ist CSF-1R ebenfalls ein solches Target? z.B. Ambit hat mir AC708 einen CSF-1R-Hemmer in der Präklinik.
KIR-AKs könnten interessant sein, wenn man diese mit anderen AKs wie z.B. Rituxan kombiniert: http://www.innate-pharma.com/sites/default/files/131014_pr_l… Eine Wirkung von AKs ist ADCC, bei der die Target-Zelle nach der Markierung mit dem AK durch Immunzellen zerstört wird. Über KIR können Tumorzellen Fresszellen aber davon abhalten, aktiv zu werden. KIR-AKs verhindern das, so dass sich theoretisch die AK-Wirkung erhöhen könnte und das unabhängig vom Target, egal ob CD20-AKs, EGFR-AKs oder HER2-AKs...
Außerdem werden Kombinationen mit Target-Therapien getestet... MEK scheint ein interessantes,mit PD-1 synergetischs Target zu sein. Genentech beginnt hier Kombi-Studien mit EXELs Cobimetinib: http://www.roche-trials.com/trialDetailsGet.action?studyNumb…
Angeblich soll die lange Wirkung von PCYCs Ibrutinib weniger auf BTK zu beruhen, sondern vielmehr auf der zusätzlichen Hemmung von ITK... diese führt zu einer stärkeren Immunantwort:
http://www.ncbi.nlm.nih.gov/pubmed/23886836
http://files.shareholder.com/downloads/PCYC/0x0x621315/B764E…
Gruß
ipollit

PD-1 AKs bilden bisher dafür die Basis. Allerdings wirkt PD-1 nicht bei allen Krebsarten und dort wo es wirkt, profitieren auch nicht alle Patienten davon... nur bei einem Teil spricht wirklich und dann auch deutlich an. Also sind auch Kombinationen von PD-1 mit anderen Mitteln interessant... oder grundsätzlich andere Ansätze. Was ist da aussichtsreich und welche beteiligten Firmen sind an der Börse?
Hier sind ein paar Targets zu finden... ich denke, es gibt aber auch ein ganze Reihe mehr



http://www.innate-pharma.com/sites/default/files/1310_iph_co…
Ich bin im Moment in Celldex mit dem CD27-AK CDX-1127, einem T-Cell Stimmulator, in Incyte mit dem IDO-Hemmer INCB24360, einem Checkpoint-Inhibitor, Macrogenics mit dem B7-H3-AK MGA271, auch ein Checkpoint-Inhibitor(?), und Innate Pharma mit dem KIR-AK Lirilumab, einem NK-Checkpoint-Inhibitor, investiert. Gibt es noch weitere?
Ist CSF-1R ebenfalls ein solches Target? z.B. Ambit hat mir AC708 einen CSF-1R-Hemmer in der Präklinik.
KIR-AKs könnten interessant sein, wenn man diese mit anderen AKs wie z.B. Rituxan kombiniert: http://www.innate-pharma.com/sites/default/files/131014_pr_l… Eine Wirkung von AKs ist ADCC, bei der die Target-Zelle nach der Markierung mit dem AK durch Immunzellen zerstört wird. Über KIR können Tumorzellen Fresszellen aber davon abhalten, aktiv zu werden. KIR-AKs verhindern das, so dass sich theoretisch die AK-Wirkung erhöhen könnte und das unabhängig vom Target, egal ob CD20-AKs, EGFR-AKs oder HER2-AKs...
Außerdem werden Kombinationen mit Target-Therapien getestet... MEK scheint ein interessantes,mit PD-1 synergetischs Target zu sein. Genentech beginnt hier Kombi-Studien mit EXELs Cobimetinib: http://www.roche-trials.com/trialDetailsGet.action?studyNumb…
Angeblich soll die lange Wirkung von PCYCs Ibrutinib weniger auf BTK zu beruhen, sondern vielmehr auf der zusätzlichen Hemmung von ITK... diese führt zu einer stärkeren Immunantwort:
http://www.ncbi.nlm.nih.gov/pubmed/23886836
http://files.shareholder.com/downloads/PCYC/0x0x621315/B764E…
Gruß
ipollit
Ohad Hammer heute mit einem Ausblick auf die ASH:
http://www.orf-blog.com/top-picks-for-ash-2013/
Wie immer sehr interessant!
http://www.orf-blog.com/top-picks-for-ash-2013/
Wie immer sehr interessant!
Antwort auf Beitrag Nr.: 45.854.252 von kmastra am 17.11.13 19:39:16Ohad Hammer vergleicht PCYCs Imbruvica mit anderen BTK-Hemmern wie CC-292... ergänzend dazu hatte ich aber ein paarmal gelesen, dass die besonders lange Wirkung von Imbruvica nicht auf BTK sondern auf ITK beruht. Wenn das stimmt, müssten die Konkurrenten ebenfalls neben BTK auch ITK hemmen, was meine ich z.B. bei CC-292 nicht der Fall ist.
INCY... "Sanofi (SNY) will present phase III data for its Jak1/2 inhibitor, fedratinib, which is Jakafi’s most advanced competitor." Laut http://t.co/Q8ZaQsqSQY hat die FDA fedratinib in PV gestoppt: "The development of fedratinib (Jak2 inhibitor) as a single agent in the treatment of Polycythemia Vera (PV) has been halted." Über Twitter schreibt Feuerstein gestern: "$SNY Jak inhibitor fedratinib placed on FDA clinical hold due to toxicity." - zumindest scheint Fedratinib nicht unproblematisch zu sein.
Gruß
ipollit
INCY... "Sanofi (SNY) will present phase III data for its Jak1/2 inhibitor, fedratinib, which is Jakafi’s most advanced competitor." Laut http://t.co/Q8ZaQsqSQY hat die FDA fedratinib in PV gestoppt: "The development of fedratinib (Jak2 inhibitor) as a single agent in the treatment of Polycythemia Vera (PV) has been halted." Über Twitter schreibt Feuerstein gestern: "$SNY Jak inhibitor fedratinib placed on FDA clinical hold due to toxicity." - zumindest scheint Fedratinib nicht unproblematisch zu sein.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.855.040 von ipollit am 17.11.13 22:14:07Jetzt hat Sanofi die weitere Entwicklung sogar komplett eingestellt:
http://m-en.sanofi.com/Images/34935_20131118_JAK-2-FEDRATINI…
Für mich war natürlich interessant was OH zu Array schrieb.
Results continue to suggest that AAG as a biomarker could identify a patient population for which approval can be obtained with a single arm phase II.
Kritischer sieht er die Ergebnisse der Kombinationsstudien:
These response rates are numerically superior to what could be expected with monotherapy Kyprolis and Velcade but the difference does not appear dramatic (~10-15% absolute improvement).
Ich hoffe einfach mal, dass Array in einem engen Kontakt zur FDA stand und steht. Und die Signale dann auch richtig entschlüsselt!
SG
http://m-en.sanofi.com/Images/34935_20131118_JAK-2-FEDRATINI…
Für mich war natürlich interessant was OH zu Array schrieb.
Results continue to suggest that AAG as a biomarker could identify a patient population for which approval can be obtained with a single arm phase II.
Kritischer sieht er die Ergebnisse der Kombinationsstudien:
These response rates are numerically superior to what could be expected with monotherapy Kyprolis and Velcade but the difference does not appear dramatic (~10-15% absolute improvement).
Ich hoffe einfach mal, dass Array in einem engen Kontakt zur FDA stand und steht. Und die Signale dann auch richtig entschlüsselt!
SG
@kmastra
interessant, danke! INCY war zuletzt auch merkwürdig stark. Jemand hatte gestern geschrieben: "if there's a class effect, may be cuz most jak2 cmpds have off target inhibition, including flt3."
Bei AMBI und FPRX habe ich mich u.a. für die CFS-R1 Hemmer/AKs in der Präklinik interessiert, da diese auch immunologisch eine Rolle spielen. Dabei ist mir aufgefallen, dass ARRY ebenfalls soetwas in der Pipeline hat/hatte und zwar ARRY-382 als cFMS-Hemmer (scheint ein Synonym für CFS-R1 zu sein). Der Kooperationspartner war Celgene. Ich meine mich schwach daran erinnern zu können, dass ich schon mal gelesen habe, dass ARRY-382 nicht weitergeführt wird. Leider kann ich dazu nichts finden... weißt du vielleicht etwas darüber? ARRY-382 ist sowohl aus ARRYs als auch aus CELGs Pipeline verschwunden. Zudem findet sich Celgene nicht mehr unter den Partnern auf der ARRY-HP, obwohl erst im Sommer eine weiterführende Kooperation vereinbart worden ist. Was bedeutet das?
CSF-R1 AKs gegen Krebs werden u.a. von Roche entwickelt. Ein CSF-R1 Inhibitor muss wohl sehr selektiv sein... flt3 könnte auch in diesem Zusammenhang eine Rolle spielen. ARRY hatte ARRY-382 als selektiv beschrieben (z.B. kein cKIT oder PDGFR)... flt3 wurde aber nicht explizit erwähnt. Komisch finde ich auch, dass das letzte Poster zu ARRY-382 erst ein paar Wochen alt ist http://www.arraybiopharma.com/PatentsPublications/Default.as… und mit "Tolerability and evidence for activity support further development in a variety of potential indications including solid tumor therapy in combination with chemotherapy or metastatic bone disease" endet. Vielleicht sind die dort beschriebenen Ergebnisse doch zu problematisch, da offensichtlich ARRY-382 erst ab 400mg eine ausreichende Wirkung auf CSF1 zeigt, aber 400mg bereits MTD ist, ab der auch gravierende Nebenwirkungen auftreten?
Im S1 von AMBI heißt es: "CSF1R is a member of the same kinase family as FLT3, cKIT, and PDGFR, and all share a highly similar structure. While the CSF1R kinase has been a target of interest in the pharmaceutical industry for several years, a key challenge has been the identification of inhibitors with sufficient selectivity for CSF1R (and minimal to no off-target activity on FLT3, cKit and PDGFR) and there are currently no approved therapies that specifically target CSF1R. The underlying treatment hypothesis requires chronic dosing, which necessitates exceptionally well tolerated compounds. We believe that a CSF1R inhibitor that also provides potent inhibition of FLT3 and/or cKIT may result in myelosuppression, a side effect which would limit dosing in oncology indications and be unacceptable in non-oncology indications."
Gruß
ipollit
interessant, danke! INCY war zuletzt auch merkwürdig stark. Jemand hatte gestern geschrieben: "if there's a class effect, may be cuz most jak2 cmpds have off target inhibition, including flt3."
Bei AMBI und FPRX habe ich mich u.a. für die CFS-R1 Hemmer/AKs in der Präklinik interessiert, da diese auch immunologisch eine Rolle spielen. Dabei ist mir aufgefallen, dass ARRY ebenfalls soetwas in der Pipeline hat/hatte und zwar ARRY-382 als cFMS-Hemmer (scheint ein Synonym für CFS-R1 zu sein). Der Kooperationspartner war Celgene. Ich meine mich schwach daran erinnern zu können, dass ich schon mal gelesen habe, dass ARRY-382 nicht weitergeführt wird. Leider kann ich dazu nichts finden... weißt du vielleicht etwas darüber? ARRY-382 ist sowohl aus ARRYs als auch aus CELGs Pipeline verschwunden. Zudem findet sich Celgene nicht mehr unter den Partnern auf der ARRY-HP, obwohl erst im Sommer eine weiterführende Kooperation vereinbart worden ist. Was bedeutet das?
CSF-R1 AKs gegen Krebs werden u.a. von Roche entwickelt. Ein CSF-R1 Inhibitor muss wohl sehr selektiv sein... flt3 könnte auch in diesem Zusammenhang eine Rolle spielen. ARRY hatte ARRY-382 als selektiv beschrieben (z.B. kein cKIT oder PDGFR)... flt3 wurde aber nicht explizit erwähnt. Komisch finde ich auch, dass das letzte Poster zu ARRY-382 erst ein paar Wochen alt ist http://www.arraybiopharma.com/PatentsPublications/Default.as… und mit "Tolerability and evidence for activity support further development in a variety of potential indications including solid tumor therapy in combination with chemotherapy or metastatic bone disease" endet. Vielleicht sind die dort beschriebenen Ergebnisse doch zu problematisch, da offensichtlich ARRY-382 erst ab 400mg eine ausreichende Wirkung auf CSF1 zeigt, aber 400mg bereits MTD ist, ab der auch gravierende Nebenwirkungen auftreten?
Im S1 von AMBI heißt es: "CSF1R is a member of the same kinase family as FLT3, cKIT, and PDGFR, and all share a highly similar structure. While the CSF1R kinase has been a target of interest in the pharmaceutical industry for several years, a key challenge has been the identification of inhibitors with sufficient selectivity for CSF1R (and minimal to no off-target activity on FLT3, cKit and PDGFR) and there are currently no approved therapies that specifically target CSF1R. The underlying treatment hypothesis requires chronic dosing, which necessitates exceptionally well tolerated compounds. We believe that a CSF1R inhibitor that also provides potent inhibition of FLT3 and/or cKIT may result in myelosuppression, a side effect which would limit dosing in oncology indications and be unacceptable in non-oncology indications."
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.848.754 von ipollit am 16.11.13 13:58:35EXEL/ARRY
hier ist noch etwas zu der PD1 + MEK Kombi... im Moment nur von Roche MPDL3280A + EXELs Cobimetinib. EXEL erhält bei Marktzulassung hohe Royalties, die (soweit ich mich erinnere) bis zu 35% betragen können. Ohad Hammer hat sich mal etwas enttäuscht von Cobimetinib gezeigt, da es wohl bei KRAS-mutierten NSCLC nicht gut wirkt. Roche hat noch weitere MEK-Hemmer in der Pipeline. Daran sieht man, dass MEK nicht gleich MEK ist. In diesem Bereich sollte ARRY vorne mit dabei sein. AZN hat ebenfalls etwas gegen PD1 in der Entwicklung, könnte somit z.B. auch eine Kombi mit Selumetinib testen. Novartis setzt anscheinend eher auf CARs (außerhalb des Körpers modifizierte T-Zellen)... haben die auch PD1-AKs oder ähnliches in der Pipeline?

Gruß
ipollit
hier ist noch etwas zu der PD1 + MEK Kombi... im Moment nur von Roche MPDL3280A + EXELs Cobimetinib. EXEL erhält bei Marktzulassung hohe Royalties, die (soweit ich mich erinnere) bis zu 35% betragen können. Ohad Hammer hat sich mal etwas enttäuscht von Cobimetinib gezeigt, da es wohl bei KRAS-mutierten NSCLC nicht gut wirkt. Roche hat noch weitere MEK-Hemmer in der Pipeline. Daran sieht man, dass MEK nicht gleich MEK ist. In diesem Bereich sollte ARRY vorne mit dabei sein. AZN hat ebenfalls etwas gegen PD1 in der Entwicklung, könnte somit z.B. auch eine Kombi mit Selumetinib testen. Novartis setzt anscheinend eher auf CARs (außerhalb des Körpers modifizierte T-Zellen)... haben die auch PD1-AKs oder ähnliches in der Pipeline?

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.858.482 von ipollit am 18.11.13 13:33:15ENTA
Ergebnisse der ersten von 6 großen PIII mit ABT-450... 95% SVR12 in GT1a und 98% SVR12 in GT1b (beides zuvor unbehandelte Patienten)
http://www.fiercebiotech.com/story/abbvie-steps-closer-fda-f…
"AbbVie's ($ABBV) all-oral "3D" regimen scored high sustained virological response rates among 631 treatment-naive patients after 12 weeks of treatment, hitting 96% for the treatment arm. Most of the patients were in the hard-to-treat genotype 1 category, with SVR rates of 95% and 98% for GT1a and GT1b patients. The discontinuation rate was low, only 0.6%, with a 1.7% relapse rate.
...
"While ABBV's cure rate data continues to be very impressive, the number of pills may be an issue from commercial front," notes IBI's Mark Schoenebaum. "For instance, Gilead's G1 regimen is simply one pill once a day. ABBV's SAPHIRE-1, on the other hand, employed: Coformulated PI + NS5a + ritonavir - once a day; non-nuc - twice a day; ribavirin - twice a day."

Gruß
ipollit
Ergebnisse der ersten von 6 großen PIII mit ABT-450... 95% SVR12 in GT1a und 98% SVR12 in GT1b (beides zuvor unbehandelte Patienten)
http://www.fiercebiotech.com/story/abbvie-steps-closer-fda-f…
"AbbVie's ($ABBV) all-oral "3D" regimen scored high sustained virological response rates among 631 treatment-naive patients after 12 weeks of treatment, hitting 96% for the treatment arm. Most of the patients were in the hard-to-treat genotype 1 category, with SVR rates of 95% and 98% for GT1a and GT1b patients. The discontinuation rate was low, only 0.6%, with a 1.7% relapse rate.
...
"While ABBV's cure rate data continues to be very impressive, the number of pills may be an issue from commercial front," notes IBI's Mark Schoenebaum. "For instance, Gilead's G1 regimen is simply one pill once a day. ABBV's SAPHIRE-1, on the other hand, employed: Coformulated PI + NS5a + ritonavir - once a day; non-nuc - twice a day; ribavirin - twice a day."
Gruß
ipollit
SNTA legt aktuell 19% zu,
nach erfolgreicher KE und Insiderkäufen ...
nach erfolgreicher KE und Insiderkäufen ...
Nochmal ENTA:
Die heutigen Ergebnisse waren ja eine Studie primär zur Sicherheit. Von daher sind die Ergebnisse m.E. deshalb sehr positiv, weil man sich schon fragt, woran eine Zulassung überhaupt noch scheitern soll. Effektivität und Sicherheit sind schon mal gegeben. Man darf ja nicht vergessen, dass ENTA alleine 195 Mio$ nur für Antrag und Zulassung an Milestones bekommt.
1) The $195M of pre-commercial milestones on ABT-450 payable by ABBV to ENTA consists of $40M for NDA/MAA submissions and $155M for marketing approvals. The $40M and $155M figures are further divided by geography; the overwhelming proportion of each amount is presumably attributable to the US and EU, with a lesser proportion for Japan, and (presumably) much lesser proportions for such countries as Canada, Australia, Switzerland, and emerging markets.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Ob und wie sich die Combo dann vor allem gegen Gilead durchsetzt steht dann auf einem anderen Blatt Papier:
With comparable efficacy, doctors' and patients' preference is likely to come down to side effects, cost, and convenience, likely in that order. So far, AbbVie's safety profile looks good; if Gilead can match it, the battle might come down to price. Part of AbbVie's regimen has to be taken twice a day while other drugs have to be taken three times a day, so AbbVie may lose on the convenience factor if it comes down to that.
http://www.fool.com/investing/general/2013/11/18/dont-crown-…
Ich würde da auch noch den Vertrieb und Marketing dazunehmen. Langfristig könnte ich mir aber schon vorstellen, dass viel über den Preis gehen wird, wenn noch weitere hocheffektive Medikamente auf dem Markt sind. Ob das ganze wirklich so ein großes Geschäft wird - ich bin da zunehmend skeptisch.
Vielleicht kommt es so, dass die neuen Medikamente so gut und schnell wirken, dass die Krankheit mehr und mehr zurückgeht und somit auch die Zahl der jährlichen Neuerkrankungen dramatisch zurückgeht bzw. die Krankheit in absehbarer Zeit weitestgehend ausgerottet ist!
Die heutigen Ergebnisse waren ja eine Studie primär zur Sicherheit. Von daher sind die Ergebnisse m.E. deshalb sehr positiv, weil man sich schon fragt, woran eine Zulassung überhaupt noch scheitern soll. Effektivität und Sicherheit sind schon mal gegeben. Man darf ja nicht vergessen, dass ENTA alleine 195 Mio$ nur für Antrag und Zulassung an Milestones bekommt.
1) The $195M of pre-commercial milestones on ABT-450 payable by ABBV to ENTA consists of $40M for NDA/MAA submissions and $155M for marketing approvals. The $40M and $155M figures are further divided by geography; the overwhelming proportion of each amount is presumably attributable to the US and EU, with a lesser proportion for Japan, and (presumably) much lesser proportions for such countries as Canada, Australia, Switzerland, and emerging markets.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Ob und wie sich die Combo dann vor allem gegen Gilead durchsetzt steht dann auf einem anderen Blatt Papier:
With comparable efficacy, doctors' and patients' preference is likely to come down to side effects, cost, and convenience, likely in that order. So far, AbbVie's safety profile looks good; if Gilead can match it, the battle might come down to price. Part of AbbVie's regimen has to be taken twice a day while other drugs have to be taken three times a day, so AbbVie may lose on the convenience factor if it comes down to that.
http://www.fool.com/investing/general/2013/11/18/dont-crown-…
Ich würde da auch noch den Vertrieb und Marketing dazunehmen. Langfristig könnte ich mir aber schon vorstellen, dass viel über den Preis gehen wird, wenn noch weitere hocheffektive Medikamente auf dem Markt sind. Ob das ganze wirklich so ein großes Geschäft wird - ich bin da zunehmend skeptisch.
Vielleicht kommt es so, dass die neuen Medikamente so gut und schnell wirken, dass die Krankheit mehr und mehr zurückgeht und somit auch die Zahl der jährlichen Neuerkrankungen dramatisch zurückgeht bzw. die Krankheit in absehbarer Zeit weitestgehend ausgerottet ist!
Antwort auf Beitrag Nr.: 45.860.784 von me_2 am 18.11.13 17:17:09SNTA
schon ein wenig merkwürdig, dass (Milliardär und Direktor) Bruce Kovner immer weiter zukauft... inzwischen müsste er mehr als 1/3 von SNTA besitzen. Falls ich richtig gerechnet habe, kommen die 4 Direktoren zusammen auf etwa 40%, die sie kontrollieren: http://seekingalpha.com/article/1845872-insiders-are-buying-…
Gruß
ipollit
schon ein wenig merkwürdig, dass (Milliardär und Direktor) Bruce Kovner immer weiter zukauft... inzwischen müsste er mehr als 1/3 von SNTA besitzen. Falls ich richtig gerechnet habe, kommen die 4 Direktoren zusammen auf etwa 40%, die sie kontrollieren: http://seekingalpha.com/article/1845872-insiders-are-buying-…
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.848.754 von ipollit am 16.11.13 13:58:35INCY
angeblich soll INCB024360 der einzige richtige IDO-Hemmer in der klinischen Entwicklung sein. NLNKs Indoximod in PII soll dagegen Schwächen gegenüber INCB024360 haben. Interessant sind Checkpoint-Hemmer (PD-1, CTLA-4, usw. über die Tumorzellen sich vor dem Immunsystem schützen) für Pharmas, da sie zwar sehr aussichtsreichen PD-1 Therapien selber entwickeln, die nach den bisherigen Ergebnisse aber alle ähnlich wirken, so dass sie diese durch geeignete Kombinationen wie z.B. mit IDO differenzieren müssen, um später Vorteile am Markt zu haben.
http://www.onclive.com/publications/oncology-live/2013/septe…
"... IDO overexpression has been observed in a wealth of tumor types, including prostate, colorectal, pancreatic, and cervical tumors, and is correlated with poorer survival in many cases. Increased IDO protein levels drive growth arrest and apoptosis of the effector T cells, a group of immune cells that includes cytotoxic T cells,helper T cells, and natural killer (NK) cells that mediate the immune system’s ability to destroy pathogens. By reducing the number of effector T cells, IDO overexpression prevents the immune system from effectively destroying cancer cells.
...
A second IDO inhibitor is in clinical trials. INCB024360 is an orally available hydroxyamidine small-molecule inhibitor. Unlike 1-MT-based inhibitors, hydroxyamidine inhibitors also inhibit tryptophan (2,3)-dioxygenase (TDO), an enzyme with identical activity to IDO. A recent study implicated TDO in the development of cancer in a similar manner to IDO, and many in the field believe it will be important to inhibit both IDO and TDO to overcome any compensatory mechanism...."
Gruß
ipollit
angeblich soll INCB024360 der einzige richtige IDO-Hemmer in der klinischen Entwicklung sein. NLNKs Indoximod in PII soll dagegen Schwächen gegenüber INCB024360 haben. Interessant sind Checkpoint-Hemmer (PD-1, CTLA-4, usw. über die Tumorzellen sich vor dem Immunsystem schützen) für Pharmas, da sie zwar sehr aussichtsreichen PD-1 Therapien selber entwickeln, die nach den bisherigen Ergebnisse aber alle ähnlich wirken, so dass sie diese durch geeignete Kombinationen wie z.B. mit IDO differenzieren müssen, um später Vorteile am Markt zu haben.
http://www.onclive.com/publications/oncology-live/2013/septe…
"... IDO overexpression has been observed in a wealth of tumor types, including prostate, colorectal, pancreatic, and cervical tumors, and is correlated with poorer survival in many cases. Increased IDO protein levels drive growth arrest and apoptosis of the effector T cells, a group of immune cells that includes cytotoxic T cells,helper T cells, and natural killer (NK) cells that mediate the immune system’s ability to destroy pathogens. By reducing the number of effector T cells, IDO overexpression prevents the immune system from effectively destroying cancer cells.
...
A second IDO inhibitor is in clinical trials. INCB024360 is an orally available hydroxyamidine small-molecule inhibitor. Unlike 1-MT-based inhibitors, hydroxyamidine inhibitors also inhibit tryptophan (2,3)-dioxygenase (TDO), an enzyme with identical activity to IDO. A recent study implicated TDO in the development of cancer in a similar manner to IDO, and many in the field believe it will be important to inhibit both IDO and TDO to overcome any compensatory mechanism...."
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.858.002 von ipollit am 18.11.13 12:39:38CLVS
Clovis erforscht eigentlich keine eigenen Medikamente, sondern lizensiert diese von anderen ein, wenn sie interessant erscheinen. Nun wurde EOS übernommen, die als einzigen Kandidaten Lucitanib in der PII haben.
http://phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9N…
Finanziell erfolgt dies über Aktien und nur zu einem geringen Teil durch Cash. Servier hält u.a. die EU-Rechte, CLVS nun die US-Rechte... Servier beteiligt sich dabei an den Entwicklungskosten, so dass die Netto-Kosten für CLVS momentan relativ gering sind.
PII in FGFR1+ Brustkrebs... PFS ist ca. doppelt so lang wie bei einem zuletzt zugelassene Therapie bei Last-line BC. Die Patienten hier haben teilweise bis zu 14 Therapien zuvor erhalten, u.a. auch andere FGFR-Hemmer:
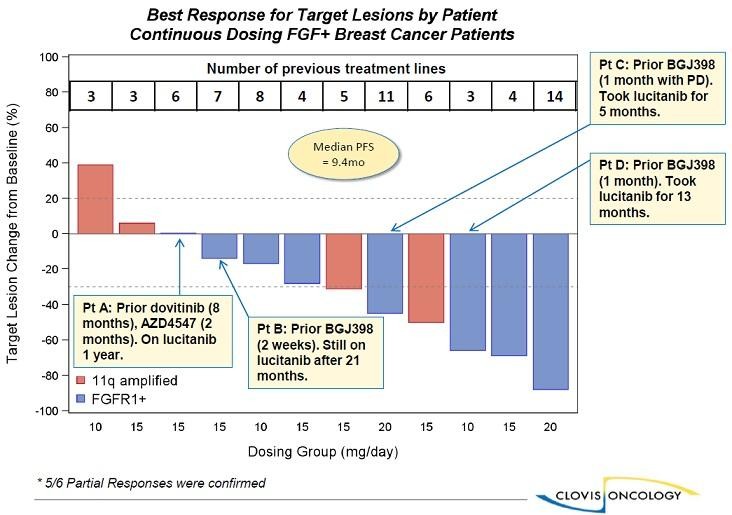
Lucitanib ist ein FGFR1,2 + VEGFR Hemmer, so wie es CLVS angibt. CLVS sagt, dass die bisherigen vielversprechenden Ergebnisse durch die Kombination von FGFR + VEGFR zustande kommen und dies weder durch selektive FGFR-Hemmer noch durch breitere Multi-Kinease-Hemmer (pan-FGFR) möglich wäre. Merkwürdig finde ich nun aber, dass in den früheren Präsentationen zu Lucitanib (E-3810) neben FGFR und VEGFR auch CFS-1R genannt wird... Lucitanib scheint auch ein starker CFS-1R Hemmer zu sein:
http://cancerres.aacrjournals.org/content/71/4/1396/T1.expan…
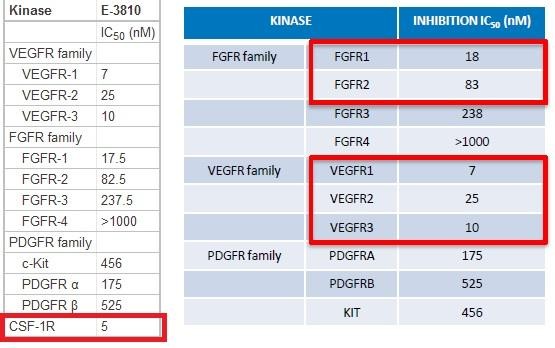
Wie in den letzten Postings erwähnt, könnte CFS-1R immunologisch wirken, indem spezielle Makrophagen (TAMs) gehemmt werden, die normalerweise das Immunsystem unterdrücken. Nach meinem Verständnis kann das zu langanhaltenden Wirkungen führen.
http://cancerres.aacrjournals.org/content/71/4/1396.full.pdf
"In addition, the observed high activity of E-3810 in inhibiting in biochemical assay CSF-R1, could suggest a modulation of tumor-associated macrophage (TAM) function. It is well known that CSF is the main growth factor responsible for the survival, proliferation, differentiation, and chemotaxis of mononuclear phagocytes, such as macrophages (36). CSF-1 has been shown to block the maturation of dentritic cells in tumors in such a way that they are unable to present antigens and promote immuno-suppresed trophic TAMs, with a less inflammatory and proangiogenic phenotype (37, 38). The interference with these processes might contribute to the drug's antitumor effects."
CFS-1R-Hemmer verhindern, dass das Immunsystem Makrophagen bildet, die statt den Tumor anzugreifen, ihn schützen und fördern...
https://www.dkfz-heidelberg.de/en/new-cancer-targets/downloa…
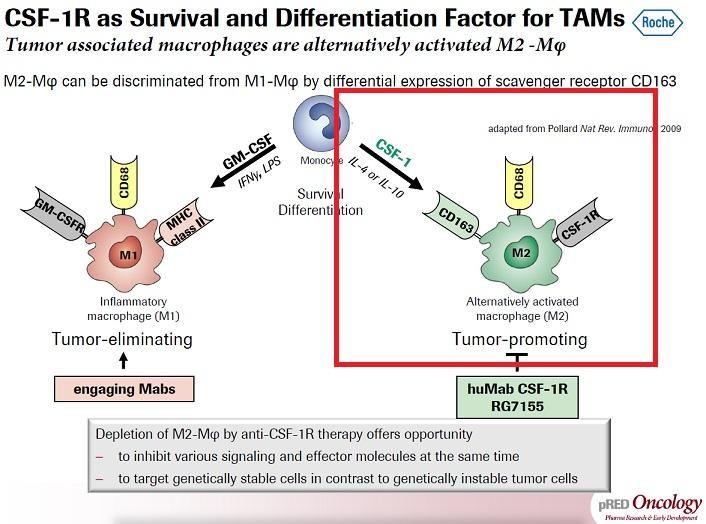
Allerdings ist das nur meine Interpretation... CLVS hat CFS-1R bisher nicht erwähnt.
Gruß
ipollit
Clovis erforscht eigentlich keine eigenen Medikamente, sondern lizensiert diese von anderen ein, wenn sie interessant erscheinen. Nun wurde EOS übernommen, die als einzigen Kandidaten Lucitanib in der PII haben.
http://phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9N…
Finanziell erfolgt dies über Aktien und nur zu einem geringen Teil durch Cash. Servier hält u.a. die EU-Rechte, CLVS nun die US-Rechte... Servier beteiligt sich dabei an den Entwicklungskosten, so dass die Netto-Kosten für CLVS momentan relativ gering sind.
PII in FGFR1+ Brustkrebs... PFS ist ca. doppelt so lang wie bei einem zuletzt zugelassene Therapie bei Last-line BC. Die Patienten hier haben teilweise bis zu 14 Therapien zuvor erhalten, u.a. auch andere FGFR-Hemmer:

Lucitanib ist ein FGFR1,2 + VEGFR Hemmer, so wie es CLVS angibt. CLVS sagt, dass die bisherigen vielversprechenden Ergebnisse durch die Kombination von FGFR + VEGFR zustande kommen und dies weder durch selektive FGFR-Hemmer noch durch breitere Multi-Kinease-Hemmer (pan-FGFR) möglich wäre. Merkwürdig finde ich nun aber, dass in den früheren Präsentationen zu Lucitanib (E-3810) neben FGFR und VEGFR auch CFS-1R genannt wird... Lucitanib scheint auch ein starker CFS-1R Hemmer zu sein:
http://cancerres.aacrjournals.org/content/71/4/1396/T1.expan…

Wie in den letzten Postings erwähnt, könnte CFS-1R immunologisch wirken, indem spezielle Makrophagen (TAMs) gehemmt werden, die normalerweise das Immunsystem unterdrücken. Nach meinem Verständnis kann das zu langanhaltenden Wirkungen führen.
http://cancerres.aacrjournals.org/content/71/4/1396.full.pdf
"In addition, the observed high activity of E-3810 in inhibiting in biochemical assay CSF-R1, could suggest a modulation of tumor-associated macrophage (TAM) function. It is well known that CSF is the main growth factor responsible for the survival, proliferation, differentiation, and chemotaxis of mononuclear phagocytes, such as macrophages (36). CSF-1 has been shown to block the maturation of dentritic cells in tumors in such a way that they are unable to present antigens and promote immuno-suppresed trophic TAMs, with a less inflammatory and proangiogenic phenotype (37, 38). The interference with these processes might contribute to the drug's antitumor effects."
CFS-1R-Hemmer verhindern, dass das Immunsystem Makrophagen bildet, die statt den Tumor anzugreifen, ihn schützen und fördern...
https://www.dkfz-heidelberg.de/en/new-cancer-targets/downloa…

Allerdings ist das nur meine Interpretation... CLVS hat CFS-1R bisher nicht erwähnt.
Gruß
ipollit
NBI... noch geht es weiter aufwärts!
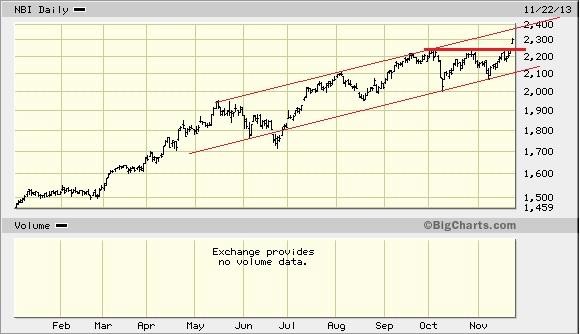
allerdings wird diese Bewegung maßgeblich von den LargeCap-Biotechs bstimmt... BIIB, GILD und CELG mit neuem ATH. Mid- und SmallCaps sind (soweit ich das sehe) meistens deutlich von ihren Höchstständen entfernt.
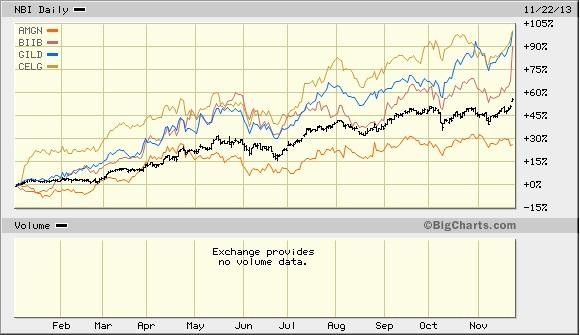
Grüße
ipollit

allerdings wird diese Bewegung maßgeblich von den LargeCap-Biotechs bstimmt... BIIB, GILD und CELG mit neuem ATH. Mid- und SmallCaps sind (soweit ich das sehe) meistens deutlich von ihren Höchstständen entfernt.

Grüße
ipollit
EXEL
Roche startet jeweils auch noch Kombi-Studien von Cobimetinib mit Onartuzumab (Metmab) und einem HER3+EGFR-Hemmer MEHD7945A.
http://biz.yahoo.com/e/131122/exel8-k.html
"Under the terms of the co-development agreement, Exelixis is entitled to an initial equal share of U.S. profits and losses for cobimetinib, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. The profit share has multiple tiers-Exelixis is entitled to 50% of profits from the first $200 million of U.S. actual sales, decreasing to 30% of profits from U.S. actual sales in excess of $400 million. Exelixis is entitled to low double-digit royalties on ex-U.S. net sales. Exelixis also has the option to co-promote in the United States. The co-promotion option would allow Exelixis to provide up to 25% of the total sales force for cobimetinib in the United States. Exelixis must exercise the co-promotion option within 12 months of receiving notification of the first patient dosed in the first phase 3 clinical trial of cobimetinib. Exelixis received notification of dosing from Genentech on January 14, 2013, which triggered the beginning of the period in which Exelixis can exercise its co-promotion option."

Gruß
ipollit
Roche startet jeweils auch noch Kombi-Studien von Cobimetinib mit Onartuzumab (Metmab) und einem HER3+EGFR-Hemmer MEHD7945A.
http://biz.yahoo.com/e/131122/exel8-k.html
"Under the terms of the co-development agreement, Exelixis is entitled to an initial equal share of U.S. profits and losses for cobimetinib, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. The profit share has multiple tiers-Exelixis is entitled to 50% of profits from the first $200 million of U.S. actual sales, decreasing to 30% of profits from U.S. actual sales in excess of $400 million. Exelixis is entitled to low double-digit royalties on ex-U.S. net sales. Exelixis also has the option to co-promote in the United States. The co-promotion option would allow Exelixis to provide up to 25% of the total sales force for cobimetinib in the United States. Exelixis must exercise the co-promotion option within 12 months of receiving notification of the first patient dosed in the first phase 3 clinical trial of cobimetinib. Exelixis received notification of dosing from Genentech on January 14, 2013, which triggered the beginning of the period in which Exelixis can exercise its co-promotion option."
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.884.042 von ipollit am 21.11.13 01:45:10Hallo ipollit,
Hammer war ja auch gleich begeistert:
CLVS did a brilliant deal and I plan on adding them to the portfolio. The drug they bought has a strong clinical proof of concept with a differentiated profile and a clear development lead. Well done Clovis!
Hatte gestern mit einem Depot-Update gerechnet...
Ich bin mit einer kleinen Position dabei.
Wie siehst Du Clovis insgesamt?
Gruß
SLG
Hammer war ja auch gleich begeistert:
CLVS did a brilliant deal and I plan on adding them to the portfolio. The drug they bought has a strong clinical proof of concept with a differentiated profile and a clear development lead. Well done Clovis!
Hatte gestern mit einem Depot-Update gerechnet...
Ich bin mit einer kleinen Position dabei.
Wie siehst Du Clovis insgesamt?
Gruß
SLG
NBI... ich hätte zumindest nichts dagegen 
http://www.faz.net/aktuell/finanzen/technische-analyse-der-b…
Der Börsenparty mit Biotech-Aktien droht kein Ende
28.11.2013 · Der Nasdaq-Biotech-Index geht steil nach oben. Das erinnert an die Jahrtausendwende. Damals folgte auf die Party ein schwerer Kater.
Die Indexentwicklung des Nasdaq Biotech ist der Stoff, aus dem die Träume sind...
... Ich gehe deshalb dezidiert davon aus, dass die Kurse der Aktien der Biotech-Unternehmen mittel- und langfristig weiteren, möglicherweise sogar erheblichen Spielraum nach oben haben. Mein Kursziel lautet auf Werte um 3000 Punkte. Der Index notiert derzeit bei 2326 Punkten. Wie fast immer an den Finanzmärkten gibt es hat auch bei dieser Prognose einen Wermutstropfen: So wahrscheinlich ein weiterer Kursanstieg, so unwahrscheinlich ist aber auch, dass dieses Ziel in einem Rutsch erreicht werden wird...

Gruß
ipollit

http://www.faz.net/aktuell/finanzen/technische-analyse-der-b…
Der Börsenparty mit Biotech-Aktien droht kein Ende
28.11.2013 · Der Nasdaq-Biotech-Index geht steil nach oben. Das erinnert an die Jahrtausendwende. Damals folgte auf die Party ein schwerer Kater.
Die Indexentwicklung des Nasdaq Biotech ist der Stoff, aus dem die Träume sind...
... Ich gehe deshalb dezidiert davon aus, dass die Kurse der Aktien der Biotech-Unternehmen mittel- und langfristig weiteren, möglicherweise sogar erheblichen Spielraum nach oben haben. Mein Kursziel lautet auf Werte um 3000 Punkte. Der Index notiert derzeit bei 2326 Punkten. Wie fast immer an den Finanzmärkten gibt es hat auch bei dieser Prognose einen Wermutstropfen: So wahrscheinlich ein weiterer Kursanstieg, so unwahrscheinlich ist aber auch, dass dieses Ziel in einem Rutsch erreicht werden wird...
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.953.540 von ipollit am 30.11.13 15:30:34Auch wenn ungewiß ist, wann genau die Biotech-Blase platzen wird: Wieland Staud ist ein Schwätzer ... man lese sich seine vor, während und nach der Finanzkrise 2008 verfaßten Kommentare durch -> alles schlichtweg unbrauchbar.
Für rationale Investoren relevanter dürften Aussagen von Leuten sein, die von der Branche Ahnung haben. So äußert sich beispielweise Novartis-CEO Jimenez im aktuellen Interview der "Finanz und Wirtschaft" folgendermaßen:
Frage FuW: Im Biotechnologiesektor sind die Bewertungen rasant gestiegen. Können Sie hier guten Gewissens Zukäufe verantworten?
Antwort Jimenez: "Wir haben uns im Pharmageschäft zuletzt nicht ohne Grund mit Übernahmen zurückgehalten. Die Preise erreichen vor dem Hintergrund der Biotechnologiehausse teils astronomische Niveaus."
Und an anderer Stelle: "Alles verläuft in Zyklen. Über die vergangenen zehn Jahre gab es im Biotechnologiesektor sehr hohe und sehr niedrige Niveaus. Das wird sich fortsetzen."
Für rationale Investoren relevanter dürften Aussagen von Leuten sein, die von der Branche Ahnung haben. So äußert sich beispielweise Novartis-CEO Jimenez im aktuellen Interview der "Finanz und Wirtschaft" folgendermaßen:
Frage FuW: Im Biotechnologiesektor sind die Bewertungen rasant gestiegen. Können Sie hier guten Gewissens Zukäufe verantworten?
Antwort Jimenez: "Wir haben uns im Pharmageschäft zuletzt nicht ohne Grund mit Übernahmen zurückgehalten. Die Preise erreichen vor dem Hintergrund der Biotechnologiehausse teils astronomische Niveaus."
Und an anderer Stelle: "Alles verläuft in Zyklen. Über die vergangenen zehn Jahre gab es im Biotechnologiesektor sehr hohe und sehr niedrige Niveaus. Das wird sich fortsetzen."
Antwort auf Beitrag Nr.: 45.909.590 von SLGramann am 25.11.13 08:29:07Hallo SLGramann,
CLVS sehe ich insgesamt sehr positiv, wenn auch die Bewertung mit einer MK von 1,8 Mrd USD nur auf Basis von PI-/PII-Kandidaten nicht gerade gering ist.
Clovis hat ein wenig anderes Geschäftsmodell als andere Biotechs. Sie lizensieren im Wesentlichen Kandidaten aus anderen Pipelines ein, statt selber alles von Null zu entwickeln. Der CEO ist der Gründer von Pharmion, der sich zuvor damit einen Namen gemacht hat... Pharmion war recht erfolgreich und wurde vor einigen Jahren von CELG übernommen. Ich hoffe mal, dass er auch mit den Einlizensierungen weiß, was er tut.
Außerdem verfolgt CLVS anscheinend das Ziel, sehr spezifische Therapien zu entwickeln, die auf spezielle Targets zugeschnitten sind und immer direkt mit den zugehörigen Diagnose-Tools auf den Markt kommen soll. D.h. bei Markteintritt soll zu der Therapie auch etwas zur Verfügung stehen, wonach die Patienten gefunden werden können, bei denen das Mittel wahrscheinlich wirkt. Ich denke, dass dies Vorteile bei der Zulassung und bei der Gewinnung von Marktanteilen bringt, wenn man vor einer Therapie etwas vorweisen kann, das für einen Therapieerfolg spricht.
Dass Hammer den letzten Deal sehr positiv sieht, liegt vielleicht auch an dem Target FGFR, von dem er offensichtlich ein großer Fan ist. Vor Monaten hatte er sich auch mal positiv zum PARP-Hemmer Rucaparib (urspünglich von Pfizer) geäußert, weniger zum EGFR-Hemmer CO-1686.
Ich habe bisher das größte Potential in CO-1686 gesehen. EGFR-Hemmer wie Tarceva sind bei NSCLC etabliert. Soweit ich mich erinnere, führen die aktuellen EGFR-Hemmer aber in 50% der Fälle mit der Zeit zu der Mutation T790M, wodurch sie dann nicht mehr wirken. CO-1686 ist der erste EGFR-Hemmer der auf gegen T790M wirkt. Meiner Meinung nach hat Tarceva&Co auch das Problem, dass es auch das natürlich EGFR z.B. in der Haut hemmt, was zu Nebenwirkungen führt, so dass es nicht so hoch dosiert werden kann. CO-1686 hemmt wenig dieses "wild-type" EGFR, so dass die Nebenwirkungen deutlich geringer sein sollten. Auch darin sehe ich einen Vorteil. Allerdings befindet es sich erst in PI... die Wirkung in den wenigen Patienten sieht aber schonmal erfolgversprechend aus. ARIAs ALK/EGFR-Hemmer AP26113 wäre vielleicht auch gegen T790M wirksam, ist aber sehr viel schwächer... die EGFR-Entwicklung wurde zuletzt gestoppt. Ein echter Konkurrent könnte AZNs AZD9291 sein (ebenfalls in PI), das ebenfalls gegen T790M zeigt... AZN scheint die Entwicklung zu fokussieren. Komisch fand ich einige Kommentare, die CO-1686 gleich abgeschrieben haben, weil jetzt ein Pharma hier mitspielen würde, so als wäre AZD9291 das Maß der Dinge... dabei gibt es dafür bisher nur irgendwelche Daten aus Studien in östlichen Ländern, die sich bei US-Studien vielleicht wieder relativieren. CLVS testet glaube ich direkt in den USA. Die Daten von CLVS sehen meiner Meinung nach etwas besser aus... man muss abwarten, wie die Ergebnisse bei größeren Studien ausfallen. CLVS wird auf jeden Fall eine vorzeitige Zulassung auf Basis einer PII anstreben.
PARP-Hemmer waren erst ziemlich in, dann wurden sie recht negativ gesehen, weil der führende PARP-Hemmer in der Entwicklung, von dem man sich viel versprochen hatte, sehr enttäuschende Ergebnisse lieferte. Später fand man heraus, dass es sich garnicht um einen PARP-Hemmer handelte. Nun gibt es einige in der Entwicklung... Rucaparib ist einer unter mehreren wie BMRNs BMN-673 oder TSROs Niraparib. Am weitesten ist wohl AZNs Oraparib. Wer am Ende die Nase vorn hat, ist noch recht offen. Rucaparib hängt in der Entwicklung etwas hinterher, könnte aber Vorteile bringen, da es sehr spezifisch und mit PARP-Test-Tools entwickelt wird.
Bei Lucitanib finde ich spannend, dass es sich um einen CSF-R1-Hemmer handelt.
Zuletzt war etwas komisch, dass CLVS sich selbst zum Verkauf gestellt hat, dann aber keinen Käufer gefunden hat.

Gruß
ipollit
CLVS sehe ich insgesamt sehr positiv, wenn auch die Bewertung mit einer MK von 1,8 Mrd USD nur auf Basis von PI-/PII-Kandidaten nicht gerade gering ist.
Clovis hat ein wenig anderes Geschäftsmodell als andere Biotechs. Sie lizensieren im Wesentlichen Kandidaten aus anderen Pipelines ein, statt selber alles von Null zu entwickeln. Der CEO ist der Gründer von Pharmion, der sich zuvor damit einen Namen gemacht hat... Pharmion war recht erfolgreich und wurde vor einigen Jahren von CELG übernommen. Ich hoffe mal, dass er auch mit den Einlizensierungen weiß, was er tut.
Außerdem verfolgt CLVS anscheinend das Ziel, sehr spezifische Therapien zu entwickeln, die auf spezielle Targets zugeschnitten sind und immer direkt mit den zugehörigen Diagnose-Tools auf den Markt kommen soll. D.h. bei Markteintritt soll zu der Therapie auch etwas zur Verfügung stehen, wonach die Patienten gefunden werden können, bei denen das Mittel wahrscheinlich wirkt. Ich denke, dass dies Vorteile bei der Zulassung und bei der Gewinnung von Marktanteilen bringt, wenn man vor einer Therapie etwas vorweisen kann, das für einen Therapieerfolg spricht.
Dass Hammer den letzten Deal sehr positiv sieht, liegt vielleicht auch an dem Target FGFR, von dem er offensichtlich ein großer Fan ist. Vor Monaten hatte er sich auch mal positiv zum PARP-Hemmer Rucaparib (urspünglich von Pfizer) geäußert, weniger zum EGFR-Hemmer CO-1686.
Ich habe bisher das größte Potential in CO-1686 gesehen. EGFR-Hemmer wie Tarceva sind bei NSCLC etabliert. Soweit ich mich erinnere, führen die aktuellen EGFR-Hemmer aber in 50% der Fälle mit der Zeit zu der Mutation T790M, wodurch sie dann nicht mehr wirken. CO-1686 ist der erste EGFR-Hemmer der auf gegen T790M wirkt. Meiner Meinung nach hat Tarceva&Co auch das Problem, dass es auch das natürlich EGFR z.B. in der Haut hemmt, was zu Nebenwirkungen führt, so dass es nicht so hoch dosiert werden kann. CO-1686 hemmt wenig dieses "wild-type" EGFR, so dass die Nebenwirkungen deutlich geringer sein sollten. Auch darin sehe ich einen Vorteil. Allerdings befindet es sich erst in PI... die Wirkung in den wenigen Patienten sieht aber schonmal erfolgversprechend aus. ARIAs ALK/EGFR-Hemmer AP26113 wäre vielleicht auch gegen T790M wirksam, ist aber sehr viel schwächer... die EGFR-Entwicklung wurde zuletzt gestoppt. Ein echter Konkurrent könnte AZNs AZD9291 sein (ebenfalls in PI), das ebenfalls gegen T790M zeigt... AZN scheint die Entwicklung zu fokussieren. Komisch fand ich einige Kommentare, die CO-1686 gleich abgeschrieben haben, weil jetzt ein Pharma hier mitspielen würde, so als wäre AZD9291 das Maß der Dinge... dabei gibt es dafür bisher nur irgendwelche Daten aus Studien in östlichen Ländern, die sich bei US-Studien vielleicht wieder relativieren. CLVS testet glaube ich direkt in den USA. Die Daten von CLVS sehen meiner Meinung nach etwas besser aus... man muss abwarten, wie die Ergebnisse bei größeren Studien ausfallen. CLVS wird auf jeden Fall eine vorzeitige Zulassung auf Basis einer PII anstreben.
PARP-Hemmer waren erst ziemlich in, dann wurden sie recht negativ gesehen, weil der führende PARP-Hemmer in der Entwicklung, von dem man sich viel versprochen hatte, sehr enttäuschende Ergebnisse lieferte. Später fand man heraus, dass es sich garnicht um einen PARP-Hemmer handelte. Nun gibt es einige in der Entwicklung... Rucaparib ist einer unter mehreren wie BMRNs BMN-673 oder TSROs Niraparib. Am weitesten ist wohl AZNs Oraparib. Wer am Ende die Nase vorn hat, ist noch recht offen. Rucaparib hängt in der Entwicklung etwas hinterher, könnte aber Vorteile bringen, da es sehr spezifisch und mit PARP-Test-Tools entwickelt wird.
Bei Lucitanib finde ich spannend, dass es sich um einen CSF-R1-Hemmer handelt.
Zuletzt war etwas komisch, dass CLVS sich selbst zum Verkauf gestellt hat, dann aber keinen Käufer gefunden hat.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.953.634 von Joschka Schröder am 30.11.13 15:54:31sagen wir es so, Wieland Staud ist ein nicht leicht zu erschütternder Optimist  von reinen Technikern halte ich sowieso nicht viel, wobei Herr Staud meiner Meinung nach nicht nur Techniker ist. Zuletzt gab es im Biotech-Bereich auch einige meiner Meinung nach zu negative Stimmen. Mir kommt es dann so vor, als wenn sich einige defensiv positioniert haben und aufgrund dessen jetzt gerne möglichst viel negatives sehen würden.
von reinen Technikern halte ich sowieso nicht viel, wobei Herr Staud meiner Meinung nach nicht nur Techniker ist. Zuletzt gab es im Biotech-Bereich auch einige meiner Meinung nach zu negative Stimmen. Mir kommt es dann so vor, als wenn sich einige defensiv positioniert haben und aufgrund dessen jetzt gerne möglichst viel negatives sehen würden.
Warum soll ein Pharma-CEO ein Interesse haben Biotechs positiv darzustellen? Aus Sicht der Pharmas sind doch Biotechs Konkurrenten... wenn die erfolgreich sind, sehen die Erfolge der Pharmas eher mau aus. Warum soll gerade sojemand noch die Preise der Konkurrenz befeuern? Bezeichnet denn so einer auch sein eigenes Unternehmen als astronomisch bewertet? Pharmas drohten und drohen massiv Umsatzeinbrüche wegen auslaufender Patente... sie müssen in neue Medikamente investieren, ob sie wollen oder nicht. Wenn sie es sich jetzt noch leisten können, sich zurückzuhalten, dann könnten sie in Zukunft, wenn der Druck bei ihnen höher wird, noch zusätzliche Nachfrage schaffen.
Es stimmt schon, dass die Bewertungen insgesamt nicht niedrig sind... aber sind sie astronomisch hoch? Nenn mir doch mal eine astronomische Bewertung?
Der NBI, der so stark gestiegen ist, berechnet sich zu etwa 50% aus wenigen LargeCaps, die noch deutlich stärker als der NBI selber gestiegen sind. Siehst du eine astronomische Bewertung in den LargeCaps wie GILD, CELG, BIIB, AMGN, REGN? Die kleineren Biotechs haben sich dagegen nicht so gut entwickelt... teilweise befinden sie sich auf Jahrestief, manche haben das gleiche Niveau wie 2009. Gibt es hier eine Blase?
Ist dies Aussage falsch, dass ein nicht unwesentlicher Teil der Bewertungen auch fundamental untermauert ist?
z.B. hat REGN sich seit 2009 fast verzwanzigfacht... aktuelle MK fast 30 Mrd USD... allerdings hatte 2009 auch niemand gedacht, dass sie mit Eylea den Konkurrenten Lucentis von Roche/Genentech locker überholen. Lucentis wird in Europa von Novartis vertrieben und ist für Novartis eines der wichtigsten Medikamente mit dem größten Umsatz. Warum sollte der CEO von Novartis von einem Biotech wie REGN begeistert sein??? REGNs Partner Sanofi hat dieses Jahr aber immer wieder angekündigt, seinen REGN-Anteil weiter zu erhöhen... die kaufen offensichtlich trotz astronomischer Preise.

oder log...

Gruß
ipollit
 von reinen Technikern halte ich sowieso nicht viel, wobei Herr Staud meiner Meinung nach nicht nur Techniker ist. Zuletzt gab es im Biotech-Bereich auch einige meiner Meinung nach zu negative Stimmen. Mir kommt es dann so vor, als wenn sich einige defensiv positioniert haben und aufgrund dessen jetzt gerne möglichst viel negatives sehen würden.
von reinen Technikern halte ich sowieso nicht viel, wobei Herr Staud meiner Meinung nach nicht nur Techniker ist. Zuletzt gab es im Biotech-Bereich auch einige meiner Meinung nach zu negative Stimmen. Mir kommt es dann so vor, als wenn sich einige defensiv positioniert haben und aufgrund dessen jetzt gerne möglichst viel negatives sehen würden.Warum soll ein Pharma-CEO ein Interesse haben Biotechs positiv darzustellen? Aus Sicht der Pharmas sind doch Biotechs Konkurrenten... wenn die erfolgreich sind, sehen die Erfolge der Pharmas eher mau aus. Warum soll gerade sojemand noch die Preise der Konkurrenz befeuern? Bezeichnet denn so einer auch sein eigenes Unternehmen als astronomisch bewertet? Pharmas drohten und drohen massiv Umsatzeinbrüche wegen auslaufender Patente... sie müssen in neue Medikamente investieren, ob sie wollen oder nicht. Wenn sie es sich jetzt noch leisten können, sich zurückzuhalten, dann könnten sie in Zukunft, wenn der Druck bei ihnen höher wird, noch zusätzliche Nachfrage schaffen.
Es stimmt schon, dass die Bewertungen insgesamt nicht niedrig sind... aber sind sie astronomisch hoch? Nenn mir doch mal eine astronomische Bewertung?
Der NBI, der so stark gestiegen ist, berechnet sich zu etwa 50% aus wenigen LargeCaps, die noch deutlich stärker als der NBI selber gestiegen sind. Siehst du eine astronomische Bewertung in den LargeCaps wie GILD, CELG, BIIB, AMGN, REGN? Die kleineren Biotechs haben sich dagegen nicht so gut entwickelt... teilweise befinden sie sich auf Jahrestief, manche haben das gleiche Niveau wie 2009. Gibt es hier eine Blase?
Ist dies Aussage falsch, dass ein nicht unwesentlicher Teil der Bewertungen auch fundamental untermauert ist?
z.B. hat REGN sich seit 2009 fast verzwanzigfacht... aktuelle MK fast 30 Mrd USD... allerdings hatte 2009 auch niemand gedacht, dass sie mit Eylea den Konkurrenten Lucentis von Roche/Genentech locker überholen. Lucentis wird in Europa von Novartis vertrieben und ist für Novartis eines der wichtigsten Medikamente mit dem größten Umsatz. Warum sollte der CEO von Novartis von einem Biotech wie REGN begeistert sein??? REGNs Partner Sanofi hat dieses Jahr aber immer wieder angekündigt, seinen REGN-Anteil weiter zu erhöhen... die kaufen offensichtlich trotz astronomischer Preise.
oder log...
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.953.882 von ipollit am 30.11.13 17:05:21oder 3-Jahres-Charts...
LargeCaps... Gilead, Biogen, Amgen, Celgene, Regeneron, Biomarin... wer hat sich da schlechter als der NBI (schwarze Linie) entwickelt?
mit REGN

ohne REGN

Einige normale SmallCaps... nur einige davon haben einen echten Rückschlag hinnehmen müssen, was das übliche Risiko ist. Die Mehrheit in diesem Chart hat sich normal entwickelt. Siehst du hier "astronomische Preise"? NBI wieder schwarz:

Gruß
ipollit
LargeCaps... Gilead, Biogen, Amgen, Celgene, Regeneron, Biomarin... wer hat sich da schlechter als der NBI (schwarze Linie) entwickelt?
mit REGN
ohne REGN
Einige normale SmallCaps... nur einige davon haben einen echten Rückschlag hinnehmen müssen, was das übliche Risiko ist. Die Mehrheit in diesem Chart hat sich normal entwickelt. Siehst du hier "astronomische Preise"? NBI wieder schwarz:
Gruß
ipollit
Du bist ein intelligenter Mensch und ich schätze Deine Kommentare sehr.
Kurz ein paar spontane Bemerkungen:
1) Zwischen Pharma- und Biotech würde ich heutzutage eigentlich nicht mehr unterscheiden. Eine Branche, ein Modell.
2) Es ist richtig, dass die Hausse funamental unvergleichlich besser untermauert ist als z.B. der Wahnsinn zur Jahrtausendwende. Auch wird der NBI maßgeblich durch Large Caps beeinflußt und es gibt durchaus kleinere Unternehmen, deren Kurse deutlich abgestraft worden sind.
3) Ich selbst habe bis auf wenige Ausnahmen meine Biotech-Investments abgebaut, weil sich das Chance-Risiko-Verhältnis m.E, deutlich verschlechtert hat. Auch ist zu berücksichtigen, dass es mittlerweile derart viele Neuentwicklungen gibt, dass es schwierig ist, den Überblick zu behalten. Ich halte mich für gut informiert. Dennoch fühle ich mich zunehmend mit der Masse verschiedenartiger Therapieansätze und Entwicklungen überfordert. Das Verhältnis zwischen Recherche-Aufwand und möglichem Investmenterfolg dürfte in keinem angemessenen Verhältnis mehr zueinander stehen.
4) Ich gehöre nicht zu denen, die - weil sie eigene Positionen abgebaut haben - nun möglichst viel Negatives sehen möchten. Anderen, die wagemutiger agieren, wünsche ich Erfolg. Dennoch scheint eine Warnung angemessen.
5) Jimenez spricht nicht anders als er denkt.
Kurz ein paar spontane Bemerkungen:
1) Zwischen Pharma- und Biotech würde ich heutzutage eigentlich nicht mehr unterscheiden. Eine Branche, ein Modell.
2) Es ist richtig, dass die Hausse funamental unvergleichlich besser untermauert ist als z.B. der Wahnsinn zur Jahrtausendwende. Auch wird der NBI maßgeblich durch Large Caps beeinflußt und es gibt durchaus kleinere Unternehmen, deren Kurse deutlich abgestraft worden sind.
3) Ich selbst habe bis auf wenige Ausnahmen meine Biotech-Investments abgebaut, weil sich das Chance-Risiko-Verhältnis m.E, deutlich verschlechtert hat. Auch ist zu berücksichtigen, dass es mittlerweile derart viele Neuentwicklungen gibt, dass es schwierig ist, den Überblick zu behalten. Ich halte mich für gut informiert. Dennoch fühle ich mich zunehmend mit der Masse verschiedenartiger Therapieansätze und Entwicklungen überfordert. Das Verhältnis zwischen Recherche-Aufwand und möglichem Investmenterfolg dürfte in keinem angemessenen Verhältnis mehr zueinander stehen.
4) Ich gehöre nicht zu denen, die - weil sie eigene Positionen abgebaut haben - nun möglichst viel Negatives sehen möchten. Anderen, die wagemutiger agieren, wünsche ich Erfolg. Dennoch scheint eine Warnung angemessen.
5) Jimenez spricht nicht anders als er denkt.
Zitat von ipollit: Einige normale SmallCaps... nur einige davon haben einen echten Rückschlag hinnehmen müssen, was das übliche Risiko ist. Die Mehrheit in diesem Chart hat sich normal entwickelt. Siehst du hier "astronomische Preise"?
Wenn man noch Unternehmen wie SGEN etc. hinzunimmt und den Kursverlauf bis Anfang Oktober betrachtet (den Zeitpunkt meines Rückzugs, möglicherweise auch Beginn eines kippenden Marktes), unterscheidet sich die Entwicklung der Small Caps in Summe nicht allzu sehr von derjenigen der großen Indexteilnehmer.
Ich kann mit meiner Vorsicht aber auch durchaus daneben liegen. Warten wir´s einfach ab.
Hammer mit einem Beitrag (und Depotaufnahme) zu Clovis:
http://www.orf-blog.com/clovis-oncology-a-buying-opportunity…
Hallo ipollit,
Hammer greift einen Gedanken von Dir in seinem Artikel auf. Du spielst inzwischen wirklich in einer anderen Liga.
http://www.orf-blog.com/clovis-oncology-a-buying-opportunity…
Hallo ipollit,
Hammer greift einen Gedanken von Dir in seinem Artikel auf. Du spielst inzwischen wirklich in einer anderen Liga.

Mal was ganz anderes:
Es werden hier in diesem Jahr bestimmt einige ordentlich Gewinn angehäuft haben. Man zahlt beim Verkauf darauf ja Abgeltungssteuer. Soweit klar. Jetzt meine Frage:
Wäre es dann nicht sinnvoll, noch in diesem Jahr Verluste aus Aktiengeschäften zu realisieren, da diese mit den Gewinnen aus anderen Aktiengeschäften verrechnet werden? Theoretisch könnte man dann ja z.B. eine Aktie mit 50% Verlust verkaufen und von dem gleichen Geld dann wieder fast doppelt so viele Aktien kaufen, wie man vorher hatte. Ich hoffe man kann mir folgen...?
Es werden hier in diesem Jahr bestimmt einige ordentlich Gewinn angehäuft haben. Man zahlt beim Verkauf darauf ja Abgeltungssteuer. Soweit klar. Jetzt meine Frage:
Wäre es dann nicht sinnvoll, noch in diesem Jahr Verluste aus Aktiengeschäften zu realisieren, da diese mit den Gewinnen aus anderen Aktiengeschäften verrechnet werden? Theoretisch könnte man dann ja z.B. eine Aktie mit 50% Verlust verkaufen und von dem gleichen Geld dann wieder fast doppelt so viele Aktien kaufen, wie man vorher hatte. Ich hoffe man kann mir folgen...?
Kann dir folgen und mache das auch. Habe dafür auch 3 Depots um Käufe desselben Wertes zu verschiedenen Einstiegskursen je nach Bedarf verkaufen zu können.
Antwort auf Beitrag Nr.: 45.956.898 von Joschka Schröder am 01.12.13 17:54:27Hallo Joschka Schröder,
danke... irgendwann müsste es eigentlich auch mal einen größeren Rückschlag geben, aber ob das in Kürze oder erst in Jahren passieren wird, lässt sich ja nur schwer vorhersagen. Zumindest war Anfang Oktober ein sehr guter Zeitpunkt für einen Ausstieg, das stimmt. Momentan bin ich noch voll investiert... einen Ausstieg mache ich lieber schrittweise, z.B. nur jeweils halb verkaufen. Was machst du dann mit dem Geld... gehst du dann in andere Branchen oder parkst du es, um später wieder hier einzusteigen? Der Markt ist ja das eine... wenn der Markt insgesamt schlecht läuft, kann man kaum etwas gewinnen, auch wenn die Unternehmen Fortschritte machen. Trotzdem gefällt es mir nicht so auszusteigen, ohne dass es dafür Gründe bei den Unternehmen selber gibt. Z.B. INFI, SNTA, ARQL, usw. könnten viel höher bewertet sein... soll ich jetzt aussteigen, bevor sie in einiger Zeit Erfolge mit ihrer Pipeline haben, nur weil der Markt insgesamt vielleicht hoch bewertet ist? Fundamental habe ich eigentlich noch ein gutes Gefühl... ob das klug ist, ist eine andere Frage.
p.s... das mit den negativen Stimmen habe ich nicht auf dich bezogen, sondern auf Leute, die z.B. über Twitter kommentieren.
Gruß
ipollit
danke... irgendwann müsste es eigentlich auch mal einen größeren Rückschlag geben, aber ob das in Kürze oder erst in Jahren passieren wird, lässt sich ja nur schwer vorhersagen. Zumindest war Anfang Oktober ein sehr guter Zeitpunkt für einen Ausstieg, das stimmt. Momentan bin ich noch voll investiert... einen Ausstieg mache ich lieber schrittweise, z.B. nur jeweils halb verkaufen. Was machst du dann mit dem Geld... gehst du dann in andere Branchen oder parkst du es, um später wieder hier einzusteigen? Der Markt ist ja das eine... wenn der Markt insgesamt schlecht läuft, kann man kaum etwas gewinnen, auch wenn die Unternehmen Fortschritte machen. Trotzdem gefällt es mir nicht so auszusteigen, ohne dass es dafür Gründe bei den Unternehmen selber gibt. Z.B. INFI, SNTA, ARQL, usw. könnten viel höher bewertet sein... soll ich jetzt aussteigen, bevor sie in einiger Zeit Erfolge mit ihrer Pipeline haben, nur weil der Markt insgesamt vielleicht hoch bewertet ist? Fundamental habe ich eigentlich noch ein gutes Gefühl... ob das klug ist, ist eine andere Frage.
p.s... das mit den negativen Stimmen habe ich nicht auf dich bezogen, sondern auf Leute, die z.B. über Twitter kommentieren.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.958.866 von SLGramann am 02.12.13 09:04:05Hallo SLGramann,
naja, das war mir nur aufgefallen, weil ich mich bei FPRX und AMBI für CSFR1 interessiert habe. Nachdem ich zuerst eher skeptisch war, finde ich jetzt den immunologischen Ansatz bei Krebs recht interessant. Oft geht es ja selbst bei neuen Therapien nur um Monate, die man gewinnt... dass man aber auch Wirkungen hat, die jahrelang anhalten, wäre doch ein riesiger Fortschritt.
Der französischen Innate Pharma hat das gesteigerte Interesse der Amis offensichtlich gut getan...

gibt es noch weitere? Wie ist es z.B. mit Compugen? Dazu schreibt Hammer nichts, weil es ein israelisches Unternehmen ist.

Gruß
ipollit
naja, das war mir nur aufgefallen, weil ich mich bei FPRX und AMBI für CSFR1 interessiert habe. Nachdem ich zuerst eher skeptisch war, finde ich jetzt den immunologischen Ansatz bei Krebs recht interessant. Oft geht es ja selbst bei neuen Therapien nur um Monate, die man gewinnt... dass man aber auch Wirkungen hat, die jahrelang anhalten, wäre doch ein riesiger Fortschritt.
Der französischen Innate Pharma hat das gesteigerte Interesse der Amis offensichtlich gut getan...
gibt es noch weitere? Wie ist es z.B. mit Compugen? Dazu schreibt Hammer nichts, weil es ein israelisches Unternehmen ist.
Gruß
ipollit
INFI:
Daten zu iNHL. Die ORR sieht richtig gut aus für Monotherapie. Deutlich besser als Idealisib, wenn ich es richtig sehe (allerdings ein sehr kleines Kollektiv):
– IPI-145 Monotherapy Highly Active in Relapsed/Refractory
Indolent Non-Hodgkin Lymphoma, with 73 Percent Overall Response Rate and
20 Percent Complete Response Rate, and Generally Well Tolerated –
http://phx.corporate-ir.net/phoenix.zhtml?c=121941&p=irol-ne…
Daten zu iNHL. Die ORR sieht richtig gut aus für Monotherapie. Deutlich besser als Idealisib, wenn ich es richtig sehe (allerdings ein sehr kleines Kollektiv):
– IPI-145 Monotherapy Highly Active in Relapsed/Refractory
Indolent Non-Hodgkin Lymphoma, with 73 Percent Overall Response Rate and
20 Percent Complete Response Rate, and Generally Well Tolerated –
http://phx.corporate-ir.net/phoenix.zhtml?c=121941&p=irol-ne…
die PI iNHL-Daten sind aber nicht sonderlich anders, als zur ASCO im Sommer... wichtiger sind glaube ich die CLL-Daten am Montag. Der Unterschied kommt meiner Meinung nach nur zustande, indem die Dosis >25mg herausgerechnet worden ist. 25mg werden in der iNHL-PII verwendet.
iNHL r/r mono PI...
- ASH13... N=15, alle kleiner oder gleich 25mg: RR 73% => 11/15, CR 20% => 3/15
- ASCO13... N=19, meisten kleiner oder gleich 25mg: RR 68% => 13/19, CR 16% => 3/19
Gruß
ipollit
iNHL r/r mono PI...
- ASH13... N=15, alle kleiner oder gleich 25mg: RR 73% => 11/15, CR 20% => 3/15
- ASCO13... N=19, meisten kleiner oder gleich 25mg: RR 68% => 13/19, CR 16% => 3/19
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.003.300 von ipollit am 07.12.13 20:18:06Hast recht!
Antwort auf Beitrag Nr.: 46.002.900 von SLGramann am 07.12.13 18:21:42INFI:
Daten zu CLL:
in patients with chronic lymphocytic leukemia (CLL), a potentially fatal hematologic malignancy (blood cancer). Data from the study showed that IPI-145 was highly active in patients with relapsed/refractory CLL, with a nodal response rate of 89 percent and an overall response rate of 48 percent
http://phx.corporate-ir.net/phoenix.zhtml?c=121941&p=irol-ne…
Ich hatte Hammer so verstanden, dass er sich 60% gewünscht hatte. Das sieht dann ja wohl nicht sonderlich gut aus.
Daten zu CLL:
in patients with chronic lymphocytic leukemia (CLL), a potentially fatal hematologic malignancy (blood cancer). Data from the study showed that IPI-145 was highly active in patients with relapsed/refractory CLL, with a nodal response rate of 89 percent and an overall response rate of 48 percent
http://phx.corporate-ir.net/phoenix.zhtml?c=121941&p=irol-ne…
Ich hatte Hammer so verstanden, dass er sich 60% gewünscht hatte. Das sieht dann ja wohl nicht sonderlich gut aus.
ENTA:
Heute gab es sehr Ergebnisse der 2. P III:
Results from the 394-patient SAPPHIRE-II trial demonstrated a sustained virologic response at 12 weeks post-treatment (SVR12) of 96 percent in chronically infected GT1 HCV treatment experienced adult patients who had previously failed pegylated interferon and ribavirin treatment. Virologic relapse or breakthrough was noted in 2 percent of patients receiving the 3D regimen plus ribavirin. The treatment regimen was well tolerated, with 1 percent of patients discontinuing treatment due to adverse events.
ARRY:
Aus meiner Sicht gab es zu 520 ja quasi nichts Neues. Trotzdem oder wohl gerade deshalb wurde ARRY abgestraft. Oder hab ich da was übersehen?
Bei 614 war ich eher enttäuscht von den Ergebnissen.
Of patients currently evaluable for efficacy, 21% achieved a Hematologic Improvement. Of particular interest, 44% of platelet-transfusion dependent patients achieved Transfusion Reduction, and 31% achieved Transfusion Independence. Lower risk MDS patients with severe low platelet counts have a particularly poor prognosis.
Müssten bei der Bildung von Blutplättchen nicht eigentlich Nplate (Amgen) und Promacta (GSK) überlegen sein?
So far, 36 patients with an average age of 66 years have been recruited to participate in the Phase 2 study. The results show that at a follow-up time of 12 weeks, 80 percent of patients receiving Promacta responded to treatment with increased platelet counts and achieved platelet transfusion independence, compared to none who received the placebo.
http://www.mdsbeacon.com/news/2013/06/13/the-european-hemato…
Wahrscheinlich aber auch schwierig, die Studien so direkt zu vergleichen...
AMBI:
Habe mir jetzt auch eine kleinere Position AMBI gekauft. Die sind nach der gescheiterten AA ja ziemlich abgestraft worden. Zusätzlich scheint es noch Unstimmigkeiten mit der FDA bzgl. der Startdosis bei der P III zu geben. An den generellen Aussichten hat sich aber doch nichts geändert? Ich denke mal, dass man sich mit der FDA sinnvoll einigen wird, zumal ja auch im Laufe der Behandlung hochdosiert werden kann.
http://www.ambitbio.com/Posters/cortes129.pdf
Momentan überlege ich mir mit Ono Pharmaceuticals einen "Pharmawert" zu kaufen. Vor allem wegen Nivolumab.
Und natürlich auch wegen Remimazolam
SG kmastra
Heute gab es sehr Ergebnisse der 2. P III:
Results from the 394-patient SAPPHIRE-II trial demonstrated a sustained virologic response at 12 weeks post-treatment (SVR12) of 96 percent in chronically infected GT1 HCV treatment experienced adult patients who had previously failed pegylated interferon and ribavirin treatment. Virologic relapse or breakthrough was noted in 2 percent of patients receiving the 3D regimen plus ribavirin. The treatment regimen was well tolerated, with 1 percent of patients discontinuing treatment due to adverse events.
ARRY:
Aus meiner Sicht gab es zu 520 ja quasi nichts Neues. Trotzdem oder wohl gerade deshalb wurde ARRY abgestraft. Oder hab ich da was übersehen?
Bei 614 war ich eher enttäuscht von den Ergebnissen.
Of patients currently evaluable for efficacy, 21% achieved a Hematologic Improvement. Of particular interest, 44% of platelet-transfusion dependent patients achieved Transfusion Reduction, and 31% achieved Transfusion Independence. Lower risk MDS patients with severe low platelet counts have a particularly poor prognosis.
Müssten bei der Bildung von Blutplättchen nicht eigentlich Nplate (Amgen) und Promacta (GSK) überlegen sein?
So far, 36 patients with an average age of 66 years have been recruited to participate in the Phase 2 study. The results show that at a follow-up time of 12 weeks, 80 percent of patients receiving Promacta responded to treatment with increased platelet counts and achieved platelet transfusion independence, compared to none who received the placebo.
http://www.mdsbeacon.com/news/2013/06/13/the-european-hemato…
Wahrscheinlich aber auch schwierig, die Studien so direkt zu vergleichen...
AMBI:
Habe mir jetzt auch eine kleinere Position AMBI gekauft. Die sind nach der gescheiterten AA ja ziemlich abgestraft worden. Zusätzlich scheint es noch Unstimmigkeiten mit der FDA bzgl. der Startdosis bei der P III zu geben. An den generellen Aussichten hat sich aber doch nichts geändert? Ich denke mal, dass man sich mit der FDA sinnvoll einigen wird, zumal ja auch im Laufe der Behandlung hochdosiert werden kann.
http://www.ambitbio.com/Posters/cortes129.pdf
Momentan überlege ich mir mit Ono Pharmaceuticals einen "Pharmawert" zu kaufen. Vor allem wegen Nivolumab.
Und natürlich auch wegen Remimazolam

SG kmastra
Antwort auf Beitrag Nr.: 46.024.202 von kmastra am 10.12.13 23:33:16"Aus meiner Sicht gab es zu 520 ja quasi nichts Neues. Trotzdem oder wohl gerade deshalb wurde ARRY abgestraft."
So sehe ich das auch. Ich glaube weiterhin, dass 520 einen Platz in der MM-Behandlung haben wird, gerade weil es ein ganz anderes Wirkungsprinzip hat und sämtliche Medikamente irgendwann ihre Wirkung verlieren.
Allerdings ist die Wirkung offenbar eben nicht so hoch, dass es einen klaren Zulassungspfad als Monotherapie gibt. Obwohl ich das auch nicht ganz verstehe, denn wenn man sich auf die low-AAG-Patienten konzentriert, ist die ORR gut.
Aber die Sichtweise ist derzeit offenbar so, dass 520 als Kombitherapeutikum eine Chance hat und da dauert die Entwicklung lange und ist kompliziert. Wenn das so ist, sollte man wohl baldmöglichst verpartnern, was Array aber wohl nicht anstrebt. Das mag der Markt natürlich gar nicht, denn so liegt viel an Risiko und Kosten bei Array, ohne schnelle Erfolgsaussichten.
Im Moment muss man wohl die MEKs als den größten Werttreiber ansehen. Da kommen im nächsten Oktober oder so die ersten Daten. Bis dahin ist vielleicht nicht viel vom Array-Kurs zu erwarten.
So sehe ich das auch. Ich glaube weiterhin, dass 520 einen Platz in der MM-Behandlung haben wird, gerade weil es ein ganz anderes Wirkungsprinzip hat und sämtliche Medikamente irgendwann ihre Wirkung verlieren.
Allerdings ist die Wirkung offenbar eben nicht so hoch, dass es einen klaren Zulassungspfad als Monotherapie gibt. Obwohl ich das auch nicht ganz verstehe, denn wenn man sich auf die low-AAG-Patienten konzentriert, ist die ORR gut.
Aber die Sichtweise ist derzeit offenbar so, dass 520 als Kombitherapeutikum eine Chance hat und da dauert die Entwicklung lange und ist kompliziert. Wenn das so ist, sollte man wohl baldmöglichst verpartnern, was Array aber wohl nicht anstrebt. Das mag der Markt natürlich gar nicht, denn so liegt viel an Risiko und Kosten bei Array, ohne schnelle Erfolgsaussichten.
Im Moment muss man wohl die MEKs als den größten Werttreiber ansehen. Da kommen im nächsten Oktober oder so die ersten Daten. Bis dahin ist vielleicht nicht viel vom Array-Kurs zu erwarten.
Antwort auf Beitrag Nr.: 46.027.623 von SLGramann am 11.12.13 13:43:52Array:
Array’s Filanesib (ARRY-520) shows consistent RR of 37-42% in combination with Kyprolis or Velcade in advanced MM. In planned Phase 3 for Kyprolis+/-filanesib (starting in ~mid-2014), physicians expect fast patients enrollment as few competing trials with Kyprolis. Physicians treating up to hundreds MM patients with Kyprolis are not seeing difference in CV issues between Kyprolis vs. Velcade and note concerns are overblown.
Physicians expect ARRY's planned Phase 3 for Kyprolis+/- filanesib would enroll patients fast as there are few Kyprolis combination studies. Slated to begin in ~mid-2014 (n=~500), primary endpoint of the Phase 3 will be PFS, with potential for accelerated approval on doubling ORR vs. Kyprolis alone. Assuming ~5 month PFS with Kyprolis (in MM patients refractory to bortezomib and lenalidomide), the trial will be designed to show ~8 month PFS with filanesib+Kyprolis.
------------
So kann man sich das wohl also in etwa vorstellen.
Ist wohl etwas fraglich, ob diese Bedingung erreicht werden kann:
"potential for accelerated approval on doubling ORR vs. Kyprolis alone"
Ohne jetzt nachzuschauen, lag die ORR bei Kyprolis damals bei 24% glaube ich. Das heißt, in Kombination mit 520 müsste man bei 50% landen, was angesichts der derzeitigen Daten als recht ambitioniert erscheint.
Welche Chancen bestehen über die "PFS-Schiene"?
Array’s Filanesib (ARRY-520) shows consistent RR of 37-42% in combination with Kyprolis or Velcade in advanced MM. In planned Phase 3 for Kyprolis+/-filanesib (starting in ~mid-2014), physicians expect fast patients enrollment as few competing trials with Kyprolis. Physicians treating up to hundreds MM patients with Kyprolis are not seeing difference in CV issues between Kyprolis vs. Velcade and note concerns are overblown.
Physicians expect ARRY's planned Phase 3 for Kyprolis+/- filanesib would enroll patients fast as there are few Kyprolis combination studies. Slated to begin in ~mid-2014 (n=~500), primary endpoint of the Phase 3 will be PFS, with potential for accelerated approval on doubling ORR vs. Kyprolis alone. Assuming ~5 month PFS with Kyprolis (in MM patients refractory to bortezomib and lenalidomide), the trial will be designed to show ~8 month PFS with filanesib+Kyprolis.
------------
So kann man sich das wohl also in etwa vorstellen.
Ist wohl etwas fraglich, ob diese Bedingung erreicht werden kann:
"potential for accelerated approval on doubling ORR vs. Kyprolis alone"
Ohne jetzt nachzuschauen, lag die ORR bei Kyprolis damals bei 24% glaube ich. Das heißt, in Kombination mit 520 müsste man bei 50% landen, was angesichts der derzeitigen Daten als recht ambitioniert erscheint.
Welche Chancen bestehen über die "PFS-Schiene"?
Antwort auf Beitrag Nr.: 46.033.279 von SLGramann am 12.12.13 07:22:38Die ORR´s anderer Kombi-Therapien in derselben Indikation (refract./relaps. MM, schwere Verlaufsform) schauen deutlich besser aus. Insoweit wäre ich in meinen Erwartungen bzgl. ARRY-520 eher zurückhaltend.
Ja die Zukunkt von 520 scheint irgendwie unsicher und unübersichtlich. Und Unsicherheit ist an der Börse ja bekanntlich so beliebt wie ein chinesischer Koch in Entenhausen. Werde Array etwas reduzieren, aber mit einer großen Position dabei bleiben. Es gibt eben auch noch viele positive Chancen, die man nicht so präsent hat (z.B. 502)...dazu noch langfristig die MEKs. Charttechnisch zudem eine interessante Konstelation.

Werde die Position bei Ambit weiter ausbauen. Die gestrige Präsentation fand ich überzeugend. Zumal man sich mit der FDA bzgl. der P III geeinigt hat. Jetzt soll mit 30 mg gestartet werden und ggf. nach 12 (?) Tagen auf 60 mg erhöht werden können. Auch zur Effektivität und zum Vergleich mit anderen Medikamenten gab es beeindruckende Fakten.
Long: Array, Ligand, Enanta, Ambit, Furiex, Genmab, Morphosys, Paion
Auf der Watchlist: Ono, Curis, Immunogen, Rigel
SG kmastra
Werde die Position bei Ambit weiter ausbauen. Die gestrige Präsentation fand ich überzeugend. Zumal man sich mit der FDA bzgl. der P III geeinigt hat. Jetzt soll mit 30 mg gestartet werden und ggf. nach 12 (?) Tagen auf 60 mg erhöht werden können. Auch zur Effektivität und zum Vergleich mit anderen Medikamenten gab es beeindruckende Fakten.
Long: Array, Ligand, Enanta, Ambit, Furiex, Genmab, Morphosys, Paion
Auf der Watchlist: Ono, Curis, Immunogen, Rigel
SG kmastra
Antwort auf Beitrag Nr.: 46.040.484 von kmastra am 12.12.13 20:52:32Hi @all
Möchte mich zunächst bei ipollit, kmastra und SLGramann für die immer ausführlichen Infos, Erklärungen und Begründungen bedanken.
@kmastra: freut mich, dass Du auch in Paion investiert bist, ich für meinen Teil hab investiert und werde Anfang Dezember 2014 schauen, was aus dem Invest geworden ist.
Der Thread dazu ist ja ein reiner Kindergarten.
Vorstellen möchte ich an dieser Stelle einen nicht-Biotechwert, dessen Potential ist als schier unglaublich erachte, trotz des Anstiegs in diesem Jahr.
Cardiome Pharma
Hab mittlerweile >30% meines Depots sozusagen vollgestopft mit diesem Wert, auf den ich leider erst vor ein paar Tagen aufmerksam geworden bin. Ich gehe/hoffe davon aus, dass noch ein paar hundert % Prozent Gewinn im nächsten Jahr drin sein dürften.
Ausführlicher habe ich bei ariva dazu gepostet, folgend die Kopien:
Bin seit heute ebenfalls drin und frage mich, wo der Haken sein soll?
Meine damit, warum ist der Kurs noch "so tief"?
Klasse I Empfehlung für eine pharmakologische Cardioversion des Vorhhofflimmerns in den Sinusrhythmus der Europäischen Gesellschaft für Kardiologie:
Das ist Wahnsinn und normalerweise müsste der Kurs schon durch alle Decken sein.
Sollte das orale Präparat irgendwann kommen, dann ist m.E. eine MK von locker > 5 Miliarden US-Dollar gerechtfertigt: Dann hätten wir keinen Blockbuster, sondern einen Megabuster.
Insofern verstehe ich den "tiefen Kurs" momentan ganz und gar nicht. "Sind irgendwelche Pharmakonzerne dagegen?"
Bei 50% Verlust würde ich ab heute verkaufen, ansonsten lasse ich die mal bis mindestens 30-40 Dollar liegen.
-----------------------------------------------------------------------------------
Hat sich heute mehr als gut gegen den Markst gestemmt. Werde sobald nächstes Gehalt kommt nochmals kaufen. Hoffe, dass das Geld in den nächsten Tagen kommt und der Kurs nicht wieder abfliegt. Hab die ersten Anstiege leider verpasst. Bin gestern durch Zufall (hab die Tops und Flops des Jahres auf cortalconsors nachgeschaut und einige Aktien den Namen nach kurz recherchiert) auf diesen Wert gekommen. Leider, leider erst jetzt. Aber egal, das sollte nichts machen.
Wie bereits gesagt, kann ich nicht nachvollziehen, warum der Kurs nicht jetzt schon zweistellig ist.
Hab soeben mit meinem Bruder (ist Kardiologe in einem sehr grossen Herzzentrum) gesimst: Es waren in letzter Zeit mehrere Vertreter da, die Werbung für Vernakalant machen!!!
Nähere/noch mehr Infos, wenn ich mit ihm telefoniert habe.
Dann auf zweistellig.
----------------------------------------------------------------------------------
Es existiert bereits eine "first line"-Empfehlung der europäischen Gesellschaft für Kardiologie zur medikamentösen Conversion eines
paroxysmalen (<48 bzw. bis 48Std. anhaltenden) Vorhofflimmerns sowie
eines VHF's das bis zu 7 Tagen bereits "anhält" sowie auch zur Conversion
eines VHF's bis zu 3 Tagen nach einer Operation.
Insofern, was hat die zitierte Krebs-Studie mit Vernakalant zu tun?
Der statistisch signifikante Beweis/Wirkung ist in bisher 4 Studien eindeutig nachgewiesen worden.
Wenn überhaupt ein Nachteil, dann die Kosten: bewegen sich in etwa 500 Euro pro Anwendung.
Wenn man sich aber den Vergleich anschaut, wie hoch z.B. die Tagestherapiekosten der neuen Blutverdünner (Antikoagulantien) bzgl. Therapie des VHF's sind, nämlich etwa 3 bis 3,50 pro Tag (Xarelto, Pradaxa, Eliquis: sind die Handelsnamen) und wie sich die Präparate in kürzester Zeit in der Breitanwendung surchgesetzt haben, dann braucht man sich hinsichtlich Brinavess (Vernakalant) m.M. überhaupt keine Sorgen zu machen.
Mein Depotanteil beträgt bei Cardiome inzwischen > 30% und ist mit Abstand inzwischen der Grösste.
Bei < 4 $ würde ich ans Verkaufen denken, ansonsten nicht vor 30-40 $.
Nachkaufen würde ich bei Überspringen der 10$ etwa, sowie in weiteren 5er Schritten.
Hättet Ihr eine Meinung dazu?
Das einzige was ich bei meiner Recherche nicht gefunden habe bzw. nicht nachvollziehen konnte: warum ist MDS vor 3 Jahren ausgestiegen?
Andererseits,wenn man sich anschaut, wieviele Instis in den letzten Wochen eingestiegen sind (u.a. bei yahoo unter Message-board nachzulesen) sowie wenn man sieht, wie sich die short-Quote in den letzten Wochen verringert hat (auch yahoo), so kann man durchaus zu dem Schluss kommen, dass es möglicherweise ein Fehler seitens MSD gewesen sein könnte.
Mag sein, dass meine erhofften Kursziele zu ambitioniert sind, jedoch ist die aktuelle MK bei DEN Aussichten geradezu lächerlich.
Und den Vergleich, wie schnell sich die neuen Antikoagulantien (Rivaroxaban, Dibigatran und Apixaban) trotz Tagestherapiekosten von 3-3,50 Euro inzwischen etabliert haben, hab ich bereits erwähnt.Ferner: sollte es in den nächsten Jahren eine orale Applikationsform des Vernakalants geben, dann sind o.g. Kurse durchaus gerechtfertigt.
Sorry, wenn das jetzt kein Biotech-Wert ist, aber für eine kritische Meinung aus "Eurem" Kreis wäre ich sehr dankbar.
Grüsse,
s.
Möchte mich zunächst bei ipollit, kmastra und SLGramann für die immer ausführlichen Infos, Erklärungen und Begründungen bedanken.
@kmastra: freut mich, dass Du auch in Paion investiert bist, ich für meinen Teil hab investiert und werde Anfang Dezember 2014 schauen, was aus dem Invest geworden ist.
Der Thread dazu ist ja ein reiner Kindergarten.
Vorstellen möchte ich an dieser Stelle einen nicht-Biotechwert, dessen Potential ist als schier unglaublich erachte, trotz des Anstiegs in diesem Jahr.
Cardiome Pharma
Hab mittlerweile >30% meines Depots sozusagen vollgestopft mit diesem Wert, auf den ich leider erst vor ein paar Tagen aufmerksam geworden bin. Ich gehe/hoffe davon aus, dass noch ein paar hundert % Prozent Gewinn im nächsten Jahr drin sein dürften.
Ausführlicher habe ich bei ariva dazu gepostet, folgend die Kopien:
Bin seit heute ebenfalls drin und frage mich, wo der Haken sein soll?
Meine damit, warum ist der Kurs noch "so tief"?
Klasse I Empfehlung für eine pharmakologische Cardioversion des Vorhhofflimmerns in den Sinusrhythmus der Europäischen Gesellschaft für Kardiologie:
Das ist Wahnsinn und normalerweise müsste der Kurs schon durch alle Decken sein.
Sollte das orale Präparat irgendwann kommen, dann ist m.E. eine MK von locker > 5 Miliarden US-Dollar gerechtfertigt: Dann hätten wir keinen Blockbuster, sondern einen Megabuster.
Insofern verstehe ich den "tiefen Kurs" momentan ganz und gar nicht. "Sind irgendwelche Pharmakonzerne dagegen?"
Bei 50% Verlust würde ich ab heute verkaufen, ansonsten lasse ich die mal bis mindestens 30-40 Dollar liegen.
-----------------------------------------------------------------------------------
Hat sich heute mehr als gut gegen den Markst gestemmt. Werde sobald nächstes Gehalt kommt nochmals kaufen. Hoffe, dass das Geld in den nächsten Tagen kommt und der Kurs nicht wieder abfliegt. Hab die ersten Anstiege leider verpasst. Bin gestern durch Zufall (hab die Tops und Flops des Jahres auf cortalconsors nachgeschaut und einige Aktien den Namen nach kurz recherchiert) auf diesen Wert gekommen. Leider, leider erst jetzt. Aber egal, das sollte nichts machen.
Wie bereits gesagt, kann ich nicht nachvollziehen, warum der Kurs nicht jetzt schon zweistellig ist.
Hab soeben mit meinem Bruder (ist Kardiologe in einem sehr grossen Herzzentrum) gesimst: Es waren in letzter Zeit mehrere Vertreter da, die Werbung für Vernakalant machen!!!
Nähere/noch mehr Infos, wenn ich mit ihm telefoniert habe.
Dann auf zweistellig.
----------------------------------------------------------------------------------
Es existiert bereits eine "first line"-Empfehlung der europäischen Gesellschaft für Kardiologie zur medikamentösen Conversion eines
paroxysmalen (<48 bzw. bis 48Std. anhaltenden) Vorhofflimmerns sowie
eines VHF's das bis zu 7 Tagen bereits "anhält" sowie auch zur Conversion
eines VHF's bis zu 3 Tagen nach einer Operation.
Insofern, was hat die zitierte Krebs-Studie mit Vernakalant zu tun?
Der statistisch signifikante Beweis/Wirkung ist in bisher 4 Studien eindeutig nachgewiesen worden.
Wenn überhaupt ein Nachteil, dann die Kosten: bewegen sich in etwa 500 Euro pro Anwendung.
Wenn man sich aber den Vergleich anschaut, wie hoch z.B. die Tagestherapiekosten der neuen Blutverdünner (Antikoagulantien) bzgl. Therapie des VHF's sind, nämlich etwa 3 bis 3,50 pro Tag (Xarelto, Pradaxa, Eliquis: sind die Handelsnamen) und wie sich die Präparate in kürzester Zeit in der Breitanwendung surchgesetzt haben, dann braucht man sich hinsichtlich Brinavess (Vernakalant) m.M. überhaupt keine Sorgen zu machen.
Mein Depotanteil beträgt bei Cardiome inzwischen > 30% und ist mit Abstand inzwischen der Grösste.
Bei < 4 $ würde ich ans Verkaufen denken, ansonsten nicht vor 30-40 $.
Nachkaufen würde ich bei Überspringen der 10$ etwa, sowie in weiteren 5er Schritten.
Hättet Ihr eine Meinung dazu?
Das einzige was ich bei meiner Recherche nicht gefunden habe bzw. nicht nachvollziehen konnte: warum ist MDS vor 3 Jahren ausgestiegen?
Andererseits,wenn man sich anschaut, wieviele Instis in den letzten Wochen eingestiegen sind (u.a. bei yahoo unter Message-board nachzulesen) sowie wenn man sieht, wie sich die short-Quote in den letzten Wochen verringert hat (auch yahoo), so kann man durchaus zu dem Schluss kommen, dass es möglicherweise ein Fehler seitens MSD gewesen sein könnte.
Mag sein, dass meine erhofften Kursziele zu ambitioniert sind, jedoch ist die aktuelle MK bei DEN Aussichten geradezu lächerlich.
Und den Vergleich, wie schnell sich die neuen Antikoagulantien (Rivaroxaban, Dibigatran und Apixaban) trotz Tagestherapiekosten von 3-3,50 Euro inzwischen etabliert haben, hab ich bereits erwähnt.Ferner: sollte es in den nächsten Jahren eine orale Applikationsform des Vernakalants geben, dann sind o.g. Kurse durchaus gerechtfertigt.
Sorry, wenn das jetzt kein Biotech-Wert ist, aber für eine kritische Meinung aus "Eurem" Kreis wäre ich sehr dankbar.
Grüsse,
s.
Antwort auf Beitrag Nr.: 46.041.526 von sufenta am 12.12.13 23:52:43Nachtrag: CRME
Aktuelle Shortquoten:
http://shortanalytics.com/getshortchart.php?tsymbol=CRME
Und vergessen zu erwähnen:
Die kürzlich übernommen:
http://www.correvio.com/home und deren Hauptprodukt:
Aggrastat (gibt keine Klnik in Deutschland,an dem man es nicht kennen würde bzw. wo es nicht zur Anwendung kommen/bisher gekommen ist)
Aggrastat® (tirofiban HCl) is a reversible GP IIb/IIIa inhibitor for use in indicated Acute Coronary Syndrome patients.
Correvio commercialises Aggrastat® in more than 50 countries worldwide either directly (Europe) or via its distributor and partner network.
Correvio International is located in Geneva, Switzerland with legal entities in Australia, Belgium, France, Germany, Italy Spain, Sweden and the UK.
Gruss
Aktuelle Shortquoten:
http://shortanalytics.com/getshortchart.php?tsymbol=CRME
Und vergessen zu erwähnen:
Die kürzlich übernommen:
http://www.correvio.com/home und deren Hauptprodukt:
Aggrastat (gibt keine Klnik in Deutschland,an dem man es nicht kennen würde bzw. wo es nicht zur Anwendung kommen/bisher gekommen ist)
Aggrastat® (tirofiban HCl) is a reversible GP IIb/IIIa inhibitor for use in indicated Acute Coronary Syndrome patients.
Correvio commercialises Aggrastat® in more than 50 countries worldwide either directly (Europe) or via its distributor and partner network.
Correvio International is located in Geneva, Switzerland with legal entities in Australia, Belgium, France, Germany, Italy Spain, Sweden and the UK.
Gruss
Antwort auf Beitrag Nr.: 46.034.924 von Joschka Schröder am 12.12.13 10:59:56Insoweit wäre ich in meinen Erwartungen bzgl. ARRY-520 eher zurückhaltend.
Ja, bin inzwischen auch ziemlich zurückhaltend und habe auch meine Position reduziert.
Allerdings finde ich es nach wie vor erstaunlich, warum scheinbar niemand die Differenzierung nach AAG-low-Patienten als sinnvoll ansieht.
Mal folgender Vergleichswert:
Kyprolis (Carfilzomib):
The ORR was 24% and a clinical benefit response (CBR, defined as ORR + minimal response) was seen in 36% of patients. Responses were durable with a DOR of 7.4 months. The results of the 003-A1 trial were submitted to the Food and Drug Administration (FDA) and this led on July 20 2012 to the approval of carfilzomib (Kyprolis®) for myeloma patients,
Bei 520 haben wir folgendes, wenn man nur die AAG-low-Patienten ansieht:
ORR: 24%
CBR: 33%
DOR: 8,6 Monate
In den fraglichen Trials hatten die Kyprolis-Patienten im Schnitt 5 vorhergehende Therapien, bei 520 lag der Schnitt bei 6 Vortherapien.
Also, die 520-Daten sind - abgesehen vom deutlich kleineren Kollektiv - eigentlich nicht schlechter als die Daten von Kyprolis.
Aber das wird eben nicht akzeptiert, weil "man" offensichtlich der Auffassung ist, dass die Differenzierung nach AAG-low und AAG-high-Patienten unsinnig oder unpraktisch ist, obwohl Theorie und Empirie danach schreien.
Bin zu dumm, um das zu verstehen.
@sufenta,
das Thema ist mir eher fremd, hab mich nur mal etwas mit den neuen Antikoagulantien wie Eliquis usw. befasst, aber das ist ja hier noch was ganz anderes.
Nach einem kurzen Blick auf dieses Unternehmen habe ich aber ein ganz schlechtes Gefühl. Werde das nicht vertiefen. Sorry.
Ja, bin inzwischen auch ziemlich zurückhaltend und habe auch meine Position reduziert.
Allerdings finde ich es nach wie vor erstaunlich, warum scheinbar niemand die Differenzierung nach AAG-low-Patienten als sinnvoll ansieht.
Mal folgender Vergleichswert:
Kyprolis (Carfilzomib):
The ORR was 24% and a clinical benefit response (CBR, defined as ORR + minimal response) was seen in 36% of patients. Responses were durable with a DOR of 7.4 months. The results of the 003-A1 trial were submitted to the Food and Drug Administration (FDA) and this led on July 20 2012 to the approval of carfilzomib (Kyprolis®) for myeloma patients,
Bei 520 haben wir folgendes, wenn man nur die AAG-low-Patienten ansieht:
ORR: 24%
CBR: 33%
DOR: 8,6 Monate
In den fraglichen Trials hatten die Kyprolis-Patienten im Schnitt 5 vorhergehende Therapien, bei 520 lag der Schnitt bei 6 Vortherapien.
Also, die 520-Daten sind - abgesehen vom deutlich kleineren Kollektiv - eigentlich nicht schlechter als die Daten von Kyprolis.
Aber das wird eben nicht akzeptiert, weil "man" offensichtlich der Auffassung ist, dass die Differenzierung nach AAG-low und AAG-high-Patienten unsinnig oder unpraktisch ist, obwohl Theorie und Empirie danach schreien.
Bin zu dumm, um das zu verstehen.
@sufenta,
das Thema ist mir eher fremd, hab mich nur mal etwas mit den neuen Antikoagulantien wie Eliquis usw. befasst, aber das ist ja hier noch was ganz anderes.
Nach einem kurzen Blick auf dieses Unternehmen habe ich aber ein ganz schlechtes Gefühl. Werde das nicht vertiefen. Sorry.
Antwort auf Beitrag Nr.: 46.048.042 von sufenta am 13.12.13 21:18:14Hallo sufenta,
finde die Aktie nicht uninteressant, kann aber adhoc keine detaillierte Einschätzung geben. Abzuwarten bleibt, ob CRME aus den zugelassenen Medikamenten ein Geschäft/Gewinn machen kann. Die Übernahme macht definitiv Sinn, weil sie ja eh einen Vertrieb in EU brauchen. Dann wäre die orale Version quasi die zusätzliche Chance obendrauf. Kenne mich da aber zu wenig aus. Das Merck die Rechte zurück gegeben hat muss nichts heißen. Vielleicht ist es zu margenschwach und/oder das Marktpotenzial ist zu klein. Kann sich dann für einen kleinen Spezialanbieter trotzdem lohnen.
Denke du hast dich eingehend mit dem Wert beschäftigt. 30% des Depots sind natürlich aber schon viel...
Bei Paion bin ich mit einer ganz kleinen Position dabei, warte ab was sich bei Ono regt.
SG kmastra
finde die Aktie nicht uninteressant, kann aber adhoc keine detaillierte Einschätzung geben. Abzuwarten bleibt, ob CRME aus den zugelassenen Medikamenten ein Geschäft/Gewinn machen kann. Die Übernahme macht definitiv Sinn, weil sie ja eh einen Vertrieb in EU brauchen. Dann wäre die orale Version quasi die zusätzliche Chance obendrauf. Kenne mich da aber zu wenig aus. Das Merck die Rechte zurück gegeben hat muss nichts heißen. Vielleicht ist es zu margenschwach und/oder das Marktpotenzial ist zu klein. Kann sich dann für einen kleinen Spezialanbieter trotzdem lohnen.
Denke du hast dich eingehend mit dem Wert beschäftigt. 30% des Depots sind natürlich aber schon viel...
Bei Paion bin ich mit einer ganz kleinen Position dabei, warte ab was sich bei Ono regt.
SG kmastra
Ono:
Hier werde ich definitiv einsteigen, auch wenn der Wert mit einem KGV von über 40 ziemlich ambitioniert bewertet ist. Aber ich denke man muss auch die mittelfristigen Wachstumsmöglichkeiten sehen. Zudem scheint es etwas konservativer als die meisten meiner anderen Invstments. Es gibt auch eine Dividende, die zumindest über dem liegt, was man sonst auf Tagesgelkonten bekäme.
Hauptgrund für meinen Einstieg ist Nivolumab. Über das Potenzial muss ich ja nichts schreiben. Neu war für mich aber, dass Ono hier neben den Rechten für Japan, Südkorea und Taiwan auch noch Royalties für den Rest der Welt bekommt.
Bristol-Myers Squibb/Ono Pharmaceuticals: In a transaction that involves no cash moving in either direction, Bristol-Myers Squibb has expanded its territorial rights to an oncology antibody acquired in its 2009 purchase of Medarex, while Ono Pharmaceutical gets co-development and co-commercialization rights to rheumatoid arthritis drug Orencia (abatacept) in Japan. Ono can earn unspecified royalties if the antibody, BMS-936558/Ono-4538, an anti-programmed cell death (PD-1) antibody in clinical development in multiple types of cancer, reaches market. Bristol Senior VP-Strategy, Alliances and Transactions Jeremy Levin cautions not to consider this deal merely an asset swap. “It’s less a swap than it is an understanding that we have different strategic imperatives,” Levin said. “So we trade the value of an existing product that we like a lot, Orencia, for a product that we think helps build a tremendously important part of the immuno-oncology franchise.” Under the Sept. 20 agreement, Bristol’s rights to BMS-936558 expand to the entire world other than Japan, Korea and Taiwan; Ono will retain rights to the antibody in those markets (In the original Medarex/Ono deal, Medarex received North American rights to the antibody.) In the U.S., ’558 is in Phase I and Phase II trials in a variety of tumor types and treatment settings, Bristol says, including renal cell carcinoma and melanoma. Ono has advanced the compound to Phase II in melanoma in Japan.—Joseph Haas
Die IR hat mir das bestätigt:
First is to ONO-4538 which seems to be a very valueable asset. Does Ono get any royalties from regions outside japan? If so how much? Does Ono have to pay any royalties to BMS?
In this contract, Ono pays to BMS the royalty of sales in Japan , South Korea , Taiwan.
On the contrary , BMS pays to Ono the royalty of sales in the rest of the world.
The rate of royalty is disclosed.
Dazu noch die Comarketing Rechte von Orencia in Japan (BMS macht damit über 1 Milliarde Umsatz), dass dort gerade auf den Markt gekommen ist.
Zudem ein funktionierendes Pharmageschäft und eine entsprechend große Pipeline. Ono hat z.B. auch die Rechte an Kyprolis in Japan. Ohad Hammer hatte sich z.B. zum BTK-Hemmer als mögliche langfristige Konkurenz zu ibrutinib geäußert.
Fragt sich nur noch wo und wie ich die Aktien kaufen kann?
SG kmastra
Hier werde ich definitiv einsteigen, auch wenn der Wert mit einem KGV von über 40 ziemlich ambitioniert bewertet ist. Aber ich denke man muss auch die mittelfristigen Wachstumsmöglichkeiten sehen. Zudem scheint es etwas konservativer als die meisten meiner anderen Invstments. Es gibt auch eine Dividende, die zumindest über dem liegt, was man sonst auf Tagesgelkonten bekäme.
Hauptgrund für meinen Einstieg ist Nivolumab. Über das Potenzial muss ich ja nichts schreiben. Neu war für mich aber, dass Ono hier neben den Rechten für Japan, Südkorea und Taiwan auch noch Royalties für den Rest der Welt bekommt.
Bristol-Myers Squibb/Ono Pharmaceuticals: In a transaction that involves no cash moving in either direction, Bristol-Myers Squibb has expanded its territorial rights to an oncology antibody acquired in its 2009 purchase of Medarex, while Ono Pharmaceutical gets co-development and co-commercialization rights to rheumatoid arthritis drug Orencia (abatacept) in Japan. Ono can earn unspecified royalties if the antibody, BMS-936558/Ono-4538, an anti-programmed cell death (PD-1) antibody in clinical development in multiple types of cancer, reaches market. Bristol Senior VP-Strategy, Alliances and Transactions Jeremy Levin cautions not to consider this deal merely an asset swap. “It’s less a swap than it is an understanding that we have different strategic imperatives,” Levin said. “So we trade the value of an existing product that we like a lot, Orencia, for a product that we think helps build a tremendously important part of the immuno-oncology franchise.” Under the Sept. 20 agreement, Bristol’s rights to BMS-936558 expand to the entire world other than Japan, Korea and Taiwan; Ono will retain rights to the antibody in those markets (In the original Medarex/Ono deal, Medarex received North American rights to the antibody.) In the U.S., ’558 is in Phase I and Phase II trials in a variety of tumor types and treatment settings, Bristol says, including renal cell carcinoma and melanoma. Ono has advanced the compound to Phase II in melanoma in Japan.—Joseph Haas
Die IR hat mir das bestätigt:
First is to ONO-4538 which seems to be a very valueable asset. Does Ono get any royalties from regions outside japan? If so how much? Does Ono have to pay any royalties to BMS?
In this contract, Ono pays to BMS the royalty of sales in Japan , South Korea , Taiwan.
On the contrary , BMS pays to Ono the royalty of sales in the rest of the world.
The rate of royalty is disclosed.
Dazu noch die Comarketing Rechte von Orencia in Japan (BMS macht damit über 1 Milliarde Umsatz), dass dort gerade auf den Markt gekommen ist.
Zudem ein funktionierendes Pharmageschäft und eine entsprechend große Pipeline. Ono hat z.B. auch die Rechte an Kyprolis in Japan. Ohad Hammer hatte sich z.B. zum BTK-Hemmer als mögliche langfristige Konkurenz zu ibrutinib geäußert.
Fragt sich nur noch wo und wie ich die Aktien kaufen kann?
SG kmastra
Antwort auf Beitrag Nr.: 46.050.380 von kmastra am 14.12.13 14:41:51Hallo kmastra, das finde ich wirklich interessant.
Die Marktkapitalisierung liegt bei ca. 8 Milliarden Dollar, richtig? Der Umsatz bei 1,5 Mrd. Dollar. Eine "normale" Pharmabewertung wäre dann bei 5 bis 6 Mrd. Dollar Marktkapitalisierung. Noch extremer weicht das KGV von der Norm ab. "Normal" wäre ein Wert zwischen 10 und 20. Hier haben wir 40+
Kannst Du irgendwann etwas konkreter darstellen, woher das Potential kommt bzw. welches Potential Du Dir vorstellst?
Die Marktkapitalisierung liegt bei ca. 8 Milliarden Dollar, richtig? Der Umsatz bei 1,5 Mrd. Dollar. Eine "normale" Pharmabewertung wäre dann bei 5 bis 6 Mrd. Dollar Marktkapitalisierung. Noch extremer weicht das KGV von der Norm ab. "Normal" wäre ein Wert zwischen 10 und 20. Hier haben wir 40+
Kannst Du irgendwann etwas konkreter darstellen, woher das Potential kommt bzw. welches Potential Du Dir vorstellst?
Antwort auf Beitrag Nr.: 46.050.484 von SLGramann am 14.12.13 15:26:54Hallo SLGramann,
du kennst dich ja mit Nivolumab und BMS bestens aus. Von daher bin ich an deiner Meinung sehr interessiert!
Leider ist es ja so, dass die genaue Höhe der Royalties nicht bekannt ist. Davon hängt natürlich viel ab. Man kann sich dem momentan nur (mehr oder weniger logisch) annähern. Ich werde der IR nochmal einige Fragen dazu stellen. Es würde mich z.B. interessieren, ob die Royalties grundsätzlich überall gleich hoch sind und ob es ggf. noch irgendwelche Co-Development Rechte gibt.
Einige grundsätzliche Überlegungen in Bezug auf Nivolumab:
Ich glaube, dass die Royaltyrechte von Ono noch ziemlich unbekannt und deshalb auch nicht eingepreist sind. Liest man von Nivolumab, taucht meist nur BMS auf, wenn Ono auftaucht, dann nur in Bezug auf die Rechte in Jap,...auch in der ofiziellen Pressemitteilung zum Deal steht davon nichts:
http://news.bms.com/press-release/partnering-news/bristol-my…
Ono hatte ja die weltweiten Rechte (mit Ausnahme der USA-Medarex). Von daher war die Position beim Deal mit BMS sehr gut. Ono hat sich da hoffentlich nicht über den Tisch ziehen lassen. Insbesondere die Rechte in der EU dürften interessant sein. Normalerweise müssten die Royalties hier klar im zweistelligen Prozentbereich sein. Man muss aber auch noch den Deal mit Orencia einbeziehen...
Das Marktpotenzial wird von einigen Analysten bei 5 Milliarden (und mehr) gesehen.
Insgesamt hat Ono:
1. Die Vertriebsrechte für Nivolumab in Japan, Südkorea und Taiwan. Dort leben fast 200 Mio Menschen. Ono muss hier Royalties an BMS zahlen. Laut Deal mit Medarex.
2. Royalties an den Verkäufen in den USA. Dies stammt noch aus dem Deal mit Medarex. Es könnte sein, dass die Royalties die gleiche Höhe haben wie umgekehrt die Royalties in Japan. Medarex hatte immer eher Deals im Singledigit Bereich (3-5%?)
3. Die Royalties im Rest der Welt (vor allem EU). Diese wurden später ausgehandelt. Es würde mich schon wundern, wenn sie nicht signifikant höher wären. Meine Schätzung wären hier 10%.
Ono hat eine Marktkapitalisierung von ca. 8 Milliarden, Umsatz von 1,5 Milliarden und einen Gewinn von 340 Mio.
Grob und zugegeben optimistisch geschätzt (!) könnte Ono:
1. Bei annähernd 1 Milliarde Umsatz (in der Spitze) in Asien und einer angenommen recht hohen Gewinnmarge der heutige Gewinn (340 Mio) nochmals erzielt werden.
2. Wenn man von 2 Milliarden Umsatz in den USA ausgeht, könnten hier Royalties von 60-100 Mio an Ono fließen.
3. Wenn man im Rest der Welt weitere 2 Milliarden Umsatz bei höherer prozentualer Beteiligung annimmt, wären das 200 Mio Royalties.
Insgesamt könnte Ono durch Nivolumab also den Umsatz verdoppeln und den Gewinn vervierfachen, wenn man annimmt, dass der Rest stabil bleibt.
SG kmastra
du kennst dich ja mit Nivolumab und BMS bestens aus. Von daher bin ich an deiner Meinung sehr interessiert!
Leider ist es ja so, dass die genaue Höhe der Royalties nicht bekannt ist. Davon hängt natürlich viel ab. Man kann sich dem momentan nur (mehr oder weniger logisch) annähern. Ich werde der IR nochmal einige Fragen dazu stellen. Es würde mich z.B. interessieren, ob die Royalties grundsätzlich überall gleich hoch sind und ob es ggf. noch irgendwelche Co-Development Rechte gibt.
Einige grundsätzliche Überlegungen in Bezug auf Nivolumab:
Ich glaube, dass die Royaltyrechte von Ono noch ziemlich unbekannt und deshalb auch nicht eingepreist sind. Liest man von Nivolumab, taucht meist nur BMS auf, wenn Ono auftaucht, dann nur in Bezug auf die Rechte in Jap,...auch in der ofiziellen Pressemitteilung zum Deal steht davon nichts:
http://news.bms.com/press-release/partnering-news/bristol-my…
Ono hatte ja die weltweiten Rechte (mit Ausnahme der USA-Medarex). Von daher war die Position beim Deal mit BMS sehr gut. Ono hat sich da hoffentlich nicht über den Tisch ziehen lassen. Insbesondere die Rechte in der EU dürften interessant sein. Normalerweise müssten die Royalties hier klar im zweistelligen Prozentbereich sein. Man muss aber auch noch den Deal mit Orencia einbeziehen...
Das Marktpotenzial wird von einigen Analysten bei 5 Milliarden (und mehr) gesehen.
Insgesamt hat Ono:
1. Die Vertriebsrechte für Nivolumab in Japan, Südkorea und Taiwan. Dort leben fast 200 Mio Menschen. Ono muss hier Royalties an BMS zahlen. Laut Deal mit Medarex.
2. Royalties an den Verkäufen in den USA. Dies stammt noch aus dem Deal mit Medarex. Es könnte sein, dass die Royalties die gleiche Höhe haben wie umgekehrt die Royalties in Japan. Medarex hatte immer eher Deals im Singledigit Bereich (3-5%?)
3. Die Royalties im Rest der Welt (vor allem EU). Diese wurden später ausgehandelt. Es würde mich schon wundern, wenn sie nicht signifikant höher wären. Meine Schätzung wären hier 10%.
Ono hat eine Marktkapitalisierung von ca. 8 Milliarden, Umsatz von 1,5 Milliarden und einen Gewinn von 340 Mio.
Grob und zugegeben optimistisch geschätzt (!) könnte Ono:
1. Bei annähernd 1 Milliarde Umsatz (in der Spitze) in Asien und einer angenommen recht hohen Gewinnmarge der heutige Gewinn (340 Mio) nochmals erzielt werden.
2. Wenn man von 2 Milliarden Umsatz in den USA ausgeht, könnten hier Royalties von 60-100 Mio an Ono fließen.
3. Wenn man im Rest der Welt weitere 2 Milliarden Umsatz bei höherer prozentualer Beteiligung annimmt, wären das 200 Mio Royalties.
Insgesamt könnte Ono durch Nivolumab also den Umsatz verdoppeln und den Gewinn vervierfachen, wenn man annimmt, dass der Rest stabil bleibt.
SG kmastra
Antwort auf Beitrag Nr.: 46.051.012 von kmastra am 14.12.13 18:19:44Hallo kmastra,
Du hast recht, dass von den Royalties im allgemeinen nicht viel bekannt ist (ich wusste es ja auch nicht), aber es war immer öffentlich.
Aus einem alten SEC-File von Medarex:
"We have the right to develop and commercialize in North America, and Ono has the right to develop and commercialize outside of North America, in each case subject to payment of a royalty to the other party on sales in such territories, should commercialization occur."
Ich würde eigentlich nicht davon ausgehen, dass die Royalties in Europa andere sind, als in USA oder Asien. Ich würde davon ausgehen, dass die überall gleich hoch sind und auf dem üblichen Medarex-Level von 2 bis 3% lagen (5 eher nicht, denke ich).
Für Nivolumab gehe ich langfristig von 5 Mrd. + X Umsatz aus. Royalties neutralisieren sich mit den asiatischen Umsätzen, so dass - wenn man Deine Milliarde unterstellt - Royalties von 3% von 4 Mrd. von BMS an ONO fließen würden. Das wären dann 120 Mio. Dollar.
Es könnte sein, dass Nivolumab bereits voll eingepreist ist. Orencia und Kyprolis dürften natürlich noch einiges bringen... Schwierig...
Na gut, von meiner Seite aus war es das, sonst überfrachten wir den Thread damit wohl etwas.
Gruß
SLG
Du hast recht, dass von den Royalties im allgemeinen nicht viel bekannt ist (ich wusste es ja auch nicht), aber es war immer öffentlich.
Aus einem alten SEC-File von Medarex:
"We have the right to develop and commercialize in North America, and Ono has the right to develop and commercialize outside of North America, in each case subject to payment of a royalty to the other party on sales in such territories, should commercialization occur."
Ich würde eigentlich nicht davon ausgehen, dass die Royalties in Europa andere sind, als in USA oder Asien. Ich würde davon ausgehen, dass die überall gleich hoch sind und auf dem üblichen Medarex-Level von 2 bis 3% lagen (5 eher nicht, denke ich).
Für Nivolumab gehe ich langfristig von 5 Mrd. + X Umsatz aus. Royalties neutralisieren sich mit den asiatischen Umsätzen, so dass - wenn man Deine Milliarde unterstellt - Royalties von 3% von 4 Mrd. von BMS an ONO fließen würden. Das wären dann 120 Mio. Dollar.
Es könnte sein, dass Nivolumab bereits voll eingepreist ist. Orencia und Kyprolis dürften natürlich noch einiges bringen... Schwierig...
Na gut, von meiner Seite aus war es das, sonst überfrachten wir den Thread damit wohl etwas.
Gruß
SLG
Antwort auf Beitrag Nr.: 46.051.506 von SLGramann am 14.12.13 21:45:52"Royalties neutralisieren sich mit den asiatischen Umsätzen, so dass - wenn man Deine Milliarde unterstellt - Royalties von 3% von 4 Mrd. von BMS an ONO fließen würden. Das wären dann 120 Mio. Dollar."
Ist natürlich Schwachsinn. Wenn es insgesamt 5 Mrd. Umsatz gäbe und davon 1 Mrd. in Asien neutralisieren sich insgesamt 2 Mrd. Dollar gegenseitig. ONO bekäme also netto nur bspw. 3% auf 3 Mrd. = 90 Mio.
Ist natürlich Schwachsinn. Wenn es insgesamt 5 Mrd. Umsatz gäbe und davon 1 Mrd. in Asien neutralisieren sich insgesamt 2 Mrd. Dollar gegenseitig. ONO bekäme also netto nur bspw. 3% auf 3 Mrd. = 90 Mio.
Antwort auf Beitrag Nr.: 46.051.830 von SLGramann am 15.12.13 07:47:40Ich würde eigentlich nicht davon ausgehen, dass die Royalties in Europa andere sind, als in USA oder Asien. Ich würde davon ausgehen, dass die überall gleich hoch sind und auf dem üblichen Medarex-Level von 2 bis 3% lagen (5 eher nicht, denke ich).
Dann hätten sie sich definitiv übern Tisch ziehen lassen, weil die Rechte ja zu 100% bei ihnen lagen. Aber es ist schwierig, da konkret mit Zahlen zu rechnen, wenn man letztlich nichts Genaues weiß. Werde die IR nochmal fragen und ggf. einen eigenen Thread aufmachen...
Dann hätten sie sich definitiv übern Tisch ziehen lassen, weil die Rechte ja zu 100% bei ihnen lagen. Aber es ist schwierig, da konkret mit Zahlen zu rechnen, wenn man letztlich nichts Genaues weiß. Werde die IR nochmal fragen und ggf. einen eigenen Thread aufmachen...
ARQL:
Der Kursverfall geht immer weiter. Sie sind jetzt aus dem NBI geflogen:
NEW YORK, Dec. 16, 2013 (GLOBE NEWSWIRE) -- The NASDAQ OMX Group, Inc. (Nasdaq:NDAQ) today announced the results of the annual re-ranking of the NASDAQ Biotechnology Index (Nasdaq:NBI), which will become effective prior to market open on Monday, December 23, 2013.
...
As a result of the re-ranking, the following 16 securities will be removed from the Index: ArQule, Inc. (Nasdaq:ARQL)...
Die Frage ist, ob man hier zukaufen sollte. In einem Jahr haben wir die Ergebnisse des AKT- und des FGFR-Inhibitors.
Wäre nicht viel mehr als ein Zock, aber die Bewertung ist wirklich nicht mehr hoch.
Der Kursverfall geht immer weiter. Sie sind jetzt aus dem NBI geflogen:
NEW YORK, Dec. 16, 2013 (GLOBE NEWSWIRE) -- The NASDAQ OMX Group, Inc. (Nasdaq:NDAQ) today announced the results of the annual re-ranking of the NASDAQ Biotechnology Index (Nasdaq:NBI), which will become effective prior to market open on Monday, December 23, 2013.
...
As a result of the re-ranking, the following 16 securities will be removed from the Index: ArQule, Inc. (Nasdaq:ARQL)...
Die Frage ist, ob man hier zukaufen sollte. In einem Jahr haben wir die Ergebnisse des AKT- und des FGFR-Inhibitors.
Wäre nicht viel mehr als ein Zock, aber die Bewertung ist wirklich nicht mehr hoch.
Antwort auf Beitrag Nr.: 46.050.236 von kmastra am 14.12.13 13:57:18Hallo kmastra,
Hab vielen Dank für Dein Kommentar.
Die Übernahme von Correvio macht exakt den Sinn den Du beschrieben hast (die Vertriebswege von Aggrastt (Wirkstoff: Tirofiban) sollen ausgenutzt werden und zum Aggrastat hatte ich ja geschrieben, dass es wohl in ganz EU-Europa keine Klinik geben dürfte, an dem die Substanz die letzten Jahre nicht zur Anwendung gekommen wäre).
Einmal in seinem Börsenleben sollte man ein All-in riskieren, jedoch bin ich mit meinen 30% wirklich schon ganz gut dabei. Gedenke aber trotzdem noch ein paar hundert Stücke nachzukaufen. Wenn auch die KZ mit 30-40$ vielleicht doch übertrieben sein sollten, gehe ich trozdem von einem mindestes Verdoppler aus.
Aber nochmal vielen Dank.
Zur Biotech:
Opko ist die letzten Tage ganz schön unter die Räder gekommen, der Chef tätigt aber weiterhin Käufe: siehe s.a. Artikel dazu:
http://seekingalpha.com/article/1892711-opko-health-a-respon…
Denke, hier kann man mit einer kleinen Posi nicht viel falsch machen und durchaus auf einen Rebound von 20-30% hoffen. Da denke ich nur an Sarepta nach Sturz auf 12$ und schon stehen sie wieder bei knapp 20$ in nicht mal 4 Wo.
Gruss,
s.
Hab vielen Dank für Dein Kommentar.
Die Übernahme von Correvio macht exakt den Sinn den Du beschrieben hast (die Vertriebswege von Aggrastt (Wirkstoff: Tirofiban) sollen ausgenutzt werden und zum Aggrastat hatte ich ja geschrieben, dass es wohl in ganz EU-Europa keine Klinik geben dürfte, an dem die Substanz die letzten Jahre nicht zur Anwendung gekommen wäre).
Einmal in seinem Börsenleben sollte man ein All-in riskieren, jedoch bin ich mit meinen 30% wirklich schon ganz gut dabei. Gedenke aber trotzdem noch ein paar hundert Stücke nachzukaufen. Wenn auch die KZ mit 30-40$ vielleicht doch übertrieben sein sollten, gehe ich trozdem von einem mindestes Verdoppler aus.
Aber nochmal vielen Dank.
Zur Biotech:
Opko ist die letzten Tage ganz schön unter die Räder gekommen, der Chef tätigt aber weiterhin Käufe: siehe s.a. Artikel dazu:
http://seekingalpha.com/article/1892711-opko-health-a-respon…
Denke, hier kann man mit einer kleinen Posi nicht viel falsch machen und durchaus auf einen Rebound von 20-30% hoffen. Da denke ich nur an Sarepta nach Sturz auf 12$ und schon stehen sie wieder bei knapp 20$ in nicht mal 4 Wo.
Gruss,
s.
Hallo sufenta,
CRME hatte ich mal vor gefühlten 10 Jahren im Depot... seitdem habe ich sie nicht mehr so verfolgt. Warum bist du denn so überzeugt von denen? Wenn der Kurs im Keller ist und das Potential riesig sein soll, sollte man besser mehrfach prüfen, ob etwas nicht stimmt! Warum sollten alle anderen das Potential übersehen? Wahrscheinlicher ist es, dass es doch irgendwo einen Haken gibt.
Vernakalant ist ja schon lange in der Entwicklung... damals habe ich es immer so verstanden, dass die orale Version die entscheidende ist. In Europa ist die IV-Version also zugelassen... was heißt das, welche Umsätze könnten damit erzielt werden?
Vielleicht liege ich damit falsch, aber im Allgemeinen schätze ich Entwicklungen gegen Herzerkrankungen immer als umfangreich und kostenintensiv, so dass Pharmas beteiligt sein sollten... oder kann dies ein kleiner Biotech wie CRME auch alleine stemmen? Bis sie ausgestiegen sind, hat Merck die Entwicklung vorangetrieben. Vor dem Ausstieg gab es bereits die IV-Zulassung in Europa und dann den Entwicklungsstopp der oralen Version. Danach hat die FDA noch die PIII der IV-Version in den USA auf hold gesetzt. In 2008 hat die FDA bereits der IV-Version die Zulassung verweigert.
Dies scheint nun der Stand zu sein, oder? Es ist unklar, ob und wie die orale Version weiterentwickelt wird (CRME müsste eine PIII beginnen). Die PIII der IV-Version ist in den USA gestoppt... es ist offen ob und wie diese weitergeführt werden kann. Dafür ist die IV-Version in Europa zugelassen. Aber was für Umsätze sind hier zu erwarten?
Im letzten Quartal (3Q13) lag der Umsatz wohl bei ca. 0,5 Mio USD... im September 2010 erfolgte die Zulassung. D.h. 3 Jahre nach Zulassung lag im letzten Quartal der Umsatz immer noch unter 1 Mio USD. Das klingt für mich nicht nach einem Erfolg. Welche Peak Sales siehst du denn hier in Europa für die IV-Version? Alles andere (IV-Version in den USA oder orale Version) scheint sehr unsicher zu sein und noch viele Jahre Entwicklung zu benötigen.
Das heißt nicht, dass der Kurs sich nicht auch positiv entwickeln kann... aber ich denke, das ist der Grund, warum die Bewertung momentan so tief ist.
Gruß
ipollit
CRME hatte ich mal vor gefühlten 10 Jahren im Depot... seitdem habe ich sie nicht mehr so verfolgt. Warum bist du denn so überzeugt von denen? Wenn der Kurs im Keller ist und das Potential riesig sein soll, sollte man besser mehrfach prüfen, ob etwas nicht stimmt! Warum sollten alle anderen das Potential übersehen? Wahrscheinlicher ist es, dass es doch irgendwo einen Haken gibt.
Vernakalant ist ja schon lange in der Entwicklung... damals habe ich es immer so verstanden, dass die orale Version die entscheidende ist. In Europa ist die IV-Version also zugelassen... was heißt das, welche Umsätze könnten damit erzielt werden?
Vielleicht liege ich damit falsch, aber im Allgemeinen schätze ich Entwicklungen gegen Herzerkrankungen immer als umfangreich und kostenintensiv, so dass Pharmas beteiligt sein sollten... oder kann dies ein kleiner Biotech wie CRME auch alleine stemmen? Bis sie ausgestiegen sind, hat Merck die Entwicklung vorangetrieben. Vor dem Ausstieg gab es bereits die IV-Zulassung in Europa und dann den Entwicklungsstopp der oralen Version. Danach hat die FDA noch die PIII der IV-Version in den USA auf hold gesetzt. In 2008 hat die FDA bereits der IV-Version die Zulassung verweigert.
Dies scheint nun der Stand zu sein, oder? Es ist unklar, ob und wie die orale Version weiterentwickelt wird (CRME müsste eine PIII beginnen). Die PIII der IV-Version ist in den USA gestoppt... es ist offen ob und wie diese weitergeführt werden kann. Dafür ist die IV-Version in Europa zugelassen. Aber was für Umsätze sind hier zu erwarten?
Im letzten Quartal (3Q13) lag der Umsatz wohl bei ca. 0,5 Mio USD... im September 2010 erfolgte die Zulassung. D.h. 3 Jahre nach Zulassung lag im letzten Quartal der Umsatz immer noch unter 1 Mio USD. Das klingt für mich nicht nach einem Erfolg. Welche Peak Sales siehst du denn hier in Europa für die IV-Version? Alles andere (IV-Version in den USA oder orale Version) scheint sehr unsicher zu sein und noch viele Jahre Entwicklung zu benötigen.
Das heißt nicht, dass der Kurs sich nicht auch positiv entwickeln kann... aber ich denke, das ist der Grund, warum die Bewertung momentan so tief ist.
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.059.886 von sufenta am 16.12.13 19:29:55"Einmal in seinem Börsenleben sollte man ein All-in riskieren"
...davon kann ich nur abraten, wenn du unter All-in alles auf eine Aktie verstehst!!!
Ich habe in 2007 viel auf GPC gesetzt, weil die PIII zu Satraplatin doch erfolgreich war, bis die FDA die Daten einfach nicht anerkannt hat. Man sollte immer etwas völlig unerwartetes mit einkalkulieren... am besten direkt den Totalverlust in einer Aktie, auch wenn es momentan blendend aussieht. Wenn du 50% verlierst, was ja nicht ungewöhnlich ist, musst du danach schon dein Kapital verdoppeln, um dies wieder auszugleichen... bei 80% verfünffachen usw. Das dürfte nicht so einfach werden, wenn es schief geht, es sei denn, du kannst dein Investment auch einfach so abschreiben.
Gruß
ipollit
...davon kann ich nur abraten, wenn du unter All-in alles auf eine Aktie verstehst!!!
Ich habe in 2007 viel auf GPC gesetzt, weil die PIII zu Satraplatin doch erfolgreich war, bis die FDA die Daten einfach nicht anerkannt hat. Man sollte immer etwas völlig unerwartetes mit einkalkulieren... am besten direkt den Totalverlust in einer Aktie, auch wenn es momentan blendend aussieht. Wenn du 50% verlierst, was ja nicht ungewöhnlich ist, musst du danach schon dein Kapital verdoppeln, um dies wieder auszugleichen... bei 80% verfünffachen usw. Das dürfte nicht so einfach werden, wenn es schief geht, es sei denn, du kannst dein Investment auch einfach so abschreiben.
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.002.252 von ipollit am 07.12.13 14:40:42Ein paar Kommentare zur Immuno-Onkologie... CLDX, INCY, MGNX, IPH.PA, CGEN

...

Gruß
ipollit

...

Gruß
ipollit
Bis zum Oktober sah es noch ganz gut aus... seitdem ist mein Depot ein wenig zurückgefallen gegenüber dem NBI, so dass am Ende die Entwicklung nur durchschnittlich ist, wobei der NBI selber sich dieses Jahr ja nicht gerade schlecht entwickelt hat 
Damit starte ich wohl so ins neue Jahr:
(Depotanteil, Abstand vom 52W-Hoch, Marktkapitalisierung in Mio USD)
11,8%___CLDX____-40%____1.890
9,8%____INCY_____-5%____8.010
9,6%____PCYC____-27%____7.740
6,2%____ARRY____-34%____578
5,2%____REGN____-13%____27.210
5,0%____EXEL_____-3%____1.090
4,8%____GEN.CO__-16%____2.053
4,3%____ISIS_____-6%____4.660
4,2%____CBST_____-7%____4.990
4,0%____CLVS____-32%____1.770
3,7%____SNTA____-59%____340
3,5%____ALNY_____-4%____4.130
3,0%____INFI____-75%____603
2,9%____ENTA____-27%____504
2,7%____ARQL____-34%____132
2,2%____XLRN_____-5%____990
2,1%____SGEN____-19%____4.890
1,9%____CRIS____-41%____241
1,7%____IMMU____-44%____343
1,7%____VSTM____-38%____300
1,7%____IPH.PA__-17%____309
1,7%____MGNX____-12%____670
1,5%____AMBI____-56%____170
1,5%____STML____-60%____242
1,3%____KBIO____-48%____140
1,1%____ARIA____-71%____1.230
0,9%____AVEO____-82%____83
Interessant finde ich noch MDVN und GERN... OMER und AERI schaue ich mir auch nochmal genauer an. MDVNs Xtandi könnte noch weiteres Umsatz-Potential bieten, während die MK von 5 Mrd USD dann noch moderat wäre. GERN ist vielleicht eine Ergänzung zu INCY (MDS), OMER und AERI vielleicht erfolgreich im Bereich der Augenerkrankungen, die, wie man an REGN sehen kann, ein interessantes Feld sind.
Gruß
ipollit

Damit starte ich wohl so ins neue Jahr:
(Depotanteil, Abstand vom 52W-Hoch, Marktkapitalisierung in Mio USD)
11,8%___CLDX____-40%____1.890
9,8%____INCY_____-5%____8.010
9,6%____PCYC____-27%____7.740
6,2%____ARRY____-34%____578
5,2%____REGN____-13%____27.210
5,0%____EXEL_____-3%____1.090
4,8%____GEN.CO__-16%____2.053
4,3%____ISIS_____-6%____4.660
4,2%____CBST_____-7%____4.990
4,0%____CLVS____-32%____1.770
3,7%____SNTA____-59%____340
3,5%____ALNY_____-4%____4.130
3,0%____INFI____-75%____603
2,9%____ENTA____-27%____504
2,7%____ARQL____-34%____132
2,2%____XLRN_____-5%____990
2,1%____SGEN____-19%____4.890
1,9%____CRIS____-41%____241
1,7%____IMMU____-44%____343
1,7%____VSTM____-38%____300
1,7%____IPH.PA__-17%____309
1,7%____MGNX____-12%____670
1,5%____AMBI____-56%____170
1,5%____STML____-60%____242
1,3%____KBIO____-48%____140
1,1%____ARIA____-71%____1.230
0,9%____AVEO____-82%____83
Interessant finde ich noch MDVN und GERN... OMER und AERI schaue ich mir auch nochmal genauer an. MDVNs Xtandi könnte noch weiteres Umsatz-Potential bieten, während die MK von 5 Mrd USD dann noch moderat wäre. GERN ist vielleicht eine Ergänzung zu INCY (MDS), OMER und AERI vielleicht erfolgreich im Bereich der Augenerkrankungen, die, wie man an REGN sehen kann, ein interessantes Feld sind.
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.126.969 von ipollit am 29.12.13 19:59:17Ich gehe mit dem folgenden Depot in das Jahr 2014:
(ungefähre Prozentangaben habe ich nur bei den Positionen gemacht, die von der Gewichtung her deutlich nach oben oder unten abweichen)
Ambit (AMBI)
Arqule (ARQL) 1%
Array (ARRY) 15%
Bluebird (BLUE) 2%
Celldex (CLDX) 10%
Clovis (CLVS)
Esperion (ESPR) 1%
Galapagos (GLPG)
Genmab (GEN) 20%
Immunogen (IMGN)
Infinity (INFI)
Macrogenics (MGNX)
Morphosys (MOR)
Stemline (STML)
Einige subjektive Anmerkungen:
Array: Die Enttäuschung des Jahres 2013. Der Markt akzeptiert 520 nicht als werthaltiges Asset. 614 scheint ohnehin ein Flop zu sein. Insofern hängt es jetzt an der Partnerpipeline, aus der Ende 2014 die ersten zulassungsrelevanten Daten kommen werden (MEK162). Zu erhoffen ist die Verpartnerung des Asthma-Programms. Insgesamt denke ich, dass die Partnerpipe sehr werthaltig ist.
Celldex: Sie haben eine ganze Reihe von hochspannenden Projekten, teilweise in fortgeschrittenem Stadium: CDX-110, CDX-011, CDX-1127, CDX-1135. Und alle Rechte liegen noch immer bei Celldex. Ich würde es gerne sehen, wenn man bald CDX-1127 mit Bristol Meyers verpartnern würde. Das dort vielleicht vorhandene Potential könnte dann optimal gehoben werden.
Clovis: Noch etwas weit weg vom Markt mit seinen Programmen. Wenn wir 18 Monate weiter wären und noch immer diesen Kurs hätten, würde ich meine Position stark ausweiten.
Galapagos: Kommen mir mit der IIb ihres Jak1-Programms etwas überfordert vor. Sie schaffen es in 2013 nicht mal das dafür vorgesehene Geld auszugeben. Ich gehe davon aus, dass sie ihre zeitlichen Vorgaben deutlich verfehlen werden.
Genmab: Sind auf Kurs. Ich hatte allerdings mit mehr Dara-Trials in 2013 gerechnet. Ich denke aber, Janssen werden da nächstes Jahr noch einiges anschieben. Zusehen und freuen.
Ich frage mich, ob wir 2014 wieder so eine Chance wie Onyx in 2013 sehen werden. Exzellentes Chance-/Risikoverhältnis. Da lag das Geld ja quasi auf der Straße. Clovis könnte vielleicht mal so etwas werden, aber eben nicht 2014 und wer weiß, wie sich die Bewertung entwickelt.
(ungefähre Prozentangaben habe ich nur bei den Positionen gemacht, die von der Gewichtung her deutlich nach oben oder unten abweichen)
Ambit (AMBI)
Arqule (ARQL) 1%
Array (ARRY) 15%
Bluebird (BLUE) 2%
Celldex (CLDX) 10%
Clovis (CLVS)
Esperion (ESPR) 1%
Galapagos (GLPG)
Genmab (GEN) 20%
Immunogen (IMGN)
Infinity (INFI)
Macrogenics (MGNX)
Morphosys (MOR)
Stemline (STML)
Einige subjektive Anmerkungen:
Array: Die Enttäuschung des Jahres 2013. Der Markt akzeptiert 520 nicht als werthaltiges Asset. 614 scheint ohnehin ein Flop zu sein. Insofern hängt es jetzt an der Partnerpipeline, aus der Ende 2014 die ersten zulassungsrelevanten Daten kommen werden (MEK162). Zu erhoffen ist die Verpartnerung des Asthma-Programms. Insgesamt denke ich, dass die Partnerpipe sehr werthaltig ist.
Celldex: Sie haben eine ganze Reihe von hochspannenden Projekten, teilweise in fortgeschrittenem Stadium: CDX-110, CDX-011, CDX-1127, CDX-1135. Und alle Rechte liegen noch immer bei Celldex. Ich würde es gerne sehen, wenn man bald CDX-1127 mit Bristol Meyers verpartnern würde. Das dort vielleicht vorhandene Potential könnte dann optimal gehoben werden.
Clovis: Noch etwas weit weg vom Markt mit seinen Programmen. Wenn wir 18 Monate weiter wären und noch immer diesen Kurs hätten, würde ich meine Position stark ausweiten.
Galapagos: Kommen mir mit der IIb ihres Jak1-Programms etwas überfordert vor. Sie schaffen es in 2013 nicht mal das dafür vorgesehene Geld auszugeben. Ich gehe davon aus, dass sie ihre zeitlichen Vorgaben deutlich verfehlen werden.
Genmab: Sind auf Kurs. Ich hatte allerdings mit mehr Dara-Trials in 2013 gerechnet. Ich denke aber, Janssen werden da nächstes Jahr noch einiges anschieben. Zusehen und freuen.
Ich frage mich, ob wir 2014 wieder so eine Chance wie Onyx in 2013 sehen werden. Exzellentes Chance-/Risikoverhältnis. Da lag das Geld ja quasi auf der Straße. Clovis könnte vielleicht mal so etwas werden, aber eben nicht 2014 und wer weiß, wie sich die Bewertung entwickelt.
hallo ipollit und SLGramann,
habe mal die Zusammensetzung der Depots für 2014 studiert und verglichen.
Besonders bei ipollit ist das eine echte Fleissarbeit, die vielen Werte regelmässig zu verfolgen, um seine Anlageentscheidung zu kontrollieren.
Besonders auffallend ist, daß die Depots fast ausschließlich aus Krebsforschenden Unternehmen besteht.
Gibt es Gründe, warum 2014 alles darauf platziert wird?
Seit vielen Jahren werden Unsummen in die Krebsforschung gesteckt, nicht nur von Aktionären, sondern auch von privaten und öffentlichen Institutionen, alles mit sehr begrenzten Erfolgen. In der Praxis wird operiert und bestrahlt oder die sinnlose, weil nicht lebensverlängernde Chemotherapie eingesetzt. Von Medikamenten hört man wenig und wenn, sind sie meistens im Versuchsstadium.
Und 2014 soll alles plötzlich anders sein?!
Ich habe jedenfalls nicht den Mut, mein ganzes Kapital in dieses Thema zu stecken. Das wäre ja so, als ob ich nur in Maschinenbau oder nur in Versicherungen investieren würde. Die Banker nennen das "Klumpenrisiko". Ich habe in meinem Biotechdepot nur einen einzigen Wert, der sich auf Krebs konzentriert (Galena).
ARRY hat ja in 2013 eine miserable Performance hingelegt. Ihr seid beide stark investiert. Was erwartet ihr in 2014? Soll man ARRY jetzt kaufen?
habe mal die Zusammensetzung der Depots für 2014 studiert und verglichen.
Besonders bei ipollit ist das eine echte Fleissarbeit, die vielen Werte regelmässig zu verfolgen, um seine Anlageentscheidung zu kontrollieren.
Besonders auffallend ist, daß die Depots fast ausschließlich aus Krebsforschenden Unternehmen besteht.
Gibt es Gründe, warum 2014 alles darauf platziert wird?
Seit vielen Jahren werden Unsummen in die Krebsforschung gesteckt, nicht nur von Aktionären, sondern auch von privaten und öffentlichen Institutionen, alles mit sehr begrenzten Erfolgen. In der Praxis wird operiert und bestrahlt oder die sinnlose, weil nicht lebensverlängernde Chemotherapie eingesetzt. Von Medikamenten hört man wenig und wenn, sind sie meistens im Versuchsstadium.
Und 2014 soll alles plötzlich anders sein?!
Ich habe jedenfalls nicht den Mut, mein ganzes Kapital in dieses Thema zu stecken. Das wäre ja so, als ob ich nur in Maschinenbau oder nur in Versicherungen investieren würde. Die Banker nennen das "Klumpenrisiko". Ich habe in meinem Biotechdepot nur einen einzigen Wert, der sich auf Krebs konzentriert (Galena).
ARRY hat ja in 2013 eine miserable Performance hingelegt. Ihr seid beide stark investiert. Was erwartet ihr in 2014? Soll man ARRY jetzt kaufen?
Antwort auf Beitrag Nr.: 46.134.029 von ollihat am 31.12.13 09:47:49Hallo
Biotech ist so oder so immer etwas Glückspiel.
Mit Fleiß und guten Infos kann man vielleicht etwas gutmachen.
Selbst im Krebsbereich kann man sich noch spezialisieren und nur auf
z.B. auf Immuntherapie setzen.
Da hatte ich IMUC (inzwischen verkauft mit Verlust), da ging NWBO natürlich gleich auch mit nach unten, es gab aber gestern einen tollen Bericht bei der BBC in England. NBWO halte ich weiter, das Risiko und die Chancen sind natürlich hoch.
Galena habe ich auch, als größte Position, Grund, ein Phase III Produkt mit großem Marktvolumen und ein zugekauftes Medikament (Abstral) das Umsatzmäßig überraschen könnte und meiner Meinung nach auch wird und die Marktkapitalisierung von 500 Mio. $ locker allein rechtfertigen kann.
Auf Arriad setze ich auch noch, aber im Gegensatz zu den anderen wohl nur kurzfristig.
Uninterresant und überbewertet finde ich z.B. Geron.
Stammzellforschung wurde abgestossen und somit die Firma null Wert,
und plötzlich 600 Mi. $ wert, wegen einem Phase II Produkt und soweit ich weiß auch noch mit nem Haufen Schulden.
Lasse mich aber gerne eines besseren belehren.
Biotech ist so oder so immer etwas Glückspiel.
Mit Fleiß und guten Infos kann man vielleicht etwas gutmachen.
Selbst im Krebsbereich kann man sich noch spezialisieren und nur auf
z.B. auf Immuntherapie setzen.
Da hatte ich IMUC (inzwischen verkauft mit Verlust), da ging NWBO natürlich gleich auch mit nach unten, es gab aber gestern einen tollen Bericht bei der BBC in England. NBWO halte ich weiter, das Risiko und die Chancen sind natürlich hoch.
Galena habe ich auch, als größte Position, Grund, ein Phase III Produkt mit großem Marktvolumen und ein zugekauftes Medikament (Abstral) das Umsatzmäßig überraschen könnte und meiner Meinung nach auch wird und die Marktkapitalisierung von 500 Mio. $ locker allein rechtfertigen kann.
Auf Arriad setze ich auch noch, aber im Gegensatz zu den anderen wohl nur kurzfristig.
Uninterresant und überbewertet finde ich z.B. Geron.
Stammzellforschung wurde abgestossen und somit die Firma null Wert,
und plötzlich 600 Mi. $ wert, wegen einem Phase II Produkt und soweit ich weiß auch noch mit nem Haufen Schulden.
Lasse mich aber gerne eines besseren belehren.
Antwort auf Beitrag Nr.: 46.134.029 von ollihat am 31.12.13 09:47:49hallo ollihat,
Klumpenrisiko ist richtig, wenn man das an einer Branche festmachen will. Ich gehe dieses Risiko aber bewusst ein, weil für mich die Vorteile bei Biotech-Investments überwiegen. Ein Vorteil ist, dass Biotechs weitgehend konjunkturunabhängig funktionieren. Zwar kann die Kursentwicklung kurzfristig extrem volatil sein, aber mittelfristig ist nicht die Frage entscheidend, wie schnell die gesamte Wirtschaft wächst, sondern ob Wirkstoff X oder Y funktioniert. Das gefällt mir. Weiterhin gefällt mir der "Moat", den ein Wirkstoff aufgrund des Patentrechts hat.
Wirtschaftlich ist die Branche bedeutend. Nach den mir bekannten Zahlen werden mit biotechnologischen Wirkstoffen weltweit ungefähr 130 Milliarden Dollar Umsatz generiert, davon etwa die Hälfte mit Antikörpern.
Die Masse des Umsatzes stammt aus den Bereichen Autoimmunerkrankungen und Krebs.
Bei der Krebsbehandlung gibt es definitiv Fortschritte. Insbesondere bei vielen Blutkrebsarten haben wir aufgrund von Medikamenten mehrere Jahre (qualitativ gute oder erträgliche) Lebenszeit für die Patienten gewonnen. Trotzdem stehen wir noch ganz am Anfang des Weges, das ist richtig.
Die Welle rollt seit den 2000er Jahren. Gerade in den letzten Jahren gibt es viele neue und spannende technologische Entwicklungen, so dass die Biotech-Brache insgesamt Fahrt aufnimmt.
2014 wird wohl kein besonderes Jahr werden, sondern vielleicht sogar eher langweilig, wenn man es mit den letzten drei, vier Jahren vergleicht. Die spannenste Entwicklung, die PD-1-Antikörper, wird von Big Pharma geprägt.
Array: Ich glaube an die Partnerpipeline, vor allem an die MEK-Inhibitoren, die von Ende 2014 an hoffentlich ihren Wert offen legen werden. Trotzdem muss Array mit den dann hoffentlich fließenden Royalties etwas vernünftiges anfangen und hier stellen sich hinsichtlich der eigenen Pipeline eben Fragen.
Empfehlungen in dem Sinne würde ich eh keine geben wollen.
Klumpenrisiko ist richtig, wenn man das an einer Branche festmachen will. Ich gehe dieses Risiko aber bewusst ein, weil für mich die Vorteile bei Biotech-Investments überwiegen. Ein Vorteil ist, dass Biotechs weitgehend konjunkturunabhängig funktionieren. Zwar kann die Kursentwicklung kurzfristig extrem volatil sein, aber mittelfristig ist nicht die Frage entscheidend, wie schnell die gesamte Wirtschaft wächst, sondern ob Wirkstoff X oder Y funktioniert. Das gefällt mir. Weiterhin gefällt mir der "Moat", den ein Wirkstoff aufgrund des Patentrechts hat.
Wirtschaftlich ist die Branche bedeutend. Nach den mir bekannten Zahlen werden mit biotechnologischen Wirkstoffen weltweit ungefähr 130 Milliarden Dollar Umsatz generiert, davon etwa die Hälfte mit Antikörpern.
Die Masse des Umsatzes stammt aus den Bereichen Autoimmunerkrankungen und Krebs.
Bei der Krebsbehandlung gibt es definitiv Fortschritte. Insbesondere bei vielen Blutkrebsarten haben wir aufgrund von Medikamenten mehrere Jahre (qualitativ gute oder erträgliche) Lebenszeit für die Patienten gewonnen. Trotzdem stehen wir noch ganz am Anfang des Weges, das ist richtig.
Die Welle rollt seit den 2000er Jahren. Gerade in den letzten Jahren gibt es viele neue und spannende technologische Entwicklungen, so dass die Biotech-Brache insgesamt Fahrt aufnimmt.
2014 wird wohl kein besonderes Jahr werden, sondern vielleicht sogar eher langweilig, wenn man es mit den letzten drei, vier Jahren vergleicht. Die spannenste Entwicklung, die PD-1-Antikörper, wird von Big Pharma geprägt.
Array: Ich glaube an die Partnerpipeline, vor allem an die MEK-Inhibitoren, die von Ende 2014 an hoffentlich ihren Wert offen legen werden. Trotzdem muss Array mit den dann hoffentlich fließenden Royalties etwas vernünftiges anfangen und hier stellen sich hinsichtlich der eigenen Pipeline eben Fragen.
Empfehlungen in dem Sinne würde ich eh keine geben wollen.
Antwort auf Beitrag Nr.: 46.134.029 von ollihat am 31.12.13 09:47:49Hallo ollihat,
SLGramann hat es bereits sehr gut beschrieben.
Ich denke, der Bereich der Medizin ist einer der innovativsten, den es zurzeit gibt... soetwas wie Internet oder IT, die ja im letzten Jahrzehnt einige der größten Unternehmen der Welt hervorgebracht haben. Krankheiten, die weit verbreitet und nicht unmittelbar gravierend sind, wie z.B. Herzerkrankungen, benötigen meistens große, sehr aufwendige Studien, um die Effekte eines Medikaments erfassen zu können. Meistens gibt es schon zahlreiche wirksame Mittel, so dass es insgesamt nicht leicht ist, eine Verbesserung zu belegen. Das ist eher das Gebiet der großen Pharma-Unternehmen. Medikemante gegen seltene Erkrankungen oder Erkrankungen, die sehr schwer sind, können dagegen auch von kleineren Unternehmen alleine entwickelt werden. Teilweise reicht es bereits aus, einen positiven Effekt bei wenigen, sehr schwer erkrankten Patienten, für die es keine Alternativen gibt, zu belegen, um eine Marktzulassung zu erhalten. Das macht den Bereich Krebs besonders interessant.
Einzelne Krebsmedikamente können schon beachtliche Erfolge vorweisen. Vor der Zulassung von Gleevec starben Menschen, die an der seltenen Blutkrebsart CML litten, recht schnell. Dabei kommt es meistens zu einer speziellen Mutation, die ein unnatürliches Protein BCR-ABL produziert, das den Krebs auslöst, indem es unkontrolliert die Zellvermehrung aktiviert. Gleevec blockiert dieses Signal. Man muss zwar wegen der Mutation dauerhaft diesen Wirkstoff nehmen, hat dann aber eine normale Lebenserwartung.
So einfach ist es leider nicht immer, dass man für eine Krebsart eine auslösende Mutation findet, deren Auswirkungen behebt und der Krebs verschwindet. So gibt es z.B. hunderte verschiedene Mutationen bei Lungenkrebs, von denen man nur einen Teil bisher kennt. Oft kommen auch mehrere zusammen. Das ganze wird jedenfalls recht schnell kompliziert. Z.B. bilden Lungenkrebszellen vermehrt EGFR-Rezeptoren, um das Zellwachstum anzuregen. Daher wirken EGFR-Hemmern bei einem Teil der Patienten, das Zellwachstum wird gestoppt, der Tumor schrumpft. Allerdings werden die EGFR-Signale auch von anderen gesunden Zellen gebraucht. Zwar bezeichnet man diese Therapien als sehr zielgerichtete "Target"-Therapien, doch heißt das nicht, dass nicht auch sehr gravierende Nebenwirkungen auftreten, indem z.B. normale gesunde Zellen auch gestört werden. So führen EGFR-Hemmer meistens zu schwerem Hautausschlag, indem die Hautzellen beeinflusst werden. Zudem mutieren die Krebszellen durch die permanente Teilung selber ständig. Wie bei der Evolution kommt es zu einer Anpassung. Durch weitere Mutationen können die Medikamente ihre Wirkung verlieren und der Signalweg ist nicht länger blockiert. So entsteht bei EGFR-Hemmung z.B. mit der Zeit eine spezielle T790M Mutation und der Krebs kann wieder unkontrolliert wachsen. Z.B. Clovis entwickelt zurzeit einen EGFR-Hemmer, der weniger den natürlichen EGFR-Signalweg hemmen soll, dafür aber diese mutierten EGFR-Signale. Auch bei Gleveec kann es zu Mutationen in BCR-ABL kommen, wie z.B. T350I... dagegen soll z.B. Ariads Ponatinib wirken.

Die Zusammenhänge sind zwar kompliziert, man versteht sie aber immer besser. Am Krebswachstum sind viele Signalwege beteiligt. Es reicht oft nicht, einen Signalweg zu blockieren, weil es Alternativen gibt. So wird bei 70% des schwarzen Hautkrebs B-Raf überaktiv, das z.B. durch Zelboraf blockiert wird. Der Krebs verschwindet für einige Zeit fast völlig, kehrt dann aber wieder zurück, ohne dass Zelboraf noch eine Wirkung zeigt. Hier scheinen die Krebszellen einen alternativen Signalweg aktiviert zu haben. Kombiniert man nun einen B-Raf-Hemmer mit einem MEK-Hemmer, so schrumpft der Krebs wieder. D.h. oft müssen mehrere Medikamente kombiniert werden, um eine dauerhafte Wirkung zu erzielen. Zumindest besteht die Hoffnung, dass Krebszellen die richtigen Kombinationen nicht mehr umgehen können. Eine Theorie ist es, dass man mit Kombinationen Krebs nach und nach chronisch machen kann, wie z.B. HIV.
Eine Chemo ist an sich so schlecht nicht, denn sie beschädigt alle sich schnell teilenden Zellen. Ohne diese Zellen gibt es praktisch keinen Krebs, da er maximal sehr langsam wachsen könnte. Dabei können natürlich auch gesunde Zellen geschädigt werden, aber es sind relativ wenige im Vergleich zu den Krebszellen. Eine zweite Theorie ist, dass im Krebs auch sehr langsam wachsende Zellen existieren, die sogenannten Krebs-Stammzellen. Diese überstehen die Chemo unbeschadet und erzeugen danach neue sich schnell teilende Zellen. Daher versucht man Mittel zu finden, die gezielt diese Krebs-Stammzellen zerstören.
Das Immunsystem erkennt fehlerhafte Zellen und beseitigt diese. Das ist ein ganz natürlicher Vorgang, da laufend fehlerhafte Zellen auftreten. Wenn Krebs entsteht, funktioniert dieser Prozess nicht mehr richtig. Krebszellen schaffen es, sich quasi vor dem Immunsystem zu tarnen. Beispielsweise produzieren sie Stoffe wie PD-1, die Immunzellen deaktivieren. Blockiert man nun diese PD-1 Signale, so erkennen die Immunzellen wieder den Krebs und zerstören diesen. Das ist der immunologische Ansatz. Im letzten Jahr konnte man in den ersten größeren Studien zeigen, dass dadurch die Patienten nicht nur ein wenig länger leben, sondern bei einigen über viele Jahre der Krebs nicht mehr auftritt. Theoretisch ist sogar eine Heilung möglich, da das Immunsystem nicht auf eine bestimmte Krebs-Mutation beschränkt ist, auf die Target-Therapien basieren, sondern jede Krebszelle beseitigen kann.
Warum bist du denn in Galena investiert? Galena ist auf dem Gebiet der Krebsimmpfstoffe aktiv, die bisher wenig erfolgreich waren. Vielleicht werden diese Mittel nie funktionieren, zumindest ist es kein leichter Weg. Ich habe deshalb recht viele Werte, weil ich nicht einschätzen kann, welcher Wert floppen wird. Bisher erreiche ich dadurch aber auch nicht mehr als die Index-Entwicklung.
ARRY sehe ich neutral. Bei MEK-Hemmern scheinen sie ganz gut zu sein... die Partner AstraZeneca und Novartis haben hier zig Studien. MEK scheint ein bedeutenden Target zu sein, nach dem, was ich bisher gelesen habe, ist es aber auch schwer zu kombinieren, so dass die Entwicklung aufwendig ist. Am Ende erhält Array Royalties im Bereich von vielleicht 10-20%. Die eigenen Entwicklungen hängen etwas hinterher.
Die Partner-Pipeline könnte interessant sein. Da kann es immer Überraschungen geben. Z.B. hat ARRY das HER2-SM ARRY-380 mit ONTY verpartnert. Konkurrent Puma (PBYI) hat im Dezember positive PII-Daten für seinen HER2/EGFR-SM Neratinib gemeldet. Es ist das einzige Medikemant in der Pipeline von PBYI. Der Kurs ist aufgrund dieser PII-Daten um mehr als 100% gestiegen, die MK beträgt nun ca. 3 Mrd USD. Wenn ich Ohad Hammer richtig verstanden habe, ist ARRY-380 eigentlich interessanter, wenn auch in der Entwicklung etwas zurück. Die MK von ARRY ist 600 Mio USD, die von ONTY nur 120 Mio USD. Und das ist nur ein Projekt von ARRY.

Gruß
ipollit
SLGramann hat es bereits sehr gut beschrieben.
Ich denke, der Bereich der Medizin ist einer der innovativsten, den es zurzeit gibt... soetwas wie Internet oder IT, die ja im letzten Jahrzehnt einige der größten Unternehmen der Welt hervorgebracht haben. Krankheiten, die weit verbreitet und nicht unmittelbar gravierend sind, wie z.B. Herzerkrankungen, benötigen meistens große, sehr aufwendige Studien, um die Effekte eines Medikaments erfassen zu können. Meistens gibt es schon zahlreiche wirksame Mittel, so dass es insgesamt nicht leicht ist, eine Verbesserung zu belegen. Das ist eher das Gebiet der großen Pharma-Unternehmen. Medikemante gegen seltene Erkrankungen oder Erkrankungen, die sehr schwer sind, können dagegen auch von kleineren Unternehmen alleine entwickelt werden. Teilweise reicht es bereits aus, einen positiven Effekt bei wenigen, sehr schwer erkrankten Patienten, für die es keine Alternativen gibt, zu belegen, um eine Marktzulassung zu erhalten. Das macht den Bereich Krebs besonders interessant.
Einzelne Krebsmedikamente können schon beachtliche Erfolge vorweisen. Vor der Zulassung von Gleevec starben Menschen, die an der seltenen Blutkrebsart CML litten, recht schnell. Dabei kommt es meistens zu einer speziellen Mutation, die ein unnatürliches Protein BCR-ABL produziert, das den Krebs auslöst, indem es unkontrolliert die Zellvermehrung aktiviert. Gleevec blockiert dieses Signal. Man muss zwar wegen der Mutation dauerhaft diesen Wirkstoff nehmen, hat dann aber eine normale Lebenserwartung.
So einfach ist es leider nicht immer, dass man für eine Krebsart eine auslösende Mutation findet, deren Auswirkungen behebt und der Krebs verschwindet. So gibt es z.B. hunderte verschiedene Mutationen bei Lungenkrebs, von denen man nur einen Teil bisher kennt. Oft kommen auch mehrere zusammen. Das ganze wird jedenfalls recht schnell kompliziert. Z.B. bilden Lungenkrebszellen vermehrt EGFR-Rezeptoren, um das Zellwachstum anzuregen. Daher wirken EGFR-Hemmern bei einem Teil der Patienten, das Zellwachstum wird gestoppt, der Tumor schrumpft. Allerdings werden die EGFR-Signale auch von anderen gesunden Zellen gebraucht. Zwar bezeichnet man diese Therapien als sehr zielgerichtete "Target"-Therapien, doch heißt das nicht, dass nicht auch sehr gravierende Nebenwirkungen auftreten, indem z.B. normale gesunde Zellen auch gestört werden. So führen EGFR-Hemmer meistens zu schwerem Hautausschlag, indem die Hautzellen beeinflusst werden. Zudem mutieren die Krebszellen durch die permanente Teilung selber ständig. Wie bei der Evolution kommt es zu einer Anpassung. Durch weitere Mutationen können die Medikamente ihre Wirkung verlieren und der Signalweg ist nicht länger blockiert. So entsteht bei EGFR-Hemmung z.B. mit der Zeit eine spezielle T790M Mutation und der Krebs kann wieder unkontrolliert wachsen. Z.B. Clovis entwickelt zurzeit einen EGFR-Hemmer, der weniger den natürlichen EGFR-Signalweg hemmen soll, dafür aber diese mutierten EGFR-Signale. Auch bei Gleveec kann es zu Mutationen in BCR-ABL kommen, wie z.B. T350I... dagegen soll z.B. Ariads Ponatinib wirken.

Die Zusammenhänge sind zwar kompliziert, man versteht sie aber immer besser. Am Krebswachstum sind viele Signalwege beteiligt. Es reicht oft nicht, einen Signalweg zu blockieren, weil es Alternativen gibt. So wird bei 70% des schwarzen Hautkrebs B-Raf überaktiv, das z.B. durch Zelboraf blockiert wird. Der Krebs verschwindet für einige Zeit fast völlig, kehrt dann aber wieder zurück, ohne dass Zelboraf noch eine Wirkung zeigt. Hier scheinen die Krebszellen einen alternativen Signalweg aktiviert zu haben. Kombiniert man nun einen B-Raf-Hemmer mit einem MEK-Hemmer, so schrumpft der Krebs wieder. D.h. oft müssen mehrere Medikamente kombiniert werden, um eine dauerhafte Wirkung zu erzielen. Zumindest besteht die Hoffnung, dass Krebszellen die richtigen Kombinationen nicht mehr umgehen können. Eine Theorie ist es, dass man mit Kombinationen Krebs nach und nach chronisch machen kann, wie z.B. HIV.
Eine Chemo ist an sich so schlecht nicht, denn sie beschädigt alle sich schnell teilenden Zellen. Ohne diese Zellen gibt es praktisch keinen Krebs, da er maximal sehr langsam wachsen könnte. Dabei können natürlich auch gesunde Zellen geschädigt werden, aber es sind relativ wenige im Vergleich zu den Krebszellen. Eine zweite Theorie ist, dass im Krebs auch sehr langsam wachsende Zellen existieren, die sogenannten Krebs-Stammzellen. Diese überstehen die Chemo unbeschadet und erzeugen danach neue sich schnell teilende Zellen. Daher versucht man Mittel zu finden, die gezielt diese Krebs-Stammzellen zerstören.
Das Immunsystem erkennt fehlerhafte Zellen und beseitigt diese. Das ist ein ganz natürlicher Vorgang, da laufend fehlerhafte Zellen auftreten. Wenn Krebs entsteht, funktioniert dieser Prozess nicht mehr richtig. Krebszellen schaffen es, sich quasi vor dem Immunsystem zu tarnen. Beispielsweise produzieren sie Stoffe wie PD-1, die Immunzellen deaktivieren. Blockiert man nun diese PD-1 Signale, so erkennen die Immunzellen wieder den Krebs und zerstören diesen. Das ist der immunologische Ansatz. Im letzten Jahr konnte man in den ersten größeren Studien zeigen, dass dadurch die Patienten nicht nur ein wenig länger leben, sondern bei einigen über viele Jahre der Krebs nicht mehr auftritt. Theoretisch ist sogar eine Heilung möglich, da das Immunsystem nicht auf eine bestimmte Krebs-Mutation beschränkt ist, auf die Target-Therapien basieren, sondern jede Krebszelle beseitigen kann.
Warum bist du denn in Galena investiert? Galena ist auf dem Gebiet der Krebsimmpfstoffe aktiv, die bisher wenig erfolgreich waren. Vielleicht werden diese Mittel nie funktionieren, zumindest ist es kein leichter Weg. Ich habe deshalb recht viele Werte, weil ich nicht einschätzen kann, welcher Wert floppen wird. Bisher erreiche ich dadurch aber auch nicht mehr als die Index-Entwicklung.
ARRY sehe ich neutral. Bei MEK-Hemmern scheinen sie ganz gut zu sein... die Partner AstraZeneca und Novartis haben hier zig Studien. MEK scheint ein bedeutenden Target zu sein, nach dem, was ich bisher gelesen habe, ist es aber auch schwer zu kombinieren, so dass die Entwicklung aufwendig ist. Am Ende erhält Array Royalties im Bereich von vielleicht 10-20%. Die eigenen Entwicklungen hängen etwas hinterher.
Die Partner-Pipeline könnte interessant sein. Da kann es immer Überraschungen geben. Z.B. hat ARRY das HER2-SM ARRY-380 mit ONTY verpartnert. Konkurrent Puma (PBYI) hat im Dezember positive PII-Daten für seinen HER2/EGFR-SM Neratinib gemeldet. Es ist das einzige Medikemant in der Pipeline von PBYI. Der Kurs ist aufgrund dieser PII-Daten um mehr als 100% gestiegen, die MK beträgt nun ca. 3 Mrd USD. Wenn ich Ohad Hammer richtig verstanden habe, ist ARRY-380 eigentlich interessanter, wenn auch in der Entwicklung etwas zurück. Die MK von ARRY ist 600 Mio USD, die von ONTY nur 120 Mio USD. Und das ist nur ein Projekt von ARRY.
Gruß
ipollit
Hallo SLGramann und ipollit,
vielen Dank für die ausführlichen Antworten.
Ich habe verstanden, daß die extreme Fokussierung auf krebsforschende Unternehmen euere ganz persönliche Analagestrategie ist. Ich wünsche euch viel Erfolg damit.
Ich werde mich da aber nicht anschliessen. Ich bin immer noch der Meinung, daß Diversifizierung auf möglichst verschiedenartige Forschungsbereiche der bessere Weg ist.
Es ist nicht so, dass kleine Unternehmen nur bei der Krebsforschung chancenreich sein können, wie ipollit sagt. Da gibt es genügend Beispiele von erfolgreichen kleinen Unternehmen, die auf anderen Gebieten forschen (Urologie, Parkinson, Schmerztherapie, Grippe, Augenpräparate, Antibiotika usw.)
Warum ich Galena im Depot habe! Das hat nichts mit den Forschungszielen zu tun. Ich habe den Wert vor gut einem Jahr gekauft, weil mich die extrem hohen Tagesumsätze ohne große Kursbewegung fasziniert hatten, nach dem Motto, wo Rauch ist . . .
Der seitherige Kursverlauf hat mir recht gegeben.
Eine grundsätzlich kritische Anmerkung zur Anlage in krebsforschende Unternehmen möchte ich noch anfügen: Die Forschung ist extrem langwierig!
Ich hatte mal ein krebsforschendes kanadisches Unternehmen mit Namen Biomira. Man hatte zwar immer mal ein neues Forschungsergebnis, aber hauptsächlich verbrannte man Geld. Das Unternehmen wurde dann in die USA verlegt und nannte sich fortan Oncothyreon. Es gab dann eine gemeinsame Forschung mit Merck. Ich habe die Aktie ein paar Mal getradet mit mäßigem Ergebnis. Am Ende platzte die Zusammenarbeit wegen mangelnder Wirksamkeit des Medikaments. Der Aktienkurs fiel wie ein Stein und ich hatte einen saftigen Verlust, den ich dann (endlich ) auch realisierte.
Die Gefahr bei so langfristigen Entwicklungen ist immer, daß man sich emotional zu sehr engagiert, man fühlt sich quasi schon verheiratet mit der Aktie. Dabei vergißt man leicht, daß das angelegte Geld ja Rendite bringen muß.
In diesem Sinne ein gutes Jahr 2014!
vielen Dank für die ausführlichen Antworten.
Ich habe verstanden, daß die extreme Fokussierung auf krebsforschende Unternehmen euere ganz persönliche Analagestrategie ist. Ich wünsche euch viel Erfolg damit.
Ich werde mich da aber nicht anschliessen. Ich bin immer noch der Meinung, daß Diversifizierung auf möglichst verschiedenartige Forschungsbereiche der bessere Weg ist.
Es ist nicht so, dass kleine Unternehmen nur bei der Krebsforschung chancenreich sein können, wie ipollit sagt. Da gibt es genügend Beispiele von erfolgreichen kleinen Unternehmen, die auf anderen Gebieten forschen (Urologie, Parkinson, Schmerztherapie, Grippe, Augenpräparate, Antibiotika usw.)
Warum ich Galena im Depot habe! Das hat nichts mit den Forschungszielen zu tun. Ich habe den Wert vor gut einem Jahr gekauft, weil mich die extrem hohen Tagesumsätze ohne große Kursbewegung fasziniert hatten, nach dem Motto, wo Rauch ist . . .
Der seitherige Kursverlauf hat mir recht gegeben.
Eine grundsätzlich kritische Anmerkung zur Anlage in krebsforschende Unternehmen möchte ich noch anfügen: Die Forschung ist extrem langwierig!
Ich hatte mal ein krebsforschendes kanadisches Unternehmen mit Namen Biomira. Man hatte zwar immer mal ein neues Forschungsergebnis, aber hauptsächlich verbrannte man Geld. Das Unternehmen wurde dann in die USA verlegt und nannte sich fortan Oncothyreon. Es gab dann eine gemeinsame Forschung mit Merck. Ich habe die Aktie ein paar Mal getradet mit mäßigem Ergebnis. Am Ende platzte die Zusammenarbeit wegen mangelnder Wirksamkeit des Medikaments. Der Aktienkurs fiel wie ein Stein und ich hatte einen saftigen Verlust, den ich dann (endlich ) auch realisierte.
Die Gefahr bei so langfristigen Entwicklungen ist immer, daß man sich emotional zu sehr engagiert, man fühlt sich quasi schon verheiratet mit der Aktie. Dabei vergißt man leicht, daß das angelegte Geld ja Rendite bringen muß.
In diesem Sinne ein gutes Jahr 2014!
Ich wünsche allen hier im Forum ein glückliches und gesundes 2014 viel Erfolg im neuen Börsenjahr. Desweiteren vielen Dank für die interessanten Diskussionen, Informationen und Hinweise die ich hier erfahren durfte.
Meine Startposition fürs neue Jahr schaut so aus: CYTK, ACRX, SRPT, GWPH, PRAN, BCRX, TNXP. Das sind zugegeben etwas andere Werte als die hier üblicherweise diskutierten, was daran liegt, dass ich Firmen mit onkologischem Schwerpunkt meide, sondern innovative Firmen mit niedriger MK und mit Substanzen suche, die meiner persönlichen Meinung nach echten Bedarf treffen und Innovationen darstellen.. Etwas provokativ geworded glaube ich nicht daran, dass die Gesundheitssysteme der Welt langfristig für eine 3-wöchige Lebenszeitverlängerung wie bei Krebsbehandlungen 5- bis 6-stellige Summen pro Jahr bezahlen werden.
Good luck uns allen!
me_2
Meine Startposition fürs neue Jahr schaut so aus: CYTK, ACRX, SRPT, GWPH, PRAN, BCRX, TNXP. Das sind zugegeben etwas andere Werte als die hier üblicherweise diskutierten, was daran liegt, dass ich Firmen mit onkologischem Schwerpunkt meide, sondern innovative Firmen mit niedriger MK und mit Substanzen suche, die meiner persönlichen Meinung nach echten Bedarf treffen und Innovationen darstellen.. Etwas provokativ geworded glaube ich nicht daran, dass die Gesundheitssysteme der Welt langfristig für eine 3-wöchige Lebenszeitverlängerung wie bei Krebsbehandlungen 5- bis 6-stellige Summen pro Jahr bezahlen werden.
Good luck uns allen!
me_2
Guten Morgen in die Runde!
erstmal ein fettes kompliment@ die teilnehmern hier im Forum, habe selten so ein durchdachte & sauber geführte Board im W.O.'s heiligen hallen erleben/lesen dürfen, absolut spitze wie hier rechechiert & diskutiert wird (insbesondere users Ipollit,kmastra & SL Gramann...bitte weiter so in 2014 ) und wo wir dabei sind, Ich wünsche euch allen alles Gute und da sich im leben nicht alles nur um Geld handelt auch in allen anderen Lebenssituationen ein erfolgreiches & gesundes Handeln für 2014!
) und wo wir dabei sind, Ich wünsche euch allen alles Gute und da sich im leben nicht alles nur um Geld handelt auch in allen anderen Lebenssituationen ein erfolgreiches & gesundes Handeln für 2014!
Eure Meinungen zu Ariad Pharmaceuticals (895301)
http://www.comdirect.de/inf/aktien/detail/news_detail.html?I…
sowie CYTRX Corp (A1JYLF)
http://www.forbes.com/sites/tommeyer/2013/12/27/the-race-to-…
wurde mich bei Gelegenheit sehr interessieren, besten Dank vorab.
erstmal ein fettes kompliment@ die teilnehmern hier im Forum, habe selten so ein durchdachte & sauber geführte Board im W.O.'s heiligen hallen erleben/lesen dürfen, absolut spitze wie hier rechechiert & diskutiert wird (insbesondere users Ipollit,kmastra & SL Gramann...bitte weiter so in 2014
 ) und wo wir dabei sind, Ich wünsche euch allen alles Gute und da sich im leben nicht alles nur um Geld handelt auch in allen anderen Lebenssituationen ein erfolgreiches & gesundes Handeln für 2014!
) und wo wir dabei sind, Ich wünsche euch allen alles Gute und da sich im leben nicht alles nur um Geld handelt auch in allen anderen Lebenssituationen ein erfolgreiches & gesundes Handeln für 2014!Eure Meinungen zu Ariad Pharmaceuticals (895301)
http://www.comdirect.de/inf/aktien/detail/news_detail.html?I…
sowie CYTRX Corp (A1JYLF)
http://www.forbes.com/sites/tommeyer/2013/12/27/the-race-to-…
wurde mich bei Gelegenheit sehr interessieren, besten Dank vorab.
Hallo, auch von mir ein frohes Neues!
Mein Portfolio sieht momentan so aus:
groß
LGND
ENTA
ARRY
AMBI
FURX
Genmab
Morphosys
IMGN
RIGL
Paion
klein
Zu Array: Letztes Jahr hat Array immerhin +34% gemacht. Wenn mir das einer jedes Jahr garantieren würde... Aber klar hab ich mir mehr erhofft und es fühlt sich auch irgendwie anders an. Eine Übersicht der US-Werte: http://investorshub.advfn.com/boards/read_msg.aspx?message_i…" target="_blank" rel="nofollow ugc noopener">http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Aber klar hab ich mir mehr erhofft und es fühlt sich auch irgendwie anders an. Eine Übersicht der US-Werte: http://investorshub.advfn.com/boards/read_msg.aspx?message_i…" target="_blank" rel="nofollow ugc noopener">http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Vielen Dank für die Infos in diesem Bord!
SG kmastra
Mein Portfolio sieht momentan so aus:
groß
LGND
ENTA
ARRY
AMBI
FURX
Genmab
Morphosys
IMGN
RIGL
Paion
klein
Zu Array: Letztes Jahr hat Array immerhin +34% gemacht. Wenn mir das einer jedes Jahr garantieren würde...
 Aber klar hab ich mir mehr erhofft und es fühlt sich auch irgendwie anders an. Eine Übersicht der US-Werte: http://investorshub.advfn.com/boards/read_msg.aspx?message_i…" target="_blank" rel="nofollow ugc noopener">http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Aber klar hab ich mir mehr erhofft und es fühlt sich auch irgendwie anders an. Eine Übersicht der US-Werte: http://investorshub.advfn.com/boards/read_msg.aspx?message_i…" target="_blank" rel="nofollow ugc noopener">http://investorshub.advfn.com/boards/read_msg.aspx?message_i…Vielen Dank für die Infos in diesem Bord!
SG kmastra
CYTRX sagt mir so nichts, tut mir leid. ARIA habe ich noch in meinem Depot... allerdings bin ich mir unsicher, ob die aktuelle MK von 1,3 Mrd USD durch Iclusig noch gesteigert werden kann. Zwar ist Iclusig wieder am Markt, doch ist das Marktpotential wegen der Nebenwirkungen angeblich begrenzt.
Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.161.393 von ipollit am 05.01.14 23:58:55Hallo,
zu Cytrx kann auch ich nichts beitragen. Ariad finde ich persönlich nicht attraktiv, da es schon jetzt ziemlich hoch bewertet ist. Langfristig bin ich eher pessimistisch, was die Marktaussichten von Iclusig betrifft (es muss ja auch erst mal ein gewisser Umsatz da sein, um überhaupt Gewinn zu machen) und der ALK Inhibitor hat zwar Potenzial ist aber noch ein großes Fragezeichen - zudem gibt es ja auch ähnliche Ansätze z.B. von Novartis, die viel weiter sind...
Mag mich aber auch irren.
Jetzt aber zu jemandem der wirklich Ahnung hat. Ohad Hammer mit einer Zusammenfassung von 2013 und einem Ausblick auf 2014.
http://www.orf-blog.com/biotech-portfolio-update-2013-summar…
Sg kmastra
zu Cytrx kann auch ich nichts beitragen. Ariad finde ich persönlich nicht attraktiv, da es schon jetzt ziemlich hoch bewertet ist. Langfristig bin ich eher pessimistisch, was die Marktaussichten von Iclusig betrifft (es muss ja auch erst mal ein gewisser Umsatz da sein, um überhaupt Gewinn zu machen) und der ALK Inhibitor hat zwar Potenzial ist aber noch ein großes Fragezeichen - zudem gibt es ja auch ähnliche Ansätze z.B. von Novartis, die viel weiter sind...
Mag mich aber auch irren.
Jetzt aber zu jemandem der wirklich Ahnung hat. Ohad Hammer mit einer Zusammenfassung von 2013 und einem Ausblick auf 2014.
http://www.orf-blog.com/biotech-portfolio-update-2013-summar…
Sg kmastra
Antwort auf Beitrag Nr.: 46.169.337 von kmastra am 07.01.14 00:09:08Ja, der Mann ist ein Traum!
Bei Array hat er m.E. einen kleinen Fehler drin, wenn er meint, dass von den MEKs in diesem Jahr keine Daten kommen.
Laut Array-Website:
The second Phase 3 study is in NRAS-mutant melanoma, which Novartis is conducting, and began in July 2013. The NRAS-mutant melanoma study, called NEMO (NRAS Melanoma and MEK Inhibitor), will evaluate the efficacy and safety of MEK162 compared to dacarbazine in 393 patients with advanced (Stage IIIC) unresectable or metastatic (Stage IV) NRAS-mutant melanoma. The primary endpoint is progression-free survival, and the key secondary endpoint is overall survival. The estimated primary completion date for the NEMO study is October 2014.
Kann natürlich trotzdem sein, dass da erst 2015 Daten veröffentlicht werden. Mal sehen.
Bei Array hat er m.E. einen kleinen Fehler drin, wenn er meint, dass von den MEKs in diesem Jahr keine Daten kommen.
Laut Array-Website:
The second Phase 3 study is in NRAS-mutant melanoma, which Novartis is conducting, and began in July 2013. The NRAS-mutant melanoma study, called NEMO (NRAS Melanoma and MEK Inhibitor), will evaluate the efficacy and safety of MEK162 compared to dacarbazine in 393 patients with advanced (Stage IIIC) unresectable or metastatic (Stage IV) NRAS-mutant melanoma. The primary endpoint is progression-free survival, and the key secondary endpoint is overall survival. The estimated primary completion date for the NEMO study is October 2014.
Kann natürlich trotzdem sein, dass da erst 2015 Daten veröffentlicht werden. Mal sehen.
Antwort auf Beitrag Nr.: 46.161.393 von ipollit am 05.01.14 23:58:55@ipollit & kmastra, besten Dank für eure Einschätzungen
...und für die Link zu OH's gesammelte werke, unglaublich wie viel akribische Wissen drinsteckt, so, jetzt mache ich mich auf dem Weg zum dritt Studium mit Mr.Hammer

...und für die Link zu OH's gesammelte werke, unglaublich wie viel akribische Wissen drinsteckt, so, jetzt mache ich mich auf dem Weg zum dritt Studium mit Mr.Hammer

PCYC
Imbruvica kann vorzeitig den Erfolg in der rr CLL PIII Imbruvica Mono vs Arzerra Mono vermelden: PFS und OS sind bereits bei der Zwischenanalyse signifikant besser. Dies ist umso beeindruckender, da es sich um eine Head to Head Studie handelt gegen ein aktives zugelassenes Medikament.
Die beantragte CLL Zulassung durch die FDA auf Basis der PII sollte bald erfolgen. Die zusätzliche PIII dürfte schon jetzt die off-label Anwendung in CLL erhöhen.

Gruß
ipollit
Imbruvica kann vorzeitig den Erfolg in der rr CLL PIII Imbruvica Mono vs Arzerra Mono vermelden: PFS und OS sind bereits bei der Zwischenanalyse signifikant besser. Dies ist umso beeindruckender, da es sich um eine Head to Head Studie handelt gegen ein aktives zugelassenes Medikament.
Die beantragte CLL Zulassung durch die FDA auf Basis der PII sollte bald erfolgen. Die zusätzliche PIII dürfte schon jetzt die off-label Anwendung in CLL erhöhen.
Gruß
ipollit
EXEL
sieht dieses Jahr besser aus...

Roche wird wahrscheinlich dieses Jahr PIII-Ergebnisse für EXELs Cobimetinib (MEK-Hemmer) in Kombination mit Zelboraf publizieren und darauf die Zulassung beantragen. EXEL erhält relativ hohe Royalties, sowie eine US Co-Vermarktung
Es sollten erste Cometriq (MET/VEGF/AXL-Hemmer) CRPC PIII-Daten kommen. Bayer hat zuletzt für 2,9 Mrd USD den Partner Algeta übernommen, um auch die restlichen Rechte an Xofigo zu erhalten. Xofigo ist ein Konkurrent von Cometriq in CRPC, da es auch auf die Knochen-Metastasen abzielt.
Außerdem gibt es Cometriq PIIIs in anderen Indikationen, deren Ergebnisse in 2015 und 2016 vorliegen sollten... sowie zahlreiche PI- und PII-Studien.

Gruß
ipollit
sieht dieses Jahr besser aus...
Roche wird wahrscheinlich dieses Jahr PIII-Ergebnisse für EXELs Cobimetinib (MEK-Hemmer) in Kombination mit Zelboraf publizieren und darauf die Zulassung beantragen. EXEL erhält relativ hohe Royalties, sowie eine US Co-Vermarktung


Es sollten erste Cometriq (MET/VEGF/AXL-Hemmer) CRPC PIII-Daten kommen. Bayer hat zuletzt für 2,9 Mrd USD den Partner Algeta übernommen, um auch die restlichen Rechte an Xofigo zu erhalten. Xofigo ist ein Konkurrent von Cometriq in CRPC, da es auch auf die Knochen-Metastasen abzielt.
Außerdem gibt es Cometriq PIIIs in anderen Indikationen, deren Ergebnisse in 2015 und 2016 vorliegen sollten... sowie zahlreiche PI- und PII-Studien.

Gruß
ipollit
Habt ihr Intercept gesehen?!?
So was "irres" ist selten. Hab ich vorher nie gehört... Schade...
So was "irres" ist selten. Hab ich vorher nie gehört... Schade...

Antwort auf Beitrag Nr.: 46.195.969 von SLGramann am 09.01.14 20:45:24Bin übrigens kurzentschlossen bei 268 Dollar eingestiegen, nachdem ich ja den 270%-Kurssprung verpasst habe...
Tja, wie bescheuert ist es, in einen kleinen development-stage-Laden zu investieren, nachdem seine Marktkapitalisierung aufgrund von PII-Daten auf 5 Milliarden gesprungen ist?
Völlig gaga? Ich glaube nicht...
Tja, wie bescheuert ist es, in einen kleinen development-stage-Laden zu investieren, nachdem seine Marktkapitalisierung aufgrund von PII-Daten auf 5 Milliarden gesprungen ist?
Völlig gaga? Ich glaube nicht...

Antwort auf Beitrag Nr.: 46.196.315 von SLGramann am 09.01.14 21:16:34Mit Deinen beiden letzten Beiträgen kann ich leider nicht allzu viel anfangen. Vielleicht findest Du ja ein wenig Zeit, etwas genauer die Motive für Deinen extremst prozyklischen Kauf zu erläutern, zumal Du, wenn ich Dich richtig verstanden habe, das Unternehmen bis heute Nachmittag überhaupt noch nicht kanntest.
Antwort auf Beitrag Nr.: 46.196.587 von Joschka Schröder am 09.01.14 21:38:33Ja, war etwas kryptisch, aber die Story ist so ungewöhnlich, dass ich einfach etwas dazu provozieren wollte, dass sich jeder selbst ein Bild macht.
Meine "Leitplanken" sind folgende:
Intercept hat einen Wirkstoffkandidaten namens OCA. Dort wurde jetzt eine PIIb abgebrochen aus folgendem Grund:
Intercept Pharmaceuticals, Inc. (Nasdaq:ICPT) (Intercept) today announced
that the FLINT trial of obeticholic acid (OCA) for the treatment of nonalcoholic steatohepatitis (NASH) has been stopped early
for efficacy based on a planned interim analysis showing that the primary endpoint of the trial has been met.
Dabei ist das für mich sehr wichtig:
This analysis demonstrated that OCA treatment resulted in a
highly statistically significant improvement (p=0.0024 on an intention-to-treat [ITT] basis) in the primary histological endpoint,
defined as a decrease in the NAFLD Activity Score (NAS) of at least two points with no worsening of fibrosis, as compared to
placebo. Those patients who had not yet completed the trial and therefore did not have a second biopsy were treated as nonresponders
in the ITT analysis.
Ich gehe daher davon aus, dass die Wirkung noch sehr viel besser ist.
Zu NASH:
http://de.wikipedia.org/wiki/Fettleber
Schwere Fälle führen zu Leberzirrhose.
Es gibt bisher keine Therapieoption.
Wie viele schwere - behandlungsbedürftige - Fälle gibt es? Allein in den USA wohl zwischen 600 Tausend und 1 Million.
Wenn man das hochrechnet, ergibt sich ein Multi-Milliarden-Markt - nur in den USA.
Ich weiß, Du magst Feuerstein nicht (ich auch nicht), aber:
2-3% of the U.S. population (315 million people) are diagnosed with NASH, with 0.3% to 0.9% diagnosed with NASH that has progressed to cirrhosis. He uses the latter, sicker patient population for his calculations because they're more likely to seek treatment. This equates to a patient population of 1.8 million people.
Assume Intercept treats 20% of these NASH+cirrhosis patients, which is 360,000 patients.
Assume Intercept prices OCA at $10,000 per year. It's a pill and a daily, chronic treatment, so this pricing is in line with that the PCSK9s might cost.
Calculator, please...
You're looking at a peak sales potential for OCA in U.S. NASH patients of $3.6 billion.
If you think 20% market share is too high, bring it down to 15%. That's $2.7 billion in peak sales.
Das könnte eventuell alles noch viel zu tief gegriffen sein, weil NASH nicht die einzige Indikation für OCA ist.
Die Zahlen oben kommen so nicht nur von Feuerstein, sondern auch von anderen Quellen.
Das alles überzeugt mich.
Meine "Leitplanken" sind folgende:
Intercept hat einen Wirkstoffkandidaten namens OCA. Dort wurde jetzt eine PIIb abgebrochen aus folgendem Grund:
Intercept Pharmaceuticals, Inc. (Nasdaq:ICPT) (Intercept) today announced
that the FLINT trial of obeticholic acid (OCA) for the treatment of nonalcoholic steatohepatitis (NASH) has been stopped early
for efficacy based on a planned interim analysis showing that the primary endpoint of the trial has been met.
Dabei ist das für mich sehr wichtig:
This analysis demonstrated that OCA treatment resulted in a
highly statistically significant improvement (p=0.0024 on an intention-to-treat [ITT] basis) in the primary histological endpoint,
defined as a decrease in the NAFLD Activity Score (NAS) of at least two points with no worsening of fibrosis, as compared to
placebo. Those patients who had not yet completed the trial and therefore did not have a second biopsy were treated as nonresponders
in the ITT analysis.
Ich gehe daher davon aus, dass die Wirkung noch sehr viel besser ist.
Zu NASH:
http://de.wikipedia.org/wiki/Fettleber
Schwere Fälle führen zu Leberzirrhose.
Es gibt bisher keine Therapieoption.
Wie viele schwere - behandlungsbedürftige - Fälle gibt es? Allein in den USA wohl zwischen 600 Tausend und 1 Million.
Wenn man das hochrechnet, ergibt sich ein Multi-Milliarden-Markt - nur in den USA.
Ich weiß, Du magst Feuerstein nicht (ich auch nicht), aber:
2-3% of the U.S. population (315 million people) are diagnosed with NASH, with 0.3% to 0.9% diagnosed with NASH that has progressed to cirrhosis. He uses the latter, sicker patient population for his calculations because they're more likely to seek treatment. This equates to a patient population of 1.8 million people.
Assume Intercept treats 20% of these NASH+cirrhosis patients, which is 360,000 patients.
Assume Intercept prices OCA at $10,000 per year. It's a pill and a daily, chronic treatment, so this pricing is in line with that the PCSK9s might cost.
Calculator, please...
You're looking at a peak sales potential for OCA in U.S. NASH patients of $3.6 billion.
If you think 20% market share is too high, bring it down to 15%. That's $2.7 billion in peak sales.
Das könnte eventuell alles noch viel zu tief gegriffen sein, weil NASH nicht die einzige Indikation für OCA ist.
Die Zahlen oben kommen so nicht nur von Feuerstein, sondern auch von anderen Quellen.
Das alles überzeugt mich.
das sind schon große Zahlen... nicht schlecht! Tja, noch aufspringen oder nicht?
IPCT Fallout... GALT +60% (nun 250 MK). Wäre das vielleicht auch eine mögliche Alternative?
http://www.streetinsider.com/Analyst+Comments/Aegis+Boosts+P…
Aegis Capital maintains its Buy rating on Galectin Therapeutics (Nasdaq: GALT), but raises its price target from $10 to $16.
Anlayst Ram Selvaraju, Ph.D., noted that the price target adjustment was in relation to recent success reported by Intercept Pharmaceuticals (Nasdaq: ICPT) in a similar indication to the one that Galectin is currently pursuing with GR-MD-02.
Selvaraju observed that, while Intercept's drug is clearly active, we note that it does not reverse fibrosis but only slows or halts disease progression. In our view, Galectin could yet turn out to have a best-in-class drug in this indication, since GR-MD-02 was shown preclinically to reverse fibrosis. Data from GR-MD-02 Phase 1 is likely to be reported within a few months. The analyst thinks Galectin's Phase 2 study in non-alcoholic steatohepatitis (NASH), a highly unmet medical need with no currently-approved effective therapy, could begin by the summer of 2014 and yield data in mid- to late 2015, potentially paving the way for a transformative partnership or potentially an acquisition of the firm.
Intercept Pharma went pubic in October 2012 with a market valuation of $235 million and now holds an enterprise value of $5 billion and shares have moved over 250 percent higher in the wake of the FLINT release, Selvaraju said, and has yet to begin Phase 3 testing of its lead candidate, obeticholic acid (OCA or INT-747) in NASH. Galectin boasts an enterprise value of about $140 million and the analyst believes INT-747's safety profile might prove inferior to GR-MD-02. He sees peak global sales of liver fibrosis-reversing hitting $1.7 billion in 2020.
Ein weitere Ansatz ist z.B. der LOXL2-AK Simtuzumab von GILD in PII.
Gruß
ipollit
IPCT Fallout... GALT +60% (nun 250 MK). Wäre das vielleicht auch eine mögliche Alternative?
http://www.streetinsider.com/Analyst+Comments/Aegis+Boosts+P…
Aegis Capital maintains its Buy rating on Galectin Therapeutics (Nasdaq: GALT), but raises its price target from $10 to $16.
Anlayst Ram Selvaraju, Ph.D., noted that the price target adjustment was in relation to recent success reported by Intercept Pharmaceuticals (Nasdaq: ICPT) in a similar indication to the one that Galectin is currently pursuing with GR-MD-02.
Selvaraju observed that, while Intercept's drug is clearly active, we note that it does not reverse fibrosis but only slows or halts disease progression. In our view, Galectin could yet turn out to have a best-in-class drug in this indication, since GR-MD-02 was shown preclinically to reverse fibrosis. Data from GR-MD-02 Phase 1 is likely to be reported within a few months. The analyst thinks Galectin's Phase 2 study in non-alcoholic steatohepatitis (NASH), a highly unmet medical need with no currently-approved effective therapy, could begin by the summer of 2014 and yield data in mid- to late 2015, potentially paving the way for a transformative partnership or potentially an acquisition of the firm.
Intercept Pharma went pubic in October 2012 with a market valuation of $235 million and now holds an enterprise value of $5 billion and shares have moved over 250 percent higher in the wake of the FLINT release, Selvaraju said, and has yet to begin Phase 3 testing of its lead candidate, obeticholic acid (OCA or INT-747) in NASH. Galectin boasts an enterprise value of about $140 million and the analyst believes INT-747's safety profile might prove inferior to GR-MD-02. He sees peak global sales of liver fibrosis-reversing hitting $1.7 billion in 2020.
Ein weitere Ansatz ist z.B. der LOXL2-AK Simtuzumab von GILD in PII.
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.197.725 von ipollit am 10.01.14 01:01:29GALT... ich weiß allerdings nicht, ob das ein seriöser Ansatz ist. Außerdem benötigt GALT wohl in Kürze neuen Cash, wenn ich das richtig sehe.
Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.197.725 von ipollit am 10.01.14 01:01:29"Tja, noch aufspringen oder nicht?"
Vielleicht gibt es ja einen Rücksetzer im Kurs. Nach so einem irren Sprung wäre das normal.
Vielleicht erwarten auch einige, dass es nun zu einer vorzeitigen Zulassung kommt. Eine Hoffnung, die enttäuscht werden könnte. Eine PIII wird sicher 3 Jahre Zeit brauchen.
Ich kann mir vorstellen, dass wir nochmal tiefere Kurse sehen und würde dann eventuell aufstocken.
Allerdings kommen im 2. Quartal zulassungsrelevante Daten in der Indikation Primary Biliary Cirrhosis, die zwar im Vergleich zu NASH sehr klein ist, aber auch psychologisch für den Aktienkurs natürlich wichtig ist.
Ich kann mir auch wirklich vorstellen, dass Intercept noch übernommen wird. Nach dem, was man bisher liest, wären langfristig weltweite Umsätze nur in der Indikation NASH von 5 Milliarden Dollar + X gut möglich. Wenn man von einer stärkeren Durchdringung des Marktes ausgeht, auch noch einiges mehr. Dann noch die weiteren Indikationen. Ich weiß, dass so etwas wie Spinnerei klingt, aber kann man bei weiter guten Daten 10 Mrd. als weltweites Umsatzpotential ausschließen?
Vielleicht gibt es ja einen Rücksetzer im Kurs. Nach so einem irren Sprung wäre das normal.
Vielleicht erwarten auch einige, dass es nun zu einer vorzeitigen Zulassung kommt. Eine Hoffnung, die enttäuscht werden könnte. Eine PIII wird sicher 3 Jahre Zeit brauchen.
Ich kann mir vorstellen, dass wir nochmal tiefere Kurse sehen und würde dann eventuell aufstocken.
Allerdings kommen im 2. Quartal zulassungsrelevante Daten in der Indikation Primary Biliary Cirrhosis, die zwar im Vergleich zu NASH sehr klein ist, aber auch psychologisch für den Aktienkurs natürlich wichtig ist.
Ich kann mir auch wirklich vorstellen, dass Intercept noch übernommen wird. Nach dem, was man bisher liest, wären langfristig weltweite Umsätze nur in der Indikation NASH von 5 Milliarden Dollar + X gut möglich. Wenn man von einer stärkeren Durchdringung des Marktes ausgeht, auch noch einiges mehr. Dann noch die weiteren Indikationen. Ich weiß, dass so etwas wie Spinnerei klingt, aber kann man bei weiter guten Daten 10 Mrd. als weltweites Umsatzpotential ausschließen?
Antwort auf Beitrag Nr.: 46.199.053 von SLGramann am 10.01.14 09:49:01Hallo SLGramann,
es sieht so aus, als würde dein Mut belohnt. Glückwunsch! Schon irre. Ich kann mich nicht dran erinnern, dass ein Biotech, der eh schon über 1 Milliarde Wert hat an einem Tag so einen Sprung hinlegt...
Merril Lynch sehen einen fairen Wert bei 872$
Da kommen Erinnerungen an Bernd Förtschs berühmte Dausend als Kursziel bei Morphosys hoch, auch wenn man das natürlich nicht ansatzweise vergleichen kann.

SG kmastra
es sieht so aus, als würde dein Mut belohnt. Glückwunsch! Schon irre. Ich kann mich nicht dran erinnern, dass ein Biotech, der eh schon über 1 Milliarde Wert hat an einem Tag so einen Sprung hinlegt...
Merril Lynch sehen einen fairen Wert bei 872$

Da kommen Erinnerungen an Bernd Förtschs berühmte Dausend als Kursziel bei Morphosys hoch, auch wenn man das natürlich nicht ansatzweise vergleichen kann.

SG kmastra
Hoffe mal dass der Biometriker bei der IA sich nicht verrechnet hat. Soll ja vorkommen.
Übrigens gibt es m.E. Ursodeoxycholsäure für dies Indikation.
Ich halte den Sprung für extrem übertrieben.
Übrigens gibt es m.E. Ursodeoxycholsäure für dies Indikation.
Ich halte den Sprung für extrem übertrieben.
Citigroup raised its price target for Intercept shares to $400 from $60 saying it still sees value in the stock despite yesterday's 300% gain. Citi believes the company's $5.4B market capitalization does not reflect its multi-billion dollar opportunity in non-alcoholic steatohepatitis/ liver fibrosis. The firm thinks Intercept's obeticholic acid could top $5B a year in sales and keeps a Buy rating on the stock.
------------
@me_2, ja, die Krankheit wird behandelt, aber offenbar nicht erfolgreich bei den weit fortgeschrittenen Erkrankten.
Das sagt Intercept dazu:
There are currently no drugs approved for the treatment of NAFLD or NASH. It has been reported that in 2010, there were approximately $615 million in off-label sales of various therapeutics for the treatment of NASH, such as insulin sensitizers (e.g., metformin), antihyperlipidemic agents (e.g., gemfibrozil), pentoxifylline and ursodiol. Lifestyle changes and exercise to reduce body weight and treatment of concomitant diabetes and dyslipidemia are accepted as the standard of care but have not conclusively been shown to prevent disease progression.
Ich denke nicht, dass hier ein Irrtum über die Größe bzw. den Bedarf in dieser Indikation besteht.
Fraglich ist eher:
- ist OCA wirklich so gut?
- wie sieht der Weg zur Zulassung aus? Wie lange?
- wie teuer wird das Produkt?
Dass OCA in der Indikation PBC die orphan drug designation hat, könnte eventuell hilfreich sein.
------------
@me_2, ja, die Krankheit wird behandelt, aber offenbar nicht erfolgreich bei den weit fortgeschrittenen Erkrankten.
Das sagt Intercept dazu:
There are currently no drugs approved for the treatment of NAFLD or NASH. It has been reported that in 2010, there were approximately $615 million in off-label sales of various therapeutics for the treatment of NASH, such as insulin sensitizers (e.g., metformin), antihyperlipidemic agents (e.g., gemfibrozil), pentoxifylline and ursodiol. Lifestyle changes and exercise to reduce body weight and treatment of concomitant diabetes and dyslipidemia are accepted as the standard of care but have not conclusively been shown to prevent disease progression.
Ich denke nicht, dass hier ein Irrtum über die Größe bzw. den Bedarf in dieser Indikation besteht.
Fraglich ist eher:
- ist OCA wirklich so gut?
- wie sieht der Weg zur Zulassung aus? Wie lange?
- wie teuer wird das Produkt?
Dass OCA in der Indikation PBC die orphan drug designation hat, könnte eventuell hilfreich sein.
Antwort auf Beitrag Nr.: 46.203.365 von SLGramann am 10.01.14 15:31:19ich vermute OCA wird nicht viel besser wirken als (das in Studien bisher nicht erfolgreiche) UDCA, beides Gallensäuren, zytoprotektiv.
Für die Zulassung brauchts doch sicher noch ein paar mehr Patienten, da dürfte sich der Abbruch der Studie nach der IA eher als kontraproduktiv erweisen, mehr als max. 100 vollständig behandelte Verum-Pat. dürfen das in FLINT ja nicht sein (1:1 Randomisierung vorausgesetzt).
Für die Zulassung brauchts doch sicher noch ein paar mehr Patienten, da dürfte sich der Abbruch der Studie nach der IA eher als kontraproduktiv erweisen, mehr als max. 100 vollständig behandelte Verum-Pat. dürfen das in FLINT ja nicht sein (1:1 Randomisierung vorausgesetzt).
Antwort auf Beitrag Nr.: 46.203.705 von me_2 am 10.01.14 15:59:46Ursodiol (= UDCA) scheint nicht wirksam zu sein bei N.A.S.H. :
http://www.sciencedaily.com/releases/2010/07/100720162310.ht…
Und bei PCH wird es nur als off-label drug eingesetzt:
http://books.google.de/books?id=Pf5j8RgzkRMC&pg=PA237&lpg=PA…
http://www.sciencedaily.com/releases/2010/07/100720162310.ht…
Und bei PCH wird es nur als off-label drug eingesetzt:
http://books.google.de/books?id=Pf5j8RgzkRMC&pg=PA237&lpg=PA…
Antwort auf Beitrag Nr.: 46.197.759 von ipollit am 10.01.14 01:18:26GALT... ist offensichtlich kein seriöses Unternehmen. Ohne harte klinische Daten (zweifelhaft, ob es soetwas jemals geben wird) würde ich hier nicht investieren.
(Galectin hieß früher Pro-Pharma)
http://www.thestreet.com/story/12100340/1/biotech-stock-mail…
http://www.thestreet.com/story/10741455/3/biotech-stock-mail…
Gruß
ipollit
(Galectin hieß früher Pro-Pharma)
http://www.thestreet.com/story/12100340/1/biotech-stock-mail…
http://www.thestreet.com/story/10741455/3/biotech-stock-mail…
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.203.365 von SLGramann am 10.01.14 15:31:19ICPT
NASH&Co scheint schon eine große relevante Indikation zu sein. In der Rechnung von Feuerstein sind ja nur US-Patienten eingerechnet. 2-3% aller Amerikaner mit Fettleber (NASH)... 0,3 bis 0,9% mit fortgeschrittener Erkrankung (Leberzirrhose/Fibrose). Werden nicht aufgrund der ungesunden Lebensweise diese Zahlen eher steigen? 3,6 Mrd Umsatz wären es dann, wenn 20% der ersthaft erkrankten nimmt und die als 0,6% der Bevölkerung annimmt. Dazu kommen dann noch Patienten außerhalb der USA.
Was ist allerdings ICPTs OCA? Es ist eine Veriante der natürlichen Gallensäure Chenodesoxycholsäure (CDCA) zu sein, die bezüglich einer besseren Stimulation von FXR optimiert worden ist.
http://www.interceptpharma.com/pdf/Adorini.EASL.April2013.pd…
Ursodiol (UDCA) ist ebenfalls eine Variante von CDCA, soll aber demnach keine Wirkung auf FXR haben.
Laut ICPT kommt die Wirkung von OCA über die Stimulation (Agonist) von FXR zustande.
Andere Studien weisen ebenfalls auf den positiven Effekt von FXR hin... http://www.nursa.org/retrieveFile.cfm?type=NRS&file=nrs08005…
Deciphering the nuclear bile acid receptor FXR paradigm
...Strongly expressed in the liver and
intestine, FXR has been shown to be the master transcriptional regulator of several entero-hepatic metabolic
pathways with relevance to the pathophysiology of conditions such as cholestasis, fatty liver disease,
cholesterol gallstone disease, intestinal inflammation and tumors. Furthermore, given the importance of FXR
in the gut-liver axis feedbacks regulating lipid and glucose homeostasis, FXR modulation appears to have
great input in diseases such as metabolic syndrome and diabetes...
...Finally, an FXR agonist may
induce the expression of peroxisome proliferator activated
receptor a (PPARa) and in turn its target gene pyruvate
dehydrogenase kinase-4 (PDK-4), to promote fatty acid
oxidation [Pineda Torra et al., 2003; Savkur et al., 2005a]
(Figure 5). Taken together, these studies propose FXR
as a pharmacological target for the management of
hypertriglyceridemia and fatty liver disease, two common
features of the metabolic syndrome in humans.
In summary, the use of FXR agonists would be beneficial
for the reduction of TG levels, but detrimental in regard
to the induction of LDL-cholesterol and reduction of
HDL-cholesterol levels. Instead, the use of FXR
antagonists would be beneficial to reduce LDL-cholesterol
and increase HDL-cholesterol levels, but disadvantageous
because of the increased TG levels. Indeed, the benefit
of FXR antagonists or agonists in diseases such as
atherosclerosis, hypercholesterolemia and
hypertriglyceridemia, remains to be established. For the
future, the identification of specific FXR isoforms linked
to a specific lipid-metabolic pathway would be extremely
helpful for the design of specific FXR (ant-)agonists
targeting the desired pathway without undesirable side
effects.
In der Theorie erhöht die Stimulation von FXR das schlechte Cholesterin, während das gute Cholesterin gesenkt wird... theoretisch führt dies zu CV-Nebenwirkungen wie Schlaganfall oder Herzinfakten. In der Praxis scheint dieser Effekt auch in den OCA-Studien aufzutreten:
https://twitter.com/AndyBiotech/status/421825760924422145
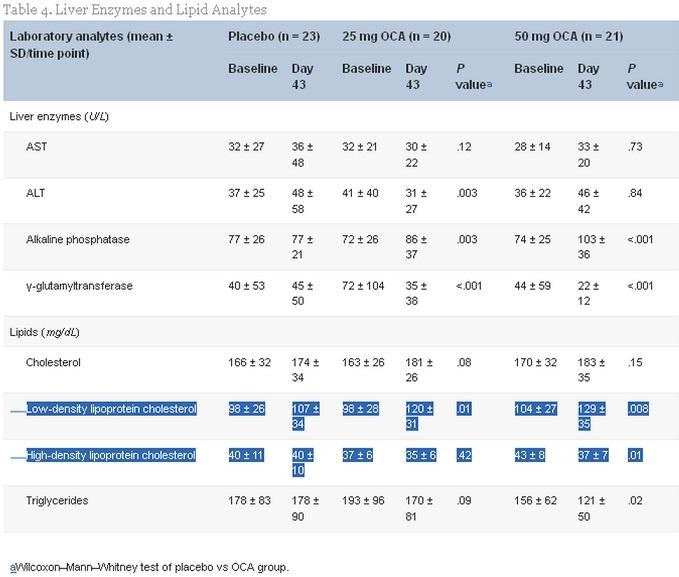
Zur genaueren Charakterisierung der Nebenwirkungen von OCA müsste es noch größere PIII-Studien geben... es ist wohl noch ein längerer Weg bis zur Zulassung gegen NASH&Co zu gehen.
EXEL hatte bereits in 2006 mit XL335 einen FXR Agonisten in der Pipeline, der an Wyeth auslizensiert wurde... nach der Übernahme durch Pfizer ist das ganze aber im Sande verlaufen, die Entwicklung ist eingestellt worden:
(nicht mehr aktuell)http://www.exelixis.com/pipeline/fxr
http://ajpgi.physiology.org/content/296/3/G543
http://www.journal-of-hepatology.eu/article/S0168-8278(09)00…
Momentan gibt es noch einen präklinischen TGR5 Agonisten XL475 bei BMS (wie ICPTs TGR5 Agonist INT-777) und das LXR-Mittel XL041 ebenfalls bei BMS.
ICPT hatte eine Übersicht von FXR Agonisten in der Präsentation... die deutsche private Phenex AG hat ebenfalls einen FXR Agonisten gegen NASH in PII http://www.phenex-pharma.com/en/r-and-d-programs/r-and-d-ove…
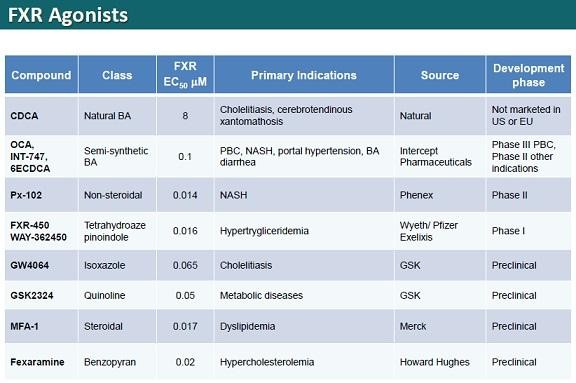
Gruß
ipollit
NASH&Co scheint schon eine große relevante Indikation zu sein. In der Rechnung von Feuerstein sind ja nur US-Patienten eingerechnet. 2-3% aller Amerikaner mit Fettleber (NASH)... 0,3 bis 0,9% mit fortgeschrittener Erkrankung (Leberzirrhose/Fibrose). Werden nicht aufgrund der ungesunden Lebensweise diese Zahlen eher steigen? 3,6 Mrd Umsatz wären es dann, wenn 20% der ersthaft erkrankten nimmt und die als 0,6% der Bevölkerung annimmt. Dazu kommen dann noch Patienten außerhalb der USA.
Was ist allerdings ICPTs OCA? Es ist eine Veriante der natürlichen Gallensäure Chenodesoxycholsäure (CDCA) zu sein, die bezüglich einer besseren Stimulation von FXR optimiert worden ist.
http://www.interceptpharma.com/pdf/Adorini.EASL.April2013.pd…

Ursodiol (UDCA) ist ebenfalls eine Variante von CDCA, soll aber demnach keine Wirkung auf FXR haben.
Laut ICPT kommt die Wirkung von OCA über die Stimulation (Agonist) von FXR zustande.
Andere Studien weisen ebenfalls auf den positiven Effekt von FXR hin... http://www.nursa.org/retrieveFile.cfm?type=NRS&file=nrs08005…
Deciphering the nuclear bile acid receptor FXR paradigm
...Strongly expressed in the liver and
intestine, FXR has been shown to be the master transcriptional regulator of several entero-hepatic metabolic
pathways with relevance to the pathophysiology of conditions such as cholestasis, fatty liver disease,
cholesterol gallstone disease, intestinal inflammation and tumors. Furthermore, given the importance of FXR
in the gut-liver axis feedbacks regulating lipid and glucose homeostasis, FXR modulation appears to have
great input in diseases such as metabolic syndrome and diabetes...
...Finally, an FXR agonist may
induce the expression of peroxisome proliferator activated
receptor a (PPARa) and in turn its target gene pyruvate
dehydrogenase kinase-4 (PDK-4), to promote fatty acid
oxidation [Pineda Torra et al., 2003; Savkur et al., 2005a]
(Figure 5). Taken together, these studies propose FXR
as a pharmacological target for the management of
hypertriglyceridemia and fatty liver disease, two common
features of the metabolic syndrome in humans.
In summary, the use of FXR agonists would be beneficial
for the reduction of TG levels, but detrimental in regard
to the induction of LDL-cholesterol and reduction of
HDL-cholesterol levels. Instead, the use of FXR
antagonists would be beneficial to reduce LDL-cholesterol
and increase HDL-cholesterol levels, but disadvantageous
because of the increased TG levels. Indeed, the benefit
of FXR antagonists or agonists in diseases such as
atherosclerosis, hypercholesterolemia and
hypertriglyceridemia, remains to be established. For the
future, the identification of specific FXR isoforms linked
to a specific lipid-metabolic pathway would be extremely
helpful for the design of specific FXR (ant-)agonists
targeting the desired pathway without undesirable side
effects.
In der Theorie erhöht die Stimulation von FXR das schlechte Cholesterin, während das gute Cholesterin gesenkt wird... theoretisch führt dies zu CV-Nebenwirkungen wie Schlaganfall oder Herzinfakten. In der Praxis scheint dieser Effekt auch in den OCA-Studien aufzutreten:
https://twitter.com/AndyBiotech/status/421825760924422145

Zur genaueren Charakterisierung der Nebenwirkungen von OCA müsste es noch größere PIII-Studien geben... es ist wohl noch ein längerer Weg bis zur Zulassung gegen NASH&Co zu gehen.
EXEL hatte bereits in 2006 mit XL335 einen FXR Agonisten in der Pipeline, der an Wyeth auslizensiert wurde... nach der Übernahme durch Pfizer ist das ganze aber im Sande verlaufen, die Entwicklung ist eingestellt worden:
(nicht mehr aktuell)http://www.exelixis.com/pipeline/fxr
http://ajpgi.physiology.org/content/296/3/G543
http://www.journal-of-hepatology.eu/article/S0168-8278(09)00…
Momentan gibt es noch einen präklinischen TGR5 Agonisten XL475 bei BMS (wie ICPTs TGR5 Agonist INT-777) und das LXR-Mittel XL041 ebenfalls bei BMS.
ICPT hatte eine Übersicht von FXR Agonisten in der Präsentation... die deutsche private Phenex AG hat ebenfalls einen FXR Agonisten gegen NASH in PII http://www.phenex-pharma.com/en/r-and-d-programs/r-and-d-ove…

Gruß
ipollit
Antwort auf Beitrag Nr.: 46.214.095 von ipollit am 12.01.14 16:23:50Hallo ipollit,
nach dem neuerlichen Kurssprung werde ich wohl morgen wieder aussteigen. Die Marktkapitalisierung von 8,5 Mrd. Dollar schränkt nun doch die weitere Phantasie - auch hinsichtlich einer Übernahme - ziemlich ein. Ich hätte schon Freitag die Konsequenz ziehen sollen. Das Cholesterin-Thema ist ebenfalls unangenehm. Das wurde Freitag nach Börsenschluss auf den Tisch gelegt. Ich rechne für Montag mit einem deutlichen Kursrutsch.
Es dürfte aber sinnvoll sein, die Entwicklung weiter zu verfolgen, denn die Indikation ist offensichtlich kommerziell ja ausgesprochen bedeutsam. Und sehr wahrscheinlich ist Deine Vermutung zutreffend, dass aufgrund der westlichen Lebensweise die Zahl der Erkrankten weiter steigen wird.
Gruß
SLG
nach dem neuerlichen Kurssprung werde ich wohl morgen wieder aussteigen. Die Marktkapitalisierung von 8,5 Mrd. Dollar schränkt nun doch die weitere Phantasie - auch hinsichtlich einer Übernahme - ziemlich ein. Ich hätte schon Freitag die Konsequenz ziehen sollen. Das Cholesterin-Thema ist ebenfalls unangenehm. Das wurde Freitag nach Börsenschluss auf den Tisch gelegt. Ich rechne für Montag mit einem deutlichen Kursrutsch.
Es dürfte aber sinnvoll sein, die Entwicklung weiter zu verfolgen, denn die Indikation ist offensichtlich kommerziell ja ausgesprochen bedeutsam. Und sehr wahrscheinlich ist Deine Vermutung zutreffend, dass aufgrund der westlichen Lebensweise die Zahl der Erkrankten weiter steigen wird.
Gruß
SLG
Antwort auf Beitrag Nr.: 46.214.095 von ipollit am 12.01.14 16:23:50Mittlerweile hat sich der ICPT-Kurs bereits wieder halbiert.
Für SLGramann freue mich natürlich über dessen schönen Tradinggewinn.
Grundsätzlich halte ich derartige Aktienkäufe jedoch für wenig sinnvoll. Um guten Gewissens mit ausreichendem Chance-Risiko-Verhältnis eine Investition einzugehen (gilt auch für Kurzfrist-Trades) bedarf es schon eines gewissen Basiswissens, das man sich nicht innerhalb weniger Stunden aneignen kann. Diese Basiswissen sollte zumindest eine nähere Kenntnis des Krankheitsbildes, anderer Therapieansätze und -entwicklungen sowie eine kritische Würdigung des konkreten Präparats umfassen. Zwischen Schnelltrades auf Zuruf (Feuerstein) und dem, was man gemeinhin als Zockerei bezeichnet, sehe ich keinen Unterschied.
ipollits Beitrag 638 zielt meines Erachtens in die richtige Richtung.
All dies ändert nichts am guten Bild, das ich während der letzten Jahre von SLGramman gewonnen habe.
Für SLGramann freue mich natürlich über dessen schönen Tradinggewinn.
Grundsätzlich halte ich derartige Aktienkäufe jedoch für wenig sinnvoll. Um guten Gewissens mit ausreichendem Chance-Risiko-Verhältnis eine Investition einzugehen (gilt auch für Kurzfrist-Trades) bedarf es schon eines gewissen Basiswissens, das man sich nicht innerhalb weniger Stunden aneignen kann. Diese Basiswissen sollte zumindest eine nähere Kenntnis des Krankheitsbildes, anderer Therapieansätze und -entwicklungen sowie eine kritische Würdigung des konkreten Präparats umfassen. Zwischen Schnelltrades auf Zuruf (Feuerstein) und dem, was man gemeinhin als Zockerei bezeichnet, sehe ich keinen Unterschied.
ipollits Beitrag 638 zielt meines Erachtens in die richtige Richtung.
All dies ändert nichts am guten Bild, das ich während der letzten Jahre von SLGramman gewonnen habe.
Antwort auf Beitrag Nr.: 46.226.887 von Joschka Schröder am 14.01.14 18:31:40Joschka,
das ist eine korrekte Einschätzung. Rückblickend war es ein wilder Zock auf der Basis extrem unzureichender Informationsbrocken mit verrückterweise glücklichem Ausgang (Verkauf zu 340 Dollar).
Hier eine umfassende, kritische und objektive Würdigung des Sachverhaltes
(benötigt eine kostenlose Registrierung bei seekingAlpha):
http://seekingalpha.com/article/1941981-the-short-story-of-i…
Meine Erachtens sehr lesenswert.
PS: Die Marktkapitalisierung erscheint mir aus heutiger Sicht noch immer deutlich zu hoch...
das ist eine korrekte Einschätzung. Rückblickend war es ein wilder Zock auf der Basis extrem unzureichender Informationsbrocken mit verrückterweise glücklichem Ausgang (Verkauf zu 340 Dollar).
Hier eine umfassende, kritische und objektive Würdigung des Sachverhaltes
(benötigt eine kostenlose Registrierung bei seekingAlpha):
http://seekingalpha.com/article/1941981-the-short-story-of-i…
Meine Erachtens sehr lesenswert.
PS: Die Marktkapitalisierung erscheint mir aus heutiger Sicht noch immer deutlich zu hoch...

Antwort auf Beitrag Nr.: 46.227.889 von SLGramann am 14.01.14 20:33:47Natürlich wäre es besser, wenn man genügend Zeit hätte, alles genau abzuwägen. Aber dadurch verpasst man aber auch manche Aufwärtsbewegung. Manchmal habe ich auch das Gefühl, dass solche Bewegungen nicht völlig unbegründet entstehen, Auch wenn man die genauen Gründe noch nicht versteht, wird der Kurs von Leuten getrieben, die besser informiert sind. Warum sollte z.B. der Kurs von ICPT sich an einem Tag verdreifachen, nur weil die auf einer CC etwas zu einer PII-Studie sagen. ICPT war keine Hype-Aktie, oder? Meiner Meinung nach werden auch besser informierte Kreise gekauft haben.
Wird nicht auch ein Umsatz-Potential von z.B. 5 Mrd USD unterschätzt? Z.B. meldet heute REGN einen Quartalsumsatz von 400 Mio USD mit Eylea. In diesem Jahr sollen es 1,7 Mrd USD werden. REGNs MK liegt bei 30 Mrd USD.

AMD, die Indikation von Eylea, ist ebenfalls ein großer Markt, der mit steigendem Alter der Bevölkerung größer wird und momentan nur von zwei Blockbustern Eylea und Lucentis abgedeckt wird. Ein wirksames Medikament gegen NASH hätte auch großes Potential, denke ich. Ist es relevant, dass NASH nicht unmittelbar lebensbedrohlich ist? Cholesterinsenker sind ja auch nur langfristig und indirekt wirksam, zählten aber lange zu den umsatzstärksten Medikamenten (z.B. Lipidor mit mehr als 12 Mrd USD p.a.), obwohl es gleich mehrere gibt.
Dass OCA sich negativ auf Cholesterin auswirkt, ist nicht so überraschend, da dies durch FXR beeinflusst werden kann.
Was gibt es noch gegen NASH? Z.B. GILDs LOXL2 AK Simtuzumab in PII oder ISISs präklinisches DGAT2-Antisense ISIS-DGAT2Rx.
Ich werde mir mal die französische Genfit genauer ansehen... der PPAR alfa/delta Agonist GFT505 könnte nächstes Jahr PII-Daten in NASH liefern http://genfit.com/en/science-discovery/therapeutic-commitmen… Es findet sich neben OCA z.B. hier: http://www.prweb.com/releases/2013/10/prweb11252212.htm
Genfit's MK ist noch recht niedrig mit ca. 250 Mio EUR:

Gruß
ipollit
Wird nicht auch ein Umsatz-Potential von z.B. 5 Mrd USD unterschätzt? Z.B. meldet heute REGN einen Quartalsumsatz von 400 Mio USD mit Eylea. In diesem Jahr sollen es 1,7 Mrd USD werden. REGNs MK liegt bei 30 Mrd USD.
AMD, die Indikation von Eylea, ist ebenfalls ein großer Markt, der mit steigendem Alter der Bevölkerung größer wird und momentan nur von zwei Blockbustern Eylea und Lucentis abgedeckt wird. Ein wirksames Medikament gegen NASH hätte auch großes Potential, denke ich. Ist es relevant, dass NASH nicht unmittelbar lebensbedrohlich ist? Cholesterinsenker sind ja auch nur langfristig und indirekt wirksam, zählten aber lange zu den umsatzstärksten Medikamenten (z.B. Lipidor mit mehr als 12 Mrd USD p.a.), obwohl es gleich mehrere gibt.
Dass OCA sich negativ auf Cholesterin auswirkt, ist nicht so überraschend, da dies durch FXR beeinflusst werden kann.
Was gibt es noch gegen NASH? Z.B. GILDs LOXL2 AK Simtuzumab in PII oder ISISs präklinisches DGAT2-Antisense ISIS-DGAT2Rx.
Ich werde mir mal die französische Genfit genauer ansehen... der PPAR alfa/delta Agonist GFT505 könnte nächstes Jahr PII-Daten in NASH liefern http://genfit.com/en/science-discovery/therapeutic-commitmen… Es findet sich neben OCA z.B. hier: http://www.prweb.com/releases/2013/10/prweb11252212.htm
Genfit's MK ist noch recht niedrig mit ca. 250 Mio EUR:
Gruß
ipollit
IPH.PA
Innate findet immer mehr Beachtung :-)

Gruß
ipollit
Innate findet immer mehr Beachtung :-)
Gruß
ipollit
AGEN
Im Bereich dem immunologischen Onkologie könnte in einigen Jahren nun auch AGEN interessant werden.
Gestern hat AGEN die 4-Antibody AG übernommen... http://www.4-antibody.com/home.cfm
4-Antibody hat eine eigene AK-Generierungs-Technologie und eine präklinische IO AK-Pipeline... öffentlich sind zwei Projekte gegen OX40 und GITR. Es könnte aber auch ein TIM-3 AK und CXCR3 AK dabei sein... http://marketreports.com/4-antibody-ag-product-pipeline-revi… -> content
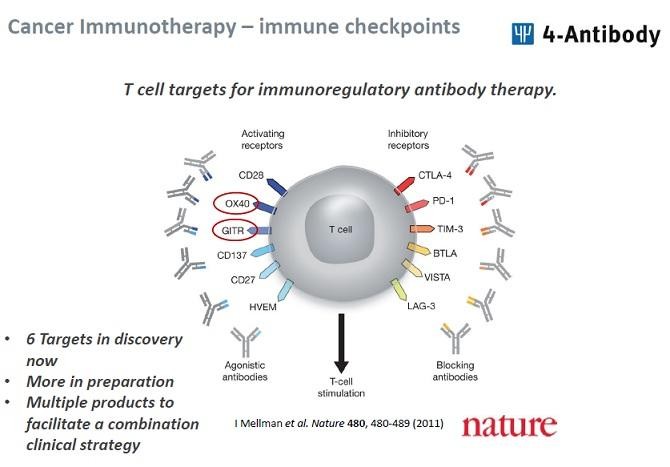
"4-Antibody is in collaboration with leading institutions such as the Ludwig Institute for Cancer Research and MSKCC, and corporate collaborations include Brazil based Recepta Biopharma."
Partner Recepta's Pipeline: http://www.receptabiopharma.com.br/eng/products/recepta_anti…
AGENs AK ist ziemlich am Boden mit ca. 110+X Mio USD

Gruß
ipollit
Im Bereich dem immunologischen Onkologie könnte in einigen Jahren nun auch AGEN interessant werden.
Gestern hat AGEN die 4-Antibody AG übernommen... http://www.4-antibody.com/home.cfm
4-Antibody hat eine eigene AK-Generierungs-Technologie und eine präklinische IO AK-Pipeline... öffentlich sind zwei Projekte gegen OX40 und GITR. Es könnte aber auch ein TIM-3 AK und CXCR3 AK dabei sein... http://marketreports.com/4-antibody-ag-product-pipeline-revi… -> content

"4-Antibody is in collaboration with leading institutions such as the Ludwig Institute for Cancer Research and MSKCC, and corporate collaborations include Brazil based Recepta Biopharma."
Partner Recepta's Pipeline: http://www.receptabiopharma.com.br/eng/products/recepta_anti…
AGENs AK ist ziemlich am Boden mit ca. 110+X Mio USD
Gruß
ipollit
aktuell laufende JPM-Biotech-Konferenz 2014... Agenda, Webcasts und Präsentationen:
http://jpmorgan.metameetings.com/confbook/healthcare14/agend…
Gruß
ipollit
http://jpmorgan.metameetings.com/confbook/healthcare14/agend…
Gruß
ipollit
ALNY
Sanofi investiert 700 Mio USD in ANLY. Vor 2 Jahren hätte ich nicht gedacht, dass ALNY mal eine MK von 5 Mrd USD haben wird.

http://www.fiercebiotech.com/story/sanofi-grabs-700m-stake-a…
Sanofi grabs a $700M stake in Alnylam as it ups the ante on RNAi
Sanofi is doubling down on its RNAi development deal with Alnylam. The pharma giant ($SNY) says it will pay a hefty premium to buy up a 12% stake in the biotech, investing $700 million and greatly expanding its rights to Alnylam's ($ALNY) lead drug along with a portfolio of current and prospective therapies.
The deal highlights Big Pharma's return to RNAi, a new technology for gene silencing that experienced a deep chill several years ago as Roche ($RHHBY) and others bowed out of the field. But Roche recently struck its second RNAi pact and Sanofi clearly believes that the industry is nearing some critical product-development milestones.
The expanded partnership also spotlights Sanofi's growing involvement in the Boston hub, where it paid $20 billion for Genzyme and its rare disease drugs. Now the Genzyme subsidiary will work with Alnylam on patisiran, in development for TTR-familial amyloid polyneuropathy, gaining marketing rights outside of North America and Europe. Sanofi also gains marketing rights to three other therapies in the pipeline while nabbing options on all other products that treat rare diseases.
Alnylam execs have been one of the chief proponents of RNAi as the next big product arena, with potential to rival monoclonal antibodies in terms of revenue potential. And they clearly relished the opportunity to boast about the new deal at the beginning of the big JPMorgan conference in San Francisco.
"RNAi therapeutics now have the opportunity to be the next product platform," Alnylam COO Barry Greene told Reuters.
Gruß
ipollit
Sanofi investiert 700 Mio USD in ANLY. Vor 2 Jahren hätte ich nicht gedacht, dass ALNY mal eine MK von 5 Mrd USD haben wird.
http://www.fiercebiotech.com/story/sanofi-grabs-700m-stake-a…
Sanofi grabs a $700M stake in Alnylam as it ups the ante on RNAi
Sanofi is doubling down on its RNAi development deal with Alnylam. The pharma giant ($SNY) says it will pay a hefty premium to buy up a 12% stake in the biotech, investing $700 million and greatly expanding its rights to Alnylam's ($ALNY) lead drug along with a portfolio of current and prospective therapies.
The deal highlights Big Pharma's return to RNAi, a new technology for gene silencing that experienced a deep chill several years ago as Roche ($RHHBY) and others bowed out of the field. But Roche recently struck its second RNAi pact and Sanofi clearly believes that the industry is nearing some critical product-development milestones.
The expanded partnership also spotlights Sanofi's growing involvement in the Boston hub, where it paid $20 billion for Genzyme and its rare disease drugs. Now the Genzyme subsidiary will work with Alnylam on patisiran, in development for TTR-familial amyloid polyneuropathy, gaining marketing rights outside of North America and Europe. Sanofi also gains marketing rights to three other therapies in the pipeline while nabbing options on all other products that treat rare diseases.
Alnylam execs have been one of the chief proponents of RNAi as the next big product arena, with potential to rival monoclonal antibodies in terms of revenue potential. And they clearly relished the opportunity to boast about the new deal at the beginning of the big JPMorgan conference in San Francisco.
"RNAi therapeutics now have the opportunity to be the next product platform," Alnylam COO Barry Greene told Reuters.
Gruß
ipollit
die Biotechs sind gut ins neue Jahr gestartet... der NBI steigt weiter! Positiv am Aufwärtstrend dürfte sein, dass es immer wieder kleinere Korrekturen gegeben hat. Ewig kann es aber auch nicht so weitergehen... wann wird es einmal eine deutlichere Korrektur geben?

Gruß
ipollit
Gruß
ipollit
die neuen IPOs XLRN und MGNX haben sich zuletzt nicht so schlecht entwickelt...


2014 scheint ein Jahr für EXEL zu werden...

und INCY ist ein Dauerläufer... gestern wurde der bisherige Chef der Onkologie von Novartis zum neuen CEO ernannt, ein erfahrener Mann und mit Jakafi durch den Partner Novartis bereits vertraut. Der bisherige CEO Friedman geht in den wohlverdienten Ruhestand.

Gruß
ipollit
2014 scheint ein Jahr für EXEL zu werden...
und INCY ist ein Dauerläufer... gestern wurde der bisherige Chef der Onkologie von Novartis zum neuen CEO ernannt, ein erfahrener Mann und mit Jakafi durch den Partner Novartis bereits vertraut. Der bisherige CEO Friedman geht in den wohlverdienten Ruhestand.
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.228.993 von ipollit am 14.01.14 23:14:19Guten Morgen allerseits und vorab zuerst mal vielen Dank an diejenigen, die mit ihren zahlreichen und fachkundigen Beiträgen den Thread hier füttern.
"Was gibt es noch gegen NASH? Z.B. GILDs LOXL2 AK Simtuzumab in PII oder ISISs präklinisches DGAT2-Antisense ISIS-DGAT2Rx."
Mir ist gestern MediciNova MNOV (http://www.medicinova.com) an der Nasdaq aufgefallen, die nach einer abgeschlossenen P I in der Indikation NASH deutlich gestiegen sind. Nach einer ersten Schnellsichtung finde ich die Pipeline (http://www.medicinova.com/html/research_developmentpipeline.…) durchaus interessant, allerdings ist alles noch im frühen Stadium, (max. P II) und die finanzielle Ausstattung scheint auch nicht zu üppig. Die Marktkapitalisierung beträgt auch nur etwas mehr als 60 Mio.
Hat sich schon mal jemand mit diesem Wert beschäftigt?
Grüße Oberländler
"Was gibt es noch gegen NASH? Z.B. GILDs LOXL2 AK Simtuzumab in PII oder ISISs präklinisches DGAT2-Antisense ISIS-DGAT2Rx."
Mir ist gestern MediciNova MNOV (http://www.medicinova.com) an der Nasdaq aufgefallen, die nach einer abgeschlossenen P I in der Indikation NASH deutlich gestiegen sind. Nach einer ersten Schnellsichtung finde ich die Pipeline (http://www.medicinova.com/html/research_developmentpipeline.…) durchaus interessant, allerdings ist alles noch im frühen Stadium, (max. P II) und die finanzielle Ausstattung scheint auch nicht zu üppig. Die Marktkapitalisierung beträgt auch nur etwas mehr als 60 Mio.
Hat sich schon mal jemand mit diesem Wert beschäftigt?
Grüße Oberländler
Genfit
GFT505 wirkt auf PPAR alfa/delta nicht auf PPAR gamma.
Takeda's Actos (Pioglitazon) wirkt im Wesentlichen auf PPAR gamma und hat als Diabetes-Mittel (Insulinsensitizer) in 2011 ca. 4,5 Mrd Umsatz erzielt. Es gab aber auch mögliche Nebenwirkungen wie Herzstörungen und ein erhöhtes Krebsrisiko. Inzwischen sind die Patente abgelaufen. GSK's Avandia (Rosiglitazon) wirkt wie Actos ebenfalls auf PPAR gamma und hatte Peak Sales von 2,5 Mrd USD. Wie bei Actos gab es Probleme wie Herzinfakte.
Die PIII-Entwicklung von Roche's Aleglitazar, BMS Muraglitazar und AZs Tesaglitazar als Diabetes-Mittel wurde jeweils wegen Nebenwirkungen abgebrochen. Diese wirken auf PPAR alfa/gamma, also auf 2 PPAR Rezeptoren.
PPAR ist also prinzipiell ein etabliertes Target... aber alles war mit PPAR gamma. Die Frage ist, ob gamma für die Nebenwirkungen verantwortlich ist.
http://www.bioportfolio.com/news/article/1576014/Edison-Inve…
"July 24th 2013: Roche’s recent decision to end the development of its PPARa/g agonist, aleglitazar, may have given a boost to the prospects of Genfit’s PPARa/d agonist GFT505. The decision certainly clears the PPAR agonist field and may open up cardiometabolic disease as a commercially attractive proposition for a future GFT505 partner. Genfit is focused on developing GFT505 in non-alcoholic steatohepatitis (NASH), although it has explored cardiometabolic disease in the past. However, it will need to persuade partners that GFT505’s different receptor sub-type profile means it is clear of the side effects of the troubled glitazar class.
Aleglitazar termination clears wider PPAR field
Earlier this month, Roche terminated its development of its PPARa/g agonist, aleglitazar, citing safety signals and lack of efficacy in AleCardio, a Phase III trial in 7,200 patients with a recent acute coronary syndrome and type 2 diabetes. If Genfit can convince partners – as seems possible – that the safety/efficacy issues of the Roche drug were related to its activity on the PPAR gamma receptor, it could boost the commercial opportunity for GFT505, which is active only on the alpha/delta receptors. Althouth Genfit is focused on developing GFT505 for NASH, the absence of competition in the PPAR field may now attract partners interested in exploring opportunities in cardiometabolic disease.
Investment case remains hinged on NASH…
The investment case for Genfit remains based on the outcome of its Phase IIb trial of GFT505 in NASH. This 270-patient study is due to read out results in December 2014. GFT505 is one of the three most advanced programmes for this condition. Its competitors are Gilead’s simtuzumab and Intercept’s INT-747, both also in Phase IIb.
…but is currently underdiagnosed
NASH has a high unmet need, but is asymptomatic and underdiagnosed. There is as yet no approved non-invasive test and the condition is not routinely screened for, even in diabetic or obese patients, because of the current lack of treatment options"

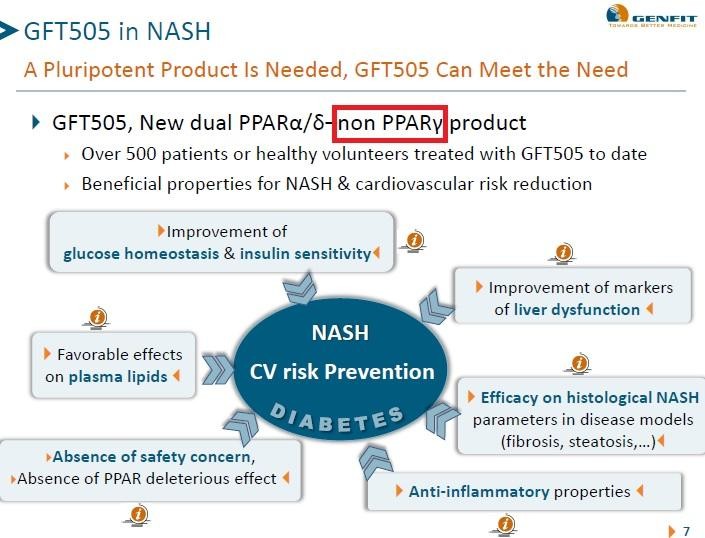
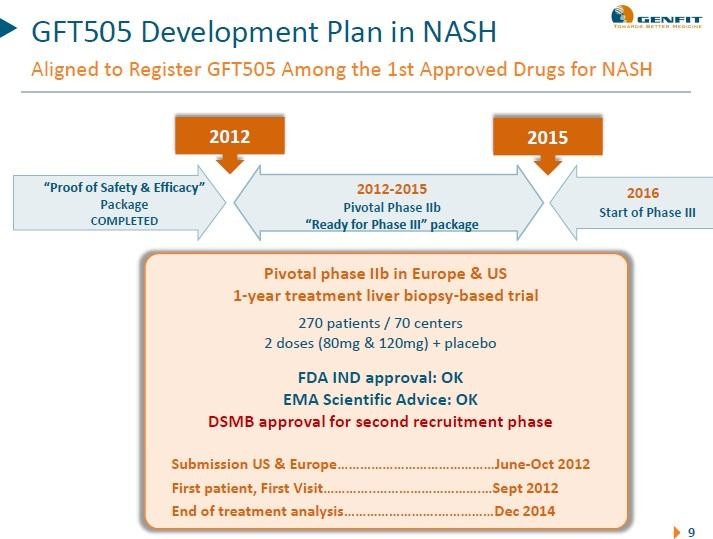
Gruß
ipollit
GFT505 wirkt auf PPAR alfa/delta nicht auf PPAR gamma.
Takeda's Actos (Pioglitazon) wirkt im Wesentlichen auf PPAR gamma und hat als Diabetes-Mittel (Insulinsensitizer) in 2011 ca. 4,5 Mrd Umsatz erzielt. Es gab aber auch mögliche Nebenwirkungen wie Herzstörungen und ein erhöhtes Krebsrisiko. Inzwischen sind die Patente abgelaufen. GSK's Avandia (Rosiglitazon) wirkt wie Actos ebenfalls auf PPAR gamma und hatte Peak Sales von 2,5 Mrd USD. Wie bei Actos gab es Probleme wie Herzinfakte.
Die PIII-Entwicklung von Roche's Aleglitazar, BMS Muraglitazar und AZs Tesaglitazar als Diabetes-Mittel wurde jeweils wegen Nebenwirkungen abgebrochen. Diese wirken auf PPAR alfa/gamma, also auf 2 PPAR Rezeptoren.
PPAR ist also prinzipiell ein etabliertes Target... aber alles war mit PPAR gamma. Die Frage ist, ob gamma für die Nebenwirkungen verantwortlich ist.
http://www.bioportfolio.com/news/article/1576014/Edison-Inve…
"July 24th 2013: Roche’s recent decision to end the development of its PPARa/g agonist, aleglitazar, may have given a boost to the prospects of Genfit’s PPARa/d agonist GFT505. The decision certainly clears the PPAR agonist field and may open up cardiometabolic disease as a commercially attractive proposition for a future GFT505 partner. Genfit is focused on developing GFT505 in non-alcoholic steatohepatitis (NASH), although it has explored cardiometabolic disease in the past. However, it will need to persuade partners that GFT505’s different receptor sub-type profile means it is clear of the side effects of the troubled glitazar class.
Aleglitazar termination clears wider PPAR field
Earlier this month, Roche terminated its development of its PPARa/g agonist, aleglitazar, citing safety signals and lack of efficacy in AleCardio, a Phase III trial in 7,200 patients with a recent acute coronary syndrome and type 2 diabetes. If Genfit can convince partners – as seems possible – that the safety/efficacy issues of the Roche drug were related to its activity on the PPAR gamma receptor, it could boost the commercial opportunity for GFT505, which is active only on the alpha/delta receptors. Althouth Genfit is focused on developing GFT505 for NASH, the absence of competition in the PPAR field may now attract partners interested in exploring opportunities in cardiometabolic disease.
Investment case remains hinged on NASH…
The investment case for Genfit remains based on the outcome of its Phase IIb trial of GFT505 in NASH. This 270-patient study is due to read out results in December 2014. GFT505 is one of the three most advanced programmes for this condition. Its competitors are Gilead’s simtuzumab and Intercept’s INT-747, both also in Phase IIb.
…but is currently underdiagnosed
NASH has a high unmet need, but is asymptomatic and underdiagnosed. There is as yet no approved non-invasive test and the condition is not routinely screened for, even in diabetic or obese patients, because of the current lack of treatment options"



Gruß
ipollit
CLVS
Die weitere Entwicklung des EGFR-Hemmers CO-1686 wird konkreter:
laut CLVS werden 60% der 1st-line Patienten aufgrund der T790M Mutation resistent gegen die aktuellen Mittel wie Traceva. Langfristig ist CO-1686 auch ein Kandidat für die 15%-35% der NSCLC 1st-line-Patienten, die auf EGFR-Hemmer ansprechen.
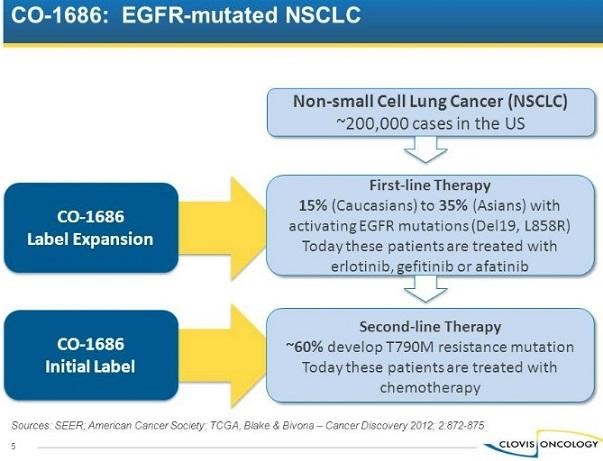
Neben der Wirkung gegen T790M scheint CO-1686 auch nicht die Nebenwirkungen wie die bisherigen Mittel zu haben, die durch die Hemmung von normalem EGFR (wild type) auftreten. Durch die neue Verabreichungsform kann man die Konzentration und damit wahrscheinlich die Wirkung nochmals erhöhen

Es wird 3 Zulassungsstudien geben: Der PII-Teil von TIGER1 (1st-line) startet in 1H 2014 -> Daten 1H 2016, der PIII-Teil ind 1H 2015 -> Daten 1H 2017; TIGER2/3 als T790M 2nd/3rd-line PII soll in 1H 2014 starten und in 2H 2015 Daten liefern. Die Zulassung könnte somit Ende 2015 beantragt werden.

Für den PARP-Hemmer Rucaparib dürfte bald eine Zulassungs-PIII (ARIEL3) in starten Eierstockkrebs starten (die PII ARIEL2 läuft seit Oktober). Außerdem ist eine Zulassungs-PII in 1H 2014 gegen Bauchspeichedrüsenkrebs geplant
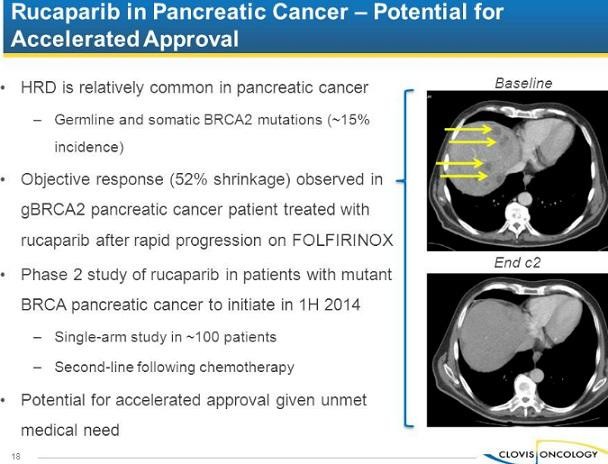
Lucitanib wird zunächst gegen FGR Brust- und Lungenkrebs entwickelt
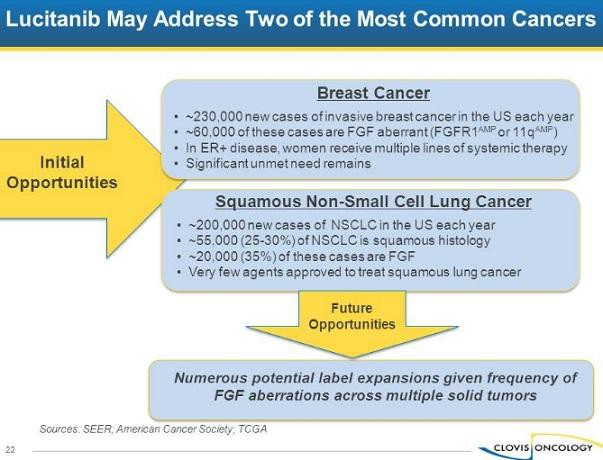
Gruß
ipollit
Die weitere Entwicklung des EGFR-Hemmers CO-1686 wird konkreter:
laut CLVS werden 60% der 1st-line Patienten aufgrund der T790M Mutation resistent gegen die aktuellen Mittel wie Traceva. Langfristig ist CO-1686 auch ein Kandidat für die 15%-35% der NSCLC 1st-line-Patienten, die auf EGFR-Hemmer ansprechen.

Neben der Wirkung gegen T790M scheint CO-1686 auch nicht die Nebenwirkungen wie die bisherigen Mittel zu haben, die durch die Hemmung von normalem EGFR (wild type) auftreten. Durch die neue Verabreichungsform kann man die Konzentration und damit wahrscheinlich die Wirkung nochmals erhöhen

Es wird 3 Zulassungsstudien geben: Der PII-Teil von TIGER1 (1st-line) startet in 1H 2014 -> Daten 1H 2016, der PIII-Teil ind 1H 2015 -> Daten 1H 2017; TIGER2/3 als T790M 2nd/3rd-line PII soll in 1H 2014 starten und in 2H 2015 Daten liefern. Die Zulassung könnte somit Ende 2015 beantragt werden.

Für den PARP-Hemmer Rucaparib dürfte bald eine Zulassungs-PIII (ARIEL3) in starten Eierstockkrebs starten (die PII ARIEL2 läuft seit Oktober). Außerdem ist eine Zulassungs-PII in 1H 2014 gegen Bauchspeichedrüsenkrebs geplant

Lucitanib wird zunächst gegen FGR Brust- und Lungenkrebs entwickelt

Gruß
ipollit
EXEL
der VEGFR+MET-Hemmer Carbozantinib und der MEK-Hemmer Cobimetinib stehen im Mittelpunkt...

dieses Jahr kommen PIII OS- und Schmerz-Daten von Carbo gegen Prostatakrebs und PIII Kombi Daten von Cobimetinib mit Zelboraf von Roche gegen MM. Aufgrund beider wird im Erfolgsfall die Zulassung beantragt.

Carbo PIII-Daten gegen Nierenkrebs soll es in 2015 und gegen Leberkrebs in 2017 geben
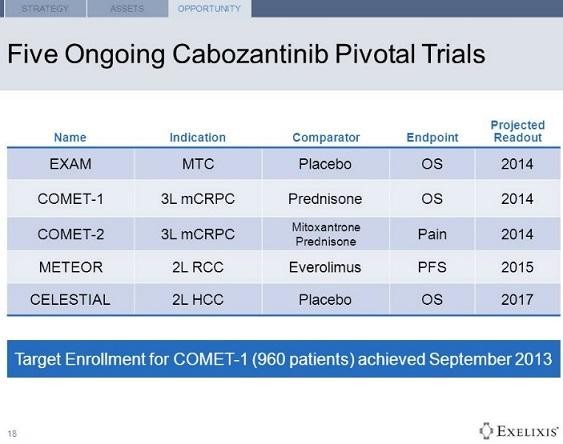
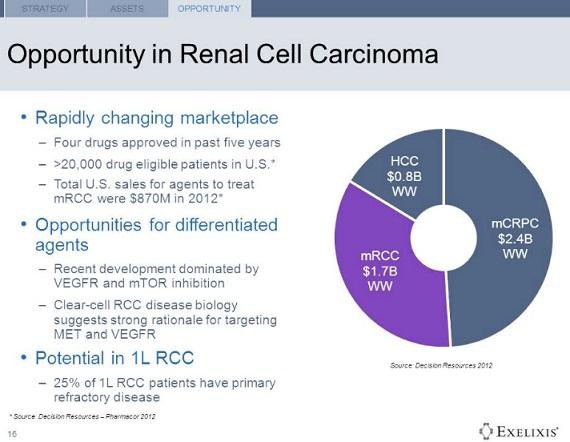
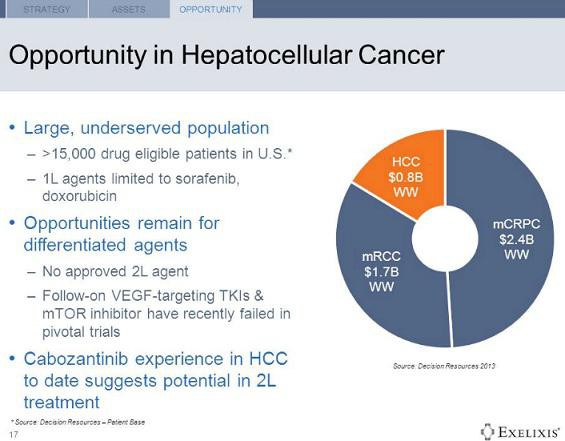
weitere Zulassungsstudien in anderen Indikation werden folgen

für Cobimetinib hat Profit-share Option für die USA mit Roche gezogen

Gruß
ipollit
der VEGFR+MET-Hemmer Carbozantinib und der MEK-Hemmer Cobimetinib stehen im Mittelpunkt...

dieses Jahr kommen PIII OS- und Schmerz-Daten von Carbo gegen Prostatakrebs und PIII Kombi Daten von Cobimetinib mit Zelboraf von Roche gegen MM. Aufgrund beider wird im Erfolgsfall die Zulassung beantragt.

Carbo PIII-Daten gegen Nierenkrebs soll es in 2015 und gegen Leberkrebs in 2017 geben



weitere Zulassungsstudien in anderen Indikation werden folgen

für Cobimetinib hat Profit-share Option für die USA mit Roche gezogen

Gruß
ipollit
Kite (privates Unternehmen)
eine interessante Präsentation bezüglich CART&Co
http://jpmorgan.metameetings.com/confbook/healthcare14/compa…
CART ist auch eine Krebstherapie, die über das Immunsystem wirkt. Anders als bei Checkpoint-Hemmer wie PD-1, die die Tarnung der Krebszellen vor dem Immunsystem schwächen, werden bei CART dem Patienten T-Zellen entnommen und außerhalb des Körpers mittels Gentherapie modifiziert, so dass diese anschließend gezielt Krebszellen angreifen. Diese modifizierten T-Zellen werden per Infusion dem Patienten wieder zurück gegeben, um dann mit der geballten Kraft des Immunsystems gegen die Krebszellen vorzugehen.
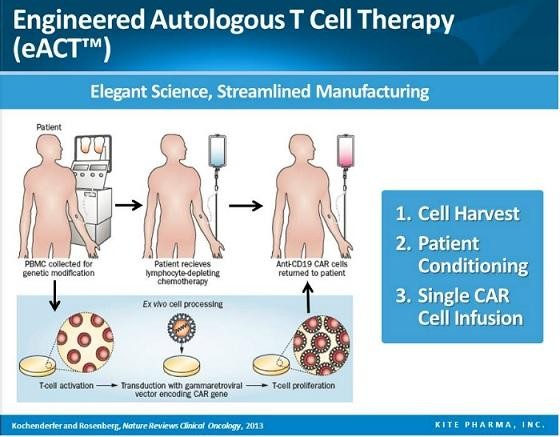
Kite verfolgt die CAR- und die TCR-Technologie. CAR richtet sich nach meinem Verständnis gegen Targets auf der Zelloberfläche, die auch von AKs erreicht werden können. TCR richtet sich dagegen gegen Targets aus dem Zellinneren.
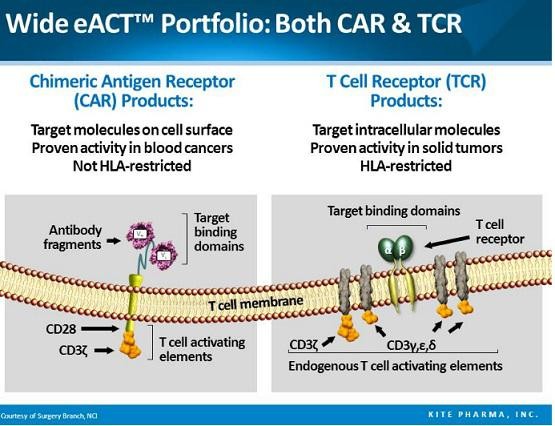
Selbst bei Patienten, bei denen zuvor zahlreiche Therapien wirkungslos geblieben sind (last-line, hoch resistenter Krebs) kann nach nur einer einzigen CART-Transfusion zu einer kompletten Eliminierung des Krebs kommen mit einer langanhaltenden Wirkung...
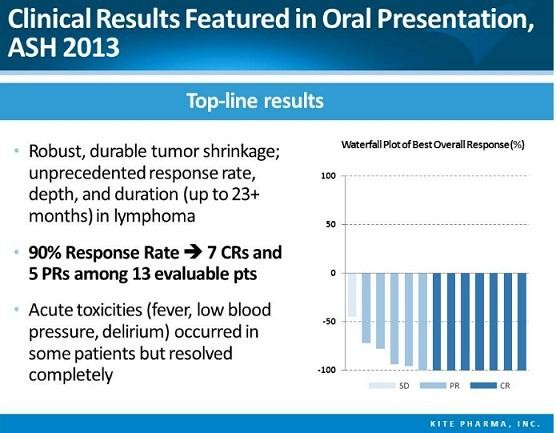
Vergleich von IO-Therapien... bei TILs werden T-Zellen entnommen, die bereits den Krebs erkannt haben und diese dann entsprechend vermehrt, statt diese auf ein spezielles Target zu modifizieren. Allerdings gibt es bisher nur bei Melanoma die Möglichkeit, solche aktivierten T-Zellen in ausreichendem Maße zu extrahieren, so dass TIL auf diese Indikaton begrenzt ist, was sich wohl nicht lohnt. Lion Biotech (LBIO) (erinnert mich an die Lion vom Neuen Markt, hat damit aber nichts zutun) entwickelt TIL: http://lionbio.com/
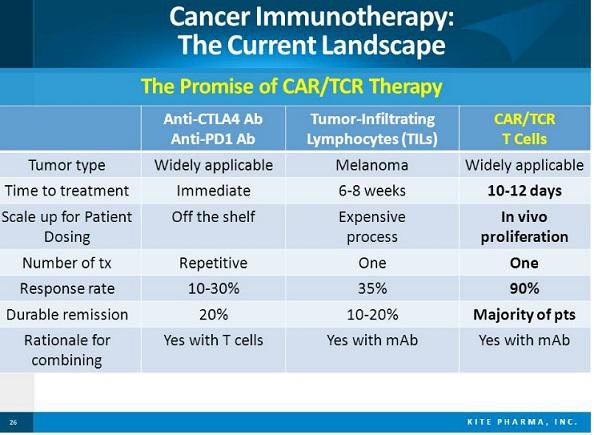
Auf dem CART-Gebiet ist Novartis am weitesten. Handelbar ist z.B. BLUE.
Gruß
ipollit
eine interessante Präsentation bezüglich CART&Co
http://jpmorgan.metameetings.com/confbook/healthcare14/compa…
CART ist auch eine Krebstherapie, die über das Immunsystem wirkt. Anders als bei Checkpoint-Hemmer wie PD-1, die die Tarnung der Krebszellen vor dem Immunsystem schwächen, werden bei CART dem Patienten T-Zellen entnommen und außerhalb des Körpers mittels Gentherapie modifiziert, so dass diese anschließend gezielt Krebszellen angreifen. Diese modifizierten T-Zellen werden per Infusion dem Patienten wieder zurück gegeben, um dann mit der geballten Kraft des Immunsystems gegen die Krebszellen vorzugehen.

Kite verfolgt die CAR- und die TCR-Technologie. CAR richtet sich nach meinem Verständnis gegen Targets auf der Zelloberfläche, die auch von AKs erreicht werden können. TCR richtet sich dagegen gegen Targets aus dem Zellinneren.

Selbst bei Patienten, bei denen zuvor zahlreiche Therapien wirkungslos geblieben sind (last-line, hoch resistenter Krebs) kann nach nur einer einzigen CART-Transfusion zu einer kompletten Eliminierung des Krebs kommen mit einer langanhaltenden Wirkung...

Vergleich von IO-Therapien... bei TILs werden T-Zellen entnommen, die bereits den Krebs erkannt haben und diese dann entsprechend vermehrt, statt diese auf ein spezielles Target zu modifizieren. Allerdings gibt es bisher nur bei Melanoma die Möglichkeit, solche aktivierten T-Zellen in ausreichendem Maße zu extrahieren, so dass TIL auf diese Indikaton begrenzt ist, was sich wohl nicht lohnt. Lion Biotech (LBIO) (erinnert mich an die Lion vom Neuen Markt, hat damit aber nichts zutun) entwickelt TIL: http://lionbio.com/

Auf dem CART-Gebiet ist Novartis am weitesten. Handelbar ist z.B. BLUE.
Gruß
ipollit
Immunocore (privates Unternehmen)
Immunocore ist ein TCR-Unternehmen, das in 2008 von Medigene für fasst nichts ausgegliedert worden ist... unfassbar! Angeblich soll Medigene aber noch einen kleineren Anteil halten von ca. 15%. Immunocore kann sich vor Partnerschaften mit großen Pharmas kaum retten, während Medigene so gut wie mit leeren Händen darsteht.
Angeblich soll Medigene aber noch einen kleineren Anteil halten von ca. 15%. Immunocore kann sich vor Partnerschaften mit großen Pharmas kaum retten, während Medigene so gut wie mit leeren Händen darsteht.
Auf der JPM-Biotech-Konferenz haben sie auch eine interessante Präsentation vorgetragen:
http://jpmorgan.metameetings.com/confbook/healthcare14/compa…
AKs, ADC, biAKs oder CARTs (außerhalb vom Körper modifizierte T-Zellen) zielen auf Oberflächen-Moleküle wie CD20, HER2 oder EGFR. Diese Ziele werden auch von normalen Antikörpern angegriffen.
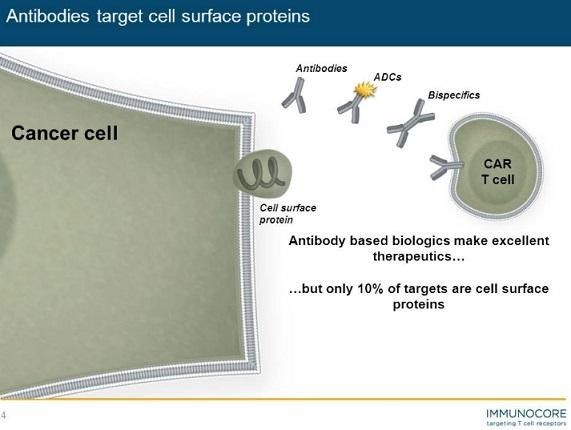
Nach meinem Verständnis prüfen dagegen T-Zellen über ihre T-Zell-Rezeptoren die normalen Körperzellen auf Krankheiten, Fehler usw... dabei werden Targets aus dem Zellinneren an die Oberfläche transportiert und dort über HLA wie ein Fingerabdruck nach außen präsentiert. Die TCRs docken dort an.
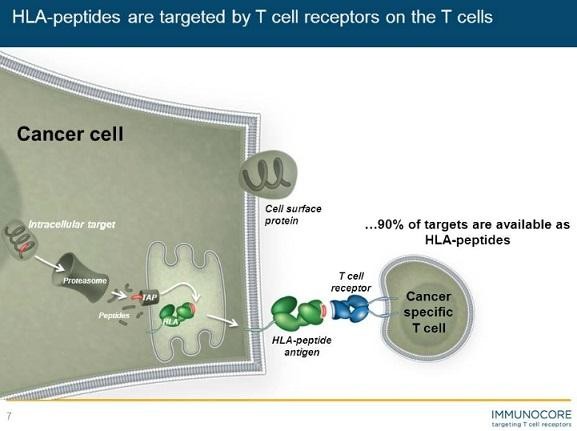
Die TCRs sind Teil der T-Zellen. Immunocore nimmt nun nur diese TCR-Rezeptoren (ohne die T-Zelle) und verbindet diese mit CD3, das T-Zellen aktivieren kann.
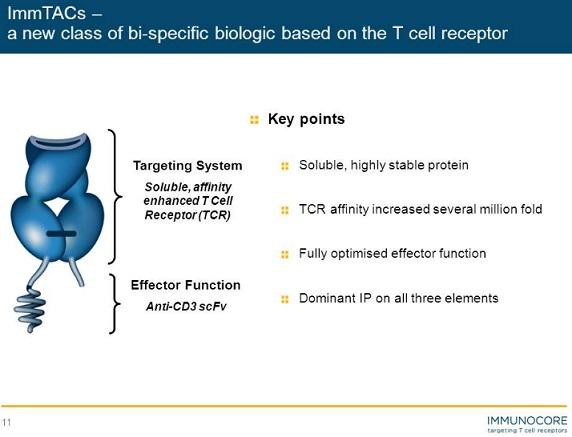
TCR dockt also an die Targets aus dem Inneren der Krebszellen an, während CD3 T-Zellen anlockt und diese aktiviert, so dass sie die Krebszelle zerstören. Man muss somit keine T-Zellen modifizieren wie bei CART.
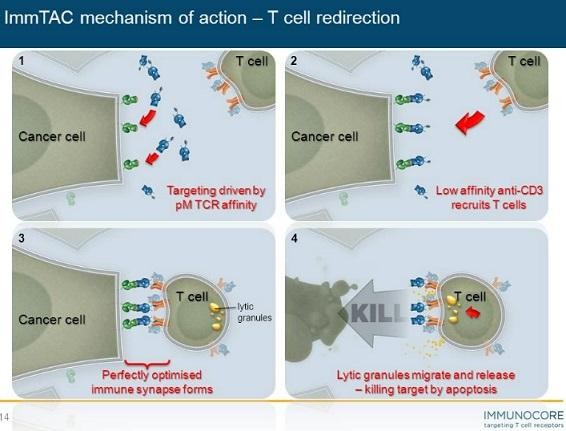
Da Krebszellen ja körpereigene Zellen sind, werden sie prinzipiell erst von T-Zellen angegriffen, wenn ausreichend deutliche Targets auf der Zelle vorhanden sind. Ansonsten könnte es wohl zu heftigen Überreaktionen gegen den eigenen Körper kommen. Krebszellen haben oft aber nur wenig HLA-Targets, so dass diese keine T-Zellen aktivieren. Daher verstärkt Immunocore die TCRs um viele Potenzen, damit sie auch an wenige HLA-Targets lange binden (normalerweise ist die Bindung wohl nur für Sekunden)... z.B. um das 3 Mio-fache...

Ein Risiko könnten gefährliche Autoimmunreaktionen sein. Ein Schwester-Unternehmen Adaptimmune, ebenfalls aus Medigene ausgegründet, stellt nach meinem Verständnis das direkte Gegenstück zu den CARTs her, indem die TCR der T-Zellen verändert werden. Es werden also wie bei CARTs modifizierte T-Zellen erstellt, indem die TCR-Rezeptoren künstlich potenter gemacht werden. Dabei scheint es in klinischen Studien schon Todesfälle gegeben zu haben:
http://pipeline.corante.com/archives/2014/01/07/adoptive_tce…
Recent studies have highlighted what can happen when T cells unexpectedly attack normal tissue. In a clinical trial of TCR-engineered T cells, researchers at the US National Cancer Institute were targeting the cancer-specific antigen MAGE-A3 when two of their nine patients slipped into a coma and died. It turns out that the cells also recognized another member of the MAGE-A family that the researchers later discovered is expressed in low levels in brain tissue. Another type of MAGE-A3-specific TCR caused two patients to die from heart failure when the TCR bound to a similar protein, called Titin, which is expressed on heart cells. Adaptimmune, the company based near Oxford, UK, that developed the T-cell receptor, has implemented more extensive safety testing techniques in an attempt to prevent unexpected reactions in the future.
Die Targets müssen also auch ausreichend selektiv getroffen werden.

Gruß
ipollit
Immunocore ist ein TCR-Unternehmen, das in 2008 von Medigene für fasst nichts ausgegliedert worden ist... unfassbar!
 Angeblich soll Medigene aber noch einen kleineren Anteil halten von ca. 15%. Immunocore kann sich vor Partnerschaften mit großen Pharmas kaum retten, während Medigene so gut wie mit leeren Händen darsteht.
Angeblich soll Medigene aber noch einen kleineren Anteil halten von ca. 15%. Immunocore kann sich vor Partnerschaften mit großen Pharmas kaum retten, während Medigene so gut wie mit leeren Händen darsteht.
Auf der JPM-Biotech-Konferenz haben sie auch eine interessante Präsentation vorgetragen:
http://jpmorgan.metameetings.com/confbook/healthcare14/compa…
AKs, ADC, biAKs oder CARTs (außerhalb vom Körper modifizierte T-Zellen) zielen auf Oberflächen-Moleküle wie CD20, HER2 oder EGFR. Diese Ziele werden auch von normalen Antikörpern angegriffen.

Nach meinem Verständnis prüfen dagegen T-Zellen über ihre T-Zell-Rezeptoren die normalen Körperzellen auf Krankheiten, Fehler usw... dabei werden Targets aus dem Zellinneren an die Oberfläche transportiert und dort über HLA wie ein Fingerabdruck nach außen präsentiert. Die TCRs docken dort an.

Die TCRs sind Teil der T-Zellen. Immunocore nimmt nun nur diese TCR-Rezeptoren (ohne die T-Zelle) und verbindet diese mit CD3, das T-Zellen aktivieren kann.

TCR dockt also an die Targets aus dem Inneren der Krebszellen an, während CD3 T-Zellen anlockt und diese aktiviert, so dass sie die Krebszelle zerstören. Man muss somit keine T-Zellen modifizieren wie bei CART.

Da Krebszellen ja körpereigene Zellen sind, werden sie prinzipiell erst von T-Zellen angegriffen, wenn ausreichend deutliche Targets auf der Zelle vorhanden sind. Ansonsten könnte es wohl zu heftigen Überreaktionen gegen den eigenen Körper kommen. Krebszellen haben oft aber nur wenig HLA-Targets, so dass diese keine T-Zellen aktivieren. Daher verstärkt Immunocore die TCRs um viele Potenzen, damit sie auch an wenige HLA-Targets lange binden (normalerweise ist die Bindung wohl nur für Sekunden)... z.B. um das 3 Mio-fache...

Ein Risiko könnten gefährliche Autoimmunreaktionen sein. Ein Schwester-Unternehmen Adaptimmune, ebenfalls aus Medigene ausgegründet, stellt nach meinem Verständnis das direkte Gegenstück zu den CARTs her, indem die TCR der T-Zellen verändert werden. Es werden also wie bei CARTs modifizierte T-Zellen erstellt, indem die TCR-Rezeptoren künstlich potenter gemacht werden. Dabei scheint es in klinischen Studien schon Todesfälle gegeben zu haben:
http://pipeline.corante.com/archives/2014/01/07/adoptive_tce…
Recent studies have highlighted what can happen when T cells unexpectedly attack normal tissue. In a clinical trial of TCR-engineered T cells, researchers at the US National Cancer Institute were targeting the cancer-specific antigen MAGE-A3 when two of their nine patients slipped into a coma and died. It turns out that the cells also recognized another member of the MAGE-A family that the researchers later discovered is expressed in low levels in brain tissue. Another type of MAGE-A3-specific TCR caused two patients to die from heart failure when the TCR bound to a similar protein, called Titin, which is expressed on heart cells. Adaptimmune, the company based near Oxford, UK, that developed the T-cell receptor, has implemented more extensive safety testing techniques in an attempt to prevent unexpected reactions in the future.
Die Targets müssen also auch ausreichend selektiv getroffen werden.

Gruß
ipollit
Hallo,
ich habe eine Chart-Übersicht in einem neuen Forum gestartet. Für den charttechnisch Interessierten:
http://www.wallstreet-online.de/diskussion/1190461-1-10/biot…
Europäische Werte fehlen allerdings noch. Wer eine gute Quelle weiß kann sich gerne bei mir melden.
SG kmastra
ich habe eine Chart-Übersicht in einem neuen Forum gestartet. Für den charttechnisch Interessierten:
http://www.wallstreet-online.de/diskussion/1190461-1-10/biot…
Europäische Werte fehlen allerdings noch. Wer eine gute Quelle weiß kann sich gerne bei mir melden.
SG kmastra
Antwort auf Beitrag Nr.: 46.244.715 von kmastra am 16.01.14 23:39:21Hallo kmastra,
vielen Dank!
Gruß
ipollit
vielen Dank!

Gruß
ipollit
ARQL
Das DMC hat die Weiterführung der METIV-HCC PIII von Tivantinib empfohlen, nachdem im letzten Jahr die Dosis aufgrund von Nebenwirkungen reduziert werden musste. Danach gab es die Vermutung, dass die anderen Darreichungsform (Tablette statt Kapsel) zu einem geänderten pharmakologischen Verhalten führt, so dass die gleiche Dosis eigentlich einer viel zu hohen Dosierung entspricht.
Dies wird nun laut Mitteilung vom DMC bestätigt... d.h. die niedrigere Dosierung sollte nicht zu einer reduzierten Wirkung führen, was ja befürchtet worden war.
"Recently completed safety analyses among patients treated with 120 mg BID tivantinib tablets showed that the incidence of neutropenia was reduced with this lower dose. In addition, pharmacokinetic analyses from this patient cohort, reviewed by the DMC, demonstrated that the plasma exposure of the 120 mg BID tablets dose was comparable to the exposure achieved with the 240 mg BID capsules dose employed in the Phase 2 trial, with similar medians and overlapping ranges.
A dose reduction from 240 mg BID tablets to 120 mg tablets BID was implemented in September, 2013 following the observation of a higher incidence of neutropenia in the initial phase of the METIV-HCC trial than was observed in the Phase 2 trial in the same patient population where a 240 mg BID capsule dose was administered. Certain enhanced patient monitoring procedures had been temporarily instituted to confirm the safety profile of the lower dose."
AH geht es aufwärts... mal schauen, wie der Markt das morgen sieht.

Gruß
ipollit
Das DMC hat die Weiterführung der METIV-HCC PIII von Tivantinib empfohlen, nachdem im letzten Jahr die Dosis aufgrund von Nebenwirkungen reduziert werden musste. Danach gab es die Vermutung, dass die anderen Darreichungsform (Tablette statt Kapsel) zu einem geänderten pharmakologischen Verhalten führt, so dass die gleiche Dosis eigentlich einer viel zu hohen Dosierung entspricht.
Dies wird nun laut Mitteilung vom DMC bestätigt... d.h. die niedrigere Dosierung sollte nicht zu einer reduzierten Wirkung führen, was ja befürchtet worden war.
"Recently completed safety analyses among patients treated with 120 mg BID tivantinib tablets showed that the incidence of neutropenia was reduced with this lower dose. In addition, pharmacokinetic analyses from this patient cohort, reviewed by the DMC, demonstrated that the plasma exposure of the 120 mg BID tablets dose was comparable to the exposure achieved with the 240 mg BID capsules dose employed in the Phase 2 trial, with similar medians and overlapping ranges.
A dose reduction from 240 mg BID tablets to 120 mg tablets BID was implemented in September, 2013 following the observation of a higher incidence of neutropenia in the initial phase of the METIV-HCC trial than was observed in the Phase 2 trial in the same patient population where a 240 mg BID capsule dose was administered. Certain enhanced patient monitoring procedures had been temporarily instituted to confirm the safety profile of the lower dose."
AH geht es aufwärts... mal schauen, wie der Markt das morgen sieht.
Gruß
ipollit
Dank an ipollit für die anregenden Beiträge!
PCYC
Ende des Monats soll ein neuer BTK-Hemmer in PI gegen Autoimmunerkrankungen wie z.B. RA gehen...

Gruß
ipollit
Ende des Monats soll ein neuer BTK-Hemmer in PI gegen Autoimmunerkrankungen wie z.B. RA gehen...

Gruß
ipollit
Ein guter Kommentar zur Stimmung auf der JPM Biotech Konferenz letzte Woche... (von wo auch die meisten Folien in meinen letzten Postings kommen)
http://www.forbes.com/sites/brucebooth/2014/01/16/jpm-2014-b…
JPM 2014: Broad Optimism About Biotech Innovation
...
Amidst the presentations and partying, there was lots of bullish thinking about biotech delivering innovative medicines, commentary that stocks were trading high but on “fundamentals”, and comparisons of the current market to the Genomics Bubble were wrapped in a “this time is different” story. While there are real drugs and actual profits today (unlike most of biotech in the Genomics Bubble), and those are important differences, we are still bound to the realities of capital market cycles. Right now, we are clearly still in the bullish phase of a 3+ year biotech cycle, but by definition cycles come and go. What most of us hope is that the sector matures (or has matured) so the cycles become less volatile: where the troughs aren’t as deep, even if the euphoria isn’t as high, and we can operate in a more balanced biotech market environment. Where hope and hype play less of a role vs actual data and patient value. This seems reasonably likely given the depth and diversity of the biotech private and public universe of companies today – and lots of momentum coming out of #JPM14 is indicative of this sector maturity. But only time will tell.
...
On the disease area side of things, three themes captured the most attention both at the meeting and in our dialogues with Pharma/Biotech:
1. Immuno-oncology is hot, hot, hot.
All of our discussions with Pharma that have even a fleeting interest in cancer involved an extensive dialogue of immuno-onc. The continued compelling PD-1 data from BMS and Merck (and the latter’s decision to file quickly), the CAR-T immunotherapy explosion around Juno’s monster Series A, and the excitement around the next wave of immune-modulatory oncology targets, kept this theme at the forefront of the cancer dialogues. Expect 2014 to see some further excitement from this field – more deals, more startups, more data. We joke that we should rename all of our companies to include I-O buzzwords in their description (e.g., “we are an immuno-oncology cardiovascular company”).
2. NASH, the new HCV?
Intercept’s early stopping of the FLINT study rocked the house and put NASH into the spotlight. Like HCV, this liver disease is a huge unmet medical need and multi-billion dollar opportunity (see Adam Feuerstein’s post here estimating the NPV of the Intercept drug is $6.5B). Historically though, its long been hard for companies to wrap their heads around how to develop drugs for NASH – the success of the FLINT study may change that. And although the FDA has yet to issue a guidance document on the topic, this is expected in 2014. But it’s clear the data have triggered real interest in the space: in multiple Pharma conservations, we heard real interest in the NASH – what do you have in the field, what have you seen, etc…. I suspect any and all metabolic disease programs across the industry were getting renewed interest this week. We certainly heard a good deal of interest around two clinical candidate stage programs in our portfolio: Nimbus’ Acetyl-CoA Carboxylase (ACC1/2) and Zafgen’s metAP2 cardiometabolic program.
3. RNA therapeutics are back in vogue.
Alnylam’s double-header deals on Monday, acquiring the Sirna assets from Merck and partnering with Genzyme /Sanofi SNY -0.68%,, sent their stock price through the roof (up 36%) and put oligonucleotide drugs on the center stage. Other players in the oligo field have also done well this week as the tide came in: Tekmira up 29%, Arrowhead up 11%, and Regulus 14% (vs Nasdaq Biotech Index up only 5%). Dicerna’s IPO prospects certainly got more interesting. And we heard renewed interest in miRagen and RaNA, our two RNA therapeutic plays, especially around their specialty/orphan disease areas like fibrosis, cardiomyopathy, and muscular atrophy. Its great to see the RNA field maturing – its breadth and diversity (RNAi, antisense, exon-skipping, microRNA, long non-coding RNA, mRNA replacement, etc…) has huge potential to impact disease, and chalking up some “wins” will be important to adequately capitalizing the R&D in the space.
...
Gruß
ipollit
http://www.forbes.com/sites/brucebooth/2014/01/16/jpm-2014-b…
JPM 2014: Broad Optimism About Biotech Innovation
...
Amidst the presentations and partying, there was lots of bullish thinking about biotech delivering innovative medicines, commentary that stocks were trading high but on “fundamentals”, and comparisons of the current market to the Genomics Bubble were wrapped in a “this time is different” story. While there are real drugs and actual profits today (unlike most of biotech in the Genomics Bubble), and those are important differences, we are still bound to the realities of capital market cycles. Right now, we are clearly still in the bullish phase of a 3+ year biotech cycle, but by definition cycles come and go. What most of us hope is that the sector matures (or has matured) so the cycles become less volatile: where the troughs aren’t as deep, even if the euphoria isn’t as high, and we can operate in a more balanced biotech market environment. Where hope and hype play less of a role vs actual data and patient value. This seems reasonably likely given the depth and diversity of the biotech private and public universe of companies today – and lots of momentum coming out of #JPM14 is indicative of this sector maturity. But only time will tell.
...
On the disease area side of things, three themes captured the most attention both at the meeting and in our dialogues with Pharma/Biotech:
1. Immuno-oncology is hot, hot, hot.
All of our discussions with Pharma that have even a fleeting interest in cancer involved an extensive dialogue of immuno-onc. The continued compelling PD-1 data from BMS and Merck (and the latter’s decision to file quickly), the CAR-T immunotherapy explosion around Juno’s monster Series A, and the excitement around the next wave of immune-modulatory oncology targets, kept this theme at the forefront of the cancer dialogues. Expect 2014 to see some further excitement from this field – more deals, more startups, more data. We joke that we should rename all of our companies to include I-O buzzwords in their description (e.g., “we are an immuno-oncology cardiovascular company”).
2. NASH, the new HCV?
Intercept’s early stopping of the FLINT study rocked the house and put NASH into the spotlight. Like HCV, this liver disease is a huge unmet medical need and multi-billion dollar opportunity (see Adam Feuerstein’s post here estimating the NPV of the Intercept drug is $6.5B). Historically though, its long been hard for companies to wrap their heads around how to develop drugs for NASH – the success of the FLINT study may change that. And although the FDA has yet to issue a guidance document on the topic, this is expected in 2014. But it’s clear the data have triggered real interest in the space: in multiple Pharma conservations, we heard real interest in the NASH – what do you have in the field, what have you seen, etc…. I suspect any and all metabolic disease programs across the industry were getting renewed interest this week. We certainly heard a good deal of interest around two clinical candidate stage programs in our portfolio: Nimbus’ Acetyl-CoA Carboxylase (ACC1/2) and Zafgen’s metAP2 cardiometabolic program.
3. RNA therapeutics are back in vogue.
Alnylam’s double-header deals on Monday, acquiring the Sirna assets from Merck and partnering with Genzyme /Sanofi SNY -0.68%,, sent their stock price through the roof (up 36%) and put oligonucleotide drugs on the center stage. Other players in the oligo field have also done well this week as the tide came in: Tekmira up 29%, Arrowhead up 11%, and Regulus 14% (vs Nasdaq Biotech Index up only 5%). Dicerna’s IPO prospects certainly got more interesting. And we heard renewed interest in miRagen and RaNA, our two RNA therapeutic plays, especially around their specialty/orphan disease areas like fibrosis, cardiomyopathy, and muscular atrophy. Its great to see the RNA field maturing – its breadth and diversity (RNAi, antisense, exon-skipping, microRNA, long non-coding RNA, mRNA replacement, etc…) has huge potential to impact disease, and chalking up some “wins” will be important to adequately capitalizing the R&D in the space.
...
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.253.763 von ipollit am 18.01.14 13:47:47Hier ein guter Artikel vom 17.01.2024 zur JPM Healthcare Konferenz:
http://mdbllc.com/wp-content/uploads/2014/01/LSD_JPM_Update_…
http://mdbllc.com/wp-content/uploads/2014/01/LSD_JPM_Update_…
Antwort auf Beitrag Nr.: 46.255.291 von Fruehrentner am 18.01.14 23:17:22Hallo Frührentner, vielen Danke!
Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.244.769 von ipollit am 17.01.14 00:05:24Hallo ipollit, die Kursreaktion bei ARQL fand ich etwas mau. Ich finde die Nachricht wirklich wichtig. Tivantinib ist nun definitiv noch "im Spiel". (Allerdings muss man mal fragen, was da bei ARQL für Leute die Studien designen? Bei NSCLC konzentriert man sich nicht auf die met-high-Patienten (um Gottes willen, warum eigentlich nicht?) und vergeigt es ziemlich komplett und bei HCC ändert man mal für die PIII(!) die Darreichungsform, was zu einer ganz anderen PK führt! Man sollte meinen, dass man so etwas vorher ausprobiert und nicht in einem pivotal-Trial mal einen Testballon fliegen lässt...)
Anderes Thema:
STML haben bei 7fachem Umsatz 40% zugelegt. Nachrichtenlos. Ist das nur das in dieser Aktie nicht unübliche Gezocke oder haben sie bei bei der JPM Healthcare Konferenz wirklich überzeugt? Das hohe Volumen könnte für letzteres sprechen.
Gruß
SLG
Anderes Thema:
STML haben bei 7fachem Umsatz 40% zugelegt. Nachrichtenlos. Ist das nur das in dieser Aktie nicht unübliche Gezocke oder haben sie bei bei der JPM Healthcare Konferenz wirklich überzeugt? Das hohe Volumen könnte für letzteres sprechen.
Gruß
SLG
Antwort auf Beitrag Nr.: 46.255.845 von SLGramann am 19.01.14 10:49:03PS: Bin sehr von Clovis überzeugt und habe meine Position um ein Drittel vergrößert.
Auch australische Biotech Firmen tummelten sich auf der JPMHC:
Australian biotechnology start-ups seek funds in US
January 13, 2014
A horde of Australian life-science hopefuls have flocked to San Francisco for the annual JPMorgan healthcare conference, keen to spruik their stories and potentially begin another strong year for Australian biotechnology stocks.
The start-up companies may not officially be invited to the conference, which began last Monday and is traditionally a platform for established outfits like Cochlear and CSL, but they plan to attract potential investors and partners nonetheless.
read more: http://www.smh.com.au/business/australian-biotechnology-star…
Australian biotechnology start-ups seek funds in US
January 13, 2014
A horde of Australian life-science hopefuls have flocked to San Francisco for the annual JPMorgan healthcare conference, keen to spruik their stories and potentially begin another strong year for Australian biotechnology stocks.
The start-up companies may not officially be invited to the conference, which began last Monday and is traditionally a platform for established outfits like Cochlear and CSL, but they plan to attract potential investors and partners nonetheless.
read more: http://www.smh.com.au/business/australian-biotechnology-star…
Antwort auf Beitrag Nr.: 46.255.359 von ipollit am 19.01.14 00:18:04@ipollit
Dank zurück für Deine fundierten Beiträge hier.
Grüße
Frührentner
Dank zurück für Deine fundierten Beiträge hier.
Grüße
Frührentner

Ich wage zu behaupten, dass auch 2014 erfreulich laufen wird für Biotechs.
Antwort auf Beitrag Nr.: 46.307.005 von Fruehrentner am 25.01.14 23:40:35Für den weiterhin überhitzten Biotech-Markt erwarte ich eine Korrektur großen Ausmaßes. Wer geduldig wartet, düfte dann gute Einstiegsgelegenheiten finden.
Antwort auf Beitrag Nr.: 46.311.219 von Joschka Schröder am 27.01.14 02:34:45Danke für Deine Einschätzung, Joschka.
Du könntest Recht behalten, denn ich war schon immer ein guter Kontraindikator
Du könntest Recht behalten, denn ich war schon immer ein guter Kontraindikator

Ich denke es herrscht Konsens, dass eine Korrektur wahrscheinlich ist. Aber wenn ich ehrlich bin: Wissen tue ich es nicht! Die Korrektur im Oktober wurde auch ziemlich schnell wieder durch eine regelrechte Kaufpanik abgelöst.

Ich habe zumindest ein wenig Geld vom Tisch genommen. Gerade bei solchen Werten, bei denen demnächst auch nichts ansteht.

Ich habe zumindest ein wenig Geld vom Tisch genommen. Gerade bei solchen Werten, bei denen demnächst auch nichts ansteht.
Zitat von kmastra: Ich denke es herrscht Konsens, dass eine Korrektur wahrscheinlich ist. Aber wenn ich ehrlich bin: Wissen tue ich es nicht!
Da geht es mir natürlich nicht anders. Meine Einschätzung basiert auf Stimmungsindikatoren und (überoptimistischen) Analysteneinschätzungen. Trotzdem kann es natürlich völlig anders kommen als erwartet, gerade im Fall politischer (Notenbank-gesteuerter) Börsen.
MDVN
mittel- und langfristig halte ich den AR-Rezeptor-Hemmer Xtandi für sehr aussichtsreich, alleine gegen Prostatakrebs könnte es ein Multi-Mrd Blockbuster werden. Brustkrebs ist eine mögliche weitere große Indikation.
Xtandi ist der direkte Konkurrent von J&J Zytia, das bereits ein wenig länger auf dem Markt ist. Die Wirkung von Xtandi scheint besser zu sein. Ein größerer Vorteil sollte sein, dass Xtandi als Monotherapie angewendet werden kann, während Zytiga nur mit Prednisone verabreicht wird, welches eigene Nebenwirkungen hat und nur ungerne von Urologen und nicht bei Brustkrebs angewendet wird.
Gestern gab es weitere sehr positive PIII-Daten...
http://www.thestreet.com/story/12279595/1/medivation-first-l…
die bisherigen Xtandi PIII-Daten bei Prostatakrebs, angewendet vor einer Chemo
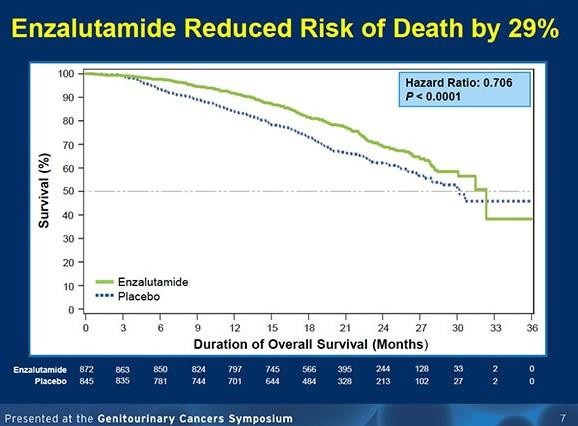
passend dazu die Zytiga+Prednisone PIII-Daten
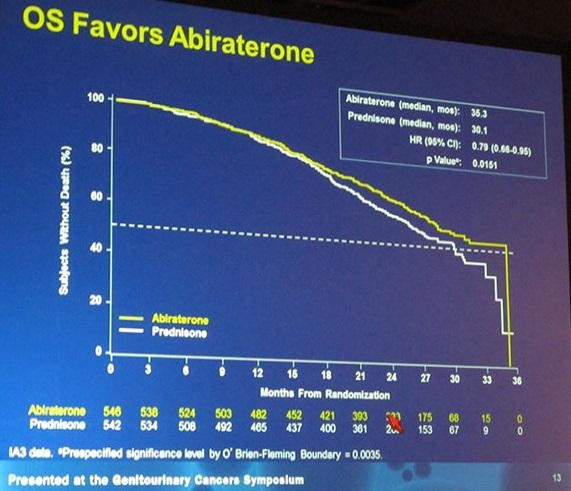
die Xtandi-Kurve trennt sich deutlich früher vom Placebo-Arm.
Partner ist Astellas, die sich in dem Bereich eigentlich gut auskennen. In den USA ist es eine 50:50 Partnerschaft, sonst erhält MDVN Royalties.
aktuelle MK 6,1 Mrd USD. Eine erste Position habe ich nun gekauft... mal schauen

Gruß
ipollit
mittel- und langfristig halte ich den AR-Rezeptor-Hemmer Xtandi für sehr aussichtsreich, alleine gegen Prostatakrebs könnte es ein Multi-Mrd Blockbuster werden. Brustkrebs ist eine mögliche weitere große Indikation.
Xtandi ist der direkte Konkurrent von J&J Zytia, das bereits ein wenig länger auf dem Markt ist. Die Wirkung von Xtandi scheint besser zu sein. Ein größerer Vorteil sollte sein, dass Xtandi als Monotherapie angewendet werden kann, während Zytiga nur mit Prednisone verabreicht wird, welches eigene Nebenwirkungen hat und nur ungerne von Urologen und nicht bei Brustkrebs angewendet wird.
Gestern gab es weitere sehr positive PIII-Daten...
http://www.thestreet.com/story/12279595/1/medivation-first-l…
die bisherigen Xtandi PIII-Daten bei Prostatakrebs, angewendet vor einer Chemo

passend dazu die Zytiga+Prednisone PIII-Daten

die Xtandi-Kurve trennt sich deutlich früher vom Placebo-Arm.
Partner ist Astellas, die sich in dem Bereich eigentlich gut auskennen. In den USA ist es eine 50:50 Partnerschaft, sonst erhält MDVN Royalties.
aktuelle MK 6,1 Mrd USD. Eine erste Position habe ich nun gekauft... mal schauen
Gruß
ipollit
ENTA:
Heute wieder eine Reihe von P III Ergebnissen vor allem all oral. Kann gut mit Gilead mithalten. Abbvie gab zudem bekannt, dass sie noch in 2014 mit der Zulassung rechnen. Das sind natürlich super Nachrichten.

Die Dynamik bei HEPC ist wirklich unglaublich. Im Grunde ist doch damit das Ende von Hepatitis eingeleitet?
Interessant auch, wie sich das ehemalige Wunder Präperat von Vertex entwickelt hat. War mal der erfolgreichste Start eines Medikaments überhaupt und ist nach wenigen Quartalen fast wieder bei null angekommen.

Heute wieder eine Reihe von P III Ergebnissen vor allem all oral. Kann gut mit Gilead mithalten. Abbvie gab zudem bekannt, dass sie noch in 2014 mit der Zulassung rechnen. Das sind natürlich super Nachrichten.

Die Dynamik bei HEPC ist wirklich unglaublich. Im Grunde ist doch damit das Ende von Hepatitis eingeleitet?
Interessant auch, wie sich das ehemalige Wunder Präperat von Vertex entwickelt hat. War mal der erfolgreichste Start eines Medikaments überhaupt und ist nach wenigen Quartalen fast wieder bei null angekommen.

...Bezieht sich natürlich auf Hepatitis C. Noch eine interssante Übersicht:


seit fast einem dreiviertel jahr hab ich mir wieder mal eine biotechaktie zugelegt.
enanta pharmaceuticals (enta) hat heute das allzeithoch durchbrochen.
zahlen kommen am 24. Februar.
enanta pharmaceuticals (enta) hat heute das allzeithoch durchbrochen.
zahlen kommen am 24. Februar.
Antwort auf Beitrag Nr.: 46.144.903 von kmastra am 02.01.14 18:16:26@kmastra
mit FURX hast du ja ziemlich gut gelegen... besser geht es kaum in dieser kurzen Zeit:

Gruß
ipollit
mit FURX hast du ja ziemlich gut gelegen... besser geht es kaum in dieser kurzen Zeit:
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.406.454 von ipollit am 08.02.14 12:13:09Hallo ipollit,
kann mich sicher nicht beschweren.
FURX ist/war eine echt komische Aktie. Scheinbar total unbekannt. Es gab nicht mal mehr irgendwelche SA-Artikel und leider auch keinen Kursanstieg in Antizipation der PIII Ergebnisse. Geholfen haben jetzt sicherlich auch die Geschehnisse um ICPT. "The next ICPT"...
Auch wenn ich die Aktie langfristig orientiert gekauft hatte, habe ich die Position nun komplett verkauft. Einen Teil hatte ich sogar vor den Ergebnissen verkauft, weil mir das Risiko sonst zu groß gewesen wäre. Aber was soll's ich freue mich über den Gewinn!
SG kmastra
kann mich sicher nicht beschweren.

FURX ist/war eine echt komische Aktie. Scheinbar total unbekannt. Es gab nicht mal mehr irgendwelche SA-Artikel und leider auch keinen Kursanstieg in Antizipation der PIII Ergebnisse. Geholfen haben jetzt sicherlich auch die Geschehnisse um ICPT. "The next ICPT"...
Auch wenn ich die Aktie langfristig orientiert gekauft hatte, habe ich die Position nun komplett verkauft. Einen Teil hatte ich sogar vor den Ergebnissen verkauft, weil mir das Risiko sonst zu groß gewesen wäre. Aber was soll's ich freue mich über den Gewinn!
SG kmastra
Hallo in die Runde,
war das schon die Korrektur? Ich weiß es nicht, denke aber eher nicht.
Irgendwann wird sicherlich "die große Korrektur" kommen. Momentan scheint die Angst etwas zu verpassen noch ziemlich groß zu sein. (s. auch schon wieder die IPOs)

Habe in letzter Zeit weitere Teilverkäufe getätigt, bei Werten die ich für optimistsich bewertet halte und FURX sogar komplett verkauft.
Bei ARRY (ja, ich weiß:laugh , AMBI, KBIO und Medigene habe ich hingegen zugekauft bzw. bin eingestiegen, weil ich die Bewertung mit einem Zeithorizont von 2 Jahren für attraktiv halte. Unabhängig davon, ob die Korrektur kommt oder nicht.
, AMBI, KBIO und Medigene habe ich hingegen zugekauft bzw. bin eingestiegen, weil ich die Bewertung mit einem Zeithorizont von 2 Jahren für attraktiv halte. Unabhängig davon, ob die Korrektur kommt oder nicht.
ARRY: Mkpt: 600 Mio$ Charttechnisch sieht es so aus, als hätte die untere Begrenzung des Abwärtstrends gehalten. Fundamental bin ich eh von einer Unterbewertumg überzeugt. ARRY war ja hier schon häufiger Thema.

AMBI: Mkpt: 180 Mio$ Finde ich weiterhin viel zu billig. Die PIII soll in gut zwei Jahren fertig sein. Bis dahin sehe ich hier erhebliches Potenzial, zumal die Chancen ziemlich gut stehen. Zudem erscheint mir der Wert unbekannt und keinesfalls gehypt. Charttechnisch sind 50% des Kursanstiegs wieder weg. Eventuell geht es hier jetzt wieder nach Oben.

KBIO: Mkpt: 96 Mio$ Hier hat der Kurs unter negativen Studienergebnissen von KB003 gelitten. Positiv sehe ich aber, dass das Program konsequent eingestellt wurde (statt eine Subgruppe zu (er)finden etc.) KBOO1 ist zudem an Sanofi verpartnert und für mich das Haupargument. KBIO wird aber nur knapp über Cash gehandelt. Mit KB004 ist zudem ein weiteres interessantes Projekt vorhanden. Charttechnisch könnte ein Boden gebildet worden sein.

Medigene: Mkpt: 38 Mio EUR Hier finde ich die Beteiligung an Immunocore interessant. Sollten aus den 3 Kooperationen (Roche, AstraZeneca und GlaxoSmithKline) tatsächlich Projekte für die Klinik entstehen bzw. sogar ein Börsengang angestrebt werden, könnte die Beteiligung schon den Börsenwert von Medigene übersteigen.
Hier könnte ein Turnaround anstehen, nachdem die letzten Jahre ja nur bergab gingen. Auch die Projekte von Medigene sind ja nicht wertlos. Von einer Biotech Blase ist hier zumindest nichts zu sehen.

P.S. Habe aber weiterhin recht große Cashreserven, um ggf. nachkaufen zu können.
SG kmastra
war das schon die Korrektur? Ich weiß es nicht, denke aber eher nicht.
Irgendwann wird sicherlich "die große Korrektur" kommen. Momentan scheint die Angst etwas zu verpassen noch ziemlich groß zu sein. (s. auch schon wieder die IPOs)
Habe in letzter Zeit weitere Teilverkäufe getätigt, bei Werten die ich für optimistsich bewertet halte und FURX sogar komplett verkauft.
Bei ARRY (ja, ich weiß:laugh
 , AMBI, KBIO und Medigene habe ich hingegen zugekauft bzw. bin eingestiegen, weil ich die Bewertung mit einem Zeithorizont von 2 Jahren für attraktiv halte. Unabhängig davon, ob die Korrektur kommt oder nicht.
, AMBI, KBIO und Medigene habe ich hingegen zugekauft bzw. bin eingestiegen, weil ich die Bewertung mit einem Zeithorizont von 2 Jahren für attraktiv halte. Unabhängig davon, ob die Korrektur kommt oder nicht. ARRY: Mkpt: 600 Mio$ Charttechnisch sieht es so aus, als hätte die untere Begrenzung des Abwärtstrends gehalten. Fundamental bin ich eh von einer Unterbewertumg überzeugt. ARRY war ja hier schon häufiger Thema.
AMBI: Mkpt: 180 Mio$ Finde ich weiterhin viel zu billig. Die PIII soll in gut zwei Jahren fertig sein. Bis dahin sehe ich hier erhebliches Potenzial, zumal die Chancen ziemlich gut stehen. Zudem erscheint mir der Wert unbekannt und keinesfalls gehypt. Charttechnisch sind 50% des Kursanstiegs wieder weg. Eventuell geht es hier jetzt wieder nach Oben.
KBIO: Mkpt: 96 Mio$ Hier hat der Kurs unter negativen Studienergebnissen von KB003 gelitten. Positiv sehe ich aber, dass das Program konsequent eingestellt wurde (statt eine Subgruppe zu (er)finden etc.) KBOO1 ist zudem an Sanofi verpartnert und für mich das Haupargument. KBIO wird aber nur knapp über Cash gehandelt. Mit KB004 ist zudem ein weiteres interessantes Projekt vorhanden. Charttechnisch könnte ein Boden gebildet worden sein.
Medigene: Mkpt: 38 Mio EUR Hier finde ich die Beteiligung an Immunocore interessant. Sollten aus den 3 Kooperationen (Roche, AstraZeneca und GlaxoSmithKline) tatsächlich Projekte für die Klinik entstehen bzw. sogar ein Börsengang angestrebt werden, könnte die Beteiligung schon den Börsenwert von Medigene übersteigen.
Hier könnte ein Turnaround anstehen, nachdem die letzten Jahre ja nur bergab gingen. Auch die Projekte von Medigene sind ja nicht wertlos. Von einer Biotech Blase ist hier zumindest nichts zu sehen.

P.S. Habe aber weiterhin recht große Cashreserven, um ggf. nachkaufen zu können.
SG kmastra
Hi @all,
Zunächst Dankeschön für Deine Infos und Kommentare zu diesem Wert ipolit (hatte mich nicht vor einigen Wochen vergessen zu bedanken):
Cardiome Pharma
Schaut mal (wenn's denn interessiert):
http://finance.yahoo.com/news/cardiomes-brinavess-demonstrat…
Denke, dass wir nun locker auf die 20 zugehen. Ende des Jahres könnte ich mir durchaus auch >> 50 vorstellen.
Grüsse an Alle und Danke auch an die anderen 2 für die updates/Infos/Anregungen
Gruss
Zunächst Dankeschön für Deine Infos und Kommentare zu diesem Wert ipolit (hatte mich nicht vor einigen Wochen vergessen zu bedanken):
Cardiome Pharma
Schaut mal (wenn's denn interessiert):
http://finance.yahoo.com/news/cardiomes-brinavess-demonstrat…
Denke, dass wir nun locker auf die 20 zugehen. Ende des Jahres könnte ich mir durchaus auch >> 50 vorstellen.
Grüsse an Alle und Danke auch an die anderen 2 für die updates/Infos/Anregungen
Gruss
Antwort auf Beitrag Nr.: 46.447.291 von sufenta am 13.02.14 21:46:15
als link von oben (gab aber einiges mehr an Nachrichten zu diesem Wert)
http://finance.yahoo.com/news/cardiomes-brinavess-demonstrat…
als link von oben (gab aber einiges mehr an Nachrichten zu diesem Wert)
http://finance.yahoo.com/news/cardiomes-brinavess-demonstrat…
Antwort auf Beitrag Nr.: 46.423.100 von kmastra am 11.02.14 13:09:09Hallo kmastra,
ARRY und AMBI sehe ich auch positiv.
Allerdings:
Bei Array sehe ich einen Finanzierungsbedarf in Höhe von ca. 100 Mio. Euro in diesem Jahr (man kann ja nicht den vorhandenen Cash ganz runterbrennen). Jetzt ist die Frage, ob und in welchem Maße neue Verpartnerungen gelingen und wie viel Geld über eine KE eingeworben werden muss.
Ich gehe davon aus, dass wir dieses Jahr bei Array noch eine größere KE sehen werden.
Was MEK162 betrifft: Nach wie vor vetritt Array die Aussage, dass es in 2015 zum ersten Zulassungsantrag kommt, was für entsprechende Daten Ende 2014 oder Anfang 2015 spricht:
("NRAS-mutant melanoma represents the first potential indication for binimetinib, with a projected regulatory filing from the NRAS-mutant melanoma study estimated to be in 2015.")
Mitte 2015 bekommen wir dann ne Menge Daten der MEKs. Ich gehe davon aus, dass Array dann einiges höher notieren werden, aber leider wird sich die KE nicht so lange ziehen lassen.
Zu AMBI: Hammer hat die Zulassungswahrscheinlichkeit kürzlich auf Nachfrage bei 50% eingeordnet. Ich denke, für sich persönlich geht er wohl von "ein Stück über 50%" aus.
Das ist zwar gut, aber AMBI ist von quizartinib schon sehr abhängig. Ich bin dabei, wage aber keine wirklich große Position einzugehen.
Gruß
SLG
ARRY und AMBI sehe ich auch positiv.
Allerdings:
Bei Array sehe ich einen Finanzierungsbedarf in Höhe von ca. 100 Mio. Euro in diesem Jahr (man kann ja nicht den vorhandenen Cash ganz runterbrennen). Jetzt ist die Frage, ob und in welchem Maße neue Verpartnerungen gelingen und wie viel Geld über eine KE eingeworben werden muss.
Ich gehe davon aus, dass wir dieses Jahr bei Array noch eine größere KE sehen werden.
Was MEK162 betrifft: Nach wie vor vetritt Array die Aussage, dass es in 2015 zum ersten Zulassungsantrag kommt, was für entsprechende Daten Ende 2014 oder Anfang 2015 spricht:
("NRAS-mutant melanoma represents the first potential indication for binimetinib, with a projected regulatory filing from the NRAS-mutant melanoma study estimated to be in 2015.")
Mitte 2015 bekommen wir dann ne Menge Daten der MEKs. Ich gehe davon aus, dass Array dann einiges höher notieren werden, aber leider wird sich die KE nicht so lange ziehen lassen.
Zu AMBI: Hammer hat die Zulassungswahrscheinlichkeit kürzlich auf Nachfrage bei 50% eingeordnet. Ich denke, für sich persönlich geht er wohl von "ein Stück über 50%" aus.
Das ist zwar gut, aber AMBI ist von quizartinib schon sehr abhängig. Ich bin dabei, wage aber keine wirklich große Position einzugehen.
Gruß
SLG
obwohl zuletzt immer von einer Biotech-Blase die Rede ist, steckt der NBI noch alle Korrekturversuche weg...

Fundamental sind meiner Meinung nach die Bewertungen insbesondere der großen Biotechs, die den NBI tragen, noch nicht deutlich übertrieben. Die massiven IPO-Wellen zeigen aber auch, dass das Interesse und die Bewertungen wohl eher im oberen Bereich liegen, so dass viele jetzt eine günstige Gelegenheit sehen, an den Markt zu gehen.
Nach den Schätzungen auf Yahoo haben die großen Biotechs im Schnitt ein KGV15e von 25,4 bei einem Gewinn-Wachstum 2014-2015 von 34%, die der Pharmas liegen dagegen bei 16,4 bei einem Wachstum von 8%. Ist das in der Relation wirklich deutlich überbewertet?
Gruß
ipollit
Fundamental sind meiner Meinung nach die Bewertungen insbesondere der großen Biotechs, die den NBI tragen, noch nicht deutlich übertrieben. Die massiven IPO-Wellen zeigen aber auch, dass das Interesse und die Bewertungen wohl eher im oberen Bereich liegen, so dass viele jetzt eine günstige Gelegenheit sehen, an den Markt zu gehen.
Nach den Schätzungen auf Yahoo haben die großen Biotechs im Schnitt ein KGV15e von 25,4 bei einem Gewinn-Wachstum 2014-2015 von 34%, die der Pharmas liegen dagegen bei 16,4 bei einem Wachstum von 8%. Ist das in der Relation wirklich deutlich überbewertet?
MK KGV15e Gewinnwachstum
GILD 127 14,6 50%
AMGN 94 14,3 7%
BIIB 82 24,9 23%
CELG 66 16,8 31%
ALXN 36 35,4 32%
REGN 33 46,5 58%
Biotechs 73 25,4 34%
JNJ 258 14,6 8%
RHHBY 256 16,7 9%
PFE 204 13,3 4%
NVS 201 15,4 5%
MRK 164 15,1 8%
SNY 134 12,8 13%
GSK 133 13,3 13%
BMY 89 32,0 -5%
AZN 83 15,3 1%
AZ 81 14,2 16%
LLY 63 18,2 13%
Pharmas 151 16,4 8%
Gruß
ipollit
Nach der Übernahme von 4-Antibody habe ich nun auch eine kleine AGEN-Position. Der Bereich der immunologischen Onkologie ist bei Pharmas sehr begehrt. AGEN hat nun mehrere Checkpoint-Hemmer und Stimulatoren in der Präklinik. INDs (PI) wird aber wohl noch bis Ende nächsten Jahres dauern, so dass man einen längeren Atem haben muss. Die Bewertung ist mit ca. 200 Mio USD aber auch nicht so hoch.

Im IO-Bereich habe ich nun bereits einige Positionen im Depot:
AGEN - OX40, CTLA-4, GITR, PD-1, TIM3, LAG3 (pre)
IPH.PA - KIR (PI/II), NKG2A (PI/II), MICA (pre)
INCY - IDO (PI/II)
CLDX - CD27 (PI)
MGNX - B7-H3 (PI)
AMBI - CSF1R (pre)
ARRY - TLR8 (PII)
Gruß,
ipollit
Im IO-Bereich habe ich nun bereits einige Positionen im Depot:
AGEN - OX40, CTLA-4, GITR, PD-1, TIM3, LAG3 (pre)
IPH.PA - KIR (PI/II), NKG2A (PI/II), MICA (pre)
INCY - IDO (PI/II)
CLDX - CD27 (PI)
MGNX - B7-H3 (PI)
AMBI - CSF1R (pre)
ARRY - TLR8 (PII)
Gruß,
ipollit
Antwort auf Beitrag Nr.: 46.494.395 von SLGramann am 20.02.14 11:43:52Hallo SLGramann,
bei ARRY setze ich sehr auf die MEKs (und das große ?). Schon irre, was Novartis und Astra Zeneca da investieren. So wie ich es verstehe, sollen beide (auch aufgrund des guten Sicherheitsprofils) auch in Kombination eingesetzt werden.
http://clinicaltrials.gov/ct2/results?term=mek162&recr=Open
http://clinicaltrials.gov/ct2/results?term=selumetinib&recr=…
Bei Novartis spielt MEK162 in den Überlegungen zumindest keine Nebenrolle. (Seite 19)
http://www.novartis.com/downloads/investors/event-calendar/2…
Ich vertraue darauf, dass sowohl Novartis als auch AZ wissen was sie da tun und halte ARRY long, auch durch die Ergebnisse. In Schwächephasen bin ich auch immer mal eine kleine Tradingposition eingegeangen und werde das so weiter machen. Momentan befindet sich ARRY ja in einem intakten Abwärtstrend. Ja, das gibt es auch noch!
Bzgl. einer KE bei ARRY bin ich aber optimistischer und hoffe, dass sie ohne auskommen. Aber klar vor allem die PIII bei 502 kostet. Bei ARRY wird mir wieder bewusst, warum ich voll verpartnerte Kandidaten mag:
1. Keine Kosten in der Entwicklung
2. Royalties sind Umsätze, die keine Ausgaben verlangen
3. Big Pharma kann es sich leisten, teure Erweiterungsstudien etc. durchzuführen und somit das Marktpotenzial auszureizen.
4. Big Pharma hat eine viel größere Chance auf eine Zulassung (s. Feuersteinrule)
5. Kein blindes Festhalten an Programmen, die nicht liefern, BP hätte auch kein Problem die Entwicklung einzustellen.
6. Insgesamt ein sehr gutes Chance/Risikoprofil
Bei AMBI sehe ich es so wie du. Hier werde ich nicht alles durch die Ergebnisse halten. Ich hoffe darauf, vorher durch Teilverkäufe das Risiko gering zu halten.
In der PIII wird nun das OS entscheiden. Nach den Ergebnissen der PII bin ich da optimistisch. Die Ansprechrate ist doch einfach sehr hoch. Man wird sehen, ob das dann totz inkompletten und kurzem Ansprechen reicht. Ohad Hammer ist da m.E. sehr vorsichtig mit seinen 50%. Was soll er auch sagen?
Wo müsste Ambit nach der Feuersteinrule eigentlich stehen, wenn man von einem Erfolg der PIII ausgeht? Wie war das noch? Unter 300 Mio 0% Wahrscheinlichkeit eines Erfolgs der P III?
SG kmastra
bei ARRY setze ich sehr auf die MEKs (und das große ?). Schon irre, was Novartis und Astra Zeneca da investieren. So wie ich es verstehe, sollen beide (auch aufgrund des guten Sicherheitsprofils) auch in Kombination eingesetzt werden.
http://clinicaltrials.gov/ct2/results?term=mek162&recr=Open
http://clinicaltrials.gov/ct2/results?term=selumetinib&recr=…
Bei Novartis spielt MEK162 in den Überlegungen zumindest keine Nebenrolle. (Seite 19)
http://www.novartis.com/downloads/investors/event-calendar/2…
Ich vertraue darauf, dass sowohl Novartis als auch AZ wissen was sie da tun und halte ARRY long, auch durch die Ergebnisse. In Schwächephasen bin ich auch immer mal eine kleine Tradingposition eingegeangen und werde das so weiter machen. Momentan befindet sich ARRY ja in einem intakten Abwärtstrend. Ja, das gibt es auch noch!
Bzgl. einer KE bei ARRY bin ich aber optimistischer und hoffe, dass sie ohne auskommen. Aber klar vor allem die PIII bei 502 kostet. Bei ARRY wird mir wieder bewusst, warum ich voll verpartnerte Kandidaten mag:
1. Keine Kosten in der Entwicklung
2. Royalties sind Umsätze, die keine Ausgaben verlangen
3. Big Pharma kann es sich leisten, teure Erweiterungsstudien etc. durchzuführen und somit das Marktpotenzial auszureizen.
4. Big Pharma hat eine viel größere Chance auf eine Zulassung (s. Feuersteinrule)
5. Kein blindes Festhalten an Programmen, die nicht liefern, BP hätte auch kein Problem die Entwicklung einzustellen.
6. Insgesamt ein sehr gutes Chance/Risikoprofil
Bei AMBI sehe ich es so wie du. Hier werde ich nicht alles durch die Ergebnisse halten. Ich hoffe darauf, vorher durch Teilverkäufe das Risiko gering zu halten.
In der PIII wird nun das OS entscheiden. Nach den Ergebnissen der PII bin ich da optimistisch. Die Ansprechrate ist doch einfach sehr hoch. Man wird sehen, ob das dann totz inkompletten und kurzem Ansprechen reicht. Ohad Hammer ist da m.E. sehr vorsichtig mit seinen 50%. Was soll er auch sagen?
Wo müsste Ambit nach der Feuersteinrule eigentlich stehen, wenn man von einem Erfolg der PIII ausgeht? Wie war das noch? Unter 300 Mio 0% Wahrscheinlichkeit eines Erfolgs der P III?
SG kmastra
Antwort auf Beitrag Nr.: 46.509.267 von ipollit am 23.02.14 16:45:25Hallo ipollit,
interessante Übersicht. Eine Blase sehe ich auch nicht unbedingt. Ich habe aber vor zwei Jahren auch keine dermaßen große Unterbewertung gesehen
Mir scheint vieles auch fundamental untermauert zu sein. GILD hatte vor ein paar Jahren bestimmt ein höheres KGV als in deiner Übersicht. Es gibt aber auch andere Beispiele. Dyax z.B. oder fast alle IPOs.
Der NBI ist ja schon wieder unfassbar. Jetzt sogar aus dem Aufwärtstrend ausgebrochen.

Zum Thema Blase:
http://www.seeitmarket.com/bioshock-talk-biotech-bubble-soli…
Zum Thema Immunotherapy:
http://www.sugarconebiotech.com/?p=515
ARRYs TLR8 habe/hatte ich gar nicht so im Blick. Ein mögliches ? mehr! Celgene ist ja auch im Boot:
http://ojs.pharmadeals.net:5555/index.php/pdr/article/viewFi…
SG kmastra
interessante Übersicht. Eine Blase sehe ich auch nicht unbedingt. Ich habe aber vor zwei Jahren auch keine dermaßen große Unterbewertung gesehen

Mir scheint vieles auch fundamental untermauert zu sein. GILD hatte vor ein paar Jahren bestimmt ein höheres KGV als in deiner Übersicht. Es gibt aber auch andere Beispiele. Dyax z.B. oder fast alle IPOs.
Der NBI ist ja schon wieder unfassbar. Jetzt sogar aus dem Aufwärtstrend ausgebrochen.
Zum Thema Blase:
http://www.seeitmarket.com/bioshock-talk-biotech-bubble-soli…
Zum Thema Immunotherapy:
http://www.sugarconebiotech.com/?p=515
ARRYs TLR8 habe/hatte ich gar nicht so im Blick. Ein mögliches ? mehr! Celgene ist ja auch im Boot:
http://ojs.pharmadeals.net:5555/index.php/pdr/article/viewFi…
SG kmastra
ONO:
Es besteht zumindest die Möglichkeit, dass ONO auch bei MK-3475 ein Anrecht auf Royalties (in Europa) hätte.

Zudem ja Rechte an Nivolumab in JP (Royalties an BMY) und umgekehrt Royalties von BMY im Rest der Welt.
Es besteht zumindest die Möglichkeit, dass ONO auch bei MK-3475 ein Anrecht auf Royalties (in Europa) hätte.

Zudem ja Rechte an Nivolumab in JP (Royalties an BMY) und umgekehrt Royalties von BMY im Rest der Welt.
Aktuell knallt´s bei den Nasdaq-Biotechs:
IMGN -8,2 %
ARRY -7,4 %
SGEN -5,4 %
ICPT -6,1 %
... nur, um einige Beispiele zu nennen.
IMGN -8,2 %
ARRY -7,4 %
SGEN -5,4 %
ICPT -6,1 %
... nur, um einige Beispiele zu nennen.
War wirklich ein verrückter Tag gestern.
Was haltet ihr von der weiteren Beschleunigung des CO-1686-Programms bei Clovis?
Die PII wird aufgebohrt, so dass es bereits 2015 zu einer Zulassung kommen könnte.
CO-1686 development once again accelerated, with potential for NDA in 2015. The pivotal TIGER program is still on track to start in 1H14, but now CLVS has increased the size of Phase 2 expansion cohorts to ~150 patients each (from ~40) and will evaluate 2 doses (details at ELCC). Importantly, these trials are open label, and will provide news flow as the TIGERs roll out (first data likely at fall meeting). The 1st cohort is enrolling T790M+ patients directly after progression on their 1st TKI (similar to TIGER 2) and the 2nd is enrolling T790M+ patients who have progressed on their 2nd or later TKI or subsequent chemo (similar to TIGER 3). The larger expansion cohorts could facilitate an accelerated NDA in 2015.
(JP Morgan)
Ist hier nicht vielleicht ein Blockbuster in der Entwicklung mit einem klaren und schnellen Zulassungsweg?
Natürlich braucht es noch weitere Daten, um das verlässlicher sagen zu können, aber die werden dieses Jahr kommen.
Ich habe das Gefühl, dass hier noch immer ein besonders gutes Chance-/Risikoprofil gegeben ist.
Ich vergleiche Clovis immer irgendwie mit Onyx...
Hallo ipollit,
bei MDVN gab es gestern einen Rücksetzer. Ich überlege, ob das langfristig vielleicht wirklich noch aussichtsreich sein könnte.
Was mich wundert ist, dass auf den ersten Blick MDVNs Pipeline wirklich nur aus diesem Produkt besteht.
Das ist recht ungewöhnlich. Ist Dir bekannt, ob sie zumindest Präklinik-Projekte haben, die sie auf der Website nicht darstellen?
Hast Du eine konkrete Einschätzung zu den Chancen und dem Potential die Xtandi bei BC hat?
Grüße
SLG
Was haltet ihr von der weiteren Beschleunigung des CO-1686-Programms bei Clovis?
Die PII wird aufgebohrt, so dass es bereits 2015 zu einer Zulassung kommen könnte.
CO-1686 development once again accelerated, with potential for NDA in 2015. The pivotal TIGER program is still on track to start in 1H14, but now CLVS has increased the size of Phase 2 expansion cohorts to ~150 patients each (from ~40) and will evaluate 2 doses (details at ELCC). Importantly, these trials are open label, and will provide news flow as the TIGERs roll out (first data likely at fall meeting). The 1st cohort is enrolling T790M+ patients directly after progression on their 1st TKI (similar to TIGER 2) and the 2nd is enrolling T790M+ patients who have progressed on their 2nd or later TKI or subsequent chemo (similar to TIGER 3). The larger expansion cohorts could facilitate an accelerated NDA in 2015.
(JP Morgan)
Ist hier nicht vielleicht ein Blockbuster in der Entwicklung mit einem klaren und schnellen Zulassungsweg?
Natürlich braucht es noch weitere Daten, um das verlässlicher sagen zu können, aber die werden dieses Jahr kommen.
Ich habe das Gefühl, dass hier noch immer ein besonders gutes Chance-/Risikoprofil gegeben ist.
Ich vergleiche Clovis immer irgendwie mit Onyx...
Hallo ipollit,
bei MDVN gab es gestern einen Rücksetzer. Ich überlege, ob das langfristig vielleicht wirklich noch aussichtsreich sein könnte.
Was mich wundert ist, dass auf den ersten Blick MDVNs Pipeline wirklich nur aus diesem Produkt besteht.
Das ist recht ungewöhnlich. Ist Dir bekannt, ob sie zumindest Präklinik-Projekte haben, die sie auf der Website nicht darstellen?
Hast Du eine konkrete Einschätzung zu den Chancen und dem Potential die Xtandi bei BC hat?
Grüße
SLG
Antwort auf Beitrag Nr.: 46.546.541 von SLGramann am 01.03.14 09:38:34Hallo SLGramann,
meine MDVN-Position habe ich am Freitag weiter erhöht. Die Ergebnisse für 4Q13 waren sehr gut, der Ausblick für dieses Jahr lag aber deutlich unter den Erwartungen. Xtandi wurde im Herbst 2012 in den USA zugelassen... im ersten Jahr 2013 erzielte es Umsätze von 392 Mio USD, im letzten Quartal waren es 126 Mio USD. Hochgerechnet auf das Jahr wären das schon 500 Mio USD. Als Ausblick auf 2014 hat MDVN 500 bis 535 Mio USD genannt, also nur ein minimale Steigerung, während die Erwartungen nach den sehr positiven PREVAIL-Daten im Januar im Schnitt bei 670 Mio USD, teilweise auch bei fast 900 Mio USD lagen.
Ob sich etwas in der Präklinik befindet, weiß ich nicht. Scheinbar investiert MDVN auch in andere Projekte ("Not too far off, we think a bigger-picture corporate vision could be unveiled, focused on diversifying revenues as MDVN heads toward profitability, achieves Xtandi milestones from Astellas and quietly spends 40% of R&D on non-Xtandi assets."). MDVN halte ich aber nur aufgrund der Aussichten von Xtandi bei Prostatakrebs. Ich setze darauf, dass es ein ähnliches Potential wie PCYCs Imbruvica hat. PCYCs Bewertung basiert ja auch nur auf diesem einen Produkt. MDVN teilt sich den US-Markt zu 50:50 mit Astellas, ansonsten erhalten sie weltweit Royalties.
Die Peak-Sales könnten langfristig bei 6 Mrd USD oder mehr liegen. Xtandi sollte das wichtigste Mittel gegen HRPC sein. Hormon-resistenter Prostatakrebs teilt sich in den Pre- und Post-Chemo-Bereich. Bisher war eine Chemo wie Taxotere der Standard. Dabei ist der Pre-Chemo-Markt deutlich größer: etwa doppelt so viele Patienten und die Behandlungsdauer ist länger, da die Krankheit vor der Chemo noch nicht so weit fortgeschritten ist. Vor einer Chemo werden die Patienten eher von Urologien behandelt als von Onkologen... man kann erwarten, dass es 50% Urologen sind vs 20% Onkologen.
Xtandi wirkt über den Androgen-Hormon-Rezeptor (AR), indem es diesen blockiert. In 2011 wurde J&Js Zytiga gegen Prostatakrebs zugelassen, das ebenfalls über AR wirkt, allerdings nicht durch Rezeptor-Blockade, sondern durch Reduzierung der Hormonproduktion. Im letzten Quartal hat Zytiga Umsätze von ca. 500 Mio USD erzielt. Ansonsten gibt es keine AR-Mittel am Markt, nur welche in der Entwicklung. Zytiga und Xtandi sind also direkte Konkurrenten, wobei Zytiga 1 Jahr Vorsprung hat. Zudem ist Zytiga bereits bei Pre-Chemo zugelassen, Xtandi nicht. Die PREVAIL-Daten zeigen aber deutliche Vorteile von Xtandi vs. Zytiga bei Pre-Chemo Anwendung. Und es kommt hinzu, dass Zytiga in Kombination mit Prednisone gegeben werden muss, Prednisone aber nur sehr ungerne von Urologen verabreicht wird. Im Herbst soll die offizielle Zulassung von Xtandi bei Pre-Chemo erfolgen. Dann könnte Xtandi Zytiga verdrängen, insbesondere bei Urologen. Im Falle von Zytiga gab es erst mit Zulassung auch deutliche Zuwäche im Pre-Chemo-Bereich.
Zytiga und Xtandi lassen sich nicht so gut nacheinander anwenden, da sie ähnlich wirken. Die Wirkdauer des zweiten Mittels wird deutlich geringer sein, damit auch die Umsätze. Xtandi sollte also das erste Mittel werden, wenn es erfolgreich werden soll, wobei Urologen die Patienten in der Regel zuerst behandeln, so dass Xtandi meiner Meinung nach hier Vorteile hat. Ein Problem war lange, dass Zytiga, das J&J durch die Übernahme von Cougar Biotech erworben hat, nur eine Patentlaufzeit bis 2016 hatte. Ein generisches Zytiga könnte dann aufgrund des Preises das erste Mittel werden. Allerdings sollen inzwischen Patente bis Ende 2020 existieren und keine Generikas drohen. Zytiga besitzt keinen statistischen OS-Vorteil in der Pre-Chemo, Xtandi schon... für AR-Mittel in der Entwicklung wird es deutlich schwieriger sein, in der Pre-Chemo eine Zulassung zu erhalten, wenn sie einen Voteil gegenüber Xtandi belegen müssen.
Xtandi-Umsatzschätzungen vor PRAVAIL...
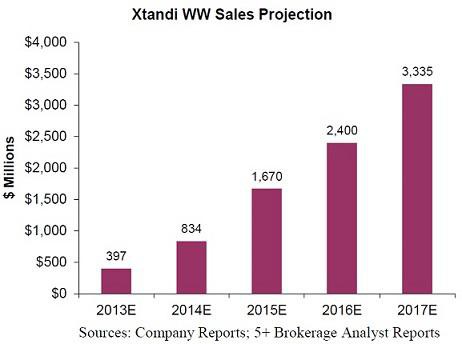
und vor den letzten Quartalszahlen
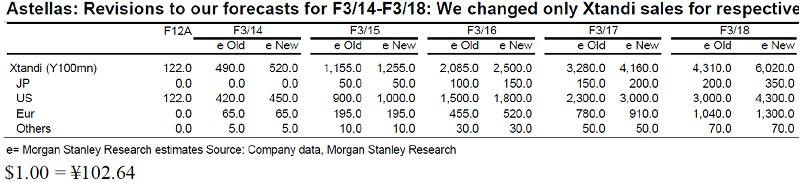
Grüße,
ipollit
meine MDVN-Position habe ich am Freitag weiter erhöht. Die Ergebnisse für 4Q13 waren sehr gut, der Ausblick für dieses Jahr lag aber deutlich unter den Erwartungen. Xtandi wurde im Herbst 2012 in den USA zugelassen... im ersten Jahr 2013 erzielte es Umsätze von 392 Mio USD, im letzten Quartal waren es 126 Mio USD. Hochgerechnet auf das Jahr wären das schon 500 Mio USD. Als Ausblick auf 2014 hat MDVN 500 bis 535 Mio USD genannt, also nur ein minimale Steigerung, während die Erwartungen nach den sehr positiven PREVAIL-Daten im Januar im Schnitt bei 670 Mio USD, teilweise auch bei fast 900 Mio USD lagen.
Ob sich etwas in der Präklinik befindet, weiß ich nicht. Scheinbar investiert MDVN auch in andere Projekte ("Not too far off, we think a bigger-picture corporate vision could be unveiled, focused on diversifying revenues as MDVN heads toward profitability, achieves Xtandi milestones from Astellas and quietly spends 40% of R&D on non-Xtandi assets."). MDVN halte ich aber nur aufgrund der Aussichten von Xtandi bei Prostatakrebs. Ich setze darauf, dass es ein ähnliches Potential wie PCYCs Imbruvica hat. PCYCs Bewertung basiert ja auch nur auf diesem einen Produkt. MDVN teilt sich den US-Markt zu 50:50 mit Astellas, ansonsten erhalten sie weltweit Royalties.
Die Peak-Sales könnten langfristig bei 6 Mrd USD oder mehr liegen. Xtandi sollte das wichtigste Mittel gegen HRPC sein. Hormon-resistenter Prostatakrebs teilt sich in den Pre- und Post-Chemo-Bereich. Bisher war eine Chemo wie Taxotere der Standard. Dabei ist der Pre-Chemo-Markt deutlich größer: etwa doppelt so viele Patienten und die Behandlungsdauer ist länger, da die Krankheit vor der Chemo noch nicht so weit fortgeschritten ist. Vor einer Chemo werden die Patienten eher von Urologien behandelt als von Onkologen... man kann erwarten, dass es 50% Urologen sind vs 20% Onkologen.
Xtandi wirkt über den Androgen-Hormon-Rezeptor (AR), indem es diesen blockiert. In 2011 wurde J&Js Zytiga gegen Prostatakrebs zugelassen, das ebenfalls über AR wirkt, allerdings nicht durch Rezeptor-Blockade, sondern durch Reduzierung der Hormonproduktion. Im letzten Quartal hat Zytiga Umsätze von ca. 500 Mio USD erzielt. Ansonsten gibt es keine AR-Mittel am Markt, nur welche in der Entwicklung. Zytiga und Xtandi sind also direkte Konkurrenten, wobei Zytiga 1 Jahr Vorsprung hat. Zudem ist Zytiga bereits bei Pre-Chemo zugelassen, Xtandi nicht. Die PREVAIL-Daten zeigen aber deutliche Vorteile von Xtandi vs. Zytiga bei Pre-Chemo Anwendung. Und es kommt hinzu, dass Zytiga in Kombination mit Prednisone gegeben werden muss, Prednisone aber nur sehr ungerne von Urologen verabreicht wird. Im Herbst soll die offizielle Zulassung von Xtandi bei Pre-Chemo erfolgen. Dann könnte Xtandi Zytiga verdrängen, insbesondere bei Urologen. Im Falle von Zytiga gab es erst mit Zulassung auch deutliche Zuwäche im Pre-Chemo-Bereich.
Zytiga und Xtandi lassen sich nicht so gut nacheinander anwenden, da sie ähnlich wirken. Die Wirkdauer des zweiten Mittels wird deutlich geringer sein, damit auch die Umsätze. Xtandi sollte also das erste Mittel werden, wenn es erfolgreich werden soll, wobei Urologen die Patienten in der Regel zuerst behandeln, so dass Xtandi meiner Meinung nach hier Vorteile hat. Ein Problem war lange, dass Zytiga, das J&J durch die Übernahme von Cougar Biotech erworben hat, nur eine Patentlaufzeit bis 2016 hatte. Ein generisches Zytiga könnte dann aufgrund des Preises das erste Mittel werden. Allerdings sollen inzwischen Patente bis Ende 2020 existieren und keine Generikas drohen. Zytiga besitzt keinen statistischen OS-Vorteil in der Pre-Chemo, Xtandi schon... für AR-Mittel in der Entwicklung wird es deutlich schwieriger sein, in der Pre-Chemo eine Zulassung zu erhalten, wenn sie einen Voteil gegenüber Xtandi belegen müssen.
Xtandi-Umsatzschätzungen vor PRAVAIL...

und vor den letzten Quartalszahlen

Grüße,
ipollit
Antwort auf Beitrag Nr.: 46.547.911 von ipollit am 01.03.14 17:11:51Weil immer auch wieder erstaunter Mitleser bzgl. Eures Detailwissens und Eurer Detailanalysen, mal ein vielleicht möglicherweise noch lohnenswertes Investment als Tip von mir mit einer Company aus Europa (bin noch nicht drin, habe aber vor, mit einer kleinen Posi einzusteigen):
http://genfit.com/en/home/index.html
Einstieg deswegen geplant:
http://genfit.com/fileadmin/press/press/press_release/2014.0…" target="_blank" rel="nofollow ugc noopener">http://genfit.com/fileadmin/press/press/press_release/2014.0…
Aktuelle Finandaten von 2013 aber leider nur auf Französisch (dessen ich leider nicht zum vollen Verständnis der Daten gewachsen bin):
http://genfit.com/en/investors/index.html
Schon Recht ambitioniert mit ca. 600 Mio unserer Währung bewertet, aber wenn man sich im Vgl. die Ami-Werte anschaut, dann wäre noch viiieeel Luft drin.
Letzte Woche bin ich zu 11,34 im Februar-IPO Celladon eingestiegen, mal schauen, ob es sich kurzfristig lohnen wird: Der cardiovaskuläre Bereich interessiert mich persönlich am meisten, weil ich wenigstens davon ein wenig verstehe. SL bei spätestens 10$.
Ansonsten vielen Dank für das Besprechen und Vorstellung von Agenus hier im Thread: bin nach meiner Recherche seit letzter Wochen ebenfalls drin.
Was mich persönlich sehr interessieren würde sind Biotech Companies, die im Bereich der RNA-Interferenz/Silencing Therapie forschen: eine Alnylam hab ich leider nach 20% plus bei ca. 22$ verkauft (hätte es nie für möglich gehalten, dass sie dahin gehen, wo sie jetzt stehen, bei eine MK von >> Mialliarden $, einfach verrückt)
Und weiss nicht, wer, aber einer von Euch Dreien ist wie ich auch in Paion investiert: hier sollten wir bis zum Sommer noch lockerst die 10 sehen!
Grüsse an Euch und die Mitleser und schönes WE,
s.
http://genfit.com/en/home/index.html
Einstieg deswegen geplant:
http://genfit.com/fileadmin/press/press/press_release/2014.0…" target="_blank" rel="nofollow ugc noopener">http://genfit.com/fileadmin/press/press/press_release/2014.0…
Aktuelle Finandaten von 2013 aber leider nur auf Französisch (dessen ich leider nicht zum vollen Verständnis der Daten gewachsen bin):
http://genfit.com/en/investors/index.html
Schon Recht ambitioniert mit ca. 600 Mio unserer Währung bewertet, aber wenn man sich im Vgl. die Ami-Werte anschaut, dann wäre noch viiieeel Luft drin.
Letzte Woche bin ich zu 11,34 im Februar-IPO Celladon eingestiegen, mal schauen, ob es sich kurzfristig lohnen wird: Der cardiovaskuläre Bereich interessiert mich persönlich am meisten, weil ich wenigstens davon ein wenig verstehe. SL bei spätestens 10$.
Ansonsten vielen Dank für das Besprechen und Vorstellung von Agenus hier im Thread: bin nach meiner Recherche seit letzter Wochen ebenfalls drin.
Was mich persönlich sehr interessieren würde sind Biotech Companies, die im Bereich der RNA-Interferenz/Silencing Therapie forschen: eine Alnylam hab ich leider nach 20% plus bei ca. 22$ verkauft (hätte es nie für möglich gehalten, dass sie dahin gehen, wo sie jetzt stehen, bei eine MK von >> Mialliarden $, einfach verrückt)
Und weiss nicht, wer, aber einer von Euch Dreien ist wie ich auch in Paion investiert: hier sollten wir bis zum Sommer noch lockerst die 10 sehen!
Grüsse an Euch und die Mitleser und schönes WE,
s.
Antwort auf Beitrag Nr.: 46.548.565 von sufenta am 01.03.14 19:43:11Hallo Sufenta,
zu Genfit hatte ich ja schon etwas geschrieben... prinzipiell dreht es sich dabei um NASH ähnlich wie bei ICPT. GFT505 wirkt über PPAR... nach dem, was ich bisher gelesen habe, ist dies eine recht schwierige Wirkstoffklasse, die zwar gute Ergebnisse liefern kann, aber bei der es schwer einzuschätzen ist, welche Nebenwirkungen entstehen (jedes Molekül kann seine speziellen Eigenarten und Probleme haben, die erst spät sichtbar werden). Es gab mehrere große PPAR-gamma Medikamente am Markt und die Entwicklung wurde von fast allen großen Pharmafirmen betrieben. Die Nebenwirkungen waren aber teilweise so groß, dass Mittel wieder vom Markt genommen werden mussten. Ich glaube sämtliche Entwicklungen wurden von den Pharmas aufgrund der Probleme eingestellt. GFT505 ist aber kein PPAR-gamma sondern ein PPAR-alfa/delta-Mittel. In diesem Bereich haben die Pharmas allerdings auch Forschungen betrieben, die dann eingestellt worden sind.
Generell scheint hier das Risiko zu bestehen, dass in größeren Studien Nebenwirkungen sichtbar werden, die eine Zulassung unmöglich machen. Auf der anderen Seite waren PPAR-Mittel alle Blockbuster. Da es eine riskante Klasse ist, werden wohl umfangreiche PIII-Studien benötigt, die Genfit nicht alleine stemmen kann. Das könnte ein Problem sein, wenn sich die Pharmas generell von PPAR abgewendet haben. Man kann mit Genfit auf den NASH-Hype setzen... GFT505 kann aber auch jederzeit scheitern. Ich habe lieber die Finger davon gelassen, da es mir zu unberechenbar ist... nach der bisherigen Kurs-Entwicklung hätte es sich allerdings gelohnt. Das muss jeder für sich selber entscheiden, was er riskiert.
RNAi ist ebenfalls ein extrem gehypter Bereich... ob das dauerhaft hält? Ich bin mit ISIS und ALNY dabei, hatte aber auch nicht damit gerechnet, dass die sich so entwickeln. Es wurde oft darauf spekuliert, dass RNAi zu einer bedeutenden Therapie-Klasse werden könnten wie z.B. Antikörper-Medikamente. RNAi wären insbesondere bei seltenen Krankheiten aussichtsreich, weil damit biologische Prozesse beeinflusst werden können, die bisher mit anderen Klassen nicht erreichbar waren (soweit ich es verstehe). Z.B. habe ich SNTA mit dem HSP90-Hemmer in PIII im Depot. Eine Hemmung von HSP90 ist theoretisch nicht ausreichend, da es noch andere Heat Shock Proteine gibt, die von den Krebs-Zellen nach Hemmung von HSP90 alternativ genutzt werden können... z.B. HSP70 oder HSP27:http://www.ncbi.nlm.nih.gov/pubmed/18794130"These cells also overexpressed Hsp27, and Hsp70 was induced with 17-AAG treatment. When the GA and 17-AAG resistant cells were transfected with Hsp27 and/or Hsp70 small interfering RNA (siRNA), the 17-AAG IC(50) decreased 10-fold compared with control transfected cells... Taken together, our results indicate that targeting of Hsp27 and Hsp70 should be exploited to increase the clinical efficacy of Hsp90-directed therapy." Soweit ich es verstehe, können HSP70 und HSP27 aber nicht auf normalen Weg so wie z.B. HSP90 gehemmt werden. Dies ist nur durch RNAi möglich, wie z.B. OGX-427 von OGXI.
RNAi schafft also neue Ansatzpunkte für Medikamente. Eine andere Frage ist, ob sie sich in der Praxis auch gut verabreichen lassen... ich glaube, dies war bisher ein Problem. Und die Verträglichkeit ist ebenfalls noch unklar. Es handelt sich also um ein komplett neues Feld, das vor Jahren mal einen Hype hatte, als z.B. 2006 Sirna für 1 Mrd USD von Merck übernommen wurde, aber nichts daraus geworden ist. In der Zeit danach war dieses Feld ziemlich out, die Kurse im Keller. Jetzt gibt es wieder diesen Hype, bei dem alles gekauft wird, was irgendwie in diese Richtung geht. Solange es keine deutlichen Erfolge in der Praxis gibt, mit wirksamen Medikamenten am Markt, kann der Hype auch schnell wieder ins Gegenteil umschlagen.
Andererseits gibt es beim aktuellen Hype anscheinend auch fundamentale Gründe... nicht wenige sehen bei schweren bisher unbehandelbaren Erbkrankheiten wie Muskelschwund sehr hohe Chancen. RNAi-Mittel könnten hier in den nächsten Jahren einen Durchbruch erzielen und zu Blockbustern werden.
Vielleicht ist hier etwas interessantes dabei... http://rnaitherapeutics.blogspot.de/
Gruß
ipollit
zu Genfit hatte ich ja schon etwas geschrieben... prinzipiell dreht es sich dabei um NASH ähnlich wie bei ICPT. GFT505 wirkt über PPAR... nach dem, was ich bisher gelesen habe, ist dies eine recht schwierige Wirkstoffklasse, die zwar gute Ergebnisse liefern kann, aber bei der es schwer einzuschätzen ist, welche Nebenwirkungen entstehen (jedes Molekül kann seine speziellen Eigenarten und Probleme haben, die erst spät sichtbar werden). Es gab mehrere große PPAR-gamma Medikamente am Markt und die Entwicklung wurde von fast allen großen Pharmafirmen betrieben. Die Nebenwirkungen waren aber teilweise so groß, dass Mittel wieder vom Markt genommen werden mussten. Ich glaube sämtliche Entwicklungen wurden von den Pharmas aufgrund der Probleme eingestellt. GFT505 ist aber kein PPAR-gamma sondern ein PPAR-alfa/delta-Mittel. In diesem Bereich haben die Pharmas allerdings auch Forschungen betrieben, die dann eingestellt worden sind.
Generell scheint hier das Risiko zu bestehen, dass in größeren Studien Nebenwirkungen sichtbar werden, die eine Zulassung unmöglich machen. Auf der anderen Seite waren PPAR-Mittel alle Blockbuster. Da es eine riskante Klasse ist, werden wohl umfangreiche PIII-Studien benötigt, die Genfit nicht alleine stemmen kann. Das könnte ein Problem sein, wenn sich die Pharmas generell von PPAR abgewendet haben. Man kann mit Genfit auf den NASH-Hype setzen... GFT505 kann aber auch jederzeit scheitern. Ich habe lieber die Finger davon gelassen, da es mir zu unberechenbar ist... nach der bisherigen Kurs-Entwicklung hätte es sich allerdings gelohnt. Das muss jeder für sich selber entscheiden, was er riskiert.
RNAi ist ebenfalls ein extrem gehypter Bereich... ob das dauerhaft hält? Ich bin mit ISIS und ALNY dabei, hatte aber auch nicht damit gerechnet, dass die sich so entwickeln. Es wurde oft darauf spekuliert, dass RNAi zu einer bedeutenden Therapie-Klasse werden könnten wie z.B. Antikörper-Medikamente. RNAi wären insbesondere bei seltenen Krankheiten aussichtsreich, weil damit biologische Prozesse beeinflusst werden können, die bisher mit anderen Klassen nicht erreichbar waren (soweit ich es verstehe). Z.B. habe ich SNTA mit dem HSP90-Hemmer in PIII im Depot. Eine Hemmung von HSP90 ist theoretisch nicht ausreichend, da es noch andere Heat Shock Proteine gibt, die von den Krebs-Zellen nach Hemmung von HSP90 alternativ genutzt werden können... z.B. HSP70 oder HSP27:http://www.ncbi.nlm.nih.gov/pubmed/18794130"These cells also overexpressed Hsp27, and Hsp70 was induced with 17-AAG treatment. When the GA and 17-AAG resistant cells were transfected with Hsp27 and/or Hsp70 small interfering RNA (siRNA), the 17-AAG IC(50) decreased 10-fold compared with control transfected cells... Taken together, our results indicate that targeting of Hsp27 and Hsp70 should be exploited to increase the clinical efficacy of Hsp90-directed therapy." Soweit ich es verstehe, können HSP70 und HSP27 aber nicht auf normalen Weg so wie z.B. HSP90 gehemmt werden. Dies ist nur durch RNAi möglich, wie z.B. OGX-427 von OGXI.
RNAi schafft also neue Ansatzpunkte für Medikamente. Eine andere Frage ist, ob sie sich in der Praxis auch gut verabreichen lassen... ich glaube, dies war bisher ein Problem. Und die Verträglichkeit ist ebenfalls noch unklar. Es handelt sich also um ein komplett neues Feld, das vor Jahren mal einen Hype hatte, als z.B. 2006 Sirna für 1 Mrd USD von Merck übernommen wurde, aber nichts daraus geworden ist. In der Zeit danach war dieses Feld ziemlich out, die Kurse im Keller. Jetzt gibt es wieder diesen Hype, bei dem alles gekauft wird, was irgendwie in diese Richtung geht. Solange es keine deutlichen Erfolge in der Praxis gibt, mit wirksamen Medikamenten am Markt, kann der Hype auch schnell wieder ins Gegenteil umschlagen.
Andererseits gibt es beim aktuellen Hype anscheinend auch fundamentale Gründe... nicht wenige sehen bei schweren bisher unbehandelbaren Erbkrankheiten wie Muskelschwund sehr hohe Chancen. RNAi-Mittel könnten hier in den nächsten Jahren einen Durchbruch erzielen und zu Blockbustern werden.
Vielleicht ist hier etwas interessantes dabei... http://rnaitherapeutics.blogspot.de/
Gruß
ipollit
Als stiller Mitleser dieser Stränge möche ich mich einmal herzlich für die ganzen tollen Beiträge bedanken, ohne einen Foristen speziell zu erwähnen.
Ich bin nicht ganz unbewandert, kann also durchaus die Qualität im Ansatz beurteilen, kann aber hier noch einiges dazulernen.
Dafür Dankeschön
Grüße
Müllerei
Ich bin nicht ganz unbewandert, kann also durchaus die Qualität im Ansatz beurteilen, kann aber hier noch einiges dazulernen.
Dafür Dankeschön
Grüße
Müllerei
ARQL
Und wieder ein Beispiel dafür, dass es bei Biotechs für nichts eine Garantie gibt, selbst wenn etwas noch so gut aussieht. Roche's MET-AK Metmab scheitert in der NSCLC PIII in Kombination mit Tarceva bereits in einer Zwischenanalyse, da offensichtlich keine positiven OS-Daten mehr zu erreichen sind. In der PII lag dagegen das HR bei 0,37 (p=0,002) bzw. der OS-Median bei 12,6 Monate vs. 3,8 Monate! Das sieht erstmal nach einer hohen Wirksamkeit aus... umso überraschender nun, dass die gleichartige PIII schon auf halber Strecke scheitert.
Ergebnisse kleiner PII-Studien sollte man demnach mit Vorsicht betrachten. Eine mögliche Erklärung für die sehr unterschiedlichen Ergebnisse könnte die unausgewogene Verteilung der EGFR-Mutation in der PII sein, die den Placebo-Arm deutlich benachteiligt hat:
http://www.orf-blog.com/biotech-portfolio-update-2013-summar…
Another open issue is how tivatinib’s benefit compares with that of onartuzumab. A cross-trial comparison favors onartuzumab, which showed a survival benefit of almost 9 months (12.6 vs. 3.8 months). Tivantinib had a ~3.5 months benefit (9.3 vs. 5.9 months). Onartuzumab’s benefit is impressive but should be viewed cautiously as it is based on a small subset (42 events) whereas Arqule’s data set is much larger (153 events). In addition, some of the effect seen in the onartuzumab trial is due to a significant imbalance in percentage of EGFR mutated patients (20% in the onartuzumab arm vs. 7% in the control arm). Because all patients received Tarceva, an EGFR inhibitor, one would expect the Metmab arm to be superior solely based on Tarceva’s effect. Moreover, Arqule’s data set implies MET inhibitors potentiate EGFR inhibitors in EGFR mutated NSCLC, which may further explain Metmab’s dramatic difference.
Vom Gefühl her ist das nicht gut für ARQL, da MET anscheinend ein schwieriges Feld ist. Bisher sah es so aus, als ob Met+ gute Ergebnisse erzielen kann, während ARQL in den gescheiterten Studien immer auch Met- einbezogen hat. Nun ist alles noch unsicherer, obwohl es auch komisch ist, dass in den PIIs immer wieder ein klaren Vorteil von Met+ gezeigt werden kann, in unterschiedlichen Indikationen und mit mehreren MET-Hemmern.
Gruß
ipollit
Und wieder ein Beispiel dafür, dass es bei Biotechs für nichts eine Garantie gibt, selbst wenn etwas noch so gut aussieht. Roche's MET-AK Metmab scheitert in der NSCLC PIII in Kombination mit Tarceva bereits in einer Zwischenanalyse, da offensichtlich keine positiven OS-Daten mehr zu erreichen sind. In der PII lag dagegen das HR bei 0,37 (p=0,002) bzw. der OS-Median bei 12,6 Monate vs. 3,8 Monate! Das sieht erstmal nach einer hohen Wirksamkeit aus... umso überraschender nun, dass die gleichartige PIII schon auf halber Strecke scheitert.
Ergebnisse kleiner PII-Studien sollte man demnach mit Vorsicht betrachten. Eine mögliche Erklärung für die sehr unterschiedlichen Ergebnisse könnte die unausgewogene Verteilung der EGFR-Mutation in der PII sein, die den Placebo-Arm deutlich benachteiligt hat:
http://www.orf-blog.com/biotech-portfolio-update-2013-summar…
Another open issue is how tivatinib’s benefit compares with that of onartuzumab. A cross-trial comparison favors onartuzumab, which showed a survival benefit of almost 9 months (12.6 vs. 3.8 months). Tivantinib had a ~3.5 months benefit (9.3 vs. 5.9 months). Onartuzumab’s benefit is impressive but should be viewed cautiously as it is based on a small subset (42 events) whereas Arqule’s data set is much larger (153 events). In addition, some of the effect seen in the onartuzumab trial is due to a significant imbalance in percentage of EGFR mutated patients (20% in the onartuzumab arm vs. 7% in the control arm). Because all patients received Tarceva, an EGFR inhibitor, one would expect the Metmab arm to be superior solely based on Tarceva’s effect. Moreover, Arqule’s data set implies MET inhibitors potentiate EGFR inhibitors in EGFR mutated NSCLC, which may further explain Metmab’s dramatic difference.
Vom Gefühl her ist das nicht gut für ARQL, da MET anscheinend ein schwieriges Feld ist. Bisher sah es so aus, als ob Met+ gute Ergebnisse erzielen kann, während ARQL in den gescheiterten Studien immer auch Met- einbezogen hat. Nun ist alles noch unsicherer, obwohl es auch komisch ist, dass in den PIIs immer wieder ein klaren Vorteil von Met+ gezeigt werden kann, in unterschiedlichen Indikationen und mit mehreren MET-Hemmern.
Gruß
ipollit
Der Ausbruch könnte sich als Fehlausbruch erweisen. Eine weitere Abwärtsbewegung scheint heute ja so gut wie sicher. Eine mögliche Konsolidierung wurde ja schon öfters besprochen. Die Woche wird spannend!
Antwort auf Beitrag Nr.: 46.554.233 von ipollit am 03.03.14 13:20:34Roche's MET-AK Metmab scheitert in der NSCLC PIII in Kombination mit Tarceva bereits in einer Zwischenanalyse, da offensichtlich keine positiven OS-Daten mehr zu erreichen sind.
Das haut mich um, angeischts der PII-Daten.
Das haut mich um, angeischts der PII-Daten.
CLDX
Enttäuschend... CDX-1135 wird wohl keine Art Solaris. Die Entwicklung und die PI in der sehr seltenen Erkrankung DDD wird beendet, weil nur ein Patient an der Studie teilgenommen hat, bei dem keine wirkliche Verbessrung festgestellt werden konnte. Diese Probleme bei der Rekrutierung hätte man auch früher etwas deutlicher kommunizieren können.
Momentan ist CLDX vor PCYC und INCY noch meine größte Position. Es gibt zwar mehrere verschiedene Kandidaten in der Pipeline, alle beinhalten aber noch deutliche Risiken. Vielleicht ist es besser, diese Übergewichtung zu reduzieren.

Gruß
ipollit
Enttäuschend... CDX-1135 wird wohl keine Art Solaris. Die Entwicklung und die PI in der sehr seltenen Erkrankung DDD wird beendet, weil nur ein Patient an der Studie teilgenommen hat, bei dem keine wirkliche Verbessrung festgestellt werden konnte. Diese Probleme bei der Rekrutierung hätte man auch früher etwas deutlicher kommunizieren können.
Momentan ist CLDX vor PCYC und INCY noch meine größte Position. Es gibt zwar mehrere verschiedene Kandidaten in der Pipeline, alle beinhalten aber noch deutliche Risiken. Vielleicht ist es besser, diese Übergewichtung zu reduzieren.
Gruß
ipollit
Genmab:
Copenhagen, Denmark; March 5, 2014 — Genmab A/S (OMX: GEN) announced today that its partner, Janssen Biotech, Inc. ("Janssen") will start a Phase III study of daratumumab in relapsed or refractory multiple myeloma. The study will compare daratumumab in combination with lenalidomide and dexamethasone to lenalidomide and dexamethasone alone.
...
About the study
This Phase III study will include approximately 500 patients who have relapsed or refractory multiple myeloma. Patients will be randomized to receive either daratumumab combined with lenalidomide and dexamethasone, or lenalidomide and dexamethasone alone. The primary endpoint of the study is progression free survival (PFS).
-----------
Na endlich!
Hallo ipollit,
bin wegen Celldex auch etwas enttäuscht, hab das DDD-Programm aber immer als "free call option" gesehen.
Meine wesentliche Hoffnung ruht auf Glembatumumab, ein Programm das ich - dank Hammer - schon im Blick hatte, als es noch Curagen gehörte.
Von Rindo halte ich auch ne ganze Menge und finde es sehr stark und verdienstvoll von Celldex, wie sie das nach dem Ausstieg von Pfizer allein durchgezogen haben.
Insgesamt habe ich letztes Jahr meine Celldex-Position etwas abgebaut, sie ist aber noch immer recht groß und vielleicht auch zu groß. Grundsätzlich würde ich hier weiter verkaufen, wenn ich Geld für anderweitige Käufe brauche. Aber eigentlich auch nur dann. Mal sehen.
Grüße
SLG
Copenhagen, Denmark; March 5, 2014 — Genmab A/S (OMX: GEN) announced today that its partner, Janssen Biotech, Inc. ("Janssen") will start a Phase III study of daratumumab in relapsed or refractory multiple myeloma. The study will compare daratumumab in combination with lenalidomide and dexamethasone to lenalidomide and dexamethasone alone.
...
About the study
This Phase III study will include approximately 500 patients who have relapsed or refractory multiple myeloma. Patients will be randomized to receive either daratumumab combined with lenalidomide and dexamethasone, or lenalidomide and dexamethasone alone. The primary endpoint of the study is progression free survival (PFS).
-----------
Na endlich!
Hallo ipollit,
bin wegen Celldex auch etwas enttäuscht, hab das DDD-Programm aber immer als "free call option" gesehen.
Meine wesentliche Hoffnung ruht auf Glembatumumab, ein Programm das ich - dank Hammer - schon im Blick hatte, als es noch Curagen gehörte.
Von Rindo halte ich auch ne ganze Menge und finde es sehr stark und verdienstvoll von Celldex, wie sie das nach dem Ausstieg von Pfizer allein durchgezogen haben.
Insgesamt habe ich letztes Jahr meine Celldex-Position etwas abgebaut, sie ist aber noch immer recht groß und vielleicht auch zu groß. Grundsätzlich würde ich hier weiter verkaufen, wenn ich Geld für anderweitige Käufe brauche. Aber eigentlich auch nur dann. Mal sehen.
Grüße
SLG
Antwort auf Beitrag Nr.: 46.554.263 von kmastra am 03.03.14 13:24:05Es ist zwar richtig, dass die Kurse stark gestiegen sind, aber gleichzeitig machen gerade die großen Biotechs, die einen wesentlichen Teil des Index ausmachen, hohe Gewinne...
https://twitter.com/zDonShimoda/status/441320204962779136/ph…

CELG finde ich beispielsweise interessant, wenn die Schätzungen halbwegs stimmen...
http://www.nasdaq.com/symbol/celg/earnings-forecast
(Kurs aktuell 163,24 USD)
EPSe
2014 6,34
2015 8,75
2016 12,36
2017 15,68
Gruß
ipollit
https://twitter.com/zDonShimoda/status/441320204962779136/ph…

CELG finde ich beispielsweise interessant, wenn die Schätzungen halbwegs stimmen...
http://www.nasdaq.com/symbol/celg/earnings-forecast
(Kurs aktuell 163,24 USD)
EPSe
2014 6,34
2015 8,75
2016 12,36
2017 15,68
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.572.447 von ipollit am 05.03.14 23:59:13Hallo ipollit,
irgendwann knallt es sicher mal - ist immer so. Nur, auf welchem Niveau sind wir dann?
CELG hatte ich mal vor zwei Jahren kurz. Seitdem stehe ich immer daneben - weil ich sie zu teuer fand. Wenn es nächsten Monat knallt und CELG auf 100 fallen und ich dann kaufe, habe ich es trotzdem falsch gemacht.
Wenn es um teuer geht... was hältst Du von FMI? Klar sind die irre teuer, aber sind sie zu teuer?
Ich habe noch keine abschließende Meinung, aber ich finde, die haben was...
Grüße
SLG
irgendwann knallt es sicher mal - ist immer so. Nur, auf welchem Niveau sind wir dann?
CELG hatte ich mal vor zwei Jahren kurz. Seitdem stehe ich immer daneben - weil ich sie zu teuer fand. Wenn es nächsten Monat knallt und CELG auf 100 fallen und ich dann kaufe, habe ich es trotzdem falsch gemacht.
Wenn es um teuer geht... was hältst Du von FMI? Klar sind die irre teuer, aber sind sie zu teuer?
Ich habe noch keine abschließende Meinung, aber ich finde, die haben was...
Grüße
SLG
Antwort auf Beitrag Nr.: 46.572.447 von ipollit am 05.03.14 23:59:13Hallo ipollit,
ja interessant und das unterstreicht auch, dass der "Hype" gerechtfertigt ist. Das eine Aktie wie Gilead ein KGV von 10 haben wird, wenn es denn so kommt, ist ja eher auszuschließen. Bis dahin kann/wird aber noch viel passieren. Der Knall, wie SLGramann es nennt, wird kommen - nur wann?
Der Wunsch möglichst ganz Oben zu verkaufen und dann ganz Unten wieder einzusteigen ist natürlich immer da aber letztlich absurd.
Ich gebe (ungern) zu, dass mich meine Vorsicht schon Geld "gekostet" hat. Aber nützt ja nix. Ein richtig/falsch etc. gibt es nicht. Es ist letztlich eine Frage, die nur jeder für sich, seine Persönlichkeit und seine Lebenssituation beantworten kann. Ich habe zumindest einen Teil der Gewinne auch in dividendenstarke Aktien und vor allem ETFs gesteckt, und meine Cashquote weiter erhöht. Ein schöner Blog zum Thema passives Einkommen, auch wenn es nichts mit Biotech zu tun hat:
http://finanziell-umdenken.blogspot.de/
Ansonsten bin ich natürlich nach wie vor signifikant in Biotech investiert.
Medigene kann von einem Artikel im Aktionär profitieren. Schon irre! Medigene wird dort eine "Vorreiterrolle" im Bereich Immuno-onkologie zugesprochen. Und das, weil sie kürzlich Trianta übernommen haben. Für 4 Mio Euro! Bester Satz aus dem Artikel war sinngemäß: Jetzt wo Dendreon gescheitert ist, ist der Weg für Medigene frei!
SG kmastra
ja interessant und das unterstreicht auch, dass der "Hype" gerechtfertigt ist. Das eine Aktie wie Gilead ein KGV von 10 haben wird, wenn es denn so kommt, ist ja eher auszuschließen. Bis dahin kann/wird aber noch viel passieren. Der Knall, wie SLGramann es nennt, wird kommen - nur wann?
Der Wunsch möglichst ganz Oben zu verkaufen und dann ganz Unten wieder einzusteigen ist natürlich immer da aber letztlich absurd.
Ich gebe (ungern) zu, dass mich meine Vorsicht schon Geld "gekostet" hat. Aber nützt ja nix. Ein richtig/falsch etc. gibt es nicht. Es ist letztlich eine Frage, die nur jeder für sich, seine Persönlichkeit und seine Lebenssituation beantworten kann. Ich habe zumindest einen Teil der Gewinne auch in dividendenstarke Aktien und vor allem ETFs gesteckt, und meine Cashquote weiter erhöht. Ein schöner Blog zum Thema passives Einkommen, auch wenn es nichts mit Biotech zu tun hat:
http://finanziell-umdenken.blogspot.de/
Ansonsten bin ich natürlich nach wie vor signifikant in Biotech investiert.
Medigene kann von einem Artikel im Aktionär profitieren. Schon irre! Medigene wird dort eine "Vorreiterrolle" im Bereich Immuno-onkologie zugesprochen. Und das, weil sie kürzlich Trianta übernommen haben. Für 4 Mio Euro! Bester Satz aus dem Artikel war sinngemäß: Jetzt wo Dendreon gescheitert ist, ist der Weg für Medigene frei!
SG kmastra
Antwort auf Beitrag Nr.: 46.578.977 von kmastra am 06.03.14 20:15:48Und sinngemäß aus diesem besagten auch Biotech-Kompentenz-Blatt(lese so 2-3 Ausgaben des Aktionärs im Jahr): Grösstes Börsen- PFLICHT blatt Deutschlands.
Ansonsten vielen Dank für den RNAi-link ipollit, kannte ich schon, hatte ihn aber wieder vergessen gehabt: und nach dortigem Lesen (den halben Sonntag dort gelesen), bin ich dann doch nicht in Genfit rein, sondern hab gestern
Tekmira (damit schon > 20% plus)
Arrowhead (-5%) und
Marina (plusminus 0) gekauft.
Celladon bin ich abschussbereit bei 13.
Benitec fehlt noch, die haben heute ordentlich nachgegeben (wie gut, dass gestern kein Geld mehr da war)
Gruss
Ansonsten vielen Dank für den RNAi-link ipollit, kannte ich schon, hatte ihn aber wieder vergessen gehabt: und nach dortigem Lesen (den halben Sonntag dort gelesen), bin ich dann doch nicht in Genfit rein, sondern hab gestern
Tekmira (damit schon > 20% plus)
Arrowhead (-5%) und
Marina (plusminus 0) gekauft.
Celladon bin ich abschussbereit bei 13.
Benitec fehlt noch, die haben heute ordentlich nachgegeben (wie gut, dass gestern kein Geld mehr da war)
Gruss
Ich habe gestern die ziemlich übergewichtete Genmab-Position etwas verkleinert und kleine Positionen bei Foundation, Threshold und Medivation gekauft.
Bei Threshold gefällt mir, dass das mit Merck Darmstadt verpartnerte TH-302 sehr breit über viele Indikationen entwickelt wird.
Zwei pivotal-Trials laufen (beide unter einem SPA) und eine weitere Indikation soll in diesem Jahr in diesen Status wechseln. Die bisherigen Daten waren auch recht gut.
Sarcoma pivotal TH-302 data likely in 3Q15 with interim look in 3Q14. This study is scheduled for a data safety monitoring board review in mid-2014 following an interim analysis after 235 events. The study completed enrollment of 620 patients on December 28, 2013 after expanding the enrollment over this past summer. The interim analysis is designed for an early stoppage of the trial if investigators find an approximate 45% improvement in overall survival (p< 0.0023, HR < 0.69), or as part of a futility analysis. We view this interim look as a high bar and therefore we assume the trial continues after the interim analysis with final analysis in 3Q15, following the predefined 434 events. The trial is powered to detect a 33% improvement in OS, but a 21% improvement (HR < 0.825, P< 0.048) should be sufficient for approval. Numerically, this means that if the control arm produces a 12 month OS as historical data suggests, the TH-302 arm would need to produce a 14.5 month OS to meet its OS endpoint. We expect this trial to meet its primary endpoint based on the 21.5m OS survival benefit from in the Phase IIb trial, though we note that that trial had only a single arm. We are enthusiastic about the prospects for this trial and the validity of the 21.5month from the single arm trial because the Phase 3 has an identical design including TH-302 maintenance doses, with no maintenance in the control arm. We expect positive data for TH-302 in pancreatic cancer in 4Q15.
We expect the front-line metastatic pancreatic cancer Phase III trial to complete enrollment at the end of 2014 and have data available at the end of 2015. The majority of the patients are enrolling at sites in the U.S. We note that the OS benefit for the Phase III dose of TH-302 in the Phase IIb trial was 2.8 months, which compares favorably Abraxane’s 1.8 month benefit. The trial included a crossover for patients who progressed on Gemcitabine alone, which lowered the median OS delta to 2.3 months, though we believe the 2.8 month OS benefit excluding the crossover patients is a more accurate reflection of the drug’s efficacy. We believe there is a significant market opportunity for TH-302 as docs have been critical of the high price and low OS benefit of the doublet of Abraxane and Gemcitabine, most recently in a letter to the New England Journal of Medicine. We view the pancreatic cancer opportunity as the major value driver for Threshold and the primary component of our $536M sales estimate in 2018.
Bei Threshold gefällt mir, dass das mit Merck Darmstadt verpartnerte TH-302 sehr breit über viele Indikationen entwickelt wird.
Zwei pivotal-Trials laufen (beide unter einem SPA) und eine weitere Indikation soll in diesem Jahr in diesen Status wechseln. Die bisherigen Daten waren auch recht gut.
Sarcoma pivotal TH-302 data likely in 3Q15 with interim look in 3Q14. This study is scheduled for a data safety monitoring board review in mid-2014 following an interim analysis after 235 events. The study completed enrollment of 620 patients on December 28, 2013 after expanding the enrollment over this past summer. The interim analysis is designed for an early stoppage of the trial if investigators find an approximate 45% improvement in overall survival (p< 0.0023, HR < 0.69), or as part of a futility analysis. We view this interim look as a high bar and therefore we assume the trial continues after the interim analysis with final analysis in 3Q15, following the predefined 434 events. The trial is powered to detect a 33% improvement in OS, but a 21% improvement (HR < 0.825, P< 0.048) should be sufficient for approval. Numerically, this means that if the control arm produces a 12 month OS as historical data suggests, the TH-302 arm would need to produce a 14.5 month OS to meet its OS endpoint. We expect this trial to meet its primary endpoint based on the 21.5m OS survival benefit from in the Phase IIb trial, though we note that that trial had only a single arm. We are enthusiastic about the prospects for this trial and the validity of the 21.5month from the single arm trial because the Phase 3 has an identical design including TH-302 maintenance doses, with no maintenance in the control arm. We expect positive data for TH-302 in pancreatic cancer in 4Q15.
We expect the front-line metastatic pancreatic cancer Phase III trial to complete enrollment at the end of 2014 and have data available at the end of 2015. The majority of the patients are enrolling at sites in the U.S. We note that the OS benefit for the Phase III dose of TH-302 in the Phase IIb trial was 2.8 months, which compares favorably Abraxane’s 1.8 month benefit. The trial included a crossover for patients who progressed on Gemcitabine alone, which lowered the median OS delta to 2.3 months, though we believe the 2.8 month OS benefit excluding the crossover patients is a more accurate reflection of the drug’s efficacy. We believe there is a significant market opportunity for TH-302 as docs have been critical of the high price and low OS benefit of the doublet of Abraxane and Gemcitabine, most recently in a letter to the New England Journal of Medicine. We view the pancreatic cancer opportunity as the major value driver for Threshold and the primary component of our $536M sales estimate in 2018.
Biotech-Blase
sicherlich werden die Kurse auch mal wieder fallen. Wahrscheinlich alleine schon aus dem Grund, weil die stark steigenden Kurse viele Momentum-Player angelockt haben, denen eigentlich fundamentale Gründe für Bewertungen egal sind, oder andere Anleger, die sich eigentlich nicht speziell für Biotechs interessieren. Alle diese werden auch schnell wieder aussteigen, wenn sich Anzeichen für einen deutlichen Kursrückgang ergeben oder andere Banchen attraktiver erscheinen.
Es ist noch nicht solange her, da gab es diesen großen Hype um HCV. Alles was in diese Richtung ging, wurde blind gekauft, was ebenfalls nach einer Blase gerochen hat. Erstmal klang es verrückt, dass z.B. GILD für über 10 Mrd USD ein PII-Unternehmen wie Pharmasset übernimmt.
Eine Pharmasset war einige Jahre zuvor noch ein unbedeutendes kleines Unternehmen. Innerhalb von nichtmal 3 Jahren hat sich der Kurs dann grob verdreizigfacht bis zum Höhepunkt der Übernahme durch GILD Anfang 2012. GILD selber ist seit der Übernahme von Pharmasset stark gestiegen. Gleichzeitig ist GILD ein Schwergewicht im NBI und aktuell der größte Biotech-Wert weltweit.


Inzwischen ist das PII-Mittel von Pharmasset von GILD nach erfolgreicher PIII als Sovaldi gegen HCV Ende 2013 auf den Markt gebracht worden. Und momentan sieht es danach aus, als ob die hohen Erwartungen während des HCV-Hypes noch deutlich übertroffen werden. Das erste neue HCV-Mittel Incivek von VRTX war schon ein Mrd-Blockbuster innerhalb kürzester Zeit, verschwand dann aber wieder, weil die Nachfolger wie Sovaldi nochmal deutlich besser sind.
http://www.forbes.com/sites/matthewherper/2014/02/21/gileads…
Hier ist der etwa ein Monat alter Verlauf der Verschreibungen, aus dem man Umsatzprognosen und die Entwicklung am Markt ableiten kann. schon da lag der reale Verlauf schon deutlich über den schon sehr optimistischen Schätzungen. Die letzten Zahlen sehen nochmal besser aus, soweit ich das sehe. Sovaldi dürfte ziemlich sicher das erfolgreichste Medikament im ersten Jahr nach der Zulassung zu werden, das es jemals gegeben hat. Aktuelle optimistische Schätzungen sehen 5 Mrd USD Umsatz dieses Jahr, momentan sieht es aber eher nach 10 Mrd USD aus, selbst 15 Mrd USD sind dieses Jahr nicht unmöglich. Zum Vergleich... bisher ist das erfolgreichste Medikament der Cholesterin-Senker Lipitor mit 13 Mrd USD, der dies aber erst nach vielen Jahren am Markt und nicht im ersten Jahr erzielt hat.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
GILD - this week's scripts: 4114 NRx (up from 3434); 6398 TRx
(up from 5291)
Since this week's TRx is 1,100 higher. The numbers will be even higher. Pretty easy to see TRx at 10,000 if NRx stays over 3,500. Of course, that is the big question.
Using $25,000 per script (less than the $28,000 face and probably much less than the cost of the new treatment available in Q4), I am getting ~$1.5B for Q1, ~$2.5B for Q2, and $3B for Q3 and Q4. using the full $28K per script gets one to $11B for the year. If NRx keep growing at 10-20% per week the numbers are bigger and bigger.
Pretty fully loaded, but hard not to buy more at these prices.
Also, the number of new scripts (4K+) is getting a little amazing. Is the market much bigger than everyone thought or are the patients being treated much earlier and therefore will not be there for the new treatment for GILD and ABBV/ENTA. 200K+ new patients is a big number.
Just very interesting to watch.
From Wells this week:
Quote:
"(1) Base case - secondary warehousing - growth in new patient starts slows Q2-Q3 then picks up again Q4 - $10.80B, up
from $7.32B
(2) Rapidly decaying Sovaldi new patient starts throughout remainder of year (bear case) - $8.18B, up from $5.44B
(3) Sovaldi new patient starts level off for rest of year - $15.54B, up from $10.26B
(4) Week over week NRx changes match those seen with Incivek+Victrelis at same point in launch - $14.34B, up from
$9.39B"
Base case is now $10.8B.
Level NRx is $15.5B!!!!!!!!!!!!! Wow!!!!!!!!!!!
Even higher than my top number.
Quote:
"**BOTTOM LINE: We believe GILD shares have stalled of late in part due to concerns regarding a potential slowdown in
uptake this year as initial ''warehoused'' patients go through treatment and other untreated patients await the all-oral
regimen. While we fully expect this will happen at some point, with each week of growth we believe the chance for 2014
sales to exceed even high expectations increases, and the large long-term opportunity within this market - especially
once GILD has a more optimal all-oral regimen - becomes clearer and clearer."
Wells has not officially changed anything. Set price target at 92-96 on 02/05 after earnings. Same with earnings projection of $4.72 for '14 earnings. They have not officially adjusted sales or earnings projections. The $4.72/sh was based on $5.5B of sales for HCV drugs in '14 (much higher than most estimates). It has HCV drugs over $8B in '16 and earnings at $6.74 and HCV over $10B in '18 and earnings at $7.81. Of course there are many other issues since non-HCV drugs go from $12.5B to $14.6B to $13.9B over same periods.
Me - sure, I am upping my expectation every week. If sales are over $8B, I would expect earnings over $6.50/sh, up from $2.04/sh in '13. If sales over $10B, $8/sh looks possible. And with sales at $15B, $12+/sh is possible. Since I think that $8/sh is pretty conservative, it allow for significantly more growth in next couple years, I am comfortable with a 20 p/e, or $160/sh. If we do get the $12+/sh, more growth is a lot less certain, and the p/e might go down to Biomaven's 15, but that still is $180/sh.
****
So Sachen sind ja auch Teil des aktuellen Biotech-Hypes. Im Gegensatz zu den Luft-Bewertungen im Jahr 2000 können die Biotechs heute wirkliche Erfolge vorweisen. Das heißt nicht, dass die Bewertungen vielleicht nicht teilweise überzogen sind und es kann auch einen Crash geben. Aber es gibt auch fundamentale Gründe, dass der Biotech-Markt weiter stark wachsen kann.
Bezüglich des HCV-Marktes sollte man allerdings auch berücksichtigen, dass die neuen Mittel den Markt deutlich verkleinern sollten, da die Behandlungen mit einer hohen Wahrscheinlichkeit zu einer Heilung führen und mit der Zeit so immer weniger Kranke behandelt werden müssen.
Gruß
ipollit
sicherlich werden die Kurse auch mal wieder fallen. Wahrscheinlich alleine schon aus dem Grund, weil die stark steigenden Kurse viele Momentum-Player angelockt haben, denen eigentlich fundamentale Gründe für Bewertungen egal sind, oder andere Anleger, die sich eigentlich nicht speziell für Biotechs interessieren. Alle diese werden auch schnell wieder aussteigen, wenn sich Anzeichen für einen deutlichen Kursrückgang ergeben oder andere Banchen attraktiver erscheinen.
Es ist noch nicht solange her, da gab es diesen großen Hype um HCV. Alles was in diese Richtung ging, wurde blind gekauft, was ebenfalls nach einer Blase gerochen hat. Erstmal klang es verrückt, dass z.B. GILD für über 10 Mrd USD ein PII-Unternehmen wie Pharmasset übernimmt.

Eine Pharmasset war einige Jahre zuvor noch ein unbedeutendes kleines Unternehmen. Innerhalb von nichtmal 3 Jahren hat sich der Kurs dann grob verdreizigfacht bis zum Höhepunkt der Übernahme durch GILD Anfang 2012. GILD selber ist seit der Übernahme von Pharmasset stark gestiegen. Gleichzeitig ist GILD ein Schwergewicht im NBI und aktuell der größte Biotech-Wert weltweit.
Inzwischen ist das PII-Mittel von Pharmasset von GILD nach erfolgreicher PIII als Sovaldi gegen HCV Ende 2013 auf den Markt gebracht worden. Und momentan sieht es danach aus, als ob die hohen Erwartungen während des HCV-Hypes noch deutlich übertroffen werden. Das erste neue HCV-Mittel Incivek von VRTX war schon ein Mrd-Blockbuster innerhalb kürzester Zeit, verschwand dann aber wieder, weil die Nachfolger wie Sovaldi nochmal deutlich besser sind.
http://www.forbes.com/sites/matthewherper/2014/02/21/gileads…

Hier ist der etwa ein Monat alter Verlauf der Verschreibungen, aus dem man Umsatzprognosen und die Entwicklung am Markt ableiten kann. schon da lag der reale Verlauf schon deutlich über den schon sehr optimistischen Schätzungen. Die letzten Zahlen sehen nochmal besser aus, soweit ich das sehe. Sovaldi dürfte ziemlich sicher das erfolgreichste Medikament im ersten Jahr nach der Zulassung zu werden, das es jemals gegeben hat. Aktuelle optimistische Schätzungen sehen 5 Mrd USD Umsatz dieses Jahr, momentan sieht es aber eher nach 10 Mrd USD aus, selbst 15 Mrd USD sind dieses Jahr nicht unmöglich. Zum Vergleich... bisher ist das erfolgreichste Medikament der Cholesterin-Senker Lipitor mit 13 Mrd USD, der dies aber erst nach vielen Jahren am Markt und nicht im ersten Jahr erzielt hat.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
GILD - this week's scripts: 4114 NRx (up from 3434); 6398 TRx
(up from 5291)
Since this week's TRx is 1,100 higher. The numbers will be even higher. Pretty easy to see TRx at 10,000 if NRx stays over 3,500. Of course, that is the big question.
Using $25,000 per script (less than the $28,000 face and probably much less than the cost of the new treatment available in Q4), I am getting ~$1.5B for Q1, ~$2.5B for Q2, and $3B for Q3 and Q4. using the full $28K per script gets one to $11B for the year. If NRx keep growing at 10-20% per week the numbers are bigger and bigger.
Pretty fully loaded, but hard not to buy more at these prices.
Also, the number of new scripts (4K+) is getting a little amazing. Is the market much bigger than everyone thought or are the patients being treated much earlier and therefore will not be there for the new treatment for GILD and ABBV/ENTA. 200K+ new patients is a big number.
Just very interesting to watch.
From Wells this week:
Quote:
"(1) Base case - secondary warehousing - growth in new patient starts slows Q2-Q3 then picks up again Q4 - $10.80B, up
from $7.32B
(2) Rapidly decaying Sovaldi new patient starts throughout remainder of year (bear case) - $8.18B, up from $5.44B
(3) Sovaldi new patient starts level off for rest of year - $15.54B, up from $10.26B
(4) Week over week NRx changes match those seen with Incivek+Victrelis at same point in launch - $14.34B, up from
$9.39B"
Base case is now $10.8B.
Level NRx is $15.5B!!!!!!!!!!!!! Wow!!!!!!!!!!!
Even higher than my top number.
Quote:
"**BOTTOM LINE: We believe GILD shares have stalled of late in part due to concerns regarding a potential slowdown in
uptake this year as initial ''warehoused'' patients go through treatment and other untreated patients await the all-oral
regimen. While we fully expect this will happen at some point, with each week of growth we believe the chance for 2014
sales to exceed even high expectations increases, and the large long-term opportunity within this market - especially
once GILD has a more optimal all-oral regimen - becomes clearer and clearer."
Wells has not officially changed anything. Set price target at 92-96 on 02/05 after earnings. Same with earnings projection of $4.72 for '14 earnings. They have not officially adjusted sales or earnings projections. The $4.72/sh was based on $5.5B of sales for HCV drugs in '14 (much higher than most estimates). It has HCV drugs over $8B in '16 and earnings at $6.74 and HCV over $10B in '18 and earnings at $7.81. Of course there are many other issues since non-HCV drugs go from $12.5B to $14.6B to $13.9B over same periods.
Me - sure, I am upping my expectation every week. If sales are over $8B, I would expect earnings over $6.50/sh, up from $2.04/sh in '13. If sales over $10B, $8/sh looks possible. And with sales at $15B, $12+/sh is possible. Since I think that $8/sh is pretty conservative, it allow for significantly more growth in next couple years, I am comfortable with a 20 p/e, or $160/sh. If we do get the $12+/sh, more growth is a lot less certain, and the p/e might go down to Biomaven's 15, but that still is $180/sh.
****
So Sachen sind ja auch Teil des aktuellen Biotech-Hypes. Im Gegensatz zu den Luft-Bewertungen im Jahr 2000 können die Biotechs heute wirkliche Erfolge vorweisen. Das heißt nicht, dass die Bewertungen vielleicht nicht teilweise überzogen sind und es kann auch einen Crash geben. Aber es gibt auch fundamentale Gründe, dass der Biotech-Markt weiter stark wachsen kann.
Bezüglich des HCV-Marktes sollte man allerdings auch berücksichtigen, dass die neuen Mittel den Markt deutlich verkleinern sollten, da die Behandlungen mit einer hohen Wahrscheinlichkeit zu einer Heilung führen und mit der Zeit so immer weniger Kranke behandelt werden müssen.
Gruß
ipollit
Biotech bleibt riskiobeladen:
WHIPPANY, N.J., THOUSAND OAKS, Calif. and SOUTH SAN FRANCISCO, Calif., March 11, 2014 /PRNewswire/ -- Bayer HealthCare Pharmaceuticals Inc. and Onyx Pharmaceuticals, Inc., an Amgen subsidiary (Nasdaq: AMGN), today announced that a Phase 3 trial evaluating the investigational use of NEXAVAR® (sorafenib) tablets as an adjuvant treatment for patients with hepatocellular carcinoma (HCC), or liver cancer, who had no detectable disease after surgical resection or local ablation, did not meet its primary endpoint of improving recurrence-free survival.
WHIPPANY, N.J., THOUSAND OAKS, Calif. and SOUTH SAN FRANCISCO, Calif., March 11, 2014 /PRNewswire/ -- Bayer HealthCare Pharmaceuticals Inc. and Onyx Pharmaceuticals, Inc., an Amgen subsidiary (Nasdaq: AMGN), today announced that a Phase 3 trial evaluating the investigational use of NEXAVAR® (sorafenib) tablets as an adjuvant treatment for patients with hepatocellular carcinoma (HCC), or liver cancer, who had no detectable disease after surgical resection or local ablation, did not meet its primary endpoint of improving recurrence-free survival.
Antwort auf Beitrag Nr.: 46.581.011 von SLGramann am 07.03.14 07:56:26Bei Threshold gefällt mir, dass das mit Merck Darmstadt verpartnerte TH-302 sehr breit über viele Indikationen entwickelt wird.
Zwei pivotal-Trials laufen (beide unter einem SPA) und eine weitere Indikation soll in diesem Jahr in diesen Status wechseln. Die bisherigen Daten waren auch recht gut.
Hallo SLGrammann,
zu TH-302:
Das das Wirkprinzip von TH-302 beruht auf Hypoxia, also der Sauerstoffarmut im Krebsgewebe.
Bei einigen anderen Entwicklungskandidaten mit demselben Wirkprinzip führte dies leider nicht zum Erfolg; deren weitere Entwicklung wurde meist in der klinischen Phase II eingestellt. Daher habe ich Threshold bisher nur auf meiner watch list.
Es gibt m.W. bisher kein einziges zugelassenes Medikament, das auf diesem Wirkprinzip beruht.
Am weitesten fortgeschritten von allen Hypoxia-targeting drugs scheint Apaziquone (E09) von Spectrum Pharmaceuticals. Dieser Wirkstoff befindet sich gegenwärtig in Phase III in der Indikation Blasenkrebs.
Zwei pivotal-Trials laufen (beide unter einem SPA) und eine weitere Indikation soll in diesem Jahr in diesen Status wechseln. Die bisherigen Daten waren auch recht gut.
Hallo SLGrammann,
zu TH-302:
Das das Wirkprinzip von TH-302 beruht auf Hypoxia, also der Sauerstoffarmut im Krebsgewebe.
Bei einigen anderen Entwicklungskandidaten mit demselben Wirkprinzip führte dies leider nicht zum Erfolg; deren weitere Entwicklung wurde meist in der klinischen Phase II eingestellt. Daher habe ich Threshold bisher nur auf meiner watch list.
Es gibt m.W. bisher kein einziges zugelassenes Medikament, das auf diesem Wirkprinzip beruht.
Am weitesten fortgeschritten von allen Hypoxia-targeting drugs scheint Apaziquone (E09) von Spectrum Pharmaceuticals. Dieser Wirkstoff befindet sich gegenwärtig in Phase III in der Indikation Blasenkrebs.
Habe mir letzte Woche eine etwas größere Position (für meine Verhältnisse) MDVN gegönnt. Der Wert wurde wegen einer sehr konservativen Umsatzschätzung für 2014 abgestraft. Ich erwarte in den kommenden Wochen und Monaten überwiegend positiven Newsflow. Die Labelerweiterung von Xtandi in den USA sollte dann den Höhepunkt für dieses Jahr darstellen. Danach sollte sich das Umsatzwachstum rasant beschleunigen.
hallo,
ich habe arca bio., oncothyreon und wuxi im depot.
ich habe arca bio., oncothyreon und wuxi im depot.
Astellas and Medivation Submit Supplemental New Drug Application for XTANDI (Enzalutamide) for Chemotherapy-Naive Advanced Prostate Cancer.
TOKYO, JAPAN and SAN FRANCISCO, CA--(Marketwired - Mar 18, 2014) - Astellas Pharma Inc. (TSE: 4503) and Medivation Inc. (NASDAQ: MDVN) today announced the submission of a supplemental New Drug Application (sNDA) to the U.S. Food and Drug Administration (FDA) seeking approval of XTANDI® (enzalutamide) capsules for the treatment of men with metastatic castration-resistant prostate cancer (mCRPC) who have not received chemotherapy. XTANDI is currently approved for the treatment of patients with mCRPC who have previously received docetaxel chemotherapy.
The sNDA application is based on the results from the Phase 3 PREVAIL trial evaluating XTANDI as compared to placebo in more than 1,700 chemotherapy-naïve mCRPC patients. The marketing authorization application is expected to be submitted to the European Medicines Agency later this year.
http://finance.yahoo.com/news/astellas-medivation-submit-sup…
TOKYO, JAPAN and SAN FRANCISCO, CA--(Marketwired - Mar 18, 2014) - Astellas Pharma Inc. (TSE: 4503) and Medivation Inc. (NASDAQ: MDVN) today announced the submission of a supplemental New Drug Application (sNDA) to the U.S. Food and Drug Administration (FDA) seeking approval of XTANDI® (enzalutamide) capsules for the treatment of men with metastatic castration-resistant prostate cancer (mCRPC) who have not received chemotherapy. XTANDI is currently approved for the treatment of patients with mCRPC who have previously received docetaxel chemotherapy.
The sNDA application is based on the results from the Phase 3 PREVAIL trial evaluating XTANDI as compared to placebo in more than 1,700 chemotherapy-naïve mCRPC patients. The marketing authorization application is expected to be submitted to the European Medicines Agency later this year.
http://finance.yahoo.com/news/astellas-medivation-submit-sup…
Bisher scheint der Aufwärtstrend noch Bestand zu haben... kommt es nach der aktuellen kleineren Korrektur zu einem weiteren Schub nach oben?

Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.654.795 von ipollit am 18.03.14 22:37:17Bisher scheint der Aufwärtstrend noch Bestand zu haben... kommt es nach der aktuellen kleineren Korrektur zu einem weiteren Schub nach oben?
Ist mit der Korrektur Freitag und Montag sowie der ausgefallenen Gegenbewegung gestern damit der Aufwärtstrend gebrochen?
Ist vielleicht aufgrund der Korrektur im Bereich Biotech etwas untergegangen, deswegen stelle ich es noch kurz ein:
Exelixis Gets Approval For Cometriq In European Union For Treatment Of MTC By RTT News, March 25, 2014, 06:29:00 AM EDT
(RTTNews.com) - Biotechnology firm Exelixis, Inc. ( EXEL ) Tuesday announced that the European Commission has approved Cometriq or cabozantinib, for the treatment of adult patients with progressive, unresectable locally advanced or metastatic medullary thyroid carcinoma, or MTC.
The U.S. Food and Drug Administration approved Cometriq for the treatment of progressive, metastatic MTC in the United States on November 29, 2012.
For comments and feedback: contact editorial@rttnews.com
http://www.rttnews.com
Read more: http://www.nasdaq.com/article/exelixis-gets-approval-for-com…
Grüße
Oberländler
Ist mit der Korrektur Freitag und Montag sowie der ausgefallenen Gegenbewegung gestern damit der Aufwärtstrend gebrochen?
Ist vielleicht aufgrund der Korrektur im Bereich Biotech etwas untergegangen, deswegen stelle ich es noch kurz ein:
Exelixis Gets Approval For Cometriq In European Union For Treatment Of MTC By RTT News, March 25, 2014, 06:29:00 AM EDT
(RTTNews.com) - Biotechnology firm Exelixis, Inc. ( EXEL ) Tuesday announced that the European Commission has approved Cometriq or cabozantinib, for the treatment of adult patients with progressive, unresectable locally advanced or metastatic medullary thyroid carcinoma, or MTC.
The U.S. Food and Drug Administration approved Cometriq for the treatment of progressive, metastatic MTC in the United States on November 29, 2012.
For comments and feedback: contact editorial@rttnews.com
http://www.rttnews.com
Read more: http://www.nasdaq.com/article/exelixis-gets-approval-for-com…
Grüße
Oberländler
Antwort auf Beitrag Nr.: 46.705.679 von Oberlaendler am 26.03.14 13:00:23Der "steile" kurzfrisitigere Aufwärtstrend ist gebrochen. Der langfristige Aufwärtstrend ist aber weiter intakt. Eine Unterstützung könnte im Bereich von 240$ liegen. Je nachdem könnte eine weitere Konsolidierung aber auch noch bis eventuell knapp unter 220$ gehen...

Ansonsten ist/ bleibt es wahnsinnig spannend. Neben der politischen Unsicherheit hat viel mehr eine Diskussion über die hohen Preise einiger Medikamente für eine sektorspezifische Unsicherheit geführt. Im Mittelpunkt steht dabei ausgerechnet Gilead mit Solvadi. Ich persönlich glaube aber nicht, dass die Diskussion, die von 3 Kongressabgeordneten losgetreten wurde kurzfristig einen Einfluss auf die Preisgestaltung haben wird. Das Thema ansich ist aber durchaus diskussionswürdig, komplex und spannend - gerade in Bezug auf Hepatitis C. Ich rechne eher damit, dass sowohl Solvadi als auch der Cocktail von ENTA/Abbvie noch sehr hochpreisig sein werden, es jedoch mit zunehmender Konkurrenz auch günstiger werden wird.
Zu EXEL:
Neben der guten Nachricht der Zulassung in der EU kommt heute die Nachricht, dass die COMET-1 Studie nicht vorzeitig (aufgrund der Effektivität) beendet wurde sondern bis zum Ende durchgeführt werden muss. Verstehe die heutige Kursreaktion von -35% nicht. War damit zu rechnen? Oder übersehe ich da was??
Bin zumindest heute eingestiegen, weil die Studienziele ja wohl auch noch erreicht werden können (Ergebnisse noch dieses Jahr) und ich den Absturz für sehr übertrieben halte.
Ansonsten ist/ bleibt es wahnsinnig spannend. Neben der politischen Unsicherheit hat viel mehr eine Diskussion über die hohen Preise einiger Medikamente für eine sektorspezifische Unsicherheit geführt. Im Mittelpunkt steht dabei ausgerechnet Gilead mit Solvadi. Ich persönlich glaube aber nicht, dass die Diskussion, die von 3 Kongressabgeordneten losgetreten wurde kurzfristig einen Einfluss auf die Preisgestaltung haben wird. Das Thema ansich ist aber durchaus diskussionswürdig, komplex und spannend - gerade in Bezug auf Hepatitis C. Ich rechne eher damit, dass sowohl Solvadi als auch der Cocktail von ENTA/Abbvie noch sehr hochpreisig sein werden, es jedoch mit zunehmender Konkurrenz auch günstiger werden wird.
Zu EXEL:
Neben der guten Nachricht der Zulassung in der EU kommt heute die Nachricht, dass die COMET-1 Studie nicht vorzeitig (aufgrund der Effektivität) beendet wurde sondern bis zum Ende durchgeführt werden muss. Verstehe die heutige Kursreaktion von -35% nicht. War damit zu rechnen? Oder übersehe ich da was??
Bin zumindest heute eingestiegen, weil die Studienziele ja wohl auch noch erreicht werden können (Ergebnisse noch dieses Jahr) und ich den Absturz für sehr übertrieben halte.
mal was am Rande:
The false discovery rate, or how not to make a fool of yourself with p values
http://www.dcscience.net/?p=6518
The false discovery rate, or how not to make a fool of yourself with p values
http://www.dcscience.net/?p=6518
Antwort auf Beitrag Nr.: 46.707.605 von kmastra am 26.03.14 15:57:39die letzten Tage waren schon ein deutlicher Rücksetzer... momentan scheint die Stimmung sehr negativ bezüglich Biotechs zu sein. Vielleicht war GILD der Auslöser (wobei der Kurs von GILD paradoxerweise kaum gesunken ist seit Beginn der steilen Abwärtsbewegung), allerdings scheint es mir eher so, dass fast jeder Grund für einen Verkauf ausgereicht hätte. Fundamental bin ich von Biotechs immer so sehr überzeugt und sehe keine wirkliche Überbewertung. Aber die Kurse wurden wahrscheinlich auch von vielen hochgetrieben, die sich eigentlich nicht für Biotechs interessieren, sondern einfach nur dem Trend gefolgt sind. Dieses Geld fließt nun wieder heraus in andere Branchen. Außerdem wartete ja quasi jeder auf einen Rücksetzer, so dass kaum Kaufkraft vorhanden ist.
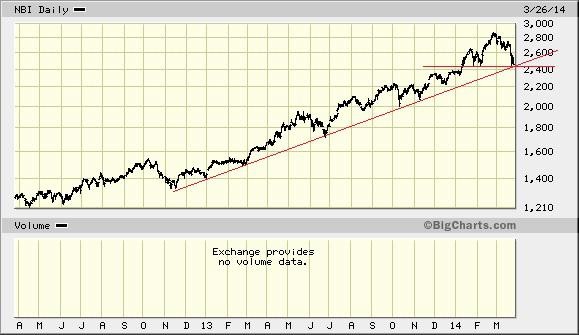
Bedenklich finde ich allerdings auch so ein Kursreaktion wie die von EXEL heute, die das aktuelle Sentiment gut zeigt. Der Kurssturz wird damit begründet, dass man bereits einen Erfolg von COMET-1 bei der Zwischenanalyse erwartet hätte. Seit wann werden Erfolge bei Zwischenanalysen erwartet? Die gleichen Leute stellen seit jeher den Erfolg von Carbo insgesamt in Frage. Während Biotechs in den letzten Jahren in der Breite gestiegen sind, war EXEL die ganze Zeit ein klarer Underperformer. Das zeigt doch, dass es keine Erwartungen bezüglich der Zwischenanalyse gab. Eigentlich ist eine Empfehlung zur Studien-Weiterführung ein Non-Event. Mir ist absolut unklar, wie das einen Einfluss auf den Gesamterfolg der Studie haben soll bzw. wie man daraus etwas negatives ableiten kann!?

Gruß
ipollit

Bedenklich finde ich allerdings auch so ein Kursreaktion wie die von EXEL heute, die das aktuelle Sentiment gut zeigt. Der Kurssturz wird damit begründet, dass man bereits einen Erfolg von COMET-1 bei der Zwischenanalyse erwartet hätte. Seit wann werden Erfolge bei Zwischenanalysen erwartet? Die gleichen Leute stellen seit jeher den Erfolg von Carbo insgesamt in Frage. Während Biotechs in den letzten Jahren in der Breite gestiegen sind, war EXEL die ganze Zeit ein klarer Underperformer. Das zeigt doch, dass es keine Erwartungen bezüglich der Zwischenanalyse gab. Eigentlich ist eine Empfehlung zur Studien-Weiterführung ein Non-Event. Mir ist absolut unklar, wie das einen Einfluss auf den Gesamterfolg der Studie haben soll bzw. wie man daraus etwas negatives ableiten kann!?
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.712.057 von ipollit am 26.03.14 23:58:00Hallo ipollit,
eine große Korrektur ist dringend erforderlich. Unabhängig von den Bewertungen, über die man sicher streiten kann, ist der gegenwärtige IPO-Boom definitiv ungesund und ein Zeichen deutlicher Überhitzung. Wird Zeit, dass das endet.
Zu EXEL:
Ich gebe Dir völlig recht, dass die Reaktion des Marktes extrem und irrational war, wenn man das nur auf dieses Nicht-Ereignis bezieht. Allerdings wurde damit möglicherweise auch nur eine vorhergehnde Irrationalität korrigiert, als man begann, eine Zulassung von Cabo bei CRPC mit erhöhter Wahrscheinlichkeit einzupreisen.
Ich halte mich an Hammer, nachdem die Erfolgswahrscheinlichkeit in dieser Indikation bei ungefähr 30% liegen dürfte und die Aktie ohne diese Indikation so um die 2,5 bis 3 Dollar wert sein dürfte.
Insofern erscheint mir der gegenwärtige Kurs nicht unangemessen.
Grüße
SLG
eine große Korrektur ist dringend erforderlich. Unabhängig von den Bewertungen, über die man sicher streiten kann, ist der gegenwärtige IPO-Boom definitiv ungesund und ein Zeichen deutlicher Überhitzung. Wird Zeit, dass das endet.
Zu EXEL:
Ich gebe Dir völlig recht, dass die Reaktion des Marktes extrem und irrational war, wenn man das nur auf dieses Nicht-Ereignis bezieht. Allerdings wurde damit möglicherweise auch nur eine vorhergehnde Irrationalität korrigiert, als man begann, eine Zulassung von Cabo bei CRPC mit erhöhter Wahrscheinlichkeit einzupreisen.
Ich halte mich an Hammer, nachdem die Erfolgswahrscheinlichkeit in dieser Indikation bei ungefähr 30% liegen dürfte und die Aktie ohne diese Indikation so um die 2,5 bis 3 Dollar wert sein dürfte.
Insofern erscheint mir der gegenwärtige Kurs nicht unangemessen.
Grüße
SLG
Antwort auf Beitrag Nr.: 46.713.161 von SLGramann am 27.03.14 09:00:37Heute Vormittag kommen übrigens wichtige PI-Daten von Clovis ( CO-1686).
Bin sehr gespannt. Die Aktie ist bei mir übergewichtet. Na ja, mal sehen...
Bin sehr gespannt. Die Aktie ist bei mir übergewichtet. Na ja, mal sehen...
Antwort auf Beitrag Nr.: 46.713.177 von SLGramann am 27.03.14 09:03:13CLVS:
In the 22 evaluable T790M positive patients across efficacious dose levels, 14 RECIST partial responses (PRs) have been observed to date, for a 64 percent objective response rate (ORR). Ten of the 14 patients (71 percent) started CO-1686 therapy immediately following progression on a prior TKI. Twenty of the 22 evaluable T790M positive patients, or 91 percent, have experienced stable disease or a PR.
In a broader population of 29 evaluable T790M positive and T790M currently unknown patients, 15 RECIST PRs have been observed to date, for a 52 percent response rate. Twenty-six of the 29 evaluable 790M positive and T790M currently unknown patients, or 90 percent, have experienced stable disease or a PR. These data will be updated if and as the T790M status of the unconfirmed patients are centrally determined.
The median duration of response cannot yet be estimated in the T790M positive patients. However, PFS greater than six months has been observed in evaluable T790M positive heavily-pretreated patients and the median has not yet been reached. In contrast, PFS in T790M negative patients is shorter, with a median of three months.
Five of nine evaluable patients, or 56 percent, dosed initially with 900mg BID of freebase and now on the HBr formulation remain on drug with continuing PRs
------
Sieht für mich sehr gut aus. ORR > 60% und PFS liegt am Ende ja dann wohl > 6 Monate.
Und das bei massiv vorbehandelten Patienten:
Patients on study were heavily pretreated prior to receiving CO-1686; 73 percent of patients across all doses had immediately progressed on TKI therapy prior to CO-1686 treatment. The median number of previous lines of therapy across patients at all doses was three; the median number of previous TKI lines was two.
Nebenwirkunsprofil scheint sehr sauber zu sein.
So wie ich es verstehe, ist hier ein Blockbuster in der Mache (Bestätigung der Daten natürlich vorausgesetzt).
In the 22 evaluable T790M positive patients across efficacious dose levels, 14 RECIST partial responses (PRs) have been observed to date, for a 64 percent objective response rate (ORR). Ten of the 14 patients (71 percent) started CO-1686 therapy immediately following progression on a prior TKI. Twenty of the 22 evaluable T790M positive patients, or 91 percent, have experienced stable disease or a PR.
In a broader population of 29 evaluable T790M positive and T790M currently unknown patients, 15 RECIST PRs have been observed to date, for a 52 percent response rate. Twenty-six of the 29 evaluable 790M positive and T790M currently unknown patients, or 90 percent, have experienced stable disease or a PR. These data will be updated if and as the T790M status of the unconfirmed patients are centrally determined.
The median duration of response cannot yet be estimated in the T790M positive patients. However, PFS greater than six months has been observed in evaluable T790M positive heavily-pretreated patients and the median has not yet been reached. In contrast, PFS in T790M negative patients is shorter, with a median of three months.
Five of nine evaluable patients, or 56 percent, dosed initially with 900mg BID of freebase and now on the HBr formulation remain on drug with continuing PRs
------
Sieht für mich sehr gut aus. ORR > 60% und PFS liegt am Ende ja dann wohl > 6 Monate.
Und das bei massiv vorbehandelten Patienten:
Patients on study were heavily pretreated prior to receiving CO-1686; 73 percent of patients across all doses had immediately progressed on TKI therapy prior to CO-1686 treatment. The median number of previous lines of therapy across patients at all doses was three; the median number of previous TKI lines was two.
Nebenwirkunsprofil scheint sehr sauber zu sein.
So wie ich es verstehe, ist hier ein Blockbuster in der Mache (Bestätigung der Daten natürlich vorausgesetzt).
Antwort auf Beitrag Nr.: 46.712.057 von ipollit am 26.03.14 23:58:00Hallo ipollit,
Schuld ist GILD natürlich sowieso nicht. Die Lage ist/war halt explosiv. Und die Überlegugen, dass die "rosigen Zeiten" vorbei sein könnten, scheinen doch sehr übertrieben. Ich rechne zumindest nicht damit, dass in den USA die Maxime" Der freie Markt reguliert sich von selbst" demnächst nicht mehr gilt.
Mit deiner Einschätzung, dasss Geld abgewandert ist, könntest du Recht haben. Hatte mich schon gewundert, warum einige Werte wie Ballard Power, Capstone etc. so dermaßen abgingen. Ich würde mir mehr Sorgen um die Nachhaltigkeit solcher Anstiege machen...
EXEL:
Hier wird es m.E. auf den Punkt gebracht:
http://www.epvantage.com/Universal/View.aspx?type=Story&id=4…
Ich bin auch deshalb eingestiegen, weil die verpartnerte Pipeline insgesamt doch recht breit ist. Zudem ist genügend Cash vorhanden.

dazu noch Cobimetinib mit Roche in PIII.
Ein SA Artikel mit guter Übersicht aber extrem schlechtem Timing:
http://seekingalpha.com/article/2107553-4-reasons-to-be-bull…
Nochmal was Grundsätzliches aus dem Bereich Strategie - und mit Bezug zu EXEL: Laut Marc Shoenebaum war die blowup Strategie (kaufen nach Kurssturz über 25% an einem Tag) eine der erfolgreichsten (die erfolgreichste??) überhaupt. Leider ist der ganze Bericht nur zahlenden Kunden verfügbar. Über Twitter hat er aber z.B. gepostet:
Some of my "biotech blow up" data. If u bought every blow up since 1997, u would be up 40%-80% at 12-24 months.
Das lässt doch für EXEL hoffen...
SG kmastra
Schuld ist GILD natürlich sowieso nicht. Die Lage ist/war halt explosiv. Und die Überlegugen, dass die "rosigen Zeiten" vorbei sein könnten, scheinen doch sehr übertrieben. Ich rechne zumindest nicht damit, dass in den USA die Maxime" Der freie Markt reguliert sich von selbst" demnächst nicht mehr gilt.
Mit deiner Einschätzung, dasss Geld abgewandert ist, könntest du Recht haben. Hatte mich schon gewundert, warum einige Werte wie Ballard Power, Capstone etc. so dermaßen abgingen. Ich würde mir mehr Sorgen um die Nachhaltigkeit solcher Anstiege machen...
EXEL:
Hier wird es m.E. auf den Punkt gebracht:
http://www.epvantage.com/Universal/View.aspx?type=Story&id=4…
Ich bin auch deshalb eingestiegen, weil die verpartnerte Pipeline insgesamt doch recht breit ist. Zudem ist genügend Cash vorhanden.

dazu noch Cobimetinib mit Roche in PIII.
Ein SA Artikel mit guter Übersicht aber extrem schlechtem Timing:

http://seekingalpha.com/article/2107553-4-reasons-to-be-bull…
Nochmal was Grundsätzliches aus dem Bereich Strategie - und mit Bezug zu EXEL: Laut Marc Shoenebaum war die blowup Strategie (kaufen nach Kurssturz über 25% an einem Tag) eine der erfolgreichsten (die erfolgreichste??) überhaupt. Leider ist der ganze Bericht nur zahlenden Kunden verfügbar. Über Twitter hat er aber z.B. gepostet:
Some of my "biotech blow up" data. If u bought every blow up since 1997, u would be up 40%-80% at 12-24 months.
Das lässt doch für EXEL hoffen...
SG kmastra
Kennt von Euch jemand ein short Zertifikat oder einen short ETF auf den nasdaq Biotechnology Index? Oder hat jemand ne Idee wie man den breiten Biotechmarkt shorten könnte? Hab schon viel rumgesucht, kann aber nichts passendes finden.
Antwort auf Beitrag Nr.: 46.719.655 von Sweetbull am 27.03.14 21:04:20Also ich hoffe ernsthaft, dass keins meiner Postings dich zu dieser Überlegung bewogen hat.
Aber sei's drum: Ein ETF wäre z.B. dieser hier (short mit Faktor 2)
https://finance.yahoo.com/q?s=BIS&ql=1
Es gibt bestimmt auch Knockoutzertifikate für BBbiotech.
Ich würde mir das auch gut überlegen. Im Allgemeinen ist es m.E. gerade im Bereich Biotech doch sinnvoller bei einzelnen Werten mit kleineren Beträgen Short zu gehen, als gegen den Gesamtmarkt zu setzen. Spontan fielen mir da Mannkind und Ariad ein. Leider ist es aber nicht so einfach, dass aus D zu tun. Aber alles (wie immer) nur meine persönliche Meinung.
Aber sei's drum: Ein ETF wäre z.B. dieser hier (short mit Faktor 2)
https://finance.yahoo.com/q?s=BIS&ql=1
Es gibt bestimmt auch Knockoutzertifikate für BBbiotech.
Ich würde mir das auch gut überlegen. Im Allgemeinen ist es m.E. gerade im Bereich Biotech doch sinnvoller bei einzelnen Werten mit kleineren Beträgen Short zu gehen, als gegen den Gesamtmarkt zu setzen. Spontan fielen mir da Mannkind und Ariad ein. Leider ist es aber nicht so einfach, dass aus D zu tun. Aber alles (wie immer) nur meine persönliche Meinung.
Antwort auf Beitrag Nr.: 46.720.079 von kmastra am 27.03.14 22:14:37Hallo,
Einen sehr aussichtsreichen Wert möchte ich Euch vorstellen bei dem ich kürzlich eingestiegen und aktuell zwar 10% im Minus bin, von dem ich jedoch glaube, dass wir dieses Jahr noch mehr als einen Verdoppler sehen könnten:
Flamel Technologies FLML
Gestern gab's Zahlen, die nicht schlecht waren.
Aus dem yahoo-Board:
Mar 18, 2014 9:22 AM
2 users liked this posts users disliked this posts 0
Reply
The Table is set......
Best-in-class drug delivery platforms creating a broad, proprietary product pipeline
6 products in development using four delivery platforms
•Generate cash flow through FDA (NDA) approval for currently unapproved marketed drugs (UMDs) with established need
Bloxiverz (neostigmine methylsulfate) approved on May 31, 2013 and launched in 3Q 2013
Second NDA has a PDUFA date of April 28, 2014
•Utilize cash flow from UMDs for development of a proprietary pipeline expected to deliver 6-8 regulatory filings through 2017
2 NDA filings anticipated in 2014 for marketed unapproved products
Expect 4-6 regulatory filings in 2015-2017 using Flamel’s technology
Utilizing the 505(b)2 pathway – known safe and efficacious drugs
•Anticipate being cash flow positive in 2H 2014
Now that the table is set, I am hoping my wife decides to do what she does best, make reservations. I am not sure one of the new drugs FLML will produce can cure my stomach from her cooking.........
Den letzten Absatz des postings wollt ich Euch natürlich auch nicht vorenthalten.
Jedenfalls scheint die Aktie weder hier, noch drüben weiter bekannt/-er zu sein, so der Anschein. Sollte sich dies ändern, wäre der Verdoppler auch kurzfristig/Ende April (am 28., s.o.) möglich und darüber hinaus besteht m.E. ein nicht unerhebliches Potential.
Hab jedenfalls vor, nicht unter mindestens 30 zu verkaufen.
homepage:
www.flamel.com
Rest steht dort.
Die letzten beiden s.a.-Artikel:
http://seekingalpha.com/article/1894451-flamel-technologies-…
http://seekingalpha.com/article/1910401-flamel-technologies-…
Meinungen? (Bin mit 30%-Depotanteil drin).
Gruss,
s.
Einen sehr aussichtsreichen Wert möchte ich Euch vorstellen bei dem ich kürzlich eingestiegen und aktuell zwar 10% im Minus bin, von dem ich jedoch glaube, dass wir dieses Jahr noch mehr als einen Verdoppler sehen könnten:
Flamel Technologies FLML
Gestern gab's Zahlen, die nicht schlecht waren.
Aus dem yahoo-Board:
Mar 18, 2014 9:22 AM
2 users liked this posts users disliked this posts 0
Reply
The Table is set......
Best-in-class drug delivery platforms creating a broad, proprietary product pipeline
6 products in development using four delivery platforms
•Generate cash flow through FDA (NDA) approval for currently unapproved marketed drugs (UMDs) with established need
Bloxiverz (neostigmine methylsulfate) approved on May 31, 2013 and launched in 3Q 2013
Second NDA has a PDUFA date of April 28, 2014
•Utilize cash flow from UMDs for development of a proprietary pipeline expected to deliver 6-8 regulatory filings through 2017
2 NDA filings anticipated in 2014 for marketed unapproved products
Expect 4-6 regulatory filings in 2015-2017 using Flamel’s technology
Utilizing the 505(b)2 pathway – known safe and efficacious drugs
•Anticipate being cash flow positive in 2H 2014
Now that the table is set, I am hoping my wife decides to do what she does best, make reservations. I am not sure one of the new drugs FLML will produce can cure my stomach from her cooking.........
Den letzten Absatz des postings wollt ich Euch natürlich auch nicht vorenthalten.
Jedenfalls scheint die Aktie weder hier, noch drüben weiter bekannt/-er zu sein, so der Anschein. Sollte sich dies ändern, wäre der Verdoppler auch kurzfristig/Ende April (am 28., s.o.) möglich und darüber hinaus besteht m.E. ein nicht unerhebliches Potential.
Hab jedenfalls vor, nicht unter mindestens 30 zu verkaufen.
homepage:
www.flamel.com
Rest steht dort.
Die letzten beiden s.a.-Artikel:
http://seekingalpha.com/article/1894451-flamel-technologies-…
http://seekingalpha.com/article/1910401-flamel-technologies-…
Meinungen? (Bin mit 30%-Depotanteil drin).
Gruss,
s.
Antwort auf Beitrag Nr.: 46.720.145 von sufenta am 27.03.14 22:29:44Ergänzung:
http://www.flamel.com/wp-content/uploads/2014/02/pipeline.pn…

http://www.flamel.com/products/eclat-pharmaceuticals-product…
http://www.flamel.com/wp-content/uploads/2014/02/pipeline.pn…

http://www.flamel.com/products/eclat-pharmaceuticals-product…
Antwort auf Beitrag Nr.: 46.720.185 von sufenta am 27.03.14 22:35:58Zahlen, soweit ich verstanden hab, ohne
http://www.flamel.com/products/eclat-pharmaceuticals-product…
Drug-Delivery-Platforms:
http://www.flamel.com/drug-delivery-platforms/
Nochmal Grüsse,
s.
http://www.flamel.com/products/eclat-pharmaceuticals-product…
Drug-Delivery-Platforms:
http://www.flamel.com/drug-delivery-platforms/
Nochmal Grüsse,
s.
Antwort auf Beitrag Nr.: 46.720.079 von kmastra am 27.03.14 22:14:37@kmastra: vielen Dank für den Tipp. Aber wie es scheint ist der Fonds nicht in Dtld handelbar-oder hast du eine WKN bzw. iSIN? BB Biotech knockouts gibt es. Ist das übrigens ein börsennotierter Fonds?
Und keine Angst-deine postings haben mich nicht dazu bewogen mir shorts anzusehen...ich denke bei den Biotechs ist eine Blase geplatzt und viele Bewertungen sind viel zu ambitioniert. Die Börse ist eben keine Einbahnstrasse und Bäume wachsen nicht in den Himmel
Und keine Angst-deine postings haben mich nicht dazu bewogen mir shorts anzusehen...ich denke bei den Biotechs ist eine Blase geplatzt und viele Bewertungen sind viel zu ambitioniert. Die Börse ist eben keine Einbahnstrasse und Bäume wachsen nicht in den Himmel

in D handelbare Hebel-Bear-Zertifikate auf den Amex Biotechnology Index:
AA8QS1
AA7SVF
AA8E0W
AA8FN6
Auf den breiteren Nasdaq Biotechnology Index habe ich bislang keine entsprechenden Zertifikate gefunden.
AA8QS1
AA7SVF
AA8E0W
AA8FN6
Auf den breiteren Nasdaq Biotechnology Index habe ich bislang keine entsprechenden Zertifikate gefunden.
Antwort auf Beitrag Nr.: 46.720.951 von Nase_weis_nix am 28.03.14 07:53:53Daaaaanke für die Mühen! Sehr lieb von Dir. Hab schon was passendes von den genannten knockouts gefunden

Antwort auf Beitrag Nr.: 46.713.161 von SLGramann am 27.03.14 09:00:37Hallo SLGramann,
"Ich halte mich an Hammer, nachdem die Erfolgswahrscheinlichkeit in dieser Indikation bei ungefähr 30% liegen dürfte und die Aktie ohne diese Indikation so um die 2,5 bis 3 Dollar wert sein dürfte.
...nachdem was Hammer heute schreibt, sieht er ohne diese Indikation eher einen Wert von 5 USD als 2,5 USD, wenn ich es richtig sehe. Wie rechnest du denn den Wert der 30% Wahrscheinlichkeit? Wenn man z.B. Xofigo als Vergleich nimmt... angenommen, COMET-1 fällt in einigen Wochen positiv aus, so wäre Carbo etwas vergleichbares zu Xofigo, wobei Carbo nach meinem Verständnis sich deutlicher gegen Knochenmetastasen richtet (bisher gibt es in diesem Bereich noch nichts) und in der Vergangenheit radioaktive Mittel wie Xofigo in der Praxis eher problematisch waren. Bayer hat für Algeta, also für 50% des zukünftigen US-Umsatz + zweistellige Royalties weltweit von Xofigo, ca. 3 Mrd USD auf den Tisch gelegt. EXEL hält 100% US und 100% weltweit... wie wäre das zu bewerten? Wenn ich es richtig überschlage, sind deine 30% auf die Zulassung (100%) hochgerechnet ein Wert von ca. 700 Mio USD. Warum setzt du den Wert von Carbo bei einer Zulassung soweit unter Xofigo an?
EXEL hat sämtliche Ressourcen auf Carbo gesetzt... ich kenne kein anderes Biotech-Unternehmen, das so massiv ein Krebs-Mittel alleine voranbringt. Momentan laufen alleine 3 große PIII-Studien in 3 großen Indikationen und es gibt zig PII-Studien, die von Dritten finanziert werden. RCC ist z.B. ähnlich groß wie COMET-1... da gibt es nächstes Jahr Zulassungs-Daten. Momentan ist dies alles so gut wie nicht eingepreist... ist das gerechtfertigt?
Dass Biotechs jetzt verkauft werden, ist ja von den Verkäufern eher ein Bauchgefühl, weil die Kurse in den letzten Jahren so gestiegen sind... irgendwelche fundamentalen Begründungen für eine Überbewertung habe ich bisher nicht gelesen. Dass analog zu den steigenden Kursen die Umsätze und die Märkte massiv zunehmen, ist den meisten anscheinend egal. Ich denke, dass am Ende aber nur die harten Umsatz-Zahlen zählen werden und nicht ein Bauchgefühl.
Gruß
ipollit
"Ich halte mich an Hammer, nachdem die Erfolgswahrscheinlichkeit in dieser Indikation bei ungefähr 30% liegen dürfte und die Aktie ohne diese Indikation so um die 2,5 bis 3 Dollar wert sein dürfte.
...nachdem was Hammer heute schreibt, sieht er ohne diese Indikation eher einen Wert von 5 USD als 2,5 USD, wenn ich es richtig sehe. Wie rechnest du denn den Wert der 30% Wahrscheinlichkeit? Wenn man z.B. Xofigo als Vergleich nimmt... angenommen, COMET-1 fällt in einigen Wochen positiv aus, so wäre Carbo etwas vergleichbares zu Xofigo, wobei Carbo nach meinem Verständnis sich deutlicher gegen Knochenmetastasen richtet (bisher gibt es in diesem Bereich noch nichts) und in der Vergangenheit radioaktive Mittel wie Xofigo in der Praxis eher problematisch waren. Bayer hat für Algeta, also für 50% des zukünftigen US-Umsatz + zweistellige Royalties weltweit von Xofigo, ca. 3 Mrd USD auf den Tisch gelegt. EXEL hält 100% US und 100% weltweit... wie wäre das zu bewerten? Wenn ich es richtig überschlage, sind deine 30% auf die Zulassung (100%) hochgerechnet ein Wert von ca. 700 Mio USD. Warum setzt du den Wert von Carbo bei einer Zulassung soweit unter Xofigo an?
EXEL hat sämtliche Ressourcen auf Carbo gesetzt... ich kenne kein anderes Biotech-Unternehmen, das so massiv ein Krebs-Mittel alleine voranbringt. Momentan laufen alleine 3 große PIII-Studien in 3 großen Indikationen und es gibt zig PII-Studien, die von Dritten finanziert werden. RCC ist z.B. ähnlich groß wie COMET-1... da gibt es nächstes Jahr Zulassungs-Daten. Momentan ist dies alles so gut wie nicht eingepreist... ist das gerechtfertigt?
Dass Biotechs jetzt verkauft werden, ist ja von den Verkäufern eher ein Bauchgefühl, weil die Kurse in den letzten Jahren so gestiegen sind... irgendwelche fundamentalen Begründungen für eine Überbewertung habe ich bisher nicht gelesen. Dass analog zu den steigenden Kursen die Umsätze und die Märkte massiv zunehmen, ist den meisten anscheinend egal. Ich denke, dass am Ende aber nur die harten Umsatz-Zahlen zählen werden und nicht ein Bauchgefühl.
Gruß
ipollit
Antwort auf Beitrag Nr.: 46.733.953 von ipollit am 30.03.14 19:09:45Hallo ipollit,
ja, nach dem neuesten Text von Hammer sieht er den Wert offenbar bei 5 Dollar.
Er hatte früher mal (in einem Kommentar?) geschrieben, dass er bei Cabo für CRPC eine 30% Zulassungswahrscheinlichkeit sieht (inzwischen wohl eher weniger?) und dass in im negativen Fall der Kurs um 50% fallen könnte. Damals stand der Kurs bei ca. 4,5 Dollar.
Richtig ist natürlich, dass die Marktreaktion auf so einen Fehler und der objektive Wert der Aktie zweierlei sind.
Dass der Wert von EXEL auch ohne CRPC höher als der heutige Kurs liegen könnte, hat er nun nachvollziehbar beschrieben.
Wenn der Trial endgültig scheitern sollte, muss man zunächst mal wohl trotzdem mit einem weiteren Kursrutsch rechnen.
Dennoch macht es sicher Sinn, jetzt auf die Käuferseite zu gehen.
Gruß
SLG
ja, nach dem neuesten Text von Hammer sieht er den Wert offenbar bei 5 Dollar.
Er hatte früher mal (in einem Kommentar?) geschrieben, dass er bei Cabo für CRPC eine 30% Zulassungswahrscheinlichkeit sieht (inzwischen wohl eher weniger?) und dass in im negativen Fall der Kurs um 50% fallen könnte. Damals stand der Kurs bei ca. 4,5 Dollar.
Richtig ist natürlich, dass die Marktreaktion auf so einen Fehler und der objektive Wert der Aktie zweierlei sind.
Dass der Wert von EXEL auch ohne CRPC höher als der heutige Kurs liegen könnte, hat er nun nachvollziehbar beschrieben.
Wenn der Trial endgültig scheitern sollte, muss man zunächst mal wohl trotzdem mit einem weiteren Kursrutsch rechnen.
Dennoch macht es sicher Sinn, jetzt auf die Käuferseite zu gehen.
Gruß
SLG
Zwar sehe ich die IPO-Schwemme grundsätzlich kritisch, aber dieser Wert könnte aus meiner Sicht interessant werden, wenn der Börsengang tatsächlich klappt:

http://www.syndax.com/index.aspx
Hier ein Bericht von fierce:
http://www.fiercebiotech.com/story/syndax-swings-69m-ipo-bre…
Was mir gefällt:
The company grabbed headlines in the fall when it became one of very few small biotechs to pick up the FDA's coveted breakthrough therapy designation, guaranteeing its lead candidate, entinostat, a priority review.
...
Now Syndax plans to test entinostat's mettle in Phase III, raising $26.6 million last year to gear up for the trial and looking to use its $69 million IPO haul to follow through with the 600-patient study. Alongside its co-sponsor, the National Cancer Institute, Syndax expects to kick off enrollment in April...
Zum medizinischen Hintergrund dieser interessante Artikel von Sally Church:
http://pharmastrategyblog.com/2011/11/update-from-aacr-molec…
Ich denke, hier haben wir einige tolle Zutaten zusammen, oder?
Sollte man beobachten.

http://www.syndax.com/index.aspx
Hier ein Bericht von fierce:
http://www.fiercebiotech.com/story/syndax-swings-69m-ipo-bre…
Was mir gefällt:
The company grabbed headlines in the fall when it became one of very few small biotechs to pick up the FDA's coveted breakthrough therapy designation, guaranteeing its lead candidate, entinostat, a priority review.
...
Now Syndax plans to test entinostat's mettle in Phase III, raising $26.6 million last year to gear up for the trial and looking to use its $69 million IPO haul to follow through with the 600-patient study. Alongside its co-sponsor, the National Cancer Institute, Syndax expects to kick off enrollment in April...
Zum medizinischen Hintergrund dieser interessante Artikel von Sally Church:
http://pharmastrategyblog.com/2011/11/update-from-aacr-molec…
Ich denke, hier haben wir einige tolle Zutaten zusammen, oder?
Sollte man beobachten.
EXEL:
Ohad Hammer kommt in seinem Beitrag ja zu einem Wert von ca. 1 Milliarde US$.
Dabei berücksichtigt er aber weder Cash (was ich nachvollziehbar finde, weil es zwar Ende 2013 noch 450Mio waren, aber die Studien eben viel Geld kosten) noch den Rest der Pipeline. Das wiederum finde ich schwierig, weil zwar die Programme noch recht früh sind aber es eben auch unlogisch erscheint, ihnen gar keinen Wert beizumessen.
Ein Beispiel wird heute im Blog diskutiert. GsK hat eine neue P2 für foretinib gestartet. http://www.clinicaltrials.gov/ct2/show/NCT02034097
Von daher sollte man m.E. auch den Rest der Pipeline (voll verpartnert) mit in seine Überlegungen einbeziehen, da er der Aktie eine gewisse Sicherheit gibt. Exelixis wird es eben (aller Wahrscheinlichkeit) auch noch dann geben, wenn C&C floppen.
Ohad Hammer kommt in seinem Beitrag ja zu einem Wert von ca. 1 Milliarde US$.
Dabei berücksichtigt er aber weder Cash (was ich nachvollziehbar finde, weil es zwar Ende 2013 noch 450Mio waren, aber die Studien eben viel Geld kosten) noch den Rest der Pipeline. Das wiederum finde ich schwierig, weil zwar die Programme noch recht früh sind aber es eben auch unlogisch erscheint, ihnen gar keinen Wert beizumessen.
Ein Beispiel wird heute im Blog diskutiert. GsK hat eine neue P2 für foretinib gestartet. http://www.clinicaltrials.gov/ct2/show/NCT02034097
Von daher sollte man m.E. auch den Rest der Pipeline (voll verpartnert) mit in seine Überlegungen einbeziehen, da er der Aktie eine gewisse Sicherheit gibt. Exelixis wird es eben (aller Wahrscheinlichkeit) auch noch dann geben, wenn C&C floppen.
Antwort auf Beitrag Nr.: 46.707.605 von kmastra am 26.03.14 15:57:39Der "steile" kurzfrisitigere Aufwärtstrend ist gebrochen. Der langfristige Aufwärtstrend ist aber weiter intakt. Eine Unterstützung könnte im Bereich von 240$ liegen. Je nachdem könnte eine weitere Konsolidierung aber auch noch bis eventuell knapp unter 220$ gehen...
Scheint mindestens auf 220 zu gehen.
Erfahrungen mit "Crashs" legen nahe, dass auch ein Rückgang von ca. 35% vom Höchstkurs der Blase aus gut möglich ist. Dann kämen wir bei ungefähr 180 raus. Das kann ich mir zumindest vorstellen.
Einen totalen Zusammenbruch (140 und tiefer) kann ich mir hingegen nicht vorstellen. Wie ipollit schon mehrfach betonte, sind die Umsätze, Gewinne und Wachstum der Branchen-Schwergewichte real und nicht fiktiv, so dass man bei einem Indexstand von 140 deutlich zu niedrige KGVs hätte.
Scheint mindestens auf 220 zu gehen.
Erfahrungen mit "Crashs" legen nahe, dass auch ein Rückgang von ca. 35% vom Höchstkurs der Blase aus gut möglich ist. Dann kämen wir bei ungefähr 180 raus. Das kann ich mir zumindest vorstellen.
Einen totalen Zusammenbruch (140 und tiefer) kann ich mir hingegen nicht vorstellen. Wie ipollit schon mehrfach betonte, sind die Umsätze, Gewinne und Wachstum der Branchen-Schwergewichte real und nicht fiktiv, so dass man bei einem Indexstand von 140 deutlich zu niedrige KGVs hätte.
Antwort auf Beitrag Nr.: 46.771.461 von SLGramann am 05.04.14 09:44:01Hallo SLGramann,
sehe ich vom Prinzip genauso. Das Problem ist nur, dass man nicht davon ausgehen sollte, dass die Märkte rational funktionieren. Es kommt halt immer wieder zu Übertreibungen in die eine oder andere Richtung. Von daher bleibt abzuwarten, wie tief es noch geht. Langfristig zählen aber natürlich wieder die Fakten. Und da bin ich auch ganz bei ipollit, dass man die positiven Entwicklungen eben nicht von der Hand weisen kann.
Ich habe einen Teil meines Geldes gestern wieder/weiter investiert. (EXEL, ARRY, AMBI)
Mag sein, dass es zu früh war. Aber ich hatte ja auch schon zu früh verkauft. Ganz Oben zu verkaufen und ganz Unten wieder einzusteigen ist eben auch eine Illusion!
Ganz Oben zu verkaufen und ganz Unten wieder einzusteigen ist eben auch eine Illusion!
Vielleicht sorgt die anstehende Berichtssaison wieder für eine Fokussierung auf die Fakten...
SG kmastra
sehe ich vom Prinzip genauso. Das Problem ist nur, dass man nicht davon ausgehen sollte, dass die Märkte rational funktionieren. Es kommt halt immer wieder zu Übertreibungen in die eine oder andere Richtung. Von daher bleibt abzuwarten, wie tief es noch geht. Langfristig zählen aber natürlich wieder die Fakten. Und da bin ich auch ganz bei ipollit, dass man die positiven Entwicklungen eben nicht von der Hand weisen kann.
Ich habe einen Teil meines Geldes gestern wieder/weiter investiert. (EXEL, ARRY, AMBI)
Mag sein, dass es zu früh war. Aber ich hatte ja auch schon zu früh verkauft.
 Ganz Oben zu verkaufen und ganz Unten wieder einzusteigen ist eben auch eine Illusion!
Ganz Oben zu verkaufen und ganz Unten wieder einzusteigen ist eben auch eine Illusion! Vielleicht sorgt die anstehende Berichtssaison wieder für eine Fokussierung auf die Fakten...
SG kmastra
Die Korrektur geht weiter. Teils auch heute wieder im Panikmodus. Scher zu sagen, wo das noch hinführt - und welche Strategie somit ratsam wäre. Ich versuche weiterhin, an schwachen Tagen mutig zu sein.
Chart vom Nasdaq Biotech Index


Chart vom S&P Biotech Index (hier sind viele kleine/mittelgroße Biotechs repräsentiert)


Besonders hart trifft es zur Zeit AMBI. Warum eigentlich? Es gibt doch keine Neuigkeiten. Liegt es "nur" an Stoplosskursen? Mittlerweile ist die Marktkapitalisierung unter 100 Mio EUR. CS (Credit Suisse?) sieht in einem Update Ambit bzw quizartinib bei AML weiterhin als interessant an.


Chart vom Nasdaq Biotech Index
Chart vom S&P Biotech Index (hier sind viele kleine/mittelgroße Biotechs repräsentiert)
Besonders hart trifft es zur Zeit AMBI. Warum eigentlich? Es gibt doch keine Neuigkeiten. Liegt es "nur" an Stoplosskursen? Mittlerweile ist die Marktkapitalisierung unter 100 Mio EUR. CS (Credit Suisse?) sieht in einem Update Ambit bzw quizartinib bei AML weiterhin als interessant an.

Antwort auf Beitrag Nr.: 46.824.031 von kmastra am 14.04.14 23:22:30Hallo kmastra,
ich traue mir auch nicht zu, Kursverläufe auf kurze Sicht vorherzusagen. Charttechnik ist nicht meins.
Dass es mal "knallen" muss, haben wir hier aber geahnt und schon vor Wochen und Monaten darüber geschrieben.
Gute Zeichen wären aus meiner Sicht, wenn der IPO-Markt austrocknen würde. Der war zuletzt total überdreht, was wahrscheinlich eines der sichersten Blasensymptome ist. Außerdem sollte man schauen, wann der Abwärtstrend an Dynamik verliert und die Umsätze zurück gehen.
Ich kann mir vorstellen, dass wir demnächst einen Boden finden werden. Wenn es eine CELG bspw. für ein 2015er KGV von 15 gibt, kann man nicht mehr wirklich von Überbewertung sprechen.
Kaufen würde ich immer unabhängig vom Marktgeschehen auf der Basis meiner subjektiven Wertvorstellung in Bezug auf konkrete Unternehmen.
Bin deshalb schon vor Tagen bei Exelixis eingestiegen.
ich traue mir auch nicht zu, Kursverläufe auf kurze Sicht vorherzusagen. Charttechnik ist nicht meins.
Dass es mal "knallen" muss, haben wir hier aber geahnt und schon vor Wochen und Monaten darüber geschrieben.
Gute Zeichen wären aus meiner Sicht, wenn der IPO-Markt austrocknen würde. Der war zuletzt total überdreht, was wahrscheinlich eines der sichersten Blasensymptome ist. Außerdem sollte man schauen, wann der Abwärtstrend an Dynamik verliert und die Umsätze zurück gehen.
Ich kann mir vorstellen, dass wir demnächst einen Boden finden werden. Wenn es eine CELG bspw. für ein 2015er KGV von 15 gibt, kann man nicht mehr wirklich von Überbewertung sprechen.
Kaufen würde ich immer unabhängig vom Marktgeschehen auf der Basis meiner subjektiven Wertvorstellung in Bezug auf konkrete Unternehmen.
Bin deshalb schon vor Tagen bei Exelixis eingestiegen.
Antwort auf Beitrag Nr.: 46.825.897 von SLGramann am 15.04.14 11:10:48Hallo
1,2 % war der Index im Plus, momentan noch 0,3 %,
und das ruck zuck, wird wohl wieder auf minus 3 % zusteuern,
ohne Nachrichten.
1,2 % war der Index im Plus, momentan noch 0,3 %,
und das ruck zuck, wird wohl wieder auf minus 3 % zusteuern,
ohne Nachrichten.
Hallo in die Runde,
sollte der Boden gefunden sein? Da muss sich jeder selber ein Bild zu machen. Ich für meinen Teil bin mittlerweile wieder voll investiert, weil einige Werte mir dann doch (mittelfristig) günstig erschienen. Habe am Ende dann aber doch nicht mehr den Mut gehabt bei AMBI noch weiter zuzukaufen - und von da an ging es bergauf. Fast schon logisch...
Momentan ist ja wieder eine Menge los im Biotech/Pharma-Bereich:
Pfizer stand wohl in Verhandlungen mit AstraZeneca zwecks Übernahme.
http://www.bloomberg.com/news/2014-04-22/astrazeneca-rises-o…
Novartis, GsK und Lilly in einem Deal, den ich erst noch so richtig verstehen muss:
http://www.foxbusiness.com/industries/2014/04/22/novartis-re…
Valeant will Allergan übernehmen:
http://www.forbes.com/sites/briansolomon/2014/04/22/bill-ack…
Einige kleinere Übernahmen wie Zalicus, Topotarget.
Dazu noch positive News von der viel beachteten Sarepta:
http://www.theflyonthewall.com/permalinks/entry.php/SRPT;RNA…
Gestern die Zulassung von ramucirumab (Dyax)
https://finance.yahoo.com/news/lillys-cyramza-ramucirumab-be…
Und vor allem: Heute Abend kommen Zahlen von Gilead! Mal sehen, ob im CC was zum Preis von Solvadi gesagt wird. Das könnte für weiteres Vertrauen sorgen. Zudem geht es dann in der Woche - und in nächster Zeit mit den Zahlen weiter...
SG kmastra
sollte der Boden gefunden sein? Da muss sich jeder selber ein Bild zu machen. Ich für meinen Teil bin mittlerweile wieder voll investiert, weil einige Werte mir dann doch (mittelfristig) günstig erschienen. Habe am Ende dann aber doch nicht mehr den Mut gehabt bei AMBI noch weiter zuzukaufen - und von da an ging es bergauf. Fast schon logisch...
Momentan ist ja wieder eine Menge los im Biotech/Pharma-Bereich:
Pfizer stand wohl in Verhandlungen mit AstraZeneca zwecks Übernahme.
http://www.bloomberg.com/news/2014-04-22/astrazeneca-rises-o…
Novartis, GsK und Lilly in einem Deal, den ich erst noch so richtig verstehen muss:
http://www.foxbusiness.com/industries/2014/04/22/novartis-re…
Valeant will Allergan übernehmen:
http://www.forbes.com/sites/briansolomon/2014/04/22/bill-ack…
Einige kleinere Übernahmen wie Zalicus, Topotarget.
Dazu noch positive News von der viel beachteten Sarepta:
http://www.theflyonthewall.com/permalinks/entry.php/SRPT;RNA…
Gestern die Zulassung von ramucirumab (Dyax)
https://finance.yahoo.com/news/lillys-cyramza-ramucirumab-be…
Und vor allem: Heute Abend kommen Zahlen von Gilead! Mal sehen, ob im CC was zum Preis von Solvadi gesagt wird. Das könnte für weiteres Vertrauen sorgen. Zudem geht es dann in der Woche - und in nächster Zeit mit den Zahlen weiter...
SG kmastra
Also der Deal zwischen Novartis und GSK ist zumindest mal nicht positiv für ARRY. Es gibt doch einige Überscheidungen. Zudem ist Mekinest bereits zugelassen. Hier wären auch keine Royalties oder Copromotion etc. fällig.
Andereseits müssten doch gerade einige Kombinationsstudien mit Mekinest neu gestartet werden.
Langfristig zählt aber sicherlich, welches Programm besser ist. Trotzdem bringt das erstmal Verunsicherung - und das jetzt wo ich meine Position bei ARRY aufgebaut habe und eigentlich vor habe sie länger zu halten
Hat jemand eine Meinung dazu, ob MEK162 oder Mekinist in den bisherigen Studien besser abgeschnitten haben?

Andereseits müssten doch gerade einige Kombinationsstudien mit Mekinest neu gestartet werden.
Langfristig zählt aber sicherlich, welches Programm besser ist. Trotzdem bringt das erstmal Verunsicherung - und das jetzt wo ich meine Position bei ARRY aufgebaut habe und eigentlich vor habe sie länger zu halten

Hat jemand eine Meinung dazu, ob MEK162 oder Mekinist in den bisherigen Studien besser abgeschnitten haben?

Antwort auf Beitrag Nr.: 46.856.596 von kmastra am 22.04.14 16:35:33Solvadi erlöst 2,27 Milliarden US$ im ersten Q nach Zulassung! Das ist natürlich extrem stark.
Ich finde eine Einschätzung über die Nachhaltigkeit aber extrem schwierig, weil gerade in den USA doch einiges anders ist. Nicht alle sind krankenversichert, es gibt Obamacare, viele HEPC Erkrankte sitzen im Gefängnis(also zahlt der Staat) , auch andere Medikamente funktionieren ja (auch ohne Nebenwirkungen)...von daher fände ich es logisch, wenn der Preis bei zunehmender Konkurrenz sinkt. Ich würde sogar vermuten, dass dies stärker geschieht als von Analystenseite geschätzt. M.E. hängt eben auch viel von den Preisen der anderen ab. Aber Gilead scheint den Markt auf Sicht zu dominieren.
Dazu kommen ja noch Idelalisib etc.


Ich finde eine Einschätzung über die Nachhaltigkeit aber extrem schwierig, weil gerade in den USA doch einiges anders ist. Nicht alle sind krankenversichert, es gibt Obamacare, viele HEPC Erkrankte sitzen im Gefängnis(also zahlt der Staat) , auch andere Medikamente funktionieren ja (auch ohne Nebenwirkungen)...von daher fände ich es logisch, wenn der Preis bei zunehmender Konkurrenz sinkt. Ich würde sogar vermuten, dass dies stärker geschieht als von Analystenseite geschätzt. M.E. hängt eben auch viel von den Preisen der anderen ab. Aber Gilead scheint den Markt auf Sicht zu dominieren.
Dazu kommen ja noch Idelalisib etc.


Endocyte verschiebt den für heute angesetzten Q1 CC auf morgen. Ist sehr ungewöhnlich. Was könnte dahinter stecken. Macht Merck ernst und startet einen Übernahmeversuch?
Die DB beschäftigt sich ziemlich ausführlich mit den große Biotechs: GILD, CELG, BIIB, AMGN
http://pull.db-gmresearch.com/cgi-bin/pull/DocPull/2088-1364…
Intersessant auch Aussagen zu MOR202 (S. 66/67) - frag mich immer wie die darauf kommen, besonders weil es noch nicht einmal mehr Studienergebnisse gibt.
http://pull.db-gmresearch.com/cgi-bin/pull/DocPull/2088-1364…
Intersessant auch Aussagen zu MOR202 (S. 66/67) - frag mich immer wie die darauf kommen, besonders weil es noch nicht einmal mehr Studienergebnisse gibt.
Antwort auf Beitrag Nr.: 46.908.374 von BiotechHype am 02.05.14 00:14:30Leider keine Übernahme, Studie wurde gestoppt, Aktie halbiert sich
http://finance.yahoo.com/news/merck-endocytes-ovarian-cancer…

http://finance.yahoo.com/news/merck-endocytes-ovarian-cancer…
Antwort auf Beitrag Nr.: 46.908.374 von BiotechHype am 02.05.14 00:14:30blick auf den kurs hilft 

CLDX:
Endlich kommt man mit CDX-1127 voran. BMS ist der optimale Partner, weil sie ein ganz breites immuno-onkologisches Spektrum haben - auch jenseits von Nivolumab.
Mir wäre eine feste Verpartnerung am liebsten gewesen. Celldex will aber wohl niemanden exklusive Rechte einräumen?
(übrigens ganz witzig, wie der Markt erst den "immunotherapie-hype" bei Celldex gespielt und dann CDX-1127 wieder ausgepreist hat - in jede Richtung konsequent bis zur Hysterie...)
NEW YORK (TheStreet) -- Bristol-Myers Squibb (BMY) and Celldex Therapeutics (CLDX) are collaborating to conduct a single clinical trial combining their respective experimental cancer immunotherapies, the companies announced Wednesday.
The phase I/II study will combine Bristol's PD-1 checkpoint inhibitor nivolumab with Celldex's CD27-targeted antibody varlilumab, also known as CDX-1127. Multiple tumor types will be treated, including non-small cell lung cancer, melanoma, ovarian, colon and head-and-neck cancer.
Similarly, AstraZeneca (AZN) and Incyte (INCY) will study a combination of their immuno-oncology compounds in multiple tumor types, the companies also announced Wednesday.
The Bristol-Celldex collaboration is somewhat unusual in that it applies only to this single clinical trial. Bristol is paying Celldex $5 million but the cost of the study is split between the two companies. Celldex will run the study, which is expected to start in the fourth quarter.
Celldex retains full ownership rights to varlilumab but Bristol does have a time-limited option to license the drug, if Celldex chooses to seek a full-time partner.
Endlich kommt man mit CDX-1127 voran. BMS ist der optimale Partner, weil sie ein ganz breites immuno-onkologisches Spektrum haben - auch jenseits von Nivolumab.
Mir wäre eine feste Verpartnerung am liebsten gewesen. Celldex will aber wohl niemanden exklusive Rechte einräumen?
(übrigens ganz witzig, wie der Markt erst den "immunotherapie-hype" bei Celldex gespielt und dann CDX-1127 wieder ausgepreist hat - in jede Richtung konsequent bis zur Hysterie...)
NEW YORK (TheStreet) -- Bristol-Myers Squibb (BMY) and Celldex Therapeutics (CLDX) are collaborating to conduct a single clinical trial combining their respective experimental cancer immunotherapies, the companies announced Wednesday.
The phase I/II study will combine Bristol's PD-1 checkpoint inhibitor nivolumab with Celldex's CD27-targeted antibody varlilumab, also known as CDX-1127. Multiple tumor types will be treated, including non-small cell lung cancer, melanoma, ovarian, colon and head-and-neck cancer.
Similarly, AstraZeneca (AZN) and Incyte (INCY) will study a combination of their immuno-oncology compounds in multiple tumor types, the companies also announced Wednesday.
The Bristol-Celldex collaboration is somewhat unusual in that it applies only to this single clinical trial. Bristol is paying Celldex $5 million but the cost of the study is split between the two companies. Celldex will run the study, which is expected to start in the fourth quarter.
Celldex retains full ownership rights to varlilumab but Bristol does have a time-limited option to license the drug, if Celldex chooses to seek a full-time partner.
CLVS:
Endlich die bt-Entscheidung.
Clovis Oncology Receives Breakthrough Therapy Designation for CO-1686 for the Treatment of Second-line EGFR Mutant Non-small Cell Lung Cancer (NSCLC) in Patients with the T790M Mutation
http://phx.corporate-ir.net/phoenix.zhtml?c=247187&p=irol-ne…
Meine größte Sorge bei Clovis ist eigentlich, dass das Unternehmen zu einem Spottpreis übernommen wird. Der derzeitige Aktienkurs ist ein Witz!
Endlich die bt-Entscheidung.
Clovis Oncology Receives Breakthrough Therapy Designation for CO-1686 for the Treatment of Second-line EGFR Mutant Non-small Cell Lung Cancer (NSCLC) in Patients with the T790M Mutation
http://phx.corporate-ir.net/phoenix.zhtml?c=247187&p=irol-ne…
Meine größte Sorge bei Clovis ist eigentlich, dass das Unternehmen zu einem Spottpreis übernommen wird. Der derzeitige Aktienkurs ist ein Witz!
Antwort auf Beitrag Nr.: 47.014.452 von SLGramann am 20.05.14 15:29:56Hallo SLGramann,
die Frage scheint letztlich nur zu welchem Preis CLVS übernommen wird. Was wäre denn für dich ein fairer Preis?
ARRY:
Hier wird die Lage bzgl. MEK162 immer unübersichtlicher und auch negativer.
Die Studie in NRAS Melanoma wurde jetzt erheblich verändert und soll erst im Juli 2016 fertig sein. Ein Zulassungsanrag in 2015 ist somit vom Tisch (?), wenn ich das alles richtig verstehe. Fragt sich warum NOV das jetzt ändert?
http://clinicaltrials.gov/ct2/show/NCT01763164
Praktisch der Link: History of changes, den ich noch gar nicht kannte.
SG kmastra
die Frage scheint letztlich nur zu welchem Preis CLVS übernommen wird. Was wäre denn für dich ein fairer Preis?
ARRY:
Hier wird die Lage bzgl. MEK162 immer unübersichtlicher und auch negativer.
Die Studie in NRAS Melanoma wurde jetzt erheblich verändert und soll erst im Juli 2016 fertig sein. Ein Zulassungsanrag in 2015 ist somit vom Tisch (?), wenn ich das alles richtig verstehe. Fragt sich warum NOV das jetzt ändert?
http://clinicaltrials.gov/ct2/show/NCT01763164
Praktisch der Link: History of changes, den ich noch gar nicht kannte.
SG kmastra
Antwort auf Beitrag Nr.: 47.020.256 von kmastra am 21.05.14 13:33:12"die Frage scheint letztlich nur zu welchem Preis CLVS übernommen wird. Was wäre denn für dich ein fairer Preis?"
Tja, ein professioneller Investor würde jetzt die PeakSales für CO-1686 und lucitanib schätzen, das Ganze mit einem DCF-Modell runterrechnen und um Zulassungswahrscheinlichkeiten bereinigen.
Vielleicht würde man mit so einem Modell auf einen Unternehmenswert in der Nähe des gegenwärtigen Börsenwerts kommen, keine Ahnung.
Ich habe einfach einen anderen (unprofessionellen) Blick auf die Dinge. Ich frage mich, für welchen Preis ich das Unternehmen verkaufen würde, wenn es mir komplett gehören würde.
Ich sehe in CO-1686 einen künftigen Blockbuster mit Zulassung 2016.
Lucitanib würde ich mir nicht mit Wahrscheinlichkeiten kaputt rechnen lassen.
Ich würde das Unternehmen nicht für weniger als 10 Mrd. Dollar verkaufen, wenn ich das entscheiden könnte. Warum sollte ich denn?
PS: Damit will ich gar nichts gegen die Methode der Analysten sagen. Für einen Portfoliomanager gibt es wohl keine bessere. Man sollte aber im Hinterkopf behalten, dass die Ergebnisse der DCF- und Wahrscheinlichkeitsberechnungen nur eines mit Sicherheit sind: Falsch. Sie sind im Einzelfall immer dramatisch falsch. Das ist alles "nur" Statistik + oft hirnrissige Modellparameter (beim DCF).
Tja, ein professioneller Investor würde jetzt die PeakSales für CO-1686 und lucitanib schätzen, das Ganze mit einem DCF-Modell runterrechnen und um Zulassungswahrscheinlichkeiten bereinigen.
Vielleicht würde man mit so einem Modell auf einen Unternehmenswert in der Nähe des gegenwärtigen Börsenwerts kommen, keine Ahnung.
Ich habe einfach einen anderen (unprofessionellen) Blick auf die Dinge. Ich frage mich, für welchen Preis ich das Unternehmen verkaufen würde, wenn es mir komplett gehören würde.
Ich sehe in CO-1686 einen künftigen Blockbuster mit Zulassung 2016.
Lucitanib würde ich mir nicht mit Wahrscheinlichkeiten kaputt rechnen lassen.
Ich würde das Unternehmen nicht für weniger als 10 Mrd. Dollar verkaufen, wenn ich das entscheiden könnte. Warum sollte ich denn?
PS: Damit will ich gar nichts gegen die Methode der Analysten sagen. Für einen Portfoliomanager gibt es wohl keine bessere. Man sollte aber im Hinterkopf behalten, dass die Ergebnisse der DCF- und Wahrscheinlichkeitsberechnungen nur eines mit Sicherheit sind: Falsch. Sie sind im Einzelfall immer dramatisch falsch. Das ist alles "nur" Statistik + oft hirnrissige Modellparameter (beim DCF).
Antwort auf Beitrag Nr.: 47.037.574 von SLGramann am 23.05.14 18:40:44Danke für die Einschätzung. Ich befürchte aber (auch ohne professionelle Analyse) da werden wir nicht landen.
Clovis wollte sich ja schon mal verkaufen und von daher gehe ich mal davon aus, dass man sich auch jetzt nicht groß wehren würde. Andereseits sind gerade vielversprechende Krebspräperate sehr begehrt und es gibt wenige, die in der Hand kleinerere Unternehmen sind. Mal sehen wer/wie viele sich ernsthaft interessieren...
Bei ARRY habe ich mich von einem Teil meiner doch großen Position getrennt.
Dafür habe ich bei AMBI nachgekauft. Ich kann jedem, der dort investiert ist nur dazu raten, sich die letzte Präsentation anzuhören. Auf der Ebene auf der ich in Sachen Biotech unterwegs bin (und das ist nicht sooo tief), hört sich das alles total vielversprechend an. Auf der ASH werden zudem Ergebnisse zu der Studie nach Knochnmarkstransplantation erwartet. Ein positiver Ausgang würde einerseits einen Erfolg der PIII wahrscheinlich machen (ggf. sogar schon nach interim analyse 2015) und auch das Marktpotenzial erheblich erweitern.
phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9NTQzMjQz…
http://phx.corporate-ir.net/phoenix.zhtml?c=208891&p=irol-Ev…
Clovis wollte sich ja schon mal verkaufen und von daher gehe ich mal davon aus, dass man sich auch jetzt nicht groß wehren würde. Andereseits sind gerade vielversprechende Krebspräperate sehr begehrt und es gibt wenige, die in der Hand kleinerere Unternehmen sind. Mal sehen wer/wie viele sich ernsthaft interessieren...
Bei ARRY habe ich mich von einem Teil meiner doch großen Position getrennt.
Dafür habe ich bei AMBI nachgekauft. Ich kann jedem, der dort investiert ist nur dazu raten, sich die letzte Präsentation anzuhören. Auf der Ebene auf der ich in Sachen Biotech unterwegs bin (und das ist nicht sooo tief), hört sich das alles total vielversprechend an. Auf der ASH werden zudem Ergebnisse zu der Studie nach Knochnmarkstransplantation erwartet. Ein positiver Ausgang würde einerseits einen Erfolg der PIII wahrscheinlich machen (ggf. sogar schon nach interim analyse 2015) und auch das Marktpotenzial erheblich erweitern.
phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9NTQzMjQz…
http://phx.corporate-ir.net/phoenix.zhtml?c=208891&p=irol-Ev…
Hallo kmastra,
ARRY sehe ich eigentlich recht positiv. Schon seit einiger Zeit werden bei Biotechs eher die negativen Seiten gesucht. Dass NVS von GSK für viel Geld u.a. einen weiteren MEK-Hemmer kauft, wird direkt so gewertet, dass MEK162 dann schlechter sein muss. Wenn sich ein Datum auf clinialtrials negativ ändert, finden sich gleich Twitter-Kommentare mit Verweis auf GSK usw.
Wenn du dir die History zu der NRAS-Studie weiter ansiehst, so ist es nicht unwahrscheinlich, dass es sich bei Juli 2016 um einen simplen Schreibfehler handelt. Diese Seiten werden zwar von z.B. Patienten genutzt, sind aber sicherlich ohne Gewähr. Wer weiß, welche Personen da mal eben zwischen Tür und Angel Daten nachtragen. 07/2016 ist jetzt bei Studienende (das ist wohl das Datum, bis zu dem man an der Studie teilnehmen kann und die Patienten begleitet werden) und Studienauswertung eingetragen. Letzteres kann meiner Meinung nach viel früher erfolgen, wenn die Datenbasis ausreichend ist, weil z.B. für OS ein Teil der Patienten dann gestorben ist. Nach der Haupt-Auswertung läuft die Studie dann noch länger, um auch Ergebnisse nach vielen Jahren zu erhalten. Im Dezember wurde diese beiden Datumsangaben ebenfalls auf ein gleiches Datum in 2016 geändert. Ein paar Wochen später wurde die primäre Auswertung wieder auf Ende 2014 korrigiert. Ich gehe davon aus, dass nach wie vor die Daten nächstes Jahr vorliegen und die Zulassung dann im positiven Fall beantragt werden kann. Dies wurde auch schon mehrfach von NVS und ARRY gesagt.
Mein Eindruck von den NVS-Präsentationen ist der, dass MEK für sie eine große Rolle spielt. MEK ist ein zentrales Element in den Kombi-Studien. NRAS wäre nur die erste Zulassung als Mono-Therapie. Darüber hinaus gibt es aber zig weitere Studien.
Dass NVS für recht viel Geld den Onkologie-Bereich von GSK übernommen hat, muss nicht heißen, dass MEK162 keine Bedeutung mehr für NVS hat. BMS, AZ, Merck usw setzen im Onkologie-Bereich stark auf Ansätze des Immunsystems. NVS hat dagegen den Schwerpunkt der TKIs... d.h. sehr spezifisch auf irgendwelche Signalwege einzuwirken. Ich denke, dass NVS hier führend ist und mit der GSK-Übernahme diese Führung noch stärken wollte. Bei MEK hat man nun einen Konkurrenten weniger. Wenn MEK ein guter Ansatz ist, so bekommt NVS einen großen Teil vom Kuchen ab. Ein Vorteil von Mekinist ist wohl, dass es bereits zugelassen ist. Es ist viel schwieriger, zwei nicht zugelassene Mittel als Kombi von der FDA genehmigt zu bekommen, als ein zugelassenes und ein neues. Daher wurde auch erstmal Mekinist und und der BRAF-Hemmer Tafinlar separat zugelassen vor deren Kombination. MEK162 könnte nächstes Jahr auch die Mono-Zulassung erhalten. NVS BRAF-Hemmer LGX818 wird ja jetzt auch nicht infrage gestellt. Ich glaube nicht, dass NVS einfach MEK162 durch Mekinist in Kombi-Studien erstzen kann... sie müssten die PI und die Dosisfindung erst wiederholen. Jeder MEK ist anders... MEK162 wird momentan so auch in anderen PIII-Indikationen entwickelt als z.B. Selumetinib. Ich fände es völlig unlogisch, wenn NVS MEK162 nun durch die PIII bringt, eine riesige Datenbasis durch zig PI und PIIs geschaffen hat und es einfach ARRY zurückgibt, um mit Mekinist weiter zu machen. Mir ist nicht bekannt, dass Mekinist besser wäre... eher im Gegenteil. Sie kaufen für 14 Mrd USD u.a. Mekinist und schenken MEK162 später Array für umsonst, so dass danach jeder andere Pharma MEK162 einlizensieren und als Konkurrent gegen Mekinist auf den Markt positionieren kann. Mehr Sinn macht es, beide MEKs bri NVS in unterschiedlichen Indikationen zu entwickeln und dann einfach zu schauen.
In ARRYs Pipeline finde ich u.a. auch den HER2-Hemmer ARRY380 interessant. Konkurrent Neratinib von PBYI wirkt bei Brustkrebs anscheinend besser als Herceptin&Co. Allerdings ist Neratinib nicht so selektiv und hemmt auch EGFR, das bei Brustkrebs keine Relevanz hat aber zu erheblichen Nebenwirkungen führt, die Neratinib auch in den Studien zeigt. Wenn der selektive HER2-Hemmer ARRY380 eine ähnliche positive Wirkung hat, könnte er bei Brustkrebs deutliche Vorteile haben... ein sehr großer Markt. Nach den Twitter-Kommentaren sind die ASCO-Ergebnisse von Neratinib bei Gehirnmetastasen von Brustkrebs-Patienten eher schlecht... hier hat ARRY380 auch Vorteile. Da es bisher keine Alternativen gibt, wäre es der schnellste Weg zum Markt. Eine PII könnte reichen.
Selumetinib ist gegen KRAS-Lungenkrebs in PIII... die KRAS-Mutation ist bei Lungenkrebs ähnlich verbreitet wie EGFR, d.h. auch ein großer Markt. Ähnlich ist es mit MEK162 und NRAS-Melanoma... dies ist neben der BRAF-Mutation auch ein relevanter Anteil bei schwarzem Hautkrebs. Bisher gibt es nichts spezifisches gegen NRAS.
Gruß
ipollit
ARRY sehe ich eigentlich recht positiv. Schon seit einiger Zeit werden bei Biotechs eher die negativen Seiten gesucht. Dass NVS von GSK für viel Geld u.a. einen weiteren MEK-Hemmer kauft, wird direkt so gewertet, dass MEK162 dann schlechter sein muss. Wenn sich ein Datum auf clinialtrials negativ ändert, finden sich gleich Twitter-Kommentare mit Verweis auf GSK usw.
Wenn du dir die History zu der NRAS-Studie weiter ansiehst, so ist es nicht unwahrscheinlich, dass es sich bei Juli 2016 um einen simplen Schreibfehler handelt. Diese Seiten werden zwar von z.B. Patienten genutzt, sind aber sicherlich ohne Gewähr. Wer weiß, welche Personen da mal eben zwischen Tür und Angel Daten nachtragen. 07/2016 ist jetzt bei Studienende (das ist wohl das Datum, bis zu dem man an der Studie teilnehmen kann und die Patienten begleitet werden) und Studienauswertung eingetragen. Letzteres kann meiner Meinung nach viel früher erfolgen, wenn die Datenbasis ausreichend ist, weil z.B. für OS ein Teil der Patienten dann gestorben ist. Nach der Haupt-Auswertung läuft die Studie dann noch länger, um auch Ergebnisse nach vielen Jahren zu erhalten. Im Dezember wurde diese beiden Datumsangaben ebenfalls auf ein gleiches Datum in 2016 geändert. Ein paar Wochen später wurde die primäre Auswertung wieder auf Ende 2014 korrigiert. Ich gehe davon aus, dass nach wie vor die Daten nächstes Jahr vorliegen und die Zulassung dann im positiven Fall beantragt werden kann. Dies wurde auch schon mehrfach von NVS und ARRY gesagt.
Mein Eindruck von den NVS-Präsentationen ist der, dass MEK für sie eine große Rolle spielt. MEK ist ein zentrales Element in den Kombi-Studien. NRAS wäre nur die erste Zulassung als Mono-Therapie. Darüber hinaus gibt es aber zig weitere Studien.
Dass NVS für recht viel Geld den Onkologie-Bereich von GSK übernommen hat, muss nicht heißen, dass MEK162 keine Bedeutung mehr für NVS hat. BMS, AZ, Merck usw setzen im Onkologie-Bereich stark auf Ansätze des Immunsystems. NVS hat dagegen den Schwerpunkt der TKIs... d.h. sehr spezifisch auf irgendwelche Signalwege einzuwirken. Ich denke, dass NVS hier führend ist und mit der GSK-Übernahme diese Führung noch stärken wollte. Bei MEK hat man nun einen Konkurrenten weniger. Wenn MEK ein guter Ansatz ist, so bekommt NVS einen großen Teil vom Kuchen ab. Ein Vorteil von Mekinist ist wohl, dass es bereits zugelassen ist. Es ist viel schwieriger, zwei nicht zugelassene Mittel als Kombi von der FDA genehmigt zu bekommen, als ein zugelassenes und ein neues. Daher wurde auch erstmal Mekinist und und der BRAF-Hemmer Tafinlar separat zugelassen vor deren Kombination. MEK162 könnte nächstes Jahr auch die Mono-Zulassung erhalten. NVS BRAF-Hemmer LGX818 wird ja jetzt auch nicht infrage gestellt. Ich glaube nicht, dass NVS einfach MEK162 durch Mekinist in Kombi-Studien erstzen kann... sie müssten die PI und die Dosisfindung erst wiederholen. Jeder MEK ist anders... MEK162 wird momentan so auch in anderen PIII-Indikationen entwickelt als z.B. Selumetinib. Ich fände es völlig unlogisch, wenn NVS MEK162 nun durch die PIII bringt, eine riesige Datenbasis durch zig PI und PIIs geschaffen hat und es einfach ARRY zurückgibt, um mit Mekinist weiter zu machen. Mir ist nicht bekannt, dass Mekinist besser wäre... eher im Gegenteil. Sie kaufen für 14 Mrd USD u.a. Mekinist und schenken MEK162 später Array für umsonst, so dass danach jeder andere Pharma MEK162 einlizensieren und als Konkurrent gegen Mekinist auf den Markt positionieren kann. Mehr Sinn macht es, beide MEKs bri NVS in unterschiedlichen Indikationen zu entwickeln und dann einfach zu schauen.
In ARRYs Pipeline finde ich u.a. auch den HER2-Hemmer ARRY380 interessant. Konkurrent Neratinib von PBYI wirkt bei Brustkrebs anscheinend besser als Herceptin&Co. Allerdings ist Neratinib nicht so selektiv und hemmt auch EGFR, das bei Brustkrebs keine Relevanz hat aber zu erheblichen Nebenwirkungen führt, die Neratinib auch in den Studien zeigt. Wenn der selektive HER2-Hemmer ARRY380 eine ähnliche positive Wirkung hat, könnte er bei Brustkrebs deutliche Vorteile haben... ein sehr großer Markt. Nach den Twitter-Kommentaren sind die ASCO-Ergebnisse von Neratinib bei Gehirnmetastasen von Brustkrebs-Patienten eher schlecht... hier hat ARRY380 auch Vorteile. Da es bisher keine Alternativen gibt, wäre es der schnellste Weg zum Markt. Eine PII könnte reichen.
Selumetinib ist gegen KRAS-Lungenkrebs in PIII... die KRAS-Mutation ist bei Lungenkrebs ähnlich verbreitet wie EGFR, d.h. auch ein großer Markt. Ähnlich ist es mit MEK162 und NRAS-Melanoma... dies ist neben der BRAF-Mutation auch ein relevanter Anteil bei schwarzem Hautkrebs. Bisher gibt es nichts spezifisches gegen NRAS.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.038.996 von ipollit am 23.05.14 23:59:53Hallo ipollit,
grundsätzich bin auch ich bei ARRY weiterhin optimistisch. ARRY war jedoch mit ziemlichem Abstand meine größte Position (und ist es nun mit AMBI immmer noch).
Was genau das mit der Änderung der Studie auf sich hat, weiß ich nicht. Es wurden ja aber auch noch andere Dinge geändert. Ich werde mal die IR kontaktieren...
Deine Gedanken kann ich aber absolut nachvollziehen. Ich glaube kaum, dass NOV GSK wegen Mekinist übernommen hat. Die Diskussion, dass ARRY MEK-162 zurückbekommt, kann ich gar nicht nachvollziehen. NOV muss ja scheinbar eh für die Studien zahlen - warum dann also ein ggf. zugelassenes Medikament abgeben.
Gespannt bin ich auf die Ergebnisse zur Kombination mit LEE011 (ASCO). Zum einen weil es ein ex Astex Programm ist und vor allem auch, weil es in der Kombination bei NOV eine noch größere Rolle als MEK162 zu spielen scheint.
Der Start einer Studie von Mekinist und LEE011 würde mich von daher wirklich beunruhigen.
Als Twitter Nutzer wirst du ja schon mitbekommen haben, dass AZ eine PI mit Selumetinib und AZD9291 gestartet hat.
http://clinicaltrials.gov/ct2/show/NCT02143466
Wie ist deine Meinung zu AMBi? Ist ein Erfolg schon bei der Zwischenanalyse nicht durchaus möglich?
SG kmastra
grundsätzich bin auch ich bei ARRY weiterhin optimistisch. ARRY war jedoch mit ziemlichem Abstand meine größte Position (und ist es nun mit AMBI immmer noch).
Was genau das mit der Änderung der Studie auf sich hat, weiß ich nicht. Es wurden ja aber auch noch andere Dinge geändert. Ich werde mal die IR kontaktieren...
Deine Gedanken kann ich aber absolut nachvollziehen. Ich glaube kaum, dass NOV GSK wegen Mekinist übernommen hat. Die Diskussion, dass ARRY MEK-162 zurückbekommt, kann ich gar nicht nachvollziehen. NOV muss ja scheinbar eh für die Studien zahlen - warum dann also ein ggf. zugelassenes Medikament abgeben.
Gespannt bin ich auf die Ergebnisse zur Kombination mit LEE011 (ASCO). Zum einen weil es ein ex Astex Programm ist und vor allem auch, weil es in der Kombination bei NOV eine noch größere Rolle als MEK162 zu spielen scheint.
Der Start einer Studie von Mekinist und LEE011 würde mich von daher wirklich beunruhigen.
Als Twitter Nutzer wirst du ja schon mitbekommen haben, dass AZ eine PI mit Selumetinib und AZD9291 gestartet hat.
http://clinicaltrials.gov/ct2/show/NCT02143466
Wie ist deine Meinung zu AMBi? Ist ein Erfolg schon bei der Zwischenanalyse nicht durchaus möglich?
SG kmastra
es wird bei dem GSK-NVS deal auf die Kartellbehörden ankommen. Wenn die sagen, dass NVS nicht zwei MEK Inhibitoren (in Kombination mit BRAF Inh. auch noch für die dieselbe Indikation) haben darf, geht MEK162 zurück an Array. Nicht das schlechteste Szenario für Array.
A
A
Antwort auf Beitrag Nr.: 47.057.078 von Axel_Olsson am 27.05.14 21:36:23Also das die Kartellbehörde (welche?) das entscheidet wäre mir neu. Wie kommst du drauf?
Ohad Hammer gibt einen Ausblick auf die ASCO z.B. CLVS:
Next-gen EGFR inhibitors – Clovis vs. AstraZeneca
Investors are closely watching the face-off between AstraZeneca (AZN) and Clovis (CLVS), which will present data for their respective EGFR inhibitors. According to the abstracts, both agents have promising efficacy in NSCLC patients who failed approved EGFR inhibitors (Tarceva, Iressa) and harbor the T790M EGFR mutation. Both drugs recently received breakthrough designation from the FDA.
AstraZeneca is expected to report improved activity for AZD9291, with a response rate of 64% in 89 patients with T790M+ tumors according to the abstract. Durability seems strong as 97% of patients who had confirmed responses were still on treatment as of the cutoff date. Clovis’ abstract for CO-1686 does not provide new meaningful data and includes the previously presented response rate of 67% in just 9 patients. At the conference, investigators will have efficacy data for more patients (40+), which are expected to be positive based on the breakthrough designation CO-1686 received last week.
The two drugs appear comparable in term of efficacy (with the caveats of cross-trial comparison) but their safety profiles are differentiated. AZD9291 leads to more classic EGFR toxicities (rash, GI) and more importantly, 5 cases of interstitial lung disease-like symptoms were noted. For CO-1686, investors’ primary concern is QTc prolongation and whether it becomes clinically meaningful with prolonged treatment. Going forward and given the similar efficacy profile, a favorable safety profile may become an important advantage in this patient population, especially if the drugs reach first line EGFR+ NSCLC.
FGFR inhibitors – Clovis still in the lead
This year’s meeting will have several presentations of FGFR inhibitors. Despite strong scientific evidence for the implication of the FGF pathway in many tumor types, FGFR inhibitors have demonstrated limited activity as monotherapy. The only exception to date is Clovis’ lucitanib, a dual FGFR/VEGFR inhibitor that demonstrated the promising results in a small data set of breast cancer patients with “FGF-aberrant” tumors. Lucitanib’s efficacy is attributed to the parallel inhibition of the VEGF and FGF pathways.
At ASCO, Clovis will present updated results which may corroborate the initial efficacy signal in breast cancer and potentially other tumor types. The abstract discloses the previously reported 50% response rate in 12 heavily pre-treated breast cancer patients.
Other companies will have data for their selective FGFR programs. AstraZeneca will report data for AZD4547 in 2 trials (gastric cancer and solid tumors). The drug generated responses in 1/38 and 1/7 patients with FGF aberrations, respectively. Novartis (NVS) will report phase I data for BGJ398 in squamous NSCLC patients with FGFR1 amplification. The abstract reports encouraging preliminary signs of activity with 4 responses among 21 patients. J&J (JNJ) will present phase I data for JNJ-42756493, including a subset of FGF pathway aberrations. According to the abstract, of 8 biomarker positive patients, two urothelial cancer patients achieved a response.
Hutchison MediPharma will report data for its dual FGFR/VEGFR inhibitor, which should be viewed as a direct competitor to lucitanib. Of 17 patients who received an improved formulation of the drug, 4 achieved a response. It is not disclosed whether these patients had FGF aberrations so it is unclear whether their responses are mediated by FGFR inhibition.
http://www.orf-blog.com/drugs-to-watch-at-asco-2014/#more-64…
Vor diesem Hintergrund ist es spannend was gerade bei CLVS passiert. Der Wert wird ohne news und gegen den Trend seit 2 Tagen abverkauft. Nach dem WE wird man sehen...

Ohad Hammer gibt einen Ausblick auf die ASCO z.B. CLVS:
Next-gen EGFR inhibitors – Clovis vs. AstraZeneca
Investors are closely watching the face-off between AstraZeneca (AZN) and Clovis (CLVS), which will present data for their respective EGFR inhibitors. According to the abstracts, both agents have promising efficacy in NSCLC patients who failed approved EGFR inhibitors (Tarceva, Iressa) and harbor the T790M EGFR mutation. Both drugs recently received breakthrough designation from the FDA.
AstraZeneca is expected to report improved activity for AZD9291, with a response rate of 64% in 89 patients with T790M+ tumors according to the abstract. Durability seems strong as 97% of patients who had confirmed responses were still on treatment as of the cutoff date. Clovis’ abstract for CO-1686 does not provide new meaningful data and includes the previously presented response rate of 67% in just 9 patients. At the conference, investigators will have efficacy data for more patients (40+), which are expected to be positive based on the breakthrough designation CO-1686 received last week.
The two drugs appear comparable in term of efficacy (with the caveats of cross-trial comparison) but their safety profiles are differentiated. AZD9291 leads to more classic EGFR toxicities (rash, GI) and more importantly, 5 cases of interstitial lung disease-like symptoms were noted. For CO-1686, investors’ primary concern is QTc prolongation and whether it becomes clinically meaningful with prolonged treatment. Going forward and given the similar efficacy profile, a favorable safety profile may become an important advantage in this patient population, especially if the drugs reach first line EGFR+ NSCLC.
FGFR inhibitors – Clovis still in the lead
This year’s meeting will have several presentations of FGFR inhibitors. Despite strong scientific evidence for the implication of the FGF pathway in many tumor types, FGFR inhibitors have demonstrated limited activity as monotherapy. The only exception to date is Clovis’ lucitanib, a dual FGFR/VEGFR inhibitor that demonstrated the promising results in a small data set of breast cancer patients with “FGF-aberrant” tumors. Lucitanib’s efficacy is attributed to the parallel inhibition of the VEGF and FGF pathways.
At ASCO, Clovis will present updated results which may corroborate the initial efficacy signal in breast cancer and potentially other tumor types. The abstract discloses the previously reported 50% response rate in 12 heavily pre-treated breast cancer patients.
Other companies will have data for their selective FGFR programs. AstraZeneca will report data for AZD4547 in 2 trials (gastric cancer and solid tumors). The drug generated responses in 1/38 and 1/7 patients with FGF aberrations, respectively. Novartis (NVS) will report phase I data for BGJ398 in squamous NSCLC patients with FGFR1 amplification. The abstract reports encouraging preliminary signs of activity with 4 responses among 21 patients. J&J (JNJ) will present phase I data for JNJ-42756493, including a subset of FGF pathway aberrations. According to the abstract, of 8 biomarker positive patients, two urothelial cancer patients achieved a response.
Hutchison MediPharma will report data for its dual FGFR/VEGFR inhibitor, which should be viewed as a direct competitor to lucitanib. Of 17 patients who received an improved formulation of the drug, 4 achieved a response. It is not disclosed whether these patients had FGF aberrations so it is unclear whether their responses are mediated by FGFR inhibition.
http://www.orf-blog.com/drugs-to-watch-at-asco-2014/#more-64…
Vor diesem Hintergrund ist es spannend was gerade bei CLVS passiert. Der Wert wird ohne news und gegen den Trend seit 2 Tagen abverkauft. Nach dem WE wird man sehen...
bei solchen Deals wird immer geschaut. "antitrust approval => Kartellbehörde"
Zitat von der Nachricht des Deals:
"The deal is conditional on each of these transactions taking place or being waived and of course is subject to antitrust approvals in several jurisdictions. It is contemplated to complete in the first half of 2015."
A
Zitat von der Nachricht des Deals:
"The deal is conditional on each of these transactions taking place or being waived and of course is subject to antitrust approvals in several jurisdictions. It is contemplated to complete in the first half of 2015."
A
interessant auch in diesem Kontext:
Ron Squarer (CEO Array) bei der letzten UBS Konferenz:
"But in the event, that binimetinib is returned to Array which we think is a very exciting prospect, we, through our existing contract will receive on-going support from Novartis. Parts of the contract are redacted but there are certainly provisions in there for on-going support. And this is separate of course from any obligations that regulatory bodies like the FTC may have for Novartis in this if these were to occur."
FTC: Federal trade commission (Wettbewerbshüter in USA)
Array ist in einer komfortablen Position. Entweder NVS bringt MEK162 auf den Markt und die Einnahmen fließen oder NVS muss MEK162 zurückgeben und die Studien abschließen oder zumindest dafür abfinden. Beides ist gut für die Aktionäre.
A
Ron Squarer (CEO Array) bei der letzten UBS Konferenz:
"But in the event, that binimetinib is returned to Array which we think is a very exciting prospect, we, through our existing contract will receive on-going support from Novartis. Parts of the contract are redacted but there are certainly provisions in there for on-going support. And this is separate of course from any obligations that regulatory bodies like the FTC may have for Novartis in this if these were to occur."
FTC: Federal trade commission (Wettbewerbshüter in USA)
Array ist in einer komfortablen Position. Entweder NVS bringt MEK162 auf den Markt und die Einnahmen fließen oder NVS muss MEK162 zurückgeben und die Studien abschließen oder zumindest dafür abfinden. Beides ist gut für die Aktionäre.
A
die Leute von NVS haben den Fehler bemerkt:
http://clinicaltrials.gov/archive/NCT01763164/2014_05_23/cha…
"Primary completion date" bei der NRAS Melanoma Phase III von Mek162 ist jetzt wieder 12/14.
A
http://clinicaltrials.gov/archive/NCT01763164/2014_05_23/cha…
"Primary completion date" bei der NRAS Melanoma Phase III von Mek162 ist jetzt wieder 12/14.
A
ARRY...
wenn ich es richtig verstehe, ist das gerade auf der ASCO präsentiert Tafinlar + Mekinist PII Update nicht so toll ausgefallen. Könnte also genug Platz für MEK162 + LGX818 sein oder EXELs Cobi + Zelboraf:
"#CombiD primary endpt was PFS, was significant but median values 8.8 vs 9.3 months ie TWO WEEKS ????value of therapy #melanoma #ASCO14
#CombiD also PFS curves crossing. OS interim/premature. I worry about cost of combo drugs for (median) 2 wks #melanoma #ASCO14
#CombiD good news is that BRAFi/MEKi reduces complications except fevers, med OS > 2 yrs in first study #melanoma #ASCO14
The $GSK COMBId data are unimpressive. Leaves the field wide open for $RHHBY $EXEL coBRIM combo #ASCO14
Presenter is spinning hard to rationalize these clinically unimpressive $GSK data. #ASCO14"
https://twitter.com/Melanoma_doctor/with_replies
https://twitter.com/AlpineBV_Miller/with_replies
Bin auf die MEK162 + LEE011 NRAS-Daten gespannt...
Gruß
ipollit
wenn ich es richtig verstehe, ist das gerade auf der ASCO präsentiert Tafinlar + Mekinist PII Update nicht so toll ausgefallen. Könnte also genug Platz für MEK162 + LGX818 sein oder EXELs Cobi + Zelboraf:
"#CombiD primary endpt was PFS, was significant but median values 8.8 vs 9.3 months ie TWO WEEKS ????value of therapy #melanoma #ASCO14
#CombiD also PFS curves crossing. OS interim/premature. I worry about cost of combo drugs for (median) 2 wks #melanoma #ASCO14
#CombiD good news is that BRAFi/MEKi reduces complications except fevers, med OS > 2 yrs in first study #melanoma #ASCO14
The $GSK COMBId data are unimpressive. Leaves the field wide open for $RHHBY $EXEL coBRIM combo #ASCO14
Presenter is spinning hard to rationalize these clinically unimpressive $GSK data. #ASCO14"

https://twitter.com/Melanoma_doctor/with_replies
https://twitter.com/AlpineBV_Miller/with_replies
Bin auf die MEK162 + LEE011 NRAS-Daten gespannt...
Gruß
ipollit
CLVS... ASCO14
Die Daten sehen für mich ganz gut aus. Bisher gibt es keinen EGFR-Hemmer der bei Lungenkrebs mit einer EGFR T790M Mutation noch wirkt. CO-1686 scheint eine langanhaltenden Wirkung zu haben.
http://phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9M…
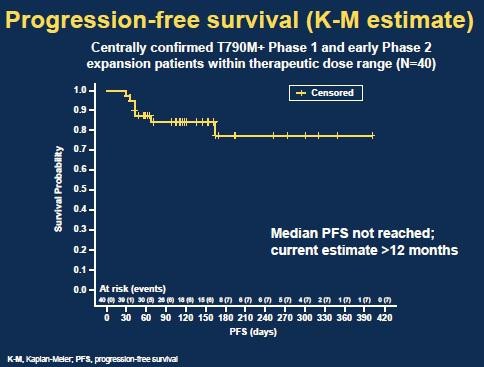
(als Dosis für die Zulassungsstudien wurden 625mg und 750mg gewählt)
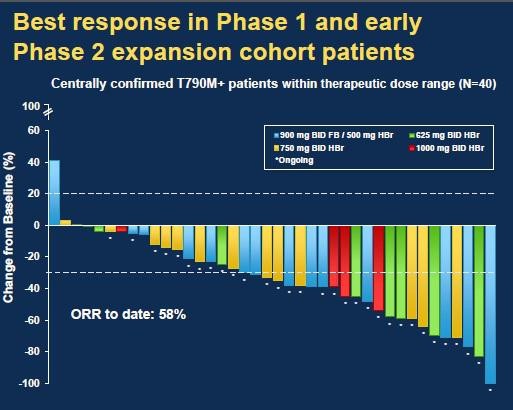
Von den Nebenwirkungen ist es positiv, dass entgegen allen anderen EGFR-Hemmern normales wild-type EGFR z.B. in der Haut nicht beeinträchtigt wird, so dass z.B. der Hautausschlag sehr gering ist (der z.B. typisch für Tarceva ist). Leider kommt es aber in einigen Fällen zu einer Herzrhythmus-Störung... das könnte ein Problem darstellen.
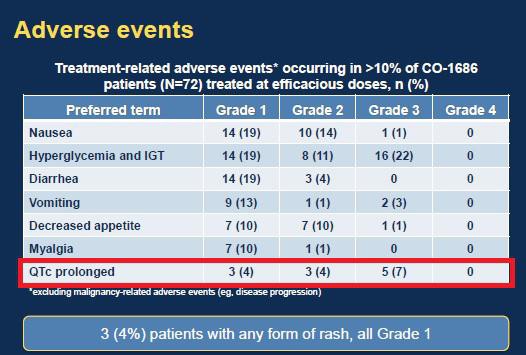
Konkurrent AZD 9291 ist auch nicht schlecht...
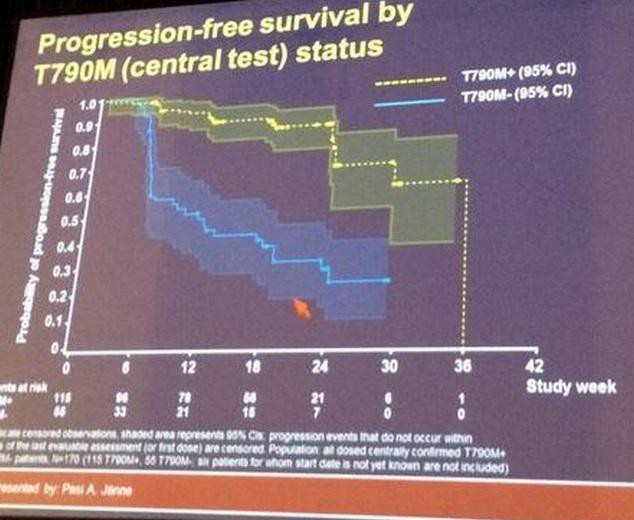
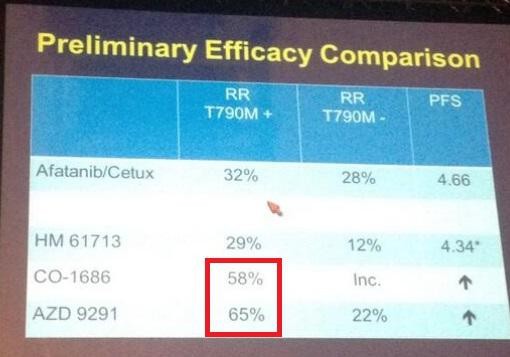
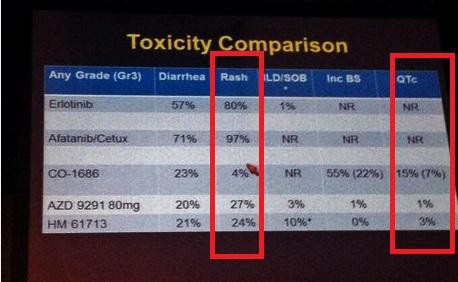
Ohad Hammers Kommentar: "So far not a lot of surprises. Have to admit I don’t have concrete insight on the CLVS vs. AZN debate. Both drugs are AMAZING (median PFS of >9-12 months) and will likely reach the market but the safety profiles are very different with each side claiming victory. Talking with people at CLVS’ analyst event got me even more confused with some claiming Astra are “hiding something” and CLVS talking about a new metabolite which inhibits IGF1R AS the cause for hyperglycemia. (portrayed that as a potential beneficial thing). Turns out that both companies are seeing ILD like symptoms but they look manageable and not problematic like what is observed with Tarceva."
Gruß
ipollit
Die Daten sehen für mich ganz gut aus. Bisher gibt es keinen EGFR-Hemmer der bei Lungenkrebs mit einer EGFR T790M Mutation noch wirkt. CO-1686 scheint eine langanhaltenden Wirkung zu haben.
http://phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9M…

(als Dosis für die Zulassungsstudien wurden 625mg und 750mg gewählt)

Von den Nebenwirkungen ist es positiv, dass entgegen allen anderen EGFR-Hemmern normales wild-type EGFR z.B. in der Haut nicht beeinträchtigt wird, so dass z.B. der Hautausschlag sehr gering ist (der z.B. typisch für Tarceva ist). Leider kommt es aber in einigen Fällen zu einer Herzrhythmus-Störung... das könnte ein Problem darstellen.

Konkurrent AZD 9291 ist auch nicht schlecht...



Ohad Hammers Kommentar: "So far not a lot of surprises. Have to admit I don’t have concrete insight on the CLVS vs. AZN debate. Both drugs are AMAZING (median PFS of >9-12 months) and will likely reach the market but the safety profiles are very different with each side claiming victory. Talking with people at CLVS’ analyst event got me even more confused with some claiming Astra are “hiding something” and CLVS talking about a new metabolite which inhibits IGF1R AS the cause for hyperglycemia. (portrayed that as a potential beneficial thing). Turns out that both companies are seeing ILD like symptoms but they look manageable and not problematic like what is observed with Tarceva."
Gruß
ipollit
PCYC - ASCO14
Ibrutinib PIII RESONATE Daten sehen meiner Meinung nach ganz gut aus... und das, obwohl ein größerer Teil im Arzerra-Arm nach festgestelltem Krankheitsfortschritt auf Ibrutinib gewechselt ist (Cross-Over), was den OS-Vorteil gegenüber Arzerra verringert
Ibrutinib ist deutlich besser als Arzerra in CLL:
https://twitter.com/AndyBiotech/status/472705529224396800
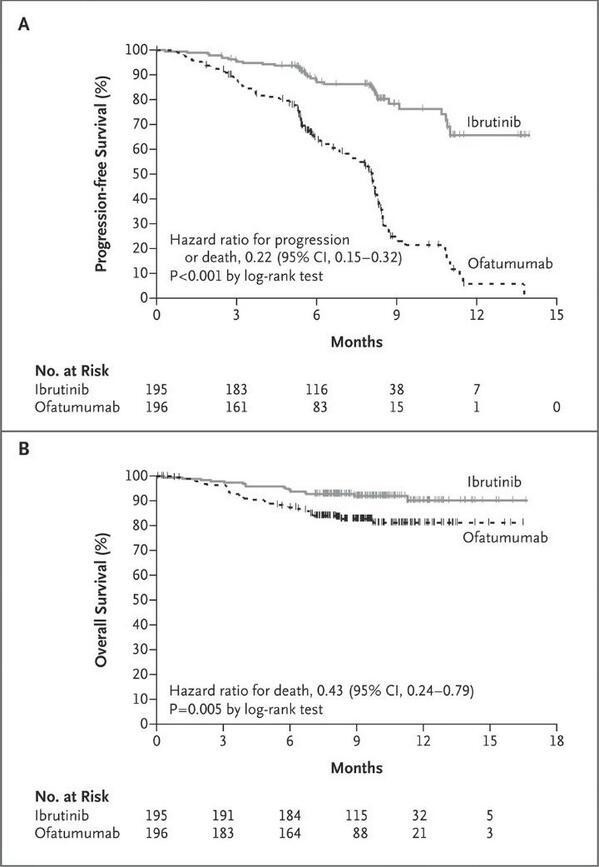
Gruß
ipollit
Ibrutinib PIII RESONATE Daten sehen meiner Meinung nach ganz gut aus... und das, obwohl ein größerer Teil im Arzerra-Arm nach festgestelltem Krankheitsfortschritt auf Ibrutinib gewechselt ist (Cross-Over), was den OS-Vorteil gegenüber Arzerra verringert
Ibrutinib ist deutlich besser als Arzerra in CLL:
https://twitter.com/AndyBiotech/status/472705529224396800

Gruß
ipollit
Antwort auf Beitrag Nr.: 47.082.528 von ipollit am 01.06.14 18:32:08Ofatuzumab ist nach dem Scheitern in der ORCHARRD-Studie kein guter Vergleichsmaßstab!
Ofatuzumab wirkt via CDC (complement-dependent cytotoxicity) und bei CLL findet man häufigt erniedrigte Komplement-Werte.
Ofatuzumab wirkt via CDC (complement-dependent cytotoxicity) und bei CLL findet man häufigt erniedrigte Komplement-Werte.
Antwort auf Beitrag Nr.: 47.082.490 von ipollit am 01.06.14 18:19:59CLVS... ASCO14
Feuerstein mit einem ganz Artikel:
http://www.thestreet.com/story/12728916/1/clovis-lung-cancer…
Feuerstein mit einem ganz Artikel:
http://www.thestreet.com/story/12728916/1/clovis-lung-cancer…
Antwort auf Beitrag Nr.: 47.082.780 von Joschka Schröder am 01.06.14 19:44:14ORCHARRD??? Da vergleichst du aber Äpfel mit Birnen!... das war eine PIII Arzerra vs Rituxan in DLBCL, nicht CLL! Rituxan und Arzerra sind als CD20-AKs der Standard. Arzerra dockt dabei ein wenig anders als Rituxan an CD20 an, weshalb es theoretisch auch wirkt, wenn weniger Krebszellen CD20 expressionieren. Soviel die Theorie... in der von dir erwähnten Studie konnte aber nicht belegt werden, dass Arzerra signifikant besser ist (schlechter ist es aber auch nicht!)
Arzerra wurde mit AA gegen rrCLL zugelassen aufgrund einer 42% RR in PII. Vor ein paar Wochen gabs zudem die Zulassung von Arzerra für 1st-line CLL... gehört damit bei CLL zum Standard.
CLL und DLBCL sind nicht dasselbe. So wirkt ein CD20-AK bei GBC-DLBCL ausgezeichnet, bei ABC-DLBCL aber nicht so gut. Erfreulicherweise ist es bei BTK-Hemmern andersherum... die wirken bei GBC-DLBCL nicht, beim ABC-Typ aber eigentlich ganz gut. Selbst innerhalb einer Indikation wir DLBCL gibt es große Unterschiede!
Aber wie gesagt ist Arzerra Standard bei CLL und damit ein guter Vergleich. Ibrutinib + Arzerra kommt bei rrCLL sogar in Studien auf 100% RR!
Der relevante Konkurrent von Ibrutinib ist ABT-199, der BCL2-Hemmer... der hat wohl höhere CR-Raten, aber auch teilweise problematische Nebenwirkungen wie TLS, was tödlich sein kann.
Gruß
ipollit
Arzerra wurde mit AA gegen rrCLL zugelassen aufgrund einer 42% RR in PII. Vor ein paar Wochen gabs zudem die Zulassung von Arzerra für 1st-line CLL... gehört damit bei CLL zum Standard.
CLL und DLBCL sind nicht dasselbe. So wirkt ein CD20-AK bei GBC-DLBCL ausgezeichnet, bei ABC-DLBCL aber nicht so gut. Erfreulicherweise ist es bei BTK-Hemmern andersherum... die wirken bei GBC-DLBCL nicht, beim ABC-Typ aber eigentlich ganz gut. Selbst innerhalb einer Indikation wir DLBCL gibt es große Unterschiede!
Aber wie gesagt ist Arzerra Standard bei CLL und damit ein guter Vergleich. Ibrutinib + Arzerra kommt bei rrCLL sogar in Studien auf 100% RR!
Der relevante Konkurrent von Ibrutinib ist ABT-199, der BCL2-Hemmer... der hat wohl höhere CR-Raten, aber auch teilweise problematische Nebenwirkungen wie TLS, was tödlich sein kann.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.082.800 von SLGramann am 01.06.14 19:51:19Feuerstein halte ich nicht für einen großen Experten... dem kommt es mehr auf Schlagzeilen an, die möglichst etwas negatives herauspicken. Das mit dem Insulin ist doch nichts neues... die Zahlen waren so in etwa vorher schon bekannt. Wenn die Gabe von Insulin das größte Problem ist, dann sieht es meiner Meinung nach sehr gut aus. Die Auswirkung aufs Herz ist da schon problematischer (auch bereits bekannt gewesen)!
Momentan kann man noch nicht sagen, wer besser ist. Jedenfalls ist es ein großer Fortschritt... EGFR ist nach KRAS die größte relevante Mutation bei NSCLC. 50% mutiert unter Behandlung mit einem EGFR-Hemmer der ersten Generation mit T790M. Dann hilft bisher nichts mehr.
Wie sieht Feuerstein denn die Wirkung/Nebenwirkung vom Standard Tarceva?
Gruß
ipollit
Momentan kann man noch nicht sagen, wer besser ist. Jedenfalls ist es ein großer Fortschritt... EGFR ist nach KRAS die größte relevante Mutation bei NSCLC. 50% mutiert unter Behandlung mit einem EGFR-Hemmer der ersten Generation mit T790M. Dann hilft bisher nichts mehr.
Wie sieht Feuerstein denn die Wirkung/Nebenwirkung vom Standard Tarceva?
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.083.016 von ipollit am 01.06.14 20:47:44Bzgl. ORRCHARD hast Du recht, sorry, der Datenfluss ist aktuell dermaßen hoch, dass sich leicht Fehler einschleichen. Indikation war in der Tat DLBCL.
Meine grundsätzlichen Vorbehalte gegenüber Ofatumumab bei CLL beruhen auf dem besonders ausgeprägten CDC-Wirkmechanismus, Details finden sich hier -> http://www.nature.com/leu/journal/vaop/ncurrent/full/leu2014…
Meine grundsätzlichen Vorbehalte gegenüber Ofatumumab bei CLL beruhen auf dem besonders ausgeprägten CDC-Wirkmechanismus, Details finden sich hier -> http://www.nature.com/leu/journal/vaop/ncurrent/full/leu2014…
Clovis wird heute abgestraft. Dabei fokussiert man sich m.E. doch sehr auf das Negative. Ist es nicht ein offenes Rennen bzw. werden nicht beide Medikamente ihren Anteil bekommen? Ein Grund dürfte auch sein, dass CLVS die Notwenigkeit einer Insulingabe bei einigen Patienten nicht während der Präsentation selber bekannt gab, sondern scheinbar erst auf Nachfrage danach.
Eine ganz gute Zusammenfassung:
http://www.epvantage.com/Universal/View.aspx?type=Story&id=5…
Jon Gardner @JonEPVantage 2 Std.
For the record on the $CLVS insulin reveal: No data in the CO-1686 #ASCO14 presentation, news came 40-some minutes into 1-hour analyst mtg.
https://twitter.com/JonEPVantage/status/473468575806914560
Zudem will AZ ja auch noch eine PIII starten (als Erstlinientherapie). Das kann CLVS so momentan nicht alleine wuppen. Von daher wäre eine Verpartnerung m.E. hilfreich.
http://clinicaltrials.gov/ct2/show/NCT02151981
Eine ganz gute Zusammenfassung:
http://www.epvantage.com/Universal/View.aspx?type=Story&id=5…
Jon Gardner @JonEPVantage 2 Std.
For the record on the $CLVS insulin reveal: No data in the CO-1686 #ASCO14 presentation, news came 40-some minutes into 1-hour analyst mtg.
https://twitter.com/JonEPVantage/status/473468575806914560
Zudem will AZ ja auch noch eine PIII starten (als Erstlinientherapie). Das kann CLVS so momentan nicht alleine wuppen. Von daher wäre eine Verpartnerung m.E. hilfreich.
http://clinicaltrials.gov/ct2/show/NCT02151981
Hat sich jemand von Euch die ASCO-Meetings der Großen wie Roche angesehen?
Wenn man alleine die Fortschritte auf dem Gebiet der Krebs-Immuntherapien betrachtet, insbesondere, welche Ansätze präklinisch nachrücken, kann einem ganz schwindelig werden. Rationales Investieren wird immer komplexer und aufwändiger. Im Grunde genommen läßt sich das nur noch in Teams, die sich ausschließlich auf Pharma-/Biotech fokussieren, bewältigen. Ich überlege, mich an der Börse völlig aus diesem Sektor zurückzuziehen.
Wenn man alleine die Fortschritte auf dem Gebiet der Krebs-Immuntherapien betrachtet, insbesondere, welche Ansätze präklinisch nachrücken, kann einem ganz schwindelig werden. Rationales Investieren wird immer komplexer und aufwändiger. Im Grunde genommen läßt sich das nur noch in Teams, die sich ausschließlich auf Pharma-/Biotech fokussieren, bewältigen. Ich überlege, mich an der Börse völlig aus diesem Sektor zurückzuziehen.
CLVS
"Ein Grund dürfte auch sein, dass CLVS die Notwenigkeit einer Insulingabe bei einigen Patienten nicht während der Präsentation selber bekannt gab, sondern scheinbar erst auf Nachfrage danach." ... das ist natürlich eine wichtige Info, die solche Wichtigtuer wie AF verbreiten. Meiner Meinung nach wird das völlig übertrieben, was im momentan noch deutlich angeschlagenen Markt auch prima funktioniert. AF hat auf seinem Artikel selber ganz unschuldig getwittert, dass er natürlich nicht der Meinung ist, dass nun AZD-9291 besser als CO-1686 wäre. Natürlich... sein Artikel liest sich nur komischerweise anders.
Sei es drum... ich kann nach wie vor nicht wirklich etwas schlechtes an CLVS finden, so dass ich zu diesen Kursen meine Position vergrößere. Die beiden einzigen relevanten Schwachstellen, die ich verstehe, sind zum einen das QT-Signal, was ein Problem sein könnte und zum anderen, dass für AZN offensichtlich 9291 zum wichtigsten Projekt in der Pipeline geworden ist. Nachdem sie das Pfizer-Übernahmeangebot ausgeschlagen haben, stehen sie unter Druck, eigene Erfolge vorzuweisen. AZN und CLVS planen nun nächstes Jahr die Zulassung zu beantragen.
Angeblich verweist CLVS bezüglich des Blutzucker-Problems auf ein Abbauprodukt von CO-1686, das an IGF-1R (insulin-like growth factor receptor) bindet. Sollte dies wirklich der Fall sein, so könnte es theoretisch auch positive Effekte haben, da die Aktivität von IGF-1R nach T790M eine weitere Mutation ist, die einen EGFR-T790M-Hemmer unwirksam machen kann. Zumindest gibt es zahlreiche Hinweise, dass EGFR- und IGF-1R-Hemmer synergetisch sind, obwohl IGF-1R-Hemmer bisher alle gefloppt sind... z.B. Genmab/Roche's R1507: http://www.medscape.com/viewarticle/759105_3 "Despite the interesting results in patient subsets defined by these molecular parameters, it appears that there are no plans for further development of R1507 in NSCLC."
http://www.ncbi.nlm.nih.gov/pubmed/23172312
"Resistance to irreversible EGF receptor tyrosine kinase inhibitors through a multistep mechanism involving the IGF1R pathway.
... The most common mechanism of drug resistance is the secondary EGFR T790M mutation. Strategies to overcome EGFR T790M-mediated drug resistance include the use of mutant selective EGFR inhibitors, including WZ4002, or the use of high concentrations of irreversible quinazoline EGFR inhibitors such as PF299804. In the current study, we develop drug-resistant versions of the EGFR-mutant PC9 cell line, which reproducibly develops EGFR T790M as a mechanism of drug resistance to gefitinib. Neither PF299804-resistant nor WZ4002-resistant clones of PC9 harbor EGFR T790M. Instead, they have shown activated insulin-like growth factor receptor (IGF1R) signaling as a result of loss of expression of IGFBP3 with the IGF1R inhibitor, BMS 536924, restoring EGFR inhibitor sensitivity. Intriguingly, prolonged exposure to either PF299804 or WZ4002 results in the emergence of a more drug-resistant subclone that exhibits ERK activation. A MEK inhibitor, CI-1040, partially restores sensitivity to the EGFR/IGF1R inhibitor combination. Moreover, an IGF1R or MEK inhibitor used in combination with either PF299804 or WZ4002 completely prevents the emergence of drug-resistant clones in this model system."
AZN testet 9291 u.a. auch mit ARRYs MEK Selumetinib.
Gruß
ipollit
"Ein Grund dürfte auch sein, dass CLVS die Notwenigkeit einer Insulingabe bei einigen Patienten nicht während der Präsentation selber bekannt gab, sondern scheinbar erst auf Nachfrage danach." ... das ist natürlich eine wichtige Info, die solche Wichtigtuer wie AF verbreiten. Meiner Meinung nach wird das völlig übertrieben, was im momentan noch deutlich angeschlagenen Markt auch prima funktioniert. AF hat auf seinem Artikel selber ganz unschuldig getwittert, dass er natürlich nicht der Meinung ist, dass nun AZD-9291 besser als CO-1686 wäre. Natürlich... sein Artikel liest sich nur komischerweise anders.
Sei es drum... ich kann nach wie vor nicht wirklich etwas schlechtes an CLVS finden, so dass ich zu diesen Kursen meine Position vergrößere. Die beiden einzigen relevanten Schwachstellen, die ich verstehe, sind zum einen das QT-Signal, was ein Problem sein könnte und zum anderen, dass für AZN offensichtlich 9291 zum wichtigsten Projekt in der Pipeline geworden ist. Nachdem sie das Pfizer-Übernahmeangebot ausgeschlagen haben, stehen sie unter Druck, eigene Erfolge vorzuweisen. AZN und CLVS planen nun nächstes Jahr die Zulassung zu beantragen.
Angeblich verweist CLVS bezüglich des Blutzucker-Problems auf ein Abbauprodukt von CO-1686, das an IGF-1R (insulin-like growth factor receptor) bindet. Sollte dies wirklich der Fall sein, so könnte es theoretisch auch positive Effekte haben, da die Aktivität von IGF-1R nach T790M eine weitere Mutation ist, die einen EGFR-T790M-Hemmer unwirksam machen kann. Zumindest gibt es zahlreiche Hinweise, dass EGFR- und IGF-1R-Hemmer synergetisch sind, obwohl IGF-1R-Hemmer bisher alle gefloppt sind... z.B. Genmab/Roche's R1507: http://www.medscape.com/viewarticle/759105_3 "Despite the interesting results in patient subsets defined by these molecular parameters, it appears that there are no plans for further development of R1507 in NSCLC."
http://www.ncbi.nlm.nih.gov/pubmed/23172312
"Resistance to irreversible EGF receptor tyrosine kinase inhibitors through a multistep mechanism involving the IGF1R pathway.
... The most common mechanism of drug resistance is the secondary EGFR T790M mutation. Strategies to overcome EGFR T790M-mediated drug resistance include the use of mutant selective EGFR inhibitors, including WZ4002, or the use of high concentrations of irreversible quinazoline EGFR inhibitors such as PF299804. In the current study, we develop drug-resistant versions of the EGFR-mutant PC9 cell line, which reproducibly develops EGFR T790M as a mechanism of drug resistance to gefitinib. Neither PF299804-resistant nor WZ4002-resistant clones of PC9 harbor EGFR T790M. Instead, they have shown activated insulin-like growth factor receptor (IGF1R) signaling as a result of loss of expression of IGFBP3 with the IGF1R inhibitor, BMS 536924, restoring EGFR inhibitor sensitivity. Intriguingly, prolonged exposure to either PF299804 or WZ4002 results in the emergence of a more drug-resistant subclone that exhibits ERK activation. A MEK inhibitor, CI-1040, partially restores sensitivity to the EGFR/IGF1R inhibitor combination. Moreover, an IGF1R or MEK inhibitor used in combination with either PF299804 or WZ4002 completely prevents the emergence of drug-resistant clones in this model system."
AZN testet 9291 u.a. auch mit ARRYs MEK Selumetinib.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.097.556 von ipollit am 04.06.14 00:23:45
AZN's AZD9291... keine IGFR-Hemmung, dafür mehr wildtype-EGFR-Hemmung
Ob es ein Plus ist, dass 2/3 der Studie in Asien läuft? Wenn ich an AVEO&Co denke, können die Ergebnisse der PIII in den USA dann doch wieder anders aussehen.
Gruß
ipollit

AZN's AZD9291... keine IGFR-Hemmung, dafür mehr wildtype-EGFR-Hemmung
Ob es ein Plus ist, dass 2/3 der Studie in Asien läuft? Wenn ich an AVEO&Co denke, können die Ergebnisse der PIII in den USA dann doch wieder anders aussehen.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.097.556 von ipollit am 04.06.14 00:23:45Hallo ipollit,
finde die Marktreaktion auch extrem. Dann kann der Markt auch konsequent sein und CO-1686 komplett auspreisen. Das ist irrational, was da läuft.
In dem tendenziösen Artikel von AF steht unter anderem ja aber auch:
"For AstraZeneca's '9291, 27% of patients reported rash and 3% of patients experienced "interstitial lung disease-like" events. The '9291 presentation also disclosed some "grade 5" adverse events at the lower dose, which means patients died. But it's unclear if these are deaths due to tumor progression or related to '9291 treatment."
Bei CLVS gibt es einige Patienten, die Insulin brauchen. Bei AZN gibt es einige "grade 5 adverse events".
Ah ja, über das eine flippt der Markt komplett negativ aus, über das andere redet kein Mensch. Ist auch ne besondere Art von ausgewogener Urteilsbildung...
Dein Hinweis auf die Asienlastigkeit der AZN-Trials finde ich interessant. Auch ich erinnere mich gut an ARQL.
Ich gehe weiterhin davon aus, dass CLVS übernommen werden wird und dass der Übernehmer ein sehr geiles Geschäft auf dem Rücken der CLVS-Aktionäre machen wird.
finde die Marktreaktion auch extrem. Dann kann der Markt auch konsequent sein und CO-1686 komplett auspreisen. Das ist irrational, was da läuft.
In dem tendenziösen Artikel von AF steht unter anderem ja aber auch:
"For AstraZeneca's '9291, 27% of patients reported rash and 3% of patients experienced "interstitial lung disease-like" events. The '9291 presentation also disclosed some "grade 5" adverse events at the lower dose, which means patients died. But it's unclear if these are deaths due to tumor progression or related to '9291 treatment."
Bei CLVS gibt es einige Patienten, die Insulin brauchen. Bei AZN gibt es einige "grade 5 adverse events".
Ah ja, über das eine flippt der Markt komplett negativ aus, über das andere redet kein Mensch. Ist auch ne besondere Art von ausgewogener Urteilsbildung...
Dein Hinweis auf die Asienlastigkeit der AZN-Trials finde ich interessant. Auch ich erinnere mich gut an ARQL.
Ich gehe weiterhin davon aus, dass CLVS übernommen werden wird und dass der Übernehmer ein sehr geiles Geschäft auf dem Rücken der CLVS-Aktionäre machen wird.
Hallo zusammen,
die Reaktion ist in der Tat irrational, aber das ist ja fast schon normal.
Der CEO von CLVS erweckt in einem Interview mit CNBC jetzt den Anschein, dass
metformin zur Behandlung grundsätzlich ausreicht und die Gabe von Insulin eher eine spontane, kurzzfristige Reaktion war.
"We have had about three patients who, when this first emerged we weren't sure exactly how to treat it, and they did go on insulin briefly, but no, we do not cause diabetes."
http://www.cnbc.com/id/101727499?__source=yahoo%257cfinance%…
Ein transparenter (vorbereiteter) Umgang mit der "Sache" wäre sicherlich besser gewesen. Aber hättehätte... So hat CLVS letztlich auch Vetrauen bei Analysten etc. eingebüßt. So etwas darf man immer nicht unterschätzen. Langfristig ist das aber Wurscht.
"EGFR activating mutations occur in approximately 10 to 15 percent of NSCLC cases in Caucasian patients and approximately 30 to 35 percent in East Asian patients."
Wahrscheinlich möchte AZ durch die Asien-lastigkeit die Studie beschleunigen...
SG kmastra
die Reaktion ist in der Tat irrational, aber das ist ja fast schon normal.
Der CEO von CLVS erweckt in einem Interview mit CNBC jetzt den Anschein, dass
metformin zur Behandlung grundsätzlich ausreicht und die Gabe von Insulin eher eine spontane, kurzzfristige Reaktion war.
"We have had about three patients who, when this first emerged we weren't sure exactly how to treat it, and they did go on insulin briefly, but no, we do not cause diabetes."
http://www.cnbc.com/id/101727499?__source=yahoo%257cfinance%…
Ein transparenter (vorbereiteter) Umgang mit der "Sache" wäre sicherlich besser gewesen. Aber hättehätte... So hat CLVS letztlich auch Vetrauen bei Analysten etc. eingebüßt. So etwas darf man immer nicht unterschätzen. Langfristig ist das aber Wurscht.
"EGFR activating mutations occur in approximately 10 to 15 percent of NSCLC cases in Caucasian patients and approximately 30 to 35 percent in East Asian patients."
Wahrscheinlich möchte AZ durch die Asien-lastigkeit die Studie beschleunigen...
SG kmastra
das sehe ich auch so. Höchstwahrscheinlich werden nicht dieselben Patienten mit beiden Medikamenten schwere Komplikationen haben. Daher wird die Zulassungsbehörde es gerne sehen, dass es dann eine wirksame Alternative gibt.
A
A
Bluebird mit sehr aufregenden Daten:
bluebird bio Reports Rapid Transfusion Independence in Beta-…
oder hier etwas epischer erklärt:
http://www.thestreet.com/story/12744079/1/blood-disorder-pat…
Natürlich muss man immer dazu sagen, dass das noch mehr als vorläufig ist, aber ich finde den gesamten Ansatz so smart, dass ich eine gewisse Begeisterung nicht verbergen will.
Endlich kommt bei diesem Gen-Gedöns mal war therapeutisches rum. Seit 20 Jahren war da nur heiße Luft.
bluebird bio Reports Rapid Transfusion Independence in Beta-…
oder hier etwas epischer erklärt:
http://www.thestreet.com/story/12744079/1/blood-disorder-pat…
Natürlich muss man immer dazu sagen, dass das noch mehr als vorläufig ist, aber ich finde den gesamten Ansatz so smart, dass ich eine gewisse Begeisterung nicht verbergen will.
Endlich kommt bei diesem Gen-Gedöns mal war therapeutisches rum. Seit 20 Jahren war da nur heiße Luft.
Antwort auf Beitrag Nr.: 47.155.772 von SLGramann am 15.06.14 17:59:57sorry, hab den ersten Link versaut:
http://investor.bluebirdbio.com/phoenix.zhtml?c=251820&p=iro…
http://investor.bluebirdbio.com/phoenix.zhtml?c=251820&p=iro…
ARRY:
Ich habe nun (endlich) auch eine Antwort von der IR bekommen:
1.Bezogen auf die Veränderung bei clinicaltrials.gov:
Novartis still expects to file in 2015. Clinicaltrials.gov states the
Estimated Primary Completion Date: December 2014 (Final data collection date for primary outcome measure)
-- Hier hatten ipollit und AxelOlsson ja schon für Auklärung gesorgt und es wurde ja auch schon wieder geändert.
2. Bezogen auf die Diskussion über die Rückgabe der MEK162 Rechte:
There is language in our agreement with Novartis that prevents them from holding two MEK inhibitors. Also, the FTC will likely make a determination whether there is overlap between Mekinist and Binimetinib.
Diese Aussage hingegen steht zumindest in Kontrast zu den von NOV selber veröffentlichten Plänen auf dem CC zur Übernahme. Das Wort language scheint mir aber auch einen gewissen Interpretationsspielraum anzudeuten...(?)
Ich habe nun (endlich) auch eine Antwort von der IR bekommen:
1.Bezogen auf die Veränderung bei clinicaltrials.gov:
Novartis still expects to file in 2015. Clinicaltrials.gov states the
Estimated Primary Completion Date: December 2014 (Final data collection date for primary outcome measure)
-- Hier hatten ipollit und AxelOlsson ja schon für Auklärung gesorgt und es wurde ja auch schon wieder geändert.
2. Bezogen auf die Diskussion über die Rückgabe der MEK162 Rechte:
There is language in our agreement with Novartis that prevents them from holding two MEK inhibitors. Also, the FTC will likely make a determination whether there is overlap between Mekinist and Binimetinib.
Diese Aussage hingegen steht zumindest in Kontrast zu den von NOV selber veröffentlichten Plänen auf dem CC zur Übernahme. Das Wort language scheint mir aber auch einen gewissen Interpretationsspielraum anzudeuten...(?)
Antwort auf Beitrag Nr.: 47.164.588 von kmastra am 17.06.14 16:33:36"There is language in our agreement with Novartis that prevents them from holding two MEK inhibitors. Also, the FTC will likely make a determination whether there is overlap between Mekinist and Binimetinib."
Es ist eben schade, dass hier jetzt so viel Unsicherheit drin ist.
ipollit hat dazu vor einer Weile geschrieben, dass Novartis das Krebswirkstoff-Geschäft von GSK sicher nicht übernimmt, um an Mekinist ranzukommen und dann MEK162 zu verschenken oder einzustampfen.
Ich sehe das eigentlich genauso. Am sinnvollsten ist es aus Sicht von Novartis, beide Wirkstoffe in den jeweils aktuellen Indikationen weiterzuentwickeln. Eventuelle Überschneidungen würde man sicher bereinigen - je nach Datenlage zu Gunsten des einen oder anderen Wirkstoffes.
Die große Frage ist aber, ob sie da in ihrer Entscheidung frei sind. Wir können nicht wissen, ob das für die FTC oder eventuell auch die europäische Kartellbehörde ein Thema ist und wenn ja, wie schwerwiegend das ist.
Aber kann man ganz ausschließen, dass Novartis aus kartellrechtlichen Gründen gezwungen wird, MEK162 zu opfern?
Das alles wird sich vielleicht erst 2015 entscheiden.
Falls Novartis auf MEK162 verzichten muss, wird man daran den Deal ganz sicher nicht scheitern lassen und MEK162 aufgeben.
Doch was dann? "Rückgabe" an Array? Doch wohl nicht für lau, nachdem man zig Millionen in das Projekt gesteckt hat? Weitergabe der Rechte an einen Big-Pharma-Konkurrenten?
Am Ende wäre auch das alles für Array wahrscheinlich eher neutral oder sogar von Vorteil. Eine "Rückgabe" - selbst unter Bedingungen für einen Wertausgleich - könnte Array sogar endlich ein überzeugendes eigenes Asset in die Hand geben. Das wäre vielleicht sogar der Durchbruch für Array.
Das schlechteste Szenario für Array, das mir einfällt, wäre, wenn Novartis MEK162 behalten darf, sich aber in Zukunft sehr stark auf Mekinist konzentriert und MEK162 nur mit halber Kraft "vor sich hin entwickelt". Da der Wirkstoff aber schon dieses und nächstes Jahr zulassungsrelevante Daten liefern wird, kann man da gar nicht sooo viel kaputt machen.
Alles in allem sehe ich Array weiter positiv und würde spätestens im Herbst die Position wieder aufstocken, wenn der Kurs immer noch bei 4,x ist.
Es ist eben schade, dass hier jetzt so viel Unsicherheit drin ist.
ipollit hat dazu vor einer Weile geschrieben, dass Novartis das Krebswirkstoff-Geschäft von GSK sicher nicht übernimmt, um an Mekinist ranzukommen und dann MEK162 zu verschenken oder einzustampfen.
Ich sehe das eigentlich genauso. Am sinnvollsten ist es aus Sicht von Novartis, beide Wirkstoffe in den jeweils aktuellen Indikationen weiterzuentwickeln. Eventuelle Überschneidungen würde man sicher bereinigen - je nach Datenlage zu Gunsten des einen oder anderen Wirkstoffes.
Die große Frage ist aber, ob sie da in ihrer Entscheidung frei sind. Wir können nicht wissen, ob das für die FTC oder eventuell auch die europäische Kartellbehörde ein Thema ist und wenn ja, wie schwerwiegend das ist.
Aber kann man ganz ausschließen, dass Novartis aus kartellrechtlichen Gründen gezwungen wird, MEK162 zu opfern?
Das alles wird sich vielleicht erst 2015 entscheiden.
Falls Novartis auf MEK162 verzichten muss, wird man daran den Deal ganz sicher nicht scheitern lassen und MEK162 aufgeben.
Doch was dann? "Rückgabe" an Array? Doch wohl nicht für lau, nachdem man zig Millionen in das Projekt gesteckt hat? Weitergabe der Rechte an einen Big-Pharma-Konkurrenten?
Am Ende wäre auch das alles für Array wahrscheinlich eher neutral oder sogar von Vorteil. Eine "Rückgabe" - selbst unter Bedingungen für einen Wertausgleich - könnte Array sogar endlich ein überzeugendes eigenes Asset in die Hand geben. Das wäre vielleicht sogar der Durchbruch für Array.
Das schlechteste Szenario für Array, das mir einfällt, wäre, wenn Novartis MEK162 behalten darf, sich aber in Zukunft sehr stark auf Mekinist konzentriert und MEK162 nur mit halber Kraft "vor sich hin entwickelt". Da der Wirkstoff aber schon dieses und nächstes Jahr zulassungsrelevante Daten liefern wird, kann man da gar nicht sooo viel kaputt machen.
Alles in allem sehe ich Array weiter positiv und würde spätestens im Herbst die Position wieder aufstocken, wenn der Kurs immer noch bei 4,x ist.
Morgen ist der IPO von Kite. Interessiert sich jemand dafür? Wenn ja, wo seht ihr den maximalen Preis, den ihr zahlen würdet?
Ich denke, dass sie gleich über 20 gehandelt werden. Ich erwäge aber auch dann, eine erste Position einzugehen.
Ich denke, dass sie gleich über 20 gehandelt werden. Ich erwäge aber auch dann, eine erste Position einzugehen.
Antwort auf Beitrag Nr.: 47.177.326 von SLGramann am 19.06.14 15:30:00Hallo SLGramann,
in der gestrigen Präsentation bei Wells Fargo zeigte sich Ron Squarrer m.E. sehr offensiv was die Zukunft von MEK162 betrifft. Grundtendenz seiner Aussagen war, dass es sehr wahrscheinlich ist, dass MEK162 zurück an ARRY geht.
"Contract has provisions that would prevent them from having a second MEK-Inhibitor." "Unlikely they will be allowed to retain both MEK-Inhibitors."
Er deutete auch an, dass NOV wohl auf Mekinist setzen würde, da es eben bereits zugelassen ist.
ARRY würde es dann in den USA und der EU wohl selbst vermarkten.
Insesamt eine recht lohnende Vernstaltung, besonders weil es in Interview-Form stattfand und keine PP-Präsentation war. Viele deiner Gedanken/Fragen wurden dort thematisiert.
http://investor.arraybiopharma.com/phoenix.zhtml?p=irol-even…
SG kmastra
in der gestrigen Präsentation bei Wells Fargo zeigte sich Ron Squarrer m.E. sehr offensiv was die Zukunft von MEK162 betrifft. Grundtendenz seiner Aussagen war, dass es sehr wahrscheinlich ist, dass MEK162 zurück an ARRY geht.
"Contract has provisions that would prevent them from having a second MEK-Inhibitor." "Unlikely they will be allowed to retain both MEK-Inhibitors."
Er deutete auch an, dass NOV wohl auf Mekinist setzen würde, da es eben bereits zugelassen ist.
ARRY würde es dann in den USA und der EU wohl selbst vermarkten.
Insesamt eine recht lohnende Vernstaltung, besonders weil es in Interview-Form stattfand und keine PP-Präsentation war. Viele deiner Gedanken/Fragen wurden dort thematisiert.
http://investor.arraybiopharma.com/phoenix.zhtml?p=irol-even…
SG kmastra
Antwort auf Beitrag Nr.: 47.178.042 von SLGramann am 19.06.14 16:45:20Kite sofort mit einer Milliarde bewertet. Hab ich geahnt/befürchtet. Habe trotzdem eine erste Position gekauft.
Antwort auf Beitrag Nr.: 47.185.286 von SLGramann am 20.06.14 17:17:34KITE:
Wenn man sinnvollerweise die Mehrzuteilungsoption reinrechnet, stehen jetzt 38,33 Mio. Aktien aus. Bei einem Kurs von 29 Dollar liegt die Marktkapitalisierung des Unternehmens nach dem ersten Handelstag bei 1,1 Milliarden Dollar.
Nicht schlecht für ein Unternehmen, das - um es polemisch zu sagen - noch nicht mal einen IND "offen" hat.
Der Hype wundert mich aber nicht. Ich bin ja selbst etwas angesteckt.
Wenn man sinnvollerweise die Mehrzuteilungsoption reinrechnet, stehen jetzt 38,33 Mio. Aktien aus. Bei einem Kurs von 29 Dollar liegt die Marktkapitalisierung des Unternehmens nach dem ersten Handelstag bei 1,1 Milliarden Dollar.
Nicht schlecht für ein Unternehmen, das - um es polemisch zu sagen - noch nicht mal einen IND "offen" hat.
Der Hype wundert mich aber nicht. Ich bin ja selbst etwas angesteckt.
Hallo SLGramann,
+70% am ersten Tag... hoffentlich endet das nicht wieder in einem wilden IPO-Hype. Wenn ich es richtig gelesen habe, dann waren es diese Woche schon wieder 8 Biotech-IPOs.
@KITE: Bisher bin ich nicht dabei. Ich finde es schwierig, für KITE&Co eine "faire" Bewertung zu finden. 1+ Mrd USD ist ja schon einiges. Bei KITE ist interessant, dass sie sowohl CAR- als auch TCR-Technologien für T-Zellen sowie etwas für DC-Zellen haben. Das klingt für mich ziemlich breit aufgestellt.
Schwierig wird es allerdings mit der Bewertung, weil mir nicht klar ist, worauf es letztlich bei CART&Co ankommt. Es gibt unterschiedlich konstruierte CARs... welcher Typ hat Vor- oder Nachteile? Neben großen Erfolgen kann es zu diesem frühen Zeitpunkt in der Entwicklung dieser Technologie auch zu erheblichen Problemen aufgrund von starken Nebenwirkungen kommen:
http://www.sugarconebiotech.com/?p=574 "...Yesterday we learned that the Memorial Sloan Kettering Cancer Center (MSKCC) and corporate partner Juno had stopped enrolling patients into 5 clinical trials of their chimeric antigen receptor (CAR) T cell therapies. Details are spare at this point, but unexpectedly, the cause of the clinical stop was severe cytokine release syndrome (CRS)... This is a critical issue in the CAR technology field, potentially holding back not just MSKCC/Juno but similar work from U Penn/Novartis and NCI and partners working with Kite Pharma. The syndrome characterized as CRS is a consequence of the massive immune response to the tumor, which is a designed consequence of the CAR technology. CAR-modified T cells are potent cytotoxic agents, and are designed to recruit unmodified T cells to the cause (the so-called bystander effect). This result is the triggering of the acute phase response, and then an outpouring of cytotoxic compounds, pro-inflammatory cytokines, and effector proteins. When allowed to proceed unchecked, the response begins to engulf normal cells and tissues, causing additional cell death, organ damage, and in the most severe cases, death... The reality is that clinical responses leading to CRS seem to have caught MSKCC/Juno flat footed in at least one clinical trial of Non-Hodgkin’s Lymphoma (NHL) – we note here that stopping 5 trials does not mean that CRS was seen in all 5, but they are related by clinical indication, so it is an obvious precautionary step to take. What will happen next we cannot know yet, as we have not yet heard the necessary detail. At the very least the MSKCC/Juno NHL programs are in for careful scrutiny..."
hier ein Blog-Eintrag zu Kite: http://www.sugarconebiotech.com/?p=552#more-552
"... Recently I came across Kite Pharma’s JPM update on their version of CAR therapy. Kite is financed by Pontifax Ltd."(dort arbeitet Ohad Hammer!)", Alta Partners, Commercial Street Capital, and individual investors, in partnership with the National Cancer Institute (NCI) Surgery Branch under a Cooperative Research and Development Agreement (CRADA). This reflects that the technology is coming out of NCI labs.
I was struck again by the duration and response rates reported and the indications they were pursuing. ... Kite calls its lead CAR construct a very straightforward name: anti-CD19 CAR. Like 19-28z CAR from Juno/MSKCC, this CAR is built with a anti-CD19 scFv, followed by CD28 and CD3 signaling components. Quite unlike the 19-28z effort however, the lead here is NHL indications..."
Wenn CARTs erfolgreich sind, könnte es auch zu rechtlichen Auseinandersetzungen zwischen NVS, Juno, Kite, Bluebird usw kommen, falls Patente nicht wasserdicht sind.
Welche Rolle spielt in diesem Zusammenhang eigentlich die französiche Cellectis ALCLS.PA http://www.cellectis.com/en? Vor ein paar Tagen gab es einen größeren Deal mit Pfizer: http://www.fiercebiotech.com/story/pfizer-buys-big-car-t-swe… "But Cellectis--and, apparently, Pfizer--believe the company's approach to CAR-T has broader potential than those of its rivals. Instead of harvesting each patient's T cells to craft a bespoke immunotherapy, Cellectis uses allogenic CAR-Ts to create what it calls an off-the-shelf solution, giving its treatments the potential to be more easily manufactured and standardized." Ein weiterer Partner ist Servier. Wenn die yahoo-Zahlen stimmen, müsste die aktuelle MK bei etwa über 300 Mio USD liegen.
Cellectis erzeugt CARTs nicht aus T-Zellen der Patienten, sondern aus T-Zellen anderer Personen, bei denen dann Merkmale entfernt werden, die Immunreaktion bei den Patienten gegen die T-Zellen selber führen könnte. Interessant finde ich auch das Abschalten von Rezeptoren bei den T-Zellen, über die Tumorzellen die T-Zellen deaktivieren können. Außerdem gibt es zur Sicherheit einen Schalter, mit dem diese T-Zellen bei Problemem abgetötet werden können.
http://www.cellectis.com/sites/default/files/140324_cls-corp…
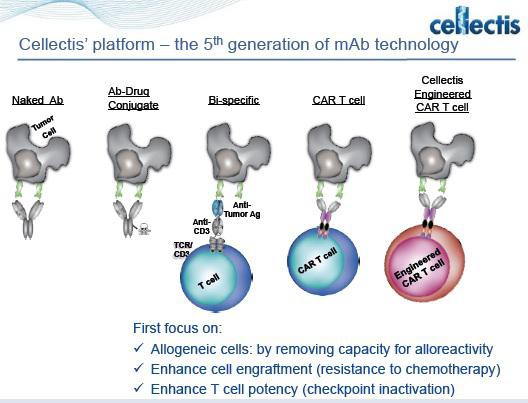

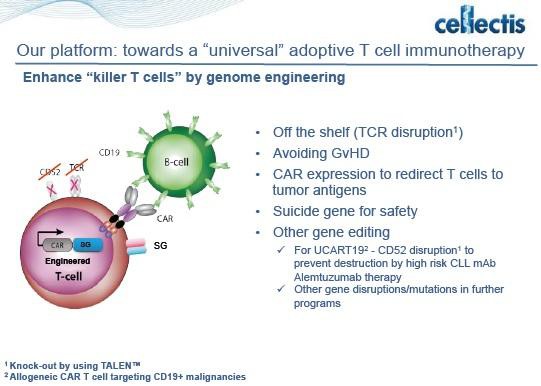

Cellectis hat allerdings nichts mit TCR wie Kite, soweit ich es sehe.
Gruß
ipollit
+70% am ersten Tag... hoffentlich endet das nicht wieder in einem wilden IPO-Hype. Wenn ich es richtig gelesen habe, dann waren es diese Woche schon wieder 8 Biotech-IPOs.
@KITE: Bisher bin ich nicht dabei. Ich finde es schwierig, für KITE&Co eine "faire" Bewertung zu finden. 1+ Mrd USD ist ja schon einiges. Bei KITE ist interessant, dass sie sowohl CAR- als auch TCR-Technologien für T-Zellen sowie etwas für DC-Zellen haben. Das klingt für mich ziemlich breit aufgestellt.
Schwierig wird es allerdings mit der Bewertung, weil mir nicht klar ist, worauf es letztlich bei CART&Co ankommt. Es gibt unterschiedlich konstruierte CARs... welcher Typ hat Vor- oder Nachteile? Neben großen Erfolgen kann es zu diesem frühen Zeitpunkt in der Entwicklung dieser Technologie auch zu erheblichen Problemen aufgrund von starken Nebenwirkungen kommen:
http://www.sugarconebiotech.com/?p=574 "...Yesterday we learned that the Memorial Sloan Kettering Cancer Center (MSKCC) and corporate partner Juno had stopped enrolling patients into 5 clinical trials of their chimeric antigen receptor (CAR) T cell therapies. Details are spare at this point, but unexpectedly, the cause of the clinical stop was severe cytokine release syndrome (CRS)... This is a critical issue in the CAR technology field, potentially holding back not just MSKCC/Juno but similar work from U Penn/Novartis and NCI and partners working with Kite Pharma. The syndrome characterized as CRS is a consequence of the massive immune response to the tumor, which is a designed consequence of the CAR technology. CAR-modified T cells are potent cytotoxic agents, and are designed to recruit unmodified T cells to the cause (the so-called bystander effect). This result is the triggering of the acute phase response, and then an outpouring of cytotoxic compounds, pro-inflammatory cytokines, and effector proteins. When allowed to proceed unchecked, the response begins to engulf normal cells and tissues, causing additional cell death, organ damage, and in the most severe cases, death... The reality is that clinical responses leading to CRS seem to have caught MSKCC/Juno flat footed in at least one clinical trial of Non-Hodgkin’s Lymphoma (NHL) – we note here that stopping 5 trials does not mean that CRS was seen in all 5, but they are related by clinical indication, so it is an obvious precautionary step to take. What will happen next we cannot know yet, as we have not yet heard the necessary detail. At the very least the MSKCC/Juno NHL programs are in for careful scrutiny..."
hier ein Blog-Eintrag zu Kite: http://www.sugarconebiotech.com/?p=552#more-552
"... Recently I came across Kite Pharma’s JPM update on their version of CAR therapy. Kite is financed by Pontifax Ltd."(dort arbeitet Ohad Hammer!)", Alta Partners, Commercial Street Capital, and individual investors, in partnership with the National Cancer Institute (NCI) Surgery Branch under a Cooperative Research and Development Agreement (CRADA). This reflects that the technology is coming out of NCI labs.
I was struck again by the duration and response rates reported and the indications they were pursuing. ... Kite calls its lead CAR construct a very straightforward name: anti-CD19 CAR. Like 19-28z CAR from Juno/MSKCC, this CAR is built with a anti-CD19 scFv, followed by CD28 and CD3 signaling components. Quite unlike the 19-28z effort however, the lead here is NHL indications..."
Wenn CARTs erfolgreich sind, könnte es auch zu rechtlichen Auseinandersetzungen zwischen NVS, Juno, Kite, Bluebird usw kommen, falls Patente nicht wasserdicht sind.
Welche Rolle spielt in diesem Zusammenhang eigentlich die französiche Cellectis ALCLS.PA http://www.cellectis.com/en? Vor ein paar Tagen gab es einen größeren Deal mit Pfizer: http://www.fiercebiotech.com/story/pfizer-buys-big-car-t-swe… "But Cellectis--and, apparently, Pfizer--believe the company's approach to CAR-T has broader potential than those of its rivals. Instead of harvesting each patient's T cells to craft a bespoke immunotherapy, Cellectis uses allogenic CAR-Ts to create what it calls an off-the-shelf solution, giving its treatments the potential to be more easily manufactured and standardized." Ein weiterer Partner ist Servier. Wenn die yahoo-Zahlen stimmen, müsste die aktuelle MK bei etwa über 300 Mio USD liegen.
Cellectis erzeugt CARTs nicht aus T-Zellen der Patienten, sondern aus T-Zellen anderer Personen, bei denen dann Merkmale entfernt werden, die Immunreaktion bei den Patienten gegen die T-Zellen selber führen könnte. Interessant finde ich auch das Abschalten von Rezeptoren bei den T-Zellen, über die Tumorzellen die T-Zellen deaktivieren können. Außerdem gibt es zur Sicherheit einen Schalter, mit dem diese T-Zellen bei Problemem abgetötet werden können.
http://www.cellectis.com/sites/default/files/140324_cls-corp…



Cellectis hat allerdings nichts mit TCR wie Kite, soweit ich es sehe.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.179.648 von kmastra am 19.06.14 20:27:09Array:
Hammer zu einigen Fragen/Bemerkungen zu Array:
Declan – I agree that if ARRY gets binimetinib back, it will have a positive effect in the long run given to thedrug’s development stage and expected p3 read outs (especially NRAS melanoma and ovarian cancer). Preliminary data from ASCO showed great potential for MEK inhibitors in BRAF+ colon cancer and other indications may be added to the list. 2 primary issues are: 1-need to raise cash to support the program 2- many of the combination studies are with NVS drugs so ARRY will have to find other drugs to combine binimetinib with (timeline implications)
Mcbio – it appears that in this case investors will appreciate that NVS is giving binimetinib back due to legal constraints and the availability of an approved direct competitor (mekinist).
JQ – from what I understand it is mostly based on anti-trust rules.
Hier im Thread hatte das glaube ich Axel_Olsson zuerst eingebracht, dass es aus kartellrechtlichen Gründen zu einer Abgabe von MEK162 kommen könnte.
Das ist natürlich deshalb interessant, weil Array so unter Umständen an ein Asset kommen könnte, obwohl es wirtschaftlich für Novartis eigentlich viel mehr Sinn machen würde, dieses Asset selbst zu behalten.
Auf der anderen Seite fordert das Kartellrecht natürlich auf keinen Fall, dass Array etwas zu bekommen hat, sondern höchstens, dass Novartis die Rechte aufgeben muss. Auch die Übertragung der MEK162-Rechte von Novartis auf einen anderen Pharma wäre insofern denkbar. Fraglich ist, ob das der Array-Novartis-Vertrag hergeben würde. Wahrscheinlich nicht.
Fraglich bleibt für mich auch, ob und in welcher Form ein Wertausgleich erfolgt, falls Novartis aus kartell- und vertragsrechtlichen Gründen gezwungen sein sollte, MEK162 an Array zurückzugeben. All die investierten Millionen können ja wohl kaum ohne Gegenleistung an Array abgetreten werden, oder?
Wie auch immer: Array ist in keiner so schlechten Position und möglicherweise sind sie sogar in einer ganz hervorragenden Position.
Vor einer KE wegen Rückgabe von MEK162 hätte ich keine Angst!
Hammer zu einigen Fragen/Bemerkungen zu Array:
Declan – I agree that if ARRY gets binimetinib back, it will have a positive effect in the long run given to thedrug’s development stage and expected p3 read outs (especially NRAS melanoma and ovarian cancer). Preliminary data from ASCO showed great potential for MEK inhibitors in BRAF+ colon cancer and other indications may be added to the list. 2 primary issues are: 1-need to raise cash to support the program 2- many of the combination studies are with NVS drugs so ARRY will have to find other drugs to combine binimetinib with (timeline implications)
Mcbio – it appears that in this case investors will appreciate that NVS is giving binimetinib back due to legal constraints and the availability of an approved direct competitor (mekinist).
JQ – from what I understand it is mostly based on anti-trust rules.
Hier im Thread hatte das glaube ich Axel_Olsson zuerst eingebracht, dass es aus kartellrechtlichen Gründen zu einer Abgabe von MEK162 kommen könnte.
Das ist natürlich deshalb interessant, weil Array so unter Umständen an ein Asset kommen könnte, obwohl es wirtschaftlich für Novartis eigentlich viel mehr Sinn machen würde, dieses Asset selbst zu behalten.
Auf der anderen Seite fordert das Kartellrecht natürlich auf keinen Fall, dass Array etwas zu bekommen hat, sondern höchstens, dass Novartis die Rechte aufgeben muss. Auch die Übertragung der MEK162-Rechte von Novartis auf einen anderen Pharma wäre insofern denkbar. Fraglich ist, ob das der Array-Novartis-Vertrag hergeben würde. Wahrscheinlich nicht.
Fraglich bleibt für mich auch, ob und in welcher Form ein Wertausgleich erfolgt, falls Novartis aus kartell- und vertragsrechtlichen Gründen gezwungen sein sollte, MEK162 an Array zurückzugeben. All die investierten Millionen können ja wohl kaum ohne Gegenleistung an Array abgetreten werden, oder?
Wie auch immer: Array ist in keiner so schlechten Position und möglicherweise sind sie sogar in einer ganz hervorragenden Position.
Vor einer KE wegen Rückgabe von MEK162 hätte ich keine Angst!
Antwort auf Beitrag Nr.: 47.193.890 von SLGramann am 23.06.14 13:48:07ARRY
so wie es sich anhört, scheint Novartis nicht das Recht zu haben, MEK162 an einen Dritten weiter zu geben:
http://seekingalpha.com/article/2228043-array-biopharma-arry…
"... Now, as I mentioned portions of our contract are redacted but I'll point out that there are provisions for that are in effect currently that are related to anti-competitive or exclusivity around MEK. There are also, as I mentioned, trailing obligation in the case that the product is returned and in this particular situation where Novartis is acquiring a series of assets. They do not have the right to assign binimetinib onwards to a third-party. This is in a situation where there has been a merger or Novartis has been acquired, so for those reasons we think that there may be a scenario in which binimetinib is returned to us within proximity of a first filing..."
Für mein Verständnis steigt mit einer Rückgabe Novartis aus dem Vertrag aus, so dass eher Array eine Entschädigung zusteht als Novartis.
Andererseits wird zurzeit die Zukunft von TKIs wie MEK162 eher in Kombinationen gesehen... ich denke, dass kein Partner dafür besser geeignet wäre als Novartis. Array selber wird keine vergleichbaren Studien durchführen können. Man erhält dann ein Mittel, dessen größtes Potential man nicht alleine erschließen kann.
Grüße
ipollit
so wie es sich anhört, scheint Novartis nicht das Recht zu haben, MEK162 an einen Dritten weiter zu geben:
http://seekingalpha.com/article/2228043-array-biopharma-arry…
"... Now, as I mentioned portions of our contract are redacted but I'll point out that there are provisions for that are in effect currently that are related to anti-competitive or exclusivity around MEK. There are also, as I mentioned, trailing obligation in the case that the product is returned and in this particular situation where Novartis is acquiring a series of assets. They do not have the right to assign binimetinib onwards to a third-party. This is in a situation where there has been a merger or Novartis has been acquired, so for those reasons we think that there may be a scenario in which binimetinib is returned to us within proximity of a first filing..."
Für mein Verständnis steigt mit einer Rückgabe Novartis aus dem Vertrag aus, so dass eher Array eine Entschädigung zusteht als Novartis.
Andererseits wird zurzeit die Zukunft von TKIs wie MEK162 eher in Kombinationen gesehen... ich denke, dass kein Partner dafür besser geeignet wäre als Novartis. Array selber wird keine vergleichbaren Studien durchführen können. Man erhält dann ein Mittel, dessen größtes Potential man nicht alleine erschließen kann.
Grüße
ipollit
Ich mache mir in letzter Zeit wieder mehr Gedanken um Exelixis.
Was glaubt ihr, wann die Top-Line-Daten aus dem COMET-1-Trial kommen werden? Exel hat da ja nur das Jahr 2014 vorgegeben. Ich gehe eigentlich davon aus, dass das nicht mehr so lange dauern kann. ???
Ich gehe davon aus, dass der Trial scheitern wird und ich hab das Gefühl, es wird daran liegen, dass sich die Vergleichsgruppe besser entwickelt hat, als historisch zu erwarten war.
Wenn der Trial scheitert und der Kurs dann noch mal deutlich runter geht, werde ich wahrscheinlich mit Blick auf Cometinib nachkaufen.
Aber nehmen wir mal an, das Unerwartete geschieht und COMET ist doch erfolgreich (10%-Chance dafür laut Hammer).
Natürlich wird die Aktie dann einen Riesensatz machen. Ich würde auf jeden Fall mit sofort 100% rechnen.
Bis zu welchem Kurs würdet ihr nach einer solchen Nachricht noch kaufen? Bis zu welchem Punkt springt ihr auf den fahrenden Zug?
Meiner Meinung nach wären +100% - also ein Kurs von 7 bis 8 Dollar - in diesem Szenario immer noch eindeutig ein Kaufkurs.
Ich denke, dass ich dann massiv kaufen würde.
Die Marktkap. läge dann bei ca. 1,5 Mrd. Allein in der Indikation CRPC könnte Cabo aber einen US-Umsatz von 500 Mio. bis zu über eine Mrd. einfahren (es gibt recht verschiedene Schätzungen).
Eine Marktkap. von 1,5 Mrd. erschiene dann wirklich nicht teuer.
Gut wäre es, wenn sich die Sache mit Cabo entscheidet (wie auch immer), bevor die Cobi-Daten kommen.
Was glaubt ihr, wann die Top-Line-Daten aus dem COMET-1-Trial kommen werden? Exel hat da ja nur das Jahr 2014 vorgegeben. Ich gehe eigentlich davon aus, dass das nicht mehr so lange dauern kann. ???
Ich gehe davon aus, dass der Trial scheitern wird und ich hab das Gefühl, es wird daran liegen, dass sich die Vergleichsgruppe besser entwickelt hat, als historisch zu erwarten war.
Wenn der Trial scheitert und der Kurs dann noch mal deutlich runter geht, werde ich wahrscheinlich mit Blick auf Cometinib nachkaufen.
Aber nehmen wir mal an, das Unerwartete geschieht und COMET ist doch erfolgreich (10%-Chance dafür laut Hammer).
Natürlich wird die Aktie dann einen Riesensatz machen. Ich würde auf jeden Fall mit sofort 100% rechnen.
Bis zu welchem Kurs würdet ihr nach einer solchen Nachricht noch kaufen? Bis zu welchem Punkt springt ihr auf den fahrenden Zug?
Meiner Meinung nach wären +100% - also ein Kurs von 7 bis 8 Dollar - in diesem Szenario immer noch eindeutig ein Kaufkurs.
Ich denke, dass ich dann massiv kaufen würde.
Die Marktkap. läge dann bei ca. 1,5 Mrd. Allein in der Indikation CRPC könnte Cabo aber einen US-Umsatz von 500 Mio. bis zu über eine Mrd. einfahren (es gibt recht verschiedene Schätzungen).
Eine Marktkap. von 1,5 Mrd. erschiene dann wirklich nicht teuer.
Gut wäre es, wenn sich die Sache mit Cabo entscheidet (wie auch immer), bevor die Cobi-Daten kommen.
Antwort auf Beitrag Nr.: 47.257.634 von SLGramann am 03.07.14 20:41:41Hallo SLGramann,
Ohad Hammer hatte mal "People expect final analysis in the Sep/Oct time frame" geschrieben.
Bzgl. ARRY hatte ich mal NOV einige Fragen geschickt.
Die hielten sich natürlich sehr bedeckt. Sie wollen nach der Transaktion zur Situation um MEK162 Stellung nehmen. Mit dieser rechnen sie März/April 2015.
SG kmastra
Ohad Hammer hatte mal "People expect final analysis in the Sep/Oct time frame" geschrieben.
Bzgl. ARRY hatte ich mal NOV einige Fragen geschickt.
Die hielten sich natürlich sehr bedeckt. Sie wollen nach der Transaktion zur Situation um MEK162 Stellung nehmen. Mit dieser rechnen sie März/April 2015.
SG kmastra
Dein Wunsch wird nicht erfüllt. Da bereits der Abverkauf von EXEL weitergeht, wird wohl wirklich ein Scheitern von CABO bzgl. OS erwartet / geleaked. Der heutige Abverkauf nach dem Eröffnungspeak ist aufgrund der hohen Short-Quote von ca. 20-25% bei EXEL aussergewöhnlich.
http://www.thestreet.com/story/12772351/1/roche-exelixis-ski…
Der verlinkte Artikel von Adam Feuerstein enthält zumindest Produktumsätze zum Durchrechnen des Exelixis-Anteils:
Aktuell Zelboraf:
ca. 50% von US 140 Mio USD = 70 Mio USD
ca. 10% von ExUS 400 Mio USD = 40 Mio USD
Das würde zusammen ca. 110 Mio USD als konservative Annahme für verbesserte Kombi mit Cobimetinib ergeben. Der Marktanteil sollte jedoch ausgeweitet werden können. Des weiteren gibt es noch weitere Kominationsstudien mit Cobimetinib.
Noch ein paar Infos:
Exelixis’ collaborator Genentech, a member of the Roche Group, informed the company that coBRIM met its primary endpoint, delivering a statistically significant increase in progression-free survival (PFS) for the combination of cobimetinib plus vemurafenib as compared to vemurafenib alone. Adverse events were consistent with those observed in a previous study of the combination.
Study Design:
coBRIM is an international, randomised, double-blind, placebo-controlled phase 3 study evaluating the safety and efficacy of cobimetinib in combination with vemurafenib, compared to vemurafenib alone, in 495 patients with BRAFV600 mutation-positive unresectable locally advanced or metastatic melanoma, previously untreated in the metastatic setting. The primary endpoint for coBRIM is progression-free survival. Secondary endpoints include overall survival, objective response rate, duration of response, and other safety, pharmacokinetic and quality of life measures.
Aussagen zu OS (Secondary Endpoint) fehlen. Hier darf es zumindest zu keiner Verschlechterung gekommen sein, wenn Genentech die Zulassung beantragen will.
http://www.thestreet.com/story/12772351/1/roche-exelixis-ski…
Der verlinkte Artikel von Adam Feuerstein enthält zumindest Produktumsätze zum Durchrechnen des Exelixis-Anteils:
Aktuell Zelboraf:
ca. 50% von US 140 Mio USD = 70 Mio USD
ca. 10% von ExUS 400 Mio USD = 40 Mio USD
Das würde zusammen ca. 110 Mio USD als konservative Annahme für verbesserte Kombi mit Cobimetinib ergeben. Der Marktanteil sollte jedoch ausgeweitet werden können. Des weiteren gibt es noch weitere Kominationsstudien mit Cobimetinib.
Noch ein paar Infos:
Exelixis’ collaborator Genentech, a member of the Roche Group, informed the company that coBRIM met its primary endpoint, delivering a statistically significant increase in progression-free survival (PFS) for the combination of cobimetinib plus vemurafenib as compared to vemurafenib alone. Adverse events were consistent with those observed in a previous study of the combination.
Study Design:
coBRIM is an international, randomised, double-blind, placebo-controlled phase 3 study evaluating the safety and efficacy of cobimetinib in combination with vemurafenib, compared to vemurafenib alone, in 495 patients with BRAFV600 mutation-positive unresectable locally advanced or metastatic melanoma, previously untreated in the metastatic setting. The primary endpoint for coBRIM is progression-free survival. Secondary endpoints include overall survival, objective response rate, duration of response, and other safety, pharmacokinetic and quality of life measures.
Aussagen zu OS (Secondary Endpoint) fehlen. Hier darf es zumindest zu keiner Verschlechterung gekommen sein, wenn Genentech die Zulassung beantragen will.
Antwort auf Beitrag Nr.: 47.257.634 von SLGramann am 03.07.14 20:41:41mein Beitrag bezog sich auf das Posting 780 von SLGramann:
"...Gut wäre es, wenn sich die Sache mit Cabo entscheidet (wie auch immer), bevor die Cobi-Daten kommen."
... dann hätte man einen ausgebombten Aktienkurs gehabt und Investitionen in EXEL wären evt. risikoärmer. Hingegen hat man jetzt bei einem weitern Rückgang die Sicherheit von Cabo.
"...Gut wäre es, wenn sich die Sache mit Cabo entscheidet (wie auch immer), bevor die Cobi-Daten kommen."
... dann hätte man einen ausgebombten Aktienkurs gehabt und Investitionen in EXEL wären evt. risikoärmer. Hingegen hat man jetzt bei einem weitern Rückgang die Sicherheit von Cabo.
Antwort auf Beitrag Nr.: 47.307.852 von Nase_weis_nix am 14.07.14 16:16:39"dann hätte man einen ausgebombten Aktienkurs gehabt und Investitionen in EXEL wären evt. risikoärmer."
Ja, das war der Gedanke - zumal ich von dem Erfolg der cobimetinib/vemurafenib-Kombi ziemlich überzeugt war. Als kmastra das mit Sept/Okt für die Cabo-CRPC-Daten geschrieben hat, hab ich den Gedanken an diesen "Zock" aber schon fast beerdigt.
Und tatsächlich war Cobimetinib jetzt schneller, obschon - was ich etwas unglücklich finde - ja noch keine konkreten Daten genannt worden sind.
Tja, was nun? Ich werde wohl einfach die Füße still halten, meine Position halten und lass sich das Ganze entwickeln.
Exelixis sind jetzt ziemlich gut nach unten abgesichert und sowohl bei Cabo wie auch bei Cobi könnten sich in nicht allzu ferner Zukunft noch beachtliche Potentiale zeigen.
Ja, das war der Gedanke - zumal ich von dem Erfolg der cobimetinib/vemurafenib-Kombi ziemlich überzeugt war. Als kmastra das mit Sept/Okt für die Cabo-CRPC-Daten geschrieben hat, hab ich den Gedanken an diesen "Zock" aber schon fast beerdigt.
Und tatsächlich war Cobimetinib jetzt schneller, obschon - was ich etwas unglücklich finde - ja noch keine konkreten Daten genannt worden sind.
Tja, was nun? Ich werde wohl einfach die Füße still halten, meine Position halten und lass sich das Ganze entwickeln.
Exelixis sind jetzt ziemlich gut nach unten abgesichert und sowohl bei Cabo wie auch bei Cobi könnten sich in nicht allzu ferner Zukunft noch beachtliche Potentiale zeigen.
Antwort auf Beitrag Nr.: 47.309.196 von SLGramann am 14.07.14 20:52:42Hallo Naseweißnix und SLGramann,
das war doch ein schöner Tag für EXEL, gestern. Neben den positiven Ergebnissen kamen gestern auch noch Übernahmegerüchte auf. Diese wurden insbesondere durch David Miller via Twitter transportiert und dann von AF aufgegriffen.
DM ist bezüglich EXEL und Cobi sehr optimistsich und sieht es als künftige Standardtrherapie bei BRAF-mutant melanoma tumors.
Das Timing bzgl. der readouts ist für den Kursverlauf sicherlich ein entscheidender Faktor. Bei EXEL ist die Shortquote ja ziemlich hoch. Einige werden da jetzt auf dem falschen Fuß erwischt worden sein und haben mit Cabo vor Cobi gerechnet bzw. Cobi gar nicht auf dem Schirm gehabt.
Es waren ja seeehr hohe Umsätze gestern. Wahrscheinlich haben Shorts sich eingedeckt und "größere Adressen" zudem eingekauft-eine explosive Mischung.
http://www.thestreet.com/story/12772905/1/investor-believes-…
Wie gut sind die Ergebnisse der Cobrim Studie im Detail?
Eine Zusammenfassung von DM vergleicht die Ergebnisse der PI:
http://ow.ly/i/6dXNx
Interesant wird m.E. vor allem das OS. Und ob die doch beachtliche Ansprechrate bestätigt wurde.
Wie geht es weiter?
-COBI im Detail, ggf. NDA
-COMET1 in wenigen Wochen
-COMET2 (noch dieses Jahr?)
-Ergebnisse in Nieren- und Leberkrebs in 2015/2016?
Die nächsten Wochen werden hier definitiv spannend...
SG kmastra
das war doch ein schöner Tag für EXEL, gestern. Neben den positiven Ergebnissen kamen gestern auch noch Übernahmegerüchte auf. Diese wurden insbesondere durch David Miller via Twitter transportiert und dann von AF aufgegriffen.
DM ist bezüglich EXEL und Cobi sehr optimistsich und sieht es als künftige Standardtrherapie bei BRAF-mutant melanoma tumors.
Das Timing bzgl. der readouts ist für den Kursverlauf sicherlich ein entscheidender Faktor. Bei EXEL ist die Shortquote ja ziemlich hoch. Einige werden da jetzt auf dem falschen Fuß erwischt worden sein und haben mit Cabo vor Cobi gerechnet bzw. Cobi gar nicht auf dem Schirm gehabt.
Es waren ja seeehr hohe Umsätze gestern. Wahrscheinlich haben Shorts sich eingedeckt und "größere Adressen" zudem eingekauft-eine explosive Mischung.
http://www.thestreet.com/story/12772905/1/investor-believes-…
Wie gut sind die Ergebnisse der Cobrim Studie im Detail?
Eine Zusammenfassung von DM vergleicht die Ergebnisse der PI:
http://ow.ly/i/6dXNx
Interesant wird m.E. vor allem das OS. Und ob die doch beachtliche Ansprechrate bestätigt wurde.
Wie geht es weiter?
-COBI im Detail, ggf. NDA
-COMET1 in wenigen Wochen
-COMET2 (noch dieses Jahr?)
-Ergebnisse in Nieren- und Leberkrebs in 2015/2016?
Die nächsten Wochen werden hier definitiv spannend...
SG kmastra
Ihr hatte, wenn ich mich recht erinnere, über die Zukunft von Array´s MEK162 spekuliert. In der heutigen Novartis-Präsentation wird die Zulassung des Präparats in mehreren Indikationen in Aussicht gestellt. 2015 soll die Zulassung in der Indikation "NRAS Mutant Melanoma" erfolgen. 2016 wird plangemäß die Zulassung in der Indikaktion "LGS Ovarian Cancer" angestrebt usw.
Antwort auf Beitrag Nr.: 47.326.080 von Joschka Schröder am 17.07.14 13:18:22EXEL, ARRY:
GSK heute mit PIII Ergebnissen, die Einfluss auf EXEL und ARRY haben dürften:
http://www.gsk.com/media/press-releases/2014/trametinib--mek…
Irgendwie ist das alles äußerst verworren. Roche sagt nur PFS signifikant - jetzt sagt GsK (NOV) OS signifikant bei Zwischenanlyse. Und was bedeutet das für ARRY?
GSK heute mit PIII Ergebnissen, die Einfluss auf EXEL und ARRY haben dürften:
http://www.gsk.com/media/press-releases/2014/trametinib--mek…
Irgendwie ist das alles äußerst verworren. Roche sagt nur PFS signifikant - jetzt sagt GsK (NOV) OS signifikant bei Zwischenanlyse. Und was bedeutet das für ARRY?

Nach einer längeren Pause, die ich dringend mal benötigt habe, habe ich diese Woche mehrere Smallcaps ins Depot geladen, die in den kommenden Monaten vor richtungsweisenden Ergebnissen/Entscheidungen stehen:
Arrowhead (ARWR): Daten einer Phase IIa Studie zu ARC-520 (Behandlung Hepatitis B)in Q3/2014
AEZS: PDUFA am 05.11.2014 zu Macrilen und eine gut gefüllte Pipeline
Alcobra (ADHD): Phase III - Ergebnisse zu MTX (Behandlung von ADHD) in Q3/2014
Ambit (AMBI): Laufende Phase III zu Quizartinib - Daten erst 2016, allerdings ist der Wert sehr niedrig bewertet.
Macrogenics (MGNX): Phase 2a - Daten zu Margetuximab (metastatic breast cancer) bis Ende 2014
Xencor (XNCR): Top-Pipeline mit Top-Partnern, u.a. Morphosys, Merck, Alexion, Boehringer-Ingelheim, Janssen,... Frühes Stadium, aber Potenzial ohne Ende.
Bleibt nur zu hoffen, dass die derzeitige Stimmung bald wieder dreht.
Arrowhead (ARWR): Daten einer Phase IIa Studie zu ARC-520 (Behandlung Hepatitis B)in Q3/2014
AEZS: PDUFA am 05.11.2014 zu Macrilen und eine gut gefüllte Pipeline
Alcobra (ADHD): Phase III - Ergebnisse zu MTX (Behandlung von ADHD) in Q3/2014
Ambit (AMBI): Laufende Phase III zu Quizartinib - Daten erst 2016, allerdings ist der Wert sehr niedrig bewertet.
Macrogenics (MGNX): Phase 2a - Daten zu Margetuximab (metastatic breast cancer) bis Ende 2014
Xencor (XNCR): Top-Pipeline mit Top-Partnern, u.a. Morphosys, Merck, Alexion, Boehringer-Ingelheim, Janssen,... Frühes Stadium, aber Potenzial ohne Ende.
Bleibt nur zu hoffen, dass die derzeitige Stimmung bald wieder dreht.
ARRY, EXEL:
http://www.epvantage.com/Universal/View.aspx?type=Story&id=5…
Ein Artikel der versucht etwas Licht ins Dunkel bei den MEKs zu bringen.
Mittlerweile kann man wohl ziemlich sicher sein, dass NOV MEK162 zurückgeben wird, weil Mekinist eben bereits zugelassen ist und auch die Ergebnisse offensichtlich so schlecht nicht sind.
Was das alles für Array heißt, wird man abwarten müssen.
Ich hätte gerne auf die Übernahme seitens NOV verzichten können. NOV ist ein guter Partner, die Konditionen waren ebenfalls gut.
Hat MEK162 als Singleagent überhaupt eine Chance? Dann könnte Array sozusagen ein größeres Stück von einem kleineren Kuchen anpeilen und selbst vermarkten.
Oder scheint nicht gerade die Kombination vielversprechend? Und wer wäre dann noch ein geeigneter Partner?
Bei EXEL wird man nun die genauen Ergebnisse sowohl von Roche als auch GSK abwarten müssen. Sicherlich hat es auch taktische Gründe, dass beide die genauen Ergebnisse so lange wie möglich zurück halten.
@Biotechhype:
Von der Werten bin ich nur bei AMBI im Bilde. Hier werden zur ASH im DEZ schon wichtige Daten erwartet. Ebenso soll es 2015 zur PIII eine Interimanalyse geben. Es besteht durchaus eine Chance, dass das schon vorher Schwung in den Wert bringt...
http://www.epvantage.com/Universal/View.aspx?type=Story&id=5…
Ein Artikel der versucht etwas Licht ins Dunkel bei den MEKs zu bringen.
Mittlerweile kann man wohl ziemlich sicher sein, dass NOV MEK162 zurückgeben wird, weil Mekinist eben bereits zugelassen ist und auch die Ergebnisse offensichtlich so schlecht nicht sind.
Was das alles für Array heißt, wird man abwarten müssen.
Ich hätte gerne auf die Übernahme seitens NOV verzichten können. NOV ist ein guter Partner, die Konditionen waren ebenfalls gut.
Hat MEK162 als Singleagent überhaupt eine Chance? Dann könnte Array sozusagen ein größeres Stück von einem kleineren Kuchen anpeilen und selbst vermarkten.
Oder scheint nicht gerade die Kombination vielversprechend? Und wer wäre dann noch ein geeigneter Partner?
Bei EXEL wird man nun die genauen Ergebnisse sowohl von Roche als auch GSK abwarten müssen. Sicherlich hat es auch taktische Gründe, dass beide die genauen Ergebnisse so lange wie möglich zurück halten.
@Biotechhype:
Von der Werten bin ich nur bei AMBI im Bilde. Hier werden zur ASH im DEZ schon wichtige Daten erwartet. Ebenso soll es 2015 zur PIII eine Interimanalyse geben. Es besteht durchaus eine Chance, dass das schon vorher Schwung in den Wert bringt...
Zitat von kmastra: Mittlerweile kann man wohl ziemlich sicher sein, dass NOV MEK162 zurückgeben wird, weil Mekinist eben bereits zugelassen ist und auch die Ergebnisse offensichtlich so schlecht nicht sind.
Wie läßt sich dies mit Novartis´Aussagen von letzter Woche in Einklang bringen, MEK162 solle im nächsten Jahr in der Indikation "NRAS Mutant Melanoma" und 2016 in der Indikaktion "LGS Ovarian Cancer" zugelassen werden?
Antwort auf Beitrag Nr.: 47.345.418 von Joschka Schröder am 21.07.14 15:34:35Hallo Joschka,
für eine Rückgabe von MEK162 gibt es sowohl kartellrechtliche als auch vertragsrechtliche Argumente(s. Diskussion eine Seite zuvor), die ein "sich entscheiden müssen" für NOV nahe legen.
NOV ist sicherlich in der komfortablen Situation, dass sie sich nicht jetzt sofort entscheiden müssen. (Übernahme von GSK wohl in Q2/15) Die laufenden Studien müssen sie laut ARRY eh zu Ende bezahlen und durchführen. Von daher gehe ich davon aus, dass sie sich öffentlich so spät wie möglich dazu äußern werden. Jetzt MEK162 offiziell zu verabschieden macht m.E. auch keinen Sinn - die Übernahme von GSK ist ja auch noch gar nicht durch und ARRY würde wohl seine Anwälte drauf ansetzen. Es stehen bis dahin ja auch schon die ersten PIII Ergebnisse von MEK162 an. Von daher verwundert mich die Kommunikation "alles bleibt wie geplant" nicht. Letztlich ist aber wohl bis 2015 eine gewisse Unsicherheit einfach da und Unsicherheit ist an der Börse ja bekanntlich so beliebt wie ein chinesicher Koch in Entenhausen. NOV selber hält sich verständlicherweise bedeckt. Ein Analyst hat ja im CC sogar direkt nachgefragt und ein "we can't comment on that" als Antwort bekommen. Von daher bleibt hier wirklich nur abwarten...
SG kmastra
für eine Rückgabe von MEK162 gibt es sowohl kartellrechtliche als auch vertragsrechtliche Argumente(s. Diskussion eine Seite zuvor), die ein "sich entscheiden müssen" für NOV nahe legen.
NOV ist sicherlich in der komfortablen Situation, dass sie sich nicht jetzt sofort entscheiden müssen. (Übernahme von GSK wohl in Q2/15) Die laufenden Studien müssen sie laut ARRY eh zu Ende bezahlen und durchführen. Von daher gehe ich davon aus, dass sie sich öffentlich so spät wie möglich dazu äußern werden. Jetzt MEK162 offiziell zu verabschieden macht m.E. auch keinen Sinn - die Übernahme von GSK ist ja auch noch gar nicht durch und ARRY würde wohl seine Anwälte drauf ansetzen. Es stehen bis dahin ja auch schon die ersten PIII Ergebnisse von MEK162 an. Von daher verwundert mich die Kommunikation "alles bleibt wie geplant" nicht. Letztlich ist aber wohl bis 2015 eine gewisse Unsicherheit einfach da und Unsicherheit ist an der Börse ja bekanntlich so beliebt wie ein chinesicher Koch in Entenhausen. NOV selber hält sich verständlicherweise bedeckt. Ein Analyst hat ja im CC sogar direkt nachgefragt und ein "we can't comment on that" als Antwort bekommen. Von daher bleibt hier wirklich nur abwarten...
SG kmastra
PBYI heute mit positiven Ergebnissen zu Neratinib - und AH einem Kursplus von über 200%!?
https://finance.yahoo.com/news/puma-biotechnology-announces-…
Mal sehen, ob das morgen ein Licht auf ARRY wirft, die ja ARRY380 haben.
http://www.arraybiopharma.com/product-pipeline/other-compoun…
Ohad Hammer (vor längerer Zeit) dazu: http://www.orf-blog.com/biotech-portfolio-update-array-morph…
Wenn sich das so hält hätte Puma eine MK von über 5 Milliarden $
https://finance.yahoo.com/news/puma-biotechnology-announces-…
Mal sehen, ob das morgen ein Licht auf ARRY wirft, die ja ARRY380 haben.
http://www.arraybiopharma.com/product-pipeline/other-compoun…
Ohad Hammer (vor längerer Zeit) dazu: http://www.orf-blog.com/biotech-portfolio-update-array-morph…
Wenn sich das so hält hätte Puma eine MK von über 5 Milliarden $
Antwort auf Beitrag Nr.: 47.354.906 von kmastra am 22.07.14 23:01:51ARRY
Der Kurs von ARRY profitiert heute ein wenig von den positiven PIII-Ergebnissen von PBYIs Neratinib in HER2 Brustkrebs. PBYI verdreifacht seinen Wert auf fast 7 Mrd USD. Neratinib scheint eine gute Ergänzung zum Multi-Blockbuster Herceptin zu sein. Anders als Herceptin ist Neratinib kein AK sondern eine Tablette, deren Wirkstoff HER2 hemmt.



Ein Wirksamer oraler HER2-Hemmer scheint demnach Potential zu besitzen. Interessant ist, dass Neratinib neben HER2 auch EGFR hemmt. EGFR hat aber eigentlich in Brustkrebs keine Relevanz, es sollte keine zusätzliche Wirkung neben HER2 besitzen. Dagegen führt die EGFR-Hemmung aber zu deutlichen Nebenwirkungen wie z.B. schwerem Durchfall oder Hautausschlag, da u.a. die Darmschleimhaut und Hautzellen angegriffen werden.
http://www.fiercebiotech.com/story/puma-shares-triple-positi…
"The pan-ErbB TKI has had tox problems in the clinic. Most notably patients have suffered from diarrhea, which has been so severe in some cases it's limited the doses used in trials. For very sick cancer patients, though, the FDA has often accepted some harsh effects on quality of life in exchange for a shot at better survival rates. Cowen's Eric Schmidt also notes that the side effect can be better controlled with the right medications.
"Tolerability has been neratinib's short suit, and the company has guided investors to expect a high rate (~30%) of grade 3 diarrhea as imodium prophylaxis was not employed in this study," Schmidt noted today. "Consultants note that the new paradigm of high dose imodium prophylaxis has been successful, and we expect it to reduce grade 3 diarrhea rates to 5-10% in the real world setting. In our view, such rates are acceptable in light of neratinib's compelling efficacy."
Dabei muss man auch sehen, dass der größte HER2-Markt bei noch nicht so kranken Patienten ist, wo Nebenwirkungen dann noch eine größere Rolle spielen werden.
Bisher brachten HER2+EGFR-Hemmer keinen Überlebensvorteil. Theoretisch besser als Neratinib könnte in Zukunft ARRYs/ONTYs ARRY-380 sein, da die Hemmung auf HER2 beschränkt bleibt. Dies ist, meine ich, das erste Mittel dieser Art. Im Idealfall erzielt es eine gleich hohe Wirkung bei deutlich geringeren Nebenwirkungen. Vielleicht lässt sich die Wirkung dann durch eine höhere Dosierung noch verbessern.
ARRY-380 liegt in der Entwicklung noch deutlich zurück. Allerdings gibt es einen Weg einer möglichen Zulassung nach erfolgreicher PII (fast track), da es nach den bisherigen Ergebnissen auch gegen Gehirn-Metastasen wirkt, die manchmal bei Brustkrebs entstehen können. Bisher gibt es dafür nichts, weder Hercetin&Co, noch Neratinib sind dann wirksam.
Meiner Meinung nach ist ARRY-380 ein weiteres Eisen im Feuer neben den MEKs Binimetinib und Selumetinib.
Grüße
ipollit
Der Kurs von ARRY profitiert heute ein wenig von den positiven PIII-Ergebnissen von PBYIs Neratinib in HER2 Brustkrebs. PBYI verdreifacht seinen Wert auf fast 7 Mrd USD. Neratinib scheint eine gute Ergänzung zum Multi-Blockbuster Herceptin zu sein. Anders als Herceptin ist Neratinib kein AK sondern eine Tablette, deren Wirkstoff HER2 hemmt.
Ein Wirksamer oraler HER2-Hemmer scheint demnach Potential zu besitzen. Interessant ist, dass Neratinib neben HER2 auch EGFR hemmt. EGFR hat aber eigentlich in Brustkrebs keine Relevanz, es sollte keine zusätzliche Wirkung neben HER2 besitzen. Dagegen führt die EGFR-Hemmung aber zu deutlichen Nebenwirkungen wie z.B. schwerem Durchfall oder Hautausschlag, da u.a. die Darmschleimhaut und Hautzellen angegriffen werden.
http://www.fiercebiotech.com/story/puma-shares-triple-positi…
"The pan-ErbB TKI has had tox problems in the clinic. Most notably patients have suffered from diarrhea, which has been so severe in some cases it's limited the doses used in trials. For very sick cancer patients, though, the FDA has often accepted some harsh effects on quality of life in exchange for a shot at better survival rates. Cowen's Eric Schmidt also notes that the side effect can be better controlled with the right medications.
"Tolerability has been neratinib's short suit, and the company has guided investors to expect a high rate (~30%) of grade 3 diarrhea as imodium prophylaxis was not employed in this study," Schmidt noted today. "Consultants note that the new paradigm of high dose imodium prophylaxis has been successful, and we expect it to reduce grade 3 diarrhea rates to 5-10% in the real world setting. In our view, such rates are acceptable in light of neratinib's compelling efficacy."
Dabei muss man auch sehen, dass der größte HER2-Markt bei noch nicht so kranken Patienten ist, wo Nebenwirkungen dann noch eine größere Rolle spielen werden.
Bisher brachten HER2+EGFR-Hemmer keinen Überlebensvorteil. Theoretisch besser als Neratinib könnte in Zukunft ARRYs/ONTYs ARRY-380 sein, da die Hemmung auf HER2 beschränkt bleibt. Dies ist, meine ich, das erste Mittel dieser Art. Im Idealfall erzielt es eine gleich hohe Wirkung bei deutlich geringeren Nebenwirkungen. Vielleicht lässt sich die Wirkung dann durch eine höhere Dosierung noch verbessern.
ARRY-380 liegt in der Entwicklung noch deutlich zurück. Allerdings gibt es einen Weg einer möglichen Zulassung nach erfolgreicher PII (fast track), da es nach den bisherigen Ergebnissen auch gegen Gehirn-Metastasen wirkt, die manchmal bei Brustkrebs entstehen können. Bisher gibt es dafür nichts, weder Hercetin&Co, noch Neratinib sind dann wirksam.
Meiner Meinung nach ist ARRY-380 ein weiteres Eisen im Feuer neben den MEKs Binimetinib und Selumetinib.
Grüße
ipollit
Die therapeutische Wirkung von ARRY-380 hält sich bislang noch im Rahmen -> http://meetinglibrary.asco.org/content/60567-100
Den Hauptumsatz werden Kadcyla und Perjeta machen. Bleibt abzuwarten, ob in besonderen Fällen ggf. noch zusätzlich ein oraler Wirkstoff wie ARRY-380 verabreicht werden kann.
Den Hauptumsatz werden Kadcyla und Perjeta machen. Bleibt abzuwarten, ob in besonderen Fällen ggf. noch zusätzlich ein oraler Wirkstoff wie ARRY-380 verabreicht werden kann.
Antwort auf Beitrag Nr.: 47.312.898 von kmastra am 15.07.14 15:06:42EXEL
"Interesant wird m.E. vor allem das OS. Und ob die doch beachtliche Ansprechrate bestätigt wurde.
Wie geht es weiter?
-COBI im Detail, ggf. NDA
-COMET1 in wenigen Wochen
-COMET2 (noch dieses Jahr?)
-Ergebnisse in Nieren- und Leberkrebs in 2015/2016?"
Ich hätte gedacht, dass die COMET1/2 Ergebnisse nicht mehr solange dauern... vielleicht in den nächsten 1-3 Monaten. Es ist meines Wissens nach auch nicht klar, in welcher Reihenfolge die Ergebnisse kommen, ob zuerst COMET1 (OS) oder zuerst COMET2 (Schmerz)?
Nächstes Jahr sollen zudem die Nierenkrebs PIII-Daten kommen. Die Wahrscheinlichkeit von positiven Ergebnisse soll hierbei höher als bei Prostatakrebs sein, da die Wirksamkeit von VEGF-Hemmern durch z.B. Avastin oder Sutent bereits belegt ist. Cabozantinib stößt auf Interesse... z.B. http://kidneycancerchronicles.com/some-background-on-cometri…
http://blog.dana-farber.org/insight/2014/01/new-strategies-i…
"Abnormally activated MET is an escape route kidney tumors use to resist the angiogenesis inhibitors pazopanib and sunitinib. Choueiri and colleagues led a clinical trial using cabozantinib, a drug that simultaneously blocks both MET and VEGF – a protein involved in angiogenesis. When cabozantinib was given to patients whose kidney cancers had progressed despite several rounds of treatment, “we found significant activity and a response rate of up to 30 percent in a small trial,” Choueiri says. This led to an international large phase 3 trial that Choueiri is leading."
Die METEOR-Studie konnte auch schneller Patienten aufnehmen als geplant, so dass die bisherige Erfahrung wohl gut war als auch Bedarf besteht.
Es könnte neben Prostatakrebs die zweite Blockbuster-Indikation sein.
Grüße
ipollit
"Interesant wird m.E. vor allem das OS. Und ob die doch beachtliche Ansprechrate bestätigt wurde.
Wie geht es weiter?
-COBI im Detail, ggf. NDA
-COMET1 in wenigen Wochen
-COMET2 (noch dieses Jahr?)
-Ergebnisse in Nieren- und Leberkrebs in 2015/2016?"
Ich hätte gedacht, dass die COMET1/2 Ergebnisse nicht mehr solange dauern... vielleicht in den nächsten 1-3 Monaten. Es ist meines Wissens nach auch nicht klar, in welcher Reihenfolge die Ergebnisse kommen, ob zuerst COMET1 (OS) oder zuerst COMET2 (Schmerz)?
Nächstes Jahr sollen zudem die Nierenkrebs PIII-Daten kommen. Die Wahrscheinlichkeit von positiven Ergebnisse soll hierbei höher als bei Prostatakrebs sein, da die Wirksamkeit von VEGF-Hemmern durch z.B. Avastin oder Sutent bereits belegt ist. Cabozantinib stößt auf Interesse... z.B. http://kidneycancerchronicles.com/some-background-on-cometri…
http://blog.dana-farber.org/insight/2014/01/new-strategies-i…
"Abnormally activated MET is an escape route kidney tumors use to resist the angiogenesis inhibitors pazopanib and sunitinib. Choueiri and colleagues led a clinical trial using cabozantinib, a drug that simultaneously blocks both MET and VEGF – a protein involved in angiogenesis. When cabozantinib was given to patients whose kidney cancers had progressed despite several rounds of treatment, “we found significant activity and a response rate of up to 30 percent in a small trial,” Choueiri says. This led to an international large phase 3 trial that Choueiri is leading."
Die METEOR-Studie konnte auch schneller Patienten aufnehmen als geplant, so dass die bisherige Erfahrung wohl gut war als auch Bedarf besteht.
Es könnte neben Prostatakrebs die zweite Blockbuster-Indikation sein.
Grüße
ipollit
Antwort auf Beitrag Nr.: 47.361.248 von Joschka Schröder am 23.07.14 21:59:03"Die therapeutische Wirkung von ARRY-380 hält sich bislang noch im Rahmen"... Es ist ja auch nur eine PI mit wenig Patienten und mehr mit dem Ziel, erste Nebenwirkungen und das Verhalten im Menschen zu untersuchen. Naja, so hat die Ergebnisse Ohad Hammer damals kommentiert:
http://www.orf-blog.com/biotech-portfolio-update-array-morph…
"... Is ARRY-380 potent enough?
The biggest question regarding ARRY-380 is whether it is efficacious enough relatively to Tykerb and neratinib. Array reported phase I results which demonstrated activity in several advanced HER2+ breast cancer patients but it is still unclear whether the theoretical ability to hit HER2 harder coupled with improved safety profile will lead to clinical superiority.
ARRY-380 only has a limited data set from a phase I trial. The trial recruited 50 patients with HER2+ tumors, the majority of whom had breast cancer. As expected, the drug appears to have a differentiated safety profile with minimal skin and GI toxicities. Activity at the highest dose (20 evaluable patients with HER2+ breast cancer) included 2 confirmed PRs, 1 unconfirmed PR and multiple cases of tumor shrinkage.
How does a modest objective response rate of 10% stack up against competition? As monotherapy, Tykerb and neratinib led to response rates of 4-8% and 24%, respectively. At first glance, ARRY-380 seems to fall at the lower end of the spectrum but it is important to remember that its phase I included patients who were more advanced. In particular, all patients failed prior Herceptin and the vast majority also failed Tykerb. In contrast, Tykerb’s and neratinib’s results were generated in far less heavily pretreated patients, all of whom were Tykerb-naïve.
Oncothyreon and Array are expected to start several combination trials which could have top line data as early as Q4 2014. The most straightforward route to registration is replicating neratinib’s phase III design in 3rd/4th line patients in combination with Xeloda. Another potential route could be HER2+ breast cancer brain metastases.
Summary
In summary, ARRY-380 clearly has activity in last line patients and future combination trials are needed for showing its true clinical relevance. Puma’s neratinib, which just started phase III, has a 2-year lead but ARRY-380 unique selectivity profile might make it a best-in-class HER2 inhibitor (At least in HER2+ breast cancer)..."
****
"Den Hauptumsatz werden Kadcyla und Perjeta machen. Bleibt abzuwarten, ob in besonderen Fällen ggf. noch zusätzlich ein oraler Wirkstoff wie ARRY-380 verabreicht werden kann."
Wie erklärst du dir dann die aktuelle PBYI MK von 7 Mrd USD? Dies müsste eine gigantische Blase sein, wenn ein oraler Wirkstoff wie Neratinib nur in besonderen Fällen zum Einsatz kommen würde.
Ich denke, dass AKs und TKIs nicht so vergleichbar sind, dass sie sich direkt Konkurrenz machen. Ein AK wirkt ja auch über das Immunsystem bzw. ein ADC über den mitgeführten Wirkstoff. TKIs hemmen dagegen nur den Signalweg. Ist dieser für den Krebs wichtig, so wird er dadurch u.U. abgetötet. Bei manchen Krebsarten wirkt nur der AK oder nur der TKI. Bei NSCLC gibt es z.B. den etablierten EGFR-TKI Tarceva... ein EGFR-AK ist bisher nicht wirksam. Letztlich wird es auf eine Kombi AK + TKI hinauslaufen... dafür sollte der TKI möglichst geringe Nebenwirkungen aufweisen.
Gruß
ipollit
http://www.orf-blog.com/biotech-portfolio-update-array-morph…
"... Is ARRY-380 potent enough?
The biggest question regarding ARRY-380 is whether it is efficacious enough relatively to Tykerb and neratinib. Array reported phase I results which demonstrated activity in several advanced HER2+ breast cancer patients but it is still unclear whether the theoretical ability to hit HER2 harder coupled with improved safety profile will lead to clinical superiority.
ARRY-380 only has a limited data set from a phase I trial. The trial recruited 50 patients with HER2+ tumors, the majority of whom had breast cancer. As expected, the drug appears to have a differentiated safety profile with minimal skin and GI toxicities. Activity at the highest dose (20 evaluable patients with HER2+ breast cancer) included 2 confirmed PRs, 1 unconfirmed PR and multiple cases of tumor shrinkage.
How does a modest objective response rate of 10% stack up against competition? As monotherapy, Tykerb and neratinib led to response rates of 4-8% and 24%, respectively. At first glance, ARRY-380 seems to fall at the lower end of the spectrum but it is important to remember that its phase I included patients who were more advanced. In particular, all patients failed prior Herceptin and the vast majority also failed Tykerb. In contrast, Tykerb’s and neratinib’s results were generated in far less heavily pretreated patients, all of whom were Tykerb-naïve.
Oncothyreon and Array are expected to start several combination trials which could have top line data as early as Q4 2014. The most straightforward route to registration is replicating neratinib’s phase III design in 3rd/4th line patients in combination with Xeloda. Another potential route could be HER2+ breast cancer brain metastases.
Summary
In summary, ARRY-380 clearly has activity in last line patients and future combination trials are needed for showing its true clinical relevance. Puma’s neratinib, which just started phase III, has a 2-year lead but ARRY-380 unique selectivity profile might make it a best-in-class HER2 inhibitor (At least in HER2+ breast cancer)..."
****
"Den Hauptumsatz werden Kadcyla und Perjeta machen. Bleibt abzuwarten, ob in besonderen Fällen ggf. noch zusätzlich ein oraler Wirkstoff wie ARRY-380 verabreicht werden kann."
Wie erklärst du dir dann die aktuelle PBYI MK von 7 Mrd USD? Dies müsste eine gigantische Blase sein, wenn ein oraler Wirkstoff wie Neratinib nur in besonderen Fällen zum Einsatz kommen würde.
Ich denke, dass AKs und TKIs nicht so vergleichbar sind, dass sie sich direkt Konkurrenz machen. Ein AK wirkt ja auch über das Immunsystem bzw. ein ADC über den mitgeführten Wirkstoff. TKIs hemmen dagegen nur den Signalweg. Ist dieser für den Krebs wichtig, so wird er dadurch u.U. abgetötet. Bei manchen Krebsarten wirkt nur der AK oder nur der TKI. Bei NSCLC gibt es z.B. den etablierten EGFR-TKI Tarceva... ein EGFR-AK ist bisher nicht wirksam. Letztlich wird es auf eine Kombi AK + TKI hinauslaufen... dafür sollte der TKI möglichst geringe Nebenwirkungen aufweisen.
Gruß
ipollit
ARRY
noch ein paar Anmerkungen zu ARRY-380:
"Our recent conversation with a breast cancer physician consultant identified CNS metastases from MBC as an opportunity for ARRY-380 use in the clinic. We add brain mets to our Oncothyreon (ONTY) model and estimate $47M of 2022 sales for this indication.
We see brain mets from MBC as an underserved indication as there is currently no approved drug for its treatment. Our physician consultant noted that ~50% of Her2-positive MBC patients from the HERA trial developed brain mets at the 8-year follow-up. We estimate that 5% of the total MBC population will eventually develop brain mets and see a potential market opportunity of greater than 2500 new patients in 2022.
The brain mets opportunity is compelling for ARRY-380 as in preclinical studies, ARRY-380 had superior efficacy against brain metastases compared to Tykerb or neratinib. Our physician consultant also saw ARRY-380’s specificity for Her2 to the exclusion of EGFR leading to a more benign side effect profile than either Tykerb or neratinib. He noted that compared to neratinib, which had 30% grade 3/4 diarrhea in early testing without prophylaxis, ARRY-380 had a cleaner profile. We estimate approval in 2019 with immediate brain met usage.
ONTY recently initiated 2 Phase I trials for MBC in combination with Xeloda and in combination with Kadcyla. Our physician consultant sees the Kadcyla combination specifically as a relevant combination in light of the shifting paradigm of treatment that will likely include Kadcyla and/or Perjeta. We see upside to these trials as they are enrolling patients with brain mets, leveraging a possible niche role that ARRY-380 could play. We see the initiation of these trials as reducing the risk in the development of ARRY-380 and lower our discount rate to 20% from 25%."
******
"Supporting our view of '380 potential is early clinical data showing responses in patients who had failed Tykerb, indicative of effective HER2 targeting. Three of 22 patients receiving '380 in a Phase 1 trial demonstrated a partial response HER2 (2 of 18 at the 600/650 mg dose level; the maximum tolerated dose is 600 mg). We note that over 80% of patients in the trial received prior Tykerb, and that competitive agents have shown lower response rates in Tykerb pretreated patients than in Tykerb-naives. Accordingly, we see potential for higher respose rates for '380 in future trials that may include patients that are less heavily pre-treated.
Physician consultation supports the potential benefit of a diarrhea-sparing drug such as '380. A breast cancer specialist with whom we conferred stressed the significant quality of life impact of diarrhea induced by Tykerb and experimental agent neratinib (Puma) in the absence of prophylaxis. The doctor indicated that an efficacious twice-a-day regimen with low toxicity would be well-received by oncologists. With Phase 1 data showing only 4% grade 2 diarrhea, '380 could prove to be such a drug, in our view."
noch ein paar Anmerkungen zu ARRY-380:
"Our recent conversation with a breast cancer physician consultant identified CNS metastases from MBC as an opportunity for ARRY-380 use in the clinic. We add brain mets to our Oncothyreon (ONTY) model and estimate $47M of 2022 sales for this indication.
We see brain mets from MBC as an underserved indication as there is currently no approved drug for its treatment. Our physician consultant noted that ~50% of Her2-positive MBC patients from the HERA trial developed brain mets at the 8-year follow-up. We estimate that 5% of the total MBC population will eventually develop brain mets and see a potential market opportunity of greater than 2500 new patients in 2022.
The brain mets opportunity is compelling for ARRY-380 as in preclinical studies, ARRY-380 had superior efficacy against brain metastases compared to Tykerb or neratinib. Our physician consultant also saw ARRY-380’s specificity for Her2 to the exclusion of EGFR leading to a more benign side effect profile than either Tykerb or neratinib. He noted that compared to neratinib, which had 30% grade 3/4 diarrhea in early testing without prophylaxis, ARRY-380 had a cleaner profile. We estimate approval in 2019 with immediate brain met usage.
ONTY recently initiated 2 Phase I trials for MBC in combination with Xeloda and in combination with Kadcyla. Our physician consultant sees the Kadcyla combination specifically as a relevant combination in light of the shifting paradigm of treatment that will likely include Kadcyla and/or Perjeta. We see upside to these trials as they are enrolling patients with brain mets, leveraging a possible niche role that ARRY-380 could play. We see the initiation of these trials as reducing the risk in the development of ARRY-380 and lower our discount rate to 20% from 25%."
******
"Supporting our view of '380 potential is early clinical data showing responses in patients who had failed Tykerb, indicative of effective HER2 targeting. Three of 22 patients receiving '380 in a Phase 1 trial demonstrated a partial response HER2 (2 of 18 at the 600/650 mg dose level; the maximum tolerated dose is 600 mg). We note that over 80% of patients in the trial received prior Tykerb, and that competitive agents have shown lower response rates in Tykerb pretreated patients than in Tykerb-naives. Accordingly, we see potential for higher respose rates for '380 in future trials that may include patients that are less heavily pre-treated.
Physician consultation supports the potential benefit of a diarrhea-sparing drug such as '380. A breast cancer specialist with whom we conferred stressed the significant quality of life impact of diarrhea induced by Tykerb and experimental agent neratinib (Puma) in the absence of prophylaxis. The doctor indicated that an efficacious twice-a-day regimen with low toxicity would be well-received by oncologists. With Phase 1 data showing only 4% grade 2 diarrhea, '380 could prove to be such a drug, in our view."
Hier nach ein paar Folien von ONTY zu ONT-380/ARRY-380... neue PI-Daten sollten Ende des Jahres kommen
http://ir.oncothyreon.com/common/download/download.cfm?compa…
HER2 wird theoretisch ähnlich stark wie mit Neritinib gehemmt... EGFR dagegen ausgespart:
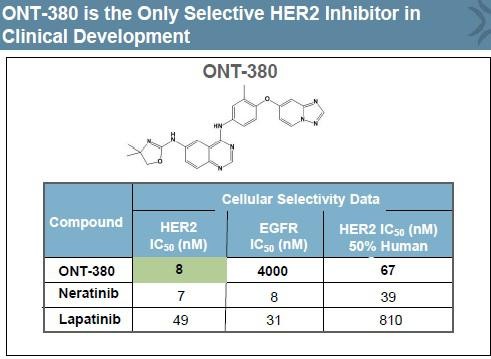
ONT-380 + Herceptin sind präklinisch synergetisch:
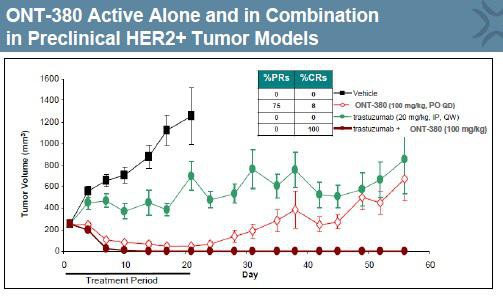
Entwicklung mit Schwerpunkt Gehirnmetastasen und Kombi-Therapien insbesondere mit Kadcyla:

zurzeit laufen 3 PI-Studien

PII-Start ist für Ende des Jahres geplant
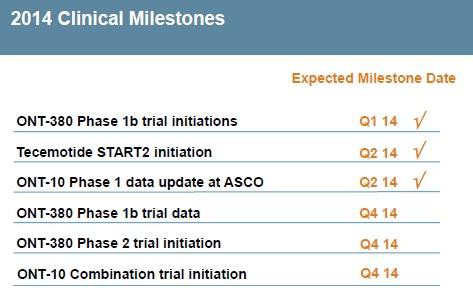
50:50 Partnerschaft von ONTY und ARRY

ARRY hat aktuell eine MK von 540 Mio USD, ONTY 215 Mio USD
Gruß
ipollit
http://ir.oncothyreon.com/common/download/download.cfm?compa…
HER2 wird theoretisch ähnlich stark wie mit Neritinib gehemmt... EGFR dagegen ausgespart:

ONT-380 + Herceptin sind präklinisch synergetisch:

Entwicklung mit Schwerpunkt Gehirnmetastasen und Kombi-Therapien insbesondere mit Kadcyla:

zurzeit laufen 3 PI-Studien

PII-Start ist für Ende des Jahres geplant

50:50 Partnerschaft von ONTY und ARRY

ARRY hat aktuell eine MK von 540 Mio USD, ONTY 215 Mio USD
Gruß
ipollit
Exel:
Roche wird die Cobi Ergebnisse wohl auf der Esmo 26-30 Sept. präsentieren. Wie die Reihenfolge und das Timing bei den Comet Trials ist, weiß ich leider auch nicht. Momentan rekrutieren sie aber bei Comet2 noch.

Roche wird die Cobi Ergebnisse wohl auf der Esmo 26-30 Sept. präsentieren. Wie die Reihenfolge und das Timing bei den Comet Trials ist, weiß ich leider auch nicht. Momentan rekrutieren sie aber bei Comet2 noch.

PCYC
warum spricht Ohad Hammer eigentlich von bisher enttäuschenden Umsatzzahlen von Imbruvica?
Nach dem folgenden Diagramm ist es bisher das zweiterfolgreichste Krebsmittel hinter Avastin. Im letzten Quartal könnten die US-Umsätze an die 100 Mio USD heranreichen...
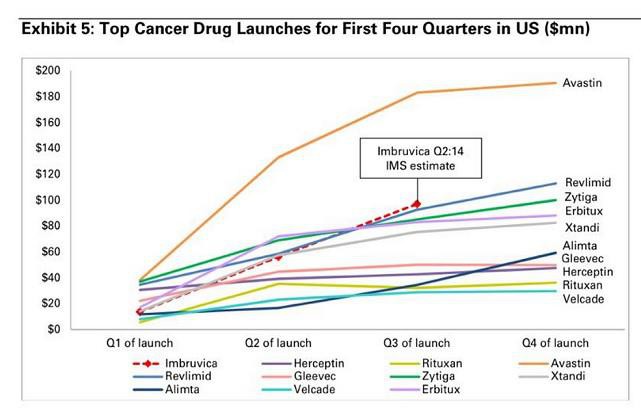
Die gerade erfolgte Zulassung von GILDs pi3k-delta Konkurrent Zydelig (Idelalisib) sieht auch eher positiv für Imbruvica aus, da die FDA dieses Mittel nur mit einem Black-Box-Warning zugelassen hat:

Grüße
ipollit
warum spricht Ohad Hammer eigentlich von bisher enttäuschenden Umsatzzahlen von Imbruvica?
Nach dem folgenden Diagramm ist es bisher das zweiterfolgreichste Krebsmittel hinter Avastin. Im letzten Quartal könnten die US-Umsätze an die 100 Mio USD heranreichen...

Die gerade erfolgte Zulassung von GILDs pi3k-delta Konkurrent Zydelig (Idelalisib) sieht auch eher positiv für Imbruvica aus, da die FDA dieses Mittel nur mit einem Black-Box-Warning zugelassen hat:

Grüße
ipollit
Am Rande:
Nachdem Stemline seit nunmehr einem Jahr und zwei Monaten an der Börse notiert ist, hat man es tatsächlich geschafft, einen IND für das Programm SL-401 zu bekommen!
Für mich ist das ein schönes Symbol dafür, wie überhitzt der IPO-Markt schon lange ist. Da können (oder konnten?) Unternehmen problemlos an den öffentlichen Kapitalmarkt gehen, die noch mitten in der Präklinik stecken, wo wohl eher eine VC-Finanzierung angezeigt wäre.
Wir haben diese Probleme bei STML damals hier im Thread diskutiert.
Davon abgesehen, fand und finde ich SL-401 interessant genug, um an dem Unternehmen beteiligt zu sein.
Ich freue mich auf die nun endlich bald beginnende klinische Entwicklung in BPDCN!
Nachdem Stemline seit nunmehr einem Jahr und zwei Monaten an der Börse notiert ist, hat man es tatsächlich geschafft, einen IND für das Programm SL-401 zu bekommen!
Für mich ist das ein schönes Symbol dafür, wie überhitzt der IPO-Markt schon lange ist. Da können (oder konnten?) Unternehmen problemlos an den öffentlichen Kapitalmarkt gehen, die noch mitten in der Präklinik stecken, wo wohl eher eine VC-Finanzierung angezeigt wäre.
Wir haben diese Probleme bei STML damals hier im Thread diskutiert.
Davon abgesehen, fand und finde ich SL-401 interessant genug, um an dem Unternehmen beteiligt zu sein.
Ich freue mich auf die nun endlich bald beginnende klinische Entwicklung in BPDCN!
PCYC
Imbruvica ist nun in 2Q14 mit 109,5 Mio USD deutlich über 100 Mio USD Umsatz gekommen. Erwartet waren eher um die 90 Mio USD.
Sehr positiv ist auch die vollständige US-Zulassung in 2nd-line CLL und rr MCL am Anfang der Woche aufgrund der guten RESONATE-Ergebnisse sowie die EU-Zulassungsempfehlung von Freitag. Das Label könnte sogar schon teilweise 1st-line abdecken.

Grüße
ipollit
Imbruvica ist nun in 2Q14 mit 109,5 Mio USD deutlich über 100 Mio USD Umsatz gekommen. Erwartet waren eher um die 90 Mio USD.
Sehr positiv ist auch die vollständige US-Zulassung in 2nd-line CLL und rr MCL am Anfang der Woche aufgrund der guten RESONATE-Ergebnisse sowie die EU-Zulassungsempfehlung von Freitag. Das Label könnte sogar schon teilweise 1st-line abdecken.

Grüße
ipollit
REGN
Eyela ist nun in einer weiteren größeren Indikation (DME) zugelassen.
Zudem wurde gestern bekannt gegeben, dass 9 PIII-Studien vom PCSK9-AK Alirocumab erfolgreich waren. Der Zulassungsantrag soll Ende des Jahres gestellt werden. Man befindet sich in einem direkten Kopf-an-Kopf-Rennen mit AMGN, die ihren PCSK9-AK in Q3 zur Zulassung einreichen wollen. Um die Zulassung von Alirocumab zu beschleunigen, hat man für ca. 68 Mio USD von BMRN außerdem eine Art Priority-Review-Gutschein abgekauft, damit die FDA die Zulassungsprüfung möglichst in 6 statt 10 Monaten durchführt.

Gruß
ipollit
Eyela ist nun in einer weiteren größeren Indikation (DME) zugelassen.
Zudem wurde gestern bekannt gegeben, dass 9 PIII-Studien vom PCSK9-AK Alirocumab erfolgreich waren. Der Zulassungsantrag soll Ende des Jahres gestellt werden. Man befindet sich in einem direkten Kopf-an-Kopf-Rennen mit AMGN, die ihren PCSK9-AK in Q3 zur Zulassung einreichen wollen. Um die Zulassung von Alirocumab zu beschleunigen, hat man für ca. 68 Mio USD von BMRN außerdem eine Art Priority-Review-Gutschein abgekauft, damit die FDA die Zulassungsprüfung möglichst in 6 statt 10 Monaten durchführt.


Gruß
ipollit
Antwort auf Beitrag Nr.: 47.402.750 von SLGramann am 30.07.14 21:44:57Hallo SLGramann,
eigentlich hatte ich gehofft, dass man in den letzten Monaten einfach die bisherige PI mit mehr Patienten weiterführt und dadurch noch aussagekräftigere Ergebnisse erhalten hätte. Soweit ich es verstehe, ist die genaue Ausgestaltung dieser neuen Studie/Studien ja noch nicht so ganz klar, oder? Wann sollen die Ergebnisse vorliegen? Strebt man auf jedenfall eine vorzeitige Zulassung an und ist das mit dieser Studie alleine bereits zu erreichen?
Als Konkurrent von SL-401 finde ich auch MGNX MGD006 interessant... es ist ein CD123 x CD3 DART, also praktisch soetwas wie Micromet's BITE gegen das Zielmolekül von SL-401.
"June 19, 2014
MacroGenics Initiates Phase 1 Study of MGD006 for the Treatment of Acute Myeloid Leukemia
MGD006 Represents the First DART(R) Molecule to Enter the Clinic
ROCKVILLE, Md., June 19, 2014 (GLOBE NEWSWIRE) -- MacroGenics, Inc. (Nasdaq:MGNX), a clinical-stage biopharmaceutical company focused on discovering and identifying innovative monoclonal antibody-based therapeutics for the treatment of cancer and autoimmune disease, today announced that a first patient received drug in a Phase 1 study of MGD006 in relapsed or refractory acute myeloid leukemia (AML). MGD006 is a humanized, Dual-Affinity Re-Targeting (DART®) bi-specific antibody-based molecule that binds to both CD123 and CD3, antigens expressed on leukemic cells and T lymphocytes, respectively. This study marks the first clinical trial of a DART product candidate.
"We are very enthusiastic about the initiation of this study in which we will explore MGD006's ability to redirect T cells against CD123-positive leukemic blasts in patients with relapsed or refractory AML," said John Di Persio, M.D., Ph.D., lead investigator and Chief, Division of Oncology, Washington University School of Medicine in St. Louis. "We hope to gain an understanding of the safety, tolerability and activity of MGD006 in this study."
"The initiation of this Phase 1 study marks a significant milestone as the first of our portfolio of DART molecules, MGD006, enters the clinic," said Scott Koenig, M.D., Ph.D., President and CEO of MacroGenics. "MGD006 has demonstrated great promise as a T cell-re-directed cancer immunotherapy in pre-clinical studies. We will see whether these studies translate into clinical trial results indicative of clinical improvement for patients with AML, a disease for which standard therapies have advanced little in the last thirty years."
MacroGenics has development and commercialization rights to MGD006 in the U.S., Canada, Mexico, Japan, South Korea and India; MacroGenics' partner, Servier, has rights to MGD006 in all other countries."
http://www.veracast.com/webcasts/baml/healthcare2014/events/…
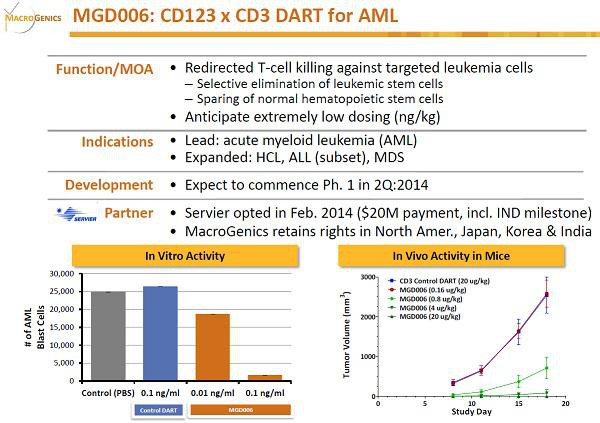
Grüße
ipollit
eigentlich hatte ich gehofft, dass man in den letzten Monaten einfach die bisherige PI mit mehr Patienten weiterführt und dadurch noch aussagekräftigere Ergebnisse erhalten hätte. Soweit ich es verstehe, ist die genaue Ausgestaltung dieser neuen Studie/Studien ja noch nicht so ganz klar, oder? Wann sollen die Ergebnisse vorliegen? Strebt man auf jedenfall eine vorzeitige Zulassung an und ist das mit dieser Studie alleine bereits zu erreichen?
Als Konkurrent von SL-401 finde ich auch MGNX MGD006 interessant... es ist ein CD123 x CD3 DART, also praktisch soetwas wie Micromet's BITE gegen das Zielmolekül von SL-401.
"June 19, 2014
MacroGenics Initiates Phase 1 Study of MGD006 for the Treatment of Acute Myeloid Leukemia
MGD006 Represents the First DART(R) Molecule to Enter the Clinic
ROCKVILLE, Md., June 19, 2014 (GLOBE NEWSWIRE) -- MacroGenics, Inc. (Nasdaq:MGNX), a clinical-stage biopharmaceutical company focused on discovering and identifying innovative monoclonal antibody-based therapeutics for the treatment of cancer and autoimmune disease, today announced that a first patient received drug in a Phase 1 study of MGD006 in relapsed or refractory acute myeloid leukemia (AML). MGD006 is a humanized, Dual-Affinity Re-Targeting (DART®) bi-specific antibody-based molecule that binds to both CD123 and CD3, antigens expressed on leukemic cells and T lymphocytes, respectively. This study marks the first clinical trial of a DART product candidate.
"We are very enthusiastic about the initiation of this study in which we will explore MGD006's ability to redirect T cells against CD123-positive leukemic blasts in patients with relapsed or refractory AML," said John Di Persio, M.D., Ph.D., lead investigator and Chief, Division of Oncology, Washington University School of Medicine in St. Louis. "We hope to gain an understanding of the safety, tolerability and activity of MGD006 in this study."
"The initiation of this Phase 1 study marks a significant milestone as the first of our portfolio of DART molecules, MGD006, enters the clinic," said Scott Koenig, M.D., Ph.D., President and CEO of MacroGenics. "MGD006 has demonstrated great promise as a T cell-re-directed cancer immunotherapy in pre-clinical studies. We will see whether these studies translate into clinical trial results indicative of clinical improvement for patients with AML, a disease for which standard therapies have advanced little in the last thirty years."
MacroGenics has development and commercialization rights to MGD006 in the U.S., Canada, Mexico, Japan, South Korea and India; MacroGenics' partner, Servier, has rights to MGD006 in all other countries."
http://www.veracast.com/webcasts/baml/healthcare2014/events/…

Grüße
ipollit
AMGN/LGND (ARRY):
Amgen heute mit ersten PIII Ergebnissen zu Kyprolis:
Amgen (AMGN) and its subsidiary, Onyx Pharmaceuticals, Inc., today announced that a planned interim analysis demonstrated that the Phase 3 clinical trial ASPIRE (CArfilzomib, Lenalidomide, and DexamethaSone versus Lenalidomide and Dexamethasone for the treatment of PatIents with Relapsed Multiple MyEloma) met its primary endpoint of progression-free survival (PFS). Patients treated with Kyprolis® (carfilzomib) for Injection in combination with Revlimid® (lenalidomide) and low-dose dexamethasone (KRd) lived significantly longer without their disease worsening (median 26.3 months) compared to patients treated with Revlimid and low-dose dexamethasone (Rd) (median 17.6 months) (HR=0.690, 95 percent CI, 0.570, 0.834, p
The safety profile observed in this study is consistent with the current U.S. Kyprolis label, including the rate of cardiac events. Treatment discontinuation due to adverse events and on-study deaths were comparable between the two arms. No new safety signals were identified.
Results will be submitted for presentation at the upcoming 56th Annual Meeting of the American Society of Hematology later this year.
https://finance.yahoo.com/news/amgen-announces-phase-3-aspir…
Erfreulich wohl besonders, dass es keine negativen Überraschungen im Sicherheitsrofil gab. Hier gab es zuletzt ja einige Befürchtungen. Aber von den 3 PIIIs scheint mir diese die unwichtigste.
Onyx is addressing these questions with 3 pivotal trials in relapsed/refractory myeloma patients. The FOCUS trial is evaluating Kyprolis vs. best supportive care and will have overall survival readout in the second half of 2013. Another trial (ASPIRE) is evaluating the addition of Kyprolis to Revlimid and should have PFS data in the fourth quarter of 2013. The ENDEAVOR trial, which started last year, is comparing Kyprolis and Velcade. Interestingly, this trial is using a modified dosing regimen for Kyprolis which appears more potent than the approved Kyprolis regimen but may also be more toxic in some patients.
http://www.orf-blog.com/onyx-a-must-own-biotech-for-2013/
Aufatmen heute vor allem bei LGND. Die waren in den letzten Wochen stark unter Druck geraten, weil ein Hedgefonds hier Short gegangen ist und anschließend in einem "Bericht" u.A. ein Kursziel von 0 EUR ausgegeben hat. So was geht auch nur in Amerika!
http://seekingalpha.com/article/2298775-ligand-pharmaceutica…
Für ARRY würde ich denken, ist die Studie heute eher nebensächlich, da es in Kombination mit Kyprolis alleine getestet werden soll. Und da wären positive Ergebnisse beim FOCUS Trial wichtiger. Andererseits wären natürlich schlechte Ergebnisse heute auch schlecht gewesen.
Matthew Herper mit einer Einschätzung:
http://www.forbes.com/sites/matthewherper/2014/07/31/fda-to-…
Amgen heute mit ersten PIII Ergebnissen zu Kyprolis:
Amgen (AMGN) and its subsidiary, Onyx Pharmaceuticals, Inc., today announced that a planned interim analysis demonstrated that the Phase 3 clinical trial ASPIRE (CArfilzomib, Lenalidomide, and DexamethaSone versus Lenalidomide and Dexamethasone for the treatment of PatIents with Relapsed Multiple MyEloma) met its primary endpoint of progression-free survival (PFS). Patients treated with Kyprolis® (carfilzomib) for Injection in combination with Revlimid® (lenalidomide) and low-dose dexamethasone (KRd) lived significantly longer without their disease worsening (median 26.3 months) compared to patients treated with Revlimid and low-dose dexamethasone (Rd) (median 17.6 months) (HR=0.690, 95 percent CI, 0.570, 0.834, p
The safety profile observed in this study is consistent with the current U.S. Kyprolis label, including the rate of cardiac events. Treatment discontinuation due to adverse events and on-study deaths were comparable between the two arms. No new safety signals were identified.
Results will be submitted for presentation at the upcoming 56th Annual Meeting of the American Society of Hematology later this year.
https://finance.yahoo.com/news/amgen-announces-phase-3-aspir…
Erfreulich wohl besonders, dass es keine negativen Überraschungen im Sicherheitsrofil gab. Hier gab es zuletzt ja einige Befürchtungen. Aber von den 3 PIIIs scheint mir diese die unwichtigste.
Onyx is addressing these questions with 3 pivotal trials in relapsed/refractory myeloma patients. The FOCUS trial is evaluating Kyprolis vs. best supportive care and will have overall survival readout in the second half of 2013. Another trial (ASPIRE) is evaluating the addition of Kyprolis to Revlimid and should have PFS data in the fourth quarter of 2013. The ENDEAVOR trial, which started last year, is comparing Kyprolis and Velcade. Interestingly, this trial is using a modified dosing regimen for Kyprolis which appears more potent than the approved Kyprolis regimen but may also be more toxic in some patients.
http://www.orf-blog.com/onyx-a-must-own-biotech-for-2013/
Aufatmen heute vor allem bei LGND. Die waren in den letzten Wochen stark unter Druck geraten, weil ein Hedgefonds hier Short gegangen ist und anschließend in einem "Bericht" u.A. ein Kursziel von 0 EUR ausgegeben hat. So was geht auch nur in Amerika!
http://seekingalpha.com/article/2298775-ligand-pharmaceutica…
Für ARRY würde ich denken, ist die Studie heute eher nebensächlich, da es in Kombination mit Kyprolis alleine getestet werden soll. Und da wären positive Ergebnisse beim FOCUS Trial wichtiger. Andererseits wären natürlich schlechte Ergebnisse heute auch schlecht gewesen.
Matthew Herper mit einer Einschätzung:
http://www.forbes.com/sites/matthewherper/2014/07/31/fda-to-…
ARQL
Fokus liegt auf den AKT-Hemmer ARQ-092, den Ohad Hammer bereits positiv hervorgehoben hat.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARQL - 2Q14 CC notes
1. With recent restructuring, cash runway has been extended another year (into 2017 now).
2. ARQL is now prioritizing ARQ092 (Akt inhibitor) over ARQ087 (FGFR inhibitor) because FGFR space very competitive and they feel they have better competitive positioning with ARQ092.
3. Regarding ongoing P3 tivantinib HCC trial, ARQL has taken steps to ensure accuracy of MET-high reading in patient tissue, which includes imposing time limitations on sample testing (within a week) and ensuring that the samples obtained contain high levels of HCC cells. Additionally, unlike in NSCLC, ARQL has found the borderline cases of MET-high and MET-low to be much fewer in HCC. It is apparently much clearer to distinguish between MET-high and MET-low in HCC.
4. The data in the P3 MARQUEE NSCLC trial has still not matured for the EGFR mutant sub-group.
5. Plan to present Phase 1a data on both ARQ092 and ARQ087 in November at EORTC. For 092, ARQL has seen a PR in lymphocytic lymphoma and long-term stable disease in neurocrine tumor of the pancreas, breast cancer, and osteosarcoma. There was also reference to pre-clinical 092 data being presented in October at the American Society of Human Genetics in a very rare and devastating disease outside of oncology.
6. ARQL believes front-line therapy in HCC from VEGF inhibitors enhances MET status and leads to more MET-high patients than MET-low. I.e., MET may be a resistance mechanism for VEGF inhibition.
Hemmung von MET ist eine deutlich kompliziertere Sache als noch vor Jahren gedacht. Zwar spielt MET bei Krebs anscheinend oft eine Rolle. Aber die Hemmung von MET hat bei Krebs nicht immer einen positiven Effekt, teilweise vielleicht auch einen negativen. Entscheidend ist, den Einfluss von MET zu verstehen und die richtigen Subgruppen zu finden, die von einer MET-Hemmung profitieren.
Gruß
ipollit
Fokus liegt auf den AKT-Hemmer ARQ-092, den Ohad Hammer bereits positiv hervorgehoben hat.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARQL - 2Q14 CC notes
1. With recent restructuring, cash runway has been extended another year (into 2017 now).
2. ARQL is now prioritizing ARQ092 (Akt inhibitor) over ARQ087 (FGFR inhibitor) because FGFR space very competitive and they feel they have better competitive positioning with ARQ092.
3. Regarding ongoing P3 tivantinib HCC trial, ARQL has taken steps to ensure accuracy of MET-high reading in patient tissue, which includes imposing time limitations on sample testing (within a week) and ensuring that the samples obtained contain high levels of HCC cells. Additionally, unlike in NSCLC, ARQL has found the borderline cases of MET-high and MET-low to be much fewer in HCC. It is apparently much clearer to distinguish between MET-high and MET-low in HCC.
4. The data in the P3 MARQUEE NSCLC trial has still not matured for the EGFR mutant sub-group.
5. Plan to present Phase 1a data on both ARQ092 and ARQ087 in November at EORTC. For 092, ARQL has seen a PR in lymphocytic lymphoma and long-term stable disease in neurocrine tumor of the pancreas, breast cancer, and osteosarcoma. There was also reference to pre-clinical 092 data being presented in October at the American Society of Human Genetics in a very rare and devastating disease outside of oncology.
6. ARQL believes front-line therapy in HCC from VEGF inhibitors enhances MET status and leads to more MET-high patients than MET-low. I.e., MET may be a resistance mechanism for VEGF inhibition.
Hemmung von MET ist eine deutlich kompliziertere Sache als noch vor Jahren gedacht. Zwar spielt MET bei Krebs anscheinend oft eine Rolle. Aber die Hemmung von MET hat bei Krebs nicht immer einen positiven Effekt, teilweise vielleicht auch einen negativen. Entscheidend ist, den Einfluss von MET zu verstehen und die richtigen Subgruppen zu finden, die von einer MET-Hemmung profitieren.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.454.352 von ipollit am 07.08.14 10:52:21EXEL
von ARQL-CC: "6. ARQL believes front-line therapy in HCC from VEGF inhibitors enhances MET status and leads to more MET-high patients than MET-low. I.e., MET may be a resistance mechanism for VEGF inhibition."
Dies würde auch für EXEL's CELESTIAL PIII sprechen, bei der Cabozantinib in HCC getestet wird. Daten sollen 2016/2017 kommen.
Bisher gehören VEGF-Hemmer wie Sutent (Sorafenib) zum Standard:
http://www.gi-oncology.de/download/2009/Abstracts/Session%20…
"Da das hepatozelluläre Karzinom ein sehr stark hypervaskularisierter Tumor ist, scheint daher die zurzeit attraktivste Strategie für die molekulare Therapie die Hemmung von VEGF (vascular endothelial growth factor) zu sein (Tabelle 1). Es konnte gezeigt werden, dass HIF-1-alpha, der eine wichtige Rolle in der HIF-Aktivierung spielt, in preneoplastischen Leberläsionen überexprimiert ist. HIF-1 ist ein Transkriptionsfaktor von VEGF, c-met und IGF-II. Erhöhte VEGF Spiegel im Serum und Gewebe und auch Polymorphismen von VEGF konnten als Marker für eine schlechte Prognose beim HCC identifiziert werden. Die Hypervaskularisation des HCC wird demnach überwiegend von VEGF vermittelt."
ARQL's Ansatz ist, dass unter VEGF-Hemmung eine Resistenz durch stärkere Aktivierung von cMET entsteht. Getestet wird Tivantinib vs. Placebo als 2nd-line Therapie bei Met-High.
Cabozantinib ist erstmal ein VEGF + cMet-Hemmer. Als VEGF-Hemmer könnte Carbo bereits besser als Sutent sein. Die zusätzliche cMet-Hemmung wirkt zudem der Resistenz entgegen. CELESTIAL testet speziell die Anwendung nach Sutent. Vom Ansatz her also durchaus sinnvoll.
Gruß
ipollit
von ARQL-CC: "6. ARQL believes front-line therapy in HCC from VEGF inhibitors enhances MET status and leads to more MET-high patients than MET-low. I.e., MET may be a resistance mechanism for VEGF inhibition."
Dies würde auch für EXEL's CELESTIAL PIII sprechen, bei der Cabozantinib in HCC getestet wird. Daten sollen 2016/2017 kommen.
Bisher gehören VEGF-Hemmer wie Sutent (Sorafenib) zum Standard:
http://www.gi-oncology.de/download/2009/Abstracts/Session%20…
"Da das hepatozelluläre Karzinom ein sehr stark hypervaskularisierter Tumor ist, scheint daher die zurzeit attraktivste Strategie für die molekulare Therapie die Hemmung von VEGF (vascular endothelial growth factor) zu sein (Tabelle 1). Es konnte gezeigt werden, dass HIF-1-alpha, der eine wichtige Rolle in der HIF-Aktivierung spielt, in preneoplastischen Leberläsionen überexprimiert ist. HIF-1 ist ein Transkriptionsfaktor von VEGF, c-met und IGF-II. Erhöhte VEGF Spiegel im Serum und Gewebe und auch Polymorphismen von VEGF konnten als Marker für eine schlechte Prognose beim HCC identifiziert werden. Die Hypervaskularisation des HCC wird demnach überwiegend von VEGF vermittelt."
ARQL's Ansatz ist, dass unter VEGF-Hemmung eine Resistenz durch stärkere Aktivierung von cMET entsteht. Getestet wird Tivantinib vs. Placebo als 2nd-line Therapie bei Met-High.
Cabozantinib ist erstmal ein VEGF + cMet-Hemmer. Als VEGF-Hemmer könnte Carbo bereits besser als Sutent sein. Die zusätzliche cMet-Hemmung wirkt zudem der Resistenz entgegen. CELESTIAL testet speziell die Anwendung nach Sutent. Vom Ansatz her also durchaus sinnvoll.
Gruß
ipollit
hier lassen sich hin und wieder ein paar Analysten-Kommentare zu einigen Biotechs finden:
http://www.smarteranalyst.com/category/healthcare/
https://twitter.com/dougheuringaria/media
Gruß
ipollit
http://www.smarteranalyst.com/category/healthcare/
https://twitter.com/dougheuringaria/media
Gruß
ipollit
INFI / TGTX

Viele sehen die IPI-145 wegen der Hemmung von pi3k-Gamma kritisch, weil dies auch Nebenwirkungen für das Immunsystem mit sich bringt. Allerdings könnte Gamma auch positive Effekte haben. Die Hemmung von delta ist zudem größer als bei GILD's Zydelig. Ich habe darauf spekuliert, dass IPI-145 eines der besten Mittel gegen iNHL sein wird. Außerdem wirkt es über Gamma auch gegen T-Zell Krebsarten wie PTCL oder CTCL, bei denen weder Zydelig noch Imbruvica wirkt.

Bei der pi3k-Delta Hemmung wäre TGTX's TGR-1202 eine Alternative. Manche sehen es als Vorteil, dass TGTX zudem einen CD20-AK in der Entwicklung hat, da diese sich gut kombinieren lassen. Ich denke aber, dass es nicht so einfach sein wird, gleich zwei neue Mittel auf den Markt zu bringen, bei denen es sowohl für pi3k-Delta als auch für CD20-AK gute Alternativen gibt.
Interessant fand ich zuletzt aber bei TGTX, dass sie von LGND das IRAK4-Programm übernommen haben. Ich hatte mal gelesen, dass IRAK4 synergetisch mit BTK wie Imbruvica ist bzw. IRAK4 ein Resistenz-Mechanismus gegen die BTK-Hemmung ist. IRAK4 finde ich daher sinnvoll.

Gruß
ipollit

Viele sehen die IPI-145 wegen der Hemmung von pi3k-Gamma kritisch, weil dies auch Nebenwirkungen für das Immunsystem mit sich bringt. Allerdings könnte Gamma auch positive Effekte haben. Die Hemmung von delta ist zudem größer als bei GILD's Zydelig. Ich habe darauf spekuliert, dass IPI-145 eines der besten Mittel gegen iNHL sein wird. Außerdem wirkt es über Gamma auch gegen T-Zell Krebsarten wie PTCL oder CTCL, bei denen weder Zydelig noch Imbruvica wirkt.
Bei der pi3k-Delta Hemmung wäre TGTX's TGR-1202 eine Alternative. Manche sehen es als Vorteil, dass TGTX zudem einen CD20-AK in der Entwicklung hat, da diese sich gut kombinieren lassen. Ich denke aber, dass es nicht so einfach sein wird, gleich zwei neue Mittel auf den Markt zu bringen, bei denen es sowohl für pi3k-Delta als auch für CD20-AK gute Alternativen gibt.
Interessant fand ich zuletzt aber bei TGTX, dass sie von LGND das IRAK4-Programm übernommen haben. Ich hatte mal gelesen, dass IRAK4 synergetisch mit BTK wie Imbruvica ist bzw. IRAK4 ein Resistenz-Mechanismus gegen die BTK-Hemmung ist. IRAK4 finde ich daher sinnvoll.
Gruß
ipollit
IPH.PA
EffiKIR-Daten nächstes Jahr von Lirilumab in AML könnten für eine Zulassung ausreichen, wenn sie positiv ausfallen:

***

Gruß
ipollit
EffiKIR-Daten nächstes Jahr von Lirilumab in AML könnten für eine Zulassung ausreichen, wenn sie positiv ausfallen:

***

Gruß
ipollit
MDVN
die Xtandi-Zahlen waren zwar durch Astellas schon bekannt... insgesamt läuft es sehr gut mit MDVN:
"raises Xtandi 2014 US sales guidance from $500-535M to $600-640M... drops expense guidance from $460-485M to $400-430M."
PDFUA-Datum für die offizielle Pre-Chemo Zulassung ist 18. September. Xtandi wird wohl rasch ein Blockbuster werden. Langfristig könnten 5+ Mrd USD Umsatz drin sein.

Gruß
ipollit
die Xtandi-Zahlen waren zwar durch Astellas schon bekannt... insgesamt läuft es sehr gut mit MDVN:
"raises Xtandi 2014 US sales guidance from $500-535M to $600-640M... drops expense guidance from $460-485M to $400-430M."
PDFUA-Datum für die offizielle Pre-Chemo Zulassung ist 18. September. Xtandi wird wohl rasch ein Blockbuster werden. Langfristig könnten 5+ Mrd USD Umsatz drin sein.
Gruß
ipollit
CLVS
bei Clovis läuft bisher auch alles nach Plan... ich denke, dass die Stimmung zuletzt zu negativ war und habe meine Position weiter erhöht.
Die nächsten Daten zu Rociletinib (CO-1686) sollen zum EORTC-AACR-NCI Symposium Mitte November kommen.

Gruß
ipollit
bei Clovis läuft bisher auch alles nach Plan... ich denke, dass die Stimmung zuletzt zu negativ war und habe meine Position weiter erhöht.
Die nächsten Daten zu Rociletinib (CO-1686) sollen zum EORTC-AACR-NCI Symposium Mitte November kommen.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.472.046 von ipollit am 08.08.14 18:51:32MDVN
hier noch ein Analysten-Kommentar...

Gruß
ipollit
hier noch ein Analysten-Kommentar...

Gruß
ipollit
Antwort auf Beitrag Nr.: 47.475.688 von ipollit am 09.08.14 12:46:53MDVN
Ensprechend dem Folgenden ist Xtandi in Brustkrebs sehr spekulativ... daher sind die Erwartungen dort recht niedrig:
"Xtandi and Zytiga are being tested in two sub-populations within breast cancer. The first is triple- negative breast cancer that is positive for androgen receptor expression, which accounts for ~3% of breast cancer. The second is ER+/Her2- breast cancer, which accounts for ~45% of breast cancer.
The role of AR signaling is TNC is based on limited preclinical data. In 2005-2006, two research groups used microarray analysis to identify a breast cancer subtype characterized by negative ER and positive AR expression (ER-/AR+). One of the groups, at Memorial Sloan Kettering, also showed that ER-/AR+ breast cancer cell lines proliferated in response to androgens, and the proliferation was inhibited by an anti-androgen.
Results from phase II study testing Xtandi predecessor bicalutamide in AR+ TNC were underwhelming. The study, conducted by the Memorial group, took five years and enrolled 26 patients who had ER-/AR+ breast cancer. Of the 26 patients, none achieved complete or partial response, and only 5 achieved stable disease greater than 6 months; median PFS was 12 weeks.
Xtandi and Zytiga are more likely than bicalutamide to show benefit in AR+ TNC. Both drugs are being tested in small phase II studies based on the belief that they are more effective at inhibiting AR signaling. We expect readout from these studies in late 2014 to the first half of 2015. Assuming androgen signaling does play a role in AR+ TNBC in humans, we would expect Xtandi and Zytiga to show a clinical benefit in these studies in this patient population.
Pre-clinical data demonstrate conflicting roles of AR signaling in ER-positive breast cancer. In ER+ tumors, estrogen signaling is the predominant oncogenic pathway, while androgen signaling is thought to act in a tumorsuppressive fashion. Therefore, it would seem paradoxical that blocking AR signaling would inhibit the growth of this cancer subtype. On the other hand, a group from the University of Denver, in collaboration with MDVN, recently published contrasting evidence, suggesting that Xtandi decreased estrogen-mediated growth of ER+/AR+ breast cancer, while bicalutamide had the opposite effect. The latest data are based on cell lines and xenografts, and have not been independently verified or proven in human studies. Experts we consulted believe the role of AR signaling in ER+ breast cancer is very much open to debate and the potential of this research is highly speculative.
Both Xtandi and Zytiga are being tested in initial proof-of-concept studies in ER+/Her2- breast cancer. In both studies, the androgen inhibitor is being given on top of the aromatase inhibitor exemestane vs. exemestane alone. In a prior drug-drug interaction study, Xtandi was shown to reduce exposure to exemestane by 40%; to compensate, exemestane dosage was doubled in the combination arm, which could lead to issues in interpreting the results. Both the Xtandi and Zytiga trials are enrolling ER+/Her2- breast cancer patients regardless of AR status, even though preclinical data from the U of Denver group were based on ER+/AR+ cell lines. This suggests that the companies and study investigators may have limited understanding of the role of AR signaling in ER+ breast cancer patients. Experts we consulted were highly skeptical that either study would lead to a positive outcome.
Revenue opportunity for Xtandi in breast cancer pales in comparison to opportunity in prostate cancer. According to published literature, AR positivity is identified in 11-30% of Triple Negative BC cases, or 2-5% of all breast cancer cases. As the total incidence of breast cancer and prostate cancer is similar, the simplistic view of the revenue opportunity in TNBC may be as little as 1/30th of the opportunity in metastatic prostate cancer (where all patients are likely to be eligible for androgen inhibition). Considering the need for a confirmatory phase III study, the earliest launch of any breast cancer indication would be in the 2018-2019 timeframe. We believe it is too early to ascribe any value to MDVN based on the breast cancer indications, and at this stage it is hard to see Xtandi being competitive with the many targeted agents in development for the many subsets of breast cancer."
Gruß
ipollit
Ensprechend dem Folgenden ist Xtandi in Brustkrebs sehr spekulativ... daher sind die Erwartungen dort recht niedrig:
"Xtandi and Zytiga are being tested in two sub-populations within breast cancer. The first is triple- negative breast cancer that is positive for androgen receptor expression, which accounts for ~3% of breast cancer. The second is ER+/Her2- breast cancer, which accounts for ~45% of breast cancer.
The role of AR signaling is TNC is based on limited preclinical data. In 2005-2006, two research groups used microarray analysis to identify a breast cancer subtype characterized by negative ER and positive AR expression (ER-/AR+). One of the groups, at Memorial Sloan Kettering, also showed that ER-/AR+ breast cancer cell lines proliferated in response to androgens, and the proliferation was inhibited by an anti-androgen.
Results from phase II study testing Xtandi predecessor bicalutamide in AR+ TNC were underwhelming. The study, conducted by the Memorial group, took five years and enrolled 26 patients who had ER-/AR+ breast cancer. Of the 26 patients, none achieved complete or partial response, and only 5 achieved stable disease greater than 6 months; median PFS was 12 weeks.
Xtandi and Zytiga are more likely than bicalutamide to show benefit in AR+ TNC. Both drugs are being tested in small phase II studies based on the belief that they are more effective at inhibiting AR signaling. We expect readout from these studies in late 2014 to the first half of 2015. Assuming androgen signaling does play a role in AR+ TNBC in humans, we would expect Xtandi and Zytiga to show a clinical benefit in these studies in this patient population.
Pre-clinical data demonstrate conflicting roles of AR signaling in ER-positive breast cancer. In ER+ tumors, estrogen signaling is the predominant oncogenic pathway, while androgen signaling is thought to act in a tumorsuppressive fashion. Therefore, it would seem paradoxical that blocking AR signaling would inhibit the growth of this cancer subtype. On the other hand, a group from the University of Denver, in collaboration with MDVN, recently published contrasting evidence, suggesting that Xtandi decreased estrogen-mediated growth of ER+/AR+ breast cancer, while bicalutamide had the opposite effect. The latest data are based on cell lines and xenografts, and have not been independently verified or proven in human studies. Experts we consulted believe the role of AR signaling in ER+ breast cancer is very much open to debate and the potential of this research is highly speculative.
Both Xtandi and Zytiga are being tested in initial proof-of-concept studies in ER+/Her2- breast cancer. In both studies, the androgen inhibitor is being given on top of the aromatase inhibitor exemestane vs. exemestane alone. In a prior drug-drug interaction study, Xtandi was shown to reduce exposure to exemestane by 40%; to compensate, exemestane dosage was doubled in the combination arm, which could lead to issues in interpreting the results. Both the Xtandi and Zytiga trials are enrolling ER+/Her2- breast cancer patients regardless of AR status, even though preclinical data from the U of Denver group were based on ER+/AR+ cell lines. This suggests that the companies and study investigators may have limited understanding of the role of AR signaling in ER+ breast cancer patients. Experts we consulted were highly skeptical that either study would lead to a positive outcome.
Revenue opportunity for Xtandi in breast cancer pales in comparison to opportunity in prostate cancer. According to published literature, AR positivity is identified in 11-30% of Triple Negative BC cases, or 2-5% of all breast cancer cases. As the total incidence of breast cancer and prostate cancer is similar, the simplistic view of the revenue opportunity in TNBC may be as little as 1/30th of the opportunity in metastatic prostate cancer (where all patients are likely to be eligible for androgen inhibition). Considering the need for a confirmatory phase III study, the earliest launch of any breast cancer indication would be in the 2018-2019 timeframe. We believe it is too early to ascribe any value to MDVN based on the breast cancer indications, and at this stage it is hard to see Xtandi being competitive with the many targeted agents in development for the many subsets of breast cancer."
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.475.925 von ipollit am 09.08.14 13:29:40MDVN / MGNX
andererseits gibt es Ansätze für eine Xtandi + IO Kombi... z.B. mit PD-1:
"The positive PREVAIL data of Xtandi in the pre-chemo setting was presented at the ASCO-GU. The meeting also featured a presentation by Dr. James Gulley highlighting the "compelling" rationale for the combination of a hormonal agent like Xtandi with immuno-oncology (IO) agents in prostate cancer. The commentary is highly consistent with our previous discussions with KOLs and provides supportive data. We believe this supports our view for potential combination of Xtandi with immunotherapy, which could increase its importance in prostate cancer as a result of further development of checkpoint inhibitors. We believe Xtandi's lack of requirement for concomitant steroid, which is at least suboptimal and potentially incompatible for use with immunotherapy, represents a fundamental differentiation vs. Zytiga in addition to other advantages. We believe this positions Xtandi well even in a generic Zytiga environment.
Biological rationale to combine immunotherapy with hormonal therapy is "particularly strong". Immuno-oncology (IO) KOLs have suggested that the most compelling combination of checkpoint inhibitors may be with hormonal agents. Androgen blockade has been shown to activate thymic regeneration in mice and humans, therefore is an immunologically active intervention. In addition, androgen blockade was shown to traffic T-cells to the human prostate with 3 weeks of initiation. A recently published National Cancer Institute study with Xtandi specifically showed that Xtandi enlarged thymus and improved survival in combination with a cancer vaccine in a preclinical model."
Hier findet sich auch einen Zusammenhang zwischen Xtandi (Enzalutamide) und IO:
http://www.immunotherapyofcancer.org/content/pdf/2051-1426-1…
In diesem Zusammenhang wird auch B7H3 als Target erwähnt: "Moreover, a greater frequency of neuroendocrine-like ENZ resistant cells expressed PD-L1, PD-L2 and ICOSL, and they showed intense staining for B7H3." Hier hat MGNX einen AK in der Entwicklung, der u.a. auch speziell bei Prostatakrebs getestet wird:

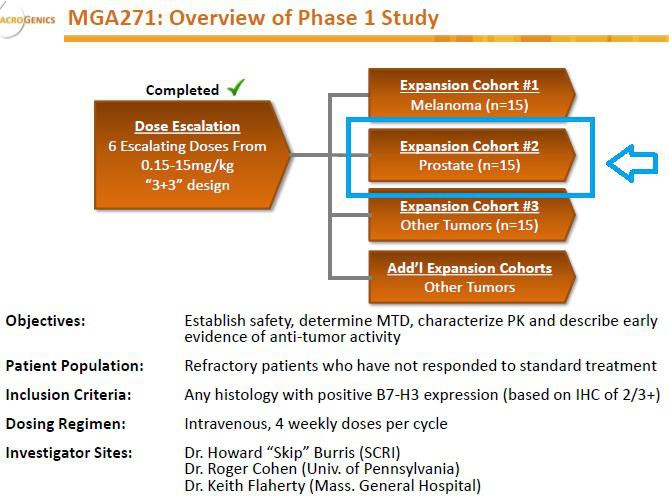
Gruß
ipollit
andererseits gibt es Ansätze für eine Xtandi + IO Kombi... z.B. mit PD-1:
"The positive PREVAIL data of Xtandi in the pre-chemo setting was presented at the ASCO-GU. The meeting also featured a presentation by Dr. James Gulley highlighting the "compelling" rationale for the combination of a hormonal agent like Xtandi with immuno-oncology (IO) agents in prostate cancer. The commentary is highly consistent with our previous discussions with KOLs and provides supportive data. We believe this supports our view for potential combination of Xtandi with immunotherapy, which could increase its importance in prostate cancer as a result of further development of checkpoint inhibitors. We believe Xtandi's lack of requirement for concomitant steroid, which is at least suboptimal and potentially incompatible for use with immunotherapy, represents a fundamental differentiation vs. Zytiga in addition to other advantages. We believe this positions Xtandi well even in a generic Zytiga environment.
Biological rationale to combine immunotherapy with hormonal therapy is "particularly strong". Immuno-oncology (IO) KOLs have suggested that the most compelling combination of checkpoint inhibitors may be with hormonal agents. Androgen blockade has been shown to activate thymic regeneration in mice and humans, therefore is an immunologically active intervention. In addition, androgen blockade was shown to traffic T-cells to the human prostate with 3 weeks of initiation. A recently published National Cancer Institute study with Xtandi specifically showed that Xtandi enlarged thymus and improved survival in combination with a cancer vaccine in a preclinical model."
Hier findet sich auch einen Zusammenhang zwischen Xtandi (Enzalutamide) und IO:
http://www.immunotherapyofcancer.org/content/pdf/2051-1426-1…
In diesem Zusammenhang wird auch B7H3 als Target erwähnt: "Moreover, a greater frequency of neuroendocrine-like ENZ resistant cells expressed PD-L1, PD-L2 and ICOSL, and they showed intense staining for B7H3." Hier hat MGNX einen AK in der Entwicklung, der u.a. auch speziell bei Prostatakrebs getestet wird:


Gruß
ipollit
Hallo ipollit, kmastra,
nochmal zurück zu EXEL: Mit Cobimetinib haben sie einen MEK-Inhibitor, der zwar relativ nahe vor der Zulassung steht (sicher nächstes Jahr), auf der anderen Seite aber offenbar bei weitem nicht so umfassend und breit entwickelt wird, wie die Konkurrenzprodukte (Mekinist und die Arry´s).
Bisher gibt es neben der Indikation Melanom für Cobi nur wenige PI-Studien:
Five phase 1 trials are now ongoing assessing the ability to combine cobimetinib with other agents. These novel combinations are being studied in patients with advanced solid tumors and in some trials entry is restricted to patients whose tumors carry specific genetic mutations. The agents being studied in combination with cobimetinib are:
GDC-0941, a PI3K inhibitor
GDC-0068, an AKT inhibitor
Onartuzumab, a MET targeting antibody
MPDL3280A, an antibody against the immune checkpoint regulator PD-L1
MEHD7945A, a biotherapeutic targeting EGFR and HER3.
Es ist inzwischen ja doch Konsens, dass MEKs ein wichtiger Baustein für alle möglichen Kombitherapien sind.
Haben Genentech/Roche das Thema etwas verschlafen? Sollte man davon ausgehen, dass künftig mehr Trials mit Cobi angeschoben werden? Könnte das Potential von Cobi nicht viel, viel größer sein, wenn man nicht so auf die Kombination mit vemurafenib verengt?
nochmal zurück zu EXEL: Mit Cobimetinib haben sie einen MEK-Inhibitor, der zwar relativ nahe vor der Zulassung steht (sicher nächstes Jahr), auf der anderen Seite aber offenbar bei weitem nicht so umfassend und breit entwickelt wird, wie die Konkurrenzprodukte (Mekinist und die Arry´s).
Bisher gibt es neben der Indikation Melanom für Cobi nur wenige PI-Studien:
Five phase 1 trials are now ongoing assessing the ability to combine cobimetinib with other agents. These novel combinations are being studied in patients with advanced solid tumors and in some trials entry is restricted to patients whose tumors carry specific genetic mutations. The agents being studied in combination with cobimetinib are:
GDC-0941, a PI3K inhibitor
GDC-0068, an AKT inhibitor
Onartuzumab, a MET targeting antibody
MPDL3280A, an antibody against the immune checkpoint regulator PD-L1
MEHD7945A, a biotherapeutic targeting EGFR and HER3.
Es ist inzwischen ja doch Konsens, dass MEKs ein wichtiger Baustein für alle möglichen Kombitherapien sind.
Haben Genentech/Roche das Thema etwas verschlafen? Sollte man davon ausgehen, dass künftig mehr Trials mit Cobi angeschoben werden? Könnte das Potential von Cobi nicht viel, viel größer sein, wenn man nicht so auf die Kombination mit vemurafenib verengt?
Antwort auf Beitrag Nr.: 47.479.870 von SLGramann am 10.08.14 17:23:16Hallo SLGramann,
vielleicht hat Roche einfach eine andere Priorität als AZN oder NOV gesetzt. Für Roche hat es sicherlich oberste Priorität gehabt, Zelboraf zu schützen. Sie waren die ersten auf dem Markt, als klar wurde, dass sich schnell Resistenzen entwickeln können und GSK eine gute Kombi mit MEK hat. Sie mussten also auch mit MEK nachlegen.
Ob MEK-Hemmer so breit wirken, ist ja noch nicht klar. Die vielen Studien kommen ja auch dadurch zustande, weil man nicht genau weiß, was funktioniert. Novartis setzt generell auf TKIs... daher die vielen TKI-Kombis. AZN testet dagegen mit Schwerpunkt eine Chemo-Kombi und speziell für die KRAS-Mutation. Bei z.B. NSCLC ist KRAS die größte bekannte Mutation, EGFR die zweit-größte. Gegen EGFR wirken die EGFR-Hemmer... bei KRAS hat man aber noch nichts zielgerichtetes. MEK wirkt theoretisch in diesem Bereich... ähnlich wie AKT oder ERK.
Roche hat z.B. HER2 als Schwerpunkt und möchte vielleicht nicht so umfangreich in MEK-Kombis einsteigen. Vielleicht machen sie das später, wenn klarer ist, womit MEK gut funktioniert.
Gruß
ipollit
vielleicht hat Roche einfach eine andere Priorität als AZN oder NOV gesetzt. Für Roche hat es sicherlich oberste Priorität gehabt, Zelboraf zu schützen. Sie waren die ersten auf dem Markt, als klar wurde, dass sich schnell Resistenzen entwickeln können und GSK eine gute Kombi mit MEK hat. Sie mussten also auch mit MEK nachlegen.
Ob MEK-Hemmer so breit wirken, ist ja noch nicht klar. Die vielen Studien kommen ja auch dadurch zustande, weil man nicht genau weiß, was funktioniert. Novartis setzt generell auf TKIs... daher die vielen TKI-Kombis. AZN testet dagegen mit Schwerpunkt eine Chemo-Kombi und speziell für die KRAS-Mutation. Bei z.B. NSCLC ist KRAS die größte bekannte Mutation, EGFR die zweit-größte. Gegen EGFR wirken die EGFR-Hemmer... bei KRAS hat man aber noch nichts zielgerichtetes. MEK wirkt theoretisch in diesem Bereich... ähnlich wie AKT oder ERK.
Roche hat z.B. HER2 als Schwerpunkt und möchte vielleicht nicht so umfangreich in MEK-Kombis einsteigen. Vielleicht machen sie das später, wenn klarer ist, womit MEK gut funktioniert.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.476.117 von ipollit am 09.08.14 14:16:00MGNX

Ohad Hammer ist ja eher skeptisch bezüglich Margetuximab. Dieser HER2-AK steht allerdings nicht in direkter Konkurrenz zu Herceptin. Letzteres wird nur bei 3+ und 2+ ampl HER2 eingesetzt, Margetuximab wird auch bei schwächerer HER2-Expression 2+ nicht ampl und 1+ getestet.
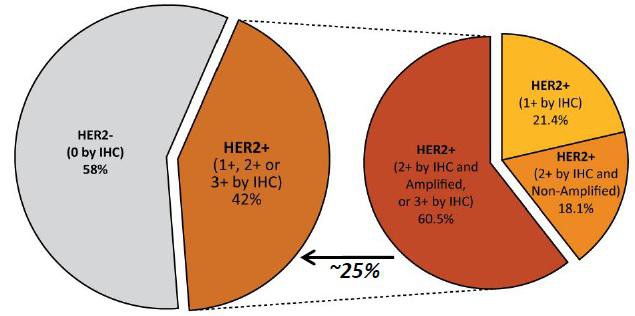
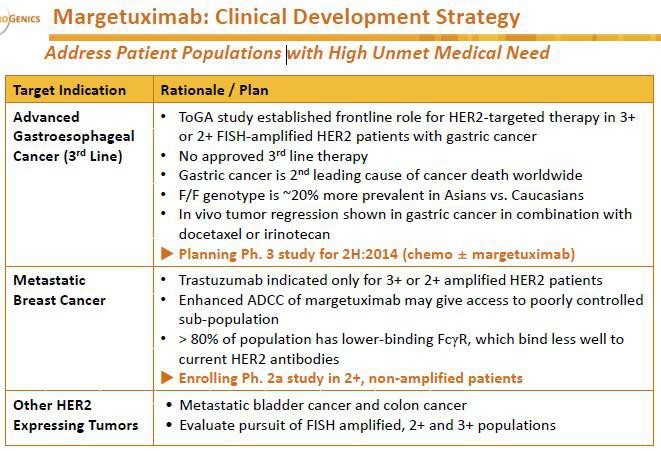
Interessiert bin ich auch am B7-H3 AK MGA271... könnte ja auch etwas in Richtung PD1 sein. Bisher habe ich keine richtigen PI-Ergebnisse gefunden, nur dass alle Patienten in der Dosisfindungs-Phase, die für eine Auswertung relevant waren, stabil waren... aber bisher kein PR/CR. Bis Ende des Jahres sollen alle Patienten in die erweiterte Phase aufgenommen worden sein... wann Ergebnisse vorliegen ist unklar, allerdings können aufgrund von Open-Label auch Zwischenergebnisse veröffentlicht werden.
Gruß
ipollit

Ohad Hammer ist ja eher skeptisch bezüglich Margetuximab. Dieser HER2-AK steht allerdings nicht in direkter Konkurrenz zu Herceptin. Letzteres wird nur bei 3+ und 2+ ampl HER2 eingesetzt, Margetuximab wird auch bei schwächerer HER2-Expression 2+ nicht ampl und 1+ getestet.


Interessiert bin ich auch am B7-H3 AK MGA271... könnte ja auch etwas in Richtung PD1 sein. Bisher habe ich keine richtigen PI-Ergebnisse gefunden, nur dass alle Patienten in der Dosisfindungs-Phase, die für eine Auswertung relevant waren, stabil waren... aber bisher kein PR/CR. Bis Ende des Jahres sollen alle Patienten in die erweiterte Phase aufgenommen worden sein... wann Ergebnisse vorliegen ist unklar, allerdings können aufgrund von Open-Label auch Zwischenergebnisse veröffentlicht werden.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.479.870 von SLGramann am 10.08.14 17:23:16Hallo SLGramann,
mir war das auch schon aufgefallen. Über die Gründe kann man nur spekulieren. Das Roche jetzt aber immerhin 5 P I Studien durchführt, finde ich positiv. Vielleicht haben sie das tatsächlich ein wenig verschlafen. Vielleicht haben sie auch wenig Kandidaten, bei denen eine Kombination den "ersten Blick" Sinn macht. Das kann sich ja aber auch immer ändern, wie ipollit schreibt.
Ohad Hammer hatte ja auch im Nachgang zur ASCO geschrieben, dass MEK eine wichtigere Rolle spielen könnten, als zunächst gedacht.
"My take from ASCO is that MEK inhibtors are going to be a much bigger class than originally thought (intersting data in BRAF+ CRC, RAS+ ovarian on top of melanoma and lung). If ARRY gets MEK162 back from NVS, this could be a transformational event. Still, I am not optimistic about filanesib."
Eine Kombination, der scheinbar auch viel zugetraut wird, ist die aus MEK und CDK4/6.
http://www.onclive.com/web-exclusives/Flaherty-Provides-Insi…
Hier hat NOV ja auch schon eine Kombination von MEK162 und Lee001 am laufen. Interessant ist, dass es ein Kollaboration zwischen Pfizer und GSK gibt, die Mekinist mit Palbociclib untersucht. Sollte sich NOV für Mekinist und gegen MEK162 entscheiden (müssen) haben sie eventuell ein Problem mit Lee001.
http://www.lgmpharma.com/blog/new-trametinib-and-palbociclib…
Mit Spannung erwarte ich die Endergebnisse (OS) von Cobimetinib mit Zelboraf. Und wie die dann im Vergleich mit der GSK-Kombi abschneiden. Diese werden wohl noch nicht auf der ESMO Ende September vorliegen. Wenn ich es richtig im Kopf habe, soll der Zulassungsantrag ja aber noch dieses Jahr eingereicht werden...
SG kmastra
mir war das auch schon aufgefallen. Über die Gründe kann man nur spekulieren. Das Roche jetzt aber immerhin 5 P I Studien durchführt, finde ich positiv. Vielleicht haben sie das tatsächlich ein wenig verschlafen. Vielleicht haben sie auch wenig Kandidaten, bei denen eine Kombination den "ersten Blick" Sinn macht. Das kann sich ja aber auch immer ändern, wie ipollit schreibt.
Ohad Hammer hatte ja auch im Nachgang zur ASCO geschrieben, dass MEK eine wichtigere Rolle spielen könnten, als zunächst gedacht.
"My take from ASCO is that MEK inhibtors are going to be a much bigger class than originally thought (intersting data in BRAF+ CRC, RAS+ ovarian on top of melanoma and lung). If ARRY gets MEK162 back from NVS, this could be a transformational event. Still, I am not optimistic about filanesib."
Eine Kombination, der scheinbar auch viel zugetraut wird, ist die aus MEK und CDK4/6.
http://www.onclive.com/web-exclusives/Flaherty-Provides-Insi…
Hier hat NOV ja auch schon eine Kombination von MEK162 und Lee001 am laufen. Interessant ist, dass es ein Kollaboration zwischen Pfizer und GSK gibt, die Mekinist mit Palbociclib untersucht. Sollte sich NOV für Mekinist und gegen MEK162 entscheiden (müssen) haben sie eventuell ein Problem mit Lee001.
http://www.lgmpharma.com/blog/new-trametinib-and-palbociclib…
Mit Spannung erwarte ich die Endergebnisse (OS) von Cobimetinib mit Zelboraf. Und wie die dann im Vergleich mit der GSK-Kombi abschneiden. Diese werden wohl noch nicht auf der ESMO Ende September vorliegen. Wenn ich es richtig im Kopf habe, soll der Zulassungsantrag ja aber noch dieses Jahr eingereicht werden...
SG kmastra
INCY
Neben JAK scheint INCY nun auch bei IDO führend zu sein. Mit 3 der 4 Pharmas, die PD-1 entwickeln, werden Kombi-Studien durchgeführt. Eine IDO-Hemmung erhöht ähnlich wie PD-1 die Körperabwehr gegen den Tumor. Dabei ist PD-1 ein Rezeptor, über den der Tumor die Immunantwort unterdrücken kann. IDO ist dagegen ein Enzym, das eine Umgebung schafft, in der T-Zellen inaktiv sind.

http://de.wikipedia.org/wiki/Indolamin-2,3-Dioxygenase
"Funktionen im Immunsystem
Sowohl die immunsuppressive als auch die immununterstützende Funktion der IDO erklären sich aus dem hohen Wert der essentiellen Aminosäure Tryptophan, die besonders während der Aktivierung von T-Zellen, aber auch von eindringenden Fremdzellen benötigt wird. Mit dem rapiden Abbau allen Tryptophans durch IDO wird in der lokalen Umgebung die Proteinsynthese effektiv lahmgelegt. Zusätzlich aktivieren die entstehenden Abbauprodukte die Erzeugung regulatorischer T-Zellen, die letztendlich für die Immunsuppression verantwortlich sind.
Immuntoleranz in Lymphknoten
Lymphknoten, die stromabwärts von einem Tumor liegen, sind sozusagen privilegiert; durch sie strömen besonders viele Tumorantigene. Es ist wichtig, dass in diesem Bereich die Immunantwort nicht überschießt, da sonst viel normales Gewebe darunter zu leiden hätte. Aus diesem Grund wird vom Körper in solchen Lymphknoten die Produktion von IDO verstärkt, um die Immunantwort zu dämpfen. Dies kann andererseits dazu führen, dass auch in Tumorgewebe verstärkt IDO produziert wird und dann Tumorantigene nicht mehr präsentiert und daher im weiteren Verlauf nicht als fremd erkannt werden. Tatsächlich wird IDO in mehreren Krebszelllinien überexprimiert. Man versucht daher, eine bessere Krebsbekämpfung durch Hemmung der IDO zu erreichen.[27]
Derselbe Mechanismus ist die Ursache, wenn chronische Infektionen lokales Tumorwachstum erleichtern, denn auch hier produzieren die stromabwärts gelegenen Lymphknoten unterhalb des Infektionsherds vermehrt IDO und verhindern dadurch eine vollständige Immunantwort durch T-Zellen. Mäuse mit verringerter IDO-Produktion zeigten dieses Phänomen nicht."
***
Durch IDO-Hemmung wird also verhindert, dass vermehrt regulatorische T-Zellen in der Tumorumgebung auftreten, die das Immunsystem herunterregeln. Stattdessen können T-Zellen gebildet werden, die den Tumor angreifen. In einer Umgebung mit einem hohen Treg Anteil ist die Wirkung von PD-1 AKs also deutlich eingeschränkt... daraus ergibt sich der Kombi-Ansatz von PD-1 + IDO.
Gruß
ipollit
Neben JAK scheint INCY nun auch bei IDO führend zu sein. Mit 3 der 4 Pharmas, die PD-1 entwickeln, werden Kombi-Studien durchgeführt. Eine IDO-Hemmung erhöht ähnlich wie PD-1 die Körperabwehr gegen den Tumor. Dabei ist PD-1 ein Rezeptor, über den der Tumor die Immunantwort unterdrücken kann. IDO ist dagegen ein Enzym, das eine Umgebung schafft, in der T-Zellen inaktiv sind.

http://de.wikipedia.org/wiki/Indolamin-2,3-Dioxygenase
"Funktionen im Immunsystem
Sowohl die immunsuppressive als auch die immununterstützende Funktion der IDO erklären sich aus dem hohen Wert der essentiellen Aminosäure Tryptophan, die besonders während der Aktivierung von T-Zellen, aber auch von eindringenden Fremdzellen benötigt wird. Mit dem rapiden Abbau allen Tryptophans durch IDO wird in der lokalen Umgebung die Proteinsynthese effektiv lahmgelegt. Zusätzlich aktivieren die entstehenden Abbauprodukte die Erzeugung regulatorischer T-Zellen, die letztendlich für die Immunsuppression verantwortlich sind.
Immuntoleranz in Lymphknoten
Lymphknoten, die stromabwärts von einem Tumor liegen, sind sozusagen privilegiert; durch sie strömen besonders viele Tumorantigene. Es ist wichtig, dass in diesem Bereich die Immunantwort nicht überschießt, da sonst viel normales Gewebe darunter zu leiden hätte. Aus diesem Grund wird vom Körper in solchen Lymphknoten die Produktion von IDO verstärkt, um die Immunantwort zu dämpfen. Dies kann andererseits dazu führen, dass auch in Tumorgewebe verstärkt IDO produziert wird und dann Tumorantigene nicht mehr präsentiert und daher im weiteren Verlauf nicht als fremd erkannt werden. Tatsächlich wird IDO in mehreren Krebszelllinien überexprimiert. Man versucht daher, eine bessere Krebsbekämpfung durch Hemmung der IDO zu erreichen.[27]
Derselbe Mechanismus ist die Ursache, wenn chronische Infektionen lokales Tumorwachstum erleichtern, denn auch hier produzieren die stromabwärts gelegenen Lymphknoten unterhalb des Infektionsherds vermehrt IDO und verhindern dadurch eine vollständige Immunantwort durch T-Zellen. Mäuse mit verringerter IDO-Produktion zeigten dieses Phänomen nicht."
***
Durch IDO-Hemmung wird also verhindert, dass vermehrt regulatorische T-Zellen in der Tumorumgebung auftreten, die das Immunsystem herunterregeln. Stattdessen können T-Zellen gebildet werden, die den Tumor angreifen. In einer Umgebung mit einem hohen Treg Anteil ist die Wirkung von PD-1 AKs also deutlich eingeschränkt... daraus ergibt sich der Kombi-Ansatz von PD-1 + IDO.
Gruß
ipollit
PCYC
im Folgenden wird nochmal beschrieben, dass Imbruvica wahrscheinlich in Zukunft die dominate Rolle spielen wird und Ansatz für alle möglichen anderen Therapien ist.
Interessant ist auch wieder der Verweis darauf, dass Imbruvica offensichtlich kein reiner BTK-Hemmer ist. Laut Versuchen gibt es CLL-Subsets, die nicht von einer BTK-Mutation abhängen und bei denen Imbruvica eigentlich nicht wirken dürfte. Da es aber dennoch wirkt, scheint es neben BTK auch auf etwas anderes einen Effekt zu haben. Hier wird ITK genannt... diesen Zusammenhang habe ich vor längerer Zeit bereits schonmal gefunden und soweit ich mich erinnere hat ITK auch immunologische Eigenschaften, was zu einer lang anhaltenden Wirkung führen kann. Jedenfalls könnte daher Imbruvica anderen BTK-Hemmern in der Entwicklung überlegen sein, auch wenn diese stärker BTK hemmen sollten.
Desweiteren ist die Erwähnung von AKT interessant... laut Ohad Hammer soll ja ARQL hier einen aussichtsreichen Kandidaten haben, der zuletzt von ARQL auch priorisiert wurde.

Gruß
ipollit
im Folgenden wird nochmal beschrieben, dass Imbruvica wahrscheinlich in Zukunft die dominate Rolle spielen wird und Ansatz für alle möglichen anderen Therapien ist.
Interessant ist auch wieder der Verweis darauf, dass Imbruvica offensichtlich kein reiner BTK-Hemmer ist. Laut Versuchen gibt es CLL-Subsets, die nicht von einer BTK-Mutation abhängen und bei denen Imbruvica eigentlich nicht wirken dürfte. Da es aber dennoch wirkt, scheint es neben BTK auch auf etwas anderes einen Effekt zu haben. Hier wird ITK genannt... diesen Zusammenhang habe ich vor längerer Zeit bereits schonmal gefunden und soweit ich mich erinnere hat ITK auch immunologische Eigenschaften, was zu einer lang anhaltenden Wirkung führen kann. Jedenfalls könnte daher Imbruvica anderen BTK-Hemmern in der Entwicklung überlegen sein, auch wenn diese stärker BTK hemmen sollten.
Desweiteren ist die Erwähnung von AKT interessant... laut Ohad Hammer soll ja ARQL hier einen aussichtsreichen Kandidaten haben, der zuletzt von ARQL auch priorisiert wurde.

Gruß
ipollit
Hallo ipollit und kmastra, vielen Dank für eure Statements zu Cobimetinib bzw. Roche/Genentech. Das Fazit von Hammer in Bezug auf MEKs und die letzte ASCO hatte ich noch im Hinterkopf. Vielleicht sehen wir bei Roche in Zukunft (noch) mehr Engagement in Bezug auf Cobi.
ARRY:
Also, ich habe heute meine Position wieder deutlich ausgebaut. Mir gefällt zwar nicht, dass sie in absehbarer Zukunft eine KE brauchen, was bei der mickrigen Marktkap. zu einer beachtlichen Verwässerung führen wird, aber auf der anderen Seite finde ich die Bewertung mit Blick auf Binimetinib und Selumetinib wirklich arg unangemessen.
Natürlich ist die Unsicherheit bei Bini sehr unschön, aber man muss "den Markt" ja auch mal fragen, wie niedrig er diese Programme denn eigentlich bewerten will?
Meiner Meinung nach lässt sich die gegenwärtige Marktkapitalisierung schon allein durch Selumetinib mehr als rechtfertigen.
Ist es sinnvoll, Bini mit Null zu bewerten, nur weil das Risiko besteht, dass dieses PIII-Asset mit einer nicht eben niedrigen Chance auf Zulassung binnen 18 Monaten komplett an Array zurückfallen könnte?
Ich finde wirklich, dass das Spinnerei ist.
Grüße
SLG
PS: Mir wäre es inzwischen ganz lieb, wenn man die Filanesib-PIII zurückstellen würde. Ist zu teuer und so lange man das nicht konsequent auf AAG-low-Patienten konzentriert, sehe ich da eh keinen großen Sinn drin.
ARRY:
Also, ich habe heute meine Position wieder deutlich ausgebaut. Mir gefällt zwar nicht, dass sie in absehbarer Zukunft eine KE brauchen, was bei der mickrigen Marktkap. zu einer beachtlichen Verwässerung führen wird, aber auf der anderen Seite finde ich die Bewertung mit Blick auf Binimetinib und Selumetinib wirklich arg unangemessen.
Natürlich ist die Unsicherheit bei Bini sehr unschön, aber man muss "den Markt" ja auch mal fragen, wie niedrig er diese Programme denn eigentlich bewerten will?
Meiner Meinung nach lässt sich die gegenwärtige Marktkapitalisierung schon allein durch Selumetinib mehr als rechtfertigen.
Ist es sinnvoll, Bini mit Null zu bewerten, nur weil das Risiko besteht, dass dieses PIII-Asset mit einer nicht eben niedrigen Chance auf Zulassung binnen 18 Monaten komplett an Array zurückfallen könnte?
Ich finde wirklich, dass das Spinnerei ist.
Grüße
SLG
PS: Mir wäre es inzwischen ganz lieb, wenn man die Filanesib-PIII zurückstellen würde. Ist zu teuer und so lange man das nicht konsequent auf AAG-low-Patienten konzentriert, sehe ich da eh keinen großen Sinn drin.
Antwort auf Beitrag Nr.: 47.508.409 von SLGramann am 13.08.14 20:34:32Hallo SLGramann,
dein Wunsch bzgl. Filanesib könnte sich recht schnell erfüllen. Amgen gab grade bekannt, dass der FOCUS trial den Endpunkt (OS) nicht erreicht hat.
Ich kann mir eigentlich nicht vorstellen, dass ARRY unter diesen Voraussetzungen eine P III startet. Wird Kyprolis so überhaupt z.B. in der EU zugelassen? Oder wie siehst du das?
https://finance.yahoo.com/news/amgen-announces-top-line-resu…
SG kmastra
dein Wunsch bzgl. Filanesib könnte sich recht schnell erfüllen. Amgen gab grade bekannt, dass der FOCUS trial den Endpunkt (OS) nicht erreicht hat.
Ich kann mir eigentlich nicht vorstellen, dass ARRY unter diesen Voraussetzungen eine P III startet. Wird Kyprolis so überhaupt z.B. in der EU zugelassen? Oder wie siehst du das?
https://finance.yahoo.com/news/amgen-announces-top-line-resu…
SG kmastra
Hi! Ja, habe mich das auch schon gefragt...
Die Fila-PIII müsste eigentlich auf FOCUS basieren... rrMM. Welche Relevanz hätten positive Ergebnisse, wenn Kyprolis Mono als der Kontrollarm hier zumindest bezügl. OS keinen bewiesen Vorteil gezeigt hat?
Ich habe mir auch noch mal frühere Kommentare zu FOCUS angesehen... diese Studie war als High Risk eingestuft. Die (wie nun gezeigt berechtigte) Sorge war, dass FOCUS gegen einen aktiven Arm testet, der manchmal aber ein gutes Ansprechen zeigt. Außerdem konnten Patienten bei nicht Ansprechen auf neue Mittel wechseln wie z.B. Pomalyst. Dies alles kann einen deutlichen Einfluss aus OS haben.
Seit einiger Zeit hatte ich auch den Eindruck, dass CELGs Pomalyst sich gegen Kyprolis durchsetzt. Das macht eine PIII auf Basis von Kyprolis nicht gerade besser. Dass FOCUS fehlgeschlagen ist, heißt allerdings wohl nicht, dass Kyprolis dort keine Anwendung mehr findet... hat die FDA nicht vorzeitig zugelassen aufgrund von RR? Allerdings ist es für Kyprolis nicht gerade von Vorteil, dort kein OS-Vorteil im Label zu haben.
Ist es richtig, dass ARRY-614 (auf unbestimmte Zeit) nicht weiterentwickelt wird?
Ich hoffe ja immer noch auf ARRY-380... das kann aber dauern. Wie sieht es mit dem AKT-Hemmer Ipataserib von Genentech aus?... ist der vielleicht auch schon in zulassungsrelevanten Studien?... z.B. triple neg BC PII (N=120) mit Daten 2016.
Umfasst die Kooperation mit LOXO weit mehr als PanTrk? "The agreement gives Loxo rights to Array’s Trk inhibitor program, as well as additional undisclosed novel oncology targets. ... Loxo has target exclusivity on 12 designated discovery targets, of which six are to be selected for additional study on or before January 2015, which will be reduced to four on or before October 2015 (Loxo has the option to increase the total candidate selection number to five)."
Gruß
ipollit
Die Fila-PIII müsste eigentlich auf FOCUS basieren... rrMM. Welche Relevanz hätten positive Ergebnisse, wenn Kyprolis Mono als der Kontrollarm hier zumindest bezügl. OS keinen bewiesen Vorteil gezeigt hat?
Ich habe mir auch noch mal frühere Kommentare zu FOCUS angesehen... diese Studie war als High Risk eingestuft. Die (wie nun gezeigt berechtigte) Sorge war, dass FOCUS gegen einen aktiven Arm testet, der manchmal aber ein gutes Ansprechen zeigt. Außerdem konnten Patienten bei nicht Ansprechen auf neue Mittel wechseln wie z.B. Pomalyst. Dies alles kann einen deutlichen Einfluss aus OS haben.
Seit einiger Zeit hatte ich auch den Eindruck, dass CELGs Pomalyst sich gegen Kyprolis durchsetzt. Das macht eine PIII auf Basis von Kyprolis nicht gerade besser. Dass FOCUS fehlgeschlagen ist, heißt allerdings wohl nicht, dass Kyprolis dort keine Anwendung mehr findet... hat die FDA nicht vorzeitig zugelassen aufgrund von RR? Allerdings ist es für Kyprolis nicht gerade von Vorteil, dort kein OS-Vorteil im Label zu haben.
Ist es richtig, dass ARRY-614 (auf unbestimmte Zeit) nicht weiterentwickelt wird?
Ich hoffe ja immer noch auf ARRY-380... das kann aber dauern. Wie sieht es mit dem AKT-Hemmer Ipataserib von Genentech aus?... ist der vielleicht auch schon in zulassungsrelevanten Studien?... z.B. triple neg BC PII (N=120) mit Daten 2016.
Umfasst die Kooperation mit LOXO weit mehr als PanTrk? "The agreement gives Loxo rights to Array’s Trk inhibitor program, as well as additional undisclosed novel oncology targets. ... Loxo has target exclusivity on 12 designated discovery targets, of which six are to be selected for additional study on or before January 2015, which will be reduced to four on or before October 2015 (Loxo has the option to increase the total candidate selection number to five)."
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.513.710 von ipollit am 14.08.14 11:50:02Hallo ipollit,
mal sehen, wie und ob sich ARRY dazu jetzt äußert. Ich denke man wird die laufenden PII Studien abwarten und hoffe, dass man dann eine vernünftige Entscheidung trifft. Die Kombination mit Kyprolis weiter zu verfolgen wäre m.E, unvernünftig. Vielleicht ja doch als Singleagent mit AAG als Biomarker?
Given the potential return of binimetinib and the value proposition that would represent to Array, we have re-examined our priorities. And as a result, Array has no plans to invest internally at this time in Array's 614, our p38/Tie2 inhibitor for the treatment of myelodysplastic syndromes. In addition, Array has no plans at this time to invest internally in ARRY-502, a CRTh2 receptor antagonist for the treatment of asthma, and we'll only provide updates on 502 if Array finalizes the collaboration on this program in the future.
http://seekingalpha.com/article/2415775-array-biopharmas-arr…
Ja, 614 wird nicht weiter verfolgt, was ich so oder so begrüße. Interessant, dass ARRY auf dem CC zum Q2 weiter sehr offensiv (auch im Q&A) mit der Rückgabe von Binimetinib umgegangen ist. Was mich etwas verunsichert, ist zum einen das die das tun (Wäre eine gewisse Zurückhaltung nicht angebracht?/ Planungen kann man ja im Hintergrund machen). Zum anderen hoffe ich sehr, dass der Vertrag das Ganze sehr eindeutig regelt. Irgendwie glaube ich besonders bei der Finanzierung der laufenden Studien nicht so ganz dran.
ARRY gab jetzt auch bekannt, dass sie im Rahmen der Kooperation 1,6 Millionen Aktien von Loxo bekommen haben. Das sind immerhin 10% und zur Zeit 20 Mio$ wert.
Auch komisch, dass Loxo mit 200 Mio bewetet wird (mit LOXO101 als wichtigstem Asset). Ebenso kommt Onty auf eine Bewertung von 200 Mio vor allem durch ONTy380. ARRY kommt auf 500 Mio und das obwohl sie u.A. noch 2 MEKs in der PIII haben.
Ich sehe es insgesamt wie SLGramann, dass alleine Selumetinib das Risiko bei ARRY begrenzt. Die Beteiligung scheint insgesamt im niderigen doubledigit Bereich zu sein, was ich o.k. finde. AZ hat jetzt zudem noch Kombinationsstudien mit MEDI4736 und AZD9291 auf den Weg gebracht...
SG kmastra
mal sehen, wie und ob sich ARRY dazu jetzt äußert. Ich denke man wird die laufenden PII Studien abwarten und hoffe, dass man dann eine vernünftige Entscheidung trifft. Die Kombination mit Kyprolis weiter zu verfolgen wäre m.E, unvernünftig. Vielleicht ja doch als Singleagent mit AAG als Biomarker?
Given the potential return of binimetinib and the value proposition that would represent to Array, we have re-examined our priorities. And as a result, Array has no plans to invest internally at this time in Array's 614, our p38/Tie2 inhibitor for the treatment of myelodysplastic syndromes. In addition, Array has no plans at this time to invest internally in ARRY-502, a CRTh2 receptor antagonist for the treatment of asthma, and we'll only provide updates on 502 if Array finalizes the collaboration on this program in the future.
http://seekingalpha.com/article/2415775-array-biopharmas-arr…
Ja, 614 wird nicht weiter verfolgt, was ich so oder so begrüße. Interessant, dass ARRY auf dem CC zum Q2 weiter sehr offensiv (auch im Q&A) mit der Rückgabe von Binimetinib umgegangen ist. Was mich etwas verunsichert, ist zum einen das die das tun (Wäre eine gewisse Zurückhaltung nicht angebracht?/ Planungen kann man ja im Hintergrund machen). Zum anderen hoffe ich sehr, dass der Vertrag das Ganze sehr eindeutig regelt. Irgendwie glaube ich besonders bei der Finanzierung der laufenden Studien nicht so ganz dran.
ARRY gab jetzt auch bekannt, dass sie im Rahmen der Kooperation 1,6 Millionen Aktien von Loxo bekommen haben. Das sind immerhin 10% und zur Zeit 20 Mio$ wert.
Auch komisch, dass Loxo mit 200 Mio bewetet wird (mit LOXO101 als wichtigstem Asset). Ebenso kommt Onty auf eine Bewertung von 200 Mio vor allem durch ONTy380. ARRY kommt auf 500 Mio und das obwohl sie u.A. noch 2 MEKs in der PIII haben.
Ich sehe es insgesamt wie SLGramann, dass alleine Selumetinib das Risiko bei ARRY begrenzt. Die Beteiligung scheint insgesamt im niderigen doubledigit Bereich zu sein, was ich o.k. finde. AZ hat jetzt zudem noch Kombinationsstudien mit MEDI4736 und AZD9291 auf den Weg gebracht...
SG kmastra
arry:
Da arry 520 recht gut mit Kyprolis kombinierbar war und Wirksamkeit gezeigt hat, könnte AMGNs Interesse an der Kombination nach den Resultaten der FOCUS-Studie gestiegen sein.
A
Da arry 520 recht gut mit Kyprolis kombinierbar war und Wirksamkeit gezeigt hat, könnte AMGNs Interesse an der Kombination nach den Resultaten der FOCUS-Studie gestiegen sein.
A
Antwort auf Beitrag Nr.: 47.517.934 von Axel_Olsson am 14.08.14 17:34:10"ARRY-520 und Kyprolis gut kombinierbar"
...naja, ich kenne aber bisher keinen biologischen Grund, warum man diese beiden unbedingt kombinieren muss. Wo soll der Unterschied zwischen einer Kombi mit Kyprolis, Pomalyst oder Velcade liegen? Da gibt es keinen biologischen Unterschied.
Die Kombination mit Kyprolis ist eher strategisch, soweit ich es verstehe. Kyprolis ist in Europa noch nicht zugelassen (ist eine Zulassung ohne FOCUS nun noch möglich?)... über die PIII-Studie erhält man schon vor der Zulassung Zugang zu Kyprolis und das sicher, da es ja in beiden Armen enthalten ist. Somit hofft man darauf, dass ein hohes Interesse an dieser Studie entsteht und man sie schnell durchführen kann.
Pomalyst ist dagegen zugelassen, dafür muss man an keiner Studie teilnehmen. Velcade sowieso. Jetzt muss man vielleicht hoffen, dass ein Interesse entsteht, nach Anwendung von Velcade und Pomalyst. Allerdings kommen ja auch noch viele weitere neue Mittel: Der Nachfolger von den drei oben genannten ist mit Ixazomib bereits in der PIII... als wirksames orales Mittel kann es alle anderen verdrängen. Und dann gibt es noch die neuen Antikörper-Mittel wie CD38 oder hoffentlich auch PD-1&Co.
Das wichtigste Mittel soll allerdings CELG's Revlimid sein. Wie funktioniert das mit ARRY-520? Gut an ARRY-520 ist, dass es eine völlig neue Klasse ist, soweit ich das sehe. Unschön finde ich die AAG-Geschichte. AAG (alpha-1-acid glycoprotein) bindet ARRY-520. Warum lässt sich dann nicht ARRY-520 entsprechend angepasst an AAG dosieren? Welche Rolle spielt AAG im Verlauf der Krankheit? Gibt es Medikamente die AAG senken? z.B habe ich mal gegoogelt, ob z.B. Revlimid einen Einluss auf AAG hat. Dabei habe ich einen seltsamen Verweis auf AAG gefunden: http://www.ehoonline.org/content/1/1/27 "Both lenalidomide and thalidomide inhibit TNFalpha production by increasing the degradation of TNFalpha mRNA and by increasing the activity of alpha-1-acid glycoproteins, which have intrinsic anti-TNFalpha activity" und weiter http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2779346/"block the increased secretion of tumour necrosis factor alpha (TNF-a) by either enhancing TNF-a mRNA degradation or neutralising a1-acid glycoprotein, a stimulator of TNF-a secretion" ... http://www.ncbi.nlm.nih.gov/pubmed/8755512/ "revealed them to be alpha1-acid glycoprotein (AGP). We show that the binding of thalidomide photoaffinity label to authentic human AGP is competed with both thalidomide and the nonradioactive photoaffinity label at concentrations comparable to those required for inhibition of production of tumor necrosis factor alpha from human monocytes, suggesting that AGP may be involved in the immunomodulatory activity of thalidomide." ... usw.
Hier gibt es einen Verweis, dass der immunologische Effekt von Revlimid mit einer Bindung von AAG zusammenhängt. In weiteren Untersuchungen wird aber auch gesagt, dass auch andere Mittel AAG binden, die aber nicht diesen immunologischen Effekt erzielen. Vielleicht ist es auch überinterpretiert, doch wenn Revlimid das dominate Mittel ist und dessen Effekt teilweise auch mit AAG zusammenhängt, könnte ein Mittel wie ARRY-520 diesen Effekt vielleicht abschwächen?
Jedenfalls gefällt mir die Bezeichnung "Biomarker" für AAG nicht sonderlich, den Array verwendet.
Gruß
ipollit
...naja, ich kenne aber bisher keinen biologischen Grund, warum man diese beiden unbedingt kombinieren muss. Wo soll der Unterschied zwischen einer Kombi mit Kyprolis, Pomalyst oder Velcade liegen? Da gibt es keinen biologischen Unterschied.
Die Kombination mit Kyprolis ist eher strategisch, soweit ich es verstehe. Kyprolis ist in Europa noch nicht zugelassen (ist eine Zulassung ohne FOCUS nun noch möglich?)... über die PIII-Studie erhält man schon vor der Zulassung Zugang zu Kyprolis und das sicher, da es ja in beiden Armen enthalten ist. Somit hofft man darauf, dass ein hohes Interesse an dieser Studie entsteht und man sie schnell durchführen kann.
Pomalyst ist dagegen zugelassen, dafür muss man an keiner Studie teilnehmen. Velcade sowieso. Jetzt muss man vielleicht hoffen, dass ein Interesse entsteht, nach Anwendung von Velcade und Pomalyst. Allerdings kommen ja auch noch viele weitere neue Mittel: Der Nachfolger von den drei oben genannten ist mit Ixazomib bereits in der PIII... als wirksames orales Mittel kann es alle anderen verdrängen. Und dann gibt es noch die neuen Antikörper-Mittel wie CD38 oder hoffentlich auch PD-1&Co.
Das wichtigste Mittel soll allerdings CELG's Revlimid sein. Wie funktioniert das mit ARRY-520? Gut an ARRY-520 ist, dass es eine völlig neue Klasse ist, soweit ich das sehe. Unschön finde ich die AAG-Geschichte. AAG (alpha-1-acid glycoprotein) bindet ARRY-520. Warum lässt sich dann nicht ARRY-520 entsprechend angepasst an AAG dosieren? Welche Rolle spielt AAG im Verlauf der Krankheit? Gibt es Medikamente die AAG senken? z.B habe ich mal gegoogelt, ob z.B. Revlimid einen Einluss auf AAG hat. Dabei habe ich einen seltsamen Verweis auf AAG gefunden: http://www.ehoonline.org/content/1/1/27 "Both lenalidomide and thalidomide inhibit TNFalpha production by increasing the degradation of TNFalpha mRNA and by increasing the activity of alpha-1-acid glycoproteins, which have intrinsic anti-TNFalpha activity" und weiter http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2779346/"block the increased secretion of tumour necrosis factor alpha (TNF-a) by either enhancing TNF-a mRNA degradation or neutralising a1-acid glycoprotein, a stimulator of TNF-a secretion" ... http://www.ncbi.nlm.nih.gov/pubmed/8755512/ "revealed them to be alpha1-acid glycoprotein (AGP). We show that the binding of thalidomide photoaffinity label to authentic human AGP is competed with both thalidomide and the nonradioactive photoaffinity label at concentrations comparable to those required for inhibition of production of tumor necrosis factor alpha from human monocytes, suggesting that AGP may be involved in the immunomodulatory activity of thalidomide." ... usw.
Hier gibt es einen Verweis, dass der immunologische Effekt von Revlimid mit einer Bindung von AAG zusammenhängt. In weiteren Untersuchungen wird aber auch gesagt, dass auch andere Mittel AAG binden, die aber nicht diesen immunologischen Effekt erzielen. Vielleicht ist es auch überinterpretiert, doch wenn Revlimid das dominate Mittel ist und dessen Effekt teilweise auch mit AAG zusammenhängt, könnte ein Mittel wie ARRY-520 diesen Effekt vielleicht abschwächen?
Jedenfalls gefällt mir die Bezeichnung "Biomarker" für AAG nicht sonderlich, den Array verwendet.
Gruß
ipollit
arry:
mit gut kombinierbar (akzeptable Nebenwirkungen) und wirksam ist folgendes gemeint:
"In the phase-1 study of ARRY-520 combined with Kyprolis® (crfilzomib) in patients with relapsed or refractory MM, it was shown that the early signals of activity of a disease control rate was 82% and a clinical benefit rate was 53%. In addition, this combination did not show any unexpected hematologic toxicity and a manageable side effect profile."
Quelle:
http://bionews-tx.com/news/2013/06/18/arry-520-with-kyprolis…
A
mit gut kombinierbar (akzeptable Nebenwirkungen) und wirksam ist folgendes gemeint:
"In the phase-1 study of ARRY-520 combined with Kyprolis® (crfilzomib) in patients with relapsed or refractory MM, it was shown that the early signals of activity of a disease control rate was 82% and a clinical benefit rate was 53%. In addition, this combination did not show any unexpected hematologic toxicity and a manageable side effect profile."
Quelle:
http://bionews-tx.com/news/2013/06/18/arry-520-with-kyprolis…
A
Antwort auf Beitrag Nr.: 47.515.567 von kmastra am 14.08.14 14:20:46"Ich sehe es insgesamt wie SLGramann, dass alleine Selumetinib das Risiko bei ARRY begrenzt."
Auch wenn mein Rumreiten auf Array schon nervig wird, muss ich nochmals schreiben, wie merkwürdig ich die Situation finde.
Ich denke, was Selumetinib angeht, sind wir hier alle einig. Dieses Programm hat signifikanten Wert für Array. Ob es die heutige Marktkap voll rechtfertigt oder nicht ganz oder sogar allein mehr Marktkap rechtfertigen würde (was ich denke), sei mal dahingestellt...
aber: Auch Binimetinib kann man doch nicht einfach auspreisen!?!
Natürlich ist die Situation derzeit nicht optimal, aber ein paar Fakten bleiben doch wohl bestehen:
1.) Binimetinib ist ein weit fortgeschrittener Wirkstoffkandidat mit recht guten Aussichten auf eine Zulassung.
2.) Array ist an dem Produkt signifikant beteiligt.
Ich weiß nicht, ob Novartis jetzt die NEMO-Studie auf "hold" hat. Ich denke, dass das aus vertragsrechtlichen und ethischen Gründen problematisch wäre.
Wenn sie nicht auf hold steht, dann müssten da dieses Jahr noch zulassungsrelevante Daten kommen.
Das kann man doch nicht einfach ignorieren, indem man sagt, dass es ja passieren könnte, dass Array die Rechte gänzlich zurückbekommt.
NEMO ist auch keine Kombistudie. Also, wenn die Daten gut sind, dann hat Array 100% der Rechte an einem zulassungsreifen Wirkstoff für NRAS-Melanoma. Ich sehe da nicht die große Katastrophe drin.
Klar, es wäre schön, wenn Novartis die ganzen Kombistudien weiterführen würde, was sie wohl nicht mehr tun werden.
Aber nochmals: NEMO ist eine singe-agent-Studie. Genau wie MILO.
Was ist denn das für ein Argument zu sagen, 100% an einem Medikament gegen NRAS-Melanoma sind nichts wert, weil sich das ganze Kombi-Potential sehr weit nach hinten schiebt?
Klar wäre es noch besser, wenn die Kombis auch weiter laufen würden, aber selbst wenn nicht, ist Binimetinib eben nicht nichts.
Ich verstehe nicht, dass der Markt da so am Rad dreht. Klar war die Situation vorher besser, aber wirklich schlecht ist sie jetzt ja auch nicht.
Für mich spinnt der Markt, wenn er Binimetinib bei Array komplett auspreist, nur weil das Risiko besteht, dass Array von vielleicht im Schnitt 15% der Rechte an einem Potential von 100 auf 100% der Rechte an einem Potential von 15 "zurückfällt".
Auch wenn mein Rumreiten auf Array schon nervig wird, muss ich nochmals schreiben, wie merkwürdig ich die Situation finde.
Ich denke, was Selumetinib angeht, sind wir hier alle einig. Dieses Programm hat signifikanten Wert für Array. Ob es die heutige Marktkap voll rechtfertigt oder nicht ganz oder sogar allein mehr Marktkap rechtfertigen würde (was ich denke), sei mal dahingestellt...
aber: Auch Binimetinib kann man doch nicht einfach auspreisen!?!
Natürlich ist die Situation derzeit nicht optimal, aber ein paar Fakten bleiben doch wohl bestehen:
1.) Binimetinib ist ein weit fortgeschrittener Wirkstoffkandidat mit recht guten Aussichten auf eine Zulassung.
2.) Array ist an dem Produkt signifikant beteiligt.
Ich weiß nicht, ob Novartis jetzt die NEMO-Studie auf "hold" hat. Ich denke, dass das aus vertragsrechtlichen und ethischen Gründen problematisch wäre.
Wenn sie nicht auf hold steht, dann müssten da dieses Jahr noch zulassungsrelevante Daten kommen.
Das kann man doch nicht einfach ignorieren, indem man sagt, dass es ja passieren könnte, dass Array die Rechte gänzlich zurückbekommt.
NEMO ist auch keine Kombistudie. Also, wenn die Daten gut sind, dann hat Array 100% der Rechte an einem zulassungsreifen Wirkstoff für NRAS-Melanoma. Ich sehe da nicht die große Katastrophe drin.
Klar, es wäre schön, wenn Novartis die ganzen Kombistudien weiterführen würde, was sie wohl nicht mehr tun werden.
Aber nochmals: NEMO ist eine singe-agent-Studie. Genau wie MILO.
Was ist denn das für ein Argument zu sagen, 100% an einem Medikament gegen NRAS-Melanoma sind nichts wert, weil sich das ganze Kombi-Potential sehr weit nach hinten schiebt?
Klar wäre es noch besser, wenn die Kombis auch weiter laufen würden, aber selbst wenn nicht, ist Binimetinib eben nicht nichts.
Ich verstehe nicht, dass der Markt da so am Rad dreht. Klar war die Situation vorher besser, aber wirklich schlecht ist sie jetzt ja auch nicht.
Für mich spinnt der Markt, wenn er Binimetinib bei Array komplett auspreist, nur weil das Risiko besteht, dass Array von vielleicht im Schnitt 15% der Rechte an einem Potential von 100 auf 100% der Rechte an einem Potential von 15 "zurückfällt".
ich sehe die Situation bei arry ähnlich. Das ist dem Markt halt zu unsicher. Es ist unsicher, aber positiv unsicher, meiner Meinung nach. Wäre da nicht dieses ATM Programm seit ca. 12 Monaten, stünde der Kurs anders. Die Pipeline wird aller Wahrscheinlichkeit einiges abwerfen. Ich denke an die MEK Inhibitoren und auch an arry-380 und -797. Da kann man schon einige Katalysatoren erkennen. Hoffen wir mal, dass es sich materialisiert, bevor der Bullenmarkt zuende ist.
A
A
Array ergreift schon Maßnahmen, um eine Übernahme schwieriger zu machen:
http://www.sec.gov/Archives/edgar/data/1100412/0001100412140…
und vergibt schon Boni, die an den Rückerhalt der Rechte an Binimetinib gekoppelt sind.
http://www.sec.gov/Archives/edgar/data/1100412/0001104659140…
"The RSU’s only vest upon achievement of certain milestones relating to a program licensed by the Company to Novartis International Pharmaceutical Ltd., with one half vesting upon achievement of the first milestone relating to the return of commercialization rights for binimetinib to the Company that have been licensed to Novartis International Pharmaceutical Ltd. and one half vesting upon achievement of the second milestone on or prior to the fourth anniversary of the grant date, in each case subject to continued service with the Company as of each vesting date."
Es wird interessant in der nächsten Zeit.
A
http://www.sec.gov/Archives/edgar/data/1100412/0001100412140…
und vergibt schon Boni, die an den Rückerhalt der Rechte an Binimetinib gekoppelt sind.
http://www.sec.gov/Archives/edgar/data/1100412/0001104659140…
"The RSU’s only vest upon achievement of certain milestones relating to a program licensed by the Company to Novartis International Pharmaceutical Ltd., with one half vesting upon achievement of the first milestone relating to the return of commercialization rights for binimetinib to the Company that have been licensed to Novartis International Pharmaceutical Ltd. and one half vesting upon achievement of the second milestone on or prior to the fourth anniversary of the grant date, in each case subject to continued service with the Company as of each vesting date."
Es wird interessant in der nächsten Zeit.
A
ARRY
hier wird Selumetinib in KRAS NSCLC erwähnt...
http://www.onclive.com/conference-coverage/ilcc-2014/Experim…
"The KRAS mutation in lung cancer is an especially thorny problem, as it is an indicator of a poor prognosis and has not, in the past, been targeted specifically by any medications.
...
There are multiple classes of drugs—predominantly experimental protein kinase inhibitors, lipid kinase inhibitors, and dual lipid/protein kinase inhibitors—designed to treat the disease by hitting targets downstream of KRAS, including Raf, MEK, ERK, PI3K, AKT, and mTOR. An example of a Raf inhibitor is vemurafenib; selumetinib is a MEK inhibitor, perifosine an AKT inhibitor, and everolimus and temsirolimus mTOR inhibitors, he pointed out.
...
He cited a study that looked at LKB1/STK1 loss and the TP53 mutation, each of which represent a different subtype of KRAS-mutated lung cancer. In a study of mice with G12D NSCLC that exhibited either LKB1 loss, the TP53 subtype, or KRAS mutation alone, subjects were given docetaxel with or without selumetinib.2 Tumor volume “changed rather dramatically [for the better] with the introduction of the MEK inhibitor in combination with docetaxel for all categories except LKB1 loss,” Gandara said.
In a trial that looked at chemotherapy with or without selumetinib (AZ6244) in stage IIIB to IV KRAS-mutant NSCLC,3 progression-free survival (PFS) was 2.1 months with docetaxel and 5.3 months in the combination group. Response was 0% in the chemotherapy cohort and 37% in the combination cohort, and overall survival was 5.3 months vs 9.4 months in the control and experimental groups, respectively.
Gandara called that response rate “astounding,” although, “admittedly, this was totally KRAS-mutated lung cancer patients, not typical lung cancer patients.”
Similar results were seen with a combination of docetaxel and the MEK inhibitor trametinib that Gandara presented at the annual meeting of the American Society of Clinical Oncology last year,4 he said..."
Gruß
ipollit
hier wird Selumetinib in KRAS NSCLC erwähnt...
http://www.onclive.com/conference-coverage/ilcc-2014/Experim…
"The KRAS mutation in lung cancer is an especially thorny problem, as it is an indicator of a poor prognosis and has not, in the past, been targeted specifically by any medications.
...
There are multiple classes of drugs—predominantly experimental protein kinase inhibitors, lipid kinase inhibitors, and dual lipid/protein kinase inhibitors—designed to treat the disease by hitting targets downstream of KRAS, including Raf, MEK, ERK, PI3K, AKT, and mTOR. An example of a Raf inhibitor is vemurafenib; selumetinib is a MEK inhibitor, perifosine an AKT inhibitor, and everolimus and temsirolimus mTOR inhibitors, he pointed out.
...
He cited a study that looked at LKB1/STK1 loss and the TP53 mutation, each of which represent a different subtype of KRAS-mutated lung cancer. In a study of mice with G12D NSCLC that exhibited either LKB1 loss, the TP53 subtype, or KRAS mutation alone, subjects were given docetaxel with or without selumetinib.2 Tumor volume “changed rather dramatically [for the better] with the introduction of the MEK inhibitor in combination with docetaxel for all categories except LKB1 loss,” Gandara said.
In a trial that looked at chemotherapy with or without selumetinib (AZ6244) in stage IIIB to IV KRAS-mutant NSCLC,3 progression-free survival (PFS) was 2.1 months with docetaxel and 5.3 months in the combination group. Response was 0% in the chemotherapy cohort and 37% in the combination cohort, and overall survival was 5.3 months vs 9.4 months in the control and experimental groups, respectively.
Gandara called that response rate “astounding,” although, “admittedly, this was totally KRAS-mutated lung cancer patients, not typical lung cancer patients.”
Similar results were seen with a combination of docetaxel and the MEK inhibitor trametinib that Gandara presented at the annual meeting of the American Society of Clinical Oncology last year,4 he said..."
Gruß
ipollit
NBI
heute gab es ein neues Allzeit-Hoch beim Nasdaq Biotech Index, nachdem die gestrige Übernahme von ITMN durch Roche den Markt weiter angeheizt hat

Mein Depot ist leider noch ein deutliches Stück vom Hoch Anfang des Jahres entfernt. Man könnte sich sogesehen auch ein Depot mit Einzelwerten sparen und stattdessen alles z.B. auf den IBB setzen.
In den letzten Monaten habe ich MDVN, CLVS, EXEL, MGNX und AMBI erhöht, so dass die Gewichtung nun so aussieht...
10,6% PCYC
9,9% INCY
7,5% CLDX
5,9% REGN
5,8% MDVN
5,7% CLVS
5,0% GEN.CO
4,9% ARRY
4,5% ENTA
4,3% CBST
4,3% EXEL
3,9% ISIS
3,8% ALNY
3,3% IPH.PA
3,1% SNTA
2,8% INFI
2,6% MGNX
2,3% AMBI
2,3% SGEN
1,8% XLRN
1,7% ARQL
1,4% IMMU
1,3% VSTM
0,9% STML
0,5% KBIO
Gruß
ipollit
heute gab es ein neues Allzeit-Hoch beim Nasdaq Biotech Index, nachdem die gestrige Übernahme von ITMN durch Roche den Markt weiter angeheizt hat
Mein Depot ist leider noch ein deutliches Stück vom Hoch Anfang des Jahres entfernt. Man könnte sich sogesehen auch ein Depot mit Einzelwerten sparen und stattdessen alles z.B. auf den IBB setzen.
In den letzten Monaten habe ich MDVN, CLVS, EXEL, MGNX und AMBI erhöht, so dass die Gewichtung nun so aussieht...
10,6% PCYC
9,9% INCY
7,5% CLDX
5,9% REGN
5,8% MDVN
5,7% CLVS
5,0% GEN.CO
4,9% ARRY
4,5% ENTA
4,3% CBST
4,3% EXEL
3,9% ISIS
3,8% ALNY
3,3% IPH.PA
3,1% SNTA
2,8% INFI
2,6% MGNX
2,3% AMBI
2,3% SGEN
1,8% XLRN
1,7% ARQL
1,4% IMMU
1,3% VSTM
0,9% STML
0,5% KBIO
Gruß
ipollit
FMI
war FMI hier nicht auch schonmal ein Thema? Ist die folgende Kalkulation realistisch?
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
"Re: FMI valuation model
FMI’s (clearly conservative) guidance for 2014 is 22-25K tests; currently, about half of the tests are being reimbursed (at an average reimbursement of $3,600). In 2015, I think FMI can do 40K tests with 75% reimbursed, and in 2016 I think they can do 60K tests with 90% or more of them reimbursed. (The average reimbursement price should remain close to the current level of $3,600, which includes a blend of FoundationOne and FoundationOne Heme.)
We can estimate the gross margin on reimbursed clinical tests by examining the 2Q14 financials. In 2Q14, FMI performed 5,908 tests; had they all of them been reimbursed, the clinical-testing revenue would have been (5,908)$3600 = $21.3M.
2Q14 COGS was $6.6M; let’s assume for the sake of simplicity that 35% of COGS pertained to the 35% of revenue derived from pharma partners. Then, the 2Q14 COGS attributable to clinical tests was (0.65)$6.6M or about $4.4M.
The key observation to make here is that COGS for a non-reimbursed test is the same as COGS for a reimbursed test, so the COGS for the pro forma $21.3M of revenue that would have resulted from full reimbursement in 2Q14 would have been only $4.4M, implying a gross margin of 79% for reimbursed clinical tests.
In 2016, let’s assume a 75% gross margin on clinical tests to allow for some (<10%) of tests still being non-reimbursed. Applying the 75% gross margin to the projected 60K tests performed during 2016 gives a 2016 gross profit from clinical testing of 60K($3,600)(0.75) = $162M.
Pharma-partnership revenue in 2016 should grow relative to 2014, but at a much slower rate than the growth in clinical-testing revenue. Still, it’s reasonable to assume that the gross profit from pharma-partnership revenue will offset much—or all—of FMI’s 2016 SG&A expenses, so that FMI’s 2016 operating profit before deducting R&D should be close to the $162M figure calculated above. If we assume $40M for 2016 R&D, this lowers operating profit to $122M, which would yield about $75M of net income on a fully-taxed basis (ignoring NOLs in order to be conservative).
Applying a 25x multiple to this $75M net income seems reasonable given the high growth rate of the revenue and income stream, which yields an enterprise value of $1.9B, or $55/sh based on 34M diluted shares I project to be outstanding in 2016 (vs. 28.1M shares and 2.3M options outstanding currently)."

Gruß
ipollit
war FMI hier nicht auch schonmal ein Thema? Ist die folgende Kalkulation realistisch?
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
"Re: FMI valuation model
FMI’s (clearly conservative) guidance for 2014 is 22-25K tests; currently, about half of the tests are being reimbursed (at an average reimbursement of $3,600). In 2015, I think FMI can do 40K tests with 75% reimbursed, and in 2016 I think they can do 60K tests with 90% or more of them reimbursed. (The average reimbursement price should remain close to the current level of $3,600, which includes a blend of FoundationOne and FoundationOne Heme.)
We can estimate the gross margin on reimbursed clinical tests by examining the 2Q14 financials. In 2Q14, FMI performed 5,908 tests; had they all of them been reimbursed, the clinical-testing revenue would have been (5,908)$3600 = $21.3M.
2Q14 COGS was $6.6M; let’s assume for the sake of simplicity that 35% of COGS pertained to the 35% of revenue derived from pharma partners. Then, the 2Q14 COGS attributable to clinical tests was (0.65)$6.6M or about $4.4M.
The key observation to make here is that COGS for a non-reimbursed test is the same as COGS for a reimbursed test, so the COGS for the pro forma $21.3M of revenue that would have resulted from full reimbursement in 2Q14 would have been only $4.4M, implying a gross margin of 79% for reimbursed clinical tests.
In 2016, let’s assume a 75% gross margin on clinical tests to allow for some (<10%) of tests still being non-reimbursed. Applying the 75% gross margin to the projected 60K tests performed during 2016 gives a 2016 gross profit from clinical testing of 60K($3,600)(0.75) = $162M.
Pharma-partnership revenue in 2016 should grow relative to 2014, but at a much slower rate than the growth in clinical-testing revenue. Still, it’s reasonable to assume that the gross profit from pharma-partnership revenue will offset much—or all—of FMI’s 2016 SG&A expenses, so that FMI’s 2016 operating profit before deducting R&D should be close to the $162M figure calculated above. If we assume $40M for 2016 R&D, this lowers operating profit to $122M, which would yield about $75M of net income on a fully-taxed basis (ignoring NOLs in order to be conservative).
Applying a 25x multiple to this $75M net income seems reasonable given the high growth rate of the revenue and income stream, which yields an enterprise value of $1.9B, or $55/sh based on 34M diluted shares I project to be outstanding in 2016 (vs. 28.1M shares and 2.3M options outstanding currently)."
Gruß
ipollit
Ich bin hier zwar nur stiller Mitleser und nicht vom Fach, aber zu FMI kann ich zumindest beitragen, daß der hier allseits geschätzte Ohad Hammer FMI eine geradezu herausragende Entwicklung prophezeit. Er sagt sinngemäß, daß es sehr schwer sei, FMI zu überschätzen...Demgemäß hat er in diesen Wert kürzlich auch verhältnismäßig viel investiert. Zwar unwichtig, aber ich bin auch drin...
Bin zuletzt über Aquinox (AQXP) gestolpert. Sie werden mit einem EV von gerade mal 16 Mio USD bewertet und damit knapp über Cash. Nachdem was ich so lesen konnte, haben sie einen vielversprechenden Produktkandidaten in Phase 2. Wo ist hier der Haken?
Hat sich schon jemand mit diesem Wert befasst?

Hat sich schon jemand mit diesem Wert befasst?

Antwort auf Beitrag Nr.: 47.620.776 von lawmeetstax am 27.08.14 11:09:13hi,
kannst du mir bitte die WKN von FMI hier reinstellen. Ich find das ding nirgends.
mfg
skipper
kannst du mir bitte die WKN von FMI hier reinstellen. Ich find das ding nirgends.
mfg
skipper
Antwort auf Beitrag Nr.: 47.622.198 von skipper2004 am 27.08.14 13:10:36Vielen Dank - schon erledigt 
gruß an alle

gruß an alle
Antwort auf Beitrag Nr.: 47.617.386 von ipollit am 26.08.14 23:24:27"war FMI hier nicht auch schonmal ein Thema?"
Hallo ipollit,
ja, ich hatte vor geraumer Zeit meinen Einstieg verkündet. Allerdings stand der Kurs damals bei über 30 Dollar... So mache ich das ja immer.
Hammer hat später von einer Gatekeeper-Funktion des Unternehmens gesprochen und das ist auch das, was mich an dem Unternehmen überzeugt. Ich halte das Marktpotential langfristig für enorm groß. Ich glaube nicht, dass das nur ein einstelliger Milliardenbetrag ein wird.
Allerdings ist klar, dass FMI nicht allein bleiben wird. Illumnia will in den Markt rein und hat gleich eine interessante Partnerschaft verkündet.
http://investor.illumina.com/phoenix.zhtml?c=121127&p=irol-n…
(Was für ein fantastisches Unternehmen!!)
Die große Frage wird also tatsächlich sein, wie kompetitiv der Markt auf lange Sicht sein wird und wie hoch die Margen dann sein werden (also in 5 oder in 10 Jahren).
Das kann natürlich niemand sagen, mein Bauchgefühl ist aber, dass die Margen - trotz einiger Konkurrenz - ganz ordentlich sein werden. Als Depotbeimischung ist FMI sicher keine schlechte Idee.
Was hältst Du eigentlich von Hammers neuestem Depotwert Aerie? Ich hab da noch kein Bild.
VG
SLG
Hallo ipollit,
ja, ich hatte vor geraumer Zeit meinen Einstieg verkündet. Allerdings stand der Kurs damals bei über 30 Dollar... So mache ich das ja immer.

Hammer hat später von einer Gatekeeper-Funktion des Unternehmens gesprochen und das ist auch das, was mich an dem Unternehmen überzeugt. Ich halte das Marktpotential langfristig für enorm groß. Ich glaube nicht, dass das nur ein einstelliger Milliardenbetrag ein wird.
Allerdings ist klar, dass FMI nicht allein bleiben wird. Illumnia will in den Markt rein und hat gleich eine interessante Partnerschaft verkündet.
http://investor.illumina.com/phoenix.zhtml?c=121127&p=irol-n…
(Was für ein fantastisches Unternehmen!!)
Die große Frage wird also tatsächlich sein, wie kompetitiv der Markt auf lange Sicht sein wird und wie hoch die Margen dann sein werden (also in 5 oder in 10 Jahren).
Das kann natürlich niemand sagen, mein Bauchgefühl ist aber, dass die Margen - trotz einiger Konkurrenz - ganz ordentlich sein werden. Als Depotbeimischung ist FMI sicher keine schlechte Idee.
Was hältst Du eigentlich von Hammers neuestem Depotwert Aerie? Ich hab da noch kein Bild.
VG
SLG
@ biotechhype
Ich bin auch bei Aquinox drin. Hellhörig bin ich geworden wegen der strategischen Beteiligungen von Pfizer und J&J. Die werden ihre Hausaufgaben hoffentlich gemacht haben...wissenschaftlich kann ich das leider nicht unterfüttern...
Ich bin auch bei Aquinox drin. Hellhörig bin ich geworden wegen der strategischen Beteiligungen von Pfizer und J&J. Die werden ihre Hausaufgaben hoffentlich gemacht haben...wissenschaftlich kann ich das leider nicht unterfüttern...
Das waren auch meine Gründe für den Einstieg, aber ich konnte mir das Kursniveau einfach nicht erklären. Im besten Fall fliegt das Teil einfach nur unter dem Radar.
Hallo zusammen,
FMI beobachte ich aus dem Augenwinkel. David Sobeck hat vor einiger Zeit mal einen interessanten Beitrag dazu geschrieben, der mir das Ganze mal einigermaßen verständlich gemacht hat:
Foundation Medicine's advantage comes from taking its data and combining it with the latest research and clinical practices to provide information to a doctor about 1) the specific genetic makeup of their patients' cancers, and 2) potentially effective treatments using approved drugs or experimental drugs in clinical trials. The value Foundation Medicine provides is not the diagnostics, itself, but analyzing the data that comes out of the diagnostics.
http://www.thestreet.com/story/12722650/1/bull-thesis-on-fou…
AQXP kenne ich gar nicht. Was mir aber auffällt ist, dass die wohl im März diesen Jahres an die Börse gegangen sind (schlechter Zeitpunkt?!).
SG kmastra
FMI beobachte ich aus dem Augenwinkel. David Sobeck hat vor einiger Zeit mal einen interessanten Beitrag dazu geschrieben, der mir das Ganze mal einigermaßen verständlich gemacht hat:
Foundation Medicine's advantage comes from taking its data and combining it with the latest research and clinical practices to provide information to a doctor about 1) the specific genetic makeup of their patients' cancers, and 2) potentially effective treatments using approved drugs or experimental drugs in clinical trials. The value Foundation Medicine provides is not the diagnostics, itself, but analyzing the data that comes out of the diagnostics.
http://www.thestreet.com/story/12722650/1/bull-thesis-on-fou…
AQXP kenne ich gar nicht. Was mir aber auffällt ist, dass die wohl im März diesen Jahres an die Börse gegangen sind (schlechter Zeitpunkt?!).
SG kmastra
EXEL:
COMET-1 ist (für uns hier wohl doch eher erwartungsgemäß) gescheitert.
Mal sehen, was die Börse daraus macht. Ein kleines Gemetzel wirds sicher geben.
The trial did not meet its primary endpoint of demonstrating a statistically significant increase in overall survival (OS) for patients treated with cabozantinib as compared to prednisone. The median OS for the cabozantinib arm of the trial was 11.0 months versus 9.8 months for the prednisone arm (hazard ratio 0.90; 95% confidence interval 0.76 – 1.06; p value 0.212).
The COMET-1 results are the subject of ongoing analyses. Exelixis will submit additional data, including secondary and exploratory endpoints, for presentation at a future medical conference. Besides OS, the exploratory endpoint of progression-free survival (PFS) as assessed by the investigators is the only time-to-event-based endpoint for which data are available. Median PFS was 5.5 months for the cabozantinib arm of the trial versus 2.8 months for the prednisone arm (hazard ratio 0.50; 95% confidence interval 0.42 – 0.60; p value <0.0001). Safety data were consistent with those observed in earlier-stage trials of cabozantinib in mCRPC.
As a result of the outcome of COMET-1, Exelixis will initiate a significant workforce reduction to enable the company to focus its financial resources on the late-stage clinical trials of cabozantinib in metastatic renal cell carcinoma (the METEOR trial) and advanced hepatocellular carcinoma (the CELESTIAL trial). The company will reduce its workforce by approximately 70 percent, or approximately 160 employees, resulting in approximately 70 remaining employees.
http://www.exelixis.com/investors-media/press-releases?cpurl…
COMET-1 ist (für uns hier wohl doch eher erwartungsgemäß) gescheitert.
Mal sehen, was die Börse daraus macht. Ein kleines Gemetzel wirds sicher geben.
The trial did not meet its primary endpoint of demonstrating a statistically significant increase in overall survival (OS) for patients treated with cabozantinib as compared to prednisone. The median OS for the cabozantinib arm of the trial was 11.0 months versus 9.8 months for the prednisone arm (hazard ratio 0.90; 95% confidence interval 0.76 – 1.06; p value 0.212).
The COMET-1 results are the subject of ongoing analyses. Exelixis will submit additional data, including secondary and exploratory endpoints, for presentation at a future medical conference. Besides OS, the exploratory endpoint of progression-free survival (PFS) as assessed by the investigators is the only time-to-event-based endpoint for which data are available. Median PFS was 5.5 months for the cabozantinib arm of the trial versus 2.8 months for the prednisone arm (hazard ratio 0.50; 95% confidence interval 0.42 – 0.60; p value <0.0001). Safety data were consistent with those observed in earlier-stage trials of cabozantinib in mCRPC.
As a result of the outcome of COMET-1, Exelixis will initiate a significant workforce reduction to enable the company to focus its financial resources on the late-stage clinical trials of cabozantinib in metastatic renal cell carcinoma (the METEOR trial) and advanced hepatocellular carcinoma (the CELESTIAL trial). The company will reduce its workforce by approximately 70 percent, or approximately 160 employees, resulting in approximately 70 remaining employees.
http://www.exelixis.com/investors-media/press-releases?cpurl…
Antwort auf Beitrag Nr.: 47.666.976 von SLGramann am 02.09.14 07:29:58Der Kursrutsch war größer, als ich vermutet hatte. Mehr als 50% sind schon eine Hausnummer.
Ich frage mich jetzt, welchen Wert man in Cabo noch sehen darf.
Denn wenn man EXEL vor allem wegen Cobi kaufen wollte, müsste man erklären, warum man nicht die nur unwesentlich teurere Array bevorzugen soll, die bei den MEKs eher stärker sind und auch sonst besser aufgestellt sind, als EXEL.
Eigentlich hängt es jetzt sehr an Cabo in RCC, oder wie seht ihr das? In der laufenden PIII ist PFS der Endpunkt. Das ist erstmal gut. Aber wie sehen die Chancen aus, sich von Afinitor wirklich abzuheben?
Die Daten kommen in genau einem Jahr, vielleicht aber auch etwas eher.
Wenn man von diesem Trial etwas erwartet, ist es sicher eine gute Idee, noch vor der ESMO zu kaufen.
Ich frage mich jetzt, welchen Wert man in Cabo noch sehen darf.
Denn wenn man EXEL vor allem wegen Cobi kaufen wollte, müsste man erklären, warum man nicht die nur unwesentlich teurere Array bevorzugen soll, die bei den MEKs eher stärker sind und auch sonst besser aufgestellt sind, als EXEL.
Eigentlich hängt es jetzt sehr an Cabo in RCC, oder wie seht ihr das? In der laufenden PIII ist PFS der Endpunkt. Das ist erstmal gut. Aber wie sehen die Chancen aus, sich von Afinitor wirklich abzuheben?
Die Daten kommen in genau einem Jahr, vielleicht aber auch etwas eher.
Wenn man von diesem Trial etwas erwartet, ist es sicher eine gute Idee, noch vor der ESMO zu kaufen.
Hallo SLGramann,
ja der Kursrutsch war definitiv größer als gedacht, vor allem weil es ja schon einen Kursrutsch bei der interim gab. Ich bin mit einer kleinen Position dabei gewesen, weil es ja auch eine kleine Hoffnung auf einen Erfolg gab. Eigentlich war/ist mein Plan jetzt nochmal nachzulegen. Bei EXEL waren ja extrem viele Short. Müssten da nicht einige jetzt auch "Gewinne" realisieren? Werde mir das aber nochmal genauer überlegen. Auch Cabo nochmal ansehen. Auspreisen kann man es sicher nicht.
Was mich doch überrascht hat ist, dass COMET2 gleich eingestellt wurde (wenn ich es richtig gelesen habe). Ist das so und wenn ja warum? (bin zur Zeit ohne echtes Internet)
Nun ist Cobi natürlich wichtiger geworden. Hier bahnt sich ein Wettlauf zwischen Roche und GSK/NOV an. Vorteile im OS wären m.E. extrem wichtig. Noch gab es bei Cobi keine Aussage zum OS, während Mekinist hier zumindest den Endpunkt erreicht hat. Mal sehen wie das Ganze dann genau aussieht. Ich bin mir aber nicht so sicher, ob Roche die OS Daten auf der ESMO schon präsentieren kann...
SG kmastra
ja der Kursrutsch war definitiv größer als gedacht, vor allem weil es ja schon einen Kursrutsch bei der interim gab. Ich bin mit einer kleinen Position dabei gewesen, weil es ja auch eine kleine Hoffnung auf einen Erfolg gab. Eigentlich war/ist mein Plan jetzt nochmal nachzulegen. Bei EXEL waren ja extrem viele Short. Müssten da nicht einige jetzt auch "Gewinne" realisieren? Werde mir das aber nochmal genauer überlegen. Auch Cabo nochmal ansehen. Auspreisen kann man es sicher nicht.
Was mich doch überrascht hat ist, dass COMET2 gleich eingestellt wurde (wenn ich es richtig gelesen habe). Ist das so und wenn ja warum? (bin zur Zeit ohne echtes Internet)
Nun ist Cobi natürlich wichtiger geworden. Hier bahnt sich ein Wettlauf zwischen Roche und GSK/NOV an. Vorteile im OS wären m.E. extrem wichtig. Noch gab es bei Cobi keine Aussage zum OS, während Mekinist hier zumindest den Endpunkt erreicht hat. Mal sehen wie das Ganze dann genau aussieht. Ich bin mir aber nicht so sicher, ob Roche die OS Daten auf der ESMO schon präsentieren kann...
SG kmastra
Antwort auf Beitrag Nr.: 47.686.725 von kmastra am 03.09.14 19:20:27Hi kmastra,
so wie ich es verstanden habe, wurde Comet2 auf dem gegenwärtigen Stand abgebrochen. Die Daten werden aber ausgewertet und bis Jahresende präsentiert werden.
Exel sieht wohl keinerlei Aussichten auf Zulassung und will/muss jetzt vor allem Kosten reduzieren.
Zu den OS-Daten bei Cobi:
Die sind wohl erst 2015 zu erwarten. Hammer dazu:
"Down the road, the overall survival will be the more important metric (should be available next year). ... Roche started its phase III trial 6 months after the initiation of the two GSK trials, so one factor that plays against cobi is the growing availability of PD-1 antibodies that may have a confounding effect on overall survival."
Grüße
SLG
so wie ich es verstanden habe, wurde Comet2 auf dem gegenwärtigen Stand abgebrochen. Die Daten werden aber ausgewertet und bis Jahresende präsentiert werden.
Exel sieht wohl keinerlei Aussichten auf Zulassung und will/muss jetzt vor allem Kosten reduzieren.
Zu den OS-Daten bei Cobi:
Die sind wohl erst 2015 zu erwarten. Hammer dazu:
"Down the road, the overall survival will be the more important metric (should be available next year). ... Roche started its phase III trial 6 months after the initiation of the two GSK trials, so one factor that plays against cobi is the growing availability of PD-1 antibodies that may have a confounding effect on overall survival."
Grüße
SLG
Hallo SLGramann,
leider ist Carbo in Prostatakrebs nicht erfolgreich gewesen. Ich hatte es eher als ein 50:50 Chance gesehen, aber ein Scheitern war insgesamt möglich, da die Wirkung in Prostatakrebs nur an den Knochenmetastasen festgemacht worden ist... dabei war es nicht wirklich klar, ob es einen echten Effekt auf die Metastasen gibt oder es sich nur auf den Knochen auswirkt, so dass die Metastasen unsichtbar werden.
Die höchsten Chancen habe ich immer bei RCC gesehen. Cabo ist ja in erster Linie ein VEGF + MET-Hemmer. VEGF ist sowohl in RCC als auch in HCC ein etabliertes Target. In RCC ist z.B. Sutent, Votrient, Nexavar und Avastin zugelassen. Naja, dass ein Erfolg alles andere als garantiert ist, hat man ja z.B. an AVEOs Tivozanib gesehen... allerdings auch 1st-line gegen Nexavar.
Cabozantinib wird dagegen in 2nd/3rd+ line getestet. Hier sahen die Ergebnisse in einer P1 (n=25) ganz gut aus:
http://www.ackc.org/kidney-cancer-information/asco-2012-repo…
Insbesondere gab es ein Ansprechen unabhängig von vorhergehenden VEGF-Behandlungen
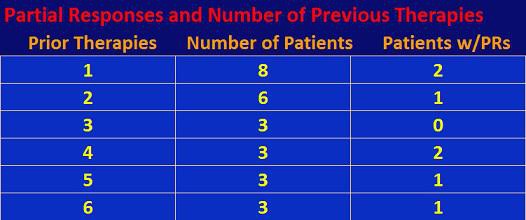
"What stands out in this trial is the response rate, specifically the pfs of 14.7 months and some tumor shrinkage in 19 of the 21 evaluated patients for a patient mix that was heavily pre-treated. For example, of the 7 patients who showed partial tumor response (> 30% shrinkage), 4 of them had four or more prior treatments. The best pfs in current therapies is about a year, and this is mostly for treatment-naïve patients. The axitinib-sorafenib second-line trial (with one prior therapy) yielded a pfs of 6.7 months and 4.7 months for axitinib and sorafenib, respectively. Additionally, the patients on this trial were all in the intermediate and poor risk categories."
Außerdem soll ein hohes Interesse von Patienten und Ärzten an METEOR bestehen.
Hier sind auch noch ein paar Kommentare, die allerdings schon etwas älter sind:
"Cabo is clearly an active drug in prostate cancer with regard to bone activity and pain palliation, but we believe there is uncertainty as to whether bone scan responses, while impressive, can translate sufficiently into a survival benefit -- the approvable endpoint in prostate cancer. We estimate cabo addresses a $300M U.S. market opportunity in postchemotherapy CRPC and estimate a 50% probability of success. Potential label expansion to treat chemotherapy-naïve CRPC could open up a $1Bn U.S. opportunity, but EXEL just initiated Phase II and we expect limited off-label use there.
Phase III RCC data in 2015 is the next major catalyst following COMET-1 data. We believe cabo’s mechanism of action makes sense in RCC where VEGF has been established as a key target and MET is a driver in a large percentage of RCC and HCC. We model a $376M and $135M U.S. market opportunity in RCC and HCC, respectively, and assume a 65% probability of success.
RET+ NSCLC is a small yet intriguing opportunity. A pivotal Phase II study in ~100 non-small cell lung cancer (NSCLC) patients carrying the RET fusion gene is expected to initiate shortly. EXEL previously saw only weak signs of activity in a Phase Ib combination trial in unselected NSCLC, but based on scientific rationale and a small investigator-sponsored study we believe the activity could be higher in an enriched patient population.
Probability of success for cobimetinib in BRAF+ melanoma (coBRIM) is very high in our view, but the opportunity is modest. Based on clinical precedent from GSK’s trametinib (Mekinist) and a strong scientific rationale, we believe coBRIM has a high probability of success. Cobimetinib is EXEL’s MEK inhibitor, licensed to Roche with pivotal melanoma data expected in 2014. BRAF+ melanoma is only a modest market opportunity and a competitive space. We model $150M cobimetinib U.S. sales in 2024 and assume a 90% probability of success."
Etwas bezüglich MET, RET und ALK...
"Exelixis' (EXEL) and Mirati's (MRTX) development strategy in NSCLC differs from Roche's. Whereas Roche enrolled patients selected for "high-MET" expression using an immunohistochemistry-based diagnostic (~40% of NSCLC), EXEL and MRTX plan to test cabozantinib and MGCD-265, respectively, in NSCLC patients harboring certain "driver mutations" representing a much smaller patient subset.
- EXEL plans to start a Phase II/III study for Cabo in RET-fusion positive NSCLC representing 1-2% of NSCLC.
- MRTX plans to test MGCD265 in MET-mutation and Axl-fusion positive NSCLC (6-8% of NSCLC patients)
with Phase I data expected in mid-2014.
Although almost all major human cancers seem to harbor some dysregulation of the MET pathway, only a minority of tumors are “addicted to MET”, explaining in our view the mixed clinical results seen thus far with Met inhibitors when studied in broader patient populations. “Met addicted” tumors are those with MET gene amplification or specific activating mutations representing only a small single-digit percentage of patients. Tumors without MET addiction including those with "high-MET" expression may rely only partly on MET signaling for invasion, growth and metastasis, according to MEDACorp KOLs we spoke to, which makes it hard to show a benefit. Whereas the METLung discontinuation clearly raises questions regarding MET as a target in NSCLC, we note that in contrast to highly specific MetMAb, cabozantinib and MGCD-265 are multi-kinase inhibitors. In addition to MET, cabozantinib also inhibits FLT-3, VEGFR, KIT, TIE1/2, and RET. MGCD-265 inhibits MET, VEGFR and Axl.
Redundancy in oncogenic signaling pathways might require inhibition of multiple kinases, which could potentially be targeted using multi-kinase inhibitors in our view. MET inhibition with multi-kinase inhibitors may be a valid strategy in different indications. Dysregulation of the MET signaling pathway occurs in a wide range of human cancers, including the most common epithelial cancers. However we believe MET may only be an oncogenic driver in some, but not all of these cancers. Recall EXEL’s cabozantinib is already approved to treat patients with Medullary Thyroid Cancer (MTC). Interestingly 80% of patients in EXEL's EXAM trial were RET mutation positive based on a genetic analysis, suggesting cabozantinib 's multikinase inhibition (including RET) may be beneficial. Similarly, Pfizer's crizotinib a multi-kinase inhibitor targeting Met and ALK has been approved to treat patients with metastatic NSCLC harboring a genetic ALK fusion with a frequency of ~3% in NSCLC."
Laut ARQL soll in HCC durch VEGF-Hemmung MET hochreguliert werden... vielleicht hilft das Carbo als VEGFR + MET-Hemmer ja auch etwas in der HCC PIII.
Ich habe meine nun geschrumpfte Position wieder etwas erhöht... mal schauen.
Viele Grüße
ipollit
leider ist Carbo in Prostatakrebs nicht erfolgreich gewesen. Ich hatte es eher als ein 50:50 Chance gesehen, aber ein Scheitern war insgesamt möglich, da die Wirkung in Prostatakrebs nur an den Knochenmetastasen festgemacht worden ist... dabei war es nicht wirklich klar, ob es einen echten Effekt auf die Metastasen gibt oder es sich nur auf den Knochen auswirkt, so dass die Metastasen unsichtbar werden.
Die höchsten Chancen habe ich immer bei RCC gesehen. Cabo ist ja in erster Linie ein VEGF + MET-Hemmer. VEGF ist sowohl in RCC als auch in HCC ein etabliertes Target. In RCC ist z.B. Sutent, Votrient, Nexavar und Avastin zugelassen. Naja, dass ein Erfolg alles andere als garantiert ist, hat man ja z.B. an AVEOs Tivozanib gesehen... allerdings auch 1st-line gegen Nexavar.
Cabozantinib wird dagegen in 2nd/3rd+ line getestet. Hier sahen die Ergebnisse in einer P1 (n=25) ganz gut aus:
http://www.ackc.org/kidney-cancer-information/asco-2012-repo…
Insbesondere gab es ein Ansprechen unabhängig von vorhergehenden VEGF-Behandlungen

"What stands out in this trial is the response rate, specifically the pfs of 14.7 months and some tumor shrinkage in 19 of the 21 evaluated patients for a patient mix that was heavily pre-treated. For example, of the 7 patients who showed partial tumor response (> 30% shrinkage), 4 of them had four or more prior treatments. The best pfs in current therapies is about a year, and this is mostly for treatment-naïve patients. The axitinib-sorafenib second-line trial (with one prior therapy) yielded a pfs of 6.7 months and 4.7 months for axitinib and sorafenib, respectively. Additionally, the patients on this trial were all in the intermediate and poor risk categories."
Außerdem soll ein hohes Interesse von Patienten und Ärzten an METEOR bestehen.
Hier sind auch noch ein paar Kommentare, die allerdings schon etwas älter sind:
"Cabo is clearly an active drug in prostate cancer with regard to bone activity and pain palliation, but we believe there is uncertainty as to whether bone scan responses, while impressive, can translate sufficiently into a survival benefit -- the approvable endpoint in prostate cancer. We estimate cabo addresses a $300M U.S. market opportunity in postchemotherapy CRPC and estimate a 50% probability of success. Potential label expansion to treat chemotherapy-naïve CRPC could open up a $1Bn U.S. opportunity, but EXEL just initiated Phase II and we expect limited off-label use there.
Phase III RCC data in 2015 is the next major catalyst following COMET-1 data. We believe cabo’s mechanism of action makes sense in RCC where VEGF has been established as a key target and MET is a driver in a large percentage of RCC and HCC. We model a $376M and $135M U.S. market opportunity in RCC and HCC, respectively, and assume a 65% probability of success.
RET+ NSCLC is a small yet intriguing opportunity. A pivotal Phase II study in ~100 non-small cell lung cancer (NSCLC) patients carrying the RET fusion gene is expected to initiate shortly. EXEL previously saw only weak signs of activity in a Phase Ib combination trial in unselected NSCLC, but based on scientific rationale and a small investigator-sponsored study we believe the activity could be higher in an enriched patient population.
Probability of success for cobimetinib in BRAF+ melanoma (coBRIM) is very high in our view, but the opportunity is modest. Based on clinical precedent from GSK’s trametinib (Mekinist) and a strong scientific rationale, we believe coBRIM has a high probability of success. Cobimetinib is EXEL’s MEK inhibitor, licensed to Roche with pivotal melanoma data expected in 2014. BRAF+ melanoma is only a modest market opportunity and a competitive space. We model $150M cobimetinib U.S. sales in 2024 and assume a 90% probability of success."
Etwas bezüglich MET, RET und ALK...
"Exelixis' (EXEL) and Mirati's (MRTX) development strategy in NSCLC differs from Roche's. Whereas Roche enrolled patients selected for "high-MET" expression using an immunohistochemistry-based diagnostic (~40% of NSCLC), EXEL and MRTX plan to test cabozantinib and MGCD-265, respectively, in NSCLC patients harboring certain "driver mutations" representing a much smaller patient subset.
- EXEL plans to start a Phase II/III study for Cabo in RET-fusion positive NSCLC representing 1-2% of NSCLC.
- MRTX plans to test MGCD265 in MET-mutation and Axl-fusion positive NSCLC (6-8% of NSCLC patients)
with Phase I data expected in mid-2014.
Although almost all major human cancers seem to harbor some dysregulation of the MET pathway, only a minority of tumors are “addicted to MET”, explaining in our view the mixed clinical results seen thus far with Met inhibitors when studied in broader patient populations. “Met addicted” tumors are those with MET gene amplification or specific activating mutations representing only a small single-digit percentage of patients. Tumors without MET addiction including those with "high-MET" expression may rely only partly on MET signaling for invasion, growth and metastasis, according to MEDACorp KOLs we spoke to, which makes it hard to show a benefit. Whereas the METLung discontinuation clearly raises questions regarding MET as a target in NSCLC, we note that in contrast to highly specific MetMAb, cabozantinib and MGCD-265 are multi-kinase inhibitors. In addition to MET, cabozantinib also inhibits FLT-3, VEGFR, KIT, TIE1/2, and RET. MGCD-265 inhibits MET, VEGFR and Axl.
Redundancy in oncogenic signaling pathways might require inhibition of multiple kinases, which could potentially be targeted using multi-kinase inhibitors in our view. MET inhibition with multi-kinase inhibitors may be a valid strategy in different indications. Dysregulation of the MET signaling pathway occurs in a wide range of human cancers, including the most common epithelial cancers. However we believe MET may only be an oncogenic driver in some, but not all of these cancers. Recall EXEL’s cabozantinib is already approved to treat patients with Medullary Thyroid Cancer (MTC). Interestingly 80% of patients in EXEL's EXAM trial were RET mutation positive based on a genetic analysis, suggesting cabozantinib 's multikinase inhibition (including RET) may be beneficial. Similarly, Pfizer's crizotinib a multi-kinase inhibitor targeting Met and ALK has been approved to treat patients with metastatic NSCLC harboring a genetic ALK fusion with a frequency of ~3% in NSCLC."
Laut ARQL soll in HCC durch VEGF-Hemmung MET hochreguliert werden... vielleicht hilft das Carbo als VEGFR + MET-Hemmer ja auch etwas in der HCC PIII.
Ich habe meine nun geschrumpfte Position wieder etwas erhöht... mal schauen.
Viele Grüße
ipollit
Antwort auf Beitrag Nr.: 47.688.288 von ipollit am 03.09.14 22:13:40Ich habe meine nun geschrumpfte Position wieder etwas erhöht... mal schauen.
Habe ich heute ebenfalls gemacht.
Habe ich heute ebenfalls gemacht.
Antwort auf Beitrag Nr.: 47.705.904 von SLGramann am 05.09.14 15:53:31ganz schön mutig !
was geschieht nun mit den betroffenen partnering deal ??
was geschieht mit den kursprognosen ?
mir fehlt aktuell der mut und die balls einzusteigen, aber …?
was geschieht nun mit den betroffenen partnering deal ??
was geschieht mit den kursprognosen ?
mir fehlt aktuell der mut und die balls einzusteigen, aber …?

Antwort auf Beitrag Nr.: 47.688.288 von ipollit am 03.09.14 22:13:40EXEL / XLRN
Vergleiche zwischen Studien sollte man zwar mit Vorsicht betrachten, aber einen gewissen Hinweis können sie schon geben.
Die Carbo PI in 3rd-line+ RCC Ergebnisse, die zur METEOR-PIII geführt haben sehen auch im Vergleich z.B. mit XLRN's Dalantercept PII ganz gut aus:
"The progression-free survival (pfs) for the 25 patients was 14.7 months. With respect to tumor shrinkage, 21 patients were evaluated, and, based on RECIST criteria, of those, 7 had a partial response (>30% shrinkage), 13 had stable disease, and one had progression. In total, 19 of the 21 evaluated patients had some shrinkage, although one had progressive disease due to new lesions."
d.h. Cabozantinib Mono in 3+ RCC (N=21): PR = 33% und PR+SD = 95%
XLRN hat einen ALK-1 Hemmer Dalantercept, der einen Alternative zu VEGF-Hemmern sein kann. Bisher gibt es zur Angiogenese-Hemmung, d.h. zur Hemmung von Blutgefäß-Neubildung von Tumoren, im Wesentlichen nur VEGF-Hemmer. ALK-1 könnten synergetisch sein, also in Kombination mit VEGF-Hemmung angewendet werden.
Zwischenergebnisse aus einer laufenden PII mit einer Kombi Dalantercept + dem VGFR-Hemmer Inlyta in 3rd-line+: "In Part 1 of this ongoing study, eligible patients must have received at least one prior line of therapy with a VEGF receptor tyrosine kinase inhibitor (TKI), such as sunitinib, and may have received up to three prior therapies (second line to fourth line patients). All patients were treated with the combination of dalantercept and axitinib. The objective response rate was 25% (5 of the 20 evaluable patients) and an additional 10 patients (50%) achieved stable disease according to RECIST v1.1 criteria. By comparison, in a separate clinical trial the axitinib AXIS Phase 3 study in second line patients, in the large subgroup of sunitinib-refractory patients treated with axitinib (n=194), the objective response rate was 11.3%." http://investor.acceleronpharma.com/releasedetail.cfm?releas…
d.h. Dalantercept + Inlyta Kombi in 3+ RCC (N=20): PR = 25% und PR+SD = 75%
Theoretisch lassen sich auch Cabo + Dalantercept kombinieren.
Die zweite Indikation, in der Dalantercept getestet werden soll, ist HCC wie bei Cabozantinib.
http://files.shareholder.com/downloads/AMDA-23MZWJ/343919019…
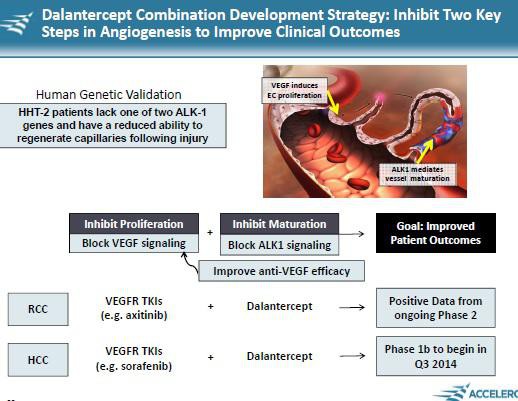


Gruß
ipollit
Vergleiche zwischen Studien sollte man zwar mit Vorsicht betrachten, aber einen gewissen Hinweis können sie schon geben.
Die Carbo PI in 3rd-line+ RCC Ergebnisse, die zur METEOR-PIII geführt haben sehen auch im Vergleich z.B. mit XLRN's Dalantercept PII ganz gut aus:
"The progression-free survival (pfs) for the 25 patients was 14.7 months. With respect to tumor shrinkage, 21 patients were evaluated, and, based on RECIST criteria, of those, 7 had a partial response (>30% shrinkage), 13 had stable disease, and one had progression. In total, 19 of the 21 evaluated patients had some shrinkage, although one had progressive disease due to new lesions."
d.h. Cabozantinib Mono in 3+ RCC (N=21): PR = 33% und PR+SD = 95%
XLRN hat einen ALK-1 Hemmer Dalantercept, der einen Alternative zu VEGF-Hemmern sein kann. Bisher gibt es zur Angiogenese-Hemmung, d.h. zur Hemmung von Blutgefäß-Neubildung von Tumoren, im Wesentlichen nur VEGF-Hemmer. ALK-1 könnten synergetisch sein, also in Kombination mit VEGF-Hemmung angewendet werden.
Zwischenergebnisse aus einer laufenden PII mit einer Kombi Dalantercept + dem VGFR-Hemmer Inlyta in 3rd-line+: "In Part 1 of this ongoing study, eligible patients must have received at least one prior line of therapy with a VEGF receptor tyrosine kinase inhibitor (TKI), such as sunitinib, and may have received up to three prior therapies (second line to fourth line patients). All patients were treated with the combination of dalantercept and axitinib. The objective response rate was 25% (5 of the 20 evaluable patients) and an additional 10 patients (50%) achieved stable disease according to RECIST v1.1 criteria. By comparison, in a separate clinical trial the axitinib AXIS Phase 3 study in second line patients, in the large subgroup of sunitinib-refractory patients treated with axitinib (n=194), the objective response rate was 11.3%." http://investor.acceleronpharma.com/releasedetail.cfm?releas…
d.h. Dalantercept + Inlyta Kombi in 3+ RCC (N=20): PR = 25% und PR+SD = 75%
Theoretisch lassen sich auch Cabo + Dalantercept kombinieren.
Die zweite Indikation, in der Dalantercept getestet werden soll, ist HCC wie bei Cabozantinib.
http://files.shareholder.com/downloads/AMDA-23MZWJ/343919019…




Gruß
ipollit
AGIO:
Ein klasse Artikel aus dem New Yorker zu Agio und AG-221:
http://www.newyorker.com/magazine/2014/09/15/transformation-…
Das nenne ich mal Journalismus. Wenn man so etwas mal mit dem vergleicht, was man in deutschen Magazinen so zu lesen bekommt, dann merkt man, wie schlecht unsere Zeitungen/Journalisten wirklich sind.
(Aber es haben immer alle die große Fresse in Deutschland, dass wir die Tollsten auf der Welt wären und die Standards setzen würden, egal, worum es geht...)
Ein klasse Artikel aus dem New Yorker zu Agio und AG-221:
http://www.newyorker.com/magazine/2014/09/15/transformation-…
Das nenne ich mal Journalismus. Wenn man so etwas mal mit dem vergleicht, was man in deutschen Magazinen so zu lesen bekommt, dann merkt man, wie schlecht unsere Zeitungen/Journalisten wirklich sind.
(Aber es haben immer alle die große Fresse in Deutschland, dass wir die Tollsten auf der Welt wären und die Standards setzen würden, egal, worum es geht...)
Antwort auf Beitrag Nr.: 47.735.526 von SLGramann am 09.09.14 18:57:01Ich hatte grade neulich drüber nachgedacht, wie sehr das Internet die Möglichkeiten in Biotech zu investieren verändert hat. Wenn ich an meine Anfangszeit denke: Artikel in den bekannten Börsenmagazinen, die nicht viel tiefer gingen (und auch heute nicht viel tiefer gehen) als "erfolgsversprechendes Medikament gegen Krebs in der Pipeline". Heute dagegen kann man sich auf der Homepage, in Investorenkonferenzen, über Experten, ... ein eigenes Bild machen. Selbst die großen Konferenzen ASCO etc. werden über Twitter ziemlich zeitnah ins Netz gebracht. Schon irre.
Der Artikel ist übrigens wirklich sehr gut recherchiert und ich finde es immer schön zu hören, dass es voran geht, auch wenn ich wie in diesem Fall nicht investiert bin. Natürlich hätte ich mich über eine Erwähnung von AMBI aber durchaus -räusper- gefreut
Der Artikel ist übrigens wirklich sehr gut recherchiert und ich finde es immer schön zu hören, dass es voran geht, auch wenn ich wie in diesem Fall nicht investiert bin. Natürlich hätte ich mich über eine Erwähnung von AMBI aber durchaus -räusper- gefreut

Antwort auf Beitrag Nr.: 47.737.104 von kmastra am 09.09.14 20:53:10Hallo kmastra,
da hast Du recht. Früher wäre für unsereins ein halbwegs verantwortliches Investieren im Biotech-Bereich ausgeschlossen gewesen. Vielleicht hätte man es über einen Fonds oder eine Beteiligungsgesellschaft versuchen können, allerdings ist das nicht mein Ding und war es nie.
Die Informationsmöglichkeiten sind heute sehr groß, aber es braucht Menschen, die die Informationen kanalisieren, bewerten und in einem größeren Kontext betrachten können.
Mir selbst fehlt dafür das Wissen und die Zeit.
Daher bin ich so sehr dankbar, für Menschen wie Ohad Hammer, der das in unglaublich wertvoller Weise schon so lange völlig kostenlos macht.
Hier im Thread möchte ich diesbezüglich ipollit hervorheben und ihm danken, dass er uns an seinen Gedanken teilhaben lässt. Ich lese beinahe jeden seiner Beiträge mit einem echten Gewinn.
Gruß
SLG
PS: Ambit habe ich ja auch im Depot. Vielleicht sind die ja wirklich ein guter Kandidat für eine Übernahme. Ich bin zum Beispiel der Meinung, dass PCYC irgendwann mal die Pipeline etwas diversifizieren sollte. Das gilt eigentlich auch für Medivation.
Eine spannende Frage ist auch, in welcher Form GILD künftig agieren werden. Die bekommen so viel Cash rein, die sollten einen Teil davon in Übernahmen stecken. Nur brauchen die eigentlich etwas ziemlich großes, damit es sich lohnt.
da hast Du recht. Früher wäre für unsereins ein halbwegs verantwortliches Investieren im Biotech-Bereich ausgeschlossen gewesen. Vielleicht hätte man es über einen Fonds oder eine Beteiligungsgesellschaft versuchen können, allerdings ist das nicht mein Ding und war es nie.
Die Informationsmöglichkeiten sind heute sehr groß, aber es braucht Menschen, die die Informationen kanalisieren, bewerten und in einem größeren Kontext betrachten können.
Mir selbst fehlt dafür das Wissen und die Zeit.
Daher bin ich so sehr dankbar, für Menschen wie Ohad Hammer, der das in unglaublich wertvoller Weise schon so lange völlig kostenlos macht.
Hier im Thread möchte ich diesbezüglich ipollit hervorheben und ihm danken, dass er uns an seinen Gedanken teilhaben lässt. Ich lese beinahe jeden seiner Beiträge mit einem echten Gewinn.
Gruß
SLG
PS: Ambit habe ich ja auch im Depot. Vielleicht sind die ja wirklich ein guter Kandidat für eine Übernahme. Ich bin zum Beispiel der Meinung, dass PCYC irgendwann mal die Pipeline etwas diversifizieren sollte. Das gilt eigentlich auch für Medivation.
Eine spannende Frage ist auch, in welcher Form GILD künftig agieren werden. Die bekommen so viel Cash rein, die sollten einen Teil davon in Übernahmen stecken. Nur brauchen die eigentlich etwas ziemlich großes, damit es sich lohnt.
Antwort auf Beitrag Nr.: 47.745.411 von SLGramann am 10.09.14 17:10:57Hallo SLGramann,
dem habe ich (wie so oft) nichts hinzuzufügen!
Ist eigentlich irgendjemand in ESPR investiert? Ich habe mir hier eine kleine Position gekauft. Anfang Oktober werden wichtige P IIb Ergebnisse erwartet:

In 2013, Esperion (ESPR) presented positive results for its LDL-C lowering drug (ETC-1002) from multiple trials. A phase II in statin-intolerant patients demonstrated a 29% placebo adjusted reduction. Based on these results, Esperion launched a phase IIb study evaluating ETC-1002 with or without Zetia vs. Zetia alone. Another trial which evaluated ETC-1002 in combination with Lipitor, demonstrated an additional 22% reduction in LDL-C levels.
As an oral drug with a mild safety profile to date (follow up is still limited), ETC-1002 may be used as another treatment line or as add-on to existing oral drugs before moving to injectible PCSK9 antibodies. The market for LDL lowering drugs is huge, so even a minority share in statin-intolerant patients (2 million in the US) represents a significant market.
2014 catalysts
The most important event will be phase IIb results in statin intolerant patients. If positive, the data will guide Esperion’s registration strategy in this indication. Potential strategies may include a head-to head trial vs. Zetia or a combination with Zetia. ETC-1002 may have a broad metabolic effect on glucose levels, weight and blood pressure. Any additional signal in the phase IIb beyond the LDL effect will boost the drug’s attractiveness.
http://www.orf-blog.com/biotech-portfolio-update-2013-summar…
http://clinicaltrials.gov/show/NCT01941836
In der Studie wird ETC-1002 u.a. auch mit Zetia verglichen. Die Chancen stehen hier ganz gut, dass der Vergleich zu Gunsten von Esperion ausgeht. Mit dem Medikament setzt Merck (insgesamt) über 2 Milliarden US$ im Jahr um. Das Patent läuft 2016 aus. Merck könnte also eventuell Interesse haben.
Konkurrenz gibt es zwar von den PCSK9, die auch besser wirken aber eben gespritzt werden.
http://www.fiercepharma.com/special-reports/zetia
http://www.fiercepharmamarketing.com/story/can-sanofiregener…
Insgesamt sehe ich bei einer Marktkapitalisierung von ca. 250 Mio $ mehr Chancen als Risiken. Die Grundannahme, dass bei vielen Patienten erstmal Statine (+ETC?) oder ETC-1002 versucht werden, um die Werte in den "grünen Bereich" zu bringen klingt plausibel.
dem habe ich (wie so oft) nichts hinzuzufügen!
Ist eigentlich irgendjemand in ESPR investiert? Ich habe mir hier eine kleine Position gekauft. Anfang Oktober werden wichtige P IIb Ergebnisse erwartet:
In 2013, Esperion (ESPR) presented positive results for its LDL-C lowering drug (ETC-1002) from multiple trials. A phase II in statin-intolerant patients demonstrated a 29% placebo adjusted reduction. Based on these results, Esperion launched a phase IIb study evaluating ETC-1002 with or without Zetia vs. Zetia alone. Another trial which evaluated ETC-1002 in combination with Lipitor, demonstrated an additional 22% reduction in LDL-C levels.
As an oral drug with a mild safety profile to date (follow up is still limited), ETC-1002 may be used as another treatment line or as add-on to existing oral drugs before moving to injectible PCSK9 antibodies. The market for LDL lowering drugs is huge, so even a minority share in statin-intolerant patients (2 million in the US) represents a significant market.
2014 catalysts
The most important event will be phase IIb results in statin intolerant patients. If positive, the data will guide Esperion’s registration strategy in this indication. Potential strategies may include a head-to head trial vs. Zetia or a combination with Zetia. ETC-1002 may have a broad metabolic effect on glucose levels, weight and blood pressure. Any additional signal in the phase IIb beyond the LDL effect will boost the drug’s attractiveness.
http://www.orf-blog.com/biotech-portfolio-update-2013-summar…
http://clinicaltrials.gov/show/NCT01941836
In der Studie wird ETC-1002 u.a. auch mit Zetia verglichen. Die Chancen stehen hier ganz gut, dass der Vergleich zu Gunsten von Esperion ausgeht. Mit dem Medikament setzt Merck (insgesamt) über 2 Milliarden US$ im Jahr um. Das Patent läuft 2016 aus. Merck könnte also eventuell Interesse haben.
Konkurrenz gibt es zwar von den PCSK9, die auch besser wirken aber eben gespritzt werden.
http://www.fiercepharma.com/special-reports/zetia
http://www.fiercepharmamarketing.com/story/can-sanofiregener…
Insgesamt sehe ich bei einer Marktkapitalisierung von ca. 250 Mio $ mehr Chancen als Risiken. Die Grundannahme, dass bei vielen Patienten erstmal Statine (+ETC?) oder ETC-1002 versucht werden, um die Werte in den "grünen Bereich" zu bringen klingt plausibel.
arry:
neuer CMO und jemand für kommerzielle Operationen.
http://biz.yahoo.com/e/140912/arry8-k.html
Ich bin perplex: Wie sicher sind sie sich wegen Binimetinib?
A
neuer CMO und jemand für kommerzielle Operationen.
http://biz.yahoo.com/e/140912/arry8-k.html
Ich bin perplex: Wie sicher sind sie sich wegen Binimetinib?
A
Antwort auf Beitrag Nr.: 47.766.552 von Axel_Olsson am 12.09.14 15:13:54Scheinbar sind sie sich da ziemlich sicher. In den letzten Präsentationen und auch im letzten Quartalsbericht war ARRY diesbezüglich sehr offensiv:
z.B:
Pipeline prioritization related to binimetinib Given the potential return of binimetinib and the investment value proposition it would represent, Array has no plans to invest internally at this time in ARRY-614, a p38/Tie2 inhibitor for myelodysplastic syndromes. In addition, Array has no plans at this time to invest further internally in ARRY-502, a CRTh2 receptor antagonist for asthma, and will only provide an update if Array finalizes a collaboration on this program.
http://investor.arraybiopharma.com/phoenix.zhtml?c=123810&p=…
Ich hoffe, dass die Umbesetzung auch mit 520 zu tun hat. Ein Blick auf den Kursverlauf legt den Schluss nahe, dass zumindest die Finanzwelt nicht an das Potenzial von 520 bzw. den im Oktober 2013 vorgelegten Plan glaubt. Seitdem tut sich zwischen ARRY und NBI eine ziemliche Schere auf.
z.B:
Pipeline prioritization related to binimetinib Given the potential return of binimetinib and the investment value proposition it would represent, Array has no plans to invest internally at this time in ARRY-614, a p38/Tie2 inhibitor for myelodysplastic syndromes. In addition, Array has no plans at this time to invest further internally in ARRY-502, a CRTh2 receptor antagonist for asthma, and will only provide an update if Array finalizes a collaboration on this program.
http://investor.arraybiopharma.com/phoenix.zhtml?c=123810&p=…
Ich hoffe, dass die Umbesetzung auch mit 520 zu tun hat. Ein Blick auf den Kursverlauf legt den Schluss nahe, dass zumindest die Finanzwelt nicht an das Potenzial von 520 bzw. den im Oktober 2013 vorgelegten Plan glaubt. Seitdem tut sich zwischen ARRY und NBI eine ziemliche Schere auf.
ich halte es für nicht unwahrscheinlich, dass sie Filanesib stillschweigend verlangsamen, denn Mike Needle, der ehemalige CMO, wurde vor etwas mehr als einem Jahr insbesondere wegen seiner Hem/Onc Erfahrung geholt. Das scheint jetzt nicht mehr im gleichen Maße gefragt zu sein.
http://www.prnewswire.com/news-releases/array-biopharma-name…
A
http://www.prnewswire.com/news-releases/array-biopharma-name…
A
Antwort auf Beitrag Nr.: 47.745.411 von SLGramann am 10.09.14 17:10:57"Eine spannende Frage ist auch, in welcher Form GILD künftig agieren werden. Die bekommen so viel Cash rein, die sollten einen Teil davon in Übernahmen stecken."
Hallo kmastra,
kurz zu ESPR: Ich habe nie Miniposition und schau einfach mal, wie es sich entwickelt. ICh denke schon, dass ETC-1002 eine Marktlücke bedienen kann, falls alles gut geht. Ich bin aber nur wenig investiert und verfolge die Entwicklung nicht sehr eng.
Nochmal zu GILD:
Hier hat sich jemand Gedanken gemacht, dass als Übernahmeziel INCY interessant sein könnte. Für meinen Geschmack ist der Artikel etwas lang und geschwätzig geworden, aber ich finde, dass die Lektüre lohnt:
http://seekingalpha.com/article/2487725-incyte-pharmaceutica…
(Nebenbei ist mir dabei aufgefallen, dass ich das Potential von Jakafi in Pancreatic Cancer vielleicht unterschätzt habe. Ich hab damals die Subgruppen-Analyse nicht wirklich ernst genommen, aber wahrscheinlich sollte man das tun.)
INCY-Website:
Top-line results from RECAP (Phase II Study of Ruxolitinib Efficacy And Safety In Combination with Capecitabine for Subjects With Recurrent Or Treatment-Refractory Metastatic Pancreatic Cancer), a double-blind, placebo-controlled trial (http://clinicaltrials.gov/show/NCT01423604), showed a hazard ratio for overall survival of 0.47 favoring the ruxolitinib arm in a prospectively defined subgroup of the patients, pre-selected as most likely to benefit from JAK pathway inhibition. The subgroup of interest represented approximately half of the randomized study population.
The U.S. Food and Drug Administration (FDA) has granted orphan status for ruxolitinib for the treatment of pancreatic cancer. Additionally, the Phase III program, which is expected to begin enrollment in the first half of 2014, includes a Special Protocol Assessment (SPA) for a registration trial of patients who failed or were intolerant to first-line therapy and who are part of the subgroup that showed benefit in the RECAP trial.
Außerdem wird in dem verlinkten Artikel viel Wirbel um das IDO1-Programm gemacht. Ich bin diesbezüglich ziemlich unsicher, was man wirklich von diesem Ansatz zu halten hat.
Hallo kmastra,
kurz zu ESPR: Ich habe nie Miniposition und schau einfach mal, wie es sich entwickelt. ICh denke schon, dass ETC-1002 eine Marktlücke bedienen kann, falls alles gut geht. Ich bin aber nur wenig investiert und verfolge die Entwicklung nicht sehr eng.
Nochmal zu GILD:
Hier hat sich jemand Gedanken gemacht, dass als Übernahmeziel INCY interessant sein könnte. Für meinen Geschmack ist der Artikel etwas lang und geschwätzig geworden, aber ich finde, dass die Lektüre lohnt:
http://seekingalpha.com/article/2487725-incyte-pharmaceutica…
(Nebenbei ist mir dabei aufgefallen, dass ich das Potential von Jakafi in Pancreatic Cancer vielleicht unterschätzt habe. Ich hab damals die Subgruppen-Analyse nicht wirklich ernst genommen, aber wahrscheinlich sollte man das tun.)
INCY-Website:
Top-line results from RECAP (Phase II Study of Ruxolitinib Efficacy And Safety In Combination with Capecitabine for Subjects With Recurrent Or Treatment-Refractory Metastatic Pancreatic Cancer), a double-blind, placebo-controlled trial (http://clinicaltrials.gov/show/NCT01423604), showed a hazard ratio for overall survival of 0.47 favoring the ruxolitinib arm in a prospectively defined subgroup of the patients, pre-selected as most likely to benefit from JAK pathway inhibition. The subgroup of interest represented approximately half of the randomized study population.
The U.S. Food and Drug Administration (FDA) has granted orphan status for ruxolitinib for the treatment of pancreatic cancer. Additionally, the Phase III program, which is expected to begin enrollment in the first half of 2014, includes a Special Protocol Assessment (SPA) for a registration trial of patients who failed or were intolerant to first-line therapy and who are part of the subgroup that showed benefit in the RECAP trial.
Außerdem wird in dem verlinkten Artikel viel Wirbel um das IDO1-Programm gemacht. Ich bin diesbezüglich ziemlich unsicher, was man wirklich von diesem Ansatz zu halten hat.
Hallo SLGrammann,
danke... naja, ich finde die Fortschritte im Biotech-Bereich interessant und hoffe auch, dass man denen, die an einer Krankheit leiden immer besser helfen kann. Früher gab es nur die großen Pharmaunternehmen, inzwischen kommen die größten Innovationen von den den vielen kleineren und größeren Biotechs. Ich habe das Gefühl, dass sich hier einfach sehr viel tut. Gelohnt hätte es sich aber mehr, einfach auf den Index zu setzen... Einzelwerte sind ziemlich riskant.
ESPR... habe ich auch auf meiner Watch-Liste. Da das Patent von Zetia wie kmastra schreibt bald ausläuft, besteht aber auch ein gewisses Risiko, dass ETC-1002 nicht deutlich besser als Zetia ist und am Ende gegen ein generisches Zetia keine Chance am Markt hat. ETC-1002 ist ja auch noch nicht in der PIII... PIIIs in diesem Bereich sind immer sehr groß und teuer (mehrere 100 Mio USD). Ein Plus ist wohl, dass bei Esperion Experten wie Roger Newton dabei sind, die bereits Lipitor entwickelt haben und sich in diesem Bereich sehr gut auskennen... http://www.forbes.com/2008/05/01/pfizer-esperion-pharmacutic…
GILD/INCY... der Artikel ist von Paul DeSantis, dessen Twitter-Beiträge ich für ganz gut halte... https://twitter.com/DrPaulyDeSantis/with_replies ähnlich wie z.B. Paul Rennert https://twitter.com/PDRennert/with_replies
INCY soll ein sehr gutes Management haben. Sie sind führend bei den JAK- und IDO-Hemmern. Wenn ich es richtig verstehe, ist JAK bei Krebs auch ein wichtiger Signalweg, so wie MAPK, zu dem MEK gehört. Bei JAK ist es der JAK/STAT-Signalweg. Letzterer spielt irgendwie bei Entzündungsreaktionen eine Rolle und Entzündungsprozesse können Krebs fördern. Viele auf z.B. twitter sehen CRP eher kritisch, sie glauben dieser Marker hätte keine Relevanz. Im Folgenden hört es sich allerdings recht positiv an. CPR scheint auch ein Entzündungsmarker zu sein, was passen würde:
"Incyte: C-Reactive Protein as Marker for Poor Survival in Cancer; Opens Solid Tumor Opportunity for Jakafi and Supports Decision to Evaluate PI3K + Jak1 Combo Study in DLBCL
We are incorporating U.S. sales of Jakafi in breast and non-small cell lung cancer (NSCLC) into our model. Our review of published literature and conversations with Incyte and its competitors suggests that positive Phase II data in pancreatic cancer last year was just the beginning. Specifically, our research points to Incyte’s use of C-reactive protein (CRP) to predict benefit in relapsed pancreatic cancer patients. Our note provides strong evidence for a much larger role of CRP across solid tumors and supports INCY's decision to evaluate '093 (PI3K inhibitor) + '110 (Jak 1 inhibitor) in diffuse large B cell lymphoma (DLBCL), an incremental $3bn opportunity.
Elevated CRP linked to: 1) tissue inflammation caused by tumor growth, 2) immunological response to presence of cancer antigens, or 3) production of inflammatory proteins by tumor cells. In addition, other studies suggest that
inflammation may promote tumor growth by creating a microenvironment where cytokines and inflammatory proteins generate malignant DNA mutations.
How Jakafi benefits patients with high CRPs? The benefit of Jakafi in cancer may primarily revolve around its antiinflammatory properties over any direct tumor effect. The Janus kinase (JAK) families of cytosolic tyrosine kinases are integral in the cytokine activating pathway, thus highly involved in the cellular processes in immunoregulatory functions. In the JAK-STAT pathway, cytokines (interferons, IL-2, IL-6, etc) activate JAKs, which phosphorylates signal transducers and activators of transcription (STAT), and controls numerous immune responses.
PI3K + Jak1 combo could open $3bn DLBCL opportunity. Role of CRP in DLBCL points to positive Phase I/II data of INCB40093 + INCB39110 in 4Q14 despite modest efficacy by PCYC's Imbruvica, GILD's Idelalisib and INFI's IPI- 145 in this setting. Positive data could lead to start of Phase III trials in 2015, enabling Incyte to catch up to its more advanced competitors.
***
INCY estimates that 30-75% of all solid tumor patients might be biomarker positive at some point in their disease, this based upon a plethora of literature reports. While management's priority remains this subgroup, it is studying ruxo in colorectal cancer (CRCA) patients in both those with and without the biomarker. Management clarified that this was being done at the FDA's behest as the Agency would like to see data validating the biomarker approach in a second tumor type, and reiterated that if successful and convincing the CRCA trial could support approval.
***
Preclinical data support a possible role for Jak inhibition in B-Cell malignancies. Certain patient subsets have STAT3 activation signatures that may make them susceptible to monotherapy approaches. There is also preclinical data supporting a combination approach with receptor signally pathway inhibitors (PI3K).
***
New roles for Jak inhibitors in multiple tumor types. Presentations suggests a rationale for combining a Jak inhibitor with a BTK inhibitor in diffuse large B cell lymphoma (DLBCL), and using Jak2 inhibition in ovarian cancer; a loss of function Jak1 mutation study could provide a broad view of where Jak1 inhibitors may be useful in oncology.
***
Novel targets offer attractive opportunities for drug development. Chief among these, in Dr. Berenson's view, was the Jak/Stat pathway based on both anecdotal clinical activity seen with Jakafi in patients with confirmed Jak2 mutations and preliminary lab work showing impressive anti-myeloma activity, irrespective of JAK mutation status. Although preliminary in nature, the data suggest Jakafi could be effective in myeloma at an appreciably lower dose than that approved for myelofibrosis, reducing the risk of associated anemia. That said, any potential development and use of Jakafi for myeloma would likely take place in the context of combination therapy."
Bald müssten ja auch die PIII-Daten zu Baricitinib kommen. Pfizers Xeljanz war ja bisher nicht sehr erfolgreich. Ich hoffe, dass Baricitinib ohne JAK3-Hemmung weniger Nebenwirkungen hat und gleichzeitig wirksamer ist. Bei oralen RA-Mitteln bin ich auch gespannt, wie die PII-Daten von INFIs pi3k-delta/gamma-Hemmer sind, die diesen Jahr kommen sollen.
IDO sehe ich auch als sehr aussichtsreich. Es sollte synergetisch mit PD-1&Co sein... immerhin hat INCY nun Entwicklungs-Partnerschaften mit allen Pharmas, die PD-1 entwickeln.
Gruß
ipollit
danke... naja, ich finde die Fortschritte im Biotech-Bereich interessant und hoffe auch, dass man denen, die an einer Krankheit leiden immer besser helfen kann. Früher gab es nur die großen Pharmaunternehmen, inzwischen kommen die größten Innovationen von den den vielen kleineren und größeren Biotechs. Ich habe das Gefühl, dass sich hier einfach sehr viel tut. Gelohnt hätte es sich aber mehr, einfach auf den Index zu setzen... Einzelwerte sind ziemlich riskant.
ESPR... habe ich auch auf meiner Watch-Liste. Da das Patent von Zetia wie kmastra schreibt bald ausläuft, besteht aber auch ein gewisses Risiko, dass ETC-1002 nicht deutlich besser als Zetia ist und am Ende gegen ein generisches Zetia keine Chance am Markt hat. ETC-1002 ist ja auch noch nicht in der PIII... PIIIs in diesem Bereich sind immer sehr groß und teuer (mehrere 100 Mio USD). Ein Plus ist wohl, dass bei Esperion Experten wie Roger Newton dabei sind, die bereits Lipitor entwickelt haben und sich in diesem Bereich sehr gut auskennen... http://www.forbes.com/2008/05/01/pfizer-esperion-pharmacutic…
GILD/INCY... der Artikel ist von Paul DeSantis, dessen Twitter-Beiträge ich für ganz gut halte... https://twitter.com/DrPaulyDeSantis/with_replies ähnlich wie z.B. Paul Rennert https://twitter.com/PDRennert/with_replies
INCY soll ein sehr gutes Management haben. Sie sind führend bei den JAK- und IDO-Hemmern. Wenn ich es richtig verstehe, ist JAK bei Krebs auch ein wichtiger Signalweg, so wie MAPK, zu dem MEK gehört. Bei JAK ist es der JAK/STAT-Signalweg. Letzterer spielt irgendwie bei Entzündungsreaktionen eine Rolle und Entzündungsprozesse können Krebs fördern. Viele auf z.B. twitter sehen CRP eher kritisch, sie glauben dieser Marker hätte keine Relevanz. Im Folgenden hört es sich allerdings recht positiv an. CPR scheint auch ein Entzündungsmarker zu sein, was passen würde:
"Incyte: C-Reactive Protein as Marker for Poor Survival in Cancer; Opens Solid Tumor Opportunity for Jakafi and Supports Decision to Evaluate PI3K + Jak1 Combo Study in DLBCL
We are incorporating U.S. sales of Jakafi in breast and non-small cell lung cancer (NSCLC) into our model. Our review of published literature and conversations with Incyte and its competitors suggests that positive Phase II data in pancreatic cancer last year was just the beginning. Specifically, our research points to Incyte’s use of C-reactive protein (CRP) to predict benefit in relapsed pancreatic cancer patients. Our note provides strong evidence for a much larger role of CRP across solid tumors and supports INCY's decision to evaluate '093 (PI3K inhibitor) + '110 (Jak 1 inhibitor) in diffuse large B cell lymphoma (DLBCL), an incremental $3bn opportunity.
Elevated CRP linked to: 1) tissue inflammation caused by tumor growth, 2) immunological response to presence of cancer antigens, or 3) production of inflammatory proteins by tumor cells. In addition, other studies suggest that
inflammation may promote tumor growth by creating a microenvironment where cytokines and inflammatory proteins generate malignant DNA mutations.
How Jakafi benefits patients with high CRPs? The benefit of Jakafi in cancer may primarily revolve around its antiinflammatory properties over any direct tumor effect. The Janus kinase (JAK) families of cytosolic tyrosine kinases are integral in the cytokine activating pathway, thus highly involved in the cellular processes in immunoregulatory functions. In the JAK-STAT pathway, cytokines (interferons, IL-2, IL-6, etc) activate JAKs, which phosphorylates signal transducers and activators of transcription (STAT), and controls numerous immune responses.
PI3K + Jak1 combo could open $3bn DLBCL opportunity. Role of CRP in DLBCL points to positive Phase I/II data of INCB40093 + INCB39110 in 4Q14 despite modest efficacy by PCYC's Imbruvica, GILD's Idelalisib and INFI's IPI- 145 in this setting. Positive data could lead to start of Phase III trials in 2015, enabling Incyte to catch up to its more advanced competitors.
***
INCY estimates that 30-75% of all solid tumor patients might be biomarker positive at some point in their disease, this based upon a plethora of literature reports. While management's priority remains this subgroup, it is studying ruxo in colorectal cancer (CRCA) patients in both those with and without the biomarker. Management clarified that this was being done at the FDA's behest as the Agency would like to see data validating the biomarker approach in a second tumor type, and reiterated that if successful and convincing the CRCA trial could support approval.
***
Preclinical data support a possible role for Jak inhibition in B-Cell malignancies. Certain patient subsets have STAT3 activation signatures that may make them susceptible to monotherapy approaches. There is also preclinical data supporting a combination approach with receptor signally pathway inhibitors (PI3K).
***
New roles for Jak inhibitors in multiple tumor types. Presentations suggests a rationale for combining a Jak inhibitor with a BTK inhibitor in diffuse large B cell lymphoma (DLBCL), and using Jak2 inhibition in ovarian cancer; a loss of function Jak1 mutation study could provide a broad view of where Jak1 inhibitors may be useful in oncology.
***
Novel targets offer attractive opportunities for drug development. Chief among these, in Dr. Berenson's view, was the Jak/Stat pathway based on both anecdotal clinical activity seen with Jakafi in patients with confirmed Jak2 mutations and preliminary lab work showing impressive anti-myeloma activity, irrespective of JAK mutation status. Although preliminary in nature, the data suggest Jakafi could be effective in myeloma at an appreciably lower dose than that approved for myelofibrosis, reducing the risk of associated anemia. That said, any potential development and use of Jakafi for myeloma would likely take place in the context of combination therapy."
Bald müssten ja auch die PIII-Daten zu Baricitinib kommen. Pfizers Xeljanz war ja bisher nicht sehr erfolgreich. Ich hoffe, dass Baricitinib ohne JAK3-Hemmung weniger Nebenwirkungen hat und gleichzeitig wirksamer ist. Bei oralen RA-Mitteln bin ich auch gespannt, wie die PII-Daten von INFIs pi3k-delta/gamma-Hemmer sind, die diesen Jahr kommen sollen.
IDO sehe ich auch als sehr aussichtsreich. Es sollte synergetisch mit PD-1&Co sein... immerhin hat INCY nun Entwicklungs-Partnerschaften mit allen Pharmas, die PD-1 entwickeln.
Gruß
ipollit
Antwort auf Beitrag Nr.: 47.778.801 von ipollit am 15.09.14 00:00:25Bei JAK ist es der JAK/STAT-Signalweg. Letzterer spielt irgendwie bei Entzündungsreaktionen eine Rolle und Entzündungsprozesse können Krebs fördern.
Hallo ipollit,
die Daten bei der entsprechenden Subgruppe bei Pankreaskrebs sind beeindruckend, aber ich kann auch die Skepsis verstehen. Das Wirkprinzip erschließt sich nicht ohne weiteres.
Klar, das hier könnte ein Erklärungsansatz sein:
In addition, other studies suggest that
inflammation may promote tumor growth by creating a microenvironment where cytokines and inflammatory proteins generate malignant DNA mutations.
How Jakafi benefits patients with high CRPs? The benefit of Jakafi in cancer may primarily revolve around its antiinflammatory properties over any direct tumor effect.
Aber warum ist so etwas nicht schon mal früher aufgefallen? Oder ist es das? Ich meine, wie lange gibt es entzündungshemmende Wirkstoffe, zum Beispiel TNF-Alpha-Hemmer? Die werden doch zehntausendfach über Jahre eingesetzt. Wäre nicht auch dort diese krebshemmende Nebenwirkung zu beobachten gewesen, wenn bspw. ein RA-Patient an Krebs erkrankt? Eher im Gegenteil muss man ja davon ausgehen, dass die Gabe solcher Präparate die Entstehung von Krebs eher fördert.
Oder läuft es normalerweise so, dass man einen TNF-Alpha-Hemmer absetzt, wenn jemand an Krebs erkrankt, so dass es nie aufgefallen ist, dass das ein positive Wirkung haben könnte?
Oder ist alles noch ganz anders?
Wie gesagt, ich verstehe die Skepsis. Aber Daten sind Daten, ob man die genauen Zusammenhänge versteht oder nicht, die Daten sprechen für sich und es wird sehr, sehr spannend, ob sich diese CRP-These durch weitere Daten bestätigen lässt.
Hallo ipollit,
die Daten bei der entsprechenden Subgruppe bei Pankreaskrebs sind beeindruckend, aber ich kann auch die Skepsis verstehen. Das Wirkprinzip erschließt sich nicht ohne weiteres.
Klar, das hier könnte ein Erklärungsansatz sein:
In addition, other studies suggest that
inflammation may promote tumor growth by creating a microenvironment where cytokines and inflammatory proteins generate malignant DNA mutations.
How Jakafi benefits patients with high CRPs? The benefit of Jakafi in cancer may primarily revolve around its antiinflammatory properties over any direct tumor effect.
Aber warum ist so etwas nicht schon mal früher aufgefallen? Oder ist es das? Ich meine, wie lange gibt es entzündungshemmende Wirkstoffe, zum Beispiel TNF-Alpha-Hemmer? Die werden doch zehntausendfach über Jahre eingesetzt. Wäre nicht auch dort diese krebshemmende Nebenwirkung zu beobachten gewesen, wenn bspw. ein RA-Patient an Krebs erkrankt? Eher im Gegenteil muss man ja davon ausgehen, dass die Gabe solcher Präparate die Entstehung von Krebs eher fördert.
Oder läuft es normalerweise so, dass man einen TNF-Alpha-Hemmer absetzt, wenn jemand an Krebs erkrankt, so dass es nie aufgefallen ist, dass das ein positive Wirkung haben könnte?
Oder ist alles noch ganz anders?
Wie gesagt, ich verstehe die Skepsis. Aber Daten sind Daten, ob man die genauen Zusammenhänge versteht oder nicht, die Daten sprechen für sich und es wird sehr, sehr spannend, ob sich diese CRP-These durch weitere Daten bestätigen lässt.
ARRY:
Novartis wird auf der ESMO PII Daten zu Binimetinib als Singleagent präsentieren.
http://epvantage.com/Universal/View.aspx?type=Story&id=53018…
http://clinicaltrials.gov/show/NCT01320085
Ron Squarrer präsentierte kürzlich auf der Morgan Stanley Konferenz:
"Trailing support" meint wohl in erster Linie, dass NOV nach der Rückgabe von Binimetinib alle Studien eine vertraglich geregelte Zeit weiterführen muss.
Interessanterweise meint es wohl aber auch (might be obtained in the contract), dass ARRY danach Zugang zu den Kombinationskandidaten für weitere Studien bekommen müsste. Man hätte als "lifecycle oportunity" dann laut RS Interesse an Lee001 in Melanoma und BYL719 für ovarian.
Als Beispiel, wie eine Rückgabe aussehen könnte, führt Squarrer OSI an, die damals Tarceva von Pfizer zurück bekamen. Ähem, das ist natürlich ein gut gewähltes Beispiel.
http://www.forbes.com/2000/06/21/mu5.html
RS sieht 700-800 Mio Umsatzpotenzial jeweils in ovarian und BRAF Melanoma.
Sowie 1 Milliarde in 2nd und 1 Milliarde in 1st line für Selumetinib in NSCLC.
Auf der ESMO will AZ voraussichtlich erste Daten zu S in 1st line vorstellen.
Zu 520 sagt er auch viel....
Ich denke erstmal wird hier ja sowieso die PII Kombistudie "Mini PIII" abgewartet (u.a. mit PFS), zudem das Endergebnis der ASPIRE Studie von Kyprolis und dann wird man sehen.
AMBI:
Laut CEO wird AMBI auf der ASH (wenn es angenommen wird) Daten zu Quizartinib als maintainance Therapie präsentieren. Dies seien "not disappointing".
In einer P II konnte ohne maintainance Therapie schon ein OS von 24 Wochen erreicht werden (3d line). Die PIII untersucht nun 2nd line das OS. Wenn im Kontrollarm (Chemo) tatsächlich wie geplant 4 Monate OS heraus kommen, würde eine statistische Signifikanz bei 6 Monaten im Q-Arm erreicht. In der interim bei 6,7. Der Effekt der maintainance Therapie könnte also durchaus entscheidend sein.
Zu der laufenden PIII soll noch dieses Jahr eine fremdfinanzierte PIII mit Q als frontline Therapie gestartet werden (da verlass ich mich aber nicht unbedingt drauf).
Eine Verpartnerung Ex-US wäre natürlich auch möglich. Laut CEO würde man aber eher erstmal die Ergebnisse der P III abwarten wollen...
Novartis wird auf der ESMO PII Daten zu Binimetinib als Singleagent präsentieren.
http://epvantage.com/Universal/View.aspx?type=Story&id=53018…
http://clinicaltrials.gov/show/NCT01320085
Ron Squarrer präsentierte kürzlich auf der Morgan Stanley Konferenz:
"Trailing support" meint wohl in erster Linie, dass NOV nach der Rückgabe von Binimetinib alle Studien eine vertraglich geregelte Zeit weiterführen muss.
Interessanterweise meint es wohl aber auch (might be obtained in the contract), dass ARRY danach Zugang zu den Kombinationskandidaten für weitere Studien bekommen müsste. Man hätte als "lifecycle oportunity" dann laut RS Interesse an Lee001 in Melanoma und BYL719 für ovarian.
Als Beispiel, wie eine Rückgabe aussehen könnte, führt Squarrer OSI an, die damals Tarceva von Pfizer zurück bekamen. Ähem, das ist natürlich ein gut gewähltes Beispiel.
http://www.forbes.com/2000/06/21/mu5.html
RS sieht 700-800 Mio Umsatzpotenzial jeweils in ovarian und BRAF Melanoma.
Sowie 1 Milliarde in 2nd und 1 Milliarde in 1st line für Selumetinib in NSCLC.
Auf der ESMO will AZ voraussichtlich erste Daten zu S in 1st line vorstellen.
Zu 520 sagt er auch viel....
Ich denke erstmal wird hier ja sowieso die PII Kombistudie "Mini PIII" abgewartet (u.a. mit PFS), zudem das Endergebnis der ASPIRE Studie von Kyprolis und dann wird man sehen.
AMBI:
Laut CEO wird AMBI auf der ASH (wenn es angenommen wird) Daten zu Quizartinib als maintainance Therapie präsentieren. Dies seien "not disappointing".
In einer P II konnte ohne maintainance Therapie schon ein OS von 24 Wochen erreicht werden (3d line). Die PIII untersucht nun 2nd line das OS. Wenn im Kontrollarm (Chemo) tatsächlich wie geplant 4 Monate OS heraus kommen, würde eine statistische Signifikanz bei 6 Monaten im Q-Arm erreicht. In der interim bei 6,7. Der Effekt der maintainance Therapie könnte also durchaus entscheidend sein.
Zu der laufenden PIII soll noch dieses Jahr eine fremdfinanzierte PIII mit Q als frontline Therapie gestartet werden (da verlass ich mich aber nicht unbedingt drauf).
Eine Verpartnerung Ex-US wäre natürlich auch möglich. Laut CEO würde man aber eher erstmal die Ergebnisse der P III abwarten wollen...
Antwort auf Beitrag Nr.: 47.858.345 von kmastra am 24.09.14 01:16:53Habe meine Array-Position noch etwas weiter ausgebaut. Bin fast wieder bei meiner ehemaligen Übergewichtung angekommen.
Ich sehe einfach kein wirklich realistisches Szenario, in dem Array mit Binimetinib so richtig verliert (es sei denn, der Wirkstoff floppt komplett). Mir scheint die Unsicherheit eher darin zu bestehen, wie viel genau Array von Binimetinib haben wird. Für eine solche Art von Unsicherheit scheint mir die Abwertung des Wirkstoffkandidaten durch die Börse auf Null als übertrieben.
ESPR: Nach einer langen Phase eher schwächerer Kurse, notiert die Aktie zuletzt wieder fester. Konnte dafür jetzt aber keinen konkreten Grund ausmachen.
Ich sehe einfach kein wirklich realistisches Szenario, in dem Array mit Binimetinib so richtig verliert (es sei denn, der Wirkstoff floppt komplett). Mir scheint die Unsicherheit eher darin zu bestehen, wie viel genau Array von Binimetinib haben wird. Für eine solche Art von Unsicherheit scheint mir die Abwertung des Wirkstoffkandidaten durch die Börse auf Null als übertrieben.
ESPR: Nach einer langen Phase eher schwächerer Kurse, notiert die Aktie zuletzt wieder fester. Konnte dafür jetzt aber keinen konkreten Grund ausmachen.
Antwort auf Beitrag Nr.: 47.778.801 von ipollit am 15.09.14 00:00:25Gelohnt hätte es sich aber mehr, einfach auf den Index zu setzen... Einzelwerte sind ziemlich riskant
Hallo ipollit, das ist schon ein interessanter Punkt und das ist auch wirklich etwas enttäuschend. Selbst das Depot von Hammer lag zuletzt ja hinter einem Biotech-Index-Fonds zurück.
Woran liegts?
Ich glaube zum einen liegt das daran, dass die großen Biotechs in den letzten Monaten und Jahren sehr gut gelaufen sind (GILD!, CELG, BIIB, REGN, selbst AMGN, aber auch so etwas wie VRTX).
Das haben wir wahrscheinlich zur falschen Zeit etwas vernachlässigt. Sicher werden sich die Wachstumsraten der Großen in den nächsten Jahren abschwächen und das wird sich auch auf die Indizes auswirken, aber in den letzten Jahren war eben Party - und die war ja absolut berechtigt.
Zum anderen komme ich immer mehr zu dem Schluss, dass man sich auf überragende Qualität konzentrieren sollte, wenn man bestimmte Wirkstoffkandidaten beurteilt. Viele unserer Gedanken gehen in die Richtung "vielleicht nicht brilliant, aber schön billig". Ich habe nicht das Gefühl, dass das ein wirklich guter Ansatz ist. Richtig überzeugende Entwicklungen waren bspw. Ibrutinib von PCYC, Jakafi von INCY oder Sovaldi von GILD. Möglicherweise gehören die Programme von AGIO auch in diese Kategorie. Höchstwahrscheinlich gilt das auch für Daratumumab von Genmab.
Bei bspw. Arqule, Exelixis, Synta usw. läuft die Argumentation eher über den Preis und langfristige Hoffnungen, dass sich alles irgendwie zum Guten wendet. Dass künftige Daten/Projekte wesentlich besser sein mögen, als das, was man bisher gesehen hat.
Das kann natürlich durchaus aufgehen, aber 1.) ist das Risiko hoch und 2.) hat man teils über Jahre echte Underperformer im Depot.
Tendenziell würde ich sagen, dass auf Sicht von 1 oder 2 Jahren das Risiko einer Biotechinvestments eher dadurch bestimmt wird, welche Pipelinequalität man gekauft hat, als davon zu welchem Preis man diese Qualität gekauft hat.
Nicht, dass Bewertungen unwichtig wären. Das will ich ganz sicher nicht sagen! Aber in dieser Branche ist die Qualitätsfrage eindeutig prioritär. Und mein Eindruck ist eben dass Qualitätszuschreibungen wie "ziemlich interessant" oder ähnliches vielleicht nicht ausreichen. Mit den wirklich brillianten Entwicklungen fährt man vielleicht besser, auch wenn man dann weniger stark streuen kann.
Viele Grüße
SLG
Hallo ipollit, das ist schon ein interessanter Punkt und das ist auch wirklich etwas enttäuschend. Selbst das Depot von Hammer lag zuletzt ja hinter einem Biotech-Index-Fonds zurück.
Woran liegts?
Ich glaube zum einen liegt das daran, dass die großen Biotechs in den letzten Monaten und Jahren sehr gut gelaufen sind (GILD!, CELG, BIIB, REGN, selbst AMGN, aber auch so etwas wie VRTX).
Das haben wir wahrscheinlich zur falschen Zeit etwas vernachlässigt. Sicher werden sich die Wachstumsraten der Großen in den nächsten Jahren abschwächen und das wird sich auch auf die Indizes auswirken, aber in den letzten Jahren war eben Party - und die war ja absolut berechtigt.
Zum anderen komme ich immer mehr zu dem Schluss, dass man sich auf überragende Qualität konzentrieren sollte, wenn man bestimmte Wirkstoffkandidaten beurteilt. Viele unserer Gedanken gehen in die Richtung "vielleicht nicht brilliant, aber schön billig". Ich habe nicht das Gefühl, dass das ein wirklich guter Ansatz ist. Richtig überzeugende Entwicklungen waren bspw. Ibrutinib von PCYC, Jakafi von INCY oder Sovaldi von GILD. Möglicherweise gehören die Programme von AGIO auch in diese Kategorie. Höchstwahrscheinlich gilt das auch für Daratumumab von Genmab.
Bei bspw. Arqule, Exelixis, Synta usw. läuft die Argumentation eher über den Preis und langfristige Hoffnungen, dass sich alles irgendwie zum Guten wendet. Dass künftige Daten/Projekte wesentlich besser sein mögen, als das, was man bisher gesehen hat.
Das kann natürlich durchaus aufgehen, aber 1.) ist das Risiko hoch und 2.) hat man teils über Jahre echte Underperformer im Depot.
Tendenziell würde ich sagen, dass auf Sicht von 1 oder 2 Jahren das Risiko einer Biotechinvestments eher dadurch bestimmt wird, welche Pipelinequalität man gekauft hat, als davon zu welchem Preis man diese Qualität gekauft hat.
Nicht, dass Bewertungen unwichtig wären. Das will ich ganz sicher nicht sagen! Aber in dieser Branche ist die Qualitätsfrage eindeutig prioritär. Und mein Eindruck ist eben dass Qualitätszuschreibungen wie "ziemlich interessant" oder ähnliches vielleicht nicht ausreichen. Mit den wirklich brillianten Entwicklungen fährt man vielleicht besser, auch wenn man dann weniger stark streuen kann.
Viele Grüße
SLG
Antwort auf Beitrag Nr.: 47.889.137 von SLGramann am 26.09.14 23:44:34"Konnte dafür jetzt aber keinen konkreten Grund ausmachen."
Der Grund scheint in folgender Präsentation zu liegen:
Esperion Therapeutics to Present at BioCentury's NewsMakers in the Biotech Industry Conference
https://www.webcaster4.com/Webcast/Page/392/5560
PIIb-Topline für ETC-1002 kommt schon Anfang Oktober.
Gut möglich, dass das Unternehmen nach den (hoffentlich überzeugenden) Daten wirklich in den Fokus kommt.
Man will Ende 2015 in die PIII (dann sicher mit Partner).
Ich habe ein gutes Gefühl hier.
Der Grund scheint in folgender Präsentation zu liegen:
Esperion Therapeutics to Present at BioCentury's NewsMakers in the Biotech Industry Conference
https://www.webcaster4.com/Webcast/Page/392/5560
PIIb-Topline für ETC-1002 kommt schon Anfang Oktober.
Gut möglich, dass das Unternehmen nach den (hoffentlich überzeugenden) Daten wirklich in den Fokus kommt.
Man will Ende 2015 in die PIII (dann sicher mit Partner).
Ich habe ein gutes Gefühl hier.
CLDX:
Nach gefühlten 1.000 Jahren hat die Rindo-PIII die Rekrutierung offiziell beendet:
http://www.clinicaltrials.gov/ct2/show/study/NCT01480479?ter…
Es ist hoch anerkennenswert, was Celldex hier nach dem Pfizer-Ausstieg allein auf die Beine gestellt hat. Ich hoffe sehr, dass Pfizer hier noch viel Grund haben wird, sich richtig zu ärgern!
Nach gefühlten 1.000 Jahren hat die Rindo-PIII die Rekrutierung offiziell beendet:
http://www.clinicaltrials.gov/ct2/show/study/NCT01480479?ter…
Es ist hoch anerkennenswert, was Celldex hier nach dem Pfizer-Ausstieg allein auf die Beine gestellt hat. Ich hoffe sehr, dass Pfizer hier noch viel Grund haben wird, sich richtig zu ärgern!
AMBI:
Übernahme für 15 Dollar. Weiß gar nicht, ob ich mich da freuen soll...
Daiichi Sankyo is paying $315 million in cash – or $15 a share – for Ambit ($AMBI), with the rest in contingent value rights based on commercialization goals.
http://www.fiercebiotech.com/story/daiichi-sankyo-bags-leuke…
Eine Übernahme stand natürlich hier durchaus im Raum.
Übernahme für 15 Dollar. Weiß gar nicht, ob ich mich da freuen soll...
Daiichi Sankyo is paying $315 million in cash – or $15 a share – for Ambit ($AMBI), with the rest in contingent value rights based on commercialization goals.
http://www.fiercebiotech.com/story/daiichi-sankyo-bags-leuke…
Eine Übernahme stand natürlich hier durchaus im Raum.
Antwort auf Beitrag Nr.: 47.895.458 von SLGramann am 29.09.14 07:13:12Putziger deal ubrigens mit dem cvr-anteil. Sowas hatte ich noch nie. Bin gespannt, wie der Markt das einpreist. Aus dem Bauch rechne ich mit einem Kurs von 17 Dollar heute.
Antwort auf Beitrag Nr.: 47.895.740 von SLGramann am 29.09.14 08:26:22Hallo SLGramann,
tja ich weiß auch nicht, ob man sich da jetzt freuen soll. Für mich war AMBI bis in den Sommer 2015 eh ein Verdopplungskandidat. Der Markt hat die Erfolgsaussichten und auch das Marktpotenzial von Quizartinib überhaupt nicht eingepreist. Es ist zumindest für Daiischi Sankyo ein guter Deal.
Die CVrs könnten noch eine große Rolle spielen. Normalerweise sind diese dann handelbar. Es wird später sicher noch bekannt gegeben werden, bei welchen Ereignissen welche Beträge an die Inhaber der Cvrs fließen. Ich könnte mit vorstellen, dass ein Erfolg der PIII, Zulassung und gewisse Umsatzziele dort beinhaltet sind.
Eventuell kann man auf diesem Umweg noch auf einen Erfolg von Quizartinib setzen...
SG kmastra
tja ich weiß auch nicht, ob man sich da jetzt freuen soll. Für mich war AMBI bis in den Sommer 2015 eh ein Verdopplungskandidat. Der Markt hat die Erfolgsaussichten und auch das Marktpotenzial von Quizartinib überhaupt nicht eingepreist. Es ist zumindest für Daiischi Sankyo ein guter Deal.
Die CVrs könnten noch eine große Rolle spielen. Normalerweise sind diese dann handelbar. Es wird später sicher noch bekannt gegeben werden, bei welchen Ereignissen welche Beträge an die Inhaber der Cvrs fließen. Ich könnte mit vorstellen, dass ein Erfolg der PIII, Zulassung und gewisse Umsatzziele dort beinhaltet sind.
Eventuell kann man auf diesem Umweg noch auf einen Erfolg von Quizartinib setzen...
SG kmastra
Heute ist ja auf der ESMO auch noch ein wichtiger Tag für EXEL.
Mich können die Ergebnisse von coBRIM nicht so recht begeistern. Ich hatte auf einen Vorteil gegenüber Mekinist gehofft. Man muss aber sicherlich auch sehen, dass EXEL an der Börse nur noch mit 300 Mio $ bewertet ist.
http://www.reuters.com/article/2014/09/29/health-cancer-roch…
http://www.roche.com/investors/ir_update/inv-update-2014-09-…
Mich können die Ergebnisse von coBRIM nicht so recht begeistern. Ich hatte auf einen Vorteil gegenüber Mekinist gehofft. Man muss aber sicherlich auch sehen, dass EXEL an der Börse nur noch mit 300 Mio $ bewertet ist.
http://www.reuters.com/article/2014/09/29/health-cancer-roch…
http://www.roche.com/investors/ir_update/inv-update-2014-09-…
Antwort auf Beitrag Nr.: 47.897.447 von kmastra am 29.09.14 11:02:21Hallo kmastra,
IRC-Daten sind sogar besser und hier hätte man dann eine Differenzierung zu GSK. Eigentlich erstaunlich. Weiß aber nicht, ob das viel bedeutet.
The trial met its primary endpoint of demonstrating a statistically significant increase in investigator-determined progression-free survival (PFS). The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR]=0.51, 95 percent CI 0.39-0.68; p<0.0001), demonstrating the combination reduced the risk of the disease worsening by half (49 percent). The median PFS by independent review committee (IRC), a secondary endpoint, was 11.3 months for the combination arm compared to 6.0 months for the control arm (HR=0.60, 95 percent CI 0.45-0.79; p=0.0003).
IRC-Daten sind sogar besser und hier hätte man dann eine Differenzierung zu GSK. Eigentlich erstaunlich. Weiß aber nicht, ob das viel bedeutet.
The trial met its primary endpoint of demonstrating a statistically significant increase in investigator-determined progression-free survival (PFS). The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR]=0.51, 95 percent CI 0.39-0.68; p<0.0001), demonstrating the combination reduced the risk of the disease worsening by half (49 percent). The median PFS by independent review committee (IRC), a secondary endpoint, was 11.3 months for the combination arm compared to 6.0 months for the control arm (HR=0.60, 95 percent CI 0.45-0.79; p=0.0003).
Antwort auf Beitrag Nr.: 47.899.676 von SLGramann am 29.09.14 15:10:58Hallo SLGramann,
der Unterschied im PFS ist schon verwirrend, zumal es die Vergleichbarkeit mit anderen Studien schwer macht. Ohad Hammer dazu:
PFS can be assessed by the treating physician or by indpendent reviewers (IRC). IRC assessment is viewed as more reliable and conservative as it is not impacted by physician bias (especially in cases where the physician knows if the patient is on the active arm or the control arm). In this case, the better PFS per IRC is surprising but not unprecedented, may emanate from physicians’ ability to determine progression based on clinical signs (clinical progression) and not only based on a CT scan.
Merkwürdig allerdings, dass bei der Beurteilung der behandelnden Ärzte Cobi schlechter weg kommt (auch was den Kontrollarm betrifft).
Heute ist ja echt was los. Was mich bei AMBI stört ist, dass es keinen CC zur Übernahme gibt. Es wird auch nicht näher erläutert, was die CVRs nun genau beinhalten. Zumindest meine email wurde prompt beantwortet. Es wird auf die kommenden SEC-Filings verwiesen. Der Markt tut sich entsprechend schwer, die CVRs zu bewerten. Mein Gefühl ist, dass sie mehr Wert sein werden als 40 Cent.
Noch was zu EXEL (interessante Überlegungen zur Kombintion):
http://epvantage.com/Universal/View.aspx?type=Story&id=53213…
Ältere Artikel zu ESPR:
http://www.forbes.com/sites/matthewherper/2013/04/25/emergin…
http://www.forbes.com/sites/johnlamattina/2013/09/05/esperio…
SG kmastra
der Unterschied im PFS ist schon verwirrend, zumal es die Vergleichbarkeit mit anderen Studien schwer macht. Ohad Hammer dazu:
PFS can be assessed by the treating physician or by indpendent reviewers (IRC). IRC assessment is viewed as more reliable and conservative as it is not impacted by physician bias (especially in cases where the physician knows if the patient is on the active arm or the control arm). In this case, the better PFS per IRC is surprising but not unprecedented, may emanate from physicians’ ability to determine progression based on clinical signs (clinical progression) and not only based on a CT scan.
Merkwürdig allerdings, dass bei der Beurteilung der behandelnden Ärzte Cobi schlechter weg kommt (auch was den Kontrollarm betrifft).
Heute ist ja echt was los. Was mich bei AMBI stört ist, dass es keinen CC zur Übernahme gibt. Es wird auch nicht näher erläutert, was die CVRs nun genau beinhalten. Zumindest meine email wurde prompt beantwortet. Es wird auf die kommenden SEC-Filings verwiesen. Der Markt tut sich entsprechend schwer, die CVRs zu bewerten. Mein Gefühl ist, dass sie mehr Wert sein werden als 40 Cent.
Noch was zu EXEL (interessante Überlegungen zur Kombintion):
http://epvantage.com/Universal/View.aspx?type=Story&id=53213…
Ältere Artikel zu ESPR:
http://www.forbes.com/sites/matthewherper/2013/04/25/emergin…
http://www.forbes.com/sites/johnlamattina/2013/09/05/esperio…
SG kmastra
Antwort auf Beitrag Nr.: 47.901.977 von kmastra am 29.09.14 19:02:02 Heute ist ja echt was los. Was mich bei AMBI stört ist, dass es keinen CC zur Übernahme gibt. Es wird auch nicht näher erläutert, was die CVRs nun genau beinhalten. Zumindest meine email wurde prompt beantwortet. Es wird auf die kommenden SEC-Filings verwiesen. Der Markt tut sich entsprechend schwer, die CVRs zu bewerten. Mein Gefühl ist, dass sie mehr Wert sein werden als 40 Cent.
AMBI jetzt mit einer Mitteilung:
At the Offer Acceptance Time, Parent and a rights agent, will enter into a Contingent Value Rights Agreement governing the terms of the CVRs. Each holder shall be entitled to one CVR for each Share outstanding (i) that the Purchaser accepts for payment from such holder pursuant to the Offer or (ii) owned by or issued to such holder as of immediately prior to the Effective Time and converted into the right to receive the Offer Price pursuant to the Merger Agreement, and one CVR for each Share subject to an In-the-money Option that is then outstanding and unexercised, whether or not vested, immediately prior to the Effective Time, each Share issuable in settlement of an RSU that is then outstanding immediately prior to the Effective Time, and each Share issuable upon the exercise of an In-the-money Warrant that is then outstanding and unexercised, immediately prior to the Effective Time (to the extent permitted pursuant to the applicable warrant). The CVRs are not transferable, will not be certificated or evidenced by any instrument and will not be registered or listed for trading.
A holder of a CVR will be entitled to a cash payment of $2.25 upon the first commercial sale in the United States following marketing authorization of a product for remission induction in patients with acute myeloid leukemia ("AML"), either alone or in combination with any other therapy, if the product's marketing authorization does not require that a patient have received at least one prior systemic therapy for AML, plus an additional $2.25 upon the first commercial sale in the US following marketing authorization of a product for the treatment of relapsed or refractory FLT3-positive AML in patients who have received at least one prior systemic therapy for AML.
http://biz.yahoo.com/e/140929/ambi8-k.html
AMBI jetzt mit einer Mitteilung:
At the Offer Acceptance Time, Parent and a rights agent, will enter into a Contingent Value Rights Agreement governing the terms of the CVRs. Each holder shall be entitled to one CVR for each Share outstanding (i) that the Purchaser accepts for payment from such holder pursuant to the Offer or (ii) owned by or issued to such holder as of immediately prior to the Effective Time and converted into the right to receive the Offer Price pursuant to the Merger Agreement, and one CVR for each Share subject to an In-the-money Option that is then outstanding and unexercised, whether or not vested, immediately prior to the Effective Time, each Share issuable in settlement of an RSU that is then outstanding immediately prior to the Effective Time, and each Share issuable upon the exercise of an In-the-money Warrant that is then outstanding and unexercised, immediately prior to the Effective Time (to the extent permitted pursuant to the applicable warrant). The CVRs are not transferable, will not be certificated or evidenced by any instrument and will not be registered or listed for trading.
A holder of a CVR will be entitled to a cash payment of $2.25 upon the first commercial sale in the United States following marketing authorization of a product for remission induction in patients with acute myeloid leukemia ("AML"), either alone or in combination with any other therapy, if the product's marketing authorization does not require that a patient have received at least one prior systemic therapy for AML, plus an additional $2.25 upon the first commercial sale in the US following marketing authorization of a product for the treatment of relapsed or refractory FLT3-positive AML in patients who have received at least one prior systemic therapy for AML.
http://biz.yahoo.com/e/140929/ambi8-k.html
Antwort auf Beitrag Nr.: 47.903.663 von kmastra am 29.09.14 22:32:17AMBI:
Ich hätte nicht gedacht, dass der Markt die CVRs nur mit 10% ihres Nominalwertes preist.
Natürlich muss man sie diskontieren, weil sie erst in Zukunft fällig werden können und natürlich muss man einen Sicherheitsabschlag vornehmen, weil sie vielleicht nie fällig werden, aber dass man diese Abschläge insgesamt auf 90% setzt, nachdem Daiichi ja gerade dokumentiert hat, dass sie quizartinib jetzt nicht sooo aussichtslos und scheiße finden...?
Ich hatte mit einem Sicherheitsabschlag von 50% gerechnet und hatte deshalb Kurse von ca. 17 Dollar erwartet.
Tja, Mr. Market... immer schön vorsichtig, es sei denn es kommt eine Räuberpistole Marke Alibaba oder so etwas des Weges, dann herrscht Euphorie.
PS: Sehe es derzeit gar nicht ein, meine AMBIs zu verkaufen. Kann man sich alles in Ruhe anschauen, denke ich mal.
Ich hätte nicht gedacht, dass der Markt die CVRs nur mit 10% ihres Nominalwertes preist.
Natürlich muss man sie diskontieren, weil sie erst in Zukunft fällig werden können und natürlich muss man einen Sicherheitsabschlag vornehmen, weil sie vielleicht nie fällig werden, aber dass man diese Abschläge insgesamt auf 90% setzt, nachdem Daiichi ja gerade dokumentiert hat, dass sie quizartinib jetzt nicht sooo aussichtslos und scheiße finden...?
Ich hatte mit einem Sicherheitsabschlag von 50% gerechnet und hatte deshalb Kurse von ca. 17 Dollar erwartet.
Tja, Mr. Market... immer schön vorsichtig, es sei denn es kommt eine Räuberpistole Marke Alibaba oder so etwas des Weges, dann herrscht Euphorie.
PS: Sehe es derzeit gar nicht ein, meine AMBIs zu verkaufen. Kann man sich alles in Ruhe anschauen, denke ich mal.
Antwort auf Beitrag Nr.: 47.920.703 von SLGramann am 01.10.14 15:48:30Hallo SLGramann,
ich rechne damit, dass die Kurse bei AMBI im Laufe der Zeit langsam ansteigen. Die Übernahme soll in Q4 vollzogen werden. Einige nehmen da jetzt lieber das Geld mit und investieren woanders. Anderseits lockt der CVR mit einer Rendite im niedrigen zweistelligen Bereich, selbst wenn nur ein Ziel erreicht wird.
Wirklich Schade, dass die Teile nicht handelbar sein werden...
Ich habe mich entschlossen, die Hälfte meiner Position zu verkaufen und bei der anderen Hälfte die Übernahme abzuwarten. Denke ich werde bei CLVS, ARRY und ARQL schrittweise nachkaufen. Zudem habe ich bei FMI und MGNX bereits kleine Positionen gekauft.
SG kmastra
ich rechne damit, dass die Kurse bei AMBI im Laufe der Zeit langsam ansteigen. Die Übernahme soll in Q4 vollzogen werden. Einige nehmen da jetzt lieber das Geld mit und investieren woanders. Anderseits lockt der CVR mit einer Rendite im niedrigen zweistelligen Bereich, selbst wenn nur ein Ziel erreicht wird.
Wirklich Schade, dass die Teile nicht handelbar sein werden...
Ich habe mich entschlossen, die Hälfte meiner Position zu verkaufen und bei der anderen Hälfte die Übernahme abzuwarten. Denke ich werde bei CLVS, ARRY und ARQL schrittweise nachkaufen. Zudem habe ich bei FMI und MGNX bereits kleine Positionen gekauft.
SG kmastra
ESPR:
Bei Esperion hat man "Anfang Oktober" sehr genau genommen und heute die Ergebnisse der PIIb veröffentlicht:
http://investor.esperion.com/releasedetail.cfm?ReleaseID=874…
Das sie positiv ausfallen war ja mehr oder weniger erwartbar. (ETC-1002 wirkt signifikant besser als ezetimibe)
Was mich positiv überrascht sind vor allem die Ergebnisse der Kombination von ETC-1002 und ezetimibe:
In patients who received the combination of 120 mg of ETC-1002 and 10 mg ezetimibe, substantial LDL-cholesterol reductions of 43 percent were significantly different from ezetimibe alone (p < 0.0001). In patients who received the combination of 180 mg of ETC-1002 and 10 mg ezetimibe, substantial LDL-cholesterol reductions of 48 percent were significantly different from ezetimibe (p < 0.0001). These reductions occurred within the first two weeks of dosing and continued throughout the treatment period.
Wichtig natürlich auch, dass es keine negativen überraschungen bei der Sicherheit gab.
Aber: Die große Frage ist jetzt, wie die PIII aussehen wird. Es steht zu befürchten, dass sich die FDA mit der Erhebung von LDL ... über dann sicher einen längeren Zeitraum als 12 Wochen nicht zufrieden geben wird. Dann käme es darauf an, in einer sehr langen und teuren Studie nachzuweisen, dass man Herzinfarkte... tatsächlich verhindern kann. Hier stehen in einigen Wochen wichtige Ergebnisse an. Aber selbst wenn diese negativ wären, muss man sehen was dann in Gesprächen mit der FDA herauskommt. Klar ist auch, dass es einen großen Bedarf gäbe. Herzkreislauferkrankungen sind immerhin Todesursache Nummer 1. Links zu Improve-it
http://www.forbes.com/sites/johnlamattina/2013/03/18/cholest…
http://www.forbes.com/sites/larryhusten/2013/11/15/the-fate-…
Bei Esperion hat man "Anfang Oktober" sehr genau genommen und heute die Ergebnisse der PIIb veröffentlicht:
http://investor.esperion.com/releasedetail.cfm?ReleaseID=874…
Das sie positiv ausfallen war ja mehr oder weniger erwartbar. (ETC-1002 wirkt signifikant besser als ezetimibe)
Was mich positiv überrascht sind vor allem die Ergebnisse der Kombination von ETC-1002 und ezetimibe:
In patients who received the combination of 120 mg of ETC-1002 and 10 mg ezetimibe, substantial LDL-cholesterol reductions of 43 percent were significantly different from ezetimibe alone (p < 0.0001). In patients who received the combination of 180 mg of ETC-1002 and 10 mg ezetimibe, substantial LDL-cholesterol reductions of 48 percent were significantly different from ezetimibe (p < 0.0001). These reductions occurred within the first two weeks of dosing and continued throughout the treatment period.
Wichtig natürlich auch, dass es keine negativen überraschungen bei der Sicherheit gab.
Aber: Die große Frage ist jetzt, wie die PIII aussehen wird. Es steht zu befürchten, dass sich die FDA mit der Erhebung von LDL ... über dann sicher einen längeren Zeitraum als 12 Wochen nicht zufrieden geben wird. Dann käme es darauf an, in einer sehr langen und teuren Studie nachzuweisen, dass man Herzinfarkte... tatsächlich verhindern kann. Hier stehen in einigen Wochen wichtige Ergebnisse an. Aber selbst wenn diese negativ wären, muss man sehen was dann in Gesprächen mit der FDA herauskommt. Klar ist auch, dass es einen großen Bedarf gäbe. Herzkreislauferkrankungen sind immerhin Todesursache Nummer 1. Links zu Improve-it
http://www.forbes.com/sites/johnlamattina/2013/03/18/cholest…
http://www.forbes.com/sites/larryhusten/2013/11/15/the-fate-…
ESPR
"PIIb-Topline für ETC-1002 kommt schon Anfang Oktober.
Gut möglich, dass das Unternehmen nach den (hoffentlich überzeugenden) Daten wirklich in den Fokus kommt."
dies scheint der Fall zu sein... nachbörslich deutlich im Plus

Grüße
ipollit
"PIIb-Topline für ETC-1002 kommt schon Anfang Oktober.
Gut möglich, dass das Unternehmen nach den (hoffentlich überzeugenden) Daten wirklich in den Fokus kommt."
dies scheint der Fall zu sein... nachbörslich deutlich im Plus
Grüße
ipollit
Antwort auf Beitrag Nr.: 47.923.685 von kmastra am 01.10.14 19:30:13"Einige nehmen da jetzt lieber das Geld mit und investieren woanders"... relativ gesehen ist der Übernahmepreis mit fast +100% okay, aber eigentlich hätte Quizartinib gefühlt mehr Potential gehabt. Ich hätte AMBI gerne auch bis zu den PIII-Ergebnissen gehalten - schade! Diese CVRs sind nicht so mein Fall, obwohl sie sich irgendwann schon lohnen könnten, wenn man bis zum Abschluss der Übernahme warten kann. Dauert das nun nicht aber noch Wochen/Monate? Gewinne werden sie nicht vor 2017 abwerfen, oder? Andererseits ist es ein praktisch risikoloser Bonus.
So entscheidend ist es für mich nun auch nicht, so dass ich das Geld mitgenommen habe. Dafür habe ich MGNX ein wenig erhöht und zwei neue Positionen Tesaro (TSRO) und FivePrime (FPRX) ins Depot genommen.
TSRO...
- für NK-1-Hemmer Rolapitant gegen Übelkeit und Erbrechen bei Chemotherapien ist die FDA-Zulassung beantragt. Es gibt zwar Konkurrenten, doch das Management hat in diesem Bereich Erfahrung (war bei MGI erfolgreich mit Aloxi) und könnte darüber einen größeren Marktanteil erreichen. WW peak sales vielleicht 750 Mio USD
- PARP-Hemmer Niraparib ist ein Konkurrent von CLVS's Rucaparib oder AZN's Olaparib. PIII-Daten in Eierstock- und Brustkrebs in 2015 und 2016. Peak sales vielleicht 1+ Mrd USD
- ALK/TRK-Hemmer in PI
- IO-AKs in der Präklinik. Neben PD-1 interessant TIM3 und LAG3 AKs, insbesondere duale PD-1+TIM3 AKs sollen aussichtsreich sein.

FPRX...
- FGFR1-Trap in PI soll einer der wenigen oder der einzige AK/Trap gegen FGFR1 sein (z.B. CLVS's Lucitanib ist ein oraler Hemmer, die insgesamt mehr Nebenwirkungen als AKs haben sollen)
- CSF1R-AK gegen RA in PI. Eine weitere Indikation könnte in den nächsten Monaten Krebs in Kombi mit z.B. PD-1 sein. Ist vielleicht so kombinierbar mit IO wie z.B. INCYs IDO-Hemmer
- FGFR2b-AK habe ich mal als interessantes Target gelesen
- IO-Partnerschaft mit BMS: Protein-Technologie soll in der Lage sein, neue bisher unbekannte IO-Targets zu finden

Grüße
ipollit
So entscheidend ist es für mich nun auch nicht, so dass ich das Geld mitgenommen habe. Dafür habe ich MGNX ein wenig erhöht und zwei neue Positionen Tesaro (TSRO) und FivePrime (FPRX) ins Depot genommen.
TSRO...
- für NK-1-Hemmer Rolapitant gegen Übelkeit und Erbrechen bei Chemotherapien ist die FDA-Zulassung beantragt. Es gibt zwar Konkurrenten, doch das Management hat in diesem Bereich Erfahrung (war bei MGI erfolgreich mit Aloxi) und könnte darüber einen größeren Marktanteil erreichen. WW peak sales vielleicht 750 Mio USD
- PARP-Hemmer Niraparib ist ein Konkurrent von CLVS's Rucaparib oder AZN's Olaparib. PIII-Daten in Eierstock- und Brustkrebs in 2015 und 2016. Peak sales vielleicht 1+ Mrd USD
- ALK/TRK-Hemmer in PI
- IO-AKs in der Präklinik. Neben PD-1 interessant TIM3 und LAG3 AKs, insbesondere duale PD-1+TIM3 AKs sollen aussichtsreich sein.
FPRX...
- FGFR1-Trap in PI soll einer der wenigen oder der einzige AK/Trap gegen FGFR1 sein (z.B. CLVS's Lucitanib ist ein oraler Hemmer, die insgesamt mehr Nebenwirkungen als AKs haben sollen)
- CSF1R-AK gegen RA in PI. Eine weitere Indikation könnte in den nächsten Monaten Krebs in Kombi mit z.B. PD-1 sein. Ist vielleicht so kombinierbar mit IO wie z.B. INCYs IDO-Hemmer
- FGFR2b-AK habe ich mal als interessantes Target gelesen
- IO-Partnerschaft mit BMS: Protein-Technologie soll in der Lage sein, neue bisher unbekannte IO-Targets zu finden
Grüße
ipollit
Antwort auf Beitrag Nr.: 47.926.183 von ipollit am 02.10.14 00:12:03" PARP-Hemmer Niraparib ist ein Konkurrent von CLVS's Rucaparib oder AZN's Olaparib. PIII-Daten in Eierstock- und Brustkrebs in 2015 und 2016. Peak sales vielleicht 1+ Mrd USD"
Hallo ipollit,
hast Du eine Einschätzung zu der Konkurrenzsituation in diesem Bereich? Ich hab das nur so im Hinterkopf, dass der Markt CLVS´s hier kaum Chancen einräumt, weil die Konkurrenz schneller am Markt ist und bessere Daten hätte?
Kann es sein, dass Olaparib hier der Platzhirsch ist?
Hat TSRO da eine bessere Chance als CLVS?
Grüße
SLG
Hallo ipollit,
hast Du eine Einschätzung zu der Konkurrenzsituation in diesem Bereich? Ich hab das nur so im Hinterkopf, dass der Markt CLVS´s hier kaum Chancen einräumt, weil die Konkurrenz schneller am Markt ist und bessere Daten hätte?
Kann es sein, dass Olaparib hier der Platzhirsch ist?
Hat TSRO da eine bessere Chance als CLVS?
Grüße
SLG
Hallo SLGramann,
PARP-Hemmer gibt es einige in der Entwicklung... im Wesentlichen wohl AZN's Olaparib, TSRO's Niraparib, BMRN's BMN-673 und CLVS's Rucaparib. Welcher da die Nase vorn hat, ist nicht richtig klar... worauf es letztlich ankommt, ist noch offen.
Ursprünglich lag Olaparib vorne, dann gab es aber Probleme und AZN hat die Entwicklung zwischenzeitlich gestoppt. TSRO hat aufgrund der Ähnlichkeit zwischen den PARP-Hemmern nach der PI direkt mit der PIII begonnen und ist dadurch nun in etwa gleich auf mit Olaparib.
Wirkung und Nebenwirkungen scheinen ähnlich zu sein. PARP-1 ist ein Reperatur-Protein, das Beschädigungen an der DNA erkennen und reparieren kann und zwar Brüche in einem DNA-Strang. Z.B. natürliche Sauerstoff-Radikale oder auch bestimmte Chemotherapeutika oder Strahlentherapie beschädigen die DNA. Eine Beschädigung in nur einem der beiden DNA-Stränge kann mittels PARP repariert werden. Wird PARP gehemmt, kann es zu einem weiteren Bruch im zweiten Strang kommen. Dann kommen andere Reparatur-Mechanismen zum Einsatz. D.h., dass eine Hemmung von PARP vielleicht erstmal keinen Effekt hat, z.B. in gesunden Zellen. Liegen aber zusätzlich Defekte im Doppelstrang-Reparatur-Mechanismus vor, ist die Zelle am Ende so beschädigt, dass sie stirbt. Manche Krebszellen weisen solche Defekte auf (z.B. BCRA-Mutationen)... bei diesen führt eine Hemmung von PARP zu einem Absterben der Zellen, wenn Beschädigungen an der DNA auftreten.
Olaparib, Niraparib und Rucaparib wird gegen BCRA+ Eierstockkrebs getestet, Olaparib, Niraparib und BMN-673 gegen BCRA+ Brustkrebs.
BCRA ist aber nur eine Mutation, bei der PARP wirkt. CLVS versucht durch Tests von FMI andere Defekte in Reparatur-Mechanismen zu finden (homologous recombination deficient (HRD) tumors). Die bisherigen Ergebnisse weisen darauf hin, dass man so neben BCRA+ weitere Patienten-Gruppen finden kann, die auf PARP-Hemmer ansprechen. Wenn es funktioniert, hat man einen Vorteil gegenüber den Konkurrenten, da diese bisher nur BCRA+ in der PIII testen.
TSRO hat in der PIII von Niraparib gegen Eierstockkrebs aber auch einen BCRA-negativen Arm. Man konnte in den PI-Studien auch dort eine Wirkung nachweisen, obwohl diese Studien sehr klein waren, so dass die Ergebnisse mit Vorsicht zu betrachten sind. Die grundsätzliche Wirkung der PARP-Hemmer ist zwar ähnlich. Doch es kann Unterschiede in den Nebenwirkungen je nach PARP-Selektivität geben, da PARP (nur PARP-1/2 ist an der DNA-Reparatur beteiligt) noch viele anderen Funktionen hat. Die Wirkung ist im Detail auch unterschiedlich... catalytic inhibitors hemmen die Reparatur, während PARP trapping zytotoxisch wirkt. Niraparib hat z.B. ein stärkeres PARP trapping als Olaparib.
Niraparib ist ähnlich weit wie Olaparib, sowohl gegen Eierstock-, als auch gegen Brustkrebs in PIII, bei ersteren gibt es zudem die Chance auf eine Wirkung bei BCRA-. Einen klaren Gewinner gibt es allerdings bisher nicht.
http://cc.talkpoint.com/ubsx001/051914a_ep/content/70_KCX6TT…
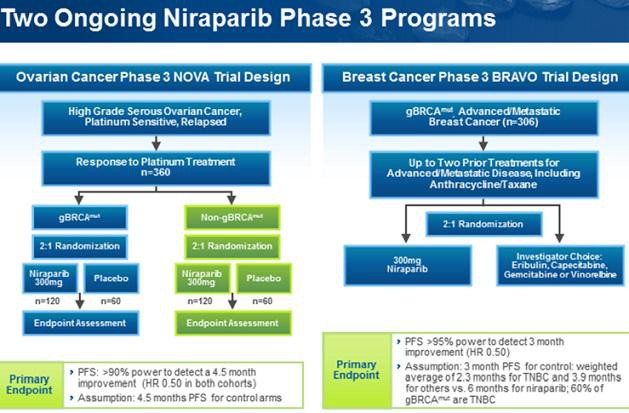
Grüße
ipollit
PARP-Hemmer gibt es einige in der Entwicklung... im Wesentlichen wohl AZN's Olaparib, TSRO's Niraparib, BMRN's BMN-673 und CLVS's Rucaparib. Welcher da die Nase vorn hat, ist nicht richtig klar... worauf es letztlich ankommt, ist noch offen.
Ursprünglich lag Olaparib vorne, dann gab es aber Probleme und AZN hat die Entwicklung zwischenzeitlich gestoppt. TSRO hat aufgrund der Ähnlichkeit zwischen den PARP-Hemmern nach der PI direkt mit der PIII begonnen und ist dadurch nun in etwa gleich auf mit Olaparib.
Wirkung und Nebenwirkungen scheinen ähnlich zu sein. PARP-1 ist ein Reperatur-Protein, das Beschädigungen an der DNA erkennen und reparieren kann und zwar Brüche in einem DNA-Strang. Z.B. natürliche Sauerstoff-Radikale oder auch bestimmte Chemotherapeutika oder Strahlentherapie beschädigen die DNA. Eine Beschädigung in nur einem der beiden DNA-Stränge kann mittels PARP repariert werden. Wird PARP gehemmt, kann es zu einem weiteren Bruch im zweiten Strang kommen. Dann kommen andere Reparatur-Mechanismen zum Einsatz. D.h., dass eine Hemmung von PARP vielleicht erstmal keinen Effekt hat, z.B. in gesunden Zellen. Liegen aber zusätzlich Defekte im Doppelstrang-Reparatur-Mechanismus vor, ist die Zelle am Ende so beschädigt, dass sie stirbt. Manche Krebszellen weisen solche Defekte auf (z.B. BCRA-Mutationen)... bei diesen führt eine Hemmung von PARP zu einem Absterben der Zellen, wenn Beschädigungen an der DNA auftreten.

Olaparib, Niraparib und Rucaparib wird gegen BCRA+ Eierstockkrebs getestet, Olaparib, Niraparib und BMN-673 gegen BCRA+ Brustkrebs.
BCRA ist aber nur eine Mutation, bei der PARP wirkt. CLVS versucht durch Tests von FMI andere Defekte in Reparatur-Mechanismen zu finden (homologous recombination deficient (HRD) tumors). Die bisherigen Ergebnisse weisen darauf hin, dass man so neben BCRA+ weitere Patienten-Gruppen finden kann, die auf PARP-Hemmer ansprechen. Wenn es funktioniert, hat man einen Vorteil gegenüber den Konkurrenten, da diese bisher nur BCRA+ in der PIII testen.
TSRO hat in der PIII von Niraparib gegen Eierstockkrebs aber auch einen BCRA-negativen Arm. Man konnte in den PI-Studien auch dort eine Wirkung nachweisen, obwohl diese Studien sehr klein waren, so dass die Ergebnisse mit Vorsicht zu betrachten sind. Die grundsätzliche Wirkung der PARP-Hemmer ist zwar ähnlich. Doch es kann Unterschiede in den Nebenwirkungen je nach PARP-Selektivität geben, da PARP (nur PARP-1/2 ist an der DNA-Reparatur beteiligt) noch viele anderen Funktionen hat. Die Wirkung ist im Detail auch unterschiedlich... catalytic inhibitors hemmen die Reparatur, während PARP trapping zytotoxisch wirkt. Niraparib hat z.B. ein stärkeres PARP trapping als Olaparib.
Niraparib ist ähnlich weit wie Olaparib, sowohl gegen Eierstock-, als auch gegen Brustkrebs in PIII, bei ersteren gibt es zudem die Chance auf eine Wirkung bei BCRA-. Einen klaren Gewinner gibt es allerdings bisher nicht.
http://cc.talkpoint.com/ubsx001/051914a_ep/content/70_KCX6TT…


Grüße
ipollit
Antwort auf Beitrag Nr.: 47.957.809 von ipollit am 06.10.14 23:34:51Hi ipollit,
vielen Dank! Werde wohl die "PARP-Karte" ausschließlich über Clovis "spielen".
Hast Du das neueste Depot-Update von Hammer gesehen?
Zu meinem Erstaunen hat er CLDX aus dem Depot genommen, weil die Bewertung zu hoch und Pipelinenachrichten zu weit weg wären. Erstaunlich deshalb, weil ich weiß, dass er eine dreifach höhere Bewertung früher schon mal gerechtfertigt hatte. Außerdem könnte es schon nächstes Jahr erste Zwischenergebnisse der PIII von Rindopepimut geben.
Insgesamt 40% Cash. Wovor hat er Angst? Dass der Gesamtmarkt crasht? Was ist heute anders als vor ein oder zwei Jahren?
Viele Grüße
SLG
PS: Vielleicht in dem Zusammenhang "Marktrisiken" oder auch nicht... Wie viel Angst sollte man als einigermaßen rationaler Mensch davor haben, dass die Ebola-Situation wirklich außer Kontrolle gerät, eventuell eine Mutation des Virus geschieht (Übertragung über den Luftweg)?
(Mein Bauchgefühl sagt mir, dass schon heute in Westafrika wesentlich mehr Menschen infiziert sind, als offiziell mitgeteilt wird.)
vielen Dank! Werde wohl die "PARP-Karte" ausschließlich über Clovis "spielen".
Hast Du das neueste Depot-Update von Hammer gesehen?
Zu meinem Erstaunen hat er CLDX aus dem Depot genommen, weil die Bewertung zu hoch und Pipelinenachrichten zu weit weg wären. Erstaunlich deshalb, weil ich weiß, dass er eine dreifach höhere Bewertung früher schon mal gerechtfertigt hatte. Außerdem könnte es schon nächstes Jahr erste Zwischenergebnisse der PIII von Rindopepimut geben.
Insgesamt 40% Cash. Wovor hat er Angst? Dass der Gesamtmarkt crasht? Was ist heute anders als vor ein oder zwei Jahren?
Viele Grüße
SLG
PS: Vielleicht in dem Zusammenhang "Marktrisiken" oder auch nicht... Wie viel Angst sollte man als einigermaßen rationaler Mensch davor haben, dass die Ebola-Situation wirklich außer Kontrolle gerät, eventuell eine Mutation des Virus geschieht (Übertragung über den Luftweg)?
(Mein Bauchgefühl sagt mir, dass schon heute in Westafrika wesentlich mehr Menschen infiziert sind, als offiziell mitgeteilt wird.)
@SLGramann
Bleibst Du drin in CLDX?
Bleibst Du drin in CLDX?
Antwort auf Beitrag Nr.: 47.958.127 von lawmeetstax am 07.10.14 06:19:53"Bleibst Du drin in CLDX?"
Ja, mit der vollen Position.
Ja, mit der vollen Position.
Hi,
hat noch jemand INFI-Aktien?
Ich überlege derzeit, meine AMBI-Position jetzt doch aufzulösen und wieder bei INFI reinzugehen. Nach der Verpartnerung von Duvelisib mit Abbvie erscheint die Geschichte ja doch wieder in einem deutlich positiveren Licht, wobei so langsam der Kurssprung, der durch die Nachricht zustande kam, wieder abgebaut wird.
hat noch jemand INFI-Aktien?
Ich überlege derzeit, meine AMBI-Position jetzt doch aufzulösen und wieder bei INFI reinzugehen. Nach der Verpartnerung von Duvelisib mit Abbvie erscheint die Geschichte ja doch wieder in einem deutlich positiveren Licht, wobei so langsam der Kurssprung, der durch die Nachricht zustande kam, wieder abgebaut wird.
Antwort auf Beitrag Nr.: 48.003.856 von SLGramann am 10.10.14 21:13:01Hi SLGramann,
meine INFI-Position habe ich noch. Siehst du INFI nach dem ABBV-Deal anders? Soweit ich es verstehe, bestand die Kritik an Duvelisib darin, dass nicht nur pi3k-delta gehemmt wird wie durch Zydelig, sondern auch pi3k-gamma. Gamma könnte mehr Nebenwirkungen hervorrufen (z.B. Lungenentzündung), während delta zur Wirkung beiträgt.
Zydelig hat insbesondere gegenüber Imbruvica ein schlechtes Label mit Black Box Warnings... dadurch ist es weniger konkurrenzfähig. Sieht es mit Duvelisib da besser aus, wenn Gamma noch mehr Probleme machen kann?
Ein weiterer möglicher negativer Punkt ist, dass durch die Zulassung von Imbruvica und Zydelig es deutlich schwieriger wird, Patienten für die PIII zu gewinnen... dadurch könnte die PIII länger dauern als geplant.
Ich habe meine INFI-Position aufgebaut, da ich Gamma nicht so negativ sehe... theoretisch und nach den bisherigen Ergebnissen könnte Duvelisib auch wirksamer sein als Zydelig, was auch an einer stärkeren Delta-Hemmung liegen könnte. Gamma erlaubt zudem eine Anwendung gegen T-Zell-Krebsarten wie PTCL oder CTCL... Imbruvica oder Zydelig wirken hier nicht.
Die Partnerschaft mit ABBV erlaubt auch eine Duvelisib + ABT-199 Kombi. ABT-199 hat ein Problem mit der Nebenwirkung TLS... allerdings kann es gegenüber Imbruvica eine höhere CR-Rate aufweisen. Jedenfalls könnte es langfristig ein Konkurrent zu Imbruvica werden, eher als Zydelig.
Besonders gespannt bin ich aber auf Duvelisib gegen immunologische Erkrankungen wie RA. Theoretisch ist die Kombination aus pi3k-delta und pi3k-gamma recht bedeutsam: z.B. https://www.scienceopen.com/document_file/c1b62b05-ccdf-4e3c… Vieleicht hat ABBV (als Vermarkter von Humira) hier auch ein Interesse (der bisherige Deal ist aber wohl nur Krebs). TGTX hat ihren pi3k-delta TGR-1202 von Rhizen. Rhizen selbst entwickelt anscheinend auch nur pi3k-delta/gamma gegen immunologische Erkrankungen wie z.B. Asthma, während pi3k-delta nur gegen Krebs getestet wird.
Momentan sieht der Markt sehr angeschlagen aus... findest du nicht? Kann man sich dann nicht auch einiges an Geld sparen, wenn man erstmal abwartet?
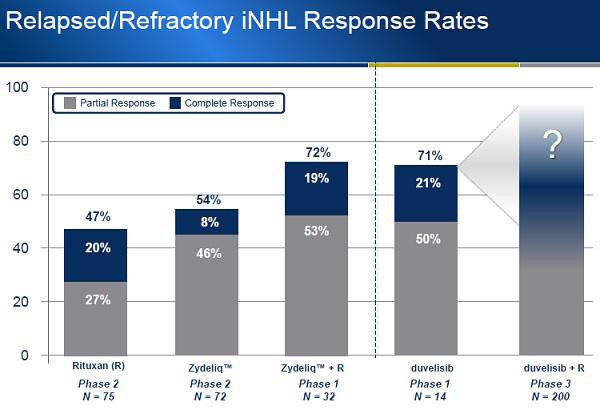
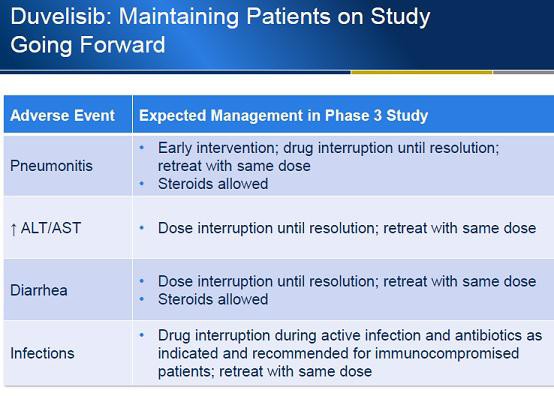
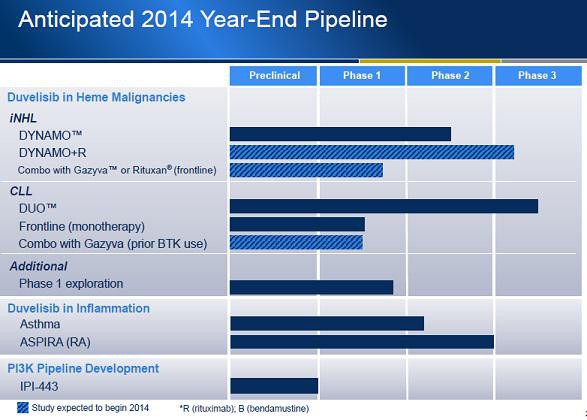
Grüße
ipollit
meine INFI-Position habe ich noch. Siehst du INFI nach dem ABBV-Deal anders? Soweit ich es verstehe, bestand die Kritik an Duvelisib darin, dass nicht nur pi3k-delta gehemmt wird wie durch Zydelig, sondern auch pi3k-gamma. Gamma könnte mehr Nebenwirkungen hervorrufen (z.B. Lungenentzündung), während delta zur Wirkung beiträgt.
Zydelig hat insbesondere gegenüber Imbruvica ein schlechtes Label mit Black Box Warnings... dadurch ist es weniger konkurrenzfähig. Sieht es mit Duvelisib da besser aus, wenn Gamma noch mehr Probleme machen kann?
Ein weiterer möglicher negativer Punkt ist, dass durch die Zulassung von Imbruvica und Zydelig es deutlich schwieriger wird, Patienten für die PIII zu gewinnen... dadurch könnte die PIII länger dauern als geplant.
Ich habe meine INFI-Position aufgebaut, da ich Gamma nicht so negativ sehe... theoretisch und nach den bisherigen Ergebnissen könnte Duvelisib auch wirksamer sein als Zydelig, was auch an einer stärkeren Delta-Hemmung liegen könnte. Gamma erlaubt zudem eine Anwendung gegen T-Zell-Krebsarten wie PTCL oder CTCL... Imbruvica oder Zydelig wirken hier nicht.
Die Partnerschaft mit ABBV erlaubt auch eine Duvelisib + ABT-199 Kombi. ABT-199 hat ein Problem mit der Nebenwirkung TLS... allerdings kann es gegenüber Imbruvica eine höhere CR-Rate aufweisen. Jedenfalls könnte es langfristig ein Konkurrent zu Imbruvica werden, eher als Zydelig.
Besonders gespannt bin ich aber auf Duvelisib gegen immunologische Erkrankungen wie RA. Theoretisch ist die Kombination aus pi3k-delta und pi3k-gamma recht bedeutsam: z.B. https://www.scienceopen.com/document_file/c1b62b05-ccdf-4e3c… Vieleicht hat ABBV (als Vermarkter von Humira) hier auch ein Interesse (der bisherige Deal ist aber wohl nur Krebs). TGTX hat ihren pi3k-delta TGR-1202 von Rhizen. Rhizen selbst entwickelt anscheinend auch nur pi3k-delta/gamma gegen immunologische Erkrankungen wie z.B. Asthma, während pi3k-delta nur gegen Krebs getestet wird.
Momentan sieht der Markt sehr angeschlagen aus... findest du nicht? Kann man sich dann nicht auch einiges an Geld sparen, wenn man erstmal abwartet?



Grüße
ipollit
Antwort auf Beitrag Nr.: 48.009.727 von ipollit am 11.10.14 21:38:08Hallo ipollit,
danke für Deine ausführliche Antwort!
"Siehst du INFI nach dem ABBV-Deal anders?"
Ja, insofern, als diese Verpartnerung für mich ein Beweis ist, dass Leute, die die Dinge unendlich viel besser einschätzen können als ich, in Duvelisib (erhebliches) Potential sehen.
Dazu kommt, dass INFI eine hohe Upfront-Zahlung erhält, was bei dem erschreckenden Cashburn des Unternehmens eine wichtige Nachricht ist. Und zumindest letzteres hat die Situation auch tatsächlich positiv verändert und nicht nur in Sachen der Wahrnehmung, zumal die gesamten Konditionen des Deals meiner Meinung nach wirklich ausgezeichnet sind.
Insgesamt stehen INFI und Duvalesib nach dem Deal doch in der öffentlichen Wahrnehmung (also auch in meiner Wahrnehmung) wesentlich stabiler und seriöser da.
Viele Grüße
SLG
Abschweifung:
"Momentan sieht der Markt sehr angeschlagen aus... findest du nicht? Kann man sich dann nicht auch einiges an Geld sparen, wenn man erstmal abwartet?"
Ja, finde ich auch und eigentlich sollte man wirklich abwarten. Vielleicht tue ich es auch. Ich war nur immer schrecklich schlecht darin, irgendetwas zu timen...
Ich kann mir durchaus vorstellen, dass wir erst am Anfang einer sehr deutlichen Korrektur stehen, gut möglicherweise eines Crashs (6.000 im DAX, 11.000 im Dow).
Aber natürlich kann es auch ganz anders kommen.
Generell bin ich sehr pessimistisch für die Zukunft. Ich denke, "wir" haben das (Wirtschafts)System so ziemlich gegen die Wand gefahren und kommen aus unseren Irrwegen auch nicht mehr raus.
Ich will das nicht im Detail auswalzen, weil das dann sehr "makro" wird und weil ich die Dinge auch komplett anders sehe, als der Mainstream. Zum Beispiel bin ich der Meinung, dass Deutschland fast alles falsch macht und keineswegs als Vorbild für die Welt taugt. Wenn man so etwas schreibt, wird man aber so gut wie nie verstanden, auch nicht, wenn man es begründet.
Darüber hinaus mache ich mir - in der kurzen Frist sozusagen - eben auch Gedanken wegen der Ebola-Epidemie.
Ich weiß, dass das unseriös und verschwörungstheoretisch klingt und ich entschuldige mich dafür, aber ich habe eben das Gefühl, dass diese Krankheit ansteckender und problematischer ist, als gesagt wird.
Jetzt lese ich, dass sich in Dallas eine Krankenschwester bei dem verstorbenen Patienten infiziert hat. Nach Spanien ist das der zweite bekannte Fall, wo sich im Westen medizinisches Personal infiziert, obwohl die Gefahren bekannt sind und Schutzmaßnahmen getroffen wurden.
Ich weiß, dass die gesamte Zahl der Kranken und Toten sehr klein ist, wenn man das mit Allerweltskrankheiten vergleicht, aber eine weitere Ausbreitung von Ebola ist für eine Panik und einen ernsthaften Einbruch der globalen Wirtschaftstätigkeit gut, obwohl der objektive Schaden gar nicht so groß werden mag.
danke für Deine ausführliche Antwort!
"Siehst du INFI nach dem ABBV-Deal anders?"
Ja, insofern, als diese Verpartnerung für mich ein Beweis ist, dass Leute, die die Dinge unendlich viel besser einschätzen können als ich, in Duvelisib (erhebliches) Potential sehen.
Dazu kommt, dass INFI eine hohe Upfront-Zahlung erhält, was bei dem erschreckenden Cashburn des Unternehmens eine wichtige Nachricht ist. Und zumindest letzteres hat die Situation auch tatsächlich positiv verändert und nicht nur in Sachen der Wahrnehmung, zumal die gesamten Konditionen des Deals meiner Meinung nach wirklich ausgezeichnet sind.
Insgesamt stehen INFI und Duvalesib nach dem Deal doch in der öffentlichen Wahrnehmung (also auch in meiner Wahrnehmung) wesentlich stabiler und seriöser da.
Viele Grüße
SLG
Abschweifung:
"Momentan sieht der Markt sehr angeschlagen aus... findest du nicht? Kann man sich dann nicht auch einiges an Geld sparen, wenn man erstmal abwartet?"
Ja, finde ich auch und eigentlich sollte man wirklich abwarten. Vielleicht tue ich es auch. Ich war nur immer schrecklich schlecht darin, irgendetwas zu timen...
Ich kann mir durchaus vorstellen, dass wir erst am Anfang einer sehr deutlichen Korrektur stehen, gut möglicherweise eines Crashs (6.000 im DAX, 11.000 im Dow).
Aber natürlich kann es auch ganz anders kommen.
Generell bin ich sehr pessimistisch für die Zukunft. Ich denke, "wir" haben das (Wirtschafts)System so ziemlich gegen die Wand gefahren und kommen aus unseren Irrwegen auch nicht mehr raus.
Ich will das nicht im Detail auswalzen, weil das dann sehr "makro" wird und weil ich die Dinge auch komplett anders sehe, als der Mainstream. Zum Beispiel bin ich der Meinung, dass Deutschland fast alles falsch macht und keineswegs als Vorbild für die Welt taugt. Wenn man so etwas schreibt, wird man aber so gut wie nie verstanden, auch nicht, wenn man es begründet.
Darüber hinaus mache ich mir - in der kurzen Frist sozusagen - eben auch Gedanken wegen der Ebola-Epidemie.
Ich weiß, dass das unseriös und verschwörungstheoretisch klingt und ich entschuldige mich dafür, aber ich habe eben das Gefühl, dass diese Krankheit ansteckender und problematischer ist, als gesagt wird.
Jetzt lese ich, dass sich in Dallas eine Krankenschwester bei dem verstorbenen Patienten infiziert hat. Nach Spanien ist das der zweite bekannte Fall, wo sich im Westen medizinisches Personal infiziert, obwohl die Gefahren bekannt sind und Schutzmaßnahmen getroffen wurden.
Ich weiß, dass die gesamte Zahl der Kranken und Toten sehr klein ist, wenn man das mit Allerweltskrankheiten vergleicht, aber eine weitere Ausbreitung von Ebola ist für eine Panik und einen ernsthaften Einbruch der globalen Wirtschaftstätigkeit gut, obwohl der objektive Schaden gar nicht so groß werden mag.
INCY
"Das Wirkprinzip erschließt sich nicht ohne weiteres... Aber warum ist so etwas nicht schon mal früher aufgefallen?"
Zumindest der Zusammenhang zwischen chronischen Entzündungen und Krebs ist schon lange bekannt:
http://www.hindawi.com/journals/jir/2014/149185/
"The role of inflammation in the development of cancer was described as early as 1863, by Rudolf Virchow. His observations that inflammatory cells infiltrate tumors led him to hypothesize that cancer arises from inflammatory sites (“lymphoreticular infiltration”)"
Auch Schmerzmittel können scheinbar gegen Krebs helfen: "Furthermore, the use of nonsteroidal anti-inflammatory drugs (NSAIDs) has been shown to decrease incidence and mortality of several cancers"
Viren, die sich dauerhaft im Körper einnisten, können Krebs auslösen. Eine recht erfolgreiche Prävention von Gebärmutterhalskrebs ist z.B. die Immpfung gegen HPV-Viren. Chronische Entzündungen führen zu Prozessen, die Krebs begünstigen oder verstärken. So schaffen sich manche Krebs-Arten selber eine entzündliche Umgebung, indem sie z.B. den wichtigen JAK-STAT-Signalweg permanent aktivieren.
Hier werden chronische Entzündungen als Auslöser von Krebs genannt:
http://www.krebsinformationsdienst.de/grundlagen/krebsentste…
"In Tumoren finden sich oft sogenannte Makrophagen. Diese Zellen des Immunsystems sind für die Abwehr von Bakterien und extrazellulären Parasiten verantwortlich. Angelockt werden sie durch Entzündungsprozesse. Forscher diskutieren daher seit längerem für verschiedene Tumorarten, ob eine chronische Entzündung zur Krebsentstehung beitragen könnte.
Der Begriff "Entzündung" ist in diesem Zusammenhang jedoch nicht mit den üblichen Vorstellungen einer Entzündung oder Infektion zu verwechseln, wie etwa bei einer vereiterten Wunde. Eine Entzündung ist im wissenschaftlichen Sinn eine charakteristische Reaktion eines Gewebes auf jede Form von äußerlichen oder innerlichen Reizen. An der Steuerung der Entzündungsreaktion sind Zellen des Immunsystems beteiligt.
Ist Gewebe gereizt, wandern Immunzellen in die betroffene Region ein. Verbunden damit ist die Ausschüttung vieler Zellbotenstoffe, darunter solchen, die die Immunreaktion steuern, aber zum Beispiel von Wachstumsfaktoren, die normalerweise für die Zellregeneration sorgen.
Lässt die Reizung nicht nach und wird die Entzündungsreaktion chronisch, können solche Steuersignale anstelle der Heilung des betroffenen Gewebes auch nachteilige Folgen auslösen. Chronische Entzündungen könnten deshalb zu Entwicklung, Wachstum und Ausbreitung eines Tumors beitragen. Folgende Mechanismen werden als mögliche Ursachen für den Zusammenhang zwischen Entzündung und Krebs diskutiert:
- Freie Radikale schädigen das Erbmaterial, aber auch andere Zellstrukturen, und könnten so ein Tumorwachstum auslösen.
- Freigesetzte Entzündungsfaktoren führen zu Mutationen von Genen oder verändern die übergeordnete Struktur des Erbmaterials der betroffenen Zellen. Dadurch können Wachstum und Teilung in diesem Gewebeunter Umständen vom Körper nicht mehr selbst reguliert werden. Der natürliche Zelltod bleibt aus, der in gesundem Gewebe für ein Gleichgewicht bei der Zellregeneration sorgt.
- Freigesetzte Wachstumsfaktoren beschleunigen auch die Zellteilung von Tumorzellen im Bereich der Entzündung.
- Freigesetzte Entzündungsfaktoren regen die Gefäßbildung an, nicht nur in gesundem Gewebe, sondern auch in und zu sich entwickelnden Tumorgewebe. Dadurch wird ein noch kleiner Tumor kontinuierlich mit Blut versorgt und kann wachsen.
- Die von Immunzellen produzierten Entzündungsfaktoren tragen unter Umständen auch dazu bei, dass manche Tumorzellen die Fähigkeit entwickeln, aus dem Gewebeverband auszuwandern. Dadurch wird das Entstehen von Metastasen begünstigt.
- Fachleute diskutieren in diesem Zusammenhang auch die Beteiligung von Stammzellen: Bei Mäusen mit Magenkrebs, an dessen Entstehung Helicobacter pylori beteiligt war, wanderten Knochenmarkstammzellen zum Magen und waren mit an der Krebsentstehung beteiligt. Löste man bei den Mäusen statt der chronischen Entzündung akute Verletzungen oder Entzündungen aus, blieb die Reaktion der Stammzellen dagegen aus.
***
STAT-JAK ist ein wesentlicher Signalweg, der bei chronischen Entzündungen und somit auch bei Krebs beteiligt ist:
http://archiv.aktuelle-wochenschau.de/druck/2013/wochenschau…
"Die unkontrollierte STAT-Aktivierung kann die Ursache für eine Vielzahl von chronischen Entzündungen und der Entstehung von verschiedenen Tumorarten sein."
***
http://www.aerzteblatt.de/archiv/50481/Onkologie-Wie-chronis…
"Chronische Entzündungen sind Triggerfaktoren für Malignome. „Derzeit wird etwa jede fünfte Krebserkrankung damit in Zusammenhang gebracht“, sagte Prof. Dr. med. Curtis C. Harris vom US National Cancer Institute (NCI) bei einem internationalen Symposium in Heidelberg. Die Forscher gehen jedoch davon aus, dass chronische Entzündungen an weit mehr Krebsarten beteiligt sind, als heute bekannt ist."
Gruß
ipollit
"Das Wirkprinzip erschließt sich nicht ohne weiteres... Aber warum ist so etwas nicht schon mal früher aufgefallen?"
Zumindest der Zusammenhang zwischen chronischen Entzündungen und Krebs ist schon lange bekannt:
http://www.hindawi.com/journals/jir/2014/149185/
"The role of inflammation in the development of cancer was described as early as 1863, by Rudolf Virchow. His observations that inflammatory cells infiltrate tumors led him to hypothesize that cancer arises from inflammatory sites (“lymphoreticular infiltration”)"
Auch Schmerzmittel können scheinbar gegen Krebs helfen: "Furthermore, the use of nonsteroidal anti-inflammatory drugs (NSAIDs) has been shown to decrease incidence and mortality of several cancers"
Viren, die sich dauerhaft im Körper einnisten, können Krebs auslösen. Eine recht erfolgreiche Prävention von Gebärmutterhalskrebs ist z.B. die Immpfung gegen HPV-Viren. Chronische Entzündungen führen zu Prozessen, die Krebs begünstigen oder verstärken. So schaffen sich manche Krebs-Arten selber eine entzündliche Umgebung, indem sie z.B. den wichtigen JAK-STAT-Signalweg permanent aktivieren.
Hier werden chronische Entzündungen als Auslöser von Krebs genannt:
http://www.krebsinformationsdienst.de/grundlagen/krebsentste…
"In Tumoren finden sich oft sogenannte Makrophagen. Diese Zellen des Immunsystems sind für die Abwehr von Bakterien und extrazellulären Parasiten verantwortlich. Angelockt werden sie durch Entzündungsprozesse. Forscher diskutieren daher seit längerem für verschiedene Tumorarten, ob eine chronische Entzündung zur Krebsentstehung beitragen könnte.
Der Begriff "Entzündung" ist in diesem Zusammenhang jedoch nicht mit den üblichen Vorstellungen einer Entzündung oder Infektion zu verwechseln, wie etwa bei einer vereiterten Wunde. Eine Entzündung ist im wissenschaftlichen Sinn eine charakteristische Reaktion eines Gewebes auf jede Form von äußerlichen oder innerlichen Reizen. An der Steuerung der Entzündungsreaktion sind Zellen des Immunsystems beteiligt.
Ist Gewebe gereizt, wandern Immunzellen in die betroffene Region ein. Verbunden damit ist die Ausschüttung vieler Zellbotenstoffe, darunter solchen, die die Immunreaktion steuern, aber zum Beispiel von Wachstumsfaktoren, die normalerweise für die Zellregeneration sorgen.
Lässt die Reizung nicht nach und wird die Entzündungsreaktion chronisch, können solche Steuersignale anstelle der Heilung des betroffenen Gewebes auch nachteilige Folgen auslösen. Chronische Entzündungen könnten deshalb zu Entwicklung, Wachstum und Ausbreitung eines Tumors beitragen. Folgende Mechanismen werden als mögliche Ursachen für den Zusammenhang zwischen Entzündung und Krebs diskutiert:
- Freie Radikale schädigen das Erbmaterial, aber auch andere Zellstrukturen, und könnten so ein Tumorwachstum auslösen.
- Freigesetzte Entzündungsfaktoren führen zu Mutationen von Genen oder verändern die übergeordnete Struktur des Erbmaterials der betroffenen Zellen. Dadurch können Wachstum und Teilung in diesem Gewebeunter Umständen vom Körper nicht mehr selbst reguliert werden. Der natürliche Zelltod bleibt aus, der in gesundem Gewebe für ein Gleichgewicht bei der Zellregeneration sorgt.
- Freigesetzte Wachstumsfaktoren beschleunigen auch die Zellteilung von Tumorzellen im Bereich der Entzündung.
- Freigesetzte Entzündungsfaktoren regen die Gefäßbildung an, nicht nur in gesundem Gewebe, sondern auch in und zu sich entwickelnden Tumorgewebe. Dadurch wird ein noch kleiner Tumor kontinuierlich mit Blut versorgt und kann wachsen.
- Die von Immunzellen produzierten Entzündungsfaktoren tragen unter Umständen auch dazu bei, dass manche Tumorzellen die Fähigkeit entwickeln, aus dem Gewebeverband auszuwandern. Dadurch wird das Entstehen von Metastasen begünstigt.
- Fachleute diskutieren in diesem Zusammenhang auch die Beteiligung von Stammzellen: Bei Mäusen mit Magenkrebs, an dessen Entstehung Helicobacter pylori beteiligt war, wanderten Knochenmarkstammzellen zum Magen und waren mit an der Krebsentstehung beteiligt. Löste man bei den Mäusen statt der chronischen Entzündung akute Verletzungen oder Entzündungen aus, blieb die Reaktion der Stammzellen dagegen aus.
***
STAT-JAK ist ein wesentlicher Signalweg, der bei chronischen Entzündungen und somit auch bei Krebs beteiligt ist:
http://archiv.aktuelle-wochenschau.de/druck/2013/wochenschau…

"Die unkontrollierte STAT-Aktivierung kann die Ursache für eine Vielzahl von chronischen Entzündungen und der Entstehung von verschiedenen Tumorarten sein."
***
http://www.aerzteblatt.de/archiv/50481/Onkologie-Wie-chronis…
"Chronische Entzündungen sind Triggerfaktoren für Malignome. „Derzeit wird etwa jede fünfte Krebserkrankung damit in Zusammenhang gebracht“, sagte Prof. Dr. med. Curtis C. Harris vom US National Cancer Institute (NCI) bei einem internationalen Symposium in Heidelberg. Die Forscher gehen jedoch davon aus, dass chronische Entzündungen an weit mehr Krebsarten beteiligt sind, als heute bekannt ist."
Gruß
ipollit
ESPR
Bisher bin ich nicht investiert, doch finde ich ESPR interessant. Zuletzt gab es eine Diskussion über die Bedeutung der Senkung von LDL. Wie wird es sich auf den Kurs auswirken, wenn die Langzeit-Outcome-Studie IMPROVE-IT von Zetia demnächst (17.11.) negativ ausfallen sollte? Allerdings senkt ETC-1002 auch CRP...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
"As Larry Huston (Forbes http://www.forbes.com/sites/larryhusten/2014/10/02/cholester…) has noted for a while, it is likely that the Ezetimibe outcomes trial (IMPROVE IT) will be a significant factor in what the FDA demands going forward for cholesterol drugs. Reminder that their doubts were strong enough that they reneged on their SPA for trig lowering. If IMPROVE IT fails it seems virtually assured that outcomes will be required (as monotherapy 1002 doesn't lower LDL much more than Ezetimibe)
Personally I think that the efficacy shown by 1002 is made somewhat more credible because it lowered both LDL and CRP. But that is hardly conclusive and probably won't count for much from a regulatory perspective.
BTW if I had to wager on what drug currently in trials would have the largest effect on outcomes it would be ISIS' ApoC3 drug because it shows strong efficacy on a multitude of Met Syndrome markers. Indicating it is getting near the causative nexus (so far 1002 is only 2). It also doesn't hurt that the epi data for heterozygous ApoC3 patients have much lower heart disease and indicators in every epi study."
***
http://investorshub.advfn.com/boards/replies.aspx?msg=106871…
FWIW I agree I overstated my position a little when talking about other bio markers changes effected by statins. I think it is best said that the other biomarker effects of statins (lower CRP, higher HDL, specific LDL types) are gaining more and more credence as other potential, equally plausible, MOA. I.e. There is now a cloud of fog around the concept that LDL is the primary beneficial MOA of statins. And the cardiology community has been badly stung repeatedly by other highly touted bio markers that failed (repeatedly) in trials and is now backing off on all of them. Including LDL. E.g. The change in treatment guidelines in 2012/2013 (which removed HDL targets AND LDL targets largely for these reasons)
I've been taking statins for fifteen years. Even when I began taking them, my personal physician told me that he didn't believe that that the MOA of the statins worked through a LDL lowering mechanism. He thought that lowering CRP was the MOA. He said at the time that most cardiologists in Southern CA thought the same thing. He says all the newer studies have vindicated his hypothesis."
Gruß
ipollit
Bisher bin ich nicht investiert, doch finde ich ESPR interessant. Zuletzt gab es eine Diskussion über die Bedeutung der Senkung von LDL. Wie wird es sich auf den Kurs auswirken, wenn die Langzeit-Outcome-Studie IMPROVE-IT von Zetia demnächst (17.11.) negativ ausfallen sollte? Allerdings senkt ETC-1002 auch CRP...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
"As Larry Huston (Forbes http://www.forbes.com/sites/larryhusten/2014/10/02/cholester…) has noted for a while, it is likely that the Ezetimibe outcomes trial (IMPROVE IT) will be a significant factor in what the FDA demands going forward for cholesterol drugs. Reminder that their doubts were strong enough that they reneged on their SPA for trig lowering. If IMPROVE IT fails it seems virtually assured that outcomes will be required (as monotherapy 1002 doesn't lower LDL much more than Ezetimibe)
Personally I think that the efficacy shown by 1002 is made somewhat more credible because it lowered both LDL and CRP. But that is hardly conclusive and probably won't count for much from a regulatory perspective.
BTW if I had to wager on what drug currently in trials would have the largest effect on outcomes it would be ISIS' ApoC3 drug because it shows strong efficacy on a multitude of Met Syndrome markers. Indicating it is getting near the causative nexus (so far 1002 is only 2). It also doesn't hurt that the epi data for heterozygous ApoC3 patients have much lower heart disease and indicators in every epi study."
***
http://investorshub.advfn.com/boards/replies.aspx?msg=106871…
FWIW I agree I overstated my position a little when talking about other bio markers changes effected by statins. I think it is best said that the other biomarker effects of statins (lower CRP, higher HDL, specific LDL types) are gaining more and more credence as other potential, equally plausible, MOA. I.e. There is now a cloud of fog around the concept that LDL is the primary beneficial MOA of statins. And the cardiology community has been badly stung repeatedly by other highly touted bio markers that failed (repeatedly) in trials and is now backing off on all of them. Including LDL. E.g. The change in treatment guidelines in 2012/2013 (which removed HDL targets AND LDL targets largely for these reasons)
I've been taking statins for fifteen years. Even when I began taking them, my personal physician told me that he didn't believe that that the MOA of the statins worked through a LDL lowering mechanism. He thought that lowering CRP was the MOA. He said at the time that most cardiologists in Southern CA thought the same thing. He says all the newer studies have vindicated his hypothesis."
Gruß
ipollit
CLDX
Warum Ohad Hammer immer anführt, dass Varlilumab mono keinen so deutlichen Effekt hat wie z.B. PD-1, habe ich nie ganz verstanden. Immerhin war ein CR dabei, der wahrscheinlich eher nicht dadurch zustande kam, dass Varlilumab CD27-Krebszellen beseitigt hat:
"Both T-cell activation and ADCC likely contributed to the sustained continuing response seen in the Hodgkin lymphoma patient treated with CDX-1127. Although the complete response in the Hodgkin lymphoma patient in liquid tumor Phase I who has failed multiple agents including Adcetris was impressive, a pushback has been that it is unclear whether this was mediated by T-cell activation, which is more relevant for checkpoint inhibitor combination or antibodydependent cellular cytotoxicity (ADCC) targeting CD27-expressing liquid tumors. Management provided some incremental data points. This patient has now remained in remission for over a year despite discontinuation of therapy per protocol for several months. The durable remission after the patient is off therapy is reminiscent of T-cell mediated response. Management noted that in the patient CD27 is not detected on Reed-Sternberg (tumor) cells but is seen in the tumor micro-environment, which also includes a large amount of CD27+ T lymphocytes. This would appear to suggest Tcell activation by CDX1127 likely played role in the achievement of CR in the patient although definitive proof is difficult.
***
Thoughts On CDX-1127: Our expert feels that CDX-1127 may have weak efficacy because there have been no responses with monotherapy in solid tumors. However, Celldex (CLDX) is planning a PI/II combination trials CDX-1127 in 2014 and has no intentions to develop as a monotherapy. Our expert agreed that depletion of Treg cells in conjunction with a safe adverse event profile could allow opportunity to pursue in combination. Our expert also believes the responses that we've observed to date with CDX-1127 may be more related to its ADCC properties and that these were CD27-overexpressed tumors. This commentary appears somewhat inconsistent with the fact that the 1 CR Hodgkin's lymphoma patients was not CD27 nor CD70 expressed. Furthermore, CDX-1127's effects as a co-stimulatory agonist are supported by a significant depletion of Tregs (which by the way our expert alluded to as a useful biomarker for other clinical programs such as anti-CTLA4/PD1/PDL1), increase in natural killer cells (which our expert suggests is a useful biomarker for the OX-40 immune checkpoint program), and induction of IP-10. While IP-10 induction is viewed as exploratory, its genesis arises from T-cell activation in HIV patients in which IP-10 is positively correlated with activated CD4 and CD8 T cells. CLDX has reported CDX-1127 increases IP-10 serum levels."
Theoretisch ist eine Kombi aus Checkpoint-Hemmer wie PD-1, der den Tumor für das Immunsystem sichtbar macht, und einem Agonisten wie z.B. CD27, der das Immunsystem aktiviert, vielversprechend. Varlilumab ist ja immer noch ziemlich am Anfang der Entwicklung.
Hier ein paar Eindrücke von Paul Rennert von der CRI-Tagung vor Kurzem...
https://twitter.com/PDRennert/with_replies
"$CLDX anti-Cd27 agonist mAb varlilumab. Dramatic CD8 T cell expansion, cytokines. No effect on Tregs (preclinical, in vitro). Nice data #CRI
$CLDX preclinical tumor models w anti-CD27. See excellent protection, memory response, synergy w anti-PD-1. Varlilumab requires Fc to x-link
$CLDX Varlilumab Clinical: P1 dose escalation, multi-dose cycles. No MTD mild tox. 2hr PD w cytokine expression. CD8s and CD4s unchanged,
NK cells tripled, Tregs dropped (solid tumors). Observational clinical activity in lymphoma, melanoma, RCC. Nice albeit limited data $CLDX"
Gruß
ipollit
Warum Ohad Hammer immer anführt, dass Varlilumab mono keinen so deutlichen Effekt hat wie z.B. PD-1, habe ich nie ganz verstanden. Immerhin war ein CR dabei, der wahrscheinlich eher nicht dadurch zustande kam, dass Varlilumab CD27-Krebszellen beseitigt hat:
"Both T-cell activation and ADCC likely contributed to the sustained continuing response seen in the Hodgkin lymphoma patient treated with CDX-1127. Although the complete response in the Hodgkin lymphoma patient in liquid tumor Phase I who has failed multiple agents including Adcetris was impressive, a pushback has been that it is unclear whether this was mediated by T-cell activation, which is more relevant for checkpoint inhibitor combination or antibodydependent cellular cytotoxicity (ADCC) targeting CD27-expressing liquid tumors. Management provided some incremental data points. This patient has now remained in remission for over a year despite discontinuation of therapy per protocol for several months. The durable remission after the patient is off therapy is reminiscent of T-cell mediated response. Management noted that in the patient CD27 is not detected on Reed-Sternberg (tumor) cells but is seen in the tumor micro-environment, which also includes a large amount of CD27+ T lymphocytes. This would appear to suggest Tcell activation by CDX1127 likely played role in the achievement of CR in the patient although definitive proof is difficult.
***
Thoughts On CDX-1127: Our expert feels that CDX-1127 may have weak efficacy because there have been no responses with monotherapy in solid tumors. However, Celldex (CLDX) is planning a PI/II combination trials CDX-1127 in 2014 and has no intentions to develop as a monotherapy. Our expert agreed that depletion of Treg cells in conjunction with a safe adverse event profile could allow opportunity to pursue in combination. Our expert also believes the responses that we've observed to date with CDX-1127 may be more related to its ADCC properties and that these were CD27-overexpressed tumors. This commentary appears somewhat inconsistent with the fact that the 1 CR Hodgkin's lymphoma patients was not CD27 nor CD70 expressed. Furthermore, CDX-1127's effects as a co-stimulatory agonist are supported by a significant depletion of Tregs (which by the way our expert alluded to as a useful biomarker for other clinical programs such as anti-CTLA4/PD1/PDL1), increase in natural killer cells (which our expert suggests is a useful biomarker for the OX-40 immune checkpoint program), and induction of IP-10. While IP-10 induction is viewed as exploratory, its genesis arises from T-cell activation in HIV patients in which IP-10 is positively correlated with activated CD4 and CD8 T cells. CLDX has reported CDX-1127 increases IP-10 serum levels."
Theoretisch ist eine Kombi aus Checkpoint-Hemmer wie PD-1, der den Tumor für das Immunsystem sichtbar macht, und einem Agonisten wie z.B. CD27, der das Immunsystem aktiviert, vielversprechend. Varlilumab ist ja immer noch ziemlich am Anfang der Entwicklung.
Hier ein paar Eindrücke von Paul Rennert von der CRI-Tagung vor Kurzem...
https://twitter.com/PDRennert/with_replies
"$CLDX anti-Cd27 agonist mAb varlilumab. Dramatic CD8 T cell expansion, cytokines. No effect on Tregs (preclinical, in vitro). Nice data #CRI
$CLDX preclinical tumor models w anti-CD27. See excellent protection, memory response, synergy w anti-PD-1. Varlilumab requires Fc to x-link
$CLDX Varlilumab Clinical: P1 dose escalation, multi-dose cycles. No MTD mild tox. 2hr PD w cytokine expression. CD8s and CD4s unchanged,
NK cells tripled, Tregs dropped (solid tumors). Observational clinical activity in lymphoma, melanoma, RCC. Nice albeit limited data $CLDX"
Gruß
ipollit
Hallo ipollit, kmastra,
habt ihr euch mal mit SAGE beschäftigt?
Nachdem Hammer sie ins Depot genommen hatte, habe ich einen Blick drauf geworfen und zunächst fand ich sie wegen ihrer CNS-Pipeline uninteressant.
Später habe ich mir aber zum Glück die Mühe gemacht, mir ihr S1-File mal anzusehen und das hatte mich dann doch überzeugt.
Der hauptsächliche Werttreiber ist sicher zur Zeit ihr Produktkandidat SAGE-547 (PI/II) , ein Mittel das Patienten helfen soll, die sich im "Status Epilepticus" (SE) befinden.
"Als Status epilepticus (in der Neurologie oft kurz Status genannt) werden ein außergewöhnlich lange andauernder epileptischer Anfall oder eine Serie von Anfällen bezeichnet, wenn das Intervall zwischen den einzelnen Anfällen so kurz ist, dass der Ausgangszustand bei der Bewusstseinslage und anderen Körperfunktionen nicht mehr erreicht wird."
http://de.wikipedia.org/wiki/Status_epilepticus
SAGE-457 wird für Personen entwickelt, die aus dem SE nicht mehr rausgeholt werden können.
"If a patient’s SE continues after administration of BDZs and anti-seizure drugs, the patient is diagnosed as having RSE, which must be treated quickly to cease the seizure activity, maintain the patient’s airway and prevent brain damage. RSE patients
are immediately admitted to the ICU and placed in a medically induced coma to stop all seizure-related activity.
Currently, there are no therapies that have been specifically approved for RSE. The primary drugs used to induce coma are continuously infused IV agents such as propofol, midazolam or pentobarbital.
The RSE patient is continually monitored through EEG to ensure burst suppression is achieved. Burst suppression is a pattern of brain waves seen on an EEG characterized by periods of activity alternating with periods of little or no activity in the brain,
informing medical personnel of the effectiveness of the medically induced coma. The goal of burst suppression is to allow the brain and corresponding neuronal tissue to restore function and reset to normal pre-seizure levels. After a short period of burst
suppression, typically 24 hours, physicians attempt to wean the patient from the medically induced coma to evaluate EEG activity to assess if the neuronal activity has returned to normal levels. If unsuccessful, the patient is placed back into the medically induced coma in order to protect underlying neurological activity and brain function. At this point, patients are considered to be in a state of
SRSE.
Currently, there are no therapies that have been specifically approved for SRSE. Treatment approaches consist of diagnosis and treatment of underlying medical conditions, adding and changing anti-seizure drugs, and repeated attempts at weaning in
conjunction with IV anesthetic agents. The majority of SRSE patients either die or have significant comorbidities, such as decreased blood pressure and cardiorespiratory collapse. "
Das eigentlich Besondere an SAGE-547 ist aber, dass der Wirkstoff schon unter realen Bedingungen Patienten verabreicht worden ist:
"We have compiled evidence of activity with SAGE-547 in emergency-use settings in six patients that support the safety and potency of SAGE-547 for the treatment of SRSE.
In each of these six cases, the treating physician applied for an individual
emergency-use IND, local institutional review board approval and proxy informed consent from next of kin.
SAGE-547 was administered with a target steady state exposure similar to that planned for our ongoing Phase 1/2 clinical trial.
The table below summarizes the experience for each of these six patients. Of note, each individual case of SRSE arose from a presumed different underlying etiology, the patients were of varying ages (17 months to 28 years of age), and all had been placed in a long-duration medically induced coma. Prior multiple attempts to wean each of these patients from their comatose state and reestablish normal brain activity had been unsuccessful. All emergency-use patients were administered SAGE-547 in advance of a further wean attempt.
Patients #1, #2 and #4 experienced resolution of SRSE during the course of SAGE-547 treatment. Patients #3 and #6 had resolution of SRSE three days after SAGE-547 treatment was discontinued. Patient #5 had low plasma exposures of SAGE-547
and experienced no appreciable benefit from treatment with SAGE-547."
Auch aus der laufenden klinischen Studie wurden im Juli erste erfreuliche Daten gemeldet:
"Preliminary data indicate that the first four patients enrolled in the clinical trial met the key efficacy endpoint, in that each was successfully weaned off his or her anesthetic agent while SAGE-547 was being administered. There have also been no reported drug-related serious adverse events in these four patients to date".
Es handelt sich um eine sehr gefährliche, oft tödliche Erkrankung und im übrigen auch quantitativ um eine bedeutende Patientengruppe:
We estimate that in the United States each year, there are up to 150,000 cases of SE, of which 30,000 SE patients die.
Dabei soll es in den USA ca. 25.000 Fälle/Jahr mit "super-refraktärem" SE geben. Wie schon erwähnt, gibt es für diese Patienten bisher keine gezielte Therapieoption.
Ich finde diesen Wirkstoffkandidaten von SAGE sehr, sehr wichtig und aufgrund der durch die "Notfall-INDs" vorliegenden Erfahrungen auch aussichtsreich.
habt ihr euch mal mit SAGE beschäftigt?
Nachdem Hammer sie ins Depot genommen hatte, habe ich einen Blick drauf geworfen und zunächst fand ich sie wegen ihrer CNS-Pipeline uninteressant.
Später habe ich mir aber zum Glück die Mühe gemacht, mir ihr S1-File mal anzusehen und das hatte mich dann doch überzeugt.
Der hauptsächliche Werttreiber ist sicher zur Zeit ihr Produktkandidat SAGE-547 (PI/II) , ein Mittel das Patienten helfen soll, die sich im "Status Epilepticus" (SE) befinden.
"Als Status epilepticus (in der Neurologie oft kurz Status genannt) werden ein außergewöhnlich lange andauernder epileptischer Anfall oder eine Serie von Anfällen bezeichnet, wenn das Intervall zwischen den einzelnen Anfällen so kurz ist, dass der Ausgangszustand bei der Bewusstseinslage und anderen Körperfunktionen nicht mehr erreicht wird."
http://de.wikipedia.org/wiki/Status_epilepticus
SAGE-457 wird für Personen entwickelt, die aus dem SE nicht mehr rausgeholt werden können.
"If a patient’s SE continues after administration of BDZs and anti-seizure drugs, the patient is diagnosed as having RSE, which must be treated quickly to cease the seizure activity, maintain the patient’s airway and prevent brain damage. RSE patients
are immediately admitted to the ICU and placed in a medically induced coma to stop all seizure-related activity.
Currently, there are no therapies that have been specifically approved for RSE. The primary drugs used to induce coma are continuously infused IV agents such as propofol, midazolam or pentobarbital.
The RSE patient is continually monitored through EEG to ensure burst suppression is achieved. Burst suppression is a pattern of brain waves seen on an EEG characterized by periods of activity alternating with periods of little or no activity in the brain,
informing medical personnel of the effectiveness of the medically induced coma. The goal of burst suppression is to allow the brain and corresponding neuronal tissue to restore function and reset to normal pre-seizure levels. After a short period of burst
suppression, typically 24 hours, physicians attempt to wean the patient from the medically induced coma to evaluate EEG activity to assess if the neuronal activity has returned to normal levels. If unsuccessful, the patient is placed back into the medically induced coma in order to protect underlying neurological activity and brain function. At this point, patients are considered to be in a state of
SRSE.
Currently, there are no therapies that have been specifically approved for SRSE. Treatment approaches consist of diagnosis and treatment of underlying medical conditions, adding and changing anti-seizure drugs, and repeated attempts at weaning in
conjunction with IV anesthetic agents. The majority of SRSE patients either die or have significant comorbidities, such as decreased blood pressure and cardiorespiratory collapse. "
Das eigentlich Besondere an SAGE-547 ist aber, dass der Wirkstoff schon unter realen Bedingungen Patienten verabreicht worden ist:
"We have compiled evidence of activity with SAGE-547 in emergency-use settings in six patients that support the safety and potency of SAGE-547 for the treatment of SRSE.
In each of these six cases, the treating physician applied for an individual
emergency-use IND, local institutional review board approval and proxy informed consent from next of kin.
SAGE-547 was administered with a target steady state exposure similar to that planned for our ongoing Phase 1/2 clinical trial.
The table below summarizes the experience for each of these six patients. Of note, each individual case of SRSE arose from a presumed different underlying etiology, the patients were of varying ages (17 months to 28 years of age), and all had been placed in a long-duration medically induced coma. Prior multiple attempts to wean each of these patients from their comatose state and reestablish normal brain activity had been unsuccessful. All emergency-use patients were administered SAGE-547 in advance of a further wean attempt.
Patients #1, #2 and #4 experienced resolution of SRSE during the course of SAGE-547 treatment. Patients #3 and #6 had resolution of SRSE three days after SAGE-547 treatment was discontinued. Patient #5 had low plasma exposures of SAGE-547
and experienced no appreciable benefit from treatment with SAGE-547."
Auch aus der laufenden klinischen Studie wurden im Juli erste erfreuliche Daten gemeldet:
"Preliminary data indicate that the first four patients enrolled in the clinical trial met the key efficacy endpoint, in that each was successfully weaned off his or her anesthetic agent while SAGE-547 was being administered. There have also been no reported drug-related serious adverse events in these four patients to date".
Es handelt sich um eine sehr gefährliche, oft tödliche Erkrankung und im übrigen auch quantitativ um eine bedeutende Patientengruppe:
We estimate that in the United States each year, there are up to 150,000 cases of SE, of which 30,000 SE patients die.
Dabei soll es in den USA ca. 25.000 Fälle/Jahr mit "super-refraktärem" SE geben. Wie schon erwähnt, gibt es für diese Patienten bisher keine gezielte Therapieoption.
Ich finde diesen Wirkstoffkandidaten von SAGE sehr, sehr wichtig und aufgrund der durch die "Notfall-INDs" vorliegenden Erfahrungen auch aussichtsreich.
Hallo SLGramann,
ja, SAGE habe ich auch auf meiner Liste. Nachdem ich nun auch eine erste Position ESPR habe, könnte ich mir SAGE auch gut vorstellen. Ich denke, dass Ohad Hammer auf ESPR, SAGE oder AERI setzt, weil diese in ihrem Marktbereich aussichtsreiche Kandidaten haben, die bereits gute Ergebnisse geliefert haben und nun in die letzte Phase vor einer möglichen Zulassung gehen.
Mit dem Bereich CNS habe ich bisher keine guten Erfahrungen gemacht. SAGE ist hier vielleicht eine Ausnahme, da sie nicht mit subjektive Kriterien prüfen, wie es z.B. bei Depressionen oder so der Fall ist, sondern die Wirkung direkt messen können. Der Bedarf ist auch klar gegeben. Allerdings ist die Bewertung mi ca. 1 Mrd USD auch nicht gerade niedrig. Zudem war mir nicht ganz klar, wann zulassungsrelevante Ergebnisse vorliegen können? Sie besitzen den Fast-Track Status, so dass bereits P2 Ergebnisse reichen. Ende des Jahres sollen P1/2-Daten kommen. Wäre auch schon aufgrund derer eine Zulassung möglich? Nächstes Jahr wollen sie dann eine "pivotal study" starten... das ist normalerweise die Studie, mit der man die Zulassung erreichen möchte. Es kann eine P2 oder P3 sein. Bisher habe ich noch nichts zu Zeiten gefunden? Die Frage ist für mich auch, wie lange eine weitere P2 brauchen würde? Wenn viele Patienten vorhanden sind, für die es keine Alternative gibt, müsste sich ja schnell genügend Patienten für eine Studie finden lassen. Die Wirkung tritt dann ja sofort oder innerhalb weniger Tage ein und lässt sich sofort beurteilen. Damit müsste die Studie ja schnell möglich sein. Weisst du etwas darüber?
Alleine in der USA 25k Patienten mit SRSE. Mit SAGE-547 könnte nicht nur den Patienten geholfen werden, sondern auch die Kosten deutlich gesenkt werden, selbst wenn die Kosten für SAGE-547 extrem hoch wären.
Würden 50% mit SAGE-547 behandelt, wären das bei einem Preis von z.B. 100k USD bereits über 1 Mrd USD, die SAGE erzielen könnte.
Die laufende P1/2 dauert nichtmal ein Jahr...
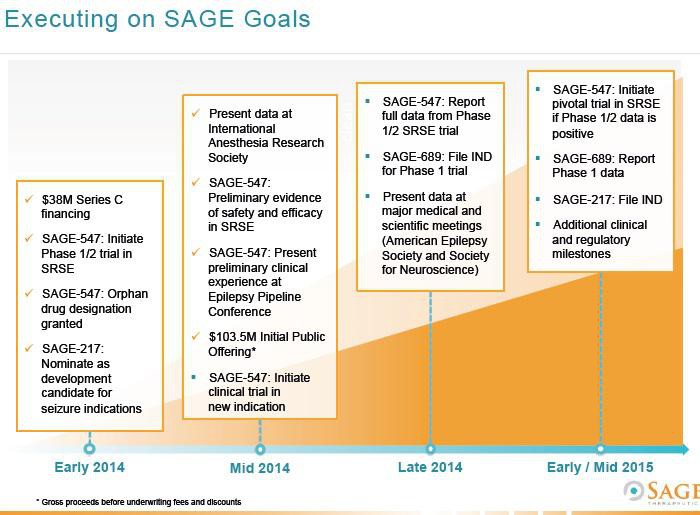
Grüße
ipollit
ja, SAGE habe ich auch auf meiner Liste. Nachdem ich nun auch eine erste Position ESPR habe, könnte ich mir SAGE auch gut vorstellen. Ich denke, dass Ohad Hammer auf ESPR, SAGE oder AERI setzt, weil diese in ihrem Marktbereich aussichtsreiche Kandidaten haben, die bereits gute Ergebnisse geliefert haben und nun in die letzte Phase vor einer möglichen Zulassung gehen.
Mit dem Bereich CNS habe ich bisher keine guten Erfahrungen gemacht. SAGE ist hier vielleicht eine Ausnahme, da sie nicht mit subjektive Kriterien prüfen, wie es z.B. bei Depressionen oder so der Fall ist, sondern die Wirkung direkt messen können. Der Bedarf ist auch klar gegeben. Allerdings ist die Bewertung mi ca. 1 Mrd USD auch nicht gerade niedrig. Zudem war mir nicht ganz klar, wann zulassungsrelevante Ergebnisse vorliegen können? Sie besitzen den Fast-Track Status, so dass bereits P2 Ergebnisse reichen. Ende des Jahres sollen P1/2-Daten kommen. Wäre auch schon aufgrund derer eine Zulassung möglich? Nächstes Jahr wollen sie dann eine "pivotal study" starten... das ist normalerweise die Studie, mit der man die Zulassung erreichen möchte. Es kann eine P2 oder P3 sein. Bisher habe ich noch nichts zu Zeiten gefunden? Die Frage ist für mich auch, wie lange eine weitere P2 brauchen würde? Wenn viele Patienten vorhanden sind, für die es keine Alternative gibt, müsste sich ja schnell genügend Patienten für eine Studie finden lassen. Die Wirkung tritt dann ja sofort oder innerhalb weniger Tage ein und lässt sich sofort beurteilen. Damit müsste die Studie ja schnell möglich sein. Weisst du etwas darüber?
Alleine in der USA 25k Patienten mit SRSE. Mit SAGE-547 könnte nicht nur den Patienten geholfen werden, sondern auch die Kosten deutlich gesenkt werden, selbst wenn die Kosten für SAGE-547 extrem hoch wären.
Würden 50% mit SAGE-547 behandelt, wären das bei einem Preis von z.B. 100k USD bereits über 1 Mrd USD, die SAGE erzielen könnte.



Die laufende P1/2 dauert nichtmal ein Jahr...

Grüße
ipollit
Antwort auf Beitrag Nr.: 48.071.002 von SLGramann am 17.10.14 21:31:04Hallo SLGramann,
SAGE habe ich auch auf meiner Watchlist. Ich habe mich aber bisher nicht wirklich damit befasst. Ich fand aber die Bewertung auf den ersten Blick recht hoch.
Eine Möglichkeit sich an SAGE zu beteiligen gibt es auch über LGND, die Royaltyrechte an 547 und wahrscheinlich auch an 689 haben. Diese dürften zwar recht gering sein, jedoch bei einem Erfolg signifikant.
Ansonsten habe ich jetzt 2/3 meiner AMBI Position verkauft und dafür CLVS, ESPR, ARQL aufgestockt sowie eine Position GILD gekauft.
ARRY
CLVS
ESPR
AMBI
ARQL
GILD
Morphosys
MGNX
FMI
EXEL
Medigene
SG kmastra
SAGE habe ich auch auf meiner Watchlist. Ich habe mich aber bisher nicht wirklich damit befasst. Ich fand aber die Bewertung auf den ersten Blick recht hoch.
Eine Möglichkeit sich an SAGE zu beteiligen gibt es auch über LGND, die Royaltyrechte an 547 und wahrscheinlich auch an 689 haben. Diese dürften zwar recht gering sein, jedoch bei einem Erfolg signifikant.
Ansonsten habe ich jetzt 2/3 meiner AMBI Position verkauft und dafür CLVS, ESPR, ARQL aufgestockt sowie eine Position GILD gekauft.
ARRY
CLVS
ESPR
AMBI
ARQL
GILD
Morphosys
MGNX
FMI
EXEL
Medigene
SG kmastra
Antwort auf Beitrag Nr.: 48.078.481 von ipollit am 19.10.14 19:11:54"Weisst du etwas darüber?"
Hallo ipollit,
nein, genau weiß ich es nicht.
Ich gehe aber fest davon aus, dass es auf der Basis des derzeitigen PI/II-Trials noch keine Zulassung geben wird.
Der pivotal-Trial in 2015 wird aber sicher ebenfalls nicht so ehr viele Patienten umfassen und er wird relativ schnell und relativ preiswert zu machen sein (die PI/II kostet nur 10 Mio. USD).
Eine Zulassung würde ich - wenn alles gut geht - für Ende 2016 erwarten.
Ein "emergency use" wird aber weiterhin angestrebt.
Dies findet man zu dem Thema im S1:
If our Phase 1/2 clinical trial of SAGE-547 is successful, we expect that the FDA will require us to complete at least one pivotal trial in order to submit an NDA for SAGE-547 as a treatment for SRSE patients. However, the FDA may require that we conduct additional pivotal trials before we can submit an NDA for SAGE-547. We have had only limited feedback from the FDA on the design of our ongoing
Phase 1/2 clinical trial of SAGE-547 and on what would be required in a pivotal clinical trial of SAGE-547.
A comprehensive toxicology dose escalating study exploring the effects of SAGE-547 in two species (rat and dog) was completed in the second quarter of 2014. The FDA will need to accept the results of these studies, which we submitted to the FDA in the second quarter of 2014, before we can commence a pivotal clinical trial for SAGE-547.
We are developing SAGE-547 as an adjunctive therapy for the treatment of SRSE. Following the completion of our ongoing Phase 1/2 clinical trial of SAGE-547, we intend to complete the additional clinical trials required for approval of SAGE-547 as rapidly as possible. We believe we may be able to
expeditiously complete these clinical trials due to the fact that the endpoints of such clinical trials will be measured shortly after initiation of therapy and the relatively small number of patients required to be enrolled in such clinical trials.
We will also provide mechanisms for access to SAGE-547 for emergency use to patients who experience SRSE but do not meet the inclusion criteria of our ongoing trial, so that they can receive the potential benefit from this product candidate.
Hallo ipollit,
nein, genau weiß ich es nicht.
Ich gehe aber fest davon aus, dass es auf der Basis des derzeitigen PI/II-Trials noch keine Zulassung geben wird.
Der pivotal-Trial in 2015 wird aber sicher ebenfalls nicht so ehr viele Patienten umfassen und er wird relativ schnell und relativ preiswert zu machen sein (die PI/II kostet nur 10 Mio. USD).
Eine Zulassung würde ich - wenn alles gut geht - für Ende 2016 erwarten.
Ein "emergency use" wird aber weiterhin angestrebt.
Dies findet man zu dem Thema im S1:
If our Phase 1/2 clinical trial of SAGE-547 is successful, we expect that the FDA will require us to complete at least one pivotal trial in order to submit an NDA for SAGE-547 as a treatment for SRSE patients. However, the FDA may require that we conduct additional pivotal trials before we can submit an NDA for SAGE-547. We have had only limited feedback from the FDA on the design of our ongoing
Phase 1/2 clinical trial of SAGE-547 and on what would be required in a pivotal clinical trial of SAGE-547.
A comprehensive toxicology dose escalating study exploring the effects of SAGE-547 in two species (rat and dog) was completed in the second quarter of 2014. The FDA will need to accept the results of these studies, which we submitted to the FDA in the second quarter of 2014, before we can commence a pivotal clinical trial for SAGE-547.
We are developing SAGE-547 as an adjunctive therapy for the treatment of SRSE. Following the completion of our ongoing Phase 1/2 clinical trial of SAGE-547, we intend to complete the additional clinical trials required for approval of SAGE-547 as rapidly as possible. We believe we may be able to
expeditiously complete these clinical trials due to the fact that the endpoints of such clinical trials will be measured shortly after initiation of therapy and the relatively small number of patients required to be enrolled in such clinical trials.
We will also provide mechanisms for access to SAGE-547 for emergency use to patients who experience SRSE but do not meet the inclusion criteria of our ongoing trial, so that they can receive the potential benefit from this product candidate.
Antwort auf Beitrag Nr.: 48.079.123 von kmastra am 19.10.14 21:40:48Hallo kmastra,
ich habe mich dazu entschlossen meine AMBI-Position Ende Oktober/Anfang November ebenfalls zu verkaufen. Nach wie vor bin ich der Meinung, dass 17 Dollar ein angemessener Preis wäre, den ich aber nicht bekommen werde.
ESPR habe ich auch etwas aufgestockt. Nach der KE-Ankündigung war das ja ganz gut möglich.
Ebenfalls ein wenig aufgestockt habe ich MGNX. Leider muss man da wohl sehr, sehr viel Zeit mitbringen. Sieht nach einem wirklich richtig guten Unternehmen aus, aber wirklich Wert hat eben DART und das ist alles noch sehr früh.
Den Verkaufserlös von AMBI werde ich dann wohl erst mal in Reserve halten.
VG
SLG
ich habe mich dazu entschlossen meine AMBI-Position Ende Oktober/Anfang November ebenfalls zu verkaufen. Nach wie vor bin ich der Meinung, dass 17 Dollar ein angemessener Preis wäre, den ich aber nicht bekommen werde.
ESPR habe ich auch etwas aufgestockt. Nach der KE-Ankündigung war das ja ganz gut möglich.
Ebenfalls ein wenig aufgestockt habe ich MGNX. Leider muss man da wohl sehr, sehr viel Zeit mitbringen. Sieht nach einem wirklich richtig guten Unternehmen aus, aber wirklich Wert hat eben DART und das ist alles noch sehr früh.
Den Verkaufserlös von AMBI werde ich dann wohl erst mal in Reserve halten.
VG
SLG
Antwort auf Beitrag Nr.: 48.087.901 von SLGramann am 20.10.14 21:36:07Hallo SLGramann,
ich habe heute den Brief meiner Bank bekommen, in dem mir das Übernahmeangebot quasi Kund getan wird. Ich hatte schon Kontakt mit meiner Bank und werde das Angebot annehmen (weil ich zumindest einen CVR für wahrscheinlich halte).
Laut der freundlichen Dame am Telefon soll es recht schnell gehen, bis ich mein Geld habe. Laut Mitteilung von Ambit muss das Angebot bis 10.11. angenommen werden. Von daher rechne ich so gegen Mitte November mit dem Geld...
http://finance.yahoo.com/news/announcement-regarding-submiss…
Sie hat mich aber auch noch auf ein Problem hingewiesen. Es könnte sein, dass die USA sowohl für die Barabfindung als auch später den CVR Quellensteuer erhebt. Laut ihrer Aussage zwar kein Problem das wieder zu bekommen, aber das würde die komplette Auszahlung nochmal verzögern. In D wird ja eh Abgeltungssteuer fällig. Also unkomplizierter ist ein Verkauf allemal
SG kmastra
ich habe heute den Brief meiner Bank bekommen, in dem mir das Übernahmeangebot quasi Kund getan wird. Ich hatte schon Kontakt mit meiner Bank und werde das Angebot annehmen (weil ich zumindest einen CVR für wahrscheinlich halte).
Laut der freundlichen Dame am Telefon soll es recht schnell gehen, bis ich mein Geld habe. Laut Mitteilung von Ambit muss das Angebot bis 10.11. angenommen werden. Von daher rechne ich so gegen Mitte November mit dem Geld...
http://finance.yahoo.com/news/announcement-regarding-submiss…
Sie hat mich aber auch noch auf ein Problem hingewiesen. Es könnte sein, dass die USA sowohl für die Barabfindung als auch später den CVR Quellensteuer erhebt. Laut ihrer Aussage zwar kein Problem das wieder zu bekommen, aber das würde die komplette Auszahlung nochmal verzögern. In D wird ja eh Abgeltungssteuer fällig. Also unkomplizierter ist ein Verkauf allemal

SG kmastra
MDVN
MDVN erweitert zunehmend die Pipeline. Nachdem sie vor einiger Zeit präklinische BET-Hemmer einlizensiert haben, erwerben sie nun (aus meiner Sicht relativ günstig) den PD1-Checkpoint-Hemmer CT-011 von CureTech, der bereits in P2 ist:
"CureTech would receive an upfront payment of up to $5.0 million from Medivation and would also be entitled to payments upon the attainment of certain development and regulatory milestones totaling $85 million. In addition, CureTech would be eligible to receive sales based milestone payments totaling up to $245 million, upon the achievement of certain annual worldwide net sales thresholds, and tiered royalties ranging from 4%-11% based on annual worldwide net sales."
****
laufende Studien Ende 2012(!)
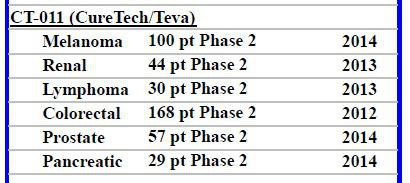
CT-011 wirkt u.a. bei Blutkrebs:
What Next – PD-L1 Inhibition in Lymphoma Too! Another of the surprises as the meeting was the first demonstration of activity for an "immune checkpoint inhibitor" cancer immunotherapy in hematological malignancies. Curetech's pidilizumab (formerly CT-011 - humanized antibody to PD-1) was given with Rituxan to patients with low grade follicular lymphoma. The combination appeared to be well tolerated. Of the 29 patients, 66% responded, with 52% having complete responses and 14% partial responses. 86% of patients had some degree of tumor regression. The depth of these responses, including the high rate of complete responses, was impressive, particularly since they were only given 4 cycles of Rituxan. Of the 15 complete responses, 10 remain on treatment, several out beyond 30 months. As in prior studies with this class of drugs, there were significant numbers of "late responders" with some patients converting to responses, or even to complete responses after 10 or more months on study. The median PFS of the entire population is 19.6 months and there appears to be a subpopulation with very durable responses. While we aren't sure what Curetech will do with this drug, this activity fits with comments from the leaders in this field (Bristol-Myers Squibb, Merck, and Roche), that early work suggests activity in blood cancers as well. This presentation suggests that a significant proportion of lymphoma patients could benefit from this class of medicine, particularly given the ubiquity of Rituxan in these diseases.[/i]
***
Teva hat aus strategischen Gründen CT-011 an CureTech zurückgegeben:
Teva: Terminates Collaboration of CT-011 (Phase II, Anti-PD-1) with CureTech; Oncology is No Longer a Therapeutic Focus This morning (1/31), Teva announced the termination of its collaboration with CureTech. CT-011 is CureTech’s PD-1 in Phase 1 and Phase 2 development for various oncology indications. The termination appears to be part of Teva’s ongoing R&D rationalization process. The company stated that following a close look at CT-011 most recent clinical and biochemical data, it has made the strategic decision to invest its resources elsewhere.
The announcement does not come as a surprise, as expectations had receded a bit following the December analyst meeting, where management stated that oncology (and women’s health) would no longer be focus therapeutics categories for the company. That said, prior to the analyst meeting, the CT-011 program had been highlighted by CEO Jeremy Levin. This was of note to many investors, as the PD-1 is viewed as a very attractive target in oncology, and one in which Levin had a strong track record at Bristol in business development.
While it’s still early in his tenure, Levin is clearly refocusing the pipeline on respiratory and CNS, two of Teva’s legacy strengths and in-line with management comments at the analyst day. However, with this focus, we believe it will take time for the company to rebuild the pipeline as the rationalization of assets brought in from prior management continues.
***
PD-1 lässt sich theoretisch gut mit Xtandi kombinieren:
Medivation: ASCO-GU Highlights Combination Potential of Xtandi with Immuno-oncology Agents The positive PREVAIL data of Xtandi in the pre-chemo setting was presented at the ASCO-GU. The meeting also featured a presentation by Dr. James Gulley highlighting the "compelling" rationale for the combination of a hormonal agent like Xtandi with immuno-oncology (IO) agents in prostate cancer. The commentary is highly consistent with our previous discussions with KOLs and provides supportive data. We believe this supports our view for potential combination of Xtandi with immunotherapy, which could increase its importance in prostate cancer as a result of further development of checkpoint inhibitors. We believe Xtandi's lack of requirement for concomitant steroid, which is at least suboptimal and potentially incompatible for use with immunotherapy, represents a fundamental differentiation vs. Zytiga in addition to other advantages. We believe this positions Xtandi well even in a generic Zytiga environment.
Biological rationale to combine immunotherapy with hormonal therapy is "particularly strong". Immuno-oncology (IO) KOLs have suggested that the most compelling combination of checkpoint inhibitors may be with hormonal agents. Androgen blockade has been shown to activate thymic regeneration in mice and humans, therefore is an immunologically active intervention. In addition, androgen blockade was shown to traffic T-cells to the human prostate with 3 weeks of initiation. A recently published National Cancer Institute study with Xtandi specifically showed that Xtandi enlarged thymus and improved survival in combination with a cancer vaccine in a preclinical model.

Gruß
ipollit
MDVN erweitert zunehmend die Pipeline. Nachdem sie vor einiger Zeit präklinische BET-Hemmer einlizensiert haben, erwerben sie nun (aus meiner Sicht relativ günstig) den PD1-Checkpoint-Hemmer CT-011 von CureTech, der bereits in P2 ist:
"CureTech would receive an upfront payment of up to $5.0 million from Medivation and would also be entitled to payments upon the attainment of certain development and regulatory milestones totaling $85 million. In addition, CureTech would be eligible to receive sales based milestone payments totaling up to $245 million, upon the achievement of certain annual worldwide net sales thresholds, and tiered royalties ranging from 4%-11% based on annual worldwide net sales."
****
laufende Studien Ende 2012(!)

CT-011 wirkt u.a. bei Blutkrebs:
What Next – PD-L1 Inhibition in Lymphoma Too! Another of the surprises as the meeting was the first demonstration of activity for an "immune checkpoint inhibitor" cancer immunotherapy in hematological malignancies. Curetech's pidilizumab (formerly CT-011 - humanized antibody to PD-1) was given with Rituxan to patients with low grade follicular lymphoma. The combination appeared to be well tolerated. Of the 29 patients, 66% responded, with 52% having complete responses and 14% partial responses. 86% of patients had some degree of tumor regression. The depth of these responses, including the high rate of complete responses, was impressive, particularly since they were only given 4 cycles of Rituxan. Of the 15 complete responses, 10 remain on treatment, several out beyond 30 months. As in prior studies with this class of drugs, there were significant numbers of "late responders" with some patients converting to responses, or even to complete responses after 10 or more months on study. The median PFS of the entire population is 19.6 months and there appears to be a subpopulation with very durable responses. While we aren't sure what Curetech will do with this drug, this activity fits with comments from the leaders in this field (Bristol-Myers Squibb, Merck, and Roche), that early work suggests activity in blood cancers as well. This presentation suggests that a significant proportion of lymphoma patients could benefit from this class of medicine, particularly given the ubiquity of Rituxan in these diseases.[/i]
***
Teva hat aus strategischen Gründen CT-011 an CureTech zurückgegeben:
Teva: Terminates Collaboration of CT-011 (Phase II, Anti-PD-1) with CureTech; Oncology is No Longer a Therapeutic Focus This morning (1/31), Teva announced the termination of its collaboration with CureTech. CT-011 is CureTech’s PD-1 in Phase 1 and Phase 2 development for various oncology indications. The termination appears to be part of Teva’s ongoing R&D rationalization process. The company stated that following a close look at CT-011 most recent clinical and biochemical data, it has made the strategic decision to invest its resources elsewhere.
The announcement does not come as a surprise, as expectations had receded a bit following the December analyst meeting, where management stated that oncology (and women’s health) would no longer be focus therapeutics categories for the company. That said, prior to the analyst meeting, the CT-011 program had been highlighted by CEO Jeremy Levin. This was of note to many investors, as the PD-1 is viewed as a very attractive target in oncology, and one in which Levin had a strong track record at Bristol in business development.
While it’s still early in his tenure, Levin is clearly refocusing the pipeline on respiratory and CNS, two of Teva’s legacy strengths and in-line with management comments at the analyst day. However, with this focus, we believe it will take time for the company to rebuild the pipeline as the rationalization of assets brought in from prior management continues.
***
PD-1 lässt sich theoretisch gut mit Xtandi kombinieren:
Medivation: ASCO-GU Highlights Combination Potential of Xtandi with Immuno-oncology Agents The positive PREVAIL data of Xtandi in the pre-chemo setting was presented at the ASCO-GU. The meeting also featured a presentation by Dr. James Gulley highlighting the "compelling" rationale for the combination of a hormonal agent like Xtandi with immuno-oncology (IO) agents in prostate cancer. The commentary is highly consistent with our previous discussions with KOLs and provides supportive data. We believe this supports our view for potential combination of Xtandi with immunotherapy, which could increase its importance in prostate cancer as a result of further development of checkpoint inhibitors. We believe Xtandi's lack of requirement for concomitant steroid, which is at least suboptimal and potentially incompatible for use with immunotherapy, represents a fundamental differentiation vs. Zytiga in addition to other advantages. We believe this positions Xtandi well even in a generic Zytiga environment.
Biological rationale to combine immunotherapy with hormonal therapy is "particularly strong". Immuno-oncology (IO) KOLs have suggested that the most compelling combination of checkpoint inhibitors may be with hormonal agents. Androgen blockade has been shown to activate thymic regeneration in mice and humans, therefore is an immunologically active intervention. In addition, androgen blockade was shown to traffic T-cells to the human prostate with 3 weeks of initiation. A recently published National Cancer Institute study with Xtandi specifically showed that Xtandi enlarged thymus and improved survival in combination with a cancer vaccine in a preclinical model.
Gruß
ipollit
Hallo ipollit, hallo SLGramann und hallo in die Runde.
Ich habe mir eine erste Position ZFGN gekauft. ZFGN hat mit Beloranib ein Medikament gegen Übergewicht in der Pipeline. Mir gefällt dabei, dass es zunächst als Orphan Medikament gegen Übergewicht für Menschen mit dem Prader Willi Syndrom entwickelt wird. Neben einer zweiten Orphan Indikation (Hypothalamic Injury) wird wohl mittelfristig auch Übergewicht (als Alternative zum Magenband...) angepeilt. Meines Erachtens wären die Vermarktungsmöglichkeiten (wenn die Nebenwirkungen es zulassen) langfristig ziemlich groß. Zwar wird es im Gegensatz zu den Alternativen von Arena, Vivus und Orexigene subkutan verabreicht, jedoch wirkt es ganz anders (so wie ich es versteh wirkt es auf den Fettstoffwechsel ein) und eben weitaus besser. Die unten aufgeführten Zahlen sind alleine auf das Medikament zurück zu führen (keine Bewegung und keine Diät). Und da finde ich die Werte nach 12 Woche ziemlich eindrucksvoll.

Zudem waren auch positive Effekte auf Blutdruck, LDL... festzustellen. (s. metabolisches Synrom)

An der Börse wird ZFGN noch mit knapp unter 500 Mio $ bewertet. Ich finde das noch nicht zu teuer. Schon im 4Q 2015 sollen erste Ergebnisse der P III zu PW vorliegen. Zudem ist der Wert noch recht unbekannt. Vielleicht wird er auch wegen der Vermarktungsflopps von Arena etc. gemieden?
AF hatte Zafgen mal kurz am Rande vorgestellt:
http://www.thestreet.com/story/12745978/1/biotech-stock-mail…
SG kmastra
Ich habe mir eine erste Position ZFGN gekauft. ZFGN hat mit Beloranib ein Medikament gegen Übergewicht in der Pipeline. Mir gefällt dabei, dass es zunächst als Orphan Medikament gegen Übergewicht für Menschen mit dem Prader Willi Syndrom entwickelt wird. Neben einer zweiten Orphan Indikation (Hypothalamic Injury) wird wohl mittelfristig auch Übergewicht (als Alternative zum Magenband...) angepeilt. Meines Erachtens wären die Vermarktungsmöglichkeiten (wenn die Nebenwirkungen es zulassen) langfristig ziemlich groß. Zwar wird es im Gegensatz zu den Alternativen von Arena, Vivus und Orexigene subkutan verabreicht, jedoch wirkt es ganz anders (so wie ich es versteh wirkt es auf den Fettstoffwechsel ein) und eben weitaus besser. Die unten aufgeführten Zahlen sind alleine auf das Medikament zurück zu führen (keine Bewegung und keine Diät). Und da finde ich die Werte nach 12 Woche ziemlich eindrucksvoll.
Zudem waren auch positive Effekte auf Blutdruck, LDL... festzustellen. (s. metabolisches Synrom)
An der Börse wird ZFGN noch mit knapp unter 500 Mio $ bewertet. Ich finde das noch nicht zu teuer. Schon im 4Q 2015 sollen erste Ergebnisse der P III zu PW vorliegen. Zudem ist der Wert noch recht unbekannt. Vielleicht wird er auch wegen der Vermarktungsflopps von Arena etc. gemieden?
AF hatte Zafgen mal kurz am Rande vorgestellt:
http://www.thestreet.com/story/12745978/1/biotech-stock-mail…
SG kmastra
Antwort auf Beitrag Nr.: 48.179.815 von kmastra am 30.10.14 21:43:01"Zwar wird es im Gegensatz zu den Alternativen von Arena, Vivus und Orexigene subkutan verabreicht, jedoch wirkt es ganz anders (so wie ich es versteh wirkt es auf den Fettstoffwechsel ein) und eben weitaus besser. Die unten aufgeführten Zahlen sind alleine auf das Medikament zurück zu führen (keine Bewegung und keine Diät). Und da finde ich die Werte nach 12 Woche ziemlich eindrucksvoll."
Hallo kmastra,
normalerweise winke ich bei einem "Anti-Verfettungsmedi" gleich ab. Bin aber froh, dass DU uns hier Zafgen mal vorgestellt hast, denn das war Grund genug, doch nicht gleich abzuwinken, sondern mal hinzusehen.
Arena und Vivus... mein erster Eindruck ist, dass der MOA von Zafgen "seriöser" ist und dass das NW-Profil daher signifikant besser sein könnte.
An der Effektivität des Kandidaten habe ich relativ wenig Zweifel. Allein der sehr dosisabhängige Effekt spricht für sich. Einzige Manko ist, dass bisher nur 3-Monatsdaten vorliegen.
Dass es sich um eine ernsthafte Indikation handelt und dass das ganze auch kommerziell bedeutend ist, ist eh evident.
Eine Arbeitskollegin von mir hat bspw. ein Magenband bekommen. Die OP war erfolgreich und der Effekt war frappierend. Dennoch wird sich wohl kaum jemand einer solchen OP unterziehen, wenn er mit einer SC-Spritze einen relevanten Effekt erzielen kann und dabei ein sauberes NW-Profil hat.
Hier mal ein langer Artikel von Reuters, der zwar schon über ein Jahr alt, aber immer noch aktuell ist:
http://www.reuters.com/article/2013/08/26/zafgen-dietdrug-id…
Ich glaube, dass es günstig wäre, wenn man mehr über die "Konkurrenz" zusammentragen würde (Arena, Vivus). Haben die wirklich gefloppt? Wenn ja, warum? Welche Vorteile bietet Zafgen wirklich? Geht es tatsächlich vorrangig um die Nebenwirkungen?
Gruß
SLG
Hallo kmastra,
normalerweise winke ich bei einem "Anti-Verfettungsmedi" gleich ab. Bin aber froh, dass DU uns hier Zafgen mal vorgestellt hast, denn das war Grund genug, doch nicht gleich abzuwinken, sondern mal hinzusehen.
Arena und Vivus... mein erster Eindruck ist, dass der MOA von Zafgen "seriöser" ist und dass das NW-Profil daher signifikant besser sein könnte.
An der Effektivität des Kandidaten habe ich relativ wenig Zweifel. Allein der sehr dosisabhängige Effekt spricht für sich. Einzige Manko ist, dass bisher nur 3-Monatsdaten vorliegen.
Dass es sich um eine ernsthafte Indikation handelt und dass das ganze auch kommerziell bedeutend ist, ist eh evident.
Eine Arbeitskollegin von mir hat bspw. ein Magenband bekommen. Die OP war erfolgreich und der Effekt war frappierend. Dennoch wird sich wohl kaum jemand einer solchen OP unterziehen, wenn er mit einer SC-Spritze einen relevanten Effekt erzielen kann und dabei ein sauberes NW-Profil hat.
Hier mal ein langer Artikel von Reuters, der zwar schon über ein Jahr alt, aber immer noch aktuell ist:
http://www.reuters.com/article/2013/08/26/zafgen-dietdrug-id…
Ich glaube, dass es günstig wäre, wenn man mehr über die "Konkurrenz" zusammentragen würde (Arena, Vivus). Haben die wirklich gefloppt? Wenn ja, warum? Welche Vorteile bietet Zafgen wirklich? Geht es tatsächlich vorrangig um die Nebenwirkungen?
Gruß
SLG
Antwort auf Beitrag Nr.: 48.183.892 von SLGramann am 31.10.14 10:49:34"Ich glaube, dass es günstig wäre, wenn man mehr über die "Konkurrenz" zusammentragen würde (Arena, Vivus)."
Arenas Belviq wurde in Europa nicht zugelassen (Antrag wurde zurückgezogen).
Das meinte die EMA (bzw. das CHMP):
What was the recommendation of the CHMP at that time?
Based on the review of the data and the company’s response to the CHMP lists of questions, at the time of the withdrawal the CHMP had some concerns and was of the provisional opinion that Belviq could not have been approved for weight control in obese and overweight patients. Although a modest benefit in terms of weight loss was seen in the main studies, the Committee was concerned about the potential risk of tumours, particularly with long-term use, based on the results of laboratory tests. The
CHMP also had other safety concerns, including the potential risk of psychiatric disorders (such as depression) and valvulopathy (problems with the heart valves), which were seen in some patients during the studies. Therefore, at the time of the withdrawal, the CHMP was of the opinion that the benefits of Belviq did not outweigh its risks
http://www.ema.europa.eu/docs/en_GB/document_library/Medicin…
Arenas Belviq wurde in Europa nicht zugelassen (Antrag wurde zurückgezogen).
Das meinte die EMA (bzw. das CHMP):
What was the recommendation of the CHMP at that time?
Based on the review of the data and the company’s response to the CHMP lists of questions, at the time of the withdrawal the CHMP had some concerns and was of the provisional opinion that Belviq could not have been approved for weight control in obese and overweight patients. Although a modest benefit in terms of weight loss was seen in the main studies, the Committee was concerned about the potential risk of tumours, particularly with long-term use, based on the results of laboratory tests. The
CHMP also had other safety concerns, including the potential risk of psychiatric disorders (such as depression) and valvulopathy (problems with the heart valves), which were seen in some patients during the studies. Therefore, at the time of the withdrawal, the CHMP was of the opinion that the benefits of Belviq did not outweigh its risks
http://www.ema.europa.eu/docs/en_GB/document_library/Medicin…
Antwort auf Beitrag Nr.: 48.184.378 von SLGramann am 31.10.14 11:19:43Und hier noch einiges zu Orexigens Contrave.
Auch das liest sich alles andere als überzeugend:
http://www.aerzteblatt.de/nachrichten/60074/Diaetpille-Contr…
Ich empfinde den Effekt des Wirkstoffs als schwach (4,1% Gewichtsverlust nach einem Jahr gegenüber der Placebo-Gruppe) und das NW-Profil als sehr unsauber.
Generell scheinen die bisherigen Mittel keine durchschlagende Wirkung aufzuweisen:
Contrave (NB32) is likely to be less effective than Qsymia, more effective than Belviq. That’s a major generalization, but in trials those taking Qsymia lost an average of 9 percent of their body weight, while those taking Belviq lost an average of just 3 percent. Clinical trials show those taking NB32 lost an average of 5 percent of their body weight.
http://www.forbes.com/sites/melaniehaiken/2014/06/10/new-wei…
Insgesamt komme ich zu dem vorläufigen Schluss, dass die Wirkung der bisherigen "weight-loss-drugs" bescheiden und die NW-Profile grottig sind.
Dass das wohl alles kommerzielle Flops sind, ist dann natürlich verständlich und ebenfalls verständlich ist der schlechte Ruf dieser Wirkstoffklasse bei Investoren, der auch mir bekannt war, bevor ich mich jetzt mit der Materie etwas näher befasst habe.
Das alles spricht natürlich für einen ganz neuen Ansatz, wie ihn Zafgen anbietet, denn der medizinische Bedarf ist an sich natürlich vorhanden!
Die wichtigste Frage wird sein, wie effektiv Beloranib über längere Zeit wirkt und wie sauber das Nebenwirkungsprofil langfristig sein wird.
Ende 2015 werden wir über beide Fragen etwas mehr wissen. Das Eingehen einer kleinen Position könnte aber schon jetzt eine gute Idee sein.
Auch das liest sich alles andere als überzeugend:
http://www.aerzteblatt.de/nachrichten/60074/Diaetpille-Contr…
Ich empfinde den Effekt des Wirkstoffs als schwach (4,1% Gewichtsverlust nach einem Jahr gegenüber der Placebo-Gruppe) und das NW-Profil als sehr unsauber.
Generell scheinen die bisherigen Mittel keine durchschlagende Wirkung aufzuweisen:
Contrave (NB32) is likely to be less effective than Qsymia, more effective than Belviq. That’s a major generalization, but in trials those taking Qsymia lost an average of 9 percent of their body weight, while those taking Belviq lost an average of just 3 percent. Clinical trials show those taking NB32 lost an average of 5 percent of their body weight.
http://www.forbes.com/sites/melaniehaiken/2014/06/10/new-wei…
Insgesamt komme ich zu dem vorläufigen Schluss, dass die Wirkung der bisherigen "weight-loss-drugs" bescheiden und die NW-Profile grottig sind.
Dass das wohl alles kommerzielle Flops sind, ist dann natürlich verständlich und ebenfalls verständlich ist der schlechte Ruf dieser Wirkstoffklasse bei Investoren, der auch mir bekannt war, bevor ich mich jetzt mit der Materie etwas näher befasst habe.
Das alles spricht natürlich für einen ganz neuen Ansatz, wie ihn Zafgen anbietet, denn der medizinische Bedarf ist an sich natürlich vorhanden!
Die wichtigste Frage wird sein, wie effektiv Beloranib über längere Zeit wirkt und wie sauber das Nebenwirkungsprofil langfristig sein wird.
Ende 2015 werden wir über beide Fragen etwas mehr wissen. Das Eingehen einer kleinen Position könnte aber schon jetzt eine gute Idee sein.
Hallo SLGramann,
vielen Dank erstmal für die Infos. So genau hatte ich mich noch gar nicht mit der Konkurrenz beschäftigt - das nur so am Rande mitgeschnitten. Meines Wissens wurden die Medikamente auch deshalb zugelassen, weil besonders in den USA Fettleibigkeit zu einem so großen volkswirtschaftlichen und auch gesundheitlichen Problem geworden ist, dass die FDA unter einem gewissen Druck stand. Wurde hier quasi Nebenwirkungen mit den Auswirkungen von Fettleibigkeit aufgewogen? Die Nebenwirkungen sind ja nicht ohne. Das ist bei dem Wirkprinzip auch nicht verwunderlich. ZFGN gibt an, dass es unter der 2 mg Dosierung quasi bisher keine Nebenwirkungen gab - aber das muss natürlich erstmal langfristig und mit mehr Patienten untersucht werden.
Obese patients treated with Contrave for one year lose approximately 5% of their body weight, adjusted for placebo. By comparison, Qsymia's placebo-adjusted weight loss at one year is around 9%, Belviq is 3%. The three drugs have never been compared directly in a single clinical trial.
http://www.thestreet.com/story/12737868/1/orexigen-goldilock…
Aber ich denke die Zahlen sehen ja ganz gut zu Gunsten von ZFGN aus, die ja bis zu 10% weniger Körpergewicht bereits nach 12 Wochen erreicht haben.
An ZFGN gefällt mir besonders, dass es sowohl ein "Proof of concept" als auch eine "route to market" gibt. Vom PW Syndrom, über Hyothalamusschädigung, zu extremer Fettleibigkeit, ggf. metabloischen Syndrom bis hin zur "Lifestylespritze beim Schönheitschirurgen". So wie es in diesem Interview klingt, will sich ZFGN aber zunächst auf PW, Patienten mit Schädigung des Hypothalamus und später auch extremes Übergewicht konzentrieren. In der Pipeline entwickelt man sowohl auch Nachfolgekandidaten, die für die größeren Indikationen als auch ggf. für Nash (macht ja auf den ersten Blick Sinn) gedacht sind un dann auch oral verabreicht werden können.
http://www.forbes.com/sites/matthewherper/2014/10/02/zafgen-…

SG kmastra
vielen Dank erstmal für die Infos. So genau hatte ich mich noch gar nicht mit der Konkurrenz beschäftigt - das nur so am Rande mitgeschnitten. Meines Wissens wurden die Medikamente auch deshalb zugelassen, weil besonders in den USA Fettleibigkeit zu einem so großen volkswirtschaftlichen und auch gesundheitlichen Problem geworden ist, dass die FDA unter einem gewissen Druck stand. Wurde hier quasi Nebenwirkungen mit den Auswirkungen von Fettleibigkeit aufgewogen? Die Nebenwirkungen sind ja nicht ohne. Das ist bei dem Wirkprinzip auch nicht verwunderlich. ZFGN gibt an, dass es unter der 2 mg Dosierung quasi bisher keine Nebenwirkungen gab - aber das muss natürlich erstmal langfristig und mit mehr Patienten untersucht werden.
Obese patients treated with Contrave for one year lose approximately 5% of their body weight, adjusted for placebo. By comparison, Qsymia's placebo-adjusted weight loss at one year is around 9%, Belviq is 3%. The three drugs have never been compared directly in a single clinical trial.
http://www.thestreet.com/story/12737868/1/orexigen-goldilock…
Aber ich denke die Zahlen sehen ja ganz gut zu Gunsten von ZFGN aus, die ja bis zu 10% weniger Körpergewicht bereits nach 12 Wochen erreicht haben.
An ZFGN gefällt mir besonders, dass es sowohl ein "Proof of concept" als auch eine "route to market" gibt. Vom PW Syndrom, über Hyothalamusschädigung, zu extremer Fettleibigkeit, ggf. metabloischen Syndrom bis hin zur "Lifestylespritze beim Schönheitschirurgen". So wie es in diesem Interview klingt, will sich ZFGN aber zunächst auf PW, Patienten mit Schädigung des Hypothalamus und später auch extremes Übergewicht konzentrieren. In der Pipeline entwickelt man sowohl auch Nachfolgekandidaten, die für die größeren Indikationen als auch ggf. für Nash (macht ja auf den ersten Blick Sinn) gedacht sind un dann auch oral verabreicht werden können.
http://www.forbes.com/sites/matthewherper/2014/10/02/zafgen-…
SG kmastra
Auch Orlistat (mittlerweile als Generikum erhältlich) überzeugt nicht wirklich:
Orlistat: Diätpille mit gefährlichen Wechselwirkungen
Dienstag, 11. Dezember 2012
http://www.aerzteblatt.de/nachrichten/52718/Orlistat-Diaetpi…
Übergewicht: Rezeptfreie Abnehmpille mit Wechselwirkungen
http://www.spiegel.de/gesundheit/diagnose/schneller-abnehmen…
Orlistat: Diätpille mit gefährlichen Wechselwirkungen
Dienstag, 11. Dezember 2012
http://www.aerzteblatt.de/nachrichten/52718/Orlistat-Diaetpi…
Übergewicht: Rezeptfreie Abnehmpille mit Wechselwirkungen
http://www.spiegel.de/gesundheit/diagnose/schneller-abnehmen…
PCYC
Imbruvica entwickelt sich ja sehr gut und bildet die Basis vieler neuer Therapie-Ansätze in Blutkrebsarten wie CLL. Gibt es eigentlich konkrete Aussagen darüber, ob es auch gegen solide Tumore eingesetzt werden soll? Zuletzt habe ich dazu einige Kommantare gelesen, aber von PCYC bisher nichts Offizielles gefunden!?

Dass Imbruvica neben BTK- auch ein ITK-Hemmer ist, habe ich ja mal geschrieben. Damit wäre eine Beeinflussung des Immunsystems gegen Krebs möglich, theoretisch auch eine Kombination z.B. mit Checkpoint-Hemmern wie PD-1 AKs.
Nach meinem Verständnis können u.a. die T-Zellen des Immunsystems Krebszellen erkennen und abtöten. Deshalb haben Krebszellen verschiedene Mechanismen, um sich vor dem Immunsystem zu schützen. So expressionieren sie PD-L1, um den PD-1 Rezeptor an T-Zellen zu aktivieren, der dann die T-Zellen deaktiviert. Ein PD-1 oder PD-L1 AK blockiert diesen Signalweg... die T-Zelle bleibt aktiv und kann die Krebszelle angreifen.
Es gibt verschiedene Arten von T-Zellen. U.a. sind das Effektor T-Zellen Tf, die z.B. Krebszellen abtöten können und regulative T-Zellen Tr, die verhindern sollen, dass die Körperantwort außer Kontrolle gerät, indem sie die Effektor-Zellen wieder deaktivieren. Ein hohes Tr/Tf Verhältnis führt daher auch dazu, dass die Immunantwort gegen den Krebs geschwächt ist. Krebszellen können u.a. über IDO dieses Verhältnis zu ihren Gunsten verändern. IDO-Hemmer wie der von INCY können helfen, dass mehr Effektor T-Zellen als regulatroische T-Zellen vorhanden sind.
Desweiteren gibt es T1-Helferzellen und T2-Helferzellen. Auch deren Verhältnis spielt bei der Erkennung und Bekämpfung von Krebs durch das Immunsystem eine Rolle:
http://www.laborzentrum.org/dokumente/th1-th2-immunbalance.p…
"Die Th1 - Immunreaktion ist charakteristisch für eine zellu-läre Immunantwort.
Th1-Zellen setzen die Zytokine Interferon-gamma (IFN-?), Tumor Nekrose Faktor-alpha (TNF-a) und Interleukin 2 (IL-2) frei. INF-? aktiviert Makrophagen, hemmt die B-Zellen und ver-hindert so eine Th2-Antwort.
Die Th1-Immunantwort ist besonders wichtig zur Abwehr intrazellulärer Infekte (Viren, Chlamydien, Mykobakterien, Pilze) bzw. Tumoren.
Eine Th2-Reaktionslage tritt bei allergischen Erkrankungen und extrazellulären parasitären und bakteriellen Infektionen auf.
Die Immunbalance ist z. B. bei Krebs und Infektionskrank-heiten zu ungunsten des Th1-Musters, also zugunsten der Th2-Zellen verschoben. Bei Th2-Dominanz ist die Immunabwehr von Tumoren und Viren auf der Effektor-ebene erschwert. Ein solcher Überschuss an Th2-Zellen wurde auch bei allergischen Erkrankungen festgestellt.
Auch chronischer Stress verschiebt die Immunantwort von Th1 zu Th2. Umweltfaktoren (Tabak, UV-Strahlung, Psycho-stress, oxidativer Stress, Medikamente, Vergiftungen, Impfungen) können einen Th2-Shift verstärken.
Da die Th1- und Th2-Zellen antagonistisch wirken, wird bereits eine Stärkung der Th1-Immunantwort bei Th2-Switch bei Tumorpatienten und umgekehrt eine Stärkung der Th2-Immunantwort bei Th1-dominiertem Entzündungsanlauf versucht."
Th1-Zellen verändern das Immunsystem so, dass besser Defekte in den Zellen erkannt werden können, wie es z.B. bei Krebs der Fall ist, während Th2-Zellen das Immunystem mehr auf externe körperfremde Bedrohungen wie z.B. Bakterien einstellen. Beides gleichzeitig geht nicht. Eine Erhöhung von Th2 führt automatisch zu einer Senkung der Th1-Immunantwort, also auch zu einer Schwächung der Immunantwort gegen Krebszellen:
http://de.wikipedia.org/wiki/T-Helferzelle
"Die von Typ2-T-Zellen ausgeschütteten Zytokine hemmen die Mechanismen, die zu einer Typ1-Antwort führen. Durch diese Kreuzhemmung wird eine einmal eingeschlagene Richtung für die Immunantwort beibehalten. Besonders IL-10 hemmt die Makrophagenaktivierung."
Imbruvica ist neben BTK- auch ein ITK-Hemmer:
http://files.shareholder.com/downloads/PCYC/0x0x621315/B764E…
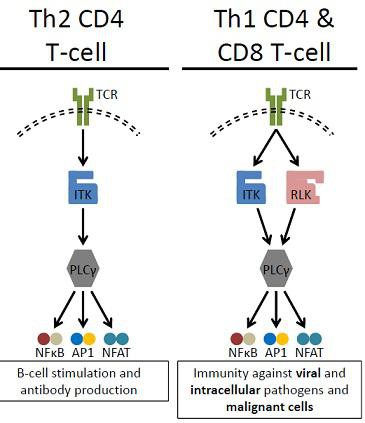
Über ITK wird die Entstehung von Th1- und Th2-Zellen stimuliert, so dass eine Hemmung von ITK die Anzahl dieser Zellen senkt. Allerdings gibt für Th1-Zellen noch einen alternativen Signalweg über RLK. Daher wirkt sich eine Hemmung von ITK nur auf Th2 aus. Imbruvica könnte somit das Verhältnis Th1 zu Th2 erhöhen, wodurch die Immunantwort sich danach mehr gegen die Krebszellen richtet.
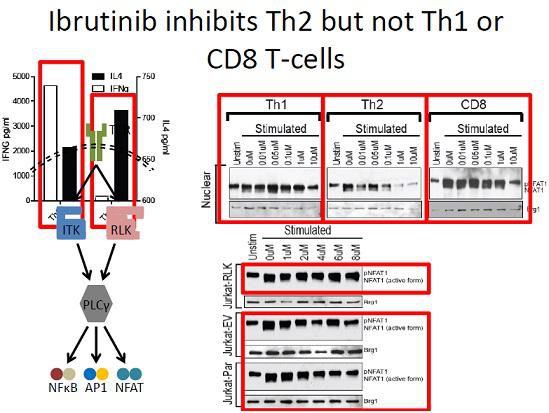
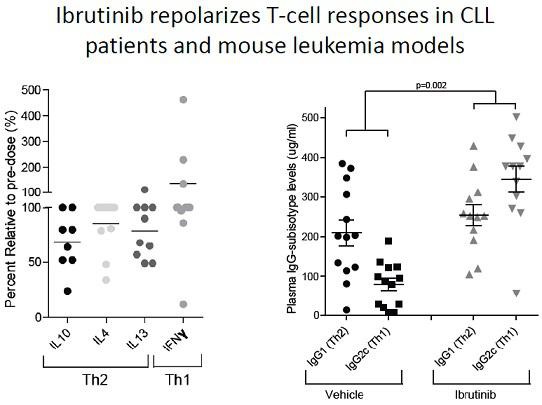
Mal schauen, ob das auch in der Praxis funktioniert. Bisher ist eine IO-Wirkung über BTK hinaus noch in keinster Weise in den Kursen enthalten.

Gruß
ipollit
Imbruvica entwickelt sich ja sehr gut und bildet die Basis vieler neuer Therapie-Ansätze in Blutkrebsarten wie CLL. Gibt es eigentlich konkrete Aussagen darüber, ob es auch gegen solide Tumore eingesetzt werden soll? Zuletzt habe ich dazu einige Kommantare gelesen, aber von PCYC bisher nichts Offizielles gefunden!?

Dass Imbruvica neben BTK- auch ein ITK-Hemmer ist, habe ich ja mal geschrieben. Damit wäre eine Beeinflussung des Immunsystems gegen Krebs möglich, theoretisch auch eine Kombination z.B. mit Checkpoint-Hemmern wie PD-1 AKs.
Nach meinem Verständnis können u.a. die T-Zellen des Immunsystems Krebszellen erkennen und abtöten. Deshalb haben Krebszellen verschiedene Mechanismen, um sich vor dem Immunsystem zu schützen. So expressionieren sie PD-L1, um den PD-1 Rezeptor an T-Zellen zu aktivieren, der dann die T-Zellen deaktiviert. Ein PD-1 oder PD-L1 AK blockiert diesen Signalweg... die T-Zelle bleibt aktiv und kann die Krebszelle angreifen.
Es gibt verschiedene Arten von T-Zellen. U.a. sind das Effektor T-Zellen Tf, die z.B. Krebszellen abtöten können und regulative T-Zellen Tr, die verhindern sollen, dass die Körperantwort außer Kontrolle gerät, indem sie die Effektor-Zellen wieder deaktivieren. Ein hohes Tr/Tf Verhältnis führt daher auch dazu, dass die Immunantwort gegen den Krebs geschwächt ist. Krebszellen können u.a. über IDO dieses Verhältnis zu ihren Gunsten verändern. IDO-Hemmer wie der von INCY können helfen, dass mehr Effektor T-Zellen als regulatroische T-Zellen vorhanden sind.
Desweiteren gibt es T1-Helferzellen und T2-Helferzellen. Auch deren Verhältnis spielt bei der Erkennung und Bekämpfung von Krebs durch das Immunsystem eine Rolle:
http://www.laborzentrum.org/dokumente/th1-th2-immunbalance.p…
"Die Th1 - Immunreaktion ist charakteristisch für eine zellu-läre Immunantwort.
Th1-Zellen setzen die Zytokine Interferon-gamma (IFN-?), Tumor Nekrose Faktor-alpha (TNF-a) und Interleukin 2 (IL-2) frei. INF-? aktiviert Makrophagen, hemmt die B-Zellen und ver-hindert so eine Th2-Antwort.
Die Th1-Immunantwort ist besonders wichtig zur Abwehr intrazellulärer Infekte (Viren, Chlamydien, Mykobakterien, Pilze) bzw. Tumoren.
Eine Th2-Reaktionslage tritt bei allergischen Erkrankungen und extrazellulären parasitären und bakteriellen Infektionen auf.
Die Immunbalance ist z. B. bei Krebs und Infektionskrank-heiten zu ungunsten des Th1-Musters, also zugunsten der Th2-Zellen verschoben. Bei Th2-Dominanz ist die Immunabwehr von Tumoren und Viren auf der Effektor-ebene erschwert. Ein solcher Überschuss an Th2-Zellen wurde auch bei allergischen Erkrankungen festgestellt.
Auch chronischer Stress verschiebt die Immunantwort von Th1 zu Th2. Umweltfaktoren (Tabak, UV-Strahlung, Psycho-stress, oxidativer Stress, Medikamente, Vergiftungen, Impfungen) können einen Th2-Shift verstärken.
Da die Th1- und Th2-Zellen antagonistisch wirken, wird bereits eine Stärkung der Th1-Immunantwort bei Th2-Switch bei Tumorpatienten und umgekehrt eine Stärkung der Th2-Immunantwort bei Th1-dominiertem Entzündungsanlauf versucht."
Th1-Zellen verändern das Immunsystem so, dass besser Defekte in den Zellen erkannt werden können, wie es z.B. bei Krebs der Fall ist, während Th2-Zellen das Immunystem mehr auf externe körperfremde Bedrohungen wie z.B. Bakterien einstellen. Beides gleichzeitig geht nicht. Eine Erhöhung von Th2 führt automatisch zu einer Senkung der Th1-Immunantwort, also auch zu einer Schwächung der Immunantwort gegen Krebszellen:
http://de.wikipedia.org/wiki/T-Helferzelle
"Die von Typ2-T-Zellen ausgeschütteten Zytokine hemmen die Mechanismen, die zu einer Typ1-Antwort führen. Durch diese Kreuzhemmung wird eine einmal eingeschlagene Richtung für die Immunantwort beibehalten. Besonders IL-10 hemmt die Makrophagenaktivierung."
Imbruvica ist neben BTK- auch ein ITK-Hemmer:
http://files.shareholder.com/downloads/PCYC/0x0x621315/B764E…

Über ITK wird die Entstehung von Th1- und Th2-Zellen stimuliert, so dass eine Hemmung von ITK die Anzahl dieser Zellen senkt. Allerdings gibt für Th1-Zellen noch einen alternativen Signalweg über RLK. Daher wirkt sich eine Hemmung von ITK nur auf Th2 aus. Imbruvica könnte somit das Verhältnis Th1 zu Th2 erhöhen, wodurch die Immunantwort sich danach mehr gegen die Krebszellen richtet.


Mal schauen, ob das auch in der Praxis funktioniert. Bisher ist eine IO-Wirkung über BTK hinaus noch in keinster Weise in den Kursen enthalten.
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.199.480 von ipollit am 02.11.14 20:42:41PCYC
Imbruvica scheint auch einen Einfluss auf AKT zu haben...

http://www.ncbi.nlm.nih.gov/pubmed/25081321
"Ibrutinib (ImbruvicaTM) potently inhibits ErbB receptor phosphorylation and cell viability of ErbB2-positive breast cancer cells
...Since BTK is predominantly expressed in hematopoietic cells, the sensitivity of solid tumor cells to Ibrutinib has not been analyzed. In this study, we determined the effect of Ibrutinib on breast cancer cells. We demonstrate that Ibrutinib efficiently reduces the phosphorylation of the receptor tyrosine kinases ErbB1, ErbB2 and ErbB3, thereby suppressing AKT and MAPK signaling in ErbB2-positive (ErbB2+) breast cancer cell lines. ... Therefore, the combination of Ibrutinib and canonical PI3K pathway inhibitors could be a new and effective approach in the treatment of breast cancer with activated ErbB receptors. Ibrutinib could thus become a valuable component of targeted therapy in aggressive ErbB2+ breast cancer."
ErbB2 ist Her2 und ErbB1 ist EGFR. Die Nebenwirkungen von Imbruvica sind eher mild... ob da diese Wirkungen z.B. gegen EGFR so dominant sind?
Gruß
ipollit
Imbruvica scheint auch einen Einfluss auf AKT zu haben...

http://www.ncbi.nlm.nih.gov/pubmed/25081321
"Ibrutinib (ImbruvicaTM) potently inhibits ErbB receptor phosphorylation and cell viability of ErbB2-positive breast cancer cells
...Since BTK is predominantly expressed in hematopoietic cells, the sensitivity of solid tumor cells to Ibrutinib has not been analyzed. In this study, we determined the effect of Ibrutinib on breast cancer cells. We demonstrate that Ibrutinib efficiently reduces the phosphorylation of the receptor tyrosine kinases ErbB1, ErbB2 and ErbB3, thereby suppressing AKT and MAPK signaling in ErbB2-positive (ErbB2+) breast cancer cell lines. ... Therefore, the combination of Ibrutinib and canonical PI3K pathway inhibitors could be a new and effective approach in the treatment of breast cancer with activated ErbB receptors. Ibrutinib could thus become a valuable component of targeted therapy in aggressive ErbB2+ breast cancer."
ErbB2 ist Her2 und ErbB1 ist EGFR. Die Nebenwirkungen von Imbruvica sind eher mild... ob da diese Wirkungen z.B. gegen EGFR so dominant sind?
Gruß
ipollit
IPH.PA & PCYC
IPH testet bald den NKG2A-Hemmer IPH2201 auch zusammen mit Imbruvica auf Basis der ITK-Hemmung und damit der Änderung des Th1/Th2-Verhältnisses
Krebszellen können HLA-E expressionieren, um über den NKG2A-Rezeptor auf T- und NK-Zellen das Immunsystem zu hemmen. IPH2201 ist ähnlich wie beim PD-1 AK in der Lage, diese negativen Signale der Krebszellen zu blockieren und damit die Krebszellen für T- und NK-Zellen wieder sichtbar zu machen.
http://innate-pharma.com/sites/default/files/140410_rd_day_f…
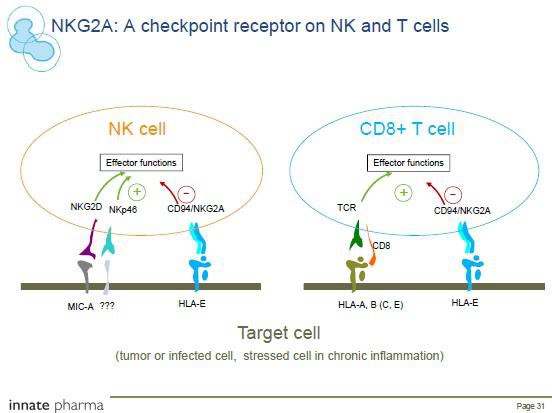

ITK-Hemmer sollen keine negativen Effekte auf die CD8+ T-Zellen und NK-Zellen haben, aber das Umfeld der Krebszellen durch Erhöhung von Th1 so verändern, dass die T-Zellen und NK-Zellen den Krebs stärker angreifen.


****
Interessant auch, dass BMS nun eine Studie von Ipilimumab (CTLA4-AK) und Nivolumab (PD1-AK) nun um IPH's KIR AK Lirilumab erweitert hat:
http://www.sugarconebiotech.com/?p=779
"Bristol-Myers Squibb (BMS) has quietly changed the protocol of clinical trial NCT01592370. This Phase 1 clinical trial has evolved from a nivolumab (anti-PD-1) study in hematological malignancies (5/4/14) to include ipilimumab (anti-CTLA4) with nivolumab (4/8/14) to now include nivolumab, ipilimumab and lirilumab (anti-KIR) as of 10/30/14"
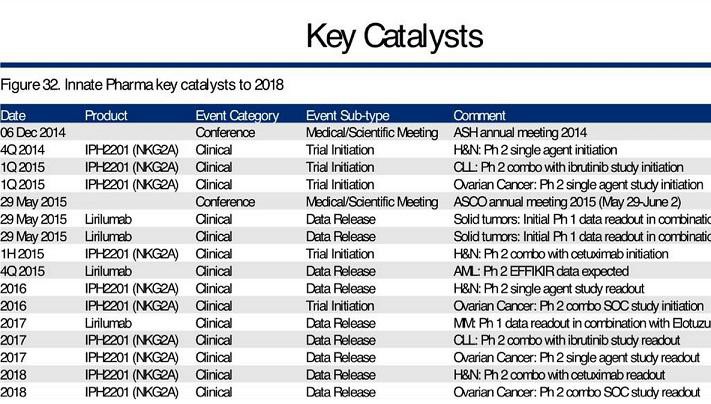

Gruß
ipollit
IPH testet bald den NKG2A-Hemmer IPH2201 auch zusammen mit Imbruvica auf Basis der ITK-Hemmung und damit der Änderung des Th1/Th2-Verhältnisses
Krebszellen können HLA-E expressionieren, um über den NKG2A-Rezeptor auf T- und NK-Zellen das Immunsystem zu hemmen. IPH2201 ist ähnlich wie beim PD-1 AK in der Lage, diese negativen Signale der Krebszellen zu blockieren und damit die Krebszellen für T- und NK-Zellen wieder sichtbar zu machen.
http://innate-pharma.com/sites/default/files/140410_rd_day_f…


ITK-Hemmer sollen keine negativen Effekte auf die CD8+ T-Zellen und NK-Zellen haben, aber das Umfeld der Krebszellen durch Erhöhung von Th1 so verändern, dass die T-Zellen und NK-Zellen den Krebs stärker angreifen.


****
Interessant auch, dass BMS nun eine Studie von Ipilimumab (CTLA4-AK) und Nivolumab (PD1-AK) nun um IPH's KIR AK Lirilumab erweitert hat:
http://www.sugarconebiotech.com/?p=779
"Bristol-Myers Squibb (BMS) has quietly changed the protocol of clinical trial NCT01592370. This Phase 1 clinical trial has evolved from a nivolumab (anti-PD-1) study in hematological malignancies (5/4/14) to include ipilimumab (anti-CTLA4) with nivolumab (4/8/14) to now include nivolumab, ipilimumab and lirilumab (anti-KIR) as of 10/30/14"

Gruß
ipollit
Antwort auf Beitrag Nr.: 48.179.815 von kmastra am 30.10.14 21:43:01Hallo kmastra,
ZFGN sieht nicht uninteressant aus. Gut auch, dass andere Parameter wie Blutdruck, LDL oder CRP positiv beeinflusst werden. Vielleicht kommen irgendwann ja auch noch Indikationen wie NASH usw dazu. Behalte ich im Auge, danke!
Vielleicht könnte demnächst auch der IPO Fibrogen interessant sein. Die haben ein besseres Epo (Epo ist immer noch ein Multi-Mrd-Blockbuster) in PIII bei großen Pharmas sowie ein Mittel FG-3019 gegen IPF in PII, das besser als z.B. ITMNs Esbriet sein soll. Letzteres war Roche 8 Mrd USD wert. Während Esbriet IPF nur verlangsamt, soll FG-3019 die Erkrankung mehr oder weniger rückgängig machen können.
Die MK dürfte allerdings deutlich über 1 Mrd USD liegen.
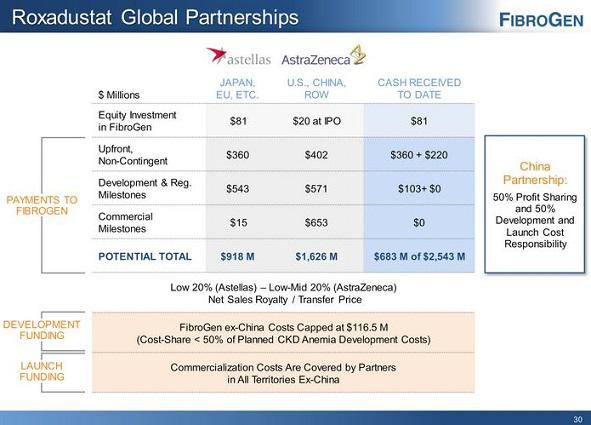
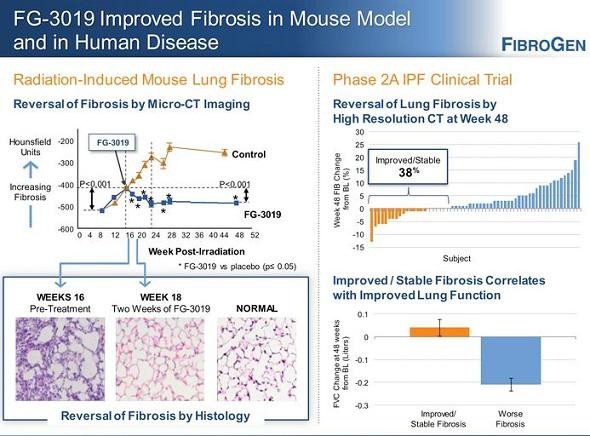
Gruß
ipollit
ZFGN sieht nicht uninteressant aus. Gut auch, dass andere Parameter wie Blutdruck, LDL oder CRP positiv beeinflusst werden. Vielleicht kommen irgendwann ja auch noch Indikationen wie NASH usw dazu. Behalte ich im Auge, danke!
Vielleicht könnte demnächst auch der IPO Fibrogen interessant sein. Die haben ein besseres Epo (Epo ist immer noch ein Multi-Mrd-Blockbuster) in PIII bei großen Pharmas sowie ein Mittel FG-3019 gegen IPF in PII, das besser als z.B. ITMNs Esbriet sein soll. Letzteres war Roche 8 Mrd USD wert. Während Esbriet IPF nur verlangsamt, soll FG-3019 die Erkrankung mehr oder weniger rückgängig machen können.
Die MK dürfte allerdings deutlich über 1 Mrd USD liegen.


Gruß
ipollit
PCYC
nun doch auch etwas Offizielles zu Imbruvica in soliden Tumoren: PCYC und AZN kooperieren bei Kombi-Studien von Imbruvica + PD-L1 AK...
http://finance.yahoo.com/news/astrazeneca-pharmacyclics-ente…
"AstraZeneca And Pharmacyclics Enter Immuno-Oncology Clinical Trial Collaboration With IMBRUVICA® In Solid Tumors
...The collaboration will evaluate the efficacy and safety of IMBRUVICA® (ibrutinib), Pharmacyclics' oral Bruton's tyrosine kinase inhibitor, in combination with AstraZeneca's anti-PD-L1 antibody, MEDI4736. Preclinical evidence suggests that the combination of IMBRUVICA with this investigational medicine may enhance their effects..."
Gruß
ipollit
nun doch auch etwas Offizielles zu Imbruvica in soliden Tumoren: PCYC und AZN kooperieren bei Kombi-Studien von Imbruvica + PD-L1 AK...
http://finance.yahoo.com/news/astrazeneca-pharmacyclics-ente…
"AstraZeneca And Pharmacyclics Enter Immuno-Oncology Clinical Trial Collaboration With IMBRUVICA® In Solid Tumors
...The collaboration will evaluate the efficacy and safety of IMBRUVICA® (ibrutinib), Pharmacyclics' oral Bruton's tyrosine kinase inhibitor, in combination with AstraZeneca's anti-PD-L1 antibody, MEDI4736. Preclinical evidence suggests that the combination of IMBRUVICA with this investigational medicine may enhance their effects..."
Gruß
ipollit
PCYC
Analystenkommentar...

Analystenkommentar...

ARRY:
Vernünftige - von uns erhoffte erhoffte - Maßnahme:
Array has previously indicated plans to initiate the FACTOR trial, a global Phase 3 study comparing the novel proteasome inhibitor Kyprolis® (carfilzomib) plus filanesib to Kyprolis alone in several hundred patients with relapsed refractory multiple myeloma (RRMM), this year, informed by data from an ongoing randomized Phase 2 Kyprolis combination study. While Array is in a position to dose patients in the FACTOR trial at this time, the company is delaying the start of patient enrollment until it has clarity on the potential return of binimetinib.
Vernünftige - von uns erhoffte erhoffte - Maßnahme:
Array has previously indicated plans to initiate the FACTOR trial, a global Phase 3 study comparing the novel proteasome inhibitor Kyprolis® (carfilzomib) plus filanesib to Kyprolis alone in several hundred patients with relapsed refractory multiple myeloma (RRMM), this year, informed by data from an ongoing randomized Phase 2 Kyprolis combination study. While Array is in a position to dose patients in the FACTOR trial at this time, the company is delaying the start of patient enrollment until it has clarity on the potential return of binimetinib.
CLDX
Der Kurs schmiert gerade etwas ab. Könnte der Grund darin liegen, daß bei der Studie zu Glemba Schwierigkeiten bestehen, geeigente Studienteilnehmer zu finden, die Studie deshalb länger dauern wird und zudem der primary endpoint neu definiert wurde? Oder ist die Sache eigentlich gar nicht so bedeutsam, daß sie diese Kursabschläge rechtfertigen würde?
Der Kurs schmiert gerade etwas ab. Könnte der Grund darin liegen, daß bei der Studie zu Glemba Schwierigkeiten bestehen, geeigente Studienteilnehmer zu finden, die Studie deshalb länger dauern wird und zudem der primary endpoint neu definiert wurde? Oder ist die Sache eigentlich gar nicht so bedeutsam, daß sie diese Kursabschläge rechtfertigen würde?
Antwort auf Beitrag Nr.: 48.231.469 von lawmeetstax am 05.11.14 16:20:11Doch, ich denke, dass der Kursrutsch daran liegt. Ob das begründet ist? Zumindest finde ich die Umstellung des Protokolls richtig negativ. Die lahmende Rekrutierung sowieso. Ich fand den doppelten primären Endpunkt dieser Studie immer attraktiv. Jetzt zeigt sich, dass man damit regulatorisch wohl nicht durchgekommen wäre.
Generell bekleckert sich CLDX bei der Durchführung klinischer Studien nicht gerade mit Ruhm. Die zeitlichen Verzögerungen sind haarsträubend, gerade weil man inzwischen große Beträge ausgibt.
Generell bekleckert sich CLDX bei der Durchführung klinischer Studien nicht gerade mit Ruhm. Die zeitlichen Verzögerungen sind haarsträubend, gerade weil man inzwischen große Beträge ausgibt.
Antwort auf Beitrag Nr.: 48.200.002 von ipollit am 02.11.14 23:15:12"Vielleicht könnte demnächst auch der IPO Fibrogen interessant sein."
Hallo ipollit,
das finde ich aber sehr spannend! Danke für den Hinweis! Zunächst war ich wegen der kompletten Auslizensierung von Roxadustat nicht so begeistert, aber inzwischen denke ich anders darüber. Die Konditionen sind gut, die (komplexe) PIII ist im Prinzip ausfinanziert und man hat ne Menge Vertriebspower im Boot. Alles gut.
Eine Marktkapitalisierung von einer Milliarde wäre sicher nicht übertrieben.
VGS
Hallo ipollit,
das finde ich aber sehr spannend! Danke für den Hinweis! Zunächst war ich wegen der kompletten Auslizensierung von Roxadustat nicht so begeistert, aber inzwischen denke ich anders darüber. Die Konditionen sind gut, die (komplexe) PIII ist im Prinzip ausfinanziert und man hat ne Menge Vertriebspower im Boot. Alles gut.
Eine Marktkapitalisierung von einer Milliarde wäre sicher nicht übertrieben.
VGS
Deutliche Aussage von Hammer zu Binimetinib:
Ruhulla – I still think there is a 90% likelihood that ARRY receives binimetinib back and this is a clear positive. I am concerned about lack of visibility and cash balance for the coming months. Long term, I really like ARRY and think it’s a good buy, will try to add more in the coming months.
Hammer lag schon oft gut mit seinen Einschätzungen, was so strategische Entwicklungen angeht (Übernahmen, Kooperationen). Das WIE ist in Bezug auf Bini wahrscheinlich die interessantere Frage als das OB.
Ruhulla – I still think there is a 90% likelihood that ARRY receives binimetinib back and this is a clear positive. I am concerned about lack of visibility and cash balance for the coming months. Long term, I really like ARRY and think it’s a good buy, will try to add more in the coming months.
Hammer lag schon oft gut mit seinen Einschätzungen, was so strategische Entwicklungen angeht (Übernahmen, Kooperationen). Das WIE ist in Bezug auf Bini wahrscheinlich die interessantere Frage als das OB.
Antwort auf Beitrag Nr.: 48.247.087 von SLGramann am 06.11.14 18:52:08Das WIE ist in Bezug auf Bini wahrscheinlich die interessantere Frage als das OB.
Scheinbar ganz gut, dass F. verschoben wurde und somit die potenzielle Rückgabe von B. in den Vordergrund rückt. Das Interesse von NOV an Mekinist haben wir wohl insgesamt unterschätzt. Ich habe neulich durch Zufall gelesen, dass NOV und GsK in dem Deal sogar einen Passus zu Mekinist eingearbeitet haben:
The oncology agreement between the companies is comprised of a $14.5 billion payment with $1.5 billion contingent on results from the phase III COMBI-d trial exploring the combination of dabrafenib and trametinib in comparison with dabrafenib and placebo for patients with metastatic melanoma.
http://www.onclive.com/web-exclusives/Novartis-Plans-Acquisi…
Die Höhe hat mich doch überrascht. Kann man daraus auch einen Wert von B. ableiten?
Scheinbar ganz gut, dass F. verschoben wurde und somit die potenzielle Rückgabe von B. in den Vordergrund rückt. Das Interesse von NOV an Mekinist haben wir wohl insgesamt unterschätzt. Ich habe neulich durch Zufall gelesen, dass NOV und GsK in dem Deal sogar einen Passus zu Mekinist eingearbeitet haben:
The oncology agreement between the companies is comprised of a $14.5 billion payment with $1.5 billion contingent on results from the phase III COMBI-d trial exploring the combination of dabrafenib and trametinib in comparison with dabrafenib and placebo for patients with metastatic melanoma.
http://www.onclive.com/web-exclusives/Novartis-Plans-Acquisi…
Die Höhe hat mich doch überrascht. Kann man daraus auch einen Wert von B. ableiten?
NVS hat anscheinend das enrollment für die NEMO Studie nicht mehr so ambitioniert vorangetrieben. NRAS Melanom und Binimetinib verschieben sich ca. 6 Monate. Meiner Meinung nach möglicherweise ein Hinweis, dass sie nicht mehr damit rechnen, dass Bini bei ihnen bleibt.
A
A
FMI, ARRY, EXEL, CLVS
MEK-Hemmer sind bisher aktiv in Metastatic Melanoma (schwarzer Hautkrebs), insbesondere mit BRAF-Hemmern. ARRYs Binimetinib wird in NRAS Melanoma getestet, Selumetinib z.B. in KRAS NSCLC (Lungenkrebs).
Das Folgende zeigt, in welche Richtung es mit Target-Therapien in Zukunft gehen könnte... dass man z.B. MEK-Hemmer nicht speziell beim schwarzen Hautkrebs oder Lungenkrebs anwendet, sondern jede Krebsart per Gen-Analyse auf bestimmte Mutationen oder andere Auffälligkeiten untersucht. MEK-Hemmer könnten so z.B. bei KRAS-, NRAS- oder BRAF-Mutationen wirksam sein.
Hier wurde mit Hilfe des FMI-Tests Multiple Myeloma analysiert... bei Patienten mit KRAS, NRAS oder BRAF-Mutationen scheint der MEK-Hemmer Trametinib (GSK, bzw. NVS) wirksam zu sein:
https://ash.confex.com/ash/2014/webprogram/Paper76173.html
Background: Diagnostic and therapeutic advances have significantly improved the outcomes for multiple myeloma (MM) patients. However, pts who are refractory to or relapse after therapy with immune modulatory drugs and proteasome inhibitors remain a therapeutic challenge. Comprehensive genomic profiling via clinical next generation sequencing (NGS)-based assays studies of MM cases have revealed multiple targetable mutations that were previously unexploited in MM.
Methods: Between June 2013 and May 2014 we performed genomic profiling of 351 patients who had progressed after initial therapy to assist physicians in therapy planning. Comprehensive genomic profiling was performed using the FoundationOne¨ or FoundationOne Heme¨ assays. FoundationOne assays 374 cancer-related and 24 frequently rearranged genes via DNA-seq, and FoundationOneHeme assays 405 cancer-related and 31 frequently rearranged genes via DNA-seq as well as 265 frequently rearranged genes by RNA-seq. All samples were sequenced in a CLIA-certified CAP-accredited laboratory to an average depth >500x .
Patients with activating alterations of KRAS, NRAS or BRAF were considered for therapy with the targeted agent trametinib (TMTB) as were patients who had a gene expression signature suggesting activation of the MAPK pathway. Retrospective review of this case series was approved by the UAMS institutional review board.
Results: We identified 63 patients who underwent treatment with Trametinib. 60 were treated based on activating mutations of KRAS, NRAS or BRAF and 3 were treated based on a GEP signature. The median age was 65 and patients had a median of 5 lines of prior therapy (range 1-20). 38 of 63 patients had prior treatment with Total Therapy. 43 underwent salvage with chemotherapy prior to initiation of TMTB, 15 had salvage transplants, 33 patients were exposed to novel agents (Pomalidomide, Carfilzomib) and 33 had Metronomic therapy before TMTB. 25% of patients were ISS stage 3 and 37% had GEP70 defined high risk. 13 had PET defined extra medullary disease (EMD).
41 patients were administered TMTB monotherapy and 22 received TMTB treatment in combination with other agents. In general the treatment was well tolerated. 10 patients discontinued therapy because of toxicities, 29 discontinued because of disease progression or death. None of the deaths were attributed to TMTB, Best treatment responses were SD in 30, PR in 8, VGPR in 2 and CR in 3 of the 63 pts. For 25 patients with evaluable PET data, treatment resulted in complete resolution of FDG avid lesions in 9 patients and a better than 50% reduction in 15 (Figure 1). We will present updated data on clinical responses as well as toxicities.
Conclusions: Treatment with targeted therapy guided by prospective comprehensive genomic profiling across all classes of genomic alterations in this heavily pretreated population of MM patients resulted in an unexpectedly high objective response rate. Observation of CR with TMTB monotherapy further supports continued investigation of this individualized approach to MM management.
********
FMI liefert ja auch den Test für CLVS's PARP-Hemmer Rucaparib. Eine typische Mutation, bei der PARP-Hemmer helfen, ist BRCA. Zusätzlich hat FMI/CLVS aber noch einen weiteren Marker entwickelt, bei dem auch ohne BRCA-Mutationen der Tumor auf PARP sensibel reagiert. Ein solcher Marker kann allerdings recht komplex sein und sich aus Kombinationen von verschiedenen Mutationen berechnen. Eine umfangreiche Genanalyse wie die von FMI sollte daher generell hilfreich sein. CLVS will hierzu demnächst Daten vorlegen, wie prospektiv selektierte Patienten auf Rucaparib ansprechen.
Solche Marker können dann auf prinzipiell alle Krebsarten ausgeweitet werden. PARP-Hemmer könnten z.B. auch bei Prostatakrebs wirken: "PARP inhibitors can suppress CRPC tumours in early trials in patients failing first line therapies #NCRI2014" oder "PARP inhibitors have shown efficacy in ovarian, breast, and prostate cancers in pts with inherited BRCA mutations". Überall wo PARP bei BRCA-Mutationen wirkt, dürfte CLVS auch weitere non-BRCA-Patienten finden, die aufgrund ihres erweiterten Markers auf PARP ansprechen. PARP ist auch kein spezieller Signalweg, sondern spielt dann eine Rolle, wenn DNA-Defekte bestehen/entstehen, was bei Krebs häufig der Fall ist.
Langfristig sollten somit umfangreiche genetische Tests wie der von FMI zum Einsatz kommen und danach individuelle Therapien zur Anwendung kommen. Es dürfte nicht nur der reine Test eine Rolle spielen, sondern auch die richtige Interpretationen, welche Therapie aufgrund der Testergebnisse wirksam sein sollte. Das dürfte FMI z.B von reinen Medizingeräte-Herstellern unterscheiden, die nur genetische Analysen durchführen.
Gruß
ipollit
MEK-Hemmer sind bisher aktiv in Metastatic Melanoma (schwarzer Hautkrebs), insbesondere mit BRAF-Hemmern. ARRYs Binimetinib wird in NRAS Melanoma getestet, Selumetinib z.B. in KRAS NSCLC (Lungenkrebs).
Das Folgende zeigt, in welche Richtung es mit Target-Therapien in Zukunft gehen könnte... dass man z.B. MEK-Hemmer nicht speziell beim schwarzen Hautkrebs oder Lungenkrebs anwendet, sondern jede Krebsart per Gen-Analyse auf bestimmte Mutationen oder andere Auffälligkeiten untersucht. MEK-Hemmer könnten so z.B. bei KRAS-, NRAS- oder BRAF-Mutationen wirksam sein.
Hier wurde mit Hilfe des FMI-Tests Multiple Myeloma analysiert... bei Patienten mit KRAS, NRAS oder BRAF-Mutationen scheint der MEK-Hemmer Trametinib (GSK, bzw. NVS) wirksam zu sein:
https://ash.confex.com/ash/2014/webprogram/Paper76173.html
Background: Diagnostic and therapeutic advances have significantly improved the outcomes for multiple myeloma (MM) patients. However, pts who are refractory to or relapse after therapy with immune modulatory drugs and proteasome inhibitors remain a therapeutic challenge. Comprehensive genomic profiling via clinical next generation sequencing (NGS)-based assays studies of MM cases have revealed multiple targetable mutations that were previously unexploited in MM.
Methods: Between June 2013 and May 2014 we performed genomic profiling of 351 patients who had progressed after initial therapy to assist physicians in therapy planning. Comprehensive genomic profiling was performed using the FoundationOne¨ or FoundationOne Heme¨ assays. FoundationOne assays 374 cancer-related and 24 frequently rearranged genes via DNA-seq, and FoundationOneHeme assays 405 cancer-related and 31 frequently rearranged genes via DNA-seq as well as 265 frequently rearranged genes by RNA-seq. All samples were sequenced in a CLIA-certified CAP-accredited laboratory to an average depth >500x .
Patients with activating alterations of KRAS, NRAS or BRAF were considered for therapy with the targeted agent trametinib (TMTB) as were patients who had a gene expression signature suggesting activation of the MAPK pathway. Retrospective review of this case series was approved by the UAMS institutional review board.
Results: We identified 63 patients who underwent treatment with Trametinib. 60 were treated based on activating mutations of KRAS, NRAS or BRAF and 3 were treated based on a GEP signature. The median age was 65 and patients had a median of 5 lines of prior therapy (range 1-20). 38 of 63 patients had prior treatment with Total Therapy. 43 underwent salvage with chemotherapy prior to initiation of TMTB, 15 had salvage transplants, 33 patients were exposed to novel agents (Pomalidomide, Carfilzomib) and 33 had Metronomic therapy before TMTB. 25% of patients were ISS stage 3 and 37% had GEP70 defined high risk. 13 had PET defined extra medullary disease (EMD).
41 patients were administered TMTB monotherapy and 22 received TMTB treatment in combination with other agents. In general the treatment was well tolerated. 10 patients discontinued therapy because of toxicities, 29 discontinued because of disease progression or death. None of the deaths were attributed to TMTB, Best treatment responses were SD in 30, PR in 8, VGPR in 2 and CR in 3 of the 63 pts. For 25 patients with evaluable PET data, treatment resulted in complete resolution of FDG avid lesions in 9 patients and a better than 50% reduction in 15 (Figure 1). We will present updated data on clinical responses as well as toxicities.
Conclusions: Treatment with targeted therapy guided by prospective comprehensive genomic profiling across all classes of genomic alterations in this heavily pretreated population of MM patients resulted in an unexpectedly high objective response rate. Observation of CR with TMTB monotherapy further supports continued investigation of this individualized approach to MM management.
********
FMI liefert ja auch den Test für CLVS's PARP-Hemmer Rucaparib. Eine typische Mutation, bei der PARP-Hemmer helfen, ist BRCA. Zusätzlich hat FMI/CLVS aber noch einen weiteren Marker entwickelt, bei dem auch ohne BRCA-Mutationen der Tumor auf PARP sensibel reagiert. Ein solcher Marker kann allerdings recht komplex sein und sich aus Kombinationen von verschiedenen Mutationen berechnen. Eine umfangreiche Genanalyse wie die von FMI sollte daher generell hilfreich sein. CLVS will hierzu demnächst Daten vorlegen, wie prospektiv selektierte Patienten auf Rucaparib ansprechen.
Solche Marker können dann auf prinzipiell alle Krebsarten ausgeweitet werden. PARP-Hemmer könnten z.B. auch bei Prostatakrebs wirken: "PARP inhibitors can suppress CRPC tumours in early trials in patients failing first line therapies #NCRI2014" oder "PARP inhibitors have shown efficacy in ovarian, breast, and prostate cancers in pts with inherited BRCA mutations". Überall wo PARP bei BRCA-Mutationen wirkt, dürfte CLVS auch weitere non-BRCA-Patienten finden, die aufgrund ihres erweiterten Markers auf PARP ansprechen. PARP ist auch kein spezieller Signalweg, sondern spielt dann eine Rolle, wenn DNA-Defekte bestehen/entstehen, was bei Krebs häufig der Fall ist.
Langfristig sollten somit umfangreiche genetische Tests wie der von FMI zum Einsatz kommen und danach individuelle Therapien zur Anwendung kommen. Es dürfte nicht nur der reine Test eine Rolle spielen, sondern auch die richtige Interpretationen, welche Therapie aufgrund der Testergebnisse wirksam sein sollte. Das dürfte FMI z.B von reinen Medizingeräte-Herstellern unterscheiden, die nur genetische Analysen durchführen.
Gruß
ipollit
EXEL
mal sehen, ob etwas positives aus der Cobimetinib + PD-1 Studie herauskommt... sehr spekulativ
https://twitter.com/AlpineBV_Miller/status/53039521875205324…
"Data show +ve benefit of MEKi on immunology of melanoma bodes well for using cobimetinib combo w/ checkpoints. $EXEL $RHHBY #SITC2014"
***
Cabozantinib: Daten zur METEOR PIII in RCC sollen in Q2 im nächsten Jahr kommen.
Gruß
ipollit
mal sehen, ob etwas positives aus der Cobimetinib + PD-1 Studie herauskommt... sehr spekulativ
https://twitter.com/AlpineBV_Miller/status/53039521875205324…
"Data show +ve benefit of MEKi on immunology of melanoma bodes well for using cobimetinib combo w/ checkpoints. $EXEL $RHHBY #SITC2014"
***
Cabozantinib: Daten zur METEOR PIII in RCC sollen in Q2 im nächsten Jahr kommen.
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.266.671 von ipollit am 09.11.14 13:55:11Hi ipollit,
starker Text zu FMI von Dir!
Und passend dazu Hammer mit einem neuen Beitrag dazu:
http://www.orf-blog.com/the-bull-case-for-foundation-medicin…
Gruß
SLG
starker Text zu FMI von Dir!
Und passend dazu Hammer mit einem neuen Beitrag dazu:
http://www.orf-blog.com/the-bull-case-for-foundation-medicin…
Gruß
SLG
Hallo,
ich bin gerade durch einen Link auf diesen Thread aufmerksam geworden
kann man vielleicht gelegentlich mal ein Biotechnologie/Medtechunternehmen ansprechen/in die Runde werfen, um dann hier ein Feedback zu bekommen was andere darüber denken?
sind vermutlich nicht die so populären
Grüße
Popeye
ich bin gerade durch einen Link auf diesen Thread aufmerksam geworden
kann man vielleicht gelegentlich mal ein Biotechnologie/Medtechunternehmen ansprechen/in die Runde werfen, um dann hier ein Feedback zu bekommen was andere darüber denken?
sind vermutlich nicht die so populären
Grüße
Popeye
SGEN, CLDX
SGEN scheint im nächsten Jahr auch einen reinen AK gegen CD40 in PI zu bringen (sonst hat SGEN ja eher ADCs):
"About SEA-CD40
SEA-CD40 utilizes our novel sugar-engineered antibody (SEA) technology to produce a non-fucosylated antibody targeting CD40. It builds on our extensive experience targeting CD40 and is the first of two non-ADC programs developed using technology discovered by our scientists. Preclinical data show that SEA-CD40 may stimulate a patient's own immune system to fight their cancer.
Status
We anticipate initiating a phase 1 trial of SEA-CD40 in multiple solid tumors in 2015."
CD40 ist auch ein IO-Target, das wie CD27, OX40, GITR, usw das Immunsystem stimmulieren soll. SGEN hatte mal einen CD40-AK in der klinischen Entwicklung und diese dann beendet... damals war IO aber noch nicht so ein Thema.
CD40 scheint bei der aktuellen SITC-Konferenz einige gute Ergebnisse geliefert zu haben:
"Great #SITC2014 talk on CD40 $RHHBY has a former $PFE drug in pancreatic Jan 2015. $SGEN has their new SEA-CD40 in humans Q1-15. Exciting."
***
https://twitter.com/ChrisHeery/status/531209243945607168
"Vonderheide: cd40a plus gem close to OS seen with gem abraxane. #SITC2014"
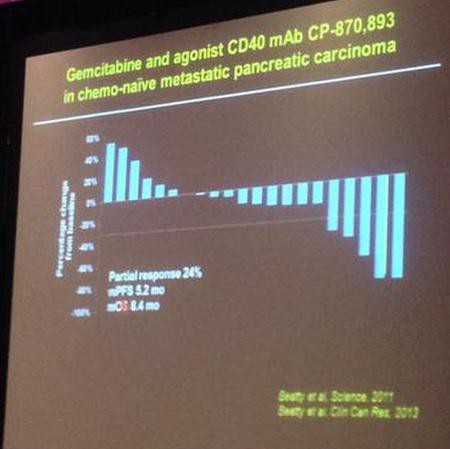
"Vonderheide: discussing CD40 agonists plus chemo. Abraxane plus cd40 agonist acts as vaccine in vivo. #SITC2014"
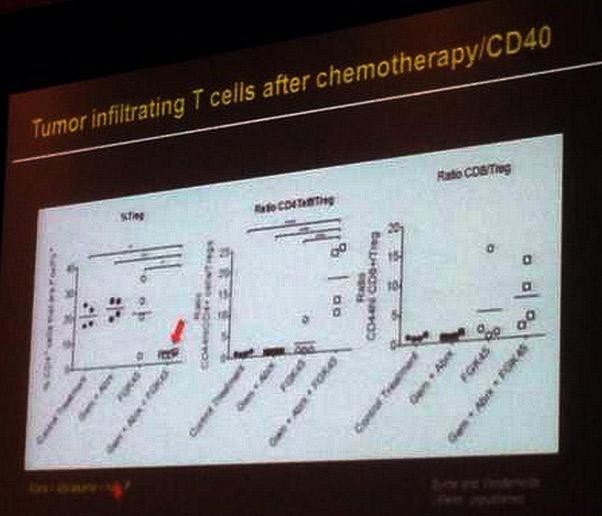
In diesem Zusammenhang ist mir ein Patent-Antrag von SGEN bezügl. CD27 aufgefallen...
http://www.4-traders.com/SEATTLE-GENETICS-INC-10808/news/Sea…
"Seattle Genetics, Inc. : "Human Immune Therapies Using a Cd27 Agonist Alone Or in Combination with Other Immune Modulators" in Patent Application Approval Process
...
It is now widely recognized that the generation of protective immunity depends not only on exposure to antigen, but also the context in which the antigen is encountered. Numerous examples exist in which introduction of a novel antigen into a host in a non-inflammatory context generates immunological tolerance rather than long-term immunity whereas exposure to antigen in the presence of an inflammatory agent (adjuvant) induces immunity. Since it can mean the difference between tolerance and immunity, much effort has gone into discovering the 'adjuvants' present within infectious agents that stimulate the molecular pathways involved in creating the appropriate immunogenic context of antigen presentation.
CD27 is a member of the tumor necrosis factor receptor (TNFR) super family which also includes TNFR type I and II (CD120a and b), nerve growth factor receptor (NGFR), CD30, Fas/Apo-1 (CD95), CD40, 4-1BB and OX40. These proteins are known to play key roles in cell growth, survival, and differentiation as well as apoptosis or programmed cell death. Homology among these family members is restricted to the extracellular region and is characterized by the presence of a cysteine knot motif which occurs three times in CD27.
...
CD27 and its ligand CD70 are expressed on discrete populations of T and B cells. CD27 is expressed on resting T cells and CD70 on activated T and B cells and dendritic cells. Within T cell subsets, CD27 is stably expressed on CD45RA+ cells even after activation, whereas on CD45RO+ cells it is weakly expressed and lost after activation. On CD45RA+ cells, activation by various means results in the upregulation of CD27 expression. CD27 is highly expressed on most of the B cell non-Hodgkin's lymphomas and B cell chronic lymphocytic leukemias. The B cell lines Ramos and Raji, also express significant levels of CD27 and CD70.
Ligation of CD27 along with treatment of T cells with sub-optimal dose of PMA, PHA, anti-CD2 or anti-CD3 antibodies is also known to result in the proliferation of T cells, thus defining a co-stimulatory role for CD27. It has also been reported that CD27-mediated co-stimulatory effects can be specifically inhibited using an anti-CD27 antibody or recombinant soluble CD27 or anti-CD70 antibody and that ligation of CD27 via its ligand, CD70 can generate cytolytic T cells.
Another co-stimulatory molecule which is known to regulate adaptive immunity is CD40. CD40 is a member of the TNF receptor superfamily and is essential for a spectrum of cell-mediated immune responses and required for the development of T cell dependent humoral immunity. In its natural role, CD40-ligand expressed on CD4+ T cells interacts with CD40 expressed on DCs or B cells, promoting increased activation of the APC and, concomitantly, further activation of the T cell. For DCs, CD40 ligation classically leads to a response similar to stimulation through TLRs such as activation marker upregulation and inflammatory cytokine production. Its importance in CD8 responses was demonstrated by studies showing that stimulation of APCs through CD40 rescued CD4-dependent CD8+ T cell responses in the absence of CD4 cells. This finding sparked much speculation that CD40 agonists alone could potentially rescue failing CD8+ T cell responses in some disease settings.
Other studies, however, have demonstrated that CD40 stimulation alone insufficiently promotes long-term immunity. In some model systems, anti-CD40 treatment alone insufficiently promoted long-term immunity, i.e., yields ineffective inflammatory cytokine production. as well as the deletion of antigen-specific T cells and termination of B cell responses. Also, soluble trimerized CD40 ligand has been used in the clinic as an agonist for the CD40 pathway and what little has been reported is consistent with the conclusion that stimulation of CD40 alone fails to reconstitute all necessary signals for long term CD8+ T cell immunity.
Both agonistic and antagonistic antibodies specific to CD40 have been suggested to have potential as human therapeutics. Antagonistic anti-CD40 antibodies include those that (1) block CD40/CD40L interaction by at least 90% and have purported antineoplastic properties; (2) those that antagonize signaling through CD40 and (3) those that deliver a stimulatory signal through CD40 but do not increase the interaction between CD40 and CD40L, e.g., G28-5.
Agonistic anti-CD40 antibodies have been reported by several groups. For example, one mAb, CD40.4 (5C3) (PharMingen, San Diego, Calif.) has been reported to increase the interaction between CD40 and CD40L by approximately 30-40%. Additionally, Seattle Genetics in U.S. Pat. No. 6,843,989 allege to provide methods of treating cancer in humans using anti-human CD40 antibodies. These antibodies are alleged to deliver a stimulatory signal, to enhance the interaction between CD40 and CD40L by at least 45% and to enhance CD40L-mediated stimulation and to possess in vivo neoplastic activity. The exemplified antibody disclosed in the Seattle Genetics patent was derived from S2C6, an agonistic anti-human CD40 antibody previously shown to deliver strong growth-promoting signals to B lymphocytes.
However, notwithstanding these prior reports, improved methods and human therapies using adjuvants that promote Th1 immunity and which enhance the activation and expansion of antigen specific CD8+ T cells, i.e. CD8+ effector and memory cells are needed. Particularly, improved methods of treating human cancer and other diseases using therapeutic adjuvants which are safe and effective, i.e., which do not elicit undesired side effects but which elicit substantial therapeutic effects, e.g., anti-tumor effects are needed. The present invention satisfies this need and provides other advantages as well.
This invention provides novel methods of human treatment using a CD27 agonist such as an agonistic CD27 antibody alone or in conjunction with another therapeutic agent, e.g. another immunostimulant or immunomodulatory agent such as an agonistic CD40 antibody, soluble CD40L, a 4-1BB:4-1BBL agonist, an OX40 agonist, TLR agonist, a moiety that depletes regulatory T cells, or a cytokine such as an interleukin or an interferon. As noted above in preferred embodiments the binding of these CD27 agonistic antibodies to immune cells will not be blocked by CD70 as this may have a beneficial effect on the agonistic activity of these antibodies on T cells. These combinations would normally be employed together with a vaccine in the form or protein, peptides, immunogenic cells, or DNA. The results show that blocking the co-stimulation of CD27 has a profound effect on anti-tumor immunity elicited by an agonistic anti-CD40 antibody much more than blocking 4-1BB co-stimulation, and that this is apparently the result of a severe impairment in CD8+ T cell expansion during CD27-CD70 blockade. These results suggest that CD27 agonists, e.g., agonist anti-CD27 antibodies may be used as therapeutic adjuvants for promoting CD8+ T cell expansion and in treating conditions wherein this is therapeutically desirable such as cancer, infectious disorders, autoimmunity, allergic disorders, and inflammatory disorders. Also, it suggested that a CD27 agonist, e.g., a CD27 agonistic antibody may be administered in association with an antigen or vaccine in order to promote antigen-specific CD8+ T cell immunity. In an especially preferred embodiment the CD27 agonist will be used to treat a cancer such as a lymphoma or other cancers identified.
While the mechanism by which anti-CD40 monoclonal antibodies generate immune responses against tumors in humans and rodents is not fully understood, it appears to operate through the stimulation of dendritic cells to a level that boosts CTL responses and circumvents the need for CD4 helper cells. It is shown herein that agonistic CD40 monoclonal antibody promotes strong expression of 4-1BB on the expanding CD8 cells, together with a modest loss of CD27 as effector CTL are generated. Interestingly, while CD40 mAb treatment caused a profound activation of dendritic cells in tumor-bearing mice, the expression of 4-1BBL and CD70, the respective ligands for 4-1BB and CD27, was relatively weak and transient. Despite this lack of expression their involvement was established by showing that mAb (AT113-2:anti-4-1BBL, and TAN1-6:anti-CD70), which blocked the interaction CD70 block in the therapeutic efficacy of CD40 mAb treatment. Likewise they had no influence on the cytotoxic activity of tumor-specific CTL cells either in vitro or in vivo. Based thereon, the present inventors concluded that 4-1BB:4-1BBL and particularly CD27:CD70 interactions are pivotal in explaining the activity of CD40 agonistic antibodies and that these antibodies act by triggering CD8 T cell proliferation and survival. Moreover, the inventors show for the first time herein that an agonistic anti-CD27 antibody is highly effective by itself in protecting lymphoma-bearing mice (A31 and BCL1) indicating that CTL can be generated at a later stage than DC and that agonistic CD27 antibodies may be used to treat cancer and other diseases wherein enhanced cellular immunity is necessary. Importantly, this anti-CD27 mAb did not protect immunocompromised SCID mice from these same tumors, underlining the need for a functional immune system (CD8 T cells) to provide this protection.
Therefore, this invention provides novel mono and combination therapies for promoting T cell immunity in a subject in need thereof, e.g., a subject with lymphoma comprising the administration of at least one CD27 agonist and optionally another moiety such as a CD40 agonist. As noted above, if a CD40 agonist is utilized in association with the subject CD27 agonistic antibody, the CD40 agonist will preferably comprise an anti-human CD40 antibody e.g., a chimeric antibody referred to herein as LOB 7/4 or a derivative thereof, e.g., humanized antibodies or fragments thereof containing the variable heavy and light sequences or CDRs derived from the LOB 7/4 antibody. The present inventors have found that this chimeric antibody possesses advantageous properties when used as a therapeutic, e.g. for treatment of cancer, especially CD40 expressing lymphomas and solid tumors."
***
Ich verstehe nicht, warum Ohad Hammer z.B. CLDX CD27-AK als schwach bezeichnet, weil er als Mono-Therapie keine hohe RR bei soliden Tumoren erzielt hat. Es ist nicht so, dass man die Wirkstoffe erst einzeln prüfen muss und dann das beste Ergebnis erhält, wenn man die wirksamsten Mono-Therapien kombiniert. Das ist eine völlig falsche Sichtweise! Ein IDO-Hemmer hat auch kaum eine Mono-Wirkung... in Kombi mit Checkpoint-Hemmern scheint er aber die Wirkung dieser deutlich zu erhöhen. Es geht um die Verhältnisse von verschiedenen Immunzellen und die Verstärkung von Immunantworten. Das Immunsystem muss aber erstmal auf den Krebs ansprechen, damit es sich Verstärkungen auswirken kann. Kombinationen verhalten sich ganz anders als Mono-Therapien.
http://ir.celldex.com/releasedetail.cfm?ReleaseID=881507
Celldex Presents Varlilumab Proof of Concept Data at SITC Annual Meeting 2014
...
Biomarker analysis demonstrated significant immunological effects consistent with CD27 costimulation across all dose levels. A serum biomarker profile of the 1mg/kg cohort (selected because it had the largest patient population; n=9) demonstrated robust and transient stimulation of multiple cytokines and chemokines consistent with varlilumab activation of CD27 signaling. Further assessment of immune cell subsets demonstrated no depletion of B cells or CD8+ T cells, with a concomitant decrease in CD4+ T cells and regulatory T cells (Treg, CD4+ and FoxP3+). Evidence for functional activation of T cells was demonstrated by upregulation of the activation marker, HLA-DR and new or enhanced melanoma antigen-specific T cell responses in select melanoma patients.
...
Two patients experienced objective responses.
- A patient with Hodgkin lymphoma experienced a complete response after 3 cycles at 0.3 mg/kg, which continues at 18.9+ months. This patient's response was delayed and there was no detectable CD27 on their tumor cells leading the Company to conclude the response was immune-mediated response and not ADCC-mediated.
- A patient with renal cell carcinoma treated in the expansion cohort experienced a partial response after 1 cycle at 3 mg/kg that further improved on the second cycle and continues at 5.5+ months. This patient had five target lesions that have all regressed, including a lung lesion that has completely disappeared.
Thirteen patients experienced stable disease (SD) (3-25.5+ months), including:
- A patient with uveal melanoma (M1c) with SD for 11.5 months
- A patient with renal cell carcinoma with SD for 25.5+ months; and
- A patient with follicular lymphoma with SD for 14 months.
...
ONTY hat eine MUC-Vakzine + CD27 AK Kombi-Studie gestartet:
$CLDX $ONTY Varilumab (CD27) + ONT-10 (MUC1) combo study in ovarian and breast: http://clinicaltrials.gov/ct2/show/NCT02270372?term=ont-10&r…
Gruß
ipollit
SGEN scheint im nächsten Jahr auch einen reinen AK gegen CD40 in PI zu bringen (sonst hat SGEN ja eher ADCs):
"About SEA-CD40
SEA-CD40 utilizes our novel sugar-engineered antibody (SEA) technology to produce a non-fucosylated antibody targeting CD40. It builds on our extensive experience targeting CD40 and is the first of two non-ADC programs developed using technology discovered by our scientists. Preclinical data show that SEA-CD40 may stimulate a patient's own immune system to fight their cancer.
Status
We anticipate initiating a phase 1 trial of SEA-CD40 in multiple solid tumors in 2015."
CD40 ist auch ein IO-Target, das wie CD27, OX40, GITR, usw das Immunsystem stimmulieren soll. SGEN hatte mal einen CD40-AK in der klinischen Entwicklung und diese dann beendet... damals war IO aber noch nicht so ein Thema.
CD40 scheint bei der aktuellen SITC-Konferenz einige gute Ergebnisse geliefert zu haben:
"Great #SITC2014 talk on CD40 $RHHBY has a former $PFE drug in pancreatic Jan 2015. $SGEN has their new SEA-CD40 in humans Q1-15. Exciting."
***
https://twitter.com/ChrisHeery/status/531209243945607168
"Vonderheide: cd40a plus gem close to OS seen with gem abraxane. #SITC2014"

"Vonderheide: discussing CD40 agonists plus chemo. Abraxane plus cd40 agonist acts as vaccine in vivo. #SITC2014"

In diesem Zusammenhang ist mir ein Patent-Antrag von SGEN bezügl. CD27 aufgefallen...
http://www.4-traders.com/SEATTLE-GENETICS-INC-10808/news/Sea…
"Seattle Genetics, Inc. : "Human Immune Therapies Using a Cd27 Agonist Alone Or in Combination with Other Immune Modulators" in Patent Application Approval Process
...
It is now widely recognized that the generation of protective immunity depends not only on exposure to antigen, but also the context in which the antigen is encountered. Numerous examples exist in which introduction of a novel antigen into a host in a non-inflammatory context generates immunological tolerance rather than long-term immunity whereas exposure to antigen in the presence of an inflammatory agent (adjuvant) induces immunity. Since it can mean the difference between tolerance and immunity, much effort has gone into discovering the 'adjuvants' present within infectious agents that stimulate the molecular pathways involved in creating the appropriate immunogenic context of antigen presentation.
CD27 is a member of the tumor necrosis factor receptor (TNFR) super family which also includes TNFR type I and II (CD120a and b), nerve growth factor receptor (NGFR), CD30, Fas/Apo-1 (CD95), CD40, 4-1BB and OX40. These proteins are known to play key roles in cell growth, survival, and differentiation as well as apoptosis or programmed cell death. Homology among these family members is restricted to the extracellular region and is characterized by the presence of a cysteine knot motif which occurs three times in CD27.
...
CD27 and its ligand CD70 are expressed on discrete populations of T and B cells. CD27 is expressed on resting T cells and CD70 on activated T and B cells and dendritic cells. Within T cell subsets, CD27 is stably expressed on CD45RA+ cells even after activation, whereas on CD45RO+ cells it is weakly expressed and lost after activation. On CD45RA+ cells, activation by various means results in the upregulation of CD27 expression. CD27 is highly expressed on most of the B cell non-Hodgkin's lymphomas and B cell chronic lymphocytic leukemias. The B cell lines Ramos and Raji, also express significant levels of CD27 and CD70.
Ligation of CD27 along with treatment of T cells with sub-optimal dose of PMA, PHA, anti-CD2 or anti-CD3 antibodies is also known to result in the proliferation of T cells, thus defining a co-stimulatory role for CD27. It has also been reported that CD27-mediated co-stimulatory effects can be specifically inhibited using an anti-CD27 antibody or recombinant soluble CD27 or anti-CD70 antibody and that ligation of CD27 via its ligand, CD70 can generate cytolytic T cells.
Another co-stimulatory molecule which is known to regulate adaptive immunity is CD40. CD40 is a member of the TNF receptor superfamily and is essential for a spectrum of cell-mediated immune responses and required for the development of T cell dependent humoral immunity. In its natural role, CD40-ligand expressed on CD4+ T cells interacts with CD40 expressed on DCs or B cells, promoting increased activation of the APC and, concomitantly, further activation of the T cell. For DCs, CD40 ligation classically leads to a response similar to stimulation through TLRs such as activation marker upregulation and inflammatory cytokine production. Its importance in CD8 responses was demonstrated by studies showing that stimulation of APCs through CD40 rescued CD4-dependent CD8+ T cell responses in the absence of CD4 cells. This finding sparked much speculation that CD40 agonists alone could potentially rescue failing CD8+ T cell responses in some disease settings.
Other studies, however, have demonstrated that CD40 stimulation alone insufficiently promotes long-term immunity. In some model systems, anti-CD40 treatment alone insufficiently promoted long-term immunity, i.e., yields ineffective inflammatory cytokine production. as well as the deletion of antigen-specific T cells and termination of B cell responses. Also, soluble trimerized CD40 ligand has been used in the clinic as an agonist for the CD40 pathway and what little has been reported is consistent with the conclusion that stimulation of CD40 alone fails to reconstitute all necessary signals for long term CD8+ T cell immunity.
Both agonistic and antagonistic antibodies specific to CD40 have been suggested to have potential as human therapeutics. Antagonistic anti-CD40 antibodies include those that (1) block CD40/CD40L interaction by at least 90% and have purported antineoplastic properties; (2) those that antagonize signaling through CD40 and (3) those that deliver a stimulatory signal through CD40 but do not increase the interaction between CD40 and CD40L, e.g., G28-5.
Agonistic anti-CD40 antibodies have been reported by several groups. For example, one mAb, CD40.4 (5C3) (PharMingen, San Diego, Calif.) has been reported to increase the interaction between CD40 and CD40L by approximately 30-40%. Additionally, Seattle Genetics in U.S. Pat. No. 6,843,989 allege to provide methods of treating cancer in humans using anti-human CD40 antibodies. These antibodies are alleged to deliver a stimulatory signal, to enhance the interaction between CD40 and CD40L by at least 45% and to enhance CD40L-mediated stimulation and to possess in vivo neoplastic activity. The exemplified antibody disclosed in the Seattle Genetics patent was derived from S2C6, an agonistic anti-human CD40 antibody previously shown to deliver strong growth-promoting signals to B lymphocytes.
However, notwithstanding these prior reports, improved methods and human therapies using adjuvants that promote Th1 immunity and which enhance the activation and expansion of antigen specific CD8+ T cells, i.e. CD8+ effector and memory cells are needed. Particularly, improved methods of treating human cancer and other diseases using therapeutic adjuvants which are safe and effective, i.e., which do not elicit undesired side effects but which elicit substantial therapeutic effects, e.g., anti-tumor effects are needed. The present invention satisfies this need and provides other advantages as well.
This invention provides novel methods of human treatment using a CD27 agonist such as an agonistic CD27 antibody alone or in conjunction with another therapeutic agent, e.g. another immunostimulant or immunomodulatory agent such as an agonistic CD40 antibody, soluble CD40L, a 4-1BB:4-1BBL agonist, an OX40 agonist, TLR agonist, a moiety that depletes regulatory T cells, or a cytokine such as an interleukin or an interferon. As noted above in preferred embodiments the binding of these CD27 agonistic antibodies to immune cells will not be blocked by CD70 as this may have a beneficial effect on the agonistic activity of these antibodies on T cells. These combinations would normally be employed together with a vaccine in the form or protein, peptides, immunogenic cells, or DNA. The results show that blocking the co-stimulation of CD27 has a profound effect on anti-tumor immunity elicited by an agonistic anti-CD40 antibody much more than blocking 4-1BB co-stimulation, and that this is apparently the result of a severe impairment in CD8+ T cell expansion during CD27-CD70 blockade. These results suggest that CD27 agonists, e.g., agonist anti-CD27 antibodies may be used as therapeutic adjuvants for promoting CD8+ T cell expansion and in treating conditions wherein this is therapeutically desirable such as cancer, infectious disorders, autoimmunity, allergic disorders, and inflammatory disorders. Also, it suggested that a CD27 agonist, e.g., a CD27 agonistic antibody may be administered in association with an antigen or vaccine in order to promote antigen-specific CD8+ T cell immunity. In an especially preferred embodiment the CD27 agonist will be used to treat a cancer such as a lymphoma or other cancers identified.
While the mechanism by which anti-CD40 monoclonal antibodies generate immune responses against tumors in humans and rodents is not fully understood, it appears to operate through the stimulation of dendritic cells to a level that boosts CTL responses and circumvents the need for CD4 helper cells. It is shown herein that agonistic CD40 monoclonal antibody promotes strong expression of 4-1BB on the expanding CD8 cells, together with a modest loss of CD27 as effector CTL are generated. Interestingly, while CD40 mAb treatment caused a profound activation of dendritic cells in tumor-bearing mice, the expression of 4-1BBL and CD70, the respective ligands for 4-1BB and CD27, was relatively weak and transient. Despite this lack of expression their involvement was established by showing that mAb (AT113-2:anti-4-1BBL, and TAN1-6:anti-CD70), which blocked the interaction CD70 block in the therapeutic efficacy of CD40 mAb treatment. Likewise they had no influence on the cytotoxic activity of tumor-specific CTL cells either in vitro or in vivo. Based thereon, the present inventors concluded that 4-1BB:4-1BBL and particularly CD27:CD70 interactions are pivotal in explaining the activity of CD40 agonistic antibodies and that these antibodies act by triggering CD8 T cell proliferation and survival. Moreover, the inventors show for the first time herein that an agonistic anti-CD27 antibody is highly effective by itself in protecting lymphoma-bearing mice (A31 and BCL1) indicating that CTL can be generated at a later stage than DC and that agonistic CD27 antibodies may be used to treat cancer and other diseases wherein enhanced cellular immunity is necessary. Importantly, this anti-CD27 mAb did not protect immunocompromised SCID mice from these same tumors, underlining the need for a functional immune system (CD8 T cells) to provide this protection.
Therefore, this invention provides novel mono and combination therapies for promoting T cell immunity in a subject in need thereof, e.g., a subject with lymphoma comprising the administration of at least one CD27 agonist and optionally another moiety such as a CD40 agonist. As noted above, if a CD40 agonist is utilized in association with the subject CD27 agonistic antibody, the CD40 agonist will preferably comprise an anti-human CD40 antibody e.g., a chimeric antibody referred to herein as LOB 7/4 or a derivative thereof, e.g., humanized antibodies or fragments thereof containing the variable heavy and light sequences or CDRs derived from the LOB 7/4 antibody. The present inventors have found that this chimeric antibody possesses advantageous properties when used as a therapeutic, e.g. for treatment of cancer, especially CD40 expressing lymphomas and solid tumors."
***
Ich verstehe nicht, warum Ohad Hammer z.B. CLDX CD27-AK als schwach bezeichnet, weil er als Mono-Therapie keine hohe RR bei soliden Tumoren erzielt hat. Es ist nicht so, dass man die Wirkstoffe erst einzeln prüfen muss und dann das beste Ergebnis erhält, wenn man die wirksamsten Mono-Therapien kombiniert. Das ist eine völlig falsche Sichtweise! Ein IDO-Hemmer hat auch kaum eine Mono-Wirkung... in Kombi mit Checkpoint-Hemmern scheint er aber die Wirkung dieser deutlich zu erhöhen. Es geht um die Verhältnisse von verschiedenen Immunzellen und die Verstärkung von Immunantworten. Das Immunsystem muss aber erstmal auf den Krebs ansprechen, damit es sich Verstärkungen auswirken kann. Kombinationen verhalten sich ganz anders als Mono-Therapien.
http://ir.celldex.com/releasedetail.cfm?ReleaseID=881507
Celldex Presents Varlilumab Proof of Concept Data at SITC Annual Meeting 2014
...
Biomarker analysis demonstrated significant immunological effects consistent with CD27 costimulation across all dose levels. A serum biomarker profile of the 1mg/kg cohort (selected because it had the largest patient population; n=9) demonstrated robust and transient stimulation of multiple cytokines and chemokines consistent with varlilumab activation of CD27 signaling. Further assessment of immune cell subsets demonstrated no depletion of B cells or CD8+ T cells, with a concomitant decrease in CD4+ T cells and regulatory T cells (Treg, CD4+ and FoxP3+). Evidence for functional activation of T cells was demonstrated by upregulation of the activation marker, HLA-DR and new or enhanced melanoma antigen-specific T cell responses in select melanoma patients.
...
Two patients experienced objective responses.
- A patient with Hodgkin lymphoma experienced a complete response after 3 cycles at 0.3 mg/kg, which continues at 18.9+ months. This patient's response was delayed and there was no detectable CD27 on their tumor cells leading the Company to conclude the response was immune-mediated response and not ADCC-mediated.
- A patient with renal cell carcinoma treated in the expansion cohort experienced a partial response after 1 cycle at 3 mg/kg that further improved on the second cycle and continues at 5.5+ months. This patient had five target lesions that have all regressed, including a lung lesion that has completely disappeared.
Thirteen patients experienced stable disease (SD) (3-25.5+ months), including:
- A patient with uveal melanoma (M1c) with SD for 11.5 months
- A patient with renal cell carcinoma with SD for 25.5+ months; and
- A patient with follicular lymphoma with SD for 14 months.
...
ONTY hat eine MUC-Vakzine + CD27 AK Kombi-Studie gestartet:
$CLDX $ONTY Varilumab (CD27) + ONT-10 (MUC1) combo study in ovarian and breast: http://clinicaltrials.gov/ct2/show/NCT02270372?term=ont-10&r…
Gruß
ipollit
AGEN, INCY, TSRO
AGEN arbeitet mit dem Ludwig Institut zusammen, die Experten im IO-Feld sind. Für mich klang es so, als ob AGEN zuerst den CTLA-4 AK in die Klinik bringen will. Deneben ist es wohl GITR, während die anderen Targets etwas mehr Zeit benötigen. Zuletzt habe ich AGEN wieder verkauft, weil die Zeiträume bis zum IND doch recht lang sind und TIM3, LAG3 vielleicht interessanter wären.
Sollte GITR aber auch ein gutes Target sein, wäre AGEN etwas...
http://www.onclive.com/publications/oncology-live/2014/july-…
"In March, Ludwig Cancer Research and Agenus Inc, a Massachusetts- based company, said they would advance a novel CTLA-4 antagonist (inhibitor) and two GITR agonists (activators) into preclinical development. In addition, the partners are working on other checkpoint modulators, including OX40 agonists and antagonists of LAG-3, TIM-3, and PD-1 ...
Among the scientists working with the network today is Jedd D. Wolchok, MD, PhD, director of the Ludwig Collaborative Laboratory and associate director of the Ludwig Center at Memorial Sloan Kettering Cancer Center in New York City (Ludwig MSK). Wolchok played a major role in the clinical studies that led to the FDA’s approval of ipilimumab. His current projects include exploring GITR and OX40, which are activating receptors in the immune system. ...
What generates particular excitement is the prospect of harnessing the body’s own defense systems to control cancers, since those mechanisms are highly adaptive and have the potential—with some help—to address the extraordinary adaptability of most malignancies. This means that the responses generated by the right immunotherapy, or the right combination of such therapies, could induce durable control and perhaps, in some cases, even a cure of some cancers. ...
How is Ludwig Cancer Research developing checkpoint modulator antibodies?
We originally established a partnership to develop therapeutic antibodies with 4-Antibody, a biotech that was acquired by Agenus. The aim of the collaboration is to utilize their technology to generate antibodies against a panel of targets that our investigators are interested in working on. ...
...
Which targets in the Agenus partnership are most advanced in terms of clinical development?
The candidates so far selected for development are two antibodies that bind and activate GITR, a molecule that stimulates T cell responses, and one that inhibits CTLA-4. Candidates against OX40, LAG-3, PD-1, and TIM-3 are currently in the process of being screened and selected.
OX40 stimulates anticancer immune responses, so we’re working with Agenus to develop agonistic antibodies against that molecule and inhibitory antibodies against LAG-3, PD-1 and TIM-3, which inhibit anticancer responses. There is much that depends on Agenus, but we would hope they will be in a position to file an investigational new drug (IND) application on the two main candidates toward the end of 2015. Following IND approval, Ludwig would begin clinical trials.
...
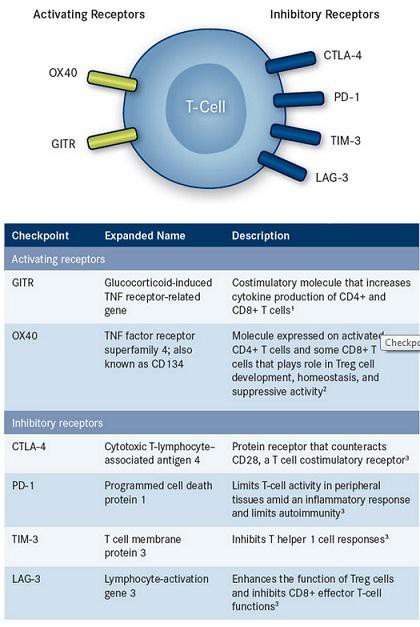
Has the universe of checkpoint modulators been defined?
Certainly not. First, there are other kinds of targets we have not discussed that are already generating interesting immune-modulating strategies. For example, ITEOS Therapeutics, a biotechnology company in Belgium that was spun off by Ludwig, is developing small-molecule drugs that inhibit two intracellular enzymes—IDO1 and TDO— that are constitutively expressed in most types of cancer.
When expressed at high levels, these enzymes boost the degradation of the amino acid tryptophan, which is essential to the effective immune surveillance of tumors. So these molecules might prove to be of great use in combination with other immunotherapies.
...
***
Letztes spricht dafür, dass INCY für IO-Kombinationen gut positioniert ist... bezüglich IDO sind sie führend.
Außerhalb der Pharmas könnte TSRO bei TIM3 mit am weitesten sein.
***
Ein Twitter-Kommentar von der SITC, der OX40-Kombis für besser hält:
"Moran: OX40 doesn't work alone in mice- only in combination with anti-PD-1 #SITC2014"
Ohad Hammer hat OX40 einmal als interessant bezeichnet. Aber insgesamt sollte man eher Kombinationen von IOs betrachten, um den besten Effekt zu erzielen.

Gruß
ipollit
AGEN arbeitet mit dem Ludwig Institut zusammen, die Experten im IO-Feld sind. Für mich klang es so, als ob AGEN zuerst den CTLA-4 AK in die Klinik bringen will. Deneben ist es wohl GITR, während die anderen Targets etwas mehr Zeit benötigen. Zuletzt habe ich AGEN wieder verkauft, weil die Zeiträume bis zum IND doch recht lang sind und TIM3, LAG3 vielleicht interessanter wären.
Sollte GITR aber auch ein gutes Target sein, wäre AGEN etwas...
http://www.onclive.com/publications/oncology-live/2014/july-…
"In March, Ludwig Cancer Research and Agenus Inc, a Massachusetts- based company, said they would advance a novel CTLA-4 antagonist (inhibitor) and two GITR agonists (activators) into preclinical development. In addition, the partners are working on other checkpoint modulators, including OX40 agonists and antagonists of LAG-3, TIM-3, and PD-1 ...
Among the scientists working with the network today is Jedd D. Wolchok, MD, PhD, director of the Ludwig Collaborative Laboratory and associate director of the Ludwig Center at Memorial Sloan Kettering Cancer Center in New York City (Ludwig MSK). Wolchok played a major role in the clinical studies that led to the FDA’s approval of ipilimumab. His current projects include exploring GITR and OX40, which are activating receptors in the immune system. ...
What generates particular excitement is the prospect of harnessing the body’s own defense systems to control cancers, since those mechanisms are highly adaptive and have the potential—with some help—to address the extraordinary adaptability of most malignancies. This means that the responses generated by the right immunotherapy, or the right combination of such therapies, could induce durable control and perhaps, in some cases, even a cure of some cancers. ...
How is Ludwig Cancer Research developing checkpoint modulator antibodies?
We originally established a partnership to develop therapeutic antibodies with 4-Antibody, a biotech that was acquired by Agenus. The aim of the collaboration is to utilize their technology to generate antibodies against a panel of targets that our investigators are interested in working on. ...
...
Which targets in the Agenus partnership are most advanced in terms of clinical development?
The candidates so far selected for development are two antibodies that bind and activate GITR, a molecule that stimulates T cell responses, and one that inhibits CTLA-4. Candidates against OX40, LAG-3, PD-1, and TIM-3 are currently in the process of being screened and selected.
OX40 stimulates anticancer immune responses, so we’re working with Agenus to develop agonistic antibodies against that molecule and inhibitory antibodies against LAG-3, PD-1 and TIM-3, which inhibit anticancer responses. There is much that depends on Agenus, but we would hope they will be in a position to file an investigational new drug (IND) application on the two main candidates toward the end of 2015. Following IND approval, Ludwig would begin clinical trials.
...

Has the universe of checkpoint modulators been defined?
Certainly not. First, there are other kinds of targets we have not discussed that are already generating interesting immune-modulating strategies. For example, ITEOS Therapeutics, a biotechnology company in Belgium that was spun off by Ludwig, is developing small-molecule drugs that inhibit two intracellular enzymes—IDO1 and TDO— that are constitutively expressed in most types of cancer.
When expressed at high levels, these enzymes boost the degradation of the amino acid tryptophan, which is essential to the effective immune surveillance of tumors. So these molecules might prove to be of great use in combination with other immunotherapies.
...
***
Letztes spricht dafür, dass INCY für IO-Kombinationen gut positioniert ist... bezüglich IDO sind sie führend.
Außerhalb der Pharmas könnte TSRO bei TIM3 mit am weitesten sein.
***
Ein Twitter-Kommentar von der SITC, der OX40-Kombis für besser hält:
"Moran: OX40 doesn't work alone in mice- only in combination with anti-PD-1 #SITC2014"
Ohad Hammer hat OX40 einmal als interessant bezeichnet. Aber insgesamt sollte man eher Kombinationen von IOs betrachten, um den besten Effekt zu erzielen.

Gruß
ipollit
Hi SLGramann,
Hammer ist ja sehr überzeugt von FMI... konnte mich aber bisher noch nicht dazu durchringen, auch eine Position zu kaufen. So ganz sicher bin ich mir nicht, dass nicht die viel größeren Konkurrenten FMI vom Markt drängen werden, wenn sie diesen Bereich als lukrativ sehen. Der Kursverlauf ist auch etwas merkwürdig... immer wenn sie eigentlich recht gute Zahlen liefern, geht der Kurs in den Keller.
Dafür bin ich nun bei SAGE und AERI dabei.
Viele Grüße,
ipollit
Hammer ist ja sehr überzeugt von FMI... konnte mich aber bisher noch nicht dazu durchringen, auch eine Position zu kaufen. So ganz sicher bin ich mir nicht, dass nicht die viel größeren Konkurrenten FMI vom Markt drängen werden, wenn sie diesen Bereich als lukrativ sehen. Der Kursverlauf ist auch etwas merkwürdig... immer wenn sie eigentlich recht gute Zahlen liefern, geht der Kurs in den Keller.
Dafür bin ich nun bei SAGE und AERI dabei.
Viele Grüße,
ipollit
Antwort auf Beitrag Nr.: 48.267.181 von Popeye82 am 09.11.14 16:26:51Hallo Popeye,
denke, hier kann jeder interessante Unternehmen ansprechen... ob ich dann etwas dazu sagen kann, weiß ich nicht. Im Wesentlichen beschäftige ich mich mit US-Biotechs... in Europa bin ich nur in Genmab und Innate investiert, Cellectis beobachte ich. OTC-MicroCaps traue ich in der Regel nicht.
Gruß
ipollit
denke, hier kann jeder interessante Unternehmen ansprechen... ob ich dann etwas dazu sagen kann, weiß ich nicht. Im Wesentlichen beschäftige ich mich mit US-Biotechs... in Europa bin ich nur in Genmab und Innate investiert, Cellectis beobachte ich. OTC-MicroCaps traue ich in der Regel nicht.
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.267.748 von ipollit am 09.11.14 18:25:30"Ich verstehe nicht, warum Ohad Hammer z.B. CLDX CD27-AK als schwach bezeichnet, weil er als Mono-Therapie keine hohe RR bei soliden Tumoren erzielt hat."
Hallo ipollit,
vielleicht solltest Du ihm diese Frage mal stellen. Du kannst Deine Zweifel ja gut begründen und belegen.
Etwas anderes Thema, aber ähnlicher Sachverhalt:
Ich wundere mich zum Beispiel über die wirklich sehr guten Daten des BT-062 (Biotest/IMGN) bei RRMM in Kombination mit Lenalidomid.
Zuletzt dieses ASH-Abstract:
https://ash.confex.com/ash/2014/webprogram/Paper72016.html
Als single-agent hat BT-062 enttäuscht. In der Kombi scheint das Produkt sehr konkurrenzfähig zu sein.
Anmerkung zu FMI: Was an den jüngsten Q-Zahlen nicht so schön war, waren die stark steigenden Kosten in Herstellung und Vertrieb, so dass die Bruttomarge gesunken ist und dann eben auch noch die Vertriebskosten schneller wachsen, als die Umsätze.
Natürlich ist es in diesem frühen Stadium der Unternehmensentwicklung zu früh, daraus viel abzuleiten, aber im Moment ist der Trend so, dass sich ein gewisses Margenproblem andeutet.
Ich denke aber, dass, wenn die Umsätze mal einen großen Sprung machen (bei einer Co-Zulassung mit einem AGIO-Kandidaten bspw.), die Margen sprunghaft nach oben gehen werden.
Gruß
SLG
Hallo ipollit,
vielleicht solltest Du ihm diese Frage mal stellen. Du kannst Deine Zweifel ja gut begründen und belegen.
Etwas anderes Thema, aber ähnlicher Sachverhalt:
Ich wundere mich zum Beispiel über die wirklich sehr guten Daten des BT-062 (Biotest/IMGN) bei RRMM in Kombination mit Lenalidomid.
Zuletzt dieses ASH-Abstract:
https://ash.confex.com/ash/2014/webprogram/Paper72016.html
Als single-agent hat BT-062 enttäuscht. In der Kombi scheint das Produkt sehr konkurrenzfähig zu sein.
Anmerkung zu FMI: Was an den jüngsten Q-Zahlen nicht so schön war, waren die stark steigenden Kosten in Herstellung und Vertrieb, so dass die Bruttomarge gesunken ist und dann eben auch noch die Vertriebskosten schneller wachsen, als die Umsätze.
Natürlich ist es in diesem frühen Stadium der Unternehmensentwicklung zu früh, daraus viel abzuleiten, aber im Moment ist der Trend so, dass sich ein gewisses Margenproblem andeutet.
Ich denke aber, dass, wenn die Umsätze mal einen großen Sprung machen (bei einer Co-Zulassung mit einem AGIO-Kandidaten bspw.), die Margen sprunghaft nach oben gehen werden.
Gruß
SLG
SAGE:
SAGE Therapeutics Reports Positive Top-Line Phase 2 Data of SAGE-547 in Patients With Super-Refractory Status Epilepticus
Of the 11 patients evaluable for efficacy, eight patients met the key efficacy endpoint of being successfully weaned off their anesthetic agents while SAGE-547 was being administered, and eight patients were successfully weaned off SAGE-547 without recurrence of SRSE. The mean duration of status epilepticus prior to treatment with SAGE-547 was 11 days. With an overall response rate of 73 percent, SAGE-547 was generally well tolerated and no drug-related serious adverse events, as determined by the Safety Review Committee, were reported in treated patients. Mean exposure levels of SAGE-547 were approximately 200nm.
http://investor.sagerx.com/releasedetail.cfm?ReleaseID=88164…
--------------
Sieht weiter gut aus. 2015 wird ein pivotal-Trial beginnen.
SAGE Therapeutics Reports Positive Top-Line Phase 2 Data of SAGE-547 in Patients With Super-Refractory Status Epilepticus
Of the 11 patients evaluable for efficacy, eight patients met the key efficacy endpoint of being successfully weaned off their anesthetic agents while SAGE-547 was being administered, and eight patients were successfully weaned off SAGE-547 without recurrence of SRSE. The mean duration of status epilepticus prior to treatment with SAGE-547 was 11 days. With an overall response rate of 73 percent, SAGE-547 was generally well tolerated and no drug-related serious adverse events, as determined by the Safety Review Committee, were reported in treated patients. Mean exposure levels of SAGE-547 were approximately 200nm.
http://investor.sagerx.com/releasedetail.cfm?ReleaseID=88164…
--------------
Sieht weiter gut aus. 2015 wird ein pivotal-Trial beginnen.
ARQL
Tivantinib scheint auch bei Prostata-Krebs (CRPC) zu wirken... jedenfalls PFS pre Chemo. Wenn ich es richtig sehe, muss für eine Zulassung allerdings OS positiv sein.
http://finance.yahoo.com/news/arqule-announces-positive-top-…
"In this trial, 78 patients were randomized 2 to 1 to receive either tivantinib as a single agent or placebo. During a pre-planned analysis, it was found that the trial met its primary endpoint of improving median progression-free survival (PFS) with tivantinib alone as compared to placebo. The results were highly statistically significant. Safety data were consistent with those observed in other trials of tivantinib. ... This study is a randomized Phase 2 trial in which men with asymptomatic or minimally symptomatic metastatic castrate resistant, chemotherapy-naïve prostate cancer were randomized 2 to 1 to receive tivantinib 360 milligrams BID or placebo..."
Bezüglich Tivantinib gibt es ja einige Bedenken, ob es sich wirklich um einen cMet-Hemmer handelt. Es gibt zumindest Hinweise, dass es auch ein "microtubule disruption agent" (MDA) ist. Ein MDA ist eine Chemo... bei Chemotherapeutika, die als Zytostatikum, (Mittel zur Hemmung des Zellwachstums bzw. der Zellteilung) wirken, gibt es zwei verschiedene Klassen abhängig vom möglichen Angriffspunkt gegen Krebs: die einen schädigen die DNA während des Teilungsprozesses (z.B. Cisplatin... das sind übrigens die Mittel, die sich theoretisch mit PARP-Hemmern kominieren lassen), die anderen stören die Mitose (Teilung des Zellkerns) selbst, indem sie den Auf- und Abbau von Mikrotubuli behindern ("Mikrotubuli sind Strukturen, die aus dem Protein Tubulin bestehen und für die Ausbildung des Spindelapparats wichtig sind"). Zu letzteren gehören z.B. Taxane wie Taxotere, Taxol oder Vinca-Alkaloide wie Vincristine. Vincristine (Oncovin) kommt z.B. in der Kombination Rituxan + CHOP (O ist Oncovin) als Goldstandard gegen NHL zum Einsatz.
Tivantinib soll eine ähnliche Wirkung wie Vinca-Alkaloide haben. Laut dem folgenden allerdings eher noch wie Colchicine, das bei Tubulin an der Colchicine-Bindestelle bindet.
http://mct.aacrjournals.org/content/early/2014/10/11/1535-71…
Tivantinib (ARQ 197) exhibits antitumor activity by directly interacting with tubulin and overcomes ABC transporter-mediated drug resistance
...However, as recently reported by us and another group, tivantinib showed cytotoxic activity independent of cellular c-MET status and also disrupted microtubule dynamics. To investigate if tivantinib exerts its cytotoxic activity by disrupting microtubules, we quantified polymerized tubulin in cells and xenograft tumors after tivantinib treatment.... Tivantinib competitively inhibited colchicine but not vincristine or vinblastine binding to purified tubulin. These results imply that tivantinib directly binds to the colchicine binding site of tubulin.... Furthermore, tivantinib showed similar IC50 values against parental and multidrug resistant cells. In contrast, other microtubule-targeting drugs, such as vincristine, paclitaxel, and colchicine, could not suppress the growth of cells overexpressing ABC transporters... These results suggest that tivantinib can overcome ABC transporter-mediated multidrug resistant tumor cells and is potentially useful against various tumors."
Viele sehen es kritisch, dass Tivantinib ein MDA sein soll, indem sie gleichzeitig die Wirkung als cMet-Hemmer in Frage stellen und Tivantinib dann als veraltete Chemo bezeichnen. Meiner Meinung nach könnte die MDA-Eigenschaft allerdings auch positiv für die laufende P3 in HCC sein. Angeblich soll diese Wirkung bei HCC aussichtsreiche sein:
http://www.dovepress.com/getfile.php?fileID=19689
“Gene expression profiling studies have recently shown that microtubule-related cellular assembly and organization is the most crucial event in HCC development, suggesting microtubules to be an important target for therapeutic intervention in HCC…
Surprisingly, although often considered as the most mature group of MBAs, and with several of these agents currently approved for other oncological indications that are in routine clinical practice, vinca alkaloids as single agents have not been extensively studied in HCC. Vindesine was tested in a Phase II study in 16 patients with advanced HCC but did not show a therapeutic effect. Vinflunine has been studied in a Phase I dose-escalation trial in patients with liver dysfunction… A subgroup analysis was carried out in these patients to estimate vinflunine’s antitumor activity… One partial response (PR) was observed while eleven patients (61.1%) had stable disease yielding a disease control rate (PR + stable disease) of 66.7%. The median progression-free survival was 3.4 months (95% confidence interval: 2.6–6.0)…”
Ob Tivantinib in HCC wirklich eine MDA-Wirkung hat, ist allerdings offen...
http://www.google.de/url?sa=t&rct=j&q=tivantinib%20neurotoxi…
...In a couple of recent reports from in vitro studies, the cytotoxic activity of tivantinib independent of MET inhibition was observed via tubulin-related mechanisms of action. However, neurotoxicity, a hallmark of tubulin inhibitors, has not been reported either in this study or other clinical trials of tivantinib. These indirect observations do not support a tubulin-mediated effect of tivantinib in the clinical setting...
Dass Tivantinib nicht neurotoxisch ist, muss meiner Meinung allerdings nicht heißen, dass es nicht als MDA wirkt. Z.B. ZIOPs Indibulin ist ebenfalls nicht neurotoxisch: http://cancerres.aacrjournals.org/content/69/1/171.full
"Indibulin is a novel tubulin binder with cytotoxic activity comparable with that of taxanes and Vinca alkaloids, but it lacks the neurotoxicity associated with other tubulin binders in preclinical models. Its inability to prevent tubulin polymerization in mature neuronal tubulin, possibly because acetylation of Lys40 of a-tubulin prevents binding, is unique."
Taxotere, die Standard-Chemo bei CRPC, ist ebenfalls ein MDA... so gesehen könnte Tivantinib aufgrund dessen auch bei Prostatakrebs wirken, der noch nicht mit Taxotere behandelt worden ist.
HCC finde ich spannender.
Gruß
ipollit
Tivantinib scheint auch bei Prostata-Krebs (CRPC) zu wirken... jedenfalls PFS pre Chemo. Wenn ich es richtig sehe, muss für eine Zulassung allerdings OS positiv sein.
http://finance.yahoo.com/news/arqule-announces-positive-top-…
"In this trial, 78 patients were randomized 2 to 1 to receive either tivantinib as a single agent or placebo. During a pre-planned analysis, it was found that the trial met its primary endpoint of improving median progression-free survival (PFS) with tivantinib alone as compared to placebo. The results were highly statistically significant. Safety data were consistent with those observed in other trials of tivantinib. ... This study is a randomized Phase 2 trial in which men with asymptomatic or minimally symptomatic metastatic castrate resistant, chemotherapy-naïve prostate cancer were randomized 2 to 1 to receive tivantinib 360 milligrams BID or placebo..."
Bezüglich Tivantinib gibt es ja einige Bedenken, ob es sich wirklich um einen cMet-Hemmer handelt. Es gibt zumindest Hinweise, dass es auch ein "microtubule disruption agent" (MDA) ist. Ein MDA ist eine Chemo... bei Chemotherapeutika, die als Zytostatikum, (Mittel zur Hemmung des Zellwachstums bzw. der Zellteilung) wirken, gibt es zwei verschiedene Klassen abhängig vom möglichen Angriffspunkt gegen Krebs: die einen schädigen die DNA während des Teilungsprozesses (z.B. Cisplatin... das sind übrigens die Mittel, die sich theoretisch mit PARP-Hemmern kominieren lassen), die anderen stören die Mitose (Teilung des Zellkerns) selbst, indem sie den Auf- und Abbau von Mikrotubuli behindern ("Mikrotubuli sind Strukturen, die aus dem Protein Tubulin bestehen und für die Ausbildung des Spindelapparats wichtig sind"). Zu letzteren gehören z.B. Taxane wie Taxotere, Taxol oder Vinca-Alkaloide wie Vincristine. Vincristine (Oncovin) kommt z.B. in der Kombination Rituxan + CHOP (O ist Oncovin) als Goldstandard gegen NHL zum Einsatz.
Tivantinib soll eine ähnliche Wirkung wie Vinca-Alkaloide haben. Laut dem folgenden allerdings eher noch wie Colchicine, das bei Tubulin an der Colchicine-Bindestelle bindet.
http://mct.aacrjournals.org/content/early/2014/10/11/1535-71…
Tivantinib (ARQ 197) exhibits antitumor activity by directly interacting with tubulin and overcomes ABC transporter-mediated drug resistance
...However, as recently reported by us and another group, tivantinib showed cytotoxic activity independent of cellular c-MET status and also disrupted microtubule dynamics. To investigate if tivantinib exerts its cytotoxic activity by disrupting microtubules, we quantified polymerized tubulin in cells and xenograft tumors after tivantinib treatment.... Tivantinib competitively inhibited colchicine but not vincristine or vinblastine binding to purified tubulin. These results imply that tivantinib directly binds to the colchicine binding site of tubulin.... Furthermore, tivantinib showed similar IC50 values against parental and multidrug resistant cells. In contrast, other microtubule-targeting drugs, such as vincristine, paclitaxel, and colchicine, could not suppress the growth of cells overexpressing ABC transporters... These results suggest that tivantinib can overcome ABC transporter-mediated multidrug resistant tumor cells and is potentially useful against various tumors."
Viele sehen es kritisch, dass Tivantinib ein MDA sein soll, indem sie gleichzeitig die Wirkung als cMet-Hemmer in Frage stellen und Tivantinib dann als veraltete Chemo bezeichnen. Meiner Meinung nach könnte die MDA-Eigenschaft allerdings auch positiv für die laufende P3 in HCC sein. Angeblich soll diese Wirkung bei HCC aussichtsreiche sein:
http://www.dovepress.com/getfile.php?fileID=19689
“Gene expression profiling studies have recently shown that microtubule-related cellular assembly and organization is the most crucial event in HCC development, suggesting microtubules to be an important target for therapeutic intervention in HCC…
Surprisingly, although often considered as the most mature group of MBAs, and with several of these agents currently approved for other oncological indications that are in routine clinical practice, vinca alkaloids as single agents have not been extensively studied in HCC. Vindesine was tested in a Phase II study in 16 patients with advanced HCC but did not show a therapeutic effect. Vinflunine has been studied in a Phase I dose-escalation trial in patients with liver dysfunction… A subgroup analysis was carried out in these patients to estimate vinflunine’s antitumor activity… One partial response (PR) was observed while eleven patients (61.1%) had stable disease yielding a disease control rate (PR + stable disease) of 66.7%. The median progression-free survival was 3.4 months (95% confidence interval: 2.6–6.0)…”
Ob Tivantinib in HCC wirklich eine MDA-Wirkung hat, ist allerdings offen...
http://www.google.de/url?sa=t&rct=j&q=tivantinib%20neurotoxi…
...In a couple of recent reports from in vitro studies, the cytotoxic activity of tivantinib independent of MET inhibition was observed via tubulin-related mechanisms of action. However, neurotoxicity, a hallmark of tubulin inhibitors, has not been reported either in this study or other clinical trials of tivantinib. These indirect observations do not support a tubulin-mediated effect of tivantinib in the clinical setting...
Dass Tivantinib nicht neurotoxisch ist, muss meiner Meinung allerdings nicht heißen, dass es nicht als MDA wirkt. Z.B. ZIOPs Indibulin ist ebenfalls nicht neurotoxisch: http://cancerres.aacrjournals.org/content/69/1/171.full
"Indibulin is a novel tubulin binder with cytotoxic activity comparable with that of taxanes and Vinca alkaloids, but it lacks the neurotoxicity associated with other tubulin binders in preclinical models. Its inability to prevent tubulin polymerization in mature neuronal tubulin, possibly because acetylation of Lys40 of a-tubulin prevents binding, is unique."
Taxotere, die Standard-Chemo bei CRPC, ist ebenfalls ein MDA... so gesehen könnte Tivantinib aufgrund dessen auch bei Prostatakrebs wirken, der noch nicht mit Taxotere behandelt worden ist.
HCC finde ich spannender.
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.273.661 von SLGramann am 10.11.14 14:11:18"2015 wird ein pivotal-Trial beginnen"
http://www.fiercebiotech.com/story/biotech-upstart-sage-sees…
"Sage wants to keep the U.S. rights to the drug, aiming for an approval to launch by 2018--a conservative estimate that could be improved on if the FDA helps accelerate the development effort. The CEO estimates that the U.S. market of treatment-resistant patients is probably around 25,000. There are ongoing discussions about licensing ex-U.S. rights, adds Jonas, but no firm plans on that score as of yet."
Eine mögliche Zulassung 2018?... das verstehe ich nicht!? Kann das sein? Ich hätte auch eher 2016 geschätzt... zumal SAGE-547 fast track hat, oder?
Grüße
ipollit
http://www.fiercebiotech.com/story/biotech-upstart-sage-sees…
"Sage wants to keep the U.S. rights to the drug, aiming for an approval to launch by 2018--a conservative estimate that could be improved on if the FDA helps accelerate the development effort. The CEO estimates that the U.S. market of treatment-resistant patients is probably around 25,000. There are ongoing discussions about licensing ex-U.S. rights, adds Jonas, but no firm plans on that score as of yet."
Eine mögliche Zulassung 2018?... das verstehe ich nicht!? Kann das sein? Ich hätte auch eher 2016 geschätzt... zumal SAGE-547 fast track hat, oder?
Grüße
ipollit
Antwort auf Beitrag Nr.: 48.269.092 von ipollit am 09.11.14 23:07:01
SAGE Therapeutics hört sich, nach flüchtigem durchschauen der Präsentation, auf jeden Fall interessant an
muss mich aber erstmal auf eigene Werte konzentrieren
Gruß
P.
SAGE Therapeutics hört sich, nach flüchtigem durchschauen der Präsentation, auf jeden Fall interessant an
muss mich aber erstmal auf eigene Werte konzentrieren
Gruß
P.
ESPR
"RT @cardiobrief: The IMPROVE-IT embargo will lift next Monday at 11:45 AM ET."
Nächsten Montag sollen also die IMPROVE-IT Daten kommen... eine Outcome-Studie, die erstmals umfangreich (10 Jahre, 18.000 Teilnehmer) prüft, ob eine Senkung von LDL mittels Zetia sich zusätzlich zu Statinen positiv auf Herz-Kreislauf-Erkrankungen auswirkt. Wichtig ist dies in sofern, weil bisher eine Senkung von LDL als Studienentpunkt entsprechender Mittel ausreicht, obwohl es inzwischen Zweifel gibt, ob LDL überhaupt ein wichtiger Parameter ist, man dadurch z.B. Schlaganfälle verhindern kann.
Zetia, das in absehbarer Zeit generisch werden wird, ist der direkte Konkurrent von ESPR's ETC-1002. Sollte IMPROVE-IT negativ ausfallen, dürfte sich das auch auf ETC-1002 auswirken, obwohl ETC-1002 auch andere Parameter wie CRP positiv beeinflusst und daher schon einen Vorteil über Statine hinaus bieten könnte. Betroffen sein werden auch PCSK9-AKs wie REGN's Alirocumab... diese Senken wohl im wesentlichen nur LDL, dafür aber sehr viel stärker als Zetia. Die stärkere Senkung könnte sich ebenfalls positiv auswirken, auch wenn IMPROVE-IT nicht erfolgreich ist. Generell könnte bei einem negativen Ergebnis eine Zulassung entsprechener Mittel aber deutlich aufwändiger und teuerer werden.
Ein interessanter Artikel dazu...
http://www.forbes.com/sites/larryhusten/2014/11/07/what-you-…
"...The drug was first approved by the FDA in 2002. It quickly became a blockbuster, with sales reaching more than $5 billion a year within a few years. Critics of the drug noted that, despite its success, there were no trials showing the drug conferred any actual clinical benefit besides lowering LDL.
...
Although ezetimibe remains a successful drug to this day– worldwide sales still total more than $4 billion each year– the ENHANCE trial put an end to the drug’s explosive growth, and provoked an explosion of criticism and concern that has yet to entirely die down.
...
IMROVE_IT... The protocol included stopping guidelines for “overwhelming efficacy” so it is clear that the results, at best, will be somewhat modest.
...
A distinct possibility, raised by the study investigators and others, is that because LDL levels will be low in both groups and because the difference in LDL between the groups will be modest, the results at best will show only small and unimpressive clinical differences.
...
Small, Mixed or Ambiguous Effect– This is what most observers probably expect. There may be a small, beneficial effect that either just reaches or just misses statistical significance. ... This is also the outcome most desired by many academic physicians, PR companies, and medical communication companies, since it will guarantee nearly full employment for many of them for a very long period."
Desweiteren wird spekuliert, dass die Hauptpräsentation am Montag nicht statistisch signifikant ist, da für Dienstag eine zweite Präsentation angesetzt ist, die vielleicht dann auf sekundäre Endpunkte und Subgruppen eingeht.
Zudem hat vor Kurzem Merck Folgendes zu Zetia gesagt:
"The Company has been unblinded to the results from the IMPROVE-IT trial, an approximately 18,000 patient event-driven cardiovascular outcomes study evaluating ezetimibe/simvastatin against simvastatin alone in patients presenting with acute coronary syndrome, which will be presented at the American Heart Association Scientific Sessions on November 17, 2014. The Company has determined that the Zetia and Vytorin intangible assets are not impaired."
Zuvor hat Merck diese Studie als Risiko angesehen. Das weist darauf hin, dass IMPROVE-IT nicht ein komplettes Desaster sein wird... mal schauen.

Gruß
ipollit
"RT @cardiobrief: The IMPROVE-IT embargo will lift next Monday at 11:45 AM ET."
Nächsten Montag sollen also die IMPROVE-IT Daten kommen... eine Outcome-Studie, die erstmals umfangreich (10 Jahre, 18.000 Teilnehmer) prüft, ob eine Senkung von LDL mittels Zetia sich zusätzlich zu Statinen positiv auf Herz-Kreislauf-Erkrankungen auswirkt. Wichtig ist dies in sofern, weil bisher eine Senkung von LDL als Studienentpunkt entsprechender Mittel ausreicht, obwohl es inzwischen Zweifel gibt, ob LDL überhaupt ein wichtiger Parameter ist, man dadurch z.B. Schlaganfälle verhindern kann.
Zetia, das in absehbarer Zeit generisch werden wird, ist der direkte Konkurrent von ESPR's ETC-1002. Sollte IMPROVE-IT negativ ausfallen, dürfte sich das auch auf ETC-1002 auswirken, obwohl ETC-1002 auch andere Parameter wie CRP positiv beeinflusst und daher schon einen Vorteil über Statine hinaus bieten könnte. Betroffen sein werden auch PCSK9-AKs wie REGN's Alirocumab... diese Senken wohl im wesentlichen nur LDL, dafür aber sehr viel stärker als Zetia. Die stärkere Senkung könnte sich ebenfalls positiv auswirken, auch wenn IMPROVE-IT nicht erfolgreich ist. Generell könnte bei einem negativen Ergebnis eine Zulassung entsprechener Mittel aber deutlich aufwändiger und teuerer werden.
Ein interessanter Artikel dazu...
http://www.forbes.com/sites/larryhusten/2014/11/07/what-you-…
"...The drug was first approved by the FDA in 2002. It quickly became a blockbuster, with sales reaching more than $5 billion a year within a few years. Critics of the drug noted that, despite its success, there were no trials showing the drug conferred any actual clinical benefit besides lowering LDL.
...
Although ezetimibe remains a successful drug to this day– worldwide sales still total more than $4 billion each year– the ENHANCE trial put an end to the drug’s explosive growth, and provoked an explosion of criticism and concern that has yet to entirely die down.
...
IMROVE_IT... The protocol included stopping guidelines for “overwhelming efficacy” so it is clear that the results, at best, will be somewhat modest.
...
A distinct possibility, raised by the study investigators and others, is that because LDL levels will be low in both groups and because the difference in LDL between the groups will be modest, the results at best will show only small and unimpressive clinical differences.
...
Small, Mixed or Ambiguous Effect– This is what most observers probably expect. There may be a small, beneficial effect that either just reaches or just misses statistical significance. ... This is also the outcome most desired by many academic physicians, PR companies, and medical communication companies, since it will guarantee nearly full employment for many of them for a very long period."
Desweiteren wird spekuliert, dass die Hauptpräsentation am Montag nicht statistisch signifikant ist, da für Dienstag eine zweite Präsentation angesetzt ist, die vielleicht dann auf sekundäre Endpunkte und Subgruppen eingeht.
Zudem hat vor Kurzem Merck Folgendes zu Zetia gesagt:
"The Company has been unblinded to the results from the IMPROVE-IT trial, an approximately 18,000 patient event-driven cardiovascular outcomes study evaluating ezetimibe/simvastatin against simvastatin alone in patients presenting with acute coronary syndrome, which will be presented at the American Heart Association Scientific Sessions on November 17, 2014. The Company has determined that the Zetia and Vytorin intangible assets are not impaired."
Zuvor hat Merck diese Studie als Risiko angesehen. Das weist darauf hin, dass IMPROVE-IT nicht ein komplettes Desaster sein wird... mal schauen.
Gruß
ipollit
REGN

http://www.fiercebiotech.com/story/promising-asthma-trial-pr…
Dupilumab is designed to block two proteins, interleukin-4 and interleukin-13, that play a key role in the inflammatory process.
...
A win here would be big for Regeneron and huge for Sanofi. Leerink Swann analyst Joseph Schwartz has projected peak annual sales potential for dupilumab at $2.8 billion for two indications--asthma and atopic dermatitis indication. And the partners could be setting the stage for even more.
...
"Many have thought that targeting the Th2 pathway in asthma would limit benefit to a subset of asthmatics, such as those with high eosinophils. In this study, blocking IL-4/IL-13 signaling with dupilumab improved lung function and reduced severe exacerbations in the broader study population," said Elias Zerhouni, who heads R&D for Sanofi. "Based on these results, we plan to move dupilumab into Phase III clinical development in patients with moderate-to-severe uncontrolled asthma."
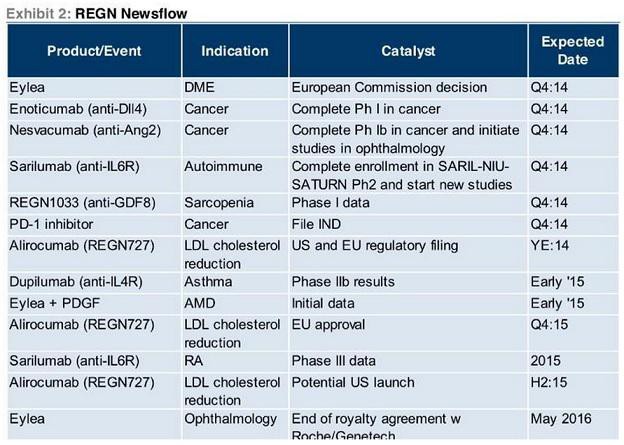
***
BoA predicts @US_FDA will approve $AMGN's evolocumab in 3Q15 and estimates $2.8bn in 2020 sales, says $REGN's PDUFA may be bit earlier. $SNY
$AMGN PSCK-9 inhibitor #evolocumab PDUFA date 8/27/15 under standard review; $SNY $REGN rival alirocumab to get priority review w/ voucher
****
http://www.fiercepharmamarketing.com/story/sales-speedster-e…
November 5, 2014: Sales speedster Eylea faces a tougher track in new DME market, Regeneron SVP says
Fast-growing wet AMD blockbuster Eylea delivered a surprise Tuesday, failing to surpass analyst expectations with a showing that prompted maker Regeneron ($REGN) to lower full-year sales guidance for the first time in the drug's three-year history. While CEO Len Schleifer was quick to highlight a new approval for diabetic macular edema that should keep sales riding high, a couple of key differences between the wet AMD and DME markets could mean growth won't happen as quickly as Regeneron--or investors--would like.
Eylea missed consensus third-quarter estimates with a $445 million performance, Regeneron said Tuesday. Investors weren't too happy with the news, sending shares down more than 7% in premarket trading. As RBC Capital Markets analyst Adnan Butt wrote in a note seen by Investor's Business Daily, they'd expected that "Eylea growth would be significant given the recent diabetic macular edema approval."
But as Bob Terifay, Regeneron's commercial SVP, explained to analysts on a conference call, they shouldn't expect to see the same eye-popping Eylea launch numbers out of the DME market--at least, not right now. "Uptake will be slower than in wet AMD," he said.
Why the lag time? There's a "significant difference" between the two markets, he said, starting with physicians' fear that in wet AMD patients, ongoing retinal edema can cause hemorrhage that leads to sudden vision loss. So they look for alternative treatment options that might dry the retina, and that's what was happening when Eylea hit the market.
When the drug rolled out, "there was a large patient population with a history of inadequate response" to rivals Lucentis and Avastin from Roche ($RHHBY), and their "physicians were waiting to switch them to Eylea," Tarifay said.
There's also the fact that anti-VEGF agents like Eylea haven't been used to treat DME for as long as they've been used in wet AMD. That means the market isn't as well-developed, and the current go-to approach--laser treatments--are still "heavily entrenched," as Tarifay put it.
And then there's the difference in payer dynamics between the two markets. Most wet AMD patients are over 65 and are covered by traditional Medicare, compared with only an estimated 30% of DME patients. Not only are commercial payers slower to provide drug coverage, but "even when coverage is granted, notification to physicians, and the loading of reimbursement information to payer portals, doesn't occur in a predictable manner," Tarifay cautioned.
The moral of the story? While DME sales will continue to grow, they're not going to turn out the forecast-busting numbers investors may be used to. But on the bright side, that wet AMD indication hasn't stopped turning out double-digit sales leaps: While Eylea may have missed estimates, it still posted a 23% sales swell.
****
http://www.fiercepharma.com/story/regenerons-eylea-bests-luc…
October 20, 2014: Regeneron's Eylea bests Lucentis, Avastin in diabetic eye disease, NIH study finds
...
On Friday, Regeneron ($REGN) announced that in an NIH-sponsored study, Eylea bested both Lucentis and Avastin--a cancer drug that docs often use off-label, thanks to its significantly lower price tag--at treating diabetic macular edema (DME).
Not only did Eylea win out efficacy-wise after 52 weeks, but it also posted a better safety record and required fewer injections on average--advantages that could provide an even bigger boost if they're confirmed by final study results due next year, according to RBC Capital Markets analyst Adnan Butt.
If anything, the data "help Eylea's launch in DME, with the potential to be even more impactful if differences persist at two years," he said, as quoted by StreetInsider
...

Gruß
ipollit

http://www.fiercebiotech.com/story/promising-asthma-trial-pr…
Dupilumab is designed to block two proteins, interleukin-4 and interleukin-13, that play a key role in the inflammatory process.
...
A win here would be big for Regeneron and huge for Sanofi. Leerink Swann analyst Joseph Schwartz has projected peak annual sales potential for dupilumab at $2.8 billion for two indications--asthma and atopic dermatitis indication. And the partners could be setting the stage for even more.
...
"Many have thought that targeting the Th2 pathway in asthma would limit benefit to a subset of asthmatics, such as those with high eosinophils. In this study, blocking IL-4/IL-13 signaling with dupilumab improved lung function and reduced severe exacerbations in the broader study population," said Elias Zerhouni, who heads R&D for Sanofi. "Based on these results, we plan to move dupilumab into Phase III clinical development in patients with moderate-to-severe uncontrolled asthma."

***
BoA predicts @US_FDA will approve $AMGN's evolocumab in 3Q15 and estimates $2.8bn in 2020 sales, says $REGN's PDUFA may be bit earlier. $SNY
$AMGN PSCK-9 inhibitor #evolocumab PDUFA date 8/27/15 under standard review; $SNY $REGN rival alirocumab to get priority review w/ voucher
****
http://www.fiercepharmamarketing.com/story/sales-speedster-e…
November 5, 2014: Sales speedster Eylea faces a tougher track in new DME market, Regeneron SVP says
Fast-growing wet AMD blockbuster Eylea delivered a surprise Tuesday, failing to surpass analyst expectations with a showing that prompted maker Regeneron ($REGN) to lower full-year sales guidance for the first time in the drug's three-year history. While CEO Len Schleifer was quick to highlight a new approval for diabetic macular edema that should keep sales riding high, a couple of key differences between the wet AMD and DME markets could mean growth won't happen as quickly as Regeneron--or investors--would like.
Eylea missed consensus third-quarter estimates with a $445 million performance, Regeneron said Tuesday. Investors weren't too happy with the news, sending shares down more than 7% in premarket trading. As RBC Capital Markets analyst Adnan Butt wrote in a note seen by Investor's Business Daily, they'd expected that "Eylea growth would be significant given the recent diabetic macular edema approval."
But as Bob Terifay, Regeneron's commercial SVP, explained to analysts on a conference call, they shouldn't expect to see the same eye-popping Eylea launch numbers out of the DME market--at least, not right now. "Uptake will be slower than in wet AMD," he said.
Why the lag time? There's a "significant difference" between the two markets, he said, starting with physicians' fear that in wet AMD patients, ongoing retinal edema can cause hemorrhage that leads to sudden vision loss. So they look for alternative treatment options that might dry the retina, and that's what was happening when Eylea hit the market.
When the drug rolled out, "there was a large patient population with a history of inadequate response" to rivals Lucentis and Avastin from Roche ($RHHBY), and their "physicians were waiting to switch them to Eylea," Tarifay said.
There's also the fact that anti-VEGF agents like Eylea haven't been used to treat DME for as long as they've been used in wet AMD. That means the market isn't as well-developed, and the current go-to approach--laser treatments--are still "heavily entrenched," as Tarifay put it.
And then there's the difference in payer dynamics between the two markets. Most wet AMD patients are over 65 and are covered by traditional Medicare, compared with only an estimated 30% of DME patients. Not only are commercial payers slower to provide drug coverage, but "even when coverage is granted, notification to physicians, and the loading of reimbursement information to payer portals, doesn't occur in a predictable manner," Tarifay cautioned.
The moral of the story? While DME sales will continue to grow, they're not going to turn out the forecast-busting numbers investors may be used to. But on the bright side, that wet AMD indication hasn't stopped turning out double-digit sales leaps: While Eylea may have missed estimates, it still posted a 23% sales swell.
****
http://www.fiercepharma.com/story/regenerons-eylea-bests-luc…
October 20, 2014: Regeneron's Eylea bests Lucentis, Avastin in diabetic eye disease, NIH study finds
...
On Friday, Regeneron ($REGN) announced that in an NIH-sponsored study, Eylea bested both Lucentis and Avastin--a cancer drug that docs often use off-label, thanks to its significantly lower price tag--at treating diabetic macular edema (DME).
Not only did Eylea win out efficacy-wise after 52 weeks, but it also posted a better safety record and required fewer injections on average--advantages that could provide an even bigger boost if they're confirmed by final study results due next year, according to RBC Capital Markets analyst Adnan Butt.
If anything, the data "help Eylea's launch in DME, with the potential to be even more impactful if differences persist at two years," he said, as quoted by StreetInsider
...
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.292.453 von ipollit am 12.11.14 00:04:45Hallo ipollit,
bei ESPR ist ja ganz schön was los! Und schon wieder was gelernt :
:
http://de.wikipedia.org/wiki/Intention-to-treat-Analyse (Montag)
http://de.wikipedia.org/wiki/Per-Protocol-Analyse (Dienstag)
Ich finde das was du schreibst/zusammengetragen hast durchaus nachvollziehbar frage mich aber, ob die Implikationen der Improve-It-Studie nicht auch übertrieben und einseitig dargestellt werden (nicht von dir sondern was man so liest).
Wäre ein Scheitern (was nach den Äußerungen von Merck sicher unwahrscheinlich ist) nicht auch irgendwie gut, da 1002 dann als "oral treatment" neben den Statinen quasi alleine wäre? Zudem wirkt 1002 ja auch noch auf andere Parameter und man kann die Ergebnisse gar nicht 1 zu 1 übertragen.
Grundsätzlich denke ich einfach auch, dass die FDA ja auch ein großes Interesse an der Entwicklung von Alternativen in dem Bereich Herz-Kreislauferkrankungen (Todesursache Nr.1=big medical need) haben sollte. Da jetzt den Entwicklern quasi die Tür vor der Nase zuzuknallen wäre doch unlogisch. Wenn tatsächlich vor Zulassung statistisch signifikante Aussagen zu Herz-Kreislaufereignissen gesammelt werden sollten würde das doch viel zu lange dauern und somit extrem teuer und unlukrativ werden. Ich gehe deshalb davon aus, dass man sich mit der FDA einigen wird und dies ab PIII und am Markt untersuchen wird.
Interessant finde ich, dass ESPR recht kurzfristig für Montag eine Investoren/Analysten Konferenz angesetzt hat. Mal sehen was dann Anfang nächster Woche "so geht"...
Beschäftigen tut mich noch, dass 1002 von einem "partial clinical hold" betroffen ist. Weiß da jemand mehr über die Hintergründe? So wie ich es verstehe könnte das aber Anfang nächsten Jahres aufgehoben werden.

Upcomimg events:
First, by early 2015 we will submit a two-year carcinogenicity reports to FDA.
(ESPR bekommt die aber schon Ende 2014)
In March, we will report top-line results from the Phase 2b 009, add-on to statin clinical trials.
In Q2 of 2015, we will report top-line results from the Phase 2, 014 clinical trials in patients with hypercholesterolemia and hypertension.
We expect to hold our end of Phase 2 meeting with FDA in mid-2015 and we expect to initiate our Phase 3 program for 1002 by Q4 of 2015 (laut CC eventuell auch früher)
http://seekingalpha.com/article/2667525-esperion-therapeutic…
Zu guter Letzt: Charttechnisch könnten die Ergebnisse der Improve-it-Studie für einen Ausbruch sorgen:

Und ganz frisch reingekommen: Vielleicht nahm Merck seinen Optimismus ja auch aus dieser Studie:
http://in.reuters.com/article/2014/11/12/us-heart-health-gen…
SG kmastra
bei ESPR ist ja ganz schön was los! Und schon wieder was gelernt
 :
:http://de.wikipedia.org/wiki/Intention-to-treat-Analyse (Montag)
http://de.wikipedia.org/wiki/Per-Protocol-Analyse (Dienstag)
Ich finde das was du schreibst/zusammengetragen hast durchaus nachvollziehbar frage mich aber, ob die Implikationen der Improve-It-Studie nicht auch übertrieben und einseitig dargestellt werden (nicht von dir sondern was man so liest).
Wäre ein Scheitern (was nach den Äußerungen von Merck sicher unwahrscheinlich ist) nicht auch irgendwie gut, da 1002 dann als "oral treatment" neben den Statinen quasi alleine wäre? Zudem wirkt 1002 ja auch noch auf andere Parameter und man kann die Ergebnisse gar nicht 1 zu 1 übertragen.
Grundsätzlich denke ich einfach auch, dass die FDA ja auch ein großes Interesse an der Entwicklung von Alternativen in dem Bereich Herz-Kreislauferkrankungen (Todesursache Nr.1=big medical need) haben sollte. Da jetzt den Entwicklern quasi die Tür vor der Nase zuzuknallen wäre doch unlogisch. Wenn tatsächlich vor Zulassung statistisch signifikante Aussagen zu Herz-Kreislaufereignissen gesammelt werden sollten würde das doch viel zu lange dauern und somit extrem teuer und unlukrativ werden. Ich gehe deshalb davon aus, dass man sich mit der FDA einigen wird und dies ab PIII und am Markt untersuchen wird.
Interessant finde ich, dass ESPR recht kurzfristig für Montag eine Investoren/Analysten Konferenz angesetzt hat. Mal sehen was dann Anfang nächster Woche "so geht"...
Beschäftigen tut mich noch, dass 1002 von einem "partial clinical hold" betroffen ist. Weiß da jemand mehr über die Hintergründe? So wie ich es verstehe könnte das aber Anfang nächsten Jahres aufgehoben werden.

Upcomimg events:
First, by early 2015 we will submit a two-year carcinogenicity reports to FDA.
(ESPR bekommt die aber schon Ende 2014)
In March, we will report top-line results from the Phase 2b 009, add-on to statin clinical trials.
In Q2 of 2015, we will report top-line results from the Phase 2, 014 clinical trials in patients with hypercholesterolemia and hypertension.
We expect to hold our end of Phase 2 meeting with FDA in mid-2015 and we expect to initiate our Phase 3 program for 1002 by Q4 of 2015 (laut CC eventuell auch früher)
http://seekingalpha.com/article/2667525-esperion-therapeutic…
Zu guter Letzt: Charttechnisch könnten die Ergebnisse der Improve-it-Studie für einen Ausbruch sorgen:
Und ganz frisch reingekommen: Vielleicht nahm Merck seinen Optimismus ja auch aus dieser Studie:
http://in.reuters.com/article/2014/11/12/us-heart-health-gen…
SG kmastra
Doppelschreiben
Sorry für die "agressive Formatierung", aber ich wollte das nicht nochmal umarbeiten
vielleicht für euch interessant
Gruß
P.
Theralase(V.TLT) 'further demonstrates 'phenomenal cancer immunity response', in testing' - SH - Nov 12, 2014
- Gaalen Engen -
http://theralase.com/pressrelease/theralase-validates-anti-c…
www.stockhouse.com/news/newswire/2014/11/12/theralase-v-tlt-…
"Theralase Technologies (TSX: V.TLT, Stock Forum) celebrated today when the company released the results from new preclinical research carried out at the Princess Margaret Cancer Centre, University Health Network (“UHN”) located in Toronto, Canada.
According to the news release, trial results further confirmed the company's Photo Dynamic Compound's (“PDCs”) ability to destroy a primary host tumour and then render the animal immune to a repeated exposure of the same cancer.
Testing performed by UHN in March 2012 involved mice being injected with 350K colon cancer cells to generate cancerous tumours that were allowed to grow five millimetres in size before treating the tumours with PDCs and Near Infrared (“NIR”) light to activate the PDC. The vast majority of tumours were destroyed as a result and the mice remained cancer-free for 20 months post-treatment.
In May 2014, the UHN again treated mice with the same protocol and those mice who successfully responded to the Photo Dynamic Therapy (“PDT”) were re-injected with an equal amount of colon cancer cells 10-23 days later. With no further treatment intervention, 60% of the mice did not demonstrate tumour re-growth, while 40% had a small tumour regrowth that was quickly destroyed.
The aforementioned results pose the possibility of short-term immune-mediated “memory response” that destroys cancer cells with no further intervention.
Research in November 2014 at UHN, mice were once again treated according to the March 2012 protocol and all of the mice who received PDT were successfully treated and remained cancer-free. These mice were then injected with an equal amount of colon cancer cells 20 days later and with no further treatment intervention none of the mice demonstrated tumour re-growth. Further confirming an ability to destroy the primary tumour and strongly suggesting a protection of the animal via the immune system leading to a short-term immune-mediated “memory response”.
Incredibly good news for the company and the world in general as it suggests a major breakthrough in the treatment of cancer, providing substantial treatment benefits and survival advantages to cancer patients
The company's patented technology has so far shown itself able to rapidly and effectively destroy “patient-specific” cancer cells, prevent their recurrence and provide long-lasting protection against local and distant metastasis, an immense clinical benefit to cancer patients and the facilities that treat their disease.
Company Chief Scientific Officer, Dr. Arkady Mandel, commented on the landmark confirmatory findings, “Our primary focus since the initial findings of the PDT memory response in May 2014 has been to further understand and validate this phenomenal effect.”
He went on to illustrate, “Our research program has achieved this mandate by demonstrating that Theralase's NIR PDT destroys the primary tumour and suggests a short term memory response, even when the animal is further challenged with a new round of cancer cells 20 days later, thus preventing the animal from developing cancer.”
Then explained, “Our latest research suggests that our original hypothesis that "memory cells", such as memory T lymphocytes, part of the immune system, may be reprogrammed to "search and destroy" the threat posed by cancer cells.”
And finally concluded, “This is a very important step toward our long-term goal of developing an affordable and practical vaccine to prevent cancer recurrence.”
Roger Dumoulin-White, Company President and CEO, added, “I am delighted that our scientific and preclinical research teams continue to further understand and validate this effect to allow us to prepare for clinical validation in human patients. Iiiiif we are able to validate the effect in humans, then the implications of this discovery are nothing short of game changing for both Theralase and more importantly for cancer patients.”
Human trials are still in the distance, but these amazing results are building the necessary framework to establish those tests and Theralase has shown itself to have both the management and medical skills and relationships to take this process to commercialization and quite possibly radically impact the sector, giving cancer patients a far less invasive yet thoroughly effective life-saving treatment.
There are hurdles left to be cleared, but the company's path seems pointed toward success and smart investors should be taking note of its continued progress. I know I am.
Theralase was in the news recently when the Toronto-based company announced in the middle of October that it would present its latest research on the destruction of cancer and bacteria at 10th International Symposium on Photodynamic Therapy and Photodiagnosis in Clinical Practice.
Shares climbed 13.43% on the news to $0.38 per share.
Currently there are 82.8m outstanding shares with a market cap of $31.5 million. "
Sorry für die "agressive Formatierung", aber ich wollte das nicht nochmal umarbeiten
vielleicht für euch interessant
Gruß
P.
Theralase(V.TLT) 'further demonstrates 'phenomenal cancer immunity response', in testing' - SH - Nov 12, 2014
- Gaalen Engen -
http://theralase.com/pressrelease/theralase-validates-anti-c…
www.stockhouse.com/news/newswire/2014/11/12/theralase-v-tlt-…
"Theralase Technologies (TSX: V.TLT, Stock Forum) celebrated today when the company released the results from new preclinical research carried out at the Princess Margaret Cancer Centre, University Health Network (“UHN”) located in Toronto, Canada.
According to the news release, trial results further confirmed the company's Photo Dynamic Compound's (“PDCs”) ability to destroy a primary host tumour and then render the animal immune to a repeated exposure of the same cancer.
Testing performed by UHN in March 2012 involved mice being injected with 350K colon cancer cells to generate cancerous tumours that were allowed to grow five millimetres in size before treating the tumours with PDCs and Near Infrared (“NIR”) light to activate the PDC. The vast majority of tumours were destroyed as a result and the mice remained cancer-free for 20 months post-treatment.
In May 2014, the UHN again treated mice with the same protocol and those mice who successfully responded to the Photo Dynamic Therapy (“PDT”) were re-injected with an equal amount of colon cancer cells 10-23 days later. With no further treatment intervention, 60% of the mice did not demonstrate tumour re-growth, while 40% had a small tumour regrowth that was quickly destroyed.
The aforementioned results pose the possibility of short-term immune-mediated “memory response” that destroys cancer cells with no further intervention.
Research in November 2014 at UHN, mice were once again treated according to the March 2012 protocol and all of the mice who received PDT were successfully treated and remained cancer-free. These mice were then injected with an equal amount of colon cancer cells 20 days later and with no further treatment intervention none of the mice demonstrated tumour re-growth. Further confirming an ability to destroy the primary tumour and strongly suggesting a protection of the animal via the immune system leading to a short-term immune-mediated “memory response”.
Incredibly good news for the company and the world in general as it suggests a major breakthrough in the treatment of cancer, providing substantial treatment benefits and survival advantages to cancer patients
The company's patented technology has so far shown itself able to rapidly and effectively destroy “patient-specific” cancer cells, prevent their recurrence and provide long-lasting protection against local and distant metastasis, an immense clinical benefit to cancer patients and the facilities that treat their disease.
Company Chief Scientific Officer, Dr. Arkady Mandel, commented on the landmark confirmatory findings, “Our primary focus since the initial findings of the PDT memory response in May 2014 has been to further understand and validate this phenomenal effect.”
He went on to illustrate, “Our research program has achieved this mandate by demonstrating that Theralase's NIR PDT destroys the primary tumour and suggests a short term memory response, even when the animal is further challenged with a new round of cancer cells 20 days later, thus preventing the animal from developing cancer.”
Then explained, “Our latest research suggests that our original hypothesis that "memory cells", such as memory T lymphocytes, part of the immune system, may be reprogrammed to "search and destroy" the threat posed by cancer cells.”
And finally concluded, “This is a very important step toward our long-term goal of developing an affordable and practical vaccine to prevent cancer recurrence.”
Roger Dumoulin-White, Company President and CEO, added, “I am delighted that our scientific and preclinical research teams continue to further understand and validate this effect to allow us to prepare for clinical validation in human patients. Iiiiif we are able to validate the effect in humans, then the implications of this discovery are nothing short of game changing for both Theralase and more importantly for cancer patients.”
Human trials are still in the distance, but these amazing results are building the necessary framework to establish those tests and Theralase has shown itself to have both the management and medical skills and relationships to take this process to commercialization and quite possibly radically impact the sector, giving cancer patients a far less invasive yet thoroughly effective life-saving treatment.
There are hurdles left to be cleared, but the company's path seems pointed toward success and smart investors should be taking note of its continued progress. I know I am.
Theralase was in the news recently when the Toronto-based company announced in the middle of October that it would present its latest research on the destruction of cancer and bacteria at 10th International Symposium on Photodynamic Therapy and Photodiagnosis in Clinical Practice.
Shares climbed 13.43% on the news to $0.38 per share.
Currently there are 82.8m outstanding shares with a market cap of $31.5 million. "
Antwort auf Beitrag Nr.: 48.303.817 von kmastra am 12.11.14 23:46:20"bei ESPR ist ja ganz schön was los! Und schon wieder was gelernt :"
:"
In der Tat. Ich habe aus Vorsichtsgründen meine Position heute verkauft.
Unter Umständen würde ich sie dann vielleicht auch teurer wieder zurück kaufen.
 :"
:"In der Tat. Ich habe aus Vorsichtsgründen meine Position heute verkauft.
Unter Umständen würde ich sie dann vielleicht auch teurer wieder zurück kaufen.
Fibrogen (FGEN):
Heute ist das IPO. Die Aktie kommt zu 18 Dollar.
http://www.fibrogen.com/press/release/pr_1415933799
Heute ist das IPO. Die Aktie kommt zu 18 Dollar.
http://www.fibrogen.com/press/release/pr_1415933799
Habe für 21,51 gekauft. Finde FGEN ist ein klasse IPO.


CLDX:
ReACT-Daten:
http://files.shareholder.com/downloads/ABEA-39HH7S/360244677…
Ich finde das definitiv ermutigend!
Nach wie vor bin ich der Meinung, dass man mit "median OS" Rindo nicht wirklich gerecht werden wird. Bei den PII-Daten war es bisher so, dass die Zahl der Überlebenden in den Rindo-Gruppen sich erst über längere Zeiträume klar ausdifferenziert hat.
Wie auch immer, die Indizien, dass Rindo wirkt und dass es einen Einfluss auf das OS hat sind inzwischen stark.
ReACT-Daten:
http://files.shareholder.com/downloads/ABEA-39HH7S/360244677…
Ich finde das definitiv ermutigend!
Nach wie vor bin ich der Meinung, dass man mit "median OS" Rindo nicht wirklich gerecht werden wird. Bei den PII-Daten war es bisher so, dass die Zahl der Überlebenden in den Rindo-Gruppen sich erst über längere Zeiträume klar ausdifferenziert hat.
Wie auch immer, die Indizien, dass Rindo wirkt und dass es einen Einfluss auf das OS hat sind inzwischen stark.
Antwort auf Beitrag Nr.: 48.326.722 von SLGramann am 14.11.14 22:33:18CLDX:
Präsentation zu ReACT:
http://files.shareholder.com/downloads/ABEA-39HH7S/360866694…
Präsentation zu ReACT:
http://files.shareholder.com/downloads/ABEA-39HH7S/360866694…
Antwort auf Beitrag Nr.: 48.326.929 von SLGramann am 14.11.14 23:09:20Bei Twitter wird ein Imbalance zwischen Verum- und Kontrollgruppe in Bezug auf die vorausgegangenen Rückfälle diskutiert, die das Ergebnis zu Gunsten von Rindo verfälscht haben könnte:

Auch der User shrew hat das im Celldex-Thread hier bei WO bereits angesprochen:
Thread: Celldex - Impfstoffe gegen Krebs
Wenn man aber nur auf die Patienten abstellt, die erst einen Rückfall hatten, dann ergibt sich immer noch eine HR von 0,59 zu Gunsten von Rindo:

Das Ergebnis ist dann also weniger überzeugend (und möglicherweise derzeit auch nicht statistisch signifikant?), aber der Trend ist immer noch sehr deutlich.
Darüber hinaus wiederhole ich nochmals meine Auffassung, dass der Effekt von Rindo ein "long tail"-Effekt ist.
Man wird irgendwann mal das 3-Jahre-OS beurteilen können. In den PII-Studien haben sich da um die 25% ergeben. Im historischen Vergleich ist das viel.

Ich denke, dass Rindo am ehesten mit Ipilimumab zu vergleichen ist. PFS und selbst median OS halte ich hier nicht für die geeignetsten Kriterien.

Auch der User shrew hat das im Celldex-Thread hier bei WO bereits angesprochen:
Thread: Celldex - Impfstoffe gegen Krebs
Wenn man aber nur auf die Patienten abstellt, die erst einen Rückfall hatten, dann ergibt sich immer noch eine HR von 0,59 zu Gunsten von Rindo:

Das Ergebnis ist dann also weniger überzeugend (und möglicherweise derzeit auch nicht statistisch signifikant?), aber der Trend ist immer noch sehr deutlich.
Darüber hinaus wiederhole ich nochmals meine Auffassung, dass der Effekt von Rindo ein "long tail"-Effekt ist.
Man wird irgendwann mal das 3-Jahre-OS beurteilen können. In den PII-Studien haben sich da um die 25% ergeben. Im historischen Vergleich ist das viel.

Ich denke, dass Rindo am ehesten mit Ipilimumab zu vergleichen ist. PFS und selbst median OS halte ich hier nicht für die geeignetsten Kriterien.
@CLDX/SLGramann
Ich verstehe Deinen Punkt hinsichtlich der leicht unterschiedlichen Ausgangsvoraussetzungen der Vergleichsgruppen, das ist sicherlich ernst zu nehmen. Aber es sollte doch leicht möglich sein, in einer verfeinerten Auswertung der Daten nur die Gruppen mit einmaligem Rezidiv zu vergleichen und diejenigen mit zweimaligem Rezidiv auszusondern. Und weil das so einfach sein sollte, unterstelle ich mal, daß CLDX hier nicht stümperhaft ins offene Messer laufen wird und auch diese Betrachtung schon längst nachvollzogen hat. Oder ist dies zu einfach gedacht von einem Laien, vielleicht weil die dann verbleibenden Vergleichsgruppen zu klein wären?
Ich verstehe Deinen Punkt hinsichtlich der leicht unterschiedlichen Ausgangsvoraussetzungen der Vergleichsgruppen, das ist sicherlich ernst zu nehmen. Aber es sollte doch leicht möglich sein, in einer verfeinerten Auswertung der Daten nur die Gruppen mit einmaligem Rezidiv zu vergleichen und diejenigen mit zweimaligem Rezidiv auszusondern. Und weil das so einfach sein sollte, unterstelle ich mal, daß CLDX hier nicht stümperhaft ins offene Messer laufen wird und auch diese Betrachtung schon längst nachvollzogen hat. Oder ist dies zu einfach gedacht von einem Laien, vielleicht weil die dann verbleibenden Vergleichsgruppen zu klein wären?
Antwort auf Beitrag Nr.: 48.329.506 von lawmeetstax am 15.11.14 14:34:34"Oder ist dies zu einfach gedacht von einem Laien, vielleicht weil die dann verbleibenden Vergleichsgruppen zu klein wären?"
Also, ich bin auch nur Laie, aber ich denke, dass das von Dir genau richtig gedacht ist.
Ich verstehe es so, dass das auch schon passiert ist.
Wenn Du Dir die zweite Graphik in meinem Bezugsbeitrag ansiehst, dann steht oben die HR von 0,47 bezogen auf das Gesamtkollektiv.
Direkt darunter hast Du dann die HR für die Patienten mit einmaligem Rezidiv (insgesamt 60 Patienten über beide Gruppen). Die HR beträgt hier 0,59 für die Verum-Gruppe.
Weniger gut, als auf das Gesamtkollektiv bezogen, aber immer noch ein deutlicher Trend.
Alles in allem ist es wieder mal ein Stück schwerer geworden, die seit Jahren ermutigenden Daten von Rindopepimut zu ignorieren.
Also, ich bin auch nur Laie, aber ich denke, dass das von Dir genau richtig gedacht ist.
Ich verstehe es so, dass das auch schon passiert ist.
Wenn Du Dir die zweite Graphik in meinem Bezugsbeitrag ansiehst, dann steht oben die HR von 0,47 bezogen auf das Gesamtkollektiv.
Direkt darunter hast Du dann die HR für die Patienten mit einmaligem Rezidiv (insgesamt 60 Patienten über beide Gruppen). Die HR beträgt hier 0,59 für die Verum-Gruppe.
Weniger gut, als auf das Gesamtkollektiv bezogen, aber immer noch ein deutlicher Trend.
Alles in allem ist es wieder mal ein Stück schwerer geworden, die seit Jahren ermutigenden Daten von Rindopepimut zu ignorieren.
Präsentation von KITE:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Muss man eigentlich mal gesehen haben. Die CAR-Technologie riecht schon nach Revolution. Natürlich bleibt erst mal unklar, wer da wirklich die Nase vorn hat, aber sicher ist Platz für mehrere Player und bei Kite hat sich offenkundig ne Menge Potential versammelt.
Sehr schade, dass Hammer zu dem Unternehmen nicht Stellung nehmen darf. Ich glaube, das gesamte Feld ist heißer, als damals die ADCs. Vielleicht vergleichbar mit PD-1 und Co.
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Muss man eigentlich mal gesehen haben. Die CAR-Technologie riecht schon nach Revolution. Natürlich bleibt erst mal unklar, wer da wirklich die Nase vorn hat, aber sicher ist Platz für mehrere Player und bei Kite hat sich offenkundig ne Menge Potential versammelt.
Sehr schade, dass Hammer zu dem Unternehmen nicht Stellung nehmen darf. Ich glaube, das gesamte Feld ist heißer, als damals die ADCs. Vielleicht vergleichbar mit PD-1 und Co.
Antwort auf Beitrag Nr.: 48.331.864 von SLGramann am 16.11.14 08:30:25
Hallo SLGramann,
dazu passt, dass JUNO jetzt auch ein IPO anstrebt:
http://www.sec.gov/Archives/edgar/data/1594864/0001193125144…
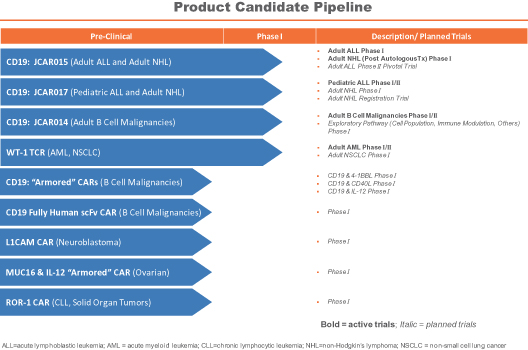
Bei einigen Krebsarten ist der Fortschritt schon jetzt enorm. Am WE gab es neue (?) Daten zu Nivolumab in 1st line Melanoma (BRAF Mutation war ausgeschlossen) die ziemlich beeindruckend sind. Unter Umständen müsste sich die "Kurve" ja sogar mit sinnvollen Kombianationen noch ein Stück nach Oben verschieben lassen...?

SG kmastra
Zitat von SLGramann: Präsentation von KITE:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Muss man eigentlich mal gesehen haben. Die CAR-Technologie riecht schon nach Revolution. Natürlich bleibt erst mal unklar, wer da wirklich die Nase vorn hat, aber sicher ist Platz für mehrere Player und bei Kite hat sich offenkundig ne Menge Potential versammelt.
Sehr schade, dass Hammer zu dem Unternehmen nicht Stellung nehmen darf. Ich glaube, das gesamte Feld ist heißer, als damals die ADCs. Vielleicht vergleichbar mit PD-1 und Co.
Hallo SLGramann,
dazu passt, dass JUNO jetzt auch ein IPO anstrebt:
http://www.sec.gov/Archives/edgar/data/1594864/0001193125144…

Bei einigen Krebsarten ist der Fortschritt schon jetzt enorm. Am WE gab es neue (?) Daten zu Nivolumab in 1st line Melanoma (BRAF Mutation war ausgeschlossen) die ziemlich beeindruckend sind. Unter Umständen müsste sich die "Kurve" ja sogar mit sinnvollen Kombianationen noch ein Stück nach Oben verschieben lassen...?

SG kmastra
Hier im Forum werden ja kaum (Morphosys) Biotechs aus D besprochen, was sicherlich auch mit der mangelnden Qualität der börsennotierten Unternehmen zu tun hat.
Neulich hat der Ex Siemens Vorstand Heinrich von Pierer mal was zur Lage der Biotechs in D geschrieben was ich ganz interessant fand:
http://www.focus.de/finanzen/experten/pierer/biotech-v-piere…
Eine Hauptursache hierfür (Anm: dafür dass D Unternehmen international unbedeutend sind) ist der begrenzte Finanzierungsmarkt für junge Unternehmen in der Frühphase. Junge biotechnologische Firmen sind schlicht unterfinanziert. Zudem fehlt ein funktionierender anschließender IPO-Markt:
Ein gutes Beispiel ist die "Story" von Medigene. Die hatten 2006 ein britisches Unternehmen namens Avidex gekauft. Neben Rhudex verfügte Avidex auch über eine Technik: "Additional drug candidates will originate from the highly innovative monoclonal T cell receptor technology platform (mTCR), on which Avidex already has a partnership with Syngenta AG."
Leider fehlte Medigene das Geld, diese Technologie weiter zu entwickeln (oder sie haben nicht daran geglaubt) und so entschied man sich 2008 (Finanzkrise) dazu, einen Spinoff zu machen aus der die beiden Fimen Immunocore und Adaptimmune hervorgingen. Heute hat Medigene noch ca. 3 % Anteile an Immunocore und 0% an Adaptimmune (vor dem Spinoff gehörte Medigene quasi 100% an beiden Unternehmen!!!)
Schaut man sich heute die beiden Unternehmen (und im Vergleich dazu Medigene ) an, kommt man aus dem Kopfschütteln nicht mehr heraus. Beide Unternehmen sind im Bereich Immunotherapie anzusiedeln und dort zwar immer noch sehr früh aber dennoch erfolgreich unterwegs:
) an, kommt man aus dem Kopfschütteln nicht mehr heraus. Beide Unternehmen sind im Bereich Immunotherapie anzusiedeln und dort zwar immer noch sehr früh aber dennoch erfolgreich unterwegs:
Immunocore: mmTAC technology to spotlight treatments that can marshal the body's T cells to home in on cancer and spare healthy tissue
Immunocore hat Partnerschaften mit Roche, AstraZeneca, GlaxoSmithKline und Eli Lilly!
http://www.fiercebiotech.com/story/immunocore-and-lilly-stri…
Adaptimmune: Adaptimmune's TCR platform is a cousin to CAR-T, a headline-grabbing method in which researchers use targeting mechanisms called chimeric antigen receptors (CARs) to train T cells to bind to proteins expressed by cancer cells. Adaptimmune hat eine weitreichende Partnerschaft mit GlaxoSmithKline.
http://www.fiercebiotech.com/story/adaptimmunes-novel-cancer…
Es ist sicher nicht zu hoch gegriffen, wenn man bei beiden Unternehmen einen Wert von mehreren 100Mio US$ ansetzen würde. Mir ist absolut schleierhaft, wie man einem solchen Spinoff damals zu den Konditionen überhaupt zustimmen konnte.
Meines Erachtens ist Medigene aber dennoch eines der interessanteren Unternehmen aus D. Vielleicht nicht die beste Aktie hat aber sicherlich die beste Story zu bieten. Aber auch als Aktie finde ich Medigene interessant, weil durch die 3% Beteiligung an Immunocore und die Royalties des zugelassenen Medimanets Veregen durchaus reale Werte da sind (zudem evtl. noch zwei verpartnerte Programme in PIII). Aus dem Fehler der Vergangenheit scheint man gelernt zu haben. Man hat mit Trianta wieder ein Unternehmen übernommen, dass im Bereich Immunotherapie tätig ist und durch eine KE nun auch Geld eingesammelt, um die Technik zu entwickeln. Sicherlich kann das langfristig nur mit potenten Pharmapartnern tun. Ich bin hier mit einer kleinen Position dabei in der Hoffnung, dass sich die Geschichte wiederholt bzw. nicht wiederholt.
SG kmastra
Neulich hat der Ex Siemens Vorstand Heinrich von Pierer mal was zur Lage der Biotechs in D geschrieben was ich ganz interessant fand:
http://www.focus.de/finanzen/experten/pierer/biotech-v-piere…
Eine Hauptursache hierfür (Anm: dafür dass D Unternehmen international unbedeutend sind) ist der begrenzte Finanzierungsmarkt für junge Unternehmen in der Frühphase. Junge biotechnologische Firmen sind schlicht unterfinanziert. Zudem fehlt ein funktionierender anschließender IPO-Markt:
Ein gutes Beispiel ist die "Story" von Medigene. Die hatten 2006 ein britisches Unternehmen namens Avidex gekauft. Neben Rhudex verfügte Avidex auch über eine Technik: "Additional drug candidates will originate from the highly innovative monoclonal T cell receptor technology platform (mTCR), on which Avidex already has a partnership with Syngenta AG."
Leider fehlte Medigene das Geld, diese Technologie weiter zu entwickeln (oder sie haben nicht daran geglaubt) und so entschied man sich 2008 (Finanzkrise) dazu, einen Spinoff zu machen aus der die beiden Fimen Immunocore und Adaptimmune hervorgingen. Heute hat Medigene noch ca. 3 % Anteile an Immunocore und 0% an Adaptimmune (vor dem Spinoff gehörte Medigene quasi 100% an beiden Unternehmen!!!)
Schaut man sich heute die beiden Unternehmen (und im Vergleich dazu Medigene
 ) an, kommt man aus dem Kopfschütteln nicht mehr heraus. Beide Unternehmen sind im Bereich Immunotherapie anzusiedeln und dort zwar immer noch sehr früh aber dennoch erfolgreich unterwegs:
) an, kommt man aus dem Kopfschütteln nicht mehr heraus. Beide Unternehmen sind im Bereich Immunotherapie anzusiedeln und dort zwar immer noch sehr früh aber dennoch erfolgreich unterwegs:Immunocore: mmTAC technology to spotlight treatments that can marshal the body's T cells to home in on cancer and spare healthy tissue
Immunocore hat Partnerschaften mit Roche, AstraZeneca, GlaxoSmithKline und Eli Lilly!
http://www.fiercebiotech.com/story/immunocore-and-lilly-stri…
Adaptimmune: Adaptimmune's TCR platform is a cousin to CAR-T, a headline-grabbing method in which researchers use targeting mechanisms called chimeric antigen receptors (CARs) to train T cells to bind to proteins expressed by cancer cells. Adaptimmune hat eine weitreichende Partnerschaft mit GlaxoSmithKline.
http://www.fiercebiotech.com/story/adaptimmunes-novel-cancer…
Es ist sicher nicht zu hoch gegriffen, wenn man bei beiden Unternehmen einen Wert von mehreren 100Mio US$ ansetzen würde. Mir ist absolut schleierhaft, wie man einem solchen Spinoff damals zu den Konditionen überhaupt zustimmen konnte.
Meines Erachtens ist Medigene aber dennoch eines der interessanteren Unternehmen aus D. Vielleicht nicht die beste Aktie hat aber sicherlich die beste Story zu bieten. Aber auch als Aktie finde ich Medigene interessant, weil durch die 3% Beteiligung an Immunocore und die Royalties des zugelassenen Medimanets Veregen durchaus reale Werte da sind (zudem evtl. noch zwei verpartnerte Programme in PIII). Aus dem Fehler der Vergangenheit scheint man gelernt zu haben. Man hat mit Trianta wieder ein Unternehmen übernommen, dass im Bereich Immunotherapie tätig ist und durch eine KE nun auch Geld eingesammelt, um die Technik zu entwickeln. Sicherlich kann das langfristig nur mit potenten Pharmapartnern tun. Ich bin hier mit einer kleinen Position dabei in der Hoffnung, dass sich die Geschichte wiederholt bzw. nicht wiederholt.
SG kmastra
ESPR
"Unter Umständen würde ich sie dann vielleicht auch teurer wieder zurück kaufen."
Sind die Ergebnisse nun deiner Meinung nach gut genug? Was ich bisher gelesen habe, scheinen die Ergebnisse besser zu sein, als man befürchtet hatte.
Meine ESPR Position möchte ich längerfristig halten. Ein Risiko wäre ein totaler Fehlschlag gewesen. So sieht es aber meiner Meinung nach ganz gut aus. ETC-1002 ist zwar noch sehr weit von einer möglichen Zulassung entfernt, doch könnte es irgendwann gut ein Multi-Mrd Blockbuster werden, an dem Pharmas sicherlich Interesse haben werden. Vielleicht steigt ja mittelfristig ein Partner ein, der die PIII finanziert.
http://www.forbes.com/sites/larryhusten/2014/11/17/improve-i…
IMPROVE-IT Meets Endpoint And Demonstrates Real But Modest Clinical Benefit For Ezetimibe
After all the waiting and all the controversy it turned out to be pretty simple. The IMPROVE-IT trial did what it set out to do and reached its primary endpoint. The benefit wasn’t very big or impressive but it will be enough to put to rest concerns that ezetimibe might have been an expensive placebo or that LDL might not be a reliable surrogate endpoint. The IMPROVE-IT results will also provide comfort to companies developing the next generation of cholesterol drugs, since their approval may have depended on validation of LDL as a surrogate endpoint.
...
Primary endpoint events occurred in 34.7% of the control group versus 32.7% of the treatment group, representing a 6.4% reduction in risk (HR 0.936, CI 0.887-0.988, p=0.016). The investigators calculated that 50 patients would need to be treated for seven years to prevent one event. There was no difference between the groups in overall deaths, coronary deaths, or cardiovascular deaths, but there were significant reductions in MI (13%, p =0.002), stroke (14%, p=0.052), and ischemic stroke (21%, p=0.008). The effect was significant across subgroups, except for diabetics, who had a larger benefit than nondiabetics.
...
Cannon added that the trial “reaffirms the LDL hypothesis, that reducing LDL prevents cardiovascular events” and that the results should be incorporated in future guidelines.
...
The result, said James Stein, “makes perfect sense and fits with the physiology just presented last week in the NEJM. Any drug that lowers LDL-C safely, given for a long enough time, will reduce cardiovascular disease risk. The key issues are extent of LDL-C lowering, duration, and baseline level of CVD risk. I am very glad to see these long overdue results as they give us another tool to help prevent heart attacks and strokes. They also help refocus us on the physiology — bad cholesterol — and away from the statin class of drugs as the only treatment for heart disease. It really is about the risk factors. And I can’t emphasize it enough. Anything that lowers LDL-C safely, when used for a long enough amount of time, will reduce CVD risk.”
...
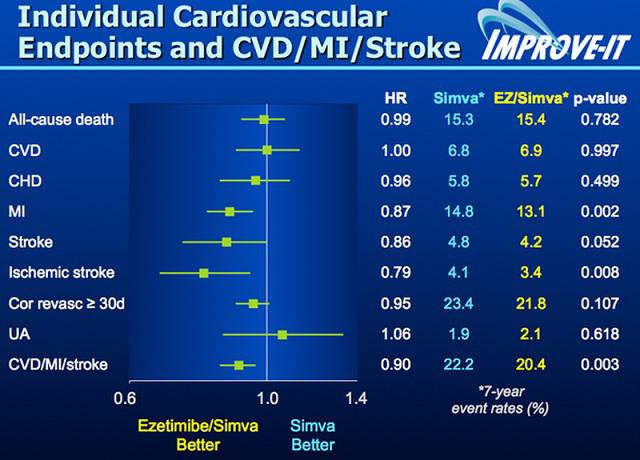
ETC-1002 kann u.a. LDL zusätzlich zu Ezetimibe oder Statinen senken und sollte damit auch einen positiven Effekt haben.

Grüße
ipollit
"Unter Umständen würde ich sie dann vielleicht auch teurer wieder zurück kaufen."
Sind die Ergebnisse nun deiner Meinung nach gut genug? Was ich bisher gelesen habe, scheinen die Ergebnisse besser zu sein, als man befürchtet hatte.
Meine ESPR Position möchte ich längerfristig halten. Ein Risiko wäre ein totaler Fehlschlag gewesen. So sieht es aber meiner Meinung nach ganz gut aus. ETC-1002 ist zwar noch sehr weit von einer möglichen Zulassung entfernt, doch könnte es irgendwann gut ein Multi-Mrd Blockbuster werden, an dem Pharmas sicherlich Interesse haben werden. Vielleicht steigt ja mittelfristig ein Partner ein, der die PIII finanziert.
http://www.forbes.com/sites/larryhusten/2014/11/17/improve-i…
IMPROVE-IT Meets Endpoint And Demonstrates Real But Modest Clinical Benefit For Ezetimibe
After all the waiting and all the controversy it turned out to be pretty simple. The IMPROVE-IT trial did what it set out to do and reached its primary endpoint. The benefit wasn’t very big or impressive but it will be enough to put to rest concerns that ezetimibe might have been an expensive placebo or that LDL might not be a reliable surrogate endpoint. The IMPROVE-IT results will also provide comfort to companies developing the next generation of cholesterol drugs, since their approval may have depended on validation of LDL as a surrogate endpoint.
...
Primary endpoint events occurred in 34.7% of the control group versus 32.7% of the treatment group, representing a 6.4% reduction in risk (HR 0.936, CI 0.887-0.988, p=0.016). The investigators calculated that 50 patients would need to be treated for seven years to prevent one event. There was no difference between the groups in overall deaths, coronary deaths, or cardiovascular deaths, but there were significant reductions in MI (13%, p =0.002), stroke (14%, p=0.052), and ischemic stroke (21%, p=0.008). The effect was significant across subgroups, except for diabetics, who had a larger benefit than nondiabetics.
...
Cannon added that the trial “reaffirms the LDL hypothesis, that reducing LDL prevents cardiovascular events” and that the results should be incorporated in future guidelines.
...
The result, said James Stein, “makes perfect sense and fits with the physiology just presented last week in the NEJM. Any drug that lowers LDL-C safely, given for a long enough time, will reduce cardiovascular disease risk. The key issues are extent of LDL-C lowering, duration, and baseline level of CVD risk. I am very glad to see these long overdue results as they give us another tool to help prevent heart attacks and strokes. They also help refocus us on the physiology — bad cholesterol — and away from the statin class of drugs as the only treatment for heart disease. It really is about the risk factors. And I can’t emphasize it enough. Anything that lowers LDL-C safely, when used for a long enough amount of time, will reduce CVD risk.”
...

ETC-1002 kann u.a. LDL zusätzlich zu Ezetimibe oder Statinen senken und sollte damit auch einen positiven Effekt haben.
Grüße
ipollit
Antwort auf Beitrag Nr.: 47.097.556 von ipollit am 04.06.14 00:23:45CLVS
"A MEK inhibitor, CI-1040, partially restores sensitivity to the EGFR/IGF1R inhibitor combination. Moreover, an IGF1R or MEK inhibitor used in combination with either PF299804 or WZ4002 completely prevents the emergence of drug-resistant clones in this model system."
AZN testet 9291 u.a. auch mit ARRYs MEK Selumetinib."
***
CLVS hat nun konsequenterweise nachgezogen...
http://finance.yahoo.com/news/clovis-oncology-enters-oncolog…
"Clovis Oncology Enters into Oncology Clinical Trial Collaboration with GlaxoSmithKline
Study to evaluate the combination of rociletinib (CO-1686) with trametinib for patients with advanced or metastatic mutant EGFR NSCLC
In preclinical models of T790M+ EGFR mutant NSCLC, acquired resistance to T790M inhibitors can occur through MAPK pathway activation3, and the combination of rociletinib and trametinib has been shown to restore MAPK pathway suppression, resulting in increased anti-tumor activity."
***
Im Sommer ist der Kurs von CLVS deutlich eingebrochen, weil sich gezeigt hat, dass unter Behandlung von Rociletinib Patienten temporär Zuckerkrankheit werden können. Grund dafür ist ein Abbauprodukt von Rociletinib, das IGF1 hemmt. Allerdings kann diese Nebenwirkung auch dazu führen, dass der Krebs schwerer gegen Rociletinib resistent werden kann und die Wirkung von Rociletinib somit u.U. sehr lange anhält.
CLVS will in den nächsten Tagen (EORTC triple meeting in Barcelona, 18-21 Nov) neue Daten zum IGF-Metaboliten präsentieren...
http://seekingalpha.com/article/2671945-clovis-oncologys-clv…
"We do have big data presentations planned for both rucaparib and for 1686 at the EORTC triple meeting in Barcelona next week. So that’s our next big data update...
We see a great opportunity for this drug beyond the T790M positive population. So for the first time at the triple meeting, we’ll be describing early evidence of activity surprisingly in the T790M negative population. So it’s a targeted therapy that was directed at mutant EGFR. We would not have expected to see any amount of activity in the T790M negative population. But at the urging of our clinicians who are participating in the Phase 1 trial, which involves both negative and positive patients in the early dosing, we believe this our signal of activity, it’s driven us to expand that to some extent and for the first time, we’re presenting an update at the 625 dose update in the T790M negative.
It’s not a huge patient group, but it’s growing. And we are enthusiastic enough about it that we’re actually running a study called TIGER-3 that will begin rolling in about two months. We’re looking not only at the T790M positive populations, but we’re enrolling and will be evaluating activity versus chemo in the T790M negative. Clearly, we've seen a signal that we think is attractive.
What's interesting is, there’s nothing about the base drug itself that would cause us to see activity in that patient group. What we think maybe happening is that in some of these patients, because we have a metabolite that as many of you know, is an inhibitor of IGF-1R and the insulin receptor that it’s causing some reemergence of activity from our drug against the activating mutations of EGFR.
So we are enthusiastic about what it means. We clearly are exploring it to put this in context, 60% of the patients are T790M positive, but another 40% are T790M negative. There are no meaningful opportunities to develop drugs in this patient group, because there were multiple driver mutations that cause the development of resistance beyond T790M that are the driver of that in this 40% of patients. There’s no one mutation that any company or we for that matter could target. So we’re excited about what this could mean."
IGF1 kann also theoretisch auch eine positive Wirkung haben... mal schauen.
Wenn ich es richtig verstanden habe, will CLVS Ende des Jahres oder im nächsten Jahr auch Kombi-Studien von Rociletinib mit Checkpoint-Hemmern wie PD-1 AKs in NSCLC starten... PD-1 ist ja in NSCLC auch recht aktiv.

Gruß
ipollit
"A MEK inhibitor, CI-1040, partially restores sensitivity to the EGFR/IGF1R inhibitor combination. Moreover, an IGF1R or MEK inhibitor used in combination with either PF299804 or WZ4002 completely prevents the emergence of drug-resistant clones in this model system."
AZN testet 9291 u.a. auch mit ARRYs MEK Selumetinib."
***
CLVS hat nun konsequenterweise nachgezogen...
http://finance.yahoo.com/news/clovis-oncology-enters-oncolog…
"Clovis Oncology Enters into Oncology Clinical Trial Collaboration with GlaxoSmithKline
Study to evaluate the combination of rociletinib (CO-1686) with trametinib for patients with advanced or metastatic mutant EGFR NSCLC
In preclinical models of T790M+ EGFR mutant NSCLC, acquired resistance to T790M inhibitors can occur through MAPK pathway activation3, and the combination of rociletinib and trametinib has been shown to restore MAPK pathway suppression, resulting in increased anti-tumor activity."
***
Im Sommer ist der Kurs von CLVS deutlich eingebrochen, weil sich gezeigt hat, dass unter Behandlung von Rociletinib Patienten temporär Zuckerkrankheit werden können. Grund dafür ist ein Abbauprodukt von Rociletinib, das IGF1 hemmt. Allerdings kann diese Nebenwirkung auch dazu führen, dass der Krebs schwerer gegen Rociletinib resistent werden kann und die Wirkung von Rociletinib somit u.U. sehr lange anhält.
CLVS will in den nächsten Tagen (EORTC triple meeting in Barcelona, 18-21 Nov) neue Daten zum IGF-Metaboliten präsentieren...
http://seekingalpha.com/article/2671945-clovis-oncologys-clv…
"We do have big data presentations planned for both rucaparib and for 1686 at the EORTC triple meeting in Barcelona next week. So that’s our next big data update...
We see a great opportunity for this drug beyond the T790M positive population. So for the first time at the triple meeting, we’ll be describing early evidence of activity surprisingly in the T790M negative population. So it’s a targeted therapy that was directed at mutant EGFR. We would not have expected to see any amount of activity in the T790M negative population. But at the urging of our clinicians who are participating in the Phase 1 trial, which involves both negative and positive patients in the early dosing, we believe this our signal of activity, it’s driven us to expand that to some extent and for the first time, we’re presenting an update at the 625 dose update in the T790M negative.
It’s not a huge patient group, but it’s growing. And we are enthusiastic enough about it that we’re actually running a study called TIGER-3 that will begin rolling in about two months. We’re looking not only at the T790M positive populations, but we’re enrolling and will be evaluating activity versus chemo in the T790M negative. Clearly, we've seen a signal that we think is attractive.
What's interesting is, there’s nothing about the base drug itself that would cause us to see activity in that patient group. What we think maybe happening is that in some of these patients, because we have a metabolite that as many of you know, is an inhibitor of IGF-1R and the insulin receptor that it’s causing some reemergence of activity from our drug against the activating mutations of EGFR.
So we are enthusiastic about what it means. We clearly are exploring it to put this in context, 60% of the patients are T790M positive, but another 40% are T790M negative. There are no meaningful opportunities to develop drugs in this patient group, because there were multiple driver mutations that cause the development of resistance beyond T790M that are the driver of that in this 40% of patients. There’s no one mutation that any company or we for that matter could target. So we’re excited about what this could mean."
IGF1 kann also theoretisch auch eine positive Wirkung haben... mal schauen.
Wenn ich es richtig verstanden habe, will CLVS Ende des Jahres oder im nächsten Jahr auch Kombi-Studien von Rociletinib mit Checkpoint-Hemmern wie PD-1 AKs in NSCLC starten... PD-1 ist ja in NSCLC auch recht aktiv.
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.326.722 von SLGramann am 14.11.14 22:33:18CLDX
Die ReACT-Daten finde ich sehr schön. Eigentlich habe ich bisher in Rindo keinen wichtigen Kandidaten gesehen, da Krebs-Vakzine bisher keine guten Ergebnisse geliefert haben. Diese Daten sehen aber vielversprechend aus.
Eine Vakzine müsste sich ja auch gut mit IO-Therapien kombinieren lassen. CLDX selber hat ja den CD27-AK
MDVN's PD1 Pidilizumab scheint in GBM wirksam zu sein, BMY hat ein PIII mit Nivo+Ipi gestartet...
https://twitter.com/AndyBiotech/status/530079103681318912
"All too true. But $CLDX running a robust GBM trial in a universe of really bad GBM trials, IMO quite remarkable. 700+ pats
***
stat sig benefit should make this SOC in EGFRvIII. GBM still disease where any progress very important.
***
$BMY is running a 260pts Ph3 trial of nivo or nivo+ipi combo in GBM
http://www.clinicaltrials.gov/ct2/show/NCT02017717
***
$BMY hasn't disclosed but presumably saw something in GBM to move fwd so aggressively vs other indications.
***
$MDVN/CureTech's inferior PD1 Pidilizumab showed some encouraging early data in #GBM:http://neuro-oncology.oxfordjournals.org/content/16/suppl_5/…

Gruß
ipollit
Die ReACT-Daten finde ich sehr schön. Eigentlich habe ich bisher in Rindo keinen wichtigen Kandidaten gesehen, da Krebs-Vakzine bisher keine guten Ergebnisse geliefert haben. Diese Daten sehen aber vielversprechend aus.
Eine Vakzine müsste sich ja auch gut mit IO-Therapien kombinieren lassen. CLDX selber hat ja den CD27-AK
MDVN's PD1 Pidilizumab scheint in GBM wirksam zu sein, BMY hat ein PIII mit Nivo+Ipi gestartet...
https://twitter.com/AndyBiotech/status/530079103681318912
"All too true. But $CLDX running a robust GBM trial in a universe of really bad GBM trials, IMO quite remarkable. 700+ pats
***
stat sig benefit should make this SOC in EGFRvIII. GBM still disease where any progress very important.
***
$BMY is running a 260pts Ph3 trial of nivo or nivo+ipi combo in GBM
http://www.clinicaltrials.gov/ct2/show/NCT02017717
***
$BMY hasn't disclosed but presumably saw something in GBM to move fwd so aggressively vs other indications.
***
$MDVN/CureTech's inferior PD1 Pidilizumab showed some encouraging early data in #GBM:http://neuro-oncology.oxfordjournals.org/content/16/suppl_5/…
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.339.166 von kmastra am 17.11.14 13:14:56KITE, Juno, MGNX
Ich bin mir noch nicht sicher, wie ich CART&Co bewerten soll. Es könnte auch sein, dass diese Therapien so speziell sind, dass sie trotz der hohen Wirkung nur als letztes Mittel zur Anwendung kommen.
Zuletzt habe ich meine MGNX Positon deutlich erhöht. Zum einen sind sie meiner Meinung nach breit aufgestellt:
- ein fc-optimierter HER2-AK der demnächst gegen Brustkrebs in die PIII gehen soll. Ohad Hammer sieht ihn negativ. MGNX hat aber zuletzt die PIII-Pläne geändert, weil sie interessante Ergebnisse gesehen haben in Patienten, die bereits mit mehreren HER2-Mitteln (AKs und ADCs) behandelt worden sind
- neuer IO-AK (B7-H3), für den in den nächsten Monaten erste PI-Daten kommen könnten. Die Indikationen werden schonmal ausgeweitet.
Bezüglich CART setze ich aber vorerst auf MGNX DARTs mit CD3. Das sind keine modifizierten T-Zellen (CARTs) sondern soetwas wie bi-spezifische Mini-AKs bei denen ein Seite an das Target wie z.B. CD19 andockt und die andere Seite mit CD3 T-Zellen bindet und aktiviert.
MGNX will sehr positive präklinische Ergebnisse zu einem neuen CD19xCD3-DART gesehen haben, die demnächst präsentiert werden sollen. Diese sollen angeblich auch gegenüber CD19-CARTs konkurrenzfähig sein. Eine Optimierung soll im Gegensatz zu BITEs nun auch statt einer kontinuierlichen Infusion eine wöchentliche Dosierung erlauben.
Mal schauen...

Gruß
ipollit
Ich bin mir noch nicht sicher, wie ich CART&Co bewerten soll. Es könnte auch sein, dass diese Therapien so speziell sind, dass sie trotz der hohen Wirkung nur als letztes Mittel zur Anwendung kommen.
Zuletzt habe ich meine MGNX Positon deutlich erhöht. Zum einen sind sie meiner Meinung nach breit aufgestellt:
- ein fc-optimierter HER2-AK der demnächst gegen Brustkrebs in die PIII gehen soll. Ohad Hammer sieht ihn negativ. MGNX hat aber zuletzt die PIII-Pläne geändert, weil sie interessante Ergebnisse gesehen haben in Patienten, die bereits mit mehreren HER2-Mitteln (AKs und ADCs) behandelt worden sind
- neuer IO-AK (B7-H3), für den in den nächsten Monaten erste PI-Daten kommen könnten. Die Indikationen werden schonmal ausgeweitet.
Bezüglich CART setze ich aber vorerst auf MGNX DARTs mit CD3. Das sind keine modifizierten T-Zellen (CARTs) sondern soetwas wie bi-spezifische Mini-AKs bei denen ein Seite an das Target wie z.B. CD19 andockt und die andere Seite mit CD3 T-Zellen bindet und aktiviert.
MGNX will sehr positive präklinische Ergebnisse zu einem neuen CD19xCD3-DART gesehen haben, die demnächst präsentiert werden sollen. Diese sollen angeblich auch gegenüber CD19-CARTs konkurrenzfähig sein. Eine Optimierung soll im Gegensatz zu BITEs nun auch statt einer kontinuierlichen Infusion eine wöchentliche Dosierung erlauben.
Mal schauen...
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.340.249 von kmastra am 17.11.14 14:52:24..auch als Aktie finde ich Medigene interessant, weil durch die 3% Beteiligung an Immunocore und die Royalties des zugelassenen Medimanets Veregen durchaus reale Werte da sind (zudem evtl. noch zwei verpartnerte Programme in PIII)..
EndoTag-1 in P3, aber
Rhudex in P2 (Verpartnert an Falk, P2 in PBC soll durch Falk erfolgen)
-
Ansonsten schöner Beitrag von Dir über deutsche Biotechs /u.Medigene.
Hier viele Infos/Analysen zu Medigene http://www.edisoninvestmentresearch.com/research/company/med…
(Latest Researchs anschauen)
u.a.
"..Trianta’s TCRs are broadly similar to chimeric antigen receptor T-cell (CAR-T) therapies that are currently attracting huge amounts of investment and interest.."
Trianta vor Kurzem in Medigene Immunotherapies umbenannt
http://www.medigene.de/presse-investoren/news/pressemitteilu…
Gruß
EndoTag-1 in P3, aber
Rhudex in P2 (Verpartnert an Falk, P2 in PBC soll durch Falk erfolgen)
-
Ansonsten schöner Beitrag von Dir über deutsche Biotechs /u.Medigene.
Hier viele Infos/Analysen zu Medigene http://www.edisoninvestmentresearch.com/research/company/med…
(Latest Researchs anschauen)
u.a.
"..Trianta’s TCRs are broadly similar to chimeric antigen receptor T-cell (CAR-T) therapies that are currently attracting huge amounts of investment and interest.."
Trianta vor Kurzem in Medigene Immunotherapies umbenannt
http://www.medigene.de/presse-investoren/news/pressemitteilu…
Gruß
Antwort auf Beitrag Nr.: 48.345.562 von RichyBerlin am 18.11.14 08:41:02Hallo Richy,
vielen Dank für die Korrektur. Ich dachte Falk würde schon eine PIII starten-wenn sie denn mal was starten...
Grundsätzlich bin ich vor allem bei Endotag skeptisch (startet da überhaupt irgendwann mal die PIII und soweit ich es versteh ist der Ansatz auch eher schon veraltet). Ich spekuliere vor allem darauf, dass Medigene die 3 Immunotherapie Plattformen so weiter entwickelt, dass sie einen Partner finden, der das interessant findet.
Meine grundsätzliche Überlegung ist die, dass man in D zwar ein schlechtes Umfeld für Biotechs hat, dass aber darin vielleicht ja auch eine Chance liegt, weil Aktien im Verhältnis zu den USA eher attraktiv bewertet sind.
In D finde ich noch Wilex interessant. Die Tochterfirma Heidelberg hat eine ADC-Technologie. Vor kurzem erst hat Roche die bestehende Partnerschaft erweitert. Das ist zwar alles sehr spekulativ, weil Wilex im Grunde fast kein Geld mehr hat - aber wenn die Finanzsituation gelöst wird und Roche tatsächlich einen Kandidaten in die Klinik bringt, wäre die Aktie m.E. unterbewertet. Überlege hier auch eine Miniposition einzugehen.
http://www.finanznachrichten.de/nachrichten-2014-10/31676966…
Bleibt zu hoffen, dass Wilex seine Finanzsituation nicht löst, indem sie einen Spinoff von Heidelberg machen...
@ipollit: Vielen Dank für den interessanten Beitrag zu CLVS! Bin sehr gespannt auf die nächsten Tage. Über Twitter war in letzter Zeit bei mir der Eindruck entstanden, dass CLVS wieder "die Nase vorn hat"- ich hoffe das die Erwartungen da jetzt nicht zu hoch sind und entsprechend enttäuscht werden.
Der Deal mit GSK/NOV macht sicherlich Sinn - auch wenn ich insgeheim gehofft hatte, dass ein großer Pharmakonzern auf die Idee kommt CLVS und ARRY gleich mit zu übernehmen. Randnotiz: Wilex hat auch einen MEK-Inhibitor.
SG kmastra
vielen Dank für die Korrektur. Ich dachte Falk würde schon eine PIII starten-wenn sie denn mal was starten...
Grundsätzlich bin ich vor allem bei Endotag skeptisch (startet da überhaupt irgendwann mal die PIII und soweit ich es versteh ist der Ansatz auch eher schon veraltet). Ich spekuliere vor allem darauf, dass Medigene die 3 Immunotherapie Plattformen so weiter entwickelt, dass sie einen Partner finden, der das interessant findet.
Meine grundsätzliche Überlegung ist die, dass man in D zwar ein schlechtes Umfeld für Biotechs hat, dass aber darin vielleicht ja auch eine Chance liegt, weil Aktien im Verhältnis zu den USA eher attraktiv bewertet sind.
In D finde ich noch Wilex interessant. Die Tochterfirma Heidelberg hat eine ADC-Technologie. Vor kurzem erst hat Roche die bestehende Partnerschaft erweitert. Das ist zwar alles sehr spekulativ, weil Wilex im Grunde fast kein Geld mehr hat - aber wenn die Finanzsituation gelöst wird und Roche tatsächlich einen Kandidaten in die Klinik bringt, wäre die Aktie m.E. unterbewertet. Überlege hier auch eine Miniposition einzugehen.
http://www.finanznachrichten.de/nachrichten-2014-10/31676966…
Bleibt zu hoffen, dass Wilex seine Finanzsituation nicht löst, indem sie einen Spinoff von Heidelberg machen...

@ipollit: Vielen Dank für den interessanten Beitrag zu CLVS! Bin sehr gespannt auf die nächsten Tage. Über Twitter war in letzter Zeit bei mir der Eindruck entstanden, dass CLVS wieder "die Nase vorn hat"- ich hoffe das die Erwartungen da jetzt nicht zu hoch sind und entsprechend enttäuscht werden.
Der Deal mit GSK/NOV macht sicherlich Sinn - auch wenn ich insgeheim gehofft hatte, dass ein großer Pharmakonzern auf die Idee kommt CLVS und ARRY gleich mit zu übernehmen. Randnotiz: Wilex hat auch einen MEK-Inhibitor.
SG kmastra
ZFGN:
Ich finde ZFGN macht beim PW-Syndrom einen richtig guten Job. Ich hatte früher mal mit einem jungen Mann zu tun, der das Pw-Syndrom hatte. Sicherlich kann man nicht alle Menschen über einen Kamm scheren aber es war wirklich unglaublich, wie viel Leid vor allem das Nichtkontrollieren-können des Esstriebs (und das daraus folgende für ihn müssen) sowohl beim Menschen selber als auch bei der Familie (Eltern, Geschwister) erzeugt. Eltern müssen oft sowohl Essen als auch den Mülleimer (!) verschließen. Im Leben des Betroffenen kreist sich (Vorsichtig ausgedrückt) sehr viel ums Essen.
Man kann sich vorstellen, dass hier auch erlernte Verhaltensweisen zum Problem beitragen, denn wenn Essen die ganze Zeit rationiert und verboten ist, ist es natürlich auch menschlich, bei Gelegenheit erst recht richtig zuzuschlagen.
Interessant finde ich, wie Zafgen in einer PII Proof of Concept Studie vorgegangen ist- und was dann dabei rauskam:
Similar to results seen in non-PWS obese patient populations, beloranib treatment in this study reduced body fat content by 8.1% vs. placebo in four weeks of treatment at the highest study dose of 1.8 mg, despite a 50% increased daily caloric allowance. Hunger-related behaviors improved, and a trend towards overall improvement in body weight was seen, although this did not reach statistical significance, in part due to the fact that study was not powered to demonstrate these differences. Key hormones, including adiponectin and leptin, also showed changes characteristic of non-PWS obese patients, demonstrating that the drug was highly active in these patients and had a similar effect to that seen in non-PWS patients. (Anmerkung: es waren 17 Teilnehmer in der Studie)
Hier ist m.E. wirklich klug vorgegangen worden, denn grundsätzlich scheint ein umfassender pädagogisch-medizinisch sinnvoll. Zum einen dürfen diese Menschen wieder mehr Essen, was zu einer Entspannung der Situation innerhalb der Familien führen sollte (und vielleicht auch dazu, dass regelrechte Fressattacken verschwinden) und zum anderen wird trotzdem dafür gesorgt, dass diese Menschen möglichst lange leben, indem Fettleibigkeit, Diabetes, LDL etc. vorgebeugt wird.
In der PIII sind dann auch neben dem Verlust an Fett Änderungen bei bestimmten Verhaltensweisen als primärer Endpunkt definiert (Nachts aufstehen um heimlich zu essen, Essensreste aus dem Mülleimer essen etc.) Es wird darüber hinaus auch untersucht, inwieweit die Lebensqaulität der Betroffenen und des (familiären) Umfelds positiv beeinflusst werden!!
Als ZFGN Investor sicherlich auch interessant:
“PWS patients remain severely impacted by their disease and are not treatable with other anti-obesity agents,” added Janalee Heinemann, Director of Research & Medical Affairs for the Prader-Willi Syndrome Association (USA). “PWS represents one of the most severe forms of genetic obesity and we welcome these results, which are a significant step towards finding a treatment for those suffering from this life threatening condition.”
Bei der derzeitigen Bewertung von ZFGN würde ich denken, dass selbst bei einem Erfolg nur bei PW (5000-7000 Patienten in den USA) noch Luft nach Oben ist. Spätere Entwicklungen in Richtung Massenmarkt wären quasi noch oben drauf. Dabei denke ich, dass die Verabreichung per Spritze gar nicht so problematisch wäre, da viele der möglichen Patienten wegen Diabetis eh schon an Spritzen gewohnt wären.
http://ir.zafgen.com/releasedetail.cfm?ReleaseID=849048
http://ir.zafgen.com/releasedetail.cfm?ReleaseID=873930
Hier mal zwei Videos zum Thema PW-Syndrom, wobei man sagen muss, dass der Junge in dem Deutschen Beitrag extrem konsequent und gut erzogen worden zu sein scheint und nicht dem Durchschnitt entspricht. Im anderen Beispiel sieht man das Leben in einem speziellen Heim. Menschen mit dem PW Syndrom können (meines Wissens) auch als Erwachsene nicht selbständig leben. Zudem halten viele Familiensysteme den täglichen Belasungen nicht Stand, so dass auch Kinder in einem Heim untergebracht werden müssen.
Ich finde ZFGN macht beim PW-Syndrom einen richtig guten Job. Ich hatte früher mal mit einem jungen Mann zu tun, der das Pw-Syndrom hatte. Sicherlich kann man nicht alle Menschen über einen Kamm scheren aber es war wirklich unglaublich, wie viel Leid vor allem das Nichtkontrollieren-können des Esstriebs (und das daraus folgende für ihn müssen) sowohl beim Menschen selber als auch bei der Familie (Eltern, Geschwister) erzeugt. Eltern müssen oft sowohl Essen als auch den Mülleimer (!) verschließen. Im Leben des Betroffenen kreist sich (Vorsichtig ausgedrückt) sehr viel ums Essen.
Man kann sich vorstellen, dass hier auch erlernte Verhaltensweisen zum Problem beitragen, denn wenn Essen die ganze Zeit rationiert und verboten ist, ist es natürlich auch menschlich, bei Gelegenheit erst recht richtig zuzuschlagen.
Interessant finde ich, wie Zafgen in einer PII Proof of Concept Studie vorgegangen ist- und was dann dabei rauskam:
Similar to results seen in non-PWS obese patient populations, beloranib treatment in this study reduced body fat content by 8.1% vs. placebo in four weeks of treatment at the highest study dose of 1.8 mg, despite a 50% increased daily caloric allowance. Hunger-related behaviors improved, and a trend towards overall improvement in body weight was seen, although this did not reach statistical significance, in part due to the fact that study was not powered to demonstrate these differences. Key hormones, including adiponectin and leptin, also showed changes characteristic of non-PWS obese patients, demonstrating that the drug was highly active in these patients and had a similar effect to that seen in non-PWS patients. (Anmerkung: es waren 17 Teilnehmer in der Studie)
Hier ist m.E. wirklich klug vorgegangen worden, denn grundsätzlich scheint ein umfassender pädagogisch-medizinisch sinnvoll. Zum einen dürfen diese Menschen wieder mehr Essen, was zu einer Entspannung der Situation innerhalb der Familien führen sollte (und vielleicht auch dazu, dass regelrechte Fressattacken verschwinden) und zum anderen wird trotzdem dafür gesorgt, dass diese Menschen möglichst lange leben, indem Fettleibigkeit, Diabetes, LDL etc. vorgebeugt wird.
In der PIII sind dann auch neben dem Verlust an Fett Änderungen bei bestimmten Verhaltensweisen als primärer Endpunkt definiert (Nachts aufstehen um heimlich zu essen, Essensreste aus dem Mülleimer essen etc.) Es wird darüber hinaus auch untersucht, inwieweit die Lebensqaulität der Betroffenen und des (familiären) Umfelds positiv beeinflusst werden!!
Als ZFGN Investor sicherlich auch interessant:
“PWS patients remain severely impacted by their disease and are not treatable with other anti-obesity agents,” added Janalee Heinemann, Director of Research & Medical Affairs for the Prader-Willi Syndrome Association (USA). “PWS represents one of the most severe forms of genetic obesity and we welcome these results, which are a significant step towards finding a treatment for those suffering from this life threatening condition.”
Bei der derzeitigen Bewertung von ZFGN würde ich denken, dass selbst bei einem Erfolg nur bei PW (5000-7000 Patienten in den USA) noch Luft nach Oben ist. Spätere Entwicklungen in Richtung Massenmarkt wären quasi noch oben drauf. Dabei denke ich, dass die Verabreichung per Spritze gar nicht so problematisch wäre, da viele der möglichen Patienten wegen Diabetis eh schon an Spritzen gewohnt wären.
http://ir.zafgen.com/releasedetail.cfm?ReleaseID=849048
http://ir.zafgen.com/releasedetail.cfm?ReleaseID=873930
Hier mal zwei Videos zum Thema PW-Syndrom, wobei man sagen muss, dass der Junge in dem Deutschen Beitrag extrem konsequent und gut erzogen worden zu sein scheint und nicht dem Durchschnitt entspricht. Im anderen Beispiel sieht man das Leben in einem speziellen Heim. Menschen mit dem PW Syndrom können (meines Wissens) auch als Erwachsene nicht selbständig leben. Zudem halten viele Familiensysteme den täglichen Belasungen nicht Stand, so dass auch Kinder in einem Heim untergebracht werden müssen.
clovis GSK/NVS arry:
Der Deal macht in der Tat Sinn. Vor allem, wenn NVS/GSK oncology davon ausgeht, dass es mit Mekinist, nicht mit MEK162 weitergeht. Meiner Meinung ist das der nächste Hinweis, dass sie anfangen, ohne MEK162 zu planen.
A
Der Deal macht in der Tat Sinn. Vor allem, wenn NVS/GSK oncology davon ausgeht, dass es mit Mekinist, nicht mit MEK162 weitergeht. Meiner Meinung ist das der nächste Hinweis, dass sie anfangen, ohne MEK162 zu planen.
A
Antwort auf Beitrag Nr.: 48.344.746 von ipollit am 17.11.14 23:05:19"ESPR
"Unter Umständen würde ich sie dann vielleicht auch teurer wieder zurück kaufen."
Sind die Ergebnisse nun deiner Meinung nach gut genug? Was ich bisher gelesen habe, scheinen die Ergebnisse besser zu sein, als man befürchtet hatte."
Ja, ich habe die Position (teurer) zurück gekauft und bin jetzt erst mal leicht im Minus. Allerdings war meine vorherige Position sehr deutlich im Plus (über 90%)und ich wollte das Risiko nicht eingehen. Ich denke schon, dass es bei schlechten Ergebnissen doch ziemlich geknallt hätte.
Jetzt sehe ich es wie Du als eine sehr langfristige Position, obschon es auch möglich ist, dass das durch eine Übernahme endet.
Um PCSK9 gibt es ja einen riesen Hype. Alles in allem könnte ESPR aber sogar das bessere bzw. kommerziell aussichtsreichere Produkt in der Mache haben.
"Unter Umständen würde ich sie dann vielleicht auch teurer wieder zurück kaufen."
Sind die Ergebnisse nun deiner Meinung nach gut genug? Was ich bisher gelesen habe, scheinen die Ergebnisse besser zu sein, als man befürchtet hatte."
Ja, ich habe die Position (teurer) zurück gekauft und bin jetzt erst mal leicht im Minus. Allerdings war meine vorherige Position sehr deutlich im Plus (über 90%)und ich wollte das Risiko nicht eingehen. Ich denke schon, dass es bei schlechten Ergebnissen doch ziemlich geknallt hätte.
Jetzt sehe ich es wie Du als eine sehr langfristige Position, obschon es auch möglich ist, dass das durch eine Übernahme endet.
Um PCSK9 gibt es ja einen riesen Hype. Alles in allem könnte ESPR aber sogar das bessere bzw. kommerziell aussichtsreichere Produkt in der Mache haben.
AGIO:
Weiterhin starke Daten:
http://www.fiercebiotech.com/story/agios-offers-another-glim…
Die haben ihren Lauf.
CLVS:
Was ist davon zu halten?
http://finance.yahoo.com/news/interim-data-rociletinib-co-16…
Median PFS of 10.4 months in clinical dose group; data continue to mature
Ist jetzt nicht so ganz toll, oder? Andererseits noch nicht abschließend? Aber der Median steht ja wohl?
Andererseits dann das:
In T790M-negative patients treated with 625mg or 500mg BID, 36% ORR and median PFS of 7.5 months observed
Wie wichtig ist das? Könnte das eventuell richtig bedeutsam werden?
Na ja, mal sehen, was der Markt draus macht...
Weiterhin starke Daten:
http://www.fiercebiotech.com/story/agios-offers-another-glim…
Die haben ihren Lauf.
CLVS:
Was ist davon zu halten?
http://finance.yahoo.com/news/interim-data-rociletinib-co-16…
Median PFS of 10.4 months in clinical dose group; data continue to mature
Ist jetzt nicht so ganz toll, oder? Andererseits noch nicht abschließend? Aber der Median steht ja wohl?
Andererseits dann das:
In T790M-negative patients treated with 625mg or 500mg BID, 36% ORR and median PFS of 7.5 months observed
Wie wichtig ist das? Könnte das eventuell richtig bedeutsam werden?
Na ja, mal sehen, was der Markt draus macht...
Interim Data from Rociletinib (CO-1686) Phase 1/2 Study Shows Compelling and Durable Clinical Activity and Progression-free Survival (PFS) in Patients with EGFR-Mutant Non-small Cell Lung Cancer (NSCLC)
Wednesday, 19 November 2014 10:45 |
- 67% objective response rate (ORR) observed in evaluable heavily-pretreated T790M+ patients treated with 625mg or 500mg BID (clinical dose group)
- Median PFS of 10.4 months in clinical dose group; data continue to mature
- Well-tolerated – majority of treatment-related adverse events are grade 1-2
- In T790M-negative patients treated with 625mg or 500mg BID, 36% ORR and median PFS of 7.5 months observed
- Only TKI shown to spare wild-type EGFR signaling
- U.S. and E.U. regulatory submissions planned in mid-2015
BARCELONA, Spain I November 18, 2014 I Clovis Oncology (NASDAQ:CLVS) announced today updated findings from its ongoing Phase 2 clinical study of rociletinib (CO-1686), the Company’s novel, oral, targeted covalent (irreversible) mutant-selective inhibitor of the epidermal growth factor receptor (EGFR) for the treatment of NSCLC in patients with initial activating EGFR mutations as well as the primary resistance mutation T790M. These data are being presented Friday, November 21 in an oral presentation (Abstract No. LBA 10) by Professor Jean-Charles Soria at the 26th EORTC-NCI-AACR (ENA) Symposium on Molecular Targets and Cancer Therapeutics in Barcelona, Spain.
“I have been involved in the clinical development of rociletinib since the first patient was dosed, and it is gratifying to see the progress made and the data presented at the ENA Symposium today,” said Dr. Jonathan Goldman, Assistant Professor, UCLA Hematology & Oncology, Associate Director of Drug Development and Director of Clinical Trials in Thoracic Oncology. “In particular, the data presented are consistent with my own experience that the 625mg BID dose provides very encouraging efficacy with excellent tolerability. In addition, the early evidence of activity in the T790M negative patients is surprising and may address a remaining unmet medical need for this additional group of patients who have also progressed on initial TKI therapy.”
“These data demonstrate the very encouraging activity and tolerability observed with rociletinib at our go-forward dose of 625mg BID, and our step-down dose of 500mg BID,” said Patrick J. Mahaffy, President and CEO of Clovis Oncology. “We are now expanding beyond our initial focus on T790M-positive patients and are very enthusiastic about our expansion into front-line patients with TIGER-1, and soon, into an all-comer population of patients with acquired TKI resistance, including both T790M-positive and T790M-negative patients with TIGER-3. We are actively preparing for the first of our planned regulatory filings, which include the U.S. NDA and E.U. MAA in mid-2015.”
Two Phase 2 expansion cohorts (known as TIGER-X) are currently enrolling in the United States, Europe, and Australia in EGFR mutant patients with the T790M mutation. Patients in these cohorts are receiving 625mg BID of the intended commercial tablet formulation of rociletinib, and data from these cohorts will form part of the NDA/MAA submission packages. The two cohorts include patients with T790M+ disease either after progression on their first and only TKI therapy, or after progression on their second or later TKI therapy or chemotherapy.
Data from 56 T790M-positive patients treated with rociletinib in the clinical dose group – which includes the recommended Phase 2 dose of 625mg BID (n=30) and the step-down dose of 500mg BID (n=26) – are being presented today, together with data from 11 T790M-negative patients treated at the same doses.
Patients in the clinical dose group were heavily pre-treated prior to receiving rociletinib; 79 percent of patients had immediately progressed on TKI therapy prior to rociletinib treatment. The median number of previous lines of therapy across patients was three.
Evidence of Activity
The objective response rate (ORR) in 27 evaluable T790M-positive patients receiving either 625 or 500mg BID was 67%. The ORR was comparable in the 625mg BID and 500mg BID dose groups. The disease control rate was 89% for the clinical dose group, and again, was consistent across doses. The median PFS for the clinical dose group was 10.4 months, with follow-up for some patients exceeding one year.
In 11 evaluable T790M-negative patients treated at 625 or 500mg BID, a 36% ORR and median PFS of 7.5 months were observed. This activity in the non-target T790M-negative patient group is surprising and may, in part, relate to the inhibition of IGF1-R (insulin growth factor receptor 1) by a metabolite of rociletinib. In addition to Clovis’ other clinical trials focused on newly-diagnosed EGFR-mutant NSCLC patients in TIGER-1 and T790M-positive patients in TIGER-X and TIGER-2, the Company is now exploring treatment of the T790M-negative population in its TIGER-3 comparative study versus chemotherapy, which includes both T790M-positive and –negative patients. Forty percent of patients who progress on TKI therapy do so for reasons other than the T790M mutation, and this represents a serious unmet medical need.
Safety and Tolerability
Data presented at ENA demonstrate that rociletinib is well-tolerated, with no evidence of systemic wild-type EGFR inhibition. The most common treatment-related adverse events (AEs) reported in ≥15 percent of all patients included: hyperglycemia, diarrhea, nausea, and reduced appetite. Most adverse events were grade 1 or 2 in severity. The only grade 3/4 treatment-related adverse event observed in more than one patient was hyperglycemia (14 percent). Hyperglycemia, when observed and requiring treatment, is typically managed with a commonly-prescribed single oral agent.
CO-1686 Clinical Development
Clovis is currently enrolling several studies in EGFR-mutant NSCLC in addition to the TIGER-X expansion cohorts noted above:
The TIGER-2 study is currently enrolling patients with EGFR-mutant NSCLC with a centrally-confirmed T790M mutation directly after progression on their first and only TKI therapy. Patients receive rociletinib at the recommended Phase 2 dose (RP2D) of 625mg BID. The primary study endpoint is overall response rate; secondary endpoints include duration of response, progression-free survival, overall survival, and safety. This global study includes, for the first time, patients from Asian countries including South Korea, Taiwan and Hong Kong.
The TIGER-1 study is a randomized Phase 2/3 registration study of rociletinib vs. erlotinib in newly-diagnosed EGFR-mutant patients. The Phase 2 portion of the study will enroll 200 patients. Upon completion of enrollment of the Phase 2 portion of the study, the Phase 3 portion of the study will immediately follow. The Phase 3 portion is a blinded study and the sizing will be determined in part by the initial data from the Phase 2 portion of the study. Study sites are currently enrolling in the U.S. and will enroll soon in Europe,Australia and Asia.
The TIGER-3 study is an international, randomized, comparative study of rociletinib versus chemotherapy in T790M-positive and T790M-negative patients with EGFR-mutant NSCLC and acquired TKI resistance, which is expected to initiate in the next few months. As well as measuring efficacy in T790M-positive patients, this study will explore whether rociletinib activity in all-comers, including T790M-negative patients, is superior to single-agent chemotherapy, the current standard of care.
For more information, please visit www.tigertrials.com.
In addition, a Phase 1 study of rociletinib is underway in Japan and an expansion cohort is currently enrolling at 625mg BID to confirm a global recommended Phase 2 dose (RP2D).
Data from the TIGER-X expansion cohorts, combined with data from TIGER-2, are expected to serve as the basis of a U.S. NDA and E.U. MAA for rociletinib in mid-2015.
Presentation Details
The presentation, titled “Interim phase 2 results with the irreversible, mutant selective, EGFR inhibitor rociletinib (CO-1686)” is being presented on Friday, November 21, during Plenary Session 8, from 11:00 to 13:00 CET.
Event Webcast Details
Clovis will host an investor/analyst webcast conference call following the rociletinib data presentation at ENA Friday, November 21 from 14:00 to 15:00 CET. Dial in information for the U.S. is 877 280 4960 and International is 857 244 7317. The passcode is 78436017. The event will be simultaneously webcast on the Company’s web site at www.clovisoncology.com, and archived for future review.
About Rociletinib
Rociletinib is an oral, potent, mutant-selective inhibitor of epidermal growth factor receptor (EGFR) under investigation for the treatment of EGFR mutated non-small cell lung cancer (NSCLC). Rociletinib targets the activating mutations to EGFR (L858R and Del19), while also inhibiting the primary resistance mutation, T790M, which develops in 60 percent of patients treated with first- and second-generation EGFR inhibitors.
As reported at ASCO earlier this year, rociletinib has demonstrated compelling efficacy in a heavily pre-treated, Western population of patients with acquired resistance to currently available EGFR inhibitors. In clinical trials to date, rociletinib is well-tolerated, without evidence of systemic wild-type EGFR inhibition. The most common adverse events were nausea, hyperglycemia, diarrhea, vomiting and decreased appetite, and these were mostly grade 1 or 2 in severity. The most common grade 3 adverse event was hyperglycemia. Inhibition of wild-type EGFR is associated with cutaneous (and other) toxicities such as acneiform rash, stomatitis and paronychia, all of which may significantly impact patients’ quality of life and result in treatment discontinuation and patient distress. Clovis believes the lack of wild-type EGFR inhibition in rociletinib’s clinical profile represents a significant point of differentiation from approved EGFR inhibitors and those currently in clinical development. In May of 2014, the U.S. FDA granted Breakthrough Therapy designation for rociletinib as treatment for mutant NSCLC in patients with the T790M mutation after progression on EGFR-directed therapy.
About EGFR and Lung Cancer
Lung cancer is the most common cancer worldwide with 1.7 million new cases annually, with NSCLC accounting for almost 85 percent of all lung cancers. NSCLC progresses rapidly with a five-year survival rate in advanced NSCLC patients of less than five percent. EGFR activating mutations occur in approximately 10 to 15 percent of NSCLC cases in Caucasian patients and approximately 30 to 35 percent in Asian patients. These patients experience significant tumor response currently approved EGFR inhibitors which are first-generation EGFR inhibitors. However, most patients ultimately progress on these therapies, with approximately 60 percent of patients developing acquired resistance from a second, or “gatekeeper” mutation, T790M.
About Clovis Oncology
Clovis Oncology, Inc. is a biopharmaceutical company focused on acquiring, developing and commercializing innovative anti-cancer agents in the U.S., Europe and additional international markets. Clovis Oncology targets development programs at specific subsets of cancer populations, and simultaneously develops diagnostic tools that direct a compound in development to the population that is most likely to benefit from its use. Clovis Oncology is headquartered in Boulder, Colorado.
SOURCE: Clovis Oncology
Wednesday, 19 November 2014 10:45 |
- 67% objective response rate (ORR) observed in evaluable heavily-pretreated T790M+ patients treated with 625mg or 500mg BID (clinical dose group)
- Median PFS of 10.4 months in clinical dose group; data continue to mature
- Well-tolerated – majority of treatment-related adverse events are grade 1-2
- In T790M-negative patients treated with 625mg or 500mg BID, 36% ORR and median PFS of 7.5 months observed
- Only TKI shown to spare wild-type EGFR signaling
- U.S. and E.U. regulatory submissions planned in mid-2015
BARCELONA, Spain I November 18, 2014 I Clovis Oncology (NASDAQ:CLVS) announced today updated findings from its ongoing Phase 2 clinical study of rociletinib (CO-1686), the Company’s novel, oral, targeted covalent (irreversible) mutant-selective inhibitor of the epidermal growth factor receptor (EGFR) for the treatment of NSCLC in patients with initial activating EGFR mutations as well as the primary resistance mutation T790M. These data are being presented Friday, November 21 in an oral presentation (Abstract No. LBA 10) by Professor Jean-Charles Soria at the 26th EORTC-NCI-AACR (ENA) Symposium on Molecular Targets and Cancer Therapeutics in Barcelona, Spain.
“I have been involved in the clinical development of rociletinib since the first patient was dosed, and it is gratifying to see the progress made and the data presented at the ENA Symposium today,” said Dr. Jonathan Goldman, Assistant Professor, UCLA Hematology & Oncology, Associate Director of Drug Development and Director of Clinical Trials in Thoracic Oncology. “In particular, the data presented are consistent with my own experience that the 625mg BID dose provides very encouraging efficacy with excellent tolerability. In addition, the early evidence of activity in the T790M negative patients is surprising and may address a remaining unmet medical need for this additional group of patients who have also progressed on initial TKI therapy.”
“These data demonstrate the very encouraging activity and tolerability observed with rociletinib at our go-forward dose of 625mg BID, and our step-down dose of 500mg BID,” said Patrick J. Mahaffy, President and CEO of Clovis Oncology. “We are now expanding beyond our initial focus on T790M-positive patients and are very enthusiastic about our expansion into front-line patients with TIGER-1, and soon, into an all-comer population of patients with acquired TKI resistance, including both T790M-positive and T790M-negative patients with TIGER-3. We are actively preparing for the first of our planned regulatory filings, which include the U.S. NDA and E.U. MAA in mid-2015.”
Two Phase 2 expansion cohorts (known as TIGER-X) are currently enrolling in the United States, Europe, and Australia in EGFR mutant patients with the T790M mutation. Patients in these cohorts are receiving 625mg BID of the intended commercial tablet formulation of rociletinib, and data from these cohorts will form part of the NDA/MAA submission packages. The two cohorts include patients with T790M+ disease either after progression on their first and only TKI therapy, or after progression on their second or later TKI therapy or chemotherapy.
Data from 56 T790M-positive patients treated with rociletinib in the clinical dose group – which includes the recommended Phase 2 dose of 625mg BID (n=30) and the step-down dose of 500mg BID (n=26) – are being presented today, together with data from 11 T790M-negative patients treated at the same doses.
Patients in the clinical dose group were heavily pre-treated prior to receiving rociletinib; 79 percent of patients had immediately progressed on TKI therapy prior to rociletinib treatment. The median number of previous lines of therapy across patients was three.
Evidence of Activity
The objective response rate (ORR) in 27 evaluable T790M-positive patients receiving either 625 or 500mg BID was 67%. The ORR was comparable in the 625mg BID and 500mg BID dose groups. The disease control rate was 89% for the clinical dose group, and again, was consistent across doses. The median PFS for the clinical dose group was 10.4 months, with follow-up for some patients exceeding one year.
In 11 evaluable T790M-negative patients treated at 625 or 500mg BID, a 36% ORR and median PFS of 7.5 months were observed. This activity in the non-target T790M-negative patient group is surprising and may, in part, relate to the inhibition of IGF1-R (insulin growth factor receptor 1) by a metabolite of rociletinib. In addition to Clovis’ other clinical trials focused on newly-diagnosed EGFR-mutant NSCLC patients in TIGER-1 and T790M-positive patients in TIGER-X and TIGER-2, the Company is now exploring treatment of the T790M-negative population in its TIGER-3 comparative study versus chemotherapy, which includes both T790M-positive and –negative patients. Forty percent of patients who progress on TKI therapy do so for reasons other than the T790M mutation, and this represents a serious unmet medical need.
Safety and Tolerability
Data presented at ENA demonstrate that rociletinib is well-tolerated, with no evidence of systemic wild-type EGFR inhibition. The most common treatment-related adverse events (AEs) reported in ≥15 percent of all patients included: hyperglycemia, diarrhea, nausea, and reduced appetite. Most adverse events were grade 1 or 2 in severity. The only grade 3/4 treatment-related adverse event observed in more than one patient was hyperglycemia (14 percent). Hyperglycemia, when observed and requiring treatment, is typically managed with a commonly-prescribed single oral agent.
CO-1686 Clinical Development
Clovis is currently enrolling several studies in EGFR-mutant NSCLC in addition to the TIGER-X expansion cohorts noted above:
The TIGER-2 study is currently enrolling patients with EGFR-mutant NSCLC with a centrally-confirmed T790M mutation directly after progression on their first and only TKI therapy. Patients receive rociletinib at the recommended Phase 2 dose (RP2D) of 625mg BID. The primary study endpoint is overall response rate; secondary endpoints include duration of response, progression-free survival, overall survival, and safety. This global study includes, for the first time, patients from Asian countries including South Korea, Taiwan and Hong Kong.
The TIGER-1 study is a randomized Phase 2/3 registration study of rociletinib vs. erlotinib in newly-diagnosed EGFR-mutant patients. The Phase 2 portion of the study will enroll 200 patients. Upon completion of enrollment of the Phase 2 portion of the study, the Phase 3 portion of the study will immediately follow. The Phase 3 portion is a blinded study and the sizing will be determined in part by the initial data from the Phase 2 portion of the study. Study sites are currently enrolling in the U.S. and will enroll soon in Europe,Australia and Asia.
The TIGER-3 study is an international, randomized, comparative study of rociletinib versus chemotherapy in T790M-positive and T790M-negative patients with EGFR-mutant NSCLC and acquired TKI resistance, which is expected to initiate in the next few months. As well as measuring efficacy in T790M-positive patients, this study will explore whether rociletinib activity in all-comers, including T790M-negative patients, is superior to single-agent chemotherapy, the current standard of care.
For more information, please visit www.tigertrials.com.
In addition, a Phase 1 study of rociletinib is underway in Japan and an expansion cohort is currently enrolling at 625mg BID to confirm a global recommended Phase 2 dose (RP2D).
Data from the TIGER-X expansion cohorts, combined with data from TIGER-2, are expected to serve as the basis of a U.S. NDA and E.U. MAA for rociletinib in mid-2015.
Presentation Details
The presentation, titled “Interim phase 2 results with the irreversible, mutant selective, EGFR inhibitor rociletinib (CO-1686)” is being presented on Friday, November 21, during Plenary Session 8, from 11:00 to 13:00 CET.
Event Webcast Details
Clovis will host an investor/analyst webcast conference call following the rociletinib data presentation at ENA Friday, November 21 from 14:00 to 15:00 CET. Dial in information for the U.S. is 877 280 4960 and International is 857 244 7317. The passcode is 78436017. The event will be simultaneously webcast on the Company’s web site at www.clovisoncology.com, and archived for future review.
About Rociletinib
Rociletinib is an oral, potent, mutant-selective inhibitor of epidermal growth factor receptor (EGFR) under investigation for the treatment of EGFR mutated non-small cell lung cancer (NSCLC). Rociletinib targets the activating mutations to EGFR (L858R and Del19), while also inhibiting the primary resistance mutation, T790M, which develops in 60 percent of patients treated with first- and second-generation EGFR inhibitors.
As reported at ASCO earlier this year, rociletinib has demonstrated compelling efficacy in a heavily pre-treated, Western population of patients with acquired resistance to currently available EGFR inhibitors. In clinical trials to date, rociletinib is well-tolerated, without evidence of systemic wild-type EGFR inhibition. The most common adverse events were nausea, hyperglycemia, diarrhea, vomiting and decreased appetite, and these were mostly grade 1 or 2 in severity. The most common grade 3 adverse event was hyperglycemia. Inhibition of wild-type EGFR is associated with cutaneous (and other) toxicities such as acneiform rash, stomatitis and paronychia, all of which may significantly impact patients’ quality of life and result in treatment discontinuation and patient distress. Clovis believes the lack of wild-type EGFR inhibition in rociletinib’s clinical profile represents a significant point of differentiation from approved EGFR inhibitors and those currently in clinical development. In May of 2014, the U.S. FDA granted Breakthrough Therapy designation for rociletinib as treatment for mutant NSCLC in patients with the T790M mutation after progression on EGFR-directed therapy.
About EGFR and Lung Cancer
Lung cancer is the most common cancer worldwide with 1.7 million new cases annually, with NSCLC accounting for almost 85 percent of all lung cancers. NSCLC progresses rapidly with a five-year survival rate in advanced NSCLC patients of less than five percent. EGFR activating mutations occur in approximately 10 to 15 percent of NSCLC cases in Caucasian patients and approximately 30 to 35 percent in Asian patients. These patients experience significant tumor response currently approved EGFR inhibitors which are first-generation EGFR inhibitors. However, most patients ultimately progress on these therapies, with approximately 60 percent of patients developing acquired resistance from a second, or “gatekeeper” mutation, T790M.
About Clovis Oncology
Clovis Oncology, Inc. is a biopharmaceutical company focused on acquiring, developing and commercializing innovative anti-cancer agents in the U.S., Europe and additional international markets. Clovis Oncology targets development programs at specific subsets of cancer populations, and simultaneously develops diagnostic tools that direct a compound in development to the population that is most likely to benefit from its use. Clovis Oncology is headquartered in Boulder, Colorado.
SOURCE: Clovis Oncology
arry MEK:
interessante Perspektive für MEK Inhibitoren
http://www.news-medical.net/news/20141118/New-research-sugge…
New research explains how thiazolidinediones work to improve glucose metabolism, suggests potential role for MEK inhibitors in diabetes
A research team led by Brigham and Women's Hospital (BWH) and Dana-Farber Cancer Institute (DFCI) has uncovered surprising new findings that underscore the role of an important signaling pathway, already known to be critical in cancer, in the development of type 2 diabetes. Their results, published in the November 17, 2014 advance online issue of the journal Nature, shed additional light on how a longstanding class of diabetes drugs, known as thiazolidinediones (TZDs), work to improve glucose metabolism and suggest that inhibitors of the signaling pathway -- known as the MEK/ERK pathway -- may also hold promise in the treatment of type 2 diabetes.
"It's been recognized that thiazolidinediones have tremendous benefits in the treatment of type 2 diabetes, but they also have significant risks," said Alexander S. Banks, PhD, lead author and a researcher in the Division of Endocrinology, Diabetes and Hypertension at BWH. "The question is, can we minimize these adverse effects by modifying the drugs slightly or by approaching the pathway from a different direction?"
This hypothesis led Banks and DFCI's Bruce Spiegelman, PhD, a researcher in the department of Cancer Biology at Dana-Farber, to focus on a critical molecular player known as CDK5. A type of enzyme known as a kinase, CDK modifies a key site on the molecule targeted by TZDs (known as PPARγ). To further understand CDK5's role, Banks and his colleagues created a special strain of mice lacking CDK5 in adipose tissues --where PPARγ is most highly active and TZDs are thought to act.
Instead of confirming their initial suspicions about CDK5, the team's results pointed them in a very different direction: their findings suggested that another key kinase was involved. In collaboration with researchers at Harvard Medical School, Banks, Spiegelman and their colleagues conducted a wide, unbiased search to determine its identity. That search ultimately led them to the kinase known as ERK.
After a detailed biochemical study of ERK function, the team set out to test its role in glucose metabolism, and found that MEK inhibitors, which block ERK function, significantly improve insulin resistance in mouse models of diabetes.
"A new class of drugs, aimed primarily at cancer, has been developed that inhibits ERK's action. These drugs, known as MEK inhibitors, help to extend the lives of patients with advanced cases of melanoma," said Banks. "One of the most exciting aspects of this paper is the concept that you could inhibit the abnormal activation of ERK seen in diabetes using these MEK inhibitors designed for treating cancer, but at lower, safer doses."
"All attempts to develop new therapeutics will carry risks, but the opportunities here certainly seem worth exploring in the clinic," said Spiegelman.
While much more work must be done to determine if MEK inhibitors will be a safe and effective treatment for type 2 diabetes, the Nature study offers an important window on the molecular underpinnings of TZD action. In addition, it suggests that MEK/ERK inhibition may offer a viable route toward minimizing the drugs' undesired effects.
interessante Perspektive für MEK Inhibitoren
http://www.news-medical.net/news/20141118/New-research-sugge…
New research explains how thiazolidinediones work to improve glucose metabolism, suggests potential role for MEK inhibitors in diabetes
A research team led by Brigham and Women's Hospital (BWH) and Dana-Farber Cancer Institute (DFCI) has uncovered surprising new findings that underscore the role of an important signaling pathway, already known to be critical in cancer, in the development of type 2 diabetes. Their results, published in the November 17, 2014 advance online issue of the journal Nature, shed additional light on how a longstanding class of diabetes drugs, known as thiazolidinediones (TZDs), work to improve glucose metabolism and suggest that inhibitors of the signaling pathway -- known as the MEK/ERK pathway -- may also hold promise in the treatment of type 2 diabetes.
"It's been recognized that thiazolidinediones have tremendous benefits in the treatment of type 2 diabetes, but they also have significant risks," said Alexander S. Banks, PhD, lead author and a researcher in the Division of Endocrinology, Diabetes and Hypertension at BWH. "The question is, can we minimize these adverse effects by modifying the drugs slightly or by approaching the pathway from a different direction?"
This hypothesis led Banks and DFCI's Bruce Spiegelman, PhD, a researcher in the department of Cancer Biology at Dana-Farber, to focus on a critical molecular player known as CDK5. A type of enzyme known as a kinase, CDK modifies a key site on the molecule targeted by TZDs (known as PPARγ). To further understand CDK5's role, Banks and his colleagues created a special strain of mice lacking CDK5 in adipose tissues --where PPARγ is most highly active and TZDs are thought to act.
Instead of confirming their initial suspicions about CDK5, the team's results pointed them in a very different direction: their findings suggested that another key kinase was involved. In collaboration with researchers at Harvard Medical School, Banks, Spiegelman and their colleagues conducted a wide, unbiased search to determine its identity. That search ultimately led them to the kinase known as ERK.
After a detailed biochemical study of ERK function, the team set out to test its role in glucose metabolism, and found that MEK inhibitors, which block ERK function, significantly improve insulin resistance in mouse models of diabetes.
"A new class of drugs, aimed primarily at cancer, has been developed that inhibits ERK's action. These drugs, known as MEK inhibitors, help to extend the lives of patients with advanced cases of melanoma," said Banks. "One of the most exciting aspects of this paper is the concept that you could inhibit the abnormal activation of ERK seen in diabetes using these MEK inhibitors designed for treating cancer, but at lower, safer doses."
"All attempts to develop new therapeutics will carry risks, but the opportunities here certainly seem worth exploring in the clinic," said Spiegelman.
While much more work must be done to determine if MEK inhibitors will be a safe and effective treatment for type 2 diabetes, the Nature study offers an important window on the molecular underpinnings of TZD action. In addition, it suggests that MEK/ERK inhibition may offer a viable route toward minimizing the drugs' undesired effects.
Antwort auf Beitrag Nr.: 48.355.735 von SLGramann am 19.11.14 07:32:49AGIO, CLVS:
Mit Blick auf die Marktkapitalisierung beider Unternehmen kann ich beide Kursreaktionen gestern nur als hysterisch bezeichnen.
Ich kann gut verstehen, dass Hammer in seinem nächsten Update am Sonntag voraussichtlich seine CLVS-Position ausweiten wird.
Mit Blick auf die Marktkapitalisierung beider Unternehmen kann ich beide Kursreaktionen gestern nur als hysterisch bezeichnen.
Ich kann gut verstehen, dass Hammer in seinem nächsten Update am Sonntag voraussichtlich seine CLVS-Position ausweiten wird.
Antwort auf Beitrag Nr.: 48.365.981 von SLGramann am 20.11.14 07:49:27
Was CLVS betrifft sehe ich das genauso. Die Reaktion ist irrational - aber es war irgendwie fast klar, dass es dann so kommt. Es ist die eine Sache was man da nun wirklich draus ableiten kann und eine ganz andere Sache ist, was die Börse dann draus macht. Komischerweise konzentriert man sich vor allem auf das (scheinbar) Negative (PFS) und vergisst dabei das Positive (Nebenwirkungen, Nachweis über wiken auch bei T790M-). Zudem wird in Kommentaren und Berichten (von sonst m.E. besonnenen Schreibern) so getan, als hätte CLVS nicht noch 2 weitere "Eisen im Feuer". Logischerweise kann man die Studienergebnisse auch nicht 1 zu 1 vergleichen. Ein m.E. durchaus gescheiter Schreiber weist darauf hin, dass CLVS schwierigere Patienten rekrutiert hat als AZN. Hier mal ein paar Links (die bestimmt bekannt sind aber trotzdem):
http://www.thestreet.com/story/12959527/1/clovis-lung-cancer…
http://www.ecco-org.eu/Global/News/ENA-2014-PR/2014/11/Trial…
http://seekingalpha.com/article/2695385-cominus-1686-data-co…
Gestern kamen sehr spät zudem noch Ergebnisse zu Rucaparib:
http://phx.corporate-ir.net/phoenix.zhtml?c=247187&p=irol-ne…
Diese sind, soweit ich es verstehe, doch nicht nur positiv für CLVS sondern auch für FMI, da eine weitere Gruppe gefunden werden konnte, die auf das Medikament anspricht. Die Kursreaktion heute dürfte interessant werden...
Zitat von SLGramann: AGIO, CLVS:
Mit Blick auf die Marktkapitalisierung beider Unternehmen kann ich beide Kursreaktionen gestern nur als hysterisch bezeichnen.
Ich kann gut verstehen, dass Hammer in seinem nächsten Update am Sonntag voraussichtlich seine CLVS-Position ausweiten wird.
Was CLVS betrifft sehe ich das genauso. Die Reaktion ist irrational - aber es war irgendwie fast klar, dass es dann so kommt. Es ist die eine Sache was man da nun wirklich draus ableiten kann und eine ganz andere Sache ist, was die Börse dann draus macht. Komischerweise konzentriert man sich vor allem auf das (scheinbar) Negative (PFS) und vergisst dabei das Positive (Nebenwirkungen, Nachweis über wiken auch bei T790M-). Zudem wird in Kommentaren und Berichten (von sonst m.E. besonnenen Schreibern) so getan, als hätte CLVS nicht noch 2 weitere "Eisen im Feuer". Logischerweise kann man die Studienergebnisse auch nicht 1 zu 1 vergleichen. Ein m.E. durchaus gescheiter Schreiber weist darauf hin, dass CLVS schwierigere Patienten rekrutiert hat als AZN. Hier mal ein paar Links (die bestimmt bekannt sind aber trotzdem):
http://www.thestreet.com/story/12959527/1/clovis-lung-cancer…
http://www.ecco-org.eu/Global/News/ENA-2014-PR/2014/11/Trial…
http://seekingalpha.com/article/2695385-cominus-1686-data-co…
Gestern kamen sehr spät zudem noch Ergebnisse zu Rucaparib:
http://phx.corporate-ir.net/phoenix.zhtml?c=247187&p=irol-ne…
Diese sind, soweit ich es verstehe, doch nicht nur positiv für CLVS sondern auch für FMI, da eine weitere Gruppe gefunden werden konnte, die auf das Medikament anspricht. Die Kursreaktion heute dürfte interessant werden...
ein Doppelschreiben
soweit ich es verstehe dürften die Chancen auf ein Blockbuster Medikament nicht so schlecht liegen
ZS Pharma - LifeSci Advisors Update, ZS-9 is 'Poised to Change the Treatment of Hyperkalemia'; Summary of KOL Event - Nov 21, 2014
- Jerry Isaacson, Ph.D.(AC) -
- On November 19th, ZS Pharma (NasdaqGM: ZSPH) hosted a Research and Development day that featured three Key Opinion Leaders (KOLs) from the specialties expected to prescribe ZS-9, an Emergency Medicine physician, a Cardiologist, and a Nephrologist. ZS-9 is being developed to treat hyperkalemia, or excess potassium, with NDA and MAA filings expected in the first half of 2015. Based on their compelling presentations, we came away from the event especially impressed with ZS-9’s rapid onset of action, tolerability profile, and potential for ZS-9 to manage both acute and chronic cases of hyperkalemia, without the safety issues related to current treatments. There are approximately 4 million patients in the US with hyperkalemia, and we estimate that the market opportunity significantly exceeds $1 billion annually in the US alone.
Strong Clinical Data Package Supports Acute and Chronic Hyperkalemia Treatment. ZS Pharma has completed 4 clinical trials with potassium (K+) binder ZS-9, meeting the primary endpoints in all studies. The data consistently demonstrate ZS-9’s ability to safely and rapidly lower serum K+ levels and maintain normokalemia (potassium of 3.5-5 mEq/L). In the most recent trial, the median time to serum K+ normalization was 2.17 hours with greater than 90% of patients receiving 10 or 15 grams of ZS-9 maintained normokalemia for 3 weeks. A 1-year safety study (ZS005) is ongoing. Company management noted that based on extensive discussions with US and European regulators, if ZS Pharma continues to meet trial endpoints, the data would support a label that includes acute and chronic hyperkalemia.
ZS-9 "will" be Revolutionary for the Acute Treatment of Hyperkalemia. Dr. Frank Peacock, an emergency room physician at the largest ER in Houston, TX, discussed the treatment path for an average patient with acute hyperkalemia. His emergency department has extensive experience treating hyperkalemia and sees 30 hyperkalemic patients on a typical day. Most methods for managing serum potassium are temporary and patients ultimately require emergency dialysis. However, the availability of a safe and effective solution to reduce serum potassium rapidly could not only replace existing therapies, but also potentially eliminate the need for emergency dialysis. As the agent with the fastest onset of action, ZS-9 would be very likely be the exclusive agent on his hospital formulary. Importantly, 50% of hyperkalemia patients are first diagnosed in the ER. This represents an entry point for ZS-9 where patients receive initial treatment to normalize K+ levels and then remain on long-term therapy to prevent future acute events.
Expected Upcoming Milestones
H1 2015 –Expected NDA & MAA submission for ZS-9 for the treatment of hyperkalemia.
H1 2016 –Potential approval and commercial launch of ZS-9.
Huge, Readily Accessible Market Opportunity. Based on 2011 IMS data for the US, 200 million grams of Kayexalate, the current standard of care, are sold annually in the non-retail setting. Using an average 15 gram dose, this represents over 13 million doses of Kayexalate administered in the hospital setting. Given ZS-9’s clinical profile, we expect it to be used as an alternative to Kayexalate, and even using conservative pricing and the capture of only Kayexalate used in hospitals, we believe sales for acute hyperkalemia could reach $300 million annually. Should these acute patients remain on ZS-9 for only a fraction of a year, the product could reach >$1 billion annually.
ZS-9 Data Published in JAMA Shows Significant Benefit for Heart Failure and Chronic Kidney Disease Patients. Cardiologist Dr. Mikhail Kosiborod presented full results from ZS Pharma’s Phase III (ZS004) study at the R&D/KOL event and at the American Heart Association Scientific Meeting last weekend.1 The results were also published in the Journal of the American Medical Association.2 Dr. Kosiborod highlighted the diversity of patients included in the study. The trial enrolled 258 patients with hyperkalemia who were treated with 10 grams of ZS-9 three times per day during a 48 hour acute phase. Patients who achieved normokalemia were randomized to once daily ZS-9 (5, 10, or 15 grams) or placebo for 28 days as part of a randomized withdrawal period. There was no upper limit for baseline serum K+, no lower limit for estimated glomerular filtration rate (eGFR), and the study enrolled patients with many different co-morbidities such as heart failure (HF), chronic kidney disease (CKD), and existing RAAS inhibitor use.
- This trial gives an accurate view of the patients that will be treated in the clinic. ZS-9 displayed similar activity in all subpopulations, confirming its real-world potential as a hyperkalemia treatment. In support of this notion, Dr. Bruce Spinowitz, a Nephrologist, discussed how medications such as RAAS inhibitors can disrupt the body’s K+ balance and trigger hyperkalemia.
- We estimate that 1.4 million CKD and HF patients would benefit from a K+ control agent to enable therapeutic doses of cardio-protective RAAS inhibitor therapy. This represents a staggering multi-billion dollar opportunity.
Excellent Safety Profile Supports Approval. Dr. Kosiborod also presented safety data from trial ZS004, reporting a tolerability profile similar to placebo and no treatment-related serious adverse events. Out of 258 patients, there were 14 cases of edema, 13 were peripheral (foot and ankle) edema, and 7 cases did not require treatment modification. Dr. Kosiborod gave an excellent review of the overall edema cases in all patients treated with ZS-9. Based on his analysis, he believes the single case of generalized edema was likely related to underlying co-morbidities and the fact that the patient recently discontinued their diuretic, and was therefore a false signal. Consistent with the strong safety and tolerability observed in ZS004, ZS Pharma CEO Robert Alexander announced new toxicology data clearly showing that ZS-9 is not systemically absorbed. Dogs treated for 9 months had no detectable ZS-9 in their urine, corresponding to levels at or below parts per billion. This confirms the human data collected in ZS004. Overall the data show that ZS-9 has an excellent safety and tolerability profile.
ZS-9 "will" become the Standard of Care, Despite a Head Start for Patiromer. Relypsa (NasdaqGS: RLYP) is developing a competing product for hyperkalemia, patiromer, which is an organic polymer that exchanges calcium ions (Ca2+) for K+. Relypsa recently filed an NDA for patiromer. There are several features of ZS-9 that set it apart from patiromer and will make it the standard of care:
- Rapid onset of action: Statistically significant reduction in serum potassium by 1 hour for ZS-9 compared to 7 hours for patiromer.
- Convenient dosing: ZS-9 is a once daily treatment for maintenance of hyperkalemia compared to twice daily for patiromer.
- Strong tolerability profile: The rate of GI side effects from ZS-9 is similar to placebo compared to higher rates of diarrhea, constipation, and nausea for patiromer.
- High ion selectivity: ZS-9 is highly selective for potassium whereas patiromer can non-specifically bind other ions including magnesium.
Ion Selectivity/Release Deserves Scrutiny. The ion selectivity/release of each compound in particular may have profound implications for extended use. Hypomagnesemia occurred in 24% of patients taking 15 grams of patiromer twice daily in a trial with heart failure patients,3 and there were 8 cases (3%) in the induction phase of Relypsa’s Phase III study. Patiromer’s mechanism of action is to exchange Ca2+ for K+. Calcium is found in vascular deposits that are more likely to occur in CKD patients due to imbalances in bone metabolism. The deposits can contribute to the development of heart disease. For these reasons, CKD patients are often prescribed non-calcium based phosphate binders to manage hyperphosphatemia and minimize new calcium deposition in the arteries.4 Although Relypsa has not reported elevations in serum Ca2+from its clinical studies, patiromer approximately contains 3,200 mg of Ca2+ in a daily dose. The Cleveland Clinic recommends Ca2+ intake of 1,400-1,600 mg/day, not to exceed 2,000 mg/day, for patients with CKD. Most Ca2+ comes from dietary intake, and the long-term exposure to additional Ca2+ via patiromer may represent an issue for CKD patients, which make up the majority of hyperkalemia cases. ...-
https://lifesci.bluematrix.com/sellside/EmailDocViewer?encry…
soweit ich es verstehe dürften die Chancen auf ein Blockbuster Medikament nicht so schlecht liegen
ZS Pharma - LifeSci Advisors Update, ZS-9 is 'Poised to Change the Treatment of Hyperkalemia'; Summary of KOL Event - Nov 21, 2014
- Jerry Isaacson, Ph.D.(AC) -
- On November 19th, ZS Pharma (NasdaqGM: ZSPH) hosted a Research and Development day that featured three Key Opinion Leaders (KOLs) from the specialties expected to prescribe ZS-9, an Emergency Medicine physician, a Cardiologist, and a Nephrologist. ZS-9 is being developed to treat hyperkalemia, or excess potassium, with NDA and MAA filings expected in the first half of 2015. Based on their compelling presentations, we came away from the event especially impressed with ZS-9’s rapid onset of action, tolerability profile, and potential for ZS-9 to manage both acute and chronic cases of hyperkalemia, without the safety issues related to current treatments. There are approximately 4 million patients in the US with hyperkalemia, and we estimate that the market opportunity significantly exceeds $1 billion annually in the US alone.
Strong Clinical Data Package Supports Acute and Chronic Hyperkalemia Treatment. ZS Pharma has completed 4 clinical trials with potassium (K+) binder ZS-9, meeting the primary endpoints in all studies. The data consistently demonstrate ZS-9’s ability to safely and rapidly lower serum K+ levels and maintain normokalemia (potassium of 3.5-5 mEq/L). In the most recent trial, the median time to serum K+ normalization was 2.17 hours with greater than 90% of patients receiving 10 or 15 grams of ZS-9 maintained normokalemia for 3 weeks. A 1-year safety study (ZS005) is ongoing. Company management noted that based on extensive discussions with US and European regulators, if ZS Pharma continues to meet trial endpoints, the data would support a label that includes acute and chronic hyperkalemia.
ZS-9 "will" be Revolutionary for the Acute Treatment of Hyperkalemia. Dr. Frank Peacock, an emergency room physician at the largest ER in Houston, TX, discussed the treatment path for an average patient with acute hyperkalemia. His emergency department has extensive experience treating hyperkalemia and sees 30 hyperkalemic patients on a typical day. Most methods for managing serum potassium are temporary and patients ultimately require emergency dialysis. However, the availability of a safe and effective solution to reduce serum potassium rapidly could not only replace existing therapies, but also potentially eliminate the need for emergency dialysis. As the agent with the fastest onset of action, ZS-9 would be very likely be the exclusive agent on his hospital formulary. Importantly, 50% of hyperkalemia patients are first diagnosed in the ER. This represents an entry point for ZS-9 where patients receive initial treatment to normalize K+ levels and then remain on long-term therapy to prevent future acute events.
Expected Upcoming Milestones
H1 2015 –Expected NDA & MAA submission for ZS-9 for the treatment of hyperkalemia.
H1 2016 –Potential approval and commercial launch of ZS-9.
Huge, Readily Accessible Market Opportunity. Based on 2011 IMS data for the US, 200 million grams of Kayexalate, the current standard of care, are sold annually in the non-retail setting. Using an average 15 gram dose, this represents over 13 million doses of Kayexalate administered in the hospital setting. Given ZS-9’s clinical profile, we expect it to be used as an alternative to Kayexalate, and even using conservative pricing and the capture of only Kayexalate used in hospitals, we believe sales for acute hyperkalemia could reach $300 million annually. Should these acute patients remain on ZS-9 for only a fraction of a year, the product could reach >$1 billion annually.
ZS-9 Data Published in JAMA Shows Significant Benefit for Heart Failure and Chronic Kidney Disease Patients. Cardiologist Dr. Mikhail Kosiborod presented full results from ZS Pharma’s Phase III (ZS004) study at the R&D/KOL event and at the American Heart Association Scientific Meeting last weekend.1 The results were also published in the Journal of the American Medical Association.2 Dr. Kosiborod highlighted the diversity of patients included in the study. The trial enrolled 258 patients with hyperkalemia who were treated with 10 grams of ZS-9 three times per day during a 48 hour acute phase. Patients who achieved normokalemia were randomized to once daily ZS-9 (5, 10, or 15 grams) or placebo for 28 days as part of a randomized withdrawal period. There was no upper limit for baseline serum K+, no lower limit for estimated glomerular filtration rate (eGFR), and the study enrolled patients with many different co-morbidities such as heart failure (HF), chronic kidney disease (CKD), and existing RAAS inhibitor use.
- This trial gives an accurate view of the patients that will be treated in the clinic. ZS-9 displayed similar activity in all subpopulations, confirming its real-world potential as a hyperkalemia treatment. In support of this notion, Dr. Bruce Spinowitz, a Nephrologist, discussed how medications such as RAAS inhibitors can disrupt the body’s K+ balance and trigger hyperkalemia.
- We estimate that 1.4 million CKD and HF patients would benefit from a K+ control agent to enable therapeutic doses of cardio-protective RAAS inhibitor therapy. This represents a staggering multi-billion dollar opportunity.
Excellent Safety Profile Supports Approval. Dr. Kosiborod also presented safety data from trial ZS004, reporting a tolerability profile similar to placebo and no treatment-related serious adverse events. Out of 258 patients, there were 14 cases of edema, 13 were peripheral (foot and ankle) edema, and 7 cases did not require treatment modification. Dr. Kosiborod gave an excellent review of the overall edema cases in all patients treated with ZS-9. Based on his analysis, he believes the single case of generalized edema was likely related to underlying co-morbidities and the fact that the patient recently discontinued their diuretic, and was therefore a false signal. Consistent with the strong safety and tolerability observed in ZS004, ZS Pharma CEO Robert Alexander announced new toxicology data clearly showing that ZS-9 is not systemically absorbed. Dogs treated for 9 months had no detectable ZS-9 in their urine, corresponding to levels at or below parts per billion. This confirms the human data collected in ZS004. Overall the data show that ZS-9 has an excellent safety and tolerability profile.
ZS-9 "will" become the Standard of Care, Despite a Head Start for Patiromer. Relypsa (NasdaqGS: RLYP) is developing a competing product for hyperkalemia, patiromer, which is an organic polymer that exchanges calcium ions (Ca2+) for K+. Relypsa recently filed an NDA for patiromer. There are several features of ZS-9 that set it apart from patiromer and will make it the standard of care:
- Rapid onset of action: Statistically significant reduction in serum potassium by 1 hour for ZS-9 compared to 7 hours for patiromer.
- Convenient dosing: ZS-9 is a once daily treatment for maintenance of hyperkalemia compared to twice daily for patiromer.
- Strong tolerability profile: The rate of GI side effects from ZS-9 is similar to placebo compared to higher rates of diarrhea, constipation, and nausea for patiromer.
- High ion selectivity: ZS-9 is highly selective for potassium whereas patiromer can non-specifically bind other ions including magnesium.
Ion Selectivity/Release Deserves Scrutiny. The ion selectivity/release of each compound in particular may have profound implications for extended use. Hypomagnesemia occurred in 24% of patients taking 15 grams of patiromer twice daily in a trial with heart failure patients,3 and there were 8 cases (3%) in the induction phase of Relypsa’s Phase III study. Patiromer’s mechanism of action is to exchange Ca2+ for K+. Calcium is found in vascular deposits that are more likely to occur in CKD patients due to imbalances in bone metabolism. The deposits can contribute to the development of heart disease. For these reasons, CKD patients are often prescribed non-calcium based phosphate binders to manage hyperphosphatemia and minimize new calcium deposition in the arteries.4 Although Relypsa has not reported elevations in serum Ca2+from its clinical studies, patiromer approximately contains 3,200 mg of Ca2+ in a daily dose. The Cleveland Clinic recommends Ca2+ intake of 1,400-1,600 mg/day, not to exceed 2,000 mg/day, for patients with CKD. Most Ca2+ comes from dietary intake, and the long-term exposure to additional Ca2+ via patiromer may represent an issue for CKD patients, which make up the majority of hyperkalemia cases. ...-
https://lifesci.bluematrix.com/sellside/EmailDocViewer?encry…
ein Doppelschreiben
soweit ich es verstehe dürften die Chancen auf ein Blockbuster Medikament nicht so schlecht liegen
"potenziell" best in class/standard of care
ZS Pharma - LifeSci Advisors Update, ZS-9 is 'Poised to Change the Treatment of Hyperkalemia'; Summary of KOL Event - Nov 21, 2014
- Jerry Isaacson, Ph.D.(AC) -
- On November 19th, ZS Pharma (NasdaqGM: ZSPH) hosted a Research and Development day that featured three Key Opinion Leaders (KOLs) from the specialties expected to prescribe ZS-9, an Emergency Medicine physician, a Cardiologist, and a Nephrologist. ZS-9 is being developed to treat hyperkalemia, or excess potassium, with NDA and MAA filings expected in the first half of 2015. Based on their compelling presentations, we came away from the event especially impressed with ZS-9’s rapid onset of action, tolerability profile, and potential for ZS-9 to manage both acute and chronic cases of hyperkalemia, without the safety issues related to current treatments. There are approximately 4 million patients in the US with hyperkalemia, and we estimate that the market opportunity significantly exceeds $1 billion annually in the US alone.
Strong Clinical Data Package Supports Acute and Chronic Hyperkalemia Treatment. ZS Pharma has completed 4 clinical trials with potassium (K+) binder ZS-9, meeting the primary endpoints in all studies. The data consistently demonstrate ZS-9’s ability to safely and rapidly lower serum K+ levels and maintain normokalemia (potassium of 3.5-5 mEq/L). In the most recent trial, the median time to serum K+ normalization was 2.17 hours with greater than 90% of patients receiving 10 or 15 grams of ZS-9 maintained normokalemia for 3 weeks. A 1-year safety study (ZS005) is ongoing. Company management noted that based on extensive discussions with US and European regulators, if ZS Pharma continues to meet trial endpoints, the data would support a label that includes acute and chronic hyperkalemia.
ZS-9 "will" be Revolutionary for the Acute Treatment of Hyperkalemia. Dr. Frank Peacock, an emergency room physician at the largest ER in Houston, TX, discussed the treatment path for an average patient with acute hyperkalemia. His emergency department has extensive experience treating hyperkalemia and sees 30 hyperkalemic patients on a typical day. Most methods for managing serum potassium are temporary and patients ultimately require emergency dialysis. However, the availability of a safe and effective solution to reduce serum potassium rapidly could not only replace existing therapies, but also potentially eliminate the need for emergency dialysis. As the agent with the fastest onset of action, ZS-9 would be very likely be the exclusive agent on his hospital formulary. Importantly, 50% of hyperkalemia patients are first diagnosed in the ER. This represents an entry point for ZS-9 where patients receive initial treatment to normalize K+ levels and then remain on long-term therapy to prevent future acute events.
Expected Upcoming Milestones
H1 2015 –Expected NDA & MAA submission for ZS-9 for the treatment of hyperkalemia.
H1 2016 –Potential approval and commercial launch of ZS-9.
Huge, Readily Accessible Market Opportunity. Based on 2011 IMS data for the US, 200 million grams of Kayexalate, the current standard of care, are sold annually in the non-retail setting. Using an average 15 gram dose, this represents over 13 million doses of Kayexalate administered in the hospital setting. Given ZS-9’s clinical profile, we expect it to be used as an alternative to Kayexalate, and even using conservative pricing and the capture of only Kayexalate used in hospitals, we believe sales for acute hyperkalemia could reach $300 million annually. Should these acute patients remain on ZS-9 for only a fraction of a year, the product could reach >$1 billion annually.
ZS-9 Data Published in JAMA Shows Significant Benefit for Heart Failure and Chronic Kidney Disease Patients. Cardiologist Dr. Mikhail Kosiborod presented full results from ZS Pharma’s Phase III (ZS004) study at the R&D/KOL event and at the American Heart Association Scientific Meeting last weekend.1 The results were also published in the Journal of the American Medical Association.2 Dr. Kosiborod highlighted the diversity of patients included in the study. The trial enrolled 258 patients with hyperkalemia who were treated with 10 grams of ZS-9 three times per day during a 48 hour acute phase. Patients who achieved normokalemia were randomized to once daily ZS-9 (5, 10, or 15 grams) or placebo for 28 days as part of a randomized withdrawal period. There was no upper limit for baseline serum K+, no lower limit for estimated glomerular filtration rate (eGFR), and the study enrolled patients with many different co-morbidities such as heart failure (HF), chronic kidney disease (CKD), and existing RAAS inhibitor use.
- This trial gives an accurate view of the patients that will be treated in the clinic. ZS-9 displayed similar activity in all subpopulations, confirming its real-world potential as a hyperkalemia treatment. In support of this notion, Dr. Bruce Spinowitz, a Nephrologist, discussed how medications such as RAAS inhibitors can disrupt the body’s K+ balance and trigger hyperkalemia.
- We estimate that 1.4 million CKD and HF patients would benefit from a K+ control agent to enable therapeutic doses of cardio-protective RAAS inhibitor therapy. This represents a staggering multi-billion dollar opportunity.
Excellent Safety Profile Supports Approval. Dr. Kosiborod also presented safety data from trial ZS004, reporting a tolerability profile similar to placebo and no treatment-related serious adverse events. Out of 258 patients, there were 14 cases of edema, 13 were peripheral (foot and ankle) edema, and 7 cases did not require treatment modification. Dr. Kosiborod gave an excellent review of the overall edema cases in all patients treated with ZS-9. Based on his analysis, he believes the single case of generalized edema was likely related to underlying co-morbidities and the fact that the patient recently discontinued their diuretic, and was therefore a false signal. Consistent with the strong safety and tolerability observed in ZS004, ZS Pharma CEO Robert Alexander announced new toxicology data clearly showing that ZS-9 is not systemically absorbed. Dogs treated for 9 months had no detectable ZS-9 in their urine, corresponding to levels at or below parts per billion. This confirms the human data collected in ZS004. Overall the data show that ZS-9 has an excellent safety and tolerability profile.
ZS-9 "will" become the Standard of Care, Despite a Head Start for Patiromer. Relypsa (NasdaqGS: RLYP) is developing a competing product for hyperkalemia, patiromer, which is an organic polymer that exchanges calcium ions (Ca2+) for K+. Relypsa recently filed an NDA for patiromer. There are several features of ZS-9 that set it apart from patiromer and will make it the standard of care:
- Rapid onset of action: Statistically significant reduction in serum potassium by 1 hour for ZS-9 compared to 7 hours for patiromer.
- Convenient dosing: ZS-9 is a once daily treatment for maintenance of hyperkalemia compared to twice daily for patiromer.
- Strong tolerability profile: The rate of GI side effects from ZS-9 is similar to placebo compared to higher rates of diarrhea, constipation, and nausea for patiromer.
- High ion selectivity: ZS-9 is highly selective for potassium whereas patiromer can non-specifically bind other ions including magnesium.
Ion Selectivity/Release Deserves Scrutiny. The ion selectivity/release of each compound in particular may have profound implications for extended use. Hypomagnesemia occurred in 24% of patients taking 15 grams of patiromer twice daily in a trial with heart failure patients,3 and there were 8 cases (3%) in the induction phase of Relypsa’s Phase III study. Patiromer’s mechanism of action is to exchange Ca2+ for K+. Calcium is found in vascular deposits that are more likely to occur in CKD patients due to imbalances in bone metabolism. The deposits can contribute to the development of heart disease. For these reasons, CKD patients are often prescribed non-calcium based phosphate binders to manage hyperphosphatemia and minimize new calcium deposition in the arteries.4 Although Relypsa has not reported elevations in serum Ca2+from its clinical studies, patiromer approximately contains 3,200 mg of Ca2+ in a daily dose. The Cleveland Clinic recommends Ca2+ intake of 1,400-1,600 mg/day, not to exceed 2,000 mg/day, for patients with CKD. Most Ca2+ comes from dietary intake, and the long-term exposure to additional Ca2+ via patiromer may represent an issue for CKD patients, which make up the majority of hyperkalemia cases. ...-
https://lifesci.bluematrix.com/sellside/EmailDocViewer?encry…
soweit ich es verstehe dürften die Chancen auf ein Blockbuster Medikament nicht so schlecht liegen
"potenziell" best in class/standard of care
ZS Pharma - LifeSci Advisors Update, ZS-9 is 'Poised to Change the Treatment of Hyperkalemia'; Summary of KOL Event - Nov 21, 2014
- Jerry Isaacson, Ph.D.(AC) -
- On November 19th, ZS Pharma (NasdaqGM: ZSPH) hosted a Research and Development day that featured three Key Opinion Leaders (KOLs) from the specialties expected to prescribe ZS-9, an Emergency Medicine physician, a Cardiologist, and a Nephrologist. ZS-9 is being developed to treat hyperkalemia, or excess potassium, with NDA and MAA filings expected in the first half of 2015. Based on their compelling presentations, we came away from the event especially impressed with ZS-9’s rapid onset of action, tolerability profile, and potential for ZS-9 to manage both acute and chronic cases of hyperkalemia, without the safety issues related to current treatments. There are approximately 4 million patients in the US with hyperkalemia, and we estimate that the market opportunity significantly exceeds $1 billion annually in the US alone.
Strong Clinical Data Package Supports Acute and Chronic Hyperkalemia Treatment. ZS Pharma has completed 4 clinical trials with potassium (K+) binder ZS-9, meeting the primary endpoints in all studies. The data consistently demonstrate ZS-9’s ability to safely and rapidly lower serum K+ levels and maintain normokalemia (potassium of 3.5-5 mEq/L). In the most recent trial, the median time to serum K+ normalization was 2.17 hours with greater than 90% of patients receiving 10 or 15 grams of ZS-9 maintained normokalemia for 3 weeks. A 1-year safety study (ZS005) is ongoing. Company management noted that based on extensive discussions with US and European regulators, if ZS Pharma continues to meet trial endpoints, the data would support a label that includes acute and chronic hyperkalemia.
ZS-9 "will" be Revolutionary for the Acute Treatment of Hyperkalemia. Dr. Frank Peacock, an emergency room physician at the largest ER in Houston, TX, discussed the treatment path for an average patient with acute hyperkalemia. His emergency department has extensive experience treating hyperkalemia and sees 30 hyperkalemic patients on a typical day. Most methods for managing serum potassium are temporary and patients ultimately require emergency dialysis. However, the availability of a safe and effective solution to reduce serum potassium rapidly could not only replace existing therapies, but also potentially eliminate the need for emergency dialysis. As the agent with the fastest onset of action, ZS-9 would be very likely be the exclusive agent on his hospital formulary. Importantly, 50% of hyperkalemia patients are first diagnosed in the ER. This represents an entry point for ZS-9 where patients receive initial treatment to normalize K+ levels and then remain on long-term therapy to prevent future acute events.
Expected Upcoming Milestones
H1 2015 –Expected NDA & MAA submission for ZS-9 for the treatment of hyperkalemia.
H1 2016 –Potential approval and commercial launch of ZS-9.
Huge, Readily Accessible Market Opportunity. Based on 2011 IMS data for the US, 200 million grams of Kayexalate, the current standard of care, are sold annually in the non-retail setting. Using an average 15 gram dose, this represents over 13 million doses of Kayexalate administered in the hospital setting. Given ZS-9’s clinical profile, we expect it to be used as an alternative to Kayexalate, and even using conservative pricing and the capture of only Kayexalate used in hospitals, we believe sales for acute hyperkalemia could reach $300 million annually. Should these acute patients remain on ZS-9 for only a fraction of a year, the product could reach >$1 billion annually.
ZS-9 Data Published in JAMA Shows Significant Benefit for Heart Failure and Chronic Kidney Disease Patients. Cardiologist Dr. Mikhail Kosiborod presented full results from ZS Pharma’s Phase III (ZS004) study at the R&D/KOL event and at the American Heart Association Scientific Meeting last weekend.1 The results were also published in the Journal of the American Medical Association.2 Dr. Kosiborod highlighted the diversity of patients included in the study. The trial enrolled 258 patients with hyperkalemia who were treated with 10 grams of ZS-9 three times per day during a 48 hour acute phase. Patients who achieved normokalemia were randomized to once daily ZS-9 (5, 10, or 15 grams) or placebo for 28 days as part of a randomized withdrawal period. There was no upper limit for baseline serum K+, no lower limit for estimated glomerular filtration rate (eGFR), and the study enrolled patients with many different co-morbidities such as heart failure (HF), chronic kidney disease (CKD), and existing RAAS inhibitor use.
- This trial gives an accurate view of the patients that will be treated in the clinic. ZS-9 displayed similar activity in all subpopulations, confirming its real-world potential as a hyperkalemia treatment. In support of this notion, Dr. Bruce Spinowitz, a Nephrologist, discussed how medications such as RAAS inhibitors can disrupt the body’s K+ balance and trigger hyperkalemia.
- We estimate that 1.4 million CKD and HF patients would benefit from a K+ control agent to enable therapeutic doses of cardio-protective RAAS inhibitor therapy. This represents a staggering multi-billion dollar opportunity.
Excellent Safety Profile Supports Approval. Dr. Kosiborod also presented safety data from trial ZS004, reporting a tolerability profile similar to placebo and no treatment-related serious adverse events. Out of 258 patients, there were 14 cases of edema, 13 were peripheral (foot and ankle) edema, and 7 cases did not require treatment modification. Dr. Kosiborod gave an excellent review of the overall edema cases in all patients treated with ZS-9. Based on his analysis, he believes the single case of generalized edema was likely related to underlying co-morbidities and the fact that the patient recently discontinued their diuretic, and was therefore a false signal. Consistent with the strong safety and tolerability observed in ZS004, ZS Pharma CEO Robert Alexander announced new toxicology data clearly showing that ZS-9 is not systemically absorbed. Dogs treated for 9 months had no detectable ZS-9 in their urine, corresponding to levels at or below parts per billion. This confirms the human data collected in ZS004. Overall the data show that ZS-9 has an excellent safety and tolerability profile.
ZS-9 "will" become the Standard of Care, Despite a Head Start for Patiromer. Relypsa (NasdaqGS: RLYP) is developing a competing product for hyperkalemia, patiromer, which is an organic polymer that exchanges calcium ions (Ca2+) for K+. Relypsa recently filed an NDA for patiromer. There are several features of ZS-9 that set it apart from patiromer and will make it the standard of care:
- Rapid onset of action: Statistically significant reduction in serum potassium by 1 hour for ZS-9 compared to 7 hours for patiromer.
- Convenient dosing: ZS-9 is a once daily treatment for maintenance of hyperkalemia compared to twice daily for patiromer.
- Strong tolerability profile: The rate of GI side effects from ZS-9 is similar to placebo compared to higher rates of diarrhea, constipation, and nausea for patiromer.
- High ion selectivity: ZS-9 is highly selective for potassium whereas patiromer can non-specifically bind other ions including magnesium.
Ion Selectivity/Release Deserves Scrutiny. The ion selectivity/release of each compound in particular may have profound implications for extended use. Hypomagnesemia occurred in 24% of patients taking 15 grams of patiromer twice daily in a trial with heart failure patients,3 and there were 8 cases (3%) in the induction phase of Relypsa’s Phase III study. Patiromer’s mechanism of action is to exchange Ca2+ for K+. Calcium is found in vascular deposits that are more likely to occur in CKD patients due to imbalances in bone metabolism. The deposits can contribute to the development of heart disease. For these reasons, CKD patients are often prescribed non-calcium based phosphate binders to manage hyperphosphatemia and minimize new calcium deposition in the arteries.4 Although Relypsa has not reported elevations in serum Ca2+from its clinical studies, patiromer approximately contains 3,200 mg of Ca2+ in a daily dose. The Cleveland Clinic recommends Ca2+ intake of 1,400-1,600 mg/day, not to exceed 2,000 mg/day, for patients with CKD. Most Ca2+ comes from dietary intake, and the long-term exposure to additional Ca2+ via patiromer may represent an issue for CKD patients, which make up the majority of hyperkalemia cases. ...-
https://lifesci.bluematrix.com/sellside/EmailDocViewer?encry…
Antwort auf Beitrag Nr.: 48.331.864 von SLGramann am 16.11.14 08:30:25
wenn Du willst kann ich Dir/Euch, richtige, Recherche zu Kite Pharma geben
ich habe 0,0 Ahnung von dieser Firma
Gruß
P.
Zitat von SLGramann: Präsentation von KITE:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Muss man eigentlich mal gesehen haben. Die CAR-Technologie riecht schon nach Revolution. Natürlich bleibt erst mal unklar, wer da wirklich die Nase vorn hat, aber sicher ist Platz für mehrere Player und bei Kite hat sich offenkundig ne Menge Potential versammelt.
Sehr schade, dass Hammer zu dem Unternehmen nicht Stellung nehmen darf. Ich glaube, das gesamte Feld ist heißer, als damals die ADCs. Vielleicht vergleichbar mit PD-1 und Co.
wenn Du willst kann ich Dir/Euch, richtige, Recherche zu Kite Pharma geben
ich habe 0,0 Ahnung von dieser Firma
Gruß
P.
Antwort auf Beitrag Nr.: 48.386.531 von Popeye82 am 22.11.14 00:20:00"wenn Du willst kann ich Dir/Euch, richtige, Recherche zu Kite Pharma geben"
Wie meinst Du das genau?
Kannst mir gerne eine Mail schreiben.
ACAD:
Spät, aber wahrscheinlich nicht ganz zu spät, darauf aufmerksam geworden.
CNS - insofern bääh, aber es liegt eindeutig ein Sonderfall vor.
At ACADIA, we are developing NUPLAZID™ (pimavanserin) as a potential first-in-class treatment for Parkinson's disease psychosis (PDP). The successful results from our pivotal Phase III study suggest that NUPLAZID has the potential to transform the treatment landscape for these patients by providing an effective treatment of psychosis without compromising motor control and safety.
Was wir haben:
- abgeschlossene P III, Zulassungsantrag wird in Q1/2015 erfolgen
- gute Wirksamkeit, hervorragendes Nebenwirkungsprofil
- dringender medizinischer Bedarf
- großer Markt (hunderttausende Patienten) - Marktpotential WW bei 2 Milliarden Dollar (meine Vermutung ist, dass es eher 3 bis 4 werden können)
- volle Rechte am Wirkstoff
- weitere denkbar und schon in der Entwicklung
Nach den P III - Daten gab es diese Entscheidung der FDA:
ACADIA Pharmaceuticals Receives FDA Breakthrough Therapy Designation for NUPLAZID™ (Pimavanserin) for Parkinson’s Disease Psychosis
FDA Decision Highlights Significant Unmet Need in the Treatment of Parkinson’s Disease Psychosis
Ich interpretiere das so, dass man behördenseitig den Zulassungsprozess mit Tempo durchziehen will. Welchen Sinn soll sonst ein BT-Status noch machen, wenn die P III schon durch ist und die Ergebnisse vorliegen?
Hier eine Präsentation des Unternehmens:
http://phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9M…
Die Marktkapitalisierung liegt zwar schon bei 3 Milliarden Dollar, aber wenn man für Nuplazid einen klaren Blockbuster-Status sieht, dann gibt es weiteres Potential, selbst ohne zusätzliche Indikationen.
Ich denke, dass die Zulassung beinahe sicher ist und bis Ende 2015 erfolgen wird.
Wie meinst Du das genau?
Kannst mir gerne eine Mail schreiben.
ACAD:
Spät, aber wahrscheinlich nicht ganz zu spät, darauf aufmerksam geworden.
CNS - insofern bääh, aber es liegt eindeutig ein Sonderfall vor.
At ACADIA, we are developing NUPLAZID™ (pimavanserin) as a potential first-in-class treatment for Parkinson's disease psychosis (PDP). The successful results from our pivotal Phase III study suggest that NUPLAZID has the potential to transform the treatment landscape for these patients by providing an effective treatment of psychosis without compromising motor control and safety.
Was wir haben:
- abgeschlossene P III, Zulassungsantrag wird in Q1/2015 erfolgen
- gute Wirksamkeit, hervorragendes Nebenwirkungsprofil
- dringender medizinischer Bedarf
- großer Markt (hunderttausende Patienten) - Marktpotential WW bei 2 Milliarden Dollar (meine Vermutung ist, dass es eher 3 bis 4 werden können)
- volle Rechte am Wirkstoff
- weitere denkbar und schon in der Entwicklung
Nach den P III - Daten gab es diese Entscheidung der FDA:
ACADIA Pharmaceuticals Receives FDA Breakthrough Therapy Designation for NUPLAZID™ (Pimavanserin) for Parkinson’s Disease Psychosis
FDA Decision Highlights Significant Unmet Need in the Treatment of Parkinson’s Disease Psychosis
Ich interpretiere das so, dass man behördenseitig den Zulassungsprozess mit Tempo durchziehen will. Welchen Sinn soll sonst ein BT-Status noch machen, wenn die P III schon durch ist und die Ergebnisse vorliegen?
Hier eine Präsentation des Unternehmens:
http://phx.corporate-ir.net/External.File?item=UGFyZW50SUQ9M…
Die Marktkapitalisierung liegt zwar schon bei 3 Milliarden Dollar, aber wenn man für Nuplazid einen klaren Blockbuster-Status sieht, dann gibt es weiteres Potential, selbst ohne zusätzliche Indikationen.
Ich denke, dass die Zulassung beinahe sicher ist und bis Ende 2015 erfolgen wird.
XLRN, FGEN
FGEN finde ich auch recht gut. Spannend finde ich auch den IPF-Kandidaten in der Pipeline.
Was ist eigentlich Bundling bei CDK? Spielt das für z.B. Roxa in Zukunft auch eine Rolle?
http://www.renalbusiness.com/articles/2007/02/does-epo-bundl…
http://www.renalandurologynews.com/epo-use-declining-after-b…
Wenn ich es richtig verstehe, ist Roxa eine Ergänzung oder Alternative zu Epo? Wie genau wirkt es? Stabilisiert es die normale EPO-Produktion des Körpers?
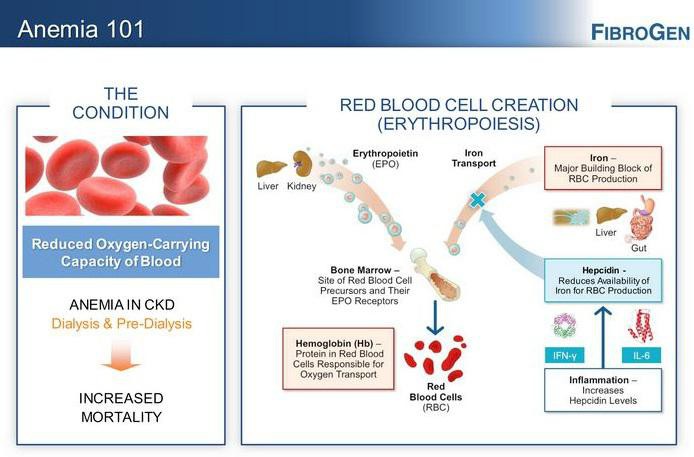
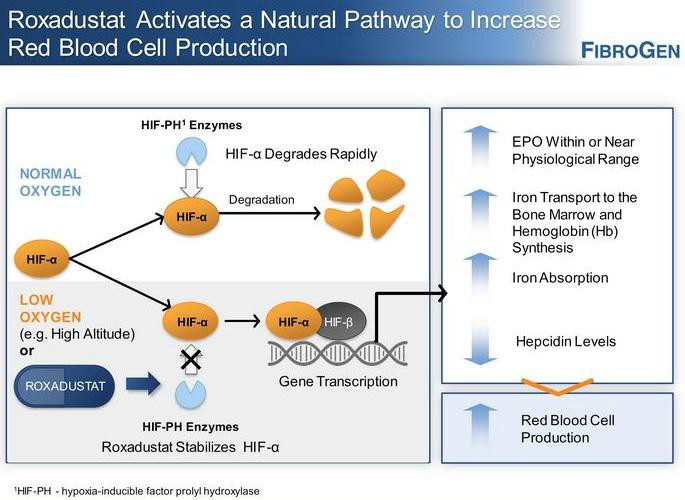
XLRN's Luspatercept und Sotatercept könnten eine Alternative zu EPO sein. Es wirkt grundsätzlich über einen anderen Mechanismus als EPO, wodurch es auch bei MDS oder der seltenen Thalassemia wirkt. MDS ist sicherlich für den Partner CELG interessant. Bei Thalassemia könnte es in Zukunft auch Konkurrenz von BLUE geben... die haben eine Gentherapie in der Pipeline, die Thalassemia heilen könnte.
http://files.shareholder.com/downloads/AMDA-23MZWJ/345425686…
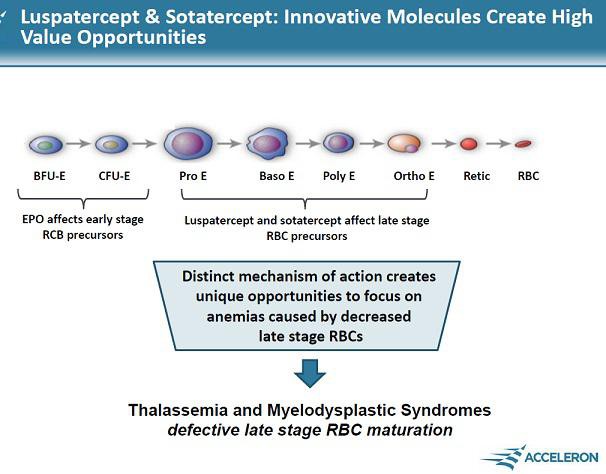
Gut für XLRN... Big-Biotech CELG bezahlt 100% der Entwicklungkosten. Die Royalties mit >20% WW sind ebenfalls sehr gut.

Wie gesagt, sind die XLRN-Mittel, die über TGF-beta wirken, theoretisch in der Lage, ESAs zu ersetzen. Es gibt Anzeichen, dass sie nicht nur auf Blutarmut wirken, sondern auch die Mineralisierung der Knochen verbessern und die Kalsifizierung der Blutgefäße verringern. Alles sind unerwünschte Nebenwirkungen der Dialyse.
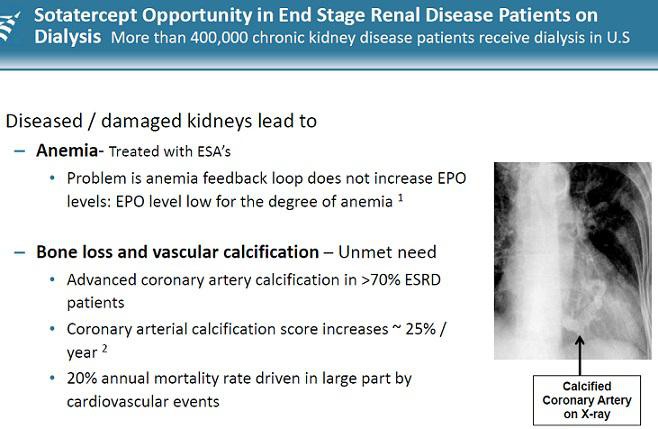
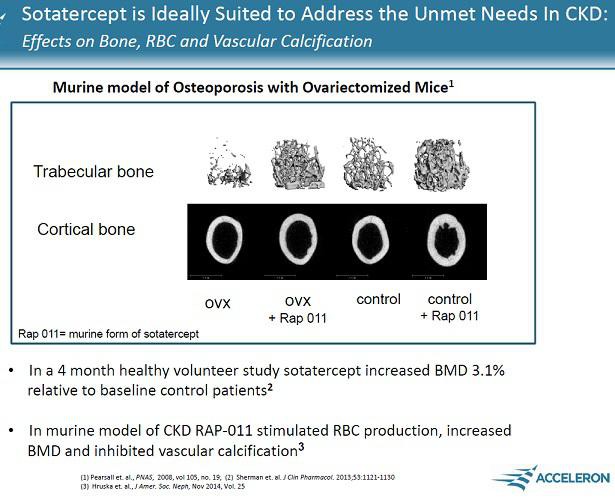




Grüße
ipollit
FGEN finde ich auch recht gut. Spannend finde ich auch den IPF-Kandidaten in der Pipeline.
Was ist eigentlich Bundling bei CDK? Spielt das für z.B. Roxa in Zukunft auch eine Rolle?
http://www.renalbusiness.com/articles/2007/02/does-epo-bundl…
http://www.renalandurologynews.com/epo-use-declining-after-b…
Wenn ich es richtig verstehe, ist Roxa eine Ergänzung oder Alternative zu Epo? Wie genau wirkt es? Stabilisiert es die normale EPO-Produktion des Körpers?



XLRN's Luspatercept und Sotatercept könnten eine Alternative zu EPO sein. Es wirkt grundsätzlich über einen anderen Mechanismus als EPO, wodurch es auch bei MDS oder der seltenen Thalassemia wirkt. MDS ist sicherlich für den Partner CELG interessant. Bei Thalassemia könnte es in Zukunft auch Konkurrenz von BLUE geben... die haben eine Gentherapie in der Pipeline, die Thalassemia heilen könnte.
http://files.shareholder.com/downloads/AMDA-23MZWJ/345425686…

Gut für XLRN... Big-Biotech CELG bezahlt 100% der Entwicklungkosten. Die Royalties mit >20% WW sind ebenfalls sehr gut.

Wie gesagt, sind die XLRN-Mittel, die über TGF-beta wirken, theoretisch in der Lage, ESAs zu ersetzen. Es gibt Anzeichen, dass sie nicht nur auf Blutarmut wirken, sondern auch die Mineralisierung der Knochen verbessern und die Kalsifizierung der Blutgefäße verringern. Alles sind unerwünschte Nebenwirkungen der Dialyse.







Grüße
ipollit
Antwort auf Beitrag Nr.: 48.369.083 von kmastra am 20.11.14 12:51:19CLVS, FMI, TSRO
Dass CLVS mit dem FMI-Test Patienten finden kann, die auch ohne BRCA-Mutation auf den PARP-Hemmer ansprechen, ist sehr gut.
Clovis’ “BRCAness” DNA signature predicts which patients respond to rucaparib therapy:
- Overall response rate (ORR) of 70% in BRCA-mutant patients; responses observed in patients with both germline and somatic mutations
- ORR of 40% in patients with BRCAness signature (all BRCA wild-type)
- ORR of only 8% in patients without BRCAness signature (all BRCA wild-type)
Approximately 67% of patients treated to date exhibit BRCAness DNA signature or BRCA-mutant status
Diese Ergebnisse sind von Ovarian-Cancer Patienten. Ich bin gespannt, ob man den Test auch auf andere Krebsarten anwenden kann. Schließlich sind die Mutationen ja nicht speziell für eine Krebsart relevant. PARP-Hemmer spielen bei der Zellteilung eine Rolle... schnelle, ungehemmte Zellteilungen sind eine grundsärtliche Eigenschaft von Krebs.
Hier sind z.B. Hinweise von einer Wirkung von PARP-Hemmern bei NSCLC in Kombi mit einer Chemo (die ebenfalls auf die Zellteilung wirkt):
http://www.onclive.com/web-exclusives/PARP-Inhibitor-Shows-P…
PARP Inhibitor Shows Potential in Squamous Cell Lung Cancer
There remains an unmet need for treatment options for patients with squamous cell non-small cell lung cancer (NSCLC), heightening the need for novel therapies. At the 2014 ESMO Congress, Suresh S. Ramalingam, MD, presented preliminary data from a randomized phase II trial that demonstrated an improvement in outcomes with the combination of the PARP inhibitor veliparib and chemotherapy in patients with this hard to treat histology.
... PARP is a protein that’s involved in DNA repair and veliparib is a very potent inhibitor of PARP1 and PARP2. Basically, when you give a PARP inhibitor, the cell is not able to repair DNA damage effectively. What we’ve seen in the past is if the cells have deficiency in homologous recombination repairs, which is what happens in BRCA mutation settings, those cells become far more dependent on the basic repair pathway, which is exactly where the PARP comes into play...
So essentially by blocking DNA in cells that are critically dependent on that pathway, you are able to induce lethal damage. In lung cancer, if you look at what the common modalities of treatment are, we use platinum compounds, which are the cornerstones of therapy, and then we use radiation and both of these work by inducing DNA damage. Cells that can repair the DNA damage end up not being sensitive to radiation or chemotherapy with platinum-based regimens...
There is certainly room for additional novel combination regimens. As monotherapy in lung cancer, we don’t think veliparib is going to be an effective agent unless, of course, we identify potentially a group of patients who have low BRCA function, not mutation, but function. That’s a group that’s not particularly a high proportion and we haven’t done much work in that group with any drug, for that matter...
Z.B. bei Lungenkrebs gehört die Chemo oder Strahlentherapie zum Standard. Krebszellen können diese überstehen, wenn die Zellen die DNA-Schäden in den Kebszellen wieder reparieren. PARP-Hemmer verhindern diese Reparatur zu einem Teil. Wenn dann noch weitere Fehler im Repartur-Mechanismus durch z.B. Mutationen wir BRCA vorhanden sind, stirbt die Zelle.
Das Problem ist nur, diese weiteren Fehler zu finden. Oben steht, dass BCRA-Fehler bei Lungenkrebs nicht so häufig sind. Z.B. der FMI-Test könnte aber weitere Patienten identifizieren, die auf PARP ansprechen. Das man so einen Test so wertvoll.
*****
Allerdings sind nicht nur CLVS und FMI dabei, einen Test zu entwickeln. TSRO versucht dies ebenfalls zusammen mit MYGN:

Gruß
ipollit
Dass CLVS mit dem FMI-Test Patienten finden kann, die auch ohne BRCA-Mutation auf den PARP-Hemmer ansprechen, ist sehr gut.
Clovis’ “BRCAness” DNA signature predicts which patients respond to rucaparib therapy:
- Overall response rate (ORR) of 70% in BRCA-mutant patients; responses observed in patients with both germline and somatic mutations
- ORR of 40% in patients with BRCAness signature (all BRCA wild-type)
- ORR of only 8% in patients without BRCAness signature (all BRCA wild-type)
Approximately 67% of patients treated to date exhibit BRCAness DNA signature or BRCA-mutant status
Diese Ergebnisse sind von Ovarian-Cancer Patienten. Ich bin gespannt, ob man den Test auch auf andere Krebsarten anwenden kann. Schließlich sind die Mutationen ja nicht speziell für eine Krebsart relevant. PARP-Hemmer spielen bei der Zellteilung eine Rolle... schnelle, ungehemmte Zellteilungen sind eine grundsärtliche Eigenschaft von Krebs.
Hier sind z.B. Hinweise von einer Wirkung von PARP-Hemmern bei NSCLC in Kombi mit einer Chemo (die ebenfalls auf die Zellteilung wirkt):
http://www.onclive.com/web-exclusives/PARP-Inhibitor-Shows-P…
PARP Inhibitor Shows Potential in Squamous Cell Lung Cancer
There remains an unmet need for treatment options for patients with squamous cell non-small cell lung cancer (NSCLC), heightening the need for novel therapies. At the 2014 ESMO Congress, Suresh S. Ramalingam, MD, presented preliminary data from a randomized phase II trial that demonstrated an improvement in outcomes with the combination of the PARP inhibitor veliparib and chemotherapy in patients with this hard to treat histology.
... PARP is a protein that’s involved in DNA repair and veliparib is a very potent inhibitor of PARP1 and PARP2. Basically, when you give a PARP inhibitor, the cell is not able to repair DNA damage effectively. What we’ve seen in the past is if the cells have deficiency in homologous recombination repairs, which is what happens in BRCA mutation settings, those cells become far more dependent on the basic repair pathway, which is exactly where the PARP comes into play...
So essentially by blocking DNA in cells that are critically dependent on that pathway, you are able to induce lethal damage. In lung cancer, if you look at what the common modalities of treatment are, we use platinum compounds, which are the cornerstones of therapy, and then we use radiation and both of these work by inducing DNA damage. Cells that can repair the DNA damage end up not being sensitive to radiation or chemotherapy with platinum-based regimens...
There is certainly room for additional novel combination regimens. As monotherapy in lung cancer, we don’t think veliparib is going to be an effective agent unless, of course, we identify potentially a group of patients who have low BRCA function, not mutation, but function. That’s a group that’s not particularly a high proportion and we haven’t done much work in that group with any drug, for that matter...
Z.B. bei Lungenkrebs gehört die Chemo oder Strahlentherapie zum Standard. Krebszellen können diese überstehen, wenn die Zellen die DNA-Schäden in den Kebszellen wieder reparieren. PARP-Hemmer verhindern diese Reparatur zu einem Teil. Wenn dann noch weitere Fehler im Repartur-Mechanismus durch z.B. Mutationen wir BRCA vorhanden sind, stirbt die Zelle.
Das Problem ist nur, diese weiteren Fehler zu finden. Oben steht, dass BCRA-Fehler bei Lungenkrebs nicht so häufig sind. Z.B. der FMI-Test könnte aber weitere Patienten identifizieren, die auf PARP ansprechen. Das man so einen Test so wertvoll.
*****
Allerdings sind nicht nur CLVS und FMI dabei, einen Test zu entwickeln. TSRO versucht dies ebenfalls zusammen mit MYGN:

Gruß
ipollit
Antwort auf Beitrag Nr.: 48.369.083 von kmastra am 20.11.14 12:51:19CLVS
"Ein m.E. durchaus gescheiter Schreiber weist darauf hin, dass CLVS schwierigere Patienten rekrutiert hat als AZN."
... meinst du Paul DeSantis?
Ein interessanter Aspekt ist auch, dass sich CLVS Rucaparib vielleicht besser mit IO-Therapien wie PD1-AKs kombinieren lassen. Letztere dürften in Zukunft in NSCLC eine große Rolle spielen.
http://seekingalpha.com/article/2695385-cominus-1686-data-co…
"... NSCLC represents the largest sales opportunity for I/O drugs according to sell-side estimates. Consequently, there are significant opportunities for differentiation based upon synergies with EGFRm+ targeted TKI's. However, we highlight for investors that thus far the rate-limiting factor in I/O combos has been related to toxicities. Moreover, we cannot understate that I/O combinations are most likely going to be selected based on a benign tox profile related to disease specific side effects (ILDs).
..., we view AZD-9291's numerical increase in ILD's (13 in total, 2 new Grade 3 events since ASCO 2014), and 5% occurrence of QTc prolongation as burdensome, and increases developmental I/O combination risk where overlapping pulmonary toxicity is a major concern to us.
... In our view hyperglycemia is always preferable to unpredictable and severe ILDs, which in one KOLs view, "we are always concerned about lung events in NSCLC." While hyperglycemia is in fact a "side effect," it is not a severe risk to the patients life; it is predictable and manageable, whereas ILDs are random and life threatening." ...
...This is in direct contrast AZD-9291 trial's that excludes heart failure patients, and those at risk of an interstitial lung event (ILDs)...
AZD-9291 hat eine deutlich höhere ILD-Rate (Interstitielle Lungenerkrankung). PD-1 kann Probleme in der Lunge machen, da die hemmenden Mechanismen den Immunsystems gesenkt werden, um den Krebs zu bekämpfen, was gleichzeitig aber auch Entzündungen der Lungen, die ja über die Luft viele Stoffe aus der Umwelt aufnehmen, provoziert. ILD ist bei den PD-1 Studien in der Regel ein Ausschluss-Kriterium... z.B. Nivolumab NSCLC PIII: http://clinicaltrials.gov/ct2/show/NCT01642004?term=Nivoluma… "Exclusion Criteria:... Subjects with interstitial lung disease that is symptomatic or may interfere with the detection or management of suspected drug-related pulmonary toxicity"

D.h. AZD-9291 und PD-1 AKs haben dieselben Ausschluss-Kriterien ILD aufgrund möglicher Probleme mit der Lunge. Dies weist auf eine überlappende Nebenwirkung hin, die zudem gefährlich und unberechenbar ist.
Die gravierenste Nebenwirkung von Rucaparib ist dagegen die temporäre Zuckerkrankheit. Diese lässt sich laut CLVS leicht mit einer Tablette beheben und spielt zudem bei einer PD-1 Therapie keine Rolle.
Ohad Hammer hat vor einem Jahr auch auf "überlappende Nebenwirkungen" hingewiesen:
"Regarding CLVS vs. AZN. I think it’s safe to say both drugs look active in T790M NSCLC even though it’s hard to predict the eventual clinical profiles of each drug. To me, the fact CLVS’ recruit patients only immediately after progression on Tarceva (or other EGFR inhibitor) makes their case more compelling. In addition, CLVS’ compound might be more wild type EGFR sparing based on some rast AZN reported.
Wit respect to PD-1, I don’t view them as a threat to EGFR inhibitors as I believe the vast majority of EGFR mutated cases will be treated with EGFR inhibitors, let alone patients with a documented T790M mutation. Combination of the two classes of drugs is very likely down the road (no overlapping toxicities)."

Gruß
ipollit
"Ein m.E. durchaus gescheiter Schreiber weist darauf hin, dass CLVS schwierigere Patienten rekrutiert hat als AZN."
... meinst du Paul DeSantis?
Ein interessanter Aspekt ist auch, dass sich CLVS Rucaparib vielleicht besser mit IO-Therapien wie PD1-AKs kombinieren lassen. Letztere dürften in Zukunft in NSCLC eine große Rolle spielen.
http://seekingalpha.com/article/2695385-cominus-1686-data-co…
"... NSCLC represents the largest sales opportunity for I/O drugs according to sell-side estimates. Consequently, there are significant opportunities for differentiation based upon synergies with EGFRm+ targeted TKI's. However, we highlight for investors that thus far the rate-limiting factor in I/O combos has been related to toxicities. Moreover, we cannot understate that I/O combinations are most likely going to be selected based on a benign tox profile related to disease specific side effects (ILDs).
..., we view AZD-9291's numerical increase in ILD's (13 in total, 2 new Grade 3 events since ASCO 2014), and 5% occurrence of QTc prolongation as burdensome, and increases developmental I/O combination risk where overlapping pulmonary toxicity is a major concern to us.
... In our view hyperglycemia is always preferable to unpredictable and severe ILDs, which in one KOLs view, "we are always concerned about lung events in NSCLC." While hyperglycemia is in fact a "side effect," it is not a severe risk to the patients life; it is predictable and manageable, whereas ILDs are random and life threatening." ...
...This is in direct contrast AZD-9291 trial's that excludes heart failure patients, and those at risk of an interstitial lung event (ILDs)...
AZD-9291 hat eine deutlich höhere ILD-Rate (Interstitielle Lungenerkrankung). PD-1 kann Probleme in der Lunge machen, da die hemmenden Mechanismen den Immunsystems gesenkt werden, um den Krebs zu bekämpfen, was gleichzeitig aber auch Entzündungen der Lungen, die ja über die Luft viele Stoffe aus der Umwelt aufnehmen, provoziert. ILD ist bei den PD-1 Studien in der Regel ein Ausschluss-Kriterium... z.B. Nivolumab NSCLC PIII: http://clinicaltrials.gov/ct2/show/NCT01642004?term=Nivoluma… "Exclusion Criteria:... Subjects with interstitial lung disease that is symptomatic or may interfere with the detection or management of suspected drug-related pulmonary toxicity"

D.h. AZD-9291 und PD-1 AKs haben dieselben Ausschluss-Kriterien ILD aufgrund möglicher Probleme mit der Lunge. Dies weist auf eine überlappende Nebenwirkung hin, die zudem gefährlich und unberechenbar ist.
Die gravierenste Nebenwirkung von Rucaparib ist dagegen die temporäre Zuckerkrankheit. Diese lässt sich laut CLVS leicht mit einer Tablette beheben und spielt zudem bei einer PD-1 Therapie keine Rolle.
Ohad Hammer hat vor einem Jahr auch auf "überlappende Nebenwirkungen" hingewiesen:
"Regarding CLVS vs. AZN. I think it’s safe to say both drugs look active in T790M NSCLC even though it’s hard to predict the eventual clinical profiles of each drug. To me, the fact CLVS’ recruit patients only immediately after progression on Tarceva (or other EGFR inhibitor) makes their case more compelling. In addition, CLVS’ compound might be more wild type EGFR sparing based on some rast AZN reported.
Wit respect to PD-1, I don’t view them as a threat to EGFR inhibitors as I believe the vast majority of EGFR mutated cases will be treated with EGFR inhibitors, let alone patients with a documented T790M mutation. Combination of the two classes of drugs is very likely down the road (no overlapping toxicities)."

Gruß
ipollit
Antwort auf Beitrag Nr.: 48.386.531 von Popeye82 am 22.11.14 00:20:00
Daran wäre ich auch sehr interessiert.
Gruß
Frührentner
Zitat von Popeye82:Zitat von SLGramann: Präsentation von KITE:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Muss man eigentlich mal gesehen haben. Die CAR-Technologie riecht schon nach Revolution. Natürlich bleibt erst mal unklar, wer da wirklich die Nase vorn hat, aber sicher ist Platz für mehrere Player und bei Kite hat sich offenkundig ne Menge Potential versammelt.
Sehr schade, dass Hammer zu dem Unternehmen nicht Stellung nehmen darf. Ich glaube, das gesamte Feld ist heißer, als damals die ADCs. Vielleicht vergleichbar mit PD-1 und Co.
wenn Du willst kann ich Dir/Euch, richtige, Recherche zu Kite Pharma geben
ich habe 0,0 Ahnung von dieser Firma
Gruß
P.
Daran wäre ich auch sehr interessiert.
Gruß
Frührentner
Antwort auf Beitrag Nr.: 48.369.083 von kmastra am 20.11.14 12:51:19CLVS
das zweite Argument von Paul DeSantis fand ich auch immer merkwürdig. Ich kann mich noch gut daran erinnern, dass so manche damals AVEO's Tivozanib PIII kritisch gesehen haben, weil sie hauptsächlich in Osteuropa und nicht in den USA oder Westeuropa durchgeführt worden ist. Eigentlich war die PIII gut und mutig, weil sie gegen ein aktives Medikament getestet haben. Der primäre Endpunkt PFS war erfolgreich und ausreichend für eine Zulassung (OS später nicht, laut AVEO wegen cross-over). Die FDA hat die PIII aber nicht anerkannt... insbesondere auch weil die Studie nicht in der westlichen Welt durchgeführt worden ist:
http://www.bostonglobe.com/business/2013/08/25/what-went-wro…
"Another issue bothered regulators. They complained that too many patients from central and eastern European countries — where there are fewer cancer drugs and it is easier to enroll patients in trials — made the testing tougher to evaluate. Those patients made up 88 percent of participants in the trial, compared with only 8 percent from the United States.
“With this small number of patients” from the United States and Western Europe, “we cannot draw firm conclusions concerning regional differences,” said J. Dawn Arrington, an FDA medical officer."
Nach der Ablehnung wurde in den Foren darüber diskutiert, ob Studien, die nicht in Amerika durchgeführt werden, generell kritisch zu sehen sind, weil sich positive Ergebnisse oft nicht in den USA repoduzieren lassen. Es wurden viele entsprechende Beispiele genannt. Als ich zum ersten Mal von AZD-9291 gehört habe, fand ich es vor diesem Hintergrund auch etwas unfair, dass man die Ergebnisse von AZD-9291, die zumindest damals hauptsächlich in Asien gewonnen worden sind, mit Rociletinib, das hauptsächlich in den USA getestet wurde, verglichen hat.
Das heißt zwar nicht, dass AZD-9291 nicht auch die gleichen Ergebnisse in den USA erzielen kann, doch fände ich einen direkten Vergleich in den USA fairer. Zwischen Asien und Europa/Amerika gibt es einen großen Unterschied, was die Verbreitung der EGFR-Mutation betrifft. Ursache könnten genetische Gründe oder eine andere Lebensweise sein. Somit könnte aber auch EGFR-mut NSCLC insgesamt etwas anders sein zwischen Asien und den USA und zu einer unterschiedlich guten Wirkung von EGFR-Hemmern in den verschiedenen Regionen führen.
Zudem sind die Patienten in der CLVS-Studie deutlich stärker vorbehandelt und damit schwerer zu behandeln. Bei den letzten CLDX-Ergebnissen wird von Unterschieden in den Patienten-Status zwischen den Studien-Armen gesprochen und das kritisch angemerkt... warum erwähnt das niemand bei der AZN-Studie?
Gruß
ipollit
das zweite Argument von Paul DeSantis fand ich auch immer merkwürdig. Ich kann mich noch gut daran erinnern, dass so manche damals AVEO's Tivozanib PIII kritisch gesehen haben, weil sie hauptsächlich in Osteuropa und nicht in den USA oder Westeuropa durchgeführt worden ist. Eigentlich war die PIII gut und mutig, weil sie gegen ein aktives Medikament getestet haben. Der primäre Endpunkt PFS war erfolgreich und ausreichend für eine Zulassung (OS später nicht, laut AVEO wegen cross-over). Die FDA hat die PIII aber nicht anerkannt... insbesondere auch weil die Studie nicht in der westlichen Welt durchgeführt worden ist:
http://www.bostonglobe.com/business/2013/08/25/what-went-wro…
"Another issue bothered regulators. They complained that too many patients from central and eastern European countries — where there are fewer cancer drugs and it is easier to enroll patients in trials — made the testing tougher to evaluate. Those patients made up 88 percent of participants in the trial, compared with only 8 percent from the United States.
“With this small number of patients” from the United States and Western Europe, “we cannot draw firm conclusions concerning regional differences,” said J. Dawn Arrington, an FDA medical officer."
Nach der Ablehnung wurde in den Foren darüber diskutiert, ob Studien, die nicht in Amerika durchgeführt werden, generell kritisch zu sehen sind, weil sich positive Ergebnisse oft nicht in den USA repoduzieren lassen. Es wurden viele entsprechende Beispiele genannt. Als ich zum ersten Mal von AZD-9291 gehört habe, fand ich es vor diesem Hintergrund auch etwas unfair, dass man die Ergebnisse von AZD-9291, die zumindest damals hauptsächlich in Asien gewonnen worden sind, mit Rociletinib, das hauptsächlich in den USA getestet wurde, verglichen hat.
Das heißt zwar nicht, dass AZD-9291 nicht auch die gleichen Ergebnisse in den USA erzielen kann, doch fände ich einen direkten Vergleich in den USA fairer. Zwischen Asien und Europa/Amerika gibt es einen großen Unterschied, was die Verbreitung der EGFR-Mutation betrifft. Ursache könnten genetische Gründe oder eine andere Lebensweise sein. Somit könnte aber auch EGFR-mut NSCLC insgesamt etwas anders sein zwischen Asien und den USA und zu einer unterschiedlich guten Wirkung von EGFR-Hemmern in den verschiedenen Regionen führen.
Zudem sind die Patienten in der CLVS-Studie deutlich stärker vorbehandelt und damit schwerer zu behandeln. Bei den letzten CLDX-Ergebnissen wird von Unterschieden in den Patienten-Status zwischen den Studien-Armen gesprochen und das kritisch angemerkt... warum erwähnt das niemand bei der AZN-Studie?
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.389.366 von ipollit am 22.11.14 20:47:02Rucaparib ... muss natürlich Rociletinib heißen... lässt sich nicht so gut auseinander halten
Antwort auf Beitrag Nr.: 48.386.381 von Popeye82 am 21.11.14 22:58:42ZSPH
habe ich vor einiger Zeit auf einer Liste von einer Bank mit unverpartnerten PIIIs gesehen. Ich fand es von den möglichen Peak Sales im Verhältnis zur MK her interessant.
Hyperkalemia ist schon eine bedeutende Indikation... es geht auch in so eine Richtung wie z.B. EPO, da es auch eine Folge von Nierenproblemen ist.
ZSPH scheint sich ein Kopf an Kopf Rennen mit RLYP zu liefern.
http://seekingalpha.com/article/2495515-relypsa-and-zs-pharm…
Gab es vor Kurzem nicht aber auch Probleme mit Wasseransammlungen/Schwellungen?...
$ZSPH weak today- AHA presentation suggests edema as a non-trivial side effect, certainly impacts the chronic use thesis. Analyst day Wed
***
$RLYP The market here is actually quite large. The acute setting is big but chronic is certainly bigger. $ZSPH may win acute setting
***
@Sharma1981N Given the faster onset, though we often treat K+ of 5.8-6.3 inpt where it just needs to stop going up.Can start rlyp drug there
***
@Sharma1981N If any EKG changes or higher K+ $ZSPH ×24-48hrs makes sense. But can then transition to $RLYP drug
***
@Sharma1981N In the outpatient setting side effects are everything. Cant tell you how many times norvasc stopped due to pt. edema complaints

ZSPH habe ich definitiv auf meiner Beobachtungsliste... im Moment habe ich ca. 30 Werte im Depot, so dass ich nicht überall gleich einsteigen möchte. Bei ZSPH wird es aber interessant, wenn sie die Zulassung für ZS-9 erhalten sollten und dann anfangen, Umsätze zu generieren.
Wäre dann aber nicht wirklich eine 50:50 Position ZSPH + RLYP sicherer?... beide mit einer etwa gleichen MK von 800 Mio USD.
Gruß
ipollit
habe ich vor einiger Zeit auf einer Liste von einer Bank mit unverpartnerten PIIIs gesehen. Ich fand es von den möglichen Peak Sales im Verhältnis zur MK her interessant.
Hyperkalemia ist schon eine bedeutende Indikation... es geht auch in so eine Richtung wie z.B. EPO, da es auch eine Folge von Nierenproblemen ist.
ZSPH scheint sich ein Kopf an Kopf Rennen mit RLYP zu liefern.
http://seekingalpha.com/article/2495515-relypsa-and-zs-pharm…
Gab es vor Kurzem nicht aber auch Probleme mit Wasseransammlungen/Schwellungen?...
$ZSPH weak today- AHA presentation suggests edema as a non-trivial side effect, certainly impacts the chronic use thesis. Analyst day Wed
***
$RLYP The market here is actually quite large. The acute setting is big but chronic is certainly bigger. $ZSPH may win acute setting
***
@Sharma1981N Given the faster onset, though we often treat K+ of 5.8-6.3 inpt where it just needs to stop going up.Can start rlyp drug there
***
@Sharma1981N If any EKG changes or higher K+ $ZSPH ×24-48hrs makes sense. But can then transition to $RLYP drug
***
@Sharma1981N In the outpatient setting side effects are everything. Cant tell you how many times norvasc stopped due to pt. edema complaints

ZSPH habe ich definitiv auf meiner Beobachtungsliste... im Moment habe ich ca. 30 Werte im Depot, so dass ich nicht überall gleich einsteigen möchte. Bei ZSPH wird es aber interessant, wenn sie die Zulassung für ZS-9 erhalten sollten und dann anfangen, Umsätze zu generieren.
Wäre dann aber nicht wirklich eine 50:50 Position ZSPH + RLYP sicherer?... beide mit einer etwa gleichen MK von 800 Mio USD.
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.199.933 von ipollit am 02.11.14 22:52:27IPH.PA
Kann das sein?
https://twitter.com/oru2day/with_replies
$IPH.PA corporate presentation Q4 update - english - now available on IPH website http://bit.ly/1xTMpLY [confirmed 2015 lirilumab read out]
***
$IPH corp present IPH22 : 3 P2 trials launch within 3 mths "Potential for rapid path to registration / Rapid read out of primary endpoints"
***
$IPH.PA I met mangt & confirmed: IPH22 H&N P2 launch within next weeks; other IPH22 P2 launch plan perfect on track; IPH41 P1 launch Q2-2015
***
$IPH.PA also confirmed that IPH22 trials read out will be quite fast (a few months) ; can expect data to flow during the year 2015
***
$IPH.PA also confirmed Effikir P2 primary measure outcome (Lukemia Free Survival) read-out upon 100th patient 20 months follow-up: END 2015
Hat derjenige etwas falsch verstanden? So ganz kann ich es mir nicht vorstellen, dass man innerhalb weniger Monate Ergebnisse erhält, aufgrund derer man eine Zulassung beantragen kann.
http://innate-pharma.com/sites/default/files/sites/default/f…


IPH22 finde ich zumindest spannend und die Entwicklung scheint sehr schnell zu sein... IPH hat 100% der Rechte, wenn ich es richtig sehe... anders als z.B. bei KIR.
Meine IPH-Position werde ich noch ein wenig aufstocken.

Gruß
ipollit
Kann das sein?
https://twitter.com/oru2day/with_replies
$IPH.PA corporate presentation Q4 update - english - now available on IPH website http://bit.ly/1xTMpLY [confirmed 2015 lirilumab read out]
***
$IPH corp present IPH22 : 3 P2 trials launch within 3 mths "Potential for rapid path to registration / Rapid read out of primary endpoints"
***
$IPH.PA I met mangt & confirmed: IPH22 H&N P2 launch within next weeks; other IPH22 P2 launch plan perfect on track; IPH41 P1 launch Q2-2015
***
$IPH.PA also confirmed that IPH22 trials read out will be quite fast (a few months) ; can expect data to flow during the year 2015
***
$IPH.PA also confirmed Effikir P2 primary measure outcome (Lukemia Free Survival) read-out upon 100th patient 20 months follow-up: END 2015
Hat derjenige etwas falsch verstanden? So ganz kann ich es mir nicht vorstellen, dass man innerhalb weniger Monate Ergebnisse erhält, aufgrund derer man eine Zulassung beantragen kann.
http://innate-pharma.com/sites/default/files/sites/default/f…


IPH22 finde ich zumindest spannend und die Entwicklung scheint sehr schnell zu sein... IPH hat 100% der Rechte, wenn ich es richtig sehe... anders als z.B. bei KIR.
Meine IPH-Position werde ich noch ein wenig aufstocken.
Gruß
ipollit
In welche Biotechs aus dem IO-Bereich kann man investieren? D.h. alles, was irgendwie auf das Immunsystem wirkt, um den Krebs zu bekämpfen...
Investiert bin ich in (jeweils mit Target)...
INCY - JAK, IDO
FPRX - CSF-1R
ISIS - STAT3 (RNAi)
PCYC - ITK
AGEN - GITR, OX40
TSRO - TIM3, LAG3 (inkl. biAKs)
MGNX - B7-H3, x-CD3 (DARTs)
CLDX - CD27, FLT3(?)
IPH.PA - KIR, NKG2A, MICA
SGEN - CD40
ARRY/VentiRx - TLR8
IMMU - CEACAM5(? über CEACAM1,TIM3?)
Desweiteren kenne ich noch (mit MK):
SCTPF Trillium (42/150?) - SIRPaFc
BLUE Bluebird (1190) - CART
KITE Kite (1710) - CART/TCR
ALCLS.PA Cellectis (357) - allogeneic CART/TCR
CCXI ChemoCentryx (203) - CCR2, CCR4, CXCR6, CXCR7, CXCL12...
DRNA Dicerna (197) - MYC (siRNA)
NKTR Nektar (1880) - IL2
Gibt es noch weitere?
Grüße
ipollit
Investiert bin ich in (jeweils mit Target)...
INCY - JAK, IDO
FPRX - CSF-1R
ISIS - STAT3 (RNAi)
PCYC - ITK
AGEN - GITR, OX40
TSRO - TIM3, LAG3 (inkl. biAKs)
MGNX - B7-H3, x-CD3 (DARTs)
CLDX - CD27, FLT3(?)
IPH.PA - KIR, NKG2A, MICA
SGEN - CD40
ARRY/VentiRx - TLR8
IMMU - CEACAM5(? über CEACAM1,TIM3?)
Desweiteren kenne ich noch (mit MK):
SCTPF Trillium (42/150?) - SIRPaFc
BLUE Bluebird (1190) - CART
KITE Kite (1710) - CART/TCR
ALCLS.PA Cellectis (357) - allogeneic CART/TCR
CCXI ChemoCentryx (203) - CCR2, CCR4, CXCR6, CXCR7, CXCL12...
DRNA Dicerna (197) - MYC (siRNA)
NKTR Nektar (1880) - IL2
Gibt es noch weitere?
Grüße
ipollit
wieder ein Doppelschreiben
und wieder Sorry, aber ich möchte die Formatierung nicht, nochmal, umarbeiten
T2 Biosystems Receives FDA Authorization to Market T2Candida +T2Dx for the Detection of Sepsis-Causing Pathogens, Novel test to identify Candida, one of the most lethal forms of common bloodstream infections that cause sepsis, faster than current methods –hours instead of days, >10,000,000 people tested for Candida every year
matt@purecommunicationsinc.com
949-370-8500
http://investors.t2biosystems.com/phoenix.zhtml?c=253528&p=i…
www.wsw.com/webcast/canaccord16/register.aspx?conf=canaccord…
"LEXINGTON, Mass., Sept. 22, 2014 (GLOBE NEWSWIRE) -- T2 Biosystems (Nasdaq:TTOO), a company developing innovative diagnostic products to improve patient health, today announced that it has received market authorization from the U.S. Food and Drug Administration (FDA) for its first two products, the T2Candida® Panel and the T2Dx® Instrument for the direct detection of Candida species in human whole blood specimens from patients with symptoms of, or medical conditions predisposing the patient to, invasive fungal infections. T2Candida and T2Dx, for the first time, provide sensitive detection of specific sepsis-causing pathogens directly from a whole blood specimen in approximately four hours. All other currently FDA-cleared detection systems require cultured blood samples for species-specific identification and take two to five days or more to provide results.
"T2Candida and T2Dx have the potential to quickly change the hospital care paradigm and improve outcomes by offering a new and effective screening option for patients who are at-risk or suspected of having sepsis," said Eleftherios Mylonakis, M.D., Ph.D., FIDSA, chief, Division of Infectious Diseases, Dean's Professor of Medical Science, Professor of Medicine, Rhode Island Hospital and The Miriam Hospital, Providence, R.I. "Compared to current blood-culture based diagnostic methods, T2Candida and T2Dx give us an option that provides specific and dependable results in a matter of hours, not days, allowing us to direct the right therapy to our patients – potentially saving their lives."
In the pivotal trial, T2Candida and T2Dx demonstrated a sensitivity of 91.1 percent and a specificity of 99.4 percent. The mean time to a positive result for T2Candida was 4.4 hours versus 129 hours for blood culture and species identification, the current gold standard. The mean time for a negative result for T2Candida was 4.2 hours, compared to 120 hours for blood culture. Both T2Candida and T2Dx were reviewed under the FDA de novo classification process for devices with low-to-moderate risk that are first-of-a-kind.
Studies have shown that if Candida can be diagnosed and treated with targeted therapy beginning within 12 hours of the presentation of symptoms, the associated mortality rate can be reduced from approximately 40 percent to 11 percent. Additionally, a typical patient with a Candida infection averages 40 days in the hospital, including nine days in intensive care, resulting in an average cost per hospital stay of more than $130,000 per patient. In a study published in the American Journal of Respiratory and Critical Care Medicine, providing targeted antifungal therapy within 24 hours of the presentation of symptoms decreased the length of hospital stay by approximately 10 days and decreased the average cost of care by approximately $30,000 per patient.
Due to the high mortality rate and cost of Candida infections, many hospitals initiate potentially inappropriate antifungal drugs while waiting for blood culture-based diagnostic results. A negative result from T2Candida may provide timely data allowing physicians to avoid or suspend unnecessary antifungal treatment. This could result in a further reduction of treatment costs, as well as potentially helping to reduce antimicrobial resistant organisms, which the Centers for Disease Control and Prevention has called "one of our most serious health threats."
T2Candida and T2Dx are the first diagnostic products powered by T2MR®, an innovative and proprietary magnetic resonance-based diagnostic technology platform that offers a fast, sensitive and simple alternative to existing diagnostic methodologies.
To date, more than 100 peer-reviewed publications have featured T2MR in a variety of studies, including the direct detection and measurement of targets in various sample types, such as whole blood, plasma, serum, saliva, sputum and urine.
"The FDA's market authorization of T2Candida and T2Dx mark a significant milestone for our Company, but more importantly for the more than 800,000 U.S. physicians across the country in need of faster diagnostic results so they can make timely and informed treatment decisions for their patients," said John McDonough, president and CEO of T2 Biosystems. "We believe the diagnostic capabilities offered by these products can support both improved clinical outcomes, as well as strong health economic benefits, and we look forward to working closely with the medical community to bring this novel diagnostic test to hospitals, physicians and patients."
About Sepsis
Sepsis is one of the leading causes of death in the U.S. and the most expensive hospital-treated condition, with costs to the healthcare system exceeding $20 billion each year, according to the U.S. Department of Health and Human Services. T2Candida uses magnetic resonance technology to help detect the presence of five clinically relevant species of Candida, the most lethal form of common blood stream infections that cause sepsis, directly from a patient's blood sample in approximately four hours, versus two to five days or more with current diagnostic methods.
About T2 Biosystems
T2 Biosystems is focused on developing innovative diagnostic products to improve patient health. With two FDA authorized products targeting sepsis and a range of additional products in development, T2 Biosystems is an emerging leader in the field of in vitro diagnostics. The Company is utilizing its proprietary T2 Magnetic Resonance platform, or T2MR, to develop a broad set of applications aimed at lowering mortality rates, improving patient outcomes and reducing the cost of healthcare by helping medical professionals make targeted treatment decisions earlier. T2MR enables the fast and sensitive detection of pathogens, biomarkers and other abnormalities in a variety of unpurified patient sample types, including whole blood, eliminating the time-consuming sample prep required in current methods. For more information, please visit www.t2biosystems.com. "
und wieder Sorry, aber ich möchte die Formatierung nicht, nochmal, umarbeiten
T2 Biosystems Receives FDA Authorization to Market T2Candida +T2Dx for the Detection of Sepsis-Causing Pathogens, Novel test to identify Candida, one of the most lethal forms of common bloodstream infections that cause sepsis, faster than current methods –hours instead of days, >10,000,000 people tested for Candida every year
matt@purecommunicationsinc.com
949-370-8500
http://investors.t2biosystems.com/phoenix.zhtml?c=253528&p=i…
www.wsw.com/webcast/canaccord16/register.aspx?conf=canaccord…
"LEXINGTON, Mass., Sept. 22, 2014 (GLOBE NEWSWIRE) -- T2 Biosystems (Nasdaq:TTOO), a company developing innovative diagnostic products to improve patient health, today announced that it has received market authorization from the U.S. Food and Drug Administration (FDA) for its first two products, the T2Candida® Panel and the T2Dx® Instrument for the direct detection of Candida species in human whole blood specimens from patients with symptoms of, or medical conditions predisposing the patient to, invasive fungal infections. T2Candida and T2Dx, for the first time, provide sensitive detection of specific sepsis-causing pathogens directly from a whole blood specimen in approximately four hours. All other currently FDA-cleared detection systems require cultured blood samples for species-specific identification and take two to five days or more to provide results.
"T2Candida and T2Dx have the potential to quickly change the hospital care paradigm and improve outcomes by offering a new and effective screening option for patients who are at-risk or suspected of having sepsis," said Eleftherios Mylonakis, M.D., Ph.D., FIDSA, chief, Division of Infectious Diseases, Dean's Professor of Medical Science, Professor of Medicine, Rhode Island Hospital and The Miriam Hospital, Providence, R.I. "Compared to current blood-culture based diagnostic methods, T2Candida and T2Dx give us an option that provides specific and dependable results in a matter of hours, not days, allowing us to direct the right therapy to our patients – potentially saving their lives."
In the pivotal trial, T2Candida and T2Dx demonstrated a sensitivity of 91.1 percent and a specificity of 99.4 percent. The mean time to a positive result for T2Candida was 4.4 hours versus 129 hours for blood culture and species identification, the current gold standard. The mean time for a negative result for T2Candida was 4.2 hours, compared to 120 hours for blood culture. Both T2Candida and T2Dx were reviewed under the FDA de novo classification process for devices with low-to-moderate risk that are first-of-a-kind.
Studies have shown that if Candida can be diagnosed and treated with targeted therapy beginning within 12 hours of the presentation of symptoms, the associated mortality rate can be reduced from approximately 40 percent to 11 percent. Additionally, a typical patient with a Candida infection averages 40 days in the hospital, including nine days in intensive care, resulting in an average cost per hospital stay of more than $130,000 per patient. In a study published in the American Journal of Respiratory and Critical Care Medicine, providing targeted antifungal therapy within 24 hours of the presentation of symptoms decreased the length of hospital stay by approximately 10 days and decreased the average cost of care by approximately $30,000 per patient.
Due to the high mortality rate and cost of Candida infections, many hospitals initiate potentially inappropriate antifungal drugs while waiting for blood culture-based diagnostic results. A negative result from T2Candida may provide timely data allowing physicians to avoid or suspend unnecessary antifungal treatment. This could result in a further reduction of treatment costs, as well as potentially helping to reduce antimicrobial resistant organisms, which the Centers for Disease Control and Prevention has called "one of our most serious health threats."
T2Candida and T2Dx are the first diagnostic products powered by T2MR®, an innovative and proprietary magnetic resonance-based diagnostic technology platform that offers a fast, sensitive and simple alternative to existing diagnostic methodologies.
To date, more than 100 peer-reviewed publications have featured T2MR in a variety of studies, including the direct detection and measurement of targets in various sample types, such as whole blood, plasma, serum, saliva, sputum and urine.
"The FDA's market authorization of T2Candida and T2Dx mark a significant milestone for our Company, but more importantly for the more than 800,000 U.S. physicians across the country in need of faster diagnostic results so they can make timely and informed treatment decisions for their patients," said John McDonough, president and CEO of T2 Biosystems. "We believe the diagnostic capabilities offered by these products can support both improved clinical outcomes, as well as strong health economic benefits, and we look forward to working closely with the medical community to bring this novel diagnostic test to hospitals, physicians and patients."
About Sepsis
Sepsis is one of the leading causes of death in the U.S. and the most expensive hospital-treated condition, with costs to the healthcare system exceeding $20 billion each year, according to the U.S. Department of Health and Human Services. T2Candida uses magnetic resonance technology to help detect the presence of five clinically relevant species of Candida, the most lethal form of common blood stream infections that cause sepsis, directly from a patient's blood sample in approximately four hours, versus two to five days or more with current diagnostic methods.
About T2 Biosystems
T2 Biosystems is focused on developing innovative diagnostic products to improve patient health. With two FDA authorized products targeting sepsis and a range of additional products in development, T2 Biosystems is an emerging leader in the field of in vitro diagnostics. The Company is utilizing its proprietary T2 Magnetic Resonance platform, or T2MR, to develop a broad set of applications aimed at lowering mortality rates, improving patient outcomes and reducing the cost of healthcare by helping medical professionals make targeted treatment decisions earlier. T2MR enables the fast and sensitive detection of pathogens, biomarkers and other abnormalities in a variety of unpurified patient sample types, including whole blood, eliminating the time-consuming sample prep required in current methods. For more information, please visit www.t2biosystems.com. "
Antwort auf Beitrag Nr.: 48.389.651 von ipollit am 22.11.14 23:13:58
nur um das mal richtigzustellen -ich stecke gerade, noch, -bei Med/Biotechunternehmen- in den aaallerersten Babyschuhen
für mich geht es darum, überhaupt, erstmal 'ein bisschen ein Gefühl zu bekommen', um zu sehen ob Biotechnologiefirmen eine ernsthafte Alternative/(An)Teil für mich werden können
würde dazu demnächst gern nochmal ein paar Zeilen mehr schreiben
Gruß
Popeye
nur um das mal richtigzustellen -ich stecke gerade, noch, -bei Med/Biotechunternehmen- in den aaallerersten Babyschuhen
für mich geht es darum, überhaupt, erstmal 'ein bisschen ein Gefühl zu bekommen', um zu sehen ob Biotechnologiefirmen eine ernsthafte Alternative/(An)Teil für mich werden können
würde dazu demnächst gern nochmal ein paar Zeilen mehr schreiben
Gruß
Popeye
Antwort auf Beitrag Nr.: 48.389.582 von ipollit am 22.11.14 22:24:46"Zudem sind die Patienten in der CLVS-Studie deutlich stärker vorbehandelt und damit schwerer zu behandeln. Bei den letzten CLDX-Ergebnissen wird von Unterschieden in den Patienten-Status zwischen den Studien-Armen gesprochen und das kritisch angemerkt... warum erwähnt das niemand bei der AZN-Studie?"
Hallo ipollit,
das geht spätestens seit der ASCO so, dass alles was AZN macht, angeblich viel toller ist, als das was CLVS liefert. Da wurde so getan, als ob AZN inzwischen einen signifikanten Zeitvorsprung habe, was mittlerweile schon wieder weitgehend relativiert werden musste. Da wurde so getan, als habe AZN das signifikant bessere NW-Profil, wobei man selbst "Grad 5-Vorfälle" keiner Nachfrage wert fand.
Für das "geschönte" Studiendesign bei AZN hat mir erst DeSantis die Augen geöffnet. Finde ich schon ziemlich krass.
Dass Du das Argument von DeSantis merkwürdig findest bezieht sich natürlich auf den Sachverhalt und nicht auf das Argument an sich, richtig?
AZN steht ja ziemlich unter Druck, nachdem sie die Pfizer-Offerte zurückgewiesen haben. Das Management muss jetzt liefern, was sie versprochen haben - nämlich endlich reihenweise Erfolge in der Onkologie. Ich denke, dass da mehr als üblich geklappert wird...
Hallo ipollit,
das geht spätestens seit der ASCO so, dass alles was AZN macht, angeblich viel toller ist, als das was CLVS liefert. Da wurde so getan, als ob AZN inzwischen einen signifikanten Zeitvorsprung habe, was mittlerweile schon wieder weitgehend relativiert werden musste. Da wurde so getan, als habe AZN das signifikant bessere NW-Profil, wobei man selbst "Grad 5-Vorfälle" keiner Nachfrage wert fand.
Für das "geschönte" Studiendesign bei AZN hat mir erst DeSantis die Augen geöffnet. Finde ich schon ziemlich krass.
Dass Du das Argument von DeSantis merkwürdig findest bezieht sich natürlich auf den Sachverhalt und nicht auf das Argument an sich, richtig?
AZN steht ja ziemlich unter Druck, nachdem sie die Pfizer-Offerte zurückgewiesen haben. Das Management muss jetzt liefern, was sie versprochen haben - nämlich endlich reihenweise Erfolge in der Onkologie. Ich denke, dass da mehr als üblich geklappert wird...
@AMBI
Ihr solltet Euch Eure Abrechnung bei Ambit genau anschauen. Die Deutsche Bank hat mir gerade deutlich weniger als 50% des Veräußerungserlöses gut geschrieben und darüberhinaus einen sehr hohen Steuerbetrag einbehalten. Beim Steuerbetrag wird es sich aller Voraussicht nach um US-Steuern handeln, für die in meinem Fall allerdings keine Einbehaltungsberechtigung besteht. Nach allem habe ich den Eindruck, daß die Abwicklung dieser Übernahme für die Banken eine echte Herausforderung nicht ohne Reibungsverluste darstellt.
Ihr solltet Euch Eure Abrechnung bei Ambit genau anschauen. Die Deutsche Bank hat mir gerade deutlich weniger als 50% des Veräußerungserlöses gut geschrieben und darüberhinaus einen sehr hohen Steuerbetrag einbehalten. Beim Steuerbetrag wird es sich aller Voraussicht nach um US-Steuern handeln, für die in meinem Fall allerdings keine Einbehaltungsberechtigung besteht. Nach allem habe ich den Eindruck, daß die Abwicklung dieser Übernahme für die Banken eine echte Herausforderung nicht ohne Reibungsverluste darstellt.
Hallo in die Runde hat von euch einer zufällig auch
http://innate-pharma.com/en/introduction auf dem Schirm?
http://innate-pharma.com/en/introduction auf dem Schirm?
noch ein paar weitere aus dem IO-Bereich...
LBIO Lion Biotechnologies (160) - TILs
AFMD Affimed (142) - x-CD3 biAKs
CGEN Compugen (352) - neuartige Checkpoint-Hemmer
Vielleicht auch noch...
TGTX TG Therapeutics (649) - pi3k-delta
TGTX könnte vielleicht dann interessant werden, wenn pi3k-delta wirklich auf T_reg wirkt, wie manche berichten. Unten ist daher auch unter INCY der pi3k-delta aufgeführt. TGTX Kandidat soll weniger Nebenwirkungen haben und sich vielleicht besser kombinieren lassen. Bei TGTX finde ich auch den IRAK4-Hemmer spannend zur Kombi mit BTK.
Unter den Partnern von CELG wird auch die privaten Adimab genannt. Schon beeindruckend, wieviele Partner Adimab hat: http://www.adimab.com/existing-partners Sie entwickelt zusammen mit FPRX IO-AKs wahrscheinlich gegen neuartige Checkpoint-Targets... FPRX hält die Rechte. Ähnlich hat TSRO die IO-AKs + IO-biAKs der privaten AnaptysBio einlizensiert, die auch sehr gut aussehen.




Gruß
ipollit
LBIO Lion Biotechnologies (160) - TILs
AFMD Affimed (142) - x-CD3 biAKs
CGEN Compugen (352) - neuartige Checkpoint-Hemmer
Vielleicht auch noch...
TGTX TG Therapeutics (649) - pi3k-delta
TGTX könnte vielleicht dann interessant werden, wenn pi3k-delta wirklich auf T_reg wirkt, wie manche berichten. Unten ist daher auch unter INCY der pi3k-delta aufgeführt. TGTX Kandidat soll weniger Nebenwirkungen haben und sich vielleicht besser kombinieren lassen. Bei TGTX finde ich auch den IRAK4-Hemmer spannend zur Kombi mit BTK.
Unter den Partnern von CELG wird auch die privaten Adimab genannt. Schon beeindruckend, wieviele Partner Adimab hat: http://www.adimab.com/existing-partners Sie entwickelt zusammen mit FPRX IO-AKs wahrscheinlich gegen neuartige Checkpoint-Targets... FPRX hält die Rechte. Ähnlich hat TSRO die IO-AKs + IO-biAKs der privaten AnaptysBio einlizensiert, die auch sehr gut aussehen.




Gruß
ipollit
Antwort auf Beitrag Nr.: 48.390.038 von SLGramann am 23.11.14 07:00:17Hallo SLGramann,
"Dass Du das Argument von DeSantis merkwürdig findest bezieht sich natürlich auf den Sachverhalt und nicht auf das Argument an sich, richtig?"
Ja, richtig. Sorry, das war missverständlich... ich finde es so wie DeSantis merkwürdig, dass dies nicht kritisch angemerkt wird.
Mal schauen, was Ohad Hammer zu CLVS heute schreibt.
Grüße
ipollit
"Dass Du das Argument von DeSantis merkwürdig findest bezieht sich natürlich auf den Sachverhalt und nicht auf das Argument an sich, richtig?"
Ja, richtig. Sorry, das war missverständlich... ich finde es so wie DeSantis merkwürdig, dass dies nicht kritisch angemerkt wird.
Mal schauen, was Ohad Hammer zu CLVS heute schreibt.
Grüße
ipollit
Antwort auf Beitrag Nr.: 48.390.863 von schnappi am 23.11.14 10:59:53Zu Innate (IPH.PA) habe ich doch gestern erst etwas geschrieben... dies ist nach MGNX die Position, die ich weiter ausbauen möchte.
Aktuell bin ich in folgenden Biotechs investiert:
9,8% INCY
9,5% PCYC
8,0% CLDX
6,0% MDVN
5,0% MGNX
4,9% GEN.CO
4,8% CLVS
4,7% REGN
4,3% ISIS
4,2% ALNY
3,9% CBST
3,9% ARRY
3,9% ENTA
2,9% INFI
2,5% EXEL
2,3% IPH.PA
2,2% FPRX
2,0% SNTA
1,9% TSRO
1,9% XLRN
1,7% ESPR
1,6% SGEN
1,6% SAGE
1,4% ARQL
1,3% IMMU
1,1% AERI
1,1% VSTM
0,9% STML
0,5% KBIO
Gruß
ipollit
Aktuell bin ich in folgenden Biotechs investiert:
9,8% INCY
9,5% PCYC
8,0% CLDX
6,0% MDVN
5,0% MGNX
4,9% GEN.CO
4,8% CLVS
4,7% REGN
4,3% ISIS
4,2% ALNY
3,9% CBST
3,9% ARRY
3,9% ENTA
2,9% INFI
2,5% EXEL
2,3% IPH.PA
2,2% FPRX
2,0% SNTA
1,9% TSRO
1,9% XLRN
1,7% ESPR
1,6% SGEN
1,6% SAGE
1,4% ARQL
1,3% IMMU
1,1% AERI
1,1% VSTM
0,9% STML
0,5% KBIO
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.391.211 von ipollit am 23.11.14 12:14:12
Oh habe da die Seiten wohl zu schnell überflogen und den Beitrag übersehen
Ich habe die schon seid paar Monaten auf der Liste
und auf Kurse unter 6 Euro gehofft um einzusteigen, aber die hällt die Marke.
Dank dir für die Antwort!
Oh habe da die Seiten wohl zu schnell überflogen und den Beitrag übersehen

Ich habe die schon seid paar Monaten auf der Liste
und auf Kurse unter 6 Euro gehofft um einzusteigen, aber die hällt die Marke.
Dank dir für die Antwort!
Wow das ist ja ein sehr produktives WE gewesen! Ich werde mir das alles mal in Ruhe durchlesen. Auf die Schnelle:
AMBI: Bei mir ist das Geld jetzt auf dem Konto angekommen. Meine Bank hatte mich ja gewarnt, dass evtl. die USA Quellsteuer erhebt. Bei mir ist das aber nicht so, es ist nur die Abgeltungssteuer abgezogen. (?!)
Soweit ich weiß gibt es mit den USA ein Abkommen gegen Doppelbesteuerung, so dass man sich die doppelt gezahlte Steuer zurück holen kann. Musst du mal mit deiner Bank besprechen.
Natürlich wird auch bei den CVRs ggf. das Spiel wieder von vorne los gehen.
@ipollit: Ja ich meinte auch und vor allem DeSantis.
http://seekingalpha.com/article/2695385-cominus-1686-data-co…
Ansonsten fand ich die Kommentare von David Miller über Twitter nachvollziehbar - z.B. $CLVS drug does MUCH better than $AZN drug in pts who are just coming off a TKI. 36% to 10%. That and rash are big!

Jetzt hat sich Ohad Hammer dem Thema angenommen:
http://www.orf-blog.com/clovis-oncology-the-more-you-ignore-…
Alles "in line" mit den Kommentaren hier im Board und darüber hinaus sehr informativ. Was ich gar nicht verstehe ist, warum er jetzt AMBI verkauft hat.
Ich habe FMI (leider) und CLVS ebenso bereits nachgekauft. Da kam das Geld von AMBI gerade Recht. Werde wohl auch noch eine Position ONTY kaufen. Hier werden Anfang Dezember Ergebnisse von ONT380 in Kombination mit u.a. Kadcyla präsentiert (PI allerdings mit Schwerpunkt auf der Sichrheit).

SG kmastra
AMBI: Bei mir ist das Geld jetzt auf dem Konto angekommen. Meine Bank hatte mich ja gewarnt, dass evtl. die USA Quellsteuer erhebt. Bei mir ist das aber nicht so, es ist nur die Abgeltungssteuer abgezogen. (?!)
Soweit ich weiß gibt es mit den USA ein Abkommen gegen Doppelbesteuerung, so dass man sich die doppelt gezahlte Steuer zurück holen kann. Musst du mal mit deiner Bank besprechen.
Natürlich wird auch bei den CVRs ggf. das Spiel wieder von vorne los gehen.
@ipollit: Ja ich meinte auch und vor allem DeSantis.
http://seekingalpha.com/article/2695385-cominus-1686-data-co…
Ansonsten fand ich die Kommentare von David Miller über Twitter nachvollziehbar - z.B. $CLVS drug does MUCH better than $AZN drug in pts who are just coming off a TKI. 36% to 10%. That and rash are big!

Jetzt hat sich Ohad Hammer dem Thema angenommen:
http://www.orf-blog.com/clovis-oncology-the-more-you-ignore-…
Alles "in line" mit den Kommentaren hier im Board und darüber hinaus sehr informativ. Was ich gar nicht verstehe ist, warum er jetzt AMBI verkauft hat.
Ich habe FMI (leider) und CLVS ebenso bereits nachgekauft. Da kam das Geld von AMBI gerade Recht. Werde wohl auch noch eine Position ONTY kaufen. Hier werden Anfang Dezember Ergebnisse von ONT380 in Kombination mit u.a. Kadcyla präsentiert (PI allerdings mit Schwerpunkt auf der Sichrheit).
SG kmastra
Antwort auf Beitrag Nr.: 48.389.651 von ipollit am 22.11.14 23:13:58
auf Grundlage Deines eingestellten Artikels ist es würde ich sagen die Frage ob man auf den, etwas, besseren Kandidaten, oder ein gestreuteres Chance/Risikoverhältnis setzen will
ich weiss nicht wie Deine Vorstellungen dazu sind
CNCE sieht finde ich interessant aus
wäre mal interessant Deren Modell genauer auszuleuchten
eine Reihe zugelassener Medikamente zu 'first in class' zu verbessern, das hätte schon was
ich werde es aber nicht tun
Gruß
P.
Zitat von ipollit: ZSPH
habe ich vor einiger Zeit auf einer Liste von einer Bank mit unverpartnerten PIIIs gesehen. Ich fand es von den möglichen Peak Sales im Verhältnis zur MK her interessant.
Hyperkalemia ist schon eine bedeutende Indikation... es geht auch in so eine Richtung wie z.B. EPO, da es auch eine Folge von Nierenproblemen ist.
ZSPH scheint sich ein Kopf an Kopf Rennen mit RLYP zu liefern.
http://seekingalpha.com/article/2495515-relypsa-and-zs-pharm…
Gab es vor Kurzem nicht aber auch Probleme mit Wasseransammlungen/Schwellungen?...
ZSPH habe ich definitiv auf meiner Beobachtungsliste... im Moment habe ich ca. 30 Werte im Depot, so dass ich nicht überall gleich einsteigen möchte. Bei ZSPH wird es aber interessant, wenn sie die Zulassung für ZS-9 erhalten sollten und dann anfangen, Umsätze zu generieren.
Wäre dann aber nicht wirklich eine 50:50 Position ZSPH + RLYP sicherer?... beide mit einer etwa gleichen MK von 800 Mio USD.
auf Grundlage Deines eingestellten Artikels ist es würde ich sagen die Frage ob man auf den, etwas, besseren Kandidaten, oder ein gestreuteres Chance/Risikoverhältnis setzen will
ich weiss nicht wie Deine Vorstellungen dazu sind
CNCE sieht finde ich interessant aus
wäre mal interessant Deren Modell genauer auszuleuchten
eine Reihe zugelassener Medikamente zu 'first in class' zu verbessern, das hätte schon was
ich werde es aber nicht tun
Gruß
P.
@kmastra
Nur ganz kurz zur US-Steuer/Ambit, da off-topic: die Anrechnung von US-Quellensteuern in D setzt immer voraus, daß die Einbehaltung in US rechtlich zulässig war. Wenn die Einbehaltung in US nach DBA aber unzulässig war (wie mE bei Ambit), dann erfolgt keine Anrechnung in Deutschland, sondern man ist gezwungen, die Quellensteuer in US zurückzufordern (blöd und umständlich). Bei mir hat die Deutsche Bank in jeder Hinsicht großen Mist gemacht und Phantasiebeiträge gutgeschrieben, noch dazu viel viel zu niedrig, muß ich morgen mit der DB klären. Der Abzug von Abgeltungssteuer muß aber selbstverständlich erfolgen. Ab jetzt wieder nur stiller Mitleser, ganz herzlichen Dank an Euch (und Ohad)!!
Nur ganz kurz zur US-Steuer/Ambit, da off-topic: die Anrechnung von US-Quellensteuern in D setzt immer voraus, daß die Einbehaltung in US rechtlich zulässig war. Wenn die Einbehaltung in US nach DBA aber unzulässig war (wie mE bei Ambit), dann erfolgt keine Anrechnung in Deutschland, sondern man ist gezwungen, die Quellensteuer in US zurückzufordern (blöd und umständlich). Bei mir hat die Deutsche Bank in jeder Hinsicht großen Mist gemacht und Phantasiebeiträge gutgeschrieben, noch dazu viel viel zu niedrig, muß ich morgen mit der DB klären. Der Abzug von Abgeltungssteuer muß aber selbstverständlich erfolgen. Ab jetzt wieder nur stiller Mitleser, ganz herzlichen Dank an Euch (und Ohad)!!
AMBI
Bei mir wurde 100% KESt. auf den Auszahlungsbetrag abgezogen und der Kaufpreis komplett auf die CVRs übertragen. Diese sind nicht handelbar und werden bei Erreichen der Ziele zwar ausbezahlt aber nicht verkauft, d.h. steuerlich wäre es besser gewesen, vor Abschluss der Maßnahme zu verkaufen.
Bei mir wurde 100% KESt. auf den Auszahlungsbetrag abgezogen und der Kaufpreis komplett auf die CVRs übertragen. Diese sind nicht handelbar und werden bei Erreichen der Ziele zwar ausbezahlt aber nicht verkauft, d.h. steuerlich wäre es besser gewesen, vor Abschluss der Maßnahme zu verkaufen.
Antwort auf Beitrag Nr.: 48.387.491 von SLGramann am 22.11.14 11:05:14ACAD:
Noch eine Ergänzung, warum ich glaube, dass die Schätzung der Peak-Sales mit 2 Mrd. weltweit zu gering sein könnte.
Die "übliche" Rechnung geht so:
For the reasons outlined above, we see pimavanserin as serving a fairly high unmet need. We know of no other drug in late-stage development for PDP, and believe that pimavanserin should have meaningful market exclusivity upon launch. As such, we think that Acadia and its commercialization partner could capture up to a third of the market. At a price similar to antipsychotics, pimavanserin offers a $900 million U.S. opportunity.
$900 Million = 1 Million PD patients x 50% with Psychosis x 30% Penetration x $6,000 per year.
http://seekingalpha.com/article/1617562-acadia-targets-pimav…
Es ist möglich, dass dieses Szenario die Gesamtzahl der potentiellen Patienten sogar überschätzt. Acadia geht bspw. nur von 40% PDP-Patienten aus.
Ich denke aber, dass die Marktdurchdringung mit 30% ziemlich konservativ ausschaut.
Vor allem aber scheint ACAD eine etwas andere Preisvorstellung zu haben.
Dies ist aus dem CC-Transscript:
Terrence O. Moore – Executive Vice President & Chief Commercial Officer
We are continuing to refine our access reimbursement work, including pricing. While we will not publicly announce the price of NUPLAZID prior to launch, one point of reference we have used in our pricing work is the price of branded atypical antipsychotics such as Abilify, which at the 20 milligram dose is currently priced at approximately $13,000 per year. So summing up our view of the PDP market, as we referenced previously, there are approximately 1 million Parkinson's disease patients in the U.S. and about 40% or 400,000 of them with PDP. In addition, our market research tells us that approximately half of the 400,000 PDP patients have what physicians often refer to as disruptive PDP symptoms.
http://seekingalpha.com/article/2667375-acadia-pharmaceutica…
Wenn man jetzt mal als Szenario folgendes annimmt:
1 Million PD patients x 40% with Psychosis x 30% Penetration x $8,000 per year
oder
1 Million PD patients x 40% with Psychosis x 40% Penetration x $10,000 per year
oder als positives Extrem:
1 Million PD patients x 40% with Psychosis x 50% Penetration x $13,000 per year
käme man auf US-Umsätze pro Jahr nur in PDP von
- 960 Mio.
- 1.600 Mio.
- 2.600 Mio.
Es hängt also sehr von den Annahmen ab, die man macht. Die Erfahrung zeigt aber, dass in der letzten Zeit für neue Wirkstoffe aggressive Preisvorstellungen durchgesetzt werden.
Im vorliegenden Fall hat die FDA mit der Vergabe des BT-Status den dringenden Bedarf sozusagen offiziell anerkannt und ich denke, dass man das auch in der Preisgestaltung sehen wird.
Noch eine Ergänzung, warum ich glaube, dass die Schätzung der Peak-Sales mit 2 Mrd. weltweit zu gering sein könnte.
Die "übliche" Rechnung geht so:
For the reasons outlined above, we see pimavanserin as serving a fairly high unmet need. We know of no other drug in late-stage development for PDP, and believe that pimavanserin should have meaningful market exclusivity upon launch. As such, we think that Acadia and its commercialization partner could capture up to a third of the market. At a price similar to antipsychotics, pimavanserin offers a $900 million U.S. opportunity.
$900 Million = 1 Million PD patients x 50% with Psychosis x 30% Penetration x $6,000 per year.
http://seekingalpha.com/article/1617562-acadia-targets-pimav…
Es ist möglich, dass dieses Szenario die Gesamtzahl der potentiellen Patienten sogar überschätzt. Acadia geht bspw. nur von 40% PDP-Patienten aus.
Ich denke aber, dass die Marktdurchdringung mit 30% ziemlich konservativ ausschaut.
Vor allem aber scheint ACAD eine etwas andere Preisvorstellung zu haben.
Dies ist aus dem CC-Transscript:
Terrence O. Moore – Executive Vice President & Chief Commercial Officer
We are continuing to refine our access reimbursement work, including pricing. While we will not publicly announce the price of NUPLAZID prior to launch, one point of reference we have used in our pricing work is the price of branded atypical antipsychotics such as Abilify, which at the 20 milligram dose is currently priced at approximately $13,000 per year. So summing up our view of the PDP market, as we referenced previously, there are approximately 1 million Parkinson's disease patients in the U.S. and about 40% or 400,000 of them with PDP. In addition, our market research tells us that approximately half of the 400,000 PDP patients have what physicians often refer to as disruptive PDP symptoms.
http://seekingalpha.com/article/2667375-acadia-pharmaceutica…
Wenn man jetzt mal als Szenario folgendes annimmt:
1 Million PD patients x 40% with Psychosis x 30% Penetration x $8,000 per year
oder
1 Million PD patients x 40% with Psychosis x 40% Penetration x $10,000 per year
oder als positives Extrem:
1 Million PD patients x 40% with Psychosis x 50% Penetration x $13,000 per year
käme man auf US-Umsätze pro Jahr nur in PDP von
- 960 Mio.
- 1.600 Mio.
- 2.600 Mio.
Es hängt also sehr von den Annahmen ab, die man macht. Die Erfahrung zeigt aber, dass in der letzten Zeit für neue Wirkstoffe aggressive Preisvorstellungen durchgesetzt werden.
Im vorliegenden Fall hat die FDA mit der Vergabe des BT-Status den dringenden Bedarf sozusagen offiziell anerkannt und ich denke, dass man das auch in der Preisgestaltung sehen wird.
Antwort auf Beitrag Nr.: 48.395.432 von Eilzug2000 am 24.11.14 09:53:40
3 Banken drei Meinugen?
Ich habe das heute noch mal mit meiner Bank besprochen. Bei mir ist die AGS tatsächlich nur auf den Gewinn angerechnet worden. Quellensteuer wurde gar nicht erhoben. Auf die CVRs werde ich dann/evtl. AGS auf den Gesamtbetrag zahlen müssen. Das das bei 3 Banken scheinbar dreimal unterschiedlich gehandhabt wurde finde ich äußerst irritierend und ärgerlich...
Zitat von Eilzug2000: AMBI
Bei mir wurde 100% KESt. auf den Auszahlungsbetrag abgezogen und der Kaufpreis komplett auf die CVRs übertragen. Diese sind nicht handelbar und werden bei Erreichen der Ziele zwar ausbezahlt aber nicht verkauft, d.h. steuerlich wäre es besser gewesen, vor Abschluss der Maßnahme zu verkaufen.
3 Banken drei Meinugen?
Ich habe das heute noch mal mit meiner Bank besprochen. Bei mir ist die AGS tatsächlich nur auf den Gewinn angerechnet worden. Quellensteuer wurde gar nicht erhoben. Auf die CVRs werde ich dann/evtl. AGS auf den Gesamtbetrag zahlen müssen. Das das bei 3 Banken scheinbar dreimal unterschiedlich gehandhabt wurde finde ich äußerst irritierend und ärgerlich...
Antwort auf Beitrag Nr.: 48.389.558 von Fruehrentner am 22.11.14 22:08:47
Daran wäre ich auch sehr interessiert.
Gruß
Frührentner[/quote]
wen es interessiert -die Einstandsrecherche
mit "richtige" Recherche meine ich jedenfalls was anderes als "20, 30 Minuten gelesen, und dann 2, 3 Seiten zusammengeschmaddert"
ich finde die Ersten, für einen grundlegenden Überblick/Einführung, immer am allerbesten
da muss man aber hier wie es aussieht ein bisschen Zeit mitbringen
www.file-upload.net/download-9897731/Kite-Pharma---Canaccord…
und das letzte Update
mehr gibt es, da, auch nicht
www.file-upload.net/download-9897750/Kite-Pharma---Canaccord…
wenn irgendwas nicht funktionieren sollte, müsst Ihr Bescheid geben
Gruß
P.
Zitat von Fruehrentner:Zitat von SLGramann: Präsentation von KITE:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Muss man eigentlich mal gesehen haben. Die CAR-Technologie riecht schon nach Revolution. Natürlich bleibt erst mal unklar, wer da wirklich die Nase vorn hat, aber sicher ist Platz für mehrere Player und bei Kite hat sich offenkundig ne Menge Potential versammelt.
Sehr schade, dass Hammer zu dem Unternehmen nicht Stellung nehmen darf. Ich glaube, das gesamte Feld ist heißer, als damals die ADCs. Vielleicht vergleichbar mit PD-1 und Co.
wenn Du willst kann ich Dir/Euch, richtige, Recherche zu Kite Pharma geben
ich habe 0,0 Ahnung von dieser Firma
Daran wäre ich auch sehr interessiert.
Gruß
Frührentner[/quote]
wen es interessiert -die Einstandsrecherche
mit "richtige" Recherche meine ich jedenfalls was anderes als "20, 30 Minuten gelesen, und dann 2, 3 Seiten zusammengeschmaddert"
ich finde die Ersten, für einen grundlegenden Überblick/Einführung, immer am allerbesten
da muss man aber hier wie es aussieht ein bisschen Zeit mitbringen
www.file-upload.net/download-9897731/Kite-Pharma---Canaccord…
und das letzte Update
mehr gibt es, da, auch nicht
www.file-upload.net/download-9897750/Kite-Pharma---Canaccord…
wenn irgendwas nicht funktionieren sollte, müsst Ihr Bescheid geben
Gruß
P.
FPRX
BMS zahlt FPRX 30 Mio sowie die Kosten für PI-Kombi-Studien des PD-1 AK Opdivo mit FPRXs CSF1R-AK FPA008. Bisher hatte FPRX FPA008 nur gegen RA entwickelt.
http://www.fiercebiotech.com/story/five-prime-hitches-bristo…
"...Preclinical data suggest that targeting PD-1 and CSF1R at the same time could lead to a broader anti-tumor immune response than either method alone, the company said, and positive results could help FPA008, once approved, cut in on the explosive sales expected for nivolumab...
On its own, FPA008 is in the midst of a Phase I trial in rheumatoid arthritis, and Five Prime believes it has potential as a monotherapy for solid tumors, idiopathic pulmonary fibrosis, lupus nephritis and other inflammatory disorders.
In the meantime, the biotech has the benefit of fleshing out FPA008's potential on Bristol-Myers' dime, putting the combo up against on-small cell lung cancer (NSCLC), melanoma, head and neck cancer, pancreatic cancer, colorectal cancer and malignant glioma...
Roche hat bereits einen eigenen CSF1R-AK in der Klinik, den sie demnächst auch in Kombi mit PD1 testen wollen

Gruß
ipollit
BMS zahlt FPRX 30 Mio sowie die Kosten für PI-Kombi-Studien des PD-1 AK Opdivo mit FPRXs CSF1R-AK FPA008. Bisher hatte FPRX FPA008 nur gegen RA entwickelt.
http://www.fiercebiotech.com/story/five-prime-hitches-bristo…
"...Preclinical data suggest that targeting PD-1 and CSF1R at the same time could lead to a broader anti-tumor immune response than either method alone, the company said, and positive results could help FPA008, once approved, cut in on the explosive sales expected for nivolumab...
On its own, FPA008 is in the midst of a Phase I trial in rheumatoid arthritis, and Five Prime believes it has potential as a monotherapy for solid tumors, idiopathic pulmonary fibrosis, lupus nephritis and other inflammatory disorders.
In the meantime, the biotech has the benefit of fleshing out FPA008's potential on Bristol-Myers' dime, putting the combo up against on-small cell lung cancer (NSCLC), melanoma, head and neck cancer, pancreatic cancer, colorectal cancer and malignant glioma...
Roche hat bereits einen eigenen CSF1R-AK in der Klinik, den sie demnächst auch in Kombi mit PD1 testen wollen

Gruß
ipollit
Antwort auf Beitrag Nr.: 48.402.335 von Popeye82 am 24.11.14 21:13:18funktioniert nicht
Antwort auf Beitrag Nr.: 48.411.590 von Fruehrentner am 25.11.14 18:59:16
habe es gerade mal mit selber runterladen versucht, da funktioniert es(waren ja auch, schon, 2 downloads)
komisch
was es jetzt "theoretisch" noch sein könnte, nachh dem klick auf Download musst Du vielleicht erst noch etwas warten, bis sich das Fenster öffnet
ansonsten -entweder Ihr kennt noch eine andere Methode, oder ich wüsste nur noch über EMail
Gruß
P.
habe es gerade mal mit selber runterladen versucht, da funktioniert es(waren ja auch, schon, 2 downloads)
komisch
was es jetzt "theoretisch" noch sein könnte, nachh dem klick auf Download musst Du vielleicht erst noch etwas warten, bis sich das Fenster öffnet
ansonsten -entweder Ihr kennt noch eine andere Methode, oder ich wüsste nur noch über EMail
Gruß
P.
Biotechnology, Industry Update -Legislation in Japan Passes - Maxim Group LLC - Nov 25, 2014
Summary:
We have reviewed a press release from Mesoblast that gave us insight into new Japanese legislation(PMD Act). We paraphrase the data from Mesoblast, emphasizing the data is from Mesoblast and not based on our own independent second source:
- Conditional product approvals will be based on existing Phase II trial results demonstrating probable efficacy and safety with bridging studies in Japanese patients.
- Conditional approvals will allow sales of each product candidate for up to 7 years.
- Conditionally approved products will be covered by health insurance.
- Conditional approvals will cover allogeneic cell therapy product candidates manufactured under GMP outside of Japan; and full approval is expected to require further confirmation of safety and efficacy in a larger population.
Conclusion: We believe the legislation (as stated from Mesoblast) represents a best-case scenario for companies like Mesoblast, Pluristem, and Athersys (allogeneic players), as well as autologous companies like Cytori and others (Cesca and NeoStem).
Details:
Japan represents a strategic milestone for Mesoblast. We believe that regulations are being proposed to allow a new and rapid clinical pathway for cell therapy companies to enter the Japanese marketplace. Through the acquisition of Prochymal, Mesoblast now has access to an experienced cell therapy partner “on the ground” in Japan—a partner that has now filed the country’s first cell therapy product. We see great strategic value in this news.
Mesoblast plans a product registration filing with the United States Food and Drug Administration (FDA) for its allogeneic MSC product in children with steroid-refractory acute GVHD in 2016. Additionally, Mesoblast remains on track for commercial launch of its allogeneic MSC product in Canada and New Zealand in 2016 in children with GVHD. ...
https://maxim.bluematrix.com/sellside/EmailDocViewer?encrypt…
Summary:
We have reviewed a press release from Mesoblast that gave us insight into new Japanese legislation(PMD Act). We paraphrase the data from Mesoblast, emphasizing the data is from Mesoblast and not based on our own independent second source:
- Conditional product approvals will be based on existing Phase II trial results demonstrating probable efficacy and safety with bridging studies in Japanese patients.
- Conditional approvals will allow sales of each product candidate for up to 7 years.
- Conditionally approved products will be covered by health insurance.
- Conditional approvals will cover allogeneic cell therapy product candidates manufactured under GMP outside of Japan; and full approval is expected to require further confirmation of safety and efficacy in a larger population.
Conclusion: We believe the legislation (as stated from Mesoblast) represents a best-case scenario for companies like Mesoblast, Pluristem, and Athersys (allogeneic players), as well as autologous companies like Cytori and others (Cesca and NeoStem).
Details:
Japan represents a strategic milestone for Mesoblast. We believe that regulations are being proposed to allow a new and rapid clinical pathway for cell therapy companies to enter the Japanese marketplace. Through the acquisition of Prochymal, Mesoblast now has access to an experienced cell therapy partner “on the ground” in Japan—a partner that has now filed the country’s first cell therapy product. We see great strategic value in this news.
Mesoblast plans a product registration filing with the United States Food and Drug Administration (FDA) for its allogeneic MSC product in children with steroid-refractory acute GVHD in 2016. Additionally, Mesoblast remains on track for commercial launch of its allogeneic MSC product in Canada and New Zealand in 2016 in children with GVHD. ...
https://maxim.bluematrix.com/sellside/EmailDocViewer?encrypt…
Antwort auf Beitrag Nr.: 48.402.335 von Popeye82 am 24.11.14 21:13:18
Zumindest der 2. link ist virenverseucht.
Zumindest der 2. link ist virenverseucht.
Antwort auf Beitrag Nr.: 48.414.876 von niemwolf am 26.11.14 07:26:22
Nicht der link, sondern die Download - Datei.
Nicht der link, sondern die Download - Datei.
Antwort auf Beitrag Nr.: 48.414.876 von niemwolf am 26.11.14 07:26:22Beide links sind verseucht! 
poppeye, was soll dieser Mist! Ich werde Meldung machen bei WO!

poppeye, was soll dieser Mist! Ich werde Meldung machen bei WO!

bei irgendwelchen Downloadern usw wäre ich auch vorsichtig... 
an vieles kommst du auch einfach mit google, solange es öffentlich zugänglich ist... z.B. suche nach: canaccord kite pdf
könnte vielleicht das hier sein...
https://research.canaccordgenuity.com/_layouts/researchnotev…
Gruß
ipollit

an vieles kommst du auch einfach mit google, solange es öffentlich zugänglich ist... z.B. suche nach: canaccord kite pdf
könnte vielleicht das hier sein...
https://research.canaccordgenuity.com/_layouts/researchnotev…
Gruß
ipollit
Antwort auf Beitrag Nr.: 48.426.000 von Fruehrentner am 26.11.14 22:30:30
kannst Du bitte in einem vernünftigen Ton reden?
die Datei von Ipollit ist es(Einstand)
kannst Du bitte in einem vernünftigen Ton reden?
die Datei von Ipollit ist es(Einstand)
Antwort auf Beitrag Nr.: 48.426.276 von ipollit am 26.11.14 23:07:38Die von Ihnen aufgerufene Adresse https://research.canaccordgenuity.com/_layouts/researchnotev… ist zurzeit nicht erreichbar.


KITE:
Die Marktkapitalisierung von 1,7 Mrd. Dollar regt zu einer KE an, die weitere 138 Mio. Dollar in die Taschen spülen soll. Zeitpunkt der KE ist noch offen, aber mit Sicherheit baldmöglichst. Der Markt ist im manischen Modus und da wird Cash gemacht.
Hier das S-1: http://files.shareholder.com/downloads/AMDA-2V2XOY/360410523…
Insgesamt bewegen wir uns zumindest partiell eindeutig in einem Blasenmodus. Für den Börsengang von Juno wird eine Marktkapitalisierung von 1,5 bis 2 Milliarden Dollar kolportiert.
AGIO mit 3 Mrd. Marktkap. So toll ich all diese Unternehmen finde, aber die einen haben noch nicht mal einen IND, die anderen sind in der P I ... m.E. deutliche Zeichen eines Überschwangs.
Popeye, Du kannst hier doch nicht wirklich auf eine exe-Datei auf irgendeiner wilden Seite verlinken. Mal abgesehen davon, dass man so etwas (exe) dann niemals öffnen darf, kann ich Fruehrenter schon verstehen...
Die Marktkapitalisierung von 1,7 Mrd. Dollar regt zu einer KE an, die weitere 138 Mio. Dollar in die Taschen spülen soll. Zeitpunkt der KE ist noch offen, aber mit Sicherheit baldmöglichst. Der Markt ist im manischen Modus und da wird Cash gemacht.
Hier das S-1: http://files.shareholder.com/downloads/AMDA-2V2XOY/360410523…
Insgesamt bewegen wir uns zumindest partiell eindeutig in einem Blasenmodus. Für den Börsengang von Juno wird eine Marktkapitalisierung von 1,5 bis 2 Milliarden Dollar kolportiert.
AGIO mit 3 Mrd. Marktkap. So toll ich all diese Unternehmen finde, aber die einen haben noch nicht mal einen IND, die anderen sind in der P I ... m.E. deutliche Zeichen eines Überschwangs.
Popeye, Du kannst hier doch nicht wirklich auf eine exe-Datei auf irgendeiner wilden Seite verlinken. Mal abgesehen davon, dass man so etwas (exe) dann niemals öffnen darf, kann ich Fruehrenter schon verstehen...
Antwort auf Beitrag Nr.: 48.412.253 von Popeye82 am 25.11.14 20:02:14
habe es gerade mal mit selber runterladen versucht, da funktioniert es(waren ja auch, schon, 2 downloads)
komisch
Spätestens jetzt würde ich mir Gedanken über ein besseres Virenprogramm machen.
habe es gerade mal mit selber runterladen versucht, da funktioniert es(waren ja auch, schon, 2 downloads)
komisch
Spätestens jetzt würde ich mir Gedanken über ein besseres Virenprogramm machen.
Aqxp
Vor einiger Zeit wurde hier auf AQXP hingewiesen, ohne daß das allerdings wissenschaftlich angefüttert werden konnte. Hingewiesen wurde nur darauf, daß Pfizer und J&J zu 30% beteiligt sind.
Für die Interessierten hier ein informativer link, der das Alleinstellungsmerkmal und das erhebliche Potential bei Gelingen aufzeigt:
http://markman.ca/2014/02/aquinox-pharmaceuticals-tackling-c…
Die Daten von 2 Phase II sollen in der ersten Hälfte 2015 kommen.
AMBI
Achtung: Einige Banken behandeln die Übernahme so, als handele es sich um eine Barausschüttung. Ohne die Folgen hierfür im Einzelnen aufzuzeigen nur der Hinweis, daß dies steuerlich in verschiedener Hinsicht nachteilig ist. Unbedingt reklamieren.
Vor einiger Zeit wurde hier auf AQXP hingewiesen, ohne daß das allerdings wissenschaftlich angefüttert werden konnte. Hingewiesen wurde nur darauf, daß Pfizer und J&J zu 30% beteiligt sind.
Für die Interessierten hier ein informativer link, der das Alleinstellungsmerkmal und das erhebliche Potential bei Gelingen aufzeigt:
http://markman.ca/2014/02/aquinox-pharmaceuticals-tackling-c…
Die Daten von 2 Phase II sollen in der ersten Hälfte 2015 kommen.
AMBI
Achtung: Einige Banken behandeln die Übernahme so, als handele es sich um eine Barausschüttung. Ohne die Folgen hierfür im Einzelnen aufzuzeigen nur der Hinweis, daß dies steuerlich in verschiedener Hinsicht nachteilig ist. Unbedingt reklamieren.
Antwort auf Beitrag Nr.: 48.449.229 von lawmeetstax am 29.11.14 09:01:33
mal eine Frage -wie würdest Du, oder Ihr, die Kenntnisse des Autors der Seite einschätzen?
Hintergrund ist der, dass er, auch, eine Firma die ich sehr interessant finde, sehr positiv, bespricht, zu der aber sehr umstrittene Meinungen kursieren, und teilweise behauptet wird dass sie, nur, Betrug ist
Gruß
P.
Zitat von lawmeetstax: Für die Interessierten hier ein informativer link, der das Alleinstellungsmerkmal und das erhebliche Potential bei Gelingen aufzeigt:
http://markman.ca/2014/02/aquinox-pharmaceuticals-tackling-c…
mal eine Frage -wie würdest Du, oder Ihr, die Kenntnisse des Autors der Seite einschätzen?
Hintergrund ist der, dass er, auch, eine Firma die ich sehr interessant finde, sehr positiv, bespricht, zu der aber sehr umstrittene Meinungen kursieren, und teilweise behauptet wird dass sie, nur, Betrug ist
Gruß
P.
Ich möchte nochmals auf Syndax hinweisen, die (noch immer) ihr IPO durchführen wollen. Sie haben Ende März schon mal ein S1 vorgelegt, haben das IPO damals aber verschoben, weil der Markt kein großes Interesse hatte.
Jetzt scheint man es erneut versuchen zu wollen.
Hier das S1/A vom 21.11.:
http://www.sec.gov/Archives/edgar/data/1395937/0001193125144…
Offenbar will man ungefähr 74 Mio. Dollar erlösen. Über die Marktkapitalisierung kann ich noch nichts sagen. Ich könnte mir 300 bis 400 Mio. Dollar vorstellen - aber das ist reines Bauchgefühl.
Das Tickersymbol wird SNDX lauten.
Was haben wir bei Syndax?
Ihr Kandidat heißt Entinostat (HDAC-Inhibitor) und wird zunächst hauptsächlich gegen fortgeschrittenen ER/PR-positiven (Östrogen-/Progesteron-positiv) Brustkrebs eingesetzt (ungefähr 70% der Brustkrebsfälle).
Es geht um eine Kombitherapie zusammen mit bspw. Exemestan (Aromatasehemmer, Hormontherapie).
Was spricht für Syndax?
Das sie schon etwas vorgelegt haben (anders als so manches anderes Unternehmen, das sich im IPO erst mal nur über eine heiße Story verkauft hat).
Wir haben eine abgeschossene P II b:
In our trial, of the 130 postmenopausal patients with ER+ advanced breast cancer progressing on a non-steroidal aromatase inhibitor, 64 patients were randomly assigned to the exemestane plus entinostat, which we refer to as EE, group and 66 patients were randomly assigned to the exemestane plus placebo, which we refer to as EP, group.
The results are summarized below:
• Median PFS approximately doubled to 4.3 months in the EE group versus 2.3 months in the EP group, corresponding to a statistically significant hazard ratio of 0.73; 95% confidence interval, or CI, of 0.50 to 1.07; P2-sided=0.11; P1-sided=0.055.
• Median overall survival improved to 28.1 months in the EE group versus 19.8 months in the EP group corresponding to a statistically significant hazard ratio of 0.59; 95% CI of 0.36 to 0.97; P2-sided=0.036; P1-sided=0.018.
• Elevated levels of protein lysine acetylation biomarker, known as hyperacetylation, were associated with an improved clinical benefit with prolonged PFS of 8.6 months in the subset of EE treated patients from whom blood was taken.
• Overall, entinostat was well-tolerated.
Aufgrund dieser Ergebnisse hat man mit einer umfassenden P III-Studie begonnen, die unter einem SPA und mit Hilfe eines CRADA läuft:
We have developed with ECOG-ACRIN the Phase 3 clinical trial to confirm the PFS and overall survival benefits observed in the Phase 2b clinical trial.
ECOG-ACRIN is conducting the Phase 3 clinical trial under sponsorship and funding support from the NCI. We are supporting the Phase 3 clinical trial under a CRADA with the NCI and a separate agreement with ECOG-ACRIN.
The trial is designed to be a randomized, double-blind, placebo-controlled trial of EE compared to EP. The protocol for the Phase 3 clinical trial was reviewed and agreed upon by the FDA under a SPA agreement with the NCI in January 2014. A SPA agreement is a written agreement on the design and size of clinical trials intended to form the primary basis of a claim of effectiveness in a New Drug Application, or NDA, from the FDA.
ECOG-ACRIN activated the trial in March 2014. The trial initiated enrollment of 600 patients across the cooperative group network of up to 800 sites worldwide in the second quarter of 2014. We anticipate that the trial will require approximately 40 months to fully enroll patients with primary PFS endpoint data expected in mid-2017.
The primary objective of the trial is to evaluate whether the addition of entinostat to exemestane improves either PFS or overall survival in HR-positive men and postmenopausal women with human epidermal growth factor receptor 2, or HER2, negative, advanced breast cancer who have previously progressed on a non-steroidal aromatase inhibitor.
The NCI and ECOG-ACRIN, in collaboration with us, have designed the trial to have two primary endpoints of PFS and overall survival. We expect that either endpoint may serve as the basis for submitting an NDA, if data are positive.
Das SPA ist aus meiner Sicht sehr wertvoll. Ebenfalls positiv ist der doppelte primäre Endpunkt PFS oder OS.
Darüber hinaus hat die FDA im September 2013 für Entinostat die Breakthrough Therapy designation erteilt.
Es ist eher selten, dass ein kleines Unternehmen wie Syndax einen BT zugestanden bekommt.
In jüngster Zeit gibt es Hinweise auf eine immunmodulatorische Wirkung:
In order to fully understand the potential for entinostat to potentiate the activity of immune therapies, we plan to work with our collaborators to initiate a series of clinical studies in combination with targeted immune therapies in melanoma, breast cancer, lung cancer and other solid tumors. Data from a completed Phase 2 NSCLC clinical trial with entinostat combined with azacitidine suggest that entinostat may prime tumors to be more responsive to subsequent immune therapy targeting PD1 or PDL1. Further, preclinical studies have indicated that entinostat works to enhance the activity of immune therapy by inhibiting the activity of host immune cells that function to suppress the activity of anti-tumor immune responses.
• ENCORE 601: Phase 1b Clinical Trial.
Based on these findings and emerging preclinical data demonstrating synergistic combined anti-tumor effects of entinostat and immune therapy, we are currently planning a Phase 1b clinical trial to examine the combination of entinostat with a selected antibody targeting PD1 or PDL1 to characterize the safety, define a recommended Phase 2 dose and assess the preliminary clinical activity of this combination. The trial will combine entinostat with an anti-PD1 antibody in patients with metastatic NSCLC or melanoma. We anticipate initiating this trial in the first half of 2015 with safety, recommended Phase 2 dose, preliminary activity and correlative data available in mid-2016.
Zusammenfassend finde ich, dass hier viel geboten wird:
- gute PIIb-Daten,
- laufende PIII mit gutem Design,
- SPA,
- Breakthrough,
- großer Markt,
- Kombinierbarkeit
Was nicht ganz gefällt sind die langen Trial-Laufzeiten, der fehlende Partner und beim NW-Profil bin ich nicht ganz sicher, wie problematisch das ist.
Hat jemand eine Meinung zu Syndax? Vor allem Kritisches und Negatives ist gefragt!
Jetzt scheint man es erneut versuchen zu wollen.
Hier das S1/A vom 21.11.:
http://www.sec.gov/Archives/edgar/data/1395937/0001193125144…
Offenbar will man ungefähr 74 Mio. Dollar erlösen. Über die Marktkapitalisierung kann ich noch nichts sagen. Ich könnte mir 300 bis 400 Mio. Dollar vorstellen - aber das ist reines Bauchgefühl.
Das Tickersymbol wird SNDX lauten.
Was haben wir bei Syndax?
Ihr Kandidat heißt Entinostat (HDAC-Inhibitor) und wird zunächst hauptsächlich gegen fortgeschrittenen ER/PR-positiven (Östrogen-/Progesteron-positiv) Brustkrebs eingesetzt (ungefähr 70% der Brustkrebsfälle).
Es geht um eine Kombitherapie zusammen mit bspw. Exemestan (Aromatasehemmer, Hormontherapie).
Was spricht für Syndax?
Das sie schon etwas vorgelegt haben (anders als so manches anderes Unternehmen, das sich im IPO erst mal nur über eine heiße Story verkauft hat).
Wir haben eine abgeschossene P II b:
In our trial, of the 130 postmenopausal patients with ER+ advanced breast cancer progressing on a non-steroidal aromatase inhibitor, 64 patients were randomly assigned to the exemestane plus entinostat, which we refer to as EE, group and 66 patients were randomly assigned to the exemestane plus placebo, which we refer to as EP, group.
The results are summarized below:
• Median PFS approximately doubled to 4.3 months in the EE group versus 2.3 months in the EP group, corresponding to a statistically significant hazard ratio of 0.73; 95% confidence interval, or CI, of 0.50 to 1.07; P2-sided=0.11; P1-sided=0.055.
• Median overall survival improved to 28.1 months in the EE group versus 19.8 months in the EP group corresponding to a statistically significant hazard ratio of 0.59; 95% CI of 0.36 to 0.97; P2-sided=0.036; P1-sided=0.018.
• Elevated levels of protein lysine acetylation biomarker, known as hyperacetylation, were associated with an improved clinical benefit with prolonged PFS of 8.6 months in the subset of EE treated patients from whom blood was taken.
• Overall, entinostat was well-tolerated.
Aufgrund dieser Ergebnisse hat man mit einer umfassenden P III-Studie begonnen, die unter einem SPA und mit Hilfe eines CRADA läuft:
We have developed with ECOG-ACRIN the Phase 3 clinical trial to confirm the PFS and overall survival benefits observed in the Phase 2b clinical trial.
ECOG-ACRIN is conducting the Phase 3 clinical trial under sponsorship and funding support from the NCI. We are supporting the Phase 3 clinical trial under a CRADA with the NCI and a separate agreement with ECOG-ACRIN.
The trial is designed to be a randomized, double-blind, placebo-controlled trial of EE compared to EP. The protocol for the Phase 3 clinical trial was reviewed and agreed upon by the FDA under a SPA agreement with the NCI in January 2014. A SPA agreement is a written agreement on the design and size of clinical trials intended to form the primary basis of a claim of effectiveness in a New Drug Application, or NDA, from the FDA.
ECOG-ACRIN activated the trial in March 2014. The trial initiated enrollment of 600 patients across the cooperative group network of up to 800 sites worldwide in the second quarter of 2014. We anticipate that the trial will require approximately 40 months to fully enroll patients with primary PFS endpoint data expected in mid-2017.
The primary objective of the trial is to evaluate whether the addition of entinostat to exemestane improves either PFS or overall survival in HR-positive men and postmenopausal women with human epidermal growth factor receptor 2, or HER2, negative, advanced breast cancer who have previously progressed on a non-steroidal aromatase inhibitor.
The NCI and ECOG-ACRIN, in collaboration with us, have designed the trial to have two primary endpoints of PFS and overall survival. We expect that either endpoint may serve as the basis for submitting an NDA, if data are positive.
Das SPA ist aus meiner Sicht sehr wertvoll. Ebenfalls positiv ist der doppelte primäre Endpunkt PFS oder OS.
Darüber hinaus hat die FDA im September 2013 für Entinostat die Breakthrough Therapy designation erteilt.
Es ist eher selten, dass ein kleines Unternehmen wie Syndax einen BT zugestanden bekommt.
In jüngster Zeit gibt es Hinweise auf eine immunmodulatorische Wirkung:
In order to fully understand the potential for entinostat to potentiate the activity of immune therapies, we plan to work with our collaborators to initiate a series of clinical studies in combination with targeted immune therapies in melanoma, breast cancer, lung cancer and other solid tumors. Data from a completed Phase 2 NSCLC clinical trial with entinostat combined with azacitidine suggest that entinostat may prime tumors to be more responsive to subsequent immune therapy targeting PD1 or PDL1. Further, preclinical studies have indicated that entinostat works to enhance the activity of immune therapy by inhibiting the activity of host immune cells that function to suppress the activity of anti-tumor immune responses.
• ENCORE 601: Phase 1b Clinical Trial.
Based on these findings and emerging preclinical data demonstrating synergistic combined anti-tumor effects of entinostat and immune therapy, we are currently planning a Phase 1b clinical trial to examine the combination of entinostat with a selected antibody targeting PD1 or PDL1 to characterize the safety, define a recommended Phase 2 dose and assess the preliminary clinical activity of this combination. The trial will combine entinostat with an anti-PD1 antibody in patients with metastatic NSCLC or melanoma. We anticipate initiating this trial in the first half of 2015 with safety, recommended Phase 2 dose, preliminary activity and correlative data available in mid-2016.
Zusammenfassend finde ich, dass hier viel geboten wird:
- gute PIIb-Daten,
- laufende PIII mit gutem Design,
- SPA,
- Breakthrough,
- großer Markt,
- Kombinierbarkeit
Was nicht ganz gefällt sind die langen Trial-Laufzeiten, der fehlende Partner und beim NW-Profil bin ich nicht ganz sicher, wie problematisch das ist.
Hat jemand eine Meinung zu Syndax? Vor allem Kritisches und Negatives ist gefragt!
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 56 | ||
| 50 | ||
| 48 | ||
| 43 | ||
| 40 | ||
| 21 | ||
| 14 | ||
| 11 | ||
| 11 | ||
| 10 |
| Wertpapier | Beiträge | |
|---|---|---|
| 10 | ||
| 10 | ||
| 9 | ||
| 9 | ||
| 8 | ||
| 8 | ||
| 7 | ||
| 7 | ||
| 6 | ||
| 6 |






















