Biotech Depot - verschiede Werte und Strategien - 500 Beiträge pro Seite
eröffnet am 06.04.12 20:55:15 von
neuester Beitrag 15.12.21 20:44:42 von
neuester Beitrag 15.12.21 20:44:42 von
Beiträge: 2.765
ID: 1.173.523
ID: 1.173.523
Aufrufe heute: 0
Gesamt: 306.557
Gesamt: 306.557
Aktive User: 0
Top-Diskussionen
| Titel | letzter Beitrag | Aufrufe |
|---|---|---|
| 20.04.24, 12:11 | 328 | |
| vor 1 Stunde | 178 | |
| gestern 18:31 | 111 | |
| 22.06.20, 20:50 | 86 | |
| gestern 15:11 | 70 | |
| vor 1 Stunde | 61 | |
| vor 1 Stunde | 49 | |
| gestern 11:20 | 46 |
Meistdiskutierte Wertpapiere
| Platz | vorher | Wertpapier | Kurs | Perf. % | Anzahl | ||
|---|---|---|---|---|---|---|---|
| 1. | 1. | 18.161,01 | +1,36 | 217 | |||
| 2. | 3. | 0,1885 | -0,26 | 90 | |||
| 3. | 2. | 1,1800 | -14,49 | 77 | |||
| 4. | 5. | 9,3500 | +1,14 | 60 | |||
| 5. | 4. | 168,29 | -1,11 | 50 | |||
| 6. | Neu! | 0,4400 | +3,53 | 36 | |||
| 7. | Neu! | 4,7950 | +6,91 | 34 | |||
| 8. | Neu! | 11,905 | +14,97 | 31 |
Im Spätherbst letzten Jahres habe ich angefangen mein Depot vollständig mit Biotech-Aktien auszustatten. Jedem Fond-Manager würde es vermutlich nächtens den Schlaf rauben, hätte er auch nur einen geringen Teil seines ihm zur Verfügung stehenden Anlagevolumens so investiert…aber jeder ist ja selbst seines Erfolges Schmied – oder Knecht – wie es immer schon so schön hieß…
Sowohl das Zinsniveau welches auf Einlagen gezahlt wird, als auch die Performance die mit DAX- und anderen Standardwerten - selbst bei guter Entwicklung erzielbar erschien konnten mich nicht aus der Reserve locken in selbige zu investieren. Ich habe mich daher für die sicherlich risikoreiche Variante des Biotechinvestments entschieden – wenngleich mir bewußt ist, daß gerade in diesem Bereich zeitaufwändige Recherche, sowie sorgfältiges Abwägen der Pro und Contras unerläßlich sind…vermutlich auch immer bleiben werden.
Klar ist eines – selbst die Profis, die mit absoluten Brancheninsidern auf „du und du“ sind – also über beste Infoquellen verfügen - stranden manchmal fürchterlich mit ihrer Anlageentscheidung. Biotech ist und bleibt extrem risikoreich – aber nirgendwo dürften ähnliche Renditen zu erzielen sein wie eben genau in dieser Branche…und das entschädigt auch bei gelegentlich mal sich als falsch herausstellenden Spekulationen.
In diesem Sinne…
Anbei mal was sich neben ein paar kleineren Beigaben derzeit in meinem Depot befindet:
DVAX – Dynavax Technologies
ACAD – Acadia Pharmaceuticals
GTXI – GTX Inc.
HZNP – Horizon Pharmaceuticals
Ich investiere nicht in OTC-Werte - zu hoch ist das Risiko hier bei nur teilweise sehr dünnen Umsätzen ohne gröbere Verluste rauszukommen wenn man raus muß. Meine verfolgte Strategie ist eine andere...
Leider findet sich auf w:o außer zu DVAX kaum mehr ein aktueller Thread der noch gepflegt wird.
Ehemalige Threads zu ACAD und GTXI scheinen in der Versenkung zu ruhen – was absolut unverständlich erscheint , da beiden Unternehmen noch dieses Jahr der „große Wurf“ gelingen könnte. HZNP dürfte hierzulande kaum bekannt sein, weil die Aktie an keiner deutschen Börse handelbar ist. DVAX wird wohl in den kommenden Wochen die bisher in den letzten Monaten erzielte Performance noch massiv ausbauen – hier rücken mehrere Kurstreiber wie Zulassungsanträge für den europäischen, sowie für den amerikanischen Markt immer näher, treffen zudem auf Übernahmespekulationen – und das bei gut 17 Mio. geshorteten Anteilen – das nenne ich wahrhaft explosives Potenzial.
Nicht jede Spekulation auf eine Zulassung durch die FDA ging in den vergangenen Wochen wirklich auf. Das haben zuletzt Unternehmen wie AEZS, KERX und CHTP – vor allem aber deren Aktionäre deutlich zu spüren bekommen. Selbst DSCO, die zumindest eine Zulassung erhielten - wenngleich auch für ein Produkt, welches kaum jemals nennenswerte Umsätze erzielen wird. Auch hier haben die erwarteten Kursgewinne gefloppt.
…habe es mir aber verkniffen dort investiert zu sein – da gab es in meinen Augen bessere Optionen.
Ich würde mich freuen wenn der gemischte Thread Resonanz findet und der eine oder andere was beizusteuern hat. Zu den von mir angesprochen Werten beabsichtige ich noch nähere Infos einzustellen, eine Art Watchlist zu führen, ein paar charttechnische Begebenheiten bei Besonderheiten einzustreuen - Meinungen, Wissenswertes oder Anregungen dazu von euch – immer her damit.
Sowohl das Zinsniveau welches auf Einlagen gezahlt wird, als auch die Performance die mit DAX- und anderen Standardwerten - selbst bei guter Entwicklung erzielbar erschien konnten mich nicht aus der Reserve locken in selbige zu investieren. Ich habe mich daher für die sicherlich risikoreiche Variante des Biotechinvestments entschieden – wenngleich mir bewußt ist, daß gerade in diesem Bereich zeitaufwändige Recherche, sowie sorgfältiges Abwägen der Pro und Contras unerläßlich sind…vermutlich auch immer bleiben werden.
Klar ist eines – selbst die Profis, die mit absoluten Brancheninsidern auf „du und du“ sind – also über beste Infoquellen verfügen - stranden manchmal fürchterlich mit ihrer Anlageentscheidung. Biotech ist und bleibt extrem risikoreich – aber nirgendwo dürften ähnliche Renditen zu erzielen sein wie eben genau in dieser Branche…und das entschädigt auch bei gelegentlich mal sich als falsch herausstellenden Spekulationen.
In diesem Sinne…
Anbei mal was sich neben ein paar kleineren Beigaben derzeit in meinem Depot befindet:
DVAX – Dynavax Technologies
ACAD – Acadia Pharmaceuticals
GTXI – GTX Inc.
HZNP – Horizon Pharmaceuticals
Ich investiere nicht in OTC-Werte - zu hoch ist das Risiko hier bei nur teilweise sehr dünnen Umsätzen ohne gröbere Verluste rauszukommen wenn man raus muß. Meine verfolgte Strategie ist eine andere...
Leider findet sich auf w:o außer zu DVAX kaum mehr ein aktueller Thread der noch gepflegt wird.
Ehemalige Threads zu ACAD und GTXI scheinen in der Versenkung zu ruhen – was absolut unverständlich erscheint , da beiden Unternehmen noch dieses Jahr der „große Wurf“ gelingen könnte. HZNP dürfte hierzulande kaum bekannt sein, weil die Aktie an keiner deutschen Börse handelbar ist. DVAX wird wohl in den kommenden Wochen die bisher in den letzten Monaten erzielte Performance noch massiv ausbauen – hier rücken mehrere Kurstreiber wie Zulassungsanträge für den europäischen, sowie für den amerikanischen Markt immer näher, treffen zudem auf Übernahmespekulationen – und das bei gut 17 Mio. geshorteten Anteilen – das nenne ich wahrhaft explosives Potenzial.
Nicht jede Spekulation auf eine Zulassung durch die FDA ging in den vergangenen Wochen wirklich auf. Das haben zuletzt Unternehmen wie AEZS, KERX und CHTP – vor allem aber deren Aktionäre deutlich zu spüren bekommen. Selbst DSCO, die zumindest eine Zulassung erhielten - wenngleich auch für ein Produkt, welches kaum jemals nennenswerte Umsätze erzielen wird. Auch hier haben die erwarteten Kursgewinne gefloppt.
…habe es mir aber verkniffen dort investiert zu sein – da gab es in meinen Augen bessere Optionen.
Ich würde mich freuen wenn der gemischte Thread Resonanz findet und der eine oder andere was beizusteuern hat. Zu den von mir angesprochen Werten beabsichtige ich noch nähere Infos einzustellen, eine Art Watchlist zu führen, ein paar charttechnische Begebenheiten bei Besonderheiten einzustreuen - Meinungen, Wissenswertes oder Anregungen dazu von euch – immer her damit.

Man merkt, das Du Dich mit der Materie auseinandergesetzt hast.
Von den 4 erwähnten Werten hab ich auch 2 auf der Watchlist.
Allerdings unter ca. 40 anderen.
Warum Du grad diese 4 gewählt hast, wirst Du uns sicher auch noch wissen lassen.
Was DSCO anbetrifft bin ich nicht ganz Deiner Meinung.
Ich vermute aber mal, das Deine Auswahl schon einen etwas spekulativen Charakter hat und Du damit relativ schnell satte Kursgewinne mit den 4 Werten erwartest.
Ich hab momentan von den Ami-Bios XOMA, DSCO und den Rohrkrepierer EPCT.
Auf jeden Fall schon mal viel Erfolg mit Deinem Depot.

Von den 4 erwähnten Werten hab ich auch 2 auf der Watchlist.
Allerdings unter ca. 40 anderen.
Warum Du grad diese 4 gewählt hast, wirst Du uns sicher auch noch wissen lassen.
Was DSCO anbetrifft bin ich nicht ganz Deiner Meinung.
Ich vermute aber mal, das Deine Auswahl schon einen etwas spekulativen Charakter hat und Du damit relativ schnell satte Kursgewinne mit den 4 Werten erwartest.
Ich hab momentan von den Ami-Bios XOMA, DSCO und den Rohrkrepierer EPCT.
Auf jeden Fall schon mal viel Erfolg mit Deinem Depot.

Antwort auf Beitrag Nr.: 43.012.084 von zwitscherton am 06.04.12 23:57:55@ zwitscherton
...eigentlich dachte ich ja daß um diese Zeit keiner mehr so wie ich vor dem PC sitzt und sich ausgerechnet mit Aktien beschäftigt...aber falsch gedacht..
Danke dir schon mal für deine nette Resonanz - und ich bin mir fast sicher daß wir uns hier wieder treffen
XOMA hatte ja in den letzten Wochen auch schon einen guten Lauf - der sicherlich in nicht unerheblicher Weise mit seinem Mega-Anteilseigner (Felix Baker) zu tun hat...
Meiner Ansicht nach ist er derzeit einer der Jungs, die in der Branche die Nase ganz weit vorne haben - aber bei deinen eigenen Recherchen zu XOMA bist du da sicher längst schon selbst drauf gestoßen
EPCT.PK gehört zu den Werten die ich eingangs schon ansprach keinesfalls zu kaufen. Ist ja ein Wert aus den "pinkies" - die könnten Hühner züchten die goldene Eier legen und ich würde sie immer noch nicht anfassen....irgendwo liegt da immer ein Hund begraben und genau nach dem zu suchen geht für mich in die falsche Richtung.
DSCO können wir ja nochmal bei Gelegenheit aufgreifen und ein bißchen fachsimpeln...
...........................................................................
Zu DVAX stell ich morgen nochmal was rein - da rührt sich in den letzten Handelstagen ziemlich was....
...eigentlich dachte ich ja daß um diese Zeit keiner mehr so wie ich vor dem PC sitzt und sich ausgerechnet mit Aktien beschäftigt...aber falsch gedacht..
Danke dir schon mal für deine nette Resonanz - und ich bin mir fast sicher daß wir uns hier wieder treffen

XOMA hatte ja in den letzten Wochen auch schon einen guten Lauf - der sicherlich in nicht unerheblicher Weise mit seinem Mega-Anteilseigner (Felix Baker) zu tun hat...
Meiner Ansicht nach ist er derzeit einer der Jungs, die in der Branche die Nase ganz weit vorne haben - aber bei deinen eigenen Recherchen zu XOMA bist du da sicher längst schon selbst drauf gestoßen

EPCT.PK gehört zu den Werten die ich eingangs schon ansprach keinesfalls zu kaufen. Ist ja ein Wert aus den "pinkies" - die könnten Hühner züchten die goldene Eier legen und ich würde sie immer noch nicht anfassen....irgendwo liegt da immer ein Hund begraben und genau nach dem zu suchen geht für mich in die falsche Richtung.
DSCO können wir ja nochmal bei Gelegenheit aufgreifen und ein bißchen fachsimpeln...
...........................................................................
Zu DVAX stell ich morgen nochmal was rein - da rührt sich in den letzten Handelstagen ziemlich was....

warum gibt es in deinem depot keine europäischen biotech unternehmen?
in Q1 2012 war kursmässig für viele europäischen aktien sehr gut.
in Q1 2012 war kursmässig für viele europäischen aktien sehr gut.
Antwort auf Beitrag Nr.: 43.011.834 von Freizeitspekulant am 06.04.12 20:55:15DVAX gefält mir auch! 
ACADIA war 2008 bei über 15 USD und im märz bei 1,5 USD. der akt. börsenwert liegt bei unter 80 mio €
was ist da so spannend? erscheint mir eine sehr riskante angelegenheit mit viel zockern
HZNP in 2011 war der kurs bei 11 jetzt bei 4 usd , börsenwert bei 60 miop € . kein überzeugendes verhalten an der börse...
GTXI war 2008 bei über 20 USD, 2012 zwischen 2,5 und 6,75 und aktuell bei 3,8 USD. immerhin ein börsenwert von 220 mio €. was ist an der firma spannend?
mein fazit:
ausser dvax sehr sehr riskante firmen die an der börse massiv enttäuschten.

ACADIA war 2008 bei über 15 USD und im märz bei 1,5 USD. der akt. börsenwert liegt bei unter 80 mio €
was ist da so spannend? erscheint mir eine sehr riskante angelegenheit mit viel zockern

HZNP in 2011 war der kurs bei 11 jetzt bei 4 usd , börsenwert bei 60 miop € . kein überzeugendes verhalten an der börse...

GTXI war 2008 bei über 20 USD, 2012 zwischen 2,5 und 6,75 und aktuell bei 3,8 USD. immerhin ein börsenwert von 220 mio €. was ist an der firma spannend?

mein fazit:
ausser dvax sehr sehr riskante firmen die an der börse massiv enttäuschten.

Antwort auf Beitrag Nr.: 43.011.834 von Freizeitspekulant am 06.04.12 20:55:15Hallo!
Ich wollte mich noch für die Thread Eröffnung bedanken! Ein Daumen stammt von mir.
Das ist ein Sektor, in dem ich leider sehr untergewichtet bin, da ich irgendwie hier nie so richtig "reinkomme" Ich hatte nur mal eine Weile relativ konservative Werte, wie z.B. HITK. Ansonsten spiele ich maximal die News (erfolgreicher Phase III Test) und gehe dann wieder raus.
Ich würde mich aber schon intensiver mit dem Sektor befassen wollen. Mich würde da interessieren, wie Ihr das so handhabt? Nach welchen Kriterien findet man so einen Titel? Es gibt ja Leute, die kennen einen Haufen Termine im Schlaf - bei welcher Firma welche Tests wie weit fortgeschritten sind... Ich habe auch die Links z.B. zu der US-Seite, wo alle Tests dokumentiert sind. Habe das aber irgendwie noch nicht in Anlageentscheidungen umsetzen können.
Die eine oder andere Firma, die ich eigentlich sehr interessant finde, die läuft dann aber doch nicht so richtig. Z.B. ein Unternehmen aus Skandinavien ist wohl an einem Mittel dran, gegen Alkoholismus. Das müsste doch eigentlich ein Blockbuster sein, wenns funktioniert. Aber in der Zeit, wo ich die Firma beobachtete, war das eher ein Mauerblümchen...
Also, mich würden da immer mal auch Eure Erfahrungen interessieren, wenn Ihr Zeit und Lust habt, und wie Ihr da recherchiert und auswählt.
Wenn der eine oder andere Mediziner ist, dann schadet das auch nicht unbedingt, habe ich aus früheren Zeiten gelernt.
Viele Grüße + Schöne Ostern
s.
Ich wollte mich noch für die Thread Eröffnung bedanken! Ein Daumen stammt von mir.

Das ist ein Sektor, in dem ich leider sehr untergewichtet bin, da ich irgendwie hier nie so richtig "reinkomme" Ich hatte nur mal eine Weile relativ konservative Werte, wie z.B. HITK. Ansonsten spiele ich maximal die News (erfolgreicher Phase III Test) und gehe dann wieder raus.
Ich würde mich aber schon intensiver mit dem Sektor befassen wollen. Mich würde da interessieren, wie Ihr das so handhabt? Nach welchen Kriterien findet man so einen Titel? Es gibt ja Leute, die kennen einen Haufen Termine im Schlaf - bei welcher Firma welche Tests wie weit fortgeschritten sind... Ich habe auch die Links z.B. zu der US-Seite, wo alle Tests dokumentiert sind. Habe das aber irgendwie noch nicht in Anlageentscheidungen umsetzen können.
Die eine oder andere Firma, die ich eigentlich sehr interessant finde, die läuft dann aber doch nicht so richtig. Z.B. ein Unternehmen aus Skandinavien ist wohl an einem Mittel dran, gegen Alkoholismus. Das müsste doch eigentlich ein Blockbuster sein, wenns funktioniert. Aber in der Zeit, wo ich die Firma beobachtete, war das eher ein Mauerblümchen...
Also, mich würden da immer mal auch Eure Erfahrungen interessieren, wenn Ihr Zeit und Lust habt, und wie Ihr da recherchiert und auswählt.
Wenn der eine oder andere Mediziner ist, dann schadet das auch nicht unbedingt, habe ich aus früheren Zeiten gelernt.

Viele Grüße + Schöne Ostern
s.
Antwort auf Beitrag Nr.: 43.012.109 von Freizeitspekulant am 07.04.12 00:43:21Hier also mal ein paar Begebenheiten zum Unternehmen, sowie meine persönliche Betrachtungweise zu meinem Investment in DVAX:
• HEPLISAV
heißt hier das Zauberwort – nach den zuletzt unternehmensseitig berichteten Top-Daten der abschließenden P III-Phase für diese Anwendung gegenüber Engerix von GSK erscheint klar daß HEPLISAV die Ablösung der bisherigen Marktführerschaft von Engerix sein dürfte. Daß GSK hierzu reagieren muß ist klar – vermutlich wird man sich nicht die Butter vom Brot nehmen lassen wollen. Ob dies nun in Form einer Partnerschaft gelöst wird oder kurzerhand ein Angebot zur Übernahme von DVAX erfolgt erscheint im Moment noch offen. Es stellt sich nur noch die Frage wie lange…
• BLA (Biologics License Application) wurde bereits für Mitte Mai angekündigt.
• Kapitalerhöhung
Erfolgreiche Platzierung von 24 Mio zusätzlichen Aktien zu je 2,50 $ pro Anteilsschein Anfang November 2011 an institutionelleAnleger. Die Kapitalerhöhung brachte dem Unternehmen somit 60 Mio. US-$ ein – wurde „kursunschädlich“ umgesetzt und bringt mir als Anleger schon mal die Sicherheit daß das Unternehmen mehr als ausreichende Kapitalreserven hat um seine strukturierte Planung auch entsprechend umsetzen zu können. Weitere Maßnahmen zur Erhöhung des Stammkapitals werden aus o.g. Gründen wohl nicht mehr erforderlich sein.
• Hauptaktionäre
DVAX – Anteile finden sich in sehr großen Mengen (60-70% der ausgegebenen Aktien ) in den Depots institutioneller Anleger, einige haben zuletzt auch ihre Beteiligungen erhöht.
• geshortete Aktien
Derzeit dürften 17-18 Mio. Shares geshortet sein – das ist sehr viel…und bringt hinsichtlich erforderlich werdender Shorteindeckungen enormes Kurspotenzial. Wie die Überlegung der Shorties aussieht ihre Leerverkäufe im Falle eines nicht wirklich überraschenden Übernahmeangebotes einzudecken ist mir etwas schleierhaft – ich würde hier jedenfalls nicht short sein wollen.
• Kursentwicklung und Chart
DVAX ist bisher schon schön gelaufen und hat den Biotech-Index klar outperformed. Dies wohl bislang in erster Linie weil zum einen der letzte Geschäftsbericht die Markterwartung klar übertroffen hatte, zudem haben die mehr als guten Ergebnisse von HEPLISAV sicher ihren Anteil dazu beigetragen daß der Kurs sich gleichermaßen gut entwickeln konnte. Der Chart – eine Augenweide. Derzeit sieht es charttechnisch gesehen nach weiterer Aufbruchstimmung gen Norden aus.
• Die Spekulation
- ein positiver FDA-Bescheid, sowie Zulassung in Europa dürfte in der bisherigen Kursentwicklung weitestgehend eingepreist sein. Die Zugpferde heißen jetzt Verpartnerung bzw. mögliche Übernahme. GSK dürfte hier aus genannten Gründen Hauptanwärter sein. Beim derzeitigen Kurs von 5,15 $ ist DVAX mit 800 Mio US-$ bewertet – mit einem Übernahmeangebot in der Gegend um 10 $ würde ein Bieter für 1,6 Mrd. US-$ noch günstig kaufen wenn man bedenkt sich so die unangefochtene Marktführerschaft für Jahre zu sichern, zudem die Restpipeline von DVAX quasi umsonst zu bekommen. Bei einer angestrebten Verpartnerung müßte ein Zweitinteressent erst mal GSK ausstechen – was sicher auch nicht billig wird. Beabsichtigt GSK eine Verpartnerung wird DVAX sicher eine sehr hohe Upfront-Zahlung plus mindestens 20+X% Beteiligung am Gewinn herausholen können.
• DVAX in meinem Depot
Ich halte meine Anteile derzeit fast schon als „BlueChip“ unter dem Rest was da sonst noch drin ist. Entsprechend hoch ist daher auch die prozentuale Gewichtung in Bezug auf den Gesamtinhalt. Obwohl ja in den letzten Wochen einige Unternehmen mit ihren jeweiligen Zulassungsanträgen teils unerwartet – und mit den in diesem Fall nicht unüblich deftigen Kursverlusten gescheitert sind, beabsichtige ich meine DVAX-Anteile durch die „FDA-Endabnahme“ zu halten.
PS: einen Chart von DVAX hätte ich eigentlich hier auch noch miteinbrngen wollen - hab es aber auf die Schnelle nicht auf die Reihe bekommen - muß mich anscheinend nochmal in die w:o-Technologie einarbeiten
• HEPLISAV
heißt hier das Zauberwort – nach den zuletzt unternehmensseitig berichteten Top-Daten der abschließenden P III-Phase für diese Anwendung gegenüber Engerix von GSK erscheint klar daß HEPLISAV die Ablösung der bisherigen Marktführerschaft von Engerix sein dürfte. Daß GSK hierzu reagieren muß ist klar – vermutlich wird man sich nicht die Butter vom Brot nehmen lassen wollen. Ob dies nun in Form einer Partnerschaft gelöst wird oder kurzerhand ein Angebot zur Übernahme von DVAX erfolgt erscheint im Moment noch offen. Es stellt sich nur noch die Frage wie lange…
• BLA (Biologics License Application) wurde bereits für Mitte Mai angekündigt.
• Kapitalerhöhung
Erfolgreiche Platzierung von 24 Mio zusätzlichen Aktien zu je 2,50 $ pro Anteilsschein Anfang November 2011 an institutionelleAnleger. Die Kapitalerhöhung brachte dem Unternehmen somit 60 Mio. US-$ ein – wurde „kursunschädlich“ umgesetzt und bringt mir als Anleger schon mal die Sicherheit daß das Unternehmen mehr als ausreichende Kapitalreserven hat um seine strukturierte Planung auch entsprechend umsetzen zu können. Weitere Maßnahmen zur Erhöhung des Stammkapitals werden aus o.g. Gründen wohl nicht mehr erforderlich sein.
• Hauptaktionäre
DVAX – Anteile finden sich in sehr großen Mengen (60-70% der ausgegebenen Aktien ) in den Depots institutioneller Anleger, einige haben zuletzt auch ihre Beteiligungen erhöht.
• geshortete Aktien
Derzeit dürften 17-18 Mio. Shares geshortet sein – das ist sehr viel…und bringt hinsichtlich erforderlich werdender Shorteindeckungen enormes Kurspotenzial. Wie die Überlegung der Shorties aussieht ihre Leerverkäufe im Falle eines nicht wirklich überraschenden Übernahmeangebotes einzudecken ist mir etwas schleierhaft – ich würde hier jedenfalls nicht short sein wollen.
• Kursentwicklung und Chart
DVAX ist bisher schon schön gelaufen und hat den Biotech-Index klar outperformed. Dies wohl bislang in erster Linie weil zum einen der letzte Geschäftsbericht die Markterwartung klar übertroffen hatte, zudem haben die mehr als guten Ergebnisse von HEPLISAV sicher ihren Anteil dazu beigetragen daß der Kurs sich gleichermaßen gut entwickeln konnte. Der Chart – eine Augenweide. Derzeit sieht es charttechnisch gesehen nach weiterer Aufbruchstimmung gen Norden aus.
• Die Spekulation
- ein positiver FDA-Bescheid, sowie Zulassung in Europa dürfte in der bisherigen Kursentwicklung weitestgehend eingepreist sein. Die Zugpferde heißen jetzt Verpartnerung bzw. mögliche Übernahme. GSK dürfte hier aus genannten Gründen Hauptanwärter sein. Beim derzeitigen Kurs von 5,15 $ ist DVAX mit 800 Mio US-$ bewertet – mit einem Übernahmeangebot in der Gegend um 10 $ würde ein Bieter für 1,6 Mrd. US-$ noch günstig kaufen wenn man bedenkt sich so die unangefochtene Marktführerschaft für Jahre zu sichern, zudem die Restpipeline von DVAX quasi umsonst zu bekommen. Bei einer angestrebten Verpartnerung müßte ein Zweitinteressent erst mal GSK ausstechen – was sicher auch nicht billig wird. Beabsichtigt GSK eine Verpartnerung wird DVAX sicher eine sehr hohe Upfront-Zahlung plus mindestens 20+X% Beteiligung am Gewinn herausholen können.
• DVAX in meinem Depot
Ich halte meine Anteile derzeit fast schon als „BlueChip“ unter dem Rest was da sonst noch drin ist. Entsprechend hoch ist daher auch die prozentuale Gewichtung in Bezug auf den Gesamtinhalt. Obwohl ja in den letzten Wochen einige Unternehmen mit ihren jeweiligen Zulassungsanträgen teils unerwartet – und mit den in diesem Fall nicht unüblich deftigen Kursverlusten gescheitert sind, beabsichtige ich meine DVAX-Anteile durch die „FDA-Endabnahme“ zu halten.
PS: einen Chart von DVAX hätte ich eigentlich hier auch noch miteinbrngen wollen - hab es aber auf die Schnelle nicht auf die Reihe bekommen - muß mich anscheinend nochmal in die w:o-Technologie einarbeiten

ein allgemeiner Biotech-Thread... sehr schön!
Bin auch seit vielen Jahren hauptsächlich in Biotechs investiert. Dieser Sektor ist in der Tat nicht gerade risikolos. Nach meiner Erfahrung darf man sich nie sicher sein, dass eine Aktie statt eines erwarteten Gewinns nicht plötzlich zur Nullnummer wird... selbst wenn die Story sich so toll und plausibel anhört. D.h. egal worauf du setzt, kalkuliere immer ein, dass es auch komplett schiefgehen kann! Man kann sich niemals sicher sein, dass z.B. eine PIII erfolgreich ist, dass eine Zulassung erfolgt oder dass nach einer Zulassung sich das Produkt auch erfolgreich verkaufen lässt. Oft fällt auch der Kurs, obwohl beispielsweise ein klinische Studie erfolgreich war, weil der Markt doch mehr erwartet oder in der nächsten Zeit nichts besseres erwartet. Von denen, die Erfolg haben, wirst du immer hören, dass sie das doch immer schon wussten und die, die ein Großteil verlieren, verschwinden in der Versenkung und hoffen auf Besserung. Man darf sich da nicht blenden lassen von Leuten, die die tolle Story haben oder sich sehr sicher sind. Die Aussage "Eine Zulassung halte ich für sehr sicher" ist bestenfalls wertlos, oft auch ein Kontraindikator! Dann sollte man sich das ganze umso genauer anschauen und sich nicht davon verleiten lassen!
Wie wählst du denn deine Werte aus? Ich bin kein Mediziner und ich wette, dass auch ein Mediziner nicht einen Erfolg oder einen Kursgewinn voraussehen kann. Es dürfte kaum möglich sein, eine einzelne Aktie so zu durchleuten, dass man alle Fallstricke findet. Also ich habe die Zeit nicht und ich halte dies auch für unnötig. Trotzdem benötigt man Infos... und nach meiner Erfahrung gibt es sehr wenige brauchbare Infos. Viele "Analysen", "Reports" oder "Empfehlungen" sind es überhaupt nicht wert, gelesen zu werden. Ein Kriterium für mich, ob eine Quelle brauchbar ist oder nicht, ist, ob jemand auch kritische Fragen stellt. Eine differenzierte Betrachtung, die sowohl das positive als auch das negative herausarbeitet, ist für mich brauchbar... kritische Stimmen sind oft hilfreich, dass man nicht alles zu rosa und optimistisch sieht.
Hast du gute Quellen? Meine Quellen sind z.B.
http://www.hammerstockblog.com/
http://pharmastrategyblog.com/
brauchbar ist auch...
http://investorshub.advfn.com/boards/board.aspx?board_id=141…
http://www.siliconinvestor.com/home.aspx?forumid=102&sort=5&…
http://www.thestreet.com/author/1352996/adam-feuerstein/all.…
http://www.fiercebiotech.com/
Außerdem bin ich vorsichtig, wenn u.a. ...
- ein Unternehmen nur ein aussichtsreiches Produkt in der Entwicklung hat, von dem alles abhängt
- ein Unternehmen in der Vergangenheit nur schlechte Ergebnisse erzielt hat
- die Marktkapitalisierung sehr klein ist (<200 Mio)
- es kein amerikanisches Unternehmen ist
- der Cash-Bestand gerade so zum Überleben reicht
Inzwischen fühle ich mich wohler, wenn ich das Risiko auf möglichst viele für mich aussichtsreiche Werte verteile. So komme ich meistens auf 20-30 Werte, wodurch ich zwar von positiven Ereignissen relativ wenig profitiere, aber auch locker einige Totalausfälle wegstecken kann.
Momentan sind meine Werte jeweils mit Gewichtung...
10,9% Pharmacyclics http://finance.yahoo.com/q?s=PCYC
10,2% Regeneron http://finance.yahoo.com/q?s=REGN
8,1% Incyte http://finance.yahoo.com/q?s=INCY
6,9% Cubist http://finance.yahoo.com/q?s=CBST
6,6% Onyx http://finance.yahoo.com/q?s=ONXX
6,1% Array http://finance.yahoo.com/q?s=ARRY
5,3% ArQule http://finance.yahoo.com/q?s=ARQL
4,9% Exelixis http://finance.yahoo.com/q?s=EXEL
3,8% Celldex http://finance.yahoo.com/q?s=CLDX
3,8% Seattle Genetics http://finance.yahoo.com/q?s=SGEN
3,1% Ziopharm http://finance.yahoo.com/q?s=ZIOP
3,1% Isis http://finance.yahoo.com/q?s=ISIS
3,0% AVEO http://finance.yahoo.com/q?s=AVEO
2,8% Threshold http://finance.yahoo.com/q?s=THLD
2,8% Rigel http://finance.yahoo.com/q?s=RIGL
2,7% ViroPharma http://finance.yahoo.com/q?s=VPHM
2,7% Alnylam http://finance.yahoo.com/q?s=ALNY
2,7% Intermune http://finance.yahoo.com/q?s=INTM
2,7% Synta http://finance.yahoo.com/q?s=SNTA
2,1% Genmab http://finance.yahoo.com/q?s=GEN.CO
1,9% YM BioScience http://finance.yahoo.com/q?s=YMI
1,5% Trius http://finance.yahoo.com/q?s=TSRX
1,0% Arena http://finance.yahoo.com/q?s=ARNA
0,9% AMAG http://finance.yahoo.com/q?s=AMAG
0,4% Targacept http://finance.yahoo.com/q?s=TRGT
0,2% NeuroSearch http://finance.yahoo.com/q?s=NEUR.CO
0,1% NeurogesX http://finance.yahoo.com/q?s=NGSX
Unten sammeln sich die Leichen, die ich irgendwann aussortiere.
Von deinen Werten habe ich mir zuletzt mal GTXI angesehen, die vielleicht in Frage kommen könnten. Allerdings beginne ich ein Position meist eher mit einem ca. 2% Anteil. Die anderen schaue ich mir auch nochmal an, sind mir aber bisher wohl nicht weiter aufgefallen.
Viel Erfolg mit deinen Investitionen!
Bin auch seit vielen Jahren hauptsächlich in Biotechs investiert. Dieser Sektor ist in der Tat nicht gerade risikolos. Nach meiner Erfahrung darf man sich nie sicher sein, dass eine Aktie statt eines erwarteten Gewinns nicht plötzlich zur Nullnummer wird... selbst wenn die Story sich so toll und plausibel anhört. D.h. egal worauf du setzt, kalkuliere immer ein, dass es auch komplett schiefgehen kann! Man kann sich niemals sicher sein, dass z.B. eine PIII erfolgreich ist, dass eine Zulassung erfolgt oder dass nach einer Zulassung sich das Produkt auch erfolgreich verkaufen lässt. Oft fällt auch der Kurs, obwohl beispielsweise ein klinische Studie erfolgreich war, weil der Markt doch mehr erwartet oder in der nächsten Zeit nichts besseres erwartet. Von denen, die Erfolg haben, wirst du immer hören, dass sie das doch immer schon wussten und die, die ein Großteil verlieren, verschwinden in der Versenkung und hoffen auf Besserung. Man darf sich da nicht blenden lassen von Leuten, die die tolle Story haben oder sich sehr sicher sind. Die Aussage "Eine Zulassung halte ich für sehr sicher" ist bestenfalls wertlos, oft auch ein Kontraindikator! Dann sollte man sich das ganze umso genauer anschauen und sich nicht davon verleiten lassen!
Wie wählst du denn deine Werte aus? Ich bin kein Mediziner und ich wette, dass auch ein Mediziner nicht einen Erfolg oder einen Kursgewinn voraussehen kann. Es dürfte kaum möglich sein, eine einzelne Aktie so zu durchleuten, dass man alle Fallstricke findet. Also ich habe die Zeit nicht und ich halte dies auch für unnötig. Trotzdem benötigt man Infos... und nach meiner Erfahrung gibt es sehr wenige brauchbare Infos. Viele "Analysen", "Reports" oder "Empfehlungen" sind es überhaupt nicht wert, gelesen zu werden. Ein Kriterium für mich, ob eine Quelle brauchbar ist oder nicht, ist, ob jemand auch kritische Fragen stellt. Eine differenzierte Betrachtung, die sowohl das positive als auch das negative herausarbeitet, ist für mich brauchbar... kritische Stimmen sind oft hilfreich, dass man nicht alles zu rosa und optimistisch sieht.
Hast du gute Quellen? Meine Quellen sind z.B.
http://www.hammerstockblog.com/
http://pharmastrategyblog.com/
brauchbar ist auch...
http://investorshub.advfn.com/boards/board.aspx?board_id=141…
http://www.siliconinvestor.com/home.aspx?forumid=102&sort=5&…
http://www.thestreet.com/author/1352996/adam-feuerstein/all.…
http://www.fiercebiotech.com/
Außerdem bin ich vorsichtig, wenn u.a. ...
- ein Unternehmen nur ein aussichtsreiches Produkt in der Entwicklung hat, von dem alles abhängt
- ein Unternehmen in der Vergangenheit nur schlechte Ergebnisse erzielt hat
- die Marktkapitalisierung sehr klein ist (<200 Mio)
- es kein amerikanisches Unternehmen ist
- der Cash-Bestand gerade so zum Überleben reicht
Inzwischen fühle ich mich wohler, wenn ich das Risiko auf möglichst viele für mich aussichtsreiche Werte verteile. So komme ich meistens auf 20-30 Werte, wodurch ich zwar von positiven Ereignissen relativ wenig profitiere, aber auch locker einige Totalausfälle wegstecken kann.
Momentan sind meine Werte jeweils mit Gewichtung...
10,9% Pharmacyclics http://finance.yahoo.com/q?s=PCYC
10,2% Regeneron http://finance.yahoo.com/q?s=REGN
8,1% Incyte http://finance.yahoo.com/q?s=INCY
6,9% Cubist http://finance.yahoo.com/q?s=CBST
6,6% Onyx http://finance.yahoo.com/q?s=ONXX
6,1% Array http://finance.yahoo.com/q?s=ARRY
5,3% ArQule http://finance.yahoo.com/q?s=ARQL
4,9% Exelixis http://finance.yahoo.com/q?s=EXEL
3,8% Celldex http://finance.yahoo.com/q?s=CLDX
3,8% Seattle Genetics http://finance.yahoo.com/q?s=SGEN
3,1% Ziopharm http://finance.yahoo.com/q?s=ZIOP
3,1% Isis http://finance.yahoo.com/q?s=ISIS
3,0% AVEO http://finance.yahoo.com/q?s=AVEO
2,8% Threshold http://finance.yahoo.com/q?s=THLD
2,8% Rigel http://finance.yahoo.com/q?s=RIGL
2,7% ViroPharma http://finance.yahoo.com/q?s=VPHM
2,7% Alnylam http://finance.yahoo.com/q?s=ALNY
2,7% Intermune http://finance.yahoo.com/q?s=INTM
2,7% Synta http://finance.yahoo.com/q?s=SNTA
2,1% Genmab http://finance.yahoo.com/q?s=GEN.CO
1,9% YM BioScience http://finance.yahoo.com/q?s=YMI
1,5% Trius http://finance.yahoo.com/q?s=TSRX
1,0% Arena http://finance.yahoo.com/q?s=ARNA
0,9% AMAG http://finance.yahoo.com/q?s=AMAG
0,4% Targacept http://finance.yahoo.com/q?s=TRGT
0,2% NeuroSearch http://finance.yahoo.com/q?s=NEUR.CO
0,1% NeurogesX http://finance.yahoo.com/q?s=NGSX
Unten sammeln sich die Leichen, die ich irgendwann aussortiere.
Von deinen Werten habe ich mir zuletzt mal GTXI angesehen, die vielleicht in Frage kommen könnten. Allerdings beginne ich ein Position meist eher mit einem ca. 2% Anteil. Die anderen schaue ich mir auch nochmal an, sind mir aber bisher wohl nicht weiter aufgefallen.
Viel Erfolg mit deinen Investitionen!
Antwort auf Beitrag Nr.: 43.012.332 von pokemon am 07.04.12 09:53:06@pokemon
hast Recht - da sind keine europäischen Unternehmen mit drinnen - außer durch DVAX die vielleicht dir noch bekannte Rhein Biotech...
Ich habe mich auch so gut wie garnicht mit den europäischen Unternehmen beschäftigt. Vermutlich wird auch dort oder da ordentliche Arbeit abgeliefert - wir hängen aber hierzu viel zu sehr (..schon allein aus markttechnischen Gründen) am Tropf des amerikanischen Marktes.
Ein paar Unternehmen aus Kanada hab ich mir mal näher ausgeleuchtet - aber auch dort die Finger weggelassen weil mich die Kanadier mit gelegentlich wenig nachvollziebarem Agieren an der Börse verblüfft hatten - irgendeiner machte da immer gewaltig Kasse wenn irgendwo positive News anstanden.
Klar ist sell the news auch ein Marktinstrument - aber die Markttransparenz konnte mich nicht wirklich begeistern...
Da hab ich eben lieber die US-Werte...
hast Recht - da sind keine europäischen Unternehmen mit drinnen - außer durch DVAX die vielleicht dir noch bekannte Rhein Biotech...
Ich habe mich auch so gut wie garnicht mit den europäischen Unternehmen beschäftigt. Vermutlich wird auch dort oder da ordentliche Arbeit abgeliefert - wir hängen aber hierzu viel zu sehr (..schon allein aus markttechnischen Gründen) am Tropf des amerikanischen Marktes.
Ein paar Unternehmen aus Kanada hab ich mir mal näher ausgeleuchtet - aber auch dort die Finger weggelassen weil mich die Kanadier mit gelegentlich wenig nachvollziebarem Agieren an der Börse verblüfft hatten - irgendeiner machte da immer gewaltig Kasse wenn irgendwo positive News anstanden.
Klar ist sell the news auch ein Marktinstrument - aber die Markttransparenz konnte mich nicht wirklich begeistern...
Da hab ich eben lieber die US-Werte...
Antwort auf Beitrag Nr.: 43.012.375 von pokemon am 07.04.12 10:12:33@pokemon
...so finde ich sollte man es nicht sehen weil Firmen gelegentlich "unter die Räder kommen" - manche auch nicht unberechtigt...aber ein Teil der eigentllich ursprünglichen Börsenspekulation basierte darauf genau solche "platten" Unternehmen aufzustöbern und an ihrer Rehabilitation und/oder dem sich dann abzeichnendem zukünftigen Erfolg mitzuverdienen - und das gehörig.
Ich habe vor einigen Jahren(!!!) Anteile eines Unternehmens mit dem Namen Inhibitex (INHX) für zum Sensationspreis von unter 40 US-Cent gekauft. Das Unternehmen wurde genauso als Rohrkrepierer mit miserabler Kursentwicklung nach einer vergeigten FDA-Zulassung bezeichnet. Vor ein paar Wochen wurden dann im Zuge der Übernahme für die Anteile 26 US-$ bezahlt...
Wie ich sagte - ich versuche mit verschiedenen Strategien Gewinne zu machen - Perlen aufzutun wenn sich noch keiner mit Ihnen befasst ist eine davon - meine Lieblingsstrategie. Du wirst nirgends so viel verdienen können wie mit Perlenfischen. Rauf und runter traden kann schöne Gewinne bringen -aber niemals in dieser Höhe wie "buy cheap - sell high"
Viel wichtiger ist es herauszufinden was hat ein "gestraucheltes" Unternehmen in der Pipeline - was kann man daraus machen - und tun sie es auch? Da spielt es für mich keine Rolle ob - wie du sagst ein Wert der jetzt bei 1,80$ steht vor vier Jahren noch bei 15$ lag - nicht das was hinter mir liegt ist wichtig - was zählt ist das was die Zukunft eventuell mit im Gepäck hat
Auch meine ACADIA-Anteile habe ich schon eingesackt als der Kurs bei exakt bei 1 US-$ lag. Jeder Trader hätte sie sicher schon nach eingefahrenen 20-30% Gewinn wieder versilbert - mir waren sogar die mittlerweile schon bezahlten 2,30 $ zu wenig dafür welches Potenzial in ACAD steckt.
Sobald es mir zeitlich ausgeht stell ich mal Infos zu ACAD, GTXI und HZNP rein.
...so finde ich sollte man es nicht sehen weil Firmen gelegentlich "unter die Räder kommen" - manche auch nicht unberechtigt...aber ein Teil der eigentllich ursprünglichen Börsenspekulation basierte darauf genau solche "platten" Unternehmen aufzustöbern und an ihrer Rehabilitation und/oder dem sich dann abzeichnendem zukünftigen Erfolg mitzuverdienen - und das gehörig.
Ich habe vor einigen Jahren(!!!) Anteile eines Unternehmens mit dem Namen Inhibitex (INHX) für zum Sensationspreis von unter 40 US-Cent gekauft. Das Unternehmen wurde genauso als Rohrkrepierer mit miserabler Kursentwicklung nach einer vergeigten FDA-Zulassung bezeichnet. Vor ein paar Wochen wurden dann im Zuge der Übernahme für die Anteile 26 US-$ bezahlt...
Wie ich sagte - ich versuche mit verschiedenen Strategien Gewinne zu machen - Perlen aufzutun wenn sich noch keiner mit Ihnen befasst ist eine davon - meine Lieblingsstrategie. Du wirst nirgends so viel verdienen können wie mit Perlenfischen. Rauf und runter traden kann schöne Gewinne bringen -aber niemals in dieser Höhe wie "buy cheap - sell high"
Viel wichtiger ist es herauszufinden was hat ein "gestraucheltes" Unternehmen in der Pipeline - was kann man daraus machen - und tun sie es auch? Da spielt es für mich keine Rolle ob - wie du sagst ein Wert der jetzt bei 1,80$ steht vor vier Jahren noch bei 15$ lag - nicht das was hinter mir liegt ist wichtig - was zählt ist das was die Zukunft eventuell mit im Gepäck hat

Auch meine ACADIA-Anteile habe ich schon eingesackt als der Kurs bei exakt bei 1 US-$ lag. Jeder Trader hätte sie sicher schon nach eingefahrenen 20-30% Gewinn wieder versilbert - mir waren sogar die mittlerweile schon bezahlten 2,30 $ zu wenig dafür welches Potenzial in ACAD steckt.
Sobald es mir zeitlich ausgeht stell ich mal Infos zu ACAD, GTXI und HZNP rein.
Antwort auf Beitrag Nr.: 43.012.793 von ipollit am 07.04.12 14:00:42@ipollit
Natürlich bleibt Biotech immer Biotech - soll heißen Risiko bleibt Risiko...es kann in zeitlichen Abständen größer oder kleiner werden, aber das ist in allen Sektoren so - sogar bei den Finanzwerten (oder da zur Zeit vielleicht gerade besonders..wer weis..)
Jeder muß immer selbst wissen vieviel Risiko er und sein Geldbeutel verträgt - war immer so - wird immer so bleiben.
Was mir aber immer wieder besonders auffällt ist daß sich die breite Masse mit Technik befasst - wie z.B. bei Autos. Hauptkriterium für viele ist in möglichst kurzer Zeit schnell von a nach b zu kommen. Ich freu mich auch wenn es sich flüssig fahren läßt - jedoch betrachte ich Technik auch von der Warte her mir zu sagen ich möchte gesund bei Punkt b ankommen und nutze auch die in der Technik mittlerweile involvierte Sicherheit.
Heutzutage ist der Handel gegenüber früher sehr schnell geworden - aber trotzdem bietet er für manches Instrumente die gegen den Totalcrash absichern - nur nicht gegen falsche Denkweise...da gibt es noch nichts... Für ersteres hilft beispielsweise ein Stopp-Loss - auch keine ganz neue Errungenschaft mehr...aber zumindest eine mit der man sich zu vorher durchdachtem Konzept selbst erziehen kann....
Für ersteres hilft beispielsweise ein Stopp-Loss - auch keine ganz neue Errungenschaft mehr...aber zumindest eine mit der man sich zu vorher durchdachtem Konzept selbst erziehen kann....
Keiner deiner Werte ist mir unbekannt - besonders Cubist (CBST) - welche ja auch schon zum Spottpreis zu haben waren, als kleine extrem spekulative Depotbeimischung im 1-2%-Bereich betitelt wurden - heute mit gut 2,5 Milliarden Marktkap. eher schon eine Hausnummer sind - aber auch THLD - die mir wegen eines zu eng gesetzten Kauflimits von 1,27 $ am Abend vor der ersten Kursexplosion von über 100% durch die Lappen gingen...aber das nur am Rande...
Verursacht deine extrem breite Streuung nicht oftmals das Scenario daß ein paar deiner Werte kräftig zulegen - der Gewinn aber durch rote Vorzeichen bei anderen dutlich geschmälert - wenn nicht sogar komplett verfrühstückt wird?
Mir sind derzeit ca. 150 US-Unternehmen relativ gut bekannt - können auch ein paar mehr sein..ohne OTC-Werte. Habe da schon meist einen guten Überblick wo unternehmensrelevante Dinge am Köcheln sind...informiere mich oft über Wochengeschehen wo es besonder interessant wird. Sehr aufschlußreich ist es auch zu beobachten und zu hinterfragen wo Insider oder große (erfolgreiche) Fonds gerade auf Einkaufstour gehen. Selbst da gibt es Favouriten, die gemessen am Erfolg einfach mehr als nur Glück haben um immer wieder zur richtigen Zeit genau die richtigen Aktien zu kaufen.... Ein Schelm der böses dabei denkt...
Die von dir genannten Boards gelegentlich mal zu durchblättern um sich auch mit Gedanken anderer auseinanderzusetzen kann auch hilfreich sein - allerdings rate ich davon ab sich von dem "Kaufen-Kaufen-Geschrei" oder seinem Gegenteil auf manchen Boards in der eigenen Investmententscheidung drängen zu lassen. Ich gebe auch zu daß es mir in 10 Jahren Börse noch bei keiner Aktie gelungen ist zum historischen Tiefstkurs zu kaufen - ein paar Cent billiger hat es die immer nochmal gegeben...was mich allerdings auch nicht stört wenn hinterher die von mir anvisierte Richtung stimmt.
Was mir besonders bei deinen Werten auffällt sind zwei Dinge: zum einen findet sich darunter kein einziger Wert der regelmäßig von so gewissen kurspushenden Seiten beackert wird um ihn an einem Tag 50% in die Höhe zu treiben - tags darauf wird der dann vom Verfasserkollegen als massive Shortchance wieder 30% nach unten gestampft...mit dem Ergebnis daß der Kurs wieder auf Ausgangsniveau angelangt ist - die meisten Zugestiegenen(außer den Daytradern) jedoch schon mal auf den ersten Minuszeichen sitzen....
Ist es Zufall daß z.B. eine Alexion Pharma fehlt oder ist es der optisch hohe Preis der dich davon abgehalten hat ein Paar Stücke mit einzubeziehen?
.. auch dir Erfolg mit deinem Fonds :-))
Natürlich bleibt Biotech immer Biotech - soll heißen Risiko bleibt Risiko...es kann in zeitlichen Abständen größer oder kleiner werden, aber das ist in allen Sektoren so - sogar bei den Finanzwerten (oder da zur Zeit vielleicht gerade besonders..wer weis..)
Jeder muß immer selbst wissen vieviel Risiko er und sein Geldbeutel verträgt - war immer so - wird immer so bleiben.
Was mir aber immer wieder besonders auffällt ist daß sich die breite Masse mit Technik befasst - wie z.B. bei Autos. Hauptkriterium für viele ist in möglichst kurzer Zeit schnell von a nach b zu kommen. Ich freu mich auch wenn es sich flüssig fahren läßt - jedoch betrachte ich Technik auch von der Warte her mir zu sagen ich möchte gesund bei Punkt b ankommen und nutze auch die in der Technik mittlerweile involvierte Sicherheit.
Heutzutage ist der Handel gegenüber früher sehr schnell geworden - aber trotzdem bietet er für manches Instrumente die gegen den Totalcrash absichern - nur nicht gegen falsche Denkweise...da gibt es noch nichts...
 Für ersteres hilft beispielsweise ein Stopp-Loss - auch keine ganz neue Errungenschaft mehr...aber zumindest eine mit der man sich zu vorher durchdachtem Konzept selbst erziehen kann....
Für ersteres hilft beispielsweise ein Stopp-Loss - auch keine ganz neue Errungenschaft mehr...aber zumindest eine mit der man sich zu vorher durchdachtem Konzept selbst erziehen kann....Keiner deiner Werte ist mir unbekannt - besonders Cubist (CBST) - welche ja auch schon zum Spottpreis zu haben waren, als kleine extrem spekulative Depotbeimischung im 1-2%-Bereich betitelt wurden - heute mit gut 2,5 Milliarden Marktkap. eher schon eine Hausnummer sind - aber auch THLD - die mir wegen eines zu eng gesetzten Kauflimits von 1,27 $ am Abend vor der ersten Kursexplosion von über 100% durch die Lappen gingen...aber das nur am Rande...

Verursacht deine extrem breite Streuung nicht oftmals das Scenario daß ein paar deiner Werte kräftig zulegen - der Gewinn aber durch rote Vorzeichen bei anderen dutlich geschmälert - wenn nicht sogar komplett verfrühstückt wird?
Mir sind derzeit ca. 150 US-Unternehmen relativ gut bekannt - können auch ein paar mehr sein..ohne OTC-Werte. Habe da schon meist einen guten Überblick wo unternehmensrelevante Dinge am Köcheln sind...informiere mich oft über Wochengeschehen wo es besonder interessant wird. Sehr aufschlußreich ist es auch zu beobachten und zu hinterfragen wo Insider oder große (erfolgreiche) Fonds gerade auf Einkaufstour gehen. Selbst da gibt es Favouriten, die gemessen am Erfolg einfach mehr als nur Glück haben um immer wieder zur richtigen Zeit genau die richtigen Aktien zu kaufen.... Ein Schelm der böses dabei denkt...

Die von dir genannten Boards gelegentlich mal zu durchblättern um sich auch mit Gedanken anderer auseinanderzusetzen kann auch hilfreich sein - allerdings rate ich davon ab sich von dem "Kaufen-Kaufen-Geschrei" oder seinem Gegenteil auf manchen Boards in der eigenen Investmententscheidung drängen zu lassen. Ich gebe auch zu daß es mir in 10 Jahren Börse noch bei keiner Aktie gelungen ist zum historischen Tiefstkurs zu kaufen - ein paar Cent billiger hat es die immer nochmal gegeben...was mich allerdings auch nicht stört wenn hinterher die von mir anvisierte Richtung stimmt.
Was mir besonders bei deinen Werten auffällt sind zwei Dinge: zum einen findet sich darunter kein einziger Wert der regelmäßig von so gewissen kurspushenden Seiten beackert wird um ihn an einem Tag 50% in die Höhe zu treiben - tags darauf wird der dann vom Verfasserkollegen als massive Shortchance wieder 30% nach unten gestampft...mit dem Ergebnis daß der Kurs wieder auf Ausgangsniveau angelangt ist - die meisten Zugestiegenen(außer den Daytradern) jedoch schon mal auf den ersten Minuszeichen sitzen....
Ist es Zufall daß z.B. eine Alexion Pharma fehlt oder ist es der optisch hohe Preis der dich davon abgehalten hat ein Paar Stücke mit einzubeziehen?
.. auch dir Erfolg mit deinem Fonds :-))
Antwort auf Beitrag Nr.: 43.012.864 von Freizeitspekulant am 07.04.12 14:48:32bei den us firmen gefallen mir
1. die hohe volatitltät
2. die hohe liquitität auch bei kleinen buden
3. die moegliche hohe bewertung
probleme habe ich
1. mit der teilweisen dreisten bewertung
2. mit der andauernden verwässerung
3. mit den hohen verwaltungskoste/gehältern
schade finde ich dass europ. biotech forschungsunternehmen so gemieden werden, nur weil bei der geringen anzahl die grossen verlierer so leicht auffallen
1. die hohe volatitltät
2. die hohe liquitität auch bei kleinen buden
3. die moegliche hohe bewertung
probleme habe ich
1. mit der teilweisen dreisten bewertung
2. mit der andauernden verwässerung
3. mit den hohen verwaltungskoste/gehältern
schade finde ich dass europ. biotech forschungsunternehmen so gemieden werden, nur weil bei der geringen anzahl die grossen verlierer so leicht auffallen

Antwort auf Beitrag Nr.: 43.012.375 von pokemon am 07.04.12 10:12:33@pokemon
...auf deine Frage was an GTXI so spannend sei...
> einiges ...vor allem wenn du den Zusammenhang zwischen dem was an der Oberläche leicht zu sehen ist und dem etwas tiefer versteckten erkennst und nutzen kannst..
...vor allem wenn du den Zusammenhang zwischen dem was an der Oberläche leicht zu sehen ist und dem etwas tiefer versteckten erkennst und nutzen kannst..
Nachfolgend mal die Übersicht zur Pipeline von GTXI.
Am 21.02.2012 erhielt GTXI von der FDA den Bescheid seine PII-Trials mit CAPESARIS zu stoppen. Infolge dieses Bescheides fiel der Aktienpreis im Panikverkauf wie ein Stein um gut 40%.
Wichtig ist dir darüber klar zu werden daß sich der FDA-geforderte Stopp auf CAPESARIS und nicht das geringste mit den PIII-Trials zu OSTARINE zu tun hat.
Man muß wissen daß sich der vor dem Kurseinbruch erreichte Kurs um 6,5 US-$ allerdings hochgradig auf OSTARINE bezog - CAPESARIS in den PII-Trials hatte da nur geringfügig zur Kursphantasie beigetragen - wie die Analysten der CityGroup wenige Tage zuvor in ihrer Einschätzung so schon formulierten: OSTARINE sei allein 11 US-$ wert - die Restpipeline, also weitere 8 US-$.
Am Tag des Absturzes, sowie in den Folgetagen hat der zweitgrößte Anteilseigner von GTXI - ein gewisser Herr Schuler mal sein Geldbeutelchen geöffnet und satte 2.309.328 Shares zum Durchschnittspreis von 3,47 US-$ für sich und seine Familie gekauft. Der Spaß war ihm immerhin 8.132.016 US-$ wert.
Nun sollte man noch wissen daß dieser Herr Schuler keine unbekannte Person in Pharmakreisen ist - um genau zu sein war er der frühere Vorstandsvorsitzende von Abbott Laboratories...hat also sicher Ahnung von dem was er da tut
Erganzend sei noch hinzugefügt daß GTXI nun am 04.04.2012 die FDA um Wiederaufnahme der gestoppten PII-Trials mit veränderter Dosis ersucht hat.
Die FDA wird sich in den kommenden 3o Tagen ab Antragstellung dazu äußern ob eine Wiederaufnahme erfolgen kann.
Falls dies wider meines Erwartens abgelehnt werden sollte, dürfte das weitestgehend im jetzigen Kursniveau eingepreist sein - im eher positiven Fall der Wiederaufnahmezusage - auch mit eventuellen Regularien - dürfte das Kursniveau von 6 US-$ schnell wieder erreicht sein...
Das dürfte sich der Herr Schuler wohl auch gedacht haben...

...auf deine Frage was an GTXI so spannend sei...
> einiges
 ...vor allem wenn du den Zusammenhang zwischen dem was an der Oberläche leicht zu sehen ist und dem etwas tiefer versteckten erkennst und nutzen kannst..
...vor allem wenn du den Zusammenhang zwischen dem was an der Oberläche leicht zu sehen ist und dem etwas tiefer versteckten erkennst und nutzen kannst..Nachfolgend mal die Übersicht zur Pipeline von GTXI.
Am 21.02.2012 erhielt GTXI von der FDA den Bescheid seine PII-Trials mit CAPESARIS zu stoppen. Infolge dieses Bescheides fiel der Aktienpreis im Panikverkauf wie ein Stein um gut 40%.
Wichtig ist dir darüber klar zu werden daß sich der FDA-geforderte Stopp auf CAPESARIS und nicht das geringste mit den PIII-Trials zu OSTARINE zu tun hat.
Man muß wissen daß sich der vor dem Kurseinbruch erreichte Kurs um 6,5 US-$ allerdings hochgradig auf OSTARINE bezog - CAPESARIS in den PII-Trials hatte da nur geringfügig zur Kursphantasie beigetragen - wie die Analysten der CityGroup wenige Tage zuvor in ihrer Einschätzung so schon formulierten: OSTARINE sei allein 11 US-$ wert - die Restpipeline, also weitere 8 US-$.
Am Tag des Absturzes, sowie in den Folgetagen hat der zweitgrößte Anteilseigner von GTXI - ein gewisser Herr Schuler mal sein Geldbeutelchen geöffnet und satte 2.309.328 Shares zum Durchschnittspreis von 3,47 US-$ für sich und seine Familie gekauft. Der Spaß war ihm immerhin 8.132.016 US-$ wert.
Nun sollte man noch wissen daß dieser Herr Schuler keine unbekannte Person in Pharmakreisen ist - um genau zu sein war er der frühere Vorstandsvorsitzende von Abbott Laboratories...hat also sicher Ahnung von dem was er da tut

Erganzend sei noch hinzugefügt daß GTXI nun am 04.04.2012 die FDA um Wiederaufnahme der gestoppten PII-Trials mit veränderter Dosis ersucht hat.
Die FDA wird sich in den kommenden 3o Tagen ab Antragstellung dazu äußern ob eine Wiederaufnahme erfolgen kann.
Falls dies wider meines Erwartens abgelehnt werden sollte, dürfte das weitestgehend im jetzigen Kursniveau eingepreist sein - im eher positiven Fall der Wiederaufnahmezusage - auch mit eventuellen Regularien - dürfte das Kursniveau von 6 US-$ schnell wieder erreicht sein...
Das dürfte sich der Herr Schuler wohl auch gedacht haben...


...habe die w:o Technik nun scheinbar besiegt - und nochmal einen Chart von DVAX reingestellt.
Aus charttechnischer Sicht haben wir bei 5,03$ eine kleine Unterstützung, der nächste Widerstand liegt bei 5,50$. Sollte der überwunden werden wär der Weg bis 7,70$ frei.

Aus charttechnischer Sicht haben wir bei 5,03$ eine kleine Unterstützung, der nächste Widerstand liegt bei 5,50$. Sollte der überwunden werden wär der Weg bis 7,70$ frei.

Antwort auf Beitrag Nr.: 43.013.519 von Freizeitspekulant am 07.04.12 21:08:34...auch nachträglich der Chart von GTXI
hier gilt es die 3,90$ zu nehmen - dann wär auch schön viel Platz bis zu den 6,23$

hier gilt es die 3,90$ zu nehmen - dann wär auch schön viel Platz bis zu den 6,23$


Antwort auf Beitrag Nr.: 43.011.834 von Freizeitspekulant am 06.04.12 20:55:15Hallo
Eine kleine Position habe ich in Astex Pharma (früher Supergen) aufgebaut.
Hier scheint auch das Risiko überschaubar.
Marktcap 175 Mio.
Cash 125 Mio, jährliche Lizenzeinnahmen ca. 60 Mio.
4 Phase II Produkte, viele Pharmapartner mit Kooperationen.
Die können gar nichts tun, dann haben Sie in 5 Jahren über 400 Mio. cash.
Buchwert 2,60 $ bei Kurs 1,86 $, das ist kaum zu finden bei einem Biotechwert!
Eine kleine Position habe ich in Astex Pharma (früher Supergen) aufgebaut.
Hier scheint auch das Risiko überschaubar.
Marktcap 175 Mio.
Cash 125 Mio, jährliche Lizenzeinnahmen ca. 60 Mio.
4 Phase II Produkte, viele Pharmapartner mit Kooperationen.
Die können gar nichts tun, dann haben Sie in 5 Jahren über 400 Mio. cash.
Buchwert 2,60 $ bei Kurs 1,86 $, das ist kaum zu finden bei einem Biotechwert!
Was haltet ihr von Biodelivery?
Läuft seit längerem sehr sehr gut und stabil, sollte noch viel Potential nach oben haben
WKN : 766464
BDSI wurde übertrieben runtergeprügelt nachdem ein Phase3 kandidat nicht übrzeugen konnte .
Was die meisten übersehen ist das BDSI bereits ein Produkt(Onsolis) gegen Krebsschmerzen auf den Markt hat .
Onsolis ist bereits in USA und Kanada erhältich EU folgt nächstes Jahr ,Onsolis hat ca 200 Million dollar potential .
In kürze stehen einige News an die BDSI abheben lassen könnte
FDA Zulassung -- REMS (Risk Evaluation and Mitigation Strategies) in Dezember 2011
BEMA® Buprenorphine/Naloxone PK Daten in Dezember 2011
Partnerdeal für BEMA® Buprenorphine 1Q 2012
Die Aktie notiert fast auf Cash niveau und auf Allzeittief was BDSI äusserst attraktiv macht .
Biodelivery Science (BDSI)
Marktkap: 28 M
Cash: 22 M
Kurs: 0.95
Shares Out: 29 M...(Insider + Institutions halten knapp 15 Million zusammen)
Neue Präsentation
http://www.bdsi.com/siteres.aspx?resid=8793c1c0-fd1b-4130-a8…
http://www.dailyfinance.com/quote/nasdaq/biodelivery-science…
Key BDSI Milestones
BEMA® Buprenorphine/Naloxone for opioid dependence
–Data from 2nd PK study in December 2011 (study to ensure proper dosing and blood-levels for pivotal BE study)
–Pivotal bioequivalence study January 2012; Data March 2012
–NDA submission target 1Q 2013
BEMA® Buprenorphine for chronic pain
–Late-stage commercial partnership discussions ongoing
–Initiation of 2nd Phase 3 trial in 1H 2012
ONSOLIS® (transmucosal fentanyl) - approved/marketed product
–Launched in U.S. in October 2009 by Meda Pharmaceuticals
–Launched in Canada August 2011; EU in 2H 2012
Late stage pipeline provides an opportunity for significant growth
–BEMA® Buprenorphine/Naloxone
Pivotal bioequivalence study data March 2012; NDA target 1Q 2013
–BEMA® Buprenorphine chronic pain
Phase 3 study initiation planned for 1H 2012; NDA target 1H 2013
Läuft seit längerem sehr sehr gut und stabil, sollte noch viel Potential nach oben haben
WKN : 766464
BDSI wurde übertrieben runtergeprügelt nachdem ein Phase3 kandidat nicht übrzeugen konnte .
Was die meisten übersehen ist das BDSI bereits ein Produkt(Onsolis) gegen Krebsschmerzen auf den Markt hat .
Onsolis ist bereits in USA und Kanada erhältich EU folgt nächstes Jahr ,Onsolis hat ca 200 Million dollar potential .
In kürze stehen einige News an die BDSI abheben lassen könnte
FDA Zulassung -- REMS (Risk Evaluation and Mitigation Strategies) in Dezember 2011
BEMA® Buprenorphine/Naloxone PK Daten in Dezember 2011
Partnerdeal für BEMA® Buprenorphine 1Q 2012
Die Aktie notiert fast auf Cash niveau und auf Allzeittief was BDSI äusserst attraktiv macht .
Biodelivery Science (BDSI)
Marktkap: 28 M
Cash: 22 M
Kurs: 0.95
Shares Out: 29 M...(Insider + Institutions halten knapp 15 Million zusammen)
Neue Präsentation
http://www.bdsi.com/siteres.aspx?resid=8793c1c0-fd1b-4130-a8…
http://www.dailyfinance.com/quote/nasdaq/biodelivery-science…
Key BDSI Milestones
BEMA® Buprenorphine/Naloxone for opioid dependence
–Data from 2nd PK study in December 2011 (study to ensure proper dosing and blood-levels for pivotal BE study)
–Pivotal bioequivalence study January 2012; Data March 2012
–NDA submission target 1Q 2013
BEMA® Buprenorphine for chronic pain
–Late-stage commercial partnership discussions ongoing
–Initiation of 2nd Phase 3 trial in 1H 2012
ONSOLIS® (transmucosal fentanyl) - approved/marketed product
–Launched in U.S. in October 2009 by Meda Pharmaceuticals
–Launched in Canada August 2011; EU in 2H 2012
Late stage pipeline provides an opportunity for significant growth
–BEMA® Buprenorphine/Naloxone
Pivotal bioequivalence study data March 2012; NDA target 1Q 2013
–BEMA® Buprenorphine chronic pain
Phase 3 study initiation planned for 1H 2012; NDA target 1H 2013
Antwort auf Beitrag Nr.: 43.014.383 von Wohnwunsch am 08.04.12 15:51:59Hi
Warum Allzeittief, 52 Wochentief war 0,77 $, aktuell 2,62 $,
Buchwert ist 0,14 $, haben wohl auch noch ein paar Verbindlichkeiten,
Cash 10,5 Mio, Nettoeinkommen - 25 Mio.
Habe nur grob geschaut, aber ganz richtig sind Deine Angaben wohl nicht.
Warum Allzeittief, 52 Wochentief war 0,77 $, aktuell 2,62 $,
Buchwert ist 0,14 $, haben wohl auch noch ein paar Verbindlichkeiten,
Cash 10,5 Mio, Nettoeinkommen - 25 Mio.
Habe nur grob geschaut, aber ganz richtig sind Deine Angaben wohl nicht.
Mein Post war etwas älter, du hast recht... Sorry
Meinungen zu der Aktie würden mich trotz allem interessieren
Meinungen zu der Aktie würden mich trotz allem interessieren
Antwort auf Beitrag Nr.: 43.012.744 von Freizeitspekulant am 07.04.12 13:29:18Ich will meinen senf zu der hoffnungslos überbewertete Aktie DVAX geben .
DVAX hat mit Heplisav ein vaccine für die behandlung von Hepatitis B entwickelt ,das problem ist das Hepatitis B im gegensatz zu Hepatitis C ein sehr kleiner Markt von nur rund 1.2 Mrd $ ist .
Heplisav mag besser sein als Engerix-B das problem ist das Engerix-B selbst ein rohrkrepierer für Glaxo ist .Der Jahresumsatz war gerade mal 250 Mil$ in 2010 (s.link) solche Zahlen gelten als Flop für Big Pharmas deshalb kann man das mit der Übernahme order Verpartnerung durch/mit GSK getrost vergessen .
http://media.mmm-online.com/documents/26/therapeuticfocus_63…
Die Marktkap von DVAX beträgt aktuell 802 Mil$ was übertrieben teuer ist erst recht wenn man sich die sehr schwache pipeline anschaut .Die restlichen 4 Produkte befinden sich gerade mal in Phase 1 .
Die Aktie wird nur wegen der bevorstehenden Zulassungsanträge hochgepusht und hat rein gar nichts mit der realen bewertung zu tun ein ähnliches beispiel dafür ist KERX das vor den Phase 3 daten genauso in die höhe getrieben wurde nur um danach geschlachtet zu werden .
Das Rückschlagpotential is brutal jede kleine schlechte news würde zum disaster erst recht wenn FDA hepli blocken sollte selbst wenn DVAV die Zulassung erhält ist die Aktie massivst überbewertet das erklärt auch die rekordzahl von über 17 mil aktien short .

Ich würde die Aktie nicht mal der Zange anfassen .
DVAX hat mit Heplisav ein vaccine für die behandlung von Hepatitis B entwickelt ,das problem ist das Hepatitis B im gegensatz zu Hepatitis C ein sehr kleiner Markt von nur rund 1.2 Mrd $ ist .
Heplisav mag besser sein als Engerix-B das problem ist das Engerix-B selbst ein rohrkrepierer für Glaxo ist .Der Jahresumsatz war gerade mal 250 Mil$ in 2010 (s.link) solche Zahlen gelten als Flop für Big Pharmas deshalb kann man das mit der Übernahme order Verpartnerung durch/mit GSK getrost vergessen .
http://media.mmm-online.com/documents/26/therapeuticfocus_63…
Die Marktkap von DVAX beträgt aktuell 802 Mil$ was übertrieben teuer ist erst recht wenn man sich die sehr schwache pipeline anschaut .Die restlichen 4 Produkte befinden sich gerade mal in Phase 1 .
Die Aktie wird nur wegen der bevorstehenden Zulassungsanträge hochgepusht und hat rein gar nichts mit der realen bewertung zu tun ein ähnliches beispiel dafür ist KERX das vor den Phase 3 daten genauso in die höhe getrieben wurde nur um danach geschlachtet zu werden .
Das Rückschlagpotential is brutal jede kleine schlechte news würde zum disaster erst recht wenn FDA hepli blocken sollte selbst wenn DVAV die Zulassung erhält ist die Aktie massivst überbewertet das erklärt auch die rekordzahl von über 17 mil aktien short .

Ich würde die Aktie nicht mal der Zange anfassen .
Antwort auf Beitrag Nr.: 43.014.347 von Kopflaus am 08.04.12 15:14:20@Kopflaus
servus und schöne Ostern
Hab mir deine Zahlen mal angeschaut - in 2011 hatte ASTX laut Jahresbericht vom 15.03.2012 ca. 60 Mio an Revenues - allerdings auch Gesamtausgaben von ca. 64 Mio.
...also mit nix tun wird es wohl nicht reichen in den nächsten fünf Jahren auf 400 Mio Cash zu kommen wie du sagtest...
Von wo ist deine Info daß ASTX aktuell über 125 Mio Cash verfügen soll?
servus und schöne Ostern

Hab mir deine Zahlen mal angeschaut - in 2011 hatte ASTX laut Jahresbericht vom 15.03.2012 ca. 60 Mio an Revenues - allerdings auch Gesamtausgaben von ca. 64 Mio.
...also mit nix tun wird es wohl nicht reichen in den nächsten fünf Jahren auf 400 Mio Cash zu kommen wie du sagtest...
Von wo ist deine Info daß ASTX aktuell über 125 Mio Cash verfügen soll?
Antwort auf Beitrag Nr.: 43.014.383 von Wohnwunsch am 08.04.12 15:51:59@ Wohnwunsch
irgendwie hast du da was versäumt...BDSI steht bei 2,62
trotzdem schöne Ostern...
irgendwie hast du da was versäumt...BDSI steht bei 2,62

trotzdem schöne Ostern...
Antwort auf Beitrag Nr.: 43.014.602 von Biohero am 08.04.12 18:45:47@biohero
..mußt sie ja nicht mit der Zange anfassen..es gibt nicht mal Kaufzwang
..aber vielleicht hast du ja einen Tipp für mich was ich mit meiner Kohle kaufen soll wenn ich DVAX für gut zweistellig verkauft habe
..so nach und nach werden die Shorties der 17 Mio. Shares schon dafür sorgen daß wir hier zweistellig werden. Einer jagt dann den anderen...
..mußt sie ja nicht mit der Zange anfassen..es gibt nicht mal Kaufzwang

..aber vielleicht hast du ja einen Tipp für mich was ich mit meiner Kohle kaufen soll wenn ich DVAX für gut zweistellig verkauft habe

..so nach und nach werden die Shorties der 17 Mio. Shares schon dafür sorgen daß wir hier zweistellig werden. Einer jagt dann den anderen...

Antwort auf Beitrag Nr.: 43.014.602 von Biohero am 08.04.12 18:45:47Der "Markt" für Hep-B-Vaccination ist also deiner Meinung nach nur sehr klein..soso..
Dann sag doch mal konkret was a: sehr klein ist... und b: wie groß der große Markt für Hep-C-Vaccination ist...
Ein "Markt" ist eigentlich überhaupt keine Aussage zum Thema Hep-C, da hier jeglicher Erfahrungsansatz fehlt. Zu sagen es wird eine Menge X mit etwas vacciniert was noch nicht mal fertig in den Regalen von Ärzten und Apothekern liegt - geschweige denn noch niemand konkret sagen kann wie hoch die Kosten der Vaccination for HEP-C sein werden ist nur reine Spekulation - und das weist du genau...
Anders gestaltet es sich bei HEP-A, Hep-B oder die Combi. Hier gibt es klare Zahlen über die Anwendungshäufigkeit sowie die damit verbundenen Kosten - folglich auch für einen Markt..
Das nenne ich einen Markt der nachweisbar vorhanden ist.
Mir sind die Zahlen zur Menge an HEP-B, sowie HEP-C-Häufigkeit/Verbreitung durchaus geläufig - daher frage ich mich wie du die HEP-C-Vaccination im Vergleich zur HEP-B-Vaccination als "sehr großen" Markt bezeichnen kannst ohne Zahlen zu nennen...
Mein Vorschlag dazu: komm doch mal konkret mit den Zahlen hierzu rüber und stell sie uns hier ein...interessiert hier sicher viele...mich besonders..
Freue mich immer über eine angeregte Diskussion
Dann sag doch mal konkret was a: sehr klein ist... und b: wie groß der große Markt für Hep-C-Vaccination ist...
Ein "Markt" ist eigentlich überhaupt keine Aussage zum Thema Hep-C, da hier jeglicher Erfahrungsansatz fehlt. Zu sagen es wird eine Menge X mit etwas vacciniert was noch nicht mal fertig in den Regalen von Ärzten und Apothekern liegt - geschweige denn noch niemand konkret sagen kann wie hoch die Kosten der Vaccination for HEP-C sein werden ist nur reine Spekulation - und das weist du genau...
Anders gestaltet es sich bei HEP-A, Hep-B oder die Combi. Hier gibt es klare Zahlen über die Anwendungshäufigkeit sowie die damit verbundenen Kosten - folglich auch für einen Markt..
Das nenne ich einen Markt der nachweisbar vorhanden ist.
Mir sind die Zahlen zur Menge an HEP-B, sowie HEP-C-Häufigkeit/Verbreitung durchaus geläufig - daher frage ich mich wie du die HEP-C-Vaccination im Vergleich zur HEP-B-Vaccination als "sehr großen" Markt bezeichnen kannst ohne Zahlen zu nennen...
Mein Vorschlag dazu: komm doch mal konkret mit den Zahlen hierzu rüber und stell sie uns hier ein...interessiert hier sicher viele...mich besonders..
Freue mich immer über eine angeregte Diskussion

Antwort auf Beitrag Nr.: 43.014.611 von Freizeitspekulant am 08.04.12 18:53:57Unter anderem von hier
http://seekingalpha.com/article/320652-astex-pharmaceuticals…
Also genau sogar 128,4 Mio. cash,
Lizenzeinnahmen 2011 waren 61,4 Mio.
wobei jährliche Steigerungsraten zu verzeichnen sind.
Die Ausgaben von 64 Mio. waren für Forschung und Entwicklung
um die Pipeline voranzubringen, es wird also kein Geld verbrannt.
Das heist, wenn dieser Bereich eingestellt würde,
hätten Sie jedes Jahr Einnahmen von 61,4 Mio. mit minimalen Ausgaben.
Frage: würdest Du wenn 300 Mio. vorhanden wären eine Firma kaufen die
128 Mio. auf der Bank hat und jedes Jahr 60 Mio. dazukommen kaufen?
Denke das wäre schon nach 5 Jahren ein super Geschäft.
Die Pipeline schreiben wir einfach mal auf 0 ab.
Marktcap der Firma wie gesagt 173 Mio.
Meiner Meinung nach braucht es da nur etwas Geduld.
Schauen wir in einem Jahr nochmal!!
http://seekingalpha.com/article/320652-astex-pharmaceuticals…
Also genau sogar 128,4 Mio. cash,
Lizenzeinnahmen 2011 waren 61,4 Mio.
wobei jährliche Steigerungsraten zu verzeichnen sind.
Die Ausgaben von 64 Mio. waren für Forschung und Entwicklung
um die Pipeline voranzubringen, es wird also kein Geld verbrannt.
Das heist, wenn dieser Bereich eingestellt würde,
hätten Sie jedes Jahr Einnahmen von 61,4 Mio. mit minimalen Ausgaben.
Frage: würdest Du wenn 300 Mio. vorhanden wären eine Firma kaufen die
128 Mio. auf der Bank hat und jedes Jahr 60 Mio. dazukommen kaufen?
Denke das wäre schon nach 5 Jahren ein super Geschäft.
Die Pipeline schreiben wir einfach mal auf 0 ab.
Marktcap der Firma wie gesagt 173 Mio.
Meiner Meinung nach braucht es da nur etwas Geduld.
Schauen wir in einem Jahr nochmal!!
Super Idee - die diskusion!
Vielen Dank für die interessanten Werte und Einblicke.
Investments in Biotech sind ja immer sehr spekulativ. Von daher ist ein Depot mit mehreren Werten m.E. der richtige Weg. Ich maße mir nicht an, den Erfolg oder Misserfolg korrekt einschätzen zu können. Auch Mediziner und Analysten können das ja kaum. Versuche aber das Risiko für mich zu minimieren.
Deshalb achte ich vor allem auf folgende Faktoren
1. Breite Pipeline - ein Flopp ist dann noch kein Vollflop
2. Verpartnerte Programme möglichst an große Player - die werden schon wissen in was sie da investieren (ähm - möchte man zumindest meinen) und können es dann auch verkaufen
3. Attraktive Bewertung/Marktkapitalisierung - es muss halt noch Potenzial da sein
4. Schön ist natürlich immer wenn das Wort blockbuster auftaucht - is klar
Natürlich spielen noch weitere Faktoren wie Cashposition, %-Royalties, Schulden, Kostenkontrolle, newsflow etc. eine Rolle.
Zur Zeit habe ich LGND, ARRY, Astex, Dyax und Paion im Depot:
LGND habe ich schon länger, weil da eigentlich alles zusammenpasst. Dazu hab ich in der entsprechenden Diskussion schon viel geschrieben. Ergänzend vielleicht noch, dass auch LGND ein SARM für Muskelwachstum in der Entwicklung hat. Soll laut LGND natürlich das bessere Profil haben jedoch schaffen die es irgendwie nicht einen Parner zu finden!? Dachte übrigens das von GTX wäre an Merck verpartnert und gefloppt?
ARRY hat alleine 7 verpartnerte Programme in P II darunter Partner wie Amgen, Astra Zeneca, Novartis, Roche, Eli Lilly und das ist längst nicht alles...
Astex wurde hier ja schon vorgestellt. Was mich hier reizt sind die 60 Mio Royalties. Leider haben die ihre Kosten nicht so im Griff wie ich mir das wünschen würde.
Dyax ist vergleichbar mit Morphosys. Hat viele Partnerschaften (17) mit Big Pharma aber auch ein Medikament in eigener Regie am Markt. Und ist dafür einfach viel zu günstig bewertet.
Paion hatte ich mir mal gekauft, weil die nur mit 20 Mio bewertet wurden und ich das bei einer sicher anstehenden verpartnerten P III für Desmopteplase für viel zu billig hielt. Mittlerweile ist da ja einiges passiert. War hier aber Gott sei Dank so schlau durch Gewinnmitnahme aus dem Risiko zu gehen und kann hier also ganz beruhigt mit meiner Restposition abwarten. Empfehlen würde ich Paion aktuell nicht.
Das wäre im Übrigen auch eine Strategie, die ich empfehlen kann. Wenn ein Wert gut gelaufen ist ruhig mal Gewinne mitnehmen und aus dem Risiko gehen.
An europäischen Werten fällt mir noch Morphosys ein, die ich auf der watch habe, da breite Pipeline etc. aber auch Übernahmekandidat.
So einen guten Link für alle biotech interessierten habe ich noch:
http://www.nektar.com/pdf/RD_Directions_MARCH08Edition.pdf
Ist zwar schon ein bischen älter aber doch interessant, wie ich finde.
Vielen Dank für die interessanten Werte und Einblicke.
Investments in Biotech sind ja immer sehr spekulativ. Von daher ist ein Depot mit mehreren Werten m.E. der richtige Weg. Ich maße mir nicht an, den Erfolg oder Misserfolg korrekt einschätzen zu können. Auch Mediziner und Analysten können das ja kaum. Versuche aber das Risiko für mich zu minimieren.
Deshalb achte ich vor allem auf folgende Faktoren
1. Breite Pipeline - ein Flopp ist dann noch kein Vollflop
2. Verpartnerte Programme möglichst an große Player - die werden schon wissen in was sie da investieren (ähm - möchte man zumindest meinen) und können es dann auch verkaufen
3. Attraktive Bewertung/Marktkapitalisierung - es muss halt noch Potenzial da sein
4. Schön ist natürlich immer wenn das Wort blockbuster auftaucht - is klar

Natürlich spielen noch weitere Faktoren wie Cashposition, %-Royalties, Schulden, Kostenkontrolle, newsflow etc. eine Rolle.
Zur Zeit habe ich LGND, ARRY, Astex, Dyax und Paion im Depot:
LGND habe ich schon länger, weil da eigentlich alles zusammenpasst. Dazu hab ich in der entsprechenden Diskussion schon viel geschrieben. Ergänzend vielleicht noch, dass auch LGND ein SARM für Muskelwachstum in der Entwicklung hat. Soll laut LGND natürlich das bessere Profil haben jedoch schaffen die es irgendwie nicht einen Parner zu finden!? Dachte übrigens das von GTX wäre an Merck verpartnert und gefloppt?
ARRY hat alleine 7 verpartnerte Programme in P II darunter Partner wie Amgen, Astra Zeneca, Novartis, Roche, Eli Lilly und das ist längst nicht alles...
Astex wurde hier ja schon vorgestellt. Was mich hier reizt sind die 60 Mio Royalties. Leider haben die ihre Kosten nicht so im Griff wie ich mir das wünschen würde.
Dyax ist vergleichbar mit Morphosys. Hat viele Partnerschaften (17) mit Big Pharma aber auch ein Medikament in eigener Regie am Markt. Und ist dafür einfach viel zu günstig bewertet.
Paion hatte ich mir mal gekauft, weil die nur mit 20 Mio bewertet wurden und ich das bei einer sicher anstehenden verpartnerten P III für Desmopteplase für viel zu billig hielt. Mittlerweile ist da ja einiges passiert. War hier aber Gott sei Dank so schlau durch Gewinnmitnahme aus dem Risiko zu gehen und kann hier also ganz beruhigt mit meiner Restposition abwarten. Empfehlen würde ich Paion aktuell nicht.
Das wäre im Übrigen auch eine Strategie, die ich empfehlen kann. Wenn ein Wert gut gelaufen ist ruhig mal Gewinne mitnehmen und aus dem Risiko gehen.
An europäischen Werten fällt mir noch Morphosys ein, die ich auf der watch habe, da breite Pipeline etc. aber auch Übernahmekandidat.
So einen guten Link für alle biotech interessierten habe ich noch:
http://www.nektar.com/pdf/RD_Directions_MARCH08Edition.pdf
Ist zwar schon ein bischen älter aber doch interessant, wie ich finde.
@kmastra
Moin - mit LGND und ARRY hast zwei gut aufgestellte Firmen im Depot, die ich immer wieder mal kurz betrachte...mir dann auch schon mal vorgenommen hab ein paar erste Stücke zu sichern (vor allem von ARRY). Dann hab ich sie aber doch wieder auf meine Watchlist verschoben...irgendwann kralle ich mir doch noch welche...
Mit DYAX hab ich mich eigentlich noch nicht weiter befaßt - daher kann ich dazu nichts sagen..für Paion konnte ich mich noch nie begeistern.
Bei GTXI hat - wie ja schon in einem Beitrag geschrieben - CAPESARIS (PII) den "Stopp" auferlegt bekommen - Von seitens der FDA erfolgt in den kommenden 30 Tagen ab Antragstellung auf "Wiederaufnahme" ein Bescheid.
Das dürfte nach der massiven Kurskorrektur als erstes "Zugpferd" für die "Kursgenesung" sorgen - dabei aber nicht vergessen daß das eigentliche Ass im Ärmel von GTXI OSTARINE in PIII ist
Zu meine Horizon Pharma-Anteilen (HZNP) stell ich heute noch ein paar Eckdaten rein - soviel schon mal jetzt - Zugpferd hier LODOTRA in PIII
mit PDUFA-Termin am 26.07.2012
Moin - mit LGND und ARRY hast zwei gut aufgestellte Firmen im Depot, die ich immer wieder mal kurz betrachte...mir dann auch schon mal vorgenommen hab ein paar erste Stücke zu sichern (vor allem von ARRY). Dann hab ich sie aber doch wieder auf meine Watchlist verschoben...irgendwann kralle ich mir doch noch welche...

Mit DYAX hab ich mich eigentlich noch nicht weiter befaßt - daher kann ich dazu nichts sagen..für Paion konnte ich mich noch nie begeistern.
Bei GTXI hat - wie ja schon in einem Beitrag geschrieben - CAPESARIS (PII) den "Stopp" auferlegt bekommen - Von seitens der FDA erfolgt in den kommenden 30 Tagen ab Antragstellung auf "Wiederaufnahme" ein Bescheid.
Das dürfte nach der massiven Kurskorrektur als erstes "Zugpferd" für die "Kursgenesung" sorgen - dabei aber nicht vergessen daß das eigentliche Ass im Ärmel von GTXI OSTARINE in PIII ist

Zu meine Horizon Pharma-Anteilen (HZNP) stell ich heute noch ein paar Eckdaten rein - soviel schon mal jetzt - Zugpferd hier LODOTRA in PIII
mit PDUFA-Termin am 26.07.2012
Antwort auf Beitrag Nr.: 43.015.085 von Freizeitspekulant am 09.04.12 09:35:20…wie also schon angedroht mal noch ein paar Eckdaten zu Horizon Pharma ( HZNP)
Das Unternehmen hatte im August letzten Jahres sein IPO, danach wurde der Wert deftig nach unten geprügelt . Eine Bodenbildung, sowie erste Anzeichen dafür daß der Kurs nun wieder gen Norden laufen dürfte ist im angehängten Chart erkennbar.
Nachdem man mit DUEXIS seine erste Product-Launch erreichen konnte steht nun der nächste große Termin am 26.07.2012 bevor – PDUFA von LODOTRA. Die Gesamtpipeline hab ich auch mal mit drangehängt – zur besseren Veranschaulichung.
Ende Februar hat man eine Kapitalerhöhung durchgeführt – 14 Mio. zusätzliche Shares zu 3,62 $ ausgegeben – so round about 50 Mio. US-$ eingesammelt. HZNP hat also Kapitalreserven um seine Programme durchzuziehen.
Insider und Institutionelle haben hier immer wieder mal heftig zugeschlagen und beachtliche Mengen an Anteilen gekauft . Gemäß dem Motto daß es zwar viele Gründe geben mag eigene Aktien zu verkaufen – wohl aber nur einen wenn in diesem Ausmaß eingekauft wird.
Zu beachten ist, daß die Aktie nur über einen geringen Float verfügt – daher können Preisschwankungen hier schon mitunter etwas intensiver ausfallen…natürlich in beide Richtungen!!
HZNP ist an deutschen Börsen nicht handelbar !!!
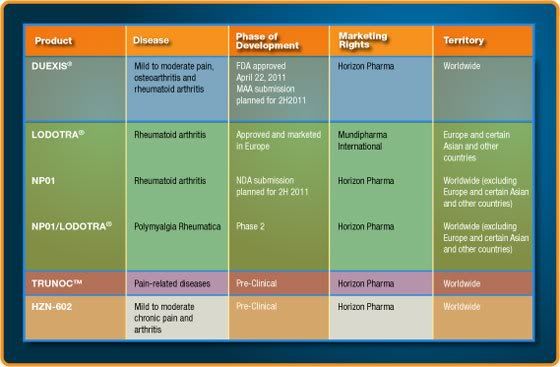
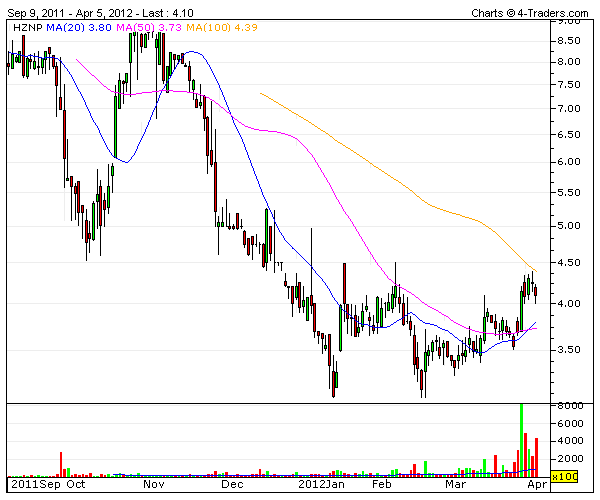
Das Unternehmen hatte im August letzten Jahres sein IPO, danach wurde der Wert deftig nach unten geprügelt . Eine Bodenbildung, sowie erste Anzeichen dafür daß der Kurs nun wieder gen Norden laufen dürfte ist im angehängten Chart erkennbar.
Nachdem man mit DUEXIS seine erste Product-Launch erreichen konnte steht nun der nächste große Termin am 26.07.2012 bevor – PDUFA von LODOTRA. Die Gesamtpipeline hab ich auch mal mit drangehängt – zur besseren Veranschaulichung.
Ende Februar hat man eine Kapitalerhöhung durchgeführt – 14 Mio. zusätzliche Shares zu 3,62 $ ausgegeben – so round about 50 Mio. US-$ eingesammelt. HZNP hat also Kapitalreserven um seine Programme durchzuziehen.
Insider und Institutionelle haben hier immer wieder mal heftig zugeschlagen und beachtliche Mengen an Anteilen gekauft . Gemäß dem Motto daß es zwar viele Gründe geben mag eigene Aktien zu verkaufen – wohl aber nur einen wenn in diesem Ausmaß eingekauft wird.

Zu beachten ist, daß die Aktie nur über einen geringen Float verfügt – daher können Preisschwankungen hier schon mitunter etwas intensiver ausfallen…natürlich in beide Richtungen!!
HZNP ist an deutschen Börsen nicht handelbar !!!


Antwort auf Beitrag Nr.: 43.015.302 von Freizeitspekulant am 09.04.12 12:08:36Die aller wichtigsten Eckdaten zu HZNP wurden gar nicht erwähnt wie z.b. das HZNP geld verbrennt wie ein schwarzes loch (Net loss for the year ended December 31, 2011, was $113.3 million,) aber schlimmer noch ist das die beiden produkte Duexis und Lodotra keine chance auf dem Markt haben da sie mit billige Generika konkurrieren müssen .
Der einzige grund um HZNP zu kaufen wäre die kommende FDA-Entscheidung in Juli aber ich würde nicht mehr als $3 bezahlen .
Der einzige grund um HZNP zu kaufen wäre die kommende FDA-Entscheidung in Juli aber ich würde nicht mehr als $3 bezahlen .
Antwort auf Beitrag Nr.: 43.015.473 von Biohero am 09.04.12 13:17:47...paßt zwar jetzt nicht zu HZNP - aber immer der Reihe nach...
Wie sieht es denn jetzt mit deinen genaueren Quantifizierungen zum HEP-B und HEP-C-Markt aus?
Stell doch mal echte Zahlen rein was denn nun klein und groß ist - wie du deinen Hep-C-Markt berechnet hast - auf welche Infos du dich da beziehst - und vor allem wie die genau aussehen...
Auch z.B. was die Hep-C-Vaccination dann kostet und was besonders interessant ist wie du dir erklärst, daß INHX für weit mehr als 2 Milliarden US-$ wegen seine Trumpfkarte übernommen wurde...
Gehen wir erst das mal an zu klären - HZNP dann als nächsten Schritt...
Wie sieht es denn jetzt mit deinen genaueren Quantifizierungen zum HEP-B und HEP-C-Markt aus?
Stell doch mal echte Zahlen rein was denn nun klein und groß ist - wie du deinen Hep-C-Markt berechnet hast - auf welche Infos du dich da beziehst - und vor allem wie die genau aussehen...
Auch z.B. was die Hep-C-Vaccination dann kostet und was besonders interessant ist wie du dir erklärst, daß INHX für weit mehr als 2 Milliarden US-$ wegen seine Trumpfkarte übernommen wurde...
Gehen wir erst das mal an zu klären - HZNP dann als nächsten Schritt...

Antwort auf Beitrag Nr.: 43.015.497 von Freizeitspekulant am 09.04.12 13:31:35Du fragst warum der Hep C ein attraktiverer Markt ist als der von Hep B ??
Ganz einfach es gibt ein überangebot an Impfstoffe für Hep B aber noch gar keins für Hep C deshalb werden die unternehmen wie INHX VRUS übernommen in der hoffnung der erste mit einem Impfstoff auf dem Markt zu sein .
http://www.businessweek.com/news/2012-03-14/former-merck-uni…
Ganz einfach es gibt ein überangebot an Impfstoffe für Hep B aber noch gar keins für Hep C deshalb werden die unternehmen wie INHX VRUS übernommen in der hoffnung der erste mit einem Impfstoff auf dem Markt zu sein .
http://www.businessweek.com/news/2012-03-14/former-merck-uni…
Antwort auf Beitrag Nr.: 43.015.568 von Biohero am 09.04.12 14:14:08...das könnte u.U. ein folgenschwerer Irrtum sein so zu denken weil:
Hep-B Vaccinatin gibt es nun genau 30 Jahre. 1982 war es soweit zu starten..Hep-C Vaccination gibt es noch nicht..und es wird noch manches mal Weihnachten werden bis das auf dem Markt ist.. Was mit INHX gekauft wurde ist ein vielversprechender Lösungsansatz - laß hier auf dem Weg bis zu einer Zulassung nur eine Kleinigkeit schiefgehen verzögert sich das um Jahre. Die FDA ist sehr genau - bei so einem weitreichenden Thema kannst du davon ausgehen daß alles 130%ig passen muß...
..aber unterstellen wir mal daß die Zulassung tatsächlich in der Tasche ist - wie geht´s dann weiter?
HEP-C ist weltweit nur halbsoweit verbreitet wie HEP-C. Somit müßte die Hep-C-Vaccination schon mal das doppelte kosten um rein rechnerisch überhaupt den gleichen Umsatz erzielen zu können wie die Hep-B-Vaccination.
Damit hätten man aber erst mal den "kleinen" Markt - den du ja für die Hep-B-Vacc. unterstellt hast. Jetzt war deine Aussage aber die Hep-C-Vacc. ist der Riesenmarkt... Schon allein wenn du nur von doppelter Größe ausgehst bist du völlig auf dem Holzweg.
Hep-B-Vacc. haben auch mit weit kleineren Umsätzen begonnen als sie heute bringen. Das liegt noch nicht mal am Preis - sondern einfach nur daran daß sich in der Anfangsphase weit weniger Menschen impfen lassen werden als man unterstellt. Beispiel Schweinegrippe - hast du Ahnung wie viel Impfstoff da in die Müllkippe gewandert ist? Ich denke nicht..und das obwohl man diese Schweinegrippe als hochgradig gefährlich dargestellt hat.
So ist es hier nicht anders - natürlich werden Impfungen stattfinden - auch Umsätze erzielt werden, aber weit geringer als erwartet. Bedenke daß nur ca. 10% der weltweit geschätzen Betroffenengruppe jährlich vacciniert werden - und das trotz 30ig-jähriger Gewohnheitsphase. Unterstellen wir weiter die gleiche 10%ige Impfquote bei Hep-C macht das rechnerisch gerademal 17 Mio. Vaccinationen aus. Das mit dem oben genannten doppelten Preis einer Hep-B Vaccination - dann hast du eine Milliarde Umsatz erzielt - mehr aber nicht.
Ist das der Riesenmarkt von dem du geschrieben hast?
Bedenke daß du bei einem angenommenen Prreis Hep-B-Vaccination x 3 auch erst bei 1,5 Milliarden wärst und bei dem Gedanken daran daß der Preis viermal so hoch läge bist du im Traumland weil du diese Vaccination nicht mehr zu diesem Preis verkaufen kannst.
Hep-B Vaccinatin gibt es nun genau 30 Jahre. 1982 war es soweit zu starten..Hep-C Vaccination gibt es noch nicht..und es wird noch manches mal Weihnachten werden bis das auf dem Markt ist.. Was mit INHX gekauft wurde ist ein vielversprechender Lösungsansatz - laß hier auf dem Weg bis zu einer Zulassung nur eine Kleinigkeit schiefgehen verzögert sich das um Jahre. Die FDA ist sehr genau - bei so einem weitreichenden Thema kannst du davon ausgehen daß alles 130%ig passen muß...
..aber unterstellen wir mal daß die Zulassung tatsächlich in der Tasche ist - wie geht´s dann weiter?
HEP-C ist weltweit nur halbsoweit verbreitet wie HEP-C. Somit müßte die Hep-C-Vaccination schon mal das doppelte kosten um rein rechnerisch überhaupt den gleichen Umsatz erzielen zu können wie die Hep-B-Vaccination.
Damit hätten man aber erst mal den "kleinen" Markt - den du ja für die Hep-B-Vacc. unterstellt hast. Jetzt war deine Aussage aber die Hep-C-Vacc. ist der Riesenmarkt... Schon allein wenn du nur von doppelter Größe ausgehst bist du völlig auf dem Holzweg.
Hep-B-Vacc. haben auch mit weit kleineren Umsätzen begonnen als sie heute bringen. Das liegt noch nicht mal am Preis - sondern einfach nur daran daß sich in der Anfangsphase weit weniger Menschen impfen lassen werden als man unterstellt. Beispiel Schweinegrippe - hast du Ahnung wie viel Impfstoff da in die Müllkippe gewandert ist? Ich denke nicht..und das obwohl man diese Schweinegrippe als hochgradig gefährlich dargestellt hat.
So ist es hier nicht anders - natürlich werden Impfungen stattfinden - auch Umsätze erzielt werden, aber weit geringer als erwartet. Bedenke daß nur ca. 10% der weltweit geschätzen Betroffenengruppe jährlich vacciniert werden - und das trotz 30ig-jähriger Gewohnheitsphase. Unterstellen wir weiter die gleiche 10%ige Impfquote bei Hep-C macht das rechnerisch gerademal 17 Mio. Vaccinationen aus. Das mit dem oben genannten doppelten Preis einer Hep-B Vaccination - dann hast du eine Milliarde Umsatz erzielt - mehr aber nicht.
Ist das der Riesenmarkt von dem du geschrieben hast?
Bedenke daß du bei einem angenommenen Prreis Hep-B-Vaccination x 3 auch erst bei 1,5 Milliarden wärst und bei dem Gedanken daran daß der Preis viermal so hoch läge bist du im Traumland weil du diese Vaccination nicht mehr zu diesem Preis verkaufen kannst.
interessante diskussion. es scheint, dass sich hier einige in die materie eingelesen haben.
der biotech-index zeigt seit geraumer zeit relative stärke zum gesamtmarkt. biotech ist zusammen mit e-bikes, smartphones und mobile payment auch der größte trend momentan an der börse. ich könnte mir gut vorstellen, dass sich hier ähnliches entwickelt, wie ende der neunziger jahre mit den internetaktien oder vor zehn jahren mit rohstoffaktien.
das große problem an der sache ist aber, dass die firmen so gut wie nie gewinne erziehlen. es sind alles hoffnungsaktien, also firmen, bei denen auf einen postiven ausgang bei einer fda entscheidung gewettet wird.
biotechaktien zeichnen sich durch permanente gap´s in den charts aus. das bringt probleme für das moneymanagement mit sich. ich bin mir noch unschlüssig, ob ich das trading im bereich biotech auch auf aktien ausbauen soll, die noch verluste generieren.
momentan stehen folgende aktien auf meinem screen:
pcyc, mdvn, vvus, thld, regn.




hat zu diesen aktien jemand eine meinung?

der biotech-index zeigt seit geraumer zeit relative stärke zum gesamtmarkt. biotech ist zusammen mit e-bikes, smartphones und mobile payment auch der größte trend momentan an der börse. ich könnte mir gut vorstellen, dass sich hier ähnliches entwickelt, wie ende der neunziger jahre mit den internetaktien oder vor zehn jahren mit rohstoffaktien.
das große problem an der sache ist aber, dass die firmen so gut wie nie gewinne erziehlen. es sind alles hoffnungsaktien, also firmen, bei denen auf einen postiven ausgang bei einer fda entscheidung gewettet wird.
biotechaktien zeichnen sich durch permanente gap´s in den charts aus. das bringt probleme für das moneymanagement mit sich. ich bin mir noch unschlüssig, ob ich das trading im bereich biotech auch auf aktien ausbauen soll, die noch verluste generieren.
momentan stehen folgende aktien auf meinem screen:
pcyc, mdvn, vvus, thld, regn.
hat zu diesen aktien jemand eine meinung?
...klar hab ich dazu eine Meinung - zu einer hab ich aber hier schon mal ganz kurz geschrieben...THLD daß ich sie mir ins Depot legen wollte - weil ich aber besonders sparsem sein wollte ist meine Kauforder zweimal nicht ausgeführt worden...
Zum Kaufen würde ich momentan abraten - da sind mehrere hundert Prozent Gewinn in extrem kurzer Zeit draufgekommen - und bei dem was der Markt grade treibt nehmen da einige ihre Gewinne mit...
Zu den anderen melde ich mich morgen - hab heute grad wenig Zeit...

Zum Kaufen würde ich momentan abraten - da sind mehrere hundert Prozent Gewinn in extrem kurzer Zeit draufgekommen - und bei dem was der Markt grade treibt nehmen da einige ihre Gewinne mit...
Zu den anderen melde ich mich morgen - hab heute grad wenig Zeit...

PCYC und REGN sind auch meine größten Positionen. Sicher bin ich mir nicht, wieviel Potential diese Aktien noch besitzen und was sie bereits ausgeschöpft haben. PCYC, REGN und MDVN halte ich für relativ solide... allerdings ist die Bewertung dadurch auch entsprechend hoch.
z.B. hat Ohad Hammer, von dem eigentlich immer sehr gute Analysen kommen, PCYC aufgrund der Bewertung komplett aus dem Depot genommen. Ich denke schon, dass PCYC noch weiteres Kurspotential hat, auch wenn der Kurs sich dabei etwas von der Realität entfernt. Deren BTK-Hemmer soll gegen alle möglichen Formen von Blutkrebs sehr aussichtsreich sein, auch wenn er noch nicht in PIII ist. Als Einprodukt-Unternehmen wird von PCYC nichts mehr übrig bleiben, wenn in den ausstehenden Studien noch etwas unerwartetes passiert. Allerdings wird das Risiko, dass etwas negatives auftritt als sehr gering eingeschätzt. Die Chance ist, dass sich PCI-32765 ähnlich etabliert wie z.B. Rituxan... d.h. Umsätze von mehreren Mrd. und PCYC wegen der Patente keine Sorge vor anderen BTK-Hemmern haben braucht. Ein Risiko/Chance besteht momentan vielleicht darin, dass hier auf eine vorzeitige Zulassung ohne PIII gesetzt wird. Vor kurzem ist der Kurs plötzlich deutlich gestiegen, als in den USA darüber diskutiert wurde, ob sehr aussichtsreiche Medikamente schneller zugelassen werden sollten. D.h. aber auch, dass wenn (positive) PII-Ergebnisse unterhalb der sehr hohen Erwartungen liegen sollten, es zu einem deutlichen Einbruch kommen kann. Andersherum besteht wohl Potential, wenn sich eine mögliche Zulassung konkret andeutet.
We are focused on upcoming PCI-32765 data in the DLBCL ABC subtype, an aggressive form of lymphoma with poor
response to frontline therapy and few if any safe and effective second line options. Although our base case assumes Phase
III trials will be necessary for approvals in the EU and U.S., highly compelling response rate and durability of response
data in the ABC DLBCL subtype, which we expect to be mature by mid-2012, could lead to accelerated filling(s) in this
setting.
PCI-32765 continues to put up strong clinical results in response rate and the apparent durability of these
responses. The drug, in our opinion, is emerging as a potential grand slam, and we expect that it is a “when not if”
situation for approvals in the CLL/SLL, DLBCL, FL and MCL settings where our revised projections yield just over $2.3
billion global peak sales in 2020.
We believe that even in a marketplace where all of GD-101, CAL-101, and a biosimilar rituximab are available, we
believe PCI-32765’s ease of use (oral, once daily) and tolerability will see the drug broadly adopted into the first
line and relapsed/refractory settings, likely in regimens including a chemotherapy component. With composition of
matter patents providing potential commercial exclusivity until 2026 and possibly 2029-2031 with a three- to five-year
extension on approval, investors and potential acquirers NPV calculations are going to generate large numbers.
***
We believe five attributes may potentially make PCI-32765 a highly successful drug:
1) High single agent activity - PCI- 32765 showed an ORR of 62% in r/r B-cell NHL, with ORR of 79% in
CLL/SLL and 78% in MCL;
2) Combinability with SOC chemotherapy - The company is running multiple combination trials with data
expected in 2H11. Initial signals look very promising;
3) Low toxicity - >220 patients have been treated with PCI-32765 to date, and no significant adverse events have
been observed;
4) Potential for prolonged treatment - While the data are still maturing, treatment duration over 9 months have
been seen;
****
BTK Inhibitors Viewed as Likely Friend, Not Foe, to Anti-CD20 Class: The specialist commented that the initial
clinical data emerging from current Burton's tyrosine kinase (BTK) agents appear very encouraging in regard to both
safety and efficacy. These agents are foreseen by the physician to have potential utility in earlier lines of lymphoma
therapy, provided supportive data are produced. The physician would not anticipate single agent BTK inhibitor use
displacing anti-CD20 agents, but rather combination use would be more likely. We await findings of the ongoing
combination trial of PCI-32765 and ofatumumab to provide initial signals of the utility of this approach.
****
• First-in-class. PCI-32765 is a Btk inhibitor. It is the first and most advanced drug in its class. There is one other
Btk inhibitor in development (Avila’s AVL-292), but it is in Phase I and likely two years behind PCYC.
Furthermore, there is no obvious advantage of AVL-292 over PCI-32765, which would imply a short-lived lead
position for PCI-32765 (Avila believes AVL0292 is more specific for Btk).
• Broad activity. PCI-32765 has demonstrated robust activity in mantle cell lymphoma (MCL), chronic
lymphocytic leukemia (CLL), and preliminary efficacy in follicular non-Hodgkin lymphoma (fNHL) and diffuse
large B-cell lymphoma (DLBCL). Essentially, PCI-32765 works in nearly all B-cell malignancies. Analysts are
likely focused on the initial MCL indication and see CLL as a long development path. For an acquirer, the large
open-ended opportunity for PCI-32765 is highly desirable.
• Substantially derisked. Despite not having Phase III data, the results in Phase II are very robust and demonstrate
a very high single agent activity in relapsed patients and a long durability of response. In our view, the high
response rate and durability leave little doubt that PCI-32765 will be positive in planned Phase III trials.
5) High unmet need - There are >200,000 new cases of NHL in the G7 countries. Most patients will relapse or
become refractory to front line therapy. PCI-32765 may have broad applications in the frontline, maintenance, and
potentially the retreatment setting.
*****
PCYC gets $150M upfront, up to $825M in milestones, and 50% of global profits and is responsible for only 40% of the
development costs. PCYC will book U.S. sales and take the lead role in the U.S. commercialization with substantial help
from Janssen. Janssen books ex-U.S. sales, and all profits are split 50/50.
*****
Pharmacyclics (PCYC) was issued a new patent covering the specific molecular mechanism of its lead BTK inhibitor. The
patent covers drugs that inhibit BTK through covalent binding to cysteine. This appears to cover the mechanism of action
the competitive drug AVL-292 from privately-held Avila.
Stronger competitive position. On the surface, it would appear that this patent could be a major impediment for Avila,
and we expect PCYC (and now Janssen) to aggressively defend its intellectual property. The strong patent estate around
BTK is an important competitive advantage for PCYC, and may impede any fast followers or deter later entrants.
z.B. hat Ohad Hammer, von dem eigentlich immer sehr gute Analysen kommen, PCYC aufgrund der Bewertung komplett aus dem Depot genommen. Ich denke schon, dass PCYC noch weiteres Kurspotential hat, auch wenn der Kurs sich dabei etwas von der Realität entfernt. Deren BTK-Hemmer soll gegen alle möglichen Formen von Blutkrebs sehr aussichtsreich sein, auch wenn er noch nicht in PIII ist. Als Einprodukt-Unternehmen wird von PCYC nichts mehr übrig bleiben, wenn in den ausstehenden Studien noch etwas unerwartetes passiert. Allerdings wird das Risiko, dass etwas negatives auftritt als sehr gering eingeschätzt. Die Chance ist, dass sich PCI-32765 ähnlich etabliert wie z.B. Rituxan... d.h. Umsätze von mehreren Mrd. und PCYC wegen der Patente keine Sorge vor anderen BTK-Hemmern haben braucht. Ein Risiko/Chance besteht momentan vielleicht darin, dass hier auf eine vorzeitige Zulassung ohne PIII gesetzt wird. Vor kurzem ist der Kurs plötzlich deutlich gestiegen, als in den USA darüber diskutiert wurde, ob sehr aussichtsreiche Medikamente schneller zugelassen werden sollten. D.h. aber auch, dass wenn (positive) PII-Ergebnisse unterhalb der sehr hohen Erwartungen liegen sollten, es zu einem deutlichen Einbruch kommen kann. Andersherum besteht wohl Potential, wenn sich eine mögliche Zulassung konkret andeutet.
We are focused on upcoming PCI-32765 data in the DLBCL ABC subtype, an aggressive form of lymphoma with poor
response to frontline therapy and few if any safe and effective second line options. Although our base case assumes Phase
III trials will be necessary for approvals in the EU and U.S., highly compelling response rate and durability of response
data in the ABC DLBCL subtype, which we expect to be mature by mid-2012, could lead to accelerated filling(s) in this
setting.
PCI-32765 continues to put up strong clinical results in response rate and the apparent durability of these
responses. The drug, in our opinion, is emerging as a potential grand slam, and we expect that it is a “when not if”
situation for approvals in the CLL/SLL, DLBCL, FL and MCL settings where our revised projections yield just over $2.3
billion global peak sales in 2020.
We believe that even in a marketplace where all of GD-101, CAL-101, and a biosimilar rituximab are available, we
believe PCI-32765’s ease of use (oral, once daily) and tolerability will see the drug broadly adopted into the first
line and relapsed/refractory settings, likely in regimens including a chemotherapy component. With composition of
matter patents providing potential commercial exclusivity until 2026 and possibly 2029-2031 with a three- to five-year
extension on approval, investors and potential acquirers NPV calculations are going to generate large numbers.
***
We believe five attributes may potentially make PCI-32765 a highly successful drug:
1) High single agent activity - PCI- 32765 showed an ORR of 62% in r/r B-cell NHL, with ORR of 79% in
CLL/SLL and 78% in MCL;
2) Combinability with SOC chemotherapy - The company is running multiple combination trials with data
expected in 2H11. Initial signals look very promising;
3) Low toxicity - >220 patients have been treated with PCI-32765 to date, and no significant adverse events have
been observed;
4) Potential for prolonged treatment - While the data are still maturing, treatment duration over 9 months have
been seen;
****
BTK Inhibitors Viewed as Likely Friend, Not Foe, to Anti-CD20 Class: The specialist commented that the initial
clinical data emerging from current Burton's tyrosine kinase (BTK) agents appear very encouraging in regard to both
safety and efficacy. These agents are foreseen by the physician to have potential utility in earlier lines of lymphoma
therapy, provided supportive data are produced. The physician would not anticipate single agent BTK inhibitor use
displacing anti-CD20 agents, but rather combination use would be more likely. We await findings of the ongoing
combination trial of PCI-32765 and ofatumumab to provide initial signals of the utility of this approach.
****
• First-in-class. PCI-32765 is a Btk inhibitor. It is the first and most advanced drug in its class. There is one other
Btk inhibitor in development (Avila’s AVL-292), but it is in Phase I and likely two years behind PCYC.
Furthermore, there is no obvious advantage of AVL-292 over PCI-32765, which would imply a short-lived lead
position for PCI-32765 (Avila believes AVL0292 is more specific for Btk).
• Broad activity. PCI-32765 has demonstrated robust activity in mantle cell lymphoma (MCL), chronic
lymphocytic leukemia (CLL), and preliminary efficacy in follicular non-Hodgkin lymphoma (fNHL) and diffuse
large B-cell lymphoma (DLBCL). Essentially, PCI-32765 works in nearly all B-cell malignancies. Analysts are
likely focused on the initial MCL indication and see CLL as a long development path. For an acquirer, the large
open-ended opportunity for PCI-32765 is highly desirable.
• Substantially derisked. Despite not having Phase III data, the results in Phase II are very robust and demonstrate
a very high single agent activity in relapsed patients and a long durability of response. In our view, the high
response rate and durability leave little doubt that PCI-32765 will be positive in planned Phase III trials.
5) High unmet need - There are >200,000 new cases of NHL in the G7 countries. Most patients will relapse or
become refractory to front line therapy. PCI-32765 may have broad applications in the frontline, maintenance, and
potentially the retreatment setting.
*****
PCYC gets $150M upfront, up to $825M in milestones, and 50% of global profits and is responsible for only 40% of the
development costs. PCYC will book U.S. sales and take the lead role in the U.S. commercialization with substantial help
from Janssen. Janssen books ex-U.S. sales, and all profits are split 50/50.
*****
Pharmacyclics (PCYC) was issued a new patent covering the specific molecular mechanism of its lead BTK inhibitor. The
patent covers drugs that inhibit BTK through covalent binding to cysteine. This appears to cover the mechanism of action
the competitive drug AVL-292 from privately-held Avila.
Stronger competitive position. On the surface, it would appear that this patent could be a major impediment for Avila,
and we expect PCYC (and now Janssen) to aggressively defend its intellectual property. The strong patent estate around
BTK is an important competitive advantage for PCYC, and may impede any fast followers or deter later entrants.
Antwort auf Beitrag Nr.: 43.011.834 von Freizeitspekulant am 06.04.12 20:55:15Eine nicht gerade lustige Woche für alle die Biotech-Aktien im Depot haben liegt hinter uns - viele Biotechs und Pharmas haben ganz schön eine auf den Deckel bekommen....da haben einige Depots Federn lassen müssen - darunter auch meines.
ACAD - da hat wohl neben den Kollektivdresche noch eine angekündigte KE die Gewinne der letzten Zeit etwas abschmelzen lassen. Die 20- und 50 Tage-Linie wurde zudem durchbrochen. Momentan scheint die 100-Tage Linie aber als Auffanghilfe zu fungieren.
DVAX - die haben sich soweit recht gut gehalten - sicher nicht ganz grundlos... hier hat sich der Kurs überhalb allen drei Durchnittslinien gehalten. Ist wie gesagt fast schon der Blue-Chip unter meinen Depotkandidaten.
GTXI - hier sind alle drei Linien (20,50,100-Tage) nach unten durchbrochen worden - nächste Ünterstützung liegt bei ca. 3,10 - könnte also durchaus möglich sein daß wir die auch noch testen...
HZNP - der Wert hat wie gesagt teilweise ziemlich große Schwankungen auf Tagesbasis. Nachdem die 100-Tage Linie nicht nach oben durchbrochen werden konnte ist er gleich mal bis unter die 20-Tagelininie durchgereicht worden. Der Float hier ist wie ebenfalls schon gesagt recht dünn - also ist der Kurs auch leicht in jede Richtung beeinflussbar. Mit der bald anstehenden PDUFA für LODOTRA rechne ich jedoch schon mit schnell wieder anziehenden Kursen.
Obwohl die Woche schon einige Werte preislich reduziert hat habe ich mich noch nicht dazu durchgerungen weiteres dazuzukaufen. Mal sehen wie die Woche so startet...
zu DVAX: ich warte immer noch auf die Nachlieferung von Zahlenmaterial zum angeblichen Megamarkt der Hep-C-Vaccinationen. Zur Erinnerung: Unser Boardkollege behauptete ja daß der Markt für Hep-C (HCV) wesentlich größer wäre als der für Hep-B (HBV. Vielleicht fällt es ihm ja beim Mitlesen nochmal ein uns eine plausible "Riesenmarktberechnung" reinzustellen.
Erfolgreiche Woche
ACAD - da hat wohl neben den Kollektivdresche noch eine angekündigte KE die Gewinne der letzten Zeit etwas abschmelzen lassen. Die 20- und 50 Tage-Linie wurde zudem durchbrochen. Momentan scheint die 100-Tage Linie aber als Auffanghilfe zu fungieren.
DVAX - die haben sich soweit recht gut gehalten - sicher nicht ganz grundlos... hier hat sich der Kurs überhalb allen drei Durchnittslinien gehalten. Ist wie gesagt fast schon der Blue-Chip unter meinen Depotkandidaten.
GTXI - hier sind alle drei Linien (20,50,100-Tage) nach unten durchbrochen worden - nächste Ünterstützung liegt bei ca. 3,10 - könnte also durchaus möglich sein daß wir die auch noch testen...
HZNP - der Wert hat wie gesagt teilweise ziemlich große Schwankungen auf Tagesbasis. Nachdem die 100-Tage Linie nicht nach oben durchbrochen werden konnte ist er gleich mal bis unter die 20-Tagelininie durchgereicht worden. Der Float hier ist wie ebenfalls schon gesagt recht dünn - also ist der Kurs auch leicht in jede Richtung beeinflussbar. Mit der bald anstehenden PDUFA für LODOTRA rechne ich jedoch schon mit schnell wieder anziehenden Kursen.
Obwohl die Woche schon einige Werte preislich reduziert hat habe ich mich noch nicht dazu durchgerungen weiteres dazuzukaufen. Mal sehen wie die Woche so startet...
zu DVAX: ich warte immer noch auf die Nachlieferung von Zahlenmaterial zum angeblichen Megamarkt der Hep-C-Vaccinationen. Zur Erinnerung: Unser Boardkollege behauptete ja daß der Markt für Hep-C (HCV) wesentlich größer wäre als der für Hep-B (HBV. Vielleicht fällt es ihm ja beim Mitlesen nochmal ein uns eine plausible "Riesenmarktberechnung" reinzustellen.
Erfolgreiche Woche

Mein absoluter TOP TIPP ist und bleibt Biodelivery, läuft sehr sehr ruhig und stetig noch Norden.
Mein persönliches Ziel bis Ende 2012 sind 10$
BioDelivery Sciences to Host Opioid Dependence Investor Event and Webcast on April 11, 2012
Event will focus on the treatment of Opioid Dependence and the BNX development program
Apr 5, 2012
RALEIGH, N.C., April 5, 2012 /PRNewswire/ -- BioDelivery Sciences International, Inc. (NASDAQ: BDSI) today announced that the Company will host a special event entitled "Treatment of Opioid Dependence: The Future Role of BEMA Buprenorphine/Naloxone" for investors and analysts on Wednesday, April 11, 2012 at 12:30 p.m. in New York City. This event will include insightful discussion from medical experts with extensive experience in the management of opioid dependence and treatment with buprenorphine.
(Logo: http://photos.prnewswire.com/prnh/20110217/CL49801LOGO )
In addition to presentations by independent experts in the management of opioid dependence, BDSI's management will speak about the clinical progress of BEMA Buprenorphine/Naloxone (BNX) for the potential treatment of opioid dependence.
The expert presentations at this event will include:
"Understanding Opioid Dependence" by Gregory Sullivan, M.D. – Board certified in Addiction Medicine and Medical Director of Parkway Medical Center in Birmingham, Alabama. For twenty years, Dr. Sullivan has been actively involved in government and pharmaceutical research on the mechanism, biology and treatment of addiction and pain.
"Buprenorphine in the Successful Management of Opioid Dependence" by Aafaque Akhter, M.D. – Former instructor of Psychiatry at Harvard Medical School and Board certified in Psychiatry and Neurology. Dr. Akhter is the founder and CEO of New England Counseling & Treatment Center, and Norton Health Care, which is one of the few clinics in the country exclusively focused on opiate addiction.
BDSI plans on initiating a pivotal pharmacokinetic study and the safety study for BNX in the third quarter of 2012. Results of the pivotal pharmacokinetic study are anticipated to be available late in the third quarter of this year. If positive, this would allow for an anticipated New Drug Application (NDA) filing in the first half of 2013.
For more information on the event, please contact Brian Korb at bkorb@troutgroup.com. Interested parties may also view the presentation live via the BioDelivery Sciences website at www.bdsi.com. A recording of the presentation will be accessible shortly following the live event and will be archived for 30 days.
About BEMA Buprenorphine/Naloxone (BNX) and Opioid Dependence
BNX is being developed for the treatment of opioid dependence and contains the same drug components as Suboxone, the only currently marketed formulation of buprenorphine and naloxone. Buprenorphine reduces the craving and withdrawal effects from the dependent opioid, and the opioid antagonist, naloxone, is present to deter abuse.
Opioid dependence is a significantly undertreated condition in the U.S., with nearly 2 million people dependent on prescription opioids according to the 2010 National Survey on Drug Use and Health, conducted by the U.S. Department of Health and Human Services. Suboxone (buprenorphine/naloxone), which was approved for the treatment of opioid dependence in 2002, has been shown to be a highly effective treatment option and, as a result, currently generates annual sales of more than $1.2 billion, growing over 20% in 2011 according to data from Wolters Kluwer. BDSI believes that BNX, which uses BDSI's proprietary BEMA delivery technology, has the potential to offer advantages over Suboxone and could seize a meaningful share of this rapidly growing market.
About BioDelivery Sciences International
BioDelivery Sciences International (NASDAQ: BDSI) is a specialty pharmaceutical company that is leveraging its novel and proprietary patented drug delivery technologies to develop and commercialize, either on its own or in partnerships with third parties, new applications of proven therapeutics. BDSI is focusing on developing products to meet unmet patient needs in the areas of pain management and oncology supportive care. BDSI's pain franchise currently consists of two products utilizing the patented BEMA technology. ONSOLIS (fentanyl buccal soluble film) is approved in the U.S., Canada, and the E.U. (where it will be marketed as BREAKYL), for the management of breakthrough pain in opioid tolerant, adult patients with cancer. The commercial rights are licensed to Meda for all territories worldwide except for Taiwan (licensed to TTY Biopharm) and South Korea (licensed to Kunwha Pharmaceutical Co.). BDSI's second pain product, BEMA Buprenorphine, is being developed for the treatment of moderate to severe chronic pain and is in development in a high dose formulation with naloxone for the treatment of opioid dependence. BEMA Buprenorphine for chronic pain is licensed on a worldwide basis to Endo Pharmaceuticals (NASDAQ: ENDP). Additional product candidates are being developed utilizing the BEMA technology for conditions such as nausea/vomiting (BEMA Granisetron). BDSI's headquarters is located in Raleigh, North Carolina. For more information, visit www.bdsi.com.
BDSI® and BEMA® are registered trademarks of BioDelivery Sciences International, Inc. ONSOLIS® is a registered trademark of Meda Pharmaceuticals, Inc. BREAKYL is registered trademark of Meda Pharma GmbH & Co. KG.
Cautionary Note on Forward-Looking Statements
This press release, the investor event described herein and any statements of presenting physicians as well as representatives and partners of BioDelivery Sciences International, Inc. (the "Company") in connection with or related thereto contain, or may contain, among other things, certain "forward-looking statements" within the meaning of the Private Securities Litigation Reform Act of 1995. Such forward-looking statements involve significant risks and uncertainties. Such statements may include, without limitation, statements with respect to the Company's plans, objectives, projections, expectations and intentions and other statements identified by words such as "projects," "may," "will," "could," "would," "should," "believes," "expects," "anticipates," "estimates," "intends," "plans," "potential" or similar expressions. These statements are based upon the current beliefs and expectations of the Company's management and are subject to significant risks and uncertainties, including those detailed in the Company's filings with the Securities and Exchange Commission. Actual results (including, without limitation, the results of (i) future non-clinical or clinical trials for BNX, (ii) the timing for the filing of or the results of the FDA's review of BNX or (iii) future sales results of BNX, if any, as well as the potential benefits of BNX) may differ significantly from those set forth in the forward-looking statements. These forward-looking statements involve certain risks and uncertainties that are subject to change based on various factors (many of which are beyond the Company's control). The Company undertakes no obligation to publicly update any forward-looking statements, whether as a result of new information, future events or otherwise, except as required by applicable law.
SOURCE BioDelivery Sciences International, Inc.
For further information: Brian Korb, Senior Vice President, The Trout Group LLC, +1-646-378-2923, bkorb@troutgroup.com or; Al Medwar, Vice President, Marketing and Corporate Development, BioDelivery Sciences International, Inc.,+1-919-582-9050, amedwar@bdsi.com
Mein persönliches Ziel bis Ende 2012 sind 10$
BioDelivery Sciences to Host Opioid Dependence Investor Event and Webcast on April 11, 2012
Event will focus on the treatment of Opioid Dependence and the BNX development program
Apr 5, 2012
RALEIGH, N.C., April 5, 2012 /PRNewswire/ -- BioDelivery Sciences International, Inc. (NASDAQ: BDSI) today announced that the Company will host a special event entitled "Treatment of Opioid Dependence: The Future Role of BEMA Buprenorphine/Naloxone" for investors and analysts on Wednesday, April 11, 2012 at 12:30 p.m. in New York City. This event will include insightful discussion from medical experts with extensive experience in the management of opioid dependence and treatment with buprenorphine.
(Logo: http://photos.prnewswire.com/prnh/20110217/CL49801LOGO )
In addition to presentations by independent experts in the management of opioid dependence, BDSI's management will speak about the clinical progress of BEMA Buprenorphine/Naloxone (BNX) for the potential treatment of opioid dependence.
The expert presentations at this event will include:
"Understanding Opioid Dependence" by Gregory Sullivan, M.D. – Board certified in Addiction Medicine and Medical Director of Parkway Medical Center in Birmingham, Alabama. For twenty years, Dr. Sullivan has been actively involved in government and pharmaceutical research on the mechanism, biology and treatment of addiction and pain.
"Buprenorphine in the Successful Management of Opioid Dependence" by Aafaque Akhter, M.D. – Former instructor of Psychiatry at Harvard Medical School and Board certified in Psychiatry and Neurology. Dr. Akhter is the founder and CEO of New England Counseling & Treatment Center, and Norton Health Care, which is one of the few clinics in the country exclusively focused on opiate addiction.
BDSI plans on initiating a pivotal pharmacokinetic study and the safety study for BNX in the third quarter of 2012. Results of the pivotal pharmacokinetic study are anticipated to be available late in the third quarter of this year. If positive, this would allow for an anticipated New Drug Application (NDA) filing in the first half of 2013.
For more information on the event, please contact Brian Korb at bkorb@troutgroup.com. Interested parties may also view the presentation live via the BioDelivery Sciences website at www.bdsi.com. A recording of the presentation will be accessible shortly following the live event and will be archived for 30 days.
About BEMA Buprenorphine/Naloxone (BNX) and Opioid Dependence
BNX is being developed for the treatment of opioid dependence and contains the same drug components as Suboxone, the only currently marketed formulation of buprenorphine and naloxone. Buprenorphine reduces the craving and withdrawal effects from the dependent opioid, and the opioid antagonist, naloxone, is present to deter abuse.
Opioid dependence is a significantly undertreated condition in the U.S., with nearly 2 million people dependent on prescription opioids according to the 2010 National Survey on Drug Use and Health, conducted by the U.S. Department of Health and Human Services. Suboxone (buprenorphine/naloxone), which was approved for the treatment of opioid dependence in 2002, has been shown to be a highly effective treatment option and, as a result, currently generates annual sales of more than $1.2 billion, growing over 20% in 2011 according to data from Wolters Kluwer. BDSI believes that BNX, which uses BDSI's proprietary BEMA delivery technology, has the potential to offer advantages over Suboxone and could seize a meaningful share of this rapidly growing market.
About BioDelivery Sciences International
BioDelivery Sciences International (NASDAQ: BDSI) is a specialty pharmaceutical company that is leveraging its novel and proprietary patented drug delivery technologies to develop and commercialize, either on its own or in partnerships with third parties, new applications of proven therapeutics. BDSI is focusing on developing products to meet unmet patient needs in the areas of pain management and oncology supportive care. BDSI's pain franchise currently consists of two products utilizing the patented BEMA technology. ONSOLIS (fentanyl buccal soluble film) is approved in the U.S., Canada, and the E.U. (where it will be marketed as BREAKYL), for the management of breakthrough pain in opioid tolerant, adult patients with cancer. The commercial rights are licensed to Meda for all territories worldwide except for Taiwan (licensed to TTY Biopharm) and South Korea (licensed to Kunwha Pharmaceutical Co.). BDSI's second pain product, BEMA Buprenorphine, is being developed for the treatment of moderate to severe chronic pain and is in development in a high dose formulation with naloxone for the treatment of opioid dependence. BEMA Buprenorphine for chronic pain is licensed on a worldwide basis to Endo Pharmaceuticals (NASDAQ: ENDP). Additional product candidates are being developed utilizing the BEMA technology for conditions such as nausea/vomiting (BEMA Granisetron). BDSI's headquarters is located in Raleigh, North Carolina. For more information, visit www.bdsi.com.
BDSI® and BEMA® are registered trademarks of BioDelivery Sciences International, Inc. ONSOLIS® is a registered trademark of Meda Pharmaceuticals, Inc. BREAKYL is registered trademark of Meda Pharma GmbH & Co. KG.
Cautionary Note on Forward-Looking Statements
This press release, the investor event described herein and any statements of presenting physicians as well as representatives and partners of BioDelivery Sciences International, Inc. (the "Company") in connection with or related thereto contain, or may contain, among other things, certain "forward-looking statements" within the meaning of the Private Securities Litigation Reform Act of 1995. Such forward-looking statements involve significant risks and uncertainties. Such statements may include, without limitation, statements with respect to the Company's plans, objectives, projections, expectations and intentions and other statements identified by words such as "projects," "may," "will," "could," "would," "should," "believes," "expects," "anticipates," "estimates," "intends," "plans," "potential" or similar expressions. These statements are based upon the current beliefs and expectations of the Company's management and are subject to significant risks and uncertainties, including those detailed in the Company's filings with the Securities and Exchange Commission. Actual results (including, without limitation, the results of (i) future non-clinical or clinical trials for BNX, (ii) the timing for the filing of or the results of the FDA's review of BNX or (iii) future sales results of BNX, if any, as well as the potential benefits of BNX) may differ significantly from those set forth in the forward-looking statements. These forward-looking statements involve certain risks and uncertainties that are subject to change based on various factors (many of which are beyond the Company's control). The Company undertakes no obligation to publicly update any forward-looking statements, whether as a result of new information, future events or otherwise, except as required by applicable law.
SOURCE BioDelivery Sciences International, Inc.
For further information: Brian Korb, Senior Vice President, The Trout Group LLC, +1-646-378-2923, bkorb@troutgroup.com or; Al Medwar, Vice President, Marketing and Corporate Development, BioDelivery Sciences International, Inc.,+1-919-582-9050, amedwar@bdsi.com
Antwort auf Beitrag Nr.: 43.041.611 von Freizeitspekulant am 15.04.12 21:17:39...feine News zu GTXI - aber lest mal selbst..
http://www.memphisdailynews.com/news/2012/apr/16/steiner-gtx…
...nachdem der Kurs heute zielstrebig versucht hat erst die 3,10er-Marke anzuvisieren haben sich nach den News schlagsrtig die roten Vorzeichen in deutlich grüne gewandelt...
http://www.memphisdailynews.com/news/2012/apr/16/steiner-gtx…
...nachdem der Kurs heute zielstrebig versucht hat erst die 3,10er-Marke anzuvisieren haben sich nach den News schlagsrtig die roten Vorzeichen in deutlich grüne gewandelt...

der nasdaq-biotechindex ibb eilt weiter von einem allzeithoch zum nächsten! das thema biotech ist momentan eindeutig der leader an der börse. hier muss man meiner meinung nach dabei sein.
der kurs von regeneron kennt kein halten mehr, zwar gut für die investierten, wer aber auf eine konsolidierungsphase wartet um einzusteigen, hat hier keine chance.
vivius hat heute ebenfalls das allzeithoch erreicht.
abwarten nächste woche auf medivation und pcyc. beide aktien befinden sich noch in konsolidierung. wenn der ibb-index aber weiter läuft, ist es nur eine frage der zeit, wann diese seitwärtsphasen nach oben aufgelöst werden.
der kurs von regeneron kennt kein halten mehr, zwar gut für die investierten, wer aber auf eine konsolidierungsphase wartet um einzusteigen, hat hier keine chance.
vivius hat heute ebenfalls das allzeithoch erreicht.
abwarten nächste woche auf medivation und pcyc. beide aktien befinden sich noch in konsolidierung. wenn der ibb-index aber weiter läuft, ist es nur eine frage der zeit, wann diese seitwärtsphasen nach oben aufgelöst werden.
Antwort auf Beitrag Nr.: 43.099.652 von steven_trader am 28.04.12 00:50:00wie gut dass ich mologen auch in 2012 habe 

mologen? die hatte ich mal im sommer 2000 für kurze zeit. hab garnicht mehr gedacht, dass es die überhaupt noch gibt.
und hat sich in 2012 ganz prächtig entwickelt 
+30%

+30%

leute, mit biotechs sind wir im richtigen bereich investiert.
während alle vom hype der smartphones, apple und social media sprechen, eilt der nasdaq biotechindex von hoch zu hoch. die gesamtmarktkorrektur der letzten drei monate war bei biotechs nicht existent.
social media und smartphones, vielleicht noch cloud-computing waren sicherlich die großen themen der börsenjahre 2010 und 2011, aber wenn alle schon davon reden, ist der börsentrend meistens schon vorbei. momentan ist das thema biotech noch nicht auf dem radar der börsenzocker, aber das wird sich mit jedem weiteren höhenflug der biotechaktien zunehmend ändern.
ich würde jetzt nicht den fehler machen und im biotechbereich nach "unterbewerteten" aktien bzw. nachzüglern suchen. biotechs, die in einem für die branche hervorragenden marktumfeld der letzten 12 monate nicht im kurs gestiegen sind, sind m.m. nach mit vorsicht zu genießen.
die großen leader sind momentan (weiterhin) mediviation mdvn, pharmacyclics pcyc, vivus vvus und synageva biopharma geva.
threshold thld und arena arna sind ebenfalls aktien, in die der kapitalfluss läuft, jedoch gilt hier besondere vorsicht auf grund der zugehörigkeit zur gruppe der securities with special margin requirements.

während alle vom hype der smartphones, apple und social media sprechen, eilt der nasdaq biotechindex von hoch zu hoch. die gesamtmarktkorrektur der letzten drei monate war bei biotechs nicht existent.
social media und smartphones, vielleicht noch cloud-computing waren sicherlich die großen themen der börsenjahre 2010 und 2011, aber wenn alle schon davon reden, ist der börsentrend meistens schon vorbei. momentan ist das thema biotech noch nicht auf dem radar der börsenzocker, aber das wird sich mit jedem weiteren höhenflug der biotechaktien zunehmend ändern.
ich würde jetzt nicht den fehler machen und im biotechbereich nach "unterbewerteten" aktien bzw. nachzüglern suchen. biotechs, die in einem für die branche hervorragenden marktumfeld der letzten 12 monate nicht im kurs gestiegen sind, sind m.m. nach mit vorsicht zu genießen.
die großen leader sind momentan (weiterhin) mediviation mdvn, pharmacyclics pcyc, vivus vvus und synageva biopharma geva.
threshold thld und arena arna sind ebenfalls aktien, in die der kapitalfluss läuft, jedoch gilt hier besondere vorsicht auf grund der zugehörigkeit zur gruppe der securities with special margin requirements.
...nachdem ich mich jetzt mal ein paar Wochen noch schöneren Dingen als dem Aktienmarkt zugewendet habe melde ich mich mal wieder hier an...
Gleich zu Anfang die besten Grüße an den "Biohero", der ja der Ansicht war HZNP wäre ein eher schlechtes Investment...chancenlos in Bezug auf Zulassung - daher auch keine Chancen damit Kursgewinne zu erzielen.
Nach meinem Einstieg bei HZNP zu 3,60$ habe ich heute mal Kurgewinne bei 8,69$ realisiert - 141% Gewinn ist doch ganz ordentlich wie ich meine...
Einen Wiedereinstieg kann ich mir hier durchaus nochmals vorstellen wenn zu erwartende Gewinnmitnahmen wieder ein sehr günstiges Kaufniveau anbieten.
Nach wie vor in meinem Depot befinden sich: ACAD - DVAX - GTXI
Zugekauft habe ich heute KERX - Keryx Pharma - hier zog heute der Kurs unter sehr hohem Volumen ca. 10% an, nachdem gemunkelt wurde daß hier evtl. ein Merger oder vielleicht auch mehr im Raum stehen könnte...
Gleich zu Anfang die besten Grüße an den "Biohero", der ja der Ansicht war HZNP wäre ein eher schlechtes Investment...chancenlos in Bezug auf Zulassung - daher auch keine Chancen damit Kursgewinne zu erzielen.
Nach meinem Einstieg bei HZNP zu 3,60$ habe ich heute mal Kurgewinne bei 8,69$ realisiert - 141% Gewinn ist doch ganz ordentlich wie ich meine...

Einen Wiedereinstieg kann ich mir hier durchaus nochmals vorstellen wenn zu erwartende Gewinnmitnahmen wieder ein sehr günstiges Kaufniveau anbieten.
Nach wie vor in meinem Depot befinden sich: ACAD - DVAX - GTXI
Zugekauft habe ich heute KERX - Keryx Pharma - hier zog heute der Kurs unter sehr hohem Volumen ca. 10% an, nachdem gemunkelt wurde daß hier evtl. ein Merger oder vielleicht auch mehr im Raum stehen könnte...
Antwort auf Beitrag Nr.: 43.349.160 von Freizeitspekulant am 03.07.12 20:19:13Leute BioDelivery wird der Highfigher in 2012, diese Aktie ist Hot Hot Hot.....
Und Voralpen sie läuft absolut unter dem Radar, auch hier bei WO kaum
in der Verfolgung



Und Voralpen sie läuft absolut unter dem Radar, auch hier bei WO kaum
in der Verfolgung



Antwort auf Beitrag Nr.: 43.349.189 von Wohnwunsch am 03.07.12 20:26:28Die zukünftigen Perlen GENE und GNOM habe heute den Weg in mein Depot gefunden.
die kursperformance von pcyc ist mir langsam unheimlich.
von 33 auf 57 in nicht mal vier wochen.
hat jemand eine idee, was da dahinter stecken könnte?
von 33 auf 57 in nicht mal vier wochen.
hat jemand eine idee, was da dahinter stecken könnte?
@ipollit,
schön Dich hier zu lesen.
Eine Anmerkung zu PCYC:
steven-trader hat schon recht, es ist unheimlich.
Auf der anderen Seite: PCYC sind jetzt 4 Mrd. schwer.
Vertex oder REGN sind 12 Mrd. schwer. Klar, bei denen ist die Zulassung durch und bei PCYC nicht.
Allerdings ist die Zulassung sehr wahrscheinlich und Ibrutinib hat mehr Potential, als die Blockbuster von Vertex oder REGN - obschon es PCYC nur halb gehört.
(Dabei sollte aber nicht vergessen werden, dass PCYC im Autoimmunbereich die vollen Rechte behalten hat. Da könnte noch sehr viel Zusatzpotential drin stecken).
Was ich sagen will:
Wenn Ibrutinib zugelassen wird und sich der antizipierte Erfolg einstellt, dann ist das Unternehmen irgendwas zwischen 8 und 12 Mrd. wert.
Der Markt muss das in den nächsten Jahren ja irgendwie Stück für Stück einpreisen, solange der Kandidat in der Spur bleibt.
(Ich gehe auch davon aus, dass PCYC und Janssen keinerlei Probleme bei der Rekrutierung für was auch immer haben werden. Die Trials werden alle so schnell laufen, wie es überhaupt nur geht.)
Ich wundere mich daher über die derzeitige Bewertung gar nicht so sehr.
Grüße
schön Dich hier zu lesen.
Eine Anmerkung zu PCYC:
steven-trader hat schon recht, es ist unheimlich.
Auf der anderen Seite: PCYC sind jetzt 4 Mrd. schwer.
Vertex oder REGN sind 12 Mrd. schwer. Klar, bei denen ist die Zulassung durch und bei PCYC nicht.
Allerdings ist die Zulassung sehr wahrscheinlich und Ibrutinib hat mehr Potential, als die Blockbuster von Vertex oder REGN - obschon es PCYC nur halb gehört.
(Dabei sollte aber nicht vergessen werden, dass PCYC im Autoimmunbereich die vollen Rechte behalten hat. Da könnte noch sehr viel Zusatzpotential drin stecken).
Was ich sagen will:
Wenn Ibrutinib zugelassen wird und sich der antizipierte Erfolg einstellt, dann ist das Unternehmen irgendwas zwischen 8 und 12 Mrd. wert.
Der Markt muss das in den nächsten Jahren ja irgendwie Stück für Stück einpreisen, solange der Kandidat in der Spur bleibt.
(Ich gehe auch davon aus, dass PCYC und Janssen keinerlei Probleme bei der Rekrutierung für was auch immer haben werden. Die Trials werden alle so schnell laufen, wie es überhaupt nur geht.)
Ich wundere mich daher über die derzeitige Bewertung gar nicht so sehr.
Grüße
Antwort auf Beitrag Nr.: 43.356.534 von SLGramann am 05.07.12 16:04:55danke für deine einschätzung zu pcyc.
wenn ich mir die kommentare der trader auf stocktwits durchlese, denken so gut wie alle nur ans shorten. die überbewertung ist da ausgemachte sache, jedoch spricht der kurs eine andere sprache.
ich halte die aktie einfach weiter, mal sehen wie weit der run noch geht.
allerdings sind solche vergleiche mit der marktkapitalisierung immer mit vorsicht zu genießen. kann sich noch einer an bernd förtsch vom aktionäre im jahr 2000 erinnern, als er für morphosis sein berühmtes kurziel "dausend" ausgerufen hat?
 sein argument war auch der vergleich der marktkapitalisierung zu medarex und abgenix.
sein argument war auch der vergleich der marktkapitalisierung zu medarex und abgenix.
wenn ich mir die kommentare der trader auf stocktwits durchlese, denken so gut wie alle nur ans shorten. die überbewertung ist da ausgemachte sache, jedoch spricht der kurs eine andere sprache.
ich halte die aktie einfach weiter, mal sehen wie weit der run noch geht.
allerdings sind solche vergleiche mit der marktkapitalisierung immer mit vorsicht zu genießen. kann sich noch einer an bernd förtsch vom aktionäre im jahr 2000 erinnern, als er für morphosis sein berühmtes kurziel "dausend" ausgerufen hat?

 sein argument war auch der vergleich der marktkapitalisierung zu medarex und abgenix.
sein argument war auch der vergleich der marktkapitalisierung zu medarex und abgenix.
hi SLGramann!
Soweit ich mich erinnere, hattest du zu Anfang des Jahres gesagt, du seist in PCYC deutlich überinvestiert. So wie es aussieht, hast du damit ja alles richtig gemacht... Glückwunsch!
Unheimlich ist mir die Bewertung nicht, nachdem wie sich andere Biotechs so entwickelt haben. Mal abgesehen davon, dass diese Branche dieses Jahr prima läuft und sich damit deutlich vom restlichen Markt abkoppeln kann, so halte ich die Bewertung von PCYC auch fundamental für gerechtfertigt.
Weiß nicht, ob REGN und VRTX passende Vergleiche sind. Vertex setzt zwar bereits Mrd um, doch soweit ich das gesehen habe, ist der Markt für Incivek gesättigt, eher rückläufig und könnte auf absehbare Zeit wieder komplett verschwinden. Einen möglichen Nachfolger hatte ja Pharmasset in der Pipeline, der so aussichtsreich war, dass sie gleich auf Basis von PII-Ergebnissen für 11 Mrd USD übernommen worden sind. Ist PCYC nicht in einer ähnlichen Lage? Ich denke, die Bewertung kann auch nochmal deutlich in die Höhe gehen... ob ich auf diesem Niveau einsteigen würde, weiß ich nicht. So kann man aber zuschauen und es laufen lassen. Langfristig vielleicht ja auch soetwas wie CELG, die immer weiter gewachsen und gewachsen sind.
viele Grüße
ipollit
Soweit ich mich erinnere, hattest du zu Anfang des Jahres gesagt, du seist in PCYC deutlich überinvestiert. So wie es aussieht, hast du damit ja alles richtig gemacht... Glückwunsch!
Unheimlich ist mir die Bewertung nicht, nachdem wie sich andere Biotechs so entwickelt haben. Mal abgesehen davon, dass diese Branche dieses Jahr prima läuft und sich damit deutlich vom restlichen Markt abkoppeln kann, so halte ich die Bewertung von PCYC auch fundamental für gerechtfertigt.
Weiß nicht, ob REGN und VRTX passende Vergleiche sind. Vertex setzt zwar bereits Mrd um, doch soweit ich das gesehen habe, ist der Markt für Incivek gesättigt, eher rückläufig und könnte auf absehbare Zeit wieder komplett verschwinden. Einen möglichen Nachfolger hatte ja Pharmasset in der Pipeline, der so aussichtsreich war, dass sie gleich auf Basis von PII-Ergebnissen für 11 Mrd USD übernommen worden sind. Ist PCYC nicht in einer ähnlichen Lage? Ich denke, die Bewertung kann auch nochmal deutlich in die Höhe gehen... ob ich auf diesem Niveau einsteigen würde, weiß ich nicht. So kann man aber zuschauen und es laufen lassen. Langfristig vielleicht ja auch soetwas wie CELG, die immer weiter gewachsen und gewachsen sind.
viele Grüße
ipollit
Hi ipollit, steven,
der Vergleich zu REGN und VRTX hinkt wirklich ziemlich. Ich hab nur zwei Unternehmen rangezogen, die ich etwas kenne und wo die Marktkap. da ist, wo ich mir PCYC in zwei oder drei Jahren auch vorstellen kann.
Insofern volle Übereinstimmung: Der Kurs ist nicht absurd, wenn Ibrutinib das hält, was man sich davon verspricht - wofür die Chancen aber überdurchschnittlich gut stehen. Eher im Gegenteil.
Daher ist der Vergleich mit Celgene auch nicht außerhalb der Welt. Kann Ibrutinib bei PCYC mal in Revlimid-Regionen vorstoßen? Potentiell wohl ja. Analysten rechnen von Celgenes Marktkap. gute 20 Mrd. nur auf das Konto von Revlimid.
Ibrutinib hat eine reelle Chance, in einigen Jahren mal ebenso wertvoll zu sein.
(Steven, hier ist auch der Unterschied zu Förtschs Vergleich von Morphosys und Medarex vor vielen Jahren. Damals bestanden alle dieser Unternehmen aus Zukunftsträumen und Phantasien. Insofern waren diese Vergleiche für die Katz. REGN, VRTX, CELG haben reale Umsätze und Gewinne, da kannst hast Du objektive Kennziffern für eine Bewertung.)
Insofern zum Shorten: Eine echte Schnapsidee, soweit man nicht nur auf einen charttechnischen Rücksetzer spekuliert, der natürlich immer drin ist.
ipollit, hast recht, ich war überinvestiert. Durch die Entwicklung der Aktie ist die Schieflage im Depot jetzt natürlich noch um einiges krasser.
Da wächst subjektiv die Angst, dass sich alles aufgrund einer bösen, unerwarteten Nachricht in Luft auflöst. Das kann ja leider jederzeit passieren. Keine so ganz einfache Situation.
Grüße
der Vergleich zu REGN und VRTX hinkt wirklich ziemlich. Ich hab nur zwei Unternehmen rangezogen, die ich etwas kenne und wo die Marktkap. da ist, wo ich mir PCYC in zwei oder drei Jahren auch vorstellen kann.
Insofern volle Übereinstimmung: Der Kurs ist nicht absurd, wenn Ibrutinib das hält, was man sich davon verspricht - wofür die Chancen aber überdurchschnittlich gut stehen. Eher im Gegenteil.
Daher ist der Vergleich mit Celgene auch nicht außerhalb der Welt. Kann Ibrutinib bei PCYC mal in Revlimid-Regionen vorstoßen? Potentiell wohl ja. Analysten rechnen von Celgenes Marktkap. gute 20 Mrd. nur auf das Konto von Revlimid.
Ibrutinib hat eine reelle Chance, in einigen Jahren mal ebenso wertvoll zu sein.
(Steven, hier ist auch der Unterschied zu Förtschs Vergleich von Morphosys und Medarex vor vielen Jahren. Damals bestanden alle dieser Unternehmen aus Zukunftsträumen und Phantasien. Insofern waren diese Vergleiche für die Katz. REGN, VRTX, CELG haben reale Umsätze und Gewinne, da kannst hast Du objektive Kennziffern für eine Bewertung.)
Insofern zum Shorten: Eine echte Schnapsidee, soweit man nicht nur auf einen charttechnischen Rücksetzer spekuliert, der natürlich immer drin ist.
ipollit, hast recht, ich war überinvestiert. Durch die Entwicklung der Aktie ist die Schieflage im Depot jetzt natürlich noch um einiges krasser.
Da wächst subjektiv die Angst, dass sich alles aufgrund einer bösen, unerwarteten Nachricht in Luft auflöst. Das kann ja leider jederzeit passieren. Keine so ganz einfache Situation.
Grüße
Antwort auf Beitrag Nr.: 43.011.834 von Freizeitspekulant am 06.04.12 20:55:15Habe mir gestern mal eine Tradingposition CBRX gesichert - charttechnisch schauts ja hier schon mal ganz gut aus...

Antwort auf Beitrag Nr.: 43.011.834 von Freizeitspekulant am 06.04.12 20:55:15Anbei also mal die Kursentwicklung von drei meiner ursprünglich sich im Depot befindlichen Werte. Den vierten - HZNP - habe ich inzwischen rein aus technischen Gründen verkauft. Bei günstiger Gelegenheit überlege ich mir hier einen Neueinstieg.
Columbia Labs (CBRX) habe ich dieser Tage neu als Tradingposition zugekauft.




Columbia Labs (CBRX) habe ich dieser Tage neu als Tradingposition zugekauft.




hab mir heute mal die wichtigsten welt-indices angesehen. dass sieht alles nicht sehr positiv aus. usa hält sich noch ganz gut, aber der rest sieht bedrohlich aus, vor allem europa und china. die einzigen branchen, die sich von diesem negativen umfeld zu entkoppeln scheinen, sind health care und biotechnologie. wir sind also weiterhin im richtigen sektor investiert.
trotzdem muss der gesamtmarkt zumindest stabil bleiben, sonst erwischt es die biotechs früher oder später auch. das letzte mal, dass ein sektor sich komplett vom gesamtmarkt entkoppeln konnte, waren die rohstoffwerte von herbst 2007 bis sommer 2008. das ergebnis ist bekannt, hoffentlich geht es den biotechs jetzt nicht genauso.
trotzdem muss der gesamtmarkt zumindest stabil bleiben, sonst erwischt es die biotechs früher oder später auch. das letzte mal, dass ein sektor sich komplett vom gesamtmarkt entkoppeln konnte, waren die rohstoffwerte von herbst 2007 bis sommer 2008. das ergebnis ist bekannt, hoffentlich geht es den biotechs jetzt nicht genauso.
Zuletzt habe ich Array und Rigel etwas aufgestockt. Array hat in Zukunft vielleicht noch Potential mit den MEKs und relativ vielen Projekten in der Pipeline. Bei RIGL setze ich auf einen Erfolg von SYK/Fostamatinib. Weiter werde ich wohl noch EXEL, CLDX und Genmab aufstocken. Auf meiner Watchlist habe ich CLVS und Galapagos.
Gibt es vielleicht weitere intressante Biotechs, die sich lohnen könnten?
Mein Portfolio habe ich momentan so gewichtet...
Nasdaq Biotech Index

17,5% Pharmacyclics - MK 4.072 Mio USD (Kurs 58,97) http://finance.yahoo.com/q?s=PCYC
8,5% Onyx - MK 4.373 Mio USD (Kurs 67,94) http://finance.yahoo.com/q?s=ONXX
8,2% Incyte - MK 3.243 Mio USD (Kurs 25,32) http://finance.yahoo.com/q?s=INCY
7,1% Regeneron - MK 11.170 Mio USD (Kurs 119,54) http://finance.yahoo.com/q?s=REGN
5,5% Array - MK 312 Mio USD (Kurs 3,495) http://finance.yahoo.com/q?s=ARRY
5,0% Cubist - MK 2.495 Mio USD (Kurs 39,4) http://finance.yahoo.com/q?s=CBST
4,9% Synta - MK 376 Mio USD (Kurs 6,53) http://finance.yahoo.com/q?s=SNTA
4,4% Exelixis - MK 866 Mio USD (Kurs 5,83) http://finance.yahoo.com/q?s=EXEL
4,3% Rigel - MK 698 Mio USD (Kurs 9,77) http://finance.yahoo.com/q?s=RIGL
3,9% Seattle Genetics - MK 3.006 Mio USD (Kurs 25,68) http://finance.yahoo.com/q?s=SGEN
3,3% ArQule - MK 399 Mio USD (Kurs 6,41) http://finance.yahoo.com/q?s=ARQL
3,2% Celldex - MK 315 Mio USD (Kurs 5,355) http://finance.yahoo.com/q?s=CLDX
3,1% AVEO - MK 558 Mio USD (Kurs 12,8) http://finance.yahoo.com/q?s=AVEO
2,9% Ziopharm - MK 488 Mio USD (Kurs 6,22) http://finance.yahoo.com/q?s=ZIOP
2,8% Arena - MK 2.028 Mio USD (Kurs 11,115) http://finance.yahoo.com/q?s=ARNA
2,7% Isis - MK 1.319 Mio USD (Kurs 13,17) http://finance.yahoo.com/q?s=ISIS
2,5% Alnylam - MK 668 Mio USD (Kurs 12,87) http://finance.yahoo.com/q?s=ALNY
2,5% Threshold - MK 446 Mio USD (Kurs 8,185) http://finance.yahoo.com/q?s=THLD
1,9% Genmab - MK 422 Mio USD (Kurs 56,8) http://finance.yahoo.com/q?s=GEN.CO
1,9% YM BioScience - MK 343 Mio USD (Kurs 2,18) http://finance.yahoo.com/q?s=YMI
1,6% Intermune - MK 771 Mio USD (Kurs 11,785) http://finance.yahoo.com/q?s=INTM
1,3% Trius - MK 227 Mio USD (Kurs 5,88) http://finance.yahoo.com/q?s=TSRX
0,7% AMAG - MK 329 Mio USD (Kurs 15,39) http://finance.yahoo.com/q?s=AMAG
Gruß
ipollit
Gibt es vielleicht weitere intressante Biotechs, die sich lohnen könnten?
Mein Portfolio habe ich momentan so gewichtet...
Nasdaq Biotech Index
17,5% Pharmacyclics - MK 4.072 Mio USD (Kurs 58,97) http://finance.yahoo.com/q?s=PCYC
8,5% Onyx - MK 4.373 Mio USD (Kurs 67,94) http://finance.yahoo.com/q?s=ONXX
8,2% Incyte - MK 3.243 Mio USD (Kurs 25,32) http://finance.yahoo.com/q?s=INCY
7,1% Regeneron - MK 11.170 Mio USD (Kurs 119,54) http://finance.yahoo.com/q?s=REGN
5,5% Array - MK 312 Mio USD (Kurs 3,495) http://finance.yahoo.com/q?s=ARRY
5,0% Cubist - MK 2.495 Mio USD (Kurs 39,4) http://finance.yahoo.com/q?s=CBST
4,9% Synta - MK 376 Mio USD (Kurs 6,53) http://finance.yahoo.com/q?s=SNTA
4,4% Exelixis - MK 866 Mio USD (Kurs 5,83) http://finance.yahoo.com/q?s=EXEL
4,3% Rigel - MK 698 Mio USD (Kurs 9,77) http://finance.yahoo.com/q?s=RIGL
3,9% Seattle Genetics - MK 3.006 Mio USD (Kurs 25,68) http://finance.yahoo.com/q?s=SGEN
3,3% ArQule - MK 399 Mio USD (Kurs 6,41) http://finance.yahoo.com/q?s=ARQL
3,2% Celldex - MK 315 Mio USD (Kurs 5,355) http://finance.yahoo.com/q?s=CLDX
3,1% AVEO - MK 558 Mio USD (Kurs 12,8) http://finance.yahoo.com/q?s=AVEO
2,9% Ziopharm - MK 488 Mio USD (Kurs 6,22) http://finance.yahoo.com/q?s=ZIOP
2,8% Arena - MK 2.028 Mio USD (Kurs 11,115) http://finance.yahoo.com/q?s=ARNA
2,7% Isis - MK 1.319 Mio USD (Kurs 13,17) http://finance.yahoo.com/q?s=ISIS
2,5% Alnylam - MK 668 Mio USD (Kurs 12,87) http://finance.yahoo.com/q?s=ALNY
2,5% Threshold - MK 446 Mio USD (Kurs 8,185) http://finance.yahoo.com/q?s=THLD
1,9% Genmab - MK 422 Mio USD (Kurs 56,8) http://finance.yahoo.com/q?s=GEN.CO
1,9% YM BioScience - MK 343 Mio USD (Kurs 2,18) http://finance.yahoo.com/q?s=YMI
1,6% Intermune - MK 771 Mio USD (Kurs 11,785) http://finance.yahoo.com/q?s=INTM
1,3% Trius - MK 227 Mio USD (Kurs 5,88) http://finance.yahoo.com/q?s=TSRX
0,7% AMAG - MK 329 Mio USD (Kurs 15,39) http://finance.yahoo.com/q?s=AMAG
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.362.786 von ipollit am 07.07.12 13:05:39ganz schön breit diversifiziert. hoffentlich verlierst du dabei nicht den überblick.
bei den ipo´s hab ich clvs auch in beobachtung. dann noch nlnk. seit november an der börse und bisher kennt die aktie nur eine richtung.
geva ist auch interessant. die aktie werde ich nächste woche kaufen, falls das ath fällt.
bei den ipo´s hab ich clvs auch in beobachtung. dann noch nlnk. seit november an der börse und bisher kennt die aktie nur eine richtung.
geva ist auch interessant. die aktie werde ich nächste woche kaufen, falls das ath fällt.
Antwort auf Beitrag Nr.: 43.362.786 von ipollit am 07.07.12 13:05:39So, Ritterschlag für Genmab:
We are initiating a position in Genmab (GEN.CO) following positive data with its CD38 antibody, daratumumab (discussed here). We are also selling our Onyx (ONXX) position at a profit of 84%, as high chances of accelerated approval for carfilzomib are already factored in.
Und ansonsten viel lesenswertes zu Synta:
http://www.hammerstockblog.com/synta-the-signal-looks-real/
We are initiating a position in Genmab (GEN.CO) following positive data with its CD38 antibody, daratumumab (discussed here). We are also selling our Onyx (ONXX) position at a profit of 84%, as high chances of accelerated approval for carfilzomib are already factored in.
Und ansonsten viel lesenswertes zu Synta:
http://www.hammerstockblog.com/synta-the-signal-looks-real/
Antwort auf Beitrag Nr.: 43.376.500 von multimediaperle am 12.07.12 00:03:42hoffentlich geht sie nicht nach hinten los
Rückblickend auf meine letzten Aktivitäten folgende Feststellungen:
HZNP - zu verkaufen war schon mal richtig - hier kommt der Kurs gerade wieder in weniger übertriebene Regionen, könnte durchaus noch unter die 6$ zurückkommen.
DVAX - mit einem deftigen Kursplus verkauft - hier scheint sich ebenfalls der Kurs tieferen Regionen im Bereich von 3,50$ zuzuwenden.
ACAD - fundamental nichts neues - kurstechnisch scheint es wieder in Richtung der 2$-Marke zu gehen.
CBRX - scheint sich erst mal auf höherem Niveau einzupendeln - der Kurs hat sich die letzten Tage trotz schlechtem Markt gut gehalten.
KERX - auch hier bislang nichts neues - außer daß in den US-Boards kräftig gebasht wird...
GTXI - hier habe ich aufgrund der momentan wunderbaren charttechnischen Situation noch etwas zugekauft. Auffällig hier daß derzeit nur sehr wenig Stücke gehandelt werden...




HZNP - zu verkaufen war schon mal richtig - hier kommt der Kurs gerade wieder in weniger übertriebene Regionen, könnte durchaus noch unter die 6$ zurückkommen.
DVAX - mit einem deftigen Kursplus verkauft - hier scheint sich ebenfalls der Kurs tieferen Regionen im Bereich von 3,50$ zuzuwenden.
ACAD - fundamental nichts neues - kurstechnisch scheint es wieder in Richtung der 2$-Marke zu gehen.
CBRX - scheint sich erst mal auf höherem Niveau einzupendeln - der Kurs hat sich die letzten Tage trotz schlechtem Markt gut gehalten.
KERX - auch hier bislang nichts neues - außer daß in den US-Boards kräftig gebasht wird...
GTXI - hier habe ich aufgrund der momentan wunderbaren charttechnischen Situation noch etwas zugekauft. Auffällig hier daß derzeit nur sehr wenig Stücke gehandelt werden...
@slgramann
hast du eigentlich noch AVEO? Soweit ich das gesehen habe, wurden die Ficlatuzumab-Ergebnisse vor ein paar Monaten negativ aufgenommen. HGF scheint prinzipiell aber kein so verkehrter Ansatz zu sein: http://www.welt.de/gesundheit/article107810239/Warum-Krebsme… Verhalten sich HGF- und cMet-Hemmer ähnlich oder wo liegen die Unterschiede?
Was hältst du von ARRY? Könnten die sich nicht auch interessant entwickeln bei einer aktuellen MK und einer immer weiter fortschreitenden Pipeline, insbesondere den MEKs. Zuletzt Zusammenfassung der JPM Päsentation von mcbio:
"ARRY @ JMP (7/12/12)
1. ARRY-797 pain results will be out by mid-August.
2. ARRY has the potential to have 5 P3 trials under way by the end of 2013.
3. ARRY is "particularly excited" about ARRY-614 and believes it is a "potential blockbuster." 150,000 MDS patients total and 614 targets low-risk/intermediate-1 population, which is 100,000 patients. The only option for the bulk of HMA failures in this patient population is supportive care, which consists of EPO, growth factor, transfusions, and iron chelators. 614 is a potential billion dollar opportunity in MDS (slide 9).
4. ARRY will meet with the FDA on 614 by the end of the year and will discuss hematologic improvement as a potential endpoint for accelerated approval.
5. The improved formulation of 614, for which results should be available at ASH, is significantly more potent than the prior formulation and gets 3X the exposure.
6. Regarding ARRY-520 for MM, someone noted the prior failures of KSP inhibitors (e.g., CYTK) but management indicated that prior KSP inhibitors were not tested in MM. The rationale for a KSP inhibitor in MM is to inhibit the MCL-1 pathway, which MM depends on."
ARRY-797 wird als äußerst spekulativ gesehen, da bisher alle p38-Schmerzmittel gescheitert sind. Soweit ich das sehe, u.a. weil der Effekt nach einigen Tagen nachlässt (ich meine ARRY hätte auch die chronischen Indikationen gestrichen). Ebenfalls sollte ARRY-520 nicht eingepreist sein, da zu unsicher.
gruß ipollit
hast du eigentlich noch AVEO? Soweit ich das gesehen habe, wurden die Ficlatuzumab-Ergebnisse vor ein paar Monaten negativ aufgenommen. HGF scheint prinzipiell aber kein so verkehrter Ansatz zu sein: http://www.welt.de/gesundheit/article107810239/Warum-Krebsme… Verhalten sich HGF- und cMet-Hemmer ähnlich oder wo liegen die Unterschiede?
Was hältst du von ARRY? Könnten die sich nicht auch interessant entwickeln bei einer aktuellen MK und einer immer weiter fortschreitenden Pipeline, insbesondere den MEKs. Zuletzt Zusammenfassung der JPM Päsentation von mcbio:
"ARRY @ JMP (7/12/12)
1. ARRY-797 pain results will be out by mid-August.
2. ARRY has the potential to have 5 P3 trials under way by the end of 2013.
3. ARRY is "particularly excited" about ARRY-614 and believes it is a "potential blockbuster." 150,000 MDS patients total and 614 targets low-risk/intermediate-1 population, which is 100,000 patients. The only option for the bulk of HMA failures in this patient population is supportive care, which consists of EPO, growth factor, transfusions, and iron chelators. 614 is a potential billion dollar opportunity in MDS (slide 9).
4. ARRY will meet with the FDA on 614 by the end of the year and will discuss hematologic improvement as a potential endpoint for accelerated approval.
5. The improved formulation of 614, for which results should be available at ASH, is significantly more potent than the prior formulation and gets 3X the exposure.
6. Regarding ARRY-520 for MM, someone noted the prior failures of KSP inhibitors (e.g., CYTK) but management indicated that prior KSP inhibitors were not tested in MM. The rationale for a KSP inhibitor in MM is to inhibit the MCL-1 pathway, which MM depends on."
ARRY-797 wird als äußerst spekulativ gesehen, da bisher alle p38-Schmerzmittel gescheitert sind. Soweit ich das sehe, u.a. weil der Effekt nach einigen Tagen nachlässt (ich meine ARRY hätte auch die chronischen Indikationen gestrichen). Ebenfalls sollte ARRY-520 nicht eingepreist sein, da zu unsicher.
gruß ipollit
Antwort auf Beitrag Nr.: 43.386.603 von ipollit am 14.07.12 17:42:35Hallo ipollit,
nein, AVEO habe ich nicht mehr. Mit Ficlatuzumab hab ich mich nie befasst. Nach wie vor finde ich die Ergebnisse von Tivozanib gar nicht so schlecht. Es würde mich nicht wundern, wenn AVEO hier am Ende doch zuletzt lacht.
Arry gefallen mir immer besser und ich habe sie jetzt auch im Niveau. Natürlich ärgere ich mich, den Einstieg bei knapp über einem Dollar verpasst zu haben... Die Pipeline ist jetzt jedenfalls reifer und es geht langsam Richtung Markt.
Mein Depot derzeit:
ARQL
ARRY
CLDX
EXEL
GILD
PCYC
SNTA
THLD
YMI
Galapagos
Genmab
MorphoSys
(wie gehabt, sehr Hammer-lastig... )
)
nein, AVEO habe ich nicht mehr. Mit Ficlatuzumab hab ich mich nie befasst. Nach wie vor finde ich die Ergebnisse von Tivozanib gar nicht so schlecht. Es würde mich nicht wundern, wenn AVEO hier am Ende doch zuletzt lacht.
Arry gefallen mir immer besser und ich habe sie jetzt auch im Niveau. Natürlich ärgere ich mich, den Einstieg bei knapp über einem Dollar verpasst zu haben... Die Pipeline ist jetzt jedenfalls reifer und es geht langsam Richtung Markt.
Mein Depot derzeit:
ARQL
ARRY
CLDX
EXEL
GILD
PCYC
SNTA
THLD
YMI
Galapagos
Genmab
MorphoSys
(wie gehabt, sehr Hammer-lastig...
 )
)
Antwort auf Beitrag Nr.: 43.382.272 von Freizeitspekulant am 13.07.12 11:31:37@Freizeitspekulant, Dein Ansatz ist eher charttechnisch basiert bzw. kurzfristig auf bestimmte kursbeeinflussende Events bezogen, oder?
Sich an Ohad Hammer zu orientieren, war immer sehr gut. Allerdings hat er im März PCYC wegen angemessener Bewertung zu ca. 25 USD verkauft. Immer liegt er also auch nicht richtig.
Unsicher bin ich mir etwas bezüglich ARQL. Hammer hat sie zuletzt einige Zeit lang als unterbewertet gesehen, wobei der Kurs weiter nachgegeben hat. Irgendwie schein der Markt dies anders zu sehen zu sehen. Gibt es hier vielleicht einen Haken?

Das Hammer-Depot dürfte momentan wie folgt gewichtet sein:
13,2% SNTA
12,3% SGEN
10,7% INCY
9,3% CLDX
8,9% EXEL
7,7% ARRY
5,7% CRIS
4,8% YMI
4,3% ARQL
4,3% MRK
3,9% THLD
3,3% MOR.DE
3,1% GSK
3,0% PGNX
2,9% GEN.CO
2,5% GILD
SNTA ist sehr hoch gewichtet. SGEN hat inzwischen auch eine 3 Mrd USD MK... ob die nicht langsam ausgereizt sind? CRIS habe ich bisher nicht weiter betrachtet, weil ich die Pipeline nicht so interessant fand. Ist vielleicht CUDC-907 etwas z.B. im Vergleich mit CAL-101?
Gruß ipollit
Unsicher bin ich mir etwas bezüglich ARQL. Hammer hat sie zuletzt einige Zeit lang als unterbewertet gesehen, wobei der Kurs weiter nachgegeben hat. Irgendwie schein der Markt dies anders zu sehen zu sehen. Gibt es hier vielleicht einen Haken?
Das Hammer-Depot dürfte momentan wie folgt gewichtet sein:
13,2% SNTA
12,3% SGEN
10,7% INCY
9,3% CLDX
8,9% EXEL
7,7% ARRY
5,7% CRIS
4,8% YMI
4,3% ARQL
4,3% MRK
3,9% THLD
3,3% MOR.DE
3,1% GSK
3,0% PGNX
2,9% GEN.CO
2,5% GILD
SNTA ist sehr hoch gewichtet. SGEN hat inzwischen auch eine 3 Mrd USD MK... ob die nicht langsam ausgereizt sind? CRIS habe ich bisher nicht weiter betrachtet, weil ich die Pipeline nicht so interessant fand. Ist vielleicht CUDC-907 etwas z.B. im Vergleich mit CAL-101?
Gruß ipollit
Antwort auf Beitrag Nr.: 43.387.964 von ipollit am 15.07.12 16:50:17ARQL finde ich auch etwas wacklig, vor allem weil die P II-Daten damals nicht voll überzeugen konnten (statistische Signifikanz).
Erneut etwas lauwarm jetzt zur ASCO:
"Arqule (ARQL) started ASCO with a negative sentiment based on a modest PFS signal from a phase II in liver cancer. In MET+ patients, tivantinib led to a PFS benefit of almost 1 month, which is probably not considered clinically meaningful."
Wenn man dann tiefer gräbt, sieht es dann doch wieder gut aus, aber die Daten sind eben nicht so "wow" bzw. glasklar, wie bei bspw. T-DM1 oder Ibrutinib.
Ich glaub, das ist der Grund für die wenig euphorische Börse. Man traut dem Braten noch nicht so recht.
Curis konnte ich mich nie zu durchringen, weil ich Vismodegib als "billig" verpartnert angesehen habe (kann mich an die Royalties jetzt nicht erinnern, war aber meiner Meinung nach langweilig).
Den Rest der Pipeline kann ich nicht beurteilen.
SGEN - finde ich auch ausgereizt. Da finde ich IMGN inzwischen wieder interessanter, die Hammer m.E. wohl doch zu früh raus genommen hat. Vielleicht ist er mit dem Verkaufen manchmal etwas schnell...
Ich hätte mir mal einen Artikel zu PGNX gewünscht. Hab das nie richtig kapiert, was da toll sein soll. Sind aber gut gelaufen.
Erneut etwas lauwarm jetzt zur ASCO:
"Arqule (ARQL) started ASCO with a negative sentiment based on a modest PFS signal from a phase II in liver cancer. In MET+ patients, tivantinib led to a PFS benefit of almost 1 month, which is probably not considered clinically meaningful."
Wenn man dann tiefer gräbt, sieht es dann doch wieder gut aus, aber die Daten sind eben nicht so "wow" bzw. glasklar, wie bei bspw. T-DM1 oder Ibrutinib.
Ich glaub, das ist der Grund für die wenig euphorische Börse. Man traut dem Braten noch nicht so recht.
Curis konnte ich mich nie zu durchringen, weil ich Vismodegib als "billig" verpartnert angesehen habe (kann mich an die Royalties jetzt nicht erinnern, war aber meiner Meinung nach langweilig).
Den Rest der Pipeline kann ich nicht beurteilen.
SGEN - finde ich auch ausgereizt. Da finde ich IMGN inzwischen wieder interessanter, die Hammer m.E. wohl doch zu früh raus genommen hat. Vielleicht ist er mit dem Verkaufen manchmal etwas schnell...
Ich hätte mir mal einen Artikel zu PGNX gewünscht. Hab das nie richtig kapiert, was da toll sein soll. Sind aber gut gelaufen.

BIOALLIANCE PHARMA ACTIONS PORT EO -,25 (WKN A0HMXA)
Melden nach Börsenschluss Paris (Heimatbörse) ein Lizenzabkommen für den US Markt.
Volumen 44mUSD plus Royalties. Marktkapitalisierung der Firma 67mEUR.
News:http://www.finanzen.net/nachricht/BioAlliance-Pharma-announc…

Melden nach Börsenschluss Paris (Heimatbörse) ein Lizenzabkommen für den US Markt.
Volumen 44mUSD plus Royalties. Marktkapitalisierung der Firma 67mEUR.
News:http://www.finanzen.net/nachricht/BioAlliance-Pharma-announc…
ein längerer Artikel zu PCYC... http://updates.clltopics.org/4606-pci-32765-ibrutinib-what-w… Mal sehen, wie sich Genmab's Arzerra vs. Rituxan langfristig entwickelt.
Die letzte Woche ist ONXX ganz gut gelaufen. Ein Konkurrent von Nexavar bei Leberkrebs ist gescheitert. Mit der Zulassung von Kyprolis hat Onyx nun endlich ein 100% eigenes Mittel am Markt, welches möglicherweise 1-2 Mrd USD Umsatz erzielen kann. Daneben könnte es in ein paar Monaten auch noch die Zulassung von Bayer's Regorafenib geben, an dessen Umsätzen Onyx mit 20% beteiligt ist.
Spannend bleibt auch REGN. Die haben gerade mit Sanofi die PIII von REGN727 gestartet. Dies ist die erste PIII eines PCSK9-Hemmers... angeblich ein zukünftiger 20 Mrd USD Markt. Nächsten Mittwoch kommen die nächsten Quartalszahlen inkl. aktueller Eylea-Umsätze... mal schauen, ob Regeneron die hohen Erwartungen erfüllen kann. Anfang August entscheidet dann die FDA über die Zulassung von Zaltrap gegen Darmkrebs, das quasi wie Avastin wirkt, aber auch dann zum Einsatz kommen kann, wenn Avastin nicht mehr wirksam ist. Und es stehen weitere Eylea-Zulassungen an, u.a. in Europa.
Gruß
ipollit
Die letzte Woche ist ONXX ganz gut gelaufen. Ein Konkurrent von Nexavar bei Leberkrebs ist gescheitert. Mit der Zulassung von Kyprolis hat Onyx nun endlich ein 100% eigenes Mittel am Markt, welches möglicherweise 1-2 Mrd USD Umsatz erzielen kann. Daneben könnte es in ein paar Monaten auch noch die Zulassung von Bayer's Regorafenib geben, an dessen Umsätzen Onyx mit 20% beteiligt ist.
Spannend bleibt auch REGN. Die haben gerade mit Sanofi die PIII von REGN727 gestartet. Dies ist die erste PIII eines PCSK9-Hemmers... angeblich ein zukünftiger 20 Mrd USD Markt. Nächsten Mittwoch kommen die nächsten Quartalszahlen inkl. aktueller Eylea-Umsätze... mal schauen, ob Regeneron die hohen Erwartungen erfüllen kann. Anfang August entscheidet dann die FDA über die Zulassung von Zaltrap gegen Darmkrebs, das quasi wie Avastin wirkt, aber auch dann zum Einsatz kommen kann, wenn Avastin nicht mehr wirksam ist. Und es stehen weitere Eylea-Zulassungen an, u.a. in Europa.
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.412.007 von ipollit am 22.07.12 20:18:03Der jüngste Kursrückgang bei PCYC scheint auf die von Dir verlinkten Befürchtungen zurückzugehen:
Rodman & Renshaw believes bleeding concerns surrounding Pharmacyclics' ibrutinib are overblown and old news. The firm says Pharmacyclics directly addressed the concerns at the 2011 ASH analyst meeting and keeps an Outperform rating on the stock.
Bei REGN bin ich auch eindeutig zu früh raus. Bei Onyx habe ich nach der positiven Panel-Empfehlung bei 64 oder so verkauft, vielleicht ebenfalls zu früh.
Ich habe bisher noch nicht verstanden, warum Arzerra bei Genmab mehr oder weniger komplett ausgepreist worden ist, nachdem vor wenigen Jahren Analysten darin noch einen riesigen Wert sehen wollten.
So schlecht scheint Arzerra ja nun auch nicht zu sein. Oder sieht man einfach nur keine Chance, sich etwas vom Rituxan-Kuchen abzuschneiden?
Rodman & Renshaw believes bleeding concerns surrounding Pharmacyclics' ibrutinib are overblown and old news. The firm says Pharmacyclics directly addressed the concerns at the 2011 ASH analyst meeting and keeps an Outperform rating on the stock.
Bei REGN bin ich auch eindeutig zu früh raus. Bei Onyx habe ich nach der positiven Panel-Empfehlung bei 64 oder so verkauft, vielleicht ebenfalls zu früh.
Ich habe bisher noch nicht verstanden, warum Arzerra bei Genmab mehr oder weniger komplett ausgepreist worden ist, nachdem vor wenigen Jahren Analysten darin noch einen riesigen Wert sehen wollten.
So schlecht scheint Arzerra ja nun auch nicht zu sein. Oder sieht man einfach nur keine Chance, sich etwas vom Rituxan-Kuchen abzuschneiden?
Da Arzerra leicht anders an CD20 andockt als Rituxan, hatte man wohl gehofft, dass es vielleicht besser wirkt bzw. auch dann noch wirkt, wenn Rituxan wirkungslos wird. In den relativ kleinen Studien konnte dies basierend auf Response-Rates aber nicht gezeigt werden... jedenfalls lagen die Ergebnisse unter den Erwartungen. Jetzt muss man es mit größeren und längeren Studien versuchen... das braucht noch ein paar Jahre und wieder mit unsicherem Ausgang. Nur in CLL hat es auf dem schnellen Weg funktioniert.
Was bei Genmab auch ziemlich schief gelaufen ist, ist der Erwerb einer eigenen AK-Produktionsstädte (http://genmab-facility.com/). Für viel Geld gekauft und nie gebraucht. Stattdessen entstehen permanent erhebliche Kosten und sie werden sie nicht los.
Gruß
Was bei Genmab auch ziemlich schief gelaufen ist, ist der Erwerb einer eigenen AK-Produktionsstädte (http://genmab-facility.com/). Für viel Geld gekauft und nie gebraucht. Stattdessen entstehen permanent erhebliche Kosten und sie werden sie nicht los.
Gruß
Danke, ipollit.
nochmals PCYC:
With Sales Years Away, Pharmacyclics Rallies on Drug Promise
By Joan E. Solsman
Pharmacyclics Inc.'s (PCYC) leukemia treatment has proven to be at least three times as effective as current options, a major factor in the stock's fourfold surge since Thanksgiving, but one significant hurdle remains: The company is unlikely to see any meaningful sales for at least three years.
That's because the Sunnyvale, Calif., company still needs to complete late-stage testing on the drug, ibrutinib. While many expect success--the treatment already is drawing comparisons to one of the most successful cancer drugs ever--some wonder if it's premature to give Pharmacyclics a $3.6 billion valuation and price the stock at 750 times future earnings, especially when the company doesn't own all of the drug's rights and the product won't hit the market until 2015 by analysts' estimates.
At such high valuation, "disappointments will inevitably emerge during the course of clinical development," Bernstein Research analyst Geoffrey C. Porges said. Pharmacyclics closed Friday at $49.99.
The company is targeting ibrutinib for several blood-cell cancers but, for now, is focusing its efforts on a blood and bone marrow cancer known as chronic lymphocytic leukemia, or CLL. The cancer causes certain abnormal white-blood cells to multiply out of control, eventually crowding out healthy cells in the blood. Ibrutinib attaches to an enzyme key to the development of the abnormal cells and shuts off its activity.
"We feel this has a multibillion-dollar revenue potential," Chief Medical Officer Lori Kunkel said at a health-care conference in January. In an email for this story, Ms. Kunkel called ibrutinib's activity unprecedented.
Among CLL patients who have failed standard chemotherapy, ibrutinib kept 88% alive without any cancer progression for a median, so far, of almost 18 months in a mid-stage study.
By comparison, the most recently approved agent in CLL, ofatumumab, has a progression-free-survival median of less than six months. And while a 2006 study found an overall tumor response rate of 58% at best with ofatumumab alone, 100% of the patients in a preliminary Pharmacyclics trial responded to treatment of ofatumumab and ibrutinib combined--and all were surviving with no cancer progression at a median follow-up of almost 10 months.
"It's eye-popping efficacy," Rodman & Renshaw analyst Michael King said.
In addition, ibrutinib has proven more durable than current treatments. It is a daily pill that early data show can be taken effectively for more than a year, and many analysts project can be taken for several. On the other hand, the standard CLL regimen--a combination chemotherapy and antibody therapy--is usually administered over the course of about six months.
Ibrutinib's impressive results have reminded some of Novartis AG's (NVS, NOVN.VX) blockbuster Gleevec, which was introduced in 2001 and quickly became the standard of care for people with another type of leukemia. Gleevec showed how targeting an underlying genetic defect could halt or delay progression of cancer and keep a large proportion of patients in remission for years.
The drug had world-wide sales of $4.66 billion last year.
Before ibrutinib gets any sales, it must get regulatory approval, which isn't seen until 2015 because the company has to complete a late-stage trial, analysts say. In a larger trial, the potential exists for unforeseen complications or weaker efficacy readings, Rodman analyst Michael King cautioned.
But Brian Skorney, an analyst at Brean Murray, Carret & Co., said such risks are overshadowed by ibrutinib's unusually strong results thus far. "The profile of the drug is so extraordinarily better, that even if the profile becomes a lot worse, it's still a major shift from what's out there," he said.
Notably absent is takeover speculation. Wedbush Securities Inc. analyst Greg Wade said the company is closely held: Five shareholders control half of it, including 20% by Chairman and Chief Executive Robert W. Duggan, and management has been vocal it wants Pharmacyclics to come into its own. The company's partnership with Johnson & Johnson (JNJ) also deters other potential suitors from making advances, he said.
Bernstein's Mr. Porges has raised concerns about the stock's runup and questioned whether the company was worth the valuation. The analyst noted that Pharmacyclics only holds about half the value of its one real asset because of the J&J partnership.
He added that Pharmacyclics's $3.6 billion market capitalization implies the drug is valued around $9 billion. Mr. Porges, though, pegs peak global sales at about $2.8 billion.
Other biotech companies with similar market capitalization have material advantages in comparison, Mr. Porges said. For example, Medivation Inc. (MDVN) is a $3.48 billion company that has a similar partnership on its prostate cancer drug but is only three months away from approval.
In addition, other companies are pursuing drugs that target the same enzyme, including developmental CLL drugs at Celgene Corp. (CELG), and Gilead Sciences Inc. (GILD), which seems to be moving faster with the studies of its GS-1101, Mr. Porges said.
"The market may not be big enough, soon enough, to support the revenue implied by the stock's recent valuation," he said.
Write to Joan E. Solsman at joan.solsman@dowjones.com
nochmals PCYC:
With Sales Years Away, Pharmacyclics Rallies on Drug Promise
By Joan E. Solsman
Pharmacyclics Inc.'s (PCYC) leukemia treatment has proven to be at least three times as effective as current options, a major factor in the stock's fourfold surge since Thanksgiving, but one significant hurdle remains: The company is unlikely to see any meaningful sales for at least three years.
That's because the Sunnyvale, Calif., company still needs to complete late-stage testing on the drug, ibrutinib. While many expect success--the treatment already is drawing comparisons to one of the most successful cancer drugs ever--some wonder if it's premature to give Pharmacyclics a $3.6 billion valuation and price the stock at 750 times future earnings, especially when the company doesn't own all of the drug's rights and the product won't hit the market until 2015 by analysts' estimates.
At such high valuation, "disappointments will inevitably emerge during the course of clinical development," Bernstein Research analyst Geoffrey C. Porges said. Pharmacyclics closed Friday at $49.99.
The company is targeting ibrutinib for several blood-cell cancers but, for now, is focusing its efforts on a blood and bone marrow cancer known as chronic lymphocytic leukemia, or CLL. The cancer causes certain abnormal white-blood cells to multiply out of control, eventually crowding out healthy cells in the blood. Ibrutinib attaches to an enzyme key to the development of the abnormal cells and shuts off its activity.
"We feel this has a multibillion-dollar revenue potential," Chief Medical Officer Lori Kunkel said at a health-care conference in January. In an email for this story, Ms. Kunkel called ibrutinib's activity unprecedented.
Among CLL patients who have failed standard chemotherapy, ibrutinib kept 88% alive without any cancer progression for a median, so far, of almost 18 months in a mid-stage study.
By comparison, the most recently approved agent in CLL, ofatumumab, has a progression-free-survival median of less than six months. And while a 2006 study found an overall tumor response rate of 58% at best with ofatumumab alone, 100% of the patients in a preliminary Pharmacyclics trial responded to treatment of ofatumumab and ibrutinib combined--and all were surviving with no cancer progression at a median follow-up of almost 10 months.
"It's eye-popping efficacy," Rodman & Renshaw analyst Michael King said.
In addition, ibrutinib has proven more durable than current treatments. It is a daily pill that early data show can be taken effectively for more than a year, and many analysts project can be taken for several. On the other hand, the standard CLL regimen--a combination chemotherapy and antibody therapy--is usually administered over the course of about six months.
Ibrutinib's impressive results have reminded some of Novartis AG's (NVS, NOVN.VX) blockbuster Gleevec, which was introduced in 2001 and quickly became the standard of care for people with another type of leukemia. Gleevec showed how targeting an underlying genetic defect could halt or delay progression of cancer and keep a large proportion of patients in remission for years.
The drug had world-wide sales of $4.66 billion last year.
Before ibrutinib gets any sales, it must get regulatory approval, which isn't seen until 2015 because the company has to complete a late-stage trial, analysts say. In a larger trial, the potential exists for unforeseen complications or weaker efficacy readings, Rodman analyst Michael King cautioned.
But Brian Skorney, an analyst at Brean Murray, Carret & Co., said such risks are overshadowed by ibrutinib's unusually strong results thus far. "The profile of the drug is so extraordinarily better, that even if the profile becomes a lot worse, it's still a major shift from what's out there," he said.
Notably absent is takeover speculation. Wedbush Securities Inc. analyst Greg Wade said the company is closely held: Five shareholders control half of it, including 20% by Chairman and Chief Executive Robert W. Duggan, and management has been vocal it wants Pharmacyclics to come into its own. The company's partnership with Johnson & Johnson (JNJ) also deters other potential suitors from making advances, he said.
Bernstein's Mr. Porges has raised concerns about the stock's runup and questioned whether the company was worth the valuation. The analyst noted that Pharmacyclics only holds about half the value of its one real asset because of the J&J partnership.
He added that Pharmacyclics's $3.6 billion market capitalization implies the drug is valued around $9 billion. Mr. Porges, though, pegs peak global sales at about $2.8 billion.
Other biotech companies with similar market capitalization have material advantages in comparison, Mr. Porges said. For example, Medivation Inc. (MDVN) is a $3.48 billion company that has a similar partnership on its prostate cancer drug but is only three months away from approval.
In addition, other companies are pursuing drugs that target the same enzyme, including developmental CLL drugs at Celgene Corp. (CELG), and Gilead Sciences Inc. (GILD), which seems to be moving faster with the studies of its GS-1101, Mr. Porges said.
"The market may not be big enough, soon enough, to support the revenue implied by the stock's recent valuation," he said.
Write to Joan E. Solsman at joan.solsman@dowjones.com
das Argument, dass man noch ein paar Jahre benötigt, halte ich für nicht ganz stichhaltig. Und 50% ist die Hälfte der weltweiten Umsätze. Das ist schon eine ganze Menge. Viele haben ja nur regionale Anteile.
Ich meine, ich hätte gelesen, dass PCYC ziemlich umfangreiche Patente bezügl. BTK-Hemmer hält und das vielleicht CELG damit noch Probleme bekommen könnte... zumindest könnte es nicht einfach so x andere BTK-Hemmer geben.
Was ist von dem zu halten, was einer bei iHub meint:
"Ibrutinib has showed great data as monotherapy or in combination therapy in relapsed and refractory CLL setting. However, IMO it is questionable for treatment naive CLL. Current SOC for 1st line has remarkable efficacy, tough but short term treatment period that induces long term remission for majority of patients. So it would be very difficult to design clinical trial in this setting, both size and duration, that shows superiority to SOC. This was my main argument why Ibrutinib to CLL is NOT Gleevec to CML. The other one is many newly diagnosed CLL don't need treatment at all because early treatment hasn't showed any benefit eventually.
FCR (fludarabine + cyclophosphamide + rituximab). LIke over 70% CR with median duration lasting 7 years."
ich denke, dass nur CLL nicht ausreichen würde.
gruß
Ich meine, ich hätte gelesen, dass PCYC ziemlich umfangreiche Patente bezügl. BTK-Hemmer hält und das vielleicht CELG damit noch Probleme bekommen könnte... zumindest könnte es nicht einfach so x andere BTK-Hemmer geben.
Was ist von dem zu halten, was einer bei iHub meint:
"Ibrutinib has showed great data as monotherapy or in combination therapy in relapsed and refractory CLL setting. However, IMO it is questionable for treatment naive CLL. Current SOC for 1st line has remarkable efficacy, tough but short term treatment period that induces long term remission for majority of patients. So it would be very difficult to design clinical trial in this setting, both size and duration, that shows superiority to SOC. This was my main argument why Ibrutinib to CLL is NOT Gleevec to CML. The other one is many newly diagnosed CLL don't need treatment at all because early treatment hasn't showed any benefit eventually.
FCR (fludarabine + cyclophosphamide + rituximab). LIke over 70% CR with median duration lasting 7 years."
ich denke, dass nur CLL nicht ausreichen würde.
gruß
Antwort auf Beitrag Nr.: 43.382.272 von Freizeitspekulant am 13.07.12 11:31:37Wie letzte Woche schon angesprochen ist der Kurs von Horizon Pharma (HZNP) seit meinem Verkauf bei 8,69 $ weiter zurückgekommen - zwar nicht bis in den Bereich der 6,30 bis 6,50 wie ich eigentlich dachte, aber für knapp unter 7 $ konnte man sich welche angeln.
Morgen ist PDUFA bei HZNP angesagt - daher habe ich die Chance heute bei knapp über 7 $ nochmals genutzt um mir welche ins Depot zu legen.
Meine Spekulation basiert hier auf ein sehr wahrscheinliches "Ja" seitens der FDA.
...mal sehen was dabei rauskommt...

Morgen ist PDUFA bei HZNP angesagt - daher habe ich die Chance heute bei knapp über 7 $ nochmals genutzt um mir welche ins Depot zu legen.
Meine Spekulation basiert hier auf ein sehr wahrscheinliches "Ja" seitens der FDA.
...mal sehen was dabei rauskommt...

Antwort auf Beitrag Nr.: 43.424.440 von Freizeitspekulant am 25.07.12 23:28:13Ob man die Aktie dann noch länger halten sollte, ist aber fraglich.
Hier ein sehr kritischer Beitrag:
http://seekingalpha.com/article/750481-debt-burden-makes-hor…
Hier ein sehr kritischer Beitrag:
http://seekingalpha.com/article/750481-debt-burden-makes-hor…
Bei Synta zeigen "Insider" eine Menge Vertrauen im Wert von 25,8 Mio. Dollar:
(lasst Taten sprechen! )
)
LEXINGTON, Mass., Jul 26, 2012 (BUSINESS WIRE) -- Synta Pharmaceuticals Corp. SNTA -0.15% today announced that it has entered into common stock subscription agreements with members of its Board of Directors for the sale of 3,976,702 shares of its common stock in a registered direct offering at a price of $6.49 per share, for gross proceeds of approximately $25.8 million. The shares were offered directly to the purchasers without a placement agent, underwriter, broker or dealer. The sale and issuance of the shares is expected to close on or about July 27, 2012.
(lasst Taten sprechen!
 )
)LEXINGTON, Mass., Jul 26, 2012 (BUSINESS WIRE) -- Synta Pharmaceuticals Corp. SNTA -0.15% today announced that it has entered into common stock subscription agreements with members of its Board of Directors for the sale of 3,976,702 shares of its common stock in a registered direct offering at a price of $6.49 per share, for gross proceeds of approximately $25.8 million. The shares were offered directly to the purchasers without a placement agent, underwriter, broker or dealer. The sale and issuance of the shares is expected to close on or about July 27, 2012.
ich frage mich der ganzen zeit über, wieso ausgerechnet jetzt der biotech- und pharmasektor so durch die decke geht.
hat hierzu jemand eine idee?
kann vielleicht die gesundheitsreform in den usa dafür verantwortlich sein?
hat hierzu jemand eine idee?
kann vielleicht die gesundheitsreform in den usa dafür verantwortlich sein?
Überraschende und negative Entwicklung bei ArQule:
ArQule Inc (NASDAQ:ARQL), co-developer of the tivantinib cancer treatment, received word from its Japanese partner Kyowa Hakko Kirin Co., that Kyowa has suspended patient enrollment in Asian trials due to safety concerns. An independent Safety Review Committee (SRC) suspects that the drug, which is in Phase III testing for non-small cell lung cancer (NSCLC), could be causing interstitial lung disease (ILD) in trial subjects. There has been an imbalance in cases of ILD in the two arms of the ATTENTION study (tivantinib vs. placebo). Patients already undergoing treatment will continue with the trial until further review can be completed. The same trial in the West (U.S., Canada, and Australia), called MARQUEE, has not revealed safety issues and already completed recruitment.
MARQUEE hat 1.000 Patienten rekrutiert und bisher ist da nichts aufgefallen. Verwirrend.
---------
Habe meine PCYC-Position diese Woche halbiert.
(Nicht wegen der ArQule-Sache, denn die kam danach, aber... man weiß ja nie, was alles passieren kann)
ArQule Inc (NASDAQ:ARQL), co-developer of the tivantinib cancer treatment, received word from its Japanese partner Kyowa Hakko Kirin Co., that Kyowa has suspended patient enrollment in Asian trials due to safety concerns. An independent Safety Review Committee (SRC) suspects that the drug, which is in Phase III testing for non-small cell lung cancer (NSCLC), could be causing interstitial lung disease (ILD) in trial subjects. There has been an imbalance in cases of ILD in the two arms of the ATTENTION study (tivantinib vs. placebo). Patients already undergoing treatment will continue with the trial until further review can be completed. The same trial in the West (U.S., Canada, and Australia), called MARQUEE, has not revealed safety issues and already completed recruitment.
MARQUEE hat 1.000 Patienten rekrutiert und bisher ist da nichts aufgefallen. Verwirrend.
---------
Habe meine PCYC-Position diese Woche halbiert.
(Nicht wegen der ArQule-Sache, denn die kam danach, aber... man weiß ja nie, was alles passieren kann)
Außerdem heute berichtenswert, dass Genmab ihren CD38 auslizensiert haben:
- Genmab licenses daratumumab to Janssen Biotech, Inc., one of the Janssen Pharmaceutical Companies of Johnson & Johnson
- $55 million upfront payment to Genmab
- Johnson & Johnson Development Corporation invests DKK 475 million (approx. $80 million) in new Genmab shares
- Total potential agreement value including upfront payment, equity investment and milestones in excess of $1.1 billion
Under the terms of the agreement, Genmab will grant Janssen an exclusive worldwide license to develop and commercialize daratumumab as well as a backup human CD38 antibody.
Under the terms of the agreement, Genmab will receive an upfront license fee of $55 million (approximately DKK 327 million) and Johnson & Johnson Development Corporation (JJDC) will invest DKK 475 million, (approximately $80 million) to subscribe for 5.4 million new shares of Genmab at a price of DKK 88 per share. Genmab's closing share price on August 29, 2012 was DKK 67.85. Genmab could also be entitled to up to $1 billion in development, regulatory and sales milestones, in addition to tiered double digit royalties. Janssen will be fully responsible for all costs associated with developing and commercializing daratumumab going forward, including the costs of two ongoing Phase I/II studies.
-------------
Eigentlich sehr gute Konditionen, aber für Genmab wäre eine Verpartnerung unter Vorbehalt bspw. der Vermarktungsrechte in europäischen Kernstaaten vielleicht doch der attraktivere Deal gewesen.
- Genmab licenses daratumumab to Janssen Biotech, Inc., one of the Janssen Pharmaceutical Companies of Johnson & Johnson
- $55 million upfront payment to Genmab
- Johnson & Johnson Development Corporation invests DKK 475 million (approx. $80 million) in new Genmab shares
- Total potential agreement value including upfront payment, equity investment and milestones in excess of $1.1 billion
Under the terms of the agreement, Genmab will grant Janssen an exclusive worldwide license to develop and commercialize daratumumab as well as a backup human CD38 antibody.
Under the terms of the agreement, Genmab will receive an upfront license fee of $55 million (approximately DKK 327 million) and Johnson & Johnson Development Corporation (JJDC) will invest DKK 475 million, (approximately $80 million) to subscribe for 5.4 million new shares of Genmab at a price of DKK 88 per share. Genmab's closing share price on August 29, 2012 was DKK 67.85. Genmab could also be entitled to up to $1 billion in development, regulatory and sales milestones, in addition to tiered double digit royalties. Janssen will be fully responsible for all costs associated with developing and commercializing daratumumab going forward, including the costs of two ongoing Phase I/II studies.
-------------
Eigentlich sehr gute Konditionen, aber für Genmab wäre eine Verpartnerung unter Vorbehalt bspw. der Vermarktungsrechte in europäischen Kernstaaten vielleicht doch der attraktivere Deal gewesen.
"Habe meine PCYC-Position diese Woche halbiert." ... hast du dafür andere Positionen aufgebaut? Vor einiger Zeit hat bei ihub einer die Frage gestellt, wer denn die nächste PCYC oder MDVN sein könnte. ARRY ist ja zuletzt ganz gut gelaufen. Ich werde wohl noch CLDX höher gewichten.
Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.559.300 von ipollit am 01.09.12 13:06:52Hallo ipollit,
bisher halte ich den Erlös zum größten Teil als Cash. Zum einen weil ich auf Deine Frage keine wirklich überzeugende Antwort weiß. Zum anderen, weil ich die wirtschaftlichen und politischen Risiken im kommenden Herbst/Winter für ganz besonders hoch halte (Iran, Ölpreis, Euro, Weltkonjunktur).
Aufgestockt habe ich dennoch etwas bei Galapagos, die danach prompt ins Fallen geraten sind. Da das bei all meinen Käufen erst mal so läuft, ist es mir aber egal.
Celldex finde ich ziemlich attraktiv. Ähnlich auch Synta. Bei beiden Werten kommen noch in diesem Jahr OS-Daten, die zeigen werden, ob man wirklich auf dem richtigen Weg ist. Wenn ja, dürfte das Potential beachtlich sein.
Dann noch eine Frage an Dich:
Du warst bei MorphoSys immer skeptisch, weil Du die Pipeline für zu unreif gehalten hast.
Und Du hattest recht damit.
Ändert sich Deine Einstellung jetzt langsam?
(Mein Bauchgefühl ist, dass in der Pipeline enormes Potential schlummert)
Gruß
bisher halte ich den Erlös zum größten Teil als Cash. Zum einen weil ich auf Deine Frage keine wirklich überzeugende Antwort weiß. Zum anderen, weil ich die wirtschaftlichen und politischen Risiken im kommenden Herbst/Winter für ganz besonders hoch halte (Iran, Ölpreis, Euro, Weltkonjunktur).
Aufgestockt habe ich dennoch etwas bei Galapagos, die danach prompt ins Fallen geraten sind. Da das bei all meinen Käufen erst mal so läuft, ist es mir aber egal.

Celldex finde ich ziemlich attraktiv. Ähnlich auch Synta. Bei beiden Werten kommen noch in diesem Jahr OS-Daten, die zeigen werden, ob man wirklich auf dem richtigen Weg ist. Wenn ja, dürfte das Potential beachtlich sein.
Dann noch eine Frage an Dich:
Du warst bei MorphoSys immer skeptisch, weil Du die Pipeline für zu unreif gehalten hast.
Und Du hattest recht damit.
Ändert sich Deine Einstellung jetzt langsam?
(Mein Bauchgefühl ist, dass in der Pipeline enormes Potential schlummert)
Gruß
Bei Galapagos bin ich noch nicht dabei, finde insbesondere GLPG0634 aber auch recht interessant. JAK1 scheint kein schlechtes Target zu sein, während JAK3 eventuell Probleme macht:
www.crosscurrentllc.com/uploads/LLY_4-25-12_Some_Upcoming_Pi…
"By inhibiting JAK1 to a higher degree, '050 could potentially lead to more inhibition of IL6. Inhibition of IL6 tends to lead toward patients feeling better in their mood. That's a big reason why Roche's Actemra (an IL6 inhibitor) does quite well in the marketplace."
www.crosscurrentllc.com/uploads/PFE_5-8-12_tofa_briefing_doc…
"Tofacitinib has serious safety issues. Most prominent is an increased incidence of malignancy. It also causes serious infections, including infections leading to death... the incidence of cancer increases with the length of a patient being exposed to a drug... The rate starts to take off with one year of exposure, and further increases with 2 years of exposure... the RA patients will potentially take the drug for decades. Serious infections are also associated with lymphopenia, which raises the question whether it was a mistake from the beginning for PFE to design the drug with heavy inhibition of JAK3, instead of limiting the JAK inhibition to JAK1 and JAK2. JAK3 inhibition is related to bone marrow suppression."
Ich bin auch mal gespannt, ob RIGL Fostamatinib als Alternative zu JAKs erfolgreich sein wird. Das Sentiment bezügl. RIGL ist meiner Meinung nach eher negativ... die ersten PIII-Ergebnisse kommen Ende des Jahres, wobei wenn ich mich recht erinnere es als erstes die etwas problematischen Ergebnisse bei TNF-Resitenz sein werden, die auch so enttäuschend wie die PII ausfallen können.
Bei CLDX gefällt mir, dass sie auch noch andere potentiell aussichtsreiche Programme haben. Z.B. CDX1127, das ähnlich wie PD-1 auf das Immunsystem wirkt, allerdings wohl stimulierend, während PD-1 (soweit ich es verstehe) eher die Dämmpfung aufhebt. Oder CDX-1135, was etwas in der Art von ALXNs Solaris ist
www.crosscurrentllc.com/uploads/CLDX_8-10-12_A_Look_at_the_B…
"Recently, Bristol (BMY) got a lot of attention for PD-1 and PD-1L antibodies. Not only does
Bristol's PD-1 program and the success on Yervoy trace back to a common lineage with Celldex
to Medarex, CLDX potentially has a better molecule. CDX-1127 activates CD27 expressing T cells.
As a cancer immunotherapy, CDX-1127 could provide an angle as an alternative to PD-1
blockage. In addition, because the drug targets CD27 directly, it can also be effective in treating
lymphoma. The Phase 1 trial currently underway is assessing both the drug in solid tumor as
immunotherapy, as well as a direct treatment for lymphoma."
Ohad Hammer sieht CDX-1127 auch positiv:
"cd1127 is a Cd27 agonist, i like this agent due to the strong scientific rationale and the fact it is an immunomodulating antibody. They just put it in phase I so preliminary data should be available next year."
Zuletzt habe ich auch EXEL aufgestockt. Steckt in Carbo nicht mehr Potential, als momentan im Kurs eingepreist ist? Ein wenig verunsichert hat mich nur das wieder abgesagte Panel, was aber vielleicht eher neutral zu werten ist. Ähnliches überlege ich auch bei ARQL... sind die Sicherheitsbedenken bezügl Tivantinib nicht etwas übertrieben? Offensichtlich scheint diese Problem in Asien auch bei anderen Mitteln zu bestehen, ohne dass dies zu einem weltweiten Stopp geführt hätte.
In ihub wurden diese 3 auch als aussichtsreich genannt:
"Seriously, I think EXEL's Cabozantinib has the potential. Enough data are out there showing strong activity across several tumor types. EXEL is certainly in a dog house now. I don't follow the crowds much. To me, the question is whether by themselves they can develop the drug to its full potential. It took them many years to find appropriate dose LOL!
ARQL's Tivantinib has potential in combination with other targeted small molecules. MET is a legitimate target. I'd like to see it combined with another strong VEGF inhibitor given Cabozantinib's data. The question - discussed here before - is whether ph3 in combination with Tarceva in non-squamous NSCLC without testing MET biomarker pans out.
CLDX's CDX011 has potential. The question is whether 25% GPNMB should be the cutoff for the patient population. They need a partner. It's even tougher to develop biomarker based biologic for a small biotech.
These all have question marks around them which is why they are where they are now. Unlike many others who like to hear only positives on the companies they like, I like to explore all negatives out there to see downside risk."
Ansonsten halte ich auch ARRY und SNTA für aussichtsreich. Vielleicht auch noch AVEO.
Bei MDVN war ich leider nie dabei... vielleicht steckt nach der Zulassung hier ebenfalls noch Potential.
Morphosys habe ich mir nicht mehr so genau angesehen. Mir hat damals nicht so gefallen, dass im Erfolgsfall nur kleine Royalties von 3-5% zu erwarten sind. Gibt es denn inzwischen mehrere aussichtsreiche Kandidaten in der Pipeline?
Gruß
www.crosscurrentllc.com/uploads/LLY_4-25-12_Some_Upcoming_Pi…
"By inhibiting JAK1 to a higher degree, '050 could potentially lead to more inhibition of IL6. Inhibition of IL6 tends to lead toward patients feeling better in their mood. That's a big reason why Roche's Actemra (an IL6 inhibitor) does quite well in the marketplace."
www.crosscurrentllc.com/uploads/PFE_5-8-12_tofa_briefing_doc…
"Tofacitinib has serious safety issues. Most prominent is an increased incidence of malignancy. It also causes serious infections, including infections leading to death... the incidence of cancer increases with the length of a patient being exposed to a drug... The rate starts to take off with one year of exposure, and further increases with 2 years of exposure... the RA patients will potentially take the drug for decades. Serious infections are also associated with lymphopenia, which raises the question whether it was a mistake from the beginning for PFE to design the drug with heavy inhibition of JAK3, instead of limiting the JAK inhibition to JAK1 and JAK2. JAK3 inhibition is related to bone marrow suppression."
Ich bin auch mal gespannt, ob RIGL Fostamatinib als Alternative zu JAKs erfolgreich sein wird. Das Sentiment bezügl. RIGL ist meiner Meinung nach eher negativ... die ersten PIII-Ergebnisse kommen Ende des Jahres, wobei wenn ich mich recht erinnere es als erstes die etwas problematischen Ergebnisse bei TNF-Resitenz sein werden, die auch so enttäuschend wie die PII ausfallen können.
Bei CLDX gefällt mir, dass sie auch noch andere potentiell aussichtsreiche Programme haben. Z.B. CDX1127, das ähnlich wie PD-1 auf das Immunsystem wirkt, allerdings wohl stimulierend, während PD-1 (soweit ich es verstehe) eher die Dämmpfung aufhebt. Oder CDX-1135, was etwas in der Art von ALXNs Solaris ist
www.crosscurrentllc.com/uploads/CLDX_8-10-12_A_Look_at_the_B…
"Recently, Bristol (BMY) got a lot of attention for PD-1 and PD-1L antibodies. Not only does
Bristol's PD-1 program and the success on Yervoy trace back to a common lineage with Celldex
to Medarex, CLDX potentially has a better molecule. CDX-1127 activates CD27 expressing T cells.
As a cancer immunotherapy, CDX-1127 could provide an angle as an alternative to PD-1
blockage. In addition, because the drug targets CD27 directly, it can also be effective in treating
lymphoma. The Phase 1 trial currently underway is assessing both the drug in solid tumor as
immunotherapy, as well as a direct treatment for lymphoma."
Ohad Hammer sieht CDX-1127 auch positiv:
"cd1127 is a Cd27 agonist, i like this agent due to the strong scientific rationale and the fact it is an immunomodulating antibody. They just put it in phase I so preliminary data should be available next year."
Zuletzt habe ich auch EXEL aufgestockt. Steckt in Carbo nicht mehr Potential, als momentan im Kurs eingepreist ist? Ein wenig verunsichert hat mich nur das wieder abgesagte Panel, was aber vielleicht eher neutral zu werten ist. Ähnliches überlege ich auch bei ARQL... sind die Sicherheitsbedenken bezügl Tivantinib nicht etwas übertrieben? Offensichtlich scheint diese Problem in Asien auch bei anderen Mitteln zu bestehen, ohne dass dies zu einem weltweiten Stopp geführt hätte.
In ihub wurden diese 3 auch als aussichtsreich genannt:
"Seriously, I think EXEL's Cabozantinib has the potential. Enough data are out there showing strong activity across several tumor types. EXEL is certainly in a dog house now. I don't follow the crowds much. To me, the question is whether by themselves they can develop the drug to its full potential. It took them many years to find appropriate dose LOL!
ARQL's Tivantinib has potential in combination with other targeted small molecules. MET is a legitimate target. I'd like to see it combined with another strong VEGF inhibitor given Cabozantinib's data. The question - discussed here before - is whether ph3 in combination with Tarceva in non-squamous NSCLC without testing MET biomarker pans out.
CLDX's CDX011 has potential. The question is whether 25% GPNMB should be the cutoff for the patient population. They need a partner. It's even tougher to develop biomarker based biologic for a small biotech.
These all have question marks around them which is why they are where they are now. Unlike many others who like to hear only positives on the companies they like, I like to explore all negatives out there to see downside risk."
Ansonsten halte ich auch ARRY und SNTA für aussichtsreich. Vielleicht auch noch AVEO.
Bei MDVN war ich leider nie dabei... vielleicht steckt nach der Zulassung hier ebenfalls noch Potential.
Morphosys habe ich mir nicht mehr so genau angesehen. Mir hat damals nicht so gefallen, dass im Erfolgsfall nur kleine Royalties von 3-5% zu erwarten sind. Gibt es denn inzwischen mehrere aussichtsreiche Kandidaten in der Pipeline?
Gruß
Antwort auf Beitrag Nr.: 43.559.300 von ipollit am 01.09.12 13:06:52Also ich kann euch Celsion (CLSN) empfehlen die erwarten Phase 3 daten für ihr Leberkrebs Studie gegen ende des Jahres .
Die Chancen auf positive daten sind sehr gut und ein weiterer pluspunkt ist das Celsion immernoch die Weltweiten Rechte an Thermodox außer Japan hält .
Die Marktkapital. ist brutalst niedrig für ein Unternehmen das kurz vor der Zulassung eines Blockbusters steht .
Celsion ist definitiv eines der besten Hot Picks für 2012 mit vervielfachungspotential !
Marktkap: $150 M
Kurs: $4.50
Management ist bisher auch nur auf der Käuferseit
http://www.secform4.com/insider-trading/749647.htm
Artikel
http://finance.townhall.com/columnists/davidsterman/2012/08/…

Die Chancen auf positive daten sind sehr gut und ein weiterer pluspunkt ist das Celsion immernoch die Weltweiten Rechte an Thermodox außer Japan hält .
Die Marktkapital. ist brutalst niedrig für ein Unternehmen das kurz vor der Zulassung eines Blockbusters steht .
Celsion ist definitiv eines der besten Hot Picks für 2012 mit vervielfachungspotential !
Marktkap: $150 M
Kurs: $4.50
Management ist bisher auch nur auf der Käuferseit
http://www.secform4.com/insider-trading/749647.htm
Artikel
http://finance.townhall.com/columnists/davidsterman/2012/08/…

Antwort auf Beitrag Nr.: 43.560.957 von ipollit am 02.09.12 17:35:02Hallo ipollit,
heute nur zu MorphoSys:
Bei MorphoSys ist die Pipeline leider noch immer ein Eisberg oder gleich ganz ein U-Boot. Es gibt noch überhaupt keine Daten, die irgendwo einen Pfad zur Zulassung aufzeigen würden.
Aber mein Punkt ist, dass ich denke, dass sich das in den nächsten 24 Monaten ändern wird und dass dann die Pipeline langsam eingepreist werden wird, was zu einer deutlich höheren Bewertung führen sollte.
Insofern kann man als Investor versuchen, das zu antizipieren, indem man schon jetzt einsteigt, auch auf die Gefahr hin, vielleicht doch zu früh zu kommen.
Bei der Partnerpipe bin ich besonders auf das Novartis-Programm BPS-804 (Target Sclerostin) gespannt. Hier könnte ein Wirkstoff gegen Osteoporose in der Mache sein, was grundsätzlich Blockbuster-Potential haben könnte. Bisher wird aber vor allem für Nischenanwendungen entwickelt.
Es gibt auch Konkurrenz von UCB/Amgen, die zeitlich leider etwas voraus ist.
Dazu kommt – und das ist typisch für die Mor-Pipe – dass dieses Programm bisher von Novartis gar nicht offiziell kommuniziert wird.
Ich hoffe aber, dass wir nächstes Jahr über dieses Programm viel Interessantes hören werden.
Ich gehe allgemein davon aus, dass aus der Partnerpipeline bis Ende 2014 bis zu 3 Programme in die P III wechseln werden (Kandidaten könnten sein BPS-804, BYM-338, CNTO1959 oder vielleicht LFG316). Den laut MorphoSys bereits in einer PIII (in Wahrheit eine PIIb mit pivotal-Qualität) befindlichen Alzheimer-Kandidaten Gantenerumab werde ich hingegen konsequent ignorieren, bis da Daten kommen (avisiert 2017).
Insgesamt glaube ich, dass in der Partnerpipe viel verborgener Wert steckt.
Dann zur Eigenpipe:
Bisher gibt es eigentlich überhaupt keine relevanten klinischen Daten.
Für das erste Programm MOR103 wird sich das noch in diesem Monat ändern. Dann kommen Daten aus einer Ib/IIa-Studie in RA.
Interessant ist an dem Programm das Target GM-CSF. Endlich mal kein „me-too-Ansatz“. Das Target wird als valide eingeschätzt. Safety könnte hier die Frage werden.
Insgesamt brenne ich nicht für MOR103, sehe aber durchaus ein gewisses Potential.
Dann kommen Ende diesen Jahres P I-Daten von MOR208 (Erprobung am Patienten, Indikation CLL). Das Target ist CD19. Der Antikörper ist Fc-modifiziert, wovon man sich höhere Effektivität verspricht.
Das Target ist definitiv interessant und der Antikörper hat etwas Besonderes.
Das dritte Programm ist MOR202. Da kommen leider erst 2015 relevante Daten. Das Target CD-38 ist uns seit kurzem ja geläufig (Genmab mit Daratumumab). Vielleicht das interessanteste Programm der Eigenpipe?
Mein Fazit:
Drei eigene Entwicklungen, bei denen zumindest die Targets interessant sind.
Daneben 16 Partnerprogramme in der Klinik.
Keine Verluste, positiver Cash-Flow.
Marktkapitalisierung: 464 Millionen Euro, davon 130 Millionen Cash unterlegt.
Sehe aufgrund des Geschäftsmodells und der reifenden Partnerpipe auf mittlere und lange Sicht kaum Risiko.
Wenn ein Projekt der Eigenpipe ein Erfolg wird, ist das Potential hingegen sehr beachtlich.
Und jetzt nähern wir uns eben einigen inflection points…
Gruß
heute nur zu MorphoSys:
Bei MorphoSys ist die Pipeline leider noch immer ein Eisberg oder gleich ganz ein U-Boot. Es gibt noch überhaupt keine Daten, die irgendwo einen Pfad zur Zulassung aufzeigen würden.
Aber mein Punkt ist, dass ich denke, dass sich das in den nächsten 24 Monaten ändern wird und dass dann die Pipeline langsam eingepreist werden wird, was zu einer deutlich höheren Bewertung führen sollte.
Insofern kann man als Investor versuchen, das zu antizipieren, indem man schon jetzt einsteigt, auch auf die Gefahr hin, vielleicht doch zu früh zu kommen.
Bei der Partnerpipe bin ich besonders auf das Novartis-Programm BPS-804 (Target Sclerostin) gespannt. Hier könnte ein Wirkstoff gegen Osteoporose in der Mache sein, was grundsätzlich Blockbuster-Potential haben könnte. Bisher wird aber vor allem für Nischenanwendungen entwickelt.
Es gibt auch Konkurrenz von UCB/Amgen, die zeitlich leider etwas voraus ist.
Dazu kommt – und das ist typisch für die Mor-Pipe – dass dieses Programm bisher von Novartis gar nicht offiziell kommuniziert wird.
Ich hoffe aber, dass wir nächstes Jahr über dieses Programm viel Interessantes hören werden.
Ich gehe allgemein davon aus, dass aus der Partnerpipeline bis Ende 2014 bis zu 3 Programme in die P III wechseln werden (Kandidaten könnten sein BPS-804, BYM-338, CNTO1959 oder vielleicht LFG316). Den laut MorphoSys bereits in einer PIII (in Wahrheit eine PIIb mit pivotal-Qualität) befindlichen Alzheimer-Kandidaten Gantenerumab werde ich hingegen konsequent ignorieren, bis da Daten kommen (avisiert 2017).
Insgesamt glaube ich, dass in der Partnerpipe viel verborgener Wert steckt.
Dann zur Eigenpipe:
Bisher gibt es eigentlich überhaupt keine relevanten klinischen Daten.
Für das erste Programm MOR103 wird sich das noch in diesem Monat ändern. Dann kommen Daten aus einer Ib/IIa-Studie in RA.
Interessant ist an dem Programm das Target GM-CSF. Endlich mal kein „me-too-Ansatz“. Das Target wird als valide eingeschätzt. Safety könnte hier die Frage werden.
Insgesamt brenne ich nicht für MOR103, sehe aber durchaus ein gewisses Potential.
Dann kommen Ende diesen Jahres P I-Daten von MOR208 (Erprobung am Patienten, Indikation CLL). Das Target ist CD19. Der Antikörper ist Fc-modifiziert, wovon man sich höhere Effektivität verspricht.
Das Target ist definitiv interessant und der Antikörper hat etwas Besonderes.
Das dritte Programm ist MOR202. Da kommen leider erst 2015 relevante Daten. Das Target CD-38 ist uns seit kurzem ja geläufig (Genmab mit Daratumumab). Vielleicht das interessanteste Programm der Eigenpipe?
Mein Fazit:
Drei eigene Entwicklungen, bei denen zumindest die Targets interessant sind.
Daneben 16 Partnerprogramme in der Klinik.
Keine Verluste, positiver Cash-Flow.
Marktkapitalisierung: 464 Millionen Euro, davon 130 Millionen Cash unterlegt.
Sehe aufgrund des Geschäftsmodells und der reifenden Partnerpipe auf mittlere und lange Sicht kaum Risiko.
Wenn ein Projekt der Eigenpipe ein Erfolg wird, ist das Potential hingegen sehr beachtlich.
Und jetzt nähern wir uns eben einigen inflection points…
Gruß
Antwort auf Beitrag Nr.: 43.560.957 von ipollit am 02.09.12 17:35:02Hallo ipollit,
Zuletzt habe ich auch EXEL aufgestockt. Steckt in Carbo nicht mehr Potential, als momentan im Kurs eingepreist ist? Ein wenig verunsichert hat mich nur das wieder abgesagte Panel, was aber vielleicht eher neutral zu werten ist. Ähnliches überlege ich auch bei ARQL... sind die Sicherheitsbedenken bezügl Tivantinib nicht etwas übertrieben? Offensichtlich scheint diese Problem in Asien auch bei anderen Mitteln zu bestehen, ohne dass dies zu einem weltweiten Stopp geführt hätte.
Cabo ist wahrscheinlich eines der merkwürdigsten Programme ever.
Schon von 2 Partnern zurückgegeben und dann plötzlich einen schwer erklärbaren und ziemlich einzigartigen Effekt auf Knochenmetastasen. Eigentlich ein Durchbruch, aber dann die offene Frage, ob das einen Effekt auf OS hat. Sonst nützt das ja alles nicht viel.
Das abgesagte Panel interpretiere ich in diesem Fall eindeutig positiv. Ich rechne mit 90% Wahrscheinlichkeit mit einer Zulassung für MTC.
Wie wir beide wissen, muss Cabo aber in anderen Indikationen zugelassen werden, um ökonomisch erfolgreich zu sein. Konkret: Prostata-Krebs.
Ich selbst wage es nicht, meine Position aufzustocken. Mir ist das Bild nicht klar genug.
Bei der Gelegenheit: MDVN habe ich komplett verpasst und will es nun eigentlich dabei belassen.
Tivantinib hat mich doch etwas geschockt. Ich finde es interessant, dass Du da ein generelles "Asien-Problem" ins Kalkül ziehst.
Mir ist/war nicht bekannt, dass so etwas schon früher vorgekommen ist.
Dennoch bleibe ich jetzt erst mal skeptisch. Meine ARQL-Position werde ich halten, derzeit aber nicht ausbauen.
Gruß
Zuletzt habe ich auch EXEL aufgestockt. Steckt in Carbo nicht mehr Potential, als momentan im Kurs eingepreist ist? Ein wenig verunsichert hat mich nur das wieder abgesagte Panel, was aber vielleicht eher neutral zu werten ist. Ähnliches überlege ich auch bei ARQL... sind die Sicherheitsbedenken bezügl Tivantinib nicht etwas übertrieben? Offensichtlich scheint diese Problem in Asien auch bei anderen Mitteln zu bestehen, ohne dass dies zu einem weltweiten Stopp geführt hätte.
Cabo ist wahrscheinlich eines der merkwürdigsten Programme ever.
Schon von 2 Partnern zurückgegeben und dann plötzlich einen schwer erklärbaren und ziemlich einzigartigen Effekt auf Knochenmetastasen. Eigentlich ein Durchbruch, aber dann die offene Frage, ob das einen Effekt auf OS hat. Sonst nützt das ja alles nicht viel.
Das abgesagte Panel interpretiere ich in diesem Fall eindeutig positiv. Ich rechne mit 90% Wahrscheinlichkeit mit einer Zulassung für MTC.
Wie wir beide wissen, muss Cabo aber in anderen Indikationen zugelassen werden, um ökonomisch erfolgreich zu sein. Konkret: Prostata-Krebs.
Ich selbst wage es nicht, meine Position aufzustocken. Mir ist das Bild nicht klar genug.
Bei der Gelegenheit: MDVN habe ich komplett verpasst und will es nun eigentlich dabei belassen.
Tivantinib hat mich doch etwas geschockt. Ich finde es interessant, dass Du da ein generelles "Asien-Problem" ins Kalkül ziehst.
Mir ist/war nicht bekannt, dass so etwas schon früher vorgekommen ist.
Dennoch bleibe ich jetzt erst mal skeptisch. Meine ARQL-Position werde ich halten, derzeit aber nicht ausbauen.
Gruß
zu ARQL...
Ich interpretiere es so, dass ILD nicht so ungewöhnlich bei Lungenkrebs ist und auch andere Mittel wie z.B. Traceva einen negativen Einfluss auf ILD haben. Zudem scheint ILD besonders Asien zu betreffen. Warum ist es bisher in keiner anderen Studie als Problem aufgetreten? Die asiatische, noch nicht voll ausgerollte ATTENTION Studie ist anscheinend weniger als halb so groß als die westliche MARQUEE, die bereits alle geplanten Patienten aufgenommen hat. Hätte nicht für MARQUEE etwas ähnliches bemerkt und gemeldet werden müssen, wenn es dort das gleiche Problem gibt? Zudem ist ATTENTION ja nicht gestoppt, sondern nur die Aufnahme weiterer Patienten, bis man sich das ganze genauer angesehen hat. Wenn es dort ein eindeutig gravierendes Problem mit ILD geben würde, hätte man die Studie nicht komplett abbrechen müssen?
Ein anderes Problem könnte sein, dass MARQUEE wohl nicht nur MET+ Patienten, sondern auch MET- Patienten enthält. Zuletzt hat sich immer gezeigt, dass MET-Hemmer bei MET- einen negativen Effekt haben, so dass die Studie vielleicht fehlschlägt, wenn zuviele MET- enthalten sind. Z.B. http://www.roche.com/ir_day-2012_hb.pdf... Folie 26.
www.thestreet.com/story/11679234/1/arqule-shares-slide-on-lu…
The ATTENTION study is being conducted in three Asian countries to determine whether the combination of tivantinib plus Tarceva can prolong survival compared to Tarceva alone in patients with non-small cell lung cancer. Tarceva is a currently approved treatment for lung cancer marketed by Roche and Astellas.
ILD is a group of diseases characterized by progressive scarring of the lungs, which over time can impair a person's ability to breathe.
Safety concerns about ILD have not affected a separate phase III lung cancer study of tivantinib dubbed "MARQUEE" which completed enrollment in May and enrolled 1,000 patients in the U.S. and Europe.
"Incidence of ILD-related events in MARQUEE is comparable to reported experience in the West and published literature for [Tarceva] treatment," said Arqule spokesman Bill Boni, adding that ILD has not been reported as a safety concern in past studies of tivantinib.
ILD is listed as a reported adverse event in Tarceva'a FDA-approved label and incidences of ILD were reported in 4.5% of Japanese lung cancer patients treated with Tarceva, according to an August post-marketing surveillance study published in the Journal of Thoracic Oncology.
Arqule and partner Daiichi Sankyo, which is running the "MARQUEE" study of tivantinib, expect to report results from an interim survival analysis later this fall.
********
finance.yahoo.com/news/propthink-arqule-setback-increases-ri…
ArQule Inc (ARQL), co-developer of the tivantinib cancer treatment, received word from its Japanese partner Kyowa Hakko Kirin Co., that Kyowa has suspended patient enrollment in Asian trials due to safety concerns. An independent Safety Review Committee (SRC) suspects that the drug, which is in Phase III testing for non-small cell lung cancer (NSCLC), could be causing interstitial lung disease (ILD) in trial subjects. There has been an imbalance in cases of ILD in the two arms of the ATTENTION study (tivantinib vs. placebo). Patients already undergoing treatment will continue with the trial until further review can be completed. The same trial in the West (U.S., Canada, and Australia), called MARQUEE, has not revealed safety issues and already completed recruitment. Management guides for interim data by year`s end, with data from ATTENTION in 2013. ArQule develops the product with Daiichi Sankyo (DSNKY) in the U.S.
Shares declined in early trading by 25% and should fluctuate around $5 until ArQule releases further data. If tivantinib proves to have similar issues of ILD in the MARQUEE trial, per the concerns of the SRC, chances of continued development as a lung cancer treatment are small. In January, ArQule reported that the drug met its primary endpoint of extending time to progression in a Phase 2 trial against Hepatocellular Carcinoma (HCC), a cancer of the liver. Shares at the time rose accordingly and set a new 52-week high over $8 and ArQule is now preparing for a Phase 3 trial for HCC. With a strong balance sheet and consistent R&D revenue over the last two years, ArQule can handle some setbacks as long as its lead candidate continues in trials. It is notable that in Japan the patient population in the ATTENTION trial does have existing predisposition to ILD. Some analysts are defending the stock because there has not been an imbalance in the MARQUEE trial to date, but due to the new potential risk of ILD, some are increasing their discount rate. Target prices remain around $10, but the downside risks are strong enough to stay away from ARQL until safety concerns are resolved.
*******
www.ncbi.nlm.nih.gov/pubmed/18337594
ILD was relatively common in these Japanese patients with NSCLC during therapy with gefitinib or chemotherapy, being higher in the older, smoking patient with preexisting ILD or poor performance status. The risk of developing ILD was higher with gefitinib than chemotherapy, mainly in the first 4 weeks
**********
Erlotinib has been suspected of causing interstitial lung disease (ILD), especially in the Asian population.
The Tarceva Label States:
There have been reports of serious interstitial lung disease (ILD)-like events, including fatalities, in patients receiving Tarceva. In the advanced NSCLC studies, the incidence of serious ILD-like events in the Tarceva-treated patients vs placebo-treated patients was 0.7% vs 0% in the maintenance study and 0.8% for both groups in the 2nd/3rd line study.
In the advanced pancreatic cancer study, the incidence was 2.5% in the Tarceva/gemcitabine group vs 0.4% in the placebo/gemcitabine arm. The overall incidence of ILD-like events in approximately 32,000 Tarceva-treated patients from all studies (including uncontrolled studies and studies with concurrent chemotherapy) was approximately 1.1%.
Reported diagnoses in patients suspected of having ILD-like events included pneumonitis, radiation pneumonitis, hypersensitivity pneumonitis, interstitial pneumonia, ILD, obliterative bronchiolitis, pulmonary fibrosis, acute respiratory distress syndrome, and lung infiltration. Symptoms started from 5 days to more than 9 months (median 39 days) after initiating Tarceva therapy.
Tarceva should be interrupted for acute onset of new or progressive unexplained pulmonary symptoms such as dyspnea, cough, and fever, and if ILD is diagnosed, Tarceva should be discontinued and appropriate treatment instituted as needed.
***********
What's the sample size (not listed on ct.gov) in the ATTENTION trial? Since it's only an east asian regional trial in Japan, Korea and Taiwan, I expect it to be small and the ILD safety signal to be unreliable and not generalizable to Caucasians. The silver lining seems to me is that Marquee, n=1000 has been ongoing for over a year- and has yet to identify ILD as a risk. Neither did the completed Phase II. Seems to me a buying opportunity.
*******
460 patients total in the trial.
I'll say ~300 so far based on enrollment start and expected end.
The signal (the imbalance) should be large enough to justify a review.
Yet another (yet maybe convoluted) argument that points to the conclusion that the tivantinib is active.
*********
twitter.com/maverickny
Sally Church ?@MaverickNY
Not sure why peeps are panicking abt ILD w/ $arql tivantinib; it's a known problem w/ Asian patients & EGFRi related Tx http://icar.us/Ox6jGN
ILD is more common in Asians on EGFRi so would expect to see it in the Attention study not Marquee
After all, c-MET receptor activation is associated with poor prognosis and EGFR TKI resistance in NSCLC, so ILD is not a surprise
*********
twitter.com/adamfeuerstein
Adam Feuerstein ?@adamfeuerstein
@ColfaxCapital all ph3 studies have indpt safety monitors. As far as we know, no concerns w/ MARQUEE.
Gruß
Ich interpretiere es so, dass ILD nicht so ungewöhnlich bei Lungenkrebs ist und auch andere Mittel wie z.B. Traceva einen negativen Einfluss auf ILD haben. Zudem scheint ILD besonders Asien zu betreffen. Warum ist es bisher in keiner anderen Studie als Problem aufgetreten? Die asiatische, noch nicht voll ausgerollte ATTENTION Studie ist anscheinend weniger als halb so groß als die westliche MARQUEE, die bereits alle geplanten Patienten aufgenommen hat. Hätte nicht für MARQUEE etwas ähnliches bemerkt und gemeldet werden müssen, wenn es dort das gleiche Problem gibt? Zudem ist ATTENTION ja nicht gestoppt, sondern nur die Aufnahme weiterer Patienten, bis man sich das ganze genauer angesehen hat. Wenn es dort ein eindeutig gravierendes Problem mit ILD geben würde, hätte man die Studie nicht komplett abbrechen müssen?
Ein anderes Problem könnte sein, dass MARQUEE wohl nicht nur MET+ Patienten, sondern auch MET- Patienten enthält. Zuletzt hat sich immer gezeigt, dass MET-Hemmer bei MET- einen negativen Effekt haben, so dass die Studie vielleicht fehlschlägt, wenn zuviele MET- enthalten sind. Z.B. http://www.roche.com/ir_day-2012_hb.pdf... Folie 26.
www.thestreet.com/story/11679234/1/arqule-shares-slide-on-lu…
The ATTENTION study is being conducted in three Asian countries to determine whether the combination of tivantinib plus Tarceva can prolong survival compared to Tarceva alone in patients with non-small cell lung cancer. Tarceva is a currently approved treatment for lung cancer marketed by Roche and Astellas.
ILD is a group of diseases characterized by progressive scarring of the lungs, which over time can impair a person's ability to breathe.
Safety concerns about ILD have not affected a separate phase III lung cancer study of tivantinib dubbed "MARQUEE" which completed enrollment in May and enrolled 1,000 patients in the U.S. and Europe.
"Incidence of ILD-related events in MARQUEE is comparable to reported experience in the West and published literature for [Tarceva] treatment," said Arqule spokesman Bill Boni, adding that ILD has not been reported as a safety concern in past studies of tivantinib.
ILD is listed as a reported adverse event in Tarceva'a FDA-approved label and incidences of ILD were reported in 4.5% of Japanese lung cancer patients treated with Tarceva, according to an August post-marketing surveillance study published in the Journal of Thoracic Oncology.
Arqule and partner Daiichi Sankyo, which is running the "MARQUEE" study of tivantinib, expect to report results from an interim survival analysis later this fall.
********
finance.yahoo.com/news/propthink-arqule-setback-increases-ri…
ArQule Inc (ARQL), co-developer of the tivantinib cancer treatment, received word from its Japanese partner Kyowa Hakko Kirin Co., that Kyowa has suspended patient enrollment in Asian trials due to safety concerns. An independent Safety Review Committee (SRC) suspects that the drug, which is in Phase III testing for non-small cell lung cancer (NSCLC), could be causing interstitial lung disease (ILD) in trial subjects. There has been an imbalance in cases of ILD in the two arms of the ATTENTION study (tivantinib vs. placebo). Patients already undergoing treatment will continue with the trial until further review can be completed. The same trial in the West (U.S., Canada, and Australia), called MARQUEE, has not revealed safety issues and already completed recruitment. Management guides for interim data by year`s end, with data from ATTENTION in 2013. ArQule develops the product with Daiichi Sankyo (DSNKY) in the U.S.
Shares declined in early trading by 25% and should fluctuate around $5 until ArQule releases further data. If tivantinib proves to have similar issues of ILD in the MARQUEE trial, per the concerns of the SRC, chances of continued development as a lung cancer treatment are small. In January, ArQule reported that the drug met its primary endpoint of extending time to progression in a Phase 2 trial against Hepatocellular Carcinoma (HCC), a cancer of the liver. Shares at the time rose accordingly and set a new 52-week high over $8 and ArQule is now preparing for a Phase 3 trial for HCC. With a strong balance sheet and consistent R&D revenue over the last two years, ArQule can handle some setbacks as long as its lead candidate continues in trials. It is notable that in Japan the patient population in the ATTENTION trial does have existing predisposition to ILD. Some analysts are defending the stock because there has not been an imbalance in the MARQUEE trial to date, but due to the new potential risk of ILD, some are increasing their discount rate. Target prices remain around $10, but the downside risks are strong enough to stay away from ARQL until safety concerns are resolved.
*******
www.ncbi.nlm.nih.gov/pubmed/18337594
ILD was relatively common in these Japanese patients with NSCLC during therapy with gefitinib or chemotherapy, being higher in the older, smoking patient with preexisting ILD or poor performance status. The risk of developing ILD was higher with gefitinib than chemotherapy, mainly in the first 4 weeks
**********
Erlotinib has been suspected of causing interstitial lung disease (ILD), especially in the Asian population.
The Tarceva Label States:
There have been reports of serious interstitial lung disease (ILD)-like events, including fatalities, in patients receiving Tarceva. In the advanced NSCLC studies, the incidence of serious ILD-like events in the Tarceva-treated patients vs placebo-treated patients was 0.7% vs 0% in the maintenance study and 0.8% for both groups in the 2nd/3rd line study.
In the advanced pancreatic cancer study, the incidence was 2.5% in the Tarceva/gemcitabine group vs 0.4% in the placebo/gemcitabine arm. The overall incidence of ILD-like events in approximately 32,000 Tarceva-treated patients from all studies (including uncontrolled studies and studies with concurrent chemotherapy) was approximately 1.1%.
Reported diagnoses in patients suspected of having ILD-like events included pneumonitis, radiation pneumonitis, hypersensitivity pneumonitis, interstitial pneumonia, ILD, obliterative bronchiolitis, pulmonary fibrosis, acute respiratory distress syndrome, and lung infiltration. Symptoms started from 5 days to more than 9 months (median 39 days) after initiating Tarceva therapy.
Tarceva should be interrupted for acute onset of new or progressive unexplained pulmonary symptoms such as dyspnea, cough, and fever, and if ILD is diagnosed, Tarceva should be discontinued and appropriate treatment instituted as needed.
***********
What's the sample size (not listed on ct.gov) in the ATTENTION trial? Since it's only an east asian regional trial in Japan, Korea and Taiwan, I expect it to be small and the ILD safety signal to be unreliable and not generalizable to Caucasians. The silver lining seems to me is that Marquee, n=1000 has been ongoing for over a year- and has yet to identify ILD as a risk. Neither did the completed Phase II. Seems to me a buying opportunity.
*******
460 patients total in the trial.
I'll say ~300 so far based on enrollment start and expected end.
The signal (the imbalance) should be large enough to justify a review.
Yet another (yet maybe convoluted) argument that points to the conclusion that the tivantinib is active.
*********
twitter.com/maverickny
Sally Church ?@MaverickNY
Not sure why peeps are panicking abt ILD w/ $arql tivantinib; it's a known problem w/ Asian patients & EGFRi related Tx http://icar.us/Ox6jGN
ILD is more common in Asians on EGFRi so would expect to see it in the Attention study not Marquee
After all, c-MET receptor activation is associated with poor prognosis and EGFR TKI resistance in NSCLC, so ILD is not a surprise
*********
twitter.com/adamfeuerstein
Adam Feuerstein ?@adamfeuerstein
@ColfaxCapital all ph3 studies have indpt safety monitors. As far as we know, no concerns w/ MARQUEE.
Gruß
Danke für die gute Übersicht zu Morphosys 
CASH von 130 mio und eine halbe Mia Börsenwert sind beeindruckend. Bei 16 Partnerprogrammen sollten doch auch einige Erfolge möglich sein.
Bei der 3 eigenen bin ich aber etwas verhalten, verdammt weit ist da noch der Weg, und partner nicht in Sicht.
Gegenüber MorphoSys kann Mologen überragende klinische Studienergebnisse bei zwei Leadprodukten MGN1703 und MGN1601 zeigen.
Unbeachtet von den meisten Biotechbeobachtern legte der Kurs in 2012 bereits 50% zu!
Denke die kommenden 12 Monate bieten molos noch sehr großes Kurspotential.

CASH von 130 mio und eine halbe Mia Börsenwert sind beeindruckend. Bei 16 Partnerprogrammen sollten doch auch einige Erfolge möglich sein.
Bei der 3 eigenen bin ich aber etwas verhalten, verdammt weit ist da noch der Weg, und partner nicht in Sicht.
Gegenüber MorphoSys kann Mologen überragende klinische Studienergebnisse bei zwei Leadprodukten MGN1703 und MGN1601 zeigen.
Unbeachtet von den meisten Biotechbeobachtern legte der Kurs in 2012 bereits 50% zu!
Denke die kommenden 12 Monate bieten molos noch sehr großes Kurspotential.

Antwort auf Beitrag Nr.: 43.012.786 von zwitscherton am 07.04.12 13:58:34dynavax ist aber gabz schön eingebrochen 

Antwort auf Beitrag Nr.: 43.584.232 von pokemon am 09.09.12 17:55:08molos rollen gerade an ! 

Antwort auf Beitrag Nr.: 43.560.968 von Biohero am 02.09.12 17:44:26BioHero,
gerade die niedrige Marktkapitalisierung kann auch misstrauisch machen.
Ich habe mich mit dem Unternehmen nie befasst, wäre aber aus den selben Gründen wie A. Feuerstein sehr skeptisch:
Tim P. asks, "I don't know how familiar you are with Celsion (CLSN) and their ThermoDox treatment in conjunction with RFA (and other approaches) for certain kinds of cancerous tumors. At any rate, they have a Phase III trial (HEAT) testing ThermoDox in conjunction with RFA for HCC (liver cancer). They are expecting results late 2012 or early 2013. Do you think that the Feuerstein/Ratain rule applies here?"
The Feuerstein-Ratain rule stipulates that the outcome of a phase III cancer study is directly correlated with the market value of the company running the study. A small market value equates to a low probability for success (or a high risk of failure.) The reverse also applies: Big market cap equals higher odds for study success.
Mark Ratain, an oncologist at the University of Chicago, and I found that for companies with market value below $300 million, the odds of a successful cancer drug clinical trial were zero. Celsion has a market value of $160 million. If the Feuerstein-Ratain rule is true, Celsion's Thermodox study will fail.
Before Celsion fans flood my inbox with hate mail, let me say that the Feuerstein-Ratain rule was developed using retrospective data. Our thesis was confirmed once prospectively with the failure of Keryx Pharmaceuticals' (KERX) colon cancer drug perifosine. Thermodox is another good, prospective test of the rule, so we'll see what happens.
Celsion has a very small following among Wall Street's institutional investors. I worry about that because the commercial opportunity for Thermodox in liver cancer, if the phase III study works and the drug is approved, is substantial. That's particularly true in Asia where liver cancer is much more prevalent. Celsion is tremendously undervalued if Thermodox succeeds, yet big investors show little interest. Could Celsion be one of those rare under-the-radar stocks? Perhaps. But it may also be one that Wall Street has looked at closely and passed on.
I'm perfectly OK with saying that I can't predict the outcome of the Thermodox phase III study. There's nothing wrong with, "I don't know." If you're looking for evidence to support a positive result, I suggest browsing through the Celsion blog maintained dutifully by investor Siavoche Siassi. He's more on top of all things Thermodox than anyone I know.
gerade die niedrige Marktkapitalisierung kann auch misstrauisch machen.
Ich habe mich mit dem Unternehmen nie befasst, wäre aber aus den selben Gründen wie A. Feuerstein sehr skeptisch:
Tim P. asks, "I don't know how familiar you are with Celsion (CLSN) and their ThermoDox treatment in conjunction with RFA (and other approaches) for certain kinds of cancerous tumors. At any rate, they have a Phase III trial (HEAT) testing ThermoDox in conjunction with RFA for HCC (liver cancer). They are expecting results late 2012 or early 2013. Do you think that the Feuerstein/Ratain rule applies here?"
The Feuerstein-Ratain rule stipulates that the outcome of a phase III cancer study is directly correlated with the market value of the company running the study. A small market value equates to a low probability for success (or a high risk of failure.) The reverse also applies: Big market cap equals higher odds for study success.
Mark Ratain, an oncologist at the University of Chicago, and I found that for companies with market value below $300 million, the odds of a successful cancer drug clinical trial were zero. Celsion has a market value of $160 million. If the Feuerstein-Ratain rule is true, Celsion's Thermodox study will fail.
Before Celsion fans flood my inbox with hate mail, let me say that the Feuerstein-Ratain rule was developed using retrospective data. Our thesis was confirmed once prospectively with the failure of Keryx Pharmaceuticals' (KERX) colon cancer drug perifosine. Thermodox is another good, prospective test of the rule, so we'll see what happens.
Celsion has a very small following among Wall Street's institutional investors. I worry about that because the commercial opportunity for Thermodox in liver cancer, if the phase III study works and the drug is approved, is substantial. That's particularly true in Asia where liver cancer is much more prevalent. Celsion is tremendously undervalued if Thermodox succeeds, yet big investors show little interest. Could Celsion be one of those rare under-the-radar stocks? Perhaps. But it may also be one that Wall Street has looked at closely and passed on.
I'm perfectly OK with saying that I can't predict the outcome of the Thermodox phase III study. There's nothing wrong with, "I don't know." If you're looking for evidence to support a positive result, I suggest browsing through the Celsion blog maintained dutifully by investor Siavoche Siassi. He's more on top of all things Thermodox than anyone I know.
Antwort auf Beitrag Nr.: 43.606.707 von SLGramann am 14.09.12 17:30:46SLG
Du legst wirklich wert auf das was diese Lachnummer der öfters falsch als richtig lag da schreibt ?
Nach seiner Feuerstein-Garbage rule also das Unternehmen mit einer Marktkap unter $300 Mil eher in Phase 3 scheitern ist der grösste Müll den ich je gelesen hab , demnach hätte ich z.b HGSI unter $1 ,DNDN unter $3 ,ACOR unter $3 ,JAZZ unter $1 und viele weitere MEIDEN müssen und somit teilweise Verzehnfacher verpasst .
Einfach zu behaupten nur weil ein Unternehmen unter einer bestimmten Marktkap notiert sogut wie keine erfolgschancen hat ist der pure schwachsinn .
Es gibt kein Investment das 100% sicher ist, klar ist ein Biotech das reichlich cash und eine breite pipeline hat nicht so risikoreich wie ein Biotech das nur ein produkt und kaum cash hat dafür hat es aber im erfolgsfall mehr Aufwärtspotenzial .Wenn man bestimmte regeln beachtet kann man das risiko stark begrenzen .
Was Celsion angeht hätte Feuerstein seinen job gemacht wüsste er das Celsion nicht an neuen Krebsmedikamenten arbeitet sondern eine super interessante technologie entwickelt hat das schon zugelassene Medikamente noch effektiver macht .
Am Freitag gabs noch mehr positive Nachrichten von CLSN erst deckt der Chef sich mit weiteren Aktien ein und dann ist die letzte Überprüfung von DMC (Daten-Überwachungsausschuss) vor den finalen Phase 3 daten positiv ausgefallen .
Celsion Announces Independent Data Monitoring Committee Completes Last Intermediate Review of Phase III HEAT Study of ThermoDox(R) in Primary Liver Cancer Prior to Final Data
http://finance.yahoo.com/news/celsion-announces-independent-…
CEO kauft weiter 5K anteile ..
http://www.secform4.com/insider-trading/749647.htm
Du legst wirklich wert auf das was diese Lachnummer der öfters falsch als richtig lag da schreibt ?
Nach seiner Feuerstein-Garbage rule also das Unternehmen mit einer Marktkap unter $300 Mil eher in Phase 3 scheitern ist der grösste Müll den ich je gelesen hab , demnach hätte ich z.b HGSI unter $1 ,DNDN unter $3 ,ACOR unter $3 ,JAZZ unter $1 und viele weitere MEIDEN müssen und somit teilweise Verzehnfacher verpasst .
Einfach zu behaupten nur weil ein Unternehmen unter einer bestimmten Marktkap notiert sogut wie keine erfolgschancen hat ist der pure schwachsinn .
Es gibt kein Investment das 100% sicher ist, klar ist ein Biotech das reichlich cash und eine breite pipeline hat nicht so risikoreich wie ein Biotech das nur ein produkt und kaum cash hat dafür hat es aber im erfolgsfall mehr Aufwärtspotenzial .Wenn man bestimmte regeln beachtet kann man das risiko stark begrenzen .
Was Celsion angeht hätte Feuerstein seinen job gemacht wüsste er das Celsion nicht an neuen Krebsmedikamenten arbeitet sondern eine super interessante technologie entwickelt hat das schon zugelassene Medikamente noch effektiver macht .
Am Freitag gabs noch mehr positive Nachrichten von CLSN erst deckt der Chef sich mit weiteren Aktien ein und dann ist die letzte Überprüfung von DMC (Daten-Überwachungsausschuss) vor den finalen Phase 3 daten positiv ausgefallen .
Celsion Announces Independent Data Monitoring Committee Completes Last Intermediate Review of Phase III HEAT Study of ThermoDox(R) in Primary Liver Cancer Prior to Final Data
http://finance.yahoo.com/news/celsion-announces-independent-…
CEO kauft weiter 5K anteile ..
http://www.secform4.com/insider-trading/749647.htm
Antwort auf Beitrag Nr.: 43.610.406 von Biohero am 16.09.12 20:02:01Na ja, Feuerstein hin oder her. Fakt ist, dass die PIII kurz vor dem Abschluss steht und der Markt das nicht einpreist.
Das gemahnt zu besonderer Vorsicht. Mehr ist gar nicht gesagt.
Natürlich kann der Markt schief liegen, dann gibts ein um so größeres Feuerwerk.
Wir werden die "Feuerstein-Rule" ja hier noch dieses Jahr im Test erleben. Warten wirs ab.
Das gemahnt zu besonderer Vorsicht. Mehr ist gar nicht gesagt.
Natürlich kann der Markt schief liegen, dann gibts ein um so größeres Feuerwerk.
Wir werden die "Feuerstein-Rule" ja hier noch dieses Jahr im Test erleben. Warten wirs ab.

Antwort auf Beitrag Nr.: 43.611.159 von SLGramann am 17.09.12 08:51:59Na ja, Feuerstein hin oder her. Fakt ist, dass die PIII kurz vor dem Abschluss steht und der Markt das nicht einpreist.
Der Markt tut das nicht einpreisen ?? Celsion hat am freitag auf ein neues 2 Jahres hoch geschlossen und das ist der anfang . Dendreon ist damals nach der veröffentlichung der P3 Daten in 2007 auch erst von $5 gestartet um bei knapp $20 zu landen .

Der Markt tut das nicht einpreisen ?? Celsion hat am freitag auf ein neues 2 Jahres hoch geschlossen und das ist der anfang . Dendreon ist damals nach der veröffentlichung der P3 Daten in 2007 auch erst von $5 gestartet um bei knapp $20 zu landen .
Hallo SLGramann,
wie siehst du denn die MOR103-Ergebnisse? So ganz eindeutig scheinen sie nicht zu sein, da keine klare Dosis-Abhängigkeit zu erkennen ist, oder?
Results at day 28 (Majority of patients were on stable regimen of DMARDS)
Placebo MOR103[0.3mg/kg] MOR103[1.0mg/kg] MOR103[1.5mg/kg]
Number of patients 27 24 22 23
Proportion of patients achieving ACR20 7% 25% 68% 30%
Proportion of patients achieving ACR50 4% 4% 23% 9%
Was ist mit ACR70... gibt es da nichts?
Kann man wahrscheinlich nicht direkt vergleichen, aber mal ein paar andere PII-Ergbnisse...
AZNs Mavrilimumab (GM-CSF)
https://acr.confex.com/acr/2011/webprogram/Paper24567.html
Results at week 12
Placebo MavMab[10mg] MavMab[30mg] MavMab[50mg] MavMab[100mg]
Number of patients 75 39 41 39 39
Proportion of patients achieving ACR20 40% 41% 56% 41% 69%
Proportion of patients achieving ACR50 12% 23% 29% 21% 31%
Proportion of patients achieving ACR70 4% 5% 10% 8% 18%
ABTs Adalimumab/Humira (TNF)
http://arthritis.about.com/od/humira/a/humiradeveloped.htm
Results at week 24
Placebo Humira[20mg] Humira[40mg] Humira[80mg]
Number of patients (insgesamt 271)
Proportion of patients achieving ACR20 15% 49% 66% 66%
Proportion of patients achieving ACR50 8% 32% 54% 53%
Proportion of patients achieving ACR70 5% 10% 27% 19%
INCYs Baricitinib (JAK1/JAK2)
http://www.incyte.com/sites/default/files/JAK%2012%20EULAR%2…
Results at week 12
Placebo Bari[1mg] Bari[2mg] Bari[4mg] Bari[8mg]
Number of patients 98 49 52 52 50
Proportion of patients achieving ACR20 41% 57% 54% 75% 78%
Proportion of patients achieving ACR50 10% 31% 17% 35% 40%
Proportion of patients achieving ACR70 2% 12% 8% 23% 20%
RIGLs Fostamatinib (SYK)
http://ir.rigel.com/phoenix.zhtml?c=120936&p=irol-newsArticl…
Results at week 12
Placebo Fosta[50mg] Fosta[100mg] Fosta[150mg]
Number of patients 47 46 49 47
Proportion of patients achieving ACR20 38% 32% 65% 72%
Proportion of patients achieving ACR50 19% 17% 49% 57%
Proportion of patients achieving ACR70 4% 2% 33% 40%
Witzig, dass Humira und andere TNF-Hemmer von BASF entwickelt worden sind, bevor sich die vom Pharmageschäft getrennt haben.
Ich bin auch mal gespannt, wie sich der Galapagos-Kandidat entwickelt. Zudem könnte es sein, dass INCY auch einen JAK1 in PII hat. Und die ersten PIII-Ergebnisse von Rigel stehen auch bald an.
Gruß ipollit
wie siehst du denn die MOR103-Ergebnisse? So ganz eindeutig scheinen sie nicht zu sein, da keine klare Dosis-Abhängigkeit zu erkennen ist, oder?
Results at day 28 (Majority of patients were on stable regimen of DMARDS)
Placebo MOR103[0.3mg/kg] MOR103[1.0mg/kg] MOR103[1.5mg/kg]
Number of patients 27 24 22 23
Proportion of patients achieving ACR20 7% 25% 68% 30%
Proportion of patients achieving ACR50 4% 4% 23% 9%
Was ist mit ACR70... gibt es da nichts?
Kann man wahrscheinlich nicht direkt vergleichen, aber mal ein paar andere PII-Ergbnisse...
AZNs Mavrilimumab (GM-CSF)
https://acr.confex.com/acr/2011/webprogram/Paper24567.html
Results at week 12
Placebo MavMab[10mg] MavMab[30mg] MavMab[50mg] MavMab[100mg]
Number of patients 75 39 41 39 39
Proportion of patients achieving ACR20 40% 41% 56% 41% 69%
Proportion of patients achieving ACR50 12% 23% 29% 21% 31%
Proportion of patients achieving ACR70 4% 5% 10% 8% 18%
ABTs Adalimumab/Humira (TNF)
http://arthritis.about.com/od/humira/a/humiradeveloped.htm
Results at week 24
Placebo Humira[20mg] Humira[40mg] Humira[80mg]
Number of patients (insgesamt 271)
Proportion of patients achieving ACR20 15% 49% 66% 66%
Proportion of patients achieving ACR50 8% 32% 54% 53%
Proportion of patients achieving ACR70 5% 10% 27% 19%
INCYs Baricitinib (JAK1/JAK2)
http://www.incyte.com/sites/default/files/JAK%2012%20EULAR%2…
Results at week 12
Placebo Bari[1mg] Bari[2mg] Bari[4mg] Bari[8mg]
Number of patients 98 49 52 52 50
Proportion of patients achieving ACR20 41% 57% 54% 75% 78%
Proportion of patients achieving ACR50 10% 31% 17% 35% 40%
Proportion of patients achieving ACR70 2% 12% 8% 23% 20%
RIGLs Fostamatinib (SYK)
http://ir.rigel.com/phoenix.zhtml?c=120936&p=irol-newsArticl…
Results at week 12
Placebo Fosta[50mg] Fosta[100mg] Fosta[150mg]
Number of patients 47 46 49 47
Proportion of patients achieving ACR20 38% 32% 65% 72%
Proportion of patients achieving ACR50 19% 17% 49% 57%
Proportion of patients achieving ACR70 4% 2% 33% 40%
Witzig, dass Humira und andere TNF-Hemmer von BASF entwickelt worden sind, bevor sich die vom Pharmageschäft getrennt haben.
Ich bin auch mal gespannt, wie sich der Galapagos-Kandidat entwickelt. Zudem könnte es sein, dass INCY auch einen JAK1 in PII hat. Und die ersten PIII-Ergebnisse von Rigel stehen auch bald an.
Gruß ipollit
Antwort auf Beitrag Nr.: 43.634.679 von ipollit am 22.09.12 18:44:00Hallo ipollit,
das Thema wurde im MorphoSys natürlich heiß hin und her diskutiert.
Mein persönliches Fazit:
Es wurde nur gerade mal 4 Wochen mit kleinen Kollektiven behandelt.
Was man hat, ist der erfolgreiche PoC. Die ACR-Daten selbst muss man wohl erst mal recht tief hängen.
Ich zitiere mal deadflowers, dem ich zustimmen muss:
Wie kommt man auf die Idee, einfach irgendeine ACR-Zahl herauszugreifen, sie Ergebnissen anderer Medikamente aus anderen Studien gegenüberzustellen, und dann zu glauben, man könnte daraus ableiten, welches das beste Medikament werden wird? Das wäre selbst bei vergleichbaren Studienkollektiven und größeren Fallzahlen nicht möglich. Nun haben wir hier 1.kleine Fallzahlen, 2.selektierte Patientenpopulationen (Erkrankungsschwere, Ko-Medikation, Vortherapien etc.), 3.eine sehr kurze Behandlungsdauer und 4.einen womöglich nicht ganz objektiv zu erhebenden Endpunkt. Wem das alles zu kompliziert ist, der möge doch nur mal einen Blick auf die Placebo-Ergebnisse verschiedener Studien werfen, wo es riesige Spannbreiten in der Wirksamkeit des Placebos gibt. Da muss man von Statistik und Medizin noch gar keine Ahnung haben, da sagt einem schon der gesunde Menschenverstand, dass Äpfel mit Birnen verglichen werden.
Aber worum geht es hier eigentlich? Oder anders formuliert: Was ist das Ziel einer Phase Ib/IIa-Studie? Es geht um Dosisfindung, Pharmakokinetik, Pharmakodynamik, Sicherheit und Verträglichkeit, und ja, eben nicht zuletzt um die Überprüfung des Therapiekonzeptes. Man möchte zeigen, dass ein Ansatz prinzipiell zu einer therapeutischen Wirksamkeit führt, und dass es sich lohnen könnte, den Ansatz weiter zu verfolgen. Das ist nicht wenig, aber mehr ist es dann halt auch nicht.
-----------
ACR70 soll übrigens gegen Null gewesen sein, hätte das Unternehmen auf Nachfrage angeblich zugegeben.
Bei der kurzen Behandlungszeit sehe ich den Punkt aber nicht so wirklich negativ.
Trotz der richtigen Anmerkungen von deadflowers habe ich einem User noch das geschrieben und stehe weiter dazu:
...kommen wir auch zu der Abweichung zwischen 1 mg und 1,5 mg-Dosis. Bis auf weiteres mache ich dafür die geringe Patientenzahl verantwortlich.
Statistik wird eben schwierig, wenn ich nur eine Handvoll Ereignisse habe...
Dass MorphoSys jetzt die 1 mg-Ergebnisse als Normalfall wertet, überzeugt natürlich nicht. Dafür gibt es keine theoretische (eher im Gegenteil) oder empirische Basis.
Ich habe beschlossen, die beiden Gruppen (1 mg und 1,5 mg) zusammenzufassen. So komme ich auf einen ACR20 von ca. 48%. Selbst das ist natürlich vorläufig und mit Vorsicht zu genießen.
Für 4 Wochen Behandlungszeit und bei nicht durchgehender MTX-Gabe wäre das m.E. aber nicht so schlecht.
Vor allem dann nicht, wenn man MOR103 von vornherein nicht gegen Humira usw. ins Rennen schickt, sondern mit dem Blick auf Patienten entwickelt, bei denen TNF-alpha-Blocker nicht (mehr) wirken. Die Messlatte liegt dann niedriger.
---------------
Ich bin der Meinung, dass MorphoSys auf dieser Basis ein umfassendes PIIa-Programm auflegen sollte.
Moroney hat aber wohl klar gesagt, dass er jetzt sofort auslizensieren will.
Ich glaube nicht, dass man mit diesen frühen, unreifen, inkonsistenten Daten einen optimalen Deal bekommt.
Andererseits wäre die weitere klinische Entwicklung bei einem Pharma sicher besser aufgehoben.
MorphoSys ist in der Klinik wirklich sehr langsam und Zeit ist eben auch Geld.
Ich denke, dass das Programm einen ziemlichen Wert hat. Man darf nur keine falschen Vergleiche heranziehen.
Die JAK-Inhibitoren werden sicher gegen Humira etc. positioniert werden und müssen dann natürlich Top-Daten liefern.
MOR103 sehe ich auf einer Ebene mit bspw. Orencia von BMS. Nur dass bei RA eben auch die Nische Blockbusterpotential erlaubt.
Grüße
SLG
PS: Incyte hat ein JAK1-Programm als Konkurrenz zu Galapagos? War mir noch nicht bekannt...
das Thema wurde im MorphoSys natürlich heiß hin und her diskutiert.
Mein persönliches Fazit:
Es wurde nur gerade mal 4 Wochen mit kleinen Kollektiven behandelt.
Was man hat, ist der erfolgreiche PoC. Die ACR-Daten selbst muss man wohl erst mal recht tief hängen.
Ich zitiere mal deadflowers, dem ich zustimmen muss:
Wie kommt man auf die Idee, einfach irgendeine ACR-Zahl herauszugreifen, sie Ergebnissen anderer Medikamente aus anderen Studien gegenüberzustellen, und dann zu glauben, man könnte daraus ableiten, welches das beste Medikament werden wird? Das wäre selbst bei vergleichbaren Studienkollektiven und größeren Fallzahlen nicht möglich. Nun haben wir hier 1.kleine Fallzahlen, 2.selektierte Patientenpopulationen (Erkrankungsschwere, Ko-Medikation, Vortherapien etc.), 3.eine sehr kurze Behandlungsdauer und 4.einen womöglich nicht ganz objektiv zu erhebenden Endpunkt. Wem das alles zu kompliziert ist, der möge doch nur mal einen Blick auf die Placebo-Ergebnisse verschiedener Studien werfen, wo es riesige Spannbreiten in der Wirksamkeit des Placebos gibt. Da muss man von Statistik und Medizin noch gar keine Ahnung haben, da sagt einem schon der gesunde Menschenverstand, dass Äpfel mit Birnen verglichen werden.
Aber worum geht es hier eigentlich? Oder anders formuliert: Was ist das Ziel einer Phase Ib/IIa-Studie? Es geht um Dosisfindung, Pharmakokinetik, Pharmakodynamik, Sicherheit und Verträglichkeit, und ja, eben nicht zuletzt um die Überprüfung des Therapiekonzeptes. Man möchte zeigen, dass ein Ansatz prinzipiell zu einer therapeutischen Wirksamkeit führt, und dass es sich lohnen könnte, den Ansatz weiter zu verfolgen. Das ist nicht wenig, aber mehr ist es dann halt auch nicht.
-----------
ACR70 soll übrigens gegen Null gewesen sein, hätte das Unternehmen auf Nachfrage angeblich zugegeben.
Bei der kurzen Behandlungszeit sehe ich den Punkt aber nicht so wirklich negativ.
Trotz der richtigen Anmerkungen von deadflowers habe ich einem User noch das geschrieben und stehe weiter dazu:
...kommen wir auch zu der Abweichung zwischen 1 mg und 1,5 mg-Dosis. Bis auf weiteres mache ich dafür die geringe Patientenzahl verantwortlich.
Statistik wird eben schwierig, wenn ich nur eine Handvoll Ereignisse habe...
Dass MorphoSys jetzt die 1 mg-Ergebnisse als Normalfall wertet, überzeugt natürlich nicht. Dafür gibt es keine theoretische (eher im Gegenteil) oder empirische Basis.
Ich habe beschlossen, die beiden Gruppen (1 mg und 1,5 mg) zusammenzufassen. So komme ich auf einen ACR20 von ca. 48%. Selbst das ist natürlich vorläufig und mit Vorsicht zu genießen.
Für 4 Wochen Behandlungszeit und bei nicht durchgehender MTX-Gabe wäre das m.E. aber nicht so schlecht.
Vor allem dann nicht, wenn man MOR103 von vornherein nicht gegen Humira usw. ins Rennen schickt, sondern mit dem Blick auf Patienten entwickelt, bei denen TNF-alpha-Blocker nicht (mehr) wirken. Die Messlatte liegt dann niedriger.
---------------
Ich bin der Meinung, dass MorphoSys auf dieser Basis ein umfassendes PIIa-Programm auflegen sollte.
Moroney hat aber wohl klar gesagt, dass er jetzt sofort auslizensieren will.
Ich glaube nicht, dass man mit diesen frühen, unreifen, inkonsistenten Daten einen optimalen Deal bekommt.
Andererseits wäre die weitere klinische Entwicklung bei einem Pharma sicher besser aufgehoben.
MorphoSys ist in der Klinik wirklich sehr langsam und Zeit ist eben auch Geld.
Ich denke, dass das Programm einen ziemlichen Wert hat. Man darf nur keine falschen Vergleiche heranziehen.
Die JAK-Inhibitoren werden sicher gegen Humira etc. positioniert werden und müssen dann natürlich Top-Daten liefern.
MOR103 sehe ich auf einer Ebene mit bspw. Orencia von BMS. Nur dass bei RA eben auch die Nische Blockbusterpotential erlaubt.
Grüße
SLG
PS: Incyte hat ein JAK1-Programm als Konkurrenz zu Galapagos? War mir noch nicht bekannt...
Positives von Synta:
http://finance.yahoo.com/news/updated-results-phase-2b-3-080…
Hammer kommentiert das am Sonntag vielleicht etwas näher.
Und so richtigen Mist von Arqule:
http://finance.yahoo.com/news/arqule-daiichi-sankyo-announce…
Ich sehe in Tivantinib kein Potential mehr. Alles andere dauert mir zu lange. Bin mit Verlusten raus.
http://finance.yahoo.com/news/updated-results-phase-2b-3-080…
Hammer kommentiert das am Sonntag vielleicht etwas näher.
Und so richtigen Mist von Arqule:
http://finance.yahoo.com/news/arqule-daiichi-sankyo-announce…
Ich sehe in Tivantinib kein Potential mehr. Alles andere dauert mir zu lange. Bin mit Verlusten raus.
Hallo SLGramann!
Naja, das von ARQL heute ist nicht so erfreulich. Allerdings habe ich Tivantinib noch nicht ganz abgeschrieben. Seit längerem gibt es Hinweise, dass MET-Hemmer sich bei MET+ und MET- unterschiedlich auswirken und zwar nicht, wie man vielleicht erstmal erwarten würde, dass Krebs, der viel MET (MET+) besitzt, besser auch MET-Hemmer ansprechen und bei weniger MET (MET-) die Wirkung einfach nur geringer ist. Es scheint eher so zu sein, dass MET+ positiv auf MET-Hemmer ansprechen, aber MET- nicht nur garnicht, sondern sogar negativ! D.h., dass bei Krebs, der wenig MET expressioniert, MET-Hemmer schädlich sind und somit das Leben verkürzen! Deswegen screent Roche bei seiner MetMab PIII den MET-Status und schließt MET- aus. Leider lief da schon die Tivantinib-PIII... und zwar ohne vorherige Prüfung auf MET+. Dadurch dürfte es eine Mischung aus MET+ und MET- sein. ARQL hat gehofft, dass mehr MET+ als MET- Patienten in die Studie aufgenommen worden sind. Wenn die bisherigen Hinweise stimmen, dann ziehen MET- OS ziemlich runter, so dass am Ende wohl keine positive statistische Signifikanz mehr möglich ist.
Ich werde jetzt erstmal nachlesen, was es für Meinungen dazu gibt und was nun noch möglich ist bzw. was ARQL von sich aus abschreibt. Jedenfalls würde ich nachwievor erwarten, dass bei einer Beschränkung auf MET+ das Ergebnis auch bei NSCLC positiv ausfallen würde.
hier z.B. von Roche: http://www.roche.com/investors/ir_agenda/ir_day-2012.htm

Gruß
ipollit
Naja, das von ARQL heute ist nicht so erfreulich. Allerdings habe ich Tivantinib noch nicht ganz abgeschrieben. Seit längerem gibt es Hinweise, dass MET-Hemmer sich bei MET+ und MET- unterschiedlich auswirken und zwar nicht, wie man vielleicht erstmal erwarten würde, dass Krebs, der viel MET (MET+) besitzt, besser auch MET-Hemmer ansprechen und bei weniger MET (MET-) die Wirkung einfach nur geringer ist. Es scheint eher so zu sein, dass MET+ positiv auf MET-Hemmer ansprechen, aber MET- nicht nur garnicht, sondern sogar negativ! D.h., dass bei Krebs, der wenig MET expressioniert, MET-Hemmer schädlich sind und somit das Leben verkürzen! Deswegen screent Roche bei seiner MetMab PIII den MET-Status und schließt MET- aus. Leider lief da schon die Tivantinib-PIII... und zwar ohne vorherige Prüfung auf MET+. Dadurch dürfte es eine Mischung aus MET+ und MET- sein. ARQL hat gehofft, dass mehr MET+ als MET- Patienten in die Studie aufgenommen worden sind. Wenn die bisherigen Hinweise stimmen, dann ziehen MET- OS ziemlich runter, so dass am Ende wohl keine positive statistische Signifikanz mehr möglich ist.
Ich werde jetzt erstmal nachlesen, was es für Meinungen dazu gibt und was nun noch möglich ist bzw. was ARQL von sich aus abschreibt. Jedenfalls würde ich nachwievor erwarten, dass bei einer Beschränkung auf MET+ das Ergebnis auch bei NSCLC positiv ausfallen würde.
hier z.B. von Roche: http://www.roche.com/investors/ir_agenda/ir_day-2012.htm
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.671.292 von ipollit am 02.10.12 21:21:02In diesem Zusammenhang könnte auch EXEL's Cabozantinib interessant sein als MET+VEGF(R2)-Hemmer. Roche sieht jedenfalls die MetMAB + Avastin Kombination aussichtsreich:

Naja, mal abwarten.
Gruß
Naja, mal abwarten.
Gruß
ARQL hat NSCLC erstmal abgeschrieben, da sie nun deutlich hinter Roche's MetMab liegen. Irgendwie schade, da Tivantinib durchaus bei Met+ wirksam sein kann, vielleicht sogar wirksamer als MetMab. Zumal MetMab ein Antikörper ist, während Tivantinib oral verabreicht werden kann. Vielleicht ist es jetzt aber doch besser, direkt in Indikationen zu gehen, wo es noch keinen direkten MET-Konkurrenten gibt und man somit vielleicht schneller eine Zulassung erhalten kann, wenn es sich als wirksam erweist.
MetMab wäre nie in die PIII gekommen, wenn man es nicht auf Met+ eingeschränkt hätte, da auf ITT-Basis mit Met+ und Met- die Ergebnisse weder für PFS noch für OS signifikant oder einen positiven Trend gezeigt haben. Das gleiche gilt für AMGN's Rilotumumab, welches in der PII auf ITT-Basis gescheitert ist, aber nun für Met+ weitergeführt wird:"Amgen is presenting data in gastric cancer for its anti-HGF antibody, rilotumumab, in combination with chemotherapy in gastric cancer (HGF is the ligand that activates MET). This program had been terminated by Amgen last year, but was recently re-activated based on a subset analysis in the trial. Although the drug had no effect in the intend-to-treat population, there was a near doubling of survival in patients with high MET expression." http://www.hammerstockblog.com/drugs-to-watch-at-asco-2012/
Hier z.B. ein Artikel zu MetMab aus 2010: http://cancergrace.org/lung/2010/10/13/metmab-looking-very-p…
"Met is a receptor protein that is mutated and overexpressed in many cancers, in which it is typically associated with a worse prognosis, including in NSCLC. Importantly, in the last few years, it has been identified as one of the mechanisms of resistance to EGFR tyrosine kinase inhibitors (TKIs) like Tarceva or Iressa (gefitinib), both from the very start of EGFR TKI therapy (primary resistance), and after an initial response (secondary or acquired resistance).
...
As you’d expect to see from prior work, the two arms were both split pretty evenly between Met high and Met low expression (54% Met high, as noted in figure above).
Looking at the entire population, there were no real differences in PFS or OS to suggest a benefit from MetMAb, but the two groups of Met high vs. Met low had remarkably different results. Specifically, the patients in the Met high group had a nearly 50% improvement in both PFS and OS (though not quite reaching statistical significance for either endpoint):
(MET+ ... Metmab hat einen deutlich positiven PFS- und OS-Effekt)

But if one group received a benefit while the overall population showed no difference, that means that another group must have done poorly. In fact, that was clearly shown in the Met low population, who had a significantly worse PFS and OS when MetMAb was added to Tarceva:
(MET- ... hier liegt Metmab mit OS und PFS deutlich unter dem "Placebo"-Arm)

There were no differences in the degree or pattern of benefit in various subgroups based on smoking history, histology, performance status, or even EGFR or KRAS mutation status. But not only were the results different for Met high vs Met low, both PFS and OS went gradually from most beneficial for Tarceva alone to most beneficial for Tarceva/MetMAb as the Met staining pattern went from o to 1+ to 2+ to 3+:
To me, these results are reminiscent of the IPASS results that showed the extremely divergent results of whether patients did better with chemo or Iressa depending on whether a patient has an EGFR mutation or not. Importantly, it underscores how important molecular markers have become, and the need to review results by relevant subgroups. Looking at the results only for an overall population not divided by Met expression, these results would have shown no discernable result and likely would have been abandoned."
Wie gesagt, hat ARQL einfach gehofft, dass deutlich mehr MET+ als MET- in der Studie enthalten sind, damit das Gesamtergebnis (anders als bei Metmab) noch positiv bleibt. Bei PFS sah es auch noch danach aus, da es bereits signifikant war. Allerdings halte ich es trotzdem für fraglich, eine solche Studie durchzuführen, wenn man weiß, dass es einem Teil der Patienten (Met-) schaden kann.
ARQL's MK befindet sich nun nahe dem Cash-Niveau. Ist das wirklich gerechtfertigt? Natürlich ist die Enttäuschung jetzt erstmal groß. Aber trotzdem haben sie noch einen führenden MET-Hemmer, der z.B. bei Leberkrebs bald in PIII geht und für den bei Darmkrebs PII-Ergebnisse anstehen. Beide berücksichtigen nun MET+, so dass es dort eigentlich besser aussehen sollte.
Das, was Ohad Hammer zuvor geschrieben hat, bezog sich ja nicht alles auf NSCLC:
"Almost two years later, Arqule returns to investors with more good news, this time in liver cancer. Actual data will be announced only at ASCO in June, however, the limited information provided by the company already positions tivantinib as one of the most promising agents in development for liver cancer.
Robust signal
The phase II study included 107 patients who failed 1st line treatment (Nexavar in the vast majority of cases) and were randomized to receive Arqule’s tivantinib (2 different doses) or placebo. Tivantinib led to a 56% increase in time to progression (TTP), with compelling hazard ratio and p value (HR=0.64, p-value = 0.04). The company did not disclose actual numbers but the difference appears to be very strong from a statistical standpoint, which is particularly impressive given the small size of the trial and the inclusion of all patients in this analysis (no subgroup analysis).
Liver cancer is a notoriously difficult indication, with only one proven drug- Onyx’s (ONXX) Nexavar. The fact patients on the control arm received placebo and not any form of active therapy demonstrates the lack of good options for 2nd line patients. On top of the aggressive chemo-resistant nature of the disease, safety is a cardinal issue in liver cancer patients, who have very low tolerability of side effects. This is where tivantinib’s benign safety profile could be critical, although even with tivantinib investigators encountered side effects that forced them to change the protocol and reduce the dose as the trial progressed.
Open questions- Survival and biomarkers
Positive randomized data sets in liver cancer are very hard to find, however, there are still a lot of open questions regarding tivantinib’s future in this indication. The absolute benefit in TTP is still unknown, let alone its effect on overall survival. Based on other phase II trials, TTP for 2nd line liver cancer is typically 2-3 months. Therefore, if the control arm had a median TTP of ~2.5 months, tivantinib added only ~1.4 months. Even if Arqule manages to replicate this achievement in phase III, it is unclear whether this benefit is enough for approval. A more important question is this difference will lead to a clinically meaningful survival benefit.
But the most intriguing piece of data would be biomarker analysis, especially such that is related to the pathway inhibited by tivantinib (cMET). The two usual suspects are expression levels of cMET or its ligand, HGF. If Arqule can show retrospectively an association between expression of any of these proteins and clinical benefit, it will probably focus on this subgroup going forward. This will decrease the theoretical market potential but it will also substantially improve probability of success and market acceptance.
Arqule chose three settings: (i) 2nd line NSCLC with Tarceva (ii) 2nd line liver cancer alone and (iii) 2nd line colon cancer with chemotherapy and Erbitux. Each of these settings represents an unmet need as well as a lucrative commercial opportunity.
So far Arqule got it right in two out of two data readouts - the third trial is expected to generate results towards mid-2013. Assuming the liver cancer data will include at least 1 good biomarker for patient selection and a survival trend, a phase III will start towards the end of 2012.
...
MET continues to be a very hot target in oncology. The two leading selective MET inhibitors, Daiichi-Sankyo/Arqule’s (ARQL) tivantanib and Roche’s Metmab are in phase III in lung cancer based on positive phase II studies. Exelixis’ (EXEL) cabozantinib, which is a dual MET/VEGFR inhibitor, is in phase III in prostate cancer.
At this year’s meeting, Arqule will report phase II results for tivantinib in 2nd line liver cancer. The drug led to a negligible PFS improvement in the entire patient population, however, the effect was more profound in patients whose tumors had high MET expression. In these patients, tivantinib led to a statistically significant benefit (2.4 vs. 1.5 months). These results are somewhat disappointing and the decision to go for phase III in 2nd line patients will probably depend on an overall survival signal, which will be presented at the conference.
...
Arqule – Survival signal in liver cancer
Arqule (ARQL) started ASCO with a negative sentiment based on a modest PFS signal from a phase II in liver cancer. In MET+ patients, tivantinib led to a PFS benefit of almost 1 month, which is probably not considered clinically meaningful. The updated overall survival data, however, showed a dramatic separation of the curves (median survival of 9 vs. 3.8 months). The main caveat for this analysis is the very low sample size (28 patients) but given statistically significant signal in PFS and the prospective biomarker analysis, this is enough to push the drug to phase III in MET+ liver cancer.

Hi Ohad,
Do you think there are chances of lead trial of arql failing towards this yr end coz they haven’t checked for met levels?
Mike - That’s always an option although the assumption is that they’ll have enough met positive pts in the adeno subgroup. ARQL could have an issue going forward if Metmab demonstrates a better effect using a biomarker defined population. btw, Roche probably saw a signal in met+ gastric cancer in their p2 since they are about to start a p3 in met+ gastric cancer.
Gruß
MetMab wäre nie in die PIII gekommen, wenn man es nicht auf Met+ eingeschränkt hätte, da auf ITT-Basis mit Met+ und Met- die Ergebnisse weder für PFS noch für OS signifikant oder einen positiven Trend gezeigt haben. Das gleiche gilt für AMGN's Rilotumumab, welches in der PII auf ITT-Basis gescheitert ist, aber nun für Met+ weitergeführt wird:"Amgen is presenting data in gastric cancer for its anti-HGF antibody, rilotumumab, in combination with chemotherapy in gastric cancer (HGF is the ligand that activates MET). This program had been terminated by Amgen last year, but was recently re-activated based on a subset analysis in the trial. Although the drug had no effect in the intend-to-treat population, there was a near doubling of survival in patients with high MET expression." http://www.hammerstockblog.com/drugs-to-watch-at-asco-2012/
Hier z.B. ein Artikel zu MetMab aus 2010: http://cancergrace.org/lung/2010/10/13/metmab-looking-very-p…
"Met is a receptor protein that is mutated and overexpressed in many cancers, in which it is typically associated with a worse prognosis, including in NSCLC. Importantly, in the last few years, it has been identified as one of the mechanisms of resistance to EGFR tyrosine kinase inhibitors (TKIs) like Tarceva or Iressa (gefitinib), both from the very start of EGFR TKI therapy (primary resistance), and after an initial response (secondary or acquired resistance).
...
As you’d expect to see from prior work, the two arms were both split pretty evenly between Met high and Met low expression (54% Met high, as noted in figure above).
Looking at the entire population, there were no real differences in PFS or OS to suggest a benefit from MetMAb, but the two groups of Met high vs. Met low had remarkably different results. Specifically, the patients in the Met high group had a nearly 50% improvement in both PFS and OS (though not quite reaching statistical significance for either endpoint):
(MET+ ... Metmab hat einen deutlich positiven PFS- und OS-Effekt)

But if one group received a benefit while the overall population showed no difference, that means that another group must have done poorly. In fact, that was clearly shown in the Met low population, who had a significantly worse PFS and OS when MetMAb was added to Tarceva:
(MET- ... hier liegt Metmab mit OS und PFS deutlich unter dem "Placebo"-Arm)

There were no differences in the degree or pattern of benefit in various subgroups based on smoking history, histology, performance status, or even EGFR or KRAS mutation status. But not only were the results different for Met high vs Met low, both PFS and OS went gradually from most beneficial for Tarceva alone to most beneficial for Tarceva/MetMAb as the Met staining pattern went from o to 1+ to 2+ to 3+:
To me, these results are reminiscent of the IPASS results that showed the extremely divergent results of whether patients did better with chemo or Iressa depending on whether a patient has an EGFR mutation or not. Importantly, it underscores how important molecular markers have become, and the need to review results by relevant subgroups. Looking at the results only for an overall population not divided by Met expression, these results would have shown no discernable result and likely would have been abandoned."
Wie gesagt, hat ARQL einfach gehofft, dass deutlich mehr MET+ als MET- in der Studie enthalten sind, damit das Gesamtergebnis (anders als bei Metmab) noch positiv bleibt. Bei PFS sah es auch noch danach aus, da es bereits signifikant war. Allerdings halte ich es trotzdem für fraglich, eine solche Studie durchzuführen, wenn man weiß, dass es einem Teil der Patienten (Met-) schaden kann.
ARQL's MK befindet sich nun nahe dem Cash-Niveau. Ist das wirklich gerechtfertigt? Natürlich ist die Enttäuschung jetzt erstmal groß. Aber trotzdem haben sie noch einen führenden MET-Hemmer, der z.B. bei Leberkrebs bald in PIII geht und für den bei Darmkrebs PII-Ergebnisse anstehen. Beide berücksichtigen nun MET+, so dass es dort eigentlich besser aussehen sollte.
Das, was Ohad Hammer zuvor geschrieben hat, bezog sich ja nicht alles auf NSCLC:
"Almost two years later, Arqule returns to investors with more good news, this time in liver cancer. Actual data will be announced only at ASCO in June, however, the limited information provided by the company already positions tivantinib as one of the most promising agents in development for liver cancer.
Robust signal
The phase II study included 107 patients who failed 1st line treatment (Nexavar in the vast majority of cases) and were randomized to receive Arqule’s tivantinib (2 different doses) or placebo. Tivantinib led to a 56% increase in time to progression (TTP), with compelling hazard ratio and p value (HR=0.64, p-value = 0.04). The company did not disclose actual numbers but the difference appears to be very strong from a statistical standpoint, which is particularly impressive given the small size of the trial and the inclusion of all patients in this analysis (no subgroup analysis).
Liver cancer is a notoriously difficult indication, with only one proven drug- Onyx’s (ONXX) Nexavar. The fact patients on the control arm received placebo and not any form of active therapy demonstrates the lack of good options for 2nd line patients. On top of the aggressive chemo-resistant nature of the disease, safety is a cardinal issue in liver cancer patients, who have very low tolerability of side effects. This is where tivantinib’s benign safety profile could be critical, although even with tivantinib investigators encountered side effects that forced them to change the protocol and reduce the dose as the trial progressed.
Open questions- Survival and biomarkers
Positive randomized data sets in liver cancer are very hard to find, however, there are still a lot of open questions regarding tivantinib’s future in this indication. The absolute benefit in TTP is still unknown, let alone its effect on overall survival. Based on other phase II trials, TTP for 2nd line liver cancer is typically 2-3 months. Therefore, if the control arm had a median TTP of ~2.5 months, tivantinib added only ~1.4 months. Even if Arqule manages to replicate this achievement in phase III, it is unclear whether this benefit is enough for approval. A more important question is this difference will lead to a clinically meaningful survival benefit.
But the most intriguing piece of data would be biomarker analysis, especially such that is related to the pathway inhibited by tivantinib (cMET). The two usual suspects are expression levels of cMET or its ligand, HGF. If Arqule can show retrospectively an association between expression of any of these proteins and clinical benefit, it will probably focus on this subgroup going forward. This will decrease the theoretical market potential but it will also substantially improve probability of success and market acceptance.
Arqule chose three settings: (i) 2nd line NSCLC with Tarceva (ii) 2nd line liver cancer alone and (iii) 2nd line colon cancer with chemotherapy and Erbitux. Each of these settings represents an unmet need as well as a lucrative commercial opportunity.
So far Arqule got it right in two out of two data readouts - the third trial is expected to generate results towards mid-2013. Assuming the liver cancer data will include at least 1 good biomarker for patient selection and a survival trend, a phase III will start towards the end of 2012.
...
MET continues to be a very hot target in oncology. The two leading selective MET inhibitors, Daiichi-Sankyo/Arqule’s (ARQL) tivantanib and Roche’s Metmab are in phase III in lung cancer based on positive phase II studies. Exelixis’ (EXEL) cabozantinib, which is a dual MET/VEGFR inhibitor, is in phase III in prostate cancer.
At this year’s meeting, Arqule will report phase II results for tivantinib in 2nd line liver cancer. The drug led to a negligible PFS improvement in the entire patient population, however, the effect was more profound in patients whose tumors had high MET expression. In these patients, tivantinib led to a statistically significant benefit (2.4 vs. 1.5 months). These results are somewhat disappointing and the decision to go for phase III in 2nd line patients will probably depend on an overall survival signal, which will be presented at the conference.
...
Arqule – Survival signal in liver cancer
Arqule (ARQL) started ASCO with a negative sentiment based on a modest PFS signal from a phase II in liver cancer. In MET+ patients, tivantinib led to a PFS benefit of almost 1 month, which is probably not considered clinically meaningful. The updated overall survival data, however, showed a dramatic separation of the curves (median survival of 9 vs. 3.8 months). The main caveat for this analysis is the very low sample size (28 patients) but given statistically significant signal in PFS and the prospective biomarker analysis, this is enough to push the drug to phase III in MET+ liver cancer.

Hi Ohad,
Do you think there are chances of lead trial of arql failing towards this yr end coz they haven’t checked for met levels?
Mike - That’s always an option although the assumption is that they’ll have enough met positive pts in the adeno subgroup. ARQL could have an issue going forward if Metmab demonstrates a better effect using a biomarker defined population. btw, Roche probably saw a signal in met+ gastric cancer in their p2 since they are about to start a p3 in met+ gastric cancer.
Gruß
Antwort auf Beitrag Nr.: 43.673.479 von ipollit am 03.10.12 15:01:52Hallo ipollit,
vielen Dank für Deine sehr interessanten Beiträge! Mag gut sein, dass es um einiges smarter ist, Arqule auf diesem Niveau zu kaufen, statt es zu verkaufen.
Meine Entscheidung war schon auch etwas impulsiv. Meine allgemeine Erfahrung ist, dass es nach solchen Flops für lange Zeit keine positive Entwicklung gibt. In diesem konkreten Fall könnte das vielleicht anders sein wegen der gegensätzlichen Wirkung auf MET+/MET- Patienten, die Du dargestellt hast.
Fürs erste bleibe ich aber draußen.
Übrigens hat Hammer heute etwas hoch interessantes zu Exelixis geschrieben, das aus meiner Sicht das Risiko dort signifikant vermindert:
http://www.hammerstockblog.com/exelixis-first-partnered-prog…
vielen Dank für Deine sehr interessanten Beiträge! Mag gut sein, dass es um einiges smarter ist, Arqule auf diesem Niveau zu kaufen, statt es zu verkaufen.
Meine Entscheidung war schon auch etwas impulsiv. Meine allgemeine Erfahrung ist, dass es nach solchen Flops für lange Zeit keine positive Entwicklung gibt. In diesem konkreten Fall könnte das vielleicht anders sein wegen der gegensätzlichen Wirkung auf MET+/MET- Patienten, die Du dargestellt hast.
Fürs erste bleibe ich aber draußen.
Übrigens hat Hammer heute etwas hoch interessantes zu Exelixis geschrieben, das aus meiner Sicht das Risiko dort signifikant vermindert:
http://www.hammerstockblog.com/exelixis-first-partnered-prog…
Antwort auf Beitrag Nr.: 43.673.939 von SLGramann am 03.10.12 16:36:23bezügl. EXEL...
Soweit ich es verstanden habe, führen BRAF-Hemmer alleine schnell zu einer Resistenz. MEK-Hemmer verhindern dies, so dass die Kombination recht vielversprechend ist.
https://www.crosscurrentllc.com/uploads/10-1-12_ESMO_Part_1.…
"A more mature data set of GSK's Phase 2 trial of BRAF inhibitor dabrafenib plus the MEK inhibitor tremetinib in BRAF mutation-positive melanoma was presented. The initial data were presented at ASCO in June. There were no surprises. The combination is still far better than dabrafenib alone. With the full-dose combination, the response rate was 76% for the combo and 54% for dabrafenib monotherapy. PFS was 9.4 months versus 5.8 months. OS has not been reached for any of the arms. The MEK inhibitor continues to minimize the side effects of the BRAF inhibitor. The interesting commercial question is that both dabrafenib and tremetinib will each be approved as monotherapy in the coming months. Invariably, in real clinical practice, the 2 drugs will be used as a combination, even though the initial labels will probably not include the combo use. So, what will be the impact on Roche's Zelboraf in the near term? Roche's MEK inhibitor is still a ways away from entering the market.
...
The following is a summary of the efficacy of BRAF and MEK inhibitors in BRAF mutation-positive melanoma to date. Zelboraf alone (ROG.VX): ORR 53%, PFS 6.9 months. Dabrafenib alone (GSK): ORR 50%, PFS 6.7%. Tremetinib alone (GSK/Japan Tobacco): ORR 22%, PFS 4.8 months. MEK163 alone (NVS/ARRY): ORR 20%, PFS 3.5 months, but the drug is particularly effective in NRAS mutation-positive melanoma. Zelboraf + GDC-0973 (ROG.VX): ORR 90%, PFS not yet available. Dabrafenib + tremetinib (GSK/Japan Tobacco): ORR 78%, PFS 9.4 months. There is no doubt the combo is the approach."
****
Welche Relevanz hat das von Adam Feuerstein beschriebene Problem?
http://www.thestreet.com/story/11722003/1/exelixis-big-money…
"BOSTON (TheStreet) -- In early August, with its stock trading stronger than it had in six months, Exelixis (EXEL) decided to raise money -- a lot of money. A 30 million-share equity offering combined with $250 million in convertible debt raised the biotech company $362 million.
The deal also put a break on the upward momentum in Exelixis' stock price. Here to explain why Exelixis trades so poorly since the financing is @ColfaxCapital, an institutional equities trader specializing in biotech and healthcare stocks. (He asked to remain anonymous, hence his Twitter handle.)
Colfax explains why investors in the Exelixis financing are profiting handsomely while those trading the stock since have been left holding the bag:
For traders and investors who have been wondering why the common equity of Exelixis has been trading so poorly since their most recent financing, one needs to understand a common equity and convertible financing.
When the company did the last financing in early August, Exelixis, through their bankers, issued 30 million shares in common equity (+4.5 million shares underwriter allowance) and $250 million in convertible notes (+$37.5 million underwriter allowance.)
Common stock was issued at $4.25. The notes are convertible at some point in the future at $5.31.
It is very likely that the financing participants took part in both the common equity and the convertible arms. For those who did not participate in the financing, this was a bad deal. It's also a bad deal for anyone who bought Exelixis after the financing. The only shareholders it was good for were the funds who bought both the common equity and the convertible arm of the deal.
This deal is very similar to an equity offering with warrants attached. It's just a pig with a different type of lipstick. Warrants are "sweeteners" in financing deals. In the case of the Exelixis financing, the convertible arm was a "sweetener" in lieu of warrants. Why are they called "sweeteners"? Because an investor can use the common equity portion of the deal to finance a portion or all of the warrants/convertible arm.
In the case of common equity and warrant deals, you'll often see a fund take down, let's say, 5 million shares of XYZ common stock, and, also be apportioned 0.5 warrants for every common share. Oftentimes, a few weeks later, when the 13F filings come out at the end of the quarter, you'll notice that very same fund owns absolutely no shares of the common stock, despite the stock having barely moved. How is this possible? Because the fund likely used the common shares in a short position to pay for the warrants, making the warrant arm of the trade almost risk-free, or reduce the cost of the warrants greatly.
Let's take a closer look at what investors in the Exelixis financing are likely doing: A hedge fund buys Exelixis common stock, in size, at $4.25 per share and has the ability to own more stock at $5.31 per share at some point in the future with the convertible arm. Therefore, any time Exelixis' stock price rises above $4.25 by a reasonable amount, the hedge fund can short the stock and use profits from that short sale to pay for the convertible stock.
For instance, days, weeks or months later, if Exelixis' stock is trading at $5.50 and the hedge fund bought 10 million shares in the financing deal, it could short 10 million shares and "arbitrage" the profits. (Since the hedge fund owns 10 million shares at $4.25, it profits from the cost basis of the short versus its long position received in the deal at $4.25.) The fund then takes those profits and uses them to pay for the convertible arm in full, or reduces the cost basis of the convertible.
Why do this? Easy, it's almost like free money. Furthermore, if an investor thinks Exelixis' cancer drug cabozantinib is going to be a billion-dollar blockbuster drug, then owning the stock at $5.31 -- or lower, cost-basis adjusted -- is a no brainer. And, if investors can get convertible shares for free, it's even better.
When a company raises money through an equity sale with warrant or convertible notes as a sweetener, investors who aren't lucky enough to participate should run away from the stock - fast."
Gruß
Soweit ich es verstanden habe, führen BRAF-Hemmer alleine schnell zu einer Resistenz. MEK-Hemmer verhindern dies, so dass die Kombination recht vielversprechend ist.
https://www.crosscurrentllc.com/uploads/10-1-12_ESMO_Part_1.…
"A more mature data set of GSK's Phase 2 trial of BRAF inhibitor dabrafenib plus the MEK inhibitor tremetinib in BRAF mutation-positive melanoma was presented. The initial data were presented at ASCO in June. There were no surprises. The combination is still far better than dabrafenib alone. With the full-dose combination, the response rate was 76% for the combo and 54% for dabrafenib monotherapy. PFS was 9.4 months versus 5.8 months. OS has not been reached for any of the arms. The MEK inhibitor continues to minimize the side effects of the BRAF inhibitor. The interesting commercial question is that both dabrafenib and tremetinib will each be approved as monotherapy in the coming months. Invariably, in real clinical practice, the 2 drugs will be used as a combination, even though the initial labels will probably not include the combo use. So, what will be the impact on Roche's Zelboraf in the near term? Roche's MEK inhibitor is still a ways away from entering the market.
...
The following is a summary of the efficacy of BRAF and MEK inhibitors in BRAF mutation-positive melanoma to date. Zelboraf alone (ROG.VX): ORR 53%, PFS 6.9 months. Dabrafenib alone (GSK): ORR 50%, PFS 6.7%. Tremetinib alone (GSK/Japan Tobacco): ORR 22%, PFS 4.8 months. MEK163 alone (NVS/ARRY): ORR 20%, PFS 3.5 months, but the drug is particularly effective in NRAS mutation-positive melanoma. Zelboraf + GDC-0973 (ROG.VX): ORR 90%, PFS not yet available. Dabrafenib + tremetinib (GSK/Japan Tobacco): ORR 78%, PFS 9.4 months. There is no doubt the combo is the approach."
****
Welche Relevanz hat das von Adam Feuerstein beschriebene Problem?
http://www.thestreet.com/story/11722003/1/exelixis-big-money…
"BOSTON (TheStreet) -- In early August, with its stock trading stronger than it had in six months, Exelixis (EXEL) decided to raise money -- a lot of money. A 30 million-share equity offering combined with $250 million in convertible debt raised the biotech company $362 million.
The deal also put a break on the upward momentum in Exelixis' stock price. Here to explain why Exelixis trades so poorly since the financing is @ColfaxCapital, an institutional equities trader specializing in biotech and healthcare stocks. (He asked to remain anonymous, hence his Twitter handle.)
Colfax explains why investors in the Exelixis financing are profiting handsomely while those trading the stock since have been left holding the bag:
For traders and investors who have been wondering why the common equity of Exelixis has been trading so poorly since their most recent financing, one needs to understand a common equity and convertible financing.
When the company did the last financing in early August, Exelixis, through their bankers, issued 30 million shares in common equity (+4.5 million shares underwriter allowance) and $250 million in convertible notes (+$37.5 million underwriter allowance.)
Common stock was issued at $4.25. The notes are convertible at some point in the future at $5.31.
It is very likely that the financing participants took part in both the common equity and the convertible arms. For those who did not participate in the financing, this was a bad deal. It's also a bad deal for anyone who bought Exelixis after the financing. The only shareholders it was good for were the funds who bought both the common equity and the convertible arm of the deal.
This deal is very similar to an equity offering with warrants attached. It's just a pig with a different type of lipstick. Warrants are "sweeteners" in financing deals. In the case of the Exelixis financing, the convertible arm was a "sweetener" in lieu of warrants. Why are they called "sweeteners"? Because an investor can use the common equity portion of the deal to finance a portion or all of the warrants/convertible arm.
In the case of common equity and warrant deals, you'll often see a fund take down, let's say, 5 million shares of XYZ common stock, and, also be apportioned 0.5 warrants for every common share. Oftentimes, a few weeks later, when the 13F filings come out at the end of the quarter, you'll notice that very same fund owns absolutely no shares of the common stock, despite the stock having barely moved. How is this possible? Because the fund likely used the common shares in a short position to pay for the warrants, making the warrant arm of the trade almost risk-free, or reduce the cost of the warrants greatly.
Let's take a closer look at what investors in the Exelixis financing are likely doing: A hedge fund buys Exelixis common stock, in size, at $4.25 per share and has the ability to own more stock at $5.31 per share at some point in the future with the convertible arm. Therefore, any time Exelixis' stock price rises above $4.25 by a reasonable amount, the hedge fund can short the stock and use profits from that short sale to pay for the convertible stock.
For instance, days, weeks or months later, if Exelixis' stock is trading at $5.50 and the hedge fund bought 10 million shares in the financing deal, it could short 10 million shares and "arbitrage" the profits. (Since the hedge fund owns 10 million shares at $4.25, it profits from the cost basis of the short versus its long position received in the deal at $4.25.) The fund then takes those profits and uses them to pay for the convertible arm in full, or reduces the cost basis of the convertible.
Why do this? Easy, it's almost like free money. Furthermore, if an investor thinks Exelixis' cancer drug cabozantinib is going to be a billion-dollar blockbuster drug, then owning the stock at $5.31 -- or lower, cost-basis adjusted -- is a no brainer. And, if investors can get convertible shares for free, it's even better.
When a company raises money through an equity sale with warrant or convertible notes as a sweetener, investors who aren't lucky enough to participate should run away from the stock - fast."
Gruß
Antwort auf Beitrag Nr.: 43.674.558 von ipollit am 03.10.12 19:00:55Hallo ipollit,
Du hattest vor einer Weile gefragt, ob man die Absetzung des ODAC-Panels für Cabo im November positiv oder negativ sehen sollte.
Hier ist ein umfassender und für mich einleuchtender Artikel zum Thema:
Evidence Suggests Likely Approval of Cabozantinib for Metastatic Medullary Thyroid Cancer
Exelixis (NASDAQ:EXEL) has a Prescription Drug User Fee Act (PDUFA) action date on November 29th, 2012 for cabozantinib as a treatment for patients with progressive, unresectable, locally advanced, or metastatic medullary thyroid cancer (MTC). The FDA’s Oncologic Drugs Advisory Committee (ODAC) had a discussion of cabozantinib on its schedule for the November 8th-9th meeting but the company recently announced that cabozantinib was removed from the schedule. The question is whether this cancellation is a positive or negative indicator. To get at this question, it is useful to work through two of the most likely reasons that the cancellation is negative: (1) the drug is so marginally effective the FDA sees no reason to discuss it or (2) the drug is effective but so toxic that the side effects clearly outweigh the benefits. If these are not plausible (or not supported by what we know of the efficacy and safety of cabozantinib) then the risk/reward profile of the bullish case looks attractive, especially after a recent pullback.
Hier gehts weiter:
http://propthink.com/evidence-suggests-likely-approval-of-ca…
PS: Die Kapitalmaßnahme sehe ich nicht so sehr kritisch. Für ein Biotech ist es nicht leicht eine PIII zu stemmen und dafür viel Geld einzuwerben. Da muss man wahrscheinlich alle Register ziehen. Incyte hatte auch mal eine üble Finanzierungsstruktur, bevor alles gut wurde.
Kritisch sehe ich eher, dass sie keinen Partner für Cabo haben und alles alleine finanzieren müssen. Findet niemand mehr den Kandidaten spannend, nachdem sie zwei mal den Partner verloren haben?
Du hattest vor einer Weile gefragt, ob man die Absetzung des ODAC-Panels für Cabo im November positiv oder negativ sehen sollte.
Hier ist ein umfassender und für mich einleuchtender Artikel zum Thema:
Evidence Suggests Likely Approval of Cabozantinib for Metastatic Medullary Thyroid Cancer
Exelixis (NASDAQ:EXEL) has a Prescription Drug User Fee Act (PDUFA) action date on November 29th, 2012 for cabozantinib as a treatment for patients with progressive, unresectable, locally advanced, or metastatic medullary thyroid cancer (MTC). The FDA’s Oncologic Drugs Advisory Committee (ODAC) had a discussion of cabozantinib on its schedule for the November 8th-9th meeting but the company recently announced that cabozantinib was removed from the schedule. The question is whether this cancellation is a positive or negative indicator. To get at this question, it is useful to work through two of the most likely reasons that the cancellation is negative: (1) the drug is so marginally effective the FDA sees no reason to discuss it or (2) the drug is effective but so toxic that the side effects clearly outweigh the benefits. If these are not plausible (or not supported by what we know of the efficacy and safety of cabozantinib) then the risk/reward profile of the bullish case looks attractive, especially after a recent pullback.
Hier gehts weiter:
http://propthink.com/evidence-suggests-likely-approval-of-ca…
PS: Die Kapitalmaßnahme sehe ich nicht so sehr kritisch. Für ein Biotech ist es nicht leicht eine PIII zu stemmen und dafür viel Geld einzuwerben. Da muss man wahrscheinlich alle Register ziehen. Incyte hatte auch mal eine üble Finanzierungsstruktur, bevor alles gut wurde.
Kritisch sehe ich eher, dass sie keinen Partner für Cabo haben und alles alleine finanzieren müssen. Findet niemand mehr den Kandidaten spannend, nachdem sie zwei mal den Partner verloren haben?
Hallo ipollit,
hast Du den jüngsten Kursrutsch bei IMGN beobachtet?
Ich habe darin eine Gelegenheit gesehen und bin bei IMGN wieder eingestiegen.
Im Thread hat JoschkaSchröder sich unter anderem auch sehr hilfreiche Gedanken zur Bewertung gemacht:
Thread: Immunogen: T-DM1 ein zukünftiger Blockbuster
Deine Meinung würde mich sehr interessieren.
Grüße
SLG
hast Du den jüngsten Kursrutsch bei IMGN beobachtet?
Ich habe darin eine Gelegenheit gesehen und bin bei IMGN wieder eingestiegen.
Im Thread hat JoschkaSchröder sich unter anderem auch sehr hilfreiche Gedanken zur Bewertung gemacht:
Thread: Immunogen: T-DM1 ein zukünftiger Blockbuster
Deine Meinung würde mich sehr interessieren.
Grüße
SLG
Hallo SLGramann,
bisher bin ich noch nicht wieder in IMGN eingestiegen. Ähnlich wie bei MOR würde ich es besser finden, wenn die Royalties etwas höher wären. In der Pipeline kenne ich mich ehrlich gesagt nicht so aus und in T-DM1 sehe ich am Ende doch eher ein Risiko als eine Chance. Wird nicht immer davon ausgegangen, dass T-DM1 Herceptin komplett ersetzt und die Umsätze von Herceptin locker überschritten werden. Aber ist das wirklich so sicher? Die wirksamste zukünftige Kombi wird wohl T-DM1 + Perjeta sein. Die Kosten für diese beiden werden 3x höher liegen als für Herceptin heute, das noch nicht generisch ist. Mit 6 Mrd Umsatz ist Herceptin heute schon an der Spitze... da sollen in Zukunft locker 12 Mrd USD drin sein? Würde Herceptin komplett durch T-DM1+Perjeta abgelöst, so wären es wegen der längeren möglichen Behandlungsdauer sogar noch mehr Kosten als nur durch den 3fachen Preis (wobei T-DM1 jeweils nur die Hälfte ausmacht)... also deutlich über 20 Mrd USD. Wo soll da eine Grenze sein? Wenn extrem teuere Medikamente nur für sehr wenige Patienten in Frage kommen mit sehr seltenen Krankheiten, dann ist das noch einigermaßen akzeptabel. Aber wie gesagt liegt Herceptin jetzt schon an der Spitze. Wenn HER+ Brustkrebs ein 20 Mrd Markt sein soll, warum nicht dann z.B. CLDXs CDX-011 gegen GPNMB+ Brustkrebs noch mehr, da sich mit diesem ADC ein noch höherer Anteil an Brustkrebs-Patienten behandeln ließe? Daher sehe ich bei T-DM1 eher Fragezeichen, wo andere schon sehr hohe Gewinne ansetzen. Der zukünftige HER+ Markt wird wohl größer als heute sein, T-DM1 wird aber vielleicht nur einen Teil davon abdecken.
Biotechs sind momentan ja insgesamt etwas zurückgekommen. Da sprechen mich vielleicht doch eher andere an als IMGN... wobei ich bisher IMGN als recht abhängig von T-DM1 gesehen habe. IMGN wäre für mich im Moment nur eine Ergänzung.
Gruß
ipollit
bisher bin ich noch nicht wieder in IMGN eingestiegen. Ähnlich wie bei MOR würde ich es besser finden, wenn die Royalties etwas höher wären. In der Pipeline kenne ich mich ehrlich gesagt nicht so aus und in T-DM1 sehe ich am Ende doch eher ein Risiko als eine Chance. Wird nicht immer davon ausgegangen, dass T-DM1 Herceptin komplett ersetzt und die Umsätze von Herceptin locker überschritten werden. Aber ist das wirklich so sicher? Die wirksamste zukünftige Kombi wird wohl T-DM1 + Perjeta sein. Die Kosten für diese beiden werden 3x höher liegen als für Herceptin heute, das noch nicht generisch ist. Mit 6 Mrd Umsatz ist Herceptin heute schon an der Spitze... da sollen in Zukunft locker 12 Mrd USD drin sein? Würde Herceptin komplett durch T-DM1+Perjeta abgelöst, so wären es wegen der längeren möglichen Behandlungsdauer sogar noch mehr Kosten als nur durch den 3fachen Preis (wobei T-DM1 jeweils nur die Hälfte ausmacht)... also deutlich über 20 Mrd USD. Wo soll da eine Grenze sein? Wenn extrem teuere Medikamente nur für sehr wenige Patienten in Frage kommen mit sehr seltenen Krankheiten, dann ist das noch einigermaßen akzeptabel. Aber wie gesagt liegt Herceptin jetzt schon an der Spitze. Wenn HER+ Brustkrebs ein 20 Mrd Markt sein soll, warum nicht dann z.B. CLDXs CDX-011 gegen GPNMB+ Brustkrebs noch mehr, da sich mit diesem ADC ein noch höherer Anteil an Brustkrebs-Patienten behandeln ließe? Daher sehe ich bei T-DM1 eher Fragezeichen, wo andere schon sehr hohe Gewinne ansetzen. Der zukünftige HER+ Markt wird wohl größer als heute sein, T-DM1 wird aber vielleicht nur einen Teil davon abdecken.
Biotechs sind momentan ja insgesamt etwas zurückgekommen. Da sprechen mich vielleicht doch eher andere an als IMGN... wobei ich bisher IMGN als recht abhängig von T-DM1 gesehen habe. IMGN wäre für mich im Moment nur eine Ergänzung.
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.784.297 von ipollit am 04.11.12 16:44:01Hallo ipollit,
vielen Dank für Dein Statement!
Ich könnte mir auch gut vorstellen, dass es langfristig auf eine T-DM1+Perjeta -Kombi hinausläuft. Roche testet ja schon entsprechend.
Davon unabhängig sehe ich aber für T-DM1 in der absehbaren Zukunft ein Potential von bis zu 2 Milliarden Dollar bei mBC. Bei rund 4% Royalties also ungefähr 80 Millionen für IMGN.
Bis dahin sehe ich persönlich wenig Risiko. Alles, was darüber hinausgeht würde ich auch erst mal abwarten wollen.
Wenn ich diese 80 Mio. unterstelle, dann deckt T-DM1 natürlich perspektivisch einen sehr großen Teil der heutigen Marktkapitalisierung ab.
Den "Rest" halte ich für mehr oder weniger geschenkt.
Bin natürlich sehr auf die neuen Daten zu CDX-011 gespannt (SABCS Anfang Dezember, oder?).
Grüße
SLG
vielen Dank für Dein Statement!
Ich könnte mir auch gut vorstellen, dass es langfristig auf eine T-DM1+Perjeta -Kombi hinausläuft. Roche testet ja schon entsprechend.
Davon unabhängig sehe ich aber für T-DM1 in der absehbaren Zukunft ein Potential von bis zu 2 Milliarden Dollar bei mBC. Bei rund 4% Royalties also ungefähr 80 Millionen für IMGN.
Bis dahin sehe ich persönlich wenig Risiko. Alles, was darüber hinausgeht würde ich auch erst mal abwarten wollen.
Wenn ich diese 80 Mio. unterstelle, dann deckt T-DM1 natürlich perspektivisch einen sehr großen Teil der heutigen Marktkapitalisierung ab.
Den "Rest" halte ich für mehr oder weniger geschenkt.
Bin natürlich sehr auf die neuen Daten zu CDX-011 gespannt (SABCS Anfang Dezember, oder?).
Grüße
SLG
Ja, zu CDX-011 könnte es dann neue Daten geben: https://www.crosscurrentllc.com/uploads/CLDX_11-2-12_San_Ant…
ich hatte mir vor einiger Zeit nochmal PCYC angesehen. Die PIIIs/PIIs sind bis auf die Rituxan-Kombi open-label, so dass dort permanent aktuelle Ergebnisse gemeldet werden können, oder verstehe ich das falsch? Außerdem scheint es mit der in diesen Jahr gestarteten MCL(nach Velcade)-PII den von Ohad Hammer gewünschten schnellen Zugang zum Markt zu geben...Ergebnisse nächstes Jahr, Zulassung 2014?
Gruß
ich hatte mir vor einiger Zeit nochmal PCYC angesehen. Die PIIIs/PIIs sind bis auf die Rituxan-Kombi open-label, so dass dort permanent aktuelle Ergebnisse gemeldet werden können, oder verstehe ich das falsch? Außerdem scheint es mit der in diesen Jahr gestarteten MCL(nach Velcade)-PII den von Ohad Hammer gewünschten schnellen Zugang zum Markt zu geben...Ergebnisse nächstes Jahr, Zulassung 2014?
Gruß
Antwort auf Beitrag Nr.: 43.784.647 von ipollit am 04.11.12 19:04:25Hallo ipollit,
zu CLDX:
Analysts at Jefferies Group upped their price target on shares of Celldex Therapeutics (NASDAQ: CLDX) from $6.00 to $7.00 in a research report issued to clients and investors on Friday. The firm currently has a “buy” rating on the stock.
The analysts wrote, “CLDX released an incremental pipeline update w/ focus on more mature data from CDX-011 EMERGE trial scheduled for presentation at San Antonio Breast mtg on 12/8. We expect EMERGE dataset along w/ FDA end of PhII mtg at year-end should help to guide CDX-011′s late-stage development strategy. We continue to maintain a Buy based on the company’s pipeline potential.”
Entscheidend ist hier wirklich, dass in den nächsten Monaten klar wird, ob und wie man mit CDX-011 zu einem "Pivotal-Trial" kommt. Ich hoffe, dass eine PIIb ausreicht. Die könnte CLDX vielleicht auch allein stemmen und dann nur für die Kommerzialisierung verpartnern.
zu PCYC:
Ehrlich gesagt ist mir auch nicht ganz klar, warum es zulassungsrelevante PIII-Trials gibt, die nicht verblindet sind. Habe ich aber auch schon bei Anderen gesehen.
Denke auch, dass Ibrutinib schneller am Markt sein wird, als mancher denkt. Auch mal sehen, was sich da bei MM und Autoimmunkrankheiten in Zuunft noch an Potential ergeben wird.
Nochmal zu IMGN:
Ich finde Deine Argumentation bezüglich der Kosten zwar sehr nachvollziehbar, aber das ist eben eine politische Frage. Es ist etwas schwierig, wenn man eine Veränderung des Regulierungsrahmens annimmt. Wir müssen ja doch heute eher davon ausgehen, was heute ist. Was da mal passieren wird, weiß ja eh keiner.
(Obwohl ich das Thema auch nicht kleinreden will. Man stelle sich mal vor, ein mab würde wirklich mal bei Alzheimer wirken. Was dann?)
Was konkret BC angeht gehe ich aber davon aus, dass die Patientinnen (zum Glück) eine sehr starke Lobby haben. Wenn T-DM1+Perjeta einen signifikanten Behandlungserfolg bringen würde (woran ich glaube), dann wären m.E. auch Kosten von 20 Mrd. durchsetzbar.
Grüße
zu CLDX:
Analysts at Jefferies Group upped their price target on shares of Celldex Therapeutics (NASDAQ: CLDX) from $6.00 to $7.00 in a research report issued to clients and investors on Friday. The firm currently has a “buy” rating on the stock.
The analysts wrote, “CLDX released an incremental pipeline update w/ focus on more mature data from CDX-011 EMERGE trial scheduled for presentation at San Antonio Breast mtg on 12/8. We expect EMERGE dataset along w/ FDA end of PhII mtg at year-end should help to guide CDX-011′s late-stage development strategy. We continue to maintain a Buy based on the company’s pipeline potential.”
Entscheidend ist hier wirklich, dass in den nächsten Monaten klar wird, ob und wie man mit CDX-011 zu einem "Pivotal-Trial" kommt. Ich hoffe, dass eine PIIb ausreicht. Die könnte CLDX vielleicht auch allein stemmen und dann nur für die Kommerzialisierung verpartnern.
zu PCYC:
Ehrlich gesagt ist mir auch nicht ganz klar, warum es zulassungsrelevante PIII-Trials gibt, die nicht verblindet sind. Habe ich aber auch schon bei Anderen gesehen.
Denke auch, dass Ibrutinib schneller am Markt sein wird, als mancher denkt. Auch mal sehen, was sich da bei MM und Autoimmunkrankheiten in Zuunft noch an Potential ergeben wird.
Nochmal zu IMGN:
Ich finde Deine Argumentation bezüglich der Kosten zwar sehr nachvollziehbar, aber das ist eben eine politische Frage. Es ist etwas schwierig, wenn man eine Veränderung des Regulierungsrahmens annimmt. Wir müssen ja doch heute eher davon ausgehen, was heute ist. Was da mal passieren wird, weiß ja eh keiner.
(Obwohl ich das Thema auch nicht kleinreden will. Man stelle sich mal vor, ein mab würde wirklich mal bei Alzheimer wirken. Was dann?)
Was konkret BC angeht gehe ich aber davon aus, dass die Patientinnen (zum Glück) eine sehr starke Lobby haben. Wenn T-DM1+Perjeta einen signifikanten Behandlungserfolg bringen würde (woran ich glaube), dann wären m.E. auch Kosten von 20 Mrd. durchsetzbar.
Grüße
Gibt ja viele Neuigkeiten heute...
Arry finde ich enorm stark!
Hat Arry-520 jetzt 22% oder 28% response rate gezeigt? Habe beide Zahlen gefunden.
Beides ist sehr stark!
Und dazu kommt jetzt möglicherweise noch ein Biomarker:
In a related abstract assessing the same group of ARRY-520-treated patients, we observed that prospective screening for the acute phase protein alpha-1-acidic glycoprotein, or AAG, may enable us to better select patients who will respond to treatment with ARRY-520. For patients with a non-elevated AAG level, the overall response rate (≥PR) increased to 33%. We believe these observed overall response rates in a heavily pre-treated patient population with limited treatment options defines a potential regulatory path to approval for ARRY-520."
Finde ich bis hierher alles sehr heiß!
Habe meine Position heute deutlich aufgestockt.
Arry finde ich enorm stark!
Hat Arry-520 jetzt 22% oder 28% response rate gezeigt? Habe beide Zahlen gefunden.
Beides ist sehr stark!
Und dazu kommt jetzt möglicherweise noch ein Biomarker:
In a related abstract assessing the same group of ARRY-520-treated patients, we observed that prospective screening for the acute phase protein alpha-1-acidic glycoprotein, or AAG, may enable us to better select patients who will respond to treatment with ARRY-520. For patients with a non-elevated AAG level, the overall response rate (≥PR) increased to 33%. We believe these observed overall response rates in a heavily pre-treated patient population with limited treatment options defines a potential regulatory path to approval for ARRY-520."
Finde ich bis hierher alles sehr heiß!
Habe meine Position heute deutlich aufgestockt.
Biomarin heute verkauft. War eine Goldgrube
http://www.bizjournals.com/sanfrancisco/blog/biotech/2012/11…
http://www.bizjournals.com/sanfrancisco/blog/biotech/2012/11…
"Hat Arry-520 jetzt 22% oder 28% response rate gezeigt?"... 22% für ARRY-520 + dex, 28% für CELGs Pomalidomide + dex, wobei Array meint, dass in ihrer Studie die Patienten noch weniger auf andere Therapien angesprochen haben.
Der gefundene Biomarker soll ARRY-520 binden und dadurch die Wirkung reduzieren.
CC-Notes...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY - 520/614 ASH CC notes
1. Squarer on two separate occasions mentioned the NVS R&D Day this Thursday and encouraged ARRY investors to listen to hear about forward plans for MEK162.
2. The ARRY-797 late-breaker abstract for the ACR meeting was accepted.
3. Per slide 12, ARRY intends to pursue accelerated approval of ARRY-520 plus dexamethasone in triple-refractory MM patients and intends to pursue a confirmatory study of 520+either bortezomib or carfilzomib in relapsed and refractory MM. Pivotal trial expected to begin in 2013.
4. ARRY hopes for durability north of 4-5 months for 520 in patients with the low AAG biomarker. Koch said 1/3 of MM patients have elevated AAG (i.e., 2/3 of MM patients could conceivably be targeted with 520). ARRY isn't certain if 520 pivotal trial would be solely focused on patients with lower levels of AAG or if ARRY would pursue a dual primary endpoint.
5. Koch is "very enthusiastic" about 520+carfilzomib combo data but deferred to the data that will be presented at the actual ASH meeting.
6. Squarer interestingly (IMHO) metioned that ARRY's relationship with ONXX is "positive" and ONXX/ARRY have had discussions about co-funding and sharing the costs of 520+carfilzomib trials going forward. Squarer reiterated that ARRY still intends to go it alone on 520 and 614 but ARRY may be open to geographies outside the U.S. and Europe. (Does anyone see ONXX as a potential partner, at a minimum, for ARRY in the future provided 520 and/or 614 data pans out? Obviously ONXX has a hem-onc interest. Just thought Squarer's comments here were interesting; don't recall ARRY ever mentioning any discussions with ONXX before.)
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY - 1Q13 CC notes
1. ARRY is seeing disease modification in OA for cartilage and bone degradation with ARRY-797, on top of the pain relief. ARRY believes this disease modification on top of pain relief from 797 is unprecedented. ARRY guided for a 797 partner for 1H13.
2. For ARRY-520, ASH abstracts will be out next Monday and the 520 abstract, if accepted, should show the biomarker they have identified that can predict patient response. The idea is that with a biomarker in hand they can select only the patients for future trials that will respond to 520 (which would hopefully enhance chances for success). The biomarker is a relatively common biomarker and won't require a new test to be created and approved.
3. Despite not being mentioned in the results PR, ARRY mentioned AMG151 in the CC and the drug appears to be on track with mention of expectation of completion of enrollment in the P2 trial being run by AMGN.
4. Regarding discussion of the MEK indications of most interest to NVS with MEK162, the combo with the NVS BRAF inhibitor LGX818 was identified. Despite being behind in the BRAF space, it was mentioned that it appears that NVS believes they have a best-in-class BRAF inhibitor. It was also noted that the MEK162 combos with various NVS PI3K inhibitors continue to be of great interest.
5. Regarding the recent deal that CELG inked with the private VentiRX (#msg-80159597 ) for VTX-2337, ARRY is ultimately entitled to royalties on this drug and has an ownership interest in VentiRx.
****
also am Donnerstag u.U. neues zu MEK162 und nächste Woche Dienstag Details zu ARRY-797:
BOULDER, Colo., Nov. 6, 2012 /PRNewswire/ -- Array BioPharma Inc. (NASDAQ: ARRY) announced that an abstract discussing the final Phase 2 trial results with ARRY-797 in patients with osteoarthritis pain will be presented at the 2012 American College of Rheumatology Annual Meeting in Washington, D.C. This abstract includes data on ARRY-797's analgesic effect and markers of disease modification. In addition, biomarkers of cartilage (COMP) and bone (CTX‑I) degradation were assessed. ARRY‑797 treatment resulted in statistically significant decreases in COMP and CTX‑I at week 4 (decreases of 10% and 38% versus placebo, respectively). The decrease in CTX‑I was sustained and returned to baseline by the follow‑up visit. The abstract concludes that further evaluation of the potential for disease modifying activity is warranted.
...
Given our internal focus on hematology/oncology, Array is in active discussions with potential partners to maximize the value of this drug.
Gruß
ipollit
Der gefundene Biomarker soll ARRY-520 binden und dadurch die Wirkung reduzieren.
CC-Notes...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY - 520/614 ASH CC notes
1. Squarer on two separate occasions mentioned the NVS R&D Day this Thursday and encouraged ARRY investors to listen to hear about forward plans for MEK162.
2. The ARRY-797 late-breaker abstract for the ACR meeting was accepted.
3. Per slide 12, ARRY intends to pursue accelerated approval of ARRY-520 plus dexamethasone in triple-refractory MM patients and intends to pursue a confirmatory study of 520+either bortezomib or carfilzomib in relapsed and refractory MM. Pivotal trial expected to begin in 2013.
4. ARRY hopes for durability north of 4-5 months for 520 in patients with the low AAG biomarker. Koch said 1/3 of MM patients have elevated AAG (i.e., 2/3 of MM patients could conceivably be targeted with 520). ARRY isn't certain if 520 pivotal trial would be solely focused on patients with lower levels of AAG or if ARRY would pursue a dual primary endpoint.
5. Koch is "very enthusiastic" about 520+carfilzomib combo data but deferred to the data that will be presented at the actual ASH meeting.
6. Squarer interestingly (IMHO) metioned that ARRY's relationship with ONXX is "positive" and ONXX/ARRY have had discussions about co-funding and sharing the costs of 520+carfilzomib trials going forward. Squarer reiterated that ARRY still intends to go it alone on 520 and 614 but ARRY may be open to geographies outside the U.S. and Europe. (Does anyone see ONXX as a potential partner, at a minimum, for ARRY in the future provided 520 and/or 614 data pans out? Obviously ONXX has a hem-onc interest. Just thought Squarer's comments here were interesting; don't recall ARRY ever mentioning any discussions with ONXX before.)
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY - 1Q13 CC notes
1. ARRY is seeing disease modification in OA for cartilage and bone degradation with ARRY-797, on top of the pain relief. ARRY believes this disease modification on top of pain relief from 797 is unprecedented. ARRY guided for a 797 partner for 1H13.
2. For ARRY-520, ASH abstracts will be out next Monday and the 520 abstract, if accepted, should show the biomarker they have identified that can predict patient response. The idea is that with a biomarker in hand they can select only the patients for future trials that will respond to 520 (which would hopefully enhance chances for success). The biomarker is a relatively common biomarker and won't require a new test to be created and approved.
3. Despite not being mentioned in the results PR, ARRY mentioned AMG151 in the CC and the drug appears to be on track with mention of expectation of completion of enrollment in the P2 trial being run by AMGN.
4. Regarding discussion of the MEK indications of most interest to NVS with MEK162, the combo with the NVS BRAF inhibitor LGX818 was identified. Despite being behind in the BRAF space, it was mentioned that it appears that NVS believes they have a best-in-class BRAF inhibitor. It was also noted that the MEK162 combos with various NVS PI3K inhibitors continue to be of great interest.
5. Regarding the recent deal that CELG inked with the private VentiRX (#msg-80159597 ) for VTX-2337, ARRY is ultimately entitled to royalties on this drug and has an ownership interest in VentiRx.
****
also am Donnerstag u.U. neues zu MEK162 und nächste Woche Dienstag Details zu ARRY-797:
BOULDER, Colo., Nov. 6, 2012 /PRNewswire/ -- Array BioPharma Inc. (NASDAQ: ARRY) announced that an abstract discussing the final Phase 2 trial results with ARRY-797 in patients with osteoarthritis pain will be presented at the 2012 American College of Rheumatology Annual Meeting in Washington, D.C. This abstract includes data on ARRY-797's analgesic effect and markers of disease modification. In addition, biomarkers of cartilage (COMP) and bone (CTX‑I) degradation were assessed. ARRY‑797 treatment resulted in statistically significant decreases in COMP and CTX‑I at week 4 (decreases of 10% and 38% versus placebo, respectively). The decrease in CTX‑I was sustained and returned to baseline by the follow‑up visit. The abstract concludes that further evaluation of the potential for disease modifying activity is warranted.
...
Given our internal focus on hematology/oncology, Array is in active discussions with potential partners to maximize the value of this drug.
Gruß
ipollit
zufällig gerade gesehen... die FDA hat heute Pfizers JAK Tofacitinib (nun Xeljanz) in RA zugelassen
INCYs/Lillys Baricitinib könnte Tofacitinib folgen (momentan in PIII)...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Advantages they noted in the CC:
- once a day versus twice a day as an advantage for baricitinib over tofacitinib.
- reduced number of drug interactions because it is not cleared in the liver as tofacitinib is.
Potential advantage, which they think might be borne out in the clinical studies:
-better safety profile in terms of Infections because it is not a JAK3 inhibitor
***
Noch etwas zu einem möglichen JAK1 von INCY in PII... scheint doch im Prinzip ein JAK1/2 zu sein:
http://seekingalpha.com/article/969661-incyte-s-ceo-discusse…
"with regard to our compound INCYTE 39110 we posted clinical trials in Myelofibrosis, rheumatoid arthritis, and psoriasis...
Rachel McMinn - Bank of America Merrill Lynch
Great. And then just one quick follow up for Paul or Rich: on your JAK1 program, I’m just curious if you have any more comments in regards to inflammation versus Myelofibrosis. I would expect something with very limited JAK2 selectivity to not work in MF but clearly you feel differently because you’re running a study there, so what are appropriate expectations in that setting? Thanks.
Rich Levy - Executive Vice President & Chief Drug Development and Medical Officer
So first of all, 39110, a JAK inhibitor with a different profile than ruxolitinib – we’re putting it into studies for which we already have data from our JAK1/JAK2 programs to be able to compare how that profile differs in diseases that we understand, and in where we can get data in a relatively short period of time. And those results will then determine whether or not we proceed further with those studies or go into different types of indications. And beyond that, in the absence of data I don’t really have further comments."
Gruß
ipollit
INCYs/Lillys Baricitinib könnte Tofacitinib folgen (momentan in PIII)...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Advantages they noted in the CC:
- once a day versus twice a day as an advantage for baricitinib over tofacitinib.
- reduced number of drug interactions because it is not cleared in the liver as tofacitinib is.
Potential advantage, which they think might be borne out in the clinical studies:
-better safety profile in terms of Infections because it is not a JAK3 inhibitor
***
Noch etwas zu einem möglichen JAK1 von INCY in PII... scheint doch im Prinzip ein JAK1/2 zu sein:
http://seekingalpha.com/article/969661-incyte-s-ceo-discusse…
"with regard to our compound INCYTE 39110 we posted clinical trials in Myelofibrosis, rheumatoid arthritis, and psoriasis...
Rachel McMinn - Bank of America Merrill Lynch
Great. And then just one quick follow up for Paul or Rich: on your JAK1 program, I’m just curious if you have any more comments in regards to inflammation versus Myelofibrosis. I would expect something with very limited JAK2 selectivity to not work in MF but clearly you feel differently because you’re running a study there, so what are appropriate expectations in that setting? Thanks.
Rich Levy - Executive Vice President & Chief Drug Development and Medical Officer
So first of all, 39110, a JAK inhibitor with a different profile than ruxolitinib – we’re putting it into studies for which we already have data from our JAK1/JAK2 programs to be able to compare how that profile differs in diseases that we understand, and in where we can get data in a relatively short period of time. And those results will then determine whether or not we proceed further with those studies or go into different types of indications. And beyond that, in the absence of data I don’t really have further comments."
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.793.921 von ipollit am 06.11.12 22:54:59Mein Timing für den Arry-Nachkauf war wieder mal "brilliant"... 
BOULDER, Colo., Nov. 8, 2012 /PRNewswire/ -- Array BioPharma Inc. (NasdaqGM: ARRY) announced today that it is offering to sell, subject to market and other conditions, shares of its common stock pursuant to an effective shelf registration statement in an underwritten public offering. Array also intends to grant the underwriters a 30-day option to purchase additional shares of common stock to cover over-allotments, if any. All of the shares to be sold in the offering are to be sold by Array, with the proceeds to be used to fund research and development activities and for general corporate purposes. Jefferies & Company, Inc. and J.P. Morgan Securities LLC are acting as joint book-running managers for the proposed offering, with Piper Jaffray & Co., Stifel Nicolaus Weisel and William Blair acting as co-managers.

BOULDER, Colo., Nov. 8, 2012 /PRNewswire/ -- Array BioPharma Inc. (NasdaqGM: ARRY) announced today that it is offering to sell, subject to market and other conditions, shares of its common stock pursuant to an effective shelf registration statement in an underwritten public offering. Array also intends to grant the underwriters a 30-day option to purchase additional shares of common stock to cover over-allotments, if any. All of the shares to be sold in the offering are to be sold by Array, with the proceeds to be used to fund research and development activities and for general corporate purposes. Jefferies & Company, Inc. and J.P. Morgan Securities LLC are acting as joint book-running managers for the proposed offering, with Piper Jaffray & Co., Stifel Nicolaus Weisel and William Blair acting as co-managers.
Antwort auf Beitrag Nr.: 43.804.986 von SLGramann am 09.11.12 08:17:12Häh? Schon wieder?
Hallo ipollit und Andere,
Hammer mit einem neuen Artikel zur ASH (unter anderem auch Array Thema):
http://www.hammerstockblog.com/top-picks-for-ash-2012/
Habe meine Array-Posi weiter aufgestockt.
Ich gehe davon aus, dass man für Arry-520 eine Zulassung bekommen wird.
Entweder erreicht Arry520+Dex schon die erforderlichen Werte (OR 20%+x mit 5 Monaten), dann könnte die Zulassung auf Basis von PII-Daten denkbar sein.
Wenn nicht, halte ich den Weg über den Biomarker und/oder über eine Kombi mit Kyprolis für sehr aussichtsreich. Dauert dann nur länger.
Nach wie vor finde ich Array schon allein wegen der ARRY520-Daten stark unterbewertet.
Hammer mit einem neuen Artikel zur ASH (unter anderem auch Array Thema):
http://www.hammerstockblog.com/top-picks-for-ash-2012/
Habe meine Array-Posi weiter aufgestockt.
Ich gehe davon aus, dass man für Arry-520 eine Zulassung bekommen wird.
Entweder erreicht Arry520+Dex schon die erforderlichen Werte (OR 20%+x mit 5 Monaten), dann könnte die Zulassung auf Basis von PII-Daten denkbar sein.
Wenn nicht, halte ich den Weg über den Biomarker und/oder über eine Kombi mit Kyprolis für sehr aussichtsreich. Dauert dann nur länger.
Nach wie vor finde ich Array schon allein wegen der ARRY520-Daten stark unterbewertet.
hier noch ein paar Kommentare von ihub...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY @ Jefferies (11/15/12)
1. ARRY's recent cash raise was designated for taking ARRY-614 and ARRY-520 forward.
2. 614 was reformulated with a new "salt" to improve the bioavailablity compared to the prior version.
3. ARRY was recently told by AZN to likely expect the P2 selumetinib BRAF melanoma data at ASCO 2013 (this is one of the most overdue timelines for drug results that I have ever seen personally, not that that necessarily means anything). ARRY expects this to be another data point showing that selumetinib is active but seems to question if AZN will push forward in BRAF melanoma given that they are behind the competition here.
4. Some discussion of AZN's CEO having reviewed the plans for selumetinib and being "comfortable" with them. ARRY seems confident that AZN will take selumetinib into pivotals in at least NSCLC and possibly thyroid and other indications. Also noted that AZN may give details on their future plans for selumetinib at their next R&D Day, which may occur in 1Q2013. There were comments on the tox issues with the GSK MEK and it not being very combinable with docetaxel and how this favors selumetinib because it is at least more combinable than the GSK MEK as it relates to safety.
5. ARRY expects to initiate a pivotal trial on its own with MEK162 next year in one indication.
6. ARRY expects that there will be combo data for the 8, 9, or 10 combo trials that NVS is running with MEK162 at ASCO 2013.
7. ARRY-797 partnership interest has "accelerated" after the disease modification data was announced. ARRY is still guiding for a partner in 1H13.
Bin mal gespannt, welche Kombi Array für die eigene MEK162-PIII wählt.
***
noch ein ihub-Kommentar zu CLDX:
http://investorshub.advfn.com/boards/replies.aspx?msg=815496…
I still say the key near-term for CLDX is the 011 update next month at the SABCS. I am holding in full through that event. CLDX also just said at Lazard they intend to expand testing of 011 into other indications where they see high GPNMB. Hopefully this bodes well for the update in breast cancer at the SABCS but, as always, no guarantees.
***
Nachdem die Woche CLVS CO-101 komplett gescheitert ist, habe ich mal eine kleine Position aufgebaut. Insgesamt sind die Biotechs seit einiger Zeit ja deutlich unter Druck... mal schauen, wie es weiter geht.
Gruß
ipollit
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY @ Jefferies (11/15/12)
1. ARRY's recent cash raise was designated for taking ARRY-614 and ARRY-520 forward.
2. 614 was reformulated with a new "salt" to improve the bioavailablity compared to the prior version.
3. ARRY was recently told by AZN to likely expect the P2 selumetinib BRAF melanoma data at ASCO 2013 (this is one of the most overdue timelines for drug results that I have ever seen personally, not that that necessarily means anything). ARRY expects this to be another data point showing that selumetinib is active but seems to question if AZN will push forward in BRAF melanoma given that they are behind the competition here.
4. Some discussion of AZN's CEO having reviewed the plans for selumetinib and being "comfortable" with them. ARRY seems confident that AZN will take selumetinib into pivotals in at least NSCLC and possibly thyroid and other indications. Also noted that AZN may give details on their future plans for selumetinib at their next R&D Day, which may occur in 1Q2013. There were comments on the tox issues with the GSK MEK and it not being very combinable with docetaxel and how this favors selumetinib because it is at least more combinable than the GSK MEK as it relates to safety.
5. ARRY expects to initiate a pivotal trial on its own with MEK162 next year in one indication.
6. ARRY expects that there will be combo data for the 8, 9, or 10 combo trials that NVS is running with MEK162 at ASCO 2013.
7. ARRY-797 partnership interest has "accelerated" after the disease modification data was announced. ARRY is still guiding for a partner in 1H13.
Bin mal gespannt, welche Kombi Array für die eigene MEK162-PIII wählt.
***
noch ein ihub-Kommentar zu CLDX:
http://investorshub.advfn.com/boards/replies.aspx?msg=815496…
I still say the key near-term for CLDX is the 011 update next month at the SABCS. I am holding in full through that event. CLDX also just said at Lazard they intend to expand testing of 011 into other indications where they see high GPNMB. Hopefully this bodes well for the update in breast cancer at the SABCS but, as always, no guarantees.
***
Nachdem die Woche CLVS CO-101 komplett gescheitert ist, habe ich mal eine kleine Position aufgebaut. Insgesamt sind die Biotechs seit einiger Zeit ja deutlich unter Druck... mal schauen, wie es weiter geht.
Gruß
ipollit
der einbruch im gesamtmarkt hat den biotechsektor nicht ausgelassen. meine werte wurden alle verkauft. jetzt ist zeit sich neu zu sortieren. die Aktien, die in dieser schlechten marktphase relative stärke zeigen, werden mit hoher warscheinlichkeit auch die leader des neuen Aufwärtstrends sein.
am stärksten zeigt sich momentan santarus (snts) und regeneron(regn).
am stärksten zeigt sich momentan santarus (snts) und regeneron(regn).
http://www.streetinsider.com/Analyst+Comments/Regeneron+%28R…
früher als gedacht landet regeneron in meinem Depot. heute kaufempfehlung durch die deutsche bank mit Kursziel 190 usd.
früher als gedacht landet regeneron in meinem Depot. heute kaufempfehlung durch die deutsche bank mit Kursziel 190 usd.
Ab heute in meinem Bio-Teich:
Rakete Keryx Biopharmaceuticals (KERX)

Rakete Keryx Biopharmaceuticals (KERX)
REGN ist momentan noch meine zweitgrößte Position... allerdings wird es nicht ewig nach oben gehen. Die MK liegt inzwischen bei über 16 Mrd USD. Eine gewisse Gefahr besteht, dass beispielsweise Ophthotech's anti-PDGF Fovista Genentech in die Hände fallen könnte, da dann die Zukunft von Eylea etwas unsicherer wird. Ansonsten bietet die Pipeline einiges... insbesondere den PCSK9-AK REGN727, für den eine annähernd 1 Mrd USD teure PIII gestartet worden ist. Dass REGN von der letzten Schwächephase nicht so betroffen war, liegt meiner Meinung aber auch einfach daran, dass die hohen Gewinne ein Polster bilden, anders als bei Biotechs, die mehr aufgrund Phantasie zukünftiger Produkte bewertet werden.

Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.849.436 von ipollit am 21.11.12 22:00:52danke für dein Statement zu regn.
im Gegensatz zu dir, handel ich ausschließlich auf grund eines trendfolgeansatzes. vom geschäftsmodell der biotechs habe ich natürlich keine Ahnung, aber um so besser, wenn es hierzu bei w:o fachkundige user gibt.
im Gegensatz zu dir, handel ich ausschließlich auf grund eines trendfolgeansatzes. vom geschäftsmodell der biotechs habe ich natürlich keine Ahnung, aber um so besser, wenn es hierzu bei w:o fachkundige user gibt.

nach CLVS habe ich nun auch eine kleine Position im HCV-Bereich aufgebaut... Achillion. GILD hat ja durch die Übernahme von Pharmasset erheblich profitiert, mal sehen, ob ACHN da in Zukunft auch noch mitreden kann.


gruß
ipollit
gruß
ipollit
Hallo ipollit,
schon gesehen? Gilead übernimmt YMI.
Fein, fein.
Gruß
schon gesehen? Gilead übernimmt YMI.
Fein, fein.
Gruß
Synta kann schon wieder einen riesen Brocken an Aktien an seine Insider verkaufen.
Das ist das zweite Mal in diesem Jahr.
Die haben ganz offensichtlich ein riesen Vertrauen in ihr Unternehmen.
Im Januar werde ich einige Veränderungen in meinem Depot vornehmen.Ich überlege, Synta höher zu gewichten, auch wenn sie schon gut gelaufen sind. Das Potential könnte aber wirklich ganz enorm groß sein. Ein funktionierender HSP90-Inhibitor wäre ja so etwas wie eine ganze Wirkstoffklasse für sich mit einem theoretisch enorm breiten Anwendungsspektrum.
Synta Pharmaceuticals Announces $60 Million Registered Direct Common Stock Offering
LEXINGTON, Mass.--(BUSINESS WIRE)-- Synta Pharmaceuticals Corp. (NAS: SNTA) announced today that it has entered into common stock purchase agreements with members of its Board of Directors and various institutional investors for the sale of 7,000,000 shares of its common stock in an issuer directed, registered direct offering. Shares were priced at $8.60, the consolidated closing bid price as of December 12, 2012, for gross proceeds of approximately $60 million. No underwriter or placement agent was used in this transaction. The offering is expected to close on or about December 18, 2012, subject to satisfaction of customary closing conditions.
Net proceeds from the offering will be used to fund Synta's operations, including, research and development, clinical trials, manufacturing, intellectual property protection and enforcement, and working capital, and for other general corporate purposes.
Das ist das zweite Mal in diesem Jahr.
Die haben ganz offensichtlich ein riesen Vertrauen in ihr Unternehmen.
Im Januar werde ich einige Veränderungen in meinem Depot vornehmen.Ich überlege, Synta höher zu gewichten, auch wenn sie schon gut gelaufen sind. Das Potential könnte aber wirklich ganz enorm groß sein. Ein funktionierender HSP90-Inhibitor wäre ja so etwas wie eine ganze Wirkstoffklasse für sich mit einem theoretisch enorm breiten Anwendungsspektrum.
Synta Pharmaceuticals Announces $60 Million Registered Direct Common Stock Offering
LEXINGTON, Mass.--(BUSINESS WIRE)-- Synta Pharmaceuticals Corp. (NAS: SNTA) announced today that it has entered into common stock purchase agreements with members of its Board of Directors and various institutional investors for the sale of 7,000,000 shares of its common stock in an issuer directed, registered direct offering. Shares were priced at $8.60, the consolidated closing bid price as of December 12, 2012, for gross proceeds of approximately $60 million. No underwriter or placement agent was used in this transaction. The offering is expected to close on or about December 18, 2012, subject to satisfaction of customary closing conditions.
Net proceeds from the offering will be used to fund Synta's operations, including, research and development, clinical trials, manufacturing, intellectual property protection and enforcement, and working capital, and for other general corporate purposes.
Hallo SLGramann,
ganz schön, dadurch hat allerdings meine größere INCY-Position etwas gelitten. Mir ist nicht klar, was das bedeutet... sieht GILD hier wirklich Potential oder ist es einfach eine weitere Chance, die auch schief gehen darf? In diesem Zusammenhang habe ich auch einige Meinungen gelesen, dass der Ursprung von CYT387 nicht unbedingt für einen Erfolg spricht. Und der Preis ist eher moderat, wenn man YMIs Cash abzieht. Schlecht für INCY ist, dass nun für die Entwicklung des Konkurrenten sehr viel mehr Geld zur Verfügung steht. Naja, wie dem auch sei, damit ist meine YMI Position beendet. Ich habe erstmal ACHN weiter aufgestockt.
Seit gestern sehe ich mir ARIA nochmal genauer an. Was hältst du von denen, nachdem sie nun mit der vorzeitigen Zulassung von Ponatinib um 20% eingebrochen sind? Die MK liegt noch immer bei über 3 Mrd USD. Ponatinib wurde immer als sehr aussichtsreich gesehen... es folgt dem 5 Mrd Blockbuster Gleevec, der für sich selber steht und CML von einer tödlichen zu einer chronischen Krankheit gemacht hat. ARIA vermarktet 100% selbst... Peak-Sales könnten bei 1+ Mrd USD liegen.
seekingalpha.com/article/836301-ariad-pharmaceuticals-gearin…
Und wie sieht es mit INFI aus? Seit Monaten ist der Kurs immer weiter gestiegen, obwohl es keine offensichtlichen Gründe dafür gab. Der delta/gamma PI3K IPI-145 scheint wohl jetzt sehr interessant zu sein als direkter Konkurrent zu GILDs GS-1101... geht es in die Richtung von PCYC? Die MK ist nun auch auf über 1 Mrd gestiegen. Steckt da noch mehr Potential? Ich finde es immer schwierig, hinterher zu laufen. Wenn es aber etwas Gutes ist, dann läuft es über eine sehr lange Zeit, so dass selbst das teuere noch relativ günstig ist. Was meinst du?
Gruß
ipollit
ganz schön, dadurch hat allerdings meine größere INCY-Position etwas gelitten. Mir ist nicht klar, was das bedeutet... sieht GILD hier wirklich Potential oder ist es einfach eine weitere Chance, die auch schief gehen darf? In diesem Zusammenhang habe ich auch einige Meinungen gelesen, dass der Ursprung von CYT387 nicht unbedingt für einen Erfolg spricht. Und der Preis ist eher moderat, wenn man YMIs Cash abzieht. Schlecht für INCY ist, dass nun für die Entwicklung des Konkurrenten sehr viel mehr Geld zur Verfügung steht. Naja, wie dem auch sei, damit ist meine YMI Position beendet. Ich habe erstmal ACHN weiter aufgestockt.
Seit gestern sehe ich mir ARIA nochmal genauer an. Was hältst du von denen, nachdem sie nun mit der vorzeitigen Zulassung von Ponatinib um 20% eingebrochen sind? Die MK liegt noch immer bei über 3 Mrd USD. Ponatinib wurde immer als sehr aussichtsreich gesehen... es folgt dem 5 Mrd Blockbuster Gleevec, der für sich selber steht und CML von einer tödlichen zu einer chronischen Krankheit gemacht hat. ARIA vermarktet 100% selbst... Peak-Sales könnten bei 1+ Mrd USD liegen.
seekingalpha.com/article/836301-ariad-pharmaceuticals-gearin…
Und wie sieht es mit INFI aus? Seit Monaten ist der Kurs immer weiter gestiegen, obwohl es keine offensichtlichen Gründe dafür gab. Der delta/gamma PI3K IPI-145 scheint wohl jetzt sehr interessant zu sein als direkter Konkurrent zu GILDs GS-1101... geht es in die Richtung von PCYC? Die MK ist nun auch auf über 1 Mrd gestiegen. Steckt da noch mehr Potential? Ich finde es immer schwierig, hinterher zu laufen. Wenn es aber etwas Gutes ist, dann läuft es über eine sehr lange Zeit, so dass selbst das teuere noch relativ günstig ist. Was meinst du?
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.931.705 von ipollit am 15.12.12 18:21:09Hallo ipollit,
ja, INCY ist jetzt unter Druck, mal sehen wie weit es runter geht. Sehe dann aber dort eher Kaufkurse.
Gilead wird im zweiten Halbjahr 2013 die PIII starten. Eine Zulassung von CYT387 kann ich mir nicht vor 2016 vorstellen.
Der Vorsprung von Jakafi ist riesig.
Was GILD angeht: Die wollen und müssen ihre Pipeline diversifizieren. Dafür wird man alle möglichen kleinen und großen Deals machen müssen und YMI passt da ins Konzept.
Wenns funktioniert, fein. Wenn nicht... na ja, den Übernahmepreis generiert GILD an free cash flow in 6 bis 8 Wochen.
Ariad
Das ist super spannend!
Ich quäle mich auch mit dieser Frage. Ich finde ARIA aber immer noch zu teuer.
Ich habe wenig Zweifel daran, dass Ponatinib ein Blockbuster wird, aber es wird viel Zeit brauchen.
Man kann ja sehen, wie relativ langsam (dafür kontinuierlich!) die Entwicklung bei bspw. Sprycel verläuft.
Natürlich haben sie dann noch diesen ALK-Inhibitor...
Also, bei 2 Milliarden Marktkap. wäre ich definitv dabei. Bei 3 Milliarden nicht.
Bei 2,5 Mrd. käme ich ganz furchtbar ins Grübeln, würde aber wahrscheinlich kaufen.
Wahrscheinlich wird Ariad in 2013 eine KE machen müssen. Vielleicht ergeben sich noch mal gute Kurse.
Generell denke ich, dass die wirklich lange Zeitachse auf der sich das Potential von Ariad entfalten muss, für Frust = Gelegenheiten sorgen könnte.
Zu INFI habe ich leider keine Meinung.
Gruß
PS: Psychologisch ist es wirklich schwierig, noch aufzuspringen, wenn die Dinge schon gut gelaufen sind. Aber das ist eine psychologische Falle. Wenn da noch viel Potential vorhanden ist, sollte man die Vergangenheit abhaken.
Bei Array war ich in dieser Situation. Die hätte ich auch zwischen 1 und 2 Dollar kaufen können, statt zwischen 2 und 4.
Aber ich sehe da noch jede Menge künftiges Potential und habe inzwischen einen ziemlich großen Depotanteil in Array.
ja, INCY ist jetzt unter Druck, mal sehen wie weit es runter geht. Sehe dann aber dort eher Kaufkurse.
Gilead wird im zweiten Halbjahr 2013 die PIII starten. Eine Zulassung von CYT387 kann ich mir nicht vor 2016 vorstellen.
Der Vorsprung von Jakafi ist riesig.
Was GILD angeht: Die wollen und müssen ihre Pipeline diversifizieren. Dafür wird man alle möglichen kleinen und großen Deals machen müssen und YMI passt da ins Konzept.
Wenns funktioniert, fein. Wenn nicht... na ja, den Übernahmepreis generiert GILD an free cash flow in 6 bis 8 Wochen.
Ariad
Das ist super spannend!
Ich quäle mich auch mit dieser Frage. Ich finde ARIA aber immer noch zu teuer.
Ich habe wenig Zweifel daran, dass Ponatinib ein Blockbuster wird, aber es wird viel Zeit brauchen.
Man kann ja sehen, wie relativ langsam (dafür kontinuierlich!) die Entwicklung bei bspw. Sprycel verläuft.
Natürlich haben sie dann noch diesen ALK-Inhibitor...
Also, bei 2 Milliarden Marktkap. wäre ich definitv dabei. Bei 3 Milliarden nicht.
Bei 2,5 Mrd. käme ich ganz furchtbar ins Grübeln, würde aber wahrscheinlich kaufen.
Wahrscheinlich wird Ariad in 2013 eine KE machen müssen. Vielleicht ergeben sich noch mal gute Kurse.
Generell denke ich, dass die wirklich lange Zeitachse auf der sich das Potential von Ariad entfalten muss, für Frust = Gelegenheiten sorgen könnte.
Zu INFI habe ich leider keine Meinung.
Gruß
PS: Psychologisch ist es wirklich schwierig, noch aufzuspringen, wenn die Dinge schon gut gelaufen sind. Aber das ist eine psychologische Falle. Wenn da noch viel Potential vorhanden ist, sollte man die Vergangenheit abhaken.
Bei Array war ich in dieser Situation. Die hätte ich auch zwischen 1 und 2 Dollar kaufen können, statt zwischen 2 und 4.
Aber ich sehe da noch jede Menge künftiges Potential und habe inzwischen einen ziemlich großen Depotanteil in Array.
Antwort auf Beitrag Nr.: 43.932.320 von SLGramann am 16.12.12 10:41:07Ponatinib ist aber das einzige Mittel, was bei der T315I-Mutation wirkt...
CML ist als Indikation vielleicht speziell... eigentlich mit jährlich 5000 US-Patienten eher klein. Aber da BCR-ABL Hemmer dauerhaft den Krebs unter Kontrolle halten können, nehmen die Patienten das Mittel viele Jahre. So wächst die Anzahl der Patienten, die in Behandlung sind, im Laufe der Zeit über 100k. Und als eigentlich kleine Indikation ist Gleveec&Co mit 100k+ USD pro Jahr sehr teuer. Der CEO schätzt, dass ca. 2500 Patienten pro Jahr die Therapie wechseln und damit potentiell für Ponatinib in Frage kommen. Im Fall einer Resistenz wg T315I gibt es keine Alternative zu Ponatinib. Diese Patienten bleiben dann theoretisch dauerhaft bei Ponatinib. Bei einer Therapie über theoretisch mehrere Jahrzehnte spielen Nebenwirkungen wohl eine größere Rolle... u.a. deshalb ist wohl der Kurs so eingebrochen. 2015 wird zudem Gleveec generisch und damit die Kosten von 100k auf 5k pro Jahr sinken. Vom Preis her wird damit wohl Gleveec die erste Wahl bleiben.
Der ALK-Hemmer... ist eigentlich ein ALK/EGFR-Hemmer:
seekingalpha.com/article/900051-ariad-pharmaceuticals-ap2611…
Wie bei Ponatinib soll AP26113 auch bei Resistenzen aufgrund von Mutationen wirken: bei ALK und bei EGFR. Interessant in dem Artikel oben ist, dass anfangs z.B. Tarceva sehr unspezifisch bei NSCLC getestet worden ist. Da nur ein Teil der Patienten EGFR-Krebszellen besitzt, wirkt es auch nur bei einem kleinen Teil, wodurch Studien teilweise fehlgeschlagen sind. Erst später hat man herausgefunden, dass man die Patienten auf EGFR testen muss und diese dann auch auf z.B. Tarceva ansprechen. EGFR ist aber nicht generell schlecht. Indem man es hemmt, wird zwar der Tumor angegriffen, allerdings auch normales Gewebe geschädigt. So erklärt man sich, dass EGFR-Hemmer zwar den Fortschritt der Krankheit hemmen (also PFS), aber keinen messbaren Einfluss auf die Überlebenszeit haben.
Vor einigen Jahren hat YMI als Vorteil seines EGFR-AK Nimotuzumab hervorgehoben, dass dieser weniger Hautauschlag verursacht, während dies von anderen als ein Anzeichen von geringerer Wirkung angesehen worden ist, da alle EGFR-Hemmer diese Nebenwirkung zeigen...
http://www.biomedreports.com/200908085071/ym-biosciences-tra…: "Nimotuzumab (nimo) (an IgG1, humanized epidermal growth factor or EGFR targeting monoclonal antibody or MAb) is currently being evaluated in 11 Phase 2 and 3 international trials, including three by YMI and eight by its licensees. The Company is making progress on its lead cancer drug nimotuzumab, which is in the same class as Erbitux (cetuximab), but has a better safety profile since it does not cause the severe (Grade 3 or 4) skin rash associated with these types of treatments. The lack of severe skin rash would otherwise be a clear advantage, but in this case the clinical effectiveness of EGFR inhibitors is thought to be linked with the occurrence of this side effect (see the Company's corporate presentation for more details and images of Grade 3 or 4 rash)."
Nebenwirkungen wie Hautausschlag scheinen aber daher zu kommen, dass EGFR generell gehemmt wird und damit auch das natürliche EGFR: "However, the adverse events in Afatinib-treated patients appeared more severe than Tarceva, including severe rashes, diarrhea, mucositis and dry skin. These side effects are common to native EGFR inhibitors and often cause physicians to reduce the dosage administered."
AP26113 scheint sowohl bei der T790M Mutation zu wirken, die bei 50% der mit EGFR-Hemmer behandelten Patienten zur Resistenz führt, als auch das natürliche EGFR auszusparen, wodurch es zu weniger Nebenwirkungen kommen sollte. Prinzipiell besitzt AP26113 ein größeres Potential als Ponatinib.
Gut finde ich bei ARIA, dass sowohl Ponatinib als auch AP26113 aus der eigenen Forschung kommt... könnte es demensprechend nicht noch weitere vielversprechende Mittel geben, die in den nächsten Jahren nachrücken?
In diesem Zusammenhang... besser bezüglich EGFR könnte hier vielleicht noch CLVS CO-1686 sein... Ohad Hammer ist hier eher skeptisch, wirklich begründet finde ich das aber nicht:
"Separately, any thoughts on CLVS after the blow-up today? I think their selective EGFR inhibitor sounds interesting and they expect PoC data in 2H13. It inhibits T790M mutation. CC today was refreshing in that the CEO didn’t try to spin failure of lead drug. Not sure about their PARP drug. Even earlier stage, they have the deal with ARRY to develop cKIT inhibitor active against exon 17 mutation.
Ohad Hammer Says:
November 13th, 2012 at 3:54 pm
The EGFR story looks good on paper but so far several companies tried to develop t790m inhibitors but nothing worked so far. There are other irreversible inhibitors in development although clvs’ molecule could be more selective towards mutated forms of the receptor.
I thought CLVS was expensive before the panc cancer failure, let alone today.
Ohad
mcbio Says:
November 13th, 2012 at 9:11 pm
Thanks Ohad. Didn’t realize there were prior T790M inhibitors that failed. Do you know if those failures were due to safety or efficacy issues, or both? I think the issue with these type of TKIs is normally safety. CLVS claims that they are nowhere near an MTD and safety looks really good so far. Obviously efficacy data still to come.
Ohad Hammer Says:
November 14th, 2012 at 6:49 am
Exelixis had XL647, which inhibits among other things T790M mutation. Pfizer and PI have potent pan-HER inhibitors in p3 that also inhibit T790M.
One advantage CLVS and ARIA have compared to those guys is the selective inhibition of mutated EGFR over normal EGFR. It still remains to be seen how it will pan out for them.
***
Gruß
ipollit
CML ist als Indikation vielleicht speziell... eigentlich mit jährlich 5000 US-Patienten eher klein. Aber da BCR-ABL Hemmer dauerhaft den Krebs unter Kontrolle halten können, nehmen die Patienten das Mittel viele Jahre. So wächst die Anzahl der Patienten, die in Behandlung sind, im Laufe der Zeit über 100k. Und als eigentlich kleine Indikation ist Gleveec&Co mit 100k+ USD pro Jahr sehr teuer. Der CEO schätzt, dass ca. 2500 Patienten pro Jahr die Therapie wechseln und damit potentiell für Ponatinib in Frage kommen. Im Fall einer Resistenz wg T315I gibt es keine Alternative zu Ponatinib. Diese Patienten bleiben dann theoretisch dauerhaft bei Ponatinib. Bei einer Therapie über theoretisch mehrere Jahrzehnte spielen Nebenwirkungen wohl eine größere Rolle... u.a. deshalb ist wohl der Kurs so eingebrochen. 2015 wird zudem Gleveec generisch und damit die Kosten von 100k auf 5k pro Jahr sinken. Vom Preis her wird damit wohl Gleveec die erste Wahl bleiben.
Der ALK-Hemmer... ist eigentlich ein ALK/EGFR-Hemmer:
seekingalpha.com/article/900051-ariad-pharmaceuticals-ap2611…
Wie bei Ponatinib soll AP26113 auch bei Resistenzen aufgrund von Mutationen wirken: bei ALK und bei EGFR. Interessant in dem Artikel oben ist, dass anfangs z.B. Tarceva sehr unspezifisch bei NSCLC getestet worden ist. Da nur ein Teil der Patienten EGFR-Krebszellen besitzt, wirkt es auch nur bei einem kleinen Teil, wodurch Studien teilweise fehlgeschlagen sind. Erst später hat man herausgefunden, dass man die Patienten auf EGFR testen muss und diese dann auch auf z.B. Tarceva ansprechen. EGFR ist aber nicht generell schlecht. Indem man es hemmt, wird zwar der Tumor angegriffen, allerdings auch normales Gewebe geschädigt. So erklärt man sich, dass EGFR-Hemmer zwar den Fortschritt der Krankheit hemmen (also PFS), aber keinen messbaren Einfluss auf die Überlebenszeit haben.
Vor einigen Jahren hat YMI als Vorteil seines EGFR-AK Nimotuzumab hervorgehoben, dass dieser weniger Hautauschlag verursacht, während dies von anderen als ein Anzeichen von geringerer Wirkung angesehen worden ist, da alle EGFR-Hemmer diese Nebenwirkung zeigen...
http://www.biomedreports.com/200908085071/ym-biosciences-tra…: "Nimotuzumab (nimo) (an IgG1, humanized epidermal growth factor or EGFR targeting monoclonal antibody or MAb) is currently being evaluated in 11 Phase 2 and 3 international trials, including three by YMI and eight by its licensees. The Company is making progress on its lead cancer drug nimotuzumab, which is in the same class as Erbitux (cetuximab), but has a better safety profile since it does not cause the severe (Grade 3 or 4) skin rash associated with these types of treatments. The lack of severe skin rash would otherwise be a clear advantage, but in this case the clinical effectiveness of EGFR inhibitors is thought to be linked with the occurrence of this side effect (see the Company's corporate presentation for more details and images of Grade 3 or 4 rash)."
Nebenwirkungen wie Hautausschlag scheinen aber daher zu kommen, dass EGFR generell gehemmt wird und damit auch das natürliche EGFR: "However, the adverse events in Afatinib-treated patients appeared more severe than Tarceva, including severe rashes, diarrhea, mucositis and dry skin. These side effects are common to native EGFR inhibitors and often cause physicians to reduce the dosage administered."
AP26113 scheint sowohl bei der T790M Mutation zu wirken, die bei 50% der mit EGFR-Hemmer behandelten Patienten zur Resistenz führt, als auch das natürliche EGFR auszusparen, wodurch es zu weniger Nebenwirkungen kommen sollte. Prinzipiell besitzt AP26113 ein größeres Potential als Ponatinib.
Gut finde ich bei ARIA, dass sowohl Ponatinib als auch AP26113 aus der eigenen Forschung kommt... könnte es demensprechend nicht noch weitere vielversprechende Mittel geben, die in den nächsten Jahren nachrücken?
In diesem Zusammenhang... besser bezüglich EGFR könnte hier vielleicht noch CLVS CO-1686 sein... Ohad Hammer ist hier eher skeptisch, wirklich begründet finde ich das aber nicht:
"Separately, any thoughts on CLVS after the blow-up today? I think their selective EGFR inhibitor sounds interesting and they expect PoC data in 2H13. It inhibits T790M mutation. CC today was refreshing in that the CEO didn’t try to spin failure of lead drug. Not sure about their PARP drug. Even earlier stage, they have the deal with ARRY to develop cKIT inhibitor active against exon 17 mutation.
Ohad Hammer Says:
November 13th, 2012 at 3:54 pm
The EGFR story looks good on paper but so far several companies tried to develop t790m inhibitors but nothing worked so far. There are other irreversible inhibitors in development although clvs’ molecule could be more selective towards mutated forms of the receptor.
I thought CLVS was expensive before the panc cancer failure, let alone today.
Ohad
mcbio Says:
November 13th, 2012 at 9:11 pm
Thanks Ohad. Didn’t realize there were prior T790M inhibitors that failed. Do you know if those failures were due to safety or efficacy issues, or both? I think the issue with these type of TKIs is normally safety. CLVS claims that they are nowhere near an MTD and safety looks really good so far. Obviously efficacy data still to come.
Ohad Hammer Says:
November 14th, 2012 at 6:49 am
Exelixis had XL647, which inhibits among other things T790M mutation. Pfizer and PI have potent pan-HER inhibitors in p3 that also inhibit T790M.
One advantage CLVS and ARIA have compared to those guys is the selective inhibition of mutated EGFR over normal EGFR. It still remains to be seen how it will pan out for them.
***
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.933.074 von ipollit am 16.12.12 18:36:28So wächst die Anzahl der Patienten, die in Behandlung sind, im Laufe der Zeit
Ja, ganz genau. Und auf die Art wird auch Ponatinib seinen Weg gehen - generisches Gleevec hin oder her.
Aber diese Entwicklung braucht Zeit. Ich denke, Sprycel ist da das richtige Muster.
Die Milliarden-Umsatzgrenze wird Ponatinib wohl erst 2017/2018 knacken.
Um die heutige Marktkapitalisierung zu rechtfertigen brauche ich einen Umsatz von ungefähr 700 Millionen Dollar. Den sehe ich nicht vor 2016.
Bis 2016 hätte ich aber gerne eine Verdopplung oder Verdreifachung des Kurses als mögliches Potential und nicht nur ein Hineinwachsen in die heutige Bewertung.
Wenn ich dann also eine Marktkap. von mindestens 6 Milliarden Dollar bis 2016 "verlange", ist es etwas schwer zu sagen, wo das herkommen könnte.
Dafür müsste sich Ponatinib perfekt entwickeln (wird es wahrscheinlich tun) und AP26113 müsste klar auf dem Weg zum Blockbuster Nr. 2 sein (was gut möglich ist).
Es steckt aber eben trotzdem schon sehr viel im Kurs drin...
Ja, ganz genau. Und auf die Art wird auch Ponatinib seinen Weg gehen - generisches Gleevec hin oder her.
Aber diese Entwicklung braucht Zeit. Ich denke, Sprycel ist da das richtige Muster.
Die Milliarden-Umsatzgrenze wird Ponatinib wohl erst 2017/2018 knacken.
Um die heutige Marktkapitalisierung zu rechtfertigen brauche ich einen Umsatz von ungefähr 700 Millionen Dollar. Den sehe ich nicht vor 2016.
Bis 2016 hätte ich aber gerne eine Verdopplung oder Verdreifachung des Kurses als mögliches Potential und nicht nur ein Hineinwachsen in die heutige Bewertung.
Wenn ich dann also eine Marktkap. von mindestens 6 Milliarden Dollar bis 2016 "verlange", ist es etwas schwer zu sagen, wo das herkommen könnte.
Dafür müsste sich Ponatinib perfekt entwickeln (wird es wahrscheinlich tun) und AP26113 müsste klar auf dem Weg zum Blockbuster Nr. 2 sein (was gut möglich ist).
Es steckt aber eben trotzdem schon sehr viel im Kurs drin...
Antwort auf Beitrag Nr.: 43.937.197 von SLGramann am 17.12.12 21:28:58Hallo ipollit und SLGramann. Ihr habt euch ja ganz schön in die Materie eingelesen. Deshalb mal zwei Fragen an Euch:
Verfolgt ihr Dyax? Ein Antikörper hat wohl ganz gute Ergebnisse geliefert, wie schätzt ihr das ein?
INDIANAPOLIS, Sept. 29, 2012 /PRNewswire/ -- Eli Lilly and Company (NYSE: LLY) today announced new data from two Phase II ramucirumab (IMC-1121B) trials in patients with non-small cell lung cancer (NSCLC). Results were presented today during the Lung Cancer — Metastatic Poster Session at the ESMO 2012 Congress (European Society for Medical Oncology), 1:00 p.m. — 2:00 p.m. CET, in Vienna, Austria.
Interim data for a study in chemotherapy-naive patients with advanced NSCLC treated with ramucirumab in combination with first-line ALIMTA® (pemetrexed for injection)/platinum-based chemotherapy (Abstract #1245) and final data for a study in patients treated with ramucirumab in combination with paclitaxel/carboplatinum chemotherapy (Abstract#1287) were presented. The pre-specified interim analysis of progression-free survival (PFS) (Abstract #1245) and final six-month PFS rate (Abstract #1287) support continued development of ramucirumab in lung cancer.
"We are encouraged by these results from two Phase II trials indicating ramucirumab may be beneficial to patients with non-small cell lung cancer," said Richard Gaynor, M.D., vice president, product development and medical affairs for Lilly Oncology. "These findings support our ongoing evaluation of ramucirumab for lung cancer patients and will need to be confirmed in larger pivotal studies."
Eli Lilly & Co. (LLY)’s experimental stomach cancer drug helped patients with advanced disease live longer, a study found. The shares rose.
The most common side effects for the medicine, called ramucirumab, were high blood pressure, diarrhea and headache, the Indianapolis-based company said in a statement today. The drug was tested in patients with gastric cancer that has spread to other parts of the body.
Leerink Swann upgraded its rating on the stock to buy from hold on the data, saying the drug has an 80 percent chance of approval as a second-line treatment. The medicine is in the final stage of testing for U.S regulatory approval. If approved, it may generate $600 million in annual sales, said Mark Schoenebaum, a New York-based analyst with ISI Group.
“Overall, the Street will view this positively, we think, as it adds credence to the pipeline thesis,” Schoenebaum said, in a note to clients. He said it will also make Lilly less dependent in the future on its experimental Alzheimer’s drug.
Lilly rose 4.8 percent to $52.86 at 11:07 a.m. New York time, after jumping 32 percent in the 12 months through yesterday. Dyax Corp, which has a partnership on the treatment, rose 28 cents or 12 percent to $2.66.
Leerink analyst Seamus Fernandez said in a report today that the stock could hit $59 to $60 a share based on his positive outlook for the drug.
ImClone Acquisition
Lilly didn’t say how much greater the survival benefit was. Full results from the research will be presented at a future medical meeting, the drugmaker said.
Ramucirumab is among the products obtained by Lilly from its $6.5 billion acquisition of ImClone Systems Inc. in 2008. Lilly has five other late-stage studies of ramucirumab ongoing in four tumor types, including breast and lung cancer. If approved for all indications in testing, the drug could have $1.6 billion in sales by 2020, Fernandez said.
More than 21,000 people will be diagnosed with stomach cancer in the U.S. in 2012 and 10,540 people will die of the disease, according to the National Cancer Institu
Wie steht ihr momentan zu Aveo? Ist der Kursverlauf nicht ein bischen übertrieben zumal die Entscheidung der FDA im Sommer ja ansteht?
SG kmastra
Verfolgt ihr Dyax? Ein Antikörper hat wohl ganz gute Ergebnisse geliefert, wie schätzt ihr das ein?
INDIANAPOLIS, Sept. 29, 2012 /PRNewswire/ -- Eli Lilly and Company (NYSE: LLY) today announced new data from two Phase II ramucirumab (IMC-1121B) trials in patients with non-small cell lung cancer (NSCLC). Results were presented today during the Lung Cancer — Metastatic Poster Session at the ESMO 2012 Congress (European Society for Medical Oncology), 1:00 p.m. — 2:00 p.m. CET, in Vienna, Austria.
Interim data for a study in chemotherapy-naive patients with advanced NSCLC treated with ramucirumab in combination with first-line ALIMTA® (pemetrexed for injection)/platinum-based chemotherapy (Abstract #1245) and final data for a study in patients treated with ramucirumab in combination with paclitaxel/carboplatinum chemotherapy (Abstract#1287) were presented. The pre-specified interim analysis of progression-free survival (PFS) (Abstract #1245) and final six-month PFS rate (Abstract #1287) support continued development of ramucirumab in lung cancer.
"We are encouraged by these results from two Phase II trials indicating ramucirumab may be beneficial to patients with non-small cell lung cancer," said Richard Gaynor, M.D., vice president, product development and medical affairs for Lilly Oncology. "These findings support our ongoing evaluation of ramucirumab for lung cancer patients and will need to be confirmed in larger pivotal studies."
Eli Lilly & Co. (LLY)’s experimental stomach cancer drug helped patients with advanced disease live longer, a study found. The shares rose.
The most common side effects for the medicine, called ramucirumab, were high blood pressure, diarrhea and headache, the Indianapolis-based company said in a statement today. The drug was tested in patients with gastric cancer that has spread to other parts of the body.
Leerink Swann upgraded its rating on the stock to buy from hold on the data, saying the drug has an 80 percent chance of approval as a second-line treatment. The medicine is in the final stage of testing for U.S regulatory approval. If approved, it may generate $600 million in annual sales, said Mark Schoenebaum, a New York-based analyst with ISI Group.
“Overall, the Street will view this positively, we think, as it adds credence to the pipeline thesis,” Schoenebaum said, in a note to clients. He said it will also make Lilly less dependent in the future on its experimental Alzheimer’s drug.
Lilly rose 4.8 percent to $52.86 at 11:07 a.m. New York time, after jumping 32 percent in the 12 months through yesterday. Dyax Corp, which has a partnership on the treatment, rose 28 cents or 12 percent to $2.66.
Leerink analyst Seamus Fernandez said in a report today that the stock could hit $59 to $60 a share based on his positive outlook for the drug.
ImClone Acquisition
Lilly didn’t say how much greater the survival benefit was. Full results from the research will be presented at a future medical meeting, the drugmaker said.
Ramucirumab is among the products obtained by Lilly from its $6.5 billion acquisition of ImClone Systems Inc. in 2008. Lilly has five other late-stage studies of ramucirumab ongoing in four tumor types, including breast and lung cancer. If approved for all indications in testing, the drug could have $1.6 billion in sales by 2020, Fernandez said.
More than 21,000 people will be diagnosed with stomach cancer in the U.S. in 2012 and 10,540 people will die of the disease, according to the National Cancer Institu
Wie steht ihr momentan zu Aveo? Ist der Kursverlauf nicht ein bischen übertrieben zumal die Entscheidung der FDA im Sommer ja ansteht?
SG kmastra
Hallo kmastra,
zu DYAX kann ich leider nichts Konkretes sagen. Wodurch wird denn der Kursverlauf bestimmt? Von Kalbitor? Da hätte ich erwartet, dass sie z.B. gegenüber VPHMs Cinryze wenig Chancen haben. Naja und die AKs... was mir bei diesen AK-Partner-Pipelines nicht so gefällt, sind diese in der Regel sehr geringen Royalties. Wie hoch sind die denn bei Dyax? Meistens sind sie ja eher im Bereich von z.B. 3%. Ramucirumab hört sich allerdings spannend an... dazu habe ich vor einiger Zeit mal gelesen, dass es aussichtsreichs sein könnte, weil es anders als z.B. Avastin VEGF-Rezeptoren blockiert und nicht nur das freie VEGF. Dadurch könnte es auch dort wirksam sein, wo Avastin&Co nicht wirkt. In diesem Fall könnte Ramucirumab langfristig mehrere Mrd USD Peak Sales erzielen... crosscurrentllc.com/uploads/LLY_10-15-12_Ramucirumab_gastric…
Von Aveo habe ich eine eher kleine bis mittlere Position. Tivozanib ist eine zweischneidige Sache. Zum ersten Rückschlag kam es, als es zwar in der PIII gegenüber Nexavar absolut gesehen gute Ergebnisse geliefert hat, Nexavar aber selber überdurchschnittlich gut abgeschnitten hat. Der Marktführer in RCC ist aber nicht Nexavar sondern Sutent, das wirksamer als Nexavar sein sollte. Nun ist unklar, ob Tivozanib auch wirksamer als Sutent ist. Es könnte auch sein, dass bei der Patientengruppe in der Studie die Krankheit nicht so weit fortgeschritten war, wodurch die guten Nexavar zustande kamen... dann wäre Tivozanib aber wohl auch nicht so wirksam, wie es aussieht.
Der zweite Rückschlag ist, dass in der Studie zunächst nur der Krankheitsfortschritt (PFS) betrachtet worden ist und dies die Basis für den Zulassungsantrag bildet. Danach hat man aber festgestellt, dass die Patienten im Nexavar-Arm länger leben als die im Tivozanib-Arm. Dadurch gehen jetzt wohl viele davon aus, dass die FDA Tivozanib so nicht zulassen wird, da es noch nie vorgekommen ist, dass ein Mittel zugelassen worden ist, das sich in einer Studie nachteilig auf das Überleben ausgewirkt hat. Eigentlich eine logische Sache. Aveo begründet es aber damit, dass die Nexavar-Patienten nach Krankheitsfortschritt auch teilweise auf Tivozanib gewechselt sind, wodurch man keine Rückschlüsse bezüglich des Überlebens zwischen Nexavar-Arm und Tivozanib-Arm ziehen könnte. Außerdem ist eigentlich für die Zulassung nur PFS relevant.
Hier wird es ein wenig positiver gesehen... Tivozanib könnte doch noch zum Mittel der Wahl bei RCC werden: www.hammerstockblog.com/aveo-pharmaceuticals%E2%80%93-attrac… Bisher sieht es aber nicht so aus und es könnte auch eine weitere lange Studie anstehen, die vielleicht sogar das komplette Ende von Tivozanib bedeuten könnte.
Gruß
zu DYAX kann ich leider nichts Konkretes sagen. Wodurch wird denn der Kursverlauf bestimmt? Von Kalbitor? Da hätte ich erwartet, dass sie z.B. gegenüber VPHMs Cinryze wenig Chancen haben. Naja und die AKs... was mir bei diesen AK-Partner-Pipelines nicht so gefällt, sind diese in der Regel sehr geringen Royalties. Wie hoch sind die denn bei Dyax? Meistens sind sie ja eher im Bereich von z.B. 3%. Ramucirumab hört sich allerdings spannend an... dazu habe ich vor einiger Zeit mal gelesen, dass es aussichtsreichs sein könnte, weil es anders als z.B. Avastin VEGF-Rezeptoren blockiert und nicht nur das freie VEGF. Dadurch könnte es auch dort wirksam sein, wo Avastin&Co nicht wirkt. In diesem Fall könnte Ramucirumab langfristig mehrere Mrd USD Peak Sales erzielen... crosscurrentllc.com/uploads/LLY_10-15-12_Ramucirumab_gastric…
Von Aveo habe ich eine eher kleine bis mittlere Position. Tivozanib ist eine zweischneidige Sache. Zum ersten Rückschlag kam es, als es zwar in der PIII gegenüber Nexavar absolut gesehen gute Ergebnisse geliefert hat, Nexavar aber selber überdurchschnittlich gut abgeschnitten hat. Der Marktführer in RCC ist aber nicht Nexavar sondern Sutent, das wirksamer als Nexavar sein sollte. Nun ist unklar, ob Tivozanib auch wirksamer als Sutent ist. Es könnte auch sein, dass bei der Patientengruppe in der Studie die Krankheit nicht so weit fortgeschritten war, wodurch die guten Nexavar zustande kamen... dann wäre Tivozanib aber wohl auch nicht so wirksam, wie es aussieht.
Der zweite Rückschlag ist, dass in der Studie zunächst nur der Krankheitsfortschritt (PFS) betrachtet worden ist und dies die Basis für den Zulassungsantrag bildet. Danach hat man aber festgestellt, dass die Patienten im Nexavar-Arm länger leben als die im Tivozanib-Arm. Dadurch gehen jetzt wohl viele davon aus, dass die FDA Tivozanib so nicht zulassen wird, da es noch nie vorgekommen ist, dass ein Mittel zugelassen worden ist, das sich in einer Studie nachteilig auf das Überleben ausgewirkt hat. Eigentlich eine logische Sache. Aveo begründet es aber damit, dass die Nexavar-Patienten nach Krankheitsfortschritt auch teilweise auf Tivozanib gewechselt sind, wodurch man keine Rückschlüsse bezüglich des Überlebens zwischen Nexavar-Arm und Tivozanib-Arm ziehen könnte. Außerdem ist eigentlich für die Zulassung nur PFS relevant.
Hier wird es ein wenig positiver gesehen... Tivozanib könnte doch noch zum Mittel der Wahl bei RCC werden: www.hammerstockblog.com/aveo-pharmaceuticals%E2%80%93-attrac… Bisher sieht es aber nicht so aus und es könnte auch eine weitere lange Studie anstehen, die vielleicht sogar das komplette Ende von Tivozanib bedeuten könnte.
Gruß
Antwort auf Beitrag Nr.: 43.937.636 von kmastra am 17.12.12 23:26:26Hallo kmastra,
zu Dyax habe ich kein Meinung, sorry.
Aveo sind mir aufgrund der von ipollit erläuterten Probleme zu unsicher. Zwar denke ich noch immer, dass Aveo die sein werden, die zuletzt lachen werden, aber da ist mir doch einfach zu viel Unsicherheit drin.
Muss aber sagen, dass ich es für geradezu skandalös halten würde, wenn sie keine Zulassung wegen des OS-Problems bekommen würden.
Und zwar weil ich die Erklärung durch das cross-over-Design für überzeugend halte.
Ich meine, wo kommen wir hin, wenn sich ein Unternehmen durch die Möglichkeit zum cross-over am Ende ins eigene Knie schießt?!
In dem konkreten Fall werden also Patienten entweder nur mit Tivo behandelt oder das andere Kollektiv mit Nexavar und danach zusätzlich mit Tivo.
Dann vergleiche ich einfach Äpfel mit Birnen, stelle fest, dass es was bringt, noch zusätzlich Tivo zu geben - und das lege ich dann gegen Tivo aus?
Das wäre irre imo.
Aber was weiß ich schon, was die FDA so macht. Die haben ja auch schon mal aus formalen Schwachsinnsgründen die Zulassung von T-DM1 für die Drittlinienbehandlung abgelehnt...
Also, viel Gelaber, kurzes Fazit: Wenn Du darauf setzt, dass die FDA sich vernünftig verhält, bekommt Aveo die Zulassung und das Unternehmen ist unterbewertet.
Ich setze aber nicht darauf.
zu Dyax habe ich kein Meinung, sorry.
Aveo sind mir aufgrund der von ipollit erläuterten Probleme zu unsicher. Zwar denke ich noch immer, dass Aveo die sein werden, die zuletzt lachen werden, aber da ist mir doch einfach zu viel Unsicherheit drin.
Muss aber sagen, dass ich es für geradezu skandalös halten würde, wenn sie keine Zulassung wegen des OS-Problems bekommen würden.
Und zwar weil ich die Erklärung durch das cross-over-Design für überzeugend halte.
Ich meine, wo kommen wir hin, wenn sich ein Unternehmen durch die Möglichkeit zum cross-over am Ende ins eigene Knie schießt?!
In dem konkreten Fall werden also Patienten entweder nur mit Tivo behandelt oder das andere Kollektiv mit Nexavar und danach zusätzlich mit Tivo.
Dann vergleiche ich einfach Äpfel mit Birnen, stelle fest, dass es was bringt, noch zusätzlich Tivo zu geben - und das lege ich dann gegen Tivo aus?
Das wäre irre imo.
Aber was weiß ich schon, was die FDA so macht. Die haben ja auch schon mal aus formalen Schwachsinnsgründen die Zulassung von T-DM1 für die Drittlinienbehandlung abgelehnt...

Also, viel Gelaber, kurzes Fazit: Wenn Du darauf setzt, dass die FDA sich vernünftig verhält, bekommt Aveo die Zulassung und das Unternehmen ist unterbewertet.
Ich setze aber nicht darauf.
Antwort auf Beitrag Nr.: 43.940.980 von SLGramann am 18.12.12 18:40:33Hallo ipollit und SLGramann, erst mal vielen Dank für eure differenzierte Rückmeldung!
Ich werde das Risiko bei Aveo auf jeden Fall begrenzen und wenn nur eine kleine Position eingehen.
Bei Dyax sind eigentlich 2 parrallele Bereiche: Einmal Kalibator etc gegen HAE. Ich war da zunächst auch skeptisch, ob Dyax ein genügend großes Stück vom Kuchen abschneiden kann (Shire ist da ja auch noch unterwegs). Aber zuletzt konten sie von Quartal zu Quartal immer zweistellig wachsen und wollen nächstes Jahr auch einen kleinen Gewinn machen. Mir gefällt da auch die klare Fokussierung und Kosteneffizienz.
Die andere Säule sind die AK. Klar sind die Einnahmen nicht so dolle so um die 2-3% aber wenn so auch schon ein kleiner Gewinn da ist wären z.B. 10 Mio an Royalties halt 10 Millionen Gewinn mehr...
Grundsätzlich gefallen mir biotechs mit breiter Pipeline. Momentan im Depot:
Ligand
Array
Dyax
Exelixis
Astex
Halozyme
SG kmastra
Ich werde das Risiko bei Aveo auf jeden Fall begrenzen und wenn nur eine kleine Position eingehen.
Bei Dyax sind eigentlich 2 parrallele Bereiche: Einmal Kalibator etc gegen HAE. Ich war da zunächst auch skeptisch, ob Dyax ein genügend großes Stück vom Kuchen abschneiden kann (Shire ist da ja auch noch unterwegs). Aber zuletzt konten sie von Quartal zu Quartal immer zweistellig wachsen und wollen nächstes Jahr auch einen kleinen Gewinn machen. Mir gefällt da auch die klare Fokussierung und Kosteneffizienz.
Die andere Säule sind die AK. Klar sind die Einnahmen nicht so dolle so um die 2-3% aber wenn so auch schon ein kleiner Gewinn da ist wären z.B. 10 Mio an Royalties halt 10 Millionen Gewinn mehr...
Grundsätzlich gefallen mir biotechs mit breiter Pipeline. Momentan im Depot:
Ligand
Array
Dyax
Exelixis
Astex
Halozyme
SG kmastra
Hallo ipollit,
im Januar will ich mein Depot etwas umbauen.
Jetzt habe ich mich entschlossen, eine Sache vorzuziehen – und zwar eine ziemlich massive Ausweitung meiner Array-Position auf etwa 25% des Depotvolumens.
Ich weiß, Array ist nun nicht gerade etwas neues oder ausgefallen kreatives…
Aber das Jahr 2013 wird für Array transformativ werden. Aller Voraussicht nach werden 5 Programme einen „pivotalen“ Status bekommen und ich finde sie alle aussichtsreich.
Ich verstehe ehrlich gesagt nicht, warum der Markt von ARRY-520 scheinbar so unbeeindruckt ist.
Ich habe mir die ASH-Präsentation jetzt mal genau angesehen. Ich finde es gut nachvollziehbar und gut belegt, dass und wie sich ein hohes AAG-Level negativ auf die Wirkung von ARRY520 auswirkt.
70% der MM-Patienten haben aber niedrige AAG-Level – dort dürfte ARRY520 besser wirksam sein, als in einer nicht selektierten Patientengruppe. Und selbst wenn man nicht nach AAG selektiert, ist die Wirksamkeit recht gut.
Wenn man selektiert, schlägt AARY520+dex sogar Pomalidomide+dex.
Klar sind Patientenzahlen bisher nur klein. Aber es ist ziemlich klar, dass Array mit den vorliegenden Daten eine zulassungsrelevante Studie mit guten Erfolgsaussichten designen kann.
Zu Arry614 habe ich keine Einschätzung, aber Array ist da offensichtlich recht optimistisch. Das kommerzielle Potential ist in jedem Fall bedeutend.
Dann die beiden verpartnerten MEK-Inhibitoren…
Die gehen nächstes Jahr beide in die PIII. Bei beiden Programmen hat Array signifikante Royaltie-Ansprüche (double-digit). Bei MEK162 haben sie noch deutlich höhere Ansprüche im US-Markt als üblich (20%+x?).
Damit haben wir 4 aussichtsreiche und kommerziell bedeutende Wirkstoffkandidaten mit dem Zulassungshorizont 2016.
Der „Rest“ der Pipeline ist auch nicht ohne!
Finde Array dafür viel zu billig!
Übertreibe ich mit meiner Euphorie?
Viele Grüße.
im Januar will ich mein Depot etwas umbauen.
Jetzt habe ich mich entschlossen, eine Sache vorzuziehen – und zwar eine ziemlich massive Ausweitung meiner Array-Position auf etwa 25% des Depotvolumens.
Ich weiß, Array ist nun nicht gerade etwas neues oder ausgefallen kreatives…
Aber das Jahr 2013 wird für Array transformativ werden. Aller Voraussicht nach werden 5 Programme einen „pivotalen“ Status bekommen und ich finde sie alle aussichtsreich.
Ich verstehe ehrlich gesagt nicht, warum der Markt von ARRY-520 scheinbar so unbeeindruckt ist.
Ich habe mir die ASH-Präsentation jetzt mal genau angesehen. Ich finde es gut nachvollziehbar und gut belegt, dass und wie sich ein hohes AAG-Level negativ auf die Wirkung von ARRY520 auswirkt.
70% der MM-Patienten haben aber niedrige AAG-Level – dort dürfte ARRY520 besser wirksam sein, als in einer nicht selektierten Patientengruppe. Und selbst wenn man nicht nach AAG selektiert, ist die Wirksamkeit recht gut.
Wenn man selektiert, schlägt AARY520+dex sogar Pomalidomide+dex.
Klar sind Patientenzahlen bisher nur klein. Aber es ist ziemlich klar, dass Array mit den vorliegenden Daten eine zulassungsrelevante Studie mit guten Erfolgsaussichten designen kann.
Zu Arry614 habe ich keine Einschätzung, aber Array ist da offensichtlich recht optimistisch. Das kommerzielle Potential ist in jedem Fall bedeutend.
Dann die beiden verpartnerten MEK-Inhibitoren…
Die gehen nächstes Jahr beide in die PIII. Bei beiden Programmen hat Array signifikante Royaltie-Ansprüche (double-digit). Bei MEK162 haben sie noch deutlich höhere Ansprüche im US-Markt als üblich (20%+x?).
Damit haben wir 4 aussichtsreiche und kommerziell bedeutende Wirkstoffkandidaten mit dem Zulassungshorizont 2016.
Der „Rest“ der Pipeline ist auch nicht ohne!
Finde Array dafür viel zu billig!
Übertreibe ich mit meiner Euphorie?
Viele Grüße.
Hallo SLGramann,
Array ist auch eine meiner größeren Positionen. Für die aktuelle MK sind ungewöhnlich viele Erfolgschancen vorhanden. Ein Plus der letzten Zeit scheint auch der neue CEO zu sein, der die Potentiale ein wenig besser rüberbringen soll als zuvor. Denn ein Haken bei Array war bisher wohl, dass sie zwar aussichtsreiche Kandidaten hatten, aber es meistens nur Rückschläge gab und nicht wirklich etwas dabei herauskam.
Naja, ob du in deiner Euphorie übertreibst, weiß ich nicht so recht. Vielleicht siehst du es ein wenig zu positiv. Allerdings gibt es ja auch eine Menge interessanter Punkte, so dass sie schon irgendwo erfolgreich sein werden. Interessant nächstes Jahr (oder habe ich es falsch verstanden?) könnte auch AMG 151 (Diabetes) werden. Wenn ich es richtig gelesen habe, dürften hier im April/Mai Daten anstehen, die sich im Erfolgsfall sehr positiv auf den Kurs auswirken dürften. Für H12013 hat Array auch einen Partner für ARRY-797 in Aussicht gestellt... mit dem richtigen Partner könnte sich hier auch einiges an Potential ergeben.
crosscurrentllc.com/uploads/ARRY_8-14-12_A_Maturing_Pipeline…
Du sagst, dass beide MEKs nächstes Jahr in die Zulassungsstudien gehen und Array hierfür double-digit Ansprüche hat. Selumetinib ist vielleicht noch nicht ganz so sicher. In den letzten Tagen hat AZ ja eine weitere PII mit neuen Dosierungen gestartet, weshalb einige meinten, dass AZ doch noch nicht soweit ist, eine PIII zu starten. Hier ein Auszug aus Twitter:
j l ?@lomu_j
$AZN starting another P2 in NSLCLC for Selmetinib aka AZD6244. Includes KRAS analysis. No p3 yet?? $ARRY t.co/0Zj5OmgF
---
19 Dez mcbio ?@mcbio316
@lomu_j good find..looks like it's 2 test lower dose of docetaxel in combo w/same dose of selumetinib used in prior P2 $ARRY
---
Sally Church ?@MaverickNY
@mcbio316 @lomu_j MEKi are not easy combo partners, often req dose modifications so need to get schedule right. They said this at ASCO
---
mcbio ?@mcbio316
@MaverickNY @lomu_j bummer that program likely delayed but as I mentioned b4 I don't think selumetinib is even $arry's most impt mek
---
Sally Church ?@MaverickNY
@mcbio316 @lomu_j agreed but still a promising approach. Better to get it right by doing more ph2 than rush into ph3
Sally Church hatte vorher etwas zu Selmetinib geschrieben: pharmastrategyblog.com/2012/11/effectively-targeting-kras-in…
Irgendwann habe ich auch mal etwas gelesen, dass Selmetinib trotz vielleicht geringerer Effektivität gegenüber GSKs Trametinib auch Vorteile haben könnte, da Trametinib deutlich mehr Nebenwirkungen haben soll. Keine Ahnung, ob das stimmt... ich denke nur, das zeigt, dass bezüglich der MEKs noch einiges offen ist und erst die Zukunft zeigen wird, welcher MEK-Hemmer wofür am besten geeignet ist.
Array profitiert allerdings mehr von MEK162. Die Selmetinib Royalties sind zwar langfristig 2stellig, beginnen aber erstmal einstellig. Hat Array für MEK162 generell höhrere Royalties? Ich hatte es so verstanden, dass sie die Option haben, eine Indikation für MEK162 zusammen mit Novartis zu entwickeln ("Initiate Array-conducted registration trial"). Dafür bekommen sie dann deutlich höhrere Umsatzanteile. Diese Indikation müssten sie aber erst wählen und auch entsprechend investieren.
Für ARRY-614 gibt es bisher ja wenig Daten. Einige sehen hier aber den wichtigsten Kandidaten in ihrer Pipeline.
******
Inwiefern wolltest du dein Depot umbauen, siehst du einige Positionen nun grundsätzlich anders? Ich ändere meine Positionen immer nur geringfügig bzw. ergibt sich dadurch ein Umbau im Laufe der Zeit, aber nicht so abrupt.
Neben Array halte ich z.B auch Celldex für recht aussichtsreich: CDX-011 mit theoretischem Herceptin-Potential, CDX-1135 ein verbessertes Solaris, CDX-1127 eine Art PD-1. Interessant finde ich auch immer noch ARQL... Tivantinib könnte bald in HCC und mCRC in Zulassungsstudien gehen. Beide haben meine ich Blockbuster-Potential und sind wahrscheinlich besser designed als die NSCLC-Studie + hier ist Metmab meine ich noch nicht so weit. Das Ganze für eine MK unter 200 Mio USD bei über 100 Mio USD Cash...
seekingalpha.com/article/1062911-arqule-an-inexpensive-and-w…
Gruß
ipollit
Array ist auch eine meiner größeren Positionen. Für die aktuelle MK sind ungewöhnlich viele Erfolgschancen vorhanden. Ein Plus der letzten Zeit scheint auch der neue CEO zu sein, der die Potentiale ein wenig besser rüberbringen soll als zuvor. Denn ein Haken bei Array war bisher wohl, dass sie zwar aussichtsreiche Kandidaten hatten, aber es meistens nur Rückschläge gab und nicht wirklich etwas dabei herauskam.
Naja, ob du in deiner Euphorie übertreibst, weiß ich nicht so recht. Vielleicht siehst du es ein wenig zu positiv. Allerdings gibt es ja auch eine Menge interessanter Punkte, so dass sie schon irgendwo erfolgreich sein werden. Interessant nächstes Jahr (oder habe ich es falsch verstanden?) könnte auch AMG 151 (Diabetes) werden. Wenn ich es richtig gelesen habe, dürften hier im April/Mai Daten anstehen, die sich im Erfolgsfall sehr positiv auf den Kurs auswirken dürften. Für H12013 hat Array auch einen Partner für ARRY-797 in Aussicht gestellt... mit dem richtigen Partner könnte sich hier auch einiges an Potential ergeben.
crosscurrentllc.com/uploads/ARRY_8-14-12_A_Maturing_Pipeline…
Du sagst, dass beide MEKs nächstes Jahr in die Zulassungsstudien gehen und Array hierfür double-digit Ansprüche hat. Selumetinib ist vielleicht noch nicht ganz so sicher. In den letzten Tagen hat AZ ja eine weitere PII mit neuen Dosierungen gestartet, weshalb einige meinten, dass AZ doch noch nicht soweit ist, eine PIII zu starten. Hier ein Auszug aus Twitter:
j l ?@lomu_j
$AZN starting another P2 in NSLCLC for Selmetinib aka AZD6244. Includes KRAS analysis. No p3 yet?? $ARRY t.co/0Zj5OmgF
---
19 Dez mcbio ?@mcbio316
@lomu_j good find..looks like it's 2 test lower dose of docetaxel in combo w/same dose of selumetinib used in prior P2 $ARRY
---
Sally Church ?@MaverickNY
@mcbio316 @lomu_j MEKi are not easy combo partners, often req dose modifications so need to get schedule right. They said this at ASCO
---
mcbio ?@mcbio316
@MaverickNY @lomu_j bummer that program likely delayed but as I mentioned b4 I don't think selumetinib is even $arry's most impt mek
---
Sally Church ?@MaverickNY
@mcbio316 @lomu_j agreed but still a promising approach. Better to get it right by doing more ph2 than rush into ph3
Sally Church hatte vorher etwas zu Selmetinib geschrieben: pharmastrategyblog.com/2012/11/effectively-targeting-kras-in…
Irgendwann habe ich auch mal etwas gelesen, dass Selmetinib trotz vielleicht geringerer Effektivität gegenüber GSKs Trametinib auch Vorteile haben könnte, da Trametinib deutlich mehr Nebenwirkungen haben soll. Keine Ahnung, ob das stimmt... ich denke nur, das zeigt, dass bezüglich der MEKs noch einiges offen ist und erst die Zukunft zeigen wird, welcher MEK-Hemmer wofür am besten geeignet ist.
Array profitiert allerdings mehr von MEK162. Die Selmetinib Royalties sind zwar langfristig 2stellig, beginnen aber erstmal einstellig. Hat Array für MEK162 generell höhrere Royalties? Ich hatte es so verstanden, dass sie die Option haben, eine Indikation für MEK162 zusammen mit Novartis zu entwickeln ("Initiate Array-conducted registration trial"). Dafür bekommen sie dann deutlich höhrere Umsatzanteile. Diese Indikation müssten sie aber erst wählen und auch entsprechend investieren.
Für ARRY-614 gibt es bisher ja wenig Daten. Einige sehen hier aber den wichtigsten Kandidaten in ihrer Pipeline.
******
Inwiefern wolltest du dein Depot umbauen, siehst du einige Positionen nun grundsätzlich anders? Ich ändere meine Positionen immer nur geringfügig bzw. ergibt sich dadurch ein Umbau im Laufe der Zeit, aber nicht so abrupt.
Neben Array halte ich z.B auch Celldex für recht aussichtsreich: CDX-011 mit theoretischem Herceptin-Potential, CDX-1135 ein verbessertes Solaris, CDX-1127 eine Art PD-1. Interessant finde ich auch immer noch ARQL... Tivantinib könnte bald in HCC und mCRC in Zulassungsstudien gehen. Beide haben meine ich Blockbuster-Potential und sind wahrscheinlich besser designed als die NSCLC-Studie + hier ist Metmab meine ich noch nicht so weit. Das Ganze für eine MK unter 200 Mio USD bei über 100 Mio USD Cash...
seekingalpha.com/article/1062911-arqule-an-inexpensive-and-w…
Gruß
ipollit
Antwort auf Beitrag Nr.: 43.956.200 von ipollit am 22.12.12 15:39:03Hallo ipollit,
vielen Dank für Deine wie immer hilfreiche Antwort.
Zu den Royalties:
Ja, ich verstehe es so, dass sie für MEK162 einen höheren Anspruch haben, als für Selumetinib.
Ein Hinweis ist, dass sie in ihrem 10K-File verschiedene Formulierungen verwenden:
Selumetinib:
The agreement also provided for research funding, which is now
complete, and provides potential additional development milestone payments of approximately $75 million and royalties on product sales.
MEK162:
The agreement provides Array with double- digit royalties on worldwide sales of any approved drugs, with royalties on U.S. sales at a significantly higher level.
double-digit wird im SEC-File nur bei MEK162 klar gesagt, bei Selumetinib ergibt es sich nur aus Investor-Präsentationen.
Mit den US-Rechten für MEK162 ist es wohl wirklich kompliziert.
Ich habe mal einiges aus dem SEC-File kopiert. Das Bild ist für mich nicht ganz klar.
Es klingt für mich fast so, als hätte man zunächst mal für alle Indikationen eine Kostenbeteiligung an der Entwicklung und könnte einzelne Sachen abwählen. Für alles, was Array abwählt, fallen sie dann auch in den USA auf die üblichen double-digit-Royalties runter. Für zwei Indikationen hat man darüber hinaus scheinbar das Recht auf ein aktives co-development.
??
We will pay a percentage of development costs up to a maximum amount with annual caps. We may opt out of paying such development costs with respect to one or more products; in which case the U.S. royalty rate would then
be reduced for any such product based on a specified formula, subject to a minimum that equals the royalty rate on sales outside the U.S.
and we would no longer have the right to develop or detail such product.
Under the agreement, the Company is responsible for completing the on-going Phase 1b expansion trial of MEK162 in patients with KRAS or BRAF mutant colorectal cancer and for the further development of MEK162 for up to two indications. Novartis is responsible for all other development activities and for the commercialization of products under the agreement, subject to the Company's option to co-detail approved drugs in the U.S.
...so long as the Company continues to co-develop products under the program in the U.S., royalties on U.S. sales are at a significantly higher level than sales outside the U.S., as described below.
The Novartis agreement also contains co-development rights whereby the Company can elect to pay a percentage share of the combined total
development costs. During the first two years of the co-development period, Novartis will reimburse the Company for 100% of the
Company's development costs. Beginning in year three, the Company will begin paying its percentage share of the combined development costs since inception of the program, up to a maximum amount with annual caps, unless it opts out of paying its percentage share of these costs. If the Company opts
out of paying its share of combined development costs with respect to one or more products, the U.S. royalty rate would then be reduced for
any such product based on a specified formula, subject to a minimum that equals the royalty rate on sales outside the U.S., and the
Company would no longer have the right to develop or detail such product.
------------------
Depot:
Nein, so radikal ist der Umbau dann auch wieder nicht.
PCYC werden weiter reduziert (ist dann eine ziemlich kleine Position).
MorphoSys werden reduziert (schon vollzogen).
YMI werden verkauft (muss ja).
Gilead werden verkauft.
Mit den freiwerdenden Mitteln werde ich keine neuen Positionen eingehen, sondern bestehende Positionen verstärken.
Das führt zu einer stärkeren Konzentration als bisher.
Ich weiß, dass Du immer sehr breit streust. Ich habe jetzt eher die Tendenz, die Diversifikation zurückzufahren.
Kaufen werde ich:
- Array (zum größten Teil schon Freitag passiert)
- Celldex (sehe ich wie Du als sehr aussichtsreich an)
- Synta
(Mit Arqule hast Du wahrscheinlich recht. Du hattest auch mit Array recht, als ich es noch nicht kapieren wollte.)
Viele Grüße
vielen Dank für Deine wie immer hilfreiche Antwort.
Zu den Royalties:
Ja, ich verstehe es so, dass sie für MEK162 einen höheren Anspruch haben, als für Selumetinib.
Ein Hinweis ist, dass sie in ihrem 10K-File verschiedene Formulierungen verwenden:
Selumetinib:
The agreement also provided for research funding, which is now
complete, and provides potential additional development milestone payments of approximately $75 million and royalties on product sales.
MEK162:
The agreement provides Array with double- digit royalties on worldwide sales of any approved drugs, with royalties on U.S. sales at a significantly higher level.
double-digit wird im SEC-File nur bei MEK162 klar gesagt, bei Selumetinib ergibt es sich nur aus Investor-Präsentationen.
Mit den US-Rechten für MEK162 ist es wohl wirklich kompliziert.
Ich habe mal einiges aus dem SEC-File kopiert. Das Bild ist für mich nicht ganz klar.
Es klingt für mich fast so, als hätte man zunächst mal für alle Indikationen eine Kostenbeteiligung an der Entwicklung und könnte einzelne Sachen abwählen. Für alles, was Array abwählt, fallen sie dann auch in den USA auf die üblichen double-digit-Royalties runter. Für zwei Indikationen hat man darüber hinaus scheinbar das Recht auf ein aktives co-development.
??
We will pay a percentage of development costs up to a maximum amount with annual caps. We may opt out of paying such development costs with respect to one or more products; in which case the U.S. royalty rate would then
be reduced for any such product based on a specified formula, subject to a minimum that equals the royalty rate on sales outside the U.S.
and we would no longer have the right to develop or detail such product.
Under the agreement, the Company is responsible for completing the on-going Phase 1b expansion trial of MEK162 in patients with KRAS or BRAF mutant colorectal cancer and for the further development of MEK162 for up to two indications. Novartis is responsible for all other development activities and for the commercialization of products under the agreement, subject to the Company's option to co-detail approved drugs in the U.S.
...so long as the Company continues to co-develop products under the program in the U.S., royalties on U.S. sales are at a significantly higher level than sales outside the U.S., as described below.
The Novartis agreement also contains co-development rights whereby the Company can elect to pay a percentage share of the combined total
development costs. During the first two years of the co-development period, Novartis will reimburse the Company for 100% of the
Company's development costs. Beginning in year three, the Company will begin paying its percentage share of the combined development costs since inception of the program, up to a maximum amount with annual caps, unless it opts out of paying its percentage share of these costs. If the Company opts
out of paying its share of combined development costs with respect to one or more products, the U.S. royalty rate would then be reduced for
any such product based on a specified formula, subject to a minimum that equals the royalty rate on sales outside the U.S., and the
Company would no longer have the right to develop or detail such product.
------------------
Depot:
Nein, so radikal ist der Umbau dann auch wieder nicht.
PCYC werden weiter reduziert (ist dann eine ziemlich kleine Position).
MorphoSys werden reduziert (schon vollzogen).
YMI werden verkauft (muss ja).
Gilead werden verkauft.
Mit den freiwerdenden Mitteln werde ich keine neuen Positionen eingehen, sondern bestehende Positionen verstärken.
Das führt zu einer stärkeren Konzentration als bisher.
Ich weiß, dass Du immer sehr breit streust. Ich habe jetzt eher die Tendenz, die Diversifikation zurückzufahren.
Kaufen werde ich:
- Array (zum größten Teil schon Freitag passiert)
- Celldex (sehe ich wie Du als sehr aussichtsreich an)
- Synta
(Mit Arqule hast Du wahrscheinlich recht. Du hattest auch mit Array recht, als ich es noch nicht kapieren wollte.)
Viele Grüße
Hallo ipollit, kmastra,
ein sehr umfangreicher Artikel von Hammer zu allen möglichen Depot-Positionen:
Unter anderem auch einiges zu Arry:
The company’s lead program is ARRY-520, a KSP inhibitor for the treatment of multiple myeloma. Updated results at ASH were encouraging and included a response rate of 22% in late stage patients in combination with steroids. This level of activity appears competitive with other novel agents such as Celgene’s (CELG) pomalidomide. In the same meeting, Celgene reported a response rate of 21% with pomalidomide in combination with steroids. Although Array’s results are from a small trial (18 patients) patients were more heavily pretreated (median of 10 prior treatment lines vs. 5 with pomalidomide).
Das bestärkt mich in meiner Einschätzung, dass der Markt ARRY520 unterschätzt.
kmastra, was Hammer zu AVEO schreibt, überzeugt mich hingegen nicht...
Viele Grüße
SLG
ein sehr umfangreicher Artikel von Hammer zu allen möglichen Depot-Positionen:
Unter anderem auch einiges zu Arry:
The company’s lead program is ARRY-520, a KSP inhibitor for the treatment of multiple myeloma. Updated results at ASH were encouraging and included a response rate of 22% in late stage patients in combination with steroids. This level of activity appears competitive with other novel agents such as Celgene’s (CELG) pomalidomide. In the same meeting, Celgene reported a response rate of 21% with pomalidomide in combination with steroids. Although Array’s results are from a small trial (18 patients) patients were more heavily pretreated (median of 10 prior treatment lines vs. 5 with pomalidomide).
Das bestärkt mich in meiner Einschätzung, dass der Markt ARRY520 unterschätzt.
kmastra, was Hammer zu AVEO schreibt, überzeugt mich hingegen nicht...
Viele Grüße
SLG
Antwort auf Beitrag Nr.: 43.958.623 von SLGramann am 24.12.12 10:52:16sorry, Link vergessen:
http://www.hammerstockblog.com/biotech-portfolio-update-%E2%…
http://www.hammerstockblog.com/biotech-portfolio-update-%E2%…
Hallo,
würde gerne in Zukunft hier meinen Senf hinzugeben.
Habe mich in den letzten Wochen bemüht mein Depot auf 2013 auszurichten. Hierbei bin ich
ein paar Positionen eingegangen, die ich für aussichtsreich halte:
Amarin Corp (AMRN) - Vascepa bringt den Turnaround
Cornerstone Therapeutics (CRTX) - 30% Wachstum mit KGV < 5
Lpath Inc (LPTN) - der kommende Regeneron-Schreck???
OncoGenex Pharm (OGXI) - 3x Phase III Krebsstudien mit einer Marketcap unter USD 200 Mio
SIGA Technologies (SIGA) - Umsatzexplosion voraus, KGV < 3
Titan Pharmaceuticals (TTNP) - Partnerschaft spült bis zu 50 Mio in die Kasse.
Finde den Thread sehr interessant, auch wenn ihr alle etwas langfristiger orientiert seid.
würde gerne in Zukunft hier meinen Senf hinzugeben.

Habe mich in den letzten Wochen bemüht mein Depot auf 2013 auszurichten. Hierbei bin ich
ein paar Positionen eingegangen, die ich für aussichtsreich halte:
Amarin Corp (AMRN) - Vascepa bringt den Turnaround
Cornerstone Therapeutics (CRTX) - 30% Wachstum mit KGV < 5
Lpath Inc (LPTN) - der kommende Regeneron-Schreck???
OncoGenex Pharm (OGXI) - 3x Phase III Krebsstudien mit einer Marketcap unter USD 200 Mio
SIGA Technologies (SIGA) - Umsatzexplosion voraus, KGV < 3
Titan Pharmaceuticals (TTNP) - Partnerschaft spült bis zu 50 Mio in die Kasse.
Finde den Thread sehr interessant, auch wenn ihr alle etwas langfristiger orientiert seid.

Zu TTNP:
Probuphine(R) Receives FDA Priority Review Designation for Adult Patients With Opioid Dependence Marketwire(Wed 7:00AM EST)
http://finance.yahoo.com/news/probuphine-r-receives-fda-prio…
PDUFA-Termin ist nun der 30.04.2013
Probuphine(R) Receives FDA Priority Review Designation for Adult Patients With Opioid Dependence Marketwire(Wed 7:00AM EST)
http://finance.yahoo.com/news/probuphine-r-receives-fda-prio…
PDUFA-Termin ist nun der 30.04.2013
Antwort auf Beitrag Nr.: 43.958.624 von SLGramann am 24.12.12 10:52:52Allen hier erstmal ein frohes und hoffentlich erfolgreiches neues Jahr!
SLGramann: Ähnlich wie du und Ipollit habe ich Array nochmal nachgefasst. Einerseits hat die ÜPosition somit eine viel zu hohe Gewichtung aber andereseits finde ich das Risiko auch überschaubar. Aveo hatte ich mir eine kleine Position gekauft. Wahrscheinlich werde ich sie die Tage wieder verkaufen, so richtig breit sind die ja nicht aufgestellt...
Eroberer: Viele deiner Werte sagen mir nichts. Amarin - klar - halte ich für sehr spekulativ, da ja noch gar nicht klar ist, wie lange sich Vascepa überhaupt vermarkten lässt...
Interessant fand ich auf jeden Fall Cornerstone. Wenn ich das richtig verstehe, haben die mehrere Produkte am Markt und vermarkten diese dann direkt an Krankenhäuser? Das scheint mir ein schlüssiges Konzept. Hast du da noch mehr Infos?
SG kmastra
SLGramann: Ähnlich wie du und Ipollit habe ich Array nochmal nachgefasst. Einerseits hat die ÜPosition somit eine viel zu hohe Gewichtung aber andereseits finde ich das Risiko auch überschaubar. Aveo hatte ich mir eine kleine Position gekauft. Wahrscheinlich werde ich sie die Tage wieder verkaufen, so richtig breit sind die ja nicht aufgestellt...
Eroberer: Viele deiner Werte sagen mir nichts. Amarin - klar - halte ich für sehr spekulativ, da ja noch gar nicht klar ist, wie lange sich Vascepa überhaupt vermarkten lässt...
Interessant fand ich auf jeden Fall Cornerstone. Wenn ich das richtig verstehe, haben die mehrere Produkte am Markt und vermarkten diese dann direkt an Krankenhäuser? Das scheint mir ein schlüssiges Konzept. Hast du da noch mehr Infos?
SG kmastra
ARRY... demnächst startet für MEK-162 die erste PIII mit Daten im Herbst 2014
investorshub.advfn.com/boards/read_msg.aspx?message_id=83203…
ARRY @ JPM (1/8/13)
1. ARRY's first official Phase 3 trial started today with NVS' opening of the Phase 3 trial for MEK162 against NRAS melanoma. ARRY expects the trial to complete in October 2014 and believes they could begin receiving revenues from the drug in 2015.
2. ARRY spoke with the FDA in December regarding path forward for ARRY-614 and came to agreement on measures of hematologic improvement (HI) as primary endpoint (slide 20). There was concern that OS might be only path forward. ARRY believes they can "hit" on HI based on the numbers from the prior formulation and is comfortable they have a path forward for 614. [Seems to be a pretty important point to me here as a primary endpoint of HI would seem to be a much lower bar than OS.]
3. In combo trial of ARRY-520 + carfilzomib, there was a CR in one of the first three patients. Carfilzomib itself only resulted in 1 CR in its entire registrational trial.




Gruß
ipollit
investorshub.advfn.com/boards/read_msg.aspx?message_id=83203…
ARRY @ JPM (1/8/13)
1. ARRY's first official Phase 3 trial started today with NVS' opening of the Phase 3 trial for MEK162 against NRAS melanoma. ARRY expects the trial to complete in October 2014 and believes they could begin receiving revenues from the drug in 2015.
2. ARRY spoke with the FDA in December regarding path forward for ARRY-614 and came to agreement on measures of hematologic improvement (HI) as primary endpoint (slide 20). There was concern that OS might be only path forward. ARRY believes they can "hit" on HI based on the numbers from the prior formulation and is comfortable they have a path forward for 614. [Seems to be a pretty important point to me here as a primary endpoint of HI would seem to be a much lower bar than OS.]
3. In combo trial of ARRY-520 + carfilzomib, there was a CR in one of the first three patients. Carfilzomib itself only resulted in 1 CR in its entire registrational trial.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.002.892 von ipollit am 10.01.13 00:59:26Vielen Dank.
Da bleibt einem "nichts anderes übrig" als einzusteigen.
Interessantes, weil oben bereits angesprochen, zu Celldex:
http://www.fool.com/investing/general/2013/01/09/does-this-b…
Darüberhinaus eine Frage noch meinerseits:
Jemand eine "kurze" (oder auch lange) Meinung zu ALNYLAM und SAREPTA ?
Grüsse, s.
Da bleibt einem "nichts anderes übrig" als einzusteigen.
Interessantes, weil oben bereits angesprochen, zu Celldex:
http://www.fool.com/investing/general/2013/01/09/does-this-b…
Darüberhinaus eine Frage noch meinerseits:
Jemand eine "kurze" (oder auch lange) Meinung zu ALNYLAM und SAREPTA ?
Grüsse, s.
Antwort auf Beitrag Nr.: 44.002.892 von ipollit am 10.01.13 00:59:26Hallo ipollit,
das sind doch gute news. Hatte ich auch schon gesehen und Array nochmals aufgestockt. Jetzt ist aber Schluss Ich glaube eigentlich auch ganz fest daran, dass AZ die P III starten wird. Array ist für mich immer noch attraktiv bewertet. Ärgerlich war halt die KE. Mal sehen was die mit dem Geld (ARRY 520) anstellen...
Ich glaube eigentlich auch ganz fest daran, dass AZ die P III starten wird. Array ist für mich immer noch attraktiv bewertet. Ärgerlich war halt die KE. Mal sehen was die mit dem Geld (ARRY 520) anstellen...
@ sufenta: Glaube das das beises qualitativ hochwertige Unternehmen sind. Habe das aber nur am Rande verfolgt.
Eine aktuelle Präsentation zu Alnylam, Array und viele mehr findest du hier:
http://jpmorgan.metameetings.com/webcasts/healthcare13/agend…
das sind doch gute news. Hatte ich auch schon gesehen und Array nochmals aufgestockt. Jetzt ist aber Schluss
 Ich glaube eigentlich auch ganz fest daran, dass AZ die P III starten wird. Array ist für mich immer noch attraktiv bewertet. Ärgerlich war halt die KE. Mal sehen was die mit dem Geld (ARRY 520) anstellen...
Ich glaube eigentlich auch ganz fest daran, dass AZ die P III starten wird. Array ist für mich immer noch attraktiv bewertet. Ärgerlich war halt die KE. Mal sehen was die mit dem Geld (ARRY 520) anstellen... @ sufenta: Glaube das das beises qualitativ hochwertige Unternehmen sind. Habe das aber nur am Rande verfolgt.
Eine aktuelle Präsentation zu Alnylam, Array und viele mehr findest du hier:
http://jpmorgan.metameetings.com/webcasts/healthcare13/agend…
Hallo sufenta,
bezüglich ANLY und SRPT: In den letzten Jahren war die RNAi-Technologie nach dem Boom in den Jahren zuvor mit der Übernahme von z.B. Sirna durch Merck usw ziemlich aus der Mode gekommen: http://www.proactiveinvestors.com/companies/news/19679/will-… Die Pharmas sind in dieser Zeit weitgehend wieder aus der Technologie ausgestiegen und es bestand die Frage, ob diese überhaupt eine Zukunft hat. RNAi&Co ist etwas komplett neues wie z.B. die Antikörper-Medikamente vor vielen Jahren. Bisher gibt es eigentlich noch keine Medikamente, die auf dieser Technik basieren, so dass hier noch viel Unsicherheit besteht und viel schiefgehen kann.
Weil ich die Technik grundsätzlich interessant finde, habe ich noch die Branchengrößen ISIS und ALNY im Depot. Allerdings habe ich zuletzt die Positionen eher reduziert, da ich die Bewertungen mit über 1 Mrd USD nicht gerade günstig fand und bei ISIS gerade Kynamro, das zusammen mit Sanofi entwickelt wird, eher enttäuscht. Demnächst entscheidet die FDA über die Zulassung, in Europa wurden sie bereits abgewiesen. Ursprünglich sollte Kynamro breiter zur Senkung der Blutfett-Werte (was klassischerweise Statine machen) eingesetzt werden. Letztlich musste man aber die Patientenzahl immer weiter auf Hochrisiko-Patienten einschränken, da Kynamro von den Nebenwirkungen wohl doch nicht so ohne ist. Jetzt steht die ganze Zulassung im Raum... Kynamro könnte also komplett scheitern. Ein größeres Problem mit diesen neuen Medikamenten scheint zu sein, dass die Verabreichung nicht so einfach ist. Z.B. Kynamro muss man sich regelmäßig spritzen, was für eine breite Anwendung ja eher hinderlich ist. Es gibt immer neue "Generationen" von dieser Technologie... die ersten Versionen sind wohl noch unbrauchbar, weshalb die Pharmas ausgestiegen sind.
Zuletzt hat sich die Stimmung bezüglich dieser Firmen aber wieder etwas geändert, weil sie aus meiner Sicht sich mehr darauf konzentrieren, sehr seltene und bisher nicht behandelbare Krankheiten zu bekämpfen. Hier spielt die Verabreichung ja nicht so eine Rolle, weil es keine Alternative gibt. Zudem können passende Medikamente die Krankheit deutlich positiv beeinflussen, wenn z.B. bei erblichen Schäden Zellen etwas falsch produzieren, weil Gene defekt sind. Mit diesen Techniken kann man die dafür verantwortlichen schädlichen Gene deaktivieren oder deren Funktion verändern und eine solche Krankheit damit theoretisch "heilen". Für seltene Erbkrankheiten scheint diese Technologie interessant zu sein.
SRPTs Eteplirsen richtet sich gegen eine Muskelerkrankung, die letztlich tödlich ist und nur 3500 Kinder weltweit betrifft. Da für so seltene Krankheiten besonders hohe Preise von 100T bis zu eine Mio USD jährlich pro Patient bezahlt werden, ist die Entwicklung derartiger Medikamente für die Firmen trotzdem lukrativ, zumal es kaum Konkurrenz gibt.
Ob nun ALNY, ISIS, SRPT, TKMR und diverse kleinere Unternehmen eine große Zukunft haben, weiß ich nicht. Zuletzt habe ich sie eher negativ gesehen. Im Moment überlege ich, ob ich meine Meinung nicht nochmal überdenken sollte.
Es gibt deutlich negative Meinungen zu ALNY, dass sie mit ihrem 5x5 Programm (5 Medikamente bis 2015 später klinischer Entwicklung) deutlich hinter dem Zeitplan zurückliegen: www.chimeraresearchgroup.com/2012/12/alnylam-falls-behind-co… Ich war überrascht, dass Ohad Hammer zuletzt sich positiv zu ALNY geäußert hat: "I really like ALNY’s TTR program. Will be happy to buy some under $15.... It mainly has to with rnai being superior to antisense. In other words, ALNY’s agent can reach more profound inhibition with low and safer doses. (Maybe less frequent)... Mcbio - What I like in ALNY is the specific TTR program. It has positive read-throghs to other programs targeting liver related conditions. With respect to RNAi, my working hypothesis that after the meltdown of the field, it will have several therapeutic indications and several programs will reach the market. ARWR have a lot going on but most of it is early stage, could be a nice speculative bet, who knows but in the meantime I prefer ALNY (and perhaps Tekmira)"
Interessant fand ich die ISIS Präsentation die Woche bei JMP: jpmorgan.metameetings.com/webcasts/healthcare13/directlink.p…. ISIS hat einfach ziemlich viele Programme in der Pipeline und will in den nächsten Jahren mehrere Medikamente zur Zulassung bringen.
seekingalpha.com/article/1107861-isis-heats-up-ahead-of-fda-…
Die FDA entscheidet Ende des Monats über Kynamro. Im Fall einer negativen Entscheidung und eines Kurseinbruchs würde ich vielleicht dazukaufen. Ich muss das ganze aber nochmal grundsätzlich überdenken. Z.B. wird hier der SMA-Kandidat, der zusammen mit BIIB entwickelt wird, sehr positiv als potentieller Blockbuster gesehen: twitter.com/MartinShkreli/status/289443755453448192
Gruß,
ipollit
bezüglich ANLY und SRPT: In den letzten Jahren war die RNAi-Technologie nach dem Boom in den Jahren zuvor mit der Übernahme von z.B. Sirna durch Merck usw ziemlich aus der Mode gekommen: http://www.proactiveinvestors.com/companies/news/19679/will-… Die Pharmas sind in dieser Zeit weitgehend wieder aus der Technologie ausgestiegen und es bestand die Frage, ob diese überhaupt eine Zukunft hat. RNAi&Co ist etwas komplett neues wie z.B. die Antikörper-Medikamente vor vielen Jahren. Bisher gibt es eigentlich noch keine Medikamente, die auf dieser Technik basieren, so dass hier noch viel Unsicherheit besteht und viel schiefgehen kann.
Weil ich die Technik grundsätzlich interessant finde, habe ich noch die Branchengrößen ISIS und ALNY im Depot. Allerdings habe ich zuletzt die Positionen eher reduziert, da ich die Bewertungen mit über 1 Mrd USD nicht gerade günstig fand und bei ISIS gerade Kynamro, das zusammen mit Sanofi entwickelt wird, eher enttäuscht. Demnächst entscheidet die FDA über die Zulassung, in Europa wurden sie bereits abgewiesen. Ursprünglich sollte Kynamro breiter zur Senkung der Blutfett-Werte (was klassischerweise Statine machen) eingesetzt werden. Letztlich musste man aber die Patientenzahl immer weiter auf Hochrisiko-Patienten einschränken, da Kynamro von den Nebenwirkungen wohl doch nicht so ohne ist. Jetzt steht die ganze Zulassung im Raum... Kynamro könnte also komplett scheitern. Ein größeres Problem mit diesen neuen Medikamenten scheint zu sein, dass die Verabreichung nicht so einfach ist. Z.B. Kynamro muss man sich regelmäßig spritzen, was für eine breite Anwendung ja eher hinderlich ist. Es gibt immer neue "Generationen" von dieser Technologie... die ersten Versionen sind wohl noch unbrauchbar, weshalb die Pharmas ausgestiegen sind.
Zuletzt hat sich die Stimmung bezüglich dieser Firmen aber wieder etwas geändert, weil sie aus meiner Sicht sich mehr darauf konzentrieren, sehr seltene und bisher nicht behandelbare Krankheiten zu bekämpfen. Hier spielt die Verabreichung ja nicht so eine Rolle, weil es keine Alternative gibt. Zudem können passende Medikamente die Krankheit deutlich positiv beeinflussen, wenn z.B. bei erblichen Schäden Zellen etwas falsch produzieren, weil Gene defekt sind. Mit diesen Techniken kann man die dafür verantwortlichen schädlichen Gene deaktivieren oder deren Funktion verändern und eine solche Krankheit damit theoretisch "heilen". Für seltene Erbkrankheiten scheint diese Technologie interessant zu sein.
SRPTs Eteplirsen richtet sich gegen eine Muskelerkrankung, die letztlich tödlich ist und nur 3500 Kinder weltweit betrifft. Da für so seltene Krankheiten besonders hohe Preise von 100T bis zu eine Mio USD jährlich pro Patient bezahlt werden, ist die Entwicklung derartiger Medikamente für die Firmen trotzdem lukrativ, zumal es kaum Konkurrenz gibt.
Ob nun ALNY, ISIS, SRPT, TKMR und diverse kleinere Unternehmen eine große Zukunft haben, weiß ich nicht. Zuletzt habe ich sie eher negativ gesehen. Im Moment überlege ich, ob ich meine Meinung nicht nochmal überdenken sollte.
Es gibt deutlich negative Meinungen zu ALNY, dass sie mit ihrem 5x5 Programm (5 Medikamente bis 2015 später klinischer Entwicklung) deutlich hinter dem Zeitplan zurückliegen: www.chimeraresearchgroup.com/2012/12/alnylam-falls-behind-co… Ich war überrascht, dass Ohad Hammer zuletzt sich positiv zu ALNY geäußert hat: "I really like ALNY’s TTR program. Will be happy to buy some under $15.... It mainly has to with rnai being superior to antisense. In other words, ALNY’s agent can reach more profound inhibition with low and safer doses. (Maybe less frequent)... Mcbio - What I like in ALNY is the specific TTR program. It has positive read-throghs to other programs targeting liver related conditions. With respect to RNAi, my working hypothesis that after the meltdown of the field, it will have several therapeutic indications and several programs will reach the market. ARWR have a lot going on but most of it is early stage, could be a nice speculative bet, who knows but in the meantime I prefer ALNY (and perhaps Tekmira)"
Interessant fand ich die ISIS Präsentation die Woche bei JMP: jpmorgan.metameetings.com/webcasts/healthcare13/directlink.p…. ISIS hat einfach ziemlich viele Programme in der Pipeline und will in den nächsten Jahren mehrere Medikamente zur Zulassung bringen.
seekingalpha.com/article/1107861-isis-heats-up-ahead-of-fda-…
Die FDA entscheidet Ende des Monats über Kynamro. Im Fall einer negativen Entscheidung und eines Kurseinbruchs würde ich vielleicht dazukaufen. Ich muss das ganze aber nochmal grundsätzlich überdenken. Z.B. wird hier der SMA-Kandidat, der zusammen mit BIIB entwickelt wird, sehr positiv als potentieller Blockbuster gesehen: twitter.com/MartinShkreli/status/289443755453448192
Gruß,
ipollit
Antwort auf Beitrag Nr.: 44.014.379 von ipollit am 12.01.13 16:07:55Hallo ipolit!
Gerade die JMP Konferenz Präsentation von ISIS war einfach phänomenal. Persönlich glaube ich nicht das Kynamro in der künftigen Entwicklung von ISIS eine Rolle spielt, vielmehr sehe ich Kynamro als Hemmschuh der aus dem Weg geräumt werden sollte. Kynamro war ungemein wichtig für die Entwicklung der Antisense-Technologie und Finanzierung der letzten Jahre aber der alleinige Focus auf dieses Medikament der früheren Generation mit seinen bekannten Nebenwirkungen hat den Blick auf die gravierenden Fortschritte in der Antisense-Technologie verhindert. Insbesondere die Angst vor einem Scheitern von Kynamro vor der FDA überschattet(e) alles.
Die Fortschritte in der Antisense-Technologie müssen endlich in den Focus rücken. Die Technologie ist mittlerweile soweit fortgeschritten das die Bildung krankheitsverursachender Proteine bereits auf RNA-Ebene zuverlässig verhindert werden kann bzw. z.B. bei der neuen Splicing-Technologie (SMA) die Bildung gesunder Proteine erst möglich gemacht wird. Was bei der Antisense-Technologie und den jüngeren Medikamentenkandidaten so faszinierend ist, ist die hohe Erfolgswahrscheinlichkeit. Bei nahezu allen Kandidaten ist die Wirksamkeit bereits in Tiermodellen und Phase I/II bewiesen und es kommt eigentlich nur noch auf Nebenwirkungsprofil an.
Hierzu ein paar Beispiele:
ISIS-TTRRx:
das krankheitsverursachende Protein TTR wurde in Tiermodellen und Phase I dosisabhängig soweit herunterreguliert das es nicht mehr nachweisbar ist.
ISIS-APOCIIIRx:
das krankheitsverursachende Protein APOCIII wurde in Tiermodellen und Phase I dosisabhängig um 78% herunterreguliert
ISIS-FXIRx
das krankheitsverursachende Protein FXI wurde in Tiermodellen und Phase I dosisabhängig um mehr als 80% herunterreguliert.
Im Prinzip verhalten sich alle anderen Kandidaten analog. Im Prinzip ist es so: die Effektivität ist bewiesen und einer Zulassung steht nur das Nebenwirkungsprofil im Wege
Bei Kynamro sind diese Nebenwirkungen wie erhöhte Leberwerte, eine hohe Anzahl von spritzenbedingten Reaktionen sowie grippeähnliche Symptome so stark das sehr viele Patienten die Behandlung abbrachen.
In der JPM Präsentation wurden ISIS-TTRRx, ISIS-APOCIIIRx und ISIS-FXIRx mit Kynamro verglichen.
Ergebnis:
1. Bei gleicher Dosierung 1,5-1,8 fach effektivere Reduzierung des Zielproteins
2. 65-89% weniger Injection-site reactions und keine Grippesymptome und auch keine erhöhten Leberwerte
ISIS-APOCIIIRx, ISIS-FXIRx und auch ISIS-CRPrx haben dieses Jahr entscheidende Phase II-Ergebnisse und sind zur Verpartnerung in 2013 vorgesehen. Auf der JPM-Konferenz sagte CEO Stan Crooke das sich allein bei diesen 3 Kandidaten Lizensierungsmöglichkeiten ergeben die die von Kynamro sogar noch übertreffen können. Bei Kynamro vergleichbaren Upfrontzahlungen (>300 Mio$) könnten das alleine fast 1 Mrd $ ergeben.
Das wichtigste auf der Konferenz war aber folgende Aussage:
"the level of interest in our technology and our pipeline is at an all-time high". (Das Interesse and unserer Technologie und unserer Pipeline ist auf einem Allzeit-Hoch)
Die Skepsis an der Bewertung bezüglich Marktkapitalisierung kann ich nicht nachvollziehen. Sarepta hat durch einen einzigen Medikamentenkandidaten eine Steigerung der Marktkapitalisierung um 600-700 Mio erreicht. ISIS hat mindestens 10 Programme mit ähnlichem Marktpotenzial in der Pipeline so das noch viel Luft nach oben besteht. Für die meisten Fonds werden Unternehmen erst ab einer Martkap. über 1 Mrd. interessant.
Auf Sicht von 5-10 Jahren sehe ich ISIS im Bereich einer Regeneron oder sogar Celgene. Im Bereich von Gendefekten (rare und severe diseases) führt kein Weg an Antisense oder RNAI-Therapien vorbei, weil diese durch die etablierten Medikamententechnologien Small molecules und Antikörper nicht oder zumindest ungleich schwerer behandelt werden können. ISIS dominiert den Bereich der Antisense/RNA- Technologie mit seiner Patenten wie kein anderes Unternehmen auch nur annähernd im Bereich humaner Antikörper. Im Bereich humaner Antikörper haben sich sicher mehr als 10 Biotechs entwickelt mit Marktkapitalisierungen von mehr als 20 Mrd $. Warum sollten sich die Bios im Antisense-Bereich nicht ähnlich entwickeln?
Gerade die JMP Konferenz Präsentation von ISIS war einfach phänomenal. Persönlich glaube ich nicht das Kynamro in der künftigen Entwicklung von ISIS eine Rolle spielt, vielmehr sehe ich Kynamro als Hemmschuh der aus dem Weg geräumt werden sollte. Kynamro war ungemein wichtig für die Entwicklung der Antisense-Technologie und Finanzierung der letzten Jahre aber der alleinige Focus auf dieses Medikament der früheren Generation mit seinen bekannten Nebenwirkungen hat den Blick auf die gravierenden Fortschritte in der Antisense-Technologie verhindert. Insbesondere die Angst vor einem Scheitern von Kynamro vor der FDA überschattet(e) alles.
Die Fortschritte in der Antisense-Technologie müssen endlich in den Focus rücken. Die Technologie ist mittlerweile soweit fortgeschritten das die Bildung krankheitsverursachender Proteine bereits auf RNA-Ebene zuverlässig verhindert werden kann bzw. z.B. bei der neuen Splicing-Technologie (SMA) die Bildung gesunder Proteine erst möglich gemacht wird. Was bei der Antisense-Technologie und den jüngeren Medikamentenkandidaten so faszinierend ist, ist die hohe Erfolgswahrscheinlichkeit. Bei nahezu allen Kandidaten ist die Wirksamkeit bereits in Tiermodellen und Phase I/II bewiesen und es kommt eigentlich nur noch auf Nebenwirkungsprofil an.
Hierzu ein paar Beispiele:
ISIS-TTRRx:
das krankheitsverursachende Protein TTR wurde in Tiermodellen und Phase I dosisabhängig soweit herunterreguliert das es nicht mehr nachweisbar ist.
ISIS-APOCIIIRx:
das krankheitsverursachende Protein APOCIII wurde in Tiermodellen und Phase I dosisabhängig um 78% herunterreguliert
ISIS-FXIRx
das krankheitsverursachende Protein FXI wurde in Tiermodellen und Phase I dosisabhängig um mehr als 80% herunterreguliert.
Im Prinzip verhalten sich alle anderen Kandidaten analog. Im Prinzip ist es so: die Effektivität ist bewiesen und einer Zulassung steht nur das Nebenwirkungsprofil im Wege
Bei Kynamro sind diese Nebenwirkungen wie erhöhte Leberwerte, eine hohe Anzahl von spritzenbedingten Reaktionen sowie grippeähnliche Symptome so stark das sehr viele Patienten die Behandlung abbrachen.
In der JPM Präsentation wurden ISIS-TTRRx, ISIS-APOCIIIRx und ISIS-FXIRx mit Kynamro verglichen.
Ergebnis:
1. Bei gleicher Dosierung 1,5-1,8 fach effektivere Reduzierung des Zielproteins
2. 65-89% weniger Injection-site reactions und keine Grippesymptome und auch keine erhöhten Leberwerte
ISIS-APOCIIIRx, ISIS-FXIRx und auch ISIS-CRPrx haben dieses Jahr entscheidende Phase II-Ergebnisse und sind zur Verpartnerung in 2013 vorgesehen. Auf der JPM-Konferenz sagte CEO Stan Crooke das sich allein bei diesen 3 Kandidaten Lizensierungsmöglichkeiten ergeben die die von Kynamro sogar noch übertreffen können. Bei Kynamro vergleichbaren Upfrontzahlungen (>300 Mio$) könnten das alleine fast 1 Mrd $ ergeben.

Das wichtigste auf der Konferenz war aber folgende Aussage:
"the level of interest in our technology and our pipeline is at an all-time high". (Das Interesse and unserer Technologie und unserer Pipeline ist auf einem Allzeit-Hoch)
Die Skepsis an der Bewertung bezüglich Marktkapitalisierung kann ich nicht nachvollziehen. Sarepta hat durch einen einzigen Medikamentenkandidaten eine Steigerung der Marktkapitalisierung um 600-700 Mio erreicht. ISIS hat mindestens 10 Programme mit ähnlichem Marktpotenzial in der Pipeline so das noch viel Luft nach oben besteht. Für die meisten Fonds werden Unternehmen erst ab einer Martkap. über 1 Mrd. interessant.
Auf Sicht von 5-10 Jahren sehe ich ISIS im Bereich einer Regeneron oder sogar Celgene. Im Bereich von Gendefekten (rare und severe diseases) führt kein Weg an Antisense oder RNAI-Therapien vorbei, weil diese durch die etablierten Medikamententechnologien Small molecules und Antikörper nicht oder zumindest ungleich schwerer behandelt werden können. ISIS dominiert den Bereich der Antisense/RNA- Technologie mit seiner Patenten wie kein anderes Unternehmen auch nur annähernd im Bereich humaner Antikörper. Im Bereich humaner Antikörper haben sich sicher mehr als 10 Biotechs entwickelt mit Marktkapitalisierungen von mehr als 20 Mrd $. Warum sollten sich die Bios im Antisense-Bereich nicht ähnlich entwickeln?
Interessiert sich jemand für SNTS?
Santarus wins FDA approval for ulcerative colitis therapy
http://drugdelivery.pharmaceutical-business-review.com/news/…
Santarus wins FDA approval for ulcerative colitis therapy
http://drugdelivery.pharmaceutical-business-review.com/news/…
Antwort auf Beitrag Nr.: 44.021.988 von me_2 am 15.01.13 09:06:09Hallo me__2,
hatte vor paar 2-3 Jahren eine größere Position in SNTS bei Kursen um 3$. Habe leider die Geduld verloren
Hier die aktuellste Präsentation:
http://ir.santarus.com/common/download/download.cfm?companyi…
hatte vor paar 2-3 Jahren eine größere Position in SNTS bei Kursen um 3$. Habe leider die Geduld verloren

Hier die aktuellste Präsentation:
http://ir.santarus.com/common/download/download.cfm?companyi…
Antwort auf Beitrag Nr.: 44.022.499 von cristrader am 15.01.13 10:34:24
Danke, kannte ich noch nicht. Bin seit einigen Wochen dabei, so als "konservatives" Pharmainvestment. Heute ist der Kurs in D ausgesetzt, mal sehen ob die FDA-News was bringen. War ja wohl keine große Überraschung das approval.
Danke, kannte ich noch nicht. Bin seit einigen Wochen dabei, so als "konservatives" Pharmainvestment. Heute ist der Kurs in D ausgesetzt, mal sehen ob die FDA-News was bringen. War ja wohl keine große Überraschung das approval.
Antwort auf Beitrag Nr.: 44.022.561 von me_2 am 15.01.13 10:43:38Viel Glück mit deinem Investment. SNTS scheint ein solides Unternehmen mit stetigem Umsatzwachstum zu sein, was sich über die nächsten Jahre sicher auszahlen wird.
Antwort auf Beitrag Nr.: 44.022.671 von cristrader am 15.01.13 11:05:43@ipollit und kmastra,
Habt vielen Dank für Eure ausführlichen Antworten. Bin "aus dem Bauch" heraus heute in ALNY eingestiegen. Mal schauen, wohin die Reise geht...STOP natürlich eng.
Sarepta und Synta werden mit nächstem Lohn folgen. Dann sollte man sein Invest für ein paar Jahre am besten vergessen.
Grüsse,
s.
Habt vielen Dank für Eure ausführlichen Antworten. Bin "aus dem Bauch" heraus heute in ALNY eingestiegen. Mal schauen, wohin die Reise geht...STOP natürlich eng.
Sarepta und Synta werden mit nächstem Lohn folgen. Dann sollte man sein Invest für ein paar Jahre am besten vergessen.
Grüsse,
s.
Irgendwie kommt ARRY noch nicht so richtig vom Fleck. Nach PCYC sind jetzt ARRY, CLDX und SNTA auch meine größten Positionen... mal schauen, wie sich die Biotechs im allgemeinen dieses Jahr entwickeln. Hoffentlich hält die gute Stimmung in diesem Bereich an.
NBI

11,7% Pharmacyclics - MK 4.990 Mio USD (Kurs 71,5 USD) finance.yahoo.com/q?s=PCYC

8,5% Array - MK 370 Mio USD (Kurs 3,88 USD) finance.yahoo.com/q?s=ARRY

8,0% Celldex - MK 453 Mio USD (Kurs 7,31 USD) finance.yahoo.com/q?s=CLDX

7,7% Synta - MK 708 Mio USD (Kurs 11,46 USD) finance.yahoo.com/q?s=SNTA

6,5% Onyx - MK 5.280 Mio USD (Kurs 78,61 USD) finance.yahoo.com/q?s=ONXX

6,4% Regeneron - MK 16.580 Mio USD (Kurs 174,48 USD) finance.yahoo.com/q?s=REGN

6,1% Incyte - MK 2.450 Mio USD (Kurs 18,7 USD) finance.yahoo.com/q?s=INCY

6,0% Exelixis - MK 877 Mio USD (Kurs 4,78 USD) finance.yahoo.com/q?s=EXEL

4,9% ArQule - MK 155 Mio USD (Kurs 2,49 USD) finance.yahoo.com/q?s=ARQL

4,9% Cubist - MK 2.820 Mio USD (Kurs 43,69 USD) finance.yahoo.com/q?s=CBST

4,3% Achillion - MK 744 Mio USD (Kurs 9,36 USD) finance.yahoo.com/q?s=ACHN

3,6% Ariad - MK 3.310 Mio USD (Kurs 19,88 USD) finance.yahoo.com/q?s=ARIA

3,4% Genmab - MK 939 Mio USD (Kurs 103,6 DKK) finance.yahoo.com/q?s=GEN.CO

2,7% Clovis - MK 522 Mio USD (Kurs 19,99 USD) finance.yahoo.com/q?s=CLVS

2,7% AVEO - MK 341 Mio USD (Kurs 7,8 USD) finance.yahoo.com/q?s=AVEO

2,7% Alnylam - MK 1.300 Mio USD (Kurs 24,77 USD) finance.yahoo.com/q?s=ALNY

2,7% Rigel - MK 583 Mio USD (Kurs 6,7 USD) finance.yahoo.com/q?s=RIGL

2,5% Isis - MK 1.380 Mio USD (Kurs 13,65 USD) finance.yahoo.com/q?s=ISIS

2,3% Seattle Genetics - MK 3.610 Mio USD (Kurs 30,3 USD) finance.yahoo.com/q?s=SGEN

1,2% Intermune - MK 655 Mio USD (Kurs 9,92 USD) finance.yahoo.com/q?s=ITMN

1,0% Trius - MK 193 Mio USD (Kurs 4,89 USD) finance.yahoo.com/q?s=TSRX

Gruß,
ipollit
NBI
11,7% Pharmacyclics - MK 4.990 Mio USD (Kurs 71,5 USD) finance.yahoo.com/q?s=PCYC
8,5% Array - MK 370 Mio USD (Kurs 3,88 USD) finance.yahoo.com/q?s=ARRY
8,0% Celldex - MK 453 Mio USD (Kurs 7,31 USD) finance.yahoo.com/q?s=CLDX
7,7% Synta - MK 708 Mio USD (Kurs 11,46 USD) finance.yahoo.com/q?s=SNTA
6,5% Onyx - MK 5.280 Mio USD (Kurs 78,61 USD) finance.yahoo.com/q?s=ONXX
6,4% Regeneron - MK 16.580 Mio USD (Kurs 174,48 USD) finance.yahoo.com/q?s=REGN
6,1% Incyte - MK 2.450 Mio USD (Kurs 18,7 USD) finance.yahoo.com/q?s=INCY
6,0% Exelixis - MK 877 Mio USD (Kurs 4,78 USD) finance.yahoo.com/q?s=EXEL
4,9% ArQule - MK 155 Mio USD (Kurs 2,49 USD) finance.yahoo.com/q?s=ARQL
4,9% Cubist - MK 2.820 Mio USD (Kurs 43,69 USD) finance.yahoo.com/q?s=CBST
4,3% Achillion - MK 744 Mio USD (Kurs 9,36 USD) finance.yahoo.com/q?s=ACHN
3,6% Ariad - MK 3.310 Mio USD (Kurs 19,88 USD) finance.yahoo.com/q?s=ARIA
3,4% Genmab - MK 939 Mio USD (Kurs 103,6 DKK) finance.yahoo.com/q?s=GEN.CO
2,7% Clovis - MK 522 Mio USD (Kurs 19,99 USD) finance.yahoo.com/q?s=CLVS
2,7% AVEO - MK 341 Mio USD (Kurs 7,8 USD) finance.yahoo.com/q?s=AVEO
2,7% Alnylam - MK 1.300 Mio USD (Kurs 24,77 USD) finance.yahoo.com/q?s=ALNY
2,7% Rigel - MK 583 Mio USD (Kurs 6,7 USD) finance.yahoo.com/q?s=RIGL
2,5% Isis - MK 1.380 Mio USD (Kurs 13,65 USD) finance.yahoo.com/q?s=ISIS
2,3% Seattle Genetics - MK 3.610 Mio USD (Kurs 30,3 USD) finance.yahoo.com/q?s=SGEN
1,2% Intermune - MK 655 Mio USD (Kurs 9,92 USD) finance.yahoo.com/q?s=ITMN
1,0% Trius - MK 193 Mio USD (Kurs 4,89 USD) finance.yahoo.com/q?s=TSRX
Gruß,
ipollit
Antwort auf Beitrag Nr.: 44.069.719 von ipollit am 27.01.13 14:21:56upps... da ist wohl etwas schief gelaufen... hier nochmal mit Charts:
NBI:

11,7% Pharmacyclics - MK 4.990 Mio USD (Kurs 71,5 USD) finance.yahoo.com/q?s=PCYC

8,5% Array - MK 370 Mio USD (Kurs 3,88 USD) finance.yahoo.com/q?s=ARRY

8,0% Celldex - MK 453 Mio USD (Kurs 7,31 USD) finance.yahoo.com/q?s=CLDX

7,7% Synta - MK 708 Mio USD (Kurs 11,46 USD) finance.yahoo.com/q?s=SNTA

6,5% Onyx - MK 5.280 Mio USD (Kurs 78,61 USD) finance.yahoo.com/q?s=ONXX

6,4% Regeneron - MK 16.580 Mio USD (Kurs 174,48 USD) finance.yahoo.com/q?s=REGN

6,1% Incyte - MK 2.450 Mio USD (Kurs 18,7 USD) finance.yahoo.com/q?s=INCY

6,0% Exelixis - MK 877 Mio USD (Kurs 4,78 USD) finance.yahoo.com/q?s=EXEL

4,9% ArQule - MK 155 Mio USD (Kurs 2,49 USD) finance.yahoo.com/q?s=ARQL

4,9% Cubist - MK 2.820 Mio USD (Kurs 43,69 USD) finance.yahoo.com/q?s=CBST

4,3% Achillion - MK 744 Mio USD (Kurs 9,36 USD) finance.yahoo.com/q?s=ACHN

3,6% Ariad - MK 3.310 Mio USD (Kurs 19,88 USD) finance.yahoo.com/q?s=ARIA

3,4% Genmab - MK 939 Mio USD (Kurs 103,6 DKK) finance.yahoo.com/q?s=GEN.CO

2,7% Clovis - MK 522 Mio USD (Kurs 19,99 USD) finance.yahoo.com/q?s=CLVS

2,7% AVEO - MK 341 Mio USD (Kurs 7,8 USD) finance.yahoo.com/q?s=AVEO

2,7% Alnylam - MK 1.300 Mio USD (Kurs 24,77 USD) finance.yahoo.com/q?s=ALNY

2,7% Rigel - MK 583 Mio USD (Kurs 6,7 USD) finance.yahoo.com/q?s=RIGL

2,5% Isis - MK 1.380 Mio USD (Kurs 13,65 USD) finance.yahoo.com/q?s=ISIS

2,3% Seattle Genetics - MK 3.610 Mio USD (Kurs 30,3 USD) finance.yahoo.com/q?s=SGEN

1,2% Intermune - MK 655 Mio USD (Kurs 9,92 USD) finance.yahoo.com/q?s=ITMN

1,0% Trius - MK 193 Mio USD (Kurs 4,89 USD) finance.yahoo.com/q?s=TSRX

Gruß
ipollit
NBI:
11,7% Pharmacyclics - MK 4.990 Mio USD (Kurs 71,5 USD) finance.yahoo.com/q?s=PCYC
8,5% Array - MK 370 Mio USD (Kurs 3,88 USD) finance.yahoo.com/q?s=ARRY
8,0% Celldex - MK 453 Mio USD (Kurs 7,31 USD) finance.yahoo.com/q?s=CLDX
7,7% Synta - MK 708 Mio USD (Kurs 11,46 USD) finance.yahoo.com/q?s=SNTA
6,5% Onyx - MK 5.280 Mio USD (Kurs 78,61 USD) finance.yahoo.com/q?s=ONXX
6,4% Regeneron - MK 16.580 Mio USD (Kurs 174,48 USD) finance.yahoo.com/q?s=REGN
6,1% Incyte - MK 2.450 Mio USD (Kurs 18,7 USD) finance.yahoo.com/q?s=INCY
6,0% Exelixis - MK 877 Mio USD (Kurs 4,78 USD) finance.yahoo.com/q?s=EXEL
4,9% ArQule - MK 155 Mio USD (Kurs 2,49 USD) finance.yahoo.com/q?s=ARQL
4,9% Cubist - MK 2.820 Mio USD (Kurs 43,69 USD) finance.yahoo.com/q?s=CBST
4,3% Achillion - MK 744 Mio USD (Kurs 9,36 USD) finance.yahoo.com/q?s=ACHN
3,6% Ariad - MK 3.310 Mio USD (Kurs 19,88 USD) finance.yahoo.com/q?s=ARIA
3,4% Genmab - MK 939 Mio USD (Kurs 103,6 DKK) finance.yahoo.com/q?s=GEN.CO
2,7% Clovis - MK 522 Mio USD (Kurs 19,99 USD) finance.yahoo.com/q?s=CLVS
2,7% AVEO - MK 341 Mio USD (Kurs 7,8 USD) finance.yahoo.com/q?s=AVEO
2,7% Alnylam - MK 1.300 Mio USD (Kurs 24,77 USD) finance.yahoo.com/q?s=ALNY
2,7% Rigel - MK 583 Mio USD (Kurs 6,7 USD) finance.yahoo.com/q?s=RIGL
2,5% Isis - MK 1.380 Mio USD (Kurs 13,65 USD) finance.yahoo.com/q?s=ISIS
2,3% Seattle Genetics - MK 3.610 Mio USD (Kurs 30,3 USD) finance.yahoo.com/q?s=SGEN
1,2% Intermune - MK 655 Mio USD (Kurs 9,92 USD) finance.yahoo.com/q?s=ITMN
1,0% Trius - MK 193 Mio USD (Kurs 4,89 USD) finance.yahoo.com/q?s=TSRX
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.069.719 von ipollit am 27.01.13 14:21:56Irgendwie kommt ARRY noch nicht so richtig vom Fleck.
Hallo ipollit,
das wird sehr wahrscheinlich noch kommen. Habe für die nächsten 24 Monate ein sehr gutes Gefühl.
Wir hatten ja dies hier:
ARRY spoke with the FDA in December regarding path forward for ARRY-614 and came to agreement on measures of hematologic improvement (HI) as primary endpoint.
Ist ja nicht nur so, dass das eine niedrigere Erfolgsschwelle ist, sondern der pivotal-Trial dürfte auch um einiges schneller zu machen sein.
Hast Du irgendwelche Informationen über das adressierte Marktpotential? MDS ist eine sehr große Indikation, aber sie beziehen sich ja erst mal auf einen kleineren Teilbereich der Patienten.
Hallo ipollit,
das wird sehr wahrscheinlich noch kommen. Habe für die nächsten 24 Monate ein sehr gutes Gefühl.
Wir hatten ja dies hier:
ARRY spoke with the FDA in December regarding path forward for ARRY-614 and came to agreement on measures of hematologic improvement (HI) as primary endpoint.
Ist ja nicht nur so, dass das eine niedrigere Erfolgsschwelle ist, sondern der pivotal-Trial dürfte auch um einiges schneller zu machen sein.
Hast Du irgendwelche Informationen über das adressierte Marktpotential? MDS ist eine sehr große Indikation, aber sie beziehen sich ja erst mal auf einen kleineren Teilbereich der Patienten.
Zitat von lunatics: Ab heute in meinem Bio-Teich:
Rakete Keryx Biopharmaceuticals (KERX)
News treiben Keryx heute auf 5.75 +64%
Bei 10 Bucks werf ich ab

http://www.fool.com/investing/general/2013/01/28/kerx-phase-…
mal ein Beispiel, wie gefährlich biotechs sein können.
der kursverlauf von clsn nach der gescheiterten Phase III.

der kursverlauf von clsn nach der gescheiterten Phase III.
CLSN ist ein weiteres Beispiel für die "Feuerstein-Ratain Rule"...
"[We] analyzed the outcomes of 59 phase III clinical trials of cancer drugs going back 10 years, stratified by the market value of the companies four months prior to trial results being announced. What we found was a remarkable difference between the market values of companies that had positive and negative announcements.
Specifically, the median market capitalization was approximately 80-fold greater for the companies with positive trials vs. companies with negative trials. There were no positive trials among the 21 micro-cap companies (companies with less than $300 million market capitalization) whereas 21 of 27 studies reported by the larger companies analyzed (greater than $1 billion capitalization) were positive."
http://celltherapyblog.blogspot.de/2012/03/predicting-succes…
Gruß
ipollit
"[We] analyzed the outcomes of 59 phase III clinical trials of cancer drugs going back 10 years, stratified by the market value of the companies four months prior to trial results being announced. What we found was a remarkable difference between the market values of companies that had positive and negative announcements.
Specifically, the median market capitalization was approximately 80-fold greater for the companies with positive trials vs. companies with negative trials. There were no positive trials among the 21 micro-cap companies (companies with less than $300 million market capitalization) whereas 21 of 27 studies reported by the larger companies analyzed (greater than $1 billion capitalization) were positive."
http://celltherapyblog.blogspot.de/2012/03/predicting-succes…
Gruß
ipollit
ich hoffe, dass sich durch immer spezifischere Ansätze Krebstherapien in Zukunft deutlich wirksamer werden...
http://www.bloomberg.com/news/2013-02-01/gilead-seeks-blood-…
“Oncology is entering an era where significant advances are going to be made, far above and beyond what’s been made previously,” Milligan said.
...
“There is a massive amount of untapped potential in the hematological malignancy space,”
...
“There are about 115,000 people in U.S. alone with CLL,” Wade said in a telephone interview. “With common prices for these type drugs at $80,000 to $90,000 a year, it’s easy to see how you get to a very big number.”
Together, these drugs from Gilead and others “have the potential to completely change the landscape, where treating CLL with just targeted therapies, as opposed to the chemotherapies of the past,” said John Byrd, leukemia research professor at Ohio State University Medical Center, in a telephone interview.
Gruß
ipollit
http://www.bloomberg.com/news/2013-02-01/gilead-seeks-blood-…
“Oncology is entering an era where significant advances are going to be made, far above and beyond what’s been made previously,” Milligan said.
...
“There is a massive amount of untapped potential in the hematological malignancy space,”
...
“There are about 115,000 people in U.S. alone with CLL,” Wade said in a telephone interview. “With common prices for these type drugs at $80,000 to $90,000 a year, it’s easy to see how you get to a very big number.”
Together, these drugs from Gilead and others “have the potential to completely change the landscape, where treating CLL with just targeted therapies, as opposed to the chemotherapies of the past,” said John Byrd, leukemia research professor at Ohio State University Medical Center, in a telephone interview.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.096.461 von steven_trader am 02.02.13 17:57:31Wobei man das jetzt nicht verallgemeinern sollte. Celsion wurde ja auch kräftig gepusht und hat nur ein Produkt. Jeder der halbwegs Ahnung hatte wusste auch um die Gefahren. In einigen Beiträgen werden hochspekulative Werte dann in den runup geschrieben. Bedenklich ist dabei, dass viele unerfahrene dann darauf reinfallen. Gerade die SA Artikel halte ich für sehr bedenklich, da sie Professionalität vortäuschen aber letztlich von Amateuren verfasst werden.
Ein interessanter Artikel:
http://www.thestreet.com/story/11823518/1/seeking-alpha-auth…" target="_blank" rel="nofollow ugc noopener">http://www.thestreet.com/story/11823518/1/seeking-alpha-auth…
Ein interessanter Artikel:
http://www.thestreet.com/story/11823518/1/seeking-alpha-auth…" target="_blank" rel="nofollow ugc noopener">http://www.thestreet.com/story/11823518/1/seeking-alpha-auth…
Antwort auf Beitrag Nr.: 44.097.387 von ipollit am 03.02.13 12:44:43CLSN ist ein weiteres Beispiel für die "Feuerstein-Ratain Rule"...
In der Tat. Wir hatten das hier im Thread genau mit Bezug auf Celsion ja Mitte September 2012 diskutiert. Danke für die Erinnerung.
Davon abgesehen, dass keine "Regel" immer funktioniert, macht die "Feuerstein-Rule" durchaus Sinn. Der Markt - insbesondere der US-Markt - verfügt durchaus über eine erhebliche Schwarmintelligenz.
Gerade auch durch die ausgeprägten Möglichkeiten des Short-Sellings ist er effizienter als bspw. der deutsche Markt.
Wenn ein Unternehmen mit einer PIII in einer großen Indikation kurz vor dem Abschluss steht, aber die Marktkapitalisierung das mögliche Potential nur sehr unzureichend widerspiegelt, dann hat das zumeist sachliche Gründe.
PS: Keryx scheint allerdings ein Gegenbeispiel zu sein - allerdings kenne ich die genaue Situation dort nicht.
In der Tat. Wir hatten das hier im Thread genau mit Bezug auf Celsion ja Mitte September 2012 diskutiert. Danke für die Erinnerung.
Davon abgesehen, dass keine "Regel" immer funktioniert, macht die "Feuerstein-Rule" durchaus Sinn. Der Markt - insbesondere der US-Markt - verfügt durchaus über eine erhebliche Schwarmintelligenz.
Gerade auch durch die ausgeprägten Möglichkeiten des Short-Sellings ist er effizienter als bspw. der deutsche Markt.
Wenn ein Unternehmen mit einer PIII in einer großen Indikation kurz vor dem Abschluss steht, aber die Marktkapitalisierung das mögliche Potential nur sehr unzureichend widerspiegelt, dann hat das zumeist sachliche Gründe.
PS: Keryx scheint allerdings ein Gegenbeispiel zu sein - allerdings kenne ich die genaue Situation dort nicht.
Update:
Habe mich letzten Freitag mit einem stattlichen Plus von TTNP getrennt. An Gewinnmitnahmen ist noch niemand gestorben.
Im Gegenzug habe ich Affymax (AFFY) gekauft. OMONTYS ist auf einem guten Weg Amgen's EPOGEN den
Rang abzulaufen. Sehe hier eine schöne Langfrist-Spekulation, die auch einen Schuss
Übernahmephantasie birgt.
Habe mich letzten Freitag mit einem stattlichen Plus von TTNP getrennt. An Gewinnmitnahmen ist noch niemand gestorben.
Im Gegenzug habe ich Affymax (AFFY) gekauft. OMONTYS ist auf einem guten Weg Amgen's EPOGEN den
Rang abzulaufen. Sehe hier eine schöne Langfrist-Spekulation, die auch einen Schuss
Übernahmephantasie birgt.
Zitat von kmastra: Wobei man das jetzt nicht verallgemeinern sollte. Celsion wurde ja auch kräftig gepusht und hat nur ein Produkt. Jeder der halbwegs Ahnung hatte wusste auch um die Gefahren. In einigen Beiträgen werden hochspekulative Werte dann in den runup geschrieben. Bedenklich ist dabei, dass viele unerfahrene dann darauf reinfallen. Gerade die SA Artikel halte ich für sehr bedenklich, da sie Professionalität vortäuschen aber letztlich von Amateuren verfasst werden.
Ein interessanter Artikel:
http://www.thestreet.com/story/11823518/1/seeking-alpha-auth…" target="_blank" rel="nofollow ugc noopener">http://www.thestreet.com/story/11823518/1/seeking-alpha-auth…
ja, du hast völlig recht, ich kaufe fast nur aus charttechnischen gründen (deshalb bin ich auch auf clsn aufmerksam geworden), aber vor einem endgültigen kauf schaue ich zumindest nochmal auf die seekingalpha seite was zur Aktie geschrieben wurde. und hier wurde clsn in den höchsten tönen gelobt, eine Zulassung so gut wie sicher. das Ergebnis ist inzwischen bekannt. ich habe mich zum glück gegen einen kauf entschieden, mir war das alles zu heiß. solche fälle werde ich zukünfitg dadurch ausschließen, im dem ich eine neue regel aufstelle, dass der kaufkandidat mindestens eine Price/sale ratio von unter 200 haben muss. dadurch fallen dann alle firmen raus, die wie clsn noch keinen cent an Umsatz generiert haben. da bleibe ich lieber bei der langweiligen snts, da weis man was man hat.
Array mit Q-Zahlen.
Einige wichtige Aussagen:
- During the quarter, Novartis declared its intention to begin a Phase 3 trial with MEK162 in NRAS melanoma which is now scheduled to start in April 2013. In addition, Novartis announced plans to pursue additional MEK162 late-stage clinical development in combination with their Raf inhibitor in BRAF mutant melanoma. Novartis has also recently accelerated its goal of regulatory submissions for MEK162 to 2015.
- During the quarter, Array paid Novartis its first annual co-development contribution of $9.2 million to maintain the maximum U.S. royalty rate for MEK162.
- Also, AstraZeneca recently announced a potential start of a Phase 3 trial with selumetinib in non-small cell lung cancer (NSCLC) during the second half of 2013.
Einige wichtige Aussagen:
- During the quarter, Novartis declared its intention to begin a Phase 3 trial with MEK162 in NRAS melanoma which is now scheduled to start in April 2013. In addition, Novartis announced plans to pursue additional MEK162 late-stage clinical development in combination with their Raf inhibitor in BRAF mutant melanoma. Novartis has also recently accelerated its goal of regulatory submissions for MEK162 to 2015.
- During the quarter, Array paid Novartis its first annual co-development contribution of $9.2 million to maintain the maximum U.S. royalty rate for MEK162.
- Also, AstraZeneca recently announced a potential start of a Phase 3 trial with selumetinib in non-small cell lung cancer (NSCLC) during the second half of 2013.
Habe gestern ein paar Stück gekauft. Nachbörslich hat sich der Kurs nicht bewegt, was mich etwas verwundert.
im Zuge der aktuellen KE von CLDX...
"CDX-011 Developments In December 2012, we had our end of Phase 2b meeting with the United States Federal Drug Administration, or FDA, for our CDX-011 program, which we have characterized as positive. Based on this meeting, we intend to initiate a CDX-011 study suitable for accelerated approval in the second half of 2013. We are currently finalizing the clinical trial design and will update investors on our plans for the accelerated approval trial on our year-end 2012 call in early March 2013."
hierzu noch im letzten Jahr z.B.
http://www.chimeraresearchgroup.com/2012/06/follow-up-on-cel…
"Path Forward: Accelerated Approval?
At several points Celldex’s management spoke about the possibility of pursuing accelerated approval of CDX-011. There is a significant unmet need for patients with triple-negative disease, given the data to date. Naturally, Celldex would love to convince the FDA that a single-arm study based on PFS(with a follow-up randomized study to test overall survival) is adequate, but that seems like somewhat unlikely. It will be interesting to hear what the FDA has to say on this."
Gruß
ipollit
"CDX-011 Developments In December 2012, we had our end of Phase 2b meeting with the United States Federal Drug Administration, or FDA, for our CDX-011 program, which we have characterized as positive. Based on this meeting, we intend to initiate a CDX-011 study suitable for accelerated approval in the second half of 2013. We are currently finalizing the clinical trial design and will update investors on our plans for the accelerated approval trial on our year-end 2012 call in early March 2013."
hierzu noch im letzten Jahr z.B.
http://www.chimeraresearchgroup.com/2012/06/follow-up-on-cel…
"Path Forward: Accelerated Approval?
At several points Celldex’s management spoke about the possibility of pursuing accelerated approval of CDX-011. There is a significant unmet need for patients with triple-negative disease, given the data to date. Naturally, Celldex would love to convince the FDA that a single-arm study based on PFS(with a follow-up randomized study to test overall survival) is adequate, but that seems like somewhat unlikely. It will be interesting to hear what the FDA has to say on this."
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.107.480 von ipollit am 06.02.13 00:38:54We are currently finalizing the clinical trial design and will update investors on our plans for the accelerated approval trial on our year-end 2012 call in early March 2013."
Finde das alles ganz ausgezeichnet.
Vielleicht kann CLDX diesen Trial noch ganz allein durchziehen und erst nach Zulassung für die weitere Entwicklung und weitere Indikationen verpartnern.
Aus meiner Sicht muss dieses Programm eines Tages verpartnert werden, um das ganze Potential erschließen zu können. Sie sind jetzt aber so weit gekommen, dass man Rechte nur gegen wirklich sehr sehr gute Konditionen weggeben sollte.
Finde das alles ganz ausgezeichnet.
Vielleicht kann CLDX diesen Trial noch ganz allein durchziehen und erst nach Zulassung für die weitere Entwicklung und weitere Indikationen verpartnern.
Aus meiner Sicht muss dieses Programm eines Tages verpartnert werden, um das ganze Potential erschließen zu können. Sie sind jetzt aber so weit gekommen, dass man Rechte nur gegen wirklich sehr sehr gute Konditionen weggeben sollte.
Hallo ipollit,
Du hast ja sicher gesehen, dass Hammer ONXX in sein Depot aufgenommen hat.
Damit hat er implizit zugegeben, dass er damals zu früh verkauft hat...
Wie auch immer, folgende Überlegungen finde ich dabei besonders interessant:
- Kyprolis’ market potential is over $3B in multiple myeloma alone, as exemplified by Velcade’s commercial performance
- Kyprolis can be positioned either as a 2nd line proteasome inhibitor (for patients who failed Velcade) or a best in class proteasome inhibitor that will replace Velcade.
- Based on this and available clinical data in Velcade pre-treated patients, Kyprolis has a high likelihood of showing clinical superiority over Velcade.
- Even if Kyprolis does not beat Velcade in a head to head trial, it can still be a >$1B drug as a 2nd line proteasome inhibitor (Providing positive data in FOCUS or ASPIRE).
- Based on Q4 sales and Velcade’s sales trajectory, Kyprolis can reach $1B in sales in 2016.
Für mich ist der schlechteste realistisch anzunehmende Fall der, dass Kyprolis Velcade nicht schlagen kann und nur der "2nd line proteasome inhibitor" wird.
Selbst dann ist - etwas auf Sicht gedacht jedenfalls - die heutige Marktkapitalisierung gerechtfertigt.
Wird Kyprolis als best in class akzeptiert, sind langfristig die 3 Milliarden Umsatz mit Kyprolis sicher realistisch. Die Aktie hätte dann in den nächsten Jahren viel Potential (warum sollte ONXX dann in einigen Jahren nicht 10 bis 15 Mrd. wert sein?).
(der MM Markt soll in den nächsten Jahren insgesamt noch mal stark wachsen)
Sieht für mich nach einem wirklich guten Chance/Risiko-Verhältnis aus.
Wie siehst Du ONXX?
Gruß
SLG
Du hast ja sicher gesehen, dass Hammer ONXX in sein Depot aufgenommen hat.
Damit hat er implizit zugegeben, dass er damals zu früh verkauft hat...
Wie auch immer, folgende Überlegungen finde ich dabei besonders interessant:
- Kyprolis’ market potential is over $3B in multiple myeloma alone, as exemplified by Velcade’s commercial performance
- Kyprolis can be positioned either as a 2nd line proteasome inhibitor (for patients who failed Velcade) or a best in class proteasome inhibitor that will replace Velcade.
- Based on this and available clinical data in Velcade pre-treated patients, Kyprolis has a high likelihood of showing clinical superiority over Velcade.
- Even if Kyprolis does not beat Velcade in a head to head trial, it can still be a >$1B drug as a 2nd line proteasome inhibitor (Providing positive data in FOCUS or ASPIRE).
- Based on Q4 sales and Velcade’s sales trajectory, Kyprolis can reach $1B in sales in 2016.
Für mich ist der schlechteste realistisch anzunehmende Fall der, dass Kyprolis Velcade nicht schlagen kann und nur der "2nd line proteasome inhibitor" wird.
Selbst dann ist - etwas auf Sicht gedacht jedenfalls - die heutige Marktkapitalisierung gerechtfertigt.
Wird Kyprolis als best in class akzeptiert, sind langfristig die 3 Milliarden Umsatz mit Kyprolis sicher realistisch. Die Aktie hätte dann in den nächsten Jahren viel Potential (warum sollte ONXX dann in einigen Jahren nicht 10 bis 15 Mrd. wert sein?).
(der MM Markt soll in den nächsten Jahren insgesamt noch mal stark wachsen)
Sieht für mich nach einem wirklich guten Chance/Risiko-Verhältnis aus.
Wie siehst Du ONXX?
Gruß
SLG
Antwort auf Beitrag Nr.: 44.123.269 von SLGramann am 09.02.13 21:49:55aber molos hat der hammer noch immer nicht 





Zitat von Freizeitspekulant: Ich würde mich freuen wenn der gemischte Thread Resonanz findet und der eine oder andere was beizusteuern hat. Zu den von mir angesprochen Werten beabsichtige ich noch nähere Infos einzustellen, eine Art Watchlist zu führen, ein paar charttechnische Begebenheiten bei Besonderheiten einzustreuen - Meinungen, Wissenswertes oder Anregungen dazu von euch – immer her damit.
vom threaderöffner hört man wohl so gut wie überhaupt nichts mehr?
Antwort auf Beitrag Nr.: 44.123.772 von steven_trader am 10.02.13 12:08:35liegt vielleicht an seinen anfangsbiotechwerten
DVAX – Dynavax Technologies
ACAD – Acadia Pharmaceuticals
GTXI – GTX Inc.
HZNP – Horizon Pharmaceuticals
und deren entwicklung
ACADIA Pharma ist ein HIT !

DVAX – Dynavax Technologies
ACAD – Acadia Pharmaceuticals
GTXI – GTX Inc.
HZNP – Horizon Pharmaceuticals
und deren entwicklung

ACADIA Pharma ist ein HIT !


bei PCYC könnte es noch schneller gehen als gedacht... Ibrutinib hat als erstes Mittel in der Onkologie den neuen "Breakthrough" Status der FDA für die Inidikation MCL erhalten. Wenn ich es richtig verstehe, so reichen damit PI-Studien für ein Zulassung aus bzw. will PCYC die Zulassung für MCL auf Basis der bisherigen Studien bis Ende des Jahres bei der FDA beantragen.
http://finance.yahoo.com/news/pharmacyclics-first-announce-b…
Pharmacylics, together with Janssen, is working with the FDA to determine the implications of this Breakthrough Therapy Designation to the ongoing and planned development and the filing requirements for the use of ibrutinib in patients with MCL and WM. The company expects to finalize the MCL filing prior to year end and will provide guidance on the WM filing after further discussions with the FDA.
Gruß
ipollit
http://finance.yahoo.com/news/pharmacyclics-first-announce-b…
Pharmacylics, together with Janssen, is working with the FDA to determine the implications of this Breakthrough Therapy Designation to the ongoing and planned development and the filing requirements for the use of ibrutinib in patients with MCL and WM. The company expects to finalize the MCL filing prior to year end and will provide guidance on the WM filing after further discussions with the FDA.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.133.891 von ipollit am 13.02.13 01:46:47hier noch etwas zu diesem neuen Status:
http://www.bloomberg.com/news/2013-02-11/innovative-drugs-ma…
"The agency assigned three experimental medicines the new status to try to reduce the time needed to get them to market against deadly diseases, Janet Woodcock, director of the FDA’s Center for Drug Evaluation and Research, said yesterday in an interview before a Bloomberg health conference in New York. Vertex Pharmaceuticals Inc. said last month that two of its drugs for cystic fibrosis had won the designation.
Breakthrough status means the companies will have closer communication with top FDA staff to move drugs for serious diseases to market more quickly, potentially with data from an expanded Phase 1 trial,..."
http://www.bloomberg.com/news/2013-02-11/innovative-drugs-ma…
"The agency assigned three experimental medicines the new status to try to reduce the time needed to get them to market against deadly diseases, Janet Woodcock, director of the FDA’s Center for Drug Evaluation and Research, said yesterday in an interview before a Bloomberg health conference in New York. Vertex Pharmaceuticals Inc. said last month that two of its drugs for cystic fibrosis had won the designation.
Breakthrough status means the companies will have closer communication with top FDA staff to move drugs for serious diseases to market more quickly, potentially with data from an expanded Phase 1 trial,..."
Update:
Habe gestern SIGA knapp unter meinem Zielkurs von 3,50 Dollar verkauft.
Im Gegenzug ist HALO in mein Depot gerutscht. Der Wert befindet sich wieder auf dem Niveau vor Bekanntgabe des Pfizer-Deals.
Habe gestern SIGA knapp unter meinem Zielkurs von 3,50 Dollar verkauft.
Im Gegenzug ist HALO in mein Depot gerutscht. Der Wert befindet sich wieder auf dem Niveau vor Bekanntgabe des Pfizer-Deals.
Bezüglich des Breakthrough-Status, der auch Zulassungen nach der PI ermöglicht, aus der gleichen Quelle:
"In addition to the three treatments that have won the new designation, 18 other drugs have applied, most for types of cancer, Woodcock said."
und heute in http://www.biocentury.com/DailyNews/CurrentIssue#46254
"Separately, FDA told BioCentury that it has granted breakthrough designation to five drug candidates. According to the agency it has denied five requests and 12 are pending. FDA does not disclose sponsors or drug candidates."
Könnte das nicht auch für kleinere Unternehmen wie z.B. ARRY, CLDX usw. interessant sein?
"In addition to the three treatments that have won the new designation, 18 other drugs have applied, most for types of cancer, Woodcock said."
und heute in http://www.biocentury.com/DailyNews/CurrentIssue#46254
"Separately, FDA told BioCentury that it has granted breakthrough designation to five drug candidates. According to the agency it has denied five requests and 12 are pending. FDA does not disclose sponsors or drug candidates."
Könnte das nicht auch für kleinere Unternehmen wie z.B. ARRY, CLDX usw. interessant sein?
Antwort auf Beitrag Nr.: 44.138.097 von ipollit am 13.02.13 20:24:13Ich finde, dass das für CDX-011 optimal passen würde...
Entscheidend sollte die Dringlichkeit für die Patienten sein.
Andererseits ist CLDX sehr klein, was die FDA vielleicht in solchen Fällen kritisch sieht. Weiß ich aber nicht.
Entscheidend sollte die Dringlichkeit für die Patienten sein.
Andererseits ist CLDX sehr klein, was die FDA vielleicht in solchen Fällen kritisch sieht. Weiß ich aber nicht.
Antwort auf Beitrag Nr.: 44.138.097 von ipollit am 13.02.13 20:24:13So ganz klar ist mir allerdings noch nicht, was konkret mit diesem Status verbunden ist? Eine direkte Zulassung ist es ja noch nicht, offensichtlich bietet es aber die Möglichkeit einer sehr frühzeitigen Zulassung:
"Drugmakers may win approval from U.S. regulators for “breakthrough” therapies after a single round of studies, rather than three, in an effort to speed them to patients, a Food and Drug Administration official said...
“We expect many of these would come available very quickly with Phase 1 data,” Woodcock said."
passt das folgende nicht z.B. sehr gut zu CDX-011 in TNBC passen... dort war ja dir Wirkung sämtlicher Alternativen/Standardtherapien gleich Null. Nur die Frage, ob die geringe Patientenzahl belastbar genug ist?
http://www.focr.org/inside-health-policy-fda-taps-first-brea…
"Temple said he expects many of the designations could come from therapies that show a response rate for populations that have been unresponsive to other treatments.
“It is very tempting because you expect the response rate to standard therapy to be essentially zero,” Temple said. “Even a relative modest effect size is pretty convincing that you've got something special so I think a lot of them are going to be for that.” "
Gruß
ipollit
"Drugmakers may win approval from U.S. regulators for “breakthrough” therapies after a single round of studies, rather than three, in an effort to speed them to patients, a Food and Drug Administration official said...
“We expect many of these would come available very quickly with Phase 1 data,” Woodcock said."
passt das folgende nicht z.B. sehr gut zu CDX-011 in TNBC passen... dort war ja dir Wirkung sämtlicher Alternativen/Standardtherapien gleich Null. Nur die Frage, ob die geringe Patientenzahl belastbar genug ist?
http://www.focr.org/inside-health-policy-fda-taps-first-brea…
"Temple said he expects many of the designations could come from therapies that show a response rate for populations that have been unresponsive to other treatments.
“It is very tempting because you expect the response rate to standard therapy to be essentially zero,” Temple said. “Even a relative modest effect size is pretty convincing that you've got something special so I think a lot of them are going to be for that.” "
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.138.157 von SLGramann am 13.02.13 20:40:43genau dasselbe habe ich auch gedacht... 
http://journals.lww.com/oncology-times/blog/onlinefirst/page…
"Difference between Breakthrough & Fast-Track Designations
Asked by OT for more clarification on how the breakthrough designation differs from the fast-track designation, Temple said the fast-track approach has an intent to treat a broad range of serious diseases and the “potential to fill an unmet medical need,” which can be based on preclinical data, while the breakthrough category is intended to treat serious or life-threatening diseases and shows early clinical evidence of “substantial improvement over existing therapies.”
For example, a new breakthrough-designated drug under study might target a molecular driver of a specific cancer in humans, analogous to ALK for a subset of lung cancer patients."
Für mich stellt sich ein wenig die Frage, was ist, wenn so spezifische Therapie zwar deutlich wirksamer ist als der Standard, es aber mehr als einen entsprechenden Kandidaten gibt. Beispielsweise gibt es nur sehr wenige BTK-Hemmer wie der von PCYC. Aber ALK-Hemmer gibt es ja viele gleichzeitig in der Entwicklung... müssen dann alle diesen Status erhalten? Oder gibt man das nur einem und alle anderen müssen den längeren Weg gehen? Vielleicht sind dann auch so Therapien wie CDX-011 oder ARRY-520 für die FDA vorteilhaft, weil diese Ansätze von anderen kaum verfolgt werden?

http://journals.lww.com/oncology-times/blog/onlinefirst/page…
"Difference between Breakthrough & Fast-Track Designations
Asked by OT for more clarification on how the breakthrough designation differs from the fast-track designation, Temple said the fast-track approach has an intent to treat a broad range of serious diseases and the “potential to fill an unmet medical need,” which can be based on preclinical data, while the breakthrough category is intended to treat serious or life-threatening diseases and shows early clinical evidence of “substantial improvement over existing therapies.”
For example, a new breakthrough-designated drug under study might target a molecular driver of a specific cancer in humans, analogous to ALK for a subset of lung cancer patients."
Für mich stellt sich ein wenig die Frage, was ist, wenn so spezifische Therapie zwar deutlich wirksamer ist als der Standard, es aber mehr als einen entsprechenden Kandidaten gibt. Beispielsweise gibt es nur sehr wenige BTK-Hemmer wie der von PCYC. Aber ALK-Hemmer gibt es ja viele gleichzeitig in der Entwicklung... müssen dann alle diesen Status erhalten? Oder gibt man das nur einem und alle anderen müssen den längeren Weg gehen? Vielleicht sind dann auch so Therapien wie CDX-011 oder ARRY-520 für die FDA vorteilhaft, weil diese Ansätze von anderen kaum verfolgt werden?
Aber es könnte auch gerade für die kleineren sehr bedeutsam sein. Ich finde diese neue Zulassungs-Variante jedenfalls sehr interessant.
http://www.fiercebiotech.com/story/fda-breakthrough-designat…
"Biotechs have been paying particularly close attention to this new, infinitely shorter path to the marketplace. A breakthrough designation would revolutionize their commercial prospects, upending some well known methods for building value through long-term partnerships with Big Pharma--which can easily take years to complete. Whether the FDA will allow smaller companies with less experience dealing with the FDA on the ultimate inside track, though, will be interesting to see."
http://www.fiercebiotech.com/story/fda-breakthrough-designat…
"Biotechs have been paying particularly close attention to this new, infinitely shorter path to the marketplace. A breakthrough designation would revolutionize their commercial prospects, upending some well known methods for building value through long-term partnerships with Big Pharma--which can easily take years to complete. Whether the FDA will allow smaller companies with less experience dealing with the FDA on the ultimate inside track, though, will be interesting to see."
Antwort auf Beitrag Nr.: 44.138.197 von ipollit am 13.02.13 20:51:54Nur die Frage, ob die geringe Patientenzahl belastbar genug ist?
Meine Vermutung ist, dass es nicht reichen wird. Wahrscheinlich hätte man den Trial anders (massiver) designt, wenn man damals schon diesen Zulassungs-Modus gehabt hätte.
So hat man halt eine PIIb vorbereiten wollen, die dann die eigentlich relevanten Daten bringen wird.
Die FDA ist in den letzten Jahren ja schon großzügiger geworden und hat auf der Grundlage von PII-Studien Zulassungen erteilt (bspw. Adcetris oder Kyprolis).
Das jetzt geht offenbar ein ganzes Stück weiter, was sehr gut dazu passt, dass man bei Krebsmedikamenten jetzt wirklich langsam bei der personalisierten Medizin ankommt.
Wenn ich mit einem Trial (der natürlich so groß sein sollte, dass er einigermaßen statistisch signifikante Aussagen erlaubt) zur Zulassung kommen kann, dann kann ich auch aggressiv eine Nische adressieren.
Beispiel ARRY-520: Warum nicht einen Trial für dreifach-refraktäre Patienten und zwar nur für solche mit nicht erhöhtem AAG-Spiegel? (Den Rest kann man dann später im normalen Test- und Zulassungsverfahren adressieren)
So eine Entscheidung dürfte jetzt einfacher zu fällen sein.
(Ich denke natürlich auch gleich an Genmabs daratumumab, der auch noch schick von J&J entwickelt wird - könnte vielleicht auch ein heißer Kandidat für "breakthrough" sein.
Insgesamt sind das wirklich gute Nachrichten für die Forschung, die Patienten und die Unternehmen und Investoren.
Meine Vermutung ist, dass es nicht reichen wird. Wahrscheinlich hätte man den Trial anders (massiver) designt, wenn man damals schon diesen Zulassungs-Modus gehabt hätte.
So hat man halt eine PIIb vorbereiten wollen, die dann die eigentlich relevanten Daten bringen wird.
Die FDA ist in den letzten Jahren ja schon großzügiger geworden und hat auf der Grundlage von PII-Studien Zulassungen erteilt (bspw. Adcetris oder Kyprolis).
Das jetzt geht offenbar ein ganzes Stück weiter, was sehr gut dazu passt, dass man bei Krebsmedikamenten jetzt wirklich langsam bei der personalisierten Medizin ankommt.
Wenn ich mit einem Trial (der natürlich so groß sein sollte, dass er einigermaßen statistisch signifikante Aussagen erlaubt) zur Zulassung kommen kann, dann kann ich auch aggressiv eine Nische adressieren.
Beispiel ARRY-520: Warum nicht einen Trial für dreifach-refraktäre Patienten und zwar nur für solche mit nicht erhöhtem AAG-Spiegel? (Den Rest kann man dann später im normalen Test- und Zulassungsverfahren adressieren)
So eine Entscheidung dürfte jetzt einfacher zu fällen sein.
(Ich denke natürlich auch gleich an Genmabs daratumumab, der auch noch schick von J&J entwickelt wird - könnte vielleicht auch ein heißer Kandidat für "breakthrough" sein.
Insgesamt sind das wirklich gute Nachrichten für die Forschung, die Patienten und die Unternehmen und Investoren.
Antwort auf Beitrag Nr.: 44.139.236 von SLGramann am 14.02.13 09:16:48Eine PI, die statistisch belastbare Aussagen zur Wirksamkeit (noch dazu i.Vgl. zu einer Standardtherapie) macht, ist keine PI mehr. Irgendwie kommt mir das ganze noch recht unausgegoren vor. Das Risiko bez. Safety (und Efficacy, was hier natürlich geringer wiegt) wird in die Anwendungs- und Vermarktungphase verschoben. Was bedeutet das auch haftungsrechtlich?
Antwort auf Beitrag Nr.: 44.139.291 von me_2 am 14.02.13 09:30:34Schon richtig, aber ich denke, der wichtigste Punkt ist, dass man von diesem extrem zeitfressenden PI - PIIa/PIIb - PIII - Schema wegkommt und mit nur einem Trial zur Zulassung kommen kann. Dass dieser Trial dann aussagekräftige Daten liefern muss, ist natürlich klar - insofern ist der Begriff PI dann vielleicht nicht ganz angemessen.
Ich denke auch, dass es hier fast immer nur um Krebs-Indikationen gehen wird und nur um "Nischen" mit austherapierten Patienten, die keine Alternativen mehr haben. Insofern sind safety-Aspekte anders zu gewichten, als sonst.
Dass die FDA ansonsten gerade bei safety die Zügel anzieht, hat ja kürzlich erst Novo Nordisk erleben müssen. (Und auch Arrays 797 habe ich deshalb für mich schon mal abgeschrieben).
Ich denke auch, dass es hier fast immer nur um Krebs-Indikationen gehen wird und nur um "Nischen" mit austherapierten Patienten, die keine Alternativen mehr haben. Insofern sind safety-Aspekte anders zu gewichten, als sonst.
Dass die FDA ansonsten gerade bei safety die Zügel anzieht, hat ja kürzlich erst Novo Nordisk erleben müssen. (Und auch Arrays 797 habe ich deshalb für mich schon mal abgeschrieben).
Antwort auf Beitrag Nr.: 44.139.687 von SLGramann am 14.02.13 10:35:46Vielleicht eine Art Orphan Drug designation, nur dass sich der Vorteil nicht auf die Gebühren und Marktrechte, sd. die Zulassungsvoraussetzungen/-Hürden bezieht. Ich frag mich nur ob das auch gesetzlich entspr. verankert wird (XY Act) oder im Rahmen des bisheriges Gesetzesrahmens geschieht. Das Schema bis PIII ist ja kein Dogma, das hat FDA auch schon gezeigt.
Antwort auf Beitrag Nr.: 44.139.236 von SLGramann am 14.02.13 09:16:48Tatsächlich haben sich auch wichtigere Leute als ich Gedanken darüber gemacht, ob nicht Genmabs daratumumab ein breakthrough-Kandidat sein könnte:
http://www.bloomberg.com/news/2013-02-15/genmab-rises-as-dan…
http://www.bloomberg.com/news/2013-02-15/genmab-rises-as-dan…
CLDX... von der letzten Präsentation:
- für CDX-011 wird zunächst ein Accelerated Approval für TNBC und GPNMB+ angestrebt, später eine PIII für GPNMB+ unabhängig von TNBC
- CDX-1127 wirkt ähnlich wie PD1 auf das Immunsystem, wobei PD1 verhindert, dass der Tumor das Immunsystem unterdrückt, während CDX-1127 das Immunsystem stimuliert. Bei letzterem könnte es auch zu einer sehr gefährlichen Überreaktion kommen... bisher soll CDX-1127 aber sehr verträglich sein.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Notes on CLDX presentation at Leering 2/14/13 (From YMB)
Some of the highlights:
1. Rindo PIII:
- accrual will be complete at YE'14
- 50% of events determination by IDMB in 3Q'14
- 75% of events in 4Q'14
- 100% of events in 1Q'15
- Keler confirmed that Rindo produces a potent immune response against EGFRvIII
2. REACT PII with Rindo+AVastin combo:
- expect results this year
- if positive results obtained, CLDX will discuss with FDA registrational trial by either extending pt numbers in that are, or initiating new trial
3. CDX-011 Accelerated Approval trial
- trial will be randomized in pts with high GPNMB/TNBC
- surrogate marker, likely PFS, will be used as end-point
- pt accrual will be completed in 12-15 months ( add about 6 months for follow-up, plus a few months for the FDA decision: approval sometime in mid to 2H'15)
4. CDX1127 PI two arm study:
- solid tumor arm: dose escalation completed, trial will be expanded into 2 indications
- lymphoid tumor: dose escalation ongoing
- results will be reported YE'13
- Keler indicated that 1127 safety profile looks very good; efficacy in preclinical trials similar to PD1 agent developed by K. at Medarex
5. CDX1135 complement inhibitor:
- inhibits all complement activation pathways and this differentiates it from Soliris which is limited to C5 complement pathway
My own 2 cents worth on 1135 in DDD:
- since this is an ultra-orphan indication, initial trial will be in less than a dozen pts
- if initial trial positive, 1135 will go into an Accelerated Approval trial (this is similar to the development pathway for Soliris)
Looks to me like CLDX is firing on all cylinders. Although they didn't tip their hands, my impression based on what Marucci and Keler said- or sometimes implied- was that the trials are going well and we can look forward to a steady stream of positive news. This personal impression is consistent with market sentiment, which has been unwaveringly positive since the EMERGE trial results were reported in Dec '12.
Gruß
ipollit
- für CDX-011 wird zunächst ein Accelerated Approval für TNBC und GPNMB+ angestrebt, später eine PIII für GPNMB+ unabhängig von TNBC
- CDX-1127 wirkt ähnlich wie PD1 auf das Immunsystem, wobei PD1 verhindert, dass der Tumor das Immunsystem unterdrückt, während CDX-1127 das Immunsystem stimuliert. Bei letzterem könnte es auch zu einer sehr gefährlichen Überreaktion kommen... bisher soll CDX-1127 aber sehr verträglich sein.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Notes on CLDX presentation at Leering 2/14/13 (From YMB)
Some of the highlights:
1. Rindo PIII:
- accrual will be complete at YE'14
- 50% of events determination by IDMB in 3Q'14
- 75% of events in 4Q'14
- 100% of events in 1Q'15
- Keler confirmed that Rindo produces a potent immune response against EGFRvIII
2. REACT PII with Rindo+AVastin combo:
- expect results this year
- if positive results obtained, CLDX will discuss with FDA registrational trial by either extending pt numbers in that are, or initiating new trial
3. CDX-011 Accelerated Approval trial
- trial will be randomized in pts with high GPNMB/TNBC
- surrogate marker, likely PFS, will be used as end-point
- pt accrual will be completed in 12-15 months ( add about 6 months for follow-up, plus a few months for the FDA decision: approval sometime in mid to 2H'15)
4. CDX1127 PI two arm study:
- solid tumor arm: dose escalation completed, trial will be expanded into 2 indications
- lymphoid tumor: dose escalation ongoing
- results will be reported YE'13
- Keler indicated that 1127 safety profile looks very good; efficacy in preclinical trials similar to PD1 agent developed by K. at Medarex
5. CDX1135 complement inhibitor:
- inhibits all complement activation pathways and this differentiates it from Soliris which is limited to C5 complement pathway
My own 2 cents worth on 1135 in DDD:
- since this is an ultra-orphan indication, initial trial will be in less than a dozen pts
- if initial trial positive, 1135 will go into an Accelerated Approval trial (this is similar to the development pathway for Soliris)
Looks to me like CLDX is firing on all cylinders. Although they didn't tip their hands, my impression based on what Marucci and Keler said- or sometimes implied- was that the trials are going well and we can look forward to a steady stream of positive news. This personal impression is consistent with market sentiment, which has been unwaveringly positive since the EMERGE trial results were reported in Dec '12.
Gruß
ipollit
INCY... Jakafi entwickelt sich inzwischen positiver
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
INCY 4Q / Year end CC
General impressions: A pretty straightforward conference call that focused mostly on their operational execution. Management appears satisfied about sales to date, and I think they gave a strong forward guidance for 2013. On the clinical trial front, this year may not be all that exciting. Some Phase 2 pancreatic cancer data (tough indication) and maybe some Phase 2 psoriasis / diabetic nephropathy data from Lilly's end. Otherwise the bigger trial data for polycythemia vera is likely to report early next year, and RA is a bit of a ways out. I still think this is a good holding for a diversified portfolio.
Jakafi Guidance / Product Sales:
- 2012, expect to see steady growth in treating MF population over the next couple of years... in 2013, 210-225 million net product guidance. This is driven by new starts along with more patients continuing on drug longer. This latter point suggests that they're having success in their strategy to educate physicians on titrating patients starting at low doses for the first 8-12 weeks. They also indicated that they're urging physicians who discontinued a patient to restart them at the lowest dose.
- adjusted net revenues grew by 25% if you exclude the 9 million in deferred revenue recognized in 3rd quarter
- underlying demand as measured by dispensed bottles grew 17%
- inventory grew by 4%
- price increased by 4%
- they expect data on studies in patients with low platelet counts, with the hope that this is added to the label in the second quarter
- 1/3 of prescribers having written for 2 or more patients
- 50% of subscriptions from new, 50% from repeat right now
- 16-18K patients w/ MF and they believe their addressable population is 15K
Other Jakafi indications:
- polycythemia vera: 2 phase 3 trials are ongoing:
Response trial: SPA, in partnership w/ novartis, fully recruited, expect sNDA in 1H14; treatment of patients resistant or intolerant to hydroxyurea
Relief trial: symptomatic benefit in PV (not required for efficacy, but are looking to use it to support label)
- pancreatic cancer trial: results in 2H13 from fully recruited phase 2 trial... OS is primary endpoint
- baricitinib (Lilly): RA P3 program began in Nov 2012 (triggered the 50 million milestone)
- also looking at baricitinib in psoriasis and diabetic nephropathy.. lilly in phase 2 for both
Other drugs in the pipeline:
- JAK1 inhibitors (incb39110 is the first one)... proof of concept in MF, RA and psoriasis
- cMET inhibitor (w/ Novartis)
- indolamine dioxygenase inhibitor-1 (IDO-1) testing in melanoma and ovarian cancer
General financial data:
- ended 2012 w/ 228 million, excludes 50 million milestone received in january
- 43.3 million in 4Q, 136 million full year net product revenues for jakafi; 3.7 million in jakavi royalties from NVS
- 2013 guidance: expect 210-225 net revenue for jakafi; gross-to-net adjustment 8-9%
- contract revenue: 66 million from amortization of upfront payments received from NVS and Lilly
- milestone: 60 million for EU pricing approval for Jakavi
- royalty arrangement: tiered rate ranges from high teens to mid 20s; when NVS receives pricing approval in specific EU countries, record tiered low single digit royalties payable to NVS on net jakafi sales in the US
- therefore, net cost of goods sold in 2013 will be about 2%... 4-6% when they have to make more drug (current drug being used is from lot made for approval and already expensed)
- 260 to 270 million R&D expense in 2013
- SG&A 100-110 million
- interest expense 47 million, non-cash charge of 28 million related to amortization of discount on 4.75% convertible senior notes
Question and Answer:
- 10 mg becoming most frequently dispensed dosage form
- trend toward lower discontinuation / patients staying on treatment longer
- use in intermediate-1 still exception rather than rule
- forecast includes some decline in rate of new patient starts
- high single digit growth quarter over quarter will satisfy low end of revenue range; low double digit growth in units, quarter over quarter will satisfy higher end... this explanation was prompted by a VERY WHINY question from one analyst (Thomas Wei?) who sees the guidance as low and laments the fact that new patient growths are going to stall. I sure hope, for Thomas Wei's model, that incidence of MF increases... I'd hate for him to be disappointed by a lack of new patient growth
- reasonable guesstimate at this point is that they're adding net about 90-100 new patients a month
- they don't see tablet splitting as an issue; price is the same across all dosages, so patients being titrated up and down doesn't have an asymmetric impact on revenues
- asked about what benefit a JAK1 specific would provide over JAK1/2: erythropoietin / thrombopoietin go through JAK2 exclusively... so JAK1 may retain inflammatory benefit while limiting anemia / thrombocytopenia
- most of the remaining questions were by analysts trying to divine future earnings, so if you're into that then have a listen
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
INCY 4Q / Year end CC
General impressions: A pretty straightforward conference call that focused mostly on their operational execution. Management appears satisfied about sales to date, and I think they gave a strong forward guidance for 2013. On the clinical trial front, this year may not be all that exciting. Some Phase 2 pancreatic cancer data (tough indication) and maybe some Phase 2 psoriasis / diabetic nephropathy data from Lilly's end. Otherwise the bigger trial data for polycythemia vera is likely to report early next year, and RA is a bit of a ways out. I still think this is a good holding for a diversified portfolio.
Jakafi Guidance / Product Sales:
- 2012, expect to see steady growth in treating MF population over the next couple of years... in 2013, 210-225 million net product guidance. This is driven by new starts along with more patients continuing on drug longer. This latter point suggests that they're having success in their strategy to educate physicians on titrating patients starting at low doses for the first 8-12 weeks. They also indicated that they're urging physicians who discontinued a patient to restart them at the lowest dose.
- adjusted net revenues grew by 25% if you exclude the 9 million in deferred revenue recognized in 3rd quarter
- underlying demand as measured by dispensed bottles grew 17%
- inventory grew by 4%
- price increased by 4%
- they expect data on studies in patients with low platelet counts, with the hope that this is added to the label in the second quarter
- 1/3 of prescribers having written for 2 or more patients
- 50% of subscriptions from new, 50% from repeat right now
- 16-18K patients w/ MF and they believe their addressable population is 15K
Other Jakafi indications:
- polycythemia vera: 2 phase 3 trials are ongoing:
Response trial: SPA, in partnership w/ novartis, fully recruited, expect sNDA in 1H14; treatment of patients resistant or intolerant to hydroxyurea
Relief trial: symptomatic benefit in PV (not required for efficacy, but are looking to use it to support label)
- pancreatic cancer trial: results in 2H13 from fully recruited phase 2 trial... OS is primary endpoint
- baricitinib (Lilly): RA P3 program began in Nov 2012 (triggered the 50 million milestone)
- also looking at baricitinib in psoriasis and diabetic nephropathy.. lilly in phase 2 for both
Other drugs in the pipeline:
- JAK1 inhibitors (incb39110 is the first one)... proof of concept in MF, RA and psoriasis
- cMET inhibitor (w/ Novartis)
- indolamine dioxygenase inhibitor-1 (IDO-1) testing in melanoma and ovarian cancer
General financial data:
- ended 2012 w/ 228 million, excludes 50 million milestone received in january
- 43.3 million in 4Q, 136 million full year net product revenues for jakafi; 3.7 million in jakavi royalties from NVS
- 2013 guidance: expect 210-225 net revenue for jakafi; gross-to-net adjustment 8-9%
- contract revenue: 66 million from amortization of upfront payments received from NVS and Lilly
- milestone: 60 million for EU pricing approval for Jakavi
- royalty arrangement: tiered rate ranges from high teens to mid 20s; when NVS receives pricing approval in specific EU countries, record tiered low single digit royalties payable to NVS on net jakafi sales in the US
- therefore, net cost of goods sold in 2013 will be about 2%... 4-6% when they have to make more drug (current drug being used is from lot made for approval and already expensed)
- 260 to 270 million R&D expense in 2013
- SG&A 100-110 million
- interest expense 47 million, non-cash charge of 28 million related to amortization of discount on 4.75% convertible senior notes
Question and Answer:
- 10 mg becoming most frequently dispensed dosage form
- trend toward lower discontinuation / patients staying on treatment longer
- use in intermediate-1 still exception rather than rule
- forecast includes some decline in rate of new patient starts
- high single digit growth quarter over quarter will satisfy low end of revenue range; low double digit growth in units, quarter over quarter will satisfy higher end... this explanation was prompted by a VERY WHINY question from one analyst (Thomas Wei?) who sees the guidance as low and laments the fact that new patient growths are going to stall. I sure hope, for Thomas Wei's model, that incidence of MF increases... I'd hate for him to be disappointed by a lack of new patient growth
- reasonable guesstimate at this point is that they're adding net about 90-100 new patients a month
- they don't see tablet splitting as an issue; price is the same across all dosages, so patients being titrated up and down doesn't have an asymmetric impact on revenues
- asked about what benefit a JAK1 specific would provide over JAK1/2: erythropoietin / thrombopoietin go through JAK2 exclusively... so JAK1 may retain inflammatory benefit while limiting anemia / thrombocytopenia
- most of the remaining questions were by analysts trying to divine future earnings, so if you're into that then have a listen
REGN... Eylea aus dem Stand zum Blockbuster:
- US-Umsätze von über 1,2 Mrd USD in 2013 angepeilt (momentan bei 276 pro Quartal)
- hinzu kommen die ex-US Umsätze von Bayer... diese sollten mittelfristig den US-Umsätzen entsprechen
- ZALTRAP liegt im zweiten Quartal nach der Zulassung bei 23 Mio USD
- breite Pipeline mit weiteren Blockbustern
http://finance.yahoo.com/news/regeneron-reports-fourth-quart…
Regeneron Reports Fourth Quarter and Full Year 2012 Financial and Operating Results
--Full year 2012 EYLEA® (aflibercept) Injection U.S. net sales of $838 million
--Estimated full year 2013 EYLEA U.S. net sales growth of approximately 50% to $1.2 billion - $1.3 billion
--Full year 2012 non-GAAP net income of $530 million or $4.66 per diluted share
Total revenues included EYLEA U.S. net product sales of $276 million in the fourth quarter and $838 million for the full year 2012.
...
"2012 was truly a transformative year for Regeneron as strong U.S. net sales of EYLEA drove our first full year of profitability on a GAAP and non-GAAP basis," said Leonard S. Schleifer, M.D., Ph.D., President and Chief Executive Officer of Regeneron. "With the recent U.S. approval of EYLEA for the treatment of macular edema following central retinal vein occlusion (CRVO), and receipt of a Medicare J-Code for EYLEA in January 2013, we expect continued strong U.S. growth for EYLEA and forecast U.S. net sales of $1.2 billion to $1.3 billion in 2013. Outside the U.S., our partner Bayer HealthCare has begun to launch EYLEA for the treatment of neovascular age-related macular degeneration (wet AMD) in Japan, Europe, Australia, and other regions, and we expect to see substantial sales growth through 2013 and beyond as pricing approvals are received."
...
EYLEA® (aflibercept) Injection for Intravitreal Injection:
The Company and Bayer HealthCare collaborate on the global development and commercialization of EYLEA outside the United States, and share profits and losses from commercialization of EYLEA outside the United States except for Japan, where the Company receives a royalty on sales. Regeneron maintains exclusive rights to EYLEA in the United States and is entitled to all profits from any such sales.
In November 2012, Bayer HealthCare received regulatory approval for EYLEA in the European Union for the treatment of patients with wet AMD. In November 2012, Bayer HealthCare received pricing approval for EYLEA in Japan for the treatment of patients with wet AMD.
Net sales recorded by Bayer HealthCare for EYLEA outside of the United States were $19 million in the fourth quarter of 2012.
ZALTRAP® (ziv-aflibercept) Injection for Intravenous Infusion:
The Company and Sanofi collaborate on the global development and commercialization of ZALTRAP, and share profits and losses from commercialization of ZALTRAP except for Japan, where the Company receives a royalty on sales. Sales of ZALTRAP in the United States commenced in August 2012, and net sales recorded by Sanofi were $23 million in the fourth quarter and $32 million for the full year of 2012.
Monoclonal Antibodies
Regeneron has eleven fully human monoclonal antibodies based on the Company's VelocImmune® technology in clinical development, including six in collaboration with Sanofi.
ODYSSEY, a large, global Phase 3 program with REGN727, an antibody targeting PCSK9 to reduce LDL cholesterol, was initiated in June 2012 and is currently enrolling patients. The Company expects to report initial results from a Phase 3 ODYSSEY trial in the second half of 2013.
REGN668, an antibody targeting IL-4R, demonstrated positive proof of concept in allergic asthma and atopic dermatitis. Data in atopic dermatitis will be presented at the 71st Annual Meeting of the American Academy of Dermatology in March 2013. Data in allergic asthma will be submitted to medical conferences for presentation later in the year.
- US-Umsätze von über 1,2 Mrd USD in 2013 angepeilt (momentan bei 276 pro Quartal)
- hinzu kommen die ex-US Umsätze von Bayer... diese sollten mittelfristig den US-Umsätzen entsprechen
- ZALTRAP liegt im zweiten Quartal nach der Zulassung bei 23 Mio USD
- breite Pipeline mit weiteren Blockbustern
http://finance.yahoo.com/news/regeneron-reports-fourth-quart…
Regeneron Reports Fourth Quarter and Full Year 2012 Financial and Operating Results
--Full year 2012 EYLEA® (aflibercept) Injection U.S. net sales of $838 million
--Estimated full year 2013 EYLEA U.S. net sales growth of approximately 50% to $1.2 billion - $1.3 billion
--Full year 2012 non-GAAP net income of $530 million or $4.66 per diluted share
Total revenues included EYLEA U.S. net product sales of $276 million in the fourth quarter and $838 million for the full year 2012.
...
"2012 was truly a transformative year for Regeneron as strong U.S. net sales of EYLEA drove our first full year of profitability on a GAAP and non-GAAP basis," said Leonard S. Schleifer, M.D., Ph.D., President and Chief Executive Officer of Regeneron. "With the recent U.S. approval of EYLEA for the treatment of macular edema following central retinal vein occlusion (CRVO), and receipt of a Medicare J-Code for EYLEA in January 2013, we expect continued strong U.S. growth for EYLEA and forecast U.S. net sales of $1.2 billion to $1.3 billion in 2013. Outside the U.S., our partner Bayer HealthCare has begun to launch EYLEA for the treatment of neovascular age-related macular degeneration (wet AMD) in Japan, Europe, Australia, and other regions, and we expect to see substantial sales growth through 2013 and beyond as pricing approvals are received."
...
EYLEA® (aflibercept) Injection for Intravitreal Injection:
The Company and Bayer HealthCare collaborate on the global development and commercialization of EYLEA outside the United States, and share profits and losses from commercialization of EYLEA outside the United States except for Japan, where the Company receives a royalty on sales. Regeneron maintains exclusive rights to EYLEA in the United States and is entitled to all profits from any such sales.
In November 2012, Bayer HealthCare received regulatory approval for EYLEA in the European Union for the treatment of patients with wet AMD. In November 2012, Bayer HealthCare received pricing approval for EYLEA in Japan for the treatment of patients with wet AMD.
Net sales recorded by Bayer HealthCare for EYLEA outside of the United States were $19 million in the fourth quarter of 2012.
ZALTRAP® (ziv-aflibercept) Injection for Intravenous Infusion:
The Company and Sanofi collaborate on the global development and commercialization of ZALTRAP, and share profits and losses from commercialization of ZALTRAP except for Japan, where the Company receives a royalty on sales. Sales of ZALTRAP in the United States commenced in August 2012, and net sales recorded by Sanofi were $23 million in the fourth quarter and $32 million for the full year of 2012.
Monoclonal Antibodies
Regeneron has eleven fully human monoclonal antibodies based on the Company's VelocImmune® technology in clinical development, including six in collaboration with Sanofi.
ODYSSEY, a large, global Phase 3 program with REGN727, an antibody targeting PCSK9 to reduce LDL cholesterol, was initiated in June 2012 and is currently enrolling patients. The Company expects to report initial results from a Phase 3 ODYSSEY trial in the second half of 2013.
REGN668, an antibody targeting IL-4R, demonstrated positive proof of concept in allergic asthma and atopic dermatitis. Data in atopic dermatitis will be presented at the 71st Annual Meeting of the American Academy of Dermatology in March 2013. Data in allergic asthma will be submitted to medical conferences for presentation later in the year.
Antwort auf Beitrag Nr.: 44.149.612 von ipollit am 16.02.13 16:33:03REGN - hab am Freitag zugeschlagen. Die Bewertung ist zwar sehr hoch, aber man kann sagen, dass die auf mittlere Sicht allein durch Eylea zu rechtfertigen ist.
Grüße
PS: "pt accrual will be completed in 12-15 months ( add about 6 months for follow-up, plus a few months for the FDA decision: approval sometime in mid to 2H'15"
... hatte mir eine kürzere Timeline erhofft...
Grüße
PS: "pt accrual will be completed in 12-15 months ( add about 6 months for follow-up, plus a few months for the FDA decision: approval sometime in mid to 2H'15"
... hatte mir eine kürzere Timeline erhofft...
Leider wird Cornerstone Th. (CTRX) von seinem Hauptanteilseigner geschluckt.
http://finance.yahoo.com/news/cornerstone-therapeutics-inc-a…
Werde zum Handelsstart entsprechend meine Anteile veräussern. Schade, denn
bei diesem Trade wäre sicherlich noch mehr drin gewesen. Über den schnellen Gewinn
beschwere ich mich nicht...
Muss mich jetzt nach einem Ersatzinvest umsehen.
http://finance.yahoo.com/news/cornerstone-therapeutics-inc-a…
Werde zum Handelsstart entsprechend meine Anteile veräussern. Schade, denn
bei diesem Trade wäre sicherlich noch mehr drin gewesen. Über den schnellen Gewinn
beschwere ich mich nicht...

Muss mich jetzt nach einem Ersatzinvest umsehen.

Antwort auf Beitrag Nr.: 44.162.919 von Der.Eroberer am 20.02.13 12:32:47Hatte ich auch auf der Watchlist, hat sich damit wohl erledigt. Warum willst du jetzt verkaufen, wenn Chiesi 6.40 bietet?
Antwort auf Beitrag Nr.: 44.162.993 von me_2 am 20.02.13 12:45:41Ich bin in solchen Sachen relativ geradlinig. Spekuliere hier nicht auf eine
Erhöhung des Angebots. Der Wert hat zudem meine erste Kurszielzone erreicht.
Nachbörslich pendelte der Kurs zwischen den avisierten $6,40 und $6,70. Wenn ich
irgendwo in der Mitte lande, dann reicht mir das einfach.
Erhöhung des Angebots. Der Wert hat zudem meine erste Kurszielzone erreicht.
Nachbörslich pendelte der Kurs zwischen den avisierten $6,40 und $6,70. Wenn ich
irgendwo in der Mitte lande, dann reicht mir das einfach.
ein alter bekannter kennt seit letzter Woche wiedermal kein halten mehr.
nämlich pcyc, aber leider bin ich nicht mehr dabei.
auch infinity pharma (infi) bricht extrem stark aus der seitwärtsphase aus. der chartverlauf sieht vielversprechend aus. auch hier ist es für mich wieder ärgerlich verlaufen, da ich meine kauforder auf grund der überkauften gesamtmarktlage löschen musste.
nämlich pcyc, aber leider bin ich nicht mehr dabei.

auch infinity pharma (infi) bricht extrem stark aus der seitwärtsphase aus. der chartverlauf sieht vielversprechend aus. auch hier ist es für mich wieder ärgerlich verlaufen, da ich meine kauforder auf grund der überkauften gesamtmarktlage löschen musste.
INFI habe ich leider auch verpasst... die steigen ja immer weiter. Allerdings gibt es glaube ich für IPI-145 noch keine wirklich belastbaren Ergebnisse oder irre ich mich da? Die Erwartungen basieren wohl eher auf der Theorie, dass PI3K-delta+gamma besser ist, als nur delta... bzw. gamma für Autoimmun-Indikationen besser geeignet sein soll. Genauso können aber in dieser frühen Phase der Entwicklung noch Probleme auftreten... das Risiko ist momentan aus meiner Sicht deutlich größer als z.B. bei PCYC. INFI wird aber in Richtung PCYC gehandelt. Warum hat Takeda/Millennium nicht Ende Dezember die bestehenden Rechte wahrgenommen? Für die Hälfte der Rechte an einem potentiellen Blockbuster ala PCYCs Ibrutinib sind 15 Mio USD nicht gerade viel?: "In exchange for Infinity’s one-time payment of $15 million, Millennium waived its right to opt into a 50-50 U.S. profit and loss-sharing arrangement in the U.S. for any of Infinity’s PI3K inhibitors, including IPI-145. ... For all of Infinity’s PI3K-delta and/or PI3K-gamma inhibitors covered under the agreement, Infinity is obligated to pay Millennium tiered royalties on worldwide net sales ranging from seven percent to 11 percent, which are the same royalty levels as those specified under the original agreement."
Zur Zeit auch gut dabei ist CLDX... die letzte KE ist kaum ins Gewicht gefallen:

Zur Zeit auch gut dabei ist CLDX... die letzte KE ist kaum ins Gewicht gefallen:
Hallo, hat sich jemand von Euch eine Meinung zu Mologen gebildet? Ich habe die Frage vor ein paar Monaten im Biotest-Forum gestellt, weil sich dort ein paar kompetente User aufhalten, aber leider keine Antwort erhalten.
Ich verfüge über keinerlei Fachwissen, aber der Kurs ist seither förmlich davongelaufen (was mich sehr ärgert).
Die Threads zur Aktie sind leider ziemlich zugemüllt, was man ausgraben kann, ist, daß die entscheidenden letzten Studienergebnisse offenbar sehr vielversprechend waren, und das Design der Studie SOLL anspruchsvoll gewesen sein.
Z.B. Deine Meinung, SLGramann, würde mich sehr interessieren, da, Du glaube, ich ein Biotechinvestor mit sehr weitem Horizont bist.
Vielen Dank
Ich verfüge über keinerlei Fachwissen, aber der Kurs ist seither förmlich davongelaufen (was mich sehr ärgert).
Die Threads zur Aktie sind leider ziemlich zugemüllt, was man ausgraben kann, ist, daß die entscheidenden letzten Studienergebnisse offenbar sehr vielversprechend waren, und das Design der Studie SOLL anspruchsvoll gewesen sein.
Z.B. Deine Meinung, SLGramann, würde mich sehr interessieren, da, Du glaube, ich ein Biotechinvestor mit sehr weitem Horizont bist.
Vielen Dank
Antwort auf Beitrag Nr.: 44.169.840 von LeoF am 21.02.13 16:01:39Leo, danke für die Blumen.
Leider habe ich zu Mologen keine Meinung (keine Ahnung).
Hier im Thread ist meiner Meinung nach übrigens ipollit derjenige, der das größte Wissen hat und Informationen am besten analysieren und verknüpfen kann (ohne anderen zu nah treten zu wollen).
Soweit ich weiß, war ihm aber Mologen auch immer herzlich egal.
Gruß
SLG
Leider habe ich zu Mologen keine Meinung (keine Ahnung).
Hier im Thread ist meiner Meinung nach übrigens ipollit derjenige, der das größte Wissen hat und Informationen am besten analysieren und verknüpfen kann (ohne anderen zu nah treten zu wollen).
Soweit ich weiß, war ihm aber Mologen auch immer herzlich egal.

Gruß
SLG
hallo slgramann,
danke.
genau besehen, ist mologen vielleicht auch nicht ganz dein niveau.
danke.
genau besehen, ist mologen vielleicht auch nicht ganz dein niveau.
Antwort auf Beitrag Nr.: 44.169.840 von LeoF am 21.02.13 16:01:39@LeoF
Bei Mologe stehen Entscheidungen an die den Kurs beeinflussen werden. Da wird z.B. Anfang März wieder über die Indexzusammenstellung für den Tecdax entschieden, was beim heutigen Kurs und bei steigenden Umsätzen gar nicht so unwahrscheinlich erscheint. Desweiteren erwarte ich weitere Daten zu den laufenden klinischen Studien, die Bekanntgabe von neuen klinischen Studien und nicht zuletzt die finale Meldung über die Auslizenzierung von MGN1703.
Empfehle dir den Faktenthread zu Mologen, dort findest du das wichtigste zu Mologen
http://www.wallstreet-online.de/diskussion/1131513-neustebei…
Bei Mologe stehen Entscheidungen an die den Kurs beeinflussen werden. Da wird z.B. Anfang März wieder über die Indexzusammenstellung für den Tecdax entschieden, was beim heutigen Kurs und bei steigenden Umsätzen gar nicht so unwahrscheinlich erscheint. Desweiteren erwarte ich weitere Daten zu den laufenden klinischen Studien, die Bekanntgabe von neuen klinischen Studien und nicht zuletzt die finale Meldung über die Auslizenzierung von MGN1703.
Empfehle dir den Faktenthread zu Mologen, dort findest du das wichtigste zu Mologen
http://www.wallstreet-online.de/diskussion/1131513-neustebei…
Das gibt morgen ein mittelschweres Blutbad bei AFFY! 
http://finance.yahoo.com/news/affymax-takeda-announce-nation…
Damit sind wohl die gesamten Jahresgewinne 2013 wieder weg. In diesen Situationen verfluche
ich diese Biotechs, aber Mund abputzen und weiter geht's...

http://finance.yahoo.com/news/affymax-takeda-announce-nation…
Damit sind wohl die gesamten Jahresgewinne 2013 wieder weg. In diesen Situationen verfluche
ich diese Biotechs, aber Mund abputzen und weiter geht's...
Hat jemand der hier versammelten Experten eine Meinung zu Targacept?
AFFY hab ich mir vor kurzem angeschaut und fand ich für mich persönlich uninteressant.
AFFY hab ich mir vor kurzem angeschaut und fand ich für mich persönlich uninteressant.
TRGT... versprichst du dir etwas von denen? Ich habe sie letztes Jahr verkauft, nachdem ich eine kleine Position aufgrund von TC-5214 hatte. Generell habe ich mit CNS bisher nie Glück gehabt, so dass ich diesen Bereich nun eher meide.
Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.123.269 von SLGramann am 09.02.13 21:49:55ONXX...
erfreulich, dass PD-332991 ONXX doch nicht ganz unrelevante 8% Royalties bringen wird:
"For PD-991, or palbociclib, a compound discovered through a research collaboration between Onyx and Pfizer, we are excited by Pfizer's plans for a Phase III trial. As you may recall, the Phase II data for this compound showed encouraging results for patients with ER positive, HER2-negative advanced breast cancer...
We have earned $3 million in milestones to date under our partnership with Pfizer for palbociclib, including $1.5 million in milestones in 2012. Onyx is eligible to receive up to an additional $11.5 million in milestone payments and an 8% royalty on potential future global net sales."
die Ergebnisse sollen bisher sehr gut aussehen...
http://www.bloomberg.com/news/2012-12-05/pfizer-experimental…
Patients were given the medicine, called PD 0332991, along with Novartis (NOVN) AG’s Femara. The findings, reported today at the San Antonio Breast Cancer Symposium, showed no tumor progression for a median of 26.1 months, compared with 7.5 months in those who received Femara alone.
...
The medicine is the first in a new class of agents that works by blocking a protein critical in the cancer cell cycle, said lead researcher Richard Finn. It’s also among the most promising in New York-based Pfizer’s drug development pipeline, with the potential for generating $5 billion in annual sales for breast and other tumor types, Andrew Baum, an analyst at Citigroup Inc. in London, wrote in a note to investors.
“This magnitude of benefit is probably one of the largest with any new agent in breast cancer, or perhaps any solid tumor,” Finn, an associate professor of medicine at the Jonsson Comprehensive Cancer Center at the University of California, Los Angeles, said in a telephone interview. “It’s dramatic to see this level of benefit with a new agent.”
...
The findings are noteworthy because of the size of the benefit and comparative safety of the experimental treatment...
...
Investors have overlooked the drug’s “mega-blockbuster potential,” said Baum, the Citigroup analyst. Pfizer is at least two years ahead of its closest competitors, Eli Lilly & Co. (LLY) and Novartis, with similar cancer drugs in development, he said in his Nov. 29 investment note.
...
“The magnitude of this benefit I don’t think should be underestimated,” Finn said. “These are patients who have incurable breast cancer. A lot of drugs in oncology have been approved or are getting a lot of traction because of improvements that last weeks to a few months. We have gone from 7 months to 26 months. That’s groundbreaking.”
***
Dieses Jahr müssten auch Ergebnisse einer HER- Brustkrebs-Studie mit Nexavar
kommen. Ursprünglich hat man hierfür auch mögliche Peak Sales von über 1 Mrd USD gesehen. Jedenfalls hat damals der Kurs sehr positiv auf die PII Ergebnisse reagiert.
Gruß
ipollit
erfreulich, dass PD-332991 ONXX doch nicht ganz unrelevante 8% Royalties bringen wird:
"For PD-991, or palbociclib, a compound discovered through a research collaboration between Onyx and Pfizer, we are excited by Pfizer's plans for a Phase III trial. As you may recall, the Phase II data for this compound showed encouraging results for patients with ER positive, HER2-negative advanced breast cancer...
We have earned $3 million in milestones to date under our partnership with Pfizer for palbociclib, including $1.5 million in milestones in 2012. Onyx is eligible to receive up to an additional $11.5 million in milestone payments and an 8% royalty on potential future global net sales."
die Ergebnisse sollen bisher sehr gut aussehen...
http://www.bloomberg.com/news/2012-12-05/pfizer-experimental…
Patients were given the medicine, called PD 0332991, along with Novartis (NOVN) AG’s Femara. The findings, reported today at the San Antonio Breast Cancer Symposium, showed no tumor progression for a median of 26.1 months, compared with 7.5 months in those who received Femara alone.
...
The medicine is the first in a new class of agents that works by blocking a protein critical in the cancer cell cycle, said lead researcher Richard Finn. It’s also among the most promising in New York-based Pfizer’s drug development pipeline, with the potential for generating $5 billion in annual sales for breast and other tumor types, Andrew Baum, an analyst at Citigroup Inc. in London, wrote in a note to investors.
“This magnitude of benefit is probably one of the largest with any new agent in breast cancer, or perhaps any solid tumor,” Finn, an associate professor of medicine at the Jonsson Comprehensive Cancer Center at the University of California, Los Angeles, said in a telephone interview. “It’s dramatic to see this level of benefit with a new agent.”
...
The findings are noteworthy because of the size of the benefit and comparative safety of the experimental treatment...
...
Investors have overlooked the drug’s “mega-blockbuster potential,” said Baum, the Citigroup analyst. Pfizer is at least two years ahead of its closest competitors, Eli Lilly & Co. (LLY) and Novartis, with similar cancer drugs in development, he said in his Nov. 29 investment note.
...
“The magnitude of this benefit I don’t think should be underestimated,” Finn said. “These are patients who have incurable breast cancer. A lot of drugs in oncology have been approved or are getting a lot of traction because of improvements that last weeks to a few months. We have gone from 7 months to 26 months. That’s groundbreaking.”
***
Dieses Jahr müssten auch Ergebnisse einer HER- Brustkrebs-Studie mit Nexavar
kommen. Ursprünglich hat man hierfür auch mögliche Peak Sales von über 1 Mrd USD gesehen. Jedenfalls hat damals der Kurs sehr positiv auf die PII Ergebnisse reagiert.
Gruß
ipollit
Zitat von me_2: Hat jemand der hier versammelten Experten eine Meinung zu Targacept?
AFFY hab ich mir vor kurzem angeschaut und fand ich für mich persönlich uninteressant.
Habe TRGT letztes Jahr mehrmals getradet, allerdings mache ich derzeit einen großen
Bogen um den Wert nachdem diverse Hoffnungsträger floppten.
Update:
Habe letzten Freitag Cyclacel (CYCC) ins Depot aufnommen, nachdem ich Cornerstone gegeben hatte. Hier winken P III - Nachrichten zu sapacitabine. Ausserdem könnte der Beginn eines Rechtsstreits mit Celgene die Aktie in den nächsten Monaten beflügeln.
AFFY steht heute nach dem Drama um OMONTYS zum Verkauf. Sehr unschöne Geschichte.
Habe letzten Freitag Cyclacel (CYCC) ins Depot aufnommen, nachdem ich Cornerstone gegeben hatte. Hier winken P III - Nachrichten zu sapacitabine. Ausserdem könnte der Beginn eines Rechtsstreits mit Celgene die Aktie in den nächsten Monaten beflügeln.
AFFY steht heute nach dem Drama um OMONTYS zum Verkauf. Sehr unschöne Geschichte.
Antwort auf Beitrag Nr.: 44.180.583 von ipollit am 25.02.13 00:33:11Hallo ipollit,
war auch erfreut, dass das im CC so klar bestätigt worden ist. Hammer war in seinem Artikel ja noch von 7,5% ausgegangen und die Quellenlage war ein wenig dünn.
Sehr wahrscheinlich hat Pfizer hier einen Mega-Blockbuster in der Pipeline und 8% von bspw. 3 Milliarden (um mal eine Zahl zu nennen) sind schon eine Hausnummer! Zumal das reiner Vorsteuergewinn wäre. Regorafenib kommt auch noch hinzu.
Es ist nicht außer der Welt, für diese beiden Produkte zusammen langfristig Royaltie-Einnahmen für Onyx von um die 500 Millionen Dollar pro Jahr für möglich zu halten.
Wie bewertet man diese Art von Umsatz? Meiner Meinung nach mindestens mit Faktor 10 (da reiner Vorsteuergewinn).
Allein daraus kann sich längerfristig die gesamte heutige Marktkapitalisierung des Unternehmens rechtfertigen lassen.
Bis dahin wird Kyprolis aber wahrscheinlich alleine 10 Mrd Dollar wert sein.
Ich verstehe sehr gut, dass Hammer hier zugeschlagen hat und bin froh, dass ich es nachgeäfft habe. Natürlich ist der Kurs zunächst mal massiv gefallen, aber das ist ein gutes Zeichen, denn das passiert zuverlässig bei allen meinen Investitionen - und manche haben sich dann längerfristig doch recht positiv entwickelt.
Auch die Gedankenspiele um eine Übernahme von Onyx sind gut nachvollziehbar. Bayer ist dazu wahrscheinlich zu bräsig, aber es gäbe genug andere sinnvolle Kandidaten. Celgene liegt auf der Hand. J&J oder Takeda fast noch mehr. Mich würde aber auch nicht wundern, wenn BMY oder - mag etwas abseitig klingen - Gilead zuschlagen würden.
Gruß
SLG
war auch erfreut, dass das im CC so klar bestätigt worden ist. Hammer war in seinem Artikel ja noch von 7,5% ausgegangen und die Quellenlage war ein wenig dünn.
Sehr wahrscheinlich hat Pfizer hier einen Mega-Blockbuster in der Pipeline und 8% von bspw. 3 Milliarden (um mal eine Zahl zu nennen) sind schon eine Hausnummer! Zumal das reiner Vorsteuergewinn wäre. Regorafenib kommt auch noch hinzu.
Es ist nicht außer der Welt, für diese beiden Produkte zusammen langfristig Royaltie-Einnahmen für Onyx von um die 500 Millionen Dollar pro Jahr für möglich zu halten.
Wie bewertet man diese Art von Umsatz? Meiner Meinung nach mindestens mit Faktor 10 (da reiner Vorsteuergewinn).
Allein daraus kann sich längerfristig die gesamte heutige Marktkapitalisierung des Unternehmens rechtfertigen lassen.
Bis dahin wird Kyprolis aber wahrscheinlich alleine 10 Mrd Dollar wert sein.
Ich verstehe sehr gut, dass Hammer hier zugeschlagen hat und bin froh, dass ich es nachgeäfft habe. Natürlich ist der Kurs zunächst mal massiv gefallen, aber das ist ein gutes Zeichen, denn das passiert zuverlässig bei allen meinen Investitionen - und manche haben sich dann längerfristig doch recht positiv entwickelt.
Auch die Gedankenspiele um eine Übernahme von Onyx sind gut nachvollziehbar. Bayer ist dazu wahrscheinlich zu bräsig, aber es gäbe genug andere sinnvolle Kandidaten. Celgene liegt auf der Hand. J&J oder Takeda fast noch mehr. Mich würde aber auch nicht wundern, wenn BMY oder - mag etwas abseitig klingen - Gilead zuschlagen würden.
Gruß
SLG
Genmab...
endlich hat man den Verkauf der überflüssigen Produktionsstätte vollziehen können. Rückblickend war diese Geschichte nichts weiter als sinnloses Geldverbrennen... Februar 2008 Kauf für 240 Mio USD... Februar 2013 Verkauf für 10 Mio USD - ganz zu schweigen von den unnützen laufenden Kosten. Da hätten die das Geld auch ein wenig besser anlegen können.
endlich hat man den Verkauf der überflüssigen Produktionsstätte vollziehen können. Rückblickend war diese Geschichte nichts weiter als sinnloses Geldverbrennen... Februar 2008 Kauf für 240 Mio USD... Februar 2013 Verkauf für 10 Mio USD - ganz zu schweigen von den unnützen laufenden Kosten. Da hätten die das Geld auch ein wenig besser anlegen können.

Antwort auf Beitrag Nr.: 44.182.079 von SLGramann am 25.02.13 13:12:28INCY...
neuer Blogeintrag von Ohad Hammer: "Incyte’s Jakafi is likely a $1B drug" http://www.orf-blog.com/incytes-jakafi-is-likely-a-1b-drug/
Jakafi soll in 2016 1 Mrd USD Umsatz pro Jahr bringen... allerdings nur ein Teil (600 Mio USD) davon in den USA, wo INCY die alleinigen Rechte hält. Wenn ich es richtig verstehe, setzt das zudem eine Zulassung für PV voraus. Er sieht die Entwicklungskosten leicht fallend und kommt somit auf geschätzte 300 Mio USD Gewinn in 2016. Ob die Kosten aber nicht weiter anziehen? Zudem... Gilead will CYT387 in der PIII direkt gegen Jakafi testen. Hoffe, dass INCY mit der Einschätzung richtig liegt, dass der positive Anemia-Effekt nur auf einer schwächeren Wirkung basiert.
Ich sehe INCY mehr als führendes JAK-Unternehmen und JAK mit Potential in weiteren Indikationen. Neben RA z.B. die PII in Diabetic Nephropathy oder die Entwicklung gegen Bauchspeicheldrüsenkrebs. Z.B. in der letzten CC:
http://www.siliconinvestor.com/readmsg.aspx?msgid=28729923
"So the rationale for the antitumor effect in pancreatic cancer relates to the basic mechanism whereby, which STAT3 phosphorylation for example is reduced because if you inhibit signaling through JAK it's going to reduce STAT3 phosphorylation. And there are good animal models in pancreatic cancer showing that that is a key mechanism. Now most pancreatic cancers have other imitations, but somehow in ways that have not yet been defined, these work in synergy such that by inhibiting STAT3 phosphorylation you get an antitumor effect and that's has been demonstrated both in cell culture as well as in xenograft models.
Now the other aspect that we're talking about is whether this will prolong survival as a result of improvement in the metabolic status so called treatment of cancer for cachexia. We think both mechanisms may be applied here, if we can increase survival in a solid tumor like pancreatic cancer, I don't think it's critical why that happens as long as you're increasing survival and pancreatic cancer is kind of our model solid tumor disease here, but this seemed like it can be applied to a number of other solid tumors including potentially breast cancer, non-small cell lung cancer, and potentially others as well."
Gruß
ipollit
neuer Blogeintrag von Ohad Hammer: "Incyte’s Jakafi is likely a $1B drug" http://www.orf-blog.com/incytes-jakafi-is-likely-a-1b-drug/
Jakafi soll in 2016 1 Mrd USD Umsatz pro Jahr bringen... allerdings nur ein Teil (600 Mio USD) davon in den USA, wo INCY die alleinigen Rechte hält. Wenn ich es richtig verstehe, setzt das zudem eine Zulassung für PV voraus. Er sieht die Entwicklungskosten leicht fallend und kommt somit auf geschätzte 300 Mio USD Gewinn in 2016. Ob die Kosten aber nicht weiter anziehen? Zudem... Gilead will CYT387 in der PIII direkt gegen Jakafi testen. Hoffe, dass INCY mit der Einschätzung richtig liegt, dass der positive Anemia-Effekt nur auf einer schwächeren Wirkung basiert.
Ich sehe INCY mehr als führendes JAK-Unternehmen und JAK mit Potential in weiteren Indikationen. Neben RA z.B. die PII in Diabetic Nephropathy oder die Entwicklung gegen Bauchspeicheldrüsenkrebs. Z.B. in der letzten CC:
http://www.siliconinvestor.com/readmsg.aspx?msgid=28729923
"So the rationale for the antitumor effect in pancreatic cancer relates to the basic mechanism whereby, which STAT3 phosphorylation for example is reduced because if you inhibit signaling through JAK it's going to reduce STAT3 phosphorylation. And there are good animal models in pancreatic cancer showing that that is a key mechanism. Now most pancreatic cancers have other imitations, but somehow in ways that have not yet been defined, these work in synergy such that by inhibiting STAT3 phosphorylation you get an antitumor effect and that's has been demonstrated both in cell culture as well as in xenograft models.
Now the other aspect that we're talking about is whether this will prolong survival as a result of improvement in the metabolic status so called treatment of cancer for cachexia. We think both mechanisms may be applied here, if we can increase survival in a solid tumor like pancreatic cancer, I don't think it's critical why that happens as long as you're increasing survival and pancreatic cancer is kind of our model solid tumor disease here, but this seemed like it can be applied to a number of other solid tumors including potentially breast cancer, non-small cell lung cancer, and potentially others as well."
Gruß
ipollit
AVEO...
etwas zu Tivozanib und Biomarker:
- "ASCO GU update on tivozanib in advanced clear cell renal cancer"
... http://pharmastrategyblog.com/2013/02/asco-gu-update-on-tivo…
- "Will biomarkers revolutionalise treatment with tivozanib?"
... http://pharmastrategyblog.com/2013/02/will-biomarkers-revolu…
etwas zu Tivozanib und Biomarker:
- "ASCO GU update on tivozanib in advanced clear cell renal cancer"
... http://pharmastrategyblog.com/2013/02/asco-gu-update-on-tivo…
- "Will biomarkers revolutionalise treatment with tivozanib?"
... http://pharmastrategyblog.com/2013/02/will-biomarkers-revolu…
CBST...
http://finance.yahoo.com/news/fda-grants-qidp-fast-track-210…
FDA Grants QIDP and Fast Track Designations for Cubist’s Late-Stage Antibiotic Candidates
* QIDP granted for ceftolozane/tazobactam in HABP/VABP and cUTI
* Fast track status provided for ceftolozane/tazobactam (CXA-201) in cIAI
* Fast track status provided for surotomycin (CB-315) in CDAD
...
The QIDP designation for ceftolozane/tazobactam will enable Cubist to benefit from certain incentives for the development of new antibiotics, including priority review, eligibility for Fast Track status, and if ceftolozane/tazobactam is ultimately approved by the FDA, a five year extension of Hatch-Waxman exclusivity. These incentives are provided under the Generating Antibiotic Incentives Now Act (GAIN Act), which received strong bipartisan support in Congress and was signed into law by President Obama in July 2012 as part of the FDA Safety and Innovation Act (FDASIA), the fifth authorization of the Prescription Drug User Fee Act.
...

Vor ein paar Tagen haben sie zudem die Option erworben Adnyxx zu kaufen, sollte deren Schmerzmedikament in der PII erfolgreich sein... ist allerdings erstmal recht unbedeutend:
http://www.bizjournals.com/boston/blog/bioflash/2013/02/cubi…
The Lexington, Mass.-based biotech company said it would acquire Adnyxx, which is studying its lead product AYX1 as a possible treatment to reduce chronic pain post surgery. Financial details were not disclosed, but Cubist said it will pay Adynxx to secure the option right and will fund it with cash on hand. As of Dec. 31, 2012, Cubist had $979.4 million in cash on hand.
http://finance.yahoo.com/news/fda-grants-qidp-fast-track-210…
FDA Grants QIDP and Fast Track Designations for Cubist’s Late-Stage Antibiotic Candidates
* QIDP granted for ceftolozane/tazobactam in HABP/VABP and cUTI
* Fast track status provided for ceftolozane/tazobactam (CXA-201) in cIAI
* Fast track status provided for surotomycin (CB-315) in CDAD
...
The QIDP designation for ceftolozane/tazobactam will enable Cubist to benefit from certain incentives for the development of new antibiotics, including priority review, eligibility for Fast Track status, and if ceftolozane/tazobactam is ultimately approved by the FDA, a five year extension of Hatch-Waxman exclusivity. These incentives are provided under the Generating Antibiotic Incentives Now Act (GAIN Act), which received strong bipartisan support in Congress and was signed into law by President Obama in July 2012 as part of the FDA Safety and Innovation Act (FDASIA), the fifth authorization of the Prescription Drug User Fee Act.
...
Vor ein paar Tagen haben sie zudem die Option erworben Adnyxx zu kaufen, sollte deren Schmerzmedikament in der PII erfolgreich sein... ist allerdings erstmal recht unbedeutend:
http://www.bizjournals.com/boston/blog/bioflash/2013/02/cubi…
The Lexington, Mass.-based biotech company said it would acquire Adnyxx, which is studying its lead product AYX1 as a possible treatment to reduce chronic pain post surgery. Financial details were not disclosed, but Cubist said it will pay Adynxx to secure the option right and will fund it with cash on hand. As of Dec. 31, 2012, Cubist had $979.4 million in cash on hand.
überlege, vielleicht eine kleine spekulative Position in XOMA zu kaufen... bei der aktuellen MK von etwas mehr als 200 Mio USD. XOMA wurde in der letzten Zeit von verschiedenen Leuten in Foren, die ich verfolge, positiv gesehen:
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
XOMA Notes from RBC Capital Markets Global Healthcare Conference
Update on Ph3 Uveitis Trials
Eyeguard A (in active setting) data is expected at YE.
Eyeguard B (in behcets) data is expected mid-14.
Eyeguard C (maintenance setting) data is expected Q1 14.
Servier is reponsible for the first $50M in trial costs after which expenses are split 50/50. Based on discussions with the FDA, the company feels an NDA can be filed with results from any two of the three Ph3 trials. XOMA maintains rights in the US and Japan and fully intends to commercialize Gevokizumab in US. The 150,000 US pts are treated by approximately 170 specialists which lends itself to a very targeted salesforce. While the company did not discuss its pricing/commercialization plans, they intend to price Gevokizumab as a "biologic" (which I assume to mean $$$) and feel that uveitis could be a very large market for Gevokizumab .
The CEO touched on Servier's 21 patient follow-on trial that preceded the Eyeguard B Ph3 trial. While the data has not been published, the results from this trial precipitated Servier's decision to move quickly to Ph3.
As far as the Ph2 PoC trials go, the company was "encouraged" by the recently announced results (#msg-83122761) from the Ph2 acne vulgaris trial however feel that a higher dose/frequency will be needed in this indication. The company is currently assessing the commercial path forward.
Ph2 data from the Erosive Osteoarthritis of the Hand trial is anticipated mid-2013. This is a large (4 million) market with few treatments options. The company hopes that the PoC data will demontrate that this indication is driven by IL-1B (#msg-83091229) and, if so, feel it could represent the second significant opportunity for Gevokizumab.
In December, the company announced, in partnership with the National Eye Institute, a third (#msg-83091342) Ph2 PoC trial. The trial is in non-infectious anterior scleritis and data is expected by year end.
One interesting development is that the company is currently pursuing several ultra-orphan indications which, if successful, could potentially bring Gevokizumab to market even earlier than the 2015 time-frame in Uveitis.
Once again the company confirmed its desire to advance the XMET A and S program to the point where it can be partnered. The company re-iterated its interest in developing XMET D (the insulin receptor antagonist) on its own.
The company did not provide an update on the partnering status of the Servier licensed ACE inhibitor.
****
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
XOMA - Credit Suisse Investment Thesis - November 2012
In the past 12 months, Xoma has made several positive strategic changes that have
positioned it well with upcoming data flow, higher probability of clinical/regulatory success,
multiple shots on goal, cost cutting and refocusing, commercial infrastructure, and an
improved capital structure.
Our investment thesis is based on expectation of positive clinical data in its lead uveitis
Phase III trials in 2013-14 and multiple opportunities for positive incremental data flow
from three proof-of-concept Phase II trials. The primary risks are clinical trial failure,
competition, and potential future dilution.
-Phase III Ongoing: Xoma’s primary value driver is gevokizumab, its IL-1ß antibody, in
Phase III development for a form of sight-threatening eye inflammation called
noninfectious uveitis. Phase II results are positive and the ongoing Phase III program
is broad, global, well designed, and partially funded by its ex-U.S. partner Servier. We
assign a high probability of success in this indication, valued at $4 per share if
successful.
-Multiple Shots on Goal with Gevokizumab: Three Phase II trials are ongoing or
planned. Each trial will provide a definitive readout versus placebo in a new indication.
These proof of concept trials will generate data in Q412 for acne vulgaris, mid-2013 for
osteoarthritis of the hand, and a third also in mid-2013. We currently assign a low 5%
probability of success to the first two indications, providing significant upside if data
are positive. Of the two disclosed indications, we have greater confidence in the
osteoarthritis indication, and see this as a substantial new market opportunity.
-Aceon Program Is an Underappreciated Asset: Xoma licensed U.S. commercial
rights to Servier’s proprietary ACE inhibitor called Aceon. Xoma recently reported that
it met the primary endpoint in its 816 patient Phase III trial of a fixed dose combination
of Aceon and a generic calcium channel blocker. While we do not see Xoma launching
this product, we believe it is substantially derisked and could generate a licensing deal
in 2013.
-Ultra-Orphan Opportunities: Xoma has identified several ultra-orphan indications for
gevokizumab and for its earlier stage candidate xMetD. The indications that have been
disclosed are readily addressable by small, relatively low cost trials, which should
provide definitive efficacy and a potentially rapid path to approval. This new strategy is
not fully understood by the Street.
Significant Clinical Newsflow in 2012-13
Timing Expected News Flow Program
Q4:12 Initiate 3rd POC Phase II trial Gevokizumab
Q4:12 Servier to initiate Phase II trial (CV disease) Gevokizumab
Q1:13 Phase 2 POC readout for moderate/severe acne vulgaris Gevokizumab
H1:13 Partnership for ACEON
Mid-2013 Phase 2 POC data readout for erosive osteoarthritis Gevokizumab
Mid-2013 Data read-out from 3rd POC Phase II study Gevokizumab
Q4:13 Results from EYEGUARD A (Active NIU trial) Gevokizumab
Q1:14 Results from EYEGUARD B (Behcet's trial) Gevokizumab
Mid-2014 Results from EYEGUARD C (Controlled NIU trial) Gevokizumab
**********
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…

http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
XOMA Notes from RBC Capital Markets Global Healthcare Conference
Update on Ph3 Uveitis Trials
Eyeguard A (in active setting) data is expected at YE.
Eyeguard B (in behcets) data is expected mid-14.
Eyeguard C (maintenance setting) data is expected Q1 14.
Servier is reponsible for the first $50M in trial costs after which expenses are split 50/50. Based on discussions with the FDA, the company feels an NDA can be filed with results from any two of the three Ph3 trials. XOMA maintains rights in the US and Japan and fully intends to commercialize Gevokizumab in US. The 150,000 US pts are treated by approximately 170 specialists which lends itself to a very targeted salesforce. While the company did not discuss its pricing/commercialization plans, they intend to price Gevokizumab as a "biologic" (which I assume to mean $$$) and feel that uveitis could be a very large market for Gevokizumab .
The CEO touched on Servier's 21 patient follow-on trial that preceded the Eyeguard B Ph3 trial. While the data has not been published, the results from this trial precipitated Servier's decision to move quickly to Ph3.
As far as the Ph2 PoC trials go, the company was "encouraged" by the recently announced results (#msg-83122761) from the Ph2 acne vulgaris trial however feel that a higher dose/frequency will be needed in this indication. The company is currently assessing the commercial path forward.
Ph2 data from the Erosive Osteoarthritis of the Hand trial is anticipated mid-2013. This is a large (4 million) market with few treatments options. The company hopes that the PoC data will demontrate that this indication is driven by IL-1B (#msg-83091229) and, if so, feel it could represent the second significant opportunity for Gevokizumab.
In December, the company announced, in partnership with the National Eye Institute, a third (#msg-83091342) Ph2 PoC trial. The trial is in non-infectious anterior scleritis and data is expected by year end.
One interesting development is that the company is currently pursuing several ultra-orphan indications which, if successful, could potentially bring Gevokizumab to market even earlier than the 2015 time-frame in Uveitis.
Once again the company confirmed its desire to advance the XMET A and S program to the point where it can be partnered. The company re-iterated its interest in developing XMET D (the insulin receptor antagonist) on its own.
The company did not provide an update on the partnering status of the Servier licensed ACE inhibitor.
****
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
XOMA - Credit Suisse Investment Thesis - November 2012
In the past 12 months, Xoma has made several positive strategic changes that have
positioned it well with upcoming data flow, higher probability of clinical/regulatory success,
multiple shots on goal, cost cutting and refocusing, commercial infrastructure, and an
improved capital structure.
Our investment thesis is based on expectation of positive clinical data in its lead uveitis
Phase III trials in 2013-14 and multiple opportunities for positive incremental data flow
from three proof-of-concept Phase II trials. The primary risks are clinical trial failure,
competition, and potential future dilution.
-Phase III Ongoing: Xoma’s primary value driver is gevokizumab, its IL-1ß antibody, in
Phase III development for a form of sight-threatening eye inflammation called
noninfectious uveitis. Phase II results are positive and the ongoing Phase III program
is broad, global, well designed, and partially funded by its ex-U.S. partner Servier. We
assign a high probability of success in this indication, valued at $4 per share if
successful.
-Multiple Shots on Goal with Gevokizumab: Three Phase II trials are ongoing or
planned. Each trial will provide a definitive readout versus placebo in a new indication.
These proof of concept trials will generate data in Q412 for acne vulgaris, mid-2013 for
osteoarthritis of the hand, and a third also in mid-2013. We currently assign a low 5%
probability of success to the first two indications, providing significant upside if data
are positive. Of the two disclosed indications, we have greater confidence in the
osteoarthritis indication, and see this as a substantial new market opportunity.
-Aceon Program Is an Underappreciated Asset: Xoma licensed U.S. commercial
rights to Servier’s proprietary ACE inhibitor called Aceon. Xoma recently reported that
it met the primary endpoint in its 816 patient Phase III trial of a fixed dose combination
of Aceon and a generic calcium channel blocker. While we do not see Xoma launching
this product, we believe it is substantially derisked and could generate a licensing deal
in 2013.
-Ultra-Orphan Opportunities: Xoma has identified several ultra-orphan indications for
gevokizumab and for its earlier stage candidate xMetD. The indications that have been
disclosed are readily addressable by small, relatively low cost trials, which should
provide definitive efficacy and a potentially rapid path to approval. This new strategy is
not fully understood by the Street.
Significant Clinical Newsflow in 2012-13
Timing Expected News Flow Program
Q4:12 Initiate 3rd POC Phase II trial Gevokizumab
Q4:12 Servier to initiate Phase II trial (CV disease) Gevokizumab
Q1:13 Phase 2 POC readout for moderate/severe acne vulgaris Gevokizumab
H1:13 Partnership for ACEON
Mid-2013 Phase 2 POC data readout for erosive osteoarthritis Gevokizumab
Mid-2013 Data read-out from 3rd POC Phase II study Gevokizumab
Q4:13 Results from EYEGUARD A (Active NIU trial) Gevokizumab
Q1:14 Results from EYEGUARD B (Behcet's trial) Gevokizumab
Mid-2014 Results from EYEGUARD C (Controlled NIU trial) Gevokizumab
**********
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
interessant vielleicht auch LXRX... auch recht spekulativ bei einer hohen MK von 1 Mrd USD
http://www.thestreet.com/story/11737824/1/lexicon-pharma-blo…
Lexicon Pharma: Blockbuster Potential From A Diabetes Drug
NEW YORK (TheStreet) -- Two of my closest friends, including my college roommate, were diagnosed with diabetes recently. I was taken aback when they told me because both my friends are fit and not even close to being overweight. This got me thinking that diabetes is not just a problem for the obese but it's probably the largest health concern facing our country.
Biotech investors who want to take advantage of this unfortunate demographic trend should take a look at Lexicon Pharmaceuticals (LXRX_).
Lexicon's LX4211 is a once-daily pill belonging to a novel class of diabetes drugs known as sodium-dependent glucose transporter (SGLT) inhibitors that work by blocking the reabsorption of glucose into the bloodstream. Instead, patients on SGLT inhibitors excrete glucose in their urine.
LX4211 inhibits SGLT-1, which is the primary transporter of glucose from the gastrointestinal tract and SGLT-2, the mechanism by which glucose is transported from kidneys back into the bloodstream.
As a "dual" SGLT inhibitor, LX4211 stands apart from Bristol-Myers Squibb (BMY_) and AstraZeneca's (AZN_) dapaglifozin and Johnson & Johnson's (JNJ_) canaglifozin, both of which inhibit SGLT-2 only. In January, FDA rejected dapaglifozin and asked for more clinical date to assuage concerns about higher rates of bladder and breast cancer reported in the treatment arms of phase III studies. J&J submitted canaglifozin to FDA in June.
By stopping glucose reabsorption in the gut, LX4211 could have more of a beneficial effect after a meal and may also help release beneficial peptides such as GLP-1 that help glucose secretion.
LX4211 also has the potential to be safer than the other drugs in the SGLT inhibitor class because blocking glucose reabsorption in the gut first followed by the kidneys may translate into less glucose secreted in urine. [Glucose-rich urine stored in a patients' bladder might be associated with the higher rates of bladder infections and bladder cancer seen with dapaglifozin.]
Lexicon's LX4211 phase IIb trial results have been outstanding. LX4211 at the highest 400 mg dose combined with metformin demonstrated a reduction of 0.86% in hemoglobin a1c (HbA1c), a standard measure of blood-sugar control. This reduction compares favorably with both dapaglifozin (0.67% HbA1c reduction) and canaglifozin (0.7% HbA1c reduction) in their respective phase III trials.
Weight loss reported in the phase IIb trial was approximately 2 kg to 2.5 kg per patient at the two highest LX4211 doses compared to a slight weight gain for placebo. This is similar to what was seen in the SGLT-2 inhibitor drugs. There were also statically significant reductions in both systolic and diastolic blood pressure favoring LX4211.
HbA1c reduction increased steadily as the LX4211 dose increased but the amount of sugar secreted in the urine stayed fairly steady at about half the levels measured in the phase III studies of dapaglifozin and canaglifozin. This is a very interesting finding, which again, underscores why LX4211 could be safer than the other SGLT inhibitors.
There were no drug-associated severe adverse events reported in Lexicon's phase IIb trial. Targeting SGLT-1 has raised concerns about gastrointestinal side effects but nausea was reported in just 10% of LX4211-treated patients.
Lexicon plans to meet with the FDA soon to discuss a phase III program for LX4211. Studies should begin next year. The company has been open about wanting to find a partner, so I would expect a Big Pharma deal to be signed within the next few months.
Lexicon' pipeline outside of LX4211 includes a drug to treat carcinoid syndrome moving into phase III studies, and drugs to treat ulcerative colitis and irritable bowel syndrome in phase II.
Lexicon shares closed Monday at $2.55 but don't make the mistake of thinking of the company as a small-cap biotech stock. With 500 million shares outstanding, Lexicon's market cap is more than $1.2 billion. Lexicon required a lifeline during the market collapse of 2008-2009 that forced the company to push through a highly dilutive, below-market financing. Fortunately, the investment company that saved Lexicon remains a large shareholder and is not a flipper.
I usually balk at owning stocks with balance sheet weighed down with too many outstanding shares, but Lexicon is very attractive at its current valuation because LX4211 has real potential to be a blockbuster diabetes drug.

http://www.thestreet.com/story/11737824/1/lexicon-pharma-blo…
Lexicon Pharma: Blockbuster Potential From A Diabetes Drug
NEW YORK (TheStreet) -- Two of my closest friends, including my college roommate, were diagnosed with diabetes recently. I was taken aback when they told me because both my friends are fit and not even close to being overweight. This got me thinking that diabetes is not just a problem for the obese but it's probably the largest health concern facing our country.
Biotech investors who want to take advantage of this unfortunate demographic trend should take a look at Lexicon Pharmaceuticals (LXRX_).
Lexicon's LX4211 is a once-daily pill belonging to a novel class of diabetes drugs known as sodium-dependent glucose transporter (SGLT) inhibitors that work by blocking the reabsorption of glucose into the bloodstream. Instead, patients on SGLT inhibitors excrete glucose in their urine.
LX4211 inhibits SGLT-1, which is the primary transporter of glucose from the gastrointestinal tract and SGLT-2, the mechanism by which glucose is transported from kidneys back into the bloodstream.
As a "dual" SGLT inhibitor, LX4211 stands apart from Bristol-Myers Squibb (BMY_) and AstraZeneca's (AZN_) dapaglifozin and Johnson & Johnson's (JNJ_) canaglifozin, both of which inhibit SGLT-2 only. In January, FDA rejected dapaglifozin and asked for more clinical date to assuage concerns about higher rates of bladder and breast cancer reported in the treatment arms of phase III studies. J&J submitted canaglifozin to FDA in June.
By stopping glucose reabsorption in the gut, LX4211 could have more of a beneficial effect after a meal and may also help release beneficial peptides such as GLP-1 that help glucose secretion.
LX4211 also has the potential to be safer than the other drugs in the SGLT inhibitor class because blocking glucose reabsorption in the gut first followed by the kidneys may translate into less glucose secreted in urine. [Glucose-rich urine stored in a patients' bladder might be associated with the higher rates of bladder infections and bladder cancer seen with dapaglifozin.]
Lexicon's LX4211 phase IIb trial results have been outstanding. LX4211 at the highest 400 mg dose combined with metformin demonstrated a reduction of 0.86% in hemoglobin a1c (HbA1c), a standard measure of blood-sugar control. This reduction compares favorably with both dapaglifozin (0.67% HbA1c reduction) and canaglifozin (0.7% HbA1c reduction) in their respective phase III trials.
Weight loss reported in the phase IIb trial was approximately 2 kg to 2.5 kg per patient at the two highest LX4211 doses compared to a slight weight gain for placebo. This is similar to what was seen in the SGLT-2 inhibitor drugs. There were also statically significant reductions in both systolic and diastolic blood pressure favoring LX4211.
HbA1c reduction increased steadily as the LX4211 dose increased but the amount of sugar secreted in the urine stayed fairly steady at about half the levels measured in the phase III studies of dapaglifozin and canaglifozin. This is a very interesting finding, which again, underscores why LX4211 could be safer than the other SGLT inhibitors.
There were no drug-associated severe adverse events reported in Lexicon's phase IIb trial. Targeting SGLT-1 has raised concerns about gastrointestinal side effects but nausea was reported in just 10% of LX4211-treated patients.
Lexicon plans to meet with the FDA soon to discuss a phase III program for LX4211. Studies should begin next year. The company has been open about wanting to find a partner, so I would expect a Big Pharma deal to be signed within the next few months.
Lexicon' pipeline outside of LX4211 includes a drug to treat carcinoid syndrome moving into phase III studies, and drugs to treat ulcerative colitis and irritable bowel syndrome in phase II.
Lexicon shares closed Monday at $2.55 but don't make the mistake of thinking of the company as a small-cap biotech stock. With 500 million shares outstanding, Lexicon's market cap is more than $1.2 billion. Lexicon required a lifeline during the market collapse of 2008-2009 that forced the company to push through a highly dilutive, below-market financing. Fortunately, the investment company that saved Lexicon remains a large shareholder and is not a flipper.
I usually balk at owning stocks with balance sheet weighed down with too many outstanding shares, but Lexicon is very attractive at its current valuation because LX4211 has real potential to be a blockbuster diabetes drug.
Antwort auf Beitrag Nr.: 44.200.868 von ipollit am 01.03.13 00:35:48Das ist wirklich interessant! Die werde ich beobachten. Ich würde allerdings erst kaufen, wenn sie LX4211 verpartnert haben, auch wenn dann der Kurs wahrscheinlich 50% höher steht.
Ich glaube, dass die Risiken in diesem Bereich sehr groß sind (Frage Nebenwirkungen) und die FDA hier ziemlich kompromisslos agiert.
Ich glaube, dass die Risiken in diesem Bereich sehr groß sind (Frage Nebenwirkungen) und die FDA hier ziemlich kompromisslos agiert.
Update:
Nach dem angekündigten Verkauf der abgetauchten AFFY habe ich mir Xenoport (XNPT)
zugelegt. Hier stehen im ersten Halbjahr wichtige Phase III - Ergebnisse an. Zudem
hat man reichlich Cash und wird unter der Hand als kleine Biogen gehandelt.
Ist vielleicht einen Blick wert.
Nach dem angekündigten Verkauf der abgetauchten AFFY habe ich mir Xenoport (XNPT)
zugelegt. Hier stehen im ersten Halbjahr wichtige Phase III - Ergebnisse an. Zudem
hat man reichlich Cash und wird unter der Hand als kleine Biogen gehandelt.
Ist vielleicht einen Blick wert.
Zu HALO:
•Halozyme Therapeutics Management Discusses Q4 2012 Results - Earnings Call Transcript
http://seekingalpha.com/article/1222991-halozyme-therapeutic…
Zu AMRN:
•Amarin Corporation's CEO Discusses Q4 2012 Results - Earnings Call Transcript
http://seekingalpha.com/article/1236761-amarin-corporation-s…
•Halozyme Therapeutics Management Discusses Q4 2012 Results - Earnings Call Transcript
http://seekingalpha.com/article/1222991-halozyme-therapeutic…
Zu AMRN:
•Amarin Corporation's CEO Discusses Q4 2012 Results - Earnings Call Transcript
http://seekingalpha.com/article/1236761-amarin-corporation-s…
Hat sich jemand mal näher mit Vertex VX-809/Kalydeco-Kombi beschäftigt?
Da gab es letztes Jahr einige Irritationen wegen der Interpretation von PII-Daten.
Alles in allem scheinen mir die Daten aber durchaus hoffnungsvoll zu sein.
Die P III hat begonnen und schon in einem Jahr könnte ggf. die Zulassung beantragt werden.
Im Erfolgsfall könnte der mögliche Umsatz ganz exorbitant hoch sein (mehrere Milliarden Dollar innerhalb kürzester Zeit).
Bei 10 Mrd. Marktkap. allerdings ein hohes Risiko. Richtig binär das Ganze...
http://www.fiercebiotech.com/story/vertex-plots-race-through…
Da gab es letztes Jahr einige Irritationen wegen der Interpretation von PII-Daten.
Alles in allem scheinen mir die Daten aber durchaus hoffnungsvoll zu sein.
Die P III hat begonnen und schon in einem Jahr könnte ggf. die Zulassung beantragt werden.
Im Erfolgsfall könnte der mögliche Umsatz ganz exorbitant hoch sein (mehrere Milliarden Dollar innerhalb kürzester Zeit).
Bei 10 Mrd. Marktkap. allerdings ein hohes Risiko. Richtig binär das Ganze...

http://www.fiercebiotech.com/story/vertex-plots-race-through…
Info: Aus Der.Eroberer wird BiotechHype (fand den Namen schon lange blöd)
Antwort auf Beitrag Nr.: 44.202.524 von SLGramann am 01.03.13 12:22:10
Vertex hat für diese Kombi übrigens im Januar den breakthrough-Status bekommen. Es ist klar, dass der medizinische Bedarf extrem dringend ist. Ich denke, dass das zur Zulassung führen sollte, wenn die Ergebnisse der PIII einen medizinischen Nutzen anzeigen, der kleiner ist, als man sich von der Studie allgemein erhofft:
Vertex today announced that the U.S. Food and Drug Administration (FDA) granted the first two Breakthrough Therapy Designations to ivacaftor monotherapy and the combination regimen of VX-809 with ivacaftor for CF.
Vertex hat für diese Kombi übrigens im Januar den breakthrough-Status bekommen. Es ist klar, dass der medizinische Bedarf extrem dringend ist. Ich denke, dass das zur Zulassung führen sollte, wenn die Ergebnisse der PIII einen medizinischen Nutzen anzeigen, der kleiner ist, als man sich von der Studie allgemein erhofft:
Vertex today announced that the U.S. Food and Drug Administration (FDA) granted the first two Breakthrough Therapy Designations to ivacaftor monotherapy and the combination regimen of VX-809 with ivacaftor for CF.
Antwort auf Beitrag Nr.: 44.203.490 von SLGramann am 01.03.13 15:40:01Im Erfolgsfall dürfte der Umsatz nur mit Patienten in den USA mehr als 4 Milliarden Dollar betragen.
ROW sind sicher weitere 2 Milliarden möglich.
Wenn...
ROW sind sicher weitere 2 Milliarden möglich.
Wenn...
Antwort auf Beitrag Nr.: 44.203.490 von SLGramann am 01.03.13 15:40:01Hier ein kleines Video zum Thema:
http://www.fool.com/investing/general/2013/02/27/vertex-ente…
http://www.fool.com/investing/general/2013/02/27/vertex-ente…
Antwort auf Beitrag Nr.: 44.203.532 von SLGramann am 01.03.13 15:46:41Danke für den Hinweis auf Vertex. Die könnten in mein Beuteschema passen. Ich werde mich mal einlesen ...
Antwort auf Beitrag Nr.: 44.204.663 von me_2 am 01.03.13 18:42:15Hier sind zwei interessante Artikel.
Dieser beschäftigt sich mit der grundsätzlichen Problematik von Kalydeco und CF:
http://www.forbes.com/sites/matthewherper/2012/10/11/the-bes…
Und dieser mit den Schwierigkeiten, die es bei der Interpretation von PII-Daten gab (geht ins Detail und ist ziemlich aufschlussreich):
http://www.forbes.com/sites/matthewherper/2012/06/01/clearin…
Dieser beschäftigt sich mit der grundsätzlichen Problematik von Kalydeco und CF:
http://www.forbes.com/sites/matthewherper/2012/10/11/the-bes…
Und dieser mit den Schwierigkeiten, die es bei der Interpretation von PII-Daten gab (geht ins Detail und ist ziemlich aufschlussreich):
http://www.forbes.com/sites/matthewherper/2012/06/01/clearin…
Vertex war ja lange Zeit im wesentlichen eine HCV-Aktie. Wie wird sich das weiter entwickeln? Ganz überzeugt bin ich von Vertex nicht, da sie nach dem anfänglichen großen Erfolg mit Incivek jetzt (soweit ich das verfolgt habe) eher ins Hintertreffen geraten sind. Die Zukunft scheint hier Gilead und Abbott zu gehören. Die Umsätze sinken bereits. Vor 2 Jahren hieß es noch "For Vertex, the approval marks the proverbial game-changer, vaulting the company from a promising biotech with a compelling pipeline to a full-fledged biopharma operation with the responsibility for marketing the mega-blockbuster in the U.S. Analysts have estimated peak sales at up to $5 billion." Im letzten Q3 hieß es dann: "Incivek sales, which analysts have been expecting to decrease, were off almost 25% from the previous quarter, to $254.3 million, a 40% decline year-over-year."
Kalydeco ist ja bereits zugelassen: (Q3)"Analysts have been closely monitoring Vertex’s Kalydeco launch, a treatment for cystic fibrosis patients with the G551D mutation, since its approval in January. Kalydeco sales of $49.2M demonstrate slight growth from the previous quarter, in which sales totaled $45.5M, but the company expects more in the long run. Vertex is pursuing a broader label through multiple ongoing late-stage studies of combination treatments, and the product’s launch across Europe should help drive revenue somewhat. Kalydeco is currently limited by its small indication (rare mutation), and until the company can broaden the potential patient base, growth will be slow; some analysts opine that the product has already reached peak sales domestically. Investors should be paying close attention as further cystic fibrosis trials begin showing results in the next two years. Kalydeco’s market opportunity is large if it can break into a wider patient population."
Werden die 1 Mrd Incivek Umsätze mittelfristig sich wieder der 0 annähern? Das muss von Kalydeco&Co aufgefangen werden und sicher ist das ja noch nicht, oder? Hat nicht z.B. Galapagos ein Kalydeco der nächsten Generation in der Pipeline?
Gruß
ipollit
Kalydeco ist ja bereits zugelassen: (Q3)"Analysts have been closely monitoring Vertex’s Kalydeco launch, a treatment for cystic fibrosis patients with the G551D mutation, since its approval in January. Kalydeco sales of $49.2M demonstrate slight growth from the previous quarter, in which sales totaled $45.5M, but the company expects more in the long run. Vertex is pursuing a broader label through multiple ongoing late-stage studies of combination treatments, and the product’s launch across Europe should help drive revenue somewhat. Kalydeco is currently limited by its small indication (rare mutation), and until the company can broaden the potential patient base, growth will be slow; some analysts opine that the product has already reached peak sales domestically. Investors should be paying close attention as further cystic fibrosis trials begin showing results in the next two years. Kalydeco’s market opportunity is large if it can break into a wider patient population."
Werden die 1 Mrd Incivek Umsätze mittelfristig sich wieder der 0 annähern? Das muss von Kalydeco&Co aufgefangen werden und sicher ist das ja noch nicht, oder? Hat nicht z.B. Galapagos ein Kalydeco der nächsten Generation in der Pipeline?
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.205.202 von SLGramann am 01.03.13 20:31:22ARRY
ein Artikel zu ARRY-520... "ASH 2012 Update on ARRY-520 in Multiple Myeloma"
http://pharmastrategyblog.com/2013/03/ash-2012update-on-arry…
ARRY-520 ist aussichtsreich, aber was den Biomarker AAG betrifft, so sehe ich den nicht so positiv, nachdem ich jetzt ein wenig dazu gelesen habe. Offensichtlich ist das kein Marker, der speziell ARRY-520 betrifft, sondern etwas, was sich generell negativ auf einige Medikamente auswirken kann, einfach indem AAG das Medikament bindet und es so nicht die eigentliche Wirkung entfalten kann. Dies müsste dann einfach einem zu niedrig dosierten Medikament entsprechen. Besser wäre es, wenn ARRY-520 erst garnicht mit AAG reagiert... offensichtlich machen das nicht alle Medikamente. AAG ist keine Mutation oder soetwas, bei der man ansetzt und die sich auch nicht so einfach verändert. Vielmehr wird es z.B. bei Stress gebildet, so dass es im Laufe der Zeit schwanken kann. Ist soetwas wirklich ein guter Marker, um auf ARRY-520 ja oder nein zu entscheiden? Nach meinem Verständnis wäre es besser, wenn man AAG ständig monitort, um abhängig davon ARRY-520 so zu geben, dass immer die richtige Dosis wirksam wird. D.h. hohes AAG gleich hohe Dosis, niedriges AAG gleich niedrige Dosis.
Vielleicht bringt es aber dennoch etwas, wenn man nur einmal AAG bestimmt... ich bin in diesen Dingen absolut kein Experte, vielleicht habe ich das alles auch falsch verstanden.
http://cdn.intechopen.com/pdfs/21455/InTech-Acute_phase_prot…
nichtsdestotrotz war der Kursanstieg gestern recht erfreulich... so darf es weiter gehen! Kommen nicht in den nächsten Monaten Daten zu AMG-151? (Estimated Study Completion Date: April 2013) http://www.biotechnologyevents.com/node/4985
Kommen nicht in den nächsten Monaten Daten zu AMG-151? (Estimated Study Completion Date: April 2013) http://www.biotechnologyevents.com/node/4985

Gruß
ipollit
ein Artikel zu ARRY-520... "ASH 2012 Update on ARRY-520 in Multiple Myeloma"
http://pharmastrategyblog.com/2013/03/ash-2012update-on-arry…
ARRY-520 ist aussichtsreich, aber was den Biomarker AAG betrifft, so sehe ich den nicht so positiv, nachdem ich jetzt ein wenig dazu gelesen habe. Offensichtlich ist das kein Marker, der speziell ARRY-520 betrifft, sondern etwas, was sich generell negativ auf einige Medikamente auswirken kann, einfach indem AAG das Medikament bindet und es so nicht die eigentliche Wirkung entfalten kann. Dies müsste dann einfach einem zu niedrig dosierten Medikament entsprechen. Besser wäre es, wenn ARRY-520 erst garnicht mit AAG reagiert... offensichtlich machen das nicht alle Medikamente. AAG ist keine Mutation oder soetwas, bei der man ansetzt und die sich auch nicht so einfach verändert. Vielmehr wird es z.B. bei Stress gebildet, so dass es im Laufe der Zeit schwanken kann. Ist soetwas wirklich ein guter Marker, um auf ARRY-520 ja oder nein zu entscheiden? Nach meinem Verständnis wäre es besser, wenn man AAG ständig monitort, um abhängig davon ARRY-520 so zu geben, dass immer die richtige Dosis wirksam wird. D.h. hohes AAG gleich hohe Dosis, niedriges AAG gleich niedrige Dosis.
Vielleicht bringt es aber dennoch etwas, wenn man nur einmal AAG bestimmt... ich bin in diesen Dingen absolut kein Experte, vielleicht habe ich das alles auch falsch verstanden.
http://cdn.intechopen.com/pdfs/21455/InTech-Acute_phase_prot…
nichtsdestotrotz war der Kursanstieg gestern recht erfreulich... so darf es weiter gehen!
 Kommen nicht in den nächsten Monaten Daten zu AMG-151? (Estimated Study Completion Date: April 2013) http://www.biotechnologyevents.com/node/4985
Kommen nicht in den nächsten Monaten Daten zu AMG-151? (Estimated Study Completion Date: April 2013) http://www.biotechnologyevents.com/node/4985Gruß
ipollit
der NBI nähert sich immer mehr dem Allzeithoch von vor über 10 Jahren...


Antwort auf Beitrag Nr.: 44.166.533 von ipollit am 20.02.13 22:14:50INFI... am folgendem sieht man, dass die Sachen meistens nicht so einfach sind und man sich nie ganz sicher sein sollte, das etwas auch wirklich funktioniert. Der pi3k-Hemmer IPI-145 wird ähnlich aussichtsreich wie Gilead GS-1101 gesehen. Letzterer wirkt spezifisch nur auf pi3k-delta, während der von INFI neben delta auch auf gamma wirkt, wovon sich INFI eine noch höhrere Wirkung verspricht. Außerdem entwickelt INFI auch gegen Autoimmun-Indikationen... dort könnte delta/gamma sicherer sein als z.B. alpha/beta. Bei Krebs CML, das ein wenig ähnlich wie CLL ist, könnte aber auch pi3k-alpha notwendig sein, auch wenn alpha eventuell zu Nebenwirkungen führt. Es ist möglich, dass das Blocken von delta mit der Zeit über alpha umgangen wird. Das sieht man aber erst in größeren Studien, die es für IPI-145 noch nicht gibt:
http://www.siliconinvestor.com/readmsg.aspx?msgid=28755928
Blood. 2013 Jan 22. [Epub ahead of print]
P110a mediated constitutive PI3K signaling limits the efficacy of p110d-selective inhibition in mantle cell lymphoma, particularly with multiple relapse.
Iyengar S, Clear A, Bödör C, Maharaj L, Lee A, Calaminici M, Matthews J, Iqbal S, Auer R, Gribben J, Joel S.
Centre for Haemato-Oncology, Barts Cancer Institute, Queen Mary University of London, London, United Kingdom.
Phosphoinositide-3 kinase (PI3K) pathway activation contributes to mantle cell lymphoma (MCL) pathogenesis but early phase studies of the PI3K p110d inhibitor GS-1101 have reported inferior responses in MCL compared to other non-Hodgkin lymphomas. As the relative importance of the class IA PI3K isoforms p110a, p110ß and p110d in MCL is not clear, we studied expression of these isoforms and assessed their contribution to PI3K signaling in this disease. We found that while p110d was highly expressed in MCL, p110a showed wide variation and expression increased significantly with relapse. Loss of PTEN expression was found in 16% (22/138) of cases, while PIK3CA and PIK3R1 mutations were absent. Although p110d inhibition was sufficient to block BCR-mediated PI3K activation, combined p110a and p110d inhibition was necessary to abolish constitutive PI3K activation. In addition, GDC-0941, a predominantly p110a/d inhibitor was significantly more active compared to GS-1101, against MCL cell lines and primary samples. We found that a high PIK3CA/PIK3CD ratio identified a subset of primary MCLs resistant to GS-1101 and this ratio increased significantly with relapse. These findings support the use of dual p110a/p110d inhibitors in MCL and suggest a role for p110a in disease progression.
Ich weiß nicht, ob das nur für CML zutrifft? Hier wird der pan-pi3k GDC-0941 erwähnt (den Roche u.a. auch mit EXELs MEK-Hemmer GDC-0973 testet). Wenn ich es richtig sehe, hat EXEL bei Sanofi auch einen pan-pi3k XL-147. Dieser scheint im wesentlichen ein alpha/delta/gamma-Hemmer zu sein... also ein wenig wie IPI-145 + alpha, wobei natürlich sehr viel unspezifischer als pan-Hemmer (http://www.esmo.org/fileadmin/media/slides/tat2011/Wednesday… ... IC50: PI3Ka 39, PI3Kb 383, PI3Kd 36, PI3Kg 23)
Insgesamt tut sich meiner Meinung nach in diesem Bereich viel... was am Ende aber erfolgreich ist, kann man wohl heute noch nicht sagen
http://www.siliconinvestor.com/readmsg.aspx?msgid=28755928
Blood. 2013 Jan 22. [Epub ahead of print]
P110a mediated constitutive PI3K signaling limits the efficacy of p110d-selective inhibition in mantle cell lymphoma, particularly with multiple relapse.
Iyengar S, Clear A, Bödör C, Maharaj L, Lee A, Calaminici M, Matthews J, Iqbal S, Auer R, Gribben J, Joel S.
Centre for Haemato-Oncology, Barts Cancer Institute, Queen Mary University of London, London, United Kingdom.
Phosphoinositide-3 kinase (PI3K) pathway activation contributes to mantle cell lymphoma (MCL) pathogenesis but early phase studies of the PI3K p110d inhibitor GS-1101 have reported inferior responses in MCL compared to other non-Hodgkin lymphomas. As the relative importance of the class IA PI3K isoforms p110a, p110ß and p110d in MCL is not clear, we studied expression of these isoforms and assessed their contribution to PI3K signaling in this disease. We found that while p110d was highly expressed in MCL, p110a showed wide variation and expression increased significantly with relapse. Loss of PTEN expression was found in 16% (22/138) of cases, while PIK3CA and PIK3R1 mutations were absent. Although p110d inhibition was sufficient to block BCR-mediated PI3K activation, combined p110a and p110d inhibition was necessary to abolish constitutive PI3K activation. In addition, GDC-0941, a predominantly p110a/d inhibitor was significantly more active compared to GS-1101, against MCL cell lines and primary samples. We found that a high PIK3CA/PIK3CD ratio identified a subset of primary MCLs resistant to GS-1101 and this ratio increased significantly with relapse. These findings support the use of dual p110a/p110d inhibitors in MCL and suggest a role for p110a in disease progression.
Ich weiß nicht, ob das nur für CML zutrifft? Hier wird der pan-pi3k GDC-0941 erwähnt (den Roche u.a. auch mit EXELs MEK-Hemmer GDC-0973 testet). Wenn ich es richtig sehe, hat EXEL bei Sanofi auch einen pan-pi3k XL-147. Dieser scheint im wesentlichen ein alpha/delta/gamma-Hemmer zu sein... also ein wenig wie IPI-145 + alpha, wobei natürlich sehr viel unspezifischer als pan-Hemmer (http://www.esmo.org/fileadmin/media/slides/tat2011/Wednesday… ... IC50: PI3Ka 39, PI3Kb 383, PI3Kd 36, PI3Kg 23)
Insgesamt tut sich meiner Meinung nach in diesem Bereich viel... was am Ende aber erfolgreich ist, kann man wohl heute noch nicht sagen
Antwort auf Beitrag Nr.: 44.207.156 von ipollit am 02.03.13 18:16:35Hallo ipollit,
in Bezug auf Vertex stimme ich zu, dass ihr HCV-Geschäft mehr oder weniger am Boden liegt - und weiter abbauen wird.
Incivek wird zusammen mit Interferon angewendet. Durch die neuen Entwicklungen insbesondere bei Gilead gibt es dafür keine wirkliche Basis mehr. Eine HCV-Therapie wird in der nahen Zukunft interferon-free sein oder keine relevante Rolle mehr spielen.
Die Patienten warten jetzt schon auf die Zulassung des Gilead-Produktes und stellen - wo immer möglich - die Behandlung einfach zurück.
Vertex arbeitet an einer eigenen rein oralen und interferonfreien HCV-Therapie, hängt aber Jahre zurück und ob sie da je was überzeugendes zu wege bringen werden, weiß kein Mensch.
Davon abgesehen finde ich das gesamte HCV-Thema etwas überreizt. Es gibt Erwartungen, der Markt könnte mal 20 Mrd. Dollar groß sein. Ich würde mich nicht wundern, wenn es mal gerade ein Zehntel davon würde...
Nein, nein, der Wert von Vertex kommt (oder kommt nicht) mehr oder weniger ausschließlich aus dem CF-Bereich.
Das macht das ganze zu einem Hochrisiko-Investment.
Kalydeco kann derzeit 4% des CF-Marktes erschließen (das hängt von einer genetischen Mutation ab, die 4% der Patienten aufweisen).
Mit diesen 4% werden sie in diesem Jahr etwa 300 Millionen Umsatz generieren.
Möglicherweise können sie mit Kalydeco bis zu 8% der Patienten adressieren (andere Mutationen, die entsprechenden Studien laufen).
Der Reiz besteht aber darin, dass man versucht, eine Kombitherapie zu entwickeln. Man kombiniert Kalydeco mit VX-809.
Wenn das funktioniert kann man statt 4% oder 8% immerhin 50% der Patienten erreichen!
PII-Ergebnisse sprechen dafür, dass das klappen könnte. Die PIII ist angelaufen und wird sehr schnell durchgezogen werden (1 Jahr).
Die FDA wird einen sehr, sehr schnellen Zulassungsprozess durchführen und die Zulassung erteilen, wenn es die Daten einigermaßen erlauben. Denn der medizinische Bedarf ist verzweifelt dringend.
Unterstellt man, dass der (irrwitzige) Preis von Kalydeco auch in der Kombitherapie gehalten werden kann, kommt man allein in den USA auf einen Umsatz von 4,4 Milliarden Dollar. Wenn man für VX-809 auch noch kassiert, dann wirds noch mehr.
Verpartnern wird man für Europa m.E. nicht, sondern den Umsatz dort selbst heben. Der Preis wird hier niedriger sein müssen, aber 2 oder 3 Milliarden sollten machbar sein.
Ich denke auch, dass diese Umsätze ganz außerordentlich schnell realisiert werden würden - ich würde meinen, dass wir binnen 24 Monaten nach Zulassung in einem Land am Peak wären.
Mit VX-661 hat Vertex noch ein zweites Molekül als Ergänzung für Kalydeco in der Mache. Hier kommen in den nächsten Monaten PII-Daten. Möglicherweise ist VX-661 potenter als VX-809.
Mein Fazit ist, dass Vertex extrem davon abhängt, ob oder ob nicht man das Label von Kalydeco mittels Kombitherapie erheblich ausweiten kann.
Gelingt das, wird die Aktie geradezu explodieren. Wenn nicht, halte ich Verluste von 50% für ein best case Szenario...
(Mit dem Galapagos-Programm habe ich mich noch nicht befasst. Ich weiß nur, dass es zeitlich sehr weit zurückhängt).
ARRY:
Danke für den Link zu dem Artikel von Sally Church!
Ich bin ja seit den ASH-Daten sehr hoffnungsvoll für ARRY-520.
Ich habe die Sache mit dem AAG-Marker genauso verstanden wie Du.
Die große Frage ist, ob man für ein Individuum einigermaßen zuverlässig sagen kann, dass dessen AAG-Level im Allgemeinen hoch oder niedrig ist und es dementsprechend in die Studie aufnimmt oder nicht.
Die Dosis über die Zeit an Veränderungen des AAG-Levels anzugleichen wäre theoretisch perfekt, wird aber vermutlich praktisch nicht durchführbar sein (Tox-Level verschiedener Dosen, Wirkungszeiten, Monitoring usw.).
Der Unterschied bei der ORR war aber so groß (und theoretisch so gut erklärbar), dass ich es begrüßen würde, wenn Array mit diesem Marker arbeiten würde und einen entsprechenden pivotal-Trial auflegen würde - einfach, um das so sicher zu machen, wie es irgendwie geht.
Vielleicht kann man später noch sehen, ob man auf erhöhte AAG-Level mit höheren Dosen von ARRY520 reagieren kann.
Meine Hoffnung ist jedenfalls, dass ARRY520 im Bereich der doppelt refraktären MM-Patienten eine Zulassung bekommen wird (vielleicht schon 2014?). Das allein wäre für mehrere hundert Millionen Dollar Umsatz gut.
Ich denke, dass die Chancen dafür recht gut sind.
Grüße
SLG
in Bezug auf Vertex stimme ich zu, dass ihr HCV-Geschäft mehr oder weniger am Boden liegt - und weiter abbauen wird.
Incivek wird zusammen mit Interferon angewendet. Durch die neuen Entwicklungen insbesondere bei Gilead gibt es dafür keine wirkliche Basis mehr. Eine HCV-Therapie wird in der nahen Zukunft interferon-free sein oder keine relevante Rolle mehr spielen.
Die Patienten warten jetzt schon auf die Zulassung des Gilead-Produktes und stellen - wo immer möglich - die Behandlung einfach zurück.
Vertex arbeitet an einer eigenen rein oralen und interferonfreien HCV-Therapie, hängt aber Jahre zurück und ob sie da je was überzeugendes zu wege bringen werden, weiß kein Mensch.
Davon abgesehen finde ich das gesamte HCV-Thema etwas überreizt. Es gibt Erwartungen, der Markt könnte mal 20 Mrd. Dollar groß sein. Ich würde mich nicht wundern, wenn es mal gerade ein Zehntel davon würde...
Nein, nein, der Wert von Vertex kommt (oder kommt nicht) mehr oder weniger ausschließlich aus dem CF-Bereich.
Das macht das ganze zu einem Hochrisiko-Investment.
Kalydeco kann derzeit 4% des CF-Marktes erschließen (das hängt von einer genetischen Mutation ab, die 4% der Patienten aufweisen).
Mit diesen 4% werden sie in diesem Jahr etwa 300 Millionen Umsatz generieren.
Möglicherweise können sie mit Kalydeco bis zu 8% der Patienten adressieren (andere Mutationen, die entsprechenden Studien laufen).
Der Reiz besteht aber darin, dass man versucht, eine Kombitherapie zu entwickeln. Man kombiniert Kalydeco mit VX-809.
Wenn das funktioniert kann man statt 4% oder 8% immerhin 50% der Patienten erreichen!
PII-Ergebnisse sprechen dafür, dass das klappen könnte. Die PIII ist angelaufen und wird sehr schnell durchgezogen werden (1 Jahr).
Die FDA wird einen sehr, sehr schnellen Zulassungsprozess durchführen und die Zulassung erteilen, wenn es die Daten einigermaßen erlauben. Denn der medizinische Bedarf ist verzweifelt dringend.
Unterstellt man, dass der (irrwitzige) Preis von Kalydeco auch in der Kombitherapie gehalten werden kann, kommt man allein in den USA auf einen Umsatz von 4,4 Milliarden Dollar. Wenn man für VX-809 auch noch kassiert, dann wirds noch mehr.
Verpartnern wird man für Europa m.E. nicht, sondern den Umsatz dort selbst heben. Der Preis wird hier niedriger sein müssen, aber 2 oder 3 Milliarden sollten machbar sein.
Ich denke auch, dass diese Umsätze ganz außerordentlich schnell realisiert werden würden - ich würde meinen, dass wir binnen 24 Monaten nach Zulassung in einem Land am Peak wären.
Mit VX-661 hat Vertex noch ein zweites Molekül als Ergänzung für Kalydeco in der Mache. Hier kommen in den nächsten Monaten PII-Daten. Möglicherweise ist VX-661 potenter als VX-809.
Mein Fazit ist, dass Vertex extrem davon abhängt, ob oder ob nicht man das Label von Kalydeco mittels Kombitherapie erheblich ausweiten kann.
Gelingt das, wird die Aktie geradezu explodieren. Wenn nicht, halte ich Verluste von 50% für ein best case Szenario...
(Mit dem Galapagos-Programm habe ich mich noch nicht befasst. Ich weiß nur, dass es zeitlich sehr weit zurückhängt).
ARRY:
Danke für den Link zu dem Artikel von Sally Church!
Ich bin ja seit den ASH-Daten sehr hoffnungsvoll für ARRY-520.
Ich habe die Sache mit dem AAG-Marker genauso verstanden wie Du.
Die große Frage ist, ob man für ein Individuum einigermaßen zuverlässig sagen kann, dass dessen AAG-Level im Allgemeinen hoch oder niedrig ist und es dementsprechend in die Studie aufnimmt oder nicht.
Die Dosis über die Zeit an Veränderungen des AAG-Levels anzugleichen wäre theoretisch perfekt, wird aber vermutlich praktisch nicht durchführbar sein (Tox-Level verschiedener Dosen, Wirkungszeiten, Monitoring usw.).
Der Unterschied bei der ORR war aber so groß (und theoretisch so gut erklärbar), dass ich es begrüßen würde, wenn Array mit diesem Marker arbeiten würde und einen entsprechenden pivotal-Trial auflegen würde - einfach, um das so sicher zu machen, wie es irgendwie geht.
Vielleicht kann man später noch sehen, ob man auf erhöhte AAG-Level mit höheren Dosen von ARRY520 reagieren kann.
Meine Hoffnung ist jedenfalls, dass ARRY520 im Bereich der doppelt refraktären MM-Patienten eine Zulassung bekommen wird (vielleicht schon 2014?). Das allein wäre für mehrere hundert Millionen Dollar Umsatz gut.
Ich denke, dass die Chancen dafür recht gut sind.
Grüße
SLG
Santarus 2012 Q4 und FY Zahlen über den Erwartungen.
SNTS seit meinem Kauf ein Selbstläufer, auch mal Glück gehabt.
http://seekingalpha.com/article/1246111-santarus-ceo-discuss…
SNTS seit meinem Kauf ein Selbstläufer, auch mal Glück gehabt.
http://seekingalpha.com/article/1246111-santarus-ceo-discuss…
CLDX:
Der Kursrutsch gestern bei CLDX ist nicht nachvollziehbar und wird heute mehr als wieder gut gemacht.
Ich finde das Trial-Design für CDX-011 klasse. Bin fast wunschlos glücklich.
Sie setzen einen pivotal trial für triple negativ GPNMB++ Patienten auf. Vergleich läuft gegen Xeloda und die primären Endpunkte sind ORR von 30% oder ein PFS-Vorteil von 2,25 Monaten.
Daten dürften 2015 vorliegen, Zulassung dann ggf. 2016.
Außerdem wird es einen langsameren Trial mit OS als Endpunkt für alle GPNMB überexprimierenden Patienten geben, der dann irgendwann mal zur vollen Zulassung mit breiterem Label führen kann.
Man kombiniert so optimal Schnelligkeit, Erfolgsoptimierung und Breite.
Und das alles wurde laut CC mit der FDA im Detail abgestimmt - auch der alternative Endpunkt.
PS: Vielleicht wäre es gut mit einer Verpartnerung zu warten, bis wir die Daten dieses accelerated approval-Trials haben!
Der Kursrutsch gestern bei CLDX ist nicht nachvollziehbar und wird heute mehr als wieder gut gemacht.
Ich finde das Trial-Design für CDX-011 klasse. Bin fast wunschlos glücklich.
Sie setzen einen pivotal trial für triple negativ GPNMB++ Patienten auf. Vergleich läuft gegen Xeloda und die primären Endpunkte sind ORR von 30% oder ein PFS-Vorteil von 2,25 Monaten.
Daten dürften 2015 vorliegen, Zulassung dann ggf. 2016.
Außerdem wird es einen langsameren Trial mit OS als Endpunkt für alle GPNMB überexprimierenden Patienten geben, der dann irgendwann mal zur vollen Zulassung mit breiterem Label führen kann.
Man kombiniert so optimal Schnelligkeit, Erfolgsoptimierung und Breite.
Und das alles wurde laut CC mit der FDA im Detail abgestimmt - auch der alternative Endpunkt.
PS: Vielleicht wäre es gut mit einer Verpartnerung zu warten, bis wir die Daten dieses accelerated approval-Trials haben!
der Nasdaq Biotech Index hat jetzt sein Allzeithoch von etwa 1620 erreicht... ob er hier hängen bleibt? Der Anstieg ist ziemlich steil gewesen. Andererseits hat der Dow bereits sein Hoch überschritten, was ja eher ein Zeichen weiterer Stärke ist.

http://www.godmode-trader.de/nachricht/Nasdaq-Biotech-Heute-…
http://www.godmode-trader.de/nachricht/Nasdaq-Biotech-Heute-…

CRIS... die Woche habe ich eine kleine Position in Curis aufgebaut. Die MK ist mit ca. 280 Mio USD noch nicht so hoch. Zum einen gibt es Royalties (im einstelligen Prozentbereich) von Genentech's Hedgehog Hemmer Erivedge, zum anderen ist Curis beteiligt am oralen Hsp90-Hemmer Debio-0932 (oral könnte ein Vorteil gegenüber SNTA's Ganetespib sein... allerdings war glaube ich die Entwicklung bei Debiopharm zuletzt nicht sonderlich schnell). Die Pipeline fand ich bisher nicht so interessant, da ich die Projekte nicht recht einschätzen kann. CUDC-907 ist ein pan-PI3K (alpha/delta/beta) + HDAC Hemmer... Curis sieht hier eine hohe Wirksamkeit ua. in MM (bei MM spielt ja auch ARRY-520 mit). Allerdings könnten die Nebenwirkungen erheblich sein. PI3K ist zur Zeit sehr in (GILD und INFI)... bisher aber nur spezifische delta-Hemmer, während die pan-Hemmer angeblich eher enttäuschend waren.
Spannend finde ich dagegen den neu einlizensierten IAP-Hemmer CUDC-427, den man nach der PI von Genentech übernommen hat. Wenn ein Pharma die Entwicklung nicht fortführt, sollte man eher skeptisch sein. Laut Curis möchte Genentech/Roche aber nur Target-Therapien weiterführen, wozu IAP-Hemmer nicht richtig passen. IAP ist mehr etwas in Kombination mit Chemo, da Krebszellen durch IAP Resistenzen gegen die Chemo entwickeln können.
Hier ist etwas zu IAP: "Inhibitors of Apoptosis Target one of the Hallmarks of Cancer"
http://biotechstrategyblog.com/2013/02/inhibitors-of-apoptos…
Ohad Hammer hält auch CRIS, ist aber nicht so begeistert:
"Cris hit its 52 week low today. Can you think of any reason for this decline?
***
Royalties from Roche on Erivedge were lower than expected. This doesn’t change the overall potential of the drug imo. Data in operable BCC is important this year.
I guess people are also worried about the IAP antagonist they licensed from Genentech. They put a lot of money behind that asset and you can’t blame the market for its skepticism. Data at ASCO 2013.
***
Ohad: what are your current thoughts on CRIS? I see they are a small holding in the portfolio. Thought Cowen presentation was interesting and they did a good job of explaining how they were able to in-license IAP inhibitor from Genentech (Roche focused on single agent targeted drugs w/companion diagnostic; IAP has more utility in combo treatment). Also, the PI3K+HDAC all-in-one sounds kind of interesting to me and CRIS explained potential utility in MM and other heme onc settings.
***
I think they have 1 clear asset to which the market assigns value (Eviredge). The rest of their pipeline is too early and I have to admt it’s hard for me to get excited. I count on Roche to grow Eviredge, which is why I hold CRIS.

Gruß
ipollit
Spannend finde ich dagegen den neu einlizensierten IAP-Hemmer CUDC-427, den man nach der PI von Genentech übernommen hat. Wenn ein Pharma die Entwicklung nicht fortführt, sollte man eher skeptisch sein. Laut Curis möchte Genentech/Roche aber nur Target-Therapien weiterführen, wozu IAP-Hemmer nicht richtig passen. IAP ist mehr etwas in Kombination mit Chemo, da Krebszellen durch IAP Resistenzen gegen die Chemo entwickeln können.
Hier ist etwas zu IAP: "Inhibitors of Apoptosis Target one of the Hallmarks of Cancer"
http://biotechstrategyblog.com/2013/02/inhibitors-of-apoptos…
Ohad Hammer hält auch CRIS, ist aber nicht so begeistert:
"Cris hit its 52 week low today. Can you think of any reason for this decline?
***
Royalties from Roche on Erivedge were lower than expected. This doesn’t change the overall potential of the drug imo. Data in operable BCC is important this year.
I guess people are also worried about the IAP antagonist they licensed from Genentech. They put a lot of money behind that asset and you can’t blame the market for its skepticism. Data at ASCO 2013.
***
Ohad: what are your current thoughts on CRIS? I see they are a small holding in the portfolio. Thought Cowen presentation was interesting and they did a good job of explaining how they were able to in-license IAP inhibitor from Genentech (Roche focused on single agent targeted drugs w/companion diagnostic; IAP has more utility in combo treatment). Also, the PI3K+HDAC all-in-one sounds kind of interesting to me and CRIS explained potential utility in MM and other heme onc settings.
***
I think they have 1 clear asset to which the market assigns value (Eviredge). The rest of their pipeline is too early and I have to admt it’s hard for me to get excited. I count on Roche to grow Eviredge, which is why I hold CRIS.
Gruß
ipollit
ONXX...
gerade auf Twitter gelesen: "guidelines for MM updated this morning, Kyprolis recommended 1st line for BMT candidates, big news $ONXX"
Das sollte die Kyprolis-Schätzungen anheben... mal sehen, wie der Markt am Montag reagiert.

gerade auf Twitter gelesen: "guidelines for MM updated this morning, Kyprolis recommended 1st line for BMT candidates, big news $ONXX"
Das sollte die Kyprolis-Schätzungen anheben... mal sehen, wie der Markt am Montag reagiert.
Antwort auf Beitrag Nr.: 44.233.687 von ipollit am 09.03.13 17:29:09I think they have 1 clear asset to which the market assigns value (Eviredge). The rest of their pipeline is too early and I have to admt it’s hard for me to get excited. I count on Roche to grow Eviredge, which is why I hold CRIS.
Hallo ipollit,
muss zugeben, dass das Fettgedruckte genau auch meine Stimmung widerspiegelt.
Was mich aber zu der Frage bringt, welches Potential den Eviredge langfristig haben könnte?
Hast Du da konkrete Erwartungen bzw. kennst Du Analystenschätzungen für die Größe des Marktes?
Gruß
SLG
Hallo ipollit,
muss zugeben, dass das Fettgedruckte genau auch meine Stimmung widerspiegelt.
Was mich aber zu der Frage bringt, welches Potential den Eviredge langfristig haben könnte?
Hast Du da konkrete Erwartungen bzw. kennst Du Analystenschätzungen für die Größe des Marktes?
Gruß
SLG
Hallo SLGramann!
"dass das Fettgedruckte genau auch meine Stimmung widerspiegelt."... ist P1 oder PII deiner Meinung nach zu früh? In solchen Dingen kann ich Ohad Hammer nicht immer zustimmen, auch wenn er meist sehr hilfreiche Beiträge bringt. PCYC's Ibrutinib sah (soweit ich mich erinnere) schon früh aussichtsreich aus, genauso MDVN's MDV3100 oder ARIA's Iclusig. Du findest ja auch ARRY-520/614 oder VRTX's VX-809/661 interessant, die sich in der PI oder PII befinden. Aus meiner Sicht ist es nicht verkehrt, sich auch frühere Phasen zumindest anzuschauen.
Der zweite Punkt, ob CRIS außer Eviredge etwas interessantes hat... wie gesagt, finde ich den IAP-Hemmer aus der Theorie heraus spannend. Und vielleicht bringt der pan-PI3K+HDAC Hemmer ja auch etwas. "hard to get excited" hört sich für mich so an, als ob hier garnichts möglich wäre oder es einfach irgendwelche Kandiaten wären, wie es tausende gibt... das sehe ich nicht so. Naja man wird sehen... ich habe es ja auch nur als eine kleine 2% Position im Depot.
Zu Eviredge... soweit ich mich erinnere sieht Ohad hier bei fortgeschrittenen BCC nur minimale Umsätze. Z.B. hier http://www.bioworld.com/node/157602 findet sich das folgende: "Cowen & Co. analyst Simos Simeonidis conservatively modeled that just 0.4 percent of the total BCC market is advanced BCC. Even so, with vismodegib's $7,500 per month pricetag, he estimates 2014 U.S. and European sales of $401 million, with peak sales of $533 million in 2022."
BCC ("weißer Hautkrebs") bildet nur in ca. 0,2% der Fälle Metastasen, was sehr gut ist, da der Krebs sich so nicht schnell ausbreiten und man ihn leicht operativ entfernen kann. In 99% der Fälle wird daher nur operiert. Die Frage ist, ob dann zusätzlich Eviredge noch etwas bringt... wohl nur in einem kleinen Teil von Risikopatienten. Allerdings ist BCC als solches auch sehr verbreitet, so dass kleine Anteile trotzdem viele Patienten betrifft.

In 10 von 24 Patienten ist BCC nicht mehr nachweisbar...

Eviredge ist der erste Smoothened Hemmer ("Because vismodegib works downstream in the pathway, it inhibits signaling by any of the three Hedgehog proteins."). Genentech hatte sich wahrscheinlich mehr davon versprochen... mehrere PII in anderen Indikationen waren nicht erfolgreich: "Yet vismodegib failed a Phase II trial in colorectal cancer as well as a Phase II trial in ovarian cancer. Low said that's because the role of Hedgehog in those cancers is complex, and its inhibition "wasn't enough to slow down tumors that much." She noted that Hedgehog plays a similar role in pancreatic cancer. That may have something to do with why Infinity Pharmaceuticals Inc.'s Hedgehog inhibitor saridegib (IPI-926), which also targets Smoothened, failed a Phase II pancreatic cancer trial last week."
Vorletzte Woche habe ich dazu auch einen interessanten Artikel gefunden: http://www.bizjournals.com/sanfrancisco/blog/biotech/2013/02… Darin wird die Theorie vertreten, dass bei der Hemmung von Smoothened mit der Zeit ein alternativer Pfad aktiv wird, der diese Hemmung umgeht. Nach einer anfänglichen Wirkung wird der Krebs resistent gegen Eviredge... dies geschieht bei Krebsarten der fehlgeschlagenen PIIs wohl recht schnell, bei BCC erst nach einiger Zeit: "How quickly is basal cell carcinoma becoming resistant to Erivedge? What we're finding is, like a lot of these targeted therapies, in a few months — a half a year to a year — the resistance starts to develop... The paper we put out last (year) basically documented that 25 percent of the people who responded in the first year will develop resistance... This, in theory, would work on regular basal cell carcinomas, too, and we're hoping that it works on other, more lethal cancers like pancreatic, small cell lung, colon — those cancers that seem to develop resistance very early to inhibitors. ... Would you like to combine a drug targeting aPKC with Erivedge? That would be something that's very interesting to try. That's definitely the way we'd like to move."
Erst im laufe der Zeit versteht man, wie diese ganzen neuen Therapien wirken. Es reicht offensichtlich nicht, z.B. in einer PI eine Wirkung zu zeigen... es ist auch wichtig zu sehen, wie lange die Wirkung anhält und wie schnell sich Resistenzen bilden: "We've written papers on this race against tumor evolution, where we develop therapies and the tumor gets around it. The goal is to try to figure out all the escape mechanisms and try to hit it upfront with all the various ways it can become resistant." Die Target-Therapien sollen möglichst nur ihr Target treffen und nicht noch andere unnötige Rezeptoren aktivieren (wie z.B. der EGFR-Hemmer Tarceva auch bei normalen Zellen andockt und dort unerwünschte Nebenwirkungen wie Hautausschlag hervorruft). Die Patienten sollten gescreent werden, ob der Krebs auch das Target aufweist. Dann sollte dieses Target auch nach Mutationen noch blockiert werden (z.B. wird Gleevec bei der T790m Mutation wirkungslos... Iclusig wirkt dann noch). Ein weiteres ist eben, dass Alternativen zum Target ebenfalls gehemmt werden müssen. Und das ganze so, dass dabei nicht zu viele Nebenwirkungen entstehen.
Somit kann man meiner Meinung nach nicht mit Bestimmtheit sagen, dass z.B. CUDC-907 als pan-PI3K+HADC Hemmer unsinnig ist, weil beispielsweise GILDs GS-1101 aussichtsreich ist und HDAC-Hemmer bisher nicht erfolgreich waren. Wie ich in einem der letzen Postings ja bereits geschrieben habe, könnte PI3K-delta z.B. für MCL nicht ausreichend sein, weil es mit PI3K-alpha umgangen werden kann. Man muss die richtige Kombination finden.
Jedenfalls scheint CUDC-907 z.B. in MM deutlich aktiver zu sein als ein PI3K-Hemmer und auch als die Kombi aus zwei Hemmern (PI3K und HDAC)...

Gruß
ipollit
"dass das Fettgedruckte genau auch meine Stimmung widerspiegelt."... ist P1 oder PII deiner Meinung nach zu früh? In solchen Dingen kann ich Ohad Hammer nicht immer zustimmen, auch wenn er meist sehr hilfreiche Beiträge bringt. PCYC's Ibrutinib sah (soweit ich mich erinnere) schon früh aussichtsreich aus, genauso MDVN's MDV3100 oder ARIA's Iclusig. Du findest ja auch ARRY-520/614 oder VRTX's VX-809/661 interessant, die sich in der PI oder PII befinden. Aus meiner Sicht ist es nicht verkehrt, sich auch frühere Phasen zumindest anzuschauen.
Der zweite Punkt, ob CRIS außer Eviredge etwas interessantes hat... wie gesagt, finde ich den IAP-Hemmer aus der Theorie heraus spannend. Und vielleicht bringt der pan-PI3K+HDAC Hemmer ja auch etwas. "hard to get excited" hört sich für mich so an, als ob hier garnichts möglich wäre oder es einfach irgendwelche Kandiaten wären, wie es tausende gibt... das sehe ich nicht so. Naja man wird sehen... ich habe es ja auch nur als eine kleine 2% Position im Depot.
Zu Eviredge... soweit ich mich erinnere sieht Ohad hier bei fortgeschrittenen BCC nur minimale Umsätze. Z.B. hier http://www.bioworld.com/node/157602 findet sich das folgende: "Cowen & Co. analyst Simos Simeonidis conservatively modeled that just 0.4 percent of the total BCC market is advanced BCC. Even so, with vismodegib's $7,500 per month pricetag, he estimates 2014 U.S. and European sales of $401 million, with peak sales of $533 million in 2022."
BCC ("weißer Hautkrebs") bildet nur in ca. 0,2% der Fälle Metastasen, was sehr gut ist, da der Krebs sich so nicht schnell ausbreiten und man ihn leicht operativ entfernen kann. In 99% der Fälle wird daher nur operiert. Die Frage ist, ob dann zusätzlich Eviredge noch etwas bringt... wohl nur in einem kleinen Teil von Risikopatienten. Allerdings ist BCC als solches auch sehr verbreitet, so dass kleine Anteile trotzdem viele Patienten betrifft.
In 10 von 24 Patienten ist BCC nicht mehr nachweisbar...
Eviredge ist der erste Smoothened Hemmer ("Because vismodegib works downstream in the pathway, it inhibits signaling by any of the three Hedgehog proteins."). Genentech hatte sich wahrscheinlich mehr davon versprochen... mehrere PII in anderen Indikationen waren nicht erfolgreich: "Yet vismodegib failed a Phase II trial in colorectal cancer as well as a Phase II trial in ovarian cancer. Low said that's because the role of Hedgehog in those cancers is complex, and its inhibition "wasn't enough to slow down tumors that much." She noted that Hedgehog plays a similar role in pancreatic cancer. That may have something to do with why Infinity Pharmaceuticals Inc.'s Hedgehog inhibitor saridegib (IPI-926), which also targets Smoothened, failed a Phase II pancreatic cancer trial last week."
Vorletzte Woche habe ich dazu auch einen interessanten Artikel gefunden: http://www.bizjournals.com/sanfrancisco/blog/biotech/2013/02… Darin wird die Theorie vertreten, dass bei der Hemmung von Smoothened mit der Zeit ein alternativer Pfad aktiv wird, der diese Hemmung umgeht. Nach einer anfänglichen Wirkung wird der Krebs resistent gegen Eviredge... dies geschieht bei Krebsarten der fehlgeschlagenen PIIs wohl recht schnell, bei BCC erst nach einiger Zeit: "How quickly is basal cell carcinoma becoming resistant to Erivedge? What we're finding is, like a lot of these targeted therapies, in a few months — a half a year to a year — the resistance starts to develop... The paper we put out last (year) basically documented that 25 percent of the people who responded in the first year will develop resistance... This, in theory, would work on regular basal cell carcinomas, too, and we're hoping that it works on other, more lethal cancers like pancreatic, small cell lung, colon — those cancers that seem to develop resistance very early to inhibitors. ... Would you like to combine a drug targeting aPKC with Erivedge? That would be something that's very interesting to try. That's definitely the way we'd like to move."
Erst im laufe der Zeit versteht man, wie diese ganzen neuen Therapien wirken. Es reicht offensichtlich nicht, z.B. in einer PI eine Wirkung zu zeigen... es ist auch wichtig zu sehen, wie lange die Wirkung anhält und wie schnell sich Resistenzen bilden: "We've written papers on this race against tumor evolution, where we develop therapies and the tumor gets around it. The goal is to try to figure out all the escape mechanisms and try to hit it upfront with all the various ways it can become resistant." Die Target-Therapien sollen möglichst nur ihr Target treffen und nicht noch andere unnötige Rezeptoren aktivieren (wie z.B. der EGFR-Hemmer Tarceva auch bei normalen Zellen andockt und dort unerwünschte Nebenwirkungen wie Hautausschlag hervorruft). Die Patienten sollten gescreent werden, ob der Krebs auch das Target aufweist. Dann sollte dieses Target auch nach Mutationen noch blockiert werden (z.B. wird Gleevec bei der T790m Mutation wirkungslos... Iclusig wirkt dann noch). Ein weiteres ist eben, dass Alternativen zum Target ebenfalls gehemmt werden müssen. Und das ganze so, dass dabei nicht zu viele Nebenwirkungen entstehen.
Somit kann man meiner Meinung nach nicht mit Bestimmtheit sagen, dass z.B. CUDC-907 als pan-PI3K+HADC Hemmer unsinnig ist, weil beispielsweise GILDs GS-1101 aussichtsreich ist und HDAC-Hemmer bisher nicht erfolgreich waren. Wie ich in einem der letzen Postings ja bereits geschrieben habe, könnte PI3K-delta z.B. für MCL nicht ausreichend sein, weil es mit PI3K-alpha umgangen werden kann. Man muss die richtige Kombination finden.
Jedenfalls scheint CUDC-907 z.B. in MM deutlich aktiver zu sein als ein PI3K-Hemmer und auch als die Kombi aus zwei Hemmern (PI3K und HDAC)...
Gruß
ipollit
ARRY...
der GKA AMG 151 scheint doch ein recht hohes Risiko zu beinhalten. Sicherheitshalber gehe ich von einem Scheitern aus... ob sich ein solches negativ auf den Kurs auswirkt oder vielleicht auch befreiend wirkt?
Wenn ich es richtig sehe, dann sind bisher alle GKAs in der PII gescheitert. Beispielsweise kam der Fehlschlag von MK-0941 erst nach dem Deal mit Amgen. U.a. hat es problematische Nebenwirkungen gegeben: "MK-0941 also caused an increase from baseline in triglycerides of up to 19% ... It is unknown whether the efficacy and safety profiles observed with MK-0941 were compound-specific or mechanism based"
http://www.medwirenews.com/57/95317/Diabetes/Glucokinase_act…
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3220852/
http://care.diabetesjournals.org/content/34/Supplement_2/S23…
Zuletzt gab es z.B. auch das:
http://www.ncbi.nlm.nih.gov/pubmed/22925001
"Small molecule glucokinase activators disturb lipid homeostasis and induce fatty liver in rodents: a warning for therapeutic applications in humans.
...
CONCLUSION AND IMPLICATIONS:
Given the risks associated with fatty liver disease in the general population and furthermore in patients with T2D, these findings represent a serious warning for the use of GKAs in humans."
Gruß
ipollit
der GKA AMG 151 scheint doch ein recht hohes Risiko zu beinhalten. Sicherheitshalber gehe ich von einem Scheitern aus... ob sich ein solches negativ auf den Kurs auswirkt oder vielleicht auch befreiend wirkt?
Wenn ich es richtig sehe, dann sind bisher alle GKAs in der PII gescheitert. Beispielsweise kam der Fehlschlag von MK-0941 erst nach dem Deal mit Amgen. U.a. hat es problematische Nebenwirkungen gegeben: "MK-0941 also caused an increase from baseline in triglycerides of up to 19% ... It is unknown whether the efficacy and safety profiles observed with MK-0941 were compound-specific or mechanism based"
http://www.medwirenews.com/57/95317/Diabetes/Glucokinase_act…
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3220852/
http://care.diabetesjournals.org/content/34/Supplement_2/S23…
Zuletzt gab es z.B. auch das:
http://www.ncbi.nlm.nih.gov/pubmed/22925001
"Small molecule glucokinase activators disturb lipid homeostasis and induce fatty liver in rodents: a warning for therapeutic applications in humans.
...
CONCLUSION AND IMPLICATIONS:
Given the risks associated with fatty liver disease in the general population and furthermore in patients with T2D, these findings represent a serious warning for the use of GKAs in humans."
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.235.300 von ipollit am 10.03.13 18:19:41Aus meiner Sicht ist es nicht verkehrt, sich auch frühere Phasen zumindest anzuschauen.
Dem stimme ich vollkommen zu.
Ich werde aber erst dann aufgeregt, wenn es Daten gibt, die so aussehen, als könnte da etwas ganz aufregendes passieren (Ibrutinib als Paradebeispiel oder aktuell Daratumumab oder sicher auch ARRY520).
Ich stecke in den Hintergründen definitiv nicht so tief drin, wie Du. Du findest den IAP-Hemmer aus der Theorie heraus interessant. Mir sind zum Beispiel diese Hintergründe unbekannt. Von daher brauche ich mitunter etwas länger. Zum Beispiel Array - da warst Du viel eher als ich überzeugt. Ich bin erst seit der ASH 2012 heiß geworden.
Und so ist es jetzt auch bei Curis. Aus der Theorie kann ich es nicht ableiten, überzeugende Daten kenne ich nicht (gibt es wohl noch nicht) und so ist die Pipeline für mich eben nichts besonderes (was sich als falsch herausstellen kann).
Was anderes:
Weil hier kürzlich LeoF wegen Mologen gefragt hat:
So ganz uninteressant sind die vielleicht wirklich nicht.
Wenn es sich erhärten sollte, dass sie einen OS-Vorteil erreichen könnten, dann müsste man wirklich mal genauer hinsehen.
Dem stimme ich vollkommen zu.
Ich werde aber erst dann aufgeregt, wenn es Daten gibt, die so aussehen, als könnte da etwas ganz aufregendes passieren (Ibrutinib als Paradebeispiel oder aktuell Daratumumab oder sicher auch ARRY520).
Ich stecke in den Hintergründen definitiv nicht so tief drin, wie Du. Du findest den IAP-Hemmer aus der Theorie heraus interessant. Mir sind zum Beispiel diese Hintergründe unbekannt. Von daher brauche ich mitunter etwas länger. Zum Beispiel Array - da warst Du viel eher als ich überzeugt. Ich bin erst seit der ASH 2012 heiß geworden.
Und so ist es jetzt auch bei Curis. Aus der Theorie kann ich es nicht ableiten, überzeugende Daten kenne ich nicht (gibt es wohl noch nicht) und so ist die Pipeline für mich eben nichts besonderes (was sich als falsch herausstellen kann).
Was anderes:
Weil hier kürzlich LeoF wegen Mologen gefragt hat:
So ganz uninteressant sind die vielleicht wirklich nicht.
Wenn es sich erhärten sollte, dass sie einen OS-Vorteil erreichen könnten, dann müsste man wirklich mal genauer hinsehen.
Onyx sucht nach einer Verstärkung der Pipeline:
Last week Coles spoke to investors about his desire to put this capital to work through a combination of internal R&D--largely with trials aimed at expanding the uses of its cancer drugs Kyprolis and Nexavar, which is partnered with Bayer--as well as smart M&A or licensing moves that bolster the company's pipeline. Though Onyx often gets named as a prime buyout target for Big Pharma outfits, Coles laid out a growth plan that clearly puts his company on the buying side of the bargaining table.
Sign up for our FREE newsletter for more news like this sent to your inbox!
"We've got great prospects for this company, so there is every indication that we should just keep going on our own," Coles told the news wire after an investor meeting in New York on March 14. "The way to build a successful, sustainable business is through acquisitions, either companies or products--even licensing deals."
--------------
Meiner Meinung nach würde ein Partnerdeal mit Array für Arry520 strategisch für beide Unternehmen ganz viel Sinn machen. Onyx muss (oder will jedenfalls) in Europa eh eine eigene Salesforce für Kyprolis aufbauen. Wenn man dann irgenwann Arry520 noch mitvermarkten könnte, wäre das schön synergistisch.
Die US-Rechte sollte Array aber behalten...
Last week Coles spoke to investors about his desire to put this capital to work through a combination of internal R&D--largely with trials aimed at expanding the uses of its cancer drugs Kyprolis and Nexavar, which is partnered with Bayer--as well as smart M&A or licensing moves that bolster the company's pipeline. Though Onyx often gets named as a prime buyout target for Big Pharma outfits, Coles laid out a growth plan that clearly puts his company on the buying side of the bargaining table.
Sign up for our FREE newsletter for more news like this sent to your inbox!
"We've got great prospects for this company, so there is every indication that we should just keep going on our own," Coles told the news wire after an investor meeting in New York on March 14. "The way to build a successful, sustainable business is through acquisitions, either companies or products--even licensing deals."
--------------
Meiner Meinung nach würde ein Partnerdeal mit Array für Arry520 strategisch für beide Unternehmen ganz viel Sinn machen. Onyx muss (oder will jedenfalls) in Europa eh eine eigene Salesforce für Kyprolis aufbauen. Wenn man dann irgenwann Arry520 noch mitvermarkten könnte, wäre das schön synergistisch.
Die US-Rechte sollte Array aber behalten...
PCYC...
Pharmacyclics price target raised to $165 from $110 at Wedbush
Wedbush raised its price target to $165 for Pharmacyclics on expectations breakthrough designation in MCL will lead to an earlier than expected approval for ibrutinib. The firm also expects significant off-label use of ibrutinib across hematological malignancies and keeps an Outperform rating on shares of Pharmacyclics.
(twitter) Wedbush now sees ibrutinib peak sales at ~$8-9bln as the drug forms backbone therapy in CLL/MCL ahead of competition.
Gruß
ipollit
Pharmacyclics price target raised to $165 from $110 at Wedbush
Wedbush raised its price target to $165 for Pharmacyclics on expectations breakthrough designation in MCL will lead to an earlier than expected approval for ibrutinib. The firm also expects significant off-label use of ibrutinib across hematological malignancies and keeps an Outperform rating on shares of Pharmacyclics.
(twitter) Wedbush now sees ibrutinib peak sales at ~$8-9bln as the drug forms backbone therapy in CLL/MCL ahead of competition.
Gruß
ipollit
CRIS... (twitter)
CEO says Ph1 single agent IAP gave CR (this is ovarian w a BRCA1+ status), one other. Agent works better as combo.
i highly doubt anyone expected a CR!
$CRIS IAP antag is monovalent = easy oral formulation + possibility for dosing combinations. downside = reduced potency/efficacy
$CRIS has said the opposite about their monomer; said carries advantages as well as efficacy
bivalent: bind several domains allatonce, leading to better caspase activation - e.g. fig 4
think the beauty of monovalent molecule = oral formulation; allows for drug/chemo combo trials
well $CRIS says combo is the key rationale 4 IAP so doesn't that lend advantage 2 mono?
IAP has broad MOA, no easy predictive biomarker (at least not yet), etc. not exactly sexy new gen Tx
private co. tetralogic has patent stating tnf expression is indicator of tumor sensitivity to IAP inhib
***
PI3K-HDAC now cont. to second dosing cohort in MM, MCL, L; will begin a combination study in Q 3/4 in solid tumors w '907.
***
holding both $ARIA and $CRIS. hope at least one of them gets CHMP approval recommendation this week
Gruß
ipollit
CEO says Ph1 single agent IAP gave CR (this is ovarian w a BRCA1+ status), one other. Agent works better as combo.
i highly doubt anyone expected a CR!
$CRIS IAP antag is monovalent = easy oral formulation + possibility for dosing combinations. downside = reduced potency/efficacy
$CRIS has said the opposite about their monomer; said carries advantages as well as efficacy
bivalent: bind several domains allatonce, leading to better caspase activation - e.g. fig 4
think the beauty of monovalent molecule = oral formulation; allows for drug/chemo combo trials
well $CRIS says combo is the key rationale 4 IAP so doesn't that lend advantage 2 mono?
IAP has broad MOA, no easy predictive biomarker (at least not yet), etc. not exactly sexy new gen Tx
private co. tetralogic has patent stating tnf expression is indicator of tumor sensitivity to IAP inhib
***
PI3K-HDAC now cont. to second dosing cohort in MM, MCL, L; will begin a combination study in Q 3/4 in solid tumors w '907.
***
holding both $ARIA and $CRIS. hope at least one of them gets CHMP approval recommendation this week
Gruß
ipollit
Genmab...
http://www.bloomberg.com/news/2013-03-20/genmab-rises-as-nor…
Genmab Rises as Nordea Says Bet on Cancer Drug: Copenhagen Mover
By Christian Wienberg - Mar 20, 2013 12:49 PM GMT+0100
Genmab A/S (GEN) rose the most in a week in Copenhagen trading after Nordea Bank AB said an experimental cancer treatment that the Danish company is developing with Johnson & Johnson (JNJ) will boost the share price.
Genmab rose 4.2 percent, the most since March 13, to 125.40 kroner at 12:40 p.m. in the Danish capital, with trading volume at 143 percent of the three-month daily average.
Findings presented at a scientific session that Nordea hosted confirm Genmab’s daratumumab is “a clearly unique asset” in the growing market for treating multiple myeloma, the bank said. Nordea repeated a strong buy recommendation on the shares of the Copenhagen-based drugmaker.
“We believe that daratumumab could be the next big thing in multiple myeloma,” Michael Novod, an analyst with Nordea in Copenhagen, said in the note.
The market for multiple myeloma is “set to grow rapidly,” approaching $9 billion in 2020 amid better diagnosis and treatment of the disease, Novod said. The cancer starts in the plasma cells in bone marrow.
Genmab and partner J&J, which is based in New Brunswick, New Jersey, are discussing “all options” for speeding up regulatory approval of daratumumab, Chief Executive officer Jan Van de Winkel said in a March 7 phone interview.

Gruß
ipollit
http://www.bloomberg.com/news/2013-03-20/genmab-rises-as-nor…
Genmab Rises as Nordea Says Bet on Cancer Drug: Copenhagen Mover
By Christian Wienberg - Mar 20, 2013 12:49 PM GMT+0100
Genmab A/S (GEN) rose the most in a week in Copenhagen trading after Nordea Bank AB said an experimental cancer treatment that the Danish company is developing with Johnson & Johnson (JNJ) will boost the share price.
Genmab rose 4.2 percent, the most since March 13, to 125.40 kroner at 12:40 p.m. in the Danish capital, with trading volume at 143 percent of the three-month daily average.
Findings presented at a scientific session that Nordea hosted confirm Genmab’s daratumumab is “a clearly unique asset” in the growing market for treating multiple myeloma, the bank said. Nordea repeated a strong buy recommendation on the shares of the Copenhagen-based drugmaker.
“We believe that daratumumab could be the next big thing in multiple myeloma,” Michael Novod, an analyst with Nordea in Copenhagen, said in the note.
The market for multiple myeloma is “set to grow rapidly,” approaching $9 billion in 2020 amid better diagnosis and treatment of the disease, Novod said. The cancer starts in the plasma cells in bone marrow.
Genmab and partner J&J, which is based in New Brunswick, New Jersey, are discussing “all options” for speeding up regulatory approval of daratumumab, Chief Executive officer Jan Van de Winkel said in a March 7 phone interview.
Gruß
ipollit
bezüglich PD-1 schreibt Ohad Hammer:
http://www.orf-blog.com/major-trends-in-cancer-drug-developm…
...
Atkins, who has been a strong advocate of immunotherapy before it became so popular, emphasized that there are probably baseline parameters that dictate whether a patient responds to immune checkpoint inhibitors or not. A lot of it has to do with the microenvironment of the tumor including infiltration of immune cells and the various mechanisms cancer cells use to evade the immune system. This “immunogenic profile” can explain the dramatic variability in response to immunotherapy (some patients can be cured while others are inherently resistant).
4 PD1 programs were presented: BMS’s (BMY) nivolumab (anti-PD1), Merck’s (MRK) MK-3475 (anti-PD1), Genentech’s MPDL3280A (anti PD-L1) and GSK (GSK)/Amplimmune’s AMP-224 (PD-L2-Fc fusion). The first 2 are in late stage development based on positive phase I data. The other two are still in phase I and initial data are expected this year.
...
Nivolumab demonstrated remarkable activity in melanoma, lung and renal cancer, which I previously discussed in my ASCO 2012 summary. Dr. Feltquate emphasized the depth of responses (many responders are progression free after 2 years) and the unusual kinetics of response (some patients respond after initial alleged progression, some maintain long term responses after very short exposure to the drug).
...
Everybody agrees that results with both nivolumab and MK-3475 are one of the most impressive data sets ever seen with a single drug in solid tumors. The safety profile was also remarkably good, substantially better than that associated with other immunotherapies (Yervoy, high dose IL-2).
...
When asked whether PD-1 antibodies are going to cure metastatic melanoma, Michael Atkins replied: “Yes, in 25% of patients”. To put this in context, patients with metastatic melanoma have a life expectancy of 11-13 months with recently approved drugs (Zelboraf, Yervoy). To date, curing these patients has been either impossible or required complicated, expensive and toxic treatments (e.g. IL-2, TILs). For the first time, patients have a 25% chance of long term remissions with a safe drug that can be simply injected to them at every clinic.
...
***
Cancer und Cure findet man ja nicht so häufig zusammen... wenn sich das bestätigt, wäre PD-1 schon ein sehr großer Fortschritt.
Mich interessiert, wie sich CLDXs CDX-1127 hier verhält. Ohad Hammer ist hier nicht eher zurückhaltend nach dem letzten Kommentar: "I am not sure about CDX-1127 just based on the fact they are not putting a lot of emphasis on it (usually companies say something like “we’re seeing early hints of activity, looking forward to present data at an upcomig medical meeting etc.). CDX-1135 I like more and more". Die Leute bei Celldex haben zuvor u.a. auch PD-1&Co bei Medarex mitentwickelt, bevor diese von BMS übernommen worden sind. CDX-1127 wirkt quasi andersherum wie PD-1, indem zwar nicht die Krebszellen vor dem Immunsystem enttarnt werden, aber das Immunsystem stimuliert wird, so dass sie theoretisch kombiniert werden können. So schlecht hörte sich das zuletzt nicht von denen an... die Kommentare klangen für mich zuversichtlich. Hier steht wohl zunächst auch das Risiko eine Überstimulation mit fatalen Folgen im Vordergrund... bisher sieht da alles okay aus.
Gruß
ipollit
http://www.orf-blog.com/major-trends-in-cancer-drug-developm…
...
Atkins, who has been a strong advocate of immunotherapy before it became so popular, emphasized that there are probably baseline parameters that dictate whether a patient responds to immune checkpoint inhibitors or not. A lot of it has to do with the microenvironment of the tumor including infiltration of immune cells and the various mechanisms cancer cells use to evade the immune system. This “immunogenic profile” can explain the dramatic variability in response to immunotherapy (some patients can be cured while others are inherently resistant).
4 PD1 programs were presented: BMS’s (BMY) nivolumab (anti-PD1), Merck’s (MRK) MK-3475 (anti-PD1), Genentech’s MPDL3280A (anti PD-L1) and GSK (GSK)/Amplimmune’s AMP-224 (PD-L2-Fc fusion). The first 2 are in late stage development based on positive phase I data. The other two are still in phase I and initial data are expected this year.
...
Nivolumab demonstrated remarkable activity in melanoma, lung and renal cancer, which I previously discussed in my ASCO 2012 summary. Dr. Feltquate emphasized the depth of responses (many responders are progression free after 2 years) and the unusual kinetics of response (some patients respond after initial alleged progression, some maintain long term responses after very short exposure to the drug).
...
Everybody agrees that results with both nivolumab and MK-3475 are one of the most impressive data sets ever seen with a single drug in solid tumors. The safety profile was also remarkably good, substantially better than that associated with other immunotherapies (Yervoy, high dose IL-2).
...
When asked whether PD-1 antibodies are going to cure metastatic melanoma, Michael Atkins replied: “Yes, in 25% of patients”. To put this in context, patients with metastatic melanoma have a life expectancy of 11-13 months with recently approved drugs (Zelboraf, Yervoy). To date, curing these patients has been either impossible or required complicated, expensive and toxic treatments (e.g. IL-2, TILs). For the first time, patients have a 25% chance of long term remissions with a safe drug that can be simply injected to them at every clinic.
...
***
Cancer und Cure findet man ja nicht so häufig zusammen... wenn sich das bestätigt, wäre PD-1 schon ein sehr großer Fortschritt.
Mich interessiert, wie sich CLDXs CDX-1127 hier verhält. Ohad Hammer ist hier nicht eher zurückhaltend nach dem letzten Kommentar: "I am not sure about CDX-1127 just based on the fact they are not putting a lot of emphasis on it (usually companies say something like “we’re seeing early hints of activity, looking forward to present data at an upcomig medical meeting etc.). CDX-1135 I like more and more". Die Leute bei Celldex haben zuvor u.a. auch PD-1&Co bei Medarex mitentwickelt, bevor diese von BMS übernommen worden sind. CDX-1127 wirkt quasi andersherum wie PD-1, indem zwar nicht die Krebszellen vor dem Immunsystem enttarnt werden, aber das Immunsystem stimuliert wird, so dass sie theoretisch kombiniert werden können. So schlecht hörte sich das zuletzt nicht von denen an... die Kommentare klangen für mich zuversichtlich. Hier steht wohl zunächst auch das Risiko eine Überstimulation mit fatalen Folgen im Vordergrund... bisher sieht da alles okay aus.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.279.281 von ipollit am 20.03.13 23:48:10PCYC
gestern mit einem heftigen Einbruch. Kann keinen Sachgrund entdecken.
Wenn es charttechnischer Unfug ist, was da passiert, gehts vielleicht auf 70?
Wäre ja spannend, um die Position wieder auszubauen!
gestern mit einem heftigen Einbruch. Kann keinen Sachgrund entdecken.
Wenn es charttechnischer Unfug ist, was da passiert, gehts vielleicht auf 70?
Wäre ja spannend, um die Position wieder auszubauen!
Antwort auf Beitrag Nr.: 44.279.281 von ipollit am 20.03.13 23:48:10dann ist wedbush wohl ein kontraindikator.
zwei tage nach der Empfehlung handelt pcyc 15% tiefer.
zwei tage nach der Empfehlung handelt pcyc 15% tiefer.
Antwort auf Beitrag Nr.: 44.287.783 von steven_trader am 22.03.13 17:22:49Hallo steven, ist schon krass, wie da abverkauft wurde. In der Sache hat Wedbush aber wohl recht, denke ich. Ibrutinib wird wahrscheinlich der Überhammer werden.
Was mich fast schon aggressiv macht, ist die Unklarheit über die wirkliche Bedeutung des breakthrough-Status.
Ich frage mich, wann die FDA und die betroffenen Unternehmen hier mal den Nebel lüften und den Anlegern klar und deutlich sagen, mit welchen Trials man zu einer Zulassung kommen kann und welche Qualität die dann hat.
Was mich fast schon aggressiv macht, ist die Unklarheit über die wirkliche Bedeutung des breakthrough-Status.
Ich frage mich, wann die FDA und die betroffenen Unternehmen hier mal den Nebel lüften und den Anlegern klar und deutlich sagen, mit welchen Trials man zu einer Zulassung kommen kann und welche Qualität die dann hat.
Bei Array sieht es ja wieder ganz gut aus. Ein Analyst hat sich gestern positiv geäußert (undervalued) und sieht ein Kursziel von 7 US$.

Die fundamentale Analyse und die Charttechnik mal Hand in Hand. Zumindest war das Timing für die Analyse gut gewählt , da der Ausbruch unmittelbar bevorstand und nun ziemlich eindeutig gelang.
, da der Ausbruch unmittelbar bevorstand und nun ziemlich eindeutig gelang.
Die fundamentale Analyse und die Charttechnik mal Hand in Hand. Zumindest war das Timing für die Analyse gut gewählt
 , da der Ausbruch unmittelbar bevorstand und nun ziemlich eindeutig gelang.
, da der Ausbruch unmittelbar bevorstand und nun ziemlich eindeutig gelang.
Antwort auf Beitrag Nr.: 44.307.307 von kmastra am 26.03.13 18:42:58Ja, eine erfreuliche Entwicklung. Merkwürdig, dass der Markt manchmal den Anstoß durch ein unwichtiges Ereignis wie einen Analystenkommentar zu brauchen scheint.
Array selbst hat schon letzte Woche die Verpflichtung eines Chief Medical Officer gemeldet und zwar eines gewissen Dr. Needle (kein Witz, er heißt wirklich so!).
Der Lebenslauf klingt beeindruckend.
Wenn man das liest, könnte man glauben, dass Array hier ein Schwergewicht für sich gewinnen konnte. Würde so ein Mann an Bord kommen, wenn er nicht der Meinung wäre, dass Arry520 und Arry614 wirklich vielversprechende Kandidaten sind?
Dr. Needle has more than 14 years of pharmaceutical industry experience in drug development and regulatory affairs. During this time, he has built an extensive network of key opinion leaders, business leaders at top biotechnology and pharmaceutical companies, medical leaders at academic centers and the FDA. Furthermore, Dr. Needle's deep industry experience includes prominent roles on the development of important oncology and hematology drugs including Erbitux® (cetuximab), Revlimid® (lenalidomide) and Pomalyst® (pomolidimide). He most recently served as the Chief Medical Officer of the Multiple Myeloma Research Foundation and Consortium (MMRF). Prior to his tenure at MMRF, he held multiple Vice President level positions at Celgene in Clinical Research and Development in Oncology, Strategic Medical Business Development, and Pediatric Strategy. Dr. Needle also served as the Vice President of Clinical Affairs at ImClone Systems Incorporated. Dr. Needle did his fellowship in Pediatric Hematology / Oncology at the Children's Hospital Medical Center and the Fred Hutchinson Cancer Research Center of the University of Washington in Seattle and the University of Texas M.D. Anderson Cancer Center in Houston. Dr. Needle has held faculty positions at the University of Pennsylvania and Columbia University. Dr. Needle graduated from Binghamton University with a Bachelor of Arts in Physics and received his medical degree from SUNY Downstate Medical Center, in Brooklyn, New York.
Array selbst hat schon letzte Woche die Verpflichtung eines Chief Medical Officer gemeldet und zwar eines gewissen Dr. Needle (kein Witz, er heißt wirklich so!).
Der Lebenslauf klingt beeindruckend.
Wenn man das liest, könnte man glauben, dass Array hier ein Schwergewicht für sich gewinnen konnte. Würde so ein Mann an Bord kommen, wenn er nicht der Meinung wäre, dass Arry520 und Arry614 wirklich vielversprechende Kandidaten sind?
Dr. Needle has more than 14 years of pharmaceutical industry experience in drug development and regulatory affairs. During this time, he has built an extensive network of key opinion leaders, business leaders at top biotechnology and pharmaceutical companies, medical leaders at academic centers and the FDA. Furthermore, Dr. Needle's deep industry experience includes prominent roles on the development of important oncology and hematology drugs including Erbitux® (cetuximab), Revlimid® (lenalidomide) and Pomalyst® (pomolidimide). He most recently served as the Chief Medical Officer of the Multiple Myeloma Research Foundation and Consortium (MMRF). Prior to his tenure at MMRF, he held multiple Vice President level positions at Celgene in Clinical Research and Development in Oncology, Strategic Medical Business Development, and Pediatric Strategy. Dr. Needle also served as the Vice President of Clinical Affairs at ImClone Systems Incorporated. Dr. Needle did his fellowship in Pediatric Hematology / Oncology at the Children's Hospital Medical Center and the Fred Hutchinson Cancer Research Center of the University of Washington in Seattle and the University of Texas M.D. Anderson Cancer Center in Houston. Dr. Needle has held faculty positions at the University of Pennsylvania and Columbia University. Dr. Needle graduated from Binghamton University with a Bachelor of Arts in Physics and received his medical degree from SUNY Downstate Medical Center, in Brooklyn, New York.
Dafür Ariad mit ausgeprägter Schwächephase.
Die Bewertung ist noch immer hoch, aber das Unternehmen ist erstklassig.
Bei 2,5 Mrd. würde ich ins Grübeln kommen, schrieb ich vor Monaten. Ex-Cash sind wir da fast.
Ich grübele also. Wer noch?
Die Bewertung ist noch immer hoch, aber das Unternehmen ist erstklassig.
Bei 2,5 Mrd. würde ich ins Grübeln kommen, schrieb ich vor Monaten. Ex-Cash sind wir da fast.
Ich grübele also. Wer noch?
Antwort auf Beitrag Nr.: 44.309.099 von SLGramann am 26.03.13 22:16:53Ist das bei Array die nächste KE? Wenn ich das richtig verstehe haben die zumindest die Option auf 75 Mio gesichert. So richtig versteh ich`s wenn nicht.
http://biz.yahoo.com/e/130327/arry8-k.html
Bzgl. Ariad hat sich heute Herr Feuerstein geäußert:
http://www.thestreet.com/story/11881472/1/ariad-pharma-falls…
http://biz.yahoo.com/e/130327/arry8-k.html
Bzgl. Ariad hat sich heute Herr Feuerstein geäußert:
http://www.thestreet.com/story/11881472/1/ariad-pharma-falls…
Antwort auf Beitrag Nr.: 44.319.045 von kmastra am 27.03.13 23:26:57@kmastra, Du verstehst es richtig. Array hat jetzt die Option, Aktien für 75 Mio. an Cantor abzugeben, die das dann am Markt plazieren würden.
Angemeldet wurde das bereits mit dem "shelf-file" vom Januar, was so eine Art Genehmigung von KEs auf Vorrat darstellt.
Jetzt wirds konkreter.
Ich gehe davon aus, dass der Deal mit Cantor in absehbarer Zukunft auch realisiert werden wird.
Schlimm finde ich das nicht. Eines Tages sollte Array 520 und/oder 614 verpartnern - aber eben so spät wie möglich und ohne Abgabe der US-Rechte. Bis dahin muss man einfach selbst noch ne Menge Geld investieren.
ARIA: Interessant, der Artikel von Feuerstein. Für AP26113 beginnen schon dieses Jahr pivotal-Trials (parallel zur PII). Ich kann mir vorstellen, dass Iclusig in einem Jahr gar nicht mehr im Zentrum der Aufmerksamkeit stehen wird.
Bis dahin könnte es aber vielleicht einen weiteren Kursrutsch geben, wenn die Iclusig-Sales zunächst mal die hohen Erwartungen enttäuschen und außerdem binnen der nächsten 12 Monate meiner Meinung nach eine weitere große KE erforderlich wird.
Angemeldet wurde das bereits mit dem "shelf-file" vom Januar, was so eine Art Genehmigung von KEs auf Vorrat darstellt.
Jetzt wirds konkreter.
Ich gehe davon aus, dass der Deal mit Cantor in absehbarer Zukunft auch realisiert werden wird.
Schlimm finde ich das nicht. Eines Tages sollte Array 520 und/oder 614 verpartnern - aber eben so spät wie möglich und ohne Abgabe der US-Rechte. Bis dahin muss man einfach selbst noch ne Menge Geld investieren.
ARIA: Interessant, der Artikel von Feuerstein. Für AP26113 beginnen schon dieses Jahr pivotal-Trials (parallel zur PII). Ich kann mir vorstellen, dass Iclusig in einem Jahr gar nicht mehr im Zentrum der Aufmerksamkeit stehen wird.
Bis dahin könnte es aber vielleicht einen weiteren Kursrutsch geben, wenn die Iclusig-Sales zunächst mal die hohen Erwartungen enttäuschen und außerdem binnen der nächsten 12 Monate meiner Meinung nach eine weitere große KE erforderlich wird.
Antwort auf Beitrag Nr.: 44.319.591 von SLGramann am 28.03.13 07:32:04Ja, der Markt hat es ja ganz entspannt aufgenommen. Wäre trotzdem schön, wenn sie da nicht bei gehen müssten. Hab noch einen Artikel oder ist es ein Schulreferat  zu ARRY gefunden:
zu ARRY gefunden:
http://seekingalpha.com/article/1305131-array-biopharma-an-e…" target="_blank" rel="nofollow ugc noopener">http://seekingalpha.com/article/1305131-array-biopharma-an-e…
Darin steht sinngemäß, dass ARRY Schulden um die 100 Mio hat, die sofort fällig würden, wenn ARRY am Quartalsende unter 20 Mio Cash hat. Von daher ist die KE verständlich.
Ansonsten ist das ein typischer SA Artikel, der nur so vor Ungereimtheiten strotzt...wobei ein Ebit von über 600 Mio in 2020 fänd ich ja gut!
 zu ARRY gefunden:
zu ARRY gefunden:http://seekingalpha.com/article/1305131-array-biopharma-an-e…" target="_blank" rel="nofollow ugc noopener">http://seekingalpha.com/article/1305131-array-biopharma-an-e…
Darin steht sinngemäß, dass ARRY Schulden um die 100 Mio hat, die sofort fällig würden, wenn ARRY am Quartalsende unter 20 Mio Cash hat. Von daher ist die KE verständlich.
Ansonsten ist das ein typischer SA Artikel, der nur so vor Ungereimtheiten strotzt...wobei ein Ebit von über 600 Mio in 2020 fänd ich ja gut!
neues von Genmab:
(ich gehe davon aus, dass noch dieses Jahr ein pivotal-Trial beginnen wird - Zulassung dann schon Ende 2014/Anfang 2015?)
Daratumumab Granted Fast Track Designation from US Food and Drug
Administration
Genmab A/S Tel: +45 7020 2728 Company Announcement no. 12
Bredgade 34E Fax: +45 7020 2729 Page 1/2
1260 Copenhagen K, Denmark www.genmab.com CVR no. 2102 3884
Company Announcement
Daratumumab receives Fast Track designation in double refractory multiple myeloma
Potential for expedited development
Copenhagen, Denmark; April 2, 2013 – Genmab A/S (OMX: GEN) announced today that the US Food and Drug Administration (FDA) has granted Fast Track designation for daratumumab. This
designation covers patients with multiple myeloma who have received at least three prior lines of therapy
including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or are double refractory to a
PI and an IMiD.
“Fast Track designation for daratumumab means that the FDA recognizes the potential of daratumumab
to fill an unmet medical need in multiple myeloma, and that we may be able to reduce the development
time and expedite review of the product,” said Jan van de Winkel, Ph.D., Chief Executive Officer of
Genmab.
In August 2012, Genmab granted Janssen Biotech, Inc. an exclusive worldwide license to develop and
commercialize daratumumab.
About Fast Track designation
Fast Track designation is intended to facilitate the development and expedite the review of drugs
intended for the treatment of serious conditions and fill an unmet medical need. This designation will
enable more frequent interactions with the FDA during drug development. In addition, portions of
marketing applications for drugs with Fast Track designation can be submitted before a complete
application is submitted, known as rolling review.
(ich gehe davon aus, dass noch dieses Jahr ein pivotal-Trial beginnen wird - Zulassung dann schon Ende 2014/Anfang 2015?)
Daratumumab Granted Fast Track Designation from US Food and Drug
Administration
Genmab A/S Tel: +45 7020 2728 Company Announcement no. 12
Bredgade 34E Fax: +45 7020 2729 Page 1/2
1260 Copenhagen K, Denmark www.genmab.com CVR no. 2102 3884
Company Announcement
Daratumumab receives Fast Track designation in double refractory multiple myeloma
Potential for expedited development
Copenhagen, Denmark; April 2, 2013 – Genmab A/S (OMX: GEN) announced today that the US Food and Drug Administration (FDA) has granted Fast Track designation for daratumumab. This
designation covers patients with multiple myeloma who have received at least three prior lines of therapy
including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or are double refractory to a
PI and an IMiD.
“Fast Track designation for daratumumab means that the FDA recognizes the potential of daratumumab
to fill an unmet medical need in multiple myeloma, and that we may be able to reduce the development
time and expedite review of the product,” said Jan van de Winkel, Ph.D., Chief Executive Officer of
Genmab.
In August 2012, Genmab granted Janssen Biotech, Inc. an exclusive worldwide license to develop and
commercialize daratumumab.
About Fast Track designation
Fast Track designation is intended to facilitate the development and expedite the review of drugs
intended for the treatment of serious conditions and fill an unmet medical need. This designation will
enable more frequent interactions with the FDA during drug development. In addition, portions of
marketing applications for drugs with Fast Track designation can be submitted before a complete
application is submitted, known as rolling review.
Habe seit einiger Zeit Immunomedics auf dem Radar. Breite Pipeline mit einem Phase III Kandidaten zum Spottpreis. Hat sich jemand diesen Wert mal angeschaut?
Antwort auf Beitrag Nr.: 44.357.905 von BiotechHype am 03.04.13 21:26:42Hab ich auch auf meiner watch. Sind auch im Bereich Antikörper Konjugate unterwegs. Was mich bisher vom investment abhielt, ist die Tatsache, dass es kaum Interesse an der Technologie von Immunomedics zu geben scheint. Das wirft doch Fragen auf. Andere Anbieter wie Immunogen oder Seattle genetics stehen da ganz anders davor.


Auch eine SGEN war mal bei USD 2,60...
Habe gestern OGXI mit Verlust aussortiert und dafür IMMU gekauft. Sollte sich auf Sicht von 12 Monaten auszahlen. Epratuzumab in Lupus wird hier der Antreiber werden. So hoffe ich zumindest...
Diese Pipeline und 50 Mio Cash zum Preis von 200 Mio ist lächerlich.
Habe gestern OGXI mit Verlust aussortiert und dafür IMMU gekauft. Sollte sich auf Sicht von 12 Monaten auszahlen. Epratuzumab in Lupus wird hier der Antreiber werden. So hoffe ich zumindest...
Diese Pipeline und 50 Mio Cash zum Preis von 200 Mio ist lächerlich.
Array mit einem Update zu Arry-520:
Array BioPharma Announces Updates on ARRY-520 Clinical Data at the 2013 International Myeloma Workshop
BOULDER, Colo., April 4, 2013 /PRNewswire via COMTEX/ --Array BioPharma Inc. (NASDAQ: ARRY) today announced that results from two ongoing ARRY-520 clinical trials in multiple myeloma (MM) were presented at the 2013 International Myeloma Workshop in Kyoto, Japan. ARRY-520 is a potent, selective KSP inhibitor with a mechanism of action distinct from other drugs used to treat MM that continues to advance in clinical trials.
Results on the following trials presented at the meeting include:
ARRY-520 Single Agent Clinical Trial in Patients with Relapsed or Refractory Multiple Myeloma (MM) (Protocol # ARRAY-520-212)
ARRY-520 demonstrated single agent activity in heavily pretreated patients, with 19 months median Overall Survival and a 16% Overall Response Rate. These results are similar to those for recently approved products Kyprolis® (carfilzomib) and Pomalyst® (pomalidomide) as single agents in a similar patient population.
ARRY-520 was generally well tolerated, with the predominant adverse events being transient and non-cumulative neutropenia and thrombocytopenia that were readily managed with growth factors and supportive care.
Consistent with other reported ARRY-520 study results, there was a low-incidence of non-hematologic adverse events with no treatment-related neuropathy observed.
Further data on a potential patient selection marker was also presented. Patients with normal levels of alpha-1-acid glycoprotein (AAG) had a longer median Overall Survival (20.2 months vs 4.5 months), improved median Event Free Survival (5.3 months vs. 2.4 months) and greater Overall Response Rate (24% vs 0%) compared to patients with elevated AAG. The identification of this marker may enable more precise targeting of patient populations who will benefit from ARRY-520.
--------------
Ich verstehe das so, dass das die Daten ohne low dose dex sind. Hier heißt es weiter warten, denn die werden entscheidend sein.
Nach wie vor finde ich die Daten mit Selektion nach AAG einfach Hammer. Ich denke, dass man in einem pivotal-Trial entsprechend selektieren sollte. Würde mich sehr wundern, wenn das die Chance auf ein gutes Ergebnis nicht deutlich erhöhen würde!
Array BioPharma Announces Updates on ARRY-520 Clinical Data at the 2013 International Myeloma Workshop
BOULDER, Colo., April 4, 2013 /PRNewswire via COMTEX/ --Array BioPharma Inc. (NASDAQ: ARRY) today announced that results from two ongoing ARRY-520 clinical trials in multiple myeloma (MM) were presented at the 2013 International Myeloma Workshop in Kyoto, Japan. ARRY-520 is a potent, selective KSP inhibitor with a mechanism of action distinct from other drugs used to treat MM that continues to advance in clinical trials.
Results on the following trials presented at the meeting include:
ARRY-520 Single Agent Clinical Trial in Patients with Relapsed or Refractory Multiple Myeloma (MM) (Protocol # ARRAY-520-212)
ARRY-520 demonstrated single agent activity in heavily pretreated patients, with 19 months median Overall Survival and a 16% Overall Response Rate. These results are similar to those for recently approved products Kyprolis® (carfilzomib) and Pomalyst® (pomalidomide) as single agents in a similar patient population.
ARRY-520 was generally well tolerated, with the predominant adverse events being transient and non-cumulative neutropenia and thrombocytopenia that were readily managed with growth factors and supportive care.
Consistent with other reported ARRY-520 study results, there was a low-incidence of non-hematologic adverse events with no treatment-related neuropathy observed.
Further data on a potential patient selection marker was also presented. Patients with normal levels of alpha-1-acid glycoprotein (AAG) had a longer median Overall Survival (20.2 months vs 4.5 months), improved median Event Free Survival (5.3 months vs. 2.4 months) and greater Overall Response Rate (24% vs 0%) compared to patients with elevated AAG. The identification of this marker may enable more precise targeting of patient populations who will benefit from ARRY-520.
--------------
Ich verstehe das so, dass das die Daten ohne low dose dex sind. Hier heißt es weiter warten, denn die werden entscheidend sein.
Nach wie vor finde ich die Daten mit Selektion nach AAG einfach Hammer. Ich denke, dass man in einem pivotal-Trial entsprechend selektieren sollte. Würde mich sehr wundern, wenn das die Chance auf ein gutes Ergebnis nicht deutlich erhöhen würde!
Antwort auf Beitrag Nr.: 44.357.905 von BiotechHype am 03.04.13 21:26:42Immunomedics hat auch eine ganze Menge kleiner Studien laufen, die sie selbst finanzieren (also nicht UCB oder Nycomed). Ich frage mich, wie sie das mit einem Cashburn von nur 6M/Q darstellen wollen. Cashzuflüsse in nächster Zeit sehe ich (beim überflugsmäßiger Recherche) nicht. Ist da übers 2013/14 mit weiteren Kapitalmaßnahmen zu rechnen?
Hallo Leute!
Was sind denn eure Biotech-Favoriten für dir nächsten 12 Monate?
Suche 3 bis 5 Werte.
Was sind denn eure Biotech-Favoriten für dir nächsten 12 Monate?
Suche 3 bis 5 Werte.
Zunächst mal hat IMMU aktuell Cash für weitere 6-7 Quartale. In der Rechnung sind keinerlei Milestones oder weitere Auslizensierungen enthalten. Mit einer Kapitalmaßnahme muss man bei Biotechs in dieser Größenordnung immer rechnen. Allerdings muss man auch sagen, dass Phase I Studien jetzt nicht unbedingt die Kostentreiber sind. Man erkennt auch die Strategie, dass mit zunehmendem Studienfortschritt eine Verpartnerung angestrebt wird. Nycomed und UCB sind schon an Bord. Ich denke, dass weitere folgen werden. Trotzdem hoffe ich, dass nicht alle Produktkandidaten verpartnert werden, denn die unverpartnerten Projekte werden das große Geld in die Kasse spülen. Aber das ist Zukunftsmusik...




Antwort auf Beitrag Nr.: 44.368.347 von BiotechHype am 05.04.13 09:29:06IMMU gefällt mir auf den 1. Blick nicht schecht, leider habe sie keine Fotos vom Management auf ihrer HP, ich schau mir immer gern die Bilder an von den Leuten, denen ich mein Geld anvertraue.
Habe gesehen, dass die auch ein Adresse in Darmstadt haben, was läuft eigentlich dort ??
Habe gesehen, dass die auch ein Adresse in Darmstadt haben, was läuft eigentlich dort ??
PCYC:
mit der nächsten breakthrough für Ibrutinib:
SUNNYVALE, Calif., April 8, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) announced today that the U.S. Food and Drug Administration (FDA) has granted an additional Breakthrough Therapy Designation for the investigational oral agent ibrutinib as monotherapy for the treatment of chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) patients with deletion of the short arm of chromosome 17 (deletion 17p). Patients harboring a deletion within chromosome 17 generally have poor response to chemoimmunotherapy and have limited treatment options. The presence of deletion 17p is one of the worst prognostic factors in patients with CLL.
In February 2013, FDA granted Breakthrough Therapy Designations for ibrutinib as a monotherapy for the treatment of patients with relapsed or refractory mantle cell lymphoma (MCL) and as a monotherapy for the treatment of patients with Waldenstrom's macroglobulinemia (WM), both of which are also B-cell malignancies. Ibrutinib is jointly being developed by Pharmacyclics and Janssen for treatment of B-cell malignancies.
The Breakthrough Therapy Designation is intended to expedite the development and review of a potential new drug for serious or life-threatening diseases where "preliminary clinical evidence indicates that the drug may demonstrate substantial improvement over existing therapies on one or more clinically significant endpoints, such as substantial treatment effects observed early in clinical development." The designation of a drug as a Breakthrough Therapy was enacted as part of the 2012 Food and Drug Administration Safety and Innovation Act. Pharmacyclics, together with Janssen, is working with the FDA to determine the implications of this Breakthrough Therapy Designation to the ongoing and planned development and the FDA filing requirements for the use of ibrutinib in CLL patients with deletion 17p.
The FDA Breakthrough Therapy Designation for ibrutinib in CLL patients with deletion 17p was based on data from pre-clinical and clinical studies where ibrutinib as a monotherapy was used to treat patients with this disease. Ibrutinib has the potential to improve the outcome in this serious and life-threatening disease which has a poor prognosis. In addition, Pharmacyclics and Janssen have recently initiated a Phase II study of ibrutinib in patients with CLL deletion 17p, RESONATE™ -17, which is a single-arm, open-label, multi-center trial using ibrutinib as a monotherapy in patients who have deletion 17p and who did not respond to or relapsed after at least one prior CLL treatment (a high unmet need population). The primary endpoint of the study will be overall response rate. This global study opened this year and Pharmacyclics plans to enroll 111 patients worldwide.
-----
Wie immmer dieser kryptische Satz:
Pharmacyclics, together with Janssen, is working with the FDA to determine the implications of this Breakthrough Therapy Designation to the ongoing and planned development and the FDA filing requirements
Die müssen doch wissen, was die damit meinen und wollen, die Mädels von der FDA?!
Aber diesmal lesen wir ja auch das:
Pharmacyclics and Janssen have recently initiated a Phase II study of ibrutinib in patients with CLL deletion 17p, RESONATE™ -17, which is a single-arm, open-label, multi-center trial using ibrutinib as a monotherapy in patients who have deletion 17p and who did not respond to or relapsed after at least one prior CLL treatment (a high unmet need population). The primary endpoint of the study will be overall response rate. This global study opened this year and Pharmacyclics plans to enroll 111 patients worldwide
Ich denke, das ist es in dieser Indikation.
PS: Herzlichen Glückwunsch an die Deppen, die zuletzt den Kurs abverkauft haben. Da sehen wirklich einige das große Bild nicht.
Die Marktkapitalisierung von PCYC dürfte deutlich zu niedrig sein.
mit der nächsten breakthrough für Ibrutinib:
SUNNYVALE, Calif., April 8, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) announced today that the U.S. Food and Drug Administration (FDA) has granted an additional Breakthrough Therapy Designation for the investigational oral agent ibrutinib as monotherapy for the treatment of chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) patients with deletion of the short arm of chromosome 17 (deletion 17p). Patients harboring a deletion within chromosome 17 generally have poor response to chemoimmunotherapy and have limited treatment options. The presence of deletion 17p is one of the worst prognostic factors in patients with CLL.
In February 2013, FDA granted Breakthrough Therapy Designations for ibrutinib as a monotherapy for the treatment of patients with relapsed or refractory mantle cell lymphoma (MCL) and as a monotherapy for the treatment of patients with Waldenstrom's macroglobulinemia (WM), both of which are also B-cell malignancies. Ibrutinib is jointly being developed by Pharmacyclics and Janssen for treatment of B-cell malignancies.
The Breakthrough Therapy Designation is intended to expedite the development and review of a potential new drug for serious or life-threatening diseases where "preliminary clinical evidence indicates that the drug may demonstrate substantial improvement over existing therapies on one or more clinically significant endpoints, such as substantial treatment effects observed early in clinical development." The designation of a drug as a Breakthrough Therapy was enacted as part of the 2012 Food and Drug Administration Safety and Innovation Act. Pharmacyclics, together with Janssen, is working with the FDA to determine the implications of this Breakthrough Therapy Designation to the ongoing and planned development and the FDA filing requirements for the use of ibrutinib in CLL patients with deletion 17p.
The FDA Breakthrough Therapy Designation for ibrutinib in CLL patients with deletion 17p was based on data from pre-clinical and clinical studies where ibrutinib as a monotherapy was used to treat patients with this disease. Ibrutinib has the potential to improve the outcome in this serious and life-threatening disease which has a poor prognosis. In addition, Pharmacyclics and Janssen have recently initiated a Phase II study of ibrutinib in patients with CLL deletion 17p, RESONATE™ -17, which is a single-arm, open-label, multi-center trial using ibrutinib as a monotherapy in patients who have deletion 17p and who did not respond to or relapsed after at least one prior CLL treatment (a high unmet need population). The primary endpoint of the study will be overall response rate. This global study opened this year and Pharmacyclics plans to enroll 111 patients worldwide.
-----
Wie immmer dieser kryptische Satz:
Pharmacyclics, together with Janssen, is working with the FDA to determine the implications of this Breakthrough Therapy Designation to the ongoing and planned development and the FDA filing requirements
Die müssen doch wissen, was die damit meinen und wollen, die Mädels von der FDA?!
Aber diesmal lesen wir ja auch das:
Pharmacyclics and Janssen have recently initiated a Phase II study of ibrutinib in patients with CLL deletion 17p, RESONATE™ -17, which is a single-arm, open-label, multi-center trial using ibrutinib as a monotherapy in patients who have deletion 17p and who did not respond to or relapsed after at least one prior CLL treatment (a high unmet need population). The primary endpoint of the study will be overall response rate. This global study opened this year and Pharmacyclics plans to enroll 111 patients worldwide
Ich denke, das ist es in dieser Indikation.
PS: Herzlichen Glückwunsch an die Deppen, die zuletzt den Kurs abverkauft haben. Da sehen wirklich einige das große Bild nicht.
Die Marktkapitalisierung von PCYC dürfte deutlich zu niedrig sein.
Antwort auf Beitrag Nr.: 44.385.873 von SLGramann am 08.04.13 15:39:35Ist aber schon extrem gut gelaufen, da geht doch nichts mehr!
Meine kürzlich erworbene REGN-Posi und die etwas ältere IMGN habe ich heute in Genmab-Aktien getauscht (wegen Daratumumab natürlich).
@ThorVestor, das ist ausdrücklich keine Empfehlung (Du hast eh das falsche Profilbild... )
)
@ThorVestor, das ist ausdrücklich keine Empfehlung (Du hast eh das falsche Profilbild...
 )
)
Antwort auf Beitrag Nr.: 44.385.873 von SLGramann am 08.04.13 15:39:35Gemeint sein muss dieser Trial:
http://clinicaltrials.gov/ct2/results?term=NCT01744691&Searc…
Verstehe allerdings nicht, warum das mit so wenig Patienten und diesem Endpunkt bis 2016 dauern soll.
Ich kann mir gut vorstellen, dass man hier mehr Dampf macht und schneller zu Ergebnissen kommt, jetzt wo man den breaktrough-Status hat.
Mal sehen, ob die Timeline irgendwann verkürzt wird.
http://clinicaltrials.gov/ct2/results?term=NCT01744691&Searc…
Verstehe allerdings nicht, warum das mit so wenig Patienten und diesem Endpunkt bis 2016 dauern soll.
Ich kann mir gut vorstellen, dass man hier mehr Dampf macht und schneller zu Ergebnissen kommt, jetzt wo man den breaktrough-Status hat.
Mal sehen, ob die Timeline irgendwann verkürzt wird.
Antwort auf Beitrag Nr.: 44.387.803 von SLGramann am 08.04.13 19:50:31April 8, 2013
Phase II Ibrutinib Monotherapy Study Shows CLL Patients Achieved Rapid and Sustainable Disease Control Irrespective of Age or High Risk Prognostic Factor
-Nine Ibrutinib Presentations at the American Association of Cancer Research -
SUNNYVALE, Calif., April 8, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) today announced results from a Phase II trial of the investigational oral agent ibrutinib which demonstrated rapid and sustained disease control as a monotherapy in untreated, relapsed and refractory chronic lymphocytic leukemia (CLL) patients, irrespective of characteristics that predict poor outcomes to chemoimmunotherapy.
This study was discussed at today's American Association for Cancer Research (AACR) annual meeting in Washington, DC together in addition to 8 other presentations covering advances in clinical and pre-clinical research with ibrutinib. The Phase II study, which was sponsored by the National Heart, Lung and Blood Institute, included an analysis of two CLL patient cohorts: the elderly, above 65 years of age, (n=24, of which 8 were treatment naive) and the high risk genetic group with a deletion of chromosome 17p (del 17p) (n=29, of which 15 were treatment naive). Many elderly patients with CLL are unable to tolerate aggressive therapies. Patients with deletion of chromosome 17p typically are poor responders to chemoimmunotherapy and have limited treatment options with no standard of care defined. Of all CLL patients enrolled in this trial, 72% had been characterized as Rai stage 3-4, indicating an advance stage, high risk patient population.
The results of the study were presented by lead investigator Adrian Wiestner, M.D., PhD, Hematology Branch, NHLBI, National Institutes of Health. "Ibrutinib was highly efficacious as a single agent in patients with untreated, relapsed and unresponsive CLL, irrespective of their del 17p status," Dr. Wiestner said. "Responses in this study appear to be durable, and results indicate the drug is effective against the disease in lymph nodes, spleen and bone marrow. This is important because existing therapies often fail to effectively eliminate cancer cells in these tissue sites. Targeted therapy for CLL is becoming a reality, and this new approach may greatly improve the lives of patients with this disease."
The study also evaluated in vivo effects of ibrutinib using blood and tissue samples collected before and during treatment. Ibrutinib demonstrated rapid and sustained disease control in blood, lymph nodes, spleen and bone marrow. After 6 months, 95 percent of patients experienced a reduction in lymph node size and all showed reduction in spleen enlargement, with a median reduction of 55 percent. In 26 patients, for whom a bone marrow biopsy was done, tumor infiltration decreased by 82 percent.
The Progression Free Survival probability for these patients at 12 months was estimated to be 94 percent. Most adverse events were mild and manageable and included diarrhea, fatigue and rash, severe events occurred in less than 13 percent of patients.
"We are very pleased with the continued research that is being demonstrated at AACR across 9 different presentations. These advances show the potential breadth of the ibrutinib program and provide further opportunities for us to pursue. We are grateful for the continued support of our collaborators, investigators, patients and shareholders," said Bob Duggan, CEO and chairman of the board.
Ibrutinib has been designated as a FDA Breakthrough Therapy in CLL patients with deletion 17p, based on data from completed Phase I/II clinical studies, where ibrutinib as a monotherapy was used to treat patients with this disease. Ibrutinib has the potential to improve the outcome in this serious and life-threatening disease, and may provide a substantial improvement over existing therapies for this indication.
--------------
Mutig von der FDA wäre es, wenn sie auf der Grundlage dieser Daten einen Zulassungsantrag für die del17p-Patienten anregen würde. Das wäre dann wirklich mal ein "breaktrough"...
Man kann so eine Zulassung ja gern vorläufig erteilen, aber die Patienten haben mit den vorhandenen Medis einfach eine schlechte Prognose und das Nebenwirkungsprofil von Ibrutinib ist besonders günstig. Worauf soll man eigentlich warten?
Phase II Ibrutinib Monotherapy Study Shows CLL Patients Achieved Rapid and Sustainable Disease Control Irrespective of Age or High Risk Prognostic Factor
-Nine Ibrutinib Presentations at the American Association of Cancer Research -
SUNNYVALE, Calif., April 8, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) today announced results from a Phase II trial of the investigational oral agent ibrutinib which demonstrated rapid and sustained disease control as a monotherapy in untreated, relapsed and refractory chronic lymphocytic leukemia (CLL) patients, irrespective of characteristics that predict poor outcomes to chemoimmunotherapy.
This study was discussed at today's American Association for Cancer Research (AACR) annual meeting in Washington, DC together in addition to 8 other presentations covering advances in clinical and pre-clinical research with ibrutinib. The Phase II study, which was sponsored by the National Heart, Lung and Blood Institute, included an analysis of two CLL patient cohorts: the elderly, above 65 years of age, (n=24, of which 8 were treatment naive) and the high risk genetic group with a deletion of chromosome 17p (del 17p) (n=29, of which 15 were treatment naive). Many elderly patients with CLL are unable to tolerate aggressive therapies. Patients with deletion of chromosome 17p typically are poor responders to chemoimmunotherapy and have limited treatment options with no standard of care defined. Of all CLL patients enrolled in this trial, 72% had been characterized as Rai stage 3-4, indicating an advance stage, high risk patient population.
The results of the study were presented by lead investigator Adrian Wiestner, M.D., PhD, Hematology Branch, NHLBI, National Institutes of Health. "Ibrutinib was highly efficacious as a single agent in patients with untreated, relapsed and unresponsive CLL, irrespective of their del 17p status," Dr. Wiestner said. "Responses in this study appear to be durable, and results indicate the drug is effective against the disease in lymph nodes, spleen and bone marrow. This is important because existing therapies often fail to effectively eliminate cancer cells in these tissue sites. Targeted therapy for CLL is becoming a reality, and this new approach may greatly improve the lives of patients with this disease."
The study also evaluated in vivo effects of ibrutinib using blood and tissue samples collected before and during treatment. Ibrutinib demonstrated rapid and sustained disease control in blood, lymph nodes, spleen and bone marrow. After 6 months, 95 percent of patients experienced a reduction in lymph node size and all showed reduction in spleen enlargement, with a median reduction of 55 percent. In 26 patients, for whom a bone marrow biopsy was done, tumor infiltration decreased by 82 percent.
The Progression Free Survival probability for these patients at 12 months was estimated to be 94 percent. Most adverse events were mild and manageable and included diarrhea, fatigue and rash, severe events occurred in less than 13 percent of patients.
"We are very pleased with the continued research that is being demonstrated at AACR across 9 different presentations. These advances show the potential breadth of the ibrutinib program and provide further opportunities for us to pursue. We are grateful for the continued support of our collaborators, investigators, patients and shareholders," said Bob Duggan, CEO and chairman of the board.
Ibrutinib has been designated as a FDA Breakthrough Therapy in CLL patients with deletion 17p, based on data from completed Phase I/II clinical studies, where ibrutinib as a monotherapy was used to treat patients with this disease. Ibrutinib has the potential to improve the outcome in this serious and life-threatening disease, and may provide a substantial improvement over existing therapies for this indication.
--------------
Mutig von der FDA wäre es, wenn sie auf der Grundlage dieser Daten einen Zulassungsantrag für die del17p-Patienten anregen würde. Das wäre dann wirklich mal ein "breaktrough"...
Man kann so eine Zulassung ja gern vorläufig erteilen, aber die Patienten haben mit den vorhandenen Medis einfach eine schlechte Prognose und das Nebenwirkungsprofil von Ibrutinib ist besonders günstig. Worauf soll man eigentlich warten?
Mal was Grundsätzliches: Die ersten Patente von biopharmazeutisch hergestellten Medikamenten sind ja schon abgelaufen. Kennt jemand Beispiele dafür, dass keine Gernerika also Biosimilars nach Ablauf des Patentschutzes auf den Markt kamen bzw. umgekehrt, dass eben welche auf den Markt kamen und die Umsätze der Originale dann einbrachen.
Komme deswegen drauf, da ich in ASTX investiert bin. Hier läuft das Patent zu Dacogen demnächst aus, ohne das Biosimilars in der Mache wären. Ähnliches ist mir zu Vidaza von Celgene bekannt. Ist es gar generell zu aufwändig, diese Biosimilars herzustellen oder wirken die dann gar nicht so gut?
Komme deswegen drauf, da ich in ASTX investiert bin. Hier läuft das Patent zu Dacogen demnächst aus, ohne das Biosimilars in der Mache wären. Ähnliches ist mir zu Vidaza von Celgene bekannt. Ist es gar generell zu aufwändig, diese Biosimilars herzustellen oder wirken die dann gar nicht so gut?
Onyx:
The FDA has endorsed Pfizer's high hopes for the breast cancer drug palbociclib (or PD-0332991), handing out its coveted "breakthrough" drug status after posting some impressive interim results from a mid-stage study tracking progression-free survival among breast cancer patients.
(Onyx hat 8% Royaltie-Anspruch auf diesen wahrscheinlich kommenden Megablockbuster)
The FDA has endorsed Pfizer's high hopes for the breast cancer drug palbociclib (or PD-0332991), handing out its coveted "breakthrough" drug status after posting some impressive interim results from a mid-stage study tracking progression-free survival among breast cancer patients.
(Onyx hat 8% Royaltie-Anspruch auf diesen wahrscheinlich kommenden Megablockbuster)
Antwort auf Beitrag Nr.: 44.398.271 von kmastra am 10.04.13 00:11:28@kmastra,
keine konkrete Antwort, aber eine kleine Annährung an das Thema:
http://www.fiercebiotech.com/story/new-math-biosimilars-send…
Nach meinem Verständnis würde ich mir bei Medikamenten auf Antikörperbasis im Moment recht wenig Sorgen machen.
Bei small molecules dürfte es anders aussehen, vermute ich mal.
keine konkrete Antwort, aber eine kleine Annährung an das Thema:
http://www.fiercebiotech.com/story/new-math-biosimilars-send…
Nach meinem Verständnis würde ich mir bei Medikamenten auf Antikörperbasis im Moment recht wenig Sorgen machen.
Bei small molecules dürfte es anders aussehen, vermute ich mal.
IMMU mit ein paar positiven Nachrichten in den letzten Tagen:
http://finance.yahoo.com/news/immunomedics-announces-clivatu…
http://finance.yahoo.com/news/immunomedics-reports-first-res…
http://finance.yahoo.com/news/immunomedics-develops-t-cell-r…
http://finance.yahoo.com/news/immunomedics-announces-clivatu…
http://finance.yahoo.com/news/immunomedics-reports-first-res…
http://finance.yahoo.com/news/immunomedics-develops-t-cell-r…
Exelixis ist zur Zeit charttechisch interessant. Fundamental ja eh, obwohl es erst 2014 so richtig interessant wird...

Hammer in Bezug auf AVEO:
I plan to add AVEO on Sunday.
Dann dürfte auch ein Artikel zum Thema kommen.
Hammer spekuliert auf einen positiven Entschluss des ODAC-Panel am 02.05.
Er ist von einem positiven Ausgang ja fest überzeugt, hat aber schon mal geschrieben, dass, wenn er sich irrt, der Kursverlust bei 60% zu taxieren sein dürfte.
Auf der anderen Seite halte ich mittelfristig 500% für möglich, wenn Tivozanib dann auch zugelassen würde (klingt sehr viel, würde aber auch "nur" eine Marktkapitalisierung von 1,5 Milliarden Dollar bedeuten, bei einem Produkt, dessen Peak-Sales wahrscheinlich locker bei 500 Mio. liegen dürften).
Sollte man sich einer solchen Spekulation vielleicht doch anschließen?
Zumindest auf der Sachebene haben m.E. die Bullen die besseren Argumente. Wir hatten das Thema hier vor einigen Wochen ja schon einmal.
I plan to add AVEO on Sunday.
Dann dürfte auch ein Artikel zum Thema kommen.
Hammer spekuliert auf einen positiven Entschluss des ODAC-Panel am 02.05.
Er ist von einem positiven Ausgang ja fest überzeugt, hat aber schon mal geschrieben, dass, wenn er sich irrt, der Kursverlust bei 60% zu taxieren sein dürfte.
Auf der anderen Seite halte ich mittelfristig 500% für möglich, wenn Tivozanib dann auch zugelassen würde (klingt sehr viel, würde aber auch "nur" eine Marktkapitalisierung von 1,5 Milliarden Dollar bedeuten, bei einem Produkt, dessen Peak-Sales wahrscheinlich locker bei 500 Mio. liegen dürften).
Sollte man sich einer solchen Spekulation vielleicht doch anschließen?
Zumindest auf der Sachebene haben m.E. die Bullen die besseren Argumente. Wir hatten das Thema hier vor einigen Wochen ja schon einmal.
Antwort auf Beitrag Nr.: 44.424.147 von SLGramann am 13.04.13 09:52:18Korrektur zu den Peak-Sales:
Die Umsätze sind mit Partner Astellas zu teilen, außerdem sind Royalties an Kyowa Hakko Kirin zu zahlen.
Insofern dürfte eine Marktkapitalisierung von 1,5 Milliarden auf mittlere Sicht etwas überoptimistisch sein.
Dennoch denke ich, dass nach einer möglichen Zulassung von Tivozanib Aveo in Richtung der Milliardenschwelle laufen sollte.
Hier das entscheidende Argument für eine mögliche Zulassung
(das Problem ist ja, dass Tivozanib beim OS (scheinbar!) etwas schlechter abgeschnitten hat, als der Vergleichsarm mit Nexavar):
The Tivo-1 study was designed so patients who were on Sorafenib could cross over to Tivozanib at disease progression. For the first 6 months, OS was comparable between the two arms, but then the OS trend line shows a slow separation occurring with Sorafenib outperforming, though not by a statistically significant amount.
But at 6 months, 15% of patients in the Sorafenib arm had already switched to Tivozanib. At 18 months 53% had switched, and by 26 months 67% were on Tivozanib. So was Sorafenib's OS of 29.3 months mostly a result of the efficacy of Sorafenib or Tivozanib?
If Tivozanib reached OS of 28.8 months with minimal crossover compared to the Sorafenib arm, we believe a strong case can be made that Tivozanib contributed the lion's share of Sorafenib's TIVO-1 OS result.
http://seekingalpha.com/instablog/1111530-chris-rees/1746201…
Für mich war diese Argumentation immer sehr gut nachvollziehbar - nur was machen ODAC-Panel und die FDA daraus?
Die Umsätze sind mit Partner Astellas zu teilen, außerdem sind Royalties an Kyowa Hakko Kirin zu zahlen.
Insofern dürfte eine Marktkapitalisierung von 1,5 Milliarden auf mittlere Sicht etwas überoptimistisch sein.
Dennoch denke ich, dass nach einer möglichen Zulassung von Tivozanib Aveo in Richtung der Milliardenschwelle laufen sollte.
Hier das entscheidende Argument für eine mögliche Zulassung
(das Problem ist ja, dass Tivozanib beim OS (scheinbar!) etwas schlechter abgeschnitten hat, als der Vergleichsarm mit Nexavar):
The Tivo-1 study was designed so patients who were on Sorafenib could cross over to Tivozanib at disease progression. For the first 6 months, OS was comparable between the two arms, but then the OS trend line shows a slow separation occurring with Sorafenib outperforming, though not by a statistically significant amount.
But at 6 months, 15% of patients in the Sorafenib arm had already switched to Tivozanib. At 18 months 53% had switched, and by 26 months 67% were on Tivozanib. So was Sorafenib's OS of 29.3 months mostly a result of the efficacy of Sorafenib or Tivozanib?
If Tivozanib reached OS of 28.8 months with minimal crossover compared to the Sorafenib arm, we believe a strong case can be made that Tivozanib contributed the lion's share of Sorafenib's TIVO-1 OS result.
http://seekingalpha.com/instablog/1111530-chris-rees/1746201…
Für mich war diese Argumentation immer sehr gut nachvollziehbar - nur was machen ODAC-Panel und die FDA daraus?
Hallo SLGramann,
ich halte noch eine kleine Position in Aveo, die ich eigentlich als Tradingposition gekauft hatte. Leider ist der Runup ja bisher ausgefallen, so dass ich überlege, sie mit ins Panel zu nehmen.
Von Hammer halte ich eigentlich sehr viel und der ist ja ziemlich optimistisch.
Besonders die Sicherheit/Verträglichkeit scheint ja bei Tivo ganz gut zu sein. Ein CRL kann ich mir eigentlich kaum vorstellen. Höchstens eine Zulassung mit Auflagen. Zum Beispiel dann wenn andere Medikamente nicht vertragen werden.
Zudem waren die Daten zu PFS ja auch ganz gut. Mal sehen ob der Panel der Argumentation zum Crossover folgen kann. Es geht ja auch nicht nur nach OS, oder?
Geht es hier eigentlich um die Zulassung als Erstlinientherapie?
Ein vieleicht hilfreicher Link:
http://seekingalpha.com/article/1289691-why-aveo-pharmaceuti…
ich halte noch eine kleine Position in Aveo, die ich eigentlich als Tradingposition gekauft hatte. Leider ist der Runup ja bisher ausgefallen, so dass ich überlege, sie mit ins Panel zu nehmen.
Von Hammer halte ich eigentlich sehr viel und der ist ja ziemlich optimistisch.
Besonders die Sicherheit/Verträglichkeit scheint ja bei Tivo ganz gut zu sein. Ein CRL kann ich mir eigentlich kaum vorstellen. Höchstens eine Zulassung mit Auflagen. Zum Beispiel dann wenn andere Medikamente nicht vertragen werden.
Zudem waren die Daten zu PFS ja auch ganz gut. Mal sehen ob der Panel der Argumentation zum Crossover folgen kann. Es geht ja auch nicht nur nach OS, oder?
Geht es hier eigentlich um die Zulassung als Erstlinientherapie?
Ein vieleicht hilfreicher Link:
http://seekingalpha.com/article/1289691-why-aveo-pharmaceuti…
Habe derzeit Auxilium Ph. (AUXL) stark auf der Watch.
2 zugelassene Produkte (Testim und Xiaflex)
Steigende Produktumsätze (325-355 Mio Dollar in 2013)
Labelexpanding für Xiaflex in den nächsten Jahren geplant
Marketcap: 800 Mio Dollar
Cash: 450 Mio Dollar
Das Problem:
Experten erwarten für den Hauptumsatzträger Testim einbrechende Umsätze nachdem das Patent zu dem Konkurrenzprodukt Androgel ausläuft. Dies soll im Jahre 2015 geschehen. Die dann auf den Markt kommenden Generika sollen somit auch den Umsatz von Testim beeinflussen. Bis dahin erwartet man Gesamtmarktwachstum und ein Wachstum des Marktanteils, nachdem man GSK als Co-Promotion Partner hinzugezogen hat. Allerdings hat man sich auf diese Situation eingestellt, indem man ausreichende Mittel eingesammelt hat um durch Aquisitonen drohende Umsatzrückgänge aufzufangen. Hier kann man praktisch jederzeit mit einer Übernahme rechnen. Zudem steht Anfang September eine PDUFA-Entscheidung zu Xiaflex an, welche das Anwendungsgebiet erweitern würde. Sehr interessanter Wert - Umsatzwachstum, Aquisitionen, FDA- Entscheidung, Cash und niedrige Bewertung.
2 zugelassene Produkte (Testim und Xiaflex)
Steigende Produktumsätze (325-355 Mio Dollar in 2013)
Labelexpanding für Xiaflex in den nächsten Jahren geplant
Marketcap: 800 Mio Dollar
Cash: 450 Mio Dollar
Das Problem:
Experten erwarten für den Hauptumsatzträger Testim einbrechende Umsätze nachdem das Patent zu dem Konkurrenzprodukt Androgel ausläuft. Dies soll im Jahre 2015 geschehen. Die dann auf den Markt kommenden Generika sollen somit auch den Umsatz von Testim beeinflussen. Bis dahin erwartet man Gesamtmarktwachstum und ein Wachstum des Marktanteils, nachdem man GSK als Co-Promotion Partner hinzugezogen hat. Allerdings hat man sich auf diese Situation eingestellt, indem man ausreichende Mittel eingesammelt hat um durch Aquisitonen drohende Umsatzrückgänge aufzufangen. Hier kann man praktisch jederzeit mit einer Übernahme rechnen. Zudem steht Anfang September eine PDUFA-Entscheidung zu Xiaflex an, welche das Anwendungsgebiet erweitern würde. Sehr interessanter Wert - Umsatzwachstum, Aquisitionen, FDA- Entscheidung, Cash und niedrige Bewertung.
Klingt für mich recht plausibel. Die Wahrscheinlichkeit der Zulassung scheint mir eindeutig höher als eine Ablehnung. Andererseits ginge es wohl weiter nach unten als nach oben. Denke ich gehe ins panel und würde im negativen Fall nachkaufen.
http://www.orf-blog.com/buying-aveo-ahead-of-fda-panel/
http://www.orf-blog.com/buying-aveo-ahead-of-fda-panel/
@SLGramann
mit VRTX hast du offensichtlich sehr gut gelegen...
Treatment with VX-661 and Ivacaftor in a Phase 2 Study Resulted in Statistically Significant Improvements in Lung Function in People with Cystic Fibrosis Who Have Two Copies of the F508del Mutation
-Treatment with combination of VX-661 and ivacaftor for 28 days in two highest dose groups resulted in mean relative increases in lung function (percent predicted FEV1) of 9.0% (p=0.01) and 7.5% (p=0.02) versus placebo -
-VX-661 was generally well-tolerated alone and in combination with ivacaftor-

Gruß
ipollit
mit VRTX hast du offensichtlich sehr gut gelegen...
Treatment with VX-661 and Ivacaftor in a Phase 2 Study Resulted in Statistically Significant Improvements in Lung Function in People with Cystic Fibrosis Who Have Two Copies of the F508del Mutation
-Treatment with combination of VX-661 and ivacaftor for 28 days in two highest dose groups resulted in mean relative increases in lung function (percent predicted FEV1) of 9.0% (p=0.01) and 7.5% (p=0.02) versus placebo -
-VX-661 was generally well-tolerated alone and in combination with ivacaftor-
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.464.807 von ipollit am 18.04.13 22:25:01Hallo ipollit,
nach einem ersten oberflächlichen Blick finde ich die Daten gar nicht sooo toll (bin geradezu enttäuscht) ...
Sollte der Markt heute bestätigen, was da nachbörslich gezockt wurde, zeigt das, dass ich die Materie nicht wirklich verstanden habe.
Gruß
SLG
nach einem ersten oberflächlichen Blick finde ich die Daten gar nicht sooo toll (bin geradezu enttäuscht) ...
Sollte der Markt heute bestätigen, was da nachbörslich gezockt wurde, zeigt das, dass ich die Materie nicht wirklich verstanden habe.

Gruß
SLG
Update:
Habe gestern LPTN gegeben. Im Gegenzug wurde AUXL gekauft. Erhoffe mir hier eine
langfristige Erholung. Das Management schreibt Shareholder Value sehr groß. Der
CEO hat unter seiner Führung schon etliche Firmen an großzügige Bieter veräußern können.
Wenn es ihm auch hier gelingt, dann wäre es ein lohnenswertes Geschäft.
Letzter CC: http://seekingalpha.com/article/1226111-auxilium-pharmaceuti…
Werde meine Position hier zeitnah weiter ausbauen.
Derzeitiges Depot: AMRN, HALO, CYCC, XNPT, IMMU, AUXL
Habe gestern LPTN gegeben. Im Gegenzug wurde AUXL gekauft. Erhoffe mir hier eine
langfristige Erholung. Das Management schreibt Shareholder Value sehr groß. Der
CEO hat unter seiner Führung schon etliche Firmen an großzügige Bieter veräußern können.
Wenn es ihm auch hier gelingt, dann wäre es ein lohnenswertes Geschäft.
Letzter CC: http://seekingalpha.com/article/1226111-auxilium-pharmaceuti…
Werde meine Position hier zeitnah weiter ausbauen.
Derzeitiges Depot: AMRN, HALO, CYCC, XNPT, IMMU, AUXL
PCYC - ahead of schedule:
SUNNYVALE, Calif., April 18, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) announced today that the enrollment target of 350 patients for its Phase III study using ibrutinib monotherapy versus ofatumumab in patients with relapsed or refractory chronic lymphocytic leukemia / small lymphocytic lymphoma (CLL/SLL), (RESONATE™) was achieved on April 3, 2013. As of today, additional 41 patients were screened and are allowed to participate in this study which has now been officially closed to enrollment.
...
We would expect to have a read out from the interim analysis during the 1st quarter 2014. If the treatment effect of ibrutinib in comparison to ofatumumab is deemed statistically favorable by an independent review committee a discussion with the FDA and other health authorities for a potential early filing can take place.
...
Pharmacyclics also announced the completion of enrollment of the planned 110 patients in the Phase II single-arm study using ibrutinib in patients with mantle cell lymphoma (MCL) who progress after bortezomib therapy and have received at least one prior rituximab-containing chemotherapy regimen, SPARK (MCL2001).
...
As previously announced Pharmacyclics expects to file a New Drug Application (NDA) with the FDA for the use of ibrutinib in patients with relapsed or refractory MCL prior to year-end. In the time before a potential U.S. marketing approval Pharmacyclics will strive to provide early access to ibrutinib under an Early Access Program (EAP).
---
Nennt mich hysterisch, aber ich verstehe nicht, warum PCYC noch immer unter 100 Dollar notiert. Alle besoffen.
SUNNYVALE, Calif., April 18, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) announced today that the enrollment target of 350 patients for its Phase III study using ibrutinib monotherapy versus ofatumumab in patients with relapsed or refractory chronic lymphocytic leukemia / small lymphocytic lymphoma (CLL/SLL), (RESONATE™) was achieved on April 3, 2013. As of today, additional 41 patients were screened and are allowed to participate in this study which has now been officially closed to enrollment.
...
We would expect to have a read out from the interim analysis during the 1st quarter 2014. If the treatment effect of ibrutinib in comparison to ofatumumab is deemed statistically favorable by an independent review committee a discussion with the FDA and other health authorities for a potential early filing can take place.
...
Pharmacyclics also announced the completion of enrollment of the planned 110 patients in the Phase II single-arm study using ibrutinib in patients with mantle cell lymphoma (MCL) who progress after bortezomib therapy and have received at least one prior rituximab-containing chemotherapy regimen, SPARK (MCL2001).
...
As previously announced Pharmacyclics expects to file a New Drug Application (NDA) with the FDA for the use of ibrutinib in patients with relapsed or refractory MCL prior to year-end. In the time before a potential U.S. marketing approval Pharmacyclics will strive to provide early access to ibrutinib under an Early Access Program (EAP).
---
Nennt mich hysterisch, aber ich verstehe nicht, warum PCYC noch immer unter 100 Dollar notiert. Alle besoffen.
Eine Fundgrube für alle Charttechnisch interessierten Anleger:
http://www.biotechinvestorsnetwork.com/#!charts/c1my0
Reiter auf none (all stocks) stellen.
http://www.biotechinvestorsnetwork.com/#!charts/c1my0
Reiter auf none (all stocks) stellen.
Antwort auf Beitrag Nr.: 44.472.419 von kmastra am 19.04.13 19:03:47super Seite, danke für den Tipp
Antwort auf Beitrag Nr.: 44.464.807 von ipollit am 18.04.13 22:25:01VRTX verkauft. Reicht erst mal, auch wenn da theoretisch noch viel Potential ist, wenn die Kombi wirklich funktioniert.
@ kmastra: Super Link, Danke!
@ SLGramann: Glückwunsch zu dem Trade. Habe VRTX über sehr lange Zeit beobachtet, aber habe nie so recht den Einstieg gefunden.
@ SLGramann: Glückwunsch zu dem Trade. Habe VRTX über sehr lange Zeit beobachtet, aber habe nie so recht den Einstieg gefunden.
Antwort auf Beitrag Nr.: 44.473.089 von BiotechHype am 19.04.13 20:29:56Danke.
Ja, ist oft schwer, den Einstieg zu finden. Bei Biogen stehe ich bspw. daneben, seit sie bei ca. 100 Dollar waren. Jetzt sinds 200 Dollar und ich stehe weiter daneben. (dabei war mir vollkommen klar, welches Potential in ihrem MS-Kandidaten steckte)
(dabei war mir vollkommen klar, welches Potential in ihrem MS-Kandidaten steckte)
-------------
noch eine kurze Bemerkung zu PCYC:
Dass sie die Rekrutierung in zwei Trials schneller als geplant über die Bühne bekommen haben, werden keine Einzelfälle bleiben. Ibrutinib ist so vielversprechend, dass sich Kliniken, Ärzte und Patienten darum reißen werden, bei den Trials mitzumachen.
Sobald in irgendeiner Indikation die erste Zulassung erfolgt ist (also voraussichtlich in MCL), wird ein massiver off-label-use einsetzen.
Ich bleibe dabei, dass PCYC zu billig ist.
Ja, ist oft schwer, den Einstieg zu finden. Bei Biogen stehe ich bspw. daneben, seit sie bei ca. 100 Dollar waren. Jetzt sinds 200 Dollar und ich stehe weiter daneben.
 (dabei war mir vollkommen klar, welches Potential in ihrem MS-Kandidaten steckte)
(dabei war mir vollkommen klar, welches Potential in ihrem MS-Kandidaten steckte)-------------
noch eine kurze Bemerkung zu PCYC:
Dass sie die Rekrutierung in zwei Trials schneller als geplant über die Bühne bekommen haben, werden keine Einzelfälle bleiben. Ibrutinib ist so vielversprechend, dass sich Kliniken, Ärzte und Patienten darum reißen werden, bei den Trials mitzumachen.
Sobald in irgendeiner Indikation die erste Zulassung erfolgt ist (also voraussichtlich in MCL), wird ein massiver off-label-use einsetzen.
Ich bleibe dabei, dass PCYC zu billig ist.
Antwort auf Beitrag Nr.: 44.473.807 von SLGramann am 19.04.13 22:06:25Ja, das ist immer ein blödes Gefühl, wenn Werte von der Watchlist abgehen und man ist nicht dabei. Neben Vertex ist das bei mir besonders bei Isis der Fall.
Aber so ist das eben. Man kann halt nicht überall dabei sein. Nebenbei bemerkt sorgen solche Kurssprünge wie der von Vertex auch immer für ein gewisses Vertrauen in die gesamte Branche. Meine Kernbeteiligungen sind heute zumindest alle gut gelaufen. Und so hab ich dann doch irgendwievon Vertex profitiert
Aber so ist das eben. Man kann halt nicht überall dabei sein. Nebenbei bemerkt sorgen solche Kurssprünge wie der von Vertex auch immer für ein gewisses Vertrauen in die gesamte Branche. Meine Kernbeteiligungen sind heute zumindest alle gut gelaufen. Und so hab ich dann doch irgendwievon Vertex profitiert

Antwort auf Beitrag Nr.: 44.428.397 von kmastra am 14.04.13 17:31:41nochmal zu AVEO:
Habe mich endgültig dagegen entschieden, hier etwas zu wagen. Ich denke zwar, dass das Risiko klein ist, will aber auch dieses Restrisiko nicht eingehen. Vor allem, weil Aveo ohne Tivozanib erst mal ziemlich nackt dastünde. Meine größte Sorge ist, dass man von ihnen eine weitere PIII fordern könnte, um diese OS-Frage definitiv zu klären.
Allen Investierten alles Gute - ich denke, ihr habt mindestens ne 70%-Chance, dass es gut ausgeht.
Habe mich endgültig dagegen entschieden, hier etwas zu wagen. Ich denke zwar, dass das Risiko klein ist, will aber auch dieses Restrisiko nicht eingehen. Vor allem, weil Aveo ohne Tivozanib erst mal ziemlich nackt dastünde. Meine größte Sorge ist, dass man von ihnen eine weitere PIII fordern könnte, um diese OS-Frage definitiv zu klären.
Allen Investierten alles Gute - ich denke, ihr habt mindestens ne 70%-Chance, dass es gut ausgeht.
Habe heute Gewinne bei HALO mitgenommen. Wird direkt zur Aufstockung von AUXL genutzt. Ist nun meine größte Position.
ASTX & PD-1...
Ein interessanter, aber auch nicht ganz leichter Artikel u.a. zu den neuen beim Immunsystem ansetzenden PD-1 Krebstherapien:
http://www.obroncology.com/blog/2013/04/aacr-2013-post-view-…
"AACR 2013 Post-View: Getting Closer To Bending The Curve For More Patients"
...
Immunotherapy: When the Body Cures the Body
...She then discussed findings of both the JCO and NEJM articles, which examined the use of nivolumab in non-small cell lung cancer (NSCLC), melanoma, kidney, colon or prostate cancer. What most impressed us, and immediately caused us to crystallize the impact on patients of Dr. Topalian’s data, was the slide she showed on the durability of response of three patients who has ceased treatment with nivolumab. Dr. Topalian provided vignettes of three patients-one with colorectal cancer (CRC), one with renal (kidney) cancer (RCC), and one with melanoma-showing that patients can remain in complete or partial response 4-5 years into their therapy. The patient with CRC remains in complete response just short of four years into follow up after stopping treatment shy of one year. The RCC patient received therapy for approximately six months had a partial response (PR) as best response shortly thereafter, then went on to produce a complete response (CR) at roughly 3.5 years, and at nearly 4.5 years remains in CR...
...Perhaps most exciting was the slide shown by Dr. Topalian that described a patient with squamous non-small cell lung cancer, a tumor type that is widely thought to be non-immunogenic. This particular patient responded to anti-PD-1 antibody therapy after an immediately previous treatment with epigenetic therapy of 5-azacitidine (Vidaza, CELG, MO) and entinostat (Syndax, private, NC), an inhibitor of HDAC 6. Dr. Topalian indicated that this patient has recently completed two years of anti-PD-1 therapy. Moreover, Dr. Topalian indicated that there are five more patients like the one in the example she cited who have achieved durable responses after prior treatment with epigenetic therapy. While the number of patients is small, the 100% response rate in this population is impressive....
...What patient would not want to be cancer-free for three, four, five years or more? Anti-PD-1 therapy could make this possible. Even if the duration of response diminishes over time, as it inevitably will, we believe the pull of durable response could eventually make drugs in the class the largest selling oncology drugs extant. The robust effect, broad applicability, and acceptable tolerability could result in sales of the drugs that would put sales of Avastin (~$6 billion) to shame. Were Vidaza, Dacogen, or SGI-110 to hitch their respective wagons to the PD-1 bandwagon, it would likely be an unmitigated (and currently unanticipated) boon to the top line for these drugs...
Early Signs that Epigenetics Holds the Keys to Immunotherapy & Vice Versa
One initial interpretation of these data might be that DNA demethylation and immune checkpoint activation are antagonistic and that without PD-1/PD-L1 blockade, HMA activity is actually undermined by immnosuppressive mechanisms. Such was the conclusion reached by Garcia-Manero et al in a poster presented at last ASH last December in which the expression of PD-1, PD-L1, PD-L2 and CTLA4 were all induced in the PBMCs of AML/MDS patients treated with low dose Dacogen, or Vidaza in combination with Revlimid (CELG) or vorinostat. On the other hand, it is possible that the induction of PD-L1 expression though HMA exposure acts as primer or homing mechanism for activated T cells...
Taken together, we believe that future clinical studies of epigenetic therapy used combination with PD-1/PD-L1 antibodies (given perhaps in sequence) will indeed show these regimens to be synergistic in their activities...
***
Zum einen scheint PD-1&Co eine sehr wichtige Wirkstoff-Klasse gegen Krebs zu werden (wobei es nur bei einem Teil der Patienten wirkt... dort aber u.U. sehr positiv). Zum anderen scheinen epigenetisch wirkende Wirkstoffe wie Darcogen oder HDACs die Wirkung der PD-1 Hemmer zu erhöhen und andersherum.
Wenn sich das bestätigen sollte, wäre dann ASTX nicht recht interessant? SGI-110 ist eine langwirkende Version von Dacogen... u.U. das beste Mittel dieser Klasse.

Gruß
ipollit
Ein interessanter, aber auch nicht ganz leichter Artikel u.a. zu den neuen beim Immunsystem ansetzenden PD-1 Krebstherapien:
http://www.obroncology.com/blog/2013/04/aacr-2013-post-view-…
"AACR 2013 Post-View: Getting Closer To Bending The Curve For More Patients"
...
Immunotherapy: When the Body Cures the Body
...She then discussed findings of both the JCO and NEJM articles, which examined the use of nivolumab in non-small cell lung cancer (NSCLC), melanoma, kidney, colon or prostate cancer. What most impressed us, and immediately caused us to crystallize the impact on patients of Dr. Topalian’s data, was the slide she showed on the durability of response of three patients who has ceased treatment with nivolumab. Dr. Topalian provided vignettes of three patients-one with colorectal cancer (CRC), one with renal (kidney) cancer (RCC), and one with melanoma-showing that patients can remain in complete or partial response 4-5 years into their therapy. The patient with CRC remains in complete response just short of four years into follow up after stopping treatment shy of one year. The RCC patient received therapy for approximately six months had a partial response (PR) as best response shortly thereafter, then went on to produce a complete response (CR) at roughly 3.5 years, and at nearly 4.5 years remains in CR...
...Perhaps most exciting was the slide shown by Dr. Topalian that described a patient with squamous non-small cell lung cancer, a tumor type that is widely thought to be non-immunogenic. This particular patient responded to anti-PD-1 antibody therapy after an immediately previous treatment with epigenetic therapy of 5-azacitidine (Vidaza, CELG, MO) and entinostat (Syndax, private, NC), an inhibitor of HDAC 6. Dr. Topalian indicated that this patient has recently completed two years of anti-PD-1 therapy. Moreover, Dr. Topalian indicated that there are five more patients like the one in the example she cited who have achieved durable responses after prior treatment with epigenetic therapy. While the number of patients is small, the 100% response rate in this population is impressive....
...What patient would not want to be cancer-free for three, four, five years or more? Anti-PD-1 therapy could make this possible. Even if the duration of response diminishes over time, as it inevitably will, we believe the pull of durable response could eventually make drugs in the class the largest selling oncology drugs extant. The robust effect, broad applicability, and acceptable tolerability could result in sales of the drugs that would put sales of Avastin (~$6 billion) to shame. Were Vidaza, Dacogen, or SGI-110 to hitch their respective wagons to the PD-1 bandwagon, it would likely be an unmitigated (and currently unanticipated) boon to the top line for these drugs...
Early Signs that Epigenetics Holds the Keys to Immunotherapy & Vice Versa
One initial interpretation of these data might be that DNA demethylation and immune checkpoint activation are antagonistic and that without PD-1/PD-L1 blockade, HMA activity is actually undermined by immnosuppressive mechanisms. Such was the conclusion reached by Garcia-Manero et al in a poster presented at last ASH last December in which the expression of PD-1, PD-L1, PD-L2 and CTLA4 were all induced in the PBMCs of AML/MDS patients treated with low dose Dacogen, or Vidaza in combination with Revlimid (CELG) or vorinostat. On the other hand, it is possible that the induction of PD-L1 expression though HMA exposure acts as primer or homing mechanism for activated T cells...
Taken together, we believe that future clinical studies of epigenetic therapy used combination with PD-1/PD-L1 antibodies (given perhaps in sequence) will indeed show these regimens to be synergistic in their activities...
***
Zum einen scheint PD-1&Co eine sehr wichtige Wirkstoff-Klasse gegen Krebs zu werden (wobei es nur bei einem Teil der Patienten wirkt... dort aber u.U. sehr positiv). Zum anderen scheinen epigenetisch wirkende Wirkstoffe wie Darcogen oder HDACs die Wirkung der PD-1 Hemmer zu erhöhen und andersherum.
Wenn sich das bestätigen sollte, wäre dann ASTX nicht recht interessant? SGI-110 ist eine langwirkende Version von Dacogen... u.U. das beste Mittel dieser Klasse.
Gruß
ipollit
Ich halte Astex auch für einen interessanten Wert. Auch aber nicht nur wegen SG-110. Die Pipeline ist doch recht breit und hat noch andere aussichtsreiche Kandidaten, die teilweise auch schon verpartnert sind:

Die Situation um Dacogen scheint mir trotz auslaufendem Patent solider als erwartet. Ebenso ist die Cashposition sehr komfortabel. Eine recht gute Übersicht bietet dieser Artikel vom Anfang des Jahres:
http://seekingalpha.com/article/1104861-astex-pharmaceutical…

Die Situation um Dacogen scheint mir trotz auslaufendem Patent solider als erwartet. Ebenso ist die Cashposition sehr komfortabel. Eine recht gute Übersicht bietet dieser Artikel vom Anfang des Jahres:
http://seekingalpha.com/article/1104861-astex-pharmaceutical…
AUXL macht mir mit der gestrigen Meldung keine Freude:
http://finance.yahoo.com/news/auxilium-pharmaceuticals-inc-a…
Zur gleichen Zeit wurde auch die erhoffte Übernahme bekannt gegeben:
http://finance.yahoo.com/news/auxilium-pharmaceuticals-compl…
Die Qurtalszahlen waren katastrophal. Bleibt abzuwarten, ob das eine zeitlich begrenzte Schwäche ist oder ob es einen Trend einläutet. Da wird das 2. Quartal mehr Aufschluss geben.
Auf der anderen Seite sehe ich die Übernahme sehr positiv. Man hat die geplante Diversifikation umgesetzt. Mit der Übernahme wurden 6 weitere Produkte in das Vermarktungs-Portfolio aufgenommen, die für einen 2012er Umsatz von $ 125 Mio gut waren. Hier sieht die Geschäftsleitung noch erhebliches Steigerungspotenzial.
Gestern überwog die Negativstimmung, die durch die wirklich miesen Quartalszahlen entstand. Langfristig sollte sich die Aquisition sehr positiv auswirken. Man sieht Kostensynergien von knapp 20 Mio Dollar. Die gilt es zu heben. Im Rahmen des 2. Quartalsbericht wird man sich dann zur weiteren Strategie im Detail äußern.
Sitze hier schon auf beträchtlichen Verlusten, aber sehe weiterhin Potenzial einer langfristigen Wertsteigerung. Hoffe, dass mir der Bericht zum 2. Quartal die letzten Zweifel nehmen kann. Vom Grundsatz her halte ich die Strategie für richtig.
http://finance.yahoo.com/news/auxilium-pharmaceuticals-inc-a…
Zur gleichen Zeit wurde auch die erhoffte Übernahme bekannt gegeben:
http://finance.yahoo.com/news/auxilium-pharmaceuticals-compl…
Die Qurtalszahlen waren katastrophal. Bleibt abzuwarten, ob das eine zeitlich begrenzte Schwäche ist oder ob es einen Trend einläutet. Da wird das 2. Quartal mehr Aufschluss geben.
Auf der anderen Seite sehe ich die Übernahme sehr positiv. Man hat die geplante Diversifikation umgesetzt. Mit der Übernahme wurden 6 weitere Produkte in das Vermarktungs-Portfolio aufgenommen, die für einen 2012er Umsatz von $ 125 Mio gut waren. Hier sieht die Geschäftsleitung noch erhebliches Steigerungspotenzial.
Gestern überwog die Negativstimmung, die durch die wirklich miesen Quartalszahlen entstand. Langfristig sollte sich die Aquisition sehr positiv auswirken. Man sieht Kostensynergien von knapp 20 Mio Dollar. Die gilt es zu heben. Im Rahmen des 2. Quartalsbericht wird man sich dann zur weiteren Strategie im Detail äußern.
Sitze hier schon auf beträchtlichen Verlusten, aber sehe weiterhin Potenzial einer langfristigen Wertsteigerung. Hoffe, dass mir der Bericht zum 2. Quartal die letzten Zweifel nehmen kann. Vom Grundsatz her halte ich die Strategie für richtig.
Aveo fällt heute um 20%. Die FDA hat heute den Fragenkatalog für den Panel bekannt gegeben.
Besonders die Frage, ob ein weiterer Trial vor Zulassung erforderlich ist, kommt nicht gut an. Dabei ist die Frage ja durchaus berechtigt und verständlich. Das die Frage kommt war eigentlich klar. Entscheidend wird sein, wie die Experten drauf antworten. Ich bleib mit einer kleinen Position drin, weil ich es immer noch für wahrscheinlicher halte, dass zumindest der Panel positiv stimmt. Das wird aber definitiv spannend...
http://www.reuters.com/article/2013/04/30/aveo-fda-idUSL2N0D…
Auch spannend ist die Situation von Dyax, die hier im board mal kurz thematisiert wurde. Die Umsätze des einzig zugelassenen Medikements haben hier dermaßen enttäuscht, dass sich der Wert gedrittelt hat. Ob das angesichts der doch recht breiten verparterten Pipeline nun eine günstige Kaufgelegenheit ist, wird sich zeigen. Dazu muss man wissen, dass das Geschäftsmodell ähnlich dem von Morphosys ist. Royalties also zwischen 2-3%. Auch das wäre noch verkraftbar. Schwierig ist aber die Tatsache, dass der Großteil der Royalties erstmal in die Tilgung der Schulden wandern. In Verbindung mit den geringen Cashreserven also eine heikle Situation.
Besonders die Frage, ob ein weiterer Trial vor Zulassung erforderlich ist, kommt nicht gut an. Dabei ist die Frage ja durchaus berechtigt und verständlich. Das die Frage kommt war eigentlich klar. Entscheidend wird sein, wie die Experten drauf antworten. Ich bleib mit einer kleinen Position drin, weil ich es immer noch für wahrscheinlicher halte, dass zumindest der Panel positiv stimmt. Das wird aber definitiv spannend...
http://www.reuters.com/article/2013/04/30/aveo-fda-idUSL2N0D…
Auch spannend ist die Situation von Dyax, die hier im board mal kurz thematisiert wurde. Die Umsätze des einzig zugelassenen Medikements haben hier dermaßen enttäuscht, dass sich der Wert gedrittelt hat. Ob das angesichts der doch recht breiten verparterten Pipeline nun eine günstige Kaufgelegenheit ist, wird sich zeigen. Dazu muss man wissen, dass das Geschäftsmodell ähnlich dem von Morphosys ist. Royalties also zwischen 2-3%. Auch das wäre noch verkraftbar. Schwierig ist aber die Tatsache, dass der Großteil der Royalties erstmal in die Tilgung der Schulden wandern. In Verbindung mit den geringen Cashreserven also eine heikle Situation.
Genmab:
Daratumumab Receives Breakthrough Therapy Designation from US Food
and Drug Administration
Daratumumab receives Breakthrough Therapy Designation in double refractory multiple
myeloma
Potential for expedited development
Copenhagen, Denmark; May 1, 2013 – Genmab A/S (OMX: GEN) announced today that the US
Food and Drug Administration (FDA) has granted Breakthrough Therapy Designation for
daratumumab for the treatment of patients with multiple myeloma who have received at least three
prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD)
or who are double refractory to a PI and IMiD.
-----
Nennt mich verrückt, aber ich kann mir die Zulassung schon Ende 2014 vorstellen.
Daratumumab Receives Breakthrough Therapy Designation from US Food
and Drug Administration
Daratumumab receives Breakthrough Therapy Designation in double refractory multiple
myeloma
Potential for expedited development
Copenhagen, Denmark; May 1, 2013 – Genmab A/S (OMX: GEN) announced today that the US
Food and Drug Administration (FDA) has granted Breakthrough Therapy Designation for
daratumumab for the treatment of patients with multiple myeloma who have received at least three
prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD)
or who are double refractory to a PI and IMiD.
-----
Nennt mich verrückt, aber ich kann mir die Zulassung schon Ende 2014 vorstellen.
Antwort auf Beitrag Nr.: 44.549.031 von SLGramann am 01.05.13 20:09:41fierce zu dara:
Eight months after Johnson & Johnson ($JNJ) committed to a $1.1 billion deal package to partner on Genmab's cancer antibody daratumumab, the FDA has blessed the Phase I/II program with its new "breakthrough" designation.
The drug--which targets the CD38 molecule expressed on the surface of multiple myeloma cells--is still early enough in the development process to potentially benefit significantly from the agency's adoption effort for promising experimental therapies. While still in its early stages, executives on these programs are promised open doors and quick responses from the FDA in order to hurry the process--potentially clipping months or years off the development cycle.
----
Das sehe ich auch so. Wenn "breakthrough" überhaupt etwas bedeuten soll, dann kann die FDA es gerade hier beweisen.
Mein Gefühl ist, dass Daratumumab ein absoluter Hammer werden und zumindest den MM-Markt aufmischen wird.
Sollten weitere Indikationen im Bereich Hämatologie erschließbar sein, dann sehen wir hier vielleicht gerade beim Entstehen eines der größten mab-Blockbuster ever zu.
Eight months after Johnson & Johnson ($JNJ) committed to a $1.1 billion deal package to partner on Genmab's cancer antibody daratumumab, the FDA has blessed the Phase I/II program with its new "breakthrough" designation.
The drug--which targets the CD38 molecule expressed on the surface of multiple myeloma cells--is still early enough in the development process to potentially benefit significantly from the agency's adoption effort for promising experimental therapies. While still in its early stages, executives on these programs are promised open doors and quick responses from the FDA in order to hurry the process--potentially clipping months or years off the development cycle.
----
Das sehe ich auch so. Wenn "breakthrough" überhaupt etwas bedeuten soll, dann kann die FDA es gerade hier beweisen.
Mein Gefühl ist, dass Daratumumab ein absoluter Hammer werden und zumindest den MM-Markt aufmischen wird.
Sollten weitere Indikationen im Bereich Hämatologie erschließbar sein, dann sehen wir hier vielleicht gerade beim Entstehen eines der größten mab-Blockbuster ever zu.
PCYC:
Aus dem CC:
Most importantly, at this time, we are targeting to submit the MCL filing before the end of the third quarter 2013.
Finde ich Hammer. Ich rechne nunmehr mit einer Zulassung von Ibrutinib im 2. Quartal 2014. Wird sofort einen beachtlichen off-label-use geben.
Aus dem CC:
Most importantly, at this time, we are targeting to submit the MCL filing before the end of the third quarter 2013.
Finde ich Hammer. Ich rechne nunmehr mit einer Zulassung von Ibrutinib im 2. Quartal 2014. Wird sofort einen beachtlichen off-label-use geben.
Puh! Aveo wird mit 13 zu 1 Stimmen im Panel abgschmettert. Mit einem so negativen Panel hätte ich nie und nimmer gerechnet. Gott sei Dank hab ich nur ne kleine Position gehabt aber andersrum wär's mir natürlich lieber gewesen...
Antwort auf Beitrag Nr.: 44.555.815 von kmastra am 02.05.13 18:13:37Schade! Tut mir leid. Ich fand die pro-Argumente ja eigentlich auch überzeugender.
Einer der wenigen Fälle, in denen Hammer bös falsch gelegen hat. NGSX fällt mir da noch ein.
Sehe auch langfristig kaum noch Potential für Aveo und gehe davon aus, dass Hammer die Trümmer verkaufen wird.
Mal sehen, ob und was er neu aufnimmt. Ariad? Astex? Mehr Genmab?
Einer der wenigen Fälle, in denen Hammer bös falsch gelegen hat. NGSX fällt mir da noch ein.
Sehe auch langfristig kaum noch Potential für Aveo und gehe davon aus, dass Hammer die Trümmer verkaufen wird.
Mal sehen, ob und was er neu aufnimmt. Ariad? Astex? Mehr Genmab?
Was mir zur Zeit auffällt, dass es in den letzten Wochen auffällig viele Flops, Enttäuschungen und Kurseinbrüche gibt. Gestern ARNA. Frage mich schon ob man hier als Kleinanleger die Odds grundsätzlich und systematisch gegen sich hat. Auf verlorenem Börsenposten sozusagen 



Antwort auf Beitrag Nr.: 44.558.971 von me_2 am 03.05.13 09:27:18ob man hier als Kleinanleger die Odds grundsätzlich und systematisch gegen sich hat.
Ja und nein. Der Nasdaq Biotech-Index ist in letzter Zeit fantastisch gelaufen - das ist die eine Seite.
Die andere Seite ist, dass in diesem Index über 100 Unternehmen versammelt sind, die eigentlich bereits eine Elite darstellen und trotzdem sind da mehr künftige Flops als Tops versammelt.
Das der Index steigt, liegt an den Topwerten, nicht an der breiten Masse.
Rein quantitativ gesehen geht im Biotech-Bereich nämlich das Meiste einfach nur schief.
Die Kunst ist, die relativ seltenen Fälle zu erkennen, wo eine besondere Qualität im Spiel ist, die wirklich heraus sticht - und sich darauf zu beschränken.
PCYC als perfektes Beispiel in den letzten zwei Jahren.
Schief liegen kann man immer, aber gerade Ohad Hammer hat es in den letzten Jahren phänomenal gut verstanden, das "Alpha" sehr früh zu sehen (zuletzt meiner Meinung nach bei Genmab).
Ja und nein. Der Nasdaq Biotech-Index ist in letzter Zeit fantastisch gelaufen - das ist die eine Seite.
Die andere Seite ist, dass in diesem Index über 100 Unternehmen versammelt sind, die eigentlich bereits eine Elite darstellen und trotzdem sind da mehr künftige Flops als Tops versammelt.
Das der Index steigt, liegt an den Topwerten, nicht an der breiten Masse.
Rein quantitativ gesehen geht im Biotech-Bereich nämlich das Meiste einfach nur schief.
Die Kunst ist, die relativ seltenen Fälle zu erkennen, wo eine besondere Qualität im Spiel ist, die wirklich heraus sticht - und sich darauf zu beschränken.
PCYC als perfektes Beispiel in den letzten zwei Jahren.
Schief liegen kann man immer, aber gerade Ohad Hammer hat es in den letzten Jahren phänomenal gut verstanden, das "Alpha" sehr früh zu sehen (zuletzt meiner Meinung nach bei Genmab).
Antwort auf Beitrag Nr.: 44.559.735 von SLGramann am 03.05.13 10:51:13Ein Aspekt ist imo auch, dass die Biotechfirmen wie kaum eine andere Branche zur Überschätzung ihrer Wirkstoffe und der eigenen Fähigkeiten, diese erfolgreich zu entwickeln, neigen. Ich war bisher der Meinung, dass dies bes. für die deutschen Biotechs zutrifft, wo nach meiner Erfahrung Wissenschaftler im Management überwiegen (die blind in ihre Substanzen verliebt sind) i.G. zu US wo mehr Marktstrategen, Pharmaleute, Administratoren, Finanzprofis in den Boards und Managements sitzen (die ihre Chancen realistischer einschätzen)...??
Die Unternehmensführung muss doch die eigene Firma und die in der Entwicklung befindlichen Produktkandidaten so positiv wie möglich darstellen. Nur so ist es möglich, dass die finanziellen Mittel vom Kapitalmarkt zur Verfügung gestellt werden. Wer würde denn eine Biotech-Schmiede Geld anvertrauen, wenn diese selbst zugeben würde, dass die Produktkandidaten keine Chancen auf eine Zulassung haben werden. So ist das Spiel...
In Sachen AVEO hätte ich nicht geglaubt, dass das Panel so negativ verlaufen würde. Eine Glaskugel müsste man haben...
In Sachen AVEO hätte ich nicht geglaubt, dass das Panel so negativ verlaufen würde. Eine Glaskugel müsste man haben...
Man muss sich sicherlich jeden Fall gesondert anschauen. Von einem allgemeinen Trend würde ich nicht sprechen.
Auf Qualität zu setzen ist auch in meinen Augen der Königsweg. Da hat sich in der Tat Hammer hervorgetan. Es gibt aber auch noch andere gute Quellen:
http://www.orf-blog.com/
http://www.biotechduediligence.com/blog.html
http://www.bbbiotech.ch/de/bb-biotech/strategie-portfolio/po…
Letztlich denke ich auch, dass es immer ein schlechtes Zeichen ist, wenn Big-Pharma kein Interesse an den Produkten oder der Technologie hat bzw. es umgekehrt ein gutes Zeichen ist.
Für mich sind auch die Diskussionen bzw. Posts hier im board immer hilfreich.
Aber auch mit Schrott lässt sich natürlich grundsätzlich Geld verdienen....
Auf Qualität zu setzen ist auch in meinen Augen der Königsweg. Da hat sich in der Tat Hammer hervorgetan. Es gibt aber auch noch andere gute Quellen:
http://www.orf-blog.com/
http://www.biotechduediligence.com/blog.html
http://www.bbbiotech.ch/de/bb-biotech/strategie-portfolio/po…
Letztlich denke ich auch, dass es immer ein schlechtes Zeichen ist, wenn Big-Pharma kein Interesse an den Produkten oder der Technologie hat bzw. es umgekehrt ein gutes Zeichen ist.
Für mich sind auch die Diskussionen bzw. Posts hier im board immer hilfreich.
Aber auch mit Schrott lässt sich natürlich grundsätzlich Geld verdienen....
Zitat von SLGramann: PCYC:
Aus dem CC:
Most importantly, at this time, we are targeting to submit the MCL filing before the end of the third quarter 2013.
Finde ich Hammer. Ich rechne nunmehr mit einer Zulassung von Ibrutinib im 2. Quartal 2014. Wird sofort einen beachtlichen off-label-use geben.
allerdings zeigt pcyc seit ende Februar relative schwäche zum biotechindex ibb

AVEO...
Finde ein so eindeutig negatives Panel auch etwas überraschend... steht im Gegensatz zu mehreren recht optimistischen Stimmen im Vorfeld, wie z.B von Ohad Hammer, Sally Church und anderen, die ich für einigermaßen kompetent halte. Ich bin mir jetzt nicht ganz klar, wie AVEOs Zukunft jetzt einzuschätzen ist. Zumindest ist aus meiner Sicht Tivozanib noch nicht gescheitert. VEGF-Hemmer sind eigentlich eine wichtige Klasse und Tivozanib soll angeblich recht spezifisch, relativ nebenwirkungsarm und damit für Kombi-Therapien recht brauchbar sein. Allerdings wird es noch etwas dauern, bis eine neue PIII und damit eine Zulassung möglich ist.
Mich würde auch interessieren, wie es mit dem ErbB3(HER3)-Hemmer AV-203 aussieht. Pfizers ErbB-Hemmer wird in http://biotechstrategyblog.com/2013/04/aacr-2013-posters-sho… positiv erwähnt. Ist AV-203 etwas ähnliches? Die präklinischen FGFR- und Notch-Hemmer könnten ebenfalls brauchbar sein.
Eigentlich ist es schon ärgerlich. Da wagt AVEO eine PIII gegen ein aktives Medikament statt wie sonst üblich gegen ein Placebo... und landet damit direkt auf der Nase. Andererseits scheint es generell kein gutes Zeichen zu sein, wenn die Studien im wesentlichen in Osteuropa durchgeführt werden. Diese Studien machen (warum auch immer) fast immer Probleme.
Viele andere, die heute gut darstehen, haben vor nicht allzu langer Zeit erhebliche Rückschläge hinnehmen müssen: PCYC mit Xcytrin, Genmab mit Zanolimumab, Zalutumumab, AMG 714, RG1507 und mehreren Arzerra-Studien, INFI mit Saridegib, MDVN mit Dimebon oder ARIA mit Ridaforolimus. Wenn etwas scheitert, muss es also noch nicht das Ende bedeuten. Vielleicht geht es ja auch bei AVEO irgendwann wieder aufwärts.
Gruß
ipollit
Finde ein so eindeutig negatives Panel auch etwas überraschend... steht im Gegensatz zu mehreren recht optimistischen Stimmen im Vorfeld, wie z.B von Ohad Hammer, Sally Church und anderen, die ich für einigermaßen kompetent halte. Ich bin mir jetzt nicht ganz klar, wie AVEOs Zukunft jetzt einzuschätzen ist. Zumindest ist aus meiner Sicht Tivozanib noch nicht gescheitert. VEGF-Hemmer sind eigentlich eine wichtige Klasse und Tivozanib soll angeblich recht spezifisch, relativ nebenwirkungsarm und damit für Kombi-Therapien recht brauchbar sein. Allerdings wird es noch etwas dauern, bis eine neue PIII und damit eine Zulassung möglich ist.
Mich würde auch interessieren, wie es mit dem ErbB3(HER3)-Hemmer AV-203 aussieht. Pfizers ErbB-Hemmer wird in http://biotechstrategyblog.com/2013/04/aacr-2013-posters-sho… positiv erwähnt. Ist AV-203 etwas ähnliches? Die präklinischen FGFR- und Notch-Hemmer könnten ebenfalls brauchbar sein.
Eigentlich ist es schon ärgerlich. Da wagt AVEO eine PIII gegen ein aktives Medikament statt wie sonst üblich gegen ein Placebo... und landet damit direkt auf der Nase. Andererseits scheint es generell kein gutes Zeichen zu sein, wenn die Studien im wesentlichen in Osteuropa durchgeführt werden. Diese Studien machen (warum auch immer) fast immer Probleme.
Viele andere, die heute gut darstehen, haben vor nicht allzu langer Zeit erhebliche Rückschläge hinnehmen müssen: PCYC mit Xcytrin, Genmab mit Zanolimumab, Zalutumumab, AMG 714, RG1507 und mehreren Arzerra-Studien, INFI mit Saridegib, MDVN mit Dimebon oder ARIA mit Ridaforolimus. Wenn etwas scheitert, muss es also noch nicht das Ende bedeuten. Vielleicht geht es ja auch bei AVEO irgendwann wieder aufwärts.
Gruß
ipollit
REGN
ein Dauerläufer... offensichtlich selbst bei 160 USD noch gut für eine Verdopplung. Zuletzt im Plus, weil ein möglicher Konkurrent zu Eylea in der PII Probleme bekommen hat. REGN will diesen Bereich der Augenerkrankungen weiter forcieren: Mit PDGF- and ANG2-Hemmern sind bereits ausichtsreiche Ergänzungen zu Eylea in der Pipeline. Die Konkurrenz, Opthotech's PDGF-Hemmer Fovista, hatte vor etwas längerer Zeit ausssichtsreiche Ergebnisse geliefert http://www.bioworld.com/content/dark-horse-fovista-challenge…... wäre gut, wenn REGN langfristig etwas entsprechendes eigenes hat.

Gruß
ipollit
ein Dauerläufer... offensichtlich selbst bei 160 USD noch gut für eine Verdopplung. Zuletzt im Plus, weil ein möglicher Konkurrent zu Eylea in der PII Probleme bekommen hat. REGN will diesen Bereich der Augenerkrankungen weiter forcieren: Mit PDGF- and ANG2-Hemmern sind bereits ausichtsreiche Ergänzungen zu Eylea in der Pipeline. Die Konkurrenz, Opthotech's PDGF-Hemmer Fovista, hatte vor etwas längerer Zeit ausssichtsreiche Ergebnisse geliefert http://www.bioworld.com/content/dark-horse-fovista-challenge…... wäre gut, wenn REGN langfristig etwas entsprechendes eigenes hat.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.566.231 von ipollit am 04.05.13 00:02:57Ich glaube die FDA war grundsätzlich ziemlich unzufrieden mit dem Design der Studie. Spätestend als herauskam, dass nur 1 "African American" in der Studie beteiligt war, war auch der größte Argument - die Sicherheitsvorteile - dahin.
Die häufigste Nebenwirkung von Tivo war Bluthochdruck. Das tritt aus irgendeinem Grund bei AA vermehrt auf. Und wie sich das nun verhält wurde quasi gar nicht untersucht.
http://www.internalmedicinenews.com/index.php?id=2049&type=9…
http://www.medscape.com/viewarticle/803527
Mal sehen wie es weitergeht. Ich habe gelesen, dass Astellas noch in diesem Jahr die Zulassung in Europa beantragen wird. Vielleicht sind die Chancen ja hier besser, weil ein Großteil der Studie ja in Osteuropa durchgeführt wurde...
Die häufigste Nebenwirkung von Tivo war Bluthochdruck. Das tritt aus irgendeinem Grund bei AA vermehrt auf. Und wie sich das nun verhält wurde quasi gar nicht untersucht.
http://www.internalmedicinenews.com/index.php?id=2049&type=9…
http://www.medscape.com/viewarticle/803527
Mal sehen wie es weitergeht. Ich habe gelesen, dass Astellas noch in diesem Jahr die Zulassung in Europa beantragen wird. Vielleicht sind die Chancen ja hier besser, weil ein Großteil der Studie ja in Osteuropa durchgeführt wurde...
"Sehe auch langfristig kaum noch Potential für Aveo und gehe davon aus, dass Hammer die Trümmer verkaufen wird."
Dass es bei AVEO kein Potential mehr gibt, finde ich einen etwas voreiligen Schluss.
Ist Tivozanib wegen des negativen OS-Trends in TIVO-1 gescheitert? Wenn ich mir alles nochmal ansehe, so ist es nachwievor möglich, dass Tivozanib der wirkungsvollste und nebenwirkungsärmste VEGF-Hemmer ist. Allerdings sind beim Studiendesign leider Fehler gemacht worden:
- die Studie wurde weltweit durchgeführt... in den USA, Westeuropa, Osteuropa, usw.
- anders als die meisten anderen Studien, war es eine Studie gegen ein aktives Medikament und kein Placebo, zumal unverblindet (d.h. jeder wusste, was er bekommt). Als aktives Medikament hat man aber nicht Sutent, die erste Wahl bei RCC, genommen, sondern nur Nexavar, das angeblich etwas schwächer als Sutent ist. Dies ergab sich daraus, dass man mit Tivozanib die Überlegenheit belegen wollte, was sehr schwierig ist, wenn die Überlegenheit nicht sehr deutlich ist. Besser wäre wohl eine PIII vs Sutent gewesen mit Prüfung auf keine schlechtere Wirkung als Sutent.
- Ursprünglich war zudem kein Crossover geplant... d.h. nach PFS (Krankheitsfortschritt = Medikament nicht mehr wirksam) können nur noch Standard-Medikamente angewendet werden. Dies hätte aber auch bedeuten können, dass Patienten im Nexavar-Arm sich dann sagen, wozu nehme ich jetzt das schwächere Nexavar, wenn ich außerhalb der Studie Sutent bekommen kann. Diese hätten die Studie abbrechen können, um Sutent außerhalb der Studie woanders zu bekommen.
- Weil man bei AVEO der Annahme war, dass Tivozanib noch besser als Sutent ist, man dieses aber außerhalb der Studie nicht bekommt, hat man sich gedacht, dass es ein Anreiz wäre, im Nexavar-Arm zu bleiben, wenn den Nexavar-Patienten angeboten wird, nach PFS auch Tivozanib zu bekommen (Crossover). Für Patienten im Tivozanib-Arm war dagegen kein Crossover auf Nexavar erlaubt, was ja eigentlich auch keinen Sinn ergibt, da diese Patienten nach Tivozanib auch den Standard Sutent erhalten können. Dieser einseitige Crossover kann problematisch sein.
- Der größte Fehler war, dabei nicht zu bedenken, dass in Osteuropa offensichtlich Sutent&Co nicht zugelassen sind. D.h. nach PFS bekommt ein Patient dort nichts mehr. Ohne Crossover vielleicht kein Problem. Aber nun konnten Nexavar-Patienten zusätzlich Tivozanib erhalten. Tivozanib-Patienten erhielten dagegen nach PFS zu einem großen Teil nichts mehr. Außerdem kann ich mir vorstellen, dass die Studie in Osteuropa besonders gut rekrutieren konnte, weil es dort anderes als in den USA keine Alternative wie Sutent gibt.
- die Folge war, dass im Nexavar-Arm viele 1st-line Nexavar erhalten haben und 2nd-line Tivozanib. Im Tivozanib-Arm nur 1st-line Tivozanib und keine 2nd-line Therpaie. Bei TKIs wie Nexavar, Sutent oder Tivozanib ist es nicht unnormal, dass nachdem ein TKI wirkungslos wird, ein anderer noch etwas Wirkung zeigt. 2 Therapien hintereinander sollten immer wirksamer sein als nur eine. Dadurch ist es nicht verwunderlich, dass der Nexavar-Arm ein höhrers OS als der Tivozanib-Arm hat, obwohl PFS von Tivozanib über PFS von Nexavar liegt.
AVEO war davon ausgegangen, dass PFS der einzige relevante Parameter in RCC ist. Die FDA hat nun aber klargemacht, dass es für sie nicht möglich ist, ein Mittel zuzulassen, dass in einer Studie einen OS-Nachteil (selbst wenn auch nur als Trend) gezeigt hat. Ich gehe nicht davon aus, dass Tivozanib vs Nexavar zu einem Nachteil führen würde, eher zu einem Vorteil (da bisher in RCC immer PFS mit OS korreliert war). Aber TIVO-1 lässt halt Raum, dass Tivozanib auch (z.B. aufgrund von unbekannten Nebenwirkungen) zu einem schlechteren OS führt. Deshalb hat die FDA nun so entschieden. Außerdem könnte das einseitige Crossover auch PFS beeinflusst haben, indem man z.B. bei den unverblindeten Nexavar-Patienten schneller geneigt war, einen Krankheitsfortschritt anzuerkennen, wenn man sie danach auf Tivozanib switchen konnte.
Das heißt für mich jetzt aber erstmal nur, dass Tivozanib ohne eine neue Studie nicht in RCC zugelassen wird. Nicht aber, dass Tivozanib bzw. AVEO kein Potential mehr hat.
Tivozanib gehört zur Klasse der VEGF-Hemmer, so wie der AK Avastin oder die SM Nexavar, Sutent&Co. Bei VEGF-Hemmern war man vor Jahren sehr euphorisch... nach der Zulassung von Avastin ist Genentech geradezu explodiert. Man ging davon aus, dass man mit den VEGF-Hemmern die Blutgefäß-Neubildung unterbinden und damit den Tumor aushungern kann. Ich bin kein Experte, aber in VEGF hat man ein zentrales Element gesehen, womit sich der Krebs im Körper ausbreitet. Gegenüber dieser Euphorie sind die Ergebnisse bisher sehr enttäuschend.
Ein Grund dafür, dass VEGF bisher nicht gut funktioniert, ist wohl, dass man bisher nicht vorhersagen kann, bei welchen Patienten es wirkt und bei welchen es vielleicht eher schadet. Ein Klassiker ist der HER-Hemmer Herceptin, der eben nur bei HER+ Brustkrebs (30%) gut wirkt und da sehr erfolgreich ist. Z.B. wirkt Avastin auch nur bei einem Teil der Patienten (15%?), bei einem großeren Teil aber nicht. Dadurch sind die durchschnittlichen Ergebnisse über alle Patienten eher schlecht. Die Situation könnte sich ändern, wenn man Biomarker findet. Trotz großer Anstrengungen, ist das bisher bei VEGF noch nicht gelungen. AVEO versucht gerade dies mit Tivozanib in den BATON PII-Studien http://pharmastrategyblog.com/2013/02/will-biomarkers-revolu…. AVEO scheint von Tivozanib sehr überzeugt zu sein, da man Tivozanib aufgrund dieser Biomarker direkt gegen Avastin in einer Darmkrebs-PII testet. Eregbnisse sollen noch dieses Jahr vorliegen. Was ist, wenn man darin z.B. Biomarker für Tivozanib findet, die auf eine Überlegenheit gegenüber Avastin hindeuten (soweit ich es verstehe, werden nur Hinweise gesucht)? Aufgrund dieser Biomarker hat man eine PII in TNBC Brustkrebs gestartet (eine Indikation, in der auch Celldex mit CDX-011 testet), da der Marker dort gehäuft auftritt. TNBC wäre ein viel größerer Markt als RCC.
Das heißt alles nicht, dass AVEO kein Risiko beinhaltet. Aber es nun abzuschreiben, weil TIVO-1 gescheitert ist, halte ich für einen Fehler. Die MK liegt nun unter Cash-Niveau. Dafür bekommt man die Chance, vielleicht den ersten VEGF-Hemmer mit funktionierenden Biomarkern in der Pipeline zu haben. Ist das nichts? Außerdem interessiert mich der ErbB3-AK... ErbB3 (HER3) gehört zur EGFR-Familie neben EGFR und HER2. EGFR und HER sind sehr etablierte Ansätze, ErbB3 war bisher eher vernachlässigt worden. ErbB3 könnte z.B. bei EGFR-Resistenz eine Rolle spielen, was u.a. einen größeren Teil von Lungenkrebs-Patienten betrifft. ErbB3-AKs könnten Blockbuster werden... allerdings gibt es da auch einige Konkurrenz. AVEO hat mit BIIB einen Partner, der nach der PII einsteigen wird, wenn es bis dahin gut aussieht. Dafür hätte AVEO die US-Rechte komplett für sich.
Mal schauen, wie Hammer das sieht.
Gruß
ipollit
Dass es bei AVEO kein Potential mehr gibt, finde ich einen etwas voreiligen Schluss.
Ist Tivozanib wegen des negativen OS-Trends in TIVO-1 gescheitert? Wenn ich mir alles nochmal ansehe, so ist es nachwievor möglich, dass Tivozanib der wirkungsvollste und nebenwirkungsärmste VEGF-Hemmer ist. Allerdings sind beim Studiendesign leider Fehler gemacht worden:
- die Studie wurde weltweit durchgeführt... in den USA, Westeuropa, Osteuropa, usw.
- anders als die meisten anderen Studien, war es eine Studie gegen ein aktives Medikament und kein Placebo, zumal unverblindet (d.h. jeder wusste, was er bekommt). Als aktives Medikament hat man aber nicht Sutent, die erste Wahl bei RCC, genommen, sondern nur Nexavar, das angeblich etwas schwächer als Sutent ist. Dies ergab sich daraus, dass man mit Tivozanib die Überlegenheit belegen wollte, was sehr schwierig ist, wenn die Überlegenheit nicht sehr deutlich ist. Besser wäre wohl eine PIII vs Sutent gewesen mit Prüfung auf keine schlechtere Wirkung als Sutent.
- Ursprünglich war zudem kein Crossover geplant... d.h. nach PFS (Krankheitsfortschritt = Medikament nicht mehr wirksam) können nur noch Standard-Medikamente angewendet werden. Dies hätte aber auch bedeuten können, dass Patienten im Nexavar-Arm sich dann sagen, wozu nehme ich jetzt das schwächere Nexavar, wenn ich außerhalb der Studie Sutent bekommen kann. Diese hätten die Studie abbrechen können, um Sutent außerhalb der Studie woanders zu bekommen.
- Weil man bei AVEO der Annahme war, dass Tivozanib noch besser als Sutent ist, man dieses aber außerhalb der Studie nicht bekommt, hat man sich gedacht, dass es ein Anreiz wäre, im Nexavar-Arm zu bleiben, wenn den Nexavar-Patienten angeboten wird, nach PFS auch Tivozanib zu bekommen (Crossover). Für Patienten im Tivozanib-Arm war dagegen kein Crossover auf Nexavar erlaubt, was ja eigentlich auch keinen Sinn ergibt, da diese Patienten nach Tivozanib auch den Standard Sutent erhalten können. Dieser einseitige Crossover kann problematisch sein.
- Der größte Fehler war, dabei nicht zu bedenken, dass in Osteuropa offensichtlich Sutent&Co nicht zugelassen sind. D.h. nach PFS bekommt ein Patient dort nichts mehr. Ohne Crossover vielleicht kein Problem. Aber nun konnten Nexavar-Patienten zusätzlich Tivozanib erhalten. Tivozanib-Patienten erhielten dagegen nach PFS zu einem großen Teil nichts mehr. Außerdem kann ich mir vorstellen, dass die Studie in Osteuropa besonders gut rekrutieren konnte, weil es dort anderes als in den USA keine Alternative wie Sutent gibt.
- die Folge war, dass im Nexavar-Arm viele 1st-line Nexavar erhalten haben und 2nd-line Tivozanib. Im Tivozanib-Arm nur 1st-line Tivozanib und keine 2nd-line Therpaie. Bei TKIs wie Nexavar, Sutent oder Tivozanib ist es nicht unnormal, dass nachdem ein TKI wirkungslos wird, ein anderer noch etwas Wirkung zeigt. 2 Therapien hintereinander sollten immer wirksamer sein als nur eine. Dadurch ist es nicht verwunderlich, dass der Nexavar-Arm ein höhrers OS als der Tivozanib-Arm hat, obwohl PFS von Tivozanib über PFS von Nexavar liegt.
AVEO war davon ausgegangen, dass PFS der einzige relevante Parameter in RCC ist. Die FDA hat nun aber klargemacht, dass es für sie nicht möglich ist, ein Mittel zuzulassen, dass in einer Studie einen OS-Nachteil (selbst wenn auch nur als Trend) gezeigt hat. Ich gehe nicht davon aus, dass Tivozanib vs Nexavar zu einem Nachteil führen würde, eher zu einem Vorteil (da bisher in RCC immer PFS mit OS korreliert war). Aber TIVO-1 lässt halt Raum, dass Tivozanib auch (z.B. aufgrund von unbekannten Nebenwirkungen) zu einem schlechteren OS führt. Deshalb hat die FDA nun so entschieden. Außerdem könnte das einseitige Crossover auch PFS beeinflusst haben, indem man z.B. bei den unverblindeten Nexavar-Patienten schneller geneigt war, einen Krankheitsfortschritt anzuerkennen, wenn man sie danach auf Tivozanib switchen konnte.
Das heißt für mich jetzt aber erstmal nur, dass Tivozanib ohne eine neue Studie nicht in RCC zugelassen wird. Nicht aber, dass Tivozanib bzw. AVEO kein Potential mehr hat.
Tivozanib gehört zur Klasse der VEGF-Hemmer, so wie der AK Avastin oder die SM Nexavar, Sutent&Co. Bei VEGF-Hemmern war man vor Jahren sehr euphorisch... nach der Zulassung von Avastin ist Genentech geradezu explodiert. Man ging davon aus, dass man mit den VEGF-Hemmern die Blutgefäß-Neubildung unterbinden und damit den Tumor aushungern kann. Ich bin kein Experte, aber in VEGF hat man ein zentrales Element gesehen, womit sich der Krebs im Körper ausbreitet. Gegenüber dieser Euphorie sind die Ergebnisse bisher sehr enttäuschend.
Ein Grund dafür, dass VEGF bisher nicht gut funktioniert, ist wohl, dass man bisher nicht vorhersagen kann, bei welchen Patienten es wirkt und bei welchen es vielleicht eher schadet. Ein Klassiker ist der HER-Hemmer Herceptin, der eben nur bei HER+ Brustkrebs (30%) gut wirkt und da sehr erfolgreich ist. Z.B. wirkt Avastin auch nur bei einem Teil der Patienten (15%?), bei einem großeren Teil aber nicht. Dadurch sind die durchschnittlichen Ergebnisse über alle Patienten eher schlecht. Die Situation könnte sich ändern, wenn man Biomarker findet. Trotz großer Anstrengungen, ist das bisher bei VEGF noch nicht gelungen. AVEO versucht gerade dies mit Tivozanib in den BATON PII-Studien http://pharmastrategyblog.com/2013/02/will-biomarkers-revolu…. AVEO scheint von Tivozanib sehr überzeugt zu sein, da man Tivozanib aufgrund dieser Biomarker direkt gegen Avastin in einer Darmkrebs-PII testet. Eregbnisse sollen noch dieses Jahr vorliegen. Was ist, wenn man darin z.B. Biomarker für Tivozanib findet, die auf eine Überlegenheit gegenüber Avastin hindeuten (soweit ich es verstehe, werden nur Hinweise gesucht)? Aufgrund dieser Biomarker hat man eine PII in TNBC Brustkrebs gestartet (eine Indikation, in der auch Celldex mit CDX-011 testet), da der Marker dort gehäuft auftritt. TNBC wäre ein viel größerer Markt als RCC.
Das heißt alles nicht, dass AVEO kein Risiko beinhaltet. Aber es nun abzuschreiben, weil TIVO-1 gescheitert ist, halte ich für einen Fehler. Die MK liegt nun unter Cash-Niveau. Dafür bekommt man die Chance, vielleicht den ersten VEGF-Hemmer mit funktionierenden Biomarkern in der Pipeline zu haben. Ist das nichts? Außerdem interessiert mich der ErbB3-AK... ErbB3 (HER3) gehört zur EGFR-Familie neben EGFR und HER2. EGFR und HER sind sehr etablierte Ansätze, ErbB3 war bisher eher vernachlässigt worden. ErbB3 könnte z.B. bei EGFR-Resistenz eine Rolle spielen, was u.a. einen größeren Teil von Lungenkrebs-Patienten betrifft. ErbB3-AKs könnten Blockbuster werden... allerdings gibt es da auch einige Konkurrenz. AVEO hat mit BIIB einen Partner, der nach der PII einsteigen wird, wenn es bis dahin gut aussieht. Dafür hätte AVEO die US-Rechte komplett für sich.
Mal schauen, wie Hammer das sieht.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.570.267 von kmastra am 05.05.13 14:04:28"Die häufigste Nebenwirkung von Tivo war Bluthochdruck."
Bluthochdruck ist eine Target-Nebenwirkung... diese hängt direkt mit VEGF zusammen. Je höher diese Nebenwirkung, umso höher ist die Wirkung auf VEGF und damit die Wirkungsamkeit des Medikaments, wenn der Tumor VEGF benötigt. Alle andere Nebenwirkungen sind off-target... d.h. echte Nebenwirkungen, wenn sie unerwünscht sind. Diese kommen dadurch, dass dies alles Multi-Kinease-Hemmer sind, d.h. neben VEGF-Rezeptoren auch noch ganz andere Rezeptoren blockieren. Es kann ein Vorteil sein, wenn Sutent z.B. auch an cKit andockt, da Sutent dadurch bei GIST-Krebs wirkt, der stark von cKit abhängt. Sutent hat dadurch aber auch starke Nebenwirkungen, die dazu führen, dass man die Dosis reduzieren, die Therapie unterbrechen oder gar ganz abbrechen muss. Dies wiederum wirkt sich negativ auf die Wirkung aus. Tivozanib ist sehr viel selektiver bezüglich VEGF und hat damit im wesentlichen nur Bluthochdruck als Nebenwirkung. Eine Nebenwirkung muss auch nicht schlimm sein... gegen Bluthochdruck gibt es ja viele Medikamente, die diese Nebenwirkung wieder aufheben können. Sutent hat graviedene Nebenwirkungen, gegen die man nichts machen kann, außer weniger Sutent zu geben.
"sind die Chancen ja hier besser, weil ein Großteil der Studie ja in Osteuropa durchgeführt wurde"
das Problem ist nicht Europa und Amerika, sondern dass Tivozanib in TIVO-1 einen negativen OS-Trend hat. Kann gut sein, dass damit auch in Europa keine Zulassung zu bekommen ist.
Gruß
ipollit
Bluthochdruck ist eine Target-Nebenwirkung... diese hängt direkt mit VEGF zusammen. Je höher diese Nebenwirkung, umso höher ist die Wirkung auf VEGF und damit die Wirkungsamkeit des Medikaments, wenn der Tumor VEGF benötigt. Alle andere Nebenwirkungen sind off-target... d.h. echte Nebenwirkungen, wenn sie unerwünscht sind. Diese kommen dadurch, dass dies alles Multi-Kinease-Hemmer sind, d.h. neben VEGF-Rezeptoren auch noch ganz andere Rezeptoren blockieren. Es kann ein Vorteil sein, wenn Sutent z.B. auch an cKit andockt, da Sutent dadurch bei GIST-Krebs wirkt, der stark von cKit abhängt. Sutent hat dadurch aber auch starke Nebenwirkungen, die dazu führen, dass man die Dosis reduzieren, die Therapie unterbrechen oder gar ganz abbrechen muss. Dies wiederum wirkt sich negativ auf die Wirkung aus. Tivozanib ist sehr viel selektiver bezüglich VEGF und hat damit im wesentlichen nur Bluthochdruck als Nebenwirkung. Eine Nebenwirkung muss auch nicht schlimm sein... gegen Bluthochdruck gibt es ja viele Medikamente, die diese Nebenwirkung wieder aufheben können. Sutent hat graviedene Nebenwirkungen, gegen die man nichts machen kann, außer weniger Sutent zu geben.
"sind die Chancen ja hier besser, weil ein Großteil der Studie ja in Osteuropa durchgeführt wurde"
das Problem ist nicht Europa und Amerika, sondern dass Tivozanib in TIVO-1 einen negativen OS-Trend hat. Kann gut sein, dass damit auch in Europa keine Zulassung zu bekommen ist.
Gruß
ipollit
CLDX...
Celldex gefällt mir immer besser aufgrund der breiten Pipeline mit vielen aussichtsreichen Projekten, zumal es im Moment meine größte Position ist.
Bisher habe ich den AK-Vakzinen mit der APC Technologie nicht sehr viel Beachtung geschenkt. Vielleicht liegt aber gerade in diesen das größte Potential von CLDX. Zurzeit sind ja die Immuntherapien gegen Krebs wie PD-1 sehr in. Angeblich sollen diese Mittel Multi-Milliarden Blockbuster werden, die alles bisherige in der Onkologie in den Schatten stellen sollen. Interessant könnten diese sein, weil sie besonders lang anhaltende Wirkungen haben (allerdings nur bei einem Teil der Patienten).
Soweit ich es verstehe, "schützen" sich Krebszellen gegen das Immunsystem, indem sie entsprechende Substanzen bilden, die das Immunsystem dämpfen. Einzelne entartete Zellen wie Krebszellen entstehen ständig und werden aber in der Regel vom Immunsystem erkannt und beseitigt. Indem nun der Tumor z.B. PD-1 produziert, werden beispielsweise die T-Killerzellen vereinfacht gesagt deaktiviert. Der Tumor produziert eine ganze Reihe dieser Substanzen, die unterschiedlich auf das Immunsystem wirken. Der Ansatz eines PD-1 AK ist nun, einfach diese Substanzen zu neutralisieren, so dass sie das Immunsystem nicht weiter dämpfen und es so direkt gegen den Krebs vorgehen kann. Für mein Verständnis greift ein PD-1 AK aber nicht direkt den Tumor an... das muss das Immunsystem im wesentlichen selber machen. Ein Immunsystem hat im Gegensatz zu einem Medikament ein ganzes Arsenal an Mitteln, mit dem es die Krebszelle abtöten kann. Einmal erkannt, hat eine Krebszelle wohl keine Chance mehr.
Dieser Ansatz klingt logisch und scheint auch teilweise sehr gut zu funktionieren. (Leider sind hier nur große Pharmas beteiligt, kleinere börsennotierte Unternehmen, die solche AKs in der Pipeline haben, kenne ich nicht) Doch wodurch erkennt das Immunsystem die Krebszelle, die ja im Prinzip eine ganz normale Körperzelle ist? Eine Möglichkeit wäre für mich, dass Krebszellen Strukturen besitzen, die auf gesunden Zellen nicht vorhanden sind. Vielleicht gibt es auch ganz andere Mechanismen. Jedenfalls gibt es tatsächlich solche Strukturen:
"CT antigens are tumor proteins with a restricted pattern of expression, generally limited to germ cell and trophoblast tissue, but are also expressed in various human cancers. Their stable and specific expression on tumor cells and lack of expression on normal tissues make them an attractive target for cancer immunotherapy."
Wenn man nun das Immunsystem stimmuliert, genau ein solches CT Antigene zu erkennen, so müsste es auf den Krebs reagieren, aber nicht auf normales gesundes Gewebe, was fatal wäre. Anscheinend passiert dies auch nach der Behandlung mit z.B. PD-1 ohne zusätzliche äußere Stimmulation. Beispielsweise ist NY-ESO-1 ein solches CT Antigen. Dieses ist aber nicht auf allen Krebszellen zu finden. Man kann aber Krebszellen dazu bringen, mehr NY-ESO-1 zu expressionieren, indem man diese mit einem demethylierenden Medikament wie ASTXs Dacogen behandelt. Nach meinem Verständnis ist die Methylisierung die epigene Programmierung der Zelle, also etwas, dass zusätzlich auf der DNA sitzt, so dass dadurch die Funktion der Gene von außen verändert wird. Dacogen wirkt auf diese Methylisierung und irgendwie werden dadurch vermehrt CT Antigene sichtbar. Es gibt Hinweise, dass nach Dacogen-Behandlung die PD-1 Hemmer eine höhere Wirkung haben. Ich könnte es mir so erklären, dass dadurch nicht nur das Immunsystem wieder am Krebs aktiv ist, sondern es auch den Krebs besser z.B. über CT Antigene erkennen kann.
Was hat nun Celldex damit zutun? Sie setzen bei diesen CT-Antigenen an: So ist z.B. CDX-1401 ein AK, der an das Antigen NY-ESO-1 gekoppelt ist und zusätzlich an bestimmten Rezeptoren von dendritischen Zellen des Immunsystems (APC-Zellen) andockt. Diese Zellen sind dafür da, fremde Antigene zu erkennen und das Immunsystem bezüglich dieser Antigene zu stimmulieren. So wird durch diese Zellen die gesamte Immunabwehr in Gang gesetzt. Dockt CDX-1401 dort an, so wird es aufgenommen und das Antigen NY-ESO-1 analysiert und das Immunsystem darauf ausgerichtet. Das Immunsystem greift dann die Krebszellen an, die NY-ESO-1 aufweisen.
CDX-1401 wird momentan in Kombination mit Dacogen getestet: http://clinicaltrials.gov/ct2/show/NCT01834248?term=CDX-1401…
Ich fände eine Kombination aus PD-1 AK + Dacogen + CD-1401 interessant: Der PD-1 AK fährt den Schutz der Krebszelle gegen das Immunsystem herunter, Dacogen stimmuliert u.a. die Krebszelle NY-ESO-1 zu expressionieren und CD-1401 aktiviert das Immunsystem gegen diese Zellen. Insgesamt müsste die Wirkung in Summe erheblich höher sein als nur bei einem dieser Mittel alleine.
hier findet sich auch etwas zu diesem Thema: http://www.google.de/#q=CDX+1401+dacogen&ei=PCuIUYv4E8fYsgag…
Gruß
ipollit
Celldex gefällt mir immer besser aufgrund der breiten Pipeline mit vielen aussichtsreichen Projekten, zumal es im Moment meine größte Position ist.
Bisher habe ich den AK-Vakzinen mit der APC Technologie nicht sehr viel Beachtung geschenkt. Vielleicht liegt aber gerade in diesen das größte Potential von CLDX. Zurzeit sind ja die Immuntherapien gegen Krebs wie PD-1 sehr in. Angeblich sollen diese Mittel Multi-Milliarden Blockbuster werden, die alles bisherige in der Onkologie in den Schatten stellen sollen. Interessant könnten diese sein, weil sie besonders lang anhaltende Wirkungen haben (allerdings nur bei einem Teil der Patienten).
Soweit ich es verstehe, "schützen" sich Krebszellen gegen das Immunsystem, indem sie entsprechende Substanzen bilden, die das Immunsystem dämpfen. Einzelne entartete Zellen wie Krebszellen entstehen ständig und werden aber in der Regel vom Immunsystem erkannt und beseitigt. Indem nun der Tumor z.B. PD-1 produziert, werden beispielsweise die T-Killerzellen vereinfacht gesagt deaktiviert. Der Tumor produziert eine ganze Reihe dieser Substanzen, die unterschiedlich auf das Immunsystem wirken. Der Ansatz eines PD-1 AK ist nun, einfach diese Substanzen zu neutralisieren, so dass sie das Immunsystem nicht weiter dämpfen und es so direkt gegen den Krebs vorgehen kann. Für mein Verständnis greift ein PD-1 AK aber nicht direkt den Tumor an... das muss das Immunsystem im wesentlichen selber machen. Ein Immunsystem hat im Gegensatz zu einem Medikament ein ganzes Arsenal an Mitteln, mit dem es die Krebszelle abtöten kann. Einmal erkannt, hat eine Krebszelle wohl keine Chance mehr.
Dieser Ansatz klingt logisch und scheint auch teilweise sehr gut zu funktionieren. (Leider sind hier nur große Pharmas beteiligt, kleinere börsennotierte Unternehmen, die solche AKs in der Pipeline haben, kenne ich nicht) Doch wodurch erkennt das Immunsystem die Krebszelle, die ja im Prinzip eine ganz normale Körperzelle ist? Eine Möglichkeit wäre für mich, dass Krebszellen Strukturen besitzen, die auf gesunden Zellen nicht vorhanden sind. Vielleicht gibt es auch ganz andere Mechanismen. Jedenfalls gibt es tatsächlich solche Strukturen:
"CT antigens are tumor proteins with a restricted pattern of expression, generally limited to germ cell and trophoblast tissue, but are also expressed in various human cancers. Their stable and specific expression on tumor cells and lack of expression on normal tissues make them an attractive target for cancer immunotherapy."
Wenn man nun das Immunsystem stimmuliert, genau ein solches CT Antigene zu erkennen, so müsste es auf den Krebs reagieren, aber nicht auf normales gesundes Gewebe, was fatal wäre. Anscheinend passiert dies auch nach der Behandlung mit z.B. PD-1 ohne zusätzliche äußere Stimmulation. Beispielsweise ist NY-ESO-1 ein solches CT Antigen. Dieses ist aber nicht auf allen Krebszellen zu finden. Man kann aber Krebszellen dazu bringen, mehr NY-ESO-1 zu expressionieren, indem man diese mit einem demethylierenden Medikament wie ASTXs Dacogen behandelt. Nach meinem Verständnis ist die Methylisierung die epigene Programmierung der Zelle, also etwas, dass zusätzlich auf der DNA sitzt, so dass dadurch die Funktion der Gene von außen verändert wird. Dacogen wirkt auf diese Methylisierung und irgendwie werden dadurch vermehrt CT Antigene sichtbar. Es gibt Hinweise, dass nach Dacogen-Behandlung die PD-1 Hemmer eine höhere Wirkung haben. Ich könnte es mir so erklären, dass dadurch nicht nur das Immunsystem wieder am Krebs aktiv ist, sondern es auch den Krebs besser z.B. über CT Antigene erkennen kann.
Was hat nun Celldex damit zutun? Sie setzen bei diesen CT-Antigenen an: So ist z.B. CDX-1401 ein AK, der an das Antigen NY-ESO-1 gekoppelt ist und zusätzlich an bestimmten Rezeptoren von dendritischen Zellen des Immunsystems (APC-Zellen) andockt. Diese Zellen sind dafür da, fremde Antigene zu erkennen und das Immunsystem bezüglich dieser Antigene zu stimmulieren. So wird durch diese Zellen die gesamte Immunabwehr in Gang gesetzt. Dockt CDX-1401 dort an, so wird es aufgenommen und das Antigen NY-ESO-1 analysiert und das Immunsystem darauf ausgerichtet. Das Immunsystem greift dann die Krebszellen an, die NY-ESO-1 aufweisen.
CDX-1401 wird momentan in Kombination mit Dacogen getestet: http://clinicaltrials.gov/ct2/show/NCT01834248?term=CDX-1401…
Ich fände eine Kombination aus PD-1 AK + Dacogen + CD-1401 interessant: Der PD-1 AK fährt den Schutz der Krebszelle gegen das Immunsystem herunter, Dacogen stimmuliert u.a. die Krebszelle NY-ESO-1 zu expressionieren und CD-1401 aktiviert das Immunsystem gegen diese Zellen. Insgesamt müsste die Wirkung in Summe erheblich höher sein als nur bei einem dieser Mittel alleine.
hier findet sich auch etwas zu diesem Thema: http://www.google.de/#q=CDX+1401+dacogen&ei=PCuIUYv4E8fYsgag…
Gruß
ipollit
Vielleicht schon bekannt, aber hier mal eine Seite, welche die Top 100 Drugs nach Umsatz in den USA aufzeigt.
http://www.drugs.com/stats/top100/sales
http://www.drugs.com/stats/top100/sales
Antwort auf Beitrag Nr.: 44.570.339 von ipollit am 05.05.13 14:36:35Hallo ipollit,
war ein paar Tage im Urlaub.
Dass es bei AVEO kein Potential mehr gibt, finde ich einen etwas voreiligen Schluss.
Klasse Text von Dir! Wie immer.
Das heißt für mich jetzt aber erstmal nur, dass Tivozanib ohne eine neue Studie nicht in RCC zugelassen wird. Nicht aber, dass Tivozanib bzw. AVEO kein Potential mehr hat.
Ja, der erste Satz ist mein Punkt.
Sie bräuchten jetzt eine P III - ohne die ganzen Designfehler.
Aber mein Gott, wie lange soll das denn dauern bis zu Zulassung? 2017/2018?
Hab mal gelesen, dass 2022 das Patent ausläuft.
Würde mich wundern, wenn sie bei RCC jetzt noch weitermachen.
a man Tivozanib aufgrund dieser Biomarker direkt gegen Avastin in einer Darmkrebs-PII testet. Eregbnisse sollen noch dieses Jahr vorliegen. Was ist, wenn man darin z.B. Biomarker für Tivozanib findet, die auf eine Überlegenheit gegenüber Avastin hindeuten (soweit ich es verstehe, werden nur Hinweise gesucht)? Aufgrund dieser Biomarker hat man eine PII in TNBC Brustkrebs gestartet (eine Indikation, in der auch Celldex mit CDX-011 testet), da der Marker dort gehäuft auftritt. TNBC wäre ein viel größerer Markt als RCC.
Richtig, das würde die Situation ändern.
Der Zeitverlust ist aber in jedem Fall enorm. Die Aussichten von Tivozanib in anderen Indikationen sind unklar und der Rest der Pipeline ist in einem sehr frühen Stadium.
Grüße
SLG
war ein paar Tage im Urlaub.
Dass es bei AVEO kein Potential mehr gibt, finde ich einen etwas voreiligen Schluss.
Klasse Text von Dir! Wie immer.
Das heißt für mich jetzt aber erstmal nur, dass Tivozanib ohne eine neue Studie nicht in RCC zugelassen wird. Nicht aber, dass Tivozanib bzw. AVEO kein Potential mehr hat.
Ja, der erste Satz ist mein Punkt.
Sie bräuchten jetzt eine P III - ohne die ganzen Designfehler.
Aber mein Gott, wie lange soll das denn dauern bis zu Zulassung? 2017/2018?
Hab mal gelesen, dass 2022 das Patent ausläuft.
Würde mich wundern, wenn sie bei RCC jetzt noch weitermachen.
a man Tivozanib aufgrund dieser Biomarker direkt gegen Avastin in einer Darmkrebs-PII testet. Eregbnisse sollen noch dieses Jahr vorliegen. Was ist, wenn man darin z.B. Biomarker für Tivozanib findet, die auf eine Überlegenheit gegenüber Avastin hindeuten (soweit ich es verstehe, werden nur Hinweise gesucht)? Aufgrund dieser Biomarker hat man eine PII in TNBC Brustkrebs gestartet (eine Indikation, in der auch Celldex mit CDX-011 testet), da der Marker dort gehäuft auftritt. TNBC wäre ein viel größerer Markt als RCC.
Richtig, das würde die Situation ändern.
Der Zeitverlust ist aber in jedem Fall enorm. Die Aussichten von Tivozanib in anderen Indikationen sind unklar und der Rest der Pipeline ist in einem sehr frühen Stadium.
Grüße
SLG
Wie im Nachbarthread beschrieben, bin ich mit Paion eine Wette auf die Phase II/III Ergebnisse von Ono Pharma zu Remimazolam eingegangen. Ono leistet gute und schnelle Arbeit, daher wiegt das Misstrauen gegenüber Paion nicht mehr so schwer. Hier kann Paion einfach nichts falsch machen, da sie es nicht selbst in der Hand haben.  Bei positiven Ergebnissen, könnten die Verpartnerungsbemühungen um Remi einen Schub erhalten.
Bei positiven Ergebnissen, könnten die Verpartnerungsbemühungen um Remi einen Schub erhalten.
 Bei positiven Ergebnissen, könnten die Verpartnerungsbemühungen um Remi einen Schub erhalten.
Bei positiven Ergebnissen, könnten die Verpartnerungsbemühungen um Remi einen Schub erhalten.
zu EXEL:
aus dem CC:
- Beyond enrolling the COMET trials we are working very actively on the initiation of our two new phase 3 pivotal trials in metastatic renal cell cancer and hepatocellular cancer or RCC and HCC respectively. We have completed three phase 3 meetings with regulatory authorities and are working very actively and starting these trials in Q3 of 2013.
- In addition to these activities, we are actively considering a study in non-small cell lung cancer patients carrying the RET fusion gene. This genetic alteration is seemed in about 1% to 2% of non-small cell lung cancer patients and only seen in patients with tumors and negative for EGFR, KRAS or else mutations.
We have initial clinical data in a small group of such patients who received cabozantinib. This data has recently been published in Cancer Discovery by the group led by Naiyer Rizvi from Memorial Sloan-Kettering Cancer Center. Amongst three heavily pre-treated patients carrying the RET fusion gene, two patients achieved a durable partial response and one long-lasting stable disease.
Bei RET-NSCL wäre ggf. eine "vorzeitige Zulassung" (also aufgrund P II-Daten) denkbar.
Hinzu kommt noch:
Received notice from Genentech, Exelixis' collaborator in the development of cobimetinib (GDC-0973/XL518) and a member of the Roche Group, in January 2013 that the first patient was dosed in a phase 3 pivotal trial evaluating the BRAF inhibitor Zelboraf (vemurafenib) alone or in combination with cobimetinib (GDC-0973/XL518) in previously untreated patients with malignant melanoma harboring the BRAF V600 mutation.
Zur Erinnerung:
http://www.orf-blog.com/exelixis-first-partnered-program-ent…
Will sagen:
cabozantinib steht inzwischen auf einer ziemlich breiten Basis. Allerdings fehlen nach wie vor überzeugende OS-Daten.
Zur ASCO kommt da wohl ein wenig mehr Licht ins Dunkel:
With this year’s ASCO meeting, non-abstracts has been accepted for presentation. Among these are a details analysis of overall survival and potentially predictor factors in our non-randomized expansion study in 144 CRPC patients treated with cabozantinib, which will be presented in a post-discussion session.
Das Risiko eines Investments wird durch XL518 m.E. deutlich gesenkt, vor allem, falls EXEL im Sommer die Co-Development-Option zieht. Trotz der zusätzlichen Lasten, die eine solche Entscheidung mit sich bringen würde, wäre es fahrlässig, das nicht zu tun.
Im Gesamtbild denke ich an eine maßvolle Aufstockung meiner EXEL-Position.
aus dem CC:
- Beyond enrolling the COMET trials we are working very actively on the initiation of our two new phase 3 pivotal trials in metastatic renal cell cancer and hepatocellular cancer or RCC and HCC respectively. We have completed three phase 3 meetings with regulatory authorities and are working very actively and starting these trials in Q3 of 2013.
- In addition to these activities, we are actively considering a study in non-small cell lung cancer patients carrying the RET fusion gene. This genetic alteration is seemed in about 1% to 2% of non-small cell lung cancer patients and only seen in patients with tumors and negative for EGFR, KRAS or else mutations.
We have initial clinical data in a small group of such patients who received cabozantinib. This data has recently been published in Cancer Discovery by the group led by Naiyer Rizvi from Memorial Sloan-Kettering Cancer Center. Amongst three heavily pre-treated patients carrying the RET fusion gene, two patients achieved a durable partial response and one long-lasting stable disease.
Bei RET-NSCL wäre ggf. eine "vorzeitige Zulassung" (also aufgrund P II-Daten) denkbar.
Hinzu kommt noch:
Received notice from Genentech, Exelixis' collaborator in the development of cobimetinib (GDC-0973/XL518) and a member of the Roche Group, in January 2013 that the first patient was dosed in a phase 3 pivotal trial evaluating the BRAF inhibitor Zelboraf (vemurafenib) alone or in combination with cobimetinib (GDC-0973/XL518) in previously untreated patients with malignant melanoma harboring the BRAF V600 mutation.
Zur Erinnerung:
http://www.orf-blog.com/exelixis-first-partnered-program-ent…
Will sagen:
cabozantinib steht inzwischen auf einer ziemlich breiten Basis. Allerdings fehlen nach wie vor überzeugende OS-Daten.
Zur ASCO kommt da wohl ein wenig mehr Licht ins Dunkel:
With this year’s ASCO meeting, non-abstracts has been accepted for presentation. Among these are a details analysis of overall survival and potentially predictor factors in our non-randomized expansion study in 144 CRPC patients treated with cabozantinib, which will be presented in a post-discussion session.
Das Risiko eines Investments wird durch XL518 m.E. deutlich gesenkt, vor allem, falls EXEL im Sommer die Co-Development-Option zieht. Trotz der zusätzlichen Lasten, die eine solche Entscheidung mit sich bringen würde, wäre es fahrlässig, das nicht zu tun.
Im Gesamtbild denke ich an eine maßvolle Aufstockung meiner EXEL-Position.
Hallo SLGramann,
EXEL halte ich auch für aussichtsreich... Cabozantinib könnte generell bei Knochenmetastasen helfen, nicht nur bei PC. Außerdem ist die Kombination aus MET+VEGF vielleicht zusätzlich (unabhängig von Knochenmetastasen) von Vorteil, so dass Cabozantinib breit angewendet werden könnte. Was MTC und RET-NSCLC betrifft, so denke ich, dass mittelfristig ARIA's Ponatinib hier die Nase vorne haben wird, da es ein sehr viel stärkere RET-Hemmer ist. Dies sind aber nur Nischen-Indikationen.
Allerdings ist der Kurs relativ zum NBI bisher sehr schwach. Es ist nicht zu erkennen, dass diese Schwäche demnächst enden könnte:


Gruß
ipollit
EXEL halte ich auch für aussichtsreich... Cabozantinib könnte generell bei Knochenmetastasen helfen, nicht nur bei PC. Außerdem ist die Kombination aus MET+VEGF vielleicht zusätzlich (unabhängig von Knochenmetastasen) von Vorteil, so dass Cabozantinib breit angewendet werden könnte. Was MTC und RET-NSCLC betrifft, so denke ich, dass mittelfristig ARIA's Ponatinib hier die Nase vorne haben wird, da es ein sehr viel stärkere RET-Hemmer ist. Dies sind aber nur Nischen-Indikationen.
Allerdings ist der Kurs relativ zum NBI bisher sehr schwach. Es ist nicht zu erkennen, dass diese Schwäche demnächst enden könnte:
Gruß
ipollit
PCYC
hier ist jemand sehr optimistisch bezüglich einer frühen Zulassung von Ibrutinib (in MCL):
http://seekingalpha.com/article/1424881-6-superstars-for-you…
"Probably number one is that the company is turning into a regulatory/U.S. Food and Drug Administration (FDA) poster child...
Now, the conundrum surrounding breakthrough designations is that this is a new process, just started in January 2013. We already have fast track approval for drugs, which follows about six months after a submission. Wall Street doesn't know quite what to think of the breakthrough therapy designation, and it is very nervous that this process might not be quite as good as it could be.
We have a couple of insights. One of them is that Pharmacyclics' partner on ibrutinib, Janssen Biotech Inc. (a subsidiary of Johnson & Johnson (JNJ)), has historically filed for early access for patients who can't get into clinical trials. Janssen typically does this about two months before it files for actual approval. The filing was made last month. In addition, the FDA is facing sequestration and major financial budgetary problems.
...
We believe the drug will be approved by the end of Q3/13. Pharmacyclics is going to file this summer, and the FDA is going to rush it through in a couple of months. Wall Street is looking at an early 2014 approval. But this is going to happen sooner rather than later. We're excited about it.
...Then we will get off-label use. It is the safest cancer drug we've seen with incredibly efficacy. It will be a real benefit for the industry."

Im Zusammenhang mit Ibrutinib finde ich auch das folgende interessant:
http://files.shareholder.com/downloads/PCYC/0x0x621039/8B222…
ca. 85% von NHL sind B-Cell Lymphome... von denen ist mit ca. 30% der größte Anteil wiederum Diffuse Large B-Cell Lymphoma (DLBCL). CLL/SLL sind dagegen ca. 6% von NHL, MCL ebenfalls 6% (http://www.lymphomation.org/classifications.htm).
DLBCL teilt sich im wesentlichen in die zwei Arten ABC und GCB. Bisher war wohl eher ABC das Problem, weil bei GCB Chemo+Rituxan (CHOP-R) relativ gut wirkt, bei ABC eher nicht so. Ibrutinib wirkt nun deutlich besser bei ABC (RR 41%) als bei GCB (RR 5%). In der obrigen Studie wird zudem gezeigt, dass es bei ABC mit der Zeit auch zu Resistenzen gegenüber Ibrutinib kommt.
D.h. Ibrutinib ist als BTK-Hemmer auch kein Wundermittel, dass überall und immer wirkt. Wirken die PI3k-Hemmer hier ähnlich oder sind sie eine Alternative? Ein Ansatz, um die Wirkung von Ibrutinib noch zu erhöhen, wären beispielsweise IRAK4-Hemmer. Das private Unternehmen Nimbus hat einen in der Pipeline http://www.reuters.com/article/2012/12/09/idUS50528+09-Dec-2…, bei LGND scheint auch etwas in der Präklinik zu sein http://www.ligand.com/irak4-inhibitor.
Gruß
ipollit
hier ist jemand sehr optimistisch bezüglich einer frühen Zulassung von Ibrutinib (in MCL):
http://seekingalpha.com/article/1424881-6-superstars-for-you…
"Probably number one is that the company is turning into a regulatory/U.S. Food and Drug Administration (FDA) poster child...
Now, the conundrum surrounding breakthrough designations is that this is a new process, just started in January 2013. We already have fast track approval for drugs, which follows about six months after a submission. Wall Street doesn't know quite what to think of the breakthrough therapy designation, and it is very nervous that this process might not be quite as good as it could be.
We have a couple of insights. One of them is that Pharmacyclics' partner on ibrutinib, Janssen Biotech Inc. (a subsidiary of Johnson & Johnson (JNJ)), has historically filed for early access for patients who can't get into clinical trials. Janssen typically does this about two months before it files for actual approval. The filing was made last month. In addition, the FDA is facing sequestration and major financial budgetary problems.
...
We believe the drug will be approved by the end of Q3/13. Pharmacyclics is going to file this summer, and the FDA is going to rush it through in a couple of months. Wall Street is looking at an early 2014 approval. But this is going to happen sooner rather than later. We're excited about it.
...Then we will get off-label use. It is the safest cancer drug we've seen with incredibly efficacy. It will be a real benefit for the industry."
Im Zusammenhang mit Ibrutinib finde ich auch das folgende interessant:
http://files.shareholder.com/downloads/PCYC/0x0x621039/8B222…
ca. 85% von NHL sind B-Cell Lymphome... von denen ist mit ca. 30% der größte Anteil wiederum Diffuse Large B-Cell Lymphoma (DLBCL). CLL/SLL sind dagegen ca. 6% von NHL, MCL ebenfalls 6% (http://www.lymphomation.org/classifications.htm).
DLBCL teilt sich im wesentlichen in die zwei Arten ABC und GCB. Bisher war wohl eher ABC das Problem, weil bei GCB Chemo+Rituxan (CHOP-R) relativ gut wirkt, bei ABC eher nicht so. Ibrutinib wirkt nun deutlich besser bei ABC (RR 41%) als bei GCB (RR 5%). In der obrigen Studie wird zudem gezeigt, dass es bei ABC mit der Zeit auch zu Resistenzen gegenüber Ibrutinib kommt.
D.h. Ibrutinib ist als BTK-Hemmer auch kein Wundermittel, dass überall und immer wirkt. Wirken die PI3k-Hemmer hier ähnlich oder sind sie eine Alternative? Ein Ansatz, um die Wirkung von Ibrutinib noch zu erhöhen, wären beispielsweise IRAK4-Hemmer. Das private Unternehmen Nimbus hat einen in der Pipeline http://www.reuters.com/article/2012/12/09/idUS50528+09-Dec-2…, bei LGND scheint auch etwas in der Präklinik zu sein http://www.ligand.com/irak4-inhibitor.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.617.591 von ipollit am 13.05.13 00:34:08D.h. Ibrutinib ist als BTK-Hemmer auch kein Wundermittel, dass überall und immer wirkt. Wirken die PI3k-Hemmer hier ähnlich oder sind sie eine Alternative?
Das ist eine ganz wichtige Frage mit Blick auf INFI. Wenn die Wirkstoffe komplementär sind (entweder als Kombi oder zumindest sequenziell), dann reduziert das das Risiko für INFI ganz enorm, aber auch das Risiko für PCYC.
Vergleichbar mit der Situation bei MM: Das sich Onyx und Celgene eben nicht auf die Füße treten, ist für Onyx-Investoren geradezu eine Lebensversicherung.
PS: Eine Zulassung von Ibrutinib noch in diesem Jahr wäre großartig, aber das erwarte nicht mal ich, obwohl ich ein echter "PCYC-Fan" bin. Ich gehe lieber weiterhin von März/April 2014 aus.
Trotzdem halte ich schon heute einen Kurs von 100 Dollar für fair. Der Markt ist hier m.E. noch immer etwas zu vorsichtig.
Das ist eine ganz wichtige Frage mit Blick auf INFI. Wenn die Wirkstoffe komplementär sind (entweder als Kombi oder zumindest sequenziell), dann reduziert das das Risiko für INFI ganz enorm, aber auch das Risiko für PCYC.
Vergleichbar mit der Situation bei MM: Das sich Onyx und Celgene eben nicht auf die Füße treten, ist für Onyx-Investoren geradezu eine Lebensversicherung.
PS: Eine Zulassung von Ibrutinib noch in diesem Jahr wäre großartig, aber das erwarte nicht mal ich, obwohl ich ein echter "PCYC-Fan" bin. Ich gehe lieber weiterhin von März/April 2014 aus.
Trotzdem halte ich schon heute einen Kurs von 100 Dollar für fair. Der Markt ist hier m.E. noch immer etwas zu vorsichtig.
Jüngst wurde zu Array eine gut und fleißig recherchierte Zusammenfassung auf SA veröffentlicht:
http://seekingalpha.com/article/1428181-part-1-will-array-bi…
http://seekingalpha.com/article/1428191-part-2-will-array-bi…
Bin hier aber bereits unvernünftig stark investiert.
stark investiert.
Dagegen überlege ich, wieder in Dyax einzusteigen. Die sind böse unter die Räder gekommen.

Heute kam die erwartete Meldung einer Kapitalerhöhung. Wäre eine Wette auf den Turnaround bei Kalbitor und vor allem einen Erfolg von Ramucirumab. Hier stehen entscheidende Ergebnisse aus.
http://www.kantarhealth.com/blog/neesha-suvarna/neesha-suvar…
Nichtsdestotrotz hat Lilly bereits angekündigt, dass sie dieses Jahr noch die Zulassung beantragen werden.
Zudem habe ich bereits eine erste Position in Furiex gekauft. Auch das ist ein Unternehmen mit einer breiten Pipeline und bereits zugelassenen Medikamenten. Habe hierzu etwas im w:o-Board geschrieben.
@ipollit: vom irak4-hemmer habe ich von seiten Ligand länger nichts gehört. Ich denke nicht, dass da zur Zeit eine P I geplant wird.
http://seekingalpha.com/article/1428181-part-1-will-array-bi…
http://seekingalpha.com/article/1428191-part-2-will-array-bi…
Bin hier aber bereits unvernünftig
 stark investiert.
stark investiert. Dagegen überlege ich, wieder in Dyax einzusteigen. Die sind böse unter die Räder gekommen.
Heute kam die erwartete Meldung einer Kapitalerhöhung. Wäre eine Wette auf den Turnaround bei Kalbitor und vor allem einen Erfolg von Ramucirumab. Hier stehen entscheidende Ergebnisse aus.
http://www.kantarhealth.com/blog/neesha-suvarna/neesha-suvar…
Nichtsdestotrotz hat Lilly bereits angekündigt, dass sie dieses Jahr noch die Zulassung beantragen werden.
Zudem habe ich bereits eine erste Position in Furiex gekauft. Auch das ist ein Unternehmen mit einer breiten Pipeline und bereits zugelassenen Medikamenten. Habe hierzu etwas im w:o-Board geschrieben.
@ipollit: vom irak4-hemmer habe ich von seiten Ligand länger nichts gehört. Ich denke nicht, dass da zur Zeit eine P I geplant wird.
Nur mal nebenbei: SNTS notiert auf ATH, 90% in 4 Monaten. Eine unspektakuläre, unauffällige Pharmaaktie 

and the sky is the limit ...


and the sky is the limit ...
Ich trag in den nächsten Tagen mal ganz unsystematisch zusammen, was mir im Zusammenhang mit der ASCO so auffällt:
Array:
Separately, a Phase III study of selumetinib in combination with docetaxel as a second-line therapy for patients with KRAS mutation-positive and metastatic non small cell lung cancer is planned to commence in the second half of 2013.
----
Es gab ja immer gewisse Zweifel, ob es selumetinib wirklich "schon" dieses Jahr in die PIII schafft. Diese Zweifel dürften jetzt ausgeräumt sein.
Array:
Separately, a Phase III study of selumetinib in combination with docetaxel as a second-line therapy for patients with KRAS mutation-positive and metastatic non small cell lung cancer is planned to commence in the second half of 2013.
----
Es gab ja immer gewisse Zweifel, ob es selumetinib wirklich "schon" dieses Jahr in die PIII schafft. Diese Zweifel dürften jetzt ausgeräumt sein.
Was ist eigentlich mit INFI passiert?
Übernahmegerüchte um Genmab:
(mit Google aus dem Niederländischen übersetzt)
"Glaxo hat Interesse an Genmab '
LONDON (Reuters) - Der britische Pharmakonzern GlaxoSmithKline in einem interessiert Übernahme des dänischen Biotechnologie-Unternehmen Genmab. Das berichtet die Daily Mail Freitag Basis Gerüchte im Markt.''
Glaxo hielte ein Gebot von 300 dänischen Kronen (ca. 40,24 €) pro Aktie.
Glaxo ist derzeit der drittgrößte Aktionär von Genmab mit
Bedeutung von 9,9 Prozent. Die US-Johnson & Johnson hat 10,6 Prozent der
das dänische Unternehmen gehört. Sowohl Glaxo und J & J haben Partnerschaften mit Genmab.
----
Bissel schwer zu glauben. Denn man muss fragen, warum sich J&J da rausdrängen lassen soll. Dara ist vermutlich viel mehr wert als 300 Kronen pro Aktie. Das Management von Genmab weiß das auch. Hätte man den Verkauf des Unternehmens angestrebt, hätte man doch J&J nicht kürzlich am Aktienkapital beteiligt, was ja bei der Auslizensierung eines Wirkstoffes nicht unbedingt normal ist und eine Übernahme definitiv erschwert.
(alternativer Gedanke ist allerdings, dass man J&J zur Beteiligung am Unternehmen "genötigt" hat, um eine "poison pill" gegen eine zu billige Übernahme durch Glaxo in die Hand zu bekommen. Denn was soll J&J langfristig mit so einer Minderheitsbeteiligung anfangen?)
Wie auch immer - vermutlich hat Dara einen enormen Wert und die Frage ist, wie viel davon auch für die Genmab-Aktionäre gehoben werden wird.
Die "Mutter" Medarex wurde ja damals einfach so an BMS verschenkt, wenn man heute mal auf Yervoy und Nivolumab schaut...
(mit Google aus dem Niederländischen übersetzt)
"Glaxo hat Interesse an Genmab '
LONDON (Reuters) - Der britische Pharmakonzern GlaxoSmithKline in einem interessiert Übernahme des dänischen Biotechnologie-Unternehmen Genmab. Das berichtet die Daily Mail Freitag Basis Gerüchte im Markt.''
Glaxo hielte ein Gebot von 300 dänischen Kronen (ca. 40,24 €) pro Aktie.
Glaxo ist derzeit der drittgrößte Aktionär von Genmab mit
Bedeutung von 9,9 Prozent. Die US-Johnson & Johnson hat 10,6 Prozent der
das dänische Unternehmen gehört. Sowohl Glaxo und J & J haben Partnerschaften mit Genmab.
----
Bissel schwer zu glauben. Denn man muss fragen, warum sich J&J da rausdrängen lassen soll. Dara ist vermutlich viel mehr wert als 300 Kronen pro Aktie. Das Management von Genmab weiß das auch. Hätte man den Verkauf des Unternehmens angestrebt, hätte man doch J&J nicht kürzlich am Aktienkapital beteiligt, was ja bei der Auslizensierung eines Wirkstoffes nicht unbedingt normal ist und eine Übernahme definitiv erschwert.
(alternativer Gedanke ist allerdings, dass man J&J zur Beteiligung am Unternehmen "genötigt" hat, um eine "poison pill" gegen eine zu billige Übernahme durch Glaxo in die Hand zu bekommen. Denn was soll J&J langfristig mit so einer Minderheitsbeteiligung anfangen?)
Wie auch immer - vermutlich hat Dara einen enormen Wert und die Frage ist, wie viel davon auch für die Genmab-Aktionäre gehoben werden wird.
Die "Mutter" Medarex wurde ja damals einfach so an BMS verschenkt, wenn man heute mal auf Yervoy und Nivolumab schaut...
Antwort auf Beitrag Nr.: 44.659.801 von SLGramann am 17.05.13 11:12:17Zu Infinity hatte AF etwas gesagt:
http://www.thestreet.com/video/11926088/biotechs-next-big-th…
Bei Array kam für mich die Ankündigung der eigenen PIII bei MEk-162 überraschend.
http://www.thestreet.com/video/11926088/biotechs-next-big-th…
Bei Array kam für mich die Ankündigung der eigenen PIII bei MEk-162 überraschend.
Der nächste Schlag in die Magengrube : XNPT
http://finance.yahoo.com/news/xenoport-reports-top-line-res…
Pos wird gegeben und in AUXL eingebracht.
http://finance.yahoo.com/news/xenoport-reports-top-line-res…
Pos wird gegeben und in AUXL eingebracht.
Antwort auf Beitrag Nr.: 44.665.733 von kmastra am 17.05.13 21:28:55nochmal INFI:
Infinity Pharmaceuticals (NASDAQ: INFI)
Bearish comments from JPMorgan regarding Infinity Pharmaceuticals pushed shares lower by more than 20% on Thursday. The loss came as investors grow skittish ahead of data at ASCO, and JPMorgan reminds those investors of why they should be worried. The questions are in regard to its investigational leukemia candidate IPI-145, for which JPMorgan predicts “a good showing.” However, the problem is how congested the market has become, and the number of big name biopharmaceutical companies expected to release better data, such as: Gilead Sciences, Pharmacyclics, and Roche.
Infinity Pharmaceuticals is a $1.2 billion company that is valued on not just one product but rather a therapeutic approach that could create numerous products, with IPI-145 being the most advanced. Therefore, with several years before seeing significant revenue (if the IPI-145 data is strong) and with a congested leukemia market I say avoid Infinity for now.
----------
weiß noch nicht recht, was ich davon halten soll. ich finde die Situation nicht so viel anders, als vor ein paar Wochen, als die Aktie fast doppelt so hoch stand.
Infinity Pharmaceuticals (NASDAQ: INFI)
Bearish comments from JPMorgan regarding Infinity Pharmaceuticals pushed shares lower by more than 20% on Thursday. The loss came as investors grow skittish ahead of data at ASCO, and JPMorgan reminds those investors of why they should be worried. The questions are in regard to its investigational leukemia candidate IPI-145, for which JPMorgan predicts “a good showing.” However, the problem is how congested the market has become, and the number of big name biopharmaceutical companies expected to release better data, such as: Gilead Sciences, Pharmacyclics, and Roche.
Infinity Pharmaceuticals is a $1.2 billion company that is valued on not just one product but rather a therapeutic approach that could create numerous products, with IPI-145 being the most advanced. Therefore, with several years before seeing significant revenue (if the IPI-145 data is strong) and with a congested leukemia market I say avoid Infinity for now.
----------
weiß noch nicht recht, was ich davon halten soll. ich finde die Situation nicht so viel anders, als vor ein paar Wochen, als die Aktie fast doppelt so hoch stand.
Antwort auf Beitrag Nr.: 44.675.229 von SLGramann am 20.05.13 16:19:44
Heute hier eingestiegen:
http://seekingalpha.com/article/1436181-alexza-pharmaceutica…
Kurzbeschreibung auf deutsch:
http://www.mind-and-brain-blog.de/822/adasuve-das-erste-inha…
Hörst sich auch im Kontext mit Teva m.M. vielversprechend an.
Meinungen der Experten aus dem Forum?
Grüsse, s.
Heute hier eingestiegen:
http://seekingalpha.com/article/1436181-alexza-pharmaceutica…
Kurzbeschreibung auf deutsch:
http://www.mind-and-brain-blog.de/822/adasuve-das-erste-inha…
Hörst sich auch im Kontext mit Teva m.M. vielversprechend an.
Meinungen der Experten aus dem Forum?
Grüsse, s.
Antwort auf Beitrag Nr.: 44.675.229 von SLGramann am 20.05.13 16:19:44INFI
habe mal eine erste Position gekauft. Ich weiß auch nicht recht, was ich von dem Kursverfall zuletzt halten soll... allerdings ist die MK mit 1,1 Mrd USD für mich jetzt einigermaßen okay. Vielleicht stecken hinter dem Verfall schlechte Nachrichten, die noch kommen, bisher habe ich nichts finden können. Oder es ist einfach aufgrund der Sorge, dass IPI-145 nicht mit GILDs Idelalisib mithalten könnte.
Idelalisib ist ein PI3k-delta Inhibitor, IPI-145 dagegen ein PI3k-delta/gamma Inhibitor. Die PI3k-delta Inhibitoren sollen ähnlich gut wie PCYCs BTK Inhibitor Ibrutinib sein, das u.a. gegen CLL erhebliche Fortschritte bringen dürfte. Aus meiner Sicht hat Ibrutinib die Nase wahrscheinlich deutlich vorne, PI3k-Inhibitoren können aber wohl zusammen (sequentiell) mit z.B. Ibrutinib angewendet werden.
Letztes Jahr hat mich gewundert, dass Takeda/Millenium nicht die 50:50 Option für IPI-145 wahrgenommen hat, was eher dafür spricht, dass IPI-145 nicht soviel Potential besitzt. Wenn ich es nun richtig gelesen habe, scheint aber eine mögliche Erklärung zu sein, dass Takeda die Option nur für Kandiaten hatte, die zuerst gegen Krebs entwickelt worden sind. IPI-145s erste Indikation ist aber Autoimmunerkrankung, so dass eventuell Takeda für IPI-145 diese Option nicht besessen hat. Takeda dürfte nachwievor noch Anspruch auf ca. 10% Royalties besitzen.
Soweit ich es gelesen habe, könnte IPI-145 wirksamer als Idelalisib sein, da es stärker Delta hemmt. Zusätzlich könnte die Gamma-Hemmung auch eine Wirksamkeit gegen T-Zell-Lymphome ermöglichen, bei denen Ibrutinib und Idelalisib wohl nicht wirkt. Interessant finde ich auch die Tests gegen Autoimmunerkrankungen wie RA und entzündliche Erkrankungen wie Asthma. Bei Gilead sehe ich bisher nichts derartiges. Zudem gibt es mit IPI-443 einen Nachfolger von IPI-145, der nochmal deutlich wirksamer sein soll.
Interessant finde ich auch den Hsp90 Inhibitor Retaspimycin. SNTAs Ganetespib könnte zwar besser sein, aber ich glaube, dass die Kombi von Hsp90 mit einem mTOR Inhibitor aussichtsreich ist, insbesondere in KRAS NSCLC, so wie INFI es mit der Retaspimycin + Everolimus Kombi testet.

Gruß
ipollit
habe mal eine erste Position gekauft. Ich weiß auch nicht recht, was ich von dem Kursverfall zuletzt halten soll... allerdings ist die MK mit 1,1 Mrd USD für mich jetzt einigermaßen okay. Vielleicht stecken hinter dem Verfall schlechte Nachrichten, die noch kommen, bisher habe ich nichts finden können. Oder es ist einfach aufgrund der Sorge, dass IPI-145 nicht mit GILDs Idelalisib mithalten könnte.
Idelalisib ist ein PI3k-delta Inhibitor, IPI-145 dagegen ein PI3k-delta/gamma Inhibitor. Die PI3k-delta Inhibitoren sollen ähnlich gut wie PCYCs BTK Inhibitor Ibrutinib sein, das u.a. gegen CLL erhebliche Fortschritte bringen dürfte. Aus meiner Sicht hat Ibrutinib die Nase wahrscheinlich deutlich vorne, PI3k-Inhibitoren können aber wohl zusammen (sequentiell) mit z.B. Ibrutinib angewendet werden.
Letztes Jahr hat mich gewundert, dass Takeda/Millenium nicht die 50:50 Option für IPI-145 wahrgenommen hat, was eher dafür spricht, dass IPI-145 nicht soviel Potential besitzt. Wenn ich es nun richtig gelesen habe, scheint aber eine mögliche Erklärung zu sein, dass Takeda die Option nur für Kandiaten hatte, die zuerst gegen Krebs entwickelt worden sind. IPI-145s erste Indikation ist aber Autoimmunerkrankung, so dass eventuell Takeda für IPI-145 diese Option nicht besessen hat. Takeda dürfte nachwievor noch Anspruch auf ca. 10% Royalties besitzen.
Soweit ich es gelesen habe, könnte IPI-145 wirksamer als Idelalisib sein, da es stärker Delta hemmt. Zusätzlich könnte die Gamma-Hemmung auch eine Wirksamkeit gegen T-Zell-Lymphome ermöglichen, bei denen Ibrutinib und Idelalisib wohl nicht wirkt. Interessant finde ich auch die Tests gegen Autoimmunerkrankungen wie RA und entzündliche Erkrankungen wie Asthma. Bei Gilead sehe ich bisher nichts derartiges. Zudem gibt es mit IPI-443 einen Nachfolger von IPI-145, der nochmal deutlich wirksamer sein soll.
Interessant finde ich auch den Hsp90 Inhibitor Retaspimycin. SNTAs Ganetespib könnte zwar besser sein, aber ich glaube, dass die Kombi von Hsp90 mit einem mTOR Inhibitor aussichtsreich ist, insbesondere in KRAS NSCLC, so wie INFI es mit der Retaspimycin + Everolimus Kombi testet.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.696.275 von ipollit am 22.05.13 23:34:10Hallo ipollit,
sehe ich alles genauso. Ich find auch nix negatives und denke, es liegt daran, dass der Markt plötzlich realisiert hat, wie weit IPI-145 zeitlich hinter Idelalisib zurückhängt.
Wenn man etwas Zeit hat, dann ist ein Investment in INFI sicher sehr aussichtsreich, weil IPI-145 ab 2016/2017 wahrscheinlich eine wichtige Rolle spielen wird.
(kann mich selbst aber nicht durchringen, weil ich anderswo stark investiert bin und nicht mehr allzu viel Luft für neue Positionen habe)
PCYC:
JNJ disclosed a new trial for ibrutinib in first-line DLBCL patients (ABC subtype). While always considered part of the long term plan, the initiation of this 800-patient trial in Q3 will mark the third disease type where a pivotal Phase III trial has been initiated (CLL, MCL, DLBCL).
If successful, this trial would be practice changing.
This 800-patient trial compares standard of care R-CHOP vs. ibrutinib + R-CHOP in first-line DLBCL patients who are non-GCB subtype (i.e. primarily ABC subtype).
Zur ASCO bekommen wir ja diesbezüglich detaillierte Ib-Daten entsprechend dieses Abstract:
Results: Seventeen patients (7, 4, and 6 in increasing ibrutinib doses) were enrolled: 59% male, median age 65 (range 46-81) years, diffuse large B-cell lymphoma 47%, mantle cell lymphoma 29% and follicular lymphoma 24%. In the 280 mg cohort, 2 patients had dose-limiting toxicity (DLT): 1 with transient syncope and 1 with periorbital cellulitis; at 560 mg, 1 patient had gastritis (grade 2). The RP2D was established at 560 mg ibrutinib. The most common (greater than or equal to 20% of patients) adverse events (AEs) were neutropenia (77%), thrombocytopenia (65%), vomiting (59%), anemia (53%), nausea (47%), fatigue (35%), headache (29%), constipation (24%), diarrhea (24%), and dizziness (24%). To date, 6 patients completed 6 cycles of treatment, and 2 patients discontinued treatment (1 due to noncompliance with the study drug and 1 due to non-DLT AE). At the time of this analysis, of the 10 patients had at least one post baseline tumor, the overall response rate was 100% (7 complete and 3 partial responses).
Conclusions: The combination of IR-CHOP has an acceptable safety profile. No new toxicities were noted with adding ibrutinib to R-CHOP. An expansion cohort 560 mg ibrutinib (RP2D) is being opened to further explore the safety and efficacy of IR-CHOP in patients with newly diagnosed diffuse large B-cell lymphomas.
Da müsste das dann mal genau auf die einzelnen Indikationen aufgespilttet werden.
Ich denke, dass die Chancen für Ibrutinib bei ABC-DLBCL sehr gut stehen und dass das kommerziell sehr bedeutend sein würde.
So ab 2017/2018 könnte man am Markt sein, so dass Ibrutinib einen kontinuierlichen Wachstumspfad haben dürfte.
PD(l)-1:
DAS ASCO-Highlight!
Könnte vielleicht meine kühnsten Erwartungen übertreffen.
Ich pflege ja diesen armen und unverstandenen BMS-Thread...
Thread: Auferstanden aus Ruinen? – Welche Zukunft hat Bristol Meyers Squibb?
Ohad Hammer:
Will am Sonntag ein ASCO-Preview bringen. Bin sehr gespannt!
Grüße
SLG
@sufenta,
sorry, kenne ich nicht und derzeit zu wenig Zeit zum gucken. Aber danke, dass Du ein paar Links für die Begründung gepostet hast! Vielleicht später.
sehe ich alles genauso. Ich find auch nix negatives und denke, es liegt daran, dass der Markt plötzlich realisiert hat, wie weit IPI-145 zeitlich hinter Idelalisib zurückhängt.
Wenn man etwas Zeit hat, dann ist ein Investment in INFI sicher sehr aussichtsreich, weil IPI-145 ab 2016/2017 wahrscheinlich eine wichtige Rolle spielen wird.
(kann mich selbst aber nicht durchringen, weil ich anderswo stark investiert bin und nicht mehr allzu viel Luft für neue Positionen habe)
PCYC:
JNJ disclosed a new trial for ibrutinib in first-line DLBCL patients (ABC subtype). While always considered part of the long term plan, the initiation of this 800-patient trial in Q3 will mark the third disease type where a pivotal Phase III trial has been initiated (CLL, MCL, DLBCL).
If successful, this trial would be practice changing.
This 800-patient trial compares standard of care R-CHOP vs. ibrutinib + R-CHOP in first-line DLBCL patients who are non-GCB subtype (i.e. primarily ABC subtype).
Zur ASCO bekommen wir ja diesbezüglich detaillierte Ib-Daten entsprechend dieses Abstract:
Results: Seventeen patients (7, 4, and 6 in increasing ibrutinib doses) were enrolled: 59% male, median age 65 (range 46-81) years, diffuse large B-cell lymphoma 47%, mantle cell lymphoma 29% and follicular lymphoma 24%. In the 280 mg cohort, 2 patients had dose-limiting toxicity (DLT): 1 with transient syncope and 1 with periorbital cellulitis; at 560 mg, 1 patient had gastritis (grade 2). The RP2D was established at 560 mg ibrutinib. The most common (greater than or equal to 20% of patients) adverse events (AEs) were neutropenia (77%), thrombocytopenia (65%), vomiting (59%), anemia (53%), nausea (47%), fatigue (35%), headache (29%), constipation (24%), diarrhea (24%), and dizziness (24%). To date, 6 patients completed 6 cycles of treatment, and 2 patients discontinued treatment (1 due to noncompliance with the study drug and 1 due to non-DLT AE). At the time of this analysis, of the 10 patients had at least one post baseline tumor, the overall response rate was 100% (7 complete and 3 partial responses).
Conclusions: The combination of IR-CHOP has an acceptable safety profile. No new toxicities were noted with adding ibrutinib to R-CHOP. An expansion cohort 560 mg ibrutinib (RP2D) is being opened to further explore the safety and efficacy of IR-CHOP in patients with newly diagnosed diffuse large B-cell lymphomas.
Da müsste das dann mal genau auf die einzelnen Indikationen aufgespilttet werden.
Ich denke, dass die Chancen für Ibrutinib bei ABC-DLBCL sehr gut stehen und dass das kommerziell sehr bedeutend sein würde.
So ab 2017/2018 könnte man am Markt sein, so dass Ibrutinib einen kontinuierlichen Wachstumspfad haben dürfte.
PD(l)-1:
DAS ASCO-Highlight!
Könnte vielleicht meine kühnsten Erwartungen übertreffen.
Ich pflege ja diesen armen und unverstandenen BMS-Thread...

Thread: Auferstanden aus Ruinen? – Welche Zukunft hat Bristol Meyers Squibb?
Ohad Hammer:
Will am Sonntag ein ASCO-Preview bringen. Bin sehr gespannt!
Grüße
SLG
@sufenta,
sorry, kenne ich nicht und derzeit zu wenig Zeit zum gucken. Aber danke, dass Du ein paar Links für die Begründung gepostet hast! Vielleicht später.
Antwort auf Beitrag Nr.: 44.684.219 von sufenta am 21.05.13 18:05:45@Sufenta,
wie stellt man sich das in der Praxis vor, einen agitierten Psychotiker zur Inhalation zu bewegen. Mit Gewalt? Das Inhalation powder muß erst angerührt werden, üblicherweise in der Apotheke, plus Transport zum Einsatzort, das dauert. i.v. Med. auf der Station geht schneller. Wie gut läßt sich die inhalierte Substanz dosieren, v.a. hinsichtlich Nebenwirkungen/Overdosing?
Hab mich nicht eingelesen, nur ein paar kritische ad-hoc Fragen...
wie stellt man sich das in der Praxis vor, einen agitierten Psychotiker zur Inhalation zu bewegen. Mit Gewalt? Das Inhalation powder muß erst angerührt werden, üblicherweise in der Apotheke, plus Transport zum Einsatzort, das dauert. i.v. Med. auf der Station geht schneller. Wie gut läßt sich die inhalierte Substanz dosieren, v.a. hinsichtlich Nebenwirkungen/Overdosing?
Hab mich nicht eingelesen, nur ein paar kritische ad-hoc Fragen...
Zu Synta:
Die haben ja noch kein ASCO-Abstract draußen, weil die Daten erst auf den letzten Drücker fertig werden, aber präsentiert werden sie:
Synta Pharmaceuticals Corp. (SNTA) today announced scheduled presentations at the 2013 American Society for Clinical Oncology (ASCO) Annual Meeting, which is taking place May 31 – June 4 in Chicago.
GALAXY-1 interim results
“A randomized study of ganetespib, a heat shock protein 90 inhibitor, in combination with docetaxel versus docetaxel alone for second-line therapy of lung adenocarcinoma (GALAXY-1)”
Abstract #: CRA8007
Date and time: June 3, 5:15 – 5:30 PM
Location: Oral Abstract Session – Lung Cancer. E Hall D2
Presenter: Suresh S. Ramalingam, M.D., Emory University, Atlanta, GA
The interim overall survival analysis of the adenocarcinoma patient population of GALAXY-1 planned for six months from the November 2012 completion of the primary enrollment stage of the trial will be conducted later this month. Results will be reviewed by an independent data review committee prior to presentation.
-----
Ich frag mich nun, ob da nächste Woche noch ein Abstract veröffentlicht wird oder alle Daten auf der ASCO?
Der SNTA-Kurs wird auf die Daten m.E. ziemlich extrem reagieren - so oder so.
Die haben ja noch kein ASCO-Abstract draußen, weil die Daten erst auf den letzten Drücker fertig werden, aber präsentiert werden sie:
Synta Pharmaceuticals Corp. (SNTA) today announced scheduled presentations at the 2013 American Society for Clinical Oncology (ASCO) Annual Meeting, which is taking place May 31 – June 4 in Chicago.
GALAXY-1 interim results
“A randomized study of ganetespib, a heat shock protein 90 inhibitor, in combination with docetaxel versus docetaxel alone for second-line therapy of lung adenocarcinoma (GALAXY-1)”
Abstract #: CRA8007
Date and time: June 3, 5:15 – 5:30 PM
Location: Oral Abstract Session – Lung Cancer. E Hall D2
Presenter: Suresh S. Ramalingam, M.D., Emory University, Atlanta, GA
The interim overall survival analysis of the adenocarcinoma patient population of GALAXY-1 planned for six months from the November 2012 completion of the primary enrollment stage of the trial will be conducted later this month. Results will be reviewed by an independent data review committee prior to presentation.
-----
Ich frag mich nun, ob da nächste Woche noch ein Abstract veröffentlicht wird oder alle Daten auf der ASCO?
Der SNTA-Kurs wird auf die Daten m.E. ziemlich extrem reagieren - so oder so.
Antwort auf Beitrag Nr.: 44.716.575 von SLGramann am 26.05.13 08:40:06Hammer hat die Frage heute beantwortet.
Ansonsten viele interessante Anmerkungen bspw. zu INFI und ARRY:
Synta (SNTA) will present updated results from the GALAXY1 trial, a large randomized phase II evaluating its Hsp90 inhibitor (ganetespib) in NSCLC. Results have important implications for an ongoing phase III trial that was designed based on initial phase II data.
Preliminary results from GALAXY1 (which I discussed here) demonstrated a survival trend, especially in patients with a 6-month follow up. While the previous analysis included only 77 patients, the upcoming analysis should include all or most of the 250 adeno patients enrolled in the trial.
The past month provided some mixed signals about the data. Earlier this month Synta announced the departure of Dr. Sumant Ramachandra, President of R&D for “personal reasons”. This raised concerns in the market as some viewed it as a red flag, several weeks before ASCO. On the other hand, the presentation was chosen by ASCO as a Clinical Review (CRA) presentation, which means results will be released only on the day of presentation. This is typically viewed as a positive indication although it is unclear how much data the organizing committee had when it made its decision (Synta disclosed that an OS analysis is expected sometime prior to ASCO). Another positive sign was the initiation of the phase III trial, implying the survival trend was not completely lost.
At ASCO, investors will evaluate the OS curves for the entire patient population as well as patients with indolent disease (6 month from diagnosis). The latter subgroup was chosen by Synta as the phase III population due to a robust efficacy signal. Given the nervousness around Synta, any attenuation of the survival signal could have animpact on the stock.
Additional presentations include results from 2 investigator-sponsored trials for ganetespib in esophagogastric and prostate cancer, respectively. Both studies had disappointing results but there was a single case of a dramatic complete response which is still ongoing after 27.5 months. Interestingly, the patient harbored a KRAS mutation, a known client protein of Hsp90. KRAS mutations are rare in gastric cancer (0-10%), and this case demonstrates again that Hsp90 inhibition might be very effective in niche indications (such as ALK and RAF mutated NSCLC).
http://www.orf-blog.com/drugs-to-watch-at-asco-2013/
Ansonsten viele interessante Anmerkungen bspw. zu INFI und ARRY:
Synta (SNTA) will present updated results from the GALAXY1 trial, a large randomized phase II evaluating its Hsp90 inhibitor (ganetespib) in NSCLC. Results have important implications for an ongoing phase III trial that was designed based on initial phase II data.
Preliminary results from GALAXY1 (which I discussed here) demonstrated a survival trend, especially in patients with a 6-month follow up. While the previous analysis included only 77 patients, the upcoming analysis should include all or most of the 250 adeno patients enrolled in the trial.
The past month provided some mixed signals about the data. Earlier this month Synta announced the departure of Dr. Sumant Ramachandra, President of R&D for “personal reasons”. This raised concerns in the market as some viewed it as a red flag, several weeks before ASCO. On the other hand, the presentation was chosen by ASCO as a Clinical Review (CRA) presentation, which means results will be released only on the day of presentation. This is typically viewed as a positive indication although it is unclear how much data the organizing committee had when it made its decision (Synta disclosed that an OS analysis is expected sometime prior to ASCO). Another positive sign was the initiation of the phase III trial, implying the survival trend was not completely lost.
At ASCO, investors will evaluate the OS curves for the entire patient population as well as patients with indolent disease (6 month from diagnosis). The latter subgroup was chosen by Synta as the phase III population due to a robust efficacy signal. Given the nervousness around Synta, any attenuation of the survival signal could have animpact on the stock.
Additional presentations include results from 2 investigator-sponsored trials for ganetespib in esophagogastric and prostate cancer, respectively. Both studies had disappointing results but there was a single case of a dramatic complete response which is still ongoing after 27.5 months. Interestingly, the patient harbored a KRAS mutation, a known client protein of Hsp90. KRAS mutations are rare in gastric cancer (0-10%), and this case demonstrates again that Hsp90 inhibition might be very effective in niche indications (such as ALK and RAF mutated NSCLC).
http://www.orf-blog.com/drugs-to-watch-at-asco-2013/
INCY
passt INCYs IDO1-Inhibitor INCB24360 auch in die PD-1 Kategorie?
Indoleamine 2, 3-dioxygenase (IDO) is an immune regulatory enzyme that is normally expressed in tumor cells and in activated immune cells. It dampens the immune response through oxidation of tryptophan, thereby blocking T-cell activation and inducing T-cell apoptosis. This creates an environment in which tumor-specific cytotoxic T lymphocytes are rendered functionally inactive or are no longer able to attack a patient’s cancer cells. Preclinical studies have shown that inhibition of IDO increases the anti-tumor immune response and dramatically increases the efficacy of various chemotherapeutic agents.
Soweit ich es verstehe, hat INCY inzwischen gleich mehrere JAK1-Inhibitoren in der Entwicklung... mal sehen, was sich mit der Zeit daraus ergibt. Etwas, das in Myelofibrosis das Leben deutlich verlängern kann, sollte erhebliches Potential besitzen. Inwiefern Jakafi dazu in der Lage ist, ist noch unklar.

******
Ich finde das dieswöchige IPO Epizyme (EPZM) http://www.epizyme.com/ interessant: epigenetische Krebs-Therapien auf Basis von Histone Methyltransferase (HMT). MK nach IPO etwa bei 400 Mio USD... vielleicht lege ich mir eine Position zu.
http://www.epizyme.com/pdf/Epizyme_IV1205_5-24.pdf
Mein Depot zurzeit:
10,2% Celldex ( CLDX )
10,2% Pharmacyclics ( PCYC )
8,8% Array ( ARRY )
6,5% Onyx ( ONXX )
6,3% Regeneron ( REGN )
6,3% Incyte ( INCY )
5,2% Cubist ( CBST )
5,0% Genmab ( GEN.CO )
4,9% Exelixis ( EXEL )
4,9% Synta ( SNTA )
4,6% Arqule ( ARQL )
3,4% Infinity ( INFI )
3,3% Isis ( ISIS )
3,0% Curis ( CRIS )
3,0% Ariad ( ARIA )
2,9% Clovis ( CLVS )
2,6% Astex ( ASTX )
2,3% Seattle Genetics ( SGEN )
1,9% Alnylam ( ALNY )
1,8% Aveo ( AVEO )
1,5% Rigel ( RIGL )
1,3% Trius ( TSRX )
Gruß
ipollit
passt INCYs IDO1-Inhibitor INCB24360 auch in die PD-1 Kategorie?
Indoleamine 2, 3-dioxygenase (IDO) is an immune regulatory enzyme that is normally expressed in tumor cells and in activated immune cells. It dampens the immune response through oxidation of tryptophan, thereby blocking T-cell activation and inducing T-cell apoptosis. This creates an environment in which tumor-specific cytotoxic T lymphocytes are rendered functionally inactive or are no longer able to attack a patient’s cancer cells. Preclinical studies have shown that inhibition of IDO increases the anti-tumor immune response and dramatically increases the efficacy of various chemotherapeutic agents.
Soweit ich es verstehe, hat INCY inzwischen gleich mehrere JAK1-Inhibitoren in der Entwicklung... mal sehen, was sich mit der Zeit daraus ergibt. Etwas, das in Myelofibrosis das Leben deutlich verlängern kann, sollte erhebliches Potential besitzen. Inwiefern Jakafi dazu in der Lage ist, ist noch unklar.
******
Ich finde das dieswöchige IPO Epizyme (EPZM) http://www.epizyme.com/ interessant: epigenetische Krebs-Therapien auf Basis von Histone Methyltransferase (HMT). MK nach IPO etwa bei 400 Mio USD... vielleicht lege ich mir eine Position zu.
http://www.epizyme.com/pdf/Epizyme_IV1205_5-24.pdf
Mein Depot zurzeit:
10,2% Celldex ( CLDX )
10,2% Pharmacyclics ( PCYC )
8,8% Array ( ARRY )
6,5% Onyx ( ONXX )
6,3% Regeneron ( REGN )
6,3% Incyte ( INCY )
5,2% Cubist ( CBST )
5,0% Genmab ( GEN.CO )
4,9% Exelixis ( EXEL )
4,9% Synta ( SNTA )
4,6% Arqule ( ARQL )
3,4% Infinity ( INFI )
3,3% Isis ( ISIS )
3,0% Curis ( CRIS )
3,0% Ariad ( ARIA )
2,9% Clovis ( CLVS )
2,6% Astex ( ASTX )
2,3% Seattle Genetics ( SGEN )
1,9% Alnylam ( ALNY )
1,8% Aveo ( AVEO )
1,5% Rigel ( RIGL )
1,3% Trius ( TSRX )
Gruß
ipollit
Genmab:
Haben einfach einen Lauf derzeit. Jetzt ersteht wohl auch noch Arzerra von den Scheintoten auf?
(leider kann ich nicht einschätzen, welches Potential im CLL-Markt für Arzerra überhaupt noch besteht. Da ändert sich derzeit so wahnsinnig viel... Denke aber, dass man in den nächsten Tagen dazu von Analystenseite das ein oder andere hören wird.)
Company Announcement
•Median 22.4 month progression free survival in patients treated with ofatumumab plus chlorambucil, an improvement of 9.3 months compared to chlorambucil alone
•No unexpected safety findings
Copenhagen, Denmark and London UK; May 29, 2013 — Genmab A/S (OMX: GEN) and GlaxoSmithKline plc (GSK) announced today that their Phase III study of ARZERRA® (ofatumumab) in combination with chlorambucil versus chlorambucil alone in patients with previously untreated chronic lymphocytic leukemia (CLL) met its primary endpoint of progression free survival (PFS) as assessed by an Independent Review Committee (IRC).
A total of 447 patients were enrolled in the study. A 9.3 month improvement in the time a patient lived without worsening of their disease (median PFS) was seen in patients randomized to ofatumumab and chlorambucil compared to patients randomized to chlorambucil alone (22.4 months vs. 13.1 months; Hazard Ratio 0.57; p<0.001).
There were no unexpected safety findings. The most common (≥1%) serious adverse events as reported by the investigator within 60 days of last treatment were neutropenia [including febrile neutropenia] (5%), anaemia (4%), pneumonia (4%), and pyrexia (2%). Infusion reactions were mild to moderate in severity with 3% of infusion reactions reported as serious.
"We are delighted with the positive results from this trial which we believe may lead to ofatumumab plus chlorambucil as an additional treatment option for the care of patients with CLL," said Jan van de Winkel, Ph.D., Chief Executive Officer of Genmab. "We look forward to submitting the study results, including secondary endpoints, to the International Workshop on CLL (iwCLL) in Cologne, Germany this September."
"As the aim of treating CLL, particularly in the frontline setting, is to maximize progression free survival while minimizing side effects, we are therefore encouraged by these promising results," said Dr. Kathy Rouan, Vice President BioPharmaceutical Development, GlaxoSmithKline. "We are planning regulatory submissions in the EU, US, and other regions in the coming months."
Haben einfach einen Lauf derzeit. Jetzt ersteht wohl auch noch Arzerra von den Scheintoten auf?
(leider kann ich nicht einschätzen, welches Potential im CLL-Markt für Arzerra überhaupt noch besteht. Da ändert sich derzeit so wahnsinnig viel... Denke aber, dass man in den nächsten Tagen dazu von Analystenseite das ein oder andere hören wird.)
Company Announcement
•Median 22.4 month progression free survival in patients treated with ofatumumab plus chlorambucil, an improvement of 9.3 months compared to chlorambucil alone
•No unexpected safety findings
Copenhagen, Denmark and London UK; May 29, 2013 — Genmab A/S (OMX: GEN) and GlaxoSmithKline plc (GSK) announced today that their Phase III study of ARZERRA® (ofatumumab) in combination with chlorambucil versus chlorambucil alone in patients with previously untreated chronic lymphocytic leukemia (CLL) met its primary endpoint of progression free survival (PFS) as assessed by an Independent Review Committee (IRC).
A total of 447 patients were enrolled in the study. A 9.3 month improvement in the time a patient lived without worsening of their disease (median PFS) was seen in patients randomized to ofatumumab and chlorambucil compared to patients randomized to chlorambucil alone (22.4 months vs. 13.1 months; Hazard Ratio 0.57; p<0.001).
There were no unexpected safety findings. The most common (≥1%) serious adverse events as reported by the investigator within 60 days of last treatment were neutropenia [including febrile neutropenia] (5%), anaemia (4%), pneumonia (4%), and pyrexia (2%). Infusion reactions were mild to moderate in severity with 3% of infusion reactions reported as serious.
"We are delighted with the positive results from this trial which we believe may lead to ofatumumab plus chlorambucil as an additional treatment option for the care of patients with CLL," said Jan van de Winkel, Ph.D., Chief Executive Officer of Genmab. "We look forward to submitting the study results, including secondary endpoints, to the International Workshop on CLL (iwCLL) in Cologne, Germany this September."
"As the aim of treating CLL, particularly in the frontline setting, is to maximize progression free survival while minimizing side effects, we are therefore encouraged by these promising results," said Dr. Kathy Rouan, Vice President BioPharmaceutical Development, GlaxoSmithKline. "We are planning regulatory submissions in the EU, US, and other regions in the coming months."
Mal ein Artikel auf Deutsch, der zwar nicht in die Tiefe geht, jedoch einige der hier besprochenen Werte beinhaltet:
http://www.boerse-online.de/aktie/nachrichten/deutschland/:B…
http://www.boerse-online.de/aktie/nachrichten/deutschland/:B…
IMMU +13%
"...tumor shrinkage, including partial responses determined by RECIST criteria, was achieved in dose-escalation trials of IMMU-130 and IMMU-132 ADC product candidates..."
http://www.nasdaq.com/article/immunomedics-presents-clinical…
"...tumor shrinkage, including partial responses determined by RECIST criteria, was achieved in dose-escalation trials of IMMU-130 and IMMU-132 ADC product candidates..."
http://www.nasdaq.com/article/immunomedics-presents-clinical…
IMMU tut meinem Depot jetzt mal gut. Finde die Bewertung immer noch recht ansprechend. Es fällt mir schwer, aber ich lasse noch laufen...
Hat jemand CLSN verfolgt, kommen die Totgeglaubten zurück?
Antwort auf Beitrag Nr.: 44.745.965 von SLGramann am 30.05.13 09:26:14Genmab - Arzerra:
Analysten gehen wohl davon aus, dass die gestern veröffentlichten Daten zwar gut, aber in Anbetracht neuer Konkurrenz nicht gut genug sind:
The 1L CLL data for Arzerra looks uncompetitive to GA101 and potentially even to Rituxan...
usw.
Wenn auch weitere PIII-Trials im nächsten Jahr positive Daten liefern sollten, könnten langfristig über die verschiedenen Indikationen hinweg Umsätze von bis zu 1 Mrd. Dollar möglich sein.
Arzerra könnte also theoretisch mal ein relativ bedeutendes Asset für Genmab werden, aber noch liegt da viel im Nebel. Euphorie ist zunächst mal nicht angezeigt, was auch gut zum gestrigen Kursverlauf passt.
Analysten gehen wohl davon aus, dass die gestern veröffentlichten Daten zwar gut, aber in Anbetracht neuer Konkurrenz nicht gut genug sind:
The 1L CLL data for Arzerra looks uncompetitive to GA101 and potentially even to Rituxan...
usw.
Wenn auch weitere PIII-Trials im nächsten Jahr positive Daten liefern sollten, könnten langfristig über die verschiedenen Indikationen hinweg Umsätze von bis zu 1 Mrd. Dollar möglich sein.
Arzerra könnte also theoretisch mal ein relativ bedeutendes Asset für Genmab werden, aber noch liegt da viel im Nebel. Euphorie ist zunächst mal nicht angezeigt, was auch gut zum gestrigen Kursverlauf passt.
Antwort auf Beitrag Nr.: 44.751.497 von BiotechHype am 30.05.13 18:24:06IMMU:
Hammer äußert sich lobend zu sehr frühen Daten des IMMU-132-ADC:
Actually, I thought initial signs with the TROP2 ADC were very encouraging. Quite surprising to see responses already at the 2 lowest doses, let alone with an ADC based on SN38 (irinotecan). Definitely something to follow up on (didn’t see anything on that program at ASCO 2013)
Ohad
Ansonsten eine Frage an die IMMU-Investoren:
Wie seht ihr Epratuzumab im Vergleich mit Benlysta?
Hat sich da mal einer die Mühe gemacht, vorhandene Daten zu vergleichen oder Meinungen von Fachleuten zu sammeln?
Ich hab nicht den Eindruck, dass der Markt da viel erwartet, wenn ich mir die Marktkapitalisierung ansehe und andererseits das große Potential bei SLE und die guten Lizenzbedingungen mit UCB.
Kann jemand da etwas Licht ins Dunkel bringen?
Hammer äußert sich lobend zu sehr frühen Daten des IMMU-132-ADC:
Actually, I thought initial signs with the TROP2 ADC were very encouraging. Quite surprising to see responses already at the 2 lowest doses, let alone with an ADC based on SN38 (irinotecan). Definitely something to follow up on (didn’t see anything on that program at ASCO 2013)
Ohad
Ansonsten eine Frage an die IMMU-Investoren:
Wie seht ihr Epratuzumab im Vergleich mit Benlysta?
Hat sich da mal einer die Mühe gemacht, vorhandene Daten zu vergleichen oder Meinungen von Fachleuten zu sammeln?
Ich hab nicht den Eindruck, dass der Markt da viel erwartet, wenn ich mir die Marktkapitalisierung ansehe und andererseits das große Potential bei SLE und die guten Lizenzbedingungen mit UCB.
Kann jemand da etwas Licht ins Dunkel bringen?
Auf fierce ist ein Artikel von John Carroll zum breakthrough-Status erschienen.
Das klingt weiter alles etwas schwammig, aber inzwischen glaube ich, dass es genau diese "Schwammigkeit" ist, die den breakthrough-Status ausmacht und ihn wertvoll macht.
Ich denke, dass man mit breakthrough keinen fest definierten Regulierungsrahmen mit konkreten Detailregelungen schaffen wollte, sondern dass man es so sehen kann, dass bei breakthrough-Projekten die FDA - etwas überspitzt formuliert - von einer Zulassungsbehörde zum Entwicklungspartner mutiert.
Man schaut sich gemeinsam an, wie man bei einem konkreten Projekt die Zeit bis zur Zulassung möglichst verkürzen kann (Trialgröße, Endpunkte usw.). Das wird jedesmal etwas anders laufen, immer auf den Einzelfall abgestimmt. Es gibt also gar nicht DEN EINEN breakthrough-Status.
(Außerdem würde ich persönlich schlussfolgern, dass ein Medikament mit breakthrough-Status eine 100%-Zulassungswahrscheinlichkeit hat, wenn es in einem pivotal-Trial den Endpunkt erreicht.)
CHICAGO--The FDA's oncology chief, Richard Pazdur, used his turn in front of the press mob at ASCO today to make some very public vows about his commitment to the newly launched breakthrough-drug program, that intriguing new classification for certain stellar therapeutic programs that will be extended VIP status at the agency.
Pazdur stressed that any drug development team working on a breakthrough drug will have no trouble getting steady feedback from the agency, and in particular the oncology division he runs. Pazdur and the agency view these drugs as potentially "transformative" therapies capable of changing the course of patients' lives. And the agency is committed to spending time in an "iterative fashion," holding monthly meetings and teleconferences to advise teams on accelerating the whole development process, with a goal of quickening final marketing decisions.
This is going to be a "different communication structure," Pazdur promises, "with much more of a continuous dialogue with sponsors." Together, regulators and development teams can change endpoints, downsize trial sizes in light of the data they're seeing and expedite reviews--adaptive research with regulatory input.
...
http://www.fiercebiotech.com/story/fda-oncology-chief-pazdur…
Das klingt weiter alles etwas schwammig, aber inzwischen glaube ich, dass es genau diese "Schwammigkeit" ist, die den breakthrough-Status ausmacht und ihn wertvoll macht.
Ich denke, dass man mit breakthrough keinen fest definierten Regulierungsrahmen mit konkreten Detailregelungen schaffen wollte, sondern dass man es so sehen kann, dass bei breakthrough-Projekten die FDA - etwas überspitzt formuliert - von einer Zulassungsbehörde zum Entwicklungspartner mutiert.
Man schaut sich gemeinsam an, wie man bei einem konkreten Projekt die Zeit bis zur Zulassung möglichst verkürzen kann (Trialgröße, Endpunkte usw.). Das wird jedesmal etwas anders laufen, immer auf den Einzelfall abgestimmt. Es gibt also gar nicht DEN EINEN breakthrough-Status.
(Außerdem würde ich persönlich schlussfolgern, dass ein Medikament mit breakthrough-Status eine 100%-Zulassungswahrscheinlichkeit hat, wenn es in einem pivotal-Trial den Endpunkt erreicht.)
CHICAGO--The FDA's oncology chief, Richard Pazdur, used his turn in front of the press mob at ASCO today to make some very public vows about his commitment to the newly launched breakthrough-drug program, that intriguing new classification for certain stellar therapeutic programs that will be extended VIP status at the agency.
Pazdur stressed that any drug development team working on a breakthrough drug will have no trouble getting steady feedback from the agency, and in particular the oncology division he runs. Pazdur and the agency view these drugs as potentially "transformative" therapies capable of changing the course of patients' lives. And the agency is committed to spending time in an "iterative fashion," holding monthly meetings and teleconferences to advise teams on accelerating the whole development process, with a goal of quickening final marketing decisions.
This is going to be a "different communication structure," Pazdur promises, "with much more of a continuous dialogue with sponsors." Together, regulators and development teams can change endpoints, downsize trial sizes in light of the data they're seeing and expedite reviews--adaptive research with regulatory input.
...
http://www.fiercebiotech.com/story/fda-oncology-chief-pazdur…
IMMU
halte ich seit ein paar Monaten.
Für IMMU sprach aus meiner Sicht
- 2 KEs kürzlich durchgeführt (also hoffentlich nicht so bald wieder; Cash ca. 50M, Cashburn 6M/Q)
- 4 konjugierte AK, auf Basis eigener Entwickungsplattform und mit geringerer Toxizität
- Substanzen in fortgeschrittener klinischer Entwicklung
- 200M $ MK
- breitgefächerte interessante Indikationen (SLE, PancreasCa., NHL, RA, CLL), die rein onkologischen PLs mag ich persönlich nicht so
- gute Partner
- haben schon (diagnostische) Produkte auf dem Markt
- pos. Analystenkommentare
Zu Epratuzumab/SLE laufen 2 P3 Studien (n=2*780) bis vorauss. H1 /2014
Von Todesfällen oder schwerwiegenden Infektionen (wie bei Benlysta) wurde bisher nichts berichtet. Die Studien werden in allen Kontinenten inkl. US und EU durchgeführt (d.h. Datenqualität und Akzeptanz!). HZK ist ein "combined Response index" ohne weitere Details, für mich ist ein Vergleich mit Benlysta nicht machbar (SLEDAI).
Der SLE Markt wird als groß genug für 2 Akteure angesehen.
Von Benlysta profitiert wohl 1 von 11 behandelten Patienten, das dürfte unschwer zu über bieten sein.
Die Bewertung nimmt der Markt gerade vor ...
Gruß
me_2
halte ich seit ein paar Monaten.
Für IMMU sprach aus meiner Sicht
- 2 KEs kürzlich durchgeführt (also hoffentlich nicht so bald wieder; Cash ca. 50M, Cashburn 6M/Q)
- 4 konjugierte AK, auf Basis eigener Entwickungsplattform und mit geringerer Toxizität
- Substanzen in fortgeschrittener klinischer Entwicklung
- 200M $ MK
- breitgefächerte interessante Indikationen (SLE, PancreasCa., NHL, RA, CLL), die rein onkologischen PLs mag ich persönlich nicht so
- gute Partner
- haben schon (diagnostische) Produkte auf dem Markt
- pos. Analystenkommentare
Zu Epratuzumab/SLE laufen 2 P3 Studien (n=2*780) bis vorauss. H1 /2014
Von Todesfällen oder schwerwiegenden Infektionen (wie bei Benlysta) wurde bisher nichts berichtet. Die Studien werden in allen Kontinenten inkl. US und EU durchgeführt (d.h. Datenqualität und Akzeptanz!). HZK ist ein "combined Response index" ohne weitere Details, für mich ist ein Vergleich mit Benlysta nicht machbar (SLEDAI).
Der SLE Markt wird als groß genug für 2 Akteure angesehen.
Von Benlysta profitiert wohl 1 von 11 behandelten Patienten, das dürfte unschwer zu über bieten sein.
Die Bewertung nimmt der Markt gerade vor ...
Gruß
me_2
ARRY
Selumetinib in uveal melanoma... auf Basis der PII müsste eigentlich eine vorzeitige Zulassung für diese Nischen-Indikation möglich sein, oder?
http://www.thestreet.com/story/11937824/1/asco-13-array-drug…
ASCO '13: Array Drug First to be Effective Against Melanoma of the Eye
An experimental drug from AstraZeneca (AZN_) and Array Biopharma (ARRY_) shrank tumors in half of patients with melanoma of the eye and delayed the re-growth of tumors for twice as long as patients treated with temozolomide, a commonly used melanoma drug.
The phase II study of selumetinib, presented at the American Society of Clinical Oncology (ASCO) annual meeting, is the first to ever demonstrate a meaningful clinical benefit for patients with advanced melanoma of the eye.
...
Melanoma of the eye is a rare cancer, with about 2,000 cases diagnosed in the U.S. each year. About half of patients develop metastatic disease with survival ranging from nine to 12 months. No currently approved drugs are effective in treating melanoma of the eye, including drugs for skin melanoma.
...
In the study, 98 patients with metastatic melanoma of the eye were randomized to treatment with selumetinib or temozolomide. Fifteen percent of selumetinib-treated patients achieving major tumor shrinkage while temozolomide produced no tumor shrinkage.
Selumetinib delayed the regrowth of tumors (progression-free survival) by a median of 15.9 weeks compared to 7 weeks for temozolomide.
Median overall survival for selumetinib-treated patients was 10.8 months compared to 9.4 months for temozolomide. The relatively small survival benefit was impacted by temozolomide patients who "crossed over" to receive selumetinib once their tumors started to grow again.
...
**********
Die Woche wurde zudem der HER2-Hemmer ARRY-380 an ONTY auslizensiert. ARRY-380 war eigentlich bereits abgeschrieben. Soweit ich es verstehe, ist ein HER2-Inhibitor gegenüber einem HER2-AK nur ein Nischenprodukt z.B. bei Brustkrebs mit HER2+ Gehirntumoren, da AKs nicht bsi ins Gehirn vordringen können. PBYI's HER-Hemmer Neratinib in PII ist ein möglicher Konkurrent, der wohl schon etwas weiter ist.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY - ONTY/380 deal CC notes (5/30/13)
1. ONTY responsible for funding Phase 2 PoC trials and they will test ARRY-380 with approved breast cancer drugs. Reference during Q&A that the multiple Phase 2 PoC trials could include combo of 380 with pertuzumab, T-DM1, Herceptin, capecitabine, and the taxanes. (ARRY has not discussed with ONTY if there will be combo trials of 380 with ONTY's PI3K, PX-866.)
2. ARRY-380 is the only selective small molecule HER2 inhibitor in the clinic or on the market.
3. Some perceived advantages of 380 over other HER2 drugs include low incidence of rash/GI side effects (limiting for other HER2 drugs) and the ability to penetrate blood brain barrier and treat brain mets.
4. If ARRY opts out of Phase 3 co-development, they expect the royalty due to ARRY will be double-digit.

Gruß
ipollit
Selumetinib in uveal melanoma... auf Basis der PII müsste eigentlich eine vorzeitige Zulassung für diese Nischen-Indikation möglich sein, oder?
http://www.thestreet.com/story/11937824/1/asco-13-array-drug…
ASCO '13: Array Drug First to be Effective Against Melanoma of the Eye
An experimental drug from AstraZeneca (AZN_) and Array Biopharma (ARRY_) shrank tumors in half of patients with melanoma of the eye and delayed the re-growth of tumors for twice as long as patients treated with temozolomide, a commonly used melanoma drug.
The phase II study of selumetinib, presented at the American Society of Clinical Oncology (ASCO) annual meeting, is the first to ever demonstrate a meaningful clinical benefit for patients with advanced melanoma of the eye.
...
Melanoma of the eye is a rare cancer, with about 2,000 cases diagnosed in the U.S. each year. About half of patients develop metastatic disease with survival ranging from nine to 12 months. No currently approved drugs are effective in treating melanoma of the eye, including drugs for skin melanoma.
...
In the study, 98 patients with metastatic melanoma of the eye were randomized to treatment with selumetinib or temozolomide. Fifteen percent of selumetinib-treated patients achieving major tumor shrinkage while temozolomide produced no tumor shrinkage.
Selumetinib delayed the regrowth of tumors (progression-free survival) by a median of 15.9 weeks compared to 7 weeks for temozolomide.
Median overall survival for selumetinib-treated patients was 10.8 months compared to 9.4 months for temozolomide. The relatively small survival benefit was impacted by temozolomide patients who "crossed over" to receive selumetinib once their tumors started to grow again.
...
**********
Die Woche wurde zudem der HER2-Hemmer ARRY-380 an ONTY auslizensiert. ARRY-380 war eigentlich bereits abgeschrieben. Soweit ich es verstehe, ist ein HER2-Inhibitor gegenüber einem HER2-AK nur ein Nischenprodukt z.B. bei Brustkrebs mit HER2+ Gehirntumoren, da AKs nicht bsi ins Gehirn vordringen können. PBYI's HER-Hemmer Neratinib in PII ist ein möglicher Konkurrent, der wohl schon etwas weiter ist.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY - ONTY/380 deal CC notes (5/30/13)
1. ONTY responsible for funding Phase 2 PoC trials and they will test ARRY-380 with approved breast cancer drugs. Reference during Q&A that the multiple Phase 2 PoC trials could include combo of 380 with pertuzumab, T-DM1, Herceptin, capecitabine, and the taxanes. (ARRY has not discussed with ONTY if there will be combo trials of 380 with ONTY's PI3K, PX-866.)
2. ARRY-380 is the only selective small molecule HER2 inhibitor in the clinic or on the market.
3. Some perceived advantages of 380 over other HER2 drugs include low incidence of rash/GI side effects (limiting for other HER2 drugs) and the ability to penetrate blood brain barrier and treat brain mets.
4. If ARRY opts out of Phase 3 co-development, they expect the royalty due to ARRY will be double-digit.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.764.917 von me_2 am 01.06.13 14:19:27nach dem Kommentar von mcbio scheint Epratuzumab aber sehr riskant zu sein:
"IMMU’s prior Phase 2 lupus data was mixed, at best. Hard to have confidence in the Phase 3 based on prior Phase 2 data IMHO."
Wenn die ADCs vielversprechend sind, könnte man auch auf eine negative Epratuzumab PIII mit entsprechendem Kurseinbruch setzen und dann erst kaufen.
Gruß
ipollit
"IMMU’s prior Phase 2 lupus data was mixed, at best. Hard to have confidence in the Phase 3 based on prior Phase 2 data IMHO."
Wenn die ADCs vielversprechend sind, könnte man auch auf eine negative Epratuzumab PIII mit entsprechendem Kurseinbruch setzen und dann erst kaufen.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.765.089 von ipollit am 01.06.13 14:57:30Kann ich aufgrund der Daten auf der IMMU-HP nicht nachvollziehen. Efficacy responder 49% mit 600mg/W vs. 21% für Placebo (EMBLEM Studie). Hab schon viele P3 auf tönerneren Füssen gesehen.
War ne P2b/dose finding study, ich denke die Richtung passt schon.
War ne P2b/dose finding study, ich denke die Richtung passt schon.
Antwort auf Beitrag Nr.: 44.765.089 von ipollit am 01.06.13 14:57:30wer oder was ist mcbio ?
Antwort auf Beitrag Nr.: 44.765.055 von ipollit am 01.06.13 14:48:16Das sind doch tolle Neuigkeiten. Vielleicht gelingt ja dann auch der charttchnische Ausbruch.
Ich fand den Deal mit ARRY-380 eigentlich auch ganz gut. 10 Millionen Upfront kann ARRY ja auch ganz gut gebrauchen, um die eigenen P III Studie(n) zu machen. Verwundert bin ich aber schon über den Partner, der ja im Grunde viel kleiner ist als ARRY selber. Die mussten sich ja sogar das Geld für die Upfront Zahlung durch eine KE besorgen. Wenn ich das auf die Schnelle richtig gesehen habe, haben die 13 Mio Cash.?
http://finance.yahoo.com/news/oncothyreon-announces-10-milli…
Ebenso gab es Neues von Aslan bzgl. ARRY 543:
http://www.aslanpharma.com/download/Press%20Release%20-%20AS…
IMMU hatte ich lange auf der Watch - und bin nun nicht dabei. Glückwunsch an alle investierten! Man kann ja aber auch nicht überall dabei sein;-)
Das Risiko des Schiterns ist bei Lupus aber nicht zu unterschätzen. Es gab ja auch ewig (50 Jahre) keinen Erfolg einer PIII bei dieser Indikation.
Adam F. hatte sich kürzlich negativ zu IMMU geäußert:
Hey Adam, can you comment on Immunomedics (IMMU_)? I haven't seen a lot of recent articles on the stock and I'm trying to decide if this stock is a good buy at these levels."
"Immunomedics was founded in 1982 and is run by the husband-and-wife team of David Goldenberg and Cynthia Sullivan. They each make more than $1 million annually but over 31 years, Immunomedics has not come close to developing a drug successfully. Epratuzumab, an anti-CD 22 monoclonal antibody, has been the company's lead drug for more than two decades. Amgen actually licensed epratuzumab in 2000 but gave the drug back three years later.
Today, UCB is developing epratuzumab in lupus under a license from Immunomedics. Two phase III studies are underway with top-line results expected in the first half of 2014. Epratuzumab phase II data in lupus were mixed. Speaking to institutional investors, I hear a lot of skepticism about epratuzumab in lupus because the drug doesn't really look any better than the currently approved lupus drug Benlysta. GlaxoSmithKline (GSK_) paid too much for Human Genome Sciences and Benlysta has been a big commercial disappointment.
On its own, Immunomedics is pursuing development of epratuzumab coupled to a radioactive payload in several lymphoma indications. Unfortunately, radio-labeled monoclonal antibodies have been an impossible sell (Spectrum's (SPPI_) Zevalin.) Even worse for Immunomedics, the lymphoma sandbox is dominated today by Pharmacyclics' ibrutinib. Roche (RHHBY) is also developing an antibody drug conjugate through a license from Seattle Genetics (SGEN_), targeting the same lymphoma indications. This week, Pfizer (PFE_) shut down development of an anti-CD 22 monoclonal antibody drug conjugate due to lack of efficacy. Immunomedics lacks the financial resources and the drug development expertise to compete.
Immunomedics is developing another radio-labeled monocolonal antibody, clivatuzumab, in pancreatic cancer. We're supposed to see phase Ib data in July.
I wrote this about Immunomedics almost four years ago:
At $3 and with an enterprise value under $200 million, Immunomedics isn't an expensive stock and I guess you can make a viable argument that the stock is undervalued given the phase II and phase III status of its drugs. (This is the bull case made by the analyst at Brean Murray Carret. She has a buy and an $8 price target on the stock.)
Today, Immunomedics is a $3 stock with an enterprise value of $150 million. Not exactly a lot of progress made in four years. "
http://www.thestreet.com/story/11932328/2/biotech-stock-mail…
Das muss natürlich nichts heißen - und war ja auch vor den kürzlich veröffentlichten Ergebnissen...
Ich fand den Deal mit ARRY-380 eigentlich auch ganz gut. 10 Millionen Upfront kann ARRY ja auch ganz gut gebrauchen, um die eigenen P III Studie(n) zu machen. Verwundert bin ich aber schon über den Partner, der ja im Grunde viel kleiner ist als ARRY selber. Die mussten sich ja sogar das Geld für die Upfront Zahlung durch eine KE besorgen. Wenn ich das auf die Schnelle richtig gesehen habe, haben die 13 Mio Cash.?
http://finance.yahoo.com/news/oncothyreon-announces-10-milli…
Ebenso gab es Neues von Aslan bzgl. ARRY 543:
http://www.aslanpharma.com/download/Press%20Release%20-%20AS…
IMMU hatte ich lange auf der Watch - und bin nun nicht dabei. Glückwunsch an alle investierten! Man kann ja aber auch nicht überall dabei sein;-)
Das Risiko des Schiterns ist bei Lupus aber nicht zu unterschätzen. Es gab ja auch ewig (50 Jahre) keinen Erfolg einer PIII bei dieser Indikation.
Adam F. hatte sich kürzlich negativ zu IMMU geäußert:
Hey Adam, can you comment on Immunomedics (IMMU_)? I haven't seen a lot of recent articles on the stock and I'm trying to decide if this stock is a good buy at these levels."
"Immunomedics was founded in 1982 and is run by the husband-and-wife team of David Goldenberg and Cynthia Sullivan. They each make more than $1 million annually but over 31 years, Immunomedics has not come close to developing a drug successfully. Epratuzumab, an anti-CD 22 monoclonal antibody, has been the company's lead drug for more than two decades. Amgen actually licensed epratuzumab in 2000 but gave the drug back three years later.
Today, UCB is developing epratuzumab in lupus under a license from Immunomedics. Two phase III studies are underway with top-line results expected in the first half of 2014. Epratuzumab phase II data in lupus were mixed. Speaking to institutional investors, I hear a lot of skepticism about epratuzumab in lupus because the drug doesn't really look any better than the currently approved lupus drug Benlysta. GlaxoSmithKline (GSK_) paid too much for Human Genome Sciences and Benlysta has been a big commercial disappointment.
On its own, Immunomedics is pursuing development of epratuzumab coupled to a radioactive payload in several lymphoma indications. Unfortunately, radio-labeled monoclonal antibodies have been an impossible sell (Spectrum's (SPPI_) Zevalin.) Even worse for Immunomedics, the lymphoma sandbox is dominated today by Pharmacyclics' ibrutinib. Roche (RHHBY) is also developing an antibody drug conjugate through a license from Seattle Genetics (SGEN_), targeting the same lymphoma indications. This week, Pfizer (PFE_) shut down development of an anti-CD 22 monoclonal antibody drug conjugate due to lack of efficacy. Immunomedics lacks the financial resources and the drug development expertise to compete.
Immunomedics is developing another radio-labeled monocolonal antibody, clivatuzumab, in pancreatic cancer. We're supposed to see phase Ib data in July.
I wrote this about Immunomedics almost four years ago:
At $3 and with an enterprise value under $200 million, Immunomedics isn't an expensive stock and I guess you can make a viable argument that the stock is undervalued given the phase II and phase III status of its drugs. (This is the bull case made by the analyst at Brean Murray Carret. She has a buy and an $8 price target on the stock.)
Today, Immunomedics is a $3 stock with an enterprise value of $150 million. Not exactly a lot of progress made in four years. "
http://www.thestreet.com/story/11932328/2/biotech-stock-mail…
Das muss natürlich nichts heißen - und war ja auch vor den kürzlich veröffentlichten Ergebnissen...
Wahnsinn auch wie die ASCO über Twitter ins WWW schwappt. Wer Lust und Zeit hat sollte sich das mal ansehen:
http://www.biotechinvestorsnetwork.com/ - ganz rechts!
Dann doch lieber zu Hause sein und Pokalfinale scheuen:

Auf die Schnelle noch einige Infos aus dem Twittergewitter zu ARRY:
Selumetinib, from Array Biopharma and AstraZeneca, also showed positive results. Results from a late-stage study showed that in uveal melanoma (that’s melanoma of the eye) patients were likely to see their tumors shrink on this new drug, but not on the older melanoma treatment temozolomide. It took 15.9 weeks for their disease to worse, versus 7 for the older drug.
“I think the study in uveal melanoma will ultimately be practice changing,” said Schucter. “This has been a very difficult disease to treat.”
http://www.forbes.com/sites/matthewherper/2013/06/01/five-pr…
laut mcbio via Twitter: "CEO said recently uveal could be fast path 2 market 4 selumetinib..assume this data not sufficient 4 approval though"
https://twitter.com/search?q=%24ARRY&src=ctag
http://www.biotechinvestorsnetwork.com/ - ganz rechts!
Dann doch lieber zu Hause sein und Pokalfinale scheuen:

Auf die Schnelle noch einige Infos aus dem Twittergewitter zu ARRY:
Selumetinib, from Array Biopharma and AstraZeneca, also showed positive results. Results from a late-stage study showed that in uveal melanoma (that’s melanoma of the eye) patients were likely to see their tumors shrink on this new drug, but not on the older melanoma treatment temozolomide. It took 15.9 weeks for their disease to worse, versus 7 for the older drug.
“I think the study in uveal melanoma will ultimately be practice changing,” said Schucter. “This has been a very difficult disease to treat.”
http://www.forbes.com/sites/matthewherper/2013/06/01/five-pr…
laut mcbio via Twitter: "CEO said recently uveal could be fast path 2 market 4 selumetinib..assume this data not sufficient 4 approval though"
https://twitter.com/search?q=%24ARRY&src=ctag
Richard Carvajal, an investigator at Memorial-Sloan Kettering Cancer Center, says that in a clinical study the selumetinib arm more than doubled progression-free survival in patients, jumping from 7 weeks in the chemotherapy arm of the study to 15.9 weeks in the drug arm. Overall survival surged from 9.4 months for chemo to 10.8 months in the selumetinib group, with crossovers into the drug arm perhaps explaining the slim OS benefit that was tracked.
http://www.fiercebiotech.com/story/astrazenecas-selumetinib-…
The research is still early, and it may be years before a treatment becomes commercially available. But Carvajal said he hopes patients can benefit from clinical trials until then.
The team is working with AstraZeneca on plans for a follow-up study to confirm the findings for selumetinib, which the company has been studying as a treatment thyroid and lung cancer. That study will open this fall.
And they are also working with GlaxoSmithKline and the National Cancer Institute to study their MEK inhibitor, called Mekinist, or trametinib, which won approval this week for treatment of advanced melanoma.
The team wants to combine Mekinist with an experimental Glaxo treatment that blocks a different protein called Akt based on studies in Schwartz's lab that show the combination may be even more effective at halting tumor growth.
http://www.reuters.com/article/2013/06/01/us-cancer-melanoma…
Bei Crossover kommt mir natürlich gleich Aveo in den Sinn. Hier scheint jedoch mehr Wert auf ethische Gesichtspunkte gelegt worden zu sein. Außerdem gibt es zur Zeit ja keine Alternativen. Kann eigentlich nicht wahr sein, dass man da jetzt noch Jahre bis zur Zulassung verstreichen lassen will...
http://www.fiercebiotech.com/story/astrazenecas-selumetinib-…
The research is still early, and it may be years before a treatment becomes commercially available. But Carvajal said he hopes patients can benefit from clinical trials until then.
The team is working with AstraZeneca on plans for a follow-up study to confirm the findings for selumetinib, which the company has been studying as a treatment thyroid and lung cancer. That study will open this fall.
And they are also working with GlaxoSmithKline and the National Cancer Institute to study their MEK inhibitor, called Mekinist, or trametinib, which won approval this week for treatment of advanced melanoma.
The team wants to combine Mekinist with an experimental Glaxo treatment that blocks a different protein called Akt based on studies in Schwartz's lab that show the combination may be even more effective at halting tumor growth.
http://www.reuters.com/article/2013/06/01/us-cancer-melanoma…
Bei Crossover kommt mir natürlich gleich Aveo in den Sinn. Hier scheint jedoch mehr Wert auf ethische Gesichtspunkte gelegt worden zu sein. Außerdem gibt es zur Zeit ja keine Alternativen. Kann eigentlich nicht wahr sein, dass man da jetzt noch Jahre bis zur Zulassung verstreichen lassen will...
SNTA:
Das scheint nicht zu reichen:
http://www.4-traders.com/SYNTA-PHARMACEUTICALS-COR-42507/new…
Schade und autsch.
Das scheint nicht zu reichen:
http://www.4-traders.com/SYNTA-PHARMACEUTICALS-COR-42507/new…
Schade und autsch.
Was ist den bei Galena Biopharma los?



ASCO...
2 Verlierer und ein Gewinner



Ohad Hammer setzt weiter auf INFI und SNTA. INFI's IPI-145 halte ich nachwievor für eine lohnende Investition. Ich sehe bisher nicht, dass Idelalisib besser ist!? Zudem wirkt IPI-145 anders als Idelalisib und Ibrutinib auch gegen T-Lymphome. Bei SNTA bin ich mir unsicher, weil alles recht schwammig ist. Die favorisierten Subgruppen könnten rein zufällig sein.
Die Reaktion bei CLVS finde ich etwas überraschend. CO-1686 ist interessant, weil bisher keine anderer EGFR-Inhibitor gegen T790M mutiertes EGFR wirkt. Jetzt gibt es in der PI ein erstes nachweisbares Ansprechen auf die CO-1686. Das ein vorläufiges PI-Ergebnis die MK direkt um 1 Mrd USD bewegt, finde ich aber schon etwas extrem. Hinzu kommt ein ebenfalls positives Ansprechen auf den PARP-Inhibitor Rucaparib in PI bei Bauchspeicheldrüsenkrebs. Die Klasse der PARP-Hemmer ist wieder in geworden und Rucaparib könnte dabei auch eine Rolle spielen.
Gruß
ipollit
2 Verlierer und ein Gewinner
Ohad Hammer setzt weiter auf INFI und SNTA. INFI's IPI-145 halte ich nachwievor für eine lohnende Investition. Ich sehe bisher nicht, dass Idelalisib besser ist!? Zudem wirkt IPI-145 anders als Idelalisib und Ibrutinib auch gegen T-Lymphome. Bei SNTA bin ich mir unsicher, weil alles recht schwammig ist. Die favorisierten Subgruppen könnten rein zufällig sein.
Die Reaktion bei CLVS finde ich etwas überraschend. CO-1686 ist interessant, weil bisher keine anderer EGFR-Inhibitor gegen T790M mutiertes EGFR wirkt. Jetzt gibt es in der PI ein erstes nachweisbares Ansprechen auf die CO-1686. Das ein vorläufiges PI-Ergebnis die MK direkt um 1 Mrd USD bewegt, finde ich aber schon etwas extrem. Hinzu kommt ein ebenfalls positives Ansprechen auf den PARP-Inhibitor Rucaparib in PI bei Bauchspeicheldrüsenkrebs. Die Klasse der PARP-Hemmer ist wieder in geworden und Rucaparib könnte dabei auch eine Rolle spielen.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.735.409 von ipollit am 28.05.13 23:23:46EPZM hat in den 2 Tagen seit dem IPO zu 15 USD fast 100% zugelegt... leider bin ich nicht dabei 


CLDX... etwas zu CDX-1127 vom Deutsche Bank Meeting (29.Mai):
http://seekingalpha.com/article/1469121-celldex-therapeutics…
Alethia Young - Deutsche Bank: So maybe now we are just in the midpoint, are there any questions in the room or over the webcast. Okay, I have no questions here, so maybe we will just move forward. And just talk a little bit about 1127. I mean just in general on the CD-27 pathway, just give us like an overview and then we will drill down a little bit further.
Anthony S. Marucci: So there's two sides of the T-Cells. So you have the checkpoint inhibitors that include [AP] and PD-1 and then you have the other side of the T-Cell which are the activating antibodies which include CD40, CD28, and including CD27. So during our early days at Medarex we helped develop [AP] and PD1. So we know this space pretty well. And our Chief Scientific Officer, Tibor Keler found this target, the CD27 coming out of Southampton and he thought that it would be really nice to be able to activate these. And that's what CD27 does.
So the checkpoint inhibitors need an immune response to help them work whereas 27 activates and then initiates that immune response. So we think that's a good side of the coin to work on.
...
Alethia Young - Deutsche Bank: And what do you see as far as like kind of limiting factors for you?
Anthony S. Marucci: No, we haven't seen any toxicity -- because that's with these kind of activating antibodies that's surely there, that's you are going to cause a lot of toxicity and we haven't seen anything like that.
Alethia Young - Deutsche Bank: And so what kind of toxicities in general might happen with these antibodies?
Anthony S. Marucci: They can cause some autoimmunity, which again if you combine that then with a checkpoint inhibitor, it makes it even worse. So we haven't seen that with this drug yet. And we have dosed all the way up to 10 mgs per kg in the solid tumor arm and so far so good.
Alethia Young - Deutsche Bank: And as far as like seeing the data with the [inaudible] meeting next year or…
Anthony S. Marucci: Yeah, I think it's a meeting called as ITC, in the early part of November. And then for the lymphoma data is probably at ASCO next year.
http://seekingalpha.com/article/1469121-celldex-therapeutics…
Alethia Young - Deutsche Bank: So maybe now we are just in the midpoint, are there any questions in the room or over the webcast. Okay, I have no questions here, so maybe we will just move forward. And just talk a little bit about 1127. I mean just in general on the CD-27 pathway, just give us like an overview and then we will drill down a little bit further.
Anthony S. Marucci: So there's two sides of the T-Cells. So you have the checkpoint inhibitors that include [AP] and PD-1 and then you have the other side of the T-Cell which are the activating antibodies which include CD40, CD28, and including CD27. So during our early days at Medarex we helped develop [AP] and PD1. So we know this space pretty well. And our Chief Scientific Officer, Tibor Keler found this target, the CD27 coming out of Southampton and he thought that it would be really nice to be able to activate these. And that's what CD27 does.
So the checkpoint inhibitors need an immune response to help them work whereas 27 activates and then initiates that immune response. So we think that's a good side of the coin to work on.
...
Alethia Young - Deutsche Bank: And what do you see as far as like kind of limiting factors for you?
Anthony S. Marucci: No, we haven't seen any toxicity -- because that's with these kind of activating antibodies that's surely there, that's you are going to cause a lot of toxicity and we haven't seen anything like that.
Alethia Young - Deutsche Bank: And so what kind of toxicities in general might happen with these antibodies?
Anthony S. Marucci: They can cause some autoimmunity, which again if you combine that then with a checkpoint inhibitor, it makes it even worse. So we haven't seen that with this drug yet. And we have dosed all the way up to 10 mgs per kg in the solid tumor arm and so far so good.
Alethia Young - Deutsche Bank: And as far as like seeing the data with the [inaudible] meeting next year or…
Anthony S. Marucci: Yeah, I think it's a meeting called as ITC, in the early part of November. And then for the lymphoma data is probably at ASCO next year.
Zur Validität von Studien-Publikationen:
http://news.doccheck.com/de/12787/gefalschte-studien-gehen-s…
ich hoffe der Link funktioniert, sonst einfach unter doccheck.de im Fenster News zu finden.
http://news.doccheck.com/de/12787/gefalschte-studien-gehen-s…
ich hoffe der Link funktioniert, sonst einfach unter doccheck.de im Fenster News zu finden.
CLSN,
kürzlich fragte ich ob die Totgeglaubten zurückkehren
http://seekingalpha.com/article/1479341-celsion-raised-from-…
Bin noch in den fahrenden Zug eingestiegen, guter Newsflow und Chance auf Kurserholung...
kürzlich fragte ich ob die Totgeglaubten zurückkehren
http://seekingalpha.com/article/1479341-celsion-raised-from-…
Bin noch in den fahrenden Zug eingestiegen, guter Newsflow und Chance auf Kurserholung...
Die Klitsche Galena auch heute wieder im freien fall!
Auf der ASCO standen die PD-1´se ja stark im Vordergrund. Wenn ich das richtig verstehe, sind das ja auch wirklich ganz ermutigende und erstaunliche Ergebnisse. Man beachte den zum Schluss parallelen Verlauf!
Für einen Teil von der Melanoma Patienten scheint es ja so gut zu funktionieren, dass sie damit "leben" können.

Fragt sich wie man das beides kombinieren kann und welche Effekte das dann hätte. Laufen da schon Studien?
Fierce hatte vor Kurzem die Frage nach der Finanzierbarkeit dieser Erfolge gestellt. Irgendwie pervers, wenn es schlicht um Leben oder Tod geht. Andereseits auch berechtigt. Ich glaube, dass könnte noch zu großen Diskussionen führen, wenn Krebs tatsächlich zu einer chronischen Erkrankung wird.
"But now it's turning into a chronic disease, and we're talking about years of maintenance therapy with drugs that cost $10,000 a month."
http://www.fiercebiotech.com/story/asco-presentations-porten…
Genervt bin ich langsam von ARRY, die ja schon wieder einen Kapitalbedarf sehen:
plans to offer, subject to market and other conditions, convertible senior notes due 2020 of approximately $100 million in aggregate principal amount in an underwritten public offering pursuant to an effective shelf registration statement on Form S-3. Array expects to grant the underwriters a 30-day option to purchase up to approximately an additional $15 million in aggregate principal amount of convertible senior notes in connection with the offering.
http://finance.yahoo.com/news/array-biopharma-announces-prop…
Für einen Teil von der Melanoma Patienten scheint es ja so gut zu funktionieren, dass sie damit "leben" können.

Fragt sich wie man das beides kombinieren kann und welche Effekte das dann hätte. Laufen da schon Studien?
Fierce hatte vor Kurzem die Frage nach der Finanzierbarkeit dieser Erfolge gestellt. Irgendwie pervers, wenn es schlicht um Leben oder Tod geht. Andereseits auch berechtigt. Ich glaube, dass könnte noch zu großen Diskussionen führen, wenn Krebs tatsächlich zu einer chronischen Erkrankung wird.
"But now it's turning into a chronic disease, and we're talking about years of maintenance therapy with drugs that cost $10,000 a month."
http://www.fiercebiotech.com/story/asco-presentations-porten…
Genervt bin ich langsam von ARRY, die ja schon wieder einen Kapitalbedarf sehen:
plans to offer, subject to market and other conditions, convertible senior notes due 2020 of approximately $100 million in aggregate principal amount in an underwritten public offering pursuant to an effective shelf registration statement on Form S-3. Array expects to grant the underwriters a 30-day option to purchase up to approximately an additional $15 million in aggregate principal amount of convertible senior notes in connection with the offering.
http://finance.yahoo.com/news/array-biopharma-announces-prop…
Price-Target immerhin/weiterhin 50 ala P.J.
http://finance.yahoo.com/news/infinity-pharmaceuticals-share…
Bin mal heute rein zu 19,01
(links funktionieren heute irgendwie nicht, deswegen copy)
http://finance.yahoo.com/news/infinity-pharmaceuticals-share…
Bin mal heute rein zu 19,01
(links funktionieren heute irgendwie nicht, deswegen copy)
Antwort auf Beitrag Nr.: 44.786.075 von sufenta am 04.06.13 21:34:45INFI... bin leider schon letzte Woche eingestiegen, mit einem solchen Kursverfall hatte ich nicht gerechnet. Habe jetzt auch ein wenig nachgelegt und werde u.U. noch weiter aufstocken.
Ich denke, dass sich IPI-145 eher PCYCs Ibrutinib annähern könnte... also alleine CLL + iNHL Mrd Potential besitzt. Durch Gamma scheint es auch gegen T-Zell Lymphome zu wirken, wodurch es sich von anderen abhebt. Außerdem kann es dadurch auch gegen RA usw. wirksam sein... falls ja, wäre das ein weiterer Mrd Markt, der nicht ansatzweise eingepreist ist.
Twitter-Kommentare...
Comparative Data for $GILD's idelalisib vs. $INFI's IPI-145 in CLL & Lymphomas. (via JPM)

PM remain confident that IPI-145 is on track & expect that prophylactic treatment will improve infection rates as the data matures.
In both CLL&B-cell malignancies, IPI-145’s RR compare favorably, especially in CLL given expectation that NRs convert to PRs (JPM)
Despite hype over IPI-145’s higher rate of infections yesterday, similar rates were seen in the idelalisib data. (JPM)
Full idelalisib data shows that some SAE driven discontinuations were due to bacterial infections (not seen in IPI-145 trials)
Also note bacterial infections in idelalisib trials(not seen in IPI-145 per Dr. Horwitz from MSKCC last night)
*****
oder RBC: "“So what would change sentiment or could turn it around? The docs defended the data and said they were surprised by the reaction today. Stock now trades at $785M market cap or $485M EV ($300M cash) or roughly $685M EV by year end or early 14. This is below even DNDN ($900M EV) and around ITMN ($650M EV). Sentiment may take some time to change but two tangible things to watch are 1) GILD could file GS-1101 on Phase II iNHL data at Lugano this month (Phase I is 58% ORR and 19mo duration and INFI has higher responses) so investors may realize that iNHL is a $1B potential fast-to-market that people forgot after CLL, and 2) ASH where INFI will report 150+ pts and durability and will be prophylaxing so if no major new infections/deaths this could reverse today’s perception.”"
*******
AZN hat heute RIGLs SYK-Hemmer gegen RA an RIGL zurückgegeben. SYK könnte auch ähnlich wie BTK wirken, es gibt auch eine PII gegen NHL. Dazu auch ein Twitter Kommentar: "Fostamatinib is probably a fine drug for some B-cell mediated diseases. Stupid of $RIGL & $AZN to chase after mainly T-cell mediated RA." Bezüglich INFI... wenn für RA eine Wirkung gegen T-Zellen gut ist, so spricht das doch auch für INFIs laufende RA-Studien.
Gruß
ipollit
Ich denke, dass sich IPI-145 eher PCYCs Ibrutinib annähern könnte... also alleine CLL + iNHL Mrd Potential besitzt. Durch Gamma scheint es auch gegen T-Zell Lymphome zu wirken, wodurch es sich von anderen abhebt. Außerdem kann es dadurch auch gegen RA usw. wirksam sein... falls ja, wäre das ein weiterer Mrd Markt, der nicht ansatzweise eingepreist ist.
Twitter-Kommentare...
Comparative Data for $GILD's idelalisib vs. $INFI's IPI-145 in CLL & Lymphomas. (via JPM)

PM remain confident that IPI-145 is on track & expect that prophylactic treatment will improve infection rates as the data matures.
In both CLL&B-cell malignancies, IPI-145’s RR compare favorably, especially in CLL given expectation that NRs convert to PRs (JPM)
Despite hype over IPI-145’s higher rate of infections yesterday, similar rates were seen in the idelalisib data. (JPM)
Full idelalisib data shows that some SAE driven discontinuations were due to bacterial infections (not seen in IPI-145 trials)
Also note bacterial infections in idelalisib trials(not seen in IPI-145 per Dr. Horwitz from MSKCC last night)
*****
oder RBC: "“So what would change sentiment or could turn it around? The docs defended the data and said they were surprised by the reaction today. Stock now trades at $785M market cap or $485M EV ($300M cash) or roughly $685M EV by year end or early 14. This is below even DNDN ($900M EV) and around ITMN ($650M EV). Sentiment may take some time to change but two tangible things to watch are 1) GILD could file GS-1101 on Phase II iNHL data at Lugano this month (Phase I is 58% ORR and 19mo duration and INFI has higher responses) so investors may realize that iNHL is a $1B potential fast-to-market that people forgot after CLL, and 2) ASH where INFI will report 150+ pts and durability and will be prophylaxing so if no major new infections/deaths this could reverse today’s perception.”"
*******
AZN hat heute RIGLs SYK-Hemmer gegen RA an RIGL zurückgegeben. SYK könnte auch ähnlich wie BTK wirken, es gibt auch eine PII gegen NHL. Dazu auch ein Twitter Kommentar: "Fostamatinib is probably a fine drug for some B-cell mediated diseases. Stupid of $RIGL & $AZN to chase after mainly T-cell mediated RA." Bezüglich INFI... wenn für RA eine Wirkung gegen T-Zellen gut ist, so spricht das doch auch für INFIs laufende RA-Studien.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.786.385 von ipollit am 04.06.13 22:09:34vor ASCO... Vergleich mit GILD und PCYC


RIGL
http://www.benzinga.com/analyst-ratings/analyst-color/13/06/…
In a report published on Tuesday, Piper Jaffray analyst Ian Somaiya downgraded Rigel Pharmaceuticals to Neutral and lowered the price target from $9.00 to $6.00.
In the report, Piper Jaffray stated, "Loss of commercial partner and reduced commercial potential moves us to sidelines. We continue to see fostamatinib as an approvable drug. However, we believe AZ's decision to return rights reflects the competitive nature of the RA market and the challenges fostamatinib would likely face gaining sufficient share to justify the ~$300mn in remaining milestone payments and 25-30% royalty on sales. While fostamatinib showed statistical significance in ACR20 reductions compared to placebo in both doses in OSKIRA-2, only the 100mg BID dose showed significance in OSKIRA-3 (Exhibit 1). Importantly, on a placebo adjusted basis, we believe fostamatinib came up short, with adjusted ACR20 scores of ~10-15% compared to 20%+ for Pfizer's Xeljanz, a likely driver of AZ's decision in our opinion. From a safety perspective, fostamatinib was well tolerated with no new safety signals emerging, one positive sign given lingering concerns for potential hypertension and CV events."

http://www.benzinga.com/analyst-ratings/analyst-color/13/06/…
In a report published on Tuesday, Piper Jaffray analyst Ian Somaiya downgraded Rigel Pharmaceuticals to Neutral and lowered the price target from $9.00 to $6.00.
In the report, Piper Jaffray stated, "Loss of commercial partner and reduced commercial potential moves us to sidelines. We continue to see fostamatinib as an approvable drug. However, we believe AZ's decision to return rights reflects the competitive nature of the RA market and the challenges fostamatinib would likely face gaining sufficient share to justify the ~$300mn in remaining milestone payments and 25-30% royalty on sales. While fostamatinib showed statistical significance in ACR20 reductions compared to placebo in both doses in OSKIRA-2, only the 100mg BID dose showed significance in OSKIRA-3 (Exhibit 1). Importantly, on a placebo adjusted basis, we believe fostamatinib came up short, with adjusted ACR20 scores of ~10-15% compared to 20%+ for Pfizer's Xeljanz, a likely driver of AZ's decision in our opinion. From a safety perspective, fostamatinib was well tolerated with no new safety signals emerging, one positive sign given lingering concerns for potential hypertension and CV events."
Antwort auf Beitrag Nr.: 44.786.015 von kmastra am 04.06.13 21:27:21Hallo kmastra,
die Kapitalmaßnahme von Array dient "nur" der Neustrukturierung der langfristigen Schulden. Die wären 2015/2016 fällig geworden - jetzt hat man Zeit bis 2020.
Alles in allem steht Array jetzt besser da. Der jüngste Kursverfall ist nicht nachvollziehbar.
INFI:
Völlig übertriebener Kursverfall. Markt spinnt. Gute Entscheidung von ipollit, jetzt nachzukaufen imho.
die Kapitalmaßnahme von Array dient "nur" der Neustrukturierung der langfristigen Schulden. Die wären 2015/2016 fällig geworden - jetzt hat man Zeit bis 2020.
Alles in allem steht Array jetzt besser da. Der jüngste Kursverfall ist nicht nachvollziehbar.
INFI:
Völlig übertriebener Kursverfall. Markt spinnt. Gute Entscheidung von ipollit, jetzt nachzukaufen imho.
CRIS CUDC-427... Könnten IAP-Hemmer auch mit Immuntherapien kombinierbar sein? Bisher gibt es dazu aber wohl noch nichts.
http://www.nature.com/nrc/journal/v12/n4/full/nrc3237.html
Combining immunotherapy and targeted therapies in cancer treatment
...
Targeted therapies may also function as co-stimulatory agents, analogous to agonistic antibodies directed against 4-1BB, GITR, OX40 and other TNFR superfamily members that are expressed on T cells. Of particular interest in this regard are antagonists of the inhibitor of apoptosis proteins (IAPs). IAP inhibitors were originally developed to counteract the role of IAPs in blocking caspase activation, thereby sensitizing cancer cells to death stimuli54. Unexpectedly, IAP inhibitors were found to mimic co-stimulatory signalling in T cells55. Although these compounds had minimal effects on resting T cells, they dramatically enhanced T cell activation on TCR engagement, resulting in increased proliferation and cytokine production. These stimulatory effects involved triggering non-canonical nuclear factor-κB (NF-κB) signalling, as cIAP1 (also known as BIRC2) and cIAP2 (also known as BIRC3) are major negative regulators of NF-κB-inducing kinase (NIK; also known as MAP3K14)56. In a preclinical mouse model of melanoma, the combination of IAP antagonists and tumour cell vaccines evoked a greater reduction in tumour growth and stronger anti-tumour T cell responses compared with either monotherapy55. These findings suggest that IAP inhibitors might potentiate the effects of vaccination and possibly of other T cell immunotherapies...
http://www.nature.com/nrc/journal/v12/n4/full/nrc3237.html
Combining immunotherapy and targeted therapies in cancer treatment
...
Targeted therapies may also function as co-stimulatory agents, analogous to agonistic antibodies directed against 4-1BB, GITR, OX40 and other TNFR superfamily members that are expressed on T cells. Of particular interest in this regard are antagonists of the inhibitor of apoptosis proteins (IAPs). IAP inhibitors were originally developed to counteract the role of IAPs in blocking caspase activation, thereby sensitizing cancer cells to death stimuli54. Unexpectedly, IAP inhibitors were found to mimic co-stimulatory signalling in T cells55. Although these compounds had minimal effects on resting T cells, they dramatically enhanced T cell activation on TCR engagement, resulting in increased proliferation and cytokine production. These stimulatory effects involved triggering non-canonical nuclear factor-κB (NF-κB) signalling, as cIAP1 (also known as BIRC2) and cIAP2 (also known as BIRC3) are major negative regulators of NF-κB-inducing kinase (NIK; also known as MAP3K14)56. In a preclinical mouse model of melanoma, the combination of IAP antagonists and tumour cell vaccines evoked a greater reduction in tumour growth and stronger anti-tumour T cell responses compared with either monotherapy55. These findings suggest that IAP inhibitors might potentiate the effects of vaccination and possibly of other T cell immunotherapies...
Auf AUXL kommen interessante 3 Monate zu:
- Q2-Zahlen inkl. Aquisition von Actient
- PDUFA-Termin Anfang September zu Xiaflex
Auxilium upgraded to Outperform from Market Perform at Leerink
Leerink upgraded Auxilium citing accretion from the Actient acquisition and optimism for FDA approval of Xiaflex in Peyronie's disease. The firm raised its price target for shares to $21 from $16.
http://www.theflyonthewall.com/permalinks/entry.php/AUXLid18…
- Q2-Zahlen inkl. Aquisition von Actient
- PDUFA-Termin Anfang September zu Xiaflex
Auxilium upgraded to Outperform from Market Perform at Leerink
Leerink upgraded Auxilium citing accretion from the Actient acquisition and optimism for FDA approval of Xiaflex in Peyronie's disease. The firm raised its price target for shares to $21 from $16.
http://www.theflyonthewall.com/permalinks/entry.php/AUXLid18…
INFI: wo gibt es Details zu den (enttäuschenden) kürzlichen Studienergebnissen, hab nichts gefunden. Danke
Antwort auf Beitrag Nr.: 44.798.037 von me_2 am 06.06.13 12:14:18@me_2,
es geht wohl eher darum, dass der Markt "erkannt" hat, wie gut die Ergebnisse der Konkurrenz sind und dass INFI zeitlich doch ziemlich zurückhängt. Außerdem gibt es Bedenken bezügl. safety.
Alles in allem gibt es aus meiner Sicht nichts grundsätzlich Neues, sondern eher eine neue Sicht auf die Situation. Bei 50 Dollar hat der Markt nach oben euphorisch übertrieben. Jetzt scheint mir zu viel Pessimismus zu herrschen.
Persönlich spiele ich aber trotzdem lieber weiter die PCYC-Karte. Ibrutinib sieht für mich weiter nach dem künftigen "backbone" der oralen CLL-Behandlung mit "sicheren" Milliardenumsätzen und Potential in vielen weiteren Indikationen aus.
INFI muss dann seine Nische finden. Ich denke, das werden sie auch, aber es wird dauern und immer wieder holpern.
Gruß
SLG
es geht wohl eher darum, dass der Markt "erkannt" hat, wie gut die Ergebnisse der Konkurrenz sind und dass INFI zeitlich doch ziemlich zurückhängt. Außerdem gibt es Bedenken bezügl. safety.
Alles in allem gibt es aus meiner Sicht nichts grundsätzlich Neues, sondern eher eine neue Sicht auf die Situation. Bei 50 Dollar hat der Markt nach oben euphorisch übertrieben. Jetzt scheint mir zu viel Pessimismus zu herrschen.
Persönlich spiele ich aber trotzdem lieber weiter die PCYC-Karte. Ibrutinib sieht für mich weiter nach dem künftigen "backbone" der oralen CLL-Behandlung mit "sicheren" Milliardenumsätzen und Potential in vielen weiteren Indikationen aus.
INFI muss dann seine Nische finden. Ich denke, das werden sie auch, aber es wird dauern und immer wieder holpern.
Gruß
SLG
Hammer mit einer detaillierten Analyse der Synta-Daten:
http://www.orf-blog.com/syntas-fiasco-disappointing-results-…
(Meiner Meinung nach ist der Markt zu skeptisch bei den "non-rapid progressors", auf die sich Synta in der PIII nun mal konzentriert. Längeres PFS und längeres OS im Vergleich zur ITT-Population werden jetzt komplett ignoriert, weil das erst rückblickend festgestellt wurde. Nun ja, trotzdem sind die Daten nun mal da und es sind immerhin 176 Patienten dieses Typs gewesen. Finde es etwas merkwürdig, wenn man einen Versuch macht, sich die Daten ansieht und sie dann mit der Begründung ignoriert, dass man vorher keine entsprechende Hypothese hatte.)
http://www.orf-blog.com/syntas-fiasco-disappointing-results-…
(Meiner Meinung nach ist der Markt zu skeptisch bei den "non-rapid progressors", auf die sich Synta in der PIII nun mal konzentriert. Längeres PFS und längeres OS im Vergleich zur ITT-Population werden jetzt komplett ignoriert, weil das erst rückblickend festgestellt wurde. Nun ja, trotzdem sind die Daten nun mal da und es sind immerhin 176 Patienten dieses Typs gewesen. Finde es etwas merkwürdig, wenn man einen Versuch macht, sich die Daten ansieht und sie dann mit der Begründung ignoriert, dass man vorher keine entsprechende Hypothese hatte.)
Antwort auf Beitrag Nr.: 44.811.571 von SLGramann am 08.06.13 10:45:50INFI...
Für PCYCs Ibrutinib spricht, dass die Nebenwirkungen deutlich geringer sind und die Wirkung u.a. bei CLL und MCL vielleicht höher ist, insbesondere die Wirkung auch recht lange anhält:
z.B. der Vergleich der Vor-ASCO Daten in meinem vorherigen Post #44.786.535: Ibrutinib hat in r/r CLL eine Ansprechrate von 71% (N=85), während es bei GILDs Idelalisib nur 44% sind. Allerdings ändern sich die Ansprechraten mit der Zeit. Zuerst werden die Krebszellen aus den Lymphknoten gedrängt. Dies wird dann noch nicht als ein Ansprechen gewertet, da der Krebs sich dabei ja nicht verringert. Diese Krebszellen werden außerhalb der Knoten aber mit der Zeit zerstört. Ursprünglich war man bei PCYC sehr verunsichert, dass zuerst mehr Krebszellen auftauchten, man hat das so interpretiert, dass Ibrutinib den Krebs sogar noch verschlimmert. Erst mit der Zeit sah man, dass sich der Krebs verringerte. Dieses Verhalten ist auch bei GILD oder INFI so... eine Aufschlüsselung findet sich im Diagramm in #44.786.075: IWCLL RR als echtes Ansprechen und PR + Nodal PR als mögliches zukünftiges Ansprechen, wenn man davon ausgeht, dass das Austreiben des Krebs (Nodal PR) sich mit der Zeit auch in ein echtes Ansprechen umwandelt. Idelalisib käme demnach auf 81% und IPI-145 sogar auf 86%... also ähnlich wie Ibrutinib.
Das zweite ist, wie lange die Therapie anspricht. Wenn der Krebs z.B. den BTK-Signalweg benötigt, dann verringert ein BTK-Hemmer wie Ibrutinib diesen deutlich. Mit der Zeit entstehen aber oft weitere Mutationen, so dass die Hemmung nicht mehr wirkt oder die Hemmung des einen Signalwegs führt zu einer Verstärkung eines anderen. In der Regel führt dies dazu, dass die Therapie mit der Zeit nicht mehr wirkt und der Krebs wieder wächst. Bei Ibrutinib scheint es erfreulicherweise so zu sein, dass dies relativ lange dauert: z.B. zeigt der Vergleich #44.786.535 für CLL, dass es nach einem Ansprechen von Ibrutinib 26 Monate später bei 75% keinen Krankheitsfortschritt gegeben hat. Bei GILSs Idelalisib hatten nach 17 Monaten bereits die Hälfte der Patienten eine Verschlechterung der Krankheit. Bei MCL wird das ebenfalls deutlich: der Median für Ibrutinib ist 13,9 Monate und für Idelalisib 3,7 Monate. (dies alles sind natürlich nur grobe Anhaltspunkte, da die Studien recht klein sind, eine Tendenz lässt sich aber daran ablesen)
Dies ist CLL und MCL, dass von Ibrutinib dominiert werden könnte. Die Werte ändern sich auch nochmal, wenn man eine Kombi mit dem Standard Rituxan vornimmt... dann gehen die Ansprechraten sogar auf 100%.
Im Vergleich ist auch DLBCL aufgeführt... wie ich vorher bereits mal geschrieben habe, wirkt Ibrutinib eigentlich nur bei dem Subtyp ABC und nicht beim Typ GCB (bei GCB wirkt aber z.B. Rituxan ganz gut): die Ansprechrate ist insgesamt nur 23% (N=70). GILDs Idelalisib scheint hier garnicht anzusprechen: 0% (N=9).
Bei iNHL (ca. 25% von NHL) sieht Ibrutinib nicht so überlegen aus: 44% (N=16) vs. Idelalisib mit 45% (N=38). IPI-145 kommt hier sogar auf 62% (N=13).
Das sind alles B-Zell Krebsarten. Daneben gibt es auch noch Krebs der T-Zellen. Hier wirkt Ibrutinib als BTK-Hemmer überhaupt nicht, Idelalisib als PI3k-delta anscheinend auch nicht. IPI-145 als PI3k delta/gamma scheint dagegen schon anzusprechen (33%, 50%).
Dass IPI-145 nun eine Nische finden muss, verstehe ich nicht ganz. Wahrscheinlich wird Ibrutinib dieses Jahr vorzeitig nach einer PII in MCL zugelassen, Idelalisib ebenfalls in Kürze vorzeitig nach einer PII in iNHL. Dann kommt im nächsten oder übernächsten Jahr eine echte Zulassung (nach PIII) von Ibrutinib in CLL. Nur letzteres wäre ein Nachteil für andere wie IPI-145, da eine Zulassung in CLL dann wohl nur noch gegen Ibrutinib möglich ist, indem es besser wirkt oder auch dann noch wirkt, wenn Ibrutinib keine Wirkung mehr zeigt (was möglich wäre, da BTK und pi3k nicht das gleich Target haben). Ibrutinib hat allerdings eine recht langanhaltende Wirkung. IPI-145 kann aber die beste Wahl für iNHL sein und zudem die einzige Wahl bei T-Zell Krebs.
Gab es bei INFI jetzt negative ASCO Ergebnisse? Der Einbruch kam wohl dadurch zustande, weil man bisher gemeint hat, dass IPI-145 weniger Nebenwirkungen hätte als Idelalisib. In den IPI-145 Studien war es wohl bisher nicht erforderlich, dass man auch prophylaktisch mit Antibiotika usw. gegen Entzündungen behandelt wird. Da es aber z.B. Lungenentzündungen gab, hat man dies nun geändert. Jetzt kursiert, dass pi3k-gamma für diese Nebenwirkungen verantwortlich wäre und man tut so, als ob IPI-145 damit aus dem Rennen wäre gegenüber Idelalisib, das ja im wensetlichen über delta und nicht über gamma wirkt. Aber wodurch wird das gestützt??? Offensichtlich verhält sich Idelalisib genauso, wenn nicht gar schlechter: "Despite hype over IPI-145’s higher rate of infections yesterday, similar rates were seen in the idelalisib data. (JPM) Full idelalisib data shows that some SAE driven discontinuations were due to bacterial infections (not seen in IPI-145 trials)" Und in den Idelalisib wird bereits prophylaktisch behandelt. Bisher sehe ich es daher als eine Übertreibung, dass IPI-145 hier ein Problem hätte... es ist mehr eine kleine Enttäuschung der Erwartungen, dass IPI-145 ähnlich geringe Nebenwirkungen hätte, wie PCYCs Ibrutinib.
Was aber noch aussteht: Wie lange spricht IPI-145 an? Ist IPI-145 das beste Mittel der Wahl bei iNHL? Ist die Wirkung von IPI-145 besser als von Idelalisib (auf dem Papier sollte das so sein, da IPI-145 auch stärker auf delta wirkt... die Daten von IPI-145 waren anfangs deutlich besser, Idelalisib hat nun etwas aufgeholt, aber wie oben beschrieben, zeigt sich die volle Wirkung erst mit der Zeit)? Ist IPI-145 das einzige derartige Mittel, das gegen T-Zell Krebs wirkt?... vielleicht kann man diese Fragen Ende des Jahres oder nächstes Jahr beantworten.
Eine weitere Differenzierung von IPI-145... es wird gegen RA und Asthma getestet. Wenn es wirkt, gäbe es hier erhebliches Potential.
Gruß
ipollit
Für PCYCs Ibrutinib spricht, dass die Nebenwirkungen deutlich geringer sind und die Wirkung u.a. bei CLL und MCL vielleicht höher ist, insbesondere die Wirkung auch recht lange anhält:
z.B. der Vergleich der Vor-ASCO Daten in meinem vorherigen Post #44.786.535: Ibrutinib hat in r/r CLL eine Ansprechrate von 71% (N=85), während es bei GILDs Idelalisib nur 44% sind. Allerdings ändern sich die Ansprechraten mit der Zeit. Zuerst werden die Krebszellen aus den Lymphknoten gedrängt. Dies wird dann noch nicht als ein Ansprechen gewertet, da der Krebs sich dabei ja nicht verringert. Diese Krebszellen werden außerhalb der Knoten aber mit der Zeit zerstört. Ursprünglich war man bei PCYC sehr verunsichert, dass zuerst mehr Krebszellen auftauchten, man hat das so interpretiert, dass Ibrutinib den Krebs sogar noch verschlimmert. Erst mit der Zeit sah man, dass sich der Krebs verringerte. Dieses Verhalten ist auch bei GILD oder INFI so... eine Aufschlüsselung findet sich im Diagramm in #44.786.075: IWCLL RR als echtes Ansprechen und PR + Nodal PR als mögliches zukünftiges Ansprechen, wenn man davon ausgeht, dass das Austreiben des Krebs (Nodal PR) sich mit der Zeit auch in ein echtes Ansprechen umwandelt. Idelalisib käme demnach auf 81% und IPI-145 sogar auf 86%... also ähnlich wie Ibrutinib.
Das zweite ist, wie lange die Therapie anspricht. Wenn der Krebs z.B. den BTK-Signalweg benötigt, dann verringert ein BTK-Hemmer wie Ibrutinib diesen deutlich. Mit der Zeit entstehen aber oft weitere Mutationen, so dass die Hemmung nicht mehr wirkt oder die Hemmung des einen Signalwegs führt zu einer Verstärkung eines anderen. In der Regel führt dies dazu, dass die Therapie mit der Zeit nicht mehr wirkt und der Krebs wieder wächst. Bei Ibrutinib scheint es erfreulicherweise so zu sein, dass dies relativ lange dauert: z.B. zeigt der Vergleich #44.786.535 für CLL, dass es nach einem Ansprechen von Ibrutinib 26 Monate später bei 75% keinen Krankheitsfortschritt gegeben hat. Bei GILSs Idelalisib hatten nach 17 Monaten bereits die Hälfte der Patienten eine Verschlechterung der Krankheit. Bei MCL wird das ebenfalls deutlich: der Median für Ibrutinib ist 13,9 Monate und für Idelalisib 3,7 Monate. (dies alles sind natürlich nur grobe Anhaltspunkte, da die Studien recht klein sind, eine Tendenz lässt sich aber daran ablesen)
Dies ist CLL und MCL, dass von Ibrutinib dominiert werden könnte. Die Werte ändern sich auch nochmal, wenn man eine Kombi mit dem Standard Rituxan vornimmt... dann gehen die Ansprechraten sogar auf 100%.
Im Vergleich ist auch DLBCL aufgeführt... wie ich vorher bereits mal geschrieben habe, wirkt Ibrutinib eigentlich nur bei dem Subtyp ABC und nicht beim Typ GCB (bei GCB wirkt aber z.B. Rituxan ganz gut): die Ansprechrate ist insgesamt nur 23% (N=70). GILDs Idelalisib scheint hier garnicht anzusprechen: 0% (N=9).
Bei iNHL (ca. 25% von NHL) sieht Ibrutinib nicht so überlegen aus: 44% (N=16) vs. Idelalisib mit 45% (N=38). IPI-145 kommt hier sogar auf 62% (N=13).
Das sind alles B-Zell Krebsarten. Daneben gibt es auch noch Krebs der T-Zellen. Hier wirkt Ibrutinib als BTK-Hemmer überhaupt nicht, Idelalisib als PI3k-delta anscheinend auch nicht. IPI-145 als PI3k delta/gamma scheint dagegen schon anzusprechen (33%, 50%).
Dass IPI-145 nun eine Nische finden muss, verstehe ich nicht ganz. Wahrscheinlich wird Ibrutinib dieses Jahr vorzeitig nach einer PII in MCL zugelassen, Idelalisib ebenfalls in Kürze vorzeitig nach einer PII in iNHL. Dann kommt im nächsten oder übernächsten Jahr eine echte Zulassung (nach PIII) von Ibrutinib in CLL. Nur letzteres wäre ein Nachteil für andere wie IPI-145, da eine Zulassung in CLL dann wohl nur noch gegen Ibrutinib möglich ist, indem es besser wirkt oder auch dann noch wirkt, wenn Ibrutinib keine Wirkung mehr zeigt (was möglich wäre, da BTK und pi3k nicht das gleich Target haben). Ibrutinib hat allerdings eine recht langanhaltende Wirkung. IPI-145 kann aber die beste Wahl für iNHL sein und zudem die einzige Wahl bei T-Zell Krebs.
Gab es bei INFI jetzt negative ASCO Ergebnisse? Der Einbruch kam wohl dadurch zustande, weil man bisher gemeint hat, dass IPI-145 weniger Nebenwirkungen hätte als Idelalisib. In den IPI-145 Studien war es wohl bisher nicht erforderlich, dass man auch prophylaktisch mit Antibiotika usw. gegen Entzündungen behandelt wird. Da es aber z.B. Lungenentzündungen gab, hat man dies nun geändert. Jetzt kursiert, dass pi3k-gamma für diese Nebenwirkungen verantwortlich wäre und man tut so, als ob IPI-145 damit aus dem Rennen wäre gegenüber Idelalisib, das ja im wensetlichen über delta und nicht über gamma wirkt. Aber wodurch wird das gestützt??? Offensichtlich verhält sich Idelalisib genauso, wenn nicht gar schlechter: "Despite hype over IPI-145’s higher rate of infections yesterday, similar rates were seen in the idelalisib data. (JPM) Full idelalisib data shows that some SAE driven discontinuations were due to bacterial infections (not seen in IPI-145 trials)" Und in den Idelalisib wird bereits prophylaktisch behandelt. Bisher sehe ich es daher als eine Übertreibung, dass IPI-145 hier ein Problem hätte... es ist mehr eine kleine Enttäuschung der Erwartungen, dass IPI-145 ähnlich geringe Nebenwirkungen hätte, wie PCYCs Ibrutinib.
Was aber noch aussteht: Wie lange spricht IPI-145 an? Ist IPI-145 das beste Mittel der Wahl bei iNHL? Ist die Wirkung von IPI-145 besser als von Idelalisib (auf dem Papier sollte das so sein, da IPI-145 auch stärker auf delta wirkt... die Daten von IPI-145 waren anfangs deutlich besser, Idelalisib hat nun etwas aufgeholt, aber wie oben beschrieben, zeigt sich die volle Wirkung erst mit der Zeit)? Ist IPI-145 das einzige derartige Mittel, das gegen T-Zell Krebs wirkt?... vielleicht kann man diese Fragen Ende des Jahres oder nächstes Jahr beantworten.
Eine weitere Differenzierung von IPI-145... es wird gegen RA und Asthma getestet. Wenn es wirkt, gäbe es hier erhebliches Potential.
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.811.609 von SLGramann am 08.06.13 10:53:52"Finde es etwas merkwürdig, wenn man einen Versuch macht, sich die Daten ansieht und sie dann mit der Begründung ignoriert, dass man vorher keine entsprechende Hypothese hatte."
naja, Hammer schreibt "There was also skepticism around the signal in non-rapid progressors because survival in patients who received Taxotere was 1 month shorter than the ITT Taxotere arm. Since these patients have more indolent disease, they are expected to have better survival, not worse."
Ist es zu erklären, warum im Taxotere-Arm, die non-rapid progressors führer gestorben sind als die rapid progressors? Eigentlich müsste doch jemand, dessen Krankheit nicht so schnell fortschreitet, implizit länger leben?
Wenn dieses Verhalten merkwürdig ist, dann könnte doch auch eine Analyse die Tax non-rapid mit Tax+G non-rapid vergleicht, zu einem falschen Schluss kommen. Zufälle gibt es in einer PII aufgrund der geringeren Patientenzahl schneller als in einer PIII. Wenn nun in der PIII die non-rapid Tax Patienten, statt früher zu sterben, länger leben als die rapid Tax Patienten (so wie es eigentlich zu erwarten wäre), so geht der ganze Vorteil aus der PII in der PIII verloren. Vielleicht dreht es sich sogar um und das Ergebnis bei non-rapid ist schlechter als das von rapid Patienten (in der PII hatten die Rapid Progressors ein HR=1,47... d.h. G hat diesen sogar geschadet, allerdings nicht signifikant). SNTA hat sich ja nun auf non-rapid festgelegt... vielleicht war das nicht so klug wie gedacht.
In einer PII gibt es immer Faktoren, die das Ergebnis scheinbar positiv beeinflussen. Vielleicht haben gerade Patienten mit z.B. blonden Haaren besser abgeschnitten als andere. Wäre es sinnvoll eine PIII nach solchen Faktoren auszurichten? Wenn man vor der PII aufgrund theoretischer Annahmen davon ausgeht, dass Patienten mit blonden Haaren besser abschneiden und man bestätigt das in der PII, so ist es ein eingermaßen zuverlässiger Faktor. Wenn man aber im Nachhinein sich alles mögliche ansieht und dann das beste herauspickt, so halte ich das nicht für vertrauenswürdig. In der Regel sind solche nachträglichen Sub-Gruppen rein zufällig und bestätigen sich nicht in der PIII.
So unproblematisch finde ich die Daten nicht:

Oben ist der Unterschied zwischen den Rapid und Non-Rapids markiert. Unten findet sich aber auch der Unterschied zwischen Männern und Frauen. Männer (N=142) haben ein HR von 1,02... d.h. in der PII hat T+G keinen Effekt auf Männer gehabt bzw. wirkt demnach G nicht bei Männern! Bei Frauen (N=110) ist T+G dagegen signifikant besser: HR=0,58 mi p=0,0366. Müsste SNTA demnach nicht auch Männer von der PIII ausschließen? Ist es wirklich wahrscheinlich, dass nur Frauen von G profitieren? Ist es wahrscheinlich, dass nur Non-Rapid Progressors von G profitieren (zumal sich diese im Taxotere-Arm unlogisch verhalten haben)? Ich halte beides für eher zufällig. Einige haben sich über Synta lustig gemacht, indem sie meinten, dass SNTAs Analysen desweiteren ergeben hätten, dass brüntte Frauen deutlich besser auf G ansprechen, zudem seien die besten Ergebnisse bei Frauen mit Namen Mary zu erzielen... entsprechend würde die neue PIII nur noch brüntte Frauen mit Namen Mary aufnehmen. ;-)
Etwas positiveres... es gab einige größere Insider-Käufe: http://www.bizjournals.com/boston/blog/bioflash/2013/06/insi…
Gruß
ipollit
naja, Hammer schreibt "There was also skepticism around the signal in non-rapid progressors because survival in patients who received Taxotere was 1 month shorter than the ITT Taxotere arm. Since these patients have more indolent disease, they are expected to have better survival, not worse."
Ist es zu erklären, warum im Taxotere-Arm, die non-rapid progressors führer gestorben sind als die rapid progressors? Eigentlich müsste doch jemand, dessen Krankheit nicht so schnell fortschreitet, implizit länger leben?
Wenn dieses Verhalten merkwürdig ist, dann könnte doch auch eine Analyse die Tax non-rapid mit Tax+G non-rapid vergleicht, zu einem falschen Schluss kommen. Zufälle gibt es in einer PII aufgrund der geringeren Patientenzahl schneller als in einer PIII. Wenn nun in der PIII die non-rapid Tax Patienten, statt früher zu sterben, länger leben als die rapid Tax Patienten (so wie es eigentlich zu erwarten wäre), so geht der ganze Vorteil aus der PII in der PIII verloren. Vielleicht dreht es sich sogar um und das Ergebnis bei non-rapid ist schlechter als das von rapid Patienten (in der PII hatten die Rapid Progressors ein HR=1,47... d.h. G hat diesen sogar geschadet, allerdings nicht signifikant). SNTA hat sich ja nun auf non-rapid festgelegt... vielleicht war das nicht so klug wie gedacht.
In einer PII gibt es immer Faktoren, die das Ergebnis scheinbar positiv beeinflussen. Vielleicht haben gerade Patienten mit z.B. blonden Haaren besser abgeschnitten als andere. Wäre es sinnvoll eine PIII nach solchen Faktoren auszurichten? Wenn man vor der PII aufgrund theoretischer Annahmen davon ausgeht, dass Patienten mit blonden Haaren besser abschneiden und man bestätigt das in der PII, so ist es ein eingermaßen zuverlässiger Faktor. Wenn man aber im Nachhinein sich alles mögliche ansieht und dann das beste herauspickt, so halte ich das nicht für vertrauenswürdig. In der Regel sind solche nachträglichen Sub-Gruppen rein zufällig und bestätigen sich nicht in der PIII.
So unproblematisch finde ich die Daten nicht:

Oben ist der Unterschied zwischen den Rapid und Non-Rapids markiert. Unten findet sich aber auch der Unterschied zwischen Männern und Frauen. Männer (N=142) haben ein HR von 1,02... d.h. in der PII hat T+G keinen Effekt auf Männer gehabt bzw. wirkt demnach G nicht bei Männern! Bei Frauen (N=110) ist T+G dagegen signifikant besser: HR=0,58 mi p=0,0366. Müsste SNTA demnach nicht auch Männer von der PIII ausschließen? Ist es wirklich wahrscheinlich, dass nur Frauen von G profitieren? Ist es wahrscheinlich, dass nur Non-Rapid Progressors von G profitieren (zumal sich diese im Taxotere-Arm unlogisch verhalten haben)? Ich halte beides für eher zufällig. Einige haben sich über Synta lustig gemacht, indem sie meinten, dass SNTAs Analysen desweiteren ergeben hätten, dass brüntte Frauen deutlich besser auf G ansprechen, zudem seien die besten Ergebnisse bei Frauen mit Namen Mary zu erzielen... entsprechend würde die neue PIII nur noch brüntte Frauen mit Namen Mary aufnehmen. ;-)
Etwas positiveres... es gab einige größere Insider-Käufe: http://www.bizjournals.com/boston/blog/bioflash/2013/06/insi…
Gruß
ipollit
Antwort auf Beitrag Nr.: 44.812.191 von ipollit am 08.06.13 14:19:21Dann kommt im nächsten oder übernächsten Jahr eine echte Zulassung (nach PIII) von Ibrutinib in CLL. Nur letzteres wäre ein Nachteil für andere wie IPI-145, da eine Zulassung in CLL dann wohl nur noch gegen Ibrutinib möglich ist, indem es besser wirkt oder auch dann noch wirkt, wenn Ibrutinib keine Wirkung mehr zeigt (was möglich wäre, da BTK und pi3k nicht das gleich Target haben). Ibrutinib hat allerdings eine recht langanhaltende Wirkung. IPI-145 kann aber die beste Wahl für iNHL sein und zudem die einzige Wahl bei T-Zell Krebs.
Ja, das meinte ich auch nur mit "Nische" - also die Situation nach einer vollständigen Zulassung von Ibrutinib, von der ich für Ende 2014 ausgehe.
Ich sehe IPI-145 bei Patienten zum Zuge kommen, bei denen Ibrutinib nicht mehr wirkt. Um diesen Markt wird man sich mit Gilead streiten müssen.
Du hast natürlich vollkommen zurecht auf das Thema T-Zell-Lymphome hingewiesen. Diesbezüglich ist IPI-145 offensichtlich nicht in einer Nischensituation (auch wenn die T-Zell-Lymphome seltener sind, als die B-zell).
-----------
Synta:
Ist es zu erklären, warum im Taxotere-Arm, die non-rapid progressors führer gestorben sind als die rapid progressors? Eigentlich müsste doch jemand, dessen Krankheit nicht so schnell fortschreitet, implizit länger leben?
Das finde ich auch unverständlich. Aber wenn man als Szenario unterstellt, dass die non-rapid progressors in Bezug auf OS nicht negativ nach unten abgewichen wären, bliebe trotzdem zunächst mal deren längeres OS bei Tax+G gegenüber Tax allein (in dem Szenario dann ein OS von 10,7 gegen 7,4 (statt 6,4)).
Soweit würde ich noch mitgehen.
Wenn man nun zusätzlich unterstellt, dass sie nicht nur nicht negativ abgewichen wären, sondern ein besseres OS als der Durchschnitt gezeigt hätten, dann kämen wir natürlich auf 10,7 gegen 7,4 + X).
Nur, es war halt nicht so. Das ist alles ausgedacht.
Vor allem kann ich dann auch unterstellen, dass es bei den Tax+G nicht bei 10,7 Monaten bleiben würde, wenn sich die non-rapid progressors "normal" verhalten hätten.
Oder bin ich da auf dem Holzweg?
Wie auch immer: Die Hazard-Ratios fand ich trotzdem enttäuschend - auch und vor allem, weil ich ein kleineres OS bei den non-rapid progressors nun auch nicht abkaufen will.
Ich habe meine Synta-Position daher aufgegeben und dafür bei Array weiter aufgestockt.
Gruß
SLG
Ja, das meinte ich auch nur mit "Nische" - also die Situation nach einer vollständigen Zulassung von Ibrutinib, von der ich für Ende 2014 ausgehe.
Ich sehe IPI-145 bei Patienten zum Zuge kommen, bei denen Ibrutinib nicht mehr wirkt. Um diesen Markt wird man sich mit Gilead streiten müssen.
Du hast natürlich vollkommen zurecht auf das Thema T-Zell-Lymphome hingewiesen. Diesbezüglich ist IPI-145 offensichtlich nicht in einer Nischensituation (auch wenn die T-Zell-Lymphome seltener sind, als die B-zell).
-----------
Synta:
Ist es zu erklären, warum im Taxotere-Arm, die non-rapid progressors führer gestorben sind als die rapid progressors? Eigentlich müsste doch jemand, dessen Krankheit nicht so schnell fortschreitet, implizit länger leben?
Das finde ich auch unverständlich. Aber wenn man als Szenario unterstellt, dass die non-rapid progressors in Bezug auf OS nicht negativ nach unten abgewichen wären, bliebe trotzdem zunächst mal deren längeres OS bei Tax+G gegenüber Tax allein (in dem Szenario dann ein OS von 10,7 gegen 7,4 (statt 6,4)).
Soweit würde ich noch mitgehen.
Wenn man nun zusätzlich unterstellt, dass sie nicht nur nicht negativ abgewichen wären, sondern ein besseres OS als der Durchschnitt gezeigt hätten, dann kämen wir natürlich auf 10,7 gegen 7,4 + X).
Nur, es war halt nicht so. Das ist alles ausgedacht.
Vor allem kann ich dann auch unterstellen, dass es bei den Tax+G nicht bei 10,7 Monaten bleiben würde, wenn sich die non-rapid progressors "normal" verhalten hätten.
Oder bin ich da auf dem Holzweg?
Wie auch immer: Die Hazard-Ratios fand ich trotzdem enttäuschend - auch und vor allem, weil ich ein kleineres OS bei den non-rapid progressors nun auch nicht abkaufen will.
Ich habe meine Synta-Position daher aufgegeben und dafür bei Array weiter aufgestockt.
Gruß
SLG
ARRY...
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY @ Jefferies (6/5/13)
1. There will be additional data next week at EHA on ARRY-520 relative to the combinability of 520 with carfilzomib (safety). The Phase 2 efficacy data of the combo will be presented in December at ASH.
2. ARRY previously talked about needing to combine 520 with Kyprolis or Velcade for full approval but mentioned here, for the first time I believe, the possibility of obtaining accelerated approval with this combo. I am curious if Squarer was hinting at the possibility of 520 obtaining AA based solely on the Phase 2 combo data of 520/carfilzomib that will report at ASH or the 520/Velcade data (not 100% sure if that data will be at ASH or later). Squarer did mention that in discussions with FDA that FDA believes 520 is an active drug and discussions have been positive.
3. The Phase 3 selumetinib KRAS NSCLC trial will begin dosing in October.
4. The Phase 3 selumetinib thyroid cancer trial has already begun dosing and AZN has moved selumetinib up into first-line in this pivotal study testing in combo with radioactive iodine as opposed to a refractory setting.
5. Memorial-Sloan Kettering has announced plans to initiate a 100-patient confirmatory, randomized uveal melanoma trial with selumetinib. ARRY hopes this will lead to approval of selumetinib in this indication.
6. Slide 9 compared the NVS/ARRY BRAF/MEK combo to that of the competition (GSK and Roche). ORR in BRAFi-naive was 88%, 76%, 92%, respectively. ORR in BRAFi-prior was 18%, N/A, 19%, respectively (showing similarity of NVS/ARRY combo to competition on efficacy front). On safety front, in attempting to show superiority of NVS/ARRY combo to GSK and Roche combos, fever was 0%, 71%, not reported, respectively. Rash was 3%, 27%, 53%, respectively. Diarrhea was 33%, 36%, and 51%, respectively. Chills was <10%, 58%, not reported, respectively. Fatigue was 23%, 53%, 30%, respectively.

***
"ARRY-614 on-track for data later in 2013... Conversations with hematologists suggest that ‘614 has generated significant clinician and MDS patient interest due to promising early Phase I/II results, leading to good study enrollment."
Gruß
ipollit
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARRY @ Jefferies (6/5/13)
1. There will be additional data next week at EHA on ARRY-520 relative to the combinability of 520 with carfilzomib (safety). The Phase 2 efficacy data of the combo will be presented in December at ASH.
2. ARRY previously talked about needing to combine 520 with Kyprolis or Velcade for full approval but mentioned here, for the first time I believe, the possibility of obtaining accelerated approval with this combo. I am curious if Squarer was hinting at the possibility of 520 obtaining AA based solely on the Phase 2 combo data of 520/carfilzomib that will report at ASH or the 520/Velcade data (not 100% sure if that data will be at ASH or later). Squarer did mention that in discussions with FDA that FDA believes 520 is an active drug and discussions have been positive.
3. The Phase 3 selumetinib KRAS NSCLC trial will begin dosing in October.
4. The Phase 3 selumetinib thyroid cancer trial has already begun dosing and AZN has moved selumetinib up into first-line in this pivotal study testing in combo with radioactive iodine as opposed to a refractory setting.
5. Memorial-Sloan Kettering has announced plans to initiate a 100-patient confirmatory, randomized uveal melanoma trial with selumetinib. ARRY hopes this will lead to approval of selumetinib in this indication.
6. Slide 9 compared the NVS/ARRY BRAF/MEK combo to that of the competition (GSK and Roche). ORR in BRAFi-naive was 88%, 76%, 92%, respectively. ORR in BRAFi-prior was 18%, N/A, 19%, respectively (showing similarity of NVS/ARRY combo to competition on efficacy front). On safety front, in attempting to show superiority of NVS/ARRY combo to GSK and Roche combos, fever was 0%, 71%, not reported, respectively. Rash was 3%, 27%, 53%, respectively. Diarrhea was 33%, 36%, and 51%, respectively. Chills was <10%, 58%, not reported, respectively. Fatigue was 23%, 53%, 30%, respectively.

***
"ARRY-614 on-track for data later in 2013... Conversations with hematologists suggest that ‘614 has generated significant clinician and MDS patient interest due to promising early Phase I/II results, leading to good study enrollment."
Gruß
ipollit
IMMU-Gewinne habe ich am Freitag realisiert, um einen Run-Up zu spielen. Bin hierzu in Rockwell Medical (RMTI) eingestiegen. Das Unternehmen hat unlängst eine Kapitalerhöhung platziert und damit ein gesundes Fundament gelegt. Die Kurtreiber sollten die anstehenden Phase III - Daten zu SFP sein, die im Juli und Oktober erwartet werden.
Antwort auf Beitrag Nr.: 44.814.189 von ipollit am 09.06.13 12:37:14Schöne Übersicht!
Alles läuft nach Plan (bezogen auf meine Erwartungen von vor 6 bis 9 Monaten vielleicht mit kleiner zeitlicher Verzögerung bei ARRY-520).
Für MEK162 sehe ich gute Chancen und allein das würde nach einer Zulassung die gegenwärtige Marktkapitalisierung rechtfertigen.
ARRY-520 könnte den Weg von Kyprolis gehen. Das würde ich jedenfalls nicht ausschließen. Der Wert des Programms wäre dann in Bezug auf die heutige Marktkap. wahnsinnig hoch. Mindestens sollte es aber in einer Kombitherapie etwas taugen. Man könnte sowohl mit Kyprolis wie auch mit Revlimid (oder Pomalyst) kombinieren, weil Arry eben einen ganz eigenen Ansatz hat.
ARRY-614 bleibt für mich ein wenig Wundertüte. Es würde mich aber gar nicht wundern, wenn dann tatsächlich ein Wunder aus dieser Tüte springt. Die FDA scheint das Programm zu mögen.
Und was kurz bevorsteht und weder bei mir noch im Markt mit nur einem Cent eingepreist ist:
Array is continuing a randomized, double blind, six week, 180 patient, Phase 2 trial in persistent asthma. Array expects top-line results from this trial during the second quarter of calendar 2013 and intends to seek a partner for further development of ARRY-502 in this large market disease.
Wer weiß, vielleicht erleben wir in den nächsten Wochen eine positive Überraschung? Ist auf jeden Fall eine free call-option.
Alles läuft nach Plan (bezogen auf meine Erwartungen von vor 6 bis 9 Monaten vielleicht mit kleiner zeitlicher Verzögerung bei ARRY-520).
Für MEK162 sehe ich gute Chancen und allein das würde nach einer Zulassung die gegenwärtige Marktkapitalisierung rechtfertigen.
ARRY-520 könnte den Weg von Kyprolis gehen. Das würde ich jedenfalls nicht ausschließen. Der Wert des Programms wäre dann in Bezug auf die heutige Marktkap. wahnsinnig hoch. Mindestens sollte es aber in einer Kombitherapie etwas taugen. Man könnte sowohl mit Kyprolis wie auch mit Revlimid (oder Pomalyst) kombinieren, weil Arry eben einen ganz eigenen Ansatz hat.
ARRY-614 bleibt für mich ein wenig Wundertüte. Es würde mich aber gar nicht wundern, wenn dann tatsächlich ein Wunder aus dieser Tüte springt. Die FDA scheint das Programm zu mögen.
Und was kurz bevorsteht und weder bei mir noch im Markt mit nur einem Cent eingepreist ist:
Array is continuing a randomized, double blind, six week, 180 patient, Phase 2 trial in persistent asthma. Array expects top-line results from this trial during the second quarter of calendar 2013 and intends to seek a partner for further development of ARRY-502 in this large market disease.
Wer weiß, vielleicht erleben wir in den nächsten Wochen eine positive Überraschung? Ist auf jeden Fall eine free call-option.
CLDX
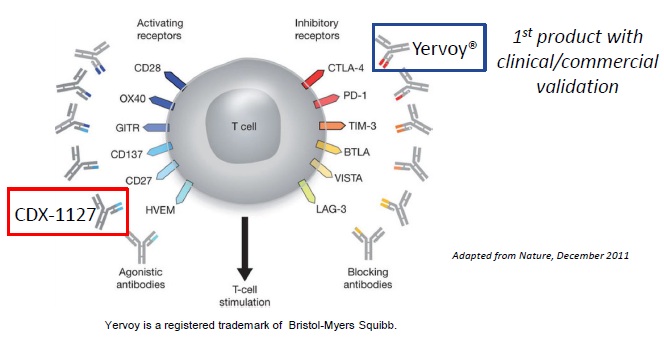
CDX-1127 reiht sich ja in die neuen Immun-Krebstherapien ein. Während CTLA-4, PD-1 usw. die Unterdrückung des Immunsystems durch die Krebszellen verhindern soll und dies offensichtlich auch sehr gut funktioniert, ist z.B. CDX-1127, das über CD-27 wirkt, eher dafür gedacht, dass Immunsystem zu aktivieren, damit es sich stärker gegen den Krebs richtet. BMY hat hier mit dem CD137-AK Urelumab eine Eigenentwicklung in der PI, die theoretisch ein Kandidat für eine Kombi mit z.B. PD-1 wäre. Mehrere Studien mit Urelumab wurden allerdings abgebrochen. Wenn ich es richtig gelesen habe, so gab es erhöhte Leberwerte, so dass nun mit niedrigeren Dosierungen weiter getestet wird. CLDXs CDX-1127 hat solche Probleme bisher nicht.
AKs, die das Immunsystem aktivieren, können zu schweren Nebenwirkungen führen, wenn das Immunsystem überreagiert. Vor mehreren Jahren gab es mal eine deutsche Firma in der Presse, bei der die Probanden in einer PI mit einem ähnlichen CD-28 AK nur knapp überlebt haben. CLDX betont, dass ihr CD-27 AK bisher sehr sicher war und es keine Anzeichen für derartige schwere Nebenwirkungen gegeben hat.
Allerdings habe ich in den folgenden Artikeln gelesen, dass agonistische (d.h. verstärkende) AKs auf CD-27 zu konträren Ergebnissen führen können. Es könnte auch sein, dass ein solcher AK das Krebswachstum beschleunigt und eher ein hemmender AK den Krebs verringert. Positiv ist allerdings eine mögliche Wirkung des CD-27 AKs auf Blutkrebs-Stammzellen... das sind quasi schwer zerstörbare Krebszellen, die dazu führen, dass es immer wieder zu Rückfällen kommt. In diesem Fall z.B. bei CLL usw...
http://www.smw.ch/content/smw-2013-13734/
"From “magic bullets” to specific cancer immunotherapy"
...In addition, T cell co-stimulatory receptors such as CD28 and the TNF receptor family members CD137, OX40, GITR and CD27 may serve as potential targets for agonistic mAbs in order to activate anti-tumoural T cell responses ... Current evidence supports the view that CD27-signalling improves anti-tumoural immunity as well. However, these findings are controversial. Some pre-clinical studies demonstrate that agonistic anti-CD27 mAbs effectively activate immune cells to control or eliminate lymphomas, leukemia and solid tumours. ...In contrast, we could recently document in a murine tumour model that activation of CD27 induces progression of solid tumours by inducing regulatory Tregs.
...
Cancer stem cells (CSCs) are a subpopulation of cancer cells that are thought to drive the growth of tumours,... Cure of cancer implies the elimination of CSCs. However, CSCs display increased resistance against chemotherapy, irradiation and even targeted therapy. Several factors favour CSC resistance, such as the expression of high levels of ABC pumps that expel small molecules and the localisation in hypoxic niches, preventing the accumulation of reactive oxygen species after radiotherapy. Therefore, new therapies that selectively destroy CSCs are needed... Recent work from our laboratory demonstrates that LSCs may be targeted by blocking CD27 signalling. The TNF-receptor family member CD27 is expressed on CML LSC and CD27 signalling activated the canonical Wnt pathway, induced LSC proliferation, increased differentiation to malignant granulocytes and promoted disease progression...
http://cancerres.aacrjournals.org/content/early/2012/05/24/0…
"CD27-signaling promotes tumor growth"
Naja, dabei handelt sich zwar nur um Tiermodelle, trotzdem besteht offensichtlich ein Risiko, dass CDX-1127 genau gegenteilig wirken könnte. Andererseits sind die Erwartungen wohl auch sehr niedrig.
******
Was ist von Innate Pharam http://www.innate-pharma.com/en/product-pipeline zu halten?... ein französischer Biotech, der in diesem Feld aktiv ist. BMY hat deren KIR-AK Lirlumab einlizensiert und führt Kombi-Studien mit PD-1 durch. Innate dürfte Royalties im 15% Bereich besitzen. MK ca. 130 Mio USD.
http://www.innate-pharma.com/sites/default/files/asco2013_tp…
Gruß
ipollit
CDX-1127 reiht sich ja in die neuen Immun-Krebstherapien ein. Während CTLA-4, PD-1 usw. die Unterdrückung des Immunsystems durch die Krebszellen verhindern soll und dies offensichtlich auch sehr gut funktioniert, ist z.B. CDX-1127, das über CD-27 wirkt, eher dafür gedacht, dass Immunsystem zu aktivieren, damit es sich stärker gegen den Krebs richtet. BMY hat hier mit dem CD137-AK Urelumab eine Eigenentwicklung in der PI, die theoretisch ein Kandidat für eine Kombi mit z.B. PD-1 wäre. Mehrere Studien mit Urelumab wurden allerdings abgebrochen. Wenn ich es richtig gelesen habe, so gab es erhöhte Leberwerte, so dass nun mit niedrigeren Dosierungen weiter getestet wird. CLDXs CDX-1127 hat solche Probleme bisher nicht.
AKs, die das Immunsystem aktivieren, können zu schweren Nebenwirkungen führen, wenn das Immunsystem überreagiert. Vor mehreren Jahren gab es mal eine deutsche Firma in der Presse, bei der die Probanden in einer PI mit einem ähnlichen CD-28 AK nur knapp überlebt haben. CLDX betont, dass ihr CD-27 AK bisher sehr sicher war und es keine Anzeichen für derartige schwere Nebenwirkungen gegeben hat.
Allerdings habe ich in den folgenden Artikeln gelesen, dass agonistische (d.h. verstärkende) AKs auf CD-27 zu konträren Ergebnissen führen können. Es könnte auch sein, dass ein solcher AK das Krebswachstum beschleunigt und eher ein hemmender AK den Krebs verringert. Positiv ist allerdings eine mögliche Wirkung des CD-27 AKs auf Blutkrebs-Stammzellen... das sind quasi schwer zerstörbare Krebszellen, die dazu führen, dass es immer wieder zu Rückfällen kommt. In diesem Fall z.B. bei CLL usw...
http://www.smw.ch/content/smw-2013-13734/
"From “magic bullets” to specific cancer immunotherapy"
...In addition, T cell co-stimulatory receptors such as CD28 and the TNF receptor family members CD137, OX40, GITR and CD27 may serve as potential targets for agonistic mAbs in order to activate anti-tumoural T cell responses ... Current evidence supports the view that CD27-signalling improves anti-tumoural immunity as well. However, these findings are controversial. Some pre-clinical studies demonstrate that agonistic anti-CD27 mAbs effectively activate immune cells to control or eliminate lymphomas, leukemia and solid tumours. ...In contrast, we could recently document in a murine tumour model that activation of CD27 induces progression of solid tumours by inducing regulatory Tregs.
...
Cancer stem cells (CSCs) are a subpopulation of cancer cells that are thought to drive the growth of tumours,... Cure of cancer implies the elimination of CSCs. However, CSCs display increased resistance against chemotherapy, irradiation and even targeted therapy. Several factors favour CSC resistance, such as the expression of high levels of ABC pumps that expel small molecules and the localisation in hypoxic niches, preventing the accumulation of reactive oxygen species after radiotherapy. Therefore, new therapies that selectively destroy CSCs are needed... Recent work from our laboratory demonstrates that LSCs may be targeted by blocking CD27 signalling. The TNF-receptor family member CD27 is expressed on CML LSC and CD27 signalling activated the canonical Wnt pathway, induced LSC proliferation, increased differentiation to malignant granulocytes and promoted disease progression...
http://cancerres.aacrjournals.org/content/early/2012/05/24/0…
"CD27-signaling promotes tumor growth"
Naja, dabei handelt sich zwar nur um Tiermodelle, trotzdem besteht offensichtlich ein Risiko, dass CDX-1127 genau gegenteilig wirken könnte. Andererseits sind die Erwartungen wohl auch sehr niedrig.
******
Was ist von Innate Pharam http://www.innate-pharma.com/en/product-pipeline zu halten?... ein französischer Biotech, der in diesem Feld aktiv ist. BMY hat deren KIR-AK Lirlumab einlizensiert und führt Kombi-Studien mit PD-1 durch. Innate dürfte Royalties im 15% Bereich besitzen. MK ca. 130 Mio USD.
http://www.innate-pharma.com/sites/default/files/asco2013_tp…
Gruß
ipollit
PCYC:
http://www.istockanalyst.com/finance/story/6461556/pharmacyc…
Pharmacyclics, Inc. (PCYC): Ibrutinib Sales Could Be Higher Than Expected
June 13, 2013 09:46 AM
(By Mani) Pharmacyclics, Inc. (NASDAQ: PCYC : 87.93, -0.205) is ahead of a transformational phase in the next 12-24 months where the treatment of Chronic lymphocytic leukemia (CLL) is going to have a paradigm shift, courtesy Ibrutinib, whose sales could be higher than expectations.
The blood cancer drug Ibrutinib is considered as an attractive and scarce blockbuster asset in oncology and could position Pharmacyclics as the next Celgene Corp. (NASDAQ: CELG : 120.12, 2.01) as the drug develops into many indications over time. The company is expected to have continued good data and advance more indications forward.
By using Ibrutinib, the CLL treatment would have a dynamic shift from toxic chemotherapy or infused/injected drugs to a simple pill with high-end impressive efficacy with years of durability and minimal tolerability issues.
"According to our recent survey, Ibrutinib will see solid uptake across not just in currently-treated relapsed/refractory patients of 7-10k in US, but also in two new markets: 1) "elderly unfit for chemo" and 2) "watch and wait" patients who don't get therapy today," RBC Capital Markets analyst Michael Yee wrote in a note to clients.
If the event materializes, then it could add another 5 – 10K patients and likely lead to "sales upside" earlier than and above investor expectations. In addition, the drug would be used more broadly across CLL and for years of chronic use. Ibrutinib should find use not only in the 7-10k pts treated annually on chemo/Rituxan.
The pricing of the drug could be much higher than expected. Oncology drugs Xalkori, Kyprolis, Pomalyst, Iclusig, etc are coming at $100-120k, and we predict a game-changing transformational oral therapy like Ibrutinib will come in on high-end of this range.
Over time, a 30-40 percent penetration into 20K patients at a minimum price of $100k with duration of 2-4 yrs, the company could generate sales of $2 billion to $3 billion plus in US alone for CLL and $4 billion to $5 billion worldwide.
"Put another way on a $5B drug x 5x sales is $25B EV with half to PCYC is $12B EV or 50-100% upside from here over the longterm. Like Revlimid in myeloma, we think Ibrutinib becomes standard of care in CLL, so future drugs are used on top or after years of Ibrutinib use," Yee noted.
The sales could increase based on rapid CLL adoption in 3 key markets (relapsed/ refractory, elderly chemo-intolerant, "watch-and-wait"), as well as adoption in other leukemias/lymphomas such as Mantle cell lymphoma (MCL), Follicular Non-Hodgkin Lymphoma and Waldenstroms.
In addition, the extensive market reach/depth of partner Janssen Biotech, Inc., a Johnson & Johnson company, which could help grow Ibrutinib sales ex-US rapidly and broadly, giving confidence of maximal sales potential.
Meanwhile, Ibrutinib filing Mantle cell lymphoma (MCL) is now anticipated in the third quarter versus prior deadline of year-end 2013 and could receive rapid FDA approval by the end of 2013 or early 2014 given FDA Breakthrough Therapy designation. This would be followed by interim analysis in the first quarter, which is likely to be positive and provide a basis for accelerated filing in CLL.
"We believe FY14 consensus of $40M is easily achievable and reflects some but not widespread CLL use. Either way, we expect Ibrutinib to be approved in CLL by 2015 and we believe 2015-16 WW consensus of $303M and $829M are still modest. We believe Ibrutinib launch and uptake could come ahead of investor expectations.," Yee said.
---------------
ARRY:
In einem schwachen Markt gehörig unter Druck geraten. Im vergangenen Oktober ging es in einer solchen Phase von 6 Dollar bis runter auf 3,30. Wo landen wir diesmal.
Hab weiter etwas aufgestockt. Bin fundamental von dem Wert extrem überzeugt.
http://www.istockanalyst.com/finance/story/6461556/pharmacyc…
Pharmacyclics, Inc. (PCYC): Ibrutinib Sales Could Be Higher Than Expected
June 13, 2013 09:46 AM
(By Mani) Pharmacyclics, Inc. (NASDAQ: PCYC : 87.93, -0.205) is ahead of a transformational phase in the next 12-24 months where the treatment of Chronic lymphocytic leukemia (CLL) is going to have a paradigm shift, courtesy Ibrutinib, whose sales could be higher than expectations.
The blood cancer drug Ibrutinib is considered as an attractive and scarce blockbuster asset in oncology and could position Pharmacyclics as the next Celgene Corp. (NASDAQ: CELG : 120.12, 2.01) as the drug develops into many indications over time. The company is expected to have continued good data and advance more indications forward.
By using Ibrutinib, the CLL treatment would have a dynamic shift from toxic chemotherapy or infused/injected drugs to a simple pill with high-end impressive efficacy with years of durability and minimal tolerability issues.
"According to our recent survey, Ibrutinib will see solid uptake across not just in currently-treated relapsed/refractory patients of 7-10k in US, but also in two new markets: 1) "elderly unfit for chemo" and 2) "watch and wait" patients who don't get therapy today," RBC Capital Markets analyst Michael Yee wrote in a note to clients.
If the event materializes, then it could add another 5 – 10K patients and likely lead to "sales upside" earlier than and above investor expectations. In addition, the drug would be used more broadly across CLL and for years of chronic use. Ibrutinib should find use not only in the 7-10k pts treated annually on chemo/Rituxan.
The pricing of the drug could be much higher than expected. Oncology drugs Xalkori, Kyprolis, Pomalyst, Iclusig, etc are coming at $100-120k, and we predict a game-changing transformational oral therapy like Ibrutinib will come in on high-end of this range.
Over time, a 30-40 percent penetration into 20K patients at a minimum price of $100k with duration of 2-4 yrs, the company could generate sales of $2 billion to $3 billion plus in US alone for CLL and $4 billion to $5 billion worldwide.
"Put another way on a $5B drug x 5x sales is $25B EV with half to PCYC is $12B EV or 50-100% upside from here over the longterm. Like Revlimid in myeloma, we think Ibrutinib becomes standard of care in CLL, so future drugs are used on top or after years of Ibrutinib use," Yee noted.
The sales could increase based on rapid CLL adoption in 3 key markets (relapsed/ refractory, elderly chemo-intolerant, "watch-and-wait"), as well as adoption in other leukemias/lymphomas such as Mantle cell lymphoma (MCL), Follicular Non-Hodgkin Lymphoma and Waldenstroms.
In addition, the extensive market reach/depth of partner Janssen Biotech, Inc., a Johnson & Johnson company, which could help grow Ibrutinib sales ex-US rapidly and broadly, giving confidence of maximal sales potential.
Meanwhile, Ibrutinib filing Mantle cell lymphoma (MCL) is now anticipated in the third quarter versus prior deadline of year-end 2013 and could receive rapid FDA approval by the end of 2013 or early 2014 given FDA Breakthrough Therapy designation. This would be followed by interim analysis in the first quarter, which is likely to be positive and provide a basis for accelerated filing in CLL.
"We believe FY14 consensus of $40M is easily achievable and reflects some but not widespread CLL use. Either way, we expect Ibrutinib to be approved in CLL by 2015 and we believe 2015-16 WW consensus of $303M and $829M are still modest. We believe Ibrutinib launch and uptake could come ahead of investor expectations.," Yee said.
---------------
ARRY:
In einem schwachen Markt gehörig unter Druck geraten. Im vergangenen Oktober ging es in einer solchen Phase von 6 Dollar bis runter auf 3,30. Wo landen wir diesmal.
Hab weiter etwas aufgestockt. Bin fundamental von dem Wert extrem überzeugt.
ASTX mit einem Update zu SG-110. Vom Markt ignoriert. Hört sich doch aber gar nicht schlecht an. Plane hier eventuell meine Position nochmal aufzustocken. Oder hab ich da was übersehen? Sind hier wirksamere Medikamente im Anmarsch?
The update focused on details of the biological and clinical activity as well as safety in the group of intermediate or high risk relapsed or refractory myelodysplastic syndromes (r/r MDS) patients treated in the dose-escalation phase 1 part of the SGI-110-01 study. The study enrolled 15 intermediate or high risk MDS patients including chronic myelomonocytic leukemia who were heavily pretreated with a median number of prior regimens of 2 (range 2-6 prior regimens). All 15 patients had received prior azacitidine or decitabine, and 40% of them previously received both agents.
Of the 15 patients, six achieved a clinical response (4 patients with hematological improvement or HI, and 2 patients with marrow CR or mCR) for an overall response rate of 40% (95% CI of 16-68%). The median duration of response was 92 days (range 28-126 days). The two mCR patients received prior treatment with both azacitidine and decitabine, and they demonstrated pronounced DNA demethylation of >10% as measured by the LINE-1 assay (19% and 38% demethylation of LINE-1). SGI-110 subcutaneous treatment was well tolerated. The most common adverse events were injection site pain (mostly Grade 1), and myelosuppression.
http://www.istockanalyst.com/article/viewiStockNews/articlei…
Hatte mir die letzte Präsentation angehört. Die war stark auf SG-110 und AT13387 fokussiert. Hier der Link für Interessierte:
http://wsw.com/webcast/jeff77/astx/
Die Vorteile von SG-110 sind selbst für mach als Laien nachvollziehbar. Im Dezember sollen auf der ASH hier erste Ergebnisse zur P II kommen...und dann relativ bald die Entscheidung über die P III.
The update focused on details of the biological and clinical activity as well as safety in the group of intermediate or high risk relapsed or refractory myelodysplastic syndromes (r/r MDS) patients treated in the dose-escalation phase 1 part of the SGI-110-01 study. The study enrolled 15 intermediate or high risk MDS patients including chronic myelomonocytic leukemia who were heavily pretreated with a median number of prior regimens of 2 (range 2-6 prior regimens). All 15 patients had received prior azacitidine or decitabine, and 40% of them previously received both agents.
Of the 15 patients, six achieved a clinical response (4 patients with hematological improvement or HI, and 2 patients with marrow CR or mCR) for an overall response rate of 40% (95% CI of 16-68%). The median duration of response was 92 days (range 28-126 days). The two mCR patients received prior treatment with both azacitidine and decitabine, and they demonstrated pronounced DNA demethylation of >10% as measured by the LINE-1 assay (19% and 38% demethylation of LINE-1). SGI-110 subcutaneous treatment was well tolerated. The most common adverse events were injection site pain (mostly Grade 1), and myelosuppression.
http://www.istockanalyst.com/article/viewiStockNews/articlei…
Hatte mir die letzte Präsentation angehört. Die war stark auf SG-110 und AT13387 fokussiert. Hier der Link für Interessierte:
http://wsw.com/webcast/jeff77/astx/
Die Vorteile von SG-110 sind selbst für mach als Laien nachvollziehbar. Im Dezember sollen auf der ASH hier erste Ergebnisse zur P II kommen...und dann relativ bald die Entscheidung über die P III.
Antwort auf Beitrag Nr.: 44.858.293 von kmastra am 16.06.13 14:42:54Bei high risk r/r MDS gibt es wohl keine Alternativen... ich denke, dass Dacogen/Vidaza etabliert sind und daher SGI-110 gut passt. Mich interessiert allerdings noch mehr, ob SGI-110 auch bei anderen Krebsarten wie solide Tumore eine Wirkung zeigt. Insbesondere finde ich spannend, dass es Hinweise gibt, dass HMAs den Krebs für das Immunsystem angreifbar machen bzw. eine Synergie mit immunologischen Krebstherapien wie PD-1 denkbar ist.
HMAs verändern die epigenische Ausprägung durch die Veränderung der Methylierung:
http://de.wikipedia.org/wiki/DNA-Methylierung
"Die DNA-Methylierung ist eine DNA-Modifikation durch Methylierung der DNA... Da fehlerhafte DNA-Methylierungen auf Zellebene reduzierte oder erhöhte Genaktivität bedingen, und diese Aktivitätsveränderungen meist stabil an Tochterzellen vererbt werden, sind sie auf Organismenebene häufig auch Ursache für Krankheiten. So weisen z. B. Tumorzellen oft Methylierungsmuster auf, die von denjenigen gesunder Gewebe signifikant abweichen. Ein Tumor kann dabei sowohl als Folge zu starker Methylierung (Hypomethylierung-Hypermethylierung) von upstream DNA-Bereichen entstehen, als auch bei verringertem Methylierungsgrad...
Seitdem man den Einfluss der Hypermethylierung auf das Tumorwachstum identifiziert hat, hat man nach Wegen gesucht, um durch Demethylierung die im Entstehen begriffenen bzw. auch schon existierende Tumore wieder der Zellzykluskontrolle zu unterwerfen. ... Es wurden klinische Studien veröffentlicht, in denen bei menschlichen Patienten ein hemmender Effekt von Aza-Desoxy-Cytosin auf Tumorentwicklung gezeigt werden konnte. Die Forscher nennen ihr Verfahren Epigenetische Therapie. Für die Behandlung des Myelo-Dysplastischen Syndroms, das sich häufig zu einer Akuten Myeloischen Leukämie entwickelt, wurde 5-Aza-2'-Desoxy-Cytosin unter dem Namen Dacogen von der FDA im Jahre 2006 als Medikament freigegeben Dacogen-Freigabe durch die FDA"
Für mein Verständnis greifen HMAs erheblich in die Funktion von Zellen ein, so dass deutliche Nebenwirkungen zu erwarten sind. Allerdings werden dabei auch Merkmale freigelegt, durch die das Immunsystem die Tumorzellen besser erkennen kann.
Ein neuer Ansatz ist ja, den Schutz der Krebszellen vor dem Immunsystems durch z.B. PD-1 Hemmer zu verringern. Das Immunsystem greift dann den Krebs an, was zu einer lang anhaltenden Unterdrückung des Krebswachstums führen kann. Das funktioniert aber nur bei einem Teil der Patienten. Es könnte sein, dass durch HMAs dieser Anteil erhöht werden kann:
"In addition, new data at AACR has caught some attention: an abstract and presentation on a sequenced approach of an HMA (Vidaza) and HDAC then immediately followed with PD-1 therapy resulted in clinical benefit of 5/5 in non-small cell lung cancer patients (including 60% (3/5) partial responses by RECIST with 10-20 month duration, and 2 stable disease >6 months). This is much higher than what PD-1 shows alone.
According to the abstract, a clinical trial testing an HMA and HDAC combined with PD-1 blockade could be synergistic and is now getting underway. This approach could be interesting as the hypothesis is epigenetic therapy with a drug like Vidaza or Dacogen (and read through is an even better drug like SGI-110) could help activate the innate and adaptive immune system and sensitize a cancer patient to immunotherapy like PD-1 (being developed by BMY and others and could be multi-billion dollar franchise in cancer)."
********
"Epigenetic priming with the oral Vidaza follow-on CC-486 shaping up as a new theme with a Phase Ib trial in solid tumors priming with CC-486 on days 1-14 followed by carboplatin or Abraxane with a CC-486 only control (days 1-21). Part 2 of the Phase Ib calls for expansion cohorts in bladed and ovarian (+carboplatin), NSCLC and pancreatic (+Abraxane) and monotherapy (colorectal). Case study data for CC-486 priming with Abraxane was supportive in pancreatic and endometrial cancers. Longer term, plans call for CC-486 +IMiDs in solid tumors. The CTEP trial in metastatic NSCLC will explore synergy of HDAC inhibition with entinostat and CC-486 epigenetic priming (vs Vidaza + entinostat and vs investigators choice). With BMS and SU2C, Celgene will test epigenetic priming with Vidaza + entinostat or CC-486 monotherapy prior to anti-PD-1 therapy with nivolumab. In the more traditional setting of hematologic malignancies, combination work with R-CHOP in DLBCL and T-cell lymphoma and Phase I iNHL trials are being pursued."
********
"Is Celgene’s oral Vidaza not going to be a major competitor to SGI-110?
Oral Vidaza has shown proof of concept in Phase II and has advanced into Phase III. However, the oral version appears less potent than IV Vidaza is and requires a high doses of the drug (leading to Grade 3 GI toxicity). Also, first Phase III is only in ‘low-risk’ MDS patients as maintenance therapy, versus SGI-110 being tested in high-risk MDS, front-line and relapsed and/or refractory patients, and in AML patients, so this is not directly competitive to the plans for oral Vidaza."
*******
http://www.stockmarketstudy.org/wordpress/astex-pharmaceutic…
"Michael G. King – JMP Securities LLC, Research Division
Okay. And then one set of studies that was, I guess, conspicuous by its absence, or by their absence, was any immune priming studies. There was a fair bit of discussion at AACR regarding the sensitivity to immunotherapies, like PD-1 antibody intervention, subsequent to HMA treatment, so I just wondered if that’s on your radar screen and what you might be able to comment about it?
Michael Molkentin
Yes, Mike. That’s a good question. We certainly have some plans for immunomodulatory clinical trials. Those plans have not been finalized yet. And these — the activity to start those kinds of trials have not started yet, that’s why we’re not commenting on it now. But rest assured, once we start planning and have clear idea about that type of study and also the timeline for that study, we’ll be communicating that to you."

"SGI-110 received full patent protection in the U.S. yesterday (6/12), according to uspto.gov (patent no. 7700567). Specifically, the SGI-110 patent covers the synthesis of oligonucleotide analogs that incorporate 5-aza-cytosine (the active moiety in hypomethylating agents (HMAs)). We view the patent scope to be much broader than the specific dinucleotide combination comprising SGI-110, covering virtually all potential prodrug forms of either Dacogen (decitabine) or Vidaza (5-aza-cytidine).
In essence, we regard the SGI-110 patent as effectively preempting the development of novel HMA therapies with differentiated PK profiles using similar methodology. With 20 years patent life from the date of filing (Feb 9, 2010), SGI-110 also enjoys a long runway of market exclusivity. The ‘110 patent increases our confidence in the longer-term outlook from a competitive perspective. However, our focus remains with SGI-110’s performance over the nearer-term, specifically the Phase II expansion trial underway that is expected yield updated AML data and convert to the initiation of a pivotal study around the timing of ASH in December."
****
Wie ich ja shconmal geschrieben habe, gibt es auch schon Studien zusammen mit Celldex, die darauf basieren:
http://www.obroncology.com/blog/2013/04/aacr-2013-post-view-…
"Early Signs that Epigenetics Holds the Keys to Immunotherapy & Vice Versa
In addition to the separate plenary sessions on immunotherapy and epigenetics, we noted several poster presentations that hinted strongly at the ability to boost anti-tumor immune responses through the epigenetic reprogramming, primarily through the use of hypothmethylating agents. ... Meanwhile, a forthcoming prospective study will test the hypothesis in vivo, assessing the combined effect of Dacogen plus the NY-ESO1 vaccine CDX-1401 (CLDX, NC) in patients with AML/MDS..."
Gruß
ipollit
HMAs verändern die epigenische Ausprägung durch die Veränderung der Methylierung:
http://de.wikipedia.org/wiki/DNA-Methylierung
"Die DNA-Methylierung ist eine DNA-Modifikation durch Methylierung der DNA... Da fehlerhafte DNA-Methylierungen auf Zellebene reduzierte oder erhöhte Genaktivität bedingen, und diese Aktivitätsveränderungen meist stabil an Tochterzellen vererbt werden, sind sie auf Organismenebene häufig auch Ursache für Krankheiten. So weisen z. B. Tumorzellen oft Methylierungsmuster auf, die von denjenigen gesunder Gewebe signifikant abweichen. Ein Tumor kann dabei sowohl als Folge zu starker Methylierung (Hypomethylierung-Hypermethylierung) von upstream DNA-Bereichen entstehen, als auch bei verringertem Methylierungsgrad...
Seitdem man den Einfluss der Hypermethylierung auf das Tumorwachstum identifiziert hat, hat man nach Wegen gesucht, um durch Demethylierung die im Entstehen begriffenen bzw. auch schon existierende Tumore wieder der Zellzykluskontrolle zu unterwerfen. ... Es wurden klinische Studien veröffentlicht, in denen bei menschlichen Patienten ein hemmender Effekt von Aza-Desoxy-Cytosin auf Tumorentwicklung gezeigt werden konnte. Die Forscher nennen ihr Verfahren Epigenetische Therapie. Für die Behandlung des Myelo-Dysplastischen Syndroms, das sich häufig zu einer Akuten Myeloischen Leukämie entwickelt, wurde 5-Aza-2'-Desoxy-Cytosin unter dem Namen Dacogen von der FDA im Jahre 2006 als Medikament freigegeben Dacogen-Freigabe durch die FDA"
Für mein Verständnis greifen HMAs erheblich in die Funktion von Zellen ein, so dass deutliche Nebenwirkungen zu erwarten sind. Allerdings werden dabei auch Merkmale freigelegt, durch die das Immunsystem die Tumorzellen besser erkennen kann.
Ein neuer Ansatz ist ja, den Schutz der Krebszellen vor dem Immunsystems durch z.B. PD-1 Hemmer zu verringern. Das Immunsystem greift dann den Krebs an, was zu einer lang anhaltenden Unterdrückung des Krebswachstums führen kann. Das funktioniert aber nur bei einem Teil der Patienten. Es könnte sein, dass durch HMAs dieser Anteil erhöht werden kann:
"In addition, new data at AACR has caught some attention: an abstract and presentation on a sequenced approach of an HMA (Vidaza) and HDAC then immediately followed with PD-1 therapy resulted in clinical benefit of 5/5 in non-small cell lung cancer patients (including 60% (3/5) partial responses by RECIST with 10-20 month duration, and 2 stable disease >6 months). This is much higher than what PD-1 shows alone.
According to the abstract, a clinical trial testing an HMA and HDAC combined with PD-1 blockade could be synergistic and is now getting underway. This approach could be interesting as the hypothesis is epigenetic therapy with a drug like Vidaza or Dacogen (and read through is an even better drug like SGI-110) could help activate the innate and adaptive immune system and sensitize a cancer patient to immunotherapy like PD-1 (being developed by BMY and others and could be multi-billion dollar franchise in cancer)."
********
"Epigenetic priming with the oral Vidaza follow-on CC-486 shaping up as a new theme with a Phase Ib trial in solid tumors priming with CC-486 on days 1-14 followed by carboplatin or Abraxane with a CC-486 only control (days 1-21). Part 2 of the Phase Ib calls for expansion cohorts in bladed and ovarian (+carboplatin), NSCLC and pancreatic (+Abraxane) and monotherapy (colorectal). Case study data for CC-486 priming with Abraxane was supportive in pancreatic and endometrial cancers. Longer term, plans call for CC-486 +IMiDs in solid tumors. The CTEP trial in metastatic NSCLC will explore synergy of HDAC inhibition with entinostat and CC-486 epigenetic priming (vs Vidaza + entinostat and vs investigators choice). With BMS and SU2C, Celgene will test epigenetic priming with Vidaza + entinostat or CC-486 monotherapy prior to anti-PD-1 therapy with nivolumab. In the more traditional setting of hematologic malignancies, combination work with R-CHOP in DLBCL and T-cell lymphoma and Phase I iNHL trials are being pursued."
********
"Is Celgene’s oral Vidaza not going to be a major competitor to SGI-110?
Oral Vidaza has shown proof of concept in Phase II and has advanced into Phase III. However, the oral version appears less potent than IV Vidaza is and requires a high doses of the drug (leading to Grade 3 GI toxicity). Also, first Phase III is only in ‘low-risk’ MDS patients as maintenance therapy, versus SGI-110 being tested in high-risk MDS, front-line and relapsed and/or refractory patients, and in AML patients, so this is not directly competitive to the plans for oral Vidaza."
*******
http://www.stockmarketstudy.org/wordpress/astex-pharmaceutic…
"Michael G. King – JMP Securities LLC, Research Division
Okay. And then one set of studies that was, I guess, conspicuous by its absence, or by their absence, was any immune priming studies. There was a fair bit of discussion at AACR regarding the sensitivity to immunotherapies, like PD-1 antibody intervention, subsequent to HMA treatment, so I just wondered if that’s on your radar screen and what you might be able to comment about it?
Michael Molkentin
Yes, Mike. That’s a good question. We certainly have some plans for immunomodulatory clinical trials. Those plans have not been finalized yet. And these — the activity to start those kinds of trials have not started yet, that’s why we’re not commenting on it now. But rest assured, once we start planning and have clear idea about that type of study and also the timeline for that study, we’ll be communicating that to you."

"SGI-110 received full patent protection in the U.S. yesterday (6/12), according to uspto.gov (patent no. 7700567). Specifically, the SGI-110 patent covers the synthesis of oligonucleotide analogs that incorporate 5-aza-cytosine (the active moiety in hypomethylating agents (HMAs)). We view the patent scope to be much broader than the specific dinucleotide combination comprising SGI-110, covering virtually all potential prodrug forms of either Dacogen (decitabine) or Vidaza (5-aza-cytidine).
In essence, we regard the SGI-110 patent as effectively preempting the development of novel HMA therapies with differentiated PK profiles using similar methodology. With 20 years patent life from the date of filing (Feb 9, 2010), SGI-110 also enjoys a long runway of market exclusivity. The ‘110 patent increases our confidence in the longer-term outlook from a competitive perspective. However, our focus remains with SGI-110’s performance over the nearer-term, specifically the Phase II expansion trial underway that is expected yield updated AML data and convert to the initiation of a pivotal study around the timing of ASH in December."
****
Wie ich ja shconmal geschrieben habe, gibt es auch schon Studien zusammen mit Celldex, die darauf basieren:
http://www.obroncology.com/blog/2013/04/aacr-2013-post-view-…
"Early Signs that Epigenetics Holds the Keys to Immunotherapy & Vice Versa
In addition to the separate plenary sessions on immunotherapy and epigenetics, we noted several poster presentations that hinted strongly at the ability to boost anti-tumor immune responses through the epigenetic reprogramming, primarily through the use of hypothmethylating agents. ... Meanwhile, a forthcoming prospective study will test the hypothesis in vivo, assessing the combined effect of Dacogen plus the NY-ESO1 vaccine CDX-1401 (CLDX, NC) in patients with AML/MDS..."
Gruß
ipollit
Danke. Die von dir geschilderten Zusammenhänge sind wirklich sehr interessant. Denke, dass dies neben LGND und ARRY meine 3. große Position wird. Neben den medizinischen Zusammenhängen erscheint mir hier auch das Chance/Risikoverhältnis ausgewogen. Die Partnerprogramme sind interessant - wenngleich sie noch sehr früh und der Konkurrenz gegenüber zeitlich hinterher sind.
Der große Vorteil von SG-110 scheint ja insbesondere in der längeren Verfügbarkeit zu liegen. Von daher kann man eine bessere Effektivität und auch eine bessere Sicherheit vermuten:

Der große Vorteil von SG-110 scheint ja insbesondere in der längeren Verfügbarkeit zu liegen. Von daher kann man eine bessere Effektivität und auch eine bessere Sicherheit vermuten:
Antwort auf Beitrag Nr.: 44.858.855 von kmastra am 16.06.13 18:42:31Die Behandlung mit SGI-110 kann zur Ausprägung von Merkmalen führen, die die Wirkung einer Immuntherapie erhöhen. Z.B. PD-L1... "On the other hand, it is possible that the induction of PD-L1 expression though HMA exposure acts as primer or homing mechanism for activated T cells. Recall in relation to the plenary talk by Dr. Topalian that tumors responding to nivolumab exhibited relatively higher levels of PD-L1 expression compared with non-responders."
Oder NY-ESO-1... hier sollte CDX-1401 besser wirken: (TAT 2013)


Gruß
ipollit
Oder NY-ESO-1... hier sollte CDX-1401 besser wirken: (TAT 2013)
Gruß
ipollit
Habe mir kurz vor Börsenschluss einen Neuling ins Depot gelegt: Enanta Pharmaceuticals (ENTA).
Starke Partner, genug Cash (121 Mio), geringe Marktkapitalisierung (290 Mio). Die fliegen definitiv noch unter dem Radar.

Starke Partner, genug Cash (121 Mio), geringe Marktkapitalisierung (290 Mio). Die fliegen definitiv noch unter dem Radar.

Wenn man sich die Kursentwicklung von ENTA heute ansieht, dann sollte die heutige Präsentation auf der Wells Fargo Healthcare Conference erfolgreich gewesen sein. Ich bleibe bei meiner gestrigen Aussage, dass dieser Wert krass unterbewertet ist. Schaut euch einfach mal die Unternehmenspräsentation an. Hat alles Hand und Fuß:
http://ir.enanta.com/phoenix.zhtml?c=147990&p=irol-EventDeta…
http://ir.enanta.com/phoenix.zhtml?c=147990&p=irol-EventDeta…
Antwort auf Beitrag Nr.: 44.872.897 von BiotechHype am 18.06.13 20:58:18@BiotechHype,
das sieht auf den ersten Blick interessant aus!
Wer jetzt noch die HCV-Karte spielen will, könnte mit Enanta richtig liegen.
Ich sehe zwar Gilead deutlich vorne, aber über Abbotts Cocktail war auch viel Gutes zu lesen. Ein Nachteil dort ist die schwierigere Verabreichung (mehrere Tabletten, möglicherweise über den Tag verteilt, während Gilead mit einer once a day Pille kommen wird).
Wie auch immer, es dürfte Platz für Abbott sein, wenn der HCV-Markt so groß wird,wie viele behaupten - und das Enanta da mit zweistelligen Royalties auf zu mindest einen Teil des Cocktails dabei ist, hat mich schon sehr überrascht.
We are eligible to receive additional pre-commercial milestones, as well as, tiered, double-digit royalties based on annual net sales allocable to ABT-450 or to any of our collaborations additional HCV protease inhibitors.
Bei 300 Mio. Marktkap. ist das definitiv eine Überlegung wert!
Leider bin ich im HCV-Bereich nicht mehr auf dem aktuellen Stand, seit ich meine GILD-Position aufgegeben habe.
Es könnte sich lohnen, hier wieder etwas nachzuarbeiten.
das sieht auf den ersten Blick interessant aus!
Wer jetzt noch die HCV-Karte spielen will, könnte mit Enanta richtig liegen.
Ich sehe zwar Gilead deutlich vorne, aber über Abbotts Cocktail war auch viel Gutes zu lesen. Ein Nachteil dort ist die schwierigere Verabreichung (mehrere Tabletten, möglicherweise über den Tag verteilt, während Gilead mit einer once a day Pille kommen wird).
Wie auch immer, es dürfte Platz für Abbott sein, wenn der HCV-Markt so groß wird,wie viele behaupten - und das Enanta da mit zweistelligen Royalties auf zu mindest einen Teil des Cocktails dabei ist, hat mich schon sehr überrascht.
We are eligible to receive additional pre-commercial milestones, as well as, tiered, double-digit royalties based on annual net sales allocable to ABT-450 or to any of our collaborations additional HCV protease inhibitors.
Bei 300 Mio. Marktkap. ist das definitiv eine Überlegung wert!
Leider bin ich im HCV-Bereich nicht mehr auf dem aktuellen Stand, seit ich meine GILD-Position aufgegeben habe.
Es könnte sich lohnen, hier wieder etwas nachzuarbeiten.
Ohad Hammer hat von aussichtsreichen IPOs... "The stream of IPO is very strong, which is great for investors looking for new opportunities... I think it provides investors in small cap biotechs more opportunities to invest. Some of the companies are quite interesting with real meat on the bone. In many cases, valuation is very reasonable."
Welche IPOs sind denn als aussichtsreich anzusehen?
Ich finde wie bereits gesagt Epizyme (EPZM) recht interessant, mit ihren epigenetischen Therapien, die sehr breit (EZH2) oder auch sehr gezielt (DOT1L) wirken können
http://www.epizyme.com/index.asp

Im Bereich der Krebs-Stammzellen geht demnächst OncoMed an die Börse... hört sich für mich auch interessant an
http://www.oncomed.com/

Bezüglich der Krebs-Stammzellen gab es bereits das IPO Stemline (STML), das sich zuletzt gut entwickelt hat.
http://www.stemline.com/


Interessant könnte auch Agios im Bereich von Therapien sein, die beim Stoffwechsel vom Tumor ansetzen:
http://www.agios.com/

Gibt es weitere interessante IPOs?
Gruß
ipollit
Welche IPOs sind denn als aussichtsreich anzusehen?
Ich finde wie bereits gesagt Epizyme (EPZM) recht interessant, mit ihren epigenetischen Therapien, die sehr breit (EZH2) oder auch sehr gezielt (DOT1L) wirken können
http://www.epizyme.com/index.asp

Im Bereich der Krebs-Stammzellen geht demnächst OncoMed an die Börse... hört sich für mich auch interessant an
http://www.oncomed.com/

Bezüglich der Krebs-Stammzellen gab es bereits das IPO Stemline (STML), das sich zuletzt gut entwickelt hat.
http://www.stemline.com/

Interessant könnte auch Agios im Bereich von Therapien sein, die beim Stoffwechsel vom Tumor ansetzen:
http://www.agios.com/

Gibt es weitere interessante IPOs?
Gruß
ipollit
Ist Celldex CDX-011 auch eine immonologisch wirkende Krebs-Therapie wie z.B. PD-1? In Tierversuchen gab es jedenfalls Hinweise, dass GPNMB auch eine derartige Funktion besitzt. Ist zwar nichts neues und fand sich schon mal Anfang letzten Jahres auf Folien von CLDX (http://files.shareholder.com/downloads/ABEA-39HH7S/251801770…)...
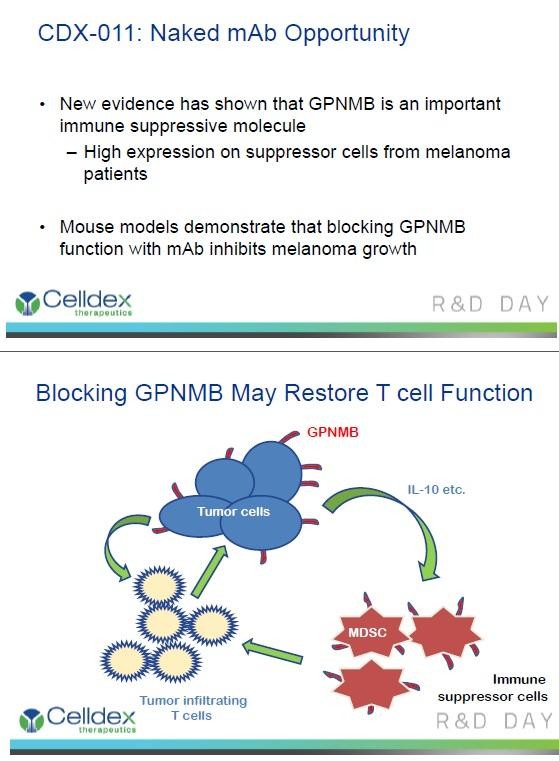
GPNMB wird bei Mäusen auch DC-HIL bezeichnet: http://en.wikipedia.org/wiki/GPNMB "Transmembrane glycoprotein NMB is a protein that in humans is encoded by the GPNMB gene. The mouse and rat orthologues of GPNMB are known as DC-HIL and Osteoactivin (OA), respectively."
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2905472/
2010... "DC-HIL/Gpnmb promotes growth of melanoma in mice by inhibiting the activation of tumor-reactive T cells
DC-HIL/Gpnmb expressed on antigen-presenting cells (APC) attenuates T cell activation by binding to syndecan-4 (SD-4) on activated T cells. Since DC-HIL/Gpnmb is expressed abundantly by mouse and human melanoma lines, we posited that melanoma-associated DC-HIL/Gpnmb exerts similar inhibitory function on melanoma-reactive T cells.... We conclude that DC-HIL/Gpnmb confers upon melanoma the ability to downregulate activation of melanoma-reactive T cells, thereby allowing melanoma to evade immunologic recognition and destruction. As such, the DC-HIL/SD-4 pathway is a potentially useful target for anti-melanoma immunotherapy.
...Among co-inhibitors of T cell activation, DC-HIL most closely resembles PD-L1 in its function (The following popper user interface control may not be accessible. .... We probed the influence of PD-L1 on B16F10 melanoma cells and found no significant effect on subcutaneous tumor growth and survival of tumor-bearing mice, consistent with previous work in PD-1-deficient mice, and supportive of DC-HIL being more important than PD-L1 in this setting...
Ich will damit nicht sagen, dass CDX-011 auch eine Aktivität wie PD-1 Hemmer besitzt, aber vielleicht wirkt es ja trotzdem in irgendeiner Weise auf das Immunsystem, dass dann den Krebs besser bekämpfen kann... z.B. indem nur Krebszellen ohne GPNMB überleben, die dann das Immunsystem selber bekämpfen kann.
Gruß
ipollit

GPNMB wird bei Mäusen auch DC-HIL bezeichnet: http://en.wikipedia.org/wiki/GPNMB "Transmembrane glycoprotein NMB is a protein that in humans is encoded by the GPNMB gene. The mouse and rat orthologues of GPNMB are known as DC-HIL and Osteoactivin (OA), respectively."
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2905472/
2010... "DC-HIL/Gpnmb promotes growth of melanoma in mice by inhibiting the activation of tumor-reactive T cells
DC-HIL/Gpnmb expressed on antigen-presenting cells (APC) attenuates T cell activation by binding to syndecan-4 (SD-4) on activated T cells. Since DC-HIL/Gpnmb is expressed abundantly by mouse and human melanoma lines, we posited that melanoma-associated DC-HIL/Gpnmb exerts similar inhibitory function on melanoma-reactive T cells.... We conclude that DC-HIL/Gpnmb confers upon melanoma the ability to downregulate activation of melanoma-reactive T cells, thereby allowing melanoma to evade immunologic recognition and destruction. As such, the DC-HIL/SD-4 pathway is a potentially useful target for anti-melanoma immunotherapy.
...Among co-inhibitors of T cell activation, DC-HIL most closely resembles PD-L1 in its function (The following popper user interface control may not be accessible. .... We probed the influence of PD-L1 on B16F10 melanoma cells and found no significant effect on subcutaneous tumor growth and survival of tumor-bearing mice, consistent with previous work in PD-1-deficient mice, and supportive of DC-HIL being more important than PD-L1 in this setting...
Ich will damit nicht sagen, dass CDX-011 auch eine Aktivität wie PD-1 Hemmer besitzt, aber vielleicht wirkt es ja trotzdem in irgendeiner Weise auf das Immunsystem, dass dann den Krebs besser bekämpfen kann... z.B. indem nur Krebszellen ohne GPNMB überleben, die dann das Immunsystem selber bekämpfen kann.
Gruß
ipollit
Habe in den vergangenen Tagen meine Astex Position ausgebaut. Dabei spekuliere ich vor allem auf gute P II Ergebnisse von SG110 im Dezember auf der ASH. Alleine das Programm ist m.E. mehr Wert als die derzeitige Marktkpt. Ipollit hatte zu dem möglichen zusätzlichen Nutzen ja was geschrieben. Dazu kommt, dass es noch eine voll verpartnerte mittelgroße Pipeline gibt. Die sind zwar allesamt etwas später dran als Konkurrenzprodukte, aber andereseits haben diese eben teils hervorragende Ergebnisse (z.B. Pfizers CDK 4/6)geliefert. Astex scheint mir deshalb aber auch wegen dem bereits zugelassenen Dacogen, der weiteren PII und dem soliden Cashbestand langfristig gut abgesichert.
Heute äußert sich auch Hammer positiv zu Astex:
"Yeah, they are shaping up as a well diversified oncology play, have all the right targets (CDK4/6, Akt, FGFR) in their partnered pipeline, and 2 proprietary program in p2. Will try to accumulate in the coming months in stock goes down."
http://www.orf-blog.com/syntas-fiasco-disappointing-results-…
Chartechnisch zur Zeit nicht uninteressant, ob die Unterstützung im Bereich von 4 $ hält. Bis Dezember ist ja aber noch ne Menge Zeit. Von daher könnte es noch tiefer gehen. Dann würde ich hier sicher auch nochmal nachlegen.

Heute äußert sich auch Hammer positiv zu Astex:
"Yeah, they are shaping up as a well diversified oncology play, have all the right targets (CDK4/6, Akt, FGFR) in their partnered pipeline, and 2 proprietary program in p2. Will try to accumulate in the coming months in stock goes down."
http://www.orf-blog.com/syntas-fiasco-disappointing-results-…
Chartechnisch zur Zeit nicht uninteressant, ob die Unterstützung im Bereich von 4 $ hält. Bis Dezember ist ja aber noch ne Menge Zeit. Von daher könnte es noch tiefer gehen. Dann würde ich hier sicher auch nochmal nachlegen.
Onyxx:
Übernahmegerüchte (dank an Pathfinder2 aus dem MorphoSys-Thread):
Onyx Pharmaceuticals Inc. (ONXX), the maker of the cancer drug Nexavar, jumped as high as 28 percent in extended trading after a report that Amgen Inc. (AMGN) may offer to buy the company.
Onyx reached $111.04 at 7:45 p.m. New York time yesterday after the Financial Post reported that documents show Amgen, the world’s largest biotechnology company by sales, is considering a bid of $120 a share for the South San Francisco, California-based company. Onyx earlier gained 1.9 percent to close at $86.82 for a market capitalization of $6.3 billion. The shares have increased 36 percent in the past 12 months.
Onyx and its partner, Bayer AG (BAYN) of Leverkusen, Germany sell Nexavar, a therapy for liver and kidney cancer, and Stivarga, a drug for stomach cancer. Onyx reported revenue of $362 million in 2012, with 80 percent coming from the two drugs. The company markets Kyprolis, a blood cancer drug approved in 2012, on its own.
“Strategically, this deal makes a great deal of sense for Amgen,” said Mark Schoenebaum, an analyst for ISI Group LLC in New York. “Amgen already has a very large cancer franchise. However, none of these drugs are direct anti-tumor agents.”
Both companies declined to comment yesterday on the report.
Übernahmegerüchte (dank an Pathfinder2 aus dem MorphoSys-Thread):
Onyx Pharmaceuticals Inc. (ONXX), the maker of the cancer drug Nexavar, jumped as high as 28 percent in extended trading after a report that Amgen Inc. (AMGN) may offer to buy the company.
Onyx reached $111.04 at 7:45 p.m. New York time yesterday after the Financial Post reported that documents show Amgen, the world’s largest biotechnology company by sales, is considering a bid of $120 a share for the South San Francisco, California-based company. Onyx earlier gained 1.9 percent to close at $86.82 for a market capitalization of $6.3 billion. The shares have increased 36 percent in the past 12 months.
Onyx and its partner, Bayer AG (BAYN) of Leverkusen, Germany sell Nexavar, a therapy for liver and kidney cancer, and Stivarga, a drug for stomach cancer. Onyx reported revenue of $362 million in 2012, with 80 percent coming from the two drugs. The company markets Kyprolis, a blood cancer drug approved in 2012, on its own.
“Strategically, this deal makes a great deal of sense for Amgen,” said Mark Schoenebaum, an analyst for ISI Group LLC in New York. “Amgen already has a very large cancer franchise. However, none of these drugs are direct anti-tumor agents.”
Both companies declined to comment yesterday on the report.
Antwort auf Beitrag Nr.: 44.950.125 von SLGramann am 29.06.13 09:24:44Könnt ich mir gut vorstellen. Onyx ist ja schon länger ein Übernahmekandidat. Auch wenn 120$ erstmal gut klingen denke ich nicht, dass das für Onyx Aktionäre soo super wäre. Das könnte sogar noch höher gehen, falls Amgen ernsthaft Interesse hat...
Antwort auf Beitrag Nr.: 44.951.989 von kmastra am 29.06.13 16:57:31Ja, sehe ich auch so. Onyx sind mehr Wert. Alles unter 150 Dollar wäre aus meiner Sicht objektiv eine Enttäuschung (auch wenn man sich subjektiv trotzdem über die Prämie freut).
Mal sehen, ob sich das überhaupt bestätigt. Bisher ist es nur ein Gerücht, das merkwürdigerweise von einer kanadischen Zeitung stammt.
Der Traum für Onyx-Aktionäre wäre natürlich ein Bieterkampf zwischen Amgen und Bayer.
(sorry, wenn ich manchmal Onyxx mit zwei x schreibe, liegt am Tickersymbol)
Mal sehen, ob sich das überhaupt bestätigt. Bisher ist es nur ein Gerücht, das merkwürdigerweise von einer kanadischen Zeitung stammt.
Der Traum für Onyx-Aktionäre wäre natürlich ein Bieterkampf zwischen Amgen und Bayer.
(sorry, wenn ich manchmal Onyxx mit zwei x schreibe, liegt am Tickersymbol)
Antwort auf Beitrag Nr.: 44.952.057 von SLGramann am 29.06.13 17:11:31Onyx Pharmaceuticals Confirms Receipt of Unsolicited Acquisition Proposal From Amgen
Board of Directors Rejects $120 per Share Proposal as Significantly Undervaluing Company
SOUTH SAN FRANCISCO, CA--(Marketwired - June 30, 2013) - Onyx Pharmaceuticals, Inc. (NASDAQ: ONXX) today confirmed that it has received and rejected an unsolicited proposal from Amgen Inc. to acquire all of Onyx's outstanding shares and share equivalents for $120 per share in cash, subject to due diligence and other conditions. The Board of Directors of Onyx had evaluated the proposal made by Amgen with the assistance of its financial and legal advisors and concluded that the price proposed by Amgen significantly undervalued Onyx and its prospects, and was not in the best interest of Onyx or its shareholders. Onyx communicated this determination to Amgen on Friday, June 28, 2013.
Based upon expressions of interest received from other third parties and the recent proposal from Amgen, the Onyx Board has authorized its financial advisor to contact potential acquirers who may have an interest in the Company in a transaction that is in the best interest of Onyx shareholders.
"Onyx has tremendous momentum and, with the expansion of our pipeline and two successful product launches, the Company and our talented employees have created significant value for Onyx shareholders," said Dr. N. Anthony Coles, Chairman and CEO. "The Board and the management team remain focused on the opportunities in front of us, including the potential to expand the use of our existing therapies in different types of cancer and across different lines of therapy, as a result of several ongoing Phase 3 studies. We are actively exploring the potential to combine Onyx with another company as an option to create additional value for Onyx shareholders."
Onyx does not intend to communicate further regarding the Amgen proposal or the process by which the Board of Directors will consider other proposals. There can be no assurance that an improved proposal will be made by Amgen or any other entity, that a definitive agreement will be executed relating to any proposed transaction, or that any transaction will be approved or consummated.
Centerview Partners, LLC is acting as financial advisor to Onyx and Goodwin Procter, LLP is acting as legal advisor.
Board of Directors Rejects $120 per Share Proposal as Significantly Undervaluing Company
SOUTH SAN FRANCISCO, CA--(Marketwired - June 30, 2013) - Onyx Pharmaceuticals, Inc. (NASDAQ: ONXX) today confirmed that it has received and rejected an unsolicited proposal from Amgen Inc. to acquire all of Onyx's outstanding shares and share equivalents for $120 per share in cash, subject to due diligence and other conditions. The Board of Directors of Onyx had evaluated the proposal made by Amgen with the assistance of its financial and legal advisors and concluded that the price proposed by Amgen significantly undervalued Onyx and its prospects, and was not in the best interest of Onyx or its shareholders. Onyx communicated this determination to Amgen on Friday, June 28, 2013.
Based upon expressions of interest received from other third parties and the recent proposal from Amgen, the Onyx Board has authorized its financial advisor to contact potential acquirers who may have an interest in the Company in a transaction that is in the best interest of Onyx shareholders.
"Onyx has tremendous momentum and, with the expansion of our pipeline and two successful product launches, the Company and our talented employees have created significant value for Onyx shareholders," said Dr. N. Anthony Coles, Chairman and CEO. "The Board and the management team remain focused on the opportunities in front of us, including the potential to expand the use of our existing therapies in different types of cancer and across different lines of therapy, as a result of several ongoing Phase 3 studies. We are actively exploring the potential to combine Onyx with another company as an option to create additional value for Onyx shareholders."
Onyx does not intend to communicate further regarding the Amgen proposal or the process by which the Board of Directors will consider other proposals. There can be no assurance that an improved proposal will be made by Amgen or any other entity, that a definitive agreement will be executed relating to any proposed transaction, or that any transaction will be approved or consummated.
Centerview Partners, LLC is acting as financial advisor to Onyx and Goodwin Procter, LLP is acting as legal advisor.
Antwort auf Beitrag Nr.: 44.955.853 von Joschka Schröder am 30.06.13 19:30:44Sehr schön! Onyx stellt sich also nun selbst zum Verkauf an den Meistbietenden. Unter den gegebenen Umständen das Beste, was sie tun können (obwohl ich langfristig die Eigenständigkeit eigentlich bevorzugt hätte).
Man darf gespannt sein, ob ein anderer Bieter einsteigt und wer das sein wird.
Vielleicht nähern wir uns am Ende den 150 Dollar doch noch an. Selbst das wäre für den Übernehmer noch immer ein gutes Geschäft.
Bayer sollten mal über ihren Schatten springen. Dann kann man sich in Zukunft zumindest ein paar Hundert Millionen pro Jahr sparen, die Onyx oder wer auch immer von Nexavar und Stivarga abbekommt.
Auch Pfizer sollte man überlegen. Die zahlen demnächst voraussichtlich jedes Jahr zwischen 300 und 500 Mio. Royalties an Onyx für Palbociclib.
Und mit Kyprolis bekommt der Übernehmende wohl einen künftigen Blockbuster an die Hand, mit einem Umsatzpotential zw. 1 und 3 Mrd. Dollar pro Jahr.
Von daher sind 150 Dollar nicht zu viel, sondern bestenfalls fair.
Man darf gespannt sein, ob ein anderer Bieter einsteigt und wer das sein wird.
Vielleicht nähern wir uns am Ende den 150 Dollar doch noch an. Selbst das wäre für den Übernehmer noch immer ein gutes Geschäft.
Bayer sollten mal über ihren Schatten springen. Dann kann man sich in Zukunft zumindest ein paar Hundert Millionen pro Jahr sparen, die Onyx oder wer auch immer von Nexavar und Stivarga abbekommt.
Auch Pfizer sollte man überlegen. Die zahlen demnächst voraussichtlich jedes Jahr zwischen 300 und 500 Mio. Royalties an Onyx für Palbociclib.
Und mit Kyprolis bekommt der Übernehmende wohl einen künftigen Blockbuster an die Hand, mit einem Umsatzpotential zw. 1 und 3 Mrd. Dollar pro Jahr.
Von daher sind 150 Dollar nicht zu viel, sondern bestenfalls fair.
ARRY / EXEL...
Im folgenden Artikel wurde untersucht, warum einige Target-Therapien gegen Krebs zunächst gute Ergebnisse erzielen, aber dann nach einiger Zeit nicht mehr wirken. Die dort vertretende Therorie ist, dass es immer einige, wenn auch nur wenige Krebszellen gibt, die resistent gegen die Therapie sind. Diese überleben und führen zum Rückfall. Desweitern wird behauptet, dass es dagegen deutlich unwahrscheinlicher ist, dass Krebszellen gleichzeitig gegen 2 unterschiedliche Target-Therapien resistent sind. Die Kombination von zweien oder mehreren gleichzeitig sollte dann zu einem sehr viel länger anhaltenden Effekt führen.
Unabhängig davon war eine Ausgangspunkt diese Untersuchung eine Abbildung von einem Patienten mit MM unter der Behandlung mit dem BRAF-Hemmer Zelboraf. Diese habe ich vor längerer Zeit mal bei einer Präsentation von Roche gesehen und ich fand sie auch sehr beeindruckend. Die Wirkung von Zelboraf ist enorm, ebenso ist es schlimm zu sehen, wie diese nach einiger Zeit wieder komplett verschwindet.
http://www.nytimes.com/2013/06/27/science/studying-tumors-di…
Studying Tumors Differently, in Hopes of Outsmarting Them
Bert Vogelstein, a cancer geneticist at Johns Hopkins University, says he is haunted by three pictures.
The first shows a man’s upper body studded with large melanomas. The second shows what happened when the man took a drug called vemurafenib. Vemurafenib belongs to a relatively new class of drugs, called targeted cancer therapy. Unlike earlier chemotherapy drugs, they attack specific molecules found only in cancer cells. In response to the vemurafenib, the tumors shrank in a matter of weeks, to the point that the man’s skin looked smooth and healthy.
The third picture is a case of déjà vu. After 16 weeks of treatment, the melanoma returned. “All the lesions reappeared — every single one,” said Dr. Vogelstein. “That struck me as nearly as amazing as the fact that they had disappeared.”
The man died several weeks later.
...
(vorsicht... sieht eventuell etwas drastisch aus)
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3157968/figure/F…
Ein vielversprechender Ansatz ist die Kombination von Zelboraf mit EXELs MEK-Hemmer GDC-0973 oder die gleiche Kombination von NVSs LGX818 und ARRYs MEK162.
Gruß
ipollit
Im folgenden Artikel wurde untersucht, warum einige Target-Therapien gegen Krebs zunächst gute Ergebnisse erzielen, aber dann nach einiger Zeit nicht mehr wirken. Die dort vertretende Therorie ist, dass es immer einige, wenn auch nur wenige Krebszellen gibt, die resistent gegen die Therapie sind. Diese überleben und führen zum Rückfall. Desweitern wird behauptet, dass es dagegen deutlich unwahrscheinlicher ist, dass Krebszellen gleichzeitig gegen 2 unterschiedliche Target-Therapien resistent sind. Die Kombination von zweien oder mehreren gleichzeitig sollte dann zu einem sehr viel länger anhaltenden Effekt führen.
Unabhängig davon war eine Ausgangspunkt diese Untersuchung eine Abbildung von einem Patienten mit MM unter der Behandlung mit dem BRAF-Hemmer Zelboraf. Diese habe ich vor längerer Zeit mal bei einer Präsentation von Roche gesehen und ich fand sie auch sehr beeindruckend. Die Wirkung von Zelboraf ist enorm, ebenso ist es schlimm zu sehen, wie diese nach einiger Zeit wieder komplett verschwindet.
http://www.nytimes.com/2013/06/27/science/studying-tumors-di…
Studying Tumors Differently, in Hopes of Outsmarting Them
Bert Vogelstein, a cancer geneticist at Johns Hopkins University, says he is haunted by three pictures.
The first shows a man’s upper body studded with large melanomas. The second shows what happened when the man took a drug called vemurafenib. Vemurafenib belongs to a relatively new class of drugs, called targeted cancer therapy. Unlike earlier chemotherapy drugs, they attack specific molecules found only in cancer cells. In response to the vemurafenib, the tumors shrank in a matter of weeks, to the point that the man’s skin looked smooth and healthy.
The third picture is a case of déjà vu. After 16 weeks of treatment, the melanoma returned. “All the lesions reappeared — every single one,” said Dr. Vogelstein. “That struck me as nearly as amazing as the fact that they had disappeared.”
The man died several weeks later.
...
(vorsicht... sieht eventuell etwas drastisch aus)
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3157968/figure/F…
Ein vielversprechender Ansatz ist die Kombination von Zelboraf mit EXELs MEK-Hemmer GDC-0973 oder die gleiche Kombination von NVSs LGX818 und ARRYs MEK162.
Gruß
ipollit
Bayer and Onyx Pharmaceuticals Announce Submission of FDA and EMA Applications for Nexavar(R) (sorafenib) for the Treatment of Radioactive Iodine-Refractory Differentiated Thyroid Cancer
WAYNE, NJ and SOUTH SAN FRANCISCO, CA--(Marketwired - July 01, 2013) - Bayer HealthCare and Onyx Pharmaceuticals (NASDAQ: ONXX) today announced the submission of a supplemental New Drug Application (sNDA) to the U.S. Food and Drug Administration (FDA) and an application for marketing authorization to the European Medicines Agency (EMA) for the oral multi-kinase inhibitor Nexavar® (sorafenib) tablets for the treatment of locally advanced or metastatic radioactive iodine (RAI)-refractory differentiated thyroid cancer.
"The filings in the U.S. and Europe for sorafenib for the potential treatment of this type of thyroid cancer bring us closer to addressing an unmet medical need for these patients who have limited or no treatment options," said Kemal Malik, M.D., Member of the Bayer HealthCare Executive Committee and Head of Global Development. "We are committed to exploring sorafenib's potential applicability in hard-to-treat cancers."
"Based on results from clinical studies we believe sorafenib could potentially provide a new option for the treatment of differentiated thyroid cancer that no longer responds to radioactive iodine therapy," said Pablo J. Cagnoni, M.D., Executive Vice President, Global Research & Development and Technical Operations, Onyx Pharmaceuticals.
The regulatory submission is based on data from the Phase 3 DECISION (stuDy of sorafEnib in loCally advanced or metastatic patientS with radioactive Iodine refractory thyrOid caNcer) trial, an international, multicenter, placebo-controlled study. In the trial, sorafenib significantly extended progression-free survival (PFS), the primary endpoint of the study, compared to placebo. Results from the study were presented at the Annual Meeting of the American Society of Clinical Oncology (ASCO) in June 2013.
DECISION Trial Design
The DECISION (stuDy of sorafEnib in loCally advanced or metastatIc patientS with radioactive Iodine refractory thyrOid caNcer) trial was an international, multicenter, placebo-controlled study. A total of 417 patients with locally advanced or metastatic, RAI-refractory, differentiated thyroid cancer (papillary, follicular, Hürthle cell and poorly differentiated) who had received no prior chemotherapy, tyrosine kinase inhibitors, monoclonal antibodies that target VEGF or VEGF receptor, or other targeted agents for thyroid cancer were randomized to receive 400 mg of oral sorafenib twice daily (207 patients) or matching placebo (210 patients). Ninety-six percent of randomized patients had metastatic disease.
The primary endpoint of the study was progression-free survival, as defined by Response Evaluation Criteria in Solid Tumors (RECIST). Secondary endpoints included overall survival, time to progression, response rate and duration of response. Safety and tolerability were also evaluated.
About Thyroid Cancer
Thyroid cancer has become the fastest-increasing cancer in the world in recent years and is the sixth most common cancer in women.(1,2) There are more than 213,000 new cases of thyroid cancer annually and approximately 35,000 people die from thyroid cancer worldwide each year.(3)
Papillary, follicular, Hürthle cell and poorly differentiated types of thyroid cancer are classified as "differentiated thyroid cancer" and account for approximately 94 percent of all thyroid cancers.(4) While the majority of differentiated thyroid cancers are curable, RAI-refractory locally advanced or metastatic disease, is more difficult to treat and is associated with a lower patient survival rate.(4,5)
About Nexavar® (sorafenib) Tablets
Nexavar is approved in the U.S. for the treatment of patients with unresectable hepatocellular carcinoma and for the treatment of patients with advanced renal cell carcinoma. Nexavar is thought to inhibit both the tumor cell and tumor vasculature. In in vitro studies, Nexavar has been shown to inhibit multiple kinases thought to be involved in both cell proliferation (growth) and angiogenesis (blood supply) -- two important processes that enable cancer growth. These kinases include Raf kinase, VEGFR-1, VEGFR-2, VEGFR-3, PDGFR-B, KIT, FLT-3 and RET.
Nexavar is currently approved in more than 100 countries. Nexavar is also being evaluated by Bayer and Onyx, international study groups, government agencies and individual investigators in a range of cancers.
Important Safety Considerations For Nexavar® (sorafenib) Tablets
Nexavar in combination with carboplatin and paclitaxel is contraindicated in patients with squamous cell lung cancer.
Cardiac ischemia and/or myocardial infarction may occur. Temporary or permanent discontinuation of Nexavar should be considered in patients who develop cardiac ischemia and/or myocardial infarction.
An increased risk of bleeding may occur following Nexavar administration. If bleeding necessitates medical intervention, consider permanent discontinuation of Nexavar.
Hypertension may occur early in the course of treatment. Monitor blood pressure weekly during the first 6 weeks and periodically thereafter and treat, if required.
Hand-foot skin reaction and rash are common and management may include topical therapies for symptomatic relief. In cases of any severe or persistent adverse reactions, temporary treatment interruption, dose modification, or permanent discontinuation of Nexavar should be considered. Nexavar should be discontinued if Stevens-Johnson Syndrome or toxic epidermal necrolysis are suspected as these may be life threatening.
Gastrointestinal perforation was an uncommon adverse reaction and has been reported in less than 1% of patients taking Nexavar. Discontinue Nexavar in the event of a gastrointestinal perforation.
Patients taking concomitant warfarin should be monitored regularly for changes in prothrombin time (PT), International Normalized Ratio (INR) or clinical bleeding episodes.
Temporary interruption of Nexavar therapy is recommended in patients undergoing major surgical procedures.
Nexavar in combination with gemcitabine/cisplatin is not recommended in patients with squamous cell lung cancer. The safety and effectiveness of Nexavar has not been established in patients with non-small cell lung cancer.
Nexavar can prolong the QT/QTc interval and increase the risk for ventricular arrhythmias. Avoid use in patients with congenital long QT syndrome and monitor patients with congestive heart failure, bradyarrhythmias, drugs known to prolong the QT interval, and electrolyte abnormalities.
Drug-induced hepatitis with Nexavar may result in hepatic failure and death. Liver function tests should be monitored regularly and in cases of increased transaminases without alternative explanation Nexavar should be discontinued.
Nexavar may cause fetal harm when administered to a pregnant woman. Women of childbearing potential should be advised to avoid becoming pregnant while on Nexavar and female patients should also be advised against breastfeeding while receiving Nexavar.
Elevations in serum lipase and reductions in serum phosphate of unknown etiology have been associated with Nexavar.
Avoid concomitant use of strong CYP3A4 inducers, when possible, because inducers can decrease the systemic exposure of Nexavar. Nexavar exposure decreases when coadministered with oral neomycin. Effects of other antibiotics on Nexavar pharmacokinetics have not been studied.
Most common adverse reactions reported for Nexavar-treated patients vs. placebo-treated patients in unresectable HCC, respectively, were: diarrhea (55% vs. 25%), fatigue (46% vs. 45%), abdominal pain (31% vs. 26%), weight loss (30% vs. 10%), anorexia (29% vs. 18%), nausea (24% vs. 20%), and hand-foot skin reaction (21% vs. 3%). Grade 3/4 adverse reactions were 45% vs. 32%.
Most common adverse reactions reported for Nexavar-treated patients vs. placebo-treated patients in advanced RCC, respectively, were: diarrhea (43% vs. 13%), rash/desquamation (40% vs. 16%), fatigue (37% vs. 28%), hand-foot skin reaction (30% vs. 7%), alopecia (27% vs. 3%), and nausea (23% vs. 19%). Grade 3/4 adverse reactions were 38% vs. 28%.
WAYNE, NJ and SOUTH SAN FRANCISCO, CA--(Marketwired - July 01, 2013) - Bayer HealthCare and Onyx Pharmaceuticals (NASDAQ: ONXX) today announced the submission of a supplemental New Drug Application (sNDA) to the U.S. Food and Drug Administration (FDA) and an application for marketing authorization to the European Medicines Agency (EMA) for the oral multi-kinase inhibitor Nexavar® (sorafenib) tablets for the treatment of locally advanced or metastatic radioactive iodine (RAI)-refractory differentiated thyroid cancer.
"The filings in the U.S. and Europe for sorafenib for the potential treatment of this type of thyroid cancer bring us closer to addressing an unmet medical need for these patients who have limited or no treatment options," said Kemal Malik, M.D., Member of the Bayer HealthCare Executive Committee and Head of Global Development. "We are committed to exploring sorafenib's potential applicability in hard-to-treat cancers."
"Based on results from clinical studies we believe sorafenib could potentially provide a new option for the treatment of differentiated thyroid cancer that no longer responds to radioactive iodine therapy," said Pablo J. Cagnoni, M.D., Executive Vice President, Global Research & Development and Technical Operations, Onyx Pharmaceuticals.
The regulatory submission is based on data from the Phase 3 DECISION (stuDy of sorafEnib in loCally advanced or metastatic patientS with radioactive Iodine refractory thyrOid caNcer) trial, an international, multicenter, placebo-controlled study. In the trial, sorafenib significantly extended progression-free survival (PFS), the primary endpoint of the study, compared to placebo. Results from the study were presented at the Annual Meeting of the American Society of Clinical Oncology (ASCO) in June 2013.
DECISION Trial Design
The DECISION (stuDy of sorafEnib in loCally advanced or metastatIc patientS with radioactive Iodine refractory thyrOid caNcer) trial was an international, multicenter, placebo-controlled study. A total of 417 patients with locally advanced or metastatic, RAI-refractory, differentiated thyroid cancer (papillary, follicular, Hürthle cell and poorly differentiated) who had received no prior chemotherapy, tyrosine kinase inhibitors, monoclonal antibodies that target VEGF or VEGF receptor, or other targeted agents for thyroid cancer were randomized to receive 400 mg of oral sorafenib twice daily (207 patients) or matching placebo (210 patients). Ninety-six percent of randomized patients had metastatic disease.
The primary endpoint of the study was progression-free survival, as defined by Response Evaluation Criteria in Solid Tumors (RECIST). Secondary endpoints included overall survival, time to progression, response rate and duration of response. Safety and tolerability were also evaluated.
About Thyroid Cancer
Thyroid cancer has become the fastest-increasing cancer in the world in recent years and is the sixth most common cancer in women.(1,2) There are more than 213,000 new cases of thyroid cancer annually and approximately 35,000 people die from thyroid cancer worldwide each year.(3)
Papillary, follicular, Hürthle cell and poorly differentiated types of thyroid cancer are classified as "differentiated thyroid cancer" and account for approximately 94 percent of all thyroid cancers.(4) While the majority of differentiated thyroid cancers are curable, RAI-refractory locally advanced or metastatic disease, is more difficult to treat and is associated with a lower patient survival rate.(4,5)
About Nexavar® (sorafenib) Tablets
Nexavar is approved in the U.S. for the treatment of patients with unresectable hepatocellular carcinoma and for the treatment of patients with advanced renal cell carcinoma. Nexavar is thought to inhibit both the tumor cell and tumor vasculature. In in vitro studies, Nexavar has been shown to inhibit multiple kinases thought to be involved in both cell proliferation (growth) and angiogenesis (blood supply) -- two important processes that enable cancer growth. These kinases include Raf kinase, VEGFR-1, VEGFR-2, VEGFR-3, PDGFR-B, KIT, FLT-3 and RET.
Nexavar is currently approved in more than 100 countries. Nexavar is also being evaluated by Bayer and Onyx, international study groups, government agencies and individual investigators in a range of cancers.
Important Safety Considerations For Nexavar® (sorafenib) Tablets
Nexavar in combination with carboplatin and paclitaxel is contraindicated in patients with squamous cell lung cancer.
Cardiac ischemia and/or myocardial infarction may occur. Temporary or permanent discontinuation of Nexavar should be considered in patients who develop cardiac ischemia and/or myocardial infarction.
An increased risk of bleeding may occur following Nexavar administration. If bleeding necessitates medical intervention, consider permanent discontinuation of Nexavar.
Hypertension may occur early in the course of treatment. Monitor blood pressure weekly during the first 6 weeks and periodically thereafter and treat, if required.
Hand-foot skin reaction and rash are common and management may include topical therapies for symptomatic relief. In cases of any severe or persistent adverse reactions, temporary treatment interruption, dose modification, or permanent discontinuation of Nexavar should be considered. Nexavar should be discontinued if Stevens-Johnson Syndrome or toxic epidermal necrolysis are suspected as these may be life threatening.
Gastrointestinal perforation was an uncommon adverse reaction and has been reported in less than 1% of patients taking Nexavar. Discontinue Nexavar in the event of a gastrointestinal perforation.
Patients taking concomitant warfarin should be monitored regularly for changes in prothrombin time (PT), International Normalized Ratio (INR) or clinical bleeding episodes.
Temporary interruption of Nexavar therapy is recommended in patients undergoing major surgical procedures.
Nexavar in combination with gemcitabine/cisplatin is not recommended in patients with squamous cell lung cancer. The safety and effectiveness of Nexavar has not been established in patients with non-small cell lung cancer.
Nexavar can prolong the QT/QTc interval and increase the risk for ventricular arrhythmias. Avoid use in patients with congenital long QT syndrome and monitor patients with congestive heart failure, bradyarrhythmias, drugs known to prolong the QT interval, and electrolyte abnormalities.
Drug-induced hepatitis with Nexavar may result in hepatic failure and death. Liver function tests should be monitored regularly and in cases of increased transaminases without alternative explanation Nexavar should be discontinued.
Nexavar may cause fetal harm when administered to a pregnant woman. Women of childbearing potential should be advised to avoid becoming pregnant while on Nexavar and female patients should also be advised against breastfeeding while receiving Nexavar.
Elevations in serum lipase and reductions in serum phosphate of unknown etiology have been associated with Nexavar.
Avoid concomitant use of strong CYP3A4 inducers, when possible, because inducers can decrease the systemic exposure of Nexavar. Nexavar exposure decreases when coadministered with oral neomycin. Effects of other antibiotics on Nexavar pharmacokinetics have not been studied.
Most common adverse reactions reported for Nexavar-treated patients vs. placebo-treated patients in unresectable HCC, respectively, were: diarrhea (55% vs. 25%), fatigue (46% vs. 45%), abdominal pain (31% vs. 26%), weight loss (30% vs. 10%), anorexia (29% vs. 18%), nausea (24% vs. 20%), and hand-foot skin reaction (21% vs. 3%). Grade 3/4 adverse reactions were 45% vs. 32%.
Most common adverse reactions reported for Nexavar-treated patients vs. placebo-treated patients in advanced RCC, respectively, were: diarrhea (43% vs. 13%), rash/desquamation (40% vs. 16%), fatigue (37% vs. 28%), hand-foot skin reaction (30% vs. 7%), alopecia (27% vs. 3%), and nausea (23% vs. 19%). Grade 3/4 adverse reactions were 38% vs. 28%.
Antwort auf Beitrag Nr.: 44.957.581 von Joschka Schröder am 01.07.13 09:24:20PS: Das Nebenwirkungsprofil ist ja gruselig.
Antwort auf Beitrag Nr.: 44.956.779 von ipollit am 01.07.13 00:01:19Ein vielversprechender Ansatz ist die Kombination von Zelboraf mit EXELs MEK-Hemmer GDC-0973
Ja! Ich finde, dass dieser Trial das ganze EXEL-Investment stark "de-risked", weil das ein zweites und sehr vielversprechendes Standbein ist. Ich kann nur hoffen, dass EXEL hier seine Co-Development-Option zieht. Ich glaube, dass der CEO mal gesagt hat, sie hätten dafür bis Januar Zeit (und nicht nur bis in den Herbst, wie ich früher dachte).
Ja! Ich finde, dass dieser Trial das ganze EXEL-Investment stark "de-risked", weil das ein zweites und sehr vielversprechendes Standbein ist. Ich kann nur hoffen, dass EXEL hier seine Co-Development-Option zieht. Ich glaube, dass der CEO mal gesagt hat, sie hätten dafür bis Januar Zeit (und nicht nur bis in den Herbst, wie ich früher dachte).
Antwort auf Beitrag Nr.: 44.956.331 von SLGramann am 30.06.13 21:33:51Das Onyx im Sinne der Aktionäre handelt, sieht man heute alleine am Kurs, der die 120$ klar überschreitet. Schön auch, wie eine solche Geschichte auf den gesamten Sektor ausstrahlt. Sind ja fast alle Werte deutlich im grünen Bereich.
ARRY:
ist jetzt offiziell eine PIII-Company:
(Und dafür zu billig. Aufgrund der hohen Royaltie-Ansprüche für MEK162 und der relativ guten Erfolgsaussichten kann man sich fragen, ob nicht schon MEK162 die derzeitige Marktkap. rechtfertigt. Was macht der Markt denn, wenn Array zur ASH bzw. im Januar/Februar 2014 gute Daten aus seiner Eigenpipe bringen sollte? Durchdrehen?)
Array BioPharma Initiates MEK162 Phase 3 MILO Study Triggering Milestone Payment
BOULDER, Colo., July 2, 2013 /PRNewswire/ -- Array BioPharma Inc. (NASDAQ: ARRY) announced today that a $5 million milestone was achieved after the start of Array's Phase 3 clinical trial in patients with low-grade serous ovarian cancer (LGSOC).
The study, called MILO (MEK Inhibitor in Low Grade Serous Ovarian Cancer), is a multinational, randomized Phase 3 trial and will evaluate MEK162 against physician's choice of standard chemotherapy treatments in 300 patients with recurrent or persistent LGSOC following at least one prior platinum-based chemotherapy regimen and no more than three lines of prior chemotherapy regimens. The primary endpoint is progression-free survival, and the key secondary endpoint is overall survival.
"Array is pleased to initiate its first Phase 3 trial with the goal of helping women with low-grade serous ovarian cancer who have progressed on cytotoxics and have no other proven therapeutic options," said Ron Squarer, Chief Executive Officer, Array BioPharma. "We also look forward to Novartis initiating both the NRAS- and BRAF-mutant melanoma pivotal studies later this year."
Array invented MEK162 and licensed worldwide rights to develop and commercialize the drug to Novartis in April 2010. Novartis recently detailed plans to initiate Phase 3 trials of MEK162 in both NRAS- and BRAF-mutant melanoma. All three trials will be conducted as part of the Novartis/Array co-development agreement under which costs are capped annually and in total for Array.
ist jetzt offiziell eine PIII-Company:
(Und dafür zu billig. Aufgrund der hohen Royaltie-Ansprüche für MEK162 und der relativ guten Erfolgsaussichten kann man sich fragen, ob nicht schon MEK162 die derzeitige Marktkap. rechtfertigt. Was macht der Markt denn, wenn Array zur ASH bzw. im Januar/Februar 2014 gute Daten aus seiner Eigenpipe bringen sollte? Durchdrehen?)
Array BioPharma Initiates MEK162 Phase 3 MILO Study Triggering Milestone Payment
BOULDER, Colo., July 2, 2013 /PRNewswire/ -- Array BioPharma Inc. (NASDAQ: ARRY) announced today that a $5 million milestone was achieved after the start of Array's Phase 3 clinical trial in patients with low-grade serous ovarian cancer (LGSOC).
The study, called MILO (MEK Inhibitor in Low Grade Serous Ovarian Cancer), is a multinational, randomized Phase 3 trial and will evaluate MEK162 against physician's choice of standard chemotherapy treatments in 300 patients with recurrent or persistent LGSOC following at least one prior platinum-based chemotherapy regimen and no more than three lines of prior chemotherapy regimens. The primary endpoint is progression-free survival, and the key secondary endpoint is overall survival.
"Array is pleased to initiate its first Phase 3 trial with the goal of helping women with low-grade serous ovarian cancer who have progressed on cytotoxics and have no other proven therapeutic options," said Ron Squarer, Chief Executive Officer, Array BioPharma. "We also look forward to Novartis initiating both the NRAS- and BRAF-mutant melanoma pivotal studies later this year."
Array invented MEK162 and licensed worldwide rights to develop and commercialize the drug to Novartis in April 2010. Novartis recently detailed plans to initiate Phase 3 trials of MEK162 in both NRAS- and BRAF-mutant melanoma. All three trials will be conducted as part of the Novartis/Array co-development agreement under which costs are capped annually and in total for Array.
ONXX...
soweit ich es lese, scheinen ja zahlreiche intressiert zu sein... AMGN, Novartis, Pfizer, Bayer. Besser geht es kaum! ONXX spielt wohl auch noch mit dem Gedanken eines Mergers mit einem anderen Biotech. Schon witzig, dass vor vielleicht einem Jahr noch 80 USD als ein guter Preis für eine Übernahme gesehen wurde und nun sind 120 USD zu wenig. Analysten rechnen teilweise schon mögliche Preise von über 200 USD aus, wenn man die gesamte Pipeline und die Synergien durch Wegfall der Vertriebsstruktur mit einrechnet.
Geschätzes EPS 11 USD für 2017... das ist schon einiges... bei einem KGV von 30 wären es über 300 USD. Mit vielleicht 2 Mrd USD Umsatz dürften das auch noch keine Peak Sales sein und ONXX könnte selber auch noch zukaufen.
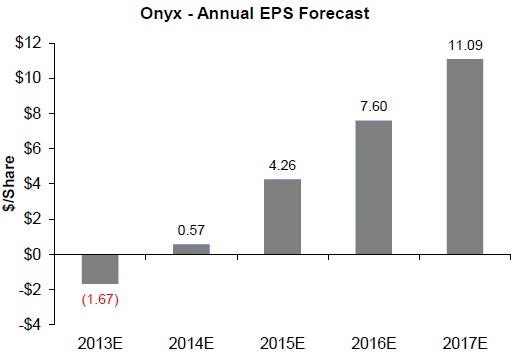
Wenn es viele Interessenten gibt und nur einer zum Zuge kommen kann, dann müssen die anderen irgendwann woanders zugreifen. Sollte also auch für andere Biotechs gut sein. Jedenfalls bleibt es spannend.
****
CLDX hat zurzeit auch einen guten Lauf... :-)

Gruß
ipollit
soweit ich es lese, scheinen ja zahlreiche intressiert zu sein... AMGN, Novartis, Pfizer, Bayer. Besser geht es kaum! ONXX spielt wohl auch noch mit dem Gedanken eines Mergers mit einem anderen Biotech. Schon witzig, dass vor vielleicht einem Jahr noch 80 USD als ein guter Preis für eine Übernahme gesehen wurde und nun sind 120 USD zu wenig. Analysten rechnen teilweise schon mögliche Preise von über 200 USD aus, wenn man die gesamte Pipeline und die Synergien durch Wegfall der Vertriebsstruktur mit einrechnet.
Geschätzes EPS 11 USD für 2017... das ist schon einiges... bei einem KGV von 30 wären es über 300 USD. Mit vielleicht 2 Mrd USD Umsatz dürften das auch noch keine Peak Sales sein und ONXX könnte selber auch noch zukaufen.

Wenn es viele Interessenten gibt und nur einer zum Zuge kommen kann, dann müssen die anderen irgendwann woanders zugreifen. Sollte also auch für andere Biotechs gut sein. Jedenfalls bleibt es spannend.
****
CLDX hat zurzeit auch einen guten Lauf... :-)
Gruß
ipollit
CLDX...
CDX-1135 pilot trial in DDD:
1. DDD is an ultra-rare disease affecting ~700 pts/yr in the US. Enrollment will be 5 pediatric and adult pts for the pilot trial.
2. Pts will be treated with an induction dose starting at 5 mg/kg and increasing to a maximum of 30 mg/kg, followed by a maintenance dose that can be dialed down to 2 mg/kg. Pts will receive infusions twice weekly for up to 26 weeks. Dosing is well designed IMO, with a 6-fold increase potential in the induction phase, and a 15-fold potential decrease in the maintenance phase. So they gave themselves a wide range to work with and to optimize the dose for each individual patient.
3. The primary endpoints are safety and complement normalization. Based on previous clinical experience with CDX-1135 and the way the trial is designed, there is a high probability that both endpoints will be met successfully.
4. Secondary endpoints are duration of complement normalization, immunogenicity, renal function, and improvement on renal biopsy. The first two endpoints are relatively straightforward, the other two will likely become the primary endpoints in the subsequent pivotal trial.
5. Since there is a severe unmet need for DDD pts, CDX-1135 will go into an accelerated approval trial after it completes this initial pilot trial. The pivotal trial will be larger, probably ~100 pts at several international sites in addition to US.
6. From a strategic perspective, the development model for CDX-1135 is similar to Soliris, a complement inhibitor initially approved for PNH, but extended to other indications more recently. CDX-1135, like Rindo, is a drug that CLDX could keep in-house and distribute on its own with a focused marketing approach.
CDX-1135 pilot trial in DDD:
1. DDD is an ultra-rare disease affecting ~700 pts/yr in the US. Enrollment will be 5 pediatric and adult pts for the pilot trial.
2. Pts will be treated with an induction dose starting at 5 mg/kg and increasing to a maximum of 30 mg/kg, followed by a maintenance dose that can be dialed down to 2 mg/kg. Pts will receive infusions twice weekly for up to 26 weeks. Dosing is well designed IMO, with a 6-fold increase potential in the induction phase, and a 15-fold potential decrease in the maintenance phase. So they gave themselves a wide range to work with and to optimize the dose for each individual patient.
3. The primary endpoints are safety and complement normalization. Based on previous clinical experience with CDX-1135 and the way the trial is designed, there is a high probability that both endpoints will be met successfully.
4. Secondary endpoints are duration of complement normalization, immunogenicity, renal function, and improvement on renal biopsy. The first two endpoints are relatively straightforward, the other two will likely become the primary endpoints in the subsequent pivotal trial.
5. Since there is a severe unmet need for DDD pts, CDX-1135 will go into an accelerated approval trial after it completes this initial pilot trial. The pivotal trial will be larger, probably ~100 pts at several international sites in addition to US.
6. From a strategic perspective, the development model for CDX-1135 is similar to Soliris, a complement inhibitor initially approved for PNH, but extended to other indications more recently. CDX-1135, like Rindo, is a drug that CLDX could keep in-house and distribute on its own with a focused marketing approach.
Antwort auf Beitrag Nr.: 44.970.547 von ipollit am 02.07.13 23:33:14Hallo ipollit,
CDX-1135 hatte ich bisher gar nicht auf dem Schirm. Aber möglicherweise besteht hier, trotz der extrem niedrigen Zahl der Betroffenen, ein beachtliches Umsatzpotential.
Ich habe mal geschaut, was für Sareptas DMD-Kandidaten erwartet wird und habe da etwas von 400.000 Dollar / Jahr und Patient gelesen. Das klingt zwar irre, aber Vertex Kalydeco kostet ja auch schon fast 300.000 Dollar.
Bei diesen seltenen Krankheiten scheinen extrem hohe Preise durchsetzbar zu sein, was auch Sinn macht, da nur geforscht wird, wenn es ein relevantes kommerzielles Potential gibt.
DDD ist nun offensichtlich viel seltener als DMD oder CF. Sollte man dann nicht einen noch höheren Preis erwarten?
Könnte man nicht an bspw. 500.000 Dollar oder mehr denken?
Selbst wenn man dann nur 500 Patienten weltweit behandeln würde, wäre das relevant.
ipollit, hast Du dazu schon mal etwas gelesen?
CDX-1135 hatte ich bisher gar nicht auf dem Schirm. Aber möglicherweise besteht hier, trotz der extrem niedrigen Zahl der Betroffenen, ein beachtliches Umsatzpotential.
Ich habe mal geschaut, was für Sareptas DMD-Kandidaten erwartet wird und habe da etwas von 400.000 Dollar / Jahr und Patient gelesen. Das klingt zwar irre, aber Vertex Kalydeco kostet ja auch schon fast 300.000 Dollar.
Bei diesen seltenen Krankheiten scheinen extrem hohe Preise durchsetzbar zu sein, was auch Sinn macht, da nur geforscht wird, wenn es ein relevantes kommerzielles Potential gibt.
DDD ist nun offensichtlich viel seltener als DMD oder CF. Sollte man dann nicht einen noch höheren Preis erwarten?
Könnte man nicht an bspw. 500.000 Dollar oder mehr denken?
Selbst wenn man dann nur 500 Patienten weltweit behandeln würde, wäre das relevant.
ipollit, hast Du dazu schon mal etwas gelesen?
Antwort auf Beitrag Nr.: 44.970.905 von SLGramann am 03.07.13 07:18:33Hallo SLGramann
CDX-1135 bindet C3 und C5, während ALXNs Soliris ein AK ist, der im wesentlichen C5 bindet, wenn ich es richtig verstehe. Sowohl C3 als auch C5 spielen bei diversen Erkrankungen eine entscheidende Rolle, insbesondere auch in sehr seltenen, aber extrem schwereren Erkrankungen, die bisher nicht behandelt werden können.
von ALXNs HP: http://www.alxn.com/RandD/Complement%20Platform/Default.aspx
"The complement system is a robust and complex branch of the body’s natural immune system. When the complement system detects foreign particles in the body, it triggers a cascade of complement protein activation, resulting in destruction or removal of the invading particles. Normally, our body’s cells and tissues are protected from complement activation by naturally occurring complement regulatory proteins anchored to the surface of cells. While complement activation is essential to maintaining health, the complement system can become uncontrolled when excessive complement activation occurs or when these naturally occurring complement regulatory proteins are missing on the surface of cells. Uncontrolled complement activation can play a role in numerous chronic and life-threatening diseases.
...Soliris® (eculizumab) works by inhibiting the complement protein C5, which acts at a relatively late stage in the complement cascade. ... By blocking the complement cascade at C5 and thereby preventing C5 activation, the normal disease-preventing functions of complement remain largely intact, while C5 activation that leads to inflammation and cell destruction is impeded.
...Another potential therapeutic target within the complement system is activated fragments of complement protein C3. When the complement system is activated, a fragment of C3 known as C3d is generated and attaches itself to injured cells and tissues. By specifically targeting these areas of inflammation through specific C3d binding, it is thought that disease-causing complement activation can be blocked and inflammation can be controlled directly at the site at which it is occurring.
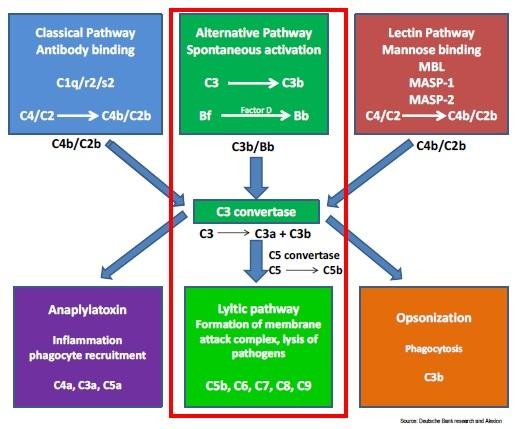
Anders als Soliris bindet CDX-1135 neben C5 auch noch C3. DDD wird wohl maßgeblich über C3 beeinflusst, indem mit der Zeit die Nieren angegriffen und versagen. Daher ist DDD ein guter Ansatz für CDX-1135. C3 spielt wohl insbesondere bei Nierenerkrankungen eine Rolle.
Soliris ist zugelassen für die beiden sehr seltenen Krankheiten PNH und aHUS. Dies ist ALXNs einziges Mittel, für dieses Jahr soll der Umsatz bei 1,5 Mrd USD liegen. Die MK liegt momentan bei 18,8 Mrd USD, lag aber auch schon über 20 Mrd USD. Die Zulassung von Soliris war 2007.

Laut CLDXs HP tritt DDD bei etwa 2-3 von 1 Mio Menschen auf. In der folgenden Präsentation wird aHUS mit 1-2 pro 1 Mio angegeben: http://cornerstoneglobalgroup.com/images/DB_Alexion_10_27_20… Sowohl für aHUS als auch für PNH wurden peak sales von jeweils 2 Mrd USD geschätzt: "PNH and aHUS are forecast to achieve global sales peaks of about $2 billion each, and with compelling evidence of Soliris efficacy in other indications, it could reach up to $8 billion in peak sales, according to Barclays Research." http://www.mmm-online.com/all-star-small-pharma-marketing-te…
Ob CDX-1135 in DDD auch ein ähnliches Potential bietet, weiß ich nicht, möglich wäre es aber. Positiv ist, dass ein führender DDD-Experte die Studien durchführt ("Dr. Richard Smith at Iowa University, a leading expert in DDD").
DDD ist aber nicht die einzige Indikation für CDX-1135... C3 und C5 scheint noch in weiteren seltenen und auch weniger seltenen Indikationen eine Rolle zu spielen.
Hier noch ein Kommentar von Ohad Hammer:
"Hi Ohad,
Celldex has been on a wicked run. At what point would you begin to trim some from your portfolio? Or are you seeing through to Rindo, -011 data. Any comment on their complement inhibitor? Seems this compound is 25yrs old. Have they just now found the right indication, DDD? A
***
I actually think this is a very interesting wild card. Beyond DDD there are a lot of other applications as demonstrated by ALXN’s Soliris and Novartis C5 antibody for ophthalmology.
Ohad
***
No concern over the fact it’s 25yrs old?
I read where someone said a new biologic would get 12 years exclusivity so it may not matter if patent life has already run out. All that said, I took my CLDX chips off the table as I figure easy money has been made. I could be wrong, of course.
***
They can also get market exclusivity based on orphan designations.
Ohad
Gruß
ipollit
CDX-1135 bindet C3 und C5, während ALXNs Soliris ein AK ist, der im wesentlichen C5 bindet, wenn ich es richtig verstehe. Sowohl C3 als auch C5 spielen bei diversen Erkrankungen eine entscheidende Rolle, insbesondere auch in sehr seltenen, aber extrem schwereren Erkrankungen, die bisher nicht behandelt werden können.
von ALXNs HP: http://www.alxn.com/RandD/Complement%20Platform/Default.aspx
"The complement system is a robust and complex branch of the body’s natural immune system. When the complement system detects foreign particles in the body, it triggers a cascade of complement protein activation, resulting in destruction or removal of the invading particles. Normally, our body’s cells and tissues are protected from complement activation by naturally occurring complement regulatory proteins anchored to the surface of cells. While complement activation is essential to maintaining health, the complement system can become uncontrolled when excessive complement activation occurs or when these naturally occurring complement regulatory proteins are missing on the surface of cells. Uncontrolled complement activation can play a role in numerous chronic and life-threatening diseases.
...Soliris® (eculizumab) works by inhibiting the complement protein C5, which acts at a relatively late stage in the complement cascade. ... By blocking the complement cascade at C5 and thereby preventing C5 activation, the normal disease-preventing functions of complement remain largely intact, while C5 activation that leads to inflammation and cell destruction is impeded.
...Another potential therapeutic target within the complement system is activated fragments of complement protein C3. When the complement system is activated, a fragment of C3 known as C3d is generated and attaches itself to injured cells and tissues. By specifically targeting these areas of inflammation through specific C3d binding, it is thought that disease-causing complement activation can be blocked and inflammation can be controlled directly at the site at which it is occurring.

Anders als Soliris bindet CDX-1135 neben C5 auch noch C3. DDD wird wohl maßgeblich über C3 beeinflusst, indem mit der Zeit die Nieren angegriffen und versagen. Daher ist DDD ein guter Ansatz für CDX-1135. C3 spielt wohl insbesondere bei Nierenerkrankungen eine Rolle.
Soliris ist zugelassen für die beiden sehr seltenen Krankheiten PNH und aHUS. Dies ist ALXNs einziges Mittel, für dieses Jahr soll der Umsatz bei 1,5 Mrd USD liegen. Die MK liegt momentan bei 18,8 Mrd USD, lag aber auch schon über 20 Mrd USD. Die Zulassung von Soliris war 2007.
Laut CLDXs HP tritt DDD bei etwa 2-3 von 1 Mio Menschen auf. In der folgenden Präsentation wird aHUS mit 1-2 pro 1 Mio angegeben: http://cornerstoneglobalgroup.com/images/DB_Alexion_10_27_20… Sowohl für aHUS als auch für PNH wurden peak sales von jeweils 2 Mrd USD geschätzt: "PNH and aHUS are forecast to achieve global sales peaks of about $2 billion each, and with compelling evidence of Soliris efficacy in other indications, it could reach up to $8 billion in peak sales, according to Barclays Research." http://www.mmm-online.com/all-star-small-pharma-marketing-te…
Ob CDX-1135 in DDD auch ein ähnliches Potential bietet, weiß ich nicht, möglich wäre es aber. Positiv ist, dass ein führender DDD-Experte die Studien durchführt ("Dr. Richard Smith at Iowa University, a leading expert in DDD").
DDD ist aber nicht die einzige Indikation für CDX-1135... C3 und C5 scheint noch in weiteren seltenen und auch weniger seltenen Indikationen eine Rolle zu spielen.
Hier noch ein Kommentar von Ohad Hammer:
"Hi Ohad,
Celldex has been on a wicked run. At what point would you begin to trim some from your portfolio? Or are you seeing through to Rindo, -011 data. Any comment on their complement inhibitor? Seems this compound is 25yrs old. Have they just now found the right indication, DDD? A
***
I actually think this is a very interesting wild card. Beyond DDD there are a lot of other applications as demonstrated by ALXN’s Soliris and Novartis C5 antibody for ophthalmology.
Ohad
***
No concern over the fact it’s 25yrs old?
I read where someone said a new biologic would get 12 years exclusivity so it may not matter if patent life has already run out. All that said, I took my CLDX chips off the table as I figure easy money has been made. I could be wrong, of course.
***
They can also get market exclusivity based on orphan designations.
Ohad
Gruß
ipollit
CDLX
...wobei CDX-1135 nur ein interessanter Kandidat ist.

- Rindopepimut könnte ein Blockbuster in GBM sein; zuletzt hat Avastin hier kein Überlebensvorteil zeigen können, so dass Rindopepimut zur ersten Wahl werden könnte
- CDX-011... ist für mich soetwas wie Herceptin bzw. Kadcyla in Brustkrebs, da der GPNMB-Anteil etwa so wie HER3 ist. Zudem gibt es noch andere Krebsarten, bei denen GPNMB überexpressioniert ist
- CDX-1127... könnte eine wichtige Kombination mit PD-1&Co sein... vielleicht ist Krebs in einigen Fällen damit sogar heilbar
- CDX-301... stärkt/aktiviert ebenfalls das Immunsystem
- APC-Technologie (z.B. CDX-1401)... wird als AK-Vakzine neben der Krebsbekämpfung auch z.B. zur Heilung von HIV o.ä. getestet. Abhängig von den Rezeptoren, die auf den Helferzellen angesprochen werden, kann das Immunsystem auch gezielt gegen einzelne Proteine abgeschwächt werden, was für Autoimmun-Erkrankungen interessant ist... so gibt es wohl auch Studien gegen Diabetes T1 oder MS.
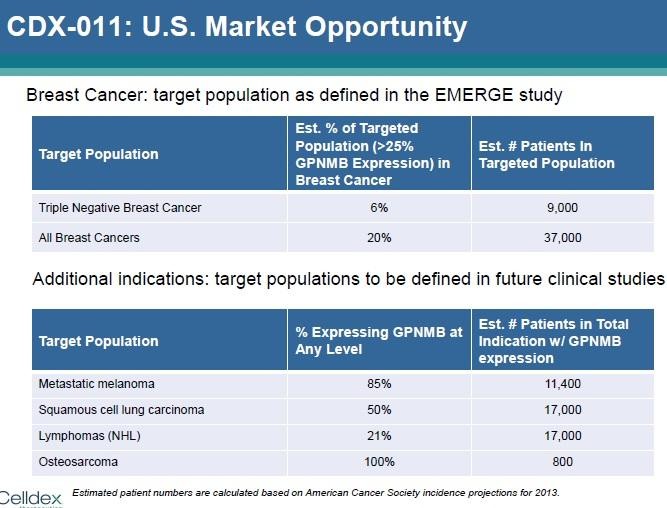
Gruß
ipollit
...wobei CDX-1135 nur ein interessanter Kandidat ist.

- Rindopepimut könnte ein Blockbuster in GBM sein; zuletzt hat Avastin hier kein Überlebensvorteil zeigen können, so dass Rindopepimut zur ersten Wahl werden könnte
- CDX-011... ist für mich soetwas wie Herceptin bzw. Kadcyla in Brustkrebs, da der GPNMB-Anteil etwa so wie HER3 ist. Zudem gibt es noch andere Krebsarten, bei denen GPNMB überexpressioniert ist
- CDX-1127... könnte eine wichtige Kombination mit PD-1&Co sein... vielleicht ist Krebs in einigen Fällen damit sogar heilbar
- CDX-301... stärkt/aktiviert ebenfalls das Immunsystem
- APC-Technologie (z.B. CDX-1401)... wird als AK-Vakzine neben der Krebsbekämpfung auch z.B. zur Heilung von HIV o.ä. getestet. Abhängig von den Rezeptoren, die auf den Helferzellen angesprochen werden, kann das Immunsystem auch gezielt gegen einzelne Proteine abgeschwächt werden, was für Autoimmun-Erkrankungen interessant ist... so gibt es wohl auch Studien gegen Diabetes T1 oder MS.

Gruß
ipollit
Antwort auf Beitrag Nr.: 44.995.977 von ipollit am 06.07.13 14:19:33Danke ipollit!
Immer wieder faszinierend, was es alles zu lernen gibt:
von Forbes:
They also point to a paradox in the health care system. Alexion, with 1,100 employees, is a multinational pharmaceutical company with offices in more than 30 countries–but only a few thousand patients the whole world over. Soliris is a blockbuster–and Alexion a juggernaut–because of the drug’s astronomical price: $440,000 per patient per year (though it is sometimes given away for free, in hardship cases). Yet the drug is so effective that private insurers and national health agencies, even sticklers like the United Kingdom and Australia, are willing to pay.
Wenn man bedenkt, dass neue Präparate in der Regel immer teurer werden (die Pharmabranche hat offensichtlich einen ganz eigenen Inflationsindex...), dann lag ich mit meiner Bauchschätzung von 500.000 Dollar für ein eventuelles DDD-Medikament wohl gar nicht so daneben.
Falls der Kandidat also etwas taugt, taugt er wohl auch für einige hundert Millionen Umsatz.
Erstaunlich ist das alles.
Für mich schwer verständlich, dass Hammer gerade jetzt verkauft hat. Denn auf mittlere Sicht reicht schon ein Erfolg bei Rindo oder bei 011, um die derzeitige Marktkapitalisierung zu rechtfertigen.
Alles andere - auch CDX-1135 - sind Freilose mit teilweise sehr hohem Potential.
Das zu frühe Verkaufen scheint mir generell eine gewisse Schwäche bei Hammer zu sein.
Immer wieder faszinierend, was es alles zu lernen gibt:
von Forbes:
They also point to a paradox in the health care system. Alexion, with 1,100 employees, is a multinational pharmaceutical company with offices in more than 30 countries–but only a few thousand patients the whole world over. Soliris is a blockbuster–and Alexion a juggernaut–because of the drug’s astronomical price: $440,000 per patient per year (though it is sometimes given away for free, in hardship cases). Yet the drug is so effective that private insurers and national health agencies, even sticklers like the United Kingdom and Australia, are willing to pay.
Wenn man bedenkt, dass neue Präparate in der Regel immer teurer werden (die Pharmabranche hat offensichtlich einen ganz eigenen Inflationsindex...), dann lag ich mit meiner Bauchschätzung von 500.000 Dollar für ein eventuelles DDD-Medikament wohl gar nicht so daneben.
Falls der Kandidat also etwas taugt, taugt er wohl auch für einige hundert Millionen Umsatz.
Erstaunlich ist das alles.
Für mich schwer verständlich, dass Hammer gerade jetzt verkauft hat. Denn auf mittlere Sicht reicht schon ein Erfolg bei Rindo oder bei 011, um die derzeitige Marktkapitalisierung zu rechtfertigen.
Alles andere - auch CDX-1135 - sind Freilose mit teilweise sehr hohem Potential.
Das zu frühe Verkaufen scheint mir generell eine gewisse Schwäche bei Hammer zu sein.
PCYC:
SUNNYVALE, Calif., July 10, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) today announced that it has submitted a New Drug Application (NDA) to the U.S. Food and Drug Administration (FDA) for the investigational oral Bruton's tyrosine kinase (BTK) inhibitor, ibrutinib, for two relapsed/refractory B-cell malignancy indications: mantle cell lymphoma (MCL) and chronic lymphocytic leukemia (CLL)/small lymphocytic lymphoma (SLL). The submission was based on data from Phase II studies in patients with relapsed/refractory MCL and in patients with relapsed/refractory CLL/SLL. With this submission, Pharmacyclics is also requesting Priority Review. Pharmacyclics is jointly developing ibrutinib with Janssen.
The NDA submission follows the receipt of a Breakthrough Therapy Designation from the FDA in February 2013 for ibrutinib as a monotherapy for the treatment of patients with relapsed/refractory MCL, and receipt of a second Breakthrough Therapy Designation for the treatment of patients with CLL/SLL with deletion of the short arm of chromosome 17 (del 17p). Further information on the implications of this filing for potential commercialization will be provided subsequent to the FDA rendering a decision on the filing.
------------
Der NDA für CLL kommt zu diesem frühen Zeitpunkt vielleicht etwas überraschend.
Jedenfalls dürfte Ibrutinib noch in diesem Jahr die Zulassung bekommen, meiner Meinung nach wahrscheinlich schon im Oktober.
Ich denke auch, dass das Mittel off label bei Patienten zum Einsatz kommen wird, die nicht relapsed/refractory sind.
Jeder Kurs unter 100 Dollar ist nicht wirklich nachvollziehbar (und zwar schon seit einigen Monaten).
SUNNYVALE, Calif., July 10, 2013 /PRNewswire/ -- Pharmacyclics, Inc. (Nasdaq: PCYC) today announced that it has submitted a New Drug Application (NDA) to the U.S. Food and Drug Administration (FDA) for the investigational oral Bruton's tyrosine kinase (BTK) inhibitor, ibrutinib, for two relapsed/refractory B-cell malignancy indications: mantle cell lymphoma (MCL) and chronic lymphocytic leukemia (CLL)/small lymphocytic lymphoma (SLL). The submission was based on data from Phase II studies in patients with relapsed/refractory MCL and in patients with relapsed/refractory CLL/SLL. With this submission, Pharmacyclics is also requesting Priority Review. Pharmacyclics is jointly developing ibrutinib with Janssen.
The NDA submission follows the receipt of a Breakthrough Therapy Designation from the FDA in February 2013 for ibrutinib as a monotherapy for the treatment of patients with relapsed/refractory MCL, and receipt of a second Breakthrough Therapy Designation for the treatment of patients with CLL/SLL with deletion of the short arm of chromosome 17 (del 17p). Further information on the implications of this filing for potential commercialization will be provided subsequent to the FDA rendering a decision on the filing.
------------
Der NDA für CLL kommt zu diesem frühen Zeitpunkt vielleicht etwas überraschend.
Jedenfalls dürfte Ibrutinib noch in diesem Jahr die Zulassung bekommen, meiner Meinung nach wahrscheinlich schon im Oktober.
Ich denke auch, dass das Mittel off label bei Patienten zum Einsatz kommen wird, die nicht relapsed/refractory sind.
Jeder Kurs unter 100 Dollar ist nicht wirklich nachvollziehbar (und zwar schon seit einigen Monaten).
Link zur JMP Healthcare Conference:
http://wsw.com/webcast/jmp21/
ARRY, ASTX, ARQL, EXEL; ENTA; CRIS, SNTA und noch viele mehr...
http://wsw.com/webcast/jmp21/
ARRY, ASTX, ARQL, EXEL; ENTA; CRIS, SNTA und noch viele mehr...
Rockwell (RMTI) heute mit positiven P3-Daten. Habe die Position zur Handelseröffnung geschlossen. Hätte einen grösseren Ausschlag erwartet/erhofft.
RMTI wandert auf ermäßigtem wieder ins Depot. Marketcap bei rund 150 Mio Dollar. Die Story sollte sich wie bei AMAG entwickeln. Geschichte wiederholt sich doch... 
http://seekingalpha.com/article/1544232-rockwell-medical-inc…

http://seekingalpha.com/article/1544232-rockwell-medical-inc…
Hallo zusammen mal wieder,
interessanter Artikel zu Virustherapie bei Karzinomen. Würde mich interessieren was die Experten davon halten.
http://www.aerzteblatt.de/archiv/142667/Onkolytische-Viren-M…
interessanter Artikel zu Virustherapie bei Karzinomen. Würde mich interessieren was die Experten davon halten.
http://www.aerzteblatt.de/archiv/142667/Onkolytische-Viren-M…
Ok, RMTI wieder gegeben. Das war schon eher die erhoffte Reaktion. 

Antwort auf Beitrag Nr.: 44.995.977 von ipollit am 06.07.13 14:19:33Nun auch Übernahme-Gerüchte bei AXLN... Roche wird als möglicher Interessent genannt. Allerdings ist dieses Gerücht deutlich unsicherer als z.B. die Übernahmegerüchte von ONXX vor 2 Wochen. Jedenfalls wirkt es sich deutlich positiv auf den Gesamtmarkt aus. Diese Woche gab es zwei Sprünge im NBI... ALXN-Gerüchte gestern und positive Studiendaten von CELG am Mittwoch.



Der NBI erreicht somit wieder ein neues Allzeit-Hoch...

Gruß
ipollit
Der NBI erreicht somit wieder ein neues Allzeit-Hoch...
Gruß
ipollit
PCYC...
Der frühe Zulassungsantrag für CLL hat mich positiv überrascht... bisher war ich nur von MCL ausgegangen. Wenn es eine beschleunigte Prüfung gibt (wovon ich ausgehe), dann wäre die Zulassung Mitte Oktober (3 Monate) möglich. Wenn die FDA hier auch noch den Breakthrough-Status aufwerten möchte, könnte eine Zulassung sogar noch schneller erfolgen.
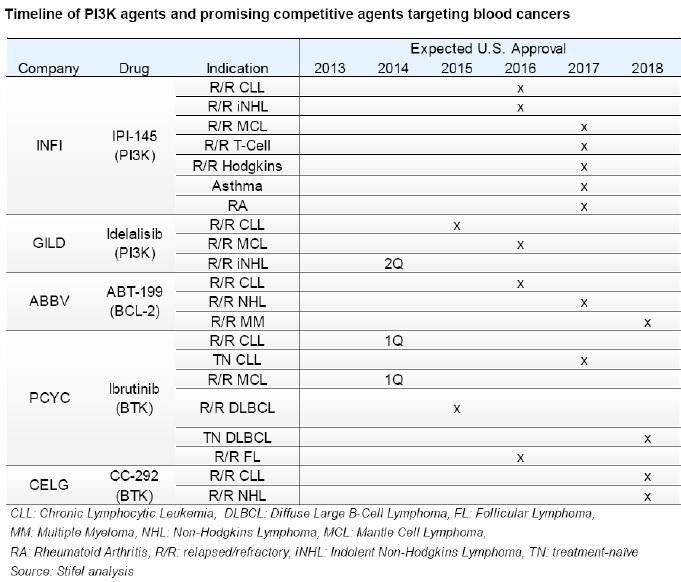
Gruß
ipollit
Der frühe Zulassungsantrag für CLL hat mich positiv überrascht... bisher war ich nur von MCL ausgegangen. Wenn es eine beschleunigte Prüfung gibt (wovon ich ausgehe), dann wäre die Zulassung Mitte Oktober (3 Monate) möglich. Wenn die FDA hier auch noch den Breakthrough-Status aufwerten möchte, könnte eine Zulassung sogar noch schneller erfolgen.

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.039.025 von ipollit am 13.07.13 13:17:31Das Gerücht, Roche wolle Alexion kaufen, gab es bereits vor einem Jahr. Damals wurde dies von der Finanz und Wortschaft (Schweiz) so kommentiert -> http://www.fuw.ch/article/roche-weiter-auf-akquisitionskurs/.
ARQL...
http://www.targetedhc.com/publications/targeted-therapies-ca…
Another oral targeted agent, ARQ 092, which targets the AKT pathway, was shown to be active in a spectrum of different solid tumors including colorectal, endometrial, and neuroendocrine tumors, and the drug demonstrated a manageable sideeffect profile.2
AKT inhibitors generally have two types of dose-limiting toxicities that relate to on-target effects of the drug: hyperglycemia and skin toxicity. In the case of ARQ 092, the researchers observed a pattern of a rise in blood sugar prior to the emergence of skin toxicity that may be a differentiating feature of this AKT inhibitor. The researchers did not observe any dose-limiting skin toxicity, and they were able to treat the hyperglycemia, allowing patients to continue the experimental treatment. This may mean that compared with other AKT inhibitors, ARQ 092 may be better tolerated at higher, more therapeutically active levels. The trial is ongoing to determine the maximum tolerated dose (MTD) and to test for efficacy.
*****
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARQL @ JMP (7/10/13)
1. In regards to P3 tivantinib HCC trial, stratification factors include: vascular invasion, extra-hepatic spread, and AFP.
2. ARQL plans to provide update on P3 MARQUEE NSCLC trial data at ESMO this year. Per slide 13 and based on a recent exploratory analysis, there was a substantial improvement in OS and PFS in 211 MET-high patients. There was no difference in OS in 234 MET-low patients. There was similar PFS in MET-high and MET-low patients.
I'm under the impression that this is the first time that ARQL has specifically said that there was "substantial improvement" in OS for MET-high tivantinib patients in MARQUEE. So, yes, I'm anxious to see the results at ESMO, which is not too far away (9/27/13 - 10/1/13). This is yet another trial where we have a signal in favor of OS for MET-high tivantinib patients. It will be interesting to see the specifics. I should add that the "summary" slide from yesterday's presentation seemed to hint that ARQL is still open to further development of tivantinib in both NSCLC and CRC.
Gruß
ipollit
http://www.targetedhc.com/publications/targeted-therapies-ca…
Another oral targeted agent, ARQ 092, which targets the AKT pathway, was shown to be active in a spectrum of different solid tumors including colorectal, endometrial, and neuroendocrine tumors, and the drug demonstrated a manageable sideeffect profile.2
AKT inhibitors generally have two types of dose-limiting toxicities that relate to on-target effects of the drug: hyperglycemia and skin toxicity. In the case of ARQ 092, the researchers observed a pattern of a rise in blood sugar prior to the emergence of skin toxicity that may be a differentiating feature of this AKT inhibitor. The researchers did not observe any dose-limiting skin toxicity, and they were able to treat the hyperglycemia, allowing patients to continue the experimental treatment. This may mean that compared with other AKT inhibitors, ARQ 092 may be better tolerated at higher, more therapeutically active levels. The trial is ongoing to determine the maximum tolerated dose (MTD) and to test for efficacy.
*****
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ARQL @ JMP (7/10/13)
1. In regards to P3 tivantinib HCC trial, stratification factors include: vascular invasion, extra-hepatic spread, and AFP.
2. ARQL plans to provide update on P3 MARQUEE NSCLC trial data at ESMO this year. Per slide 13 and based on a recent exploratory analysis, there was a substantial improvement in OS and PFS in 211 MET-high patients. There was no difference in OS in 234 MET-low patients. There was similar PFS in MET-high and MET-low patients.
I'm under the impression that this is the first time that ARQL has specifically said that there was "substantial improvement" in OS for MET-high tivantinib patients in MARQUEE. So, yes, I'm anxious to see the results at ESMO, which is not too far away (9/27/13 - 10/1/13). This is yet another trial where we have a signal in favor of OS for MET-high tivantinib patients. It will be interesting to see the specifics. I should add that the "summary" slide from yesterday's presentation seemed to hint that ARQL is still open to further development of tivantinib in both NSCLC and CRC.
Gruß
ipollit
SNTA
Ganetespib wird umfangreich getestet... im Wesentlichen zunächst bei Lungen- und Brustkrebs:
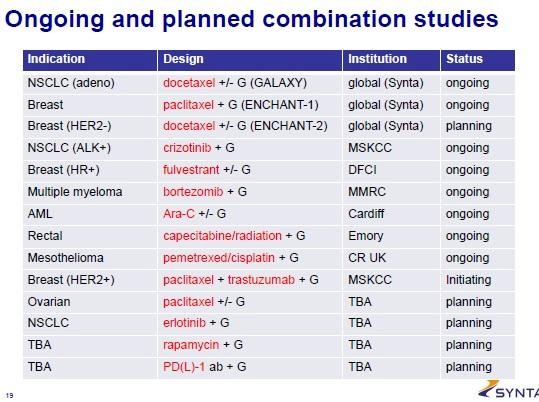
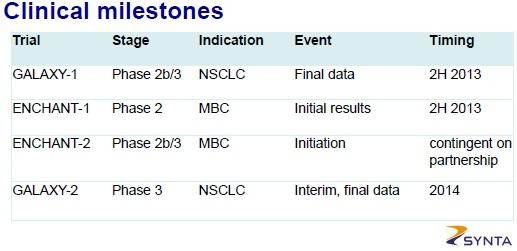
Ohad Hammer hat zuletzt ja auch von einem CR in einer Brustkrebs-Studie gesprochen: "2 additional points from the report are a complete response from the company’s ongoing triple-negative breast cancer trial (we already know there is another PR in that trial) and a forthcoming licensing deal in Asia."
alleine 2nd-line NSCLC soll eine Blockbuster-Indikation sein
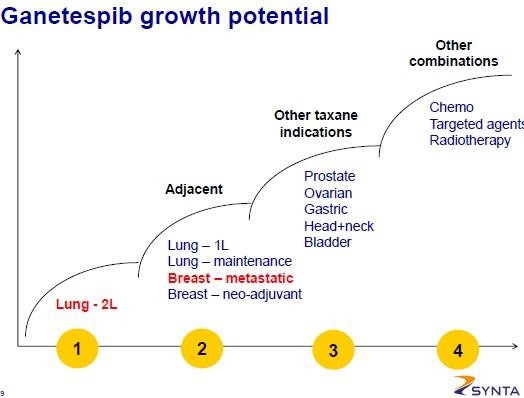
offensichtlich ist auch eine PD-1 Kombinations-Studie geplant... naja, PD-1 wird wohl nun mit x Sachen getestet...
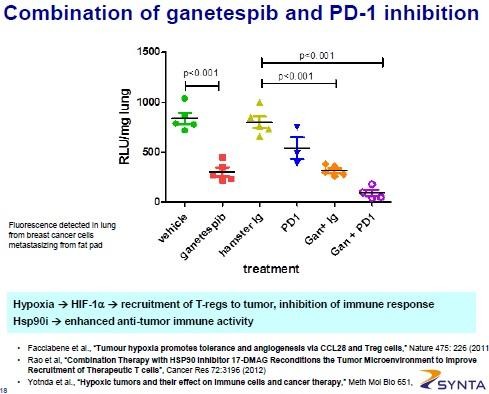
Gruß
ipollit
Ganetespib wird umfangreich getestet... im Wesentlichen zunächst bei Lungen- und Brustkrebs:


Ohad Hammer hat zuletzt ja auch von einem CR in einer Brustkrebs-Studie gesprochen: "2 additional points from the report are a complete response from the company’s ongoing triple-negative breast cancer trial (we already know there is another PR in that trial) and a forthcoming licensing deal in Asia."
alleine 2nd-line NSCLC soll eine Blockbuster-Indikation sein

offensichtlich ist auch eine PD-1 Kombinations-Studie geplant... naja, PD-1 wird wohl nun mit x Sachen getestet...

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.042.689 von ipollit am 14.07.13 19:00:01ARQL:
Hallo ipollit,
wenn ich mich richtig erinnere, wird die Rekrutierung für den Tivantinib-HCC-Trial bis ca. Mitte 2015 andauern.
Wie weit ist die Konkurrenz? Also metmab? Wird der AK bei HCC getestet?
Gruß
SLG
Hallo ipollit,
wenn ich mich richtig erinnere, wird die Rekrutierung für den Tivantinib-HCC-Trial bis ca. Mitte 2015 andauern.
Wie weit ist die Konkurrenz? Also metmab? Wird der AK bei HCC getestet?
Gruß
SLG
CLDX
könnte es eigentlich für Rindopepimut bei positiven PII ReACT-Daten eine vorzeitige Zulassung geben? Nach einer PII ist ja soetwas möglich, wenn es keine Alternativen gibt und z.B. PFS positiv ausfällt.
"Also during the fourth quarter of 2011, Celldex expects to initiate a Phase 2 randomized study of rindopepimut in combination with Avastin®in recurrent or refractory GB patients with EGFRvIII expression (the ReACT study). The ReACT study is expected to enroll up to 95 patients in the U.S. and will evaluate objective response rates (ORR), progression free survival (PFS) and overall survival (OS) endpoints in this patient population. ...
We have already been granted Orphan Drug designation for this program by the FDA, which allows for 7 years of market exclusivity from product launch in the U.S. as well as Fast Track designation to accelerate the review of rindopepimut."

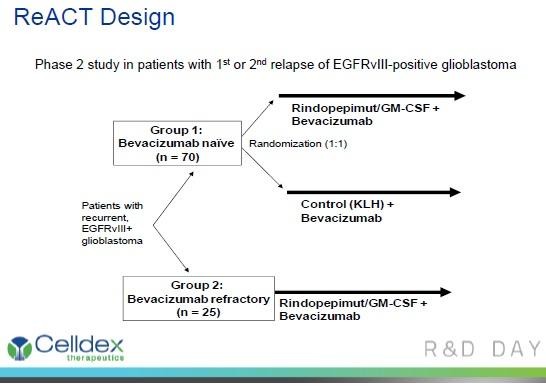
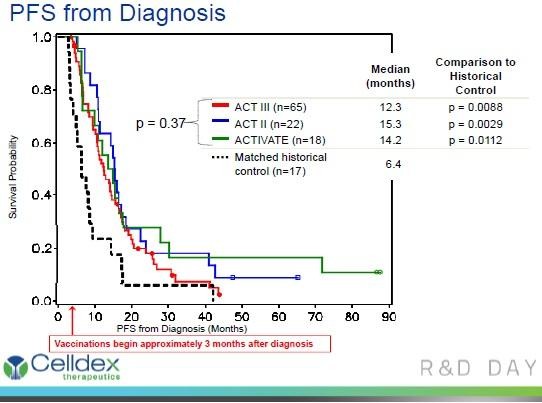

http://clinicaltrials.gov/ct2/show/NCT01498328?term=Rindopep…
A Study of Rindopepimut/GM-CSF in Patients With Relapsed EGFRvIII-Positive Glioblastoma (ReACT)
Estimated Enrollment: 95
Study Start Date: December 2011
Estimated Primary Completion Date: March 2014 (Final data collection date for primary outcome measure)
http://clinicaltrials.gov/ct2/show/NCT01058850?term=Rindopep…
Phase I Rindopepimut After Conventional Radiation in Children w/ Diffuse Intrinsic Pontine Gliomas
Estimated Enrollment: 12
Study Start Date: June 2011
Estimated Study Completion Date: September 2014
Estimated Primary Completion Date: September 2013 (Final data collection date for primary outcome measure)
Gruß
ipollit
könnte es eigentlich für Rindopepimut bei positiven PII ReACT-Daten eine vorzeitige Zulassung geben? Nach einer PII ist ja soetwas möglich, wenn es keine Alternativen gibt und z.B. PFS positiv ausfällt.
"Also during the fourth quarter of 2011, Celldex expects to initiate a Phase 2 randomized study of rindopepimut in combination with Avastin®in recurrent or refractory GB patients with EGFRvIII expression (the ReACT study). The ReACT study is expected to enroll up to 95 patients in the U.S. and will evaluate objective response rates (ORR), progression free survival (PFS) and overall survival (OS) endpoints in this patient population. ...
We have already been granted Orphan Drug designation for this program by the FDA, which allows for 7 years of market exclusivity from product launch in the U.S. as well as Fast Track designation to accelerate the review of rindopepimut."




http://clinicaltrials.gov/ct2/show/NCT01498328?term=Rindopep…
A Study of Rindopepimut/GM-CSF in Patients With Relapsed EGFRvIII-Positive Glioblastoma (ReACT)
Estimated Enrollment: 95
Study Start Date: December 2011
Estimated Primary Completion Date: March 2014 (Final data collection date for primary outcome measure)
http://clinicaltrials.gov/ct2/show/NCT01058850?term=Rindopep…
Phase I Rindopepimut After Conventional Radiation in Children w/ Diffuse Intrinsic Pontine Gliomas
Estimated Enrollment: 12
Study Start Date: June 2011
Estimated Study Completion Date: September 2014
Estimated Primary Completion Date: September 2013 (Final data collection date for primary outcome measure)
Gruß
ipollit
PCYC
U.a. Ibrutinib hat PCYC für fast umsonst vor einigen Jahren von Celera gekauft... ein paar Prozent Royalties muss PCYC dafür noch zahlen. Celera wurde wiederum von Quest übernommen, die heute diese Royalties für 486 Mio USD an Royalty Pharma verkauft haben.
http://www.fiercebiotech.com/story/quest-grabs-485m-deal-cas…
Two years ago, Quest Diagnostics ($DGX) picked up Celera and its gene-based testing tech for $344 million, net of cash and investments. And today it cashed in a lottery ticket it picked up in the deal, selling the royalty rights Celera held for the breakthrough cancer drug ibrutinib for $485 million.
...
According to a recent SEC filing, Pharmacyclics explained that it owed Celera a single-digit royalty on ibrutinib...
https://twitter.com/AndyBiotech
"JMP believes this Royalty Pharma transaction implies annual sales approximating $7bn at peak."

Gruß
ipollit
U.a. Ibrutinib hat PCYC für fast umsonst vor einigen Jahren von Celera gekauft... ein paar Prozent Royalties muss PCYC dafür noch zahlen. Celera wurde wiederum von Quest übernommen, die heute diese Royalties für 486 Mio USD an Royalty Pharma verkauft haben.
http://www.fiercebiotech.com/story/quest-grabs-485m-deal-cas…
Two years ago, Quest Diagnostics ($DGX) picked up Celera and its gene-based testing tech for $344 million, net of cash and investments. And today it cashed in a lottery ticket it picked up in the deal, selling the royalty rights Celera held for the breakthrough cancer drug ibrutinib for $485 million.
...
According to a recent SEC filing, Pharmacyclics explained that it owed Celera a single-digit royalty on ibrutinib...
https://twitter.com/AndyBiotech
"JMP believes this Royalty Pharma transaction implies annual sales approximating $7bn at peak."

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.074.257 von ipollit am 18.07.13 21:29:47könnte es eigentlich für Rindopepimut bei positiven PII ReACT-Daten eine vorzeitige Zulassung geben?
Kann mir ganz gut vorstellen, dass die Daten positiv sind (Avastin scheint ja hier eher nicht wirksam zu sein, so dass die Kontrollgruppe mit "nur Avastin" schlechter abschneiden sollte). Wie Du sagst, gibt es keine Alternativen und mit den ACT-Studien laufen sozusagen ja auch schon confirmatory-Trials mit bisher guten Daten. So schlecht dürften die Chancen eigentlich gar nicht stehen, auch wenn ReACT nicht eben viele Patienten umfasst.
Kann mir ganz gut vorstellen, dass die Daten positiv sind (Avastin scheint ja hier eher nicht wirksam zu sein, so dass die Kontrollgruppe mit "nur Avastin" schlechter abschneiden sollte). Wie Du sagst, gibt es keine Alternativen und mit den ACT-Studien laufen sozusagen ja auch schon confirmatory-Trials mit bisher guten Daten. So schlecht dürften die Chancen eigentlich gar nicht stehen, auch wenn ReACT nicht eben viele Patienten umfasst.
Ranking der US- und EU-Biotechs nach Marktkapitalisierung... die deutsche Morphosys ist mit Platz 32 gut dabei, nicht weit weg von Genmab auf Platz 27
(https://twitter.com/AndyBiotech)

Gruß
ipollit
(https://twitter.com/AndyBiotech)

Gruß
ipollit
Die letzten IPOs machen keinen Spaß! Schon der erste Kurs liegt immer massiv über dem IPO-Preis, der wiederum immer hoch angesetzt ist. Eigentlich hätte ich mir gerne die eine oder andere kleinere Position gekauft, aber so hat das keinen Zweck.
Wie weit stecken wir schon in einer Blase? Wenn IPOs so massiv gekauft werden, ist es zumindest kein gutes Zeichen... es kommt mir vor wie zu Zeiten des Neuen Marktes, als es nur darum ging, bei der Zeichnung dabei zu sein, egal um was es sich dabei handelt.
Ich hoffe, dass in der Zukunft nochmal eine Zeit kommt, in der man sich diese Unternehmen in Ruhe anschauen und dann zu niedrigeren Bewertungen einsteigen kann
Epizyme... IPO zu 15 USD

OncoMed... IPO zu 17 USD

nächste Woche kommt noch Agios (AGIO). Nur ein paar, die mich interessiert haben.
Gruß
ipollit
Wie weit stecken wir schon in einer Blase? Wenn IPOs so massiv gekauft werden, ist es zumindest kein gutes Zeichen... es kommt mir vor wie zu Zeiten des Neuen Marktes, als es nur darum ging, bei der Zeichnung dabei zu sein, egal um was es sich dabei handelt.
Ich hoffe, dass in der Zukunft nochmal eine Zeit kommt, in der man sich diese Unternehmen in Ruhe anschauen und dann zu niedrigeren Bewertungen einsteigen kann
Epizyme... IPO zu 15 USD
OncoMed... IPO zu 17 USD
nächste Woche kommt noch Agios (AGIO). Nur ein paar, die mich interessiert haben.
Gruß
ipollit
EXEL
Von der Partner-Pipeline hört man ja nicht so viel. Darunter befinden sich auch einige pi3k-Hemmer: 2 pan-pi3k XL147 und XL765 (pi3k+mTOR) mit Sanofi und einem pi3k-delta mit Merck.
Pan-Hemmer machen bisher Probleme, da sie sehr breit in die Zellen eingreifen: "Since PI3K is critical in the survival of cells, the broad inhibition of PI3K would not just kill cancer cells but could kill all cells. ... We specifically favor PI3K combinations with other targeted therapies. A promising candidate for combination is Xtandi, an inhibitor of the androgen receptor. The androgen signaling pathway is critical for prostate cancer and this selectivity may help synergize efficacy for cancer while not increasing toxicity in other tissues."
XL147 wird u.a. in Brustkrebs in Kombi mit Letrazole getestet: "Ongoing clinical trials include a phase 2 trial in endometrial cancer, a Phase 1b/2 trial in hormone receptor positive breast cancer in combination with letrazole, and phase 1 trials in combination with a MEK inhibitor or an ErbB3 inhibitor." Letrazole geht auch in die Richtung von Xtandi, indem es auf Hormon-Rezeptoren wirkt.
XL765: "Ongoing clinical trials include a single agent phase 2 trial in Non-Hodgkins lymphoma, combination phase 1b/2 trials with temozolomide in patients with glioblastoma, with letrazole in hormone receptor positive breast cancer, with bendamustine and/or rituximab in lymphoma or leukemia, and a phase 1 trial in combination with a MEK inhibitor."
Mal sehen, wie die sich mit der Zeit entwickeln. Im Erfolgsfall würde wohl auch EXEL profitieren: "At least that's the case for Exelixis, which cashed in May 28 (2009) in a big way in a deal with Sanofi-Aventis. In exchange for $140 million up-front, Sanofi gains world-wide rights to Exelixis's two earlyish-stage clinical compounds, XL147 and XL765 (both are in Phase Ib/II). ... This latest deal has the requisite biobucks--north of $ 1 billion plus double-digit royalties for XL147 and XL765--that we've come to associate with traditional pharma-biotech deals (it will be quite another matter if said money actually materializes)." http://invivoblog.blogspot.de/2009_05_01_archive.html
Im Vordergrund bei EXEL steht aber natürlich die Eigenentwicklung von Cabozantinib.
Der Kurs hat sich zuletzt etwas besser entwickelt... MK jetzt ca. 1 Mrd USD. Vielleicht gibt es ja mal einen deutlicheren Ausbruch nach oben, nachdem es längere Zeit seitwärts ging.

Gruß
ipollit
Von der Partner-Pipeline hört man ja nicht so viel. Darunter befinden sich auch einige pi3k-Hemmer: 2 pan-pi3k XL147 und XL765 (pi3k+mTOR) mit Sanofi und einem pi3k-delta mit Merck.
Pan-Hemmer machen bisher Probleme, da sie sehr breit in die Zellen eingreifen: "Since PI3K is critical in the survival of cells, the broad inhibition of PI3K would not just kill cancer cells but could kill all cells. ... We specifically favor PI3K combinations with other targeted therapies. A promising candidate for combination is Xtandi, an inhibitor of the androgen receptor. The androgen signaling pathway is critical for prostate cancer and this selectivity may help synergize efficacy for cancer while not increasing toxicity in other tissues."
XL147 wird u.a. in Brustkrebs in Kombi mit Letrazole getestet: "Ongoing clinical trials include a phase 2 trial in endometrial cancer, a Phase 1b/2 trial in hormone receptor positive breast cancer in combination with letrazole, and phase 1 trials in combination with a MEK inhibitor or an ErbB3 inhibitor." Letrazole geht auch in die Richtung von Xtandi, indem es auf Hormon-Rezeptoren wirkt.
XL765: "Ongoing clinical trials include a single agent phase 2 trial in Non-Hodgkins lymphoma, combination phase 1b/2 trials with temozolomide in patients with glioblastoma, with letrazole in hormone receptor positive breast cancer, with bendamustine and/or rituximab in lymphoma or leukemia, and a phase 1 trial in combination with a MEK inhibitor."
Mal sehen, wie die sich mit der Zeit entwickeln. Im Erfolgsfall würde wohl auch EXEL profitieren: "At least that's the case for Exelixis, which cashed in May 28 (2009) in a big way in a deal with Sanofi-Aventis. In exchange for $140 million up-front, Sanofi gains world-wide rights to Exelixis's two earlyish-stage clinical compounds, XL147 and XL765 (both are in Phase Ib/II). ... This latest deal has the requisite biobucks--north of $ 1 billion plus double-digit royalties for XL147 and XL765--that we've come to associate with traditional pharma-biotech deals (it will be quite another matter if said money actually materializes)." http://invivoblog.blogspot.de/2009_05_01_archive.html
Im Vordergrund bei EXEL steht aber natürlich die Eigenentwicklung von Cabozantinib.
Der Kurs hat sich zuletzt etwas besser entwickelt... MK jetzt ca. 1 Mrd USD. Vielleicht gibt es ja mal einen deutlicheren Ausbruch nach oben, nachdem es längere Zeit seitwärts ging.
Gruß
ipollit
STML
Letzte Woche habe ich mir eine erste Position Stemline (STML) zugelegt. Der Wert ist zwar schon sehr gut gelaufen, aber hat meiner Meinung nach mit der aktuellen MK von 327 Mio USD auch noch weiteres Potential. Interessant finde ich SL-401, das soetwas ähnliches ist wie ein ADC, nur statt eines AKs ein Interleukin-Protein, das an den IL-3Ralpha-Rezeptor andockt. (den entsprechenden ADC gibt es wohl in der Präklinik)
IL-3Ralpha (CD123) ist im wesentlichen bei Blutkrebsarten auf den Krebszellen stark ausgebildet. Zudem soll es neben den "normalen" Krebszellen auch die schlafenden Krebsstammzellen treffen: "The specific alpha subunit of the interleukin-3 receptor (IL-3Ralpha, CD123) is strongly expressed in various leukemic blasts and leukemic stem cells and seems to be an excellent target for the therapy of leukemias... Recent studies have shown that interleukin-3 receptor alpha (CD123) is highly expressed on leukemia stem cells of patients with acute myeloid leukemia (AML), and is correlated with tumor load and poor prognosis. CD123 was highly expressed in the bone marrow of the patients with myelodysplastic syndrome (MDS), significantly correlated with the proportion of bone marrow blasts, and thus might be the marker of MDS malignant clone. IL3RA is also a useful new marker for distinguishing B-cell disorders with circulating villous lymphocytes as its expression is characteristic of typical hairy cell leukemia (HCL) with high sensitivity and specificity."
Dabei gibt es mindestens 2 Indikationen für eine vorzeitige Zulassung. Insbesondere wirkt SL-401 bei dem sehr seltenen Krebs BPDCN mit 50% CR (N=6), der bisher nicht behandelt werden kann. Für AML, bei der keine 1st-line Chemo wirkt, ist in Europa z.B. nur ASTX Dacogen zugelassen... also gibt es auch bei AML einen entsprechenden Bedarf. SL-401 könnte noch bei weiteren Blukrebsarten wirken... z.B. auch bei CML.
Zudem gibt es mit SL-701 noch ein weiteres Mittel, das gegen Hirntumore wirken soll... wie z.B. CLDXs Rindopepimut.
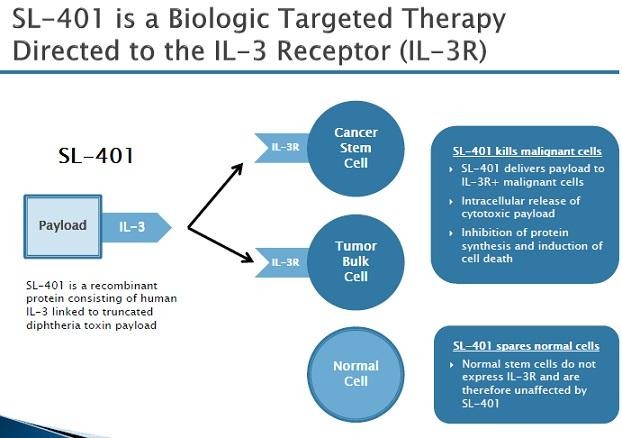
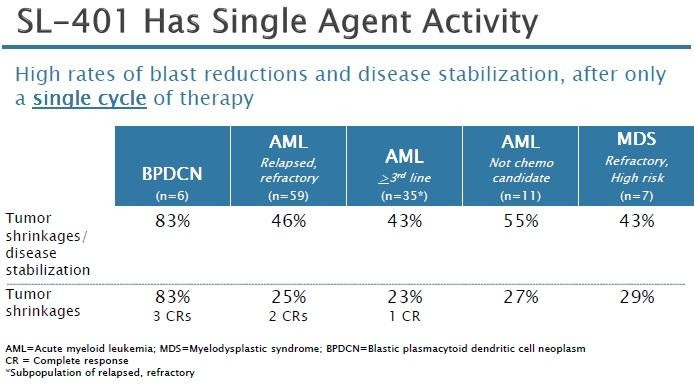
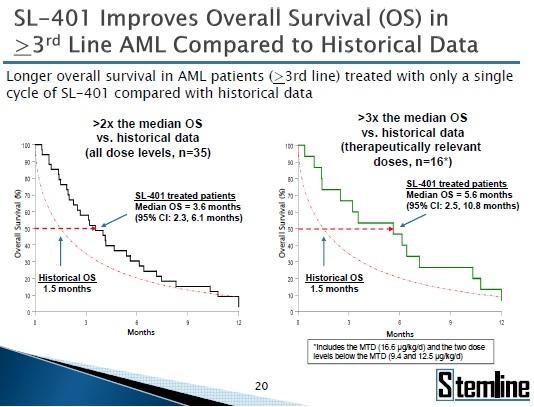



Gruß
ipollit
Letzte Woche habe ich mir eine erste Position Stemline (STML) zugelegt. Der Wert ist zwar schon sehr gut gelaufen, aber hat meiner Meinung nach mit der aktuellen MK von 327 Mio USD auch noch weiteres Potential. Interessant finde ich SL-401, das soetwas ähnliches ist wie ein ADC, nur statt eines AKs ein Interleukin-Protein, das an den IL-3Ralpha-Rezeptor andockt. (den entsprechenden ADC gibt es wohl in der Präklinik)
IL-3Ralpha (CD123) ist im wesentlichen bei Blutkrebsarten auf den Krebszellen stark ausgebildet. Zudem soll es neben den "normalen" Krebszellen auch die schlafenden Krebsstammzellen treffen: "The specific alpha subunit of the interleukin-3 receptor (IL-3Ralpha, CD123) is strongly expressed in various leukemic blasts and leukemic stem cells and seems to be an excellent target for the therapy of leukemias... Recent studies have shown that interleukin-3 receptor alpha (CD123) is highly expressed on leukemia stem cells of patients with acute myeloid leukemia (AML), and is correlated with tumor load and poor prognosis. CD123 was highly expressed in the bone marrow of the patients with myelodysplastic syndrome (MDS), significantly correlated with the proportion of bone marrow blasts, and thus might be the marker of MDS malignant clone. IL3RA is also a useful new marker for distinguishing B-cell disorders with circulating villous lymphocytes as its expression is characteristic of typical hairy cell leukemia (HCL) with high sensitivity and specificity."
Dabei gibt es mindestens 2 Indikationen für eine vorzeitige Zulassung. Insbesondere wirkt SL-401 bei dem sehr seltenen Krebs BPDCN mit 50% CR (N=6), der bisher nicht behandelt werden kann. Für AML, bei der keine 1st-line Chemo wirkt, ist in Europa z.B. nur ASTX Dacogen zugelassen... also gibt es auch bei AML einen entsprechenden Bedarf. SL-401 könnte noch bei weiteren Blukrebsarten wirken... z.B. auch bei CML.
Zudem gibt es mit SL-701 noch ein weiteres Mittel, das gegen Hirntumore wirken soll... wie z.B. CLDXs Rindopepimut.





Gruß
ipollit
Antwort auf Beitrag Nr.: 45.084.893 von ipollit am 20.07.13 21:12:50Hallo ipollit,
das sieht auf den ersten Blick wirklich hochinteressant aus!
Ich habe aber keine Einträge bei clinicaltrials.gov gefunden?
Mir ist der Status ihrer Trials nicht ganz klar.
Im 10-K für 2012 lesen wir folgendes:
SL-401 was evaluated in a completed multi-center Phase 1/2 clinical trial of patients with advanced hematologic cancers, which we refer to as
the 401 AHC Study. As described below, SL-401 demonstrated single agent anti-tumor activity, including durable CRs, and was well-tolerated
at clinically active doses. Specifically, a single cycle of SL-401 induced four durable CRs in relapsed or refractory patients: two CRs in BPDCN
and two CRs in AML.
In der hier in Bezug genommenen "401 AHC Studie" wurden laut 10-K 3 BPDCN-Patienten behandelt, davon hatten 2 eine CR.
The 401 AHC Study was undertaken in 80 patients with advanced hematologic cancers, including relapsed or refractory AML patients (n=59),
AML patients who were poor risk and not candidates for chemotherapy (n=11), high risk MDS patients (n=7), or patients with blastic
plasmacytoid dendritic cell neoplasm (BPDCN) (n=3), with “n” representing the number of patients.
In der von Dir zitierten Präsentation gibt es nun aber 6 Patienten und 3 CR´s.
Werden da jetzt schon Patienten aus dem pivotal-Trial für BPDCN mitgezählt? Dieser Trial läuft also definitiv schon? Das ist mir auch nicht so ganz klar geworden, weil der unter next steps geführt wird.
Letzte Anmerkung: Bisher scheint das Unternehmen von cleveren Einlizensierungen aus dem Uni-Bereich zu leben und weniger von eigener Forschung (auch SL-401 ist einlizensiert und Steamline wird geringfügige Royalties zu zahlen haben, die ich auf 2 bis 4% schätze).
Ist aber kein relevanter Eindruck, wenn SL-401 etwas taugt, wonach es aussieht.
Im Moment denke ich, dass ich es Dir am Montag nachmachen und kaufen werde.
das sieht auf den ersten Blick wirklich hochinteressant aus!
Ich habe aber keine Einträge bei clinicaltrials.gov gefunden?
Mir ist der Status ihrer Trials nicht ganz klar.
Im 10-K für 2012 lesen wir folgendes:
SL-401 was evaluated in a completed multi-center Phase 1/2 clinical trial of patients with advanced hematologic cancers, which we refer to as
the 401 AHC Study. As described below, SL-401 demonstrated single agent anti-tumor activity, including durable CRs, and was well-tolerated
at clinically active doses. Specifically, a single cycle of SL-401 induced four durable CRs in relapsed or refractory patients: two CRs in BPDCN
and two CRs in AML.
In der hier in Bezug genommenen "401 AHC Studie" wurden laut 10-K 3 BPDCN-Patienten behandelt, davon hatten 2 eine CR.
The 401 AHC Study was undertaken in 80 patients with advanced hematologic cancers, including relapsed or refractory AML patients (n=59),
AML patients who were poor risk and not candidates for chemotherapy (n=11), high risk MDS patients (n=7), or patients with blastic
plasmacytoid dendritic cell neoplasm (BPDCN) (n=3), with “n” representing the number of patients.
In der von Dir zitierten Präsentation gibt es nun aber 6 Patienten und 3 CR´s.
Werden da jetzt schon Patienten aus dem pivotal-Trial für BPDCN mitgezählt? Dieser Trial läuft also definitiv schon? Das ist mir auch nicht so ganz klar geworden, weil der unter next steps geführt wird.
Letzte Anmerkung: Bisher scheint das Unternehmen von cleveren Einlizensierungen aus dem Uni-Bereich zu leben und weniger von eigener Forschung (auch SL-401 ist einlizensiert und Steamline wird geringfügige Royalties zu zahlen haben, die ich auf 2 bis 4% schätze).
Ist aber kein relevanter Eindruck, wenn SL-401 etwas taugt, wonach es aussieht.
Im Moment denke ich, dass ich es Dir am Montag nachmachen und kaufen werde.
Hallo SLGramann!
Naja... sehr gut, diese Kritikpunkte gibt es wirklich! So sehr habe ich da nicht nachgehakt. Ausschlaggebend ist für mich nur gewesen, dass ich den Ansatz interessant und plausibel finde und dass die ersten klinischen Daten mit CRs bereits in der PI vielversprechend sind sowie es eine Orphan Drug Indikation als auch ein breiteres Potential gibt. Es kann nun sein, dass nicht alles mit rechten Dingen zuging und sich am Ende die positiven Ergebnisse in Luft auflösen. So ist STML auch ein noch junger IPO und hat vor Kurzen nur ein MK von fast 100 Mio USD gehabt, was eher auf eine Mogelpackung hindeutet.
Auf Twitter wurde bezügl. der letzten JPM Präsentation vor Kurzen auch kritisch angemerkt, dass SMTL immer noch keinen Termin für die PIIs nennt sondern nur von diesen alten Ergebnissen berichtet. Vielleicht stimmt bei dem Unternehmen auch etwas nicht, so dass ich es momentan als eine Risikoposition ansehe. Die Privotal-Trials laufen definitiv noch nicht!
Wie sich die CRs zusammensetzen, muss ich mir nochmal ansehen. Eigentlich sind CRs in einer PI selten, insbesondere wenn es keine Alternativen gibt... das weist auf einen funktionierenden Wirkmechanismus hin. Ich hoffe nicht, dass gemogelt worden ist und die CRs nicht echt sind.
Vielleicht noch ein relevanter Punkt, bei dem ich nicht weiß, ob sich das irgendwie auswirkt... in Kürze läuft die Lock-Up Periode ab: "lock-up ends ~Aug 16. affiliates hold ~21% or 2.6M shares subj to rule 144"https://twitter.com/zDonShimoda/status/357987161011798018
Gruß
ipollit
Naja... sehr gut, diese Kritikpunkte gibt es wirklich! So sehr habe ich da nicht nachgehakt. Ausschlaggebend ist für mich nur gewesen, dass ich den Ansatz interessant und plausibel finde und dass die ersten klinischen Daten mit CRs bereits in der PI vielversprechend sind sowie es eine Orphan Drug Indikation als auch ein breiteres Potential gibt. Es kann nun sein, dass nicht alles mit rechten Dingen zuging und sich am Ende die positiven Ergebnisse in Luft auflösen. So ist STML auch ein noch junger IPO und hat vor Kurzen nur ein MK von fast 100 Mio USD gehabt, was eher auf eine Mogelpackung hindeutet.
Auf Twitter wurde bezügl. der letzten JPM Präsentation vor Kurzen auch kritisch angemerkt, dass SMTL immer noch keinen Termin für die PIIs nennt sondern nur von diesen alten Ergebnissen berichtet. Vielleicht stimmt bei dem Unternehmen auch etwas nicht, so dass ich es momentan als eine Risikoposition ansehe. Die Privotal-Trials laufen definitiv noch nicht!
Wie sich die CRs zusammensetzen, muss ich mir nochmal ansehen. Eigentlich sind CRs in einer PI selten, insbesondere wenn es keine Alternativen gibt... das weist auf einen funktionierenden Wirkmechanismus hin. Ich hoffe nicht, dass gemogelt worden ist und die CRs nicht echt sind.
Vielleicht noch ein relevanter Punkt, bei dem ich nicht weiß, ob sich das irgendwie auswirkt... in Kürze läuft die Lock-Up Periode ab: "lock-up ends ~Aug 16. affiliates hold ~21% or 2.6M shares subj to rule 144"https://twitter.com/zDonShimoda/status/357987161011798018
Gruß
ipollit
zuletzt habe ich ARRY, ASTX und INFI ein wenig aufgestockt. ONXX werde ich wohl weiter verringern und mindestens SNTA noch etwas zukaufen, vielleicht auch weiter STML.
(jeweils mit der aktuellen MK in Mio USD)
13,9% Celldex - 1.700 - http://finance.yahoo.com/q?s=CLDX
10,3% Pharmacyclics - 7.870 - http://finance.yahoo.com/q?s=PCYC
7,4% Array - 631 - http://finance.yahoo.com/q?s=ARRY
5,6% Clovis - 2.060 - http://finance.yahoo.com/q?s=CLVS
5,4% Regeneron - 24.250 - http://finance.yahoo.com/q?s=REGN
5,3% Incyte - 3.140 - http://finance.yahoo.com/q?s=INCY
4,9% Infinity - 939 - http://finance.yahoo.com/q?s=INFI
4,8% Exelixis - 1.000 - http://finance.yahoo.com/q?s=EXEL
4,1% Genmab - 1.641 - http://finance.yahoo.com/q?s=GEN.CO
4,0% Isis - 3.220 - http://finance.yahoo.com/q?s=ISIS
3,7% Cubist - 3.680 - http://finance.yahoo.com/q?s=CBST
3,6% Onyx - 9.190 - http://finance.yahoo.com/q?s=ONXX
3,5% Astex - 544 - http://finance.yahoo.com/q?s=ASTX
3,5% Ariad - 3.700 - http://finance.yahoo.com/q?s=ARIA
3,3% Synta - 396 - http://finance.yahoo.com/q?s=SNTA
2,8% ArQule - 163 - http://finance.yahoo.com/q?s=ARQL
2,6% Curis - 302 - http://finance.yahoo.com/q?s=CRIS
2,5% Alnylam - 2.760 - http://finance.yahoo.com/q?s=ALNY
2,1% Seattle Genetics - 4.740 - http://finance.yahoo.com/q?s=SGEN
1,6% Trius - 550 - http://finance.yahoo.com/q?s=TSRX
1,5% Stemline - 327 - http://finance.yahoo.com/q?s=STML
1,5% AVEO - 129 - http://finance.yahoo.com/q?s=AVEO
1,1% Rigel - 331 - http://finance.yahoo.com/q?s=RIGL
0,9% Innate - 126 - http://finance.yahoo.com/q?s=IPH.PA
Gruß
ipollit
(jeweils mit der aktuellen MK in Mio USD)
13,9% Celldex - 1.700 - http://finance.yahoo.com/q?s=CLDX
10,3% Pharmacyclics - 7.870 - http://finance.yahoo.com/q?s=PCYC
7,4% Array - 631 - http://finance.yahoo.com/q?s=ARRY
5,6% Clovis - 2.060 - http://finance.yahoo.com/q?s=CLVS
5,4% Regeneron - 24.250 - http://finance.yahoo.com/q?s=REGN
5,3% Incyte - 3.140 - http://finance.yahoo.com/q?s=INCY
4,9% Infinity - 939 - http://finance.yahoo.com/q?s=INFI
4,8% Exelixis - 1.000 - http://finance.yahoo.com/q?s=EXEL
4,1% Genmab - 1.641 - http://finance.yahoo.com/q?s=GEN.CO
4,0% Isis - 3.220 - http://finance.yahoo.com/q?s=ISIS
3,7% Cubist - 3.680 - http://finance.yahoo.com/q?s=CBST
3,6% Onyx - 9.190 - http://finance.yahoo.com/q?s=ONXX
3,5% Astex - 544 - http://finance.yahoo.com/q?s=ASTX
3,5% Ariad - 3.700 - http://finance.yahoo.com/q?s=ARIA
3,3% Synta - 396 - http://finance.yahoo.com/q?s=SNTA
2,8% ArQule - 163 - http://finance.yahoo.com/q?s=ARQL
2,6% Curis - 302 - http://finance.yahoo.com/q?s=CRIS
2,5% Alnylam - 2.760 - http://finance.yahoo.com/q?s=ALNY
2,1% Seattle Genetics - 4.740 - http://finance.yahoo.com/q?s=SGEN
1,6% Trius - 550 - http://finance.yahoo.com/q?s=TSRX
1,5% Stemline - 327 - http://finance.yahoo.com/q?s=STML
1,5% AVEO - 129 - http://finance.yahoo.com/q?s=AVEO
1,1% Rigel - 331 - http://finance.yahoo.com/q?s=RIGL
0,9% Innate - 126 - http://finance.yahoo.com/q?s=IPH.PA
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.086.241 von ipollit am 21.07.13 13:59:42Ich würde nicht so weit gehen, dass bei dem Unternehmen etwas nicht stimmt im Sinne von Betrug.
Vielleicht finden wir noch heraus, woher diese 6 Patienten plötzlich kommen.
Ein interessanter Fakt ist, dass sie bisher keine Kontrolle über die Trials hatten und wohl auch nicht haben, was vielleicht die zusätzlichen Patienten erklärt. Stemline war bis jetzt wirklich sehr schlank aufgestellt. Das muss man ihnen aber nicht zwingend negativ auslegen:
(ich schau mir mal noch weiter die SEC-Files an)
To date, we have not sponsored any clinical trials relating to SL-401 or SL-701. Instead, faculty members at the Scott and White
Cancer Research Institute, MD Anderson Cancer Center, British Columbia Cancer Agency and Duke University have conducted
and sponsored all clinical trials relating to SL-401 and faculty members at the University of Pittsburgh have conducted and
sponsored all clinical trials relating to SL-701, in each case under their own INDs. Because the completed SL-401 and SL-701
clinical trials were investigator-sponsored, we did not control the design or conduct of the previous trials, and it is possible that the
FDA will not view these previous trials as providing adequate support for future clinical trials, whether controlled by us or third
parties, for any one or more reasons, including elements of the design or execution of the previous trials or safety concerns or
other trial results.
While we plan to assume control of the overall clinical and regulatory development of SL-401 and SL-701 going forward, we have
so far been dependent on contractual arrangements with each investigator and their respective academic institutions, and will
continue to be until we assume control. Such arrangements provide us certain information rights with respect to the completed
trials, including access to and the ability to use and reference the data, including for our own regulatory filings, resulting from the
completed trials. If these obligations are breached by the investigators or institutions, or if the data prove to be inadequate
compared to the first-hand knowledge we might have gained had the completed trials been corporate-sponsored trials, then our
ability to design and conduct our planned corporate-sponsored clinical trials may be adversely affected. Additionally, the FDA may
disagree with the sufficiency of our right of reference to the preclinical, manufacturing, or clinical data generated by these prior
investigator-sponsored trials, or our interpretation of preclinical, manufacturing, or clinical data from these clinical trials. If so, the
FDA may require us to obtain and submit additional preclinical, manufacturing, or clinical data before we may initiate our planned
trials and/or may not accept such additional data as adequate to initiate our planned trials.
We intend to assume control over the clinical and regulatory development of SL-401 by either exercising our right under our
agreement with Scott and White Memorial Hospital to have Scott and White transfer to us the existing IND for SL-401 or by
submitting our own IND for SL-401. We expect to either transfer the IND or submit our own IND in the next twelve months. We
intend to assume control over the clinical development of SL-701 by filing a corporate-sponsored IND, for which we may exercise
our rights of reference under our agreements with the University of Pittsburgh with respect to the existing INDs for SL-701.
Vielleicht finden wir noch heraus, woher diese 6 Patienten plötzlich kommen.
Ein interessanter Fakt ist, dass sie bisher keine Kontrolle über die Trials hatten und wohl auch nicht haben, was vielleicht die zusätzlichen Patienten erklärt. Stemline war bis jetzt wirklich sehr schlank aufgestellt. Das muss man ihnen aber nicht zwingend negativ auslegen:
(ich schau mir mal noch weiter die SEC-Files an)
To date, we have not sponsored any clinical trials relating to SL-401 or SL-701. Instead, faculty members at the Scott and White
Cancer Research Institute, MD Anderson Cancer Center, British Columbia Cancer Agency and Duke University have conducted
and sponsored all clinical trials relating to SL-401 and faculty members at the University of Pittsburgh have conducted and
sponsored all clinical trials relating to SL-701, in each case under their own INDs. Because the completed SL-401 and SL-701
clinical trials were investigator-sponsored, we did not control the design or conduct of the previous trials, and it is possible that the
FDA will not view these previous trials as providing adequate support for future clinical trials, whether controlled by us or third
parties, for any one or more reasons, including elements of the design or execution of the previous trials or safety concerns or
other trial results.
While we plan to assume control of the overall clinical and regulatory development of SL-401 and SL-701 going forward, we have
so far been dependent on contractual arrangements with each investigator and their respective academic institutions, and will
continue to be until we assume control. Such arrangements provide us certain information rights with respect to the completed
trials, including access to and the ability to use and reference the data, including for our own regulatory filings, resulting from the
completed trials. If these obligations are breached by the investigators or institutions, or if the data prove to be inadequate
compared to the first-hand knowledge we might have gained had the completed trials been corporate-sponsored trials, then our
ability to design and conduct our planned corporate-sponsored clinical trials may be adversely affected. Additionally, the FDA may
disagree with the sufficiency of our right of reference to the preclinical, manufacturing, or clinical data generated by these prior
investigator-sponsored trials, or our interpretation of preclinical, manufacturing, or clinical data from these clinical trials. If so, the
FDA may require us to obtain and submit additional preclinical, manufacturing, or clinical data before we may initiate our planned
trials and/or may not accept such additional data as adequate to initiate our planned trials.
We intend to assume control over the clinical and regulatory development of SL-401 by either exercising our right under our
agreement with Scott and White Memorial Hospital to have Scott and White transfer to us the existing IND for SL-401 or by
submitting our own IND for SL-401. We expect to either transfer the IND or submit our own IND in the next twelve months. We
intend to assume control over the clinical development of SL-701 by filing a corporate-sponsored IND, for which we may exercise
our rights of reference under our agreements with the University of Pittsburgh with respect to the existing INDs for SL-701.
Antwort auf Beitrag Nr.: 45.086.241 von ipollit am 21.07.13 13:59:42Im SEC-File zur KE vom 17.05.2013 heißt es übrigens:
Also, der "abgeschlossene" Trial hat hier 2 weitere Patienten dazugewonnen. Den dritten dann vielleicht noch etwas später? Das halte ich aber wirklich für möglich, wenn man bedenkt, dass der ja gar nicht von Stemline durchgeführt wird.
(jetzt höre ich aber erst mal auf damit)
The 401 AHC Study was undertaken in 82 patients with advanced hematologic cancers, including relapsed or refractory AML
patients (n=59), AML patients who were poor risk and not candidates for chemotherapy (n=11), high risk MDS patients (n=7), or
patients with blastic plasmacytoid dendritic cell neoplasm (BPDCN) (n=5), with "n" representing the number of patients. The
median patient age was 65 years, with a range of seven to 84 years of age. Patients received a single cycle of SL-401 of doses
ranging from 4.0 to 22.1 μg/kg/day, consisting of a 15-minute intravenous infusion on either an every-other-day schedule for up to
six treatments, or daily for a five-day schedule.
Dr. Arthur E. Frankel was the sponsor of the 401 AHC Study and the principal investigator at the Scott and White Cancer
Research Institute/Texas A&M (Temple, TX). The other principal investigators and co-investigators of the 401 AHC Study have
been Dr. Hagop M. Kantarjian and Dr. Marina Konopleva at MD Anderson Cancer Center (Houston, TX), Dr. David A. Rizzieri at
Duke University (Durham, NC), and Dr. Donna E. Hogge at the British Columbia Cancer Agency (Vancouver, Canada). Updated
401 AHC Study results will be presented at the American Society of Clinical Oncology (ASCO) annual conference in June 2013.
Also, der "abgeschlossene" Trial hat hier 2 weitere Patienten dazugewonnen. Den dritten dann vielleicht noch etwas später? Das halte ich aber wirklich für möglich, wenn man bedenkt, dass der ja gar nicht von Stemline durchgeführt wird.
(jetzt höre ich aber erst mal auf damit)
The 401 AHC Study was undertaken in 82 patients with advanced hematologic cancers, including relapsed or refractory AML
patients (n=59), AML patients who were poor risk and not candidates for chemotherapy (n=11), high risk MDS patients (n=7), or
patients with blastic plasmacytoid dendritic cell neoplasm (BPDCN) (n=5), with "n" representing the number of patients. The
median patient age was 65 years, with a range of seven to 84 years of age. Patients received a single cycle of SL-401 of doses
ranging from 4.0 to 22.1 μg/kg/day, consisting of a 15-minute intravenous infusion on either an every-other-day schedule for up to
six treatments, or daily for a five-day schedule.
Dr. Arthur E. Frankel was the sponsor of the 401 AHC Study and the principal investigator at the Scott and White Cancer
Research Institute/Texas A&M (Temple, TX). The other principal investigators and co-investigators of the 401 AHC Study have
been Dr. Hagop M. Kantarjian and Dr. Marina Konopleva at MD Anderson Cancer Center (Houston, TX), Dr. David A. Rizzieri at
Duke University (Durham, NC), and Dr. Donna E. Hogge at the British Columbia Cancer Agency (Vancouver, Canada). Updated
401 AHC Study results will be presented at the American Society of Clinical Oncology (ASCO) annual conference in June 2013.
Antwort auf Beitrag Nr.: 45.086.637 von SLGramann am 21.07.13 16:40:56Es handelt sich dabei um dieselbe PI/II. In den ASCO- und ASH-Postern, die auf der HP zu finden sind, sieht man, dass der Stand, auf den du dich beziehst dem ASH (2012) Poster entspricht:
"Study Design: Eighty patients with advanced hematologic cancers, including relapsed or refractory AML (n = 59), de novo AML unfit for chemotherapy (n = 11), high-risk MDS (n = 7), and relapsed/refractory BPDCN (n = 3), were enrolled in a multicenter study at four study sites in the US and Canada."
Bis ASCO (2013) wurden noch 3 weitere BPDCN-Patienten und 3 CML Patienten aufgenommen:
"Eighty-five patients with advanced hematologic cancers, including relapsed or refractory AML (n = 59), de novo AML unfit for chemotherapy (n = 11), high-risk MDS (n = 7), CML in accelerated or blast phase failing prior tyrosine kinase-containing therapy (n = 3), and relapsed/refractory BPDCN (n = 5), were enrolled in a multicenter study at four study sites in the US and Canada."
und...
"Single site, single dose level, single cycle expansion cohort involving patients with BPDCN, which was part of a larger 86 patient phase 1-2 study of SL-401 study (Frankel et al, J Clin Oncol 31 Suppl, 7029, 2013; presentation at ASCO 2013; Abstract 7029). Seven patients with BPDCN were screened, and six patients treated (Table 1)."
US/Canada-Studien sind ja schonmal positiv... es kann ja gut sein, dass man gerne noch mehr BPDCN-Patienten aufnimmt, weil es keine Alternative gibt und eine mögliche komplette Zerstörung des Krebs (CR) dagegen sehr hoffnungsvoll ist. Für BPDCN beträgt laut der JMP-Präsentation der median-OS nach Diagnose nur 12 Monate. http://wsw.com/webcast/jmp21/stml/
sehr positiv ist auch, dass es bei SL-401 keine Myelosuppression als Nebenwirkung gibt, was insbesondere bei 3rd-line AML wichtig ist. Myelosuppression ist z.B. typisch für die Chemo und es ist sehr positiv, wenn eine Therapie nicht diese Nebenwirkung aufweist... z.B. 5:15min oder 12:45min in http://pharmastrategyblog.com/2013/06/asco-2013-cll-intervie…
Interessant ist auch, dass sich die bisherigen Ergebnisse der PI/II nur auf einen Behandlungszyklus beziehen. STML hat von der FDA die Genehmigung erhalten, auch mehrere Zyklen durchzuführen, so wie es in der Praxis üblich wäre... dadurch ist zu erwarten, dass die Ergebnisse noch besser ausfallen werden.
Gruß
ipollit
"Study Design: Eighty patients with advanced hematologic cancers, including relapsed or refractory AML (n = 59), de novo AML unfit for chemotherapy (n = 11), high-risk MDS (n = 7), and relapsed/refractory BPDCN (n = 3), were enrolled in a multicenter study at four study sites in the US and Canada."
Bis ASCO (2013) wurden noch 3 weitere BPDCN-Patienten und 3 CML Patienten aufgenommen:
"Eighty-five patients with advanced hematologic cancers, including relapsed or refractory AML (n = 59), de novo AML unfit for chemotherapy (n = 11), high-risk MDS (n = 7), CML in accelerated or blast phase failing prior tyrosine kinase-containing therapy (n = 3), and relapsed/refractory BPDCN (n = 5), were enrolled in a multicenter study at four study sites in the US and Canada."
und...
"Single site, single dose level, single cycle expansion cohort involving patients with BPDCN, which was part of a larger 86 patient phase 1-2 study of SL-401 study (Frankel et al, J Clin Oncol 31 Suppl, 7029, 2013; presentation at ASCO 2013; Abstract 7029). Seven patients with BPDCN were screened, and six patients treated (Table 1)."
US/Canada-Studien sind ja schonmal positiv... es kann ja gut sein, dass man gerne noch mehr BPDCN-Patienten aufnimmt, weil es keine Alternative gibt und eine mögliche komplette Zerstörung des Krebs (CR) dagegen sehr hoffnungsvoll ist. Für BPDCN beträgt laut der JMP-Präsentation der median-OS nach Diagnose nur 12 Monate. http://wsw.com/webcast/jmp21/stml/
sehr positiv ist auch, dass es bei SL-401 keine Myelosuppression als Nebenwirkung gibt, was insbesondere bei 3rd-line AML wichtig ist. Myelosuppression ist z.B. typisch für die Chemo und es ist sehr positiv, wenn eine Therapie nicht diese Nebenwirkung aufweist... z.B. 5:15min oder 12:45min in http://pharmastrategyblog.com/2013/06/asco-2013-cll-intervie…
Interessant ist auch, dass sich die bisherigen Ergebnisse der PI/II nur auf einen Behandlungszyklus beziehen. STML hat von der FDA die Genehmigung erhalten, auch mehrere Zyklen durchzuführen, so wie es in der Praxis üblich wäre... dadurch ist zu erwarten, dass die Ergebnisse noch besser ausfallen werden.
Gruß
ipollit
Zitat von ipollit: sehr positiv ist auch, dass es bei SL-401 keine Myelosuppression als Nebenwirkung gibt, was insbesondere bei 3rd-line AML wichtig ist.
...
Interessant ist auch, dass sich die bisherigen Ergebnisse der PI/II nur auf einen Behandlungszyklus beziehen. STML hat von der FDA die Genehmigung erhalten, auch mehrere Zyklen durchzuführen, so wie es in der Praxis üblich wäre... dadurch ist zu erwarten, dass die Ergebnisse noch besser ausfallen werden.
Nach wiederholter Gabe eines IL-3-Toxin-Konjugats wäre eigentlich eine ausgeprägte Myelosuppression zu erwarten.
PS: Interessanter Thread!
Interessant auch in der JMP-Präsentation 15:00min... von den 6 Patienten haben 5 angesprochen. Der Patient, die nicht angesprochen hat, war der erste behandelte Patienten der noch die niedrigste Dosis erhalten hat (bei einer Dosisfindung erhalten die Patienten jeweils unterschiedliche Dosierungen, u.U. ist die erste noch nicht wirksam). Danach ist er auch noch nach Pakistan gegangen, so dass man nicht weiß, ob er nicht doch angesprochen hat... also könnte die Ansprechrate auch bei 100% liegen.
Desweiteren wird ein Patient gezeigt, der noch als PR gewertet wird, aber bereits Anzeichen für einen CR zeigt. Die Wirkung scheint also sehr hoch zu sein.
Wenn ich das am Ende richtig verstanden habe, sollen zu ASH Ergebnisse von weiteren BPDCN-Patienten folgen... die Zulassungsstudien kommen dann erst nächstes Jahr.
Cash ca. 100 Mio USD... auch nicht schlecht.
Gruß
ipollit
Desweiteren wird ein Patient gezeigt, der noch als PR gewertet wird, aber bereits Anzeichen für einen CR zeigt. Die Wirkung scheint also sehr hoch zu sein.
Wenn ich das am Ende richtig verstanden habe, sollen zu ASH Ergebnisse von weiteren BPDCN-Patienten folgen... die Zulassungsstudien kommen dann erst nächstes Jahr.
Cash ca. 100 Mio USD... auch nicht schlecht.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.086.797 von Joschka Schröder am 21.07.13 17:43:30"Nach wiederholter Gabe eines IL-3-Toxin-Konjugats wäre eigentlich eine ausgeprägte Myelosuppression zu erwarten."
... soweit ich es verstehe, gab es bisher nur einen Zyklus. Zum anderen... warum soll es zu einer deutlichen Myelosuppression kommen? Das Prinzip eines ADC&Co ist es doch, dass das Toxin nur im Target landet. IL-3R findet sich aber kaum auf gesunden Zellen.
Ein interessanter Aspekt ist auch, dass die Krebs-Stammzellen mit zerstört werden, die bei den meisten anderen Therapien, insbesondere bei Chemo und Strahlentherapie überleben und zu einem Wiederauftreten des Krebs führen.
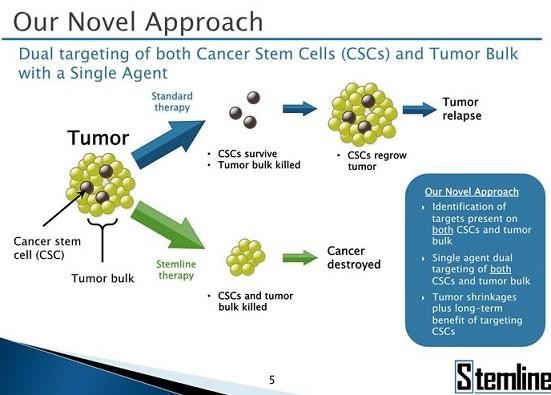
Links findet sich im gesunden Knochenmark kaum IL-3R (rot)... rechts bei AML ist alles rot. Genauso bei den Stammzellen... links gesund unter 1%, rechts Krebsstammzellen über 99% IL-3R.
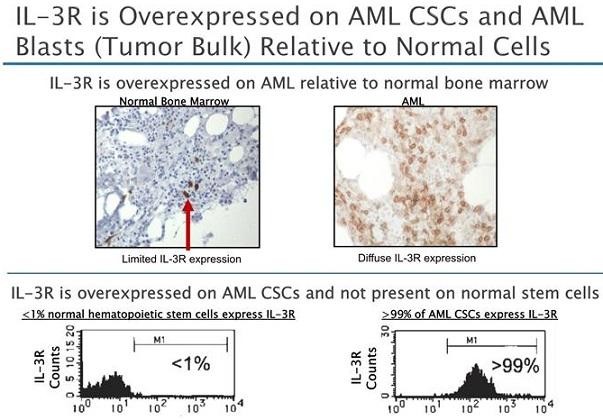
Gruß
ipollit
... soweit ich es verstehe, gab es bisher nur einen Zyklus. Zum anderen... warum soll es zu einer deutlichen Myelosuppression kommen? Das Prinzip eines ADC&Co ist es doch, dass das Toxin nur im Target landet. IL-3R findet sich aber kaum auf gesunden Zellen.
Ein interessanter Aspekt ist auch, dass die Krebs-Stammzellen mit zerstört werden, die bei den meisten anderen Therapien, insbesondere bei Chemo und Strahlentherapie überleben und zu einem Wiederauftreten des Krebs führen.

Links findet sich im gesunden Knochenmark kaum IL-3R (rot)... rechts bei AML ist alles rot. Genauso bei den Stammzellen... links gesund unter 1%, rechts Krebsstammzellen über 99% IL-3R.

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.086.875 von ipollit am 21.07.13 18:14:19Ist nicht mein Gebiet. Habe früher jedoch gelernt, IL-3 stimuliere (bei Gesunden) in größerem Stil pluripotente KM-Zellen (darüber hinaus aber auch einige andere Zelltypen wie z.B. Endothelialzellen).
Vielleicht ist alles eine Frage der jeweiligen Expressionsstärke. Das Expressionsmuster in verschiedenen Geweben müßte man mal in neutralen Publikationen recherchieren.
Vielleicht ist alles eine Frage der jeweiligen Expressionsstärke. Das Expressionsmuster in verschiedenen Geweben müßte man mal in neutralen Publikationen recherchieren.
Antwort auf Beitrag Nr.: 45.086.929 von Joschka Schröder am 21.07.13 18:31:00Ich bin auch keiner vom Fach. Meinst du, dass IL-3R für die Blutbildung unbedingt erforderlich ist und dass die Zerstörung dieser Zellen zu Myelosuppression führt? Haben nicht die meisten Target-Therapien auch gewisse Nebenwirkungen, weil die Zielmoleküle ja auch eine Funktion in den gesunden Zellen haben?
Entsteht bei Chemo&Co nicht Myelosuppression, weil die Chemo alle sich schnell teilenden Zellen beschädigt, so dass z.B. die Haare ausfallen... und Blutzellen sich auch relativ oft teilen? Andererseits trifft die Chemo dadurch nicht die Stammzellen, da diese sich nur sehr langsam teilen. Um CSC zu treffen, müsste das Toxin von SL-401 doch auf etwas anderes wirken, als die Zellteilung. Genau kenne ich mich damit aber nicht aus.
"Das Expressionsmuster in verschiedenen Geweben müßte man mal in neutralen Publikationen recherchieren."... was heißt für dich neutral? Wie SLGramannn ja bereits geschrieben hat, kommt SL-401 aus dem akademischen Bereich. Die bisherigen Studien und Ergebnisse wurden unabhängig von STML erzielt. Oder beziehst du "neutral" nicht auf ein mögliches kommerzielles Interesse?
Gruß
ipollit
Entsteht bei Chemo&Co nicht Myelosuppression, weil die Chemo alle sich schnell teilenden Zellen beschädigt, so dass z.B. die Haare ausfallen... und Blutzellen sich auch relativ oft teilen? Andererseits trifft die Chemo dadurch nicht die Stammzellen, da diese sich nur sehr langsam teilen. Um CSC zu treffen, müsste das Toxin von SL-401 doch auf etwas anderes wirken, als die Zellteilung. Genau kenne ich mich damit aber nicht aus.
"Das Expressionsmuster in verschiedenen Geweben müßte man mal in neutralen Publikationen recherchieren."... was heißt für dich neutral? Wie SLGramannn ja bereits geschrieben hat, kommt SL-401 aus dem akademischen Bereich. Die bisherigen Studien und Ergebnisse wurden unabhängig von STML erzielt. Oder beziehst du "neutral" nicht auf ein mögliches kommerzielles Interesse?
Gruß
ipollit
Zitat von ipollit: Meinst du, dass IL-3R für die Blutbildung unbedingt erforderlich ist und dass die Zerstörung dieser Zellen zu Myelosuppression führt?
Eigentlich ja. Ist aber vermutlich eine Frage der Dosis/Applikationsdauer bzw. Stärke des Toxins und des Expressionsmusters. Aber, wie geschrieben, mit IL-3 habe ich mich nie näher befasst. Daher alles unter Vorbehalt.
Zitat von ipollit: Haben nicht die meisten Target-Therapien auch gewisse Nebenwirkungen, weil die Zielmoleküle ja auch eine Funktion in den gesunden Zellen haben?
Entsteht bei Chemo&Co nicht Myelosuppression, weil die Chemo alle sich schnell teilenden Zellen beschädigt, so dass z.B. die Haare ausfallen... und Blutzellen sich auch relativ oft teilen?
Zweifellos.
Zitat von ipollit: Um CSC zu treffen, müsste das Toxin von SL-401 doch auf etwas anderes wirken, als die Zellteilung.
Ich habe mir bislang nur die Toxine von IMGN, SGEN und Wilex näher angesehen. Das Wilex-Toxin (Amanitin) greift im Gegensatz zu den Toxinen der beiden anderen Unternehmen nicht in die Mitose ein, sondern tötet auf andem Weg quasi jede Targetzelle ab. Nachteil: Ein Amanitin-haltiges Immunkonjugat wird im Normalfall unakzeptable Nebenwirkungen haben, wenn das Target in einem gewissen Umfang auch von gesunden Zellen exprimiert wird.
Auf einer der von Dir geposteten Abbildung ist zu lesen, Stemline verwende ein "truncated diphteria toxin". Dies spricht für eine direkte Hemmung der Proteinsynthese ... und damit ebenfalls für einen von der Zellteilung unabhängigen Killing-Mechanismus.
Zitat von ipollit: "Das Expressionsmuster in verschiedenen Geweben müßte man mal in neutralen Publikationen recherchieren."... was heißt für dich neutral? Wie SLGramannn ja bereits geschrieben hat, kommt SL-401 aus dem akademischen Bereich. Die bisherigen Studien und Ergebnisse wurden unabhängig von STML erzielt. Oder beziehst du "neutral" nicht auf ein mögliches kommerzielles Interesse?
War etwas mißverständlich formuliert. Gemeint war aber, dass ich gerne in einer umfassenden Grundlagenpublikation nachschauen würde, welche Gewebe in welchem Ausmaß IL-3-R exprimieren.
Antwort auf Beitrag Nr.: 45.087.083 von Joschka Schröder am 21.07.13 19:40:33Danke! Bezüglich ADCs... was hältst du dann von CLDXs CDX-011? GPNMB scheint kein schlechtes Target zu sein, das allerdings nicht nur auf den Tumor begrenzt ist. Hierfür lässt sich also nur so ein ADC wie der von SGEN einsetzen?
http://www.google.de/url?sa=t&rct=j&q=%22a%20metastatic%20me…
"Glycoprotein non-metastatic b (GPNMB): A metastatic mediator and emerging therapeutic target in cancer"
Gibt es denn Targets, die nur auf Krebszellen zu finden sind? Dies ist ja auch ein Problem von therapeutischen Vakzinen... sonst müsste es ja zu Autoimmunreaktionen kommen, falls man es überhaupt schafft, dass das Immunsystem auf solche Targets reagiert.
Vielleicht bringt Pre-Targeting wie das von Immunomedics etwas?... http://www.immunomedics.com/pretargeting.shtml
Gruß
ipollit
http://www.google.de/url?sa=t&rct=j&q=%22a%20metastatic%20me…
"Glycoprotein non-metastatic b (GPNMB): A metastatic mediator and emerging therapeutic target in cancer"
Gibt es denn Targets, die nur auf Krebszellen zu finden sind? Dies ist ja auch ein Problem von therapeutischen Vakzinen... sonst müsste es ja zu Autoimmunreaktionen kommen, falls man es überhaupt schafft, dass das Immunsystem auf solche Targets reagiert.
Vielleicht bringt Pre-Targeting wie das von Immunomedics etwas?... http://www.immunomedics.com/pretargeting.shtml
Gruß
ipollit
Bin jetzt mit einer kleinen Position bei Stemline dabei. Wenn die Ansprechraten bei BPDCN real sind, dann werden die ihren Weg gehen. Hat sich eigentlich Hammer mal irgendwann zu denen geäußert?
ARRY-502:
Daten sind da:
The proof-of-concept study enrolled 184 patients in the United States with mild-to-moderate persistent allergic asthma, a population which represents more than 12 million patients in the U.S. ARRY-502, dosed at 200 mg twice daily (N = 93) for 4 weeks, improved FEV1 by 3.9% versus placebo (N = 91), achieving statistical significance (P = 0.02). A predefined endpoint using the median baseline value of a Th2 associated biomarker was also evaluated. Patients in this population achieved enhanced improvement in FEV1 (6.8 % versus placebo, P = 0.008).
Secondary efficacy endpoints also achieved statistical significance including:
Reduced short-acting beta agonist (SABA) use
Asthma control as measured by the Asthma Control Questionnaire (ACQ)
Forced Vital Capacity (FVC) improvement
Symptom free days during treatment
Improvement in Rhinasthma and Asthma Quality of Life questionnaires (AQLQ)
The overall frequency of adverse events was lower in the ARRY-502 group including fewer asthma exacerbations versus the placebo group. There were no treatment-emergent serious adverse events in patients receiving ARRY-502; all treatment-related adverse events were either mild or moderate in severity. A total of 15 (11 in the placebo group, 4 in the ARRY-502 group) out of 184 patients discontinued the study early, primarily due to exacerbations of asthma (5 in the placebo group, 1 in the ARRY-502 group).
------------------
Was die Effektivität angeht fehlt mir hier komplett der Vergleichsmaßstab, aber die p-Werte lesen sich natürlich gut.
Das Nebenwirkungsprofil scheint sehr sauber zu sein, nachdem was hier bekannt gemacht wurde.
Bin gespannt, was sich hieraus noch ergibt!
Daten sind da:
The proof-of-concept study enrolled 184 patients in the United States with mild-to-moderate persistent allergic asthma, a population which represents more than 12 million patients in the U.S. ARRY-502, dosed at 200 mg twice daily (N = 93) for 4 weeks, improved FEV1 by 3.9% versus placebo (N = 91), achieving statistical significance (P = 0.02). A predefined endpoint using the median baseline value of a Th2 associated biomarker was also evaluated. Patients in this population achieved enhanced improvement in FEV1 (6.8 % versus placebo, P = 0.008).
Secondary efficacy endpoints also achieved statistical significance including:
Reduced short-acting beta agonist (SABA) use
Asthma control as measured by the Asthma Control Questionnaire (ACQ)
Forced Vital Capacity (FVC) improvement
Symptom free days during treatment
Improvement in Rhinasthma and Asthma Quality of Life questionnaires (AQLQ)
The overall frequency of adverse events was lower in the ARRY-502 group including fewer asthma exacerbations versus the placebo group. There were no treatment-emergent serious adverse events in patients receiving ARRY-502; all treatment-related adverse events were either mild or moderate in severity. A total of 15 (11 in the placebo group, 4 in the ARRY-502 group) out of 184 patients discontinued the study early, primarily due to exacerbations of asthma (5 in the placebo group, 1 in the ARRY-502 group).
------------------
Was die Effektivität angeht fehlt mir hier komplett der Vergleichsmaßstab, aber die p-Werte lesen sich natürlich gut.
Das Nebenwirkungsprofil scheint sehr sauber zu sein, nachdem was hier bekannt gemacht wurde.
Bin gespannt, was sich hieraus noch ergibt!
Antwort auf Beitrag Nr.: 45.097.803 von SLGramann am 23.07.13 15:05:28Hallo SLGramann,
bezüglich der Effektivität schreibt Adam Feuerstein:
Follow-up studies of ARRY-502 will need to demonstrate an improvement in lung function over a longer period of time in order for the drug to be considered a clinically meaningful treatment for asthma patients. For comparison sake, Merck's Singulair was approved for asthma treatment based on an approximate 9 percent improvement in FEV1 after 12 weeks.
Array 502 hatte ja 3,9% nach 4 Wochen, wobei es unter Berücksichtigung des Biomarkers 6,8% waren. Die Frage ist also, ob sich das nach mehreren Wochen entsprechend steigern lässt. Gerade die Berücksichtigung des Biomarkers scheint vielversprechend. Bitte mit schönem Upfront verpartnern, damit die Finanzierung von 520 und 614 staht.
http://www.thestreet.com/story/11986010/2/array-seeks-asthma…
-results.html" target="_blank" rel="nofollow ugc noopener">http://www.thestreet.com/story/11986010/2/array-seeks-asthma…
-results.html
SG kmastra

bezüglich der Effektivität schreibt Adam Feuerstein:
Follow-up studies of ARRY-502 will need to demonstrate an improvement in lung function over a longer period of time in order for the drug to be considered a clinically meaningful treatment for asthma patients. For comparison sake, Merck's Singulair was approved for asthma treatment based on an approximate 9 percent improvement in FEV1 after 12 weeks.
Array 502 hatte ja 3,9% nach 4 Wochen, wobei es unter Berücksichtigung des Biomarkers 6,8% waren. Die Frage ist also, ob sich das nach mehreren Wochen entsprechend steigern lässt. Gerade die Berücksichtigung des Biomarkers scheint vielversprechend. Bitte mit schönem Upfront verpartnern, damit die Finanzierung von 520 und 614 staht.
http://www.thestreet.com/story/11986010/2/array-seeks-asthma…
-results.html" target="_blank" rel="nofollow ugc noopener">http://www.thestreet.com/story/11986010/2/array-seeks-asthma…
-results.html
SG kmastra

Antwort auf Beitrag Nr.: 45.098.477 von kmastra am 23.07.13 16:16:42Bitte mit schönem Upfront verpartnern, damit die Finanzierung von 520 und 614 staht.
Ja, die Verpartnerung - oder präziser gesagt, die Auslizensierung des Programms - ist der Härtetest für die Güte der heute gemeldeten Daten. In dieser Indikation kommt ja nur ein Big Pharma in Betracht und die werden es sich sehr gut überlegen, ob sie hier in eine sehr große und sehr teure PIII gehen wollen.
Da das Programm aber bisher faktisch mit Null bewertet war, ist es eben eine free call option.
Zu meinem Erstaunen sieht Ohad Hammer ja auch bei Arry-797 noch Potential, trotz des offensichtlich problematischen Nebenwirkungsprofils.
Der Traum wäre es, wenn man beide Projekte noch in diesem Jahr auslizensieren könnte. Die Pipeline ist jetzt schon stark. Nach einer Auslizensierung von 502 und/oder 797 wäre sie nochmals um einiges (mehrere 100 Mio. Dollar) werthaltiger. Also, hoffen wir das Beste und konzentrieren uns ansonsten auf die ASH... Das wird für mich der spannendste Dezember seit langem!
Ja, die Verpartnerung - oder präziser gesagt, die Auslizensierung des Programms - ist der Härtetest für die Güte der heute gemeldeten Daten. In dieser Indikation kommt ja nur ein Big Pharma in Betracht und die werden es sich sehr gut überlegen, ob sie hier in eine sehr große und sehr teure PIII gehen wollen.
Da das Programm aber bisher faktisch mit Null bewertet war, ist es eben eine free call option.
Zu meinem Erstaunen sieht Ohad Hammer ja auch bei Arry-797 noch Potential, trotz des offensichtlich problematischen Nebenwirkungsprofils.
Der Traum wäre es, wenn man beide Projekte noch in diesem Jahr auslizensieren könnte. Die Pipeline ist jetzt schon stark. Nach einer Auslizensierung von 502 und/oder 797 wäre sie nochmals um einiges (mehrere 100 Mio. Dollar) werthaltiger. Also, hoffen wir das Beste und konzentrieren uns ansonsten auf die ASH... Das wird für mich der spannendste Dezember seit langem!
Antwort auf Beitrag Nr.: 45.098.477 von kmastra am 23.07.13 16:16:42Bei Singlair scheint sich beim Delta zwischen Placebo und Wirkstoff nach den ersten Wochen leider nicht mehr viel verändert zu haben.

Figure 2: FEV1 Mean Percent Change from Baseline (U.S. Trial: Singulair N=406; Placebo N=270) (ANOVA Model)
The efficacy of Singulair for the chronic treatment of asthma in adults and adolescents 15 years of age and older was demonstrated in two (U.S. and Multinational) similarly designed, randomized, 12-week, double-blind, placebo-controlled trials in 1576 patients (795 treated with Singulair, 530 treated with placebo, and 251 treated with active control). The median age was 33 years (range 15 to 85); 56.8% were females and 43.2% were males. The ethnic/racial distribution in these studies was 71.6% Caucasian, 17.7% Hispanic, 7.2% other origins and 3.5% Black. Patients had mild or moderate asthma and were non-smokers who required approximately 5 puffs of inhaled β-agonist per day on an "as-needed" basis. The patients had a mean baseline percent of predicted forced expiratory volume in 1 second (FEV1) of 66% (approximate range, 40 to 90%). The co-primary endpoints in these trials were FEV1 and daytime asthma symptoms. In both studies after 12 weeks, a random subset of patients receiving Singulair was switched to placebo for an additional 3 weeks of double-blind treatment to evaluate for possible rebound effects.
The results of the U.S. trial on the primary endpoint, morning FEV1, expressed as mean percent change from baseline averaged over the 12-week treatment period, are shown in FIGURE 2. Compared with placebo, treatment with one Singulair 10-mg tablet daily in the evening resulted in a statistically significant increase in FEV1 percent change from baseline (13.0%-change in the group treated with Singulair vs. 4.2%-change in the placebo group, p<0.001); the change from baseline in FEV1 for Singulair was 0.32 liters compared with 0.10 liters for placebo, corresponding to a between-group difference of 0.22 liters (p<0.001, 95% CI 0.17 liters, 0.27 liters). The results of the Multinational trial on FEV1 were similar.
http://www.drugs.com/pro/singulair.html
Ob Big Pharma in Arry-502 einen Wert erkennen wird, wird man einfach abwarten müssen. Im Lichte der Singulair-Daten ist Euphorie zunächst mal unangebracht.

Figure 2: FEV1 Mean Percent Change from Baseline (U.S. Trial: Singulair N=406; Placebo N=270) (ANOVA Model)
The efficacy of Singulair for the chronic treatment of asthma in adults and adolescents 15 years of age and older was demonstrated in two (U.S. and Multinational) similarly designed, randomized, 12-week, double-blind, placebo-controlled trials in 1576 patients (795 treated with Singulair, 530 treated with placebo, and 251 treated with active control). The median age was 33 years (range 15 to 85); 56.8% were females and 43.2% were males. The ethnic/racial distribution in these studies was 71.6% Caucasian, 17.7% Hispanic, 7.2% other origins and 3.5% Black. Patients had mild or moderate asthma and were non-smokers who required approximately 5 puffs of inhaled β-agonist per day on an "as-needed" basis. The patients had a mean baseline percent of predicted forced expiratory volume in 1 second (FEV1) of 66% (approximate range, 40 to 90%). The co-primary endpoints in these trials were FEV1 and daytime asthma symptoms. In both studies after 12 weeks, a random subset of patients receiving Singulair was switched to placebo for an additional 3 weeks of double-blind treatment to evaluate for possible rebound effects.
The results of the U.S. trial on the primary endpoint, morning FEV1, expressed as mean percent change from baseline averaged over the 12-week treatment period, are shown in FIGURE 2. Compared with placebo, treatment with one Singulair 10-mg tablet daily in the evening resulted in a statistically significant increase in FEV1 percent change from baseline (13.0%-change in the group treated with Singulair vs. 4.2%-change in the placebo group, p<0.001); the change from baseline in FEV1 for Singulair was 0.32 liters compared with 0.10 liters for placebo, corresponding to a between-group difference of 0.22 liters (p<0.001, 95% CI 0.17 liters, 0.27 liters). The results of the Multinational trial on FEV1 were similar.
http://www.drugs.com/pro/singulair.html
Ob Big Pharma in Arry-502 einen Wert erkennen wird, wird man einfach abwarten müssen. Im Lichte der Singulair-Daten ist Euphorie zunächst mal unangebracht.
Antwort auf Beitrag Nr.: 45.100.839 von Joschka Schröder am 23.07.13 21:26:35Ich wollte damit nur ausdrücken, dass meiner Meinung nach der Markt den Programmen 797 und 502 bisher keinen oder zumindest keinen relevanten Wert beimisst. Diese These ergibt sich aus der Marktkapitalisierung von Array einerseits und dem Wert, den ich den MEK-Inhibitoren und den Programmen 520 und 614 andererseits zubillige.
Die Situation ist ähnlich wie noch vor einiger Zeit bei MorphoSys. Zu viel Pipeline für die Marktkapitalisierung. Und nach allem, was man lesen konnte, lagen und liegen die Erwartungen des Marktes gerade für die Programme 797 und 502 wohl sehr niedrig und für mich bewertungstechnisch damit bei Null.
Die Situation ist ähnlich wie noch vor einiger Zeit bei MorphoSys. Zu viel Pipeline für die Marktkapitalisierung. Und nach allem, was man lesen konnte, lagen und liegen die Erwartungen des Marktes gerade für die Programme 797 und 502 wohl sehr niedrig und für mich bewertungstechnisch damit bei Null.
Antwort auf Beitrag Nr.: 45.100.363 von SLGramann am 23.07.13 20:10:44Guter Fund. Da heißt es jetzt erst mal abwarten. Der Markt wäre ja ziemlich groß. Es wurden soweit ich das verstanden habe auch nicht alle Fakten auf den Tisch gelegt.
Ich finde Array immer noch viel zu günstig. Ich hatte bei 502 eher mit negativen Ergebnissen gerechnet. Glaube das ging den meisten so. Mal sehen, vielleicht geht es ja jetzt in Antizipation von ASH weiter bergauf.
Dort werden ja PII Ergebnisse von 520 und PI von 614 präsentiert? So ganz klar ist mir das nicht, weil immer von der jeweiligen Entscheidung zu pivotal trials am Ende des Jahres geredet wird. Oder sind das schon PII Ergebnisse zu 614? Oder soll die Zulassung nach PII Ergebnissen eingereicht werden?
797 würde ich auch noch nicht abschreiben, da es eben kein Opiod ist und einen anderen Wirkmechanismus hat. Es könnte also in Kombination eingesetzt werden und macht auch nicht so abhängig.
Ich finde Array immer noch viel zu günstig. Ich hatte bei 502 eher mit negativen Ergebnissen gerechnet. Glaube das ging den meisten so. Mal sehen, vielleicht geht es ja jetzt in Antizipation von ASH weiter bergauf.
Dort werden ja PII Ergebnisse von 520 und PI von 614 präsentiert? So ganz klar ist mir das nicht, weil immer von der jeweiligen Entscheidung zu pivotal trials am Ende des Jahres geredet wird. Oder sind das schon PII Ergebnisse zu 614? Oder soll die Zulassung nach PII Ergebnissen eingereicht werden?
797 würde ich auch noch nicht abschreiben, da es eben kein Opiod ist und einen anderen Wirkmechanismus hat. Es könnte also in Kombination eingesetzt werden und macht auch nicht so abhängig.
In Sachen IPO und Nachzügler kann ich nur nochmal ENTA ins Spiel bringen. Fliegt m.E. derzeit absolut unter dem Radar. Wird sich dieses Jahr allerdings mit Phase 3 Ergebnissen ändern:
...Gilead may be leading the pack, but it is not alone in a race that will likely deliver billions of dollars in sales to the first to market. AbbVie (NYSE: ABBV) is nipping at Gilead's heels with its own all-oral, interferon-free treatment for HCV, with and without ribavirin. Much like sofosbuvir, AbbVie's HCV protease inhibitor ABT-450, in combination with other AbbVie drugs, produced strong response rates of greater than 90 percent in only a few months. ABT-450 was developed in a joint effort with Enanta Pharmaceuticals, Inc. (NASDAQ: ENTA).
AbbVie's drugs, ABT-450/r, ABT-267 and ABT-333, have received the vaunted "Breakthrough Therapy" designation from the FDA. A "Breakthrough Therapy" designation from the FDA, a relatively new category from the FDA (initiated in 2012), is meant to expedite the regulatory process for drug candidates that may meet great areas of unmet medical need. To date, the FDA has received over 60 applications for "Breakthrough Therapy" designation, but only 15 have been awarded, with AbbVie commanding three of them with its HCV treatments.
Shares of ABBV have also lofted higher, rising about 27 percent in 2013, on bets that they can catch Gilead in the quest for FDA approval to market a new HCV treatment. The Breakthrough designation gives AbbVie an outside shot, but Gilead appears to still be out front in a very close contest.
...
http://seekingalpha.com/article/1564282-plenty-of-room-for-e…
...Gilead may be leading the pack, but it is not alone in a race that will likely deliver billions of dollars in sales to the first to market. AbbVie (NYSE: ABBV) is nipping at Gilead's heels with its own all-oral, interferon-free treatment for HCV, with and without ribavirin. Much like sofosbuvir, AbbVie's HCV protease inhibitor ABT-450, in combination with other AbbVie drugs, produced strong response rates of greater than 90 percent in only a few months. ABT-450 was developed in a joint effort with Enanta Pharmaceuticals, Inc. (NASDAQ: ENTA).
AbbVie's drugs, ABT-450/r, ABT-267 and ABT-333, have received the vaunted "Breakthrough Therapy" designation from the FDA. A "Breakthrough Therapy" designation from the FDA, a relatively new category from the FDA (initiated in 2012), is meant to expedite the regulatory process for drug candidates that may meet great areas of unmet medical need. To date, the FDA has received over 60 applications for "Breakthrough Therapy" designation, but only 15 have been awarded, with AbbVie commanding three of them with its HCV treatments.
Shares of ABBV have also lofted higher, rising about 27 percent in 2013, on bets that they can catch Gilead in the quest for FDA approval to market a new HCV treatment. The Breakthrough designation gives AbbVie an outside shot, but Gilead appears to still be out front in a very close contest.
...
http://seekingalpha.com/article/1564282-plenty-of-room-for-e…
Hier der bisher umfassendste Artikel zu ENTA von gestern:
http://seekingalpha.com/article/1569402-4-months-post-ipo-en…
http://seekingalpha.com/article/1569402-4-months-post-ipo-en…
Antwort auf Beitrag Nr.: 45.100.363 von SLGramann am 23.07.13 20:10:44ARRY
bezügl. der ARRY-502 PII-Ergebnisse... es ist nicht so leicht zu sagen, wie diese Ergebnisse zu bewerten sind. Singulair gibt es ja schon lange am Markt, inzwischen ist es generisch, aber wie ARRY sagte, lagen die Umsätze in 2011 mit Patentschutz bei über 5 Mrd USD. D.h. ein Markt ist schon vorhanden.
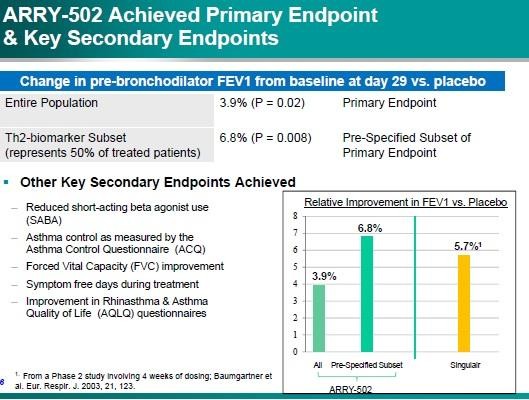
CRTh2 wirkt wohl nur bei Asthma mit Th2, was laut ARRY die Hälfte aller Asthma-Patienten betrifft. Wenn man den Vergleich nimmt, den ARRY bei der Päsentation gezeigt hat, so wäre ARRY-502 beim Durchschnitt aller Patienten schlechter als Singulair, bei den relevanten Th2-Patienten allerdings gleich oder etwas besser. Ich weiß nicht, wie eine vergleichbare Effektivität zu bewerten ist, wenn man bereits ein sehr etabliertes Generikum am Markt hat. Insgesamt sind Singulair oder ARRY-502 wohl eher sehr nebenwirkungsam bei gleichzeitiger geringer Effektivität. Könnte man beides auch kombinieren und damit bessere Ergebnisse erzielen?
ARRY ist nicht das einzige Unternehmen, welches einen CRTh2 gegen Asthma entwickelt. Beispielsweise hat vor ein paar Jahren Oxagen ähnliche Ergebnisse für OC000459 erzielt... die 4 Wochen-Ergebnisse lagen sogar mit +7,4% vs. Placebo noch höher (zumal wahrscheinlich uanabhängig von Th2). Trotzdem konnten sie keinen Pharma-Partner finden, vielleicht auch, weil die Studien nur in Osteuropa durchgeführt worden sind.
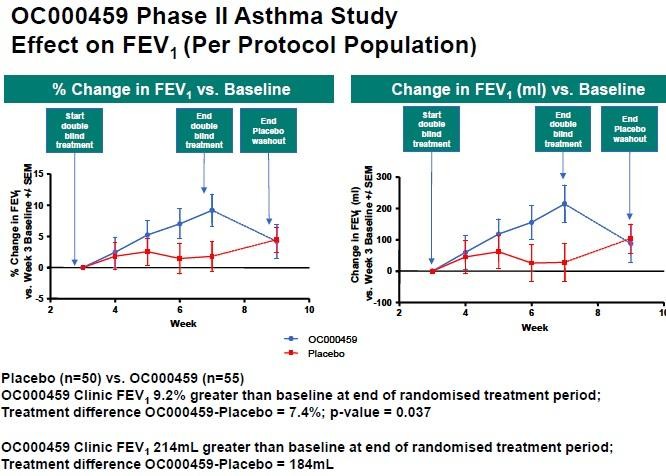
Schließlich hat Atopix (http://www.atopixtherapeutics.co.uk/) es einlizensiert und eine 12 Wochen-Studie durchgeführt. Diese Ergebnisse sehen für mich eher schlechter aus, als die nach 4 Wochen, da die Placebo-Gruppe recht variabel ist. Es wäre interessant zu wissen, wie die Placebos sich bei ARRY-502 entwickelt haben, dann kann man den relative Abstand von 3,9% oder 6,8% etwas besser einordnen. Immmerhin hat ARRY die Studien nur in den USA durchgeführt.
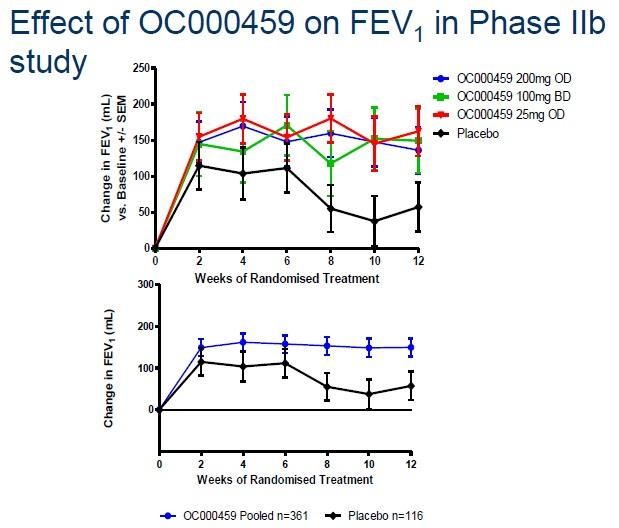
Wie SLGramann schon gesagt hat, scheinen die Ergebnisse nach 12 Wochen wahrscheinlich nicht besser als die nach 4 Wochen zu werden.
Gruß
ipollit
bezügl. der ARRY-502 PII-Ergebnisse... es ist nicht so leicht zu sagen, wie diese Ergebnisse zu bewerten sind. Singulair gibt es ja schon lange am Markt, inzwischen ist es generisch, aber wie ARRY sagte, lagen die Umsätze in 2011 mit Patentschutz bei über 5 Mrd USD. D.h. ein Markt ist schon vorhanden.

CRTh2 wirkt wohl nur bei Asthma mit Th2, was laut ARRY die Hälfte aller Asthma-Patienten betrifft. Wenn man den Vergleich nimmt, den ARRY bei der Päsentation gezeigt hat, so wäre ARRY-502 beim Durchschnitt aller Patienten schlechter als Singulair, bei den relevanten Th2-Patienten allerdings gleich oder etwas besser. Ich weiß nicht, wie eine vergleichbare Effektivität zu bewerten ist, wenn man bereits ein sehr etabliertes Generikum am Markt hat. Insgesamt sind Singulair oder ARRY-502 wohl eher sehr nebenwirkungsam bei gleichzeitiger geringer Effektivität. Könnte man beides auch kombinieren und damit bessere Ergebnisse erzielen?
ARRY ist nicht das einzige Unternehmen, welches einen CRTh2 gegen Asthma entwickelt. Beispielsweise hat vor ein paar Jahren Oxagen ähnliche Ergebnisse für OC000459 erzielt... die 4 Wochen-Ergebnisse lagen sogar mit +7,4% vs. Placebo noch höher (zumal wahrscheinlich uanabhängig von Th2). Trotzdem konnten sie keinen Pharma-Partner finden, vielleicht auch, weil die Studien nur in Osteuropa durchgeführt worden sind.

Schließlich hat Atopix (http://www.atopixtherapeutics.co.uk/) es einlizensiert und eine 12 Wochen-Studie durchgeführt. Diese Ergebnisse sehen für mich eher schlechter aus, als die nach 4 Wochen, da die Placebo-Gruppe recht variabel ist. Es wäre interessant zu wissen, wie die Placebos sich bei ARRY-502 entwickelt haben, dann kann man den relative Abstand von 3,9% oder 6,8% etwas besser einordnen. Immmerhin hat ARRY die Studien nur in den USA durchgeführt.

Wie SLGramann schon gesagt hat, scheinen die Ergebnisse nach 12 Wochen wahrscheinlich nicht besser als die nach 4 Wochen zu werden.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.110.521 von BiotechHype am 25.07.13 08:27:24ENTA
derselbe Link, nur zur Original-Seite... http://propthink.com/four-months-after-ipo-enanta-pharmaceut…
ENTA ist mit der Bewertung in der Tat interessant. Ich hatte zuletzt ACHN, die aber nichts gebracht haben. Im HCV-Bereich ist GILD das Maß der Dinge. ABT ist aber auch nicht so schlecht aufgestellt. Insgesamt könnte der HCV-Markt aber eher Enttäuschungen bringen.
Trotzdem ist es interessant, dass ENTA bei einer 300 Mio USD MK (100 Mio USD Cash) nicht unwesentlich an ABT-450 beteiligt ist und zwar mit 10% bis 20% bei gleichzeitig 0 Kosten. Der Umsatz von ABT-450 könnte in die Mrd gehen. Mit EDP-239 Partner NVS sind die Konditionen ähnlich... der NS5A ist allerdings noch in der frühen klinischen Phase.
Eine mögliche Zulassung von ABT-450 ist ja in absehbarer Zeit möglich. Ich werde mir jedenfalls ENTA nochmal genauer anschauen.
Gruß
ipollit
derselbe Link, nur zur Original-Seite... http://propthink.com/four-months-after-ipo-enanta-pharmaceut…
ENTA ist mit der Bewertung in der Tat interessant. Ich hatte zuletzt ACHN, die aber nichts gebracht haben. Im HCV-Bereich ist GILD das Maß der Dinge. ABT ist aber auch nicht so schlecht aufgestellt. Insgesamt könnte der HCV-Markt aber eher Enttäuschungen bringen.
Trotzdem ist es interessant, dass ENTA bei einer 300 Mio USD MK (100 Mio USD Cash) nicht unwesentlich an ABT-450 beteiligt ist und zwar mit 10% bis 20% bei gleichzeitig 0 Kosten. Der Umsatz von ABT-450 könnte in die Mrd gehen. Mit EDP-239 Partner NVS sind die Konditionen ähnlich... der NS5A ist allerdings noch in der frühen klinischen Phase.
Eine mögliche Zulassung von ABT-450 ist ja in absehbarer Zeit möglich. Ich werde mir jedenfalls ENTA nochmal genauer anschauen.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.116.807 von ipollit am 25.07.13 20:54:47Hier ist es auch nochmal zusammengefasst:
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Re: ENTA’s partnership economics
On ABT-450, ENTA is eligible to receive $195M in pre-commercialization milestones (of which an undisclosed portion is for NDA filings and the rest is for regulatory approvals) and a double-digit royalty on worldwide sales. (ENTA already received $57M up-front and $55M in clinical-development milestones from ABBV.) ABBV funds all clinical development and commercialization expenses for ABT-450 worldwide.
On ABT-493, the economics are similar to ABT-450 except that ENTA has the option to co-fund development and thereby earn a profit share rather than a royalty in the US market.
On EDP-239, ENTA is theoretically eligible to receive $395M in pre-commercial milestones and $160M in commercial milestones from NVS, as well as a double-digit royalty on worldwide sales. (ENTA already received $34M up-front and $11M in clinical milestones from NVS.) NVS funds all development and commercialization expenses worldwide. I used the word theoretically at the beginning of this paragraph because the EDP-239 program appears to be in the slow lane; I’m not convinced it will amount to anything since NVS appears to have pulled away from the HCV arena.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Re: ENTA’s partnership economics
On ABT-450, ENTA is eligible to receive $195M in pre-commercialization milestones (of which an undisclosed portion is for NDA filings and the rest is for regulatory approvals) and a double-digit royalty on worldwide sales. (ENTA already received $57M up-front and $55M in clinical-development milestones from ABBV.) ABBV funds all clinical development and commercialization expenses for ABT-450 worldwide.
On ABT-493, the economics are similar to ABT-450 except that ENTA has the option to co-fund development and thereby earn a profit share rather than a royalty in the US market.
On EDP-239, ENTA is theoretically eligible to receive $395M in pre-commercial milestones and $160M in commercial milestones from NVS, as well as a double-digit royalty on worldwide sales. (ENTA already received $34M up-front and $11M in clinical milestones from NVS.) NVS funds all development and commercialization expenses worldwide. I used the word theoretically at the beginning of this paragraph because the EDP-239 program appears to be in the slow lane; I’m not convinced it will amount to anything since NVS appears to have pulled away from the HCV arena.
Antwort auf Beitrag Nr.: 45.116.461 von ipollit am 25.07.13 20:06:49Besonders begeistert bin ich von Singulair eigentlich nicht (als Monotherapeutikum begrenzte Wirksamkeit), auch wenn das Präparat insbesondere von Kinderärzten (s.u.) gerne verschrieben wird. Hin und wieder treten auch unangenehme neurologische/psychiatrische Nebenwirkungen auf (z.B. Albträume, Schwindel, Mißempfindungen, Halluzinatonen).
Ein Markt für derartige Therapeutika gibt es gleichwohl und der Ansatz via Th2 ist bei allergischem Asthma recht intelligent.
Eine Kombination aus ARRY-502 und einem Leukotrienantagonisten wie Singulair dürfte allerdings synergistisch wirken und die Möglichkeit eröffnen, (insbesondere bei Kindern in der Wachstumsphase) Kortison einzusparen. Insoweit erscheinen die jüngsten Ergebnisse trotz der begrenzten Wirksamkeit durchaus interessant.
Ein Markt für derartige Therapeutika gibt es gleichwohl und der Ansatz via Th2 ist bei allergischem Asthma recht intelligent.
Eine Kombination aus ARRY-502 und einem Leukotrienantagonisten wie Singulair dürfte allerdings synergistisch wirken und die Möglichkeit eröffnen, (insbesondere bei Kindern in der Wachstumsphase) Kortison einzusparen. Insoweit erscheinen die jüngsten Ergebnisse trotz der begrenzten Wirksamkeit durchaus interessant.
Ich hatte mir den CC von ARRY angehört. Dort sprachen sie u.A. auch die Möglichkeit der Kombination mit anderen Wirkstoffen an. Besonders auch deshalb, weil das Nebenwirkungsprofil ja hervorragend war (besser als Placebo?).
Deshalb wäre auch eine höhere Dosierung - und damit evtl. auch bessere Wirkamkeit denkbar. Ebenso sprachen sie verklausuliert davon, dass man es mit anderen Verabreichungsformen versuchen könnte (z.B. Spray?). Eine weitere Möglichkeit die Ergebnisse zu verbessern ist die Beschränkung auf eine bestimmte Population (s. Biomarker etc.) Mehrmals betonten sie zudem, dass wegen wettbewerbstechnischen Gründen nicht alle Daten veröffentlichst werden - wohl aber den mögliche Partnern zur Verfügung stehen. Aber insgesamt ist und bleibt das Ganze für mich ein Zusatzjoker - wenn auch ein ziemlich großer.
Nach wie vor ist Array für mich die attraktivste Aktie im ganzen Biotechsektor. Wenn ich irgendwas mit Array vergleiche, dürfte ich es eigentlich gar nicht kaufen...
http://seekingalpha.com/article/1565582-array-biopharma-inc-…
ENTA fine ich auch interessant. Im Biotech Value Board wird da recht viel zu gepostet. Tenor dort:
-Zulassung wahrscheinlich, zumindest wirds kaum an der Effektivität scheitern.
-Das Novartis Program wird wohl nicht weiter verfolgt.
-Milestones würden bei Zulassung schon den Wert der Aktie decken.
Scheint mir die günstigste Aktie mit einem Medikament mit Breakthrough-Status zu sein. Die Royalties sind gut.
Übersicht zum Breakthroughstatus:
http://orphandruganaut.wordpress.com/2013/05/20/fda-breakthr…
Deshalb wäre auch eine höhere Dosierung - und damit evtl. auch bessere Wirkamkeit denkbar. Ebenso sprachen sie verklausuliert davon, dass man es mit anderen Verabreichungsformen versuchen könnte (z.B. Spray?). Eine weitere Möglichkeit die Ergebnisse zu verbessern ist die Beschränkung auf eine bestimmte Population (s. Biomarker etc.) Mehrmals betonten sie zudem, dass wegen wettbewerbstechnischen Gründen nicht alle Daten veröffentlichst werden - wohl aber den mögliche Partnern zur Verfügung stehen. Aber insgesamt ist und bleibt das Ganze für mich ein Zusatzjoker - wenn auch ein ziemlich großer.
Nach wie vor ist Array für mich die attraktivste Aktie im ganzen Biotechsektor. Wenn ich irgendwas mit Array vergleiche, dürfte ich es eigentlich gar nicht kaufen...
http://seekingalpha.com/article/1565582-array-biopharma-inc-…
ENTA fine ich auch interessant. Im Biotech Value Board wird da recht viel zu gepostet. Tenor dort:
-Zulassung wahrscheinlich, zumindest wirds kaum an der Effektivität scheitern.
-Das Novartis Program wird wohl nicht weiter verfolgt.
-Milestones würden bei Zulassung schon den Wert der Aktie decken.
Scheint mir die günstigste Aktie mit einem Medikament mit Breakthrough-Status zu sein. Die Royalties sind gut.
Übersicht zum Breakthroughstatus:
http://orphandruganaut.wordpress.com/2013/05/20/fda-breakthr…
Antwort auf Beitrag Nr.: 45.117.381 von kmastra am 25.07.13 22:25:22Den CC habe ich mir nun auch angehört... so schlecht klingt es nicht. Z.B. wurde darauf hingewiesen, dass Singulair mit der Zeit immer weniger wirkt bzw. viele Patienten darüber hinaus weitere Optionen benötigen. Singulair wäre zu Kortison nicht additiv, ARRY-502 + Kortison wahrscheinlich schon.
Es würde zwar einige CRTh2-Konkurrenten geben, aber keiner hätte bisher statistisch signifikante Ergebnisse erzielt (naja, ist die OC000459 PII etwa nicht signifikant?). ARRY-502 wäre den anderen überlegen... man kann es zumindest mal behaupten
CRTh2 wirkt wie gesagt nur bei Th2... für Th2 gibt es offensichtlich aber keinen aussagekräftigen Biomarker. ARRY hat nicht veröffentlicht, mit welchem Biomarker sie die 6,8% erzielt haben. Wenn ich es richtig verstanden habe, so haben sie eine ganze Reihe an Markern getestet... ich hoffe mal, vor und nicht in der Studie, sonst halte ich die Aussagekraft für begrenzt, wenn man sich dann doch nur den besten herauspickt.
Desweiteren wären auch die sekundären Endpunkte klinisch relevant. Z.B. hat vor einiger Zeit REGN für den IL-4Ralpha AK Dupilumab angeblich vielversprechende PII-Ergebnisse veröffentlicht: http://newsroom.regeneron.com/releasedetail.cfm?ReleaseID=76…. Dort war der pimäre Endpunkt die Reduktion von Asthmaanfällen... eine Reduktion von 87% wurde erreicht. Aus den Folien von ARRY geht hervor, dass es in der Placebo-Gruppe 5 Anfälle gab, unter der Behandlung mit ARRY-502 dagegen nur einen... bei gleichem N auch eine Reduktion von 80%.
Letztlich bringt es alles nur etwas, wenn sich ein Partner findet... ARRY wird diese Indikation alleine in keiner Studie mehr testen. An dem Deal kann man dann sehen, wie aussichtsreich ARRY-502 ist.
Gruß
ipollit
Es würde zwar einige CRTh2-Konkurrenten geben, aber keiner hätte bisher statistisch signifikante Ergebnisse erzielt (naja, ist die OC000459 PII etwa nicht signifikant?). ARRY-502 wäre den anderen überlegen... man kann es zumindest mal behaupten

CRTh2 wirkt wie gesagt nur bei Th2... für Th2 gibt es offensichtlich aber keinen aussagekräftigen Biomarker. ARRY hat nicht veröffentlicht, mit welchem Biomarker sie die 6,8% erzielt haben. Wenn ich es richtig verstanden habe, so haben sie eine ganze Reihe an Markern getestet... ich hoffe mal, vor und nicht in der Studie, sonst halte ich die Aussagekraft für begrenzt, wenn man sich dann doch nur den besten herauspickt.
Desweiteren wären auch die sekundären Endpunkte klinisch relevant. Z.B. hat vor einiger Zeit REGN für den IL-4Ralpha AK Dupilumab angeblich vielversprechende PII-Ergebnisse veröffentlicht: http://newsroom.regeneron.com/releasedetail.cfm?ReleaseID=76…. Dort war der pimäre Endpunkt die Reduktion von Asthmaanfällen... eine Reduktion von 87% wurde erreicht. Aus den Folien von ARRY geht hervor, dass es in der Placebo-Gruppe 5 Anfälle gab, unter der Behandlung mit ARRY-502 dagegen nur einen... bei gleichem N auch eine Reduktion von 80%.
Letztlich bringt es alles nur etwas, wenn sich ein Partner findet... ARRY wird diese Indikation alleine in keiner Studie mehr testen. An dem Deal kann man dann sehen, wie aussichtsreich ARRY-502 ist.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.093.103 von SLGramann am 22.07.13 20:24:07STML
"Hat sich eigentlich Hammer mal irgendwann zu denen geäußert?"
ja, hat er:
"STML – They have intriguing AML data although using bacterial toxins has certain issues, immunogenicity in particular."
"I thought their data in AML was pretty good but the main issue is with immunogenecity that prevents long term treatment."
"STML had an impressive fundraising , will take a look at them again."
Es gibt also vielleicht doch einen Haken mit SL-401. Wobei ich mir nicht sicher bin, ob es wirklich ein Haken ist. Wie Joschka Schröder ja schon geschrieben hat, handelt es sich bei den SGEN und IMGN ADC-Toxinen eher um normale Chemotherapeutika. SL-401 ist dagegen ein Immunotoxin http://de.wikipedia.org/wiki/Immuntoxin bestehend aus dem Interleukin IL3 fusioniert mit dem Diphtherietoxin. Dieses wird normalerweise vom Diphtherie-Bakterium gebildet. Wegen des Bakterien-Toxins spricht Hammer von Problemen mit der Immunantwort des Körpers. Der Körper erkennt dieses Gift als fremd und bildet Antikörper, die es eliminieren. Mit der Zeit kann so die Wirkung nachlassen. Allerdings betrifft das mehr oder weniger alle AKs oder ADCs usw.
Die Kombination aus IL und dem Diphtherietoxin ist ein alter Hut. In Kombination mit IL2 war es 1999 das erste zugelassene Immunotoxin Denileukindiftitox bzw. Ontak http://de.wikipedia.org/wiki/Denileukin_Diftitox. Ontak ist nur in Amerika zugelassen und auch nur gegen CTCL.
Meiner Meinung nach würde ein SGEN ADC nicht so gut funktionieren, da die normalen Chemos gegen sich nur langsam teilende Krebsstammzellen nicht richtig wirken.
STML sind auch nicht die einzigen, die an einer IL-3R Therapie arbeiten... u.a. CSL hat auch so etwas:
http://www.csl.com.au/research-development/recent-highlights…
Breakthrough Medicines
In the Breakthrough Medicines program, CSL aims to develop new protein based therapies to address significant unmet medical needs.
Significant progress has been made in the earlier stage recombinant monoclonal antibody (mAb) projects including the Anti-G-CSFR mAb (CSL324) for treating inflammatory conditions caused by an over activity of white blood cells called neutrophils, and also the Anti-IL-3R mAb (CSL362) for treating acute myeloid leukaemia (AML). CSL now has data supporting an AML minimal residual disease (MRD) indication and non-human primate and other studies also support the potentially valuable additional use of CSL362 in treating a serious autoimmune disease. In August 2012 CSL commenced a Phase I study of CSL362 in AML.
AML minimal residual disease ist glaube ich die letzte Stufe vor der Heilung. Der Krebs ist noch nicht besiegt, da ein paar wenige Zellen überlebt haben und früher oder später zu einem Rückfall führen. IL-3R scheint zumindest geeignet zu sein, auch die Krebsstammzellen anzugreifen: "Accumulating evidence supports the role of leukemic stem cells (LSCs) in the high relapse rate of acute myeloid leukemia (AML) patients." http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3601163/
darin auch: "...Currently, a new Phase I clinical trial (NCT01632852) with CSL362, another chimeric anti-CD123 mAb, is recruiting patients with CD123+ AML who are in complete remission, but exhibit a high risk of relapse. Interestingly. CD33 is internalized upon the binding of mAbs, indicating that it is an appropriate target for toxin/chemotherapy conjugated mAb-based therapies. Calicheamicin, an antitumor antibiotic, has been conjugated to a humanized anti-CD33 antibody to produce gemtuzumab ozogamicin (Mylotarg).45,46 Based on its activity and safety profile, Mylotarg was approved in 2000 by the Food and Drug Administration (FDA) for the treatment of CD33+ AML in relapsed patients older than 60 and unfit for conventional chemotherapy.45,49 Mainly because of severe hepatic toxicity that became evident in post-marketing studies,50 the drug was withdrawn from the market in 2010."
Mylotarg ist einer der ersten ADCs, ebenfalls mit einem bakteriellen Toxin, und richtet sich gegen CD33.
Gruß
ipollit
"Hat sich eigentlich Hammer mal irgendwann zu denen geäußert?"
ja, hat er:
"STML – They have intriguing AML data although using bacterial toxins has certain issues, immunogenicity in particular."
"I thought their data in AML was pretty good but the main issue is with immunogenecity that prevents long term treatment."
"STML had an impressive fundraising , will take a look at them again."
Es gibt also vielleicht doch einen Haken mit SL-401. Wobei ich mir nicht sicher bin, ob es wirklich ein Haken ist. Wie Joschka Schröder ja schon geschrieben hat, handelt es sich bei den SGEN und IMGN ADC-Toxinen eher um normale Chemotherapeutika. SL-401 ist dagegen ein Immunotoxin http://de.wikipedia.org/wiki/Immuntoxin bestehend aus dem Interleukin IL3 fusioniert mit dem Diphtherietoxin. Dieses wird normalerweise vom Diphtherie-Bakterium gebildet. Wegen des Bakterien-Toxins spricht Hammer von Problemen mit der Immunantwort des Körpers. Der Körper erkennt dieses Gift als fremd und bildet Antikörper, die es eliminieren. Mit der Zeit kann so die Wirkung nachlassen. Allerdings betrifft das mehr oder weniger alle AKs oder ADCs usw.
Die Kombination aus IL und dem Diphtherietoxin ist ein alter Hut. In Kombination mit IL2 war es 1999 das erste zugelassene Immunotoxin Denileukindiftitox bzw. Ontak http://de.wikipedia.org/wiki/Denileukin_Diftitox. Ontak ist nur in Amerika zugelassen und auch nur gegen CTCL.
Meiner Meinung nach würde ein SGEN ADC nicht so gut funktionieren, da die normalen Chemos gegen sich nur langsam teilende Krebsstammzellen nicht richtig wirken.
STML sind auch nicht die einzigen, die an einer IL-3R Therapie arbeiten... u.a. CSL hat auch so etwas:
http://www.csl.com.au/research-development/recent-highlights…
Breakthrough Medicines
In the Breakthrough Medicines program, CSL aims to develop new protein based therapies to address significant unmet medical needs.
Significant progress has been made in the earlier stage recombinant monoclonal antibody (mAb) projects including the Anti-G-CSFR mAb (CSL324) for treating inflammatory conditions caused by an over activity of white blood cells called neutrophils, and also the Anti-IL-3R mAb (CSL362) for treating acute myeloid leukaemia (AML). CSL now has data supporting an AML minimal residual disease (MRD) indication and non-human primate and other studies also support the potentially valuable additional use of CSL362 in treating a serious autoimmune disease. In August 2012 CSL commenced a Phase I study of CSL362 in AML.
AML minimal residual disease ist glaube ich die letzte Stufe vor der Heilung. Der Krebs ist noch nicht besiegt, da ein paar wenige Zellen überlebt haben und früher oder später zu einem Rückfall führen. IL-3R scheint zumindest geeignet zu sein, auch die Krebsstammzellen anzugreifen: "Accumulating evidence supports the role of leukemic stem cells (LSCs) in the high relapse rate of acute myeloid leukemia (AML) patients." http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3601163/
darin auch: "...Currently, a new Phase I clinical trial (NCT01632852) with CSL362, another chimeric anti-CD123 mAb, is recruiting patients with CD123+ AML who are in complete remission, but exhibit a high risk of relapse. Interestingly. CD33 is internalized upon the binding of mAbs, indicating that it is an appropriate target for toxin/chemotherapy conjugated mAb-based therapies. Calicheamicin, an antitumor antibiotic, has been conjugated to a humanized anti-CD33 antibody to produce gemtuzumab ozogamicin (Mylotarg).45,46 Based on its activity and safety profile, Mylotarg was approved in 2000 by the Food and Drug Administration (FDA) for the treatment of CD33+ AML in relapsed patients older than 60 and unfit for conventional chemotherapy.45,49 Mainly because of severe hepatic toxicity that became evident in post-marketing studies,50 the drug was withdrawn from the market in 2010."
Mylotarg ist einer der ersten ADCs, ebenfalls mit einem bakteriellen Toxin, und richtet sich gegen CD33.
Gruß
ipollit
Ohne Gewähr, aus dem Biotech Value Board:
ENTA—All six phase-3 trials of ABT-450 + ABT-267 + ABT-333 are fully enrolled, according to ABBV’s 2Q13 CC on now.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
ENTA—All six phase-3 trials of ABT-450 + ABT-267 + ABT-333 are fully enrolled, according to ABBV’s 2Q13 CC on now.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Ein Auszug aus der Q & A - Runde des Conference Calls von ABBV. Im ersten Teil der Frage geht es um ENTA's ABT-450...
Jami Rubin with Goldman Sachs.
Jami Rubin - Goldman Sachs
A couple questions for you, Scott – are you there Scott Brun? Great. Okay, so a couple pipeline-related questions. Based on your now Q2 2014 filing timeframe for your all oral Hep C regiment, can you confirm that you are now neck-and-neck with Gilead in this horserace of bringing the all oral regiment to the market? And really most importantly if you could help us to think about what the trajectory might look like, because clearly initially I think people think there’s a lot of low-hanging fruit and how are you and Gilead going to compete in the marketplace? I also think the market assumes that they’re going to get the lion’s share of the market.
And then secondly on ABT-199 the potential registrational trial, can you tell us if the FDA does accept that filing what is the timeframe for bringing ABT-199 to the market? And now since Pharamacyclics’ Exchange A have already filed CLL indication how do you see that marketplace shaking up? It seems that it’s getting somewhat crowded. Thanks a lot.
Scott Brun
Sure thing, Jami. Why don’t I go ahead with the timing and such on the HCV and then I’ll get Rick to talk a little bit about the market potential. So you know, as you said we’re on track for a Q2 ’14 filing. Acknowledging it’s a very tight race we’re feeling very, very good about our position. We’re very pleased with the progress on the program and certainly it is a top priority for us to be able to move as quickly as possible on the filing. But things are going extremely well in that regard.
Rick Gonzalez
Jami, this is Rick. As far as the market launch obviously we’re planning that these two products will launch very close to one another and we do agree there will be a fair amount of pent-up demand so we’re certainly building up all of the assets we need to be in a position to be able to have an aggressive launch and feel good about our ability to be able to compete effectively in this market. You want to go back to the 199 question?
http://seekingalpha.com/article/1576262-abbvie-inc-abbv-ceo-…
Jami Rubin with Goldman Sachs.
Jami Rubin - Goldman Sachs
A couple questions for you, Scott – are you there Scott Brun? Great. Okay, so a couple pipeline-related questions. Based on your now Q2 2014 filing timeframe for your all oral Hep C regiment, can you confirm that you are now neck-and-neck with Gilead in this horserace of bringing the all oral regiment to the market? And really most importantly if you could help us to think about what the trajectory might look like, because clearly initially I think people think there’s a lot of low-hanging fruit and how are you and Gilead going to compete in the marketplace? I also think the market assumes that they’re going to get the lion’s share of the market.
And then secondly on ABT-199 the potential registrational trial, can you tell us if the FDA does accept that filing what is the timeframe for bringing ABT-199 to the market? And now since Pharamacyclics’ Exchange A have already filed CLL indication how do you see that marketplace shaking up? It seems that it’s getting somewhat crowded. Thanks a lot.
Scott Brun
Sure thing, Jami. Why don’t I go ahead with the timing and such on the HCV and then I’ll get Rick to talk a little bit about the market potential. So you know, as you said we’re on track for a Q2 ’14 filing. Acknowledging it’s a very tight race we’re feeling very, very good about our position. We’re very pleased with the progress on the program and certainly it is a top priority for us to be able to move as quickly as possible on the filing. But things are going extremely well in that regard.
Rick Gonzalez
Jami, this is Rick. As far as the market launch obviously we’re planning that these two products will launch very close to one another and we do agree there will be a fair amount of pent-up demand so we’re certainly building up all of the assets we need to be in a position to be able to have an aggressive launch and feel good about our ability to be able to compete effectively in this market. You want to go back to the 199 question?
http://seekingalpha.com/article/1576262-abbvie-inc-abbv-ceo-…
Heute gab es ja auch noch Neuigkeiten von Vertex, die mir ihrer all-oral-Version Probleme haben. Das ist natürlich zunächst mal gut für ENTA. Es sind ja nun schon einige Wettbewerber ausgeschieden bzw. weit zurück gefallen.
http://news.investors.com/technology/072613-665299-gild-stoc…
http://news.investors.com/technology/072613-665299-gild-stoc…
SNTA:
Synta´s Ganetespib mit deutlicher Wirkung bei Brustkrebs als single agent.
http://phx.corporate-ir.net/phoenix.zhtml?c=147988&p=irol-ne…
Wenn sich das bestätigen lässt und die Wirkung in Kombitherapien noch steigt bzw. Ganetespib zur Wirkung bereits vorhandener Therapien additiv ist, könnte sich hier ein sehr breites Anwendungsspektrum eröffnen.
Der heutige Kurssprung ist insofern m.E. nachvollziehbar.
Synta´s Ganetespib mit deutlicher Wirkung bei Brustkrebs als single agent.
http://phx.corporate-ir.net/phoenix.zhtml?c=147988&p=irol-ne…
Wenn sich das bestätigen lässt und die Wirkung in Kombitherapien noch steigt bzw. Ganetespib zur Wirkung bereits vorhandener Therapien additiv ist, könnte sich hier ein sehr breites Anwendungsspektrum eröffnen.
Der heutige Kurssprung ist insofern m.E. nachvollziehbar.
Antwort auf Beitrag Nr.: 45.135.263 von SLGramann am 29.07.13 16:58:41Feuerstein sehr kritisch zu Synta (zwischen den Zeilen kann man einen Betrugsvorwurf herauslesen):
http://www.thestreet.com/story/11992141/1/synta-suffers-from…
http://www.thestreet.com/story/11992141/1/synta-suffers-from…
Feuerstein bringt kaum noch etwas lesenswertes. Unabhängig von seiner Meinung zu SNTA, ist er mir immer öfters als populistischer Krawallmacher aufgefallen, eher im Stil eines Jim Cramer. Er beschäftigt sich u.a. recht gerne mit Werten, die nicht gerade in sind oder offensichtliche Schwächen haben, um diese dann nieder zu machen. Etwas Hintergründiges oder neue Gesichtspunkte finden sich dabei so gut wie nie...
Sein CLDX-Artikel trägt den Titel "Celldex Might Be The Next Alexion? Buy Buy Buy!!"... kann man so jemanden noch ernst nehmen?
Gruß
ipollit
Sein CLDX-Artikel trägt den Titel "Celldex Might Be The Next Alexion? Buy Buy Buy!!"... kann man so jemanden noch ernst nehmen?
Gruß
ipollit
30.07.2013 - 04:27 | Quelle: dpa-AFX Analysen
CAMBRIDGE (MASSACHUSETTS) (dpa-AFX) - Array BioPharma Inc. (ARRY) rose more than 8% to $6.79 in after-hours on Monday after it announced a strategic global R&D collaboration with Celgene Corp. (CELG). Under the terms of the agreement, Array will receive an up-front payment of $11 million and Celgene will have an exclusive option to license multiple clinical development candidates. Array is entitled to receive potential milestone payments of up to $376 million based upon achieving certain development, regulatory and sales objectives. Array is also entitled to receive royalties on net sales of all drugs and will retain all rights to the program if Celgene does not exercise its option.
CAMBRIDGE (MASSACHUSETTS) (dpa-AFX) - Array BioPharma Inc. (ARRY) rose more than 8% to $6.79 in after-hours on Monday after it announced a strategic global R&D collaboration with Celgene Corp. (CELG). Under the terms of the agreement, Array will receive an up-front payment of $11 million and Celgene will have an exclusive option to license multiple clinical development candidates. Array is entitled to receive potential milestone payments of up to $376 million based upon achieving certain development, regulatory and sales objectives. Array is also entitled to receive royalties on net sales of all drugs and will retain all rights to the program if Celgene does not exercise its option.
wow... CBST schlägt direkt doppelt zu und kauft die Antibiotika-Konkurrenten OPTR für 801 Mio USD (10,75 + 5 USD) und TSRX für 818 Mio USD (13,5 USD)...



Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.146.649 von ipollit am 30.07.13 23:06:22Von TSRX habe ich nun nach ENTA umgeschichtet... mal schauen, mittelfristig ist es meiner Meinung nach auch ein Übernahme-Kandidat.

Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.154.855 von ipollit am 31.07.13 19:27:59Zufälle gibts - habe heute auch ENTA gekauft. Mein Depot zur Zeit:
LGND - Vor allem wegen der Royalties von Promacta und Kyprolis aber auch der riesigen Pipeline an voll verpartnerten Programmen (85).

ARRY - Da gibt es mindestens 4 gute Gründe und noch viele weitere. Wird hier ja ausführlich besprochen. Für mich klar unterbewertet.

ASTX - Vor allem wegen der Aussichten von SG110 aber auch ansonsten hat die Pipeline noch einiges mehr zu bieten.

FURX - Bekommt Royalties für Nesina und Priligy. Nesina ist in Jp am wachsen, in den USA grad zugelassen und hat in der EU die Empfehlung zur Zulassung bekommen. Wird von Takeda vermarktet. Furiex ist noch recht unbekannt.

ENTA - Ich gehe davon aus, dass der HEp C Markt bald von Gilead dominiert wird und Abbvie aber dennoch ein kleines Stück vom großen Kuchen abbekommt. Zudem scheint der Wert tatsächlich total unbekannt zu sein, was sich spätestens im nächsten Jahr ändern sollte.

Paion - Kleine Restposition, die ich abgeltungssteuerfrei halte und einfach auf gute Ergebnisse von Remimazolam - verpartnert an Ono hoffe.

Valneva - Das ist nur eine Tradingposition. Hier ist eine Kapitalerhöhung in Kombination mit einem Zusammenschluss aus Intercell und Vivalis gründlich daneben gegangen. Ich sehe aber nicht, dass deswegen die neue Firma nur noch halb so viel Wert ist wie vorher.

SG kmastra
LGND - Vor allem wegen der Royalties von Promacta und Kyprolis aber auch der riesigen Pipeline an voll verpartnerten Programmen (85).
ARRY - Da gibt es mindestens 4 gute Gründe und noch viele weitere. Wird hier ja ausführlich besprochen. Für mich klar unterbewertet.
ASTX - Vor allem wegen der Aussichten von SG110 aber auch ansonsten hat die Pipeline noch einiges mehr zu bieten.
FURX - Bekommt Royalties für Nesina und Priligy. Nesina ist in Jp am wachsen, in den USA grad zugelassen und hat in der EU die Empfehlung zur Zulassung bekommen. Wird von Takeda vermarktet. Furiex ist noch recht unbekannt.
ENTA - Ich gehe davon aus, dass der HEp C Markt bald von Gilead dominiert wird und Abbvie aber dennoch ein kleines Stück vom großen Kuchen abbekommt. Zudem scheint der Wert tatsächlich total unbekannt zu sein, was sich spätestens im nächsten Jahr ändern sollte.
Paion - Kleine Restposition, die ich abgeltungssteuerfrei halte und einfach auf gute Ergebnisse von Remimazolam - verpartnert an Ono hoffe.
Valneva - Das ist nur eine Tradingposition. Hier ist eine Kapitalerhöhung in Kombination mit einem Zusammenschluss aus Intercell und Vivalis gründlich daneben gegangen. Ich sehe aber nicht, dass deswegen die neue Firma nur noch halb so viel Wert ist wie vorher.
SG kmastra
INCY
entwickelt sich momentan ganz gut... hinter CLDX, PCYC und ARRY ist es meine viertgrößte Position.

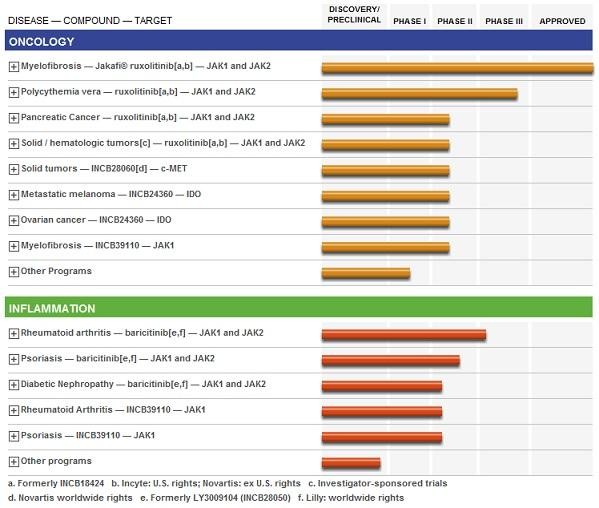
three updates JAK1 inhibitor INCB39110 by YE:
- Psoriasis PII (oral presentation at EADV in Oct 2-6)... Daten sollen laut INCY positiv sein
- RA (ACR in Nov 25-30)
- Myelofibrosis (ASH in Dec 7-10)
- zweiter JAK1 INCB47986 in PI gegen Krebsindikationen, sowie weitere JAK-Hemmer in der Präklinik
- für 2013 sollen die Jakafi-Umsätze bei 220 bis 230 Mio USD liegen. Nächstes Jahr könnte die FDA einen OS-Vorteil dem Label von Jakafi hizufügen, wobei dies noch unsicher ist. Ein belegter Überlebensvorteil dürfte aber sehr positiv sein.
- Jakafi PII-Ergebnisse in Kombi mit Xeloda gegen 2nd-line Bauchspeicheldrüsenkrebs sollen in diesem Quartal (3Q13) kommen, wobei der Ausgang sehr ungewiss ist. In einem Erfolgsfall (signifikanter Überlebensvorteil von mindestens +20%) könnten die Peak Sales (WW) eventuell bei 500 Mio USD liegen.
- neu ist ein pi3k-delta INCB040093 in PI in Kombination mit Rituxan
Gruß
ipollit
entwickelt sich momentan ganz gut... hinter CLDX, PCYC und ARRY ist es meine viertgrößte Position.


three updates JAK1 inhibitor INCB39110 by YE:
- Psoriasis PII (oral presentation at EADV in Oct 2-6)... Daten sollen laut INCY positiv sein
- RA (ACR in Nov 25-30)
- Myelofibrosis (ASH in Dec 7-10)
- zweiter JAK1 INCB47986 in PI gegen Krebsindikationen, sowie weitere JAK-Hemmer in der Präklinik
- für 2013 sollen die Jakafi-Umsätze bei 220 bis 230 Mio USD liegen. Nächstes Jahr könnte die FDA einen OS-Vorteil dem Label von Jakafi hizufügen, wobei dies noch unsicher ist. Ein belegter Überlebensvorteil dürfte aber sehr positiv sein.
- Jakafi PII-Ergebnisse in Kombi mit Xeloda gegen 2nd-line Bauchspeicheldrüsenkrebs sollen in diesem Quartal (3Q13) kommen, wobei der Ausgang sehr ungewiss ist. In einem Erfolgsfall (signifikanter Überlebensvorteil von mindestens +20%) könnten die Peak Sales (WW) eventuell bei 500 Mio USD liegen.
- neu ist ein pi3k-delta INCB040093 in PI in Kombination mit Rituxan
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.155.393 von kmastra am 31.07.13 20:32:54Hallo kmastra, schöne Werte!
Besonders FURX finde ich spannend. Trotz der Anstiegs scheinen die mir nach unten durch Alogliptin einigermaßen abgesichert zu sein. Für den Wirkstoff waren ursprünglich Milliardenumsätze geschätzt worden. Weil man nun zu spät am Markt ist, werden es vielleicht "nur" 700 Mio., aber bei ca. 8% Royalties ist das nicht zu verachten.
Was aber hältst Du von Eluxadoline? Zulassungswahrscheinlichkeit? Umsatzpotential? Konkurrenz?
Vielen Dank!
Gruß
SLG
Besonders FURX finde ich spannend. Trotz der Anstiegs scheinen die mir nach unten durch Alogliptin einigermaßen abgesichert zu sein. Für den Wirkstoff waren ursprünglich Milliardenumsätze geschätzt worden. Weil man nun zu spät am Markt ist, werden es vielleicht "nur" 700 Mio., aber bei ca. 8% Royalties ist das nicht zu verachten.
Was aber hältst Du von Eluxadoline? Zulassungswahrscheinlichkeit? Umsatzpotential? Konkurrenz?
Vielen Dank!
Gruß
SLG
Hallo SLGramann,
was Furiex betrifft ist die Lage etwas unübersichtlich. So wie ich das verstehe gehört Nesina zu einer Wirkstoffklasse, die in Verdacht steht Bauchspeicheldrüsenkrebs zu begünstigen. Wegen dieser Befürchtung gingen die Umsätze von z.B. Januvia (Merck) zurück. Zuletzt gab es wieder die Meinung, dass diese Medikamente sicher sind.
http://www.fiercepharma.com/story/fda-clears-mercks-januvia-…
Ich sehe es aber auch genauso wie du, dass Furiex erstmal nach unten abgesichert ist. Umsätze von 500 Mio dürften drin sein. Die Wachstumsaussichten sind nicht schlecht, da grad die Vermarktung in den USa beginnt und in der EU die Zulassung empfohlen wurde.
Eluxadoline: Hier werden Anfang 2014 PIII Ergebnisse erwartet. Davon hängt jetzt ersmal alles weitere ab. Einige Details findest du in der letzten Präsentation:
http://files.shareholder.com/downloads/ABEA-4H9PM3/255064830…
Bei den Aussichten von Nesina und ggf. einem Erfolg der P III von Eluxadoline finde ich Furiex chancenreich bewertet. Zumal der Wert ähnlich wie ENTA recht unbekann ist.
SG kmastra
was Furiex betrifft ist die Lage etwas unübersichtlich. So wie ich das verstehe gehört Nesina zu einer Wirkstoffklasse, die in Verdacht steht Bauchspeicheldrüsenkrebs zu begünstigen. Wegen dieser Befürchtung gingen die Umsätze von z.B. Januvia (Merck) zurück. Zuletzt gab es wieder die Meinung, dass diese Medikamente sicher sind.
http://www.fiercepharma.com/story/fda-clears-mercks-januvia-…
Ich sehe es aber auch genauso wie du, dass Furiex erstmal nach unten abgesichert ist. Umsätze von 500 Mio dürften drin sein. Die Wachstumsaussichten sind nicht schlecht, da grad die Vermarktung in den USa beginnt und in der EU die Zulassung empfohlen wurde.
Eluxadoline: Hier werden Anfang 2014 PIII Ergebnisse erwartet. Davon hängt jetzt ersmal alles weitere ab. Einige Details findest du in der letzten Präsentation:
http://files.shareholder.com/downloads/ABEA-4H9PM3/255064830…
Bei den Aussichten von Nesina und ggf. einem Erfolg der P III von Eluxadoline finde ich Furiex chancenreich bewertet. Zumal der Wert ähnlich wie ENTA recht unbekann ist.
SG kmastra
Antwort auf Beitrag Nr.: 45.179.361 von kmastra am 04.08.13 23:44:40Danke!
Laut der Präsentation gibt es für IBS-D nur ein von der FDA zugelassenes Produkt, das, vermute ich, heutzutage die Zulassung nie und nimmer erhalten würde.
In diesem Artikel steht auch etwas zu Preis und Umsatz:
http://www.nytimes.com/2002/06/08/us/us-lets-drug-tied-to-de…
Vielleicht wäre es sinnvoll, heute einen Preis von 200 bis 300 Dollar / Monat zu unterstellen.
Das Marktpotential könnte also durchaus im Bereich von mehreren hundert Millionen Dollar liegen (ich würde erst mal mit 200 Mio. "kalkulieren", falls alles glatt geht), allerdings auch nur dann, wenn man mit einem Big Pharma mit schlagkräftigem Vertrieb verpartnert. Schwer zu sagen, was dann bei Furiex hängenbleibt.
Alles in allem fällt es zwar schwer, in Bezug auf Eluxadolime in Euphorie zu geraten, aber das Chance/Risiko-Verhältnis scheint mir bei Furiex doch sehr günstig zu sein. Allerdings gehe ich dabei davon aus, dass Nesina seinen Weg machen wird. (Ich habe verfolgt, wie gut sich Onglyza bei Bristol entwickelt hat, trotz riesiger Konkurrenz. Der Diabetes-Markt ist einfach so groß, dass es da Platz für mehrere gleiche Wirkstoffe gibt, wenn nur eine gewisse Vertriebspower vorhanden ist, die Takeda aber hat - vor allem in Japan). Gut möglich, dass wir mit Schätzungen von 500 oder 700 Mio. für Nesina deutlich zu vorsichtig sind.
Gruß
SLG
Laut der Präsentation gibt es für IBS-D nur ein von der FDA zugelassenes Produkt, das, vermute ich, heutzutage die Zulassung nie und nimmer erhalten würde.
In diesem Artikel steht auch etwas zu Preis und Umsatz:
http://www.nytimes.com/2002/06/08/us/us-lets-drug-tied-to-de…
Vielleicht wäre es sinnvoll, heute einen Preis von 200 bis 300 Dollar / Monat zu unterstellen.
Das Marktpotential könnte also durchaus im Bereich von mehreren hundert Millionen Dollar liegen (ich würde erst mal mit 200 Mio. "kalkulieren", falls alles glatt geht), allerdings auch nur dann, wenn man mit einem Big Pharma mit schlagkräftigem Vertrieb verpartnert. Schwer zu sagen, was dann bei Furiex hängenbleibt.
Alles in allem fällt es zwar schwer, in Bezug auf Eluxadolime in Euphorie zu geraten, aber das Chance/Risiko-Verhältnis scheint mir bei Furiex doch sehr günstig zu sein. Allerdings gehe ich dabei davon aus, dass Nesina seinen Weg machen wird. (Ich habe verfolgt, wie gut sich Onglyza bei Bristol entwickelt hat, trotz riesiger Konkurrenz. Der Diabetes-Markt ist einfach so groß, dass es da Platz für mehrere gleiche Wirkstoffe gibt, wenn nur eine gewisse Vertriebspower vorhanden ist, die Takeda aber hat - vor allem in Japan). Gut möglich, dass wir mit Schätzungen von 500 oder 700 Mio. für Nesina deutlich zu vorsichtig sind.
Gruß
SLG
Ja. An der Vertriebspower wird es nicht liegen. Das ist für mich auch ein ganz wichtiger Faktor. Takeda hatte ja bis vor kurzem mit Actos einen Blockbuster im Bereich Diabetis auch erfolgreich in den USA vermarktet. Das Problem sind halt die Sicherheitsbedenken. Takeda hat die Zulassung für Nesina ja nur mit der Auflage umfangreicher weiterer Studien bekommen.
Was mich etwas nachdenklich stimmt ist, dass das Wachstum in Japan im letzten Quartal quasi nicht mehr vorhanden war. Auch das könnte mit der Diskussion um die Sicherheit zusammenhängen. Zuletzt gab es da ja aber eine positive Meinung zu.
http://www.japantimes.co.jp/news/2013/04/29/national/takeda-…
http://www.fiercebiotech.com/story/takeda-grabs-long-awaited…
http://www.takeda.com/investor-information/results/
Was mich etwas nachdenklich stimmt ist, dass das Wachstum in Japan im letzten Quartal quasi nicht mehr vorhanden war. Auch das könnte mit der Diskussion um die Sicherheit zusammenhängen. Zuletzt gab es da ja aber eine positive Meinung zu.
http://www.japantimes.co.jp/news/2013/04/29/national/takeda-…
http://www.fiercebiotech.com/story/takeda-grabs-long-awaited…
http://www.takeda.com/investor-information/results/
Nochmal was zu Furiex und Nesina. Kann sein, dass wir mit unseren Erwartungen in der Tat zu konservativ waren.

http://www.firstwordpharma.com/node/1128674#axzz2b4nLGHM4

http://www.firstwordpharma.com/node/1128674#axzz2b4nLGHM4
Zitat von ipollit: STML
"Hat sich eigentlich Hammer mal irgendwann zu denen geäußert?"
ja, hat er:
"STML – They have intriguing AML data although using bacterial toxins has certain issues, immunogenicity in particular."
"I thought their data in AML was pretty good but the main issue is with immunogenecity that prevents long term treatment."
"STML had an impressive fundraising , will take a look at them again."
Wegen des Bakterien-Toxins spricht Hammer von Problemen mit der Immunantwort des Körpers. Der Körper erkennt dieses Gift als fremd und bildet Antikörper, die es eliminieren.
Da hat Hammer recht.
Zitat von ipollit: Mit der Zeit kann so die Wirkung nachlassen. Allerdings betrifft das mehr oder weniger alle AKs oder ADCs usw.
Bei vollständig humanen Antikörpern und ADC´s (mit geeignetem Toxin) sind da eigentlich keine Probleme zu erwarten.
Zitat von ipollit: Meiner Meinung nach würde ein SGEN ADC nicht so gut funktionieren, da die normalen Chemos gegen sich nur langsam teilende Krebsstammzellen nicht richtig wirken.
Mittlerweile sind Toxine in Entwicklung, die direkt an der Zell-DNA angreifen. Damit ließen sich auch langsam teilende Zellen erwischen. Diese neuartigen Toxine haben zudem noch einige andere Vorteile.
Antwort auf Beitrag Nr.: 45.228.553 von Joschka Schröder am 12.08.13 09:43:48Wegen des Bakterien-Toxins spricht Hammer von Problemen mit der Immunantwort des Körpers. Der Körper erkennt dieses Gift als fremd und bildet Antikörper, die es eliminieren.
Da hat Hammer recht.
Welcher Zeitraum wäre denn da theoretisch zu erwarten, bis der Körper seine AK-Antwort aufgebaut hat? 3 Monate? Oder viel kürzer?
Da hat Hammer recht.
Welcher Zeitraum wäre denn da theoretisch zu erwarten, bis der Körper seine AK-Antwort aufgebaut hat? 3 Monate? Oder viel kürzer?
Antwort auf Beitrag Nr.: 45.228.895 von SLGramann am 12.08.13 10:26:58Die Antikörperbildung dürfte gleich nach der ersten Gabe einsetzen (wie bei einer aktiven Impfung). Wann der AK-Titer letztlich so hoch ist, dass die Wirkung des ADC maßgeblich neutralisiert wird, läßt sich nicht ohne weiteres voraussagen. Das hängt neben dem Dosis-Schema von vielen individuellen Faktoren ab.
hab mal eine allgemeine frage, wie ihr biotechaktien handelt. der Sektor ist zweifelsfrei einer der leader nach der Finanzkrise. ich selbst habe seit 2009 meine größten gewinne am Aktienmarkt im biotech und healthcarebereich eingefahren. aber trotzdem gibt's speziell hier ein großes Problem, nämlich das der fda Zulassungen mit den Konsequenz, dass riesige gaps im chartbild entstehen, auf die man nicht reagieren kann, da die fda-entscheidungen ja nachbörslich veröffentlicht werden.
jetzt mal meine fragen:
verkauft ihr eure Positionen, wenn eine fda-entscheidung anfällt oder nehmt ihr das Risiko in kauf?
werden diese fda-entscheidungen an einem vorher festgelegten Datum veröffentlicht, oder erfolgen diese Meldung spontan und unangekündigt?
gibt es im Internet Webseiten, die zukünftige fda-entscheidungen z.b als Kalender auflisten, dass man sich zumindest ungefähr darauf einstellen kann, wann diese Entscheidungen fallen?
jetzt mal meine fragen:
verkauft ihr eure Positionen, wenn eine fda-entscheidung anfällt oder nehmt ihr das Risiko in kauf?
werden diese fda-entscheidungen an einem vorher festgelegten Datum veröffentlicht, oder erfolgen diese Meldung spontan und unangekündigt?
gibt es im Internet Webseiten, die zukünftige fda-entscheidungen z.b als Kalender auflisten, dass man sich zumindest ungefähr darauf einstellen kann, wann diese Entscheidungen fallen?
Hi also so Kalender gibt's viele z.B. http://www.fdatracker.com/pdufa-calendar/
Ich persönlich habe 2 Entscheidungen der Fda mit gemacht und bei einer voll abgeloost. Ich finde ob man verkauft oder nicht hängt immer an den Chancen des Produktes wie man das für sich selbst bewertet. Risikoloser ist es natürlich vorher zu verkaufen. Als Beispiel ACAD da konntest du auch nach der Zulassung deinen Schnitt noch machen.
Grüße
Ich persönlich habe 2 Entscheidungen der Fda mit gemacht und bei einer voll abgeloost. Ich finde ob man verkauft oder nicht hängt immer an den Chancen des Produktes wie man das für sich selbst bewertet. Risikoloser ist es natürlich vorher zu verkaufen. Als Beispiel ACAD da konntest du auch nach der Zulassung deinen Schnitt noch machen.
Grüße
Antwort auf Beitrag Nr.: 45.257.647 von Steel21x am 15.08.13 14:25:27danke für die info. allerdings sind diese Kalender mit Vorsicht zu genießen.
z.b. melden viele biotechfirmen Ergebnisse im "2. Halbjahr". in den Kalendern steht dann das Datum 31.12, weils der letzte tag der frist ist.
das tatsächliche Ergebnis kann aber schon viel früher kommen. ich habe mal die probe gemacht und die Kalender z.b. auf die celsion Entscheidung am 31.janaur hin überprüft. da war aber kein hinweis zu finden.
also leider nichts konkretes. ich werde in Sachen biotechs die schon anfang des jahres hier im thread erwähnte Feuerstein rule anwenden, also keine biotechs unter einer Milliarde marktkapitalisierung.
ist zwar auch kein Allheilmittel, aber das Risiko wird dadurch minimiert.
z.b. melden viele biotechfirmen Ergebnisse im "2. Halbjahr". in den Kalendern steht dann das Datum 31.12, weils der letzte tag der frist ist.
das tatsächliche Ergebnis kann aber schon viel früher kommen. ich habe mal die probe gemacht und die Kalender z.b. auf die celsion Entscheidung am 31.janaur hin überprüft. da war aber kein hinweis zu finden.
also leider nichts konkretes. ich werde in Sachen biotechs die schon anfang des jahres hier im thread erwähnte Feuerstein rule anwenden, also keine biotechs unter einer Milliarde marktkapitalisierung.
ist zwar auch kein Allheilmittel, aber das Risiko wird dadurch minimiert.
Antwort auf Beitrag Nr.: 45.257.029 von steven_trader am 15.08.13 13:15:35Deine Fragen hören sich danach an, dass du FDA-Entscheidungen als einen wesentlichen Punkt für den Kurs ansiehst. Meiner Meinung nach stimmt es zwar, dass die Entscheidung einer Marktzulassung einen deutlichen Einfluss auf den Kurs haben kann, aber es ist nicht das wesentliche. Eine Zulassung bedeutet nicht immer einen Kursgewinn. Wenn die Zulassung wahrscheinlich ist und erwartet wird, dann bleibt der Kurs bestenfalls unverändert... oft gibt er dann aber unmittelbar und in der Zeit danach erstmal deutlich nach. Kommt keine Zulassung, die zuvor bereits schon eingepreist war, gehts noch deutlicher nach unten. D.h. bei einer wahrscheinlichen Zulassung ist garnicht viel zu holen. Ist andersherum die Zulassung unsicher, so springt der Kurs im Erfolgsfall nach oben. Aber die Wahrscheinlichkeit ist eben auch hoch, dass es nicht zur Zulassung kommt.
Beides spricht vielleicht eher dafür, zu verkaufen, falls eine FDA-Entscheidung ansteht. Daneben gibt es aber auch ab und zu Studienergebnisse und zu jeder Zeit ein mögliches Problem mit den Studien... du kannst dir nie sicher sein, dass nicht morgen eine Aktie stark abstürzt. So gesehen besteht das Risiko also nicht nur bei der Zulassungsentscheidung (die zudem nicht genau terminiert ist, sondern sowohl vor als auch nach dem PDUFA-Tag kommen kann) sondern zu jeder Zeit. Vor der FDA-Entscheidung gibt es oft auch ein Experten-Panel, das sich für oder gegen eine Zulassung aussprechen kann. Vor diesem Panel werden die FDA-Dokumente veröffentlicht, die kritische Fragen beinhalten... auf beides reagiert der Kurs genauso wie auf die Zulassung selber.
Für mich heißt das, ich halte eigentlich immer, wenn ich davon ausgehe, dass die Ergebnisse die Markterwartungen erfüllen oder übertreffen können, unabhängig von konkreten Terminen wie Studiendaten oder Entscheidungen. Allerdings halte ich immer nur kleinere Positionen zwischen 1% und 15% meines Depots... also ca. 20 bis 30 Positionen. Sollten eine oder mehrere crashen, so sind die Auswirkungen begrenzt. Es muss nur in Summe mehr erfolgreich sein als fehlschlagen... alles andere ist für mich zu riskant.
Gruß
ipollit
Beides spricht vielleicht eher dafür, zu verkaufen, falls eine FDA-Entscheidung ansteht. Daneben gibt es aber auch ab und zu Studienergebnisse und zu jeder Zeit ein mögliches Problem mit den Studien... du kannst dir nie sicher sein, dass nicht morgen eine Aktie stark abstürzt. So gesehen besteht das Risiko also nicht nur bei der Zulassungsentscheidung (die zudem nicht genau terminiert ist, sondern sowohl vor als auch nach dem PDUFA-Tag kommen kann) sondern zu jeder Zeit. Vor der FDA-Entscheidung gibt es oft auch ein Experten-Panel, das sich für oder gegen eine Zulassung aussprechen kann. Vor diesem Panel werden die FDA-Dokumente veröffentlicht, die kritische Fragen beinhalten... auf beides reagiert der Kurs genauso wie auf die Zulassung selber.
Für mich heißt das, ich halte eigentlich immer, wenn ich davon ausgehe, dass die Ergebnisse die Markterwartungen erfüllen oder übertreffen können, unabhängig von konkreten Terminen wie Studiendaten oder Entscheidungen. Allerdings halte ich immer nur kleinere Positionen zwischen 1% und 15% meines Depots... also ca. 20 bis 30 Positionen. Sollten eine oder mehrere crashen, so sind die Auswirkungen begrenzt. Es muss nur in Summe mehr erfolgreich sein als fehlschlagen... alles andere ist für mich zu riskant.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.228.895 von SLGramann am 12.08.13 10:26:58Es entstehen Auto-AKs gegen SL-401... wie gravierend das ist, kann ich allerdings nicht beurteilen. In dem ASCO-Poster zu BPDCN sind Levels am 1. und 15. Tag angegeben. Der Patient mit dem höchsten Auto-AK Level hat dabei allerdings auch den deutlichsten CR.
http://www.stemline.com/ScientifcPresDownloads/SL-401_ASCO%2…
"In 2000, we fused DNA encoding diphtheria toxin (DT) amino acid residues 1-388, a Met-His linker, and human interleukin 3 (IL3), transformed E. coli, induced expression with IPTG, and purified DT388IL3 designated SL-401 from inclusion bodies by denaturation, refolding, anion exchange chromatography and size exclusion chromatography (Frankel, Protein Eng 13, 575, 2000; Figure 1)."
Hier ist etwas zu Ontak, das quasi dasselbe wie SL-401 ist, nur IL-2 statt IL-3a...
http://dailymed.nlm.nih.gov/dailymed/archives/fdaDrugInfo.cf…
In Study 1 [see Clinical Studies (14.1)], of 95 patients treated with denileukin diftitox, 66% tested positive for antibodies at baseline probably due to a prior exposure to diphtheria toxin or its vaccine. After 1, 2, and 3 courses of treatment, 94%, 99%, and 100% of patients tested positive, respectively. Mean titers of anti-denileukin diftitox antibodies were similarly increased in the 9 and 18 mcg/kg/day dose groups after 2 courses of treatment. Meanwhile, pharmacokinetic parameters decreased substantially (Cmax~57%, AUC~80%), and clearance increased 2- to 8- fold.
In Study 2 [see Clinical Studies (14.2)], 131 patients were assessed for binding antibodies. Of these, 51 patients (39%) had antibodies at baseline. Seventy-six percent of patients tested positive after 1 course of treatment and 97% after 3 courses of treatment. Neutralizing antibodies were assessed in 60 patients; 45%, 73%, and 97% had evidence of inhibited functional activity in the cellular assay at baseline and after 1 and 3 courses of treatment, respectively.
Gruß
ipollit
http://www.stemline.com/ScientifcPresDownloads/SL-401_ASCO%2…

"In 2000, we fused DNA encoding diphtheria toxin (DT) amino acid residues 1-388, a Met-His linker, and human interleukin 3 (IL3), transformed E. coli, induced expression with IPTG, and purified DT388IL3 designated SL-401 from inclusion bodies by denaturation, refolding, anion exchange chromatography and size exclusion chromatography (Frankel, Protein Eng 13, 575, 2000; Figure 1)."
Hier ist etwas zu Ontak, das quasi dasselbe wie SL-401 ist, nur IL-2 statt IL-3a...
http://dailymed.nlm.nih.gov/dailymed/archives/fdaDrugInfo.cf…
In Study 1 [see Clinical Studies (14.1)], of 95 patients treated with denileukin diftitox, 66% tested positive for antibodies at baseline probably due to a prior exposure to diphtheria toxin or its vaccine. After 1, 2, and 3 courses of treatment, 94%, 99%, and 100% of patients tested positive, respectively. Mean titers of anti-denileukin diftitox antibodies were similarly increased in the 9 and 18 mcg/kg/day dose groups after 2 courses of treatment. Meanwhile, pharmacokinetic parameters decreased substantially (Cmax~57%, AUC~80%), and clearance increased 2- to 8- fold.
In Study 2 [see Clinical Studies (14.2)], 131 patients were assessed for binding antibodies. Of these, 51 patients (39%) had antibodies at baseline. Seventy-six percent of patients tested positive after 1 course of treatment and 97% after 3 courses of treatment. Neutralizing antibodies were assessed in 60 patients; 45%, 73%, and 97% had evidence of inhibited functional activity in the cellular assay at baseline and after 1 and 3 courses of treatment, respectively.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.271.051 von ipollit am 17.08.13 17:42:58danke für den kommentar. ich halte aber maximal 6 Positionen im Depot, 25 -30% depotwert pro position. als Absicherung dafür enge stop-orders. ein gap nach unten über 40% kann da fatal sein, weil der stop nichts mehr nutzt. deshalb kaufe ich nur sehr ungern biotechs. das Problem lässt sich wohl leider nicht so einfach lösen außer die positonsgröße massiv zu verkleinern.
ONXX
am Ende gab es keine Übernahmeschlacht... AMGN kommt für 125 USD Cash zum Zug. Zuletzt war der Kurs eher etwas höher gewesen, mehr war dann wohl doch nicht drin.

http://finance.yahoo.com/news/amgen-buy-onyx-more-10-2207440…
Amgen to buy Onyx for more than $10 billion
(Reuters) - Amgen Inc (AMGN) struck a deal to buy Onyx Pharmaceuticals Inc (ONXX) for more than $10 billion on Sunday, ending a two- month-long auction for the cancer drug maker.
Amgen said it will pay $125 per share for Onyx, a 4.2 percent increase from the $120 a share it offered in June. Onyx said that bid significantly undervalued the company and put itself up for sale.
The acquisition represents the fifth-largest biotechnology deal in history and gives Amgen full rights to Kyprolis, the new multiple myeloma drug that analysts expect to reach annual peak sales in excess of $2 billion.
Amgen will also gain a revenue stream from the liver and kidney cancer drug Nexavar that Onyx shares with Bayer AG (BAYN.DE), as well as royalty payments on Bayer's much newer colon cancer drug, Stivarga, and potential future royalties on an experimental breast cancer drug being developed by Pfizer Inc (PFE).
It is Amgen's biggest deal since its $16 billion acquisition of Immunex in 2001 that gave it the rheumatoid arthritis drug Enbrel, which is one of Amgen's biggest-selling products.
It is also by far the biggest deal under CEO Bob Bradway, who assumed the top spot in May 2012. He has done a handful of much smaller deals, the biggest to date being a $1.16 billion acquisition of Micromet.
Onyx shares closed at $116.96 on Friday.
Gruß
ipollit
am Ende gab es keine Übernahmeschlacht... AMGN kommt für 125 USD Cash zum Zug. Zuletzt war der Kurs eher etwas höher gewesen, mehr war dann wohl doch nicht drin.
http://finance.yahoo.com/news/amgen-buy-onyx-more-10-2207440…
Amgen to buy Onyx for more than $10 billion
(Reuters) - Amgen Inc (AMGN) struck a deal to buy Onyx Pharmaceuticals Inc (ONXX) for more than $10 billion on Sunday, ending a two- month-long auction for the cancer drug maker.
Amgen said it will pay $125 per share for Onyx, a 4.2 percent increase from the $120 a share it offered in June. Onyx said that bid significantly undervalued the company and put itself up for sale.
The acquisition represents the fifth-largest biotechnology deal in history and gives Amgen full rights to Kyprolis, the new multiple myeloma drug that analysts expect to reach annual peak sales in excess of $2 billion.
Amgen will also gain a revenue stream from the liver and kidney cancer drug Nexavar that Onyx shares with Bayer AG (BAYN.DE), as well as royalty payments on Bayer's much newer colon cancer drug, Stivarga, and potential future royalties on an experimental breast cancer drug being developed by Pfizer Inc (PFE).
It is Amgen's biggest deal since its $16 billion acquisition of Immunex in 2001 that gave it the rheumatoid arthritis drug Enbrel, which is one of Amgen's biggest-selling products.
It is also by far the biggest deal under CEO Bob Bradway, who assumed the top spot in May 2012. He has done a handful of much smaller deals, the biggest to date being a $1.16 billion acquisition of Micromet.
Onyx shares closed at $116.96 on Friday.
Gruß
ipollit
Ganz frische News, falls es wen interessiert (vorbörslich +60% !!):
Catalyst Pharmaceutical Partners Receives Breakthrough Therapy Designation From FDA for Firdapse(TM) for the Treatment of LEMS
Read more: http://www.nasdaq.com/press-release/catalyst-pharmaceutical-…
Catalyst Pharmaceutical Partners Receives Breakthrough Therapy Designation From FDA for Firdapse(TM) for the Treatment of LEMS
Read more: http://www.nasdaq.com/press-release/catalyst-pharmaceutical-…
Feuerstein kommentiert die Zwischenergebnisse von Astex gewohnt pessimistisch. Gibt es hierzu Meinungen? Ich finde man kann daraus nicht viel entnehmen, was ja nicht gleich bedeutet, dass die P II scheitern wird...
http://finance.yahoo.com/news/astex-pharmaceuticals-announce…
http://www.thestreet.com/story/12022555/1/biotech-stock-mail…
Eindeutig Recht muss ich AF bei seinen Beobachtungen zu Twitter geben. Dort gibt es für den Interessierten so manchen Twitterer, der gute und unabhängige Kommentare und Informationen veröffentlicht.
http://finance.yahoo.com/news/astex-pharmaceuticals-announce…
http://www.thestreet.com/story/12022555/1/biotech-stock-mail…
Eindeutig Recht muss ich AF bei seinen Beobachtungen zu Twitter geben. Dort gibt es für den Interessierten so manchen Twitterer, der gute und unabhängige Kommentare und Informationen veröffentlicht.
ASTX
angeblich will der Japanische Pharma Otsuka Astex für 8,5 bis 9,5 USD pro Stück übernehmen ... bisher gibt es aber nichts offizielles. Ich würde lieber sehen, was SGI-110 bringt. Der Kurs geht jedenfalls entsprechend nach oben:
... bisher gibt es aber nichts offizielles. Ich würde lieber sehen, was SGI-110 bringt. Der Kurs geht jedenfalls entsprechend nach oben:
http://www.fiercebiotech.com/story/report-otsuka-steps-buy-a…
Report: Otsuka steps in to buy Astex cancer drug pipeline for $900M
By John Carroll and Emily Mullin
Just a few days after Astex reported positive midstage data on a leukemia therapy, reports are circulating that Japan's Otsuka has stepped in to buy the U.S. biotech for $900 million. And Astex shares immediately shot up 29% on the news.
Japan's Nikkei reports that Otsuka is looking to expand its oncology pipeline with the Astex buyout.
FierceBiotech reported a week ago that Dublin, CA-based Astex Pharmaceuticals ($ASTX) revealed that its small molecule SGI-110 showed "clear activity" in a Phase II trial of patients with acute myeloid leukemia and myelodysplastic syndrome. The drug was given as either a 60 mg or 90 mg dose daily for 5 days in a 28-day course. The primary endpoint was overall remission rate.
Out of 67 patients, there was a 25% complete remission rate--8 remissions occurring in relapsed/refractory AML and another 9 remissions in treatment-naive elderly patients with AML. And Astex shares jumped 20% on the data.
Astex earns revenue from its royalty stream on the leukemia-related drug Dacogen. Yet the company has had a bumpy ride in the drug development world. Last fall the company said that it was dumping development of amuvatinib after it flunked a midstage trial of the drug in patients with small-cell lung cancer. The company said it was looking for another company to license the drug, which is still listed as a pipeline asset.
Astex shares also got hammered in early 2012 after regulators turned a skeptical eye on Eisai's request for an expanded use of Dacogen. An expert panel soon after rejected the application to use the drug to treat AML in elderly patients who had failed chemo.
Astex also has been working on the CDK inhibitor AT7519 and the HSP90 inhibitor AT13387.
Brean Capital's Gene Mack quickly shot back to Bloomberg that the reported buyout figure sounded light to him. "If it's for real, I think the offer is too low," Mack told the business news service. "Any oncology company would look at it as a target."
Otsuka has been at work on new drugs for Alzheimer's and other disease arenas, scrambling to diversify as the patent expiration on the blockbuster schizophrenia drug Abilify looms in 2015. There's no official word yet from either company.

Gruß
ipollit
angeblich will der Japanische Pharma Otsuka Astex für 8,5 bis 9,5 USD pro Stück übernehmen
 ... bisher gibt es aber nichts offizielles. Ich würde lieber sehen, was SGI-110 bringt. Der Kurs geht jedenfalls entsprechend nach oben:
... bisher gibt es aber nichts offizielles. Ich würde lieber sehen, was SGI-110 bringt. Der Kurs geht jedenfalls entsprechend nach oben:http://www.fiercebiotech.com/story/report-otsuka-steps-buy-a…
Report: Otsuka steps in to buy Astex cancer drug pipeline for $900M
By John Carroll and Emily Mullin
Just a few days after Astex reported positive midstage data on a leukemia therapy, reports are circulating that Japan's Otsuka has stepped in to buy the U.S. biotech for $900 million. And Astex shares immediately shot up 29% on the news.
Japan's Nikkei reports that Otsuka is looking to expand its oncology pipeline with the Astex buyout.
FierceBiotech reported a week ago that Dublin, CA-based Astex Pharmaceuticals ($ASTX) revealed that its small molecule SGI-110 showed "clear activity" in a Phase II trial of patients with acute myeloid leukemia and myelodysplastic syndrome. The drug was given as either a 60 mg or 90 mg dose daily for 5 days in a 28-day course. The primary endpoint was overall remission rate.
Out of 67 patients, there was a 25% complete remission rate--8 remissions occurring in relapsed/refractory AML and another 9 remissions in treatment-naive elderly patients with AML. And Astex shares jumped 20% on the data.
Astex earns revenue from its royalty stream on the leukemia-related drug Dacogen. Yet the company has had a bumpy ride in the drug development world. Last fall the company said that it was dumping development of amuvatinib after it flunked a midstage trial of the drug in patients with small-cell lung cancer. The company said it was looking for another company to license the drug, which is still listed as a pipeline asset.
Astex shares also got hammered in early 2012 after regulators turned a skeptical eye on Eisai's request for an expanded use of Dacogen. An expert panel soon after rejected the application to use the drug to treat AML in elderly patients who had failed chemo.
Astex also has been working on the CDK inhibitor AT7519 and the HSP90 inhibitor AT13387.
Brean Capital's Gene Mack quickly shot back to Bloomberg that the reported buyout figure sounded light to him. "If it's for real, I think the offer is too low," Mack told the business news service. "Any oncology company would look at it as a target."
Otsuka has been at work on new drugs for Alzheimer's and other disease arenas, scrambling to diversify as the patent expiration on the blockbuster schizophrenia drug Abilify looms in 2015. There's no official word yet from either company.
Gruß
ipollit
Da macht die doch überraschende Bekanntgabe der Zwischenergebnisse Sinn.
Great news for Amarin (AMRN_) fans: You're no longer the worst-performing cult stock in biotech. That (dis)honor has passed to Arena Pharmaceuticals (ARNA_).

-- Reported by Adam Feuerstein in Boston.
ASTX
so ganz zufrieden kann man wohl nicht sein... ich hätte mir auch etwas mehr versprochen, insbesondere interessiert es mich, ob HMAs zum Priming für u.a. Immuntherapien wie PD-1 geeignet sind.
Die Unzufriedenheit zeigt sich auch im Kurs, der, obwohl 8,5 von ASTX bereits akzeptiert sind, teilweise darüber hinaus geht... oder sind es etwa nur reine Short-Eindeckungen oder soetwas?

http://www.bloomberg.com/news/2013-09-05/otsuka-holdings-off…
Otsuka Bid for Astex Seen Undervaluing Cancer-Drug Maker
By Meg Tirrell & Marco Lui - Sep 5, 2013 10:18 PM GMT+0200
Otsuka Holdings Co. (4578)’s offer of as much as $886 million for Astex Pharmaceuticals Inc. (ASTX) is too low and investors should hold out for more, two analysts and a shareholder said.
Otsuka, the maker of the mood-stabilizing drug Abilify, said in a statement today it will pay $8.50 a share for the Dublin, California-based maker of cancer medicines. That’s 27 percent higher than Astex’s closing stock price on Sept. 3, the day before the deal was reported by the Nikkei newspaper.
Astex should settle for nothing less than $13 a share, said Gene Mack, an analyst with Brean Capital LLC in New York. Otsuka’s bid undervalues Astex’s approved drug, Dacogen, for blood cancers and its pipeline of compounds, including SGI-110, Mack said in a note to clients today. One shareholder compared the deal to the Dutch colonists’ 1626 purchase of Manhattan from American Indians for an estimated $24 in goods.
“Otsuka got a price equivalent to what Peter Minuit got on Manhattan,” said Stuart Weisbrod, founder and chief investment officer of Iguana Healthcare Partners, which holds Astex shares as part of the $130 million in assets it manages. “This will go down as the biggest rip-off of investors in biotech history.”
Astex Chief Executive Officer Jim Manuso said on a conference call that the sale process started after a five-year internal review. Jefferies LLC acted as financial adviser, and many companies were contacted about a potential deal, he said.
Highest Bidder
“Otsuka emerged as the highest bidder interested in acquiring Astex,” Manuso said. The executives didn’t take questions on the call and the company didn’t immediately return a telephone message seeking further comment about the bid.
Astex rose 3.4 percent to a nine-year high of $8.55 at the close in New York, above Otsuka’s offer price in an indication that investors may expect a higher bid. The shares surged 24 percent yesterday after the Nikkei newspaper said Tokyo-based Otsuka planned to buy Astex for 90 billion yen ($900 million).
Otsuka, which also makes Pocari Sweat drinks and Soyjoy nutrition bars, would gain a stable of treatments for cancer, an area ripe in acquisitions. Amgen Inc. agreed last month to pay $10.4 billion for Onyx Pharmaceuticals Inc. (ONXX) to gain access to new oncology drugs.
Astex’s pipeline includes SGI-110, which last week produced results in a mid-stage study in acute myeloid leukemia that drove the stock up 24 percent in one day. The company said it will present further data at the American Society of Hematology meeting later this year.
$1 Billion
“If they waited until they turned the card on the SGI-110 data at ASH this year, they could be worth double what they’re selling for right now,” Mike King, an analyst with JMP Securities, said in a telephone interview today. “I don’t understand why you sell a company in advance of the most important data point in the company’s history.”
King said Astex should command at least $1 billion, and other companies may be interested, such as Johnson & Johnson (JNJ), Astex’s parter on Dacogen. Ernie Knewitz, a spokesman for New Brunswick, New Jersey-based J&J, declined to comment.
Otsuka fell 1 percent to 2,950 yen at the close in Tokyo, paring the stock’s gain this year to 21 percent. The benchmark Topix index has increased 35 percent in the same period.
Abilify is one of the world’s best-selling schizophrenia treatments. The company has been searching for new products before 2015, when its patent on Abilify expires. Its acquisition offer will be made via a tender process to begin within 10 days and remain open for 20 days.
If successful, the acquisition will be the fourth largest by a Japanese pharmaceutical company in the past five years.
Gruß
ipollit
so ganz zufrieden kann man wohl nicht sein... ich hätte mir auch etwas mehr versprochen, insbesondere interessiert es mich, ob HMAs zum Priming für u.a. Immuntherapien wie PD-1 geeignet sind.
Die Unzufriedenheit zeigt sich auch im Kurs, der, obwohl 8,5 von ASTX bereits akzeptiert sind, teilweise darüber hinaus geht... oder sind es etwa nur reine Short-Eindeckungen oder soetwas?
http://www.bloomberg.com/news/2013-09-05/otsuka-holdings-off…
Otsuka Bid for Astex Seen Undervaluing Cancer-Drug Maker
By Meg Tirrell & Marco Lui - Sep 5, 2013 10:18 PM GMT+0200
Otsuka Holdings Co. (4578)’s offer of as much as $886 million for Astex Pharmaceuticals Inc. (ASTX) is too low and investors should hold out for more, two analysts and a shareholder said.
Otsuka, the maker of the mood-stabilizing drug Abilify, said in a statement today it will pay $8.50 a share for the Dublin, California-based maker of cancer medicines. That’s 27 percent higher than Astex’s closing stock price on Sept. 3, the day before the deal was reported by the Nikkei newspaper.
Astex should settle for nothing less than $13 a share, said Gene Mack, an analyst with Brean Capital LLC in New York. Otsuka’s bid undervalues Astex’s approved drug, Dacogen, for blood cancers and its pipeline of compounds, including SGI-110, Mack said in a note to clients today. One shareholder compared the deal to the Dutch colonists’ 1626 purchase of Manhattan from American Indians for an estimated $24 in goods.
“Otsuka got a price equivalent to what Peter Minuit got on Manhattan,” said Stuart Weisbrod, founder and chief investment officer of Iguana Healthcare Partners, which holds Astex shares as part of the $130 million in assets it manages. “This will go down as the biggest rip-off of investors in biotech history.”
Astex Chief Executive Officer Jim Manuso said on a conference call that the sale process started after a five-year internal review. Jefferies LLC acted as financial adviser, and many companies were contacted about a potential deal, he said.
Highest Bidder
“Otsuka emerged as the highest bidder interested in acquiring Astex,” Manuso said. The executives didn’t take questions on the call and the company didn’t immediately return a telephone message seeking further comment about the bid.
Astex rose 3.4 percent to a nine-year high of $8.55 at the close in New York, above Otsuka’s offer price in an indication that investors may expect a higher bid. The shares surged 24 percent yesterday after the Nikkei newspaper said Tokyo-based Otsuka planned to buy Astex for 90 billion yen ($900 million).
Otsuka, which also makes Pocari Sweat drinks and Soyjoy nutrition bars, would gain a stable of treatments for cancer, an area ripe in acquisitions. Amgen Inc. agreed last month to pay $10.4 billion for Onyx Pharmaceuticals Inc. (ONXX) to gain access to new oncology drugs.
Astex’s pipeline includes SGI-110, which last week produced results in a mid-stage study in acute myeloid leukemia that drove the stock up 24 percent in one day. The company said it will present further data at the American Society of Hematology meeting later this year.
$1 Billion
“If they waited until they turned the card on the SGI-110 data at ASH this year, they could be worth double what they’re selling for right now,” Mike King, an analyst with JMP Securities, said in a telephone interview today. “I don’t understand why you sell a company in advance of the most important data point in the company’s history.”
King said Astex should command at least $1 billion, and other companies may be interested, such as Johnson & Johnson (JNJ), Astex’s parter on Dacogen. Ernie Knewitz, a spokesman for New Brunswick, New Jersey-based J&J, declined to comment.
Otsuka fell 1 percent to 2,950 yen at the close in Tokyo, paring the stock’s gain this year to 21 percent. The benchmark Topix index has increased 35 percent in the same period.
Abilify is one of the world’s best-selling schizophrenia treatments. The company has been searching for new products before 2015, when its patent on Abilify expires. Its acquisition offer will be made via a tender process to begin within 10 days and remain open for 20 days.
If successful, the acquisition will be the fourth largest by a Japanese pharmaceutical company in the past five years.
Gruß
ipollit
Habe meine restlichen ONXX und die RIGL-Position nach dem Fehlschlag von R343. Dafür habe ich nun eine erste Position in IMMU und AMBI, sowie SNTA ein wenig erhöht.
MK 523 Mio USD

MK 283 Mio USD

Gruß
ipollit
MK 523 Mio USD
MK 283 Mio USD
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.394.927 von ipollit am 05.09.13 23:43:35Hallo ipollit,
AMBI habe ich auch nachvollzogen. Meine restlichen Onyx verkaufe ich nächste Woche, auch wenn ich mit dem Preis nicht so recht zufrieden bin.
Ich hatte gedacht, dass Hammer vielleicht Verastem interessant finden würde. Die Marktkap. ist vertretbar, denke ich. Immerhin hat ihr Lead-Programm inzwischen einen möglichen Zulassungspfad.
Hast Du eine Einschätzung zu Verastem?
Gruß
SLG
Hallo kmastra,
Glückwunsch zu ASTX! Ich konnte mich nie überwinden, obwohl so viel für einen Kauf sprach. Wer zu spät kommt...
Gruß
SLG
AMBI habe ich auch nachvollzogen. Meine restlichen Onyx verkaufe ich nächste Woche, auch wenn ich mit dem Preis nicht so recht zufrieden bin.
Ich hatte gedacht, dass Hammer vielleicht Verastem interessant finden würde. Die Marktkap. ist vertretbar, denke ich. Immerhin hat ihr Lead-Programm inzwischen einen möglichen Zulassungspfad.
Hast Du eine Einschätzung zu Verastem?
Gruß
SLG
Hallo kmastra,
Glückwunsch zu ASTX! Ich konnte mich nie überwinden, obwohl so viel für einen Kauf sprach. Wer zu spät kommt...
Gruß
SLG
Antwort auf Beitrag Nr.: 45.395.587 von SLGramann am 06.09.13 08:26:35Hallo SLGramann, hallo ipollit: vielen Dank!
Grundsätzlich sehe ich es aber wie ipollit und hätte gerne noch bis Dezember abgewartet. Aber sei es drum - will mich da jetzt nicht beschweren. Das hebe ich mir ggf. für Dezember auf
Mal sehen wie ich das frei gewordene Geld investiere. Schiele schon länger auf Morphosys und denke, das ich da zuschlagen werde. Hier sehe ich trotz der guten Performance noch langfristig Potenzial. Unfassbar, wie positiv es dort voran geht. Wahrscheinlich werde ich auch Array weiter aufstocken. In meinen Augen ist auch das (leider) ein langfristiger Übernahmekandidat.
Gruß kmastra
Grundsätzlich sehe ich es aber wie ipollit und hätte gerne noch bis Dezember abgewartet. Aber sei es drum - will mich da jetzt nicht beschweren. Das hebe ich mir ggf. für Dezember auf

Mal sehen wie ich das frei gewordene Geld investiere. Schiele schon länger auf Morphosys und denke, das ich da zuschlagen werde. Hier sehe ich trotz der guten Performance noch langfristig Potenzial. Unfassbar, wie positiv es dort voran geht. Wahrscheinlich werde ich auch Array weiter aufstocken. In meinen Augen ist auch das (leider) ein langfristiger Übernahmekandidat.
Gruß kmastra
Hallo ipollit,
einfach mal Dank und Respekt wegen Stemline!
Du warst doch hier derjenige, der auf das Unternehmen aufmerksam gemacht hat.
Inzwischen kommen immer mehr positive Analystenkommentare und auch Hammer hat sich kürzlich erstmals positiv geäußert.
Da warst Du den ganzen Leuten weit voraus.
Klar, was am Ende draus wird, kann kein Mensch wissen, aber bisher "Hut ab"!
Research analysts at Wedbush initiated coverage on shares of Stemline Therapeutics (NASDAQ:STML) in a report released on Wednesday, TheFlyOnTheWall.com reports. The firm set an “outperform” rating and a $49.00 price target on the stock.
einfach mal Dank und Respekt wegen Stemline!
Du warst doch hier derjenige, der auf das Unternehmen aufmerksam gemacht hat.
Inzwischen kommen immer mehr positive Analystenkommentare und auch Hammer hat sich kürzlich erstmals positiv geäußert.
Da warst Du den ganzen Leuten weit voraus.
Klar, was am Ende draus wird, kann kein Mensch wissen, aber bisher "Hut ab"!
Research analysts at Wedbush initiated coverage on shares of Stemline Therapeutics (NASDAQ:STML) in a report released on Wednesday, TheFlyOnTheWall.com reports. The firm set an “outperform” rating and a $49.00 price target on the stock.
Antwort auf Beitrag Nr.: 45.437.047 von SLGramann am 12.09.13 16:17:49STML, CLDX
Hallo SLGramann,
danke... ehrlicherweise haben aber einige auf Twitter schon früher auf STML hingewiesen.
Hier ist auch ein PT von 60 USD:
http://www.benzinga.com/analyst-ratings/analyst-color/13/08/…
In a report published Thursday, Jefferies analyst Thomas Wei initiated coverage on Stemline Therapeutics with a Buy rating and $60.00 price target.
In the report, Jefferies noted, “STML's lead drug, SL-401, is entering pivotal trials in 2014 in BPDCN, a rare lymphoma, and third-line acute myeloid leukemia. We are impressed by the robust response rates in both settings, including durable complete responses, after a single cycle of treatment, and we believe that even better efficacy could be achieved with multiple SL-401 cycles. We estimate SL-401 peak sales of $500m+.”
Im wesentlichen scheint sich dies auf SL-401 zu beziehen. SL-701 gegen Gehirntumore könnte aber auch interessant werden. Die bisherigen Ergebnisse sind zumindest nicht schlecht... von der Ausrichtung ist es meiner Meinung nach ähnlich wie CLDXs Rindopepimut. Zuletzt gab es von Wedbush ein PT für CLDX von 35 USD, wobei der Wert von Rindopepimut bei 28 USD gesehen wird. Ob das nun realtistisch ist, sei mal dahingestellt... aber 28 USD sind mehr als die aktuelle MK von CLDX von 2 Mrd USD. Bei STML wird SL-701 bisher noch nicht in die Bewertung miteingerechnet, soweit ich es sehe.
http://www.streetinsider.com/Analyst+Comments/Celldex+(CLDX)…
Celldex (CLDX) Target Raised at Wedbush
Wedbush on Wednesday reiterated an Outperform on Celldex Therapeutics (NASDAQ: CLDX) and raised its price target to $35.00 (from $20.00). Analyst Gregory R. Wade revised rindopepimut projections and added pipeline value.
"Our 2018E global sales is now $1.2B from $856M. Revising our rindopepimut value to $28/share from $20/share on 6x 2018 revenues, with an early stop for efficacy remaining as $14/share in potential upside," said Wade.
"Our $35 price target is a based off of 6x multiples of our 2018 rindopepimut (global), CDX-011 (US breast cancer) and CDX-1135 (dense deposit disease, US and EU) sales, discounted back to YE:14. Upside from $35/share could come from ACT IV stopping early (potentially worth $14/share from earlier commercialization and reduced risk) and positive CDX-1127 results could add an additional $10-20/share for expectations around just the US renal cancer and melanoma opportunities," he added.
Gruß
ipollit
Hallo SLGramann,
danke... ehrlicherweise haben aber einige auf Twitter schon früher auf STML hingewiesen.
Hier ist auch ein PT von 60 USD:
http://www.benzinga.com/analyst-ratings/analyst-color/13/08/…
In a report published Thursday, Jefferies analyst Thomas Wei initiated coverage on Stemline Therapeutics with a Buy rating and $60.00 price target.
In the report, Jefferies noted, “STML's lead drug, SL-401, is entering pivotal trials in 2014 in BPDCN, a rare lymphoma, and third-line acute myeloid leukemia. We are impressed by the robust response rates in both settings, including durable complete responses, after a single cycle of treatment, and we believe that even better efficacy could be achieved with multiple SL-401 cycles. We estimate SL-401 peak sales of $500m+.”
Im wesentlichen scheint sich dies auf SL-401 zu beziehen. SL-701 gegen Gehirntumore könnte aber auch interessant werden. Die bisherigen Ergebnisse sind zumindest nicht schlecht... von der Ausrichtung ist es meiner Meinung nach ähnlich wie CLDXs Rindopepimut. Zuletzt gab es von Wedbush ein PT für CLDX von 35 USD, wobei der Wert von Rindopepimut bei 28 USD gesehen wird. Ob das nun realtistisch ist, sei mal dahingestellt... aber 28 USD sind mehr als die aktuelle MK von CLDX von 2 Mrd USD. Bei STML wird SL-701 bisher noch nicht in die Bewertung miteingerechnet, soweit ich es sehe.
http://www.streetinsider.com/Analyst+Comments/Celldex+(CLDX)…
Celldex (CLDX) Target Raised at Wedbush
Wedbush on Wednesday reiterated an Outperform on Celldex Therapeutics (NASDAQ: CLDX) and raised its price target to $35.00 (from $20.00). Analyst Gregory R. Wade revised rindopepimut projections and added pipeline value.
"Our 2018E global sales is now $1.2B from $856M. Revising our rindopepimut value to $28/share from $20/share on 6x 2018 revenues, with an early stop for efficacy remaining as $14/share in potential upside," said Wade.
"Our $35 price target is a based off of 6x multiples of our 2018 rindopepimut (global), CDX-011 (US breast cancer) and CDX-1135 (dense deposit disease, US and EU) sales, discounted back to YE:14. Upside from $35/share could come from ACT IV stopping early (potentially worth $14/share from earlier commercialization and reduced risk) and positive CDX-1127 results could add an additional $10-20/share for expectations around just the US renal cancer and melanoma opportunities," he added.
Gruß
ipollit
!
Dieser Beitrag wurde vom System automatisch gesperrt. Bei Fragen wenden Sie sich bitte an feedback@wallstreet-online.de
Nochmal was zu ENTA:
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Based on today’s Morgan Stanley webcast, there are two additional details we can add:
1) The $195M of pre-commercial milestones on ABT-450 payable by ABBV to ENTA consists of $40M for NDA/MAA submissions and $155M for marketing approvals. The $40M and $155M figures are further divided by geography; the overwhelming proportion of each amount is presumably attributable to the US and EU, with a lesser proportion for Japan, and (presumably) much lesser proportions for such countries as Canada, Australia, Switzerland, and emerging markets.
2) ENTA’s royalty on sales of ABBV’s ABT-450-based regimen will be tiered based on product sales in the same manner as IRS tax brackets. The lowest royalty rate is in the low teens, and the highest royalty rate is approximately 20%. The royalty applies to the proportion of value ABT-450 is deemed to contribute to the overall treatment regimen, which I estimate to be 35% for the regimen* ABBV is testing globally for genotype-1 patients. (It matters little whether ribavirin is included in this cocktail since ribavirin is available in all countries as a cheap generic.) For the ABT-450/r + ABT-267 regimen that ABBV plans to test in Japan for genotype-1b (#msg-91870291), I estimate the ENTA’ royalty will apply to 50% of the overall sales.
Versteh ich das richtig, dass Enanta also bei z.B. 1 Milliarde Umsatz die Royalties anteilig bekommt, weil es ja ein Cocktail aus mehreren Wirkstoffen ist? Also angenommen Enanta bekäme 12% Royalties bei der ersten Milliarde Umsatz - dann bekämen sie die 12% auch nur von einem Drittel des Umsatzes also ca. 40 Millionen?
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Based on today’s Morgan Stanley webcast, there are two additional details we can add:
1) The $195M of pre-commercial milestones on ABT-450 payable by ABBV to ENTA consists of $40M for NDA/MAA submissions and $155M for marketing approvals. The $40M and $155M figures are further divided by geography; the overwhelming proportion of each amount is presumably attributable to the US and EU, with a lesser proportion for Japan, and (presumably) much lesser proportions for such countries as Canada, Australia, Switzerland, and emerging markets.
2) ENTA’s royalty on sales of ABBV’s ABT-450-based regimen will be tiered based on product sales in the same manner as IRS tax brackets. The lowest royalty rate is in the low teens, and the highest royalty rate is approximately 20%. The royalty applies to the proportion of value ABT-450 is deemed to contribute to the overall treatment regimen, which I estimate to be 35% for the regimen* ABBV is testing globally for genotype-1 patients. (It matters little whether ribavirin is included in this cocktail since ribavirin is available in all countries as a cheap generic.) For the ABT-450/r + ABT-267 regimen that ABBV plans to test in Japan for genotype-1b (#msg-91870291), I estimate the ENTA’ royalty will apply to 50% of the overall sales.
Versteh ich das richtig, dass Enanta also bei z.B. 1 Milliarde Umsatz die Royalties anteilig bekommt, weil es ja ein Cocktail aus mehreren Wirkstoffen ist? Also angenommen Enanta bekäme 12% Royalties bei der ersten Milliarde Umsatz - dann bekämen sie die 12% auch nur von einem Drittel des Umsatzes also ca. 40 Millionen?
Antwort auf Beitrag Nr.: 45.453.217 von kmastra am 15.09.13 19:55:03Würdest du erwarten, dass ENTA Royalties für alle Medikamente eines wie auch immer gearteten Cocktails erhält, auch wenn ENTA nichts mit der Entwicklung zutun hat?
Andersherum... worauf beziehen sich eventuelle Peak Sales? Ich sehe hier immer nur den ABT-450 Anteil... also 1 Mrd Umsatz bedeutet für mich 1 Mrd USD ABT-450 + Kosten für weitere Anteile des Cocktails, z.B. 2 Mrd USD. Ein Cocktail muss ja auch nicht fix sein, sondern es können unterschiedliche Mittel je nach Indikation zum Einsatz kommen. Nach meinem Verständnis bildet ABT-450 aber die Basis für alle eventuellen Cocktails.
Gruß
ipollit
Andersherum... worauf beziehen sich eventuelle Peak Sales? Ich sehe hier immer nur den ABT-450 Anteil... also 1 Mrd Umsatz bedeutet für mich 1 Mrd USD ABT-450 + Kosten für weitere Anteile des Cocktails, z.B. 2 Mrd USD. Ein Cocktail muss ja auch nicht fix sein, sondern es können unterschiedliche Mittel je nach Indikation zum Einsatz kommen. Nach meinem Verständnis bildet ABT-450 aber die Basis für alle eventuellen Cocktails.
Gruß
ipollit
Neuer Artikel von Hammer zu Daratumumab und den anderen CD38-mabs:
http://www.orf-blog.com/is-genmabs-daratumumab-the-next-ibru…
Er vergleicht Dara mit Ibrutinib, was den Entwicklungs- und Zulassungspfad angeht. Und auch wenn das Umsatzpotential zunächst kleiner erscheint, könnte Genmab nach wie vor stark unterbewertet sein. Hammer stockt seinen Depotanteil auf.
(Ich hab allerdings schon einen großen Depotanteil in Genmab und lasse bei mir alles, wie es ist.)
http://www.orf-blog.com/is-genmabs-daratumumab-the-next-ibru…
Er vergleicht Dara mit Ibrutinib, was den Entwicklungs- und Zulassungspfad angeht. Und auch wenn das Umsatzpotential zunächst kleiner erscheint, könnte Genmab nach wie vor stark unterbewertet sein. Hammer stockt seinen Depotanteil auf.
(Ich hab allerdings schon einen großen Depotanteil in Genmab und lasse bei mir alles, wie es ist.)
Antwort auf Beitrag Nr.: 45.453.769 von ipollit am 15.09.13 23:30:02Ist vielleicht ein bisschen naiv, das anzunehmen aber was soll ich sagen... !
!
Insgesamt ist es natürlich schon nachvollziebar, dass ENTA nichts für etwas bekommt für das es nichts kann. Ich gehe - wie wohl die meisten- schon davon aus, dass Gilead das größere Stück vom Kuchen abbekommen wird. Ob dann noch 2 Milliarden Peak sales realistisch sind, würde ich eher bezweifeln. Nach der Rechnung von DewDiligence (35% ABT-450) würde dann ja der Gesamtumsatz des Cocktailes 6 Milliarden betragen. Wobei eventuell auch nicht alle Bestandteile gleich teuer sein werden. Wie genau die Zusammensetzung aussieht und ob sich diese dann in der Praxis verändern lässt übersteigt meinen Horizont. Hier werde ich wohl abwarten müssen. Sehr positiv dürften sich aber die anstehenden Meilensteinzahlungen auswirken. Diese werden bei Antrag und Zulassung fällig. Beides ist ja doch recht wahrscheinlich.
Der neue Artikel von Hammer ist sehr interessant. Für mich gibt es gute Argumente, in alle 3 Unternehmen zu investieren. Werde nach Morphosys auch eine Position bei Genmab eingehen. Überzeugt mich! Dezember wird spannend - auch bzgl. ARRY!
Gruß kmastra
 !
!Insgesamt ist es natürlich schon nachvollziebar, dass ENTA nichts für etwas bekommt für das es nichts kann. Ich gehe - wie wohl die meisten- schon davon aus, dass Gilead das größere Stück vom Kuchen abbekommen wird. Ob dann noch 2 Milliarden Peak sales realistisch sind, würde ich eher bezweifeln. Nach der Rechnung von DewDiligence (35% ABT-450) würde dann ja der Gesamtumsatz des Cocktailes 6 Milliarden betragen. Wobei eventuell auch nicht alle Bestandteile gleich teuer sein werden. Wie genau die Zusammensetzung aussieht und ob sich diese dann in der Praxis verändern lässt übersteigt meinen Horizont. Hier werde ich wohl abwarten müssen. Sehr positiv dürften sich aber die anstehenden Meilensteinzahlungen auswirken. Diese werden bei Antrag und Zulassung fällig. Beides ist ja doch recht wahrscheinlich.
Der neue Artikel von Hammer ist sehr interessant. Für mich gibt es gute Argumente, in alle 3 Unternehmen zu investieren. Werde nach Morphosys auch eine Position bei Genmab eingehen. Überzeugt mich! Dezember wird spannend - auch bzgl. ARRY!
Gruß kmastra
Antwort auf Beitrag Nr.: 45.456.815 von kmastra am 16.09.13 13:22:36Ja, das wird für mich der spannendste Dezember (die spannenste ASH) überhaupt!
Mal was grundsätzliches zum HEP-C-Markt:
Es gibt da ja die Erzählung, dass dieser Markt zwischen 10 und 20 Milliarden Dollar groß werden wird.
Vielleicht wird das so sein, aber ich bin sehr skeptisch.
Wer sich für das Thema interessiert, sollte mal diesen kritischen Artikel lesen:
http://www.thestreet.com/story/11413796/1/gilead-vertex-and-…
Leider schreibt der Blogger nichts mehr. Seine Artikel waren damals immer super. Da konnte man mitunter fast so viel lernen, wie bei Hammer.
Mal was grundsätzliches zum HEP-C-Markt:
Es gibt da ja die Erzählung, dass dieser Markt zwischen 10 und 20 Milliarden Dollar groß werden wird.
Vielleicht wird das so sein, aber ich bin sehr skeptisch.
Wer sich für das Thema interessiert, sollte mal diesen kritischen Artikel lesen:
http://www.thestreet.com/story/11413796/1/gilead-vertex-and-…
Leider schreibt der Blogger nichts mehr. Seine Artikel waren damals immer super. Da konnte man mitunter fast so viel lernen, wie bei Hammer.
Hallo SLGramann,
hätte gerne etwas zu VSTM geschrieben bzw. habe ich auch, aber WO hat mein Posting geblockt, weil ich darin das Wort M.E.R.L.I.N erwähnt habe. Kaum zu glauben, oder? Verletzung von Urheberrechten!...

da ein höherer Preis für meine ASTX doch recht unwahrscheinlich geworden ist, habe ich diese Position komplett verkauft. Dafür nun auch eine neue Position VSTM... zusätzlich noch IMMU, AMBI und ARQL weiter aufgestockt.
So ganz logisch finde ich Hammers Verkäufe nicht immer. Es mag zwar stimmen, dass CLDX hoch bewertet ist, aber die Aktie läuft doch immer recht gut... solange etwas läuft, sollte man doch besser dabei bleiben, selbst wenn man die Bewertung für etwas übertrieben hält. Warum sollte morgen der Kurs von z.B. CLDX deutlich nachgeben? Wenn, dann wird doch eher der Gesamtmarkt korrigieren... aber auch da passt noch der Trend.


Gruß
ipollit
hätte gerne etwas zu VSTM geschrieben bzw. habe ich auch, aber WO hat mein Posting geblockt, weil ich darin das Wort M.E.R.L.I.N erwähnt habe. Kaum zu glauben, oder? Verletzung von Urheberrechten!...

da ein höherer Preis für meine ASTX doch recht unwahrscheinlich geworden ist, habe ich diese Position komplett verkauft. Dafür nun auch eine neue Position VSTM... zusätzlich noch IMMU, AMBI und ARQL weiter aufgestockt.
So ganz logisch finde ich Hammers Verkäufe nicht immer. Es mag zwar stimmen, dass CLDX hoch bewertet ist, aber die Aktie läuft doch immer recht gut... solange etwas läuft, sollte man doch besser dabei bleiben, selbst wenn man die Bewertung für etwas übertrieben hält. Warum sollte morgen der Kurs von z.B. CLDX deutlich nachgeben? Wenn, dann wird doch eher der Gesamtmarkt korrigieren... aber auch da passt noch der Trend.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.468.701 von ipollit am 17.09.13 23:58:52Hallo ipollit,
wie kannst Du auch einfach das Wort M.E.R.... verwenden ohne an die Folgen zu denken...
Nein, im ernst, sehr, sehr schade, dass Dein Beitrag gelöscht wurde. Ich hätte ihn sehr gern gelesen. Bin selbst von Verastem angetan, auch wenn Hammer skeptisch ist.
Dass Du ARQL aufgestockt hast, finde ich cool. Ich trau mich nicht. Seit Jahren gibts da nur Rückschläge irgendwie.
Wenn Hammer eine Schwäche hat, dann ist es sein zu frühes Verkaufen. Krass war das bei PCYC. Er weiß ganz genau, dass das ein 5 Milliarden-Dollar + Geschäft wird und verkauft PCYC bei einer Marktkap. von 1,5 Mrd. oder so...
Bei CLDX sehe ich keine Überbewertung! Seit Monaten verfestigt sich das Bild, dass Rindo wahrscheinlich zugelassen werden kann (jedenfalls ist die Wahrscheinlichkeit recht hoch) und dass das doch an die Milliarde Umsatz bringen kann.
Wieso sollte ich da verkaufen?
Der Rest der Pipeline ist ja auch nicht uninteressant.
Grüße
SLG
wie kannst Du auch einfach das Wort M.E.R.... verwenden ohne an die Folgen zu denken...

Nein, im ernst, sehr, sehr schade, dass Dein Beitrag gelöscht wurde. Ich hätte ihn sehr gern gelesen. Bin selbst von Verastem angetan, auch wenn Hammer skeptisch ist.
Dass Du ARQL aufgestockt hast, finde ich cool. Ich trau mich nicht. Seit Jahren gibts da nur Rückschläge irgendwie.
Wenn Hammer eine Schwäche hat, dann ist es sein zu frühes Verkaufen. Krass war das bei PCYC. Er weiß ganz genau, dass das ein 5 Milliarden-Dollar + Geschäft wird und verkauft PCYC bei einer Marktkap. von 1,5 Mrd. oder so...
Bei CLDX sehe ich keine Überbewertung! Seit Monaten verfestigt sich das Bild, dass Rindo wahrscheinlich zugelassen werden kann (jedenfalls ist die Wahrscheinlichkeit recht hoch) und dass das doch an die Milliarde Umsatz bringen kann.
Wieso sollte ich da verkaufen?
Der Rest der Pipeline ist ja auch nicht uninteressant.
Grüße
SLG
Antwort auf Beitrag Nr.: 45.469.921 von SLGramann am 18.09.13 09:55:27ARQL
so schlecht finde ich ARQL nicht bei einer MK von aktuell 142 Mio USD und ca. 100 Mio USD Cash. Zum einen ist da Tivantinib, das inzwischen wahrscheinlich mit Null gerechnet wird, so als ob es schon komplett gescheitert wäre. Dabei befindet es sich in PIII u.a. in HCC. Zuletzt wurde vom Kontrollgremium in der HCC-PIII eine Reduzierung der Dosis empfohlen wg. möglicher Nebenwirkungen. Ein wenig seltsam, da es zuvor mit einer viel höheren Dosis in anderen Indikationen ohne Probleme getestet wurde und immer noch wird. Jedenfalls führte das zum letzten Kursrutsch. NSCLC ist meiner Meinung noch von ARQL noch nicht abgeschrieben... es sollen noch Subgruppen-Analysen kommen, u.a. zu Met+.

Noch interessanter finde ich aber die AKIP-Pipeline. Die Kinease-Hemmer sollen (wenn ich es richtig verstehe) ein wenig anders am Target ansetzen und so sich etwas differenzieren von anderen Hemmern des gleichen Targets:
AKIP capabilities
Drug discovery at ArQule utilizes a proven innovative and efficient drug discovery engine which employs a proprietary structure-based drug design technology known as the ArQule Kinase Inhibitor Platform(AKIP™). This platform targets inactive forms of kinases that have pivotal roles in cancer and other diseases. AKIP integrates in silico drug design, parallel robotic chemistry, and novel assay development expertise to create non-ATP competitive inhibitors that interact with these kinases in novel binding modes. Inhibitors identified through AKIP are optimized into drug candidates having the appropriate efficacy and selectivity for their target with minimal side effects.
We believe we have within this platform the capability to rationally design novel kinase inhibitors that encompass new chemical spaces and allow for an expanding intellectual property estate. We anticipate that these novel kinase inhibitors, when targeted against selected therapeutically relevant kinases, will have utility in a broad range of human diseases in addition to cancer.

Hammer findet z.B. den AKT- und den FGFR-Hemmer gut... z.B. bezügl. des IPOs FPRX (u.U. auch interessant mit 250 Mio MK)... das folgende also nicht zu ARQL(!):"I know their FGF-decoy program, which looks very good on paper but encountered setbacks in the clinic. They have something between a pan-FGFR small molecule inhibitor and an antibody for the soluble ligand, could have a unique profile. I am a big believer in FGFR as a family of targets."
Hammers Kollege Ran Nussbaum sagt im folgenden: http://www.thelifesciencesreport.com/pub/na/three-new-picks-… "It's not about what the most advanced asset is. I'm looking at what the biggest asset is and why. You'll see situations like this with a lot of companies. ArQule Inc. (ARQL:NASDAQ) is in phase 3 with the c-Met inhibitor tivantinib for cancer treatment, but I think the phase 1 trial of its AKT inhibitor, ARQ 092, in solid tumors, is more promising. We are talking about the market potential and how the product is differentiated from other agents."[/i]
Den AKT-Hemmer ARQ092 finde ich am spannensten. So weit ich es verstehe, fällt AKT in den Bereich pi3k und mTOR. Bisher waren die AKT-Hemmer u.U. nicht stark/selektiv genug... ARQ092 könnte einer der besten AKT-Hemmer sein. U.a. zeigt er als Nebenwirkung eine Überzuckerung wie bei Diabetes... dies ist aber angeblich ein On-Target-Effekt, d.h. AKT wird nur unterdrückt, wenn diese Nebenwirkung auftritt. Dennoch scheint ARQ092 relativ verträglich zu sein.
http://www.targetedonc.com/publications/targeted-therapies-c…
Another oral targeted agent, ARQ 092, which targets the AKT pathway, was shown to be active in a spectrum of different solid tumors including colorectal, endometrial, and neuroendocrine tumors, and the drug demonstrated a manageable sideeffect profile.
AKT inhibitors generally have two types of dose-limiting toxicities that relate to on-target effects of the drug: hyperglycemia and skin toxicity. In the case of ARQ 092, the researchers observed a pattern of a rise in blood sugar prior to the emergence of skin toxicity that may be a differentiating feature of this AKT inhibitor. The researchers did not observe any dose-limiting skin toxicity, and they were able to treat the hyperglycemia, allowing patients to continue the experimental treatment. This may mean that compared with other AKT inhibitors, ARQ 092 may be better tolerated at higher, more therapeutically active levels. The trial is ongoing to determine the maximum tolerated dose (MTD) and to test for efficacy.
Interessant ist auch, dass BTK- und S6K-Hemmer in der Präklinik sind. Zu letzterem habe ich heute gelesen, dass er eine mögliche Ergänzung zu BRAF + MEK (wie z.B. Zelboraf + EXELs GDC-0973) sein kann:
http://www.wistar.org/news-and-media/press-releases/Villanue…
...
A possible answer, they reasoned, was in the PI3K/mTOR pathway, a network of signaling enzymes often active within melanoma cells. However, they could find no sign that any of the “usual suspects”—points along the pathway commonly known to be involved in cancers—had any evident part in BRAF/MEK resistance. It was not until they examined farther “downstream” that they found persistent activation of S6K, an enzyme that appears to be at the point where P13K/mTOR and MAP kinase pathways merge.
So the researchers tried combinations of inhibitors against BRAF, MEK and PI3K/mTOR (as there are currently no effective S6K inhibitors) in a mouse model of melanoma. “With a triple combination of drugs, the tumors slow down and just stop growing,” Villanueva explained.
...
“There are currently therapeutics available that can block the pathway that leads to S6K, but we are also interested in developing inhibitors to S6K itself.”

Gruß
ipollit
so schlecht finde ich ARQL nicht bei einer MK von aktuell 142 Mio USD und ca. 100 Mio USD Cash. Zum einen ist da Tivantinib, das inzwischen wahrscheinlich mit Null gerechnet wird, so als ob es schon komplett gescheitert wäre. Dabei befindet es sich in PIII u.a. in HCC. Zuletzt wurde vom Kontrollgremium in der HCC-PIII eine Reduzierung der Dosis empfohlen wg. möglicher Nebenwirkungen. Ein wenig seltsam, da es zuvor mit einer viel höheren Dosis in anderen Indikationen ohne Probleme getestet wurde und immer noch wird. Jedenfalls führte das zum letzten Kursrutsch. NSCLC ist meiner Meinung noch von ARQL noch nicht abgeschrieben... es sollen noch Subgruppen-Analysen kommen, u.a. zu Met+.

Noch interessanter finde ich aber die AKIP-Pipeline. Die Kinease-Hemmer sollen (wenn ich es richtig verstehe) ein wenig anders am Target ansetzen und so sich etwas differenzieren von anderen Hemmern des gleichen Targets:
AKIP capabilities
Drug discovery at ArQule utilizes a proven innovative and efficient drug discovery engine which employs a proprietary structure-based drug design technology known as the ArQule Kinase Inhibitor Platform(AKIP™). This platform targets inactive forms of kinases that have pivotal roles in cancer and other diseases. AKIP integrates in silico drug design, parallel robotic chemistry, and novel assay development expertise to create non-ATP competitive inhibitors that interact with these kinases in novel binding modes. Inhibitors identified through AKIP are optimized into drug candidates having the appropriate efficacy and selectivity for their target with minimal side effects.
We believe we have within this platform the capability to rationally design novel kinase inhibitors that encompass new chemical spaces and allow for an expanding intellectual property estate. We anticipate that these novel kinase inhibitors, when targeted against selected therapeutically relevant kinases, will have utility in a broad range of human diseases in addition to cancer.

Hammer findet z.B. den AKT- und den FGFR-Hemmer gut... z.B. bezügl. des IPOs FPRX (u.U. auch interessant mit 250 Mio MK)... das folgende also nicht zu ARQL(!):"I know their FGF-decoy program, which looks very good on paper but encountered setbacks in the clinic. They have something between a pan-FGFR small molecule inhibitor and an antibody for the soluble ligand, could have a unique profile. I am a big believer in FGFR as a family of targets."
Hammers Kollege Ran Nussbaum sagt im folgenden: http://www.thelifesciencesreport.com/pub/na/three-new-picks-… "It's not about what the most advanced asset is. I'm looking at what the biggest asset is and why. You'll see situations like this with a lot of companies. ArQule Inc. (ARQL:NASDAQ) is in phase 3 with the c-Met inhibitor tivantinib for cancer treatment, but I think the phase 1 trial of its AKT inhibitor, ARQ 092, in solid tumors, is more promising. We are talking about the market potential and how the product is differentiated from other agents."[/i]
Den AKT-Hemmer ARQ092 finde ich am spannensten. So weit ich es verstehe, fällt AKT in den Bereich pi3k und mTOR. Bisher waren die AKT-Hemmer u.U. nicht stark/selektiv genug... ARQ092 könnte einer der besten AKT-Hemmer sein. U.a. zeigt er als Nebenwirkung eine Überzuckerung wie bei Diabetes... dies ist aber angeblich ein On-Target-Effekt, d.h. AKT wird nur unterdrückt, wenn diese Nebenwirkung auftritt. Dennoch scheint ARQ092 relativ verträglich zu sein.
http://www.targetedonc.com/publications/targeted-therapies-c…
Another oral targeted agent, ARQ 092, which targets the AKT pathway, was shown to be active in a spectrum of different solid tumors including colorectal, endometrial, and neuroendocrine tumors, and the drug demonstrated a manageable sideeffect profile.
AKT inhibitors generally have two types of dose-limiting toxicities that relate to on-target effects of the drug: hyperglycemia and skin toxicity. In the case of ARQ 092, the researchers observed a pattern of a rise in blood sugar prior to the emergence of skin toxicity that may be a differentiating feature of this AKT inhibitor. The researchers did not observe any dose-limiting skin toxicity, and they were able to treat the hyperglycemia, allowing patients to continue the experimental treatment. This may mean that compared with other AKT inhibitors, ARQ 092 may be better tolerated at higher, more therapeutically active levels. The trial is ongoing to determine the maximum tolerated dose (MTD) and to test for efficacy.
Interessant ist auch, dass BTK- und S6K-Hemmer in der Präklinik sind. Zu letzterem habe ich heute gelesen, dass er eine mögliche Ergänzung zu BRAF + MEK (wie z.B. Zelboraf + EXELs GDC-0973) sein kann:
http://www.wistar.org/news-and-media/press-releases/Villanue…
...
A possible answer, they reasoned, was in the PI3K/mTOR pathway, a network of signaling enzymes often active within melanoma cells. However, they could find no sign that any of the “usual suspects”—points along the pathway commonly known to be involved in cancers—had any evident part in BRAF/MEK resistance. It was not until they examined farther “downstream” that they found persistent activation of S6K, an enzyme that appears to be at the point where P13K/mTOR and MAP kinase pathways merge.
So the researchers tried combinations of inhibitors against BRAF, MEK and PI3K/mTOR (as there are currently no effective S6K inhibitors) in a mouse model of melanoma. “With a triple combination of drugs, the tumors slow down and just stop growing,” Villanueva explained.
...
“There are currently therapeutics available that can block the pathway that leads to S6K, but we are also interested in developing inhibitors to S6K itself.”
Gruß
ipollit
Sagt mal, wer ist dieser Hammer eigentlich? Lese hier immer wieder von ihm.
Danke im Voraus!
Danke im Voraus!
Antwort auf Beitrag Nr.: 45.495.781 von Boomaktie am 22.09.13 08:09:51Ohad Hammer veröffentlicht in recht regelmäßigen Abständen Analysen zu Biotech Aktien. Dabei ist er vor allem auf Aktien fokussiert, die im Bereich Krebs tätig sind. Mit seinen Analysen liegt er meist richtig. Er hat (soweit ich das überhaupt beurteilen kann) ziemlich viel Ahnung. Arbeitet auch in dem Bereich als Analyst. In den Kommentaren beantwortet er zudem auch Fragen. Ich finde es zudem nicht selbstverständlich, dass er solche Analysen überhaupt umsonst ins Netz stellt. Er führt auch ein online Depot. Die Werte dürften bekannt sein...

http://www.orf-blog.com/is-genmabs-daratumumab-the-next-ibru…

http://www.orf-blog.com/is-genmabs-daratumumab-the-next-ibru…
Antwort auf Beitrag Nr.: 45.456.815 von kmastra am 16.09.13 13:22:36ENTA
es muss aber nicht so sein, dass GILD die Nase klar vorne hat. Dieser DewDiligence ist auch der Meinung, dass ABT gegenüber GILD konkurrieren kann: "$ABBV/ $ENTA can do more than merely compete in HCV genotype-1, IMO; I expect them to WIN... "Win" in this context means having the largest market share in the segment. $ABBV $ENTA" https://twitter.com/DewDiligence/status/361830091912785920, zum anderen hat er laut seiner Aussage ca. 1 Mio USD in ENTA investiert, was man wohl nicht einfach so macht.
egal wie, die letzten Tage ist ENTA schonmal gut gelaufen...

Gruß
ipollit
es muss aber nicht so sein, dass GILD die Nase klar vorne hat. Dieser DewDiligence ist auch der Meinung, dass ABT gegenüber GILD konkurrieren kann: "$ABBV/ $ENTA can do more than merely compete in HCV genotype-1, IMO; I expect them to WIN... "Win" in this context means having the largest market share in the segment. $ABBV $ENTA" https://twitter.com/DewDiligence/status/361830091912785920, zum anderen hat er laut seiner Aussage ca. 1 Mio USD in ENTA investiert, was man wohl nicht einfach so macht.
egal wie, die letzten Tage ist ENTA schonmal gut gelaufen...
Gruß
ipollit
CLVS
Clovis würde sich gerne selber verkaufen... "Clovis is working with advisers including Credit Suisse AG to help it find a buyer, the people said, asking not to be identified as the information is private. The process is still in the early stages and the company is not yet in exclusive talks with any potential acquirer, one of the people said." http://www.bloomberg.com/news/2013-09-17/clovis-oncology-sai…
und entsprechende luftige Kursziele... "Citi initiated coverage on Clovis Oncology (NASDAQ: CLVS) with a Buy rating and a price target of $109.00. Analyst Yaron Werber called the company an excellent M&A target and thinks it could fetch as much as $177 per share in a sale. This assumes Clovis Oncology drugs are approved and gain traction in terms of market share." http://www.streetinsider.com/Hot+New+Coverage/UPDATE%3A+Citi…
Der größte Teil der Bewertung (aktuell 2,25 Mrd USD) basiert auf PI-Ergebnissen von nur wenigen NSCLC-Partienten mit einer T790M-Mutation, der am meisten verbreiteten Resistenz gegen EGFR-Hemmer. CO-1686 ist der erste, der hier wirken könnte. In naher Zukunft könnte aber möglicherweise Konkurrenz entstehen durch AZNs AZD9291 (ex-US PI-Daten nächstes Wochenende zur ESMO) oder vielleicht ARIAs AP26113.
Weitere CO-1686-Daten sollen am 28.10. kommen... Ende des Jahres vielleicht der Start einer Zulassungs-PII für T790M.
Das Management von CLVS hat Erfahrung mit Verkäufen... u.a. durch den 3 Mrd USD Verkauf von Pharmion an CELG.

Gruß
ipollit
Clovis würde sich gerne selber verkaufen... "Clovis is working with advisers including Credit Suisse AG to help it find a buyer, the people said, asking not to be identified as the information is private. The process is still in the early stages and the company is not yet in exclusive talks with any potential acquirer, one of the people said." http://www.bloomberg.com/news/2013-09-17/clovis-oncology-sai…
und entsprechende luftige Kursziele... "Citi initiated coverage on Clovis Oncology (NASDAQ: CLVS) with a Buy rating and a price target of $109.00. Analyst Yaron Werber called the company an excellent M&A target and thinks it could fetch as much as $177 per share in a sale. This assumes Clovis Oncology drugs are approved and gain traction in terms of market share." http://www.streetinsider.com/Hot+New+Coverage/UPDATE%3A+Citi…
Der größte Teil der Bewertung (aktuell 2,25 Mrd USD) basiert auf PI-Ergebnissen von nur wenigen NSCLC-Partienten mit einer T790M-Mutation, der am meisten verbreiteten Resistenz gegen EGFR-Hemmer. CO-1686 ist der erste, der hier wirken könnte. In naher Zukunft könnte aber möglicherweise Konkurrenz entstehen durch AZNs AZD9291 (ex-US PI-Daten nächstes Wochenende zur ESMO) oder vielleicht ARIAs AP26113.
Weitere CO-1686-Daten sollen am 28.10. kommen... Ende des Jahres vielleicht der Start einer Zulassungs-PII für T790M.
Das Management von CLVS hat Erfahrung mit Verkäufen... u.a. durch den 3 Mrd USD Verkauf von Pharmion an CELG.
Gruß
ipollit
REGN
Sanofi ist interessiert den Anteil an REGN weiter zu erhöhen von aktuell 16% auf bis zu 30%. Die Kooperation zwischen REGN und Sanofi ist für mich ähnlich wie zwischen Genentech und Roche damals. Langfristig ist es nicht unwahrscheinlich, dass Sanofi REGN komplett schlucken könnte.
http://www.businessweek.com/ap/2013-09-13/regeneron-climbs-a…
"He said Sanofi could also look at raising its stake in Regeneron to as much as 30 percent. Sanofi holds about 16 percent of Regeneron and said in February it has the right to increase this to a maximum 30 percent under its decade-long partnership with Regeneron.
"The Regeneron relationship has become extremely productive for us," Viehbacher said. "Over time, it could well make sense to build our stake up to 30 percent. How fast we do that, whether or not we do that is a function of a number of different factors - but it is a bulky chunk of money to use."
Eylea hat inzwischen schon Lucentis überholt...
http://www.mmm-online.com/eylea-outduels-lucentis-for-physic…
"According to BioTrends, Eylea's patient share, which stands at 26% of surveyed doctors' wet-AMD patients, outpaces that of Lucentis, which holds about 21% of the surveyed doctors' wet-AMD patients. That means Eylea has overtaken the older med just two years after approval, quickly eroding Lucentis' hold on the market, despite Roche's having five years to establish Lucentis."
http://www.istockanalyst.com/finance/story/6443684/regeneron…
"We currently forecast 2020E Eylea sales of $3.7B of which $1.2B come from DME. However, we are also cautious given that we believe current expectations assume Eylea growth can continue, that the DME market will materialize and that Eylea will continue to take market share," Harrison said."
weitere Blockbuster könnten folgen:
PCSK9 zur Reduzierung der Blutfettwerte: http://www.epvantage.com/Universal/View.aspx?type=Story&id=4… "... In the lead is alirocumab (REGN727/SAR236553) from Sanofi/Regeneron; phase III trials will begin to report later this year. With dosing every two weeks, alirocumab has also been formulated in a pen device. The product is slated to be launched in 2015, and sales are forecast to reach $621m by 2018, according to EvaluatePharma.
Next in line is Amgen’s AMG145, which is in a phase III trial recruiting patients. Deutsch Bank notes that this could be launched a year later than Sanofi’s. EvaluatePharma forecasts 2018 sales of $140m. AMG145 could boast more flexible dosing and is progressing with once-monthly, as well as fortnightly dosing. However, the analysts note that once-monthly dosing results in a modest loss of efficacy and requires two separate injections.
This leaves Pfizer’s PF-04950615 in third place, with an expected launch in 2017. Roche is, however, hot on its heels... "
interessant vielleicht auch IL4R-AK Dupilumab u.a. gegen Asthma und Allergien: http://www.businessweek.com/ap/2013-09-13/regeneron-climbs-a…"Lazard Capital Markets analyst Joshua Schimmer said he believes the Tarrytown, N.Y., company has "another blockbuster franchise" in the works to complement its eye drug Eylea. He said Regeneron's experimental drug dupilumab could address a market exceeding $10 billion. Regeneron and its partner Sanofi are conducting clinical trials of the drug as a treatment for allergic asthma and atopic dermatitis, and Schimmer said it could be used as a treatment for other conditions including food allergies and eosinophilic esophagitis, an allergic inflammation of the esophagus." ... das sollte der gleiche Markt sein, in dem auch ARRYs CRTh2-Hemmer ARRY-502 eingesetzt werden könnte.

Gruß
ipollit
Sanofi ist interessiert den Anteil an REGN weiter zu erhöhen von aktuell 16% auf bis zu 30%. Die Kooperation zwischen REGN und Sanofi ist für mich ähnlich wie zwischen Genentech und Roche damals. Langfristig ist es nicht unwahrscheinlich, dass Sanofi REGN komplett schlucken könnte.
http://www.businessweek.com/ap/2013-09-13/regeneron-climbs-a…
"He said Sanofi could also look at raising its stake in Regeneron to as much as 30 percent. Sanofi holds about 16 percent of Regeneron and said in February it has the right to increase this to a maximum 30 percent under its decade-long partnership with Regeneron.
"The Regeneron relationship has become extremely productive for us," Viehbacher said. "Over time, it could well make sense to build our stake up to 30 percent. How fast we do that, whether or not we do that is a function of a number of different factors - but it is a bulky chunk of money to use."
Eylea hat inzwischen schon Lucentis überholt...
http://www.mmm-online.com/eylea-outduels-lucentis-for-physic…
"According to BioTrends, Eylea's patient share, which stands at 26% of surveyed doctors' wet-AMD patients, outpaces that of Lucentis, which holds about 21% of the surveyed doctors' wet-AMD patients. That means Eylea has overtaken the older med just two years after approval, quickly eroding Lucentis' hold on the market, despite Roche's having five years to establish Lucentis."
http://www.istockanalyst.com/finance/story/6443684/regeneron…
"We currently forecast 2020E Eylea sales of $3.7B of which $1.2B come from DME. However, we are also cautious given that we believe current expectations assume Eylea growth can continue, that the DME market will materialize and that Eylea will continue to take market share," Harrison said."
weitere Blockbuster könnten folgen:
PCSK9 zur Reduzierung der Blutfettwerte: http://www.epvantage.com/Universal/View.aspx?type=Story&id=4… "... In the lead is alirocumab (REGN727/SAR236553) from Sanofi/Regeneron; phase III trials will begin to report later this year. With dosing every two weeks, alirocumab has also been formulated in a pen device. The product is slated to be launched in 2015, and sales are forecast to reach $621m by 2018, according to EvaluatePharma.
Next in line is Amgen’s AMG145, which is in a phase III trial recruiting patients. Deutsch Bank notes that this could be launched a year later than Sanofi’s. EvaluatePharma forecasts 2018 sales of $140m. AMG145 could boast more flexible dosing and is progressing with once-monthly, as well as fortnightly dosing. However, the analysts note that once-monthly dosing results in a modest loss of efficacy and requires two separate injections.
This leaves Pfizer’s PF-04950615 in third place, with an expected launch in 2017. Roche is, however, hot on its heels... "
interessant vielleicht auch IL4R-AK Dupilumab u.a. gegen Asthma und Allergien: http://www.businessweek.com/ap/2013-09-13/regeneron-climbs-a…"Lazard Capital Markets analyst Joshua Schimmer said he believes the Tarrytown, N.Y., company has "another blockbuster franchise" in the works to complement its eye drug Eylea. He said Regeneron's experimental drug dupilumab could address a market exceeding $10 billion. Regeneron and its partner Sanofi are conducting clinical trials of the drug as a treatment for allergic asthma and atopic dermatitis, and Schimmer said it could be used as a treatment for other conditions including food allergies and eosinophilic esophagitis, an allergic inflammation of the esophagus." ... das sollte der gleiche Markt sein, in dem auch ARRYs CRTh2-Hemmer ARRY-502 eingesetzt werden könnte.
Gruß
ipollit
CLDX
Eine Kombination von CDX-1127 mit einem Checkpoint-Hemmer wie Yervoy fände ich spannend...
"CDX-1127 (phase I) likely has achieved goals for the solid tumor trial, of demonstrating initial safety and immune response... Management noted that tumor response could be limited by immune checkpoints that may still exist in these patients. At the SITC meeting (Nov 6-10), we expect data on 20+ patients from the solid tumor dose escalation cohorts, limited data from the expansion cohorts in melanoma and renal cell carcinoma as well as preclinical data on the combination of CDX1127 with Yervoy as an example of immune co-stimulatory agonist and checkpoint inhibitor combination... Regarding the development strategy, management indicated a plan to initiate combination studies in 2014 and, in absence of a partnership, Yervoy could potentially be used as a combination partner."
https://twitter.com/zDonShimoda/status/380666548169363457/ph…
"CDX-1127 prelim data expected Nov 6 at SITC..Jefferies looking for OR in high teens"

Gruß
ipollit
Eine Kombination von CDX-1127 mit einem Checkpoint-Hemmer wie Yervoy fände ich spannend...
"CDX-1127 (phase I) likely has achieved goals for the solid tumor trial, of demonstrating initial safety and immune response... Management noted that tumor response could be limited by immune checkpoints that may still exist in these patients. At the SITC meeting (Nov 6-10), we expect data on 20+ patients from the solid tumor dose escalation cohorts, limited data from the expansion cohorts in melanoma and renal cell carcinoma as well as preclinical data on the combination of CDX1127 with Yervoy as an example of immune co-stimulatory agonist and checkpoint inhibitor combination... Regarding the development strategy, management indicated a plan to initiate combination studies in 2014 and, in absence of a partnership, Yervoy could potentially be used as a combination partner."
https://twitter.com/zDonShimoda/status/380666548169363457/ph…
"CDX-1127 prelim data expected Nov 6 at SITC..Jefferies looking for OR in high teens"

Gruß
ipollit
Antwort auf Beitrag Nr.: 45.496.633 von ipollit am 22.09.13 13:14:17Hallo ipollit,
ENTA ist ja quasi genau dann gestiegen, als ich zu zweifeln begann.
Dew Dilligence hatte ja auch eine (sehr optimistische) Kalkulation aufgestellt und kommt auf ein Kursziel von 66$.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Deinen Nachkauf bei Arqule kann ich gut nachvollziehen. Der allgemeine Rat zu kaufen, wenn die Kanonen donnern ist m.E. gerade bei solide fianzierten Biotechs (und oder solchen mit verpartnerten Programmen) sehr erfolgreich. Interessant auch der Link zum Interview mit Nussbaum. Er äußert sich ja auch recht positiv zu Morphosys und Genmab. Mir persönlich gefällt Morphosys sogar noch besser. Ich bin da sehr gespannt auf die ersten Ergebnisse zu MOR202. Celgene hat da ja doch einiges an Geld auf den Tisch gelegt. Überhaupt muss man dem Management ein Kompliment machen. Was da in den letzten Jahren an Werten geschaffen wurde ist unglaublich.
Ansonsten habe ich mir noch eine Position ISIS aufgebaut. Auch hier gibt es ja eine extrem breite Pipeline und zuletzt auch gute Studienergebnisse. Im Vergleich zu ALNY und SRPT scheint mir ISIS trotz des Anstiegs nicht zu teuer. Dazu noch die lukrativen Deals mit z.B. Biogen.
Meine Tradingposition Valneva habe ich aufgelöst, auch wenn gerade Bewegung drin ist. Ich gabe mir statt dessen eine Position IGXT gekauft. Hier gibt es Anfang 2014 einen PDUFA Termin. Fundamental bin ich nicht wirklich überzeugt aber es ist halt ein Zock auf einen Runup. Hier soll noch eine Kapitalerhöhung durchgeführt werden und dann...?
Meine Werte zur Zeit: LGND, ARRY, ENTA, FURX, Morphosys, Genmab, ISIS, IGXT, Paion
SG kmastra
ENTA ist ja quasi genau dann gestiegen, als ich zu zweifeln begann.

Dew Dilligence hatte ja auch eine (sehr optimistische) Kalkulation aufgestellt und kommt auf ein Kursziel von 66$.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
Deinen Nachkauf bei Arqule kann ich gut nachvollziehen. Der allgemeine Rat zu kaufen, wenn die Kanonen donnern ist m.E. gerade bei solide fianzierten Biotechs (und oder solchen mit verpartnerten Programmen) sehr erfolgreich. Interessant auch der Link zum Interview mit Nussbaum. Er äußert sich ja auch recht positiv zu Morphosys und Genmab. Mir persönlich gefällt Morphosys sogar noch besser. Ich bin da sehr gespannt auf die ersten Ergebnisse zu MOR202. Celgene hat da ja doch einiges an Geld auf den Tisch gelegt. Überhaupt muss man dem Management ein Kompliment machen. Was da in den letzten Jahren an Werten geschaffen wurde ist unglaublich.
Ansonsten habe ich mir noch eine Position ISIS aufgebaut. Auch hier gibt es ja eine extrem breite Pipeline und zuletzt auch gute Studienergebnisse. Im Vergleich zu ALNY und SRPT scheint mir ISIS trotz des Anstiegs nicht zu teuer. Dazu noch die lukrativen Deals mit z.B. Biogen.
Meine Tradingposition Valneva habe ich aufgelöst, auch wenn gerade Bewegung drin ist. Ich gabe mir statt dessen eine Position IGXT gekauft. Hier gibt es Anfang 2014 einen PDUFA Termin. Fundamental bin ich nicht wirklich überzeugt aber es ist halt ein Zock auf einen Runup. Hier soll noch eine Kapitalerhöhung durchgeführt werden und dann...?
Meine Werte zur Zeit: LGND, ARRY, ENTA, FURX, Morphosys, Genmab, ISIS, IGXT, Paion
SG kmastra
Antwort auf Beitrag Nr.: 45.496.687 von ipollit am 22.09.13 13:39:52CLVS
angeblich haben sie einen Käufer gesucht und keine Interessenten gefunden... das ist natürlich nicht so positiv.
Naja, vor diesen Gerüchten hatte ich CLVS tendentiell auf reduzieren, da die Bewertung schon recht hoch ist für dieses frühe Entwicklungsstadium. Andererseits halte ich CO-1686 immer noch für aussichtsreich, weil EGFR-Hemmer etabliert sind, aber sich in 50% eine Resistenz aufgrund von T790 bildet:
http://mct.aacrjournals.org/content/7/4/874.full
"For example, non–small cell lung cancers (NSCLC) harboring mutant epidermal growth factor receptor (EGFR) often respond well to treatment with the EGFR kinase inhibitors gefitinib and erlotinib. These TKIs compete with ATP in a reversible manner to bind the kinase domain of their targets. Although the initial response to treatment with these agents can be dramatic, most patients eventually relapse due to the acquisition of drug resistance. In approximately half of NSCLC cases that showed an initial response to EGFR TKIs and subsequently progressed, resistance is associated with the emergence of a single recurrent missense mutation T790M within the EGFR kinase domain."
CO-1686 ist bisher der einzige EGFR-Hemmer, der auch bei T790 wirkt. Außerdem bindet es nicht so stark an normalem wild-type EGFR, weshalb die Nebenwirkungen geringer sein könnten... vielleicht kann man so auch wirksamer dosieren. Insgesamt könnte CO-1686 meiner Meinung nach der EGFR-Hemmer der ersten Wahl werden, was andere nicht so sehen. Aber was ist das wert? Eine vorzeitige Zulassung wäre frühestens 2015 möglich und wie gesagt, gibt es aber noch kaum Daten. Astellas hat vor einigen Jahren für 4 Mrd USD OSI übernommen, dessen EGFR-Hemmer Tarceva der Standard bei NSCLC ist. OSI hatte aber nur 50% der US-Rechte und weltweit Royalties von Roche.
Gruß
ipollit
angeblich haben sie einen Käufer gesucht und keine Interessenten gefunden... das ist natürlich nicht so positiv.
Naja, vor diesen Gerüchten hatte ich CLVS tendentiell auf reduzieren, da die Bewertung schon recht hoch ist für dieses frühe Entwicklungsstadium. Andererseits halte ich CO-1686 immer noch für aussichtsreich, weil EGFR-Hemmer etabliert sind, aber sich in 50% eine Resistenz aufgrund von T790 bildet:
http://mct.aacrjournals.org/content/7/4/874.full
"For example, non–small cell lung cancers (NSCLC) harboring mutant epidermal growth factor receptor (EGFR) often respond well to treatment with the EGFR kinase inhibitors gefitinib and erlotinib. These TKIs compete with ATP in a reversible manner to bind the kinase domain of their targets. Although the initial response to treatment with these agents can be dramatic, most patients eventually relapse due to the acquisition of drug resistance. In approximately half of NSCLC cases that showed an initial response to EGFR TKIs and subsequently progressed, resistance is associated with the emergence of a single recurrent missense mutation T790M within the EGFR kinase domain."
CO-1686 ist bisher der einzige EGFR-Hemmer, der auch bei T790 wirkt. Außerdem bindet es nicht so stark an normalem wild-type EGFR, weshalb die Nebenwirkungen geringer sein könnten... vielleicht kann man so auch wirksamer dosieren. Insgesamt könnte CO-1686 meiner Meinung nach der EGFR-Hemmer der ersten Wahl werden, was andere nicht so sehen. Aber was ist das wert? Eine vorzeitige Zulassung wäre frühestens 2015 möglich und wie gesagt, gibt es aber noch kaum Daten. Astellas hat vor einigen Jahren für 4 Mrd USD OSI übernommen, dessen EGFR-Hemmer Tarceva der Standard bei NSCLC ist. OSI hatte aber nur 50% der US-Rechte und weltweit Royalties von Roche.
Gruß
ipollit
es könnte vielleich sein, dass inzwischen eine kleine Biotech-Blase entstanden ist. Wenn ich sehe, wie z.B. CLDX zuletzt gestiegen ist...

MKs z.B. ...
- CLDX: 2,7 Mrd USD
- SGEN: 5,3 Mrd USD
- ALNY: 4,0 Mrd USD
- ISIS: 4,2 Mrd USD
- INCY: 5,6 Mrd USD
- PCYC: 8,7 Mrd USD
- ...
Vielleicht sollte man hier und da etwas reduzieren.
Gibt es noch interessante Werte, die nicht Mrd MKs haben?
- KaloBios (KBIO)... EphA3-AK?
- Acceleron (XLRN)... ALK1-Hemmer?
- Five Prime (FPRX)... FGFR-Hemmer?
- Mirati (MRTX)... AXL-Hemmer?
Gruß
ipollit
MKs z.B. ...
- CLDX: 2,7 Mrd USD
- SGEN: 5,3 Mrd USD
- ALNY: 4,0 Mrd USD
- ISIS: 4,2 Mrd USD
- INCY: 5,6 Mrd USD
- PCYC: 8,7 Mrd USD
- ...
Vielleicht sollte man hier und da etwas reduzieren.
Gibt es noch interessante Werte, die nicht Mrd MKs haben?
- KaloBios (KBIO)... EphA3-AK?
- Acceleron (XLRN)... ALK1-Hemmer?
- Five Prime (FPRX)... FGFR-Hemmer?
- Mirati (MRTX)... AXL-Hemmer?
Gruß
ipollit
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 55 | ||
| 49 | ||
| 44 | ||
| 42 | ||
| 40 | ||
| 21 | ||
| 14 | ||
| 10 | ||
| 10 | ||
| 10 |
| Wertpapier | Beiträge | |
|---|---|---|
| 9 | ||
| 9 | ||
| 9 | ||
| 8 | ||
| 7 | ||
| 7 | ||
| 7 | ||
| 7 | ||
| 6 | ||
| 6 |






















