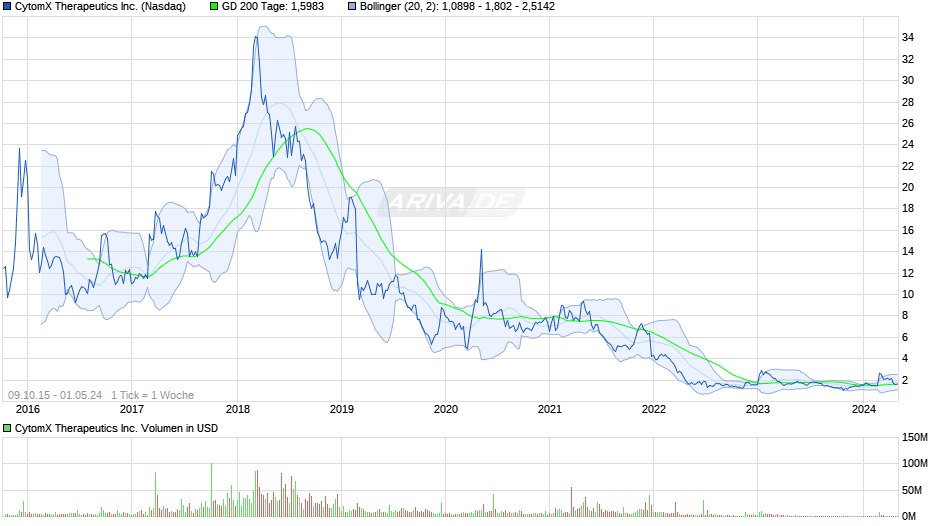
CytomX - ein bahnbrechender Ansatz in der Tumortherapie - 500 Beiträge pro Seite (Seite 3)
eröffnet am 01.07.16 16:03:16 von
neuester Beitrag 27.01.24 11:32:06 von
neuester Beitrag 27.01.24 11:32:06 von
Beiträge: 1.459
ID: 1.234.534
ID: 1.234.534
Aufrufe heute: 1
Gesamt: 163.641
Gesamt: 163.641
Aktive User: 0
ISIN: US23284F1057 · WKN: A14158 · Symbol: 6C1
1,5180
EUR
+1,47 %
+0,0220 EUR
Letzter Kurs 12:10:48 Tradegate
Neuigkeiten
08.04.24 · globenewswire |
03.04.24 · globenewswire |
21.03.24 · globenewswire |
18.03.24 · globenewswire |
12.03.24 · wO Chartvergleich |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,9000 | +59,66 | |
| 4,7450 | +35,57 | |
| 0,5250 | +19,08 | |
| 5,8900 | +17,80 | |
| 12,800 | +17,43 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,6900 | -14,50 | |
| 2,8150 | -15,21 | |
| 3,0400 | -19,95 | |
| 1,9500 | -25,14 | |
| 0,5121 | -30,80 |
Antwort auf Beitrag Nr.: 59.296.052 von deadflowers am 26.11.18 00:50:01Ich habe zum Anfang der Woche meine Position auf zartrosa verbilligt und spekuliere auf eine mittelfristige Erholung bis spätestens Ende Q1/2019. Nach meiner Auffassung erlauben die bisherigen Studienergebnissen zu CX072 eine positive Erwartungshaltung. Die langersehnten Ergebnisse zu CX2009 könnten weiter Auftrieb gegeben. Jedoch rechne ich auf Grund des schwierigen Umfeldes bei Biotech eher mit einem Seitwärtstrend mit spätem Ausbruch nach oben.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 59.322.017 von Jerry_Maguire am 28.11.18 23:38:18CytomX Therapeutics Announces Technology Acquisition From Agensys, Inc., an Affiliate of Astellas Pharma Inc.
January 7, 2019 at 8:00 AM EST
SOUTH SAN FRANCISCO, Calif., Jan. 07, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq:CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced it has acquired drug conjugate linker-toxin and CD3-based bispecific technologies from Agensys, Inc., an affiliate of Astellas Pharma Inc. Under the terms of the agreement, CytomX will pay Astellas a one-time, up-front payment.
“The clinical progress we reported throughout 2018 provided initial proof of concept for our Probody therapeutic platform. This transaction with Astellas provides us with novel payloads and CD3 binding moieties for our next wave of potent anti-cancer agents that leverage our technology, including Probody drug conjugates and Probody T cell engaging bispecifics,” said W. Michael Kavanaugh, M.D. chief scientific officer and head of research and non-clinical development at CytomX.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
CytomX muss von der eigenen Technologie bereits sehr überzeugt sein. Sonst hätte man den Zukauf zumindest nicht jetzt getätigt, oder?
January 7, 2019 at 8:00 AM EST
SOUTH SAN FRANCISCO, Calif., Jan. 07, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq:CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced it has acquired drug conjugate linker-toxin and CD3-based bispecific technologies from Agensys, Inc., an affiliate of Astellas Pharma Inc. Under the terms of the agreement, CytomX will pay Astellas a one-time, up-front payment.
“The clinical progress we reported throughout 2018 provided initial proof of concept for our Probody therapeutic platform. This transaction with Astellas provides us with novel payloads and CD3 binding moieties for our next wave of potent anti-cancer agents that leverage our technology, including Probody drug conjugates and Probody T cell engaging bispecifics,” said W. Michael Kavanaugh, M.D. chief scientific officer and head of research and non-clinical development at CytomX.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
CytomX muss von der eigenen Technologie bereits sehr überzeugt sein. Sonst hätte man den Zukauf zumindest nicht jetzt getätigt, oder?
Antwort auf Beitrag Nr.: 59.575.358 von Admiral377 am 07.01.19 15:16:01Langer Winterschlaf bei Cytom X. Ja das sehe ich auch so, offensichtlich will man sich bereits die Linker Toxine sichern um zukünftige Gewinne im Haus zu behalten. Würde das auch positiv werten.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 59.575.358 von Admiral377 am 07.01.19 15:16:01Ich hoffe es.
Was heißt das genau, "aquired... technology"?
Die gesamte Technologie wurde exklusiv übernommen? Oder hat man sie lediglich lizenziert, wie bislang von Immunogen?
Im Worst Case könnte das im letzteren Fall bedeuten, dass die Payloads von Immunogen in den bislang gestartet PDC-Studien nicht so tolle Ergebnisse gebracht haben und nun auf eine andere Technologie gesetzt wird.
Was heißt das genau, "aquired... technology"?
Die gesamte Technologie wurde exklusiv übernommen? Oder hat man sie lediglich lizenziert, wie bislang von Immunogen?
Im Worst Case könnte das im letzteren Fall bedeuten, dass die Payloads von Immunogen in den bislang gestartet PDC-Studien nicht so tolle Ergebnisse gebracht haben und nun auf eine andere Technologie gesetzt wird.
Antwort auf Beitrag Nr.: 59.575.691 von BReal am 07.01.19 15:58:34Nach dreimaligem Lesen kann eigentlich nur der vollständige Erwerb gemeint sein, oder es wurde nachlässig formuliert. Den Erwerb würde ich positiv werten.
Offenbar befindet sich Agensys seit längerem in Auflösung, siehe beispielsweise hier:
https://www.genengnews.com/topics/drug-discovery/astellas-sh…
Astellas hat wohl keine Lust mehr auf (neue) ADC-Forschung. Von daher gehe ich davon aus, dass diese Technologie aus der Resteverwertung komplett übernommen wurde. Zwar kann ich nicht beurteilen, wie die im Vergleich zu anderen ADC-Technologien (Immunogen, Seattle, Heidelberg) zu bewerten ist, gehe aber davon aus, das die Leute bei Cytomx es können, und das ganze unter "keep out the middleman" zu sehen ist, sprich man macht die PDCs künftig komplett allein.
https://www.genengnews.com/topics/drug-discovery/astellas-sh…
Astellas hat wohl keine Lust mehr auf (neue) ADC-Forschung. Von daher gehe ich davon aus, dass diese Technologie aus der Resteverwertung komplett übernommen wurde. Zwar kann ich nicht beurteilen, wie die im Vergleich zu anderen ADC-Technologien (Immunogen, Seattle, Heidelberg) zu bewerten ist, gehe aber davon aus, das die Leute bei Cytomx es können, und das ganze unter "keep out the middleman" zu sehen ist, sprich man macht die PDCs künftig komplett allein.
Interessant finde ich ja schon auch, dass der CSO aufgrund des klinischen Fortschritts nun von einem "...initial Proof of Concept..." spricht...by the way die Summe der Aqui würde mich auch interessieren

Antwort auf Beitrag Nr.: 59.582.348 von Gustl24 am 08.01.19 11:16:43Von einem PoC wurde im 2018 SITC Report in 11/18 auch schon gesprochen. Nur dass das den Markt kalt gelassen hat. Soweit ich es verstehe hat sich Astella aus der ADC Forschung zurück gezogen um sich den eigentlichen onkologischen Therapien zu zu wenden bzw. dies mit Partnern zu tun und einen Teil der Ergebnisse zu verkaufen.
Gruß
JM
Gruß
JM
CytomX Therapeutics to Host Research and Development Day on February 26, 2019
SOUTH SAN FRANCISCO, Calif., Jan. 30, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced its plans to host a Research and Development Day on February 26, 2019 from 8:00 a.m. – 11:30 a.m. ET in New York City.
Members of CytomX’s senior executive team will be joined by:
Alex Spira, M.D., Ph.D., FACP, Director, Virginia Cancer Specialists Research Institute, Assistant Professor, Johns Hopkins School of Medicine and Medical Director, US Oncology Lung Program
Alex Spira steht im Zusammenhang mit CX-072. Darum wird es bei dem Tag also auf jeden Fall gehen.
Zudem habe ich auf der Cytomx-Seite noch dieses Poster gefunden.
https://cytomx.com/wp-content/uploads/SABCS-2018-CX-072-TNBC…
Die Teilnahme am San Antonio Breast Cancer Symposium Anfang Dezember 2018, wo das Poster vorgestellt wurde, wurde meines Wissens nirgends verkündet. 14 Patienten mit TNBC sind laut Poster zunächst in der Phase 2a dabei. In der Phase 2a Studie gibt es natürlich auch andere Tumortypen, aber das Poster dreht sich um TNBC und das Phase 2a Studiendesign.
Leider funktioniert die NCT-Nummer und der Link aus dem Poster nicht. Komisch..
SOUTH SAN FRANCISCO, Calif., Jan. 30, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced its plans to host a Research and Development Day on February 26, 2019 from 8:00 a.m. – 11:30 a.m. ET in New York City.
Members of CytomX’s senior executive team will be joined by:
Alex Spira, M.D., Ph.D., FACP, Director, Virginia Cancer Specialists Research Institute, Assistant Professor, Johns Hopkins School of Medicine and Medical Director, US Oncology Lung Program
Alex Spira steht im Zusammenhang mit CX-072. Darum wird es bei dem Tag also auf jeden Fall gehen.
Zudem habe ich auf der Cytomx-Seite noch dieses Poster gefunden.
https://cytomx.com/wp-content/uploads/SABCS-2018-CX-072-TNBC…
Die Teilnahme am San Antonio Breast Cancer Symposium Anfang Dezember 2018, wo das Poster vorgestellt wurde, wurde meines Wissens nirgends verkündet. 14 Patienten mit TNBC sind laut Poster zunächst in der Phase 2a dabei. In der Phase 2a Studie gibt es natürlich auch andere Tumortypen, aber das Poster dreht sich um TNBC und das Phase 2a Studiendesign.
Leider funktioniert die NCT-Nummer und der Link aus dem Poster nicht. Komisch..
Das sieht (momentan) ganz gut aus, ich habe zu den günstigen Kursen immer wieder paar nachgekauft.
Bei Morphosys wusste man vor vielen Jahren auch nicht was wird, hier hat mann zwar mehr Risiko im Moment, aber wenn dann wird es sich auch lohnen aller Morphosys

Alles meine Gedanken
Bei Morphosys wusste man vor vielen Jahren auch nicht was wird, hier hat mann zwar mehr Risiko im Moment, aber wenn dann wird es sich auch lohnen aller Morphosys

Alles meine Gedanken
Antwort auf Beitrag Nr.: 59.750.610 von hinz12 am 30.01.19 22:00:41Alex soira heißt der gute Mann. Wo hast du die Info her dass er in Zusammenhang mit cx-072 steht?
Antwort auf Beitrag Nr.: 59.772.804 von biopadawan am 01.02.19 21:54:41Laut der Pressemeldung von Cytomx heißt der gute Mann Alex Spira.
Google den Namen mal in Verbindung mit CX-072. Er hat an vielen bis jetzt veröffentlichten Postern zu CX-072 mitgearbeitet.
Google den Namen mal in Verbindung mit CX-072. Er hat an vielen bis jetzt veröffentlichten Postern zu CX-072 mitgearbeitet.
Antwort auf Beitrag Nr.: 59.773.023 von hinz12 am 01.02.19 22:22:44Hallo Hinz12,
Alex Spira war auch wesentlich in der klinische Phasen-Entwicklung von Tecentriq/ Pd-L1 von Roche beteiligt. Er ist im IO-Klinikbereich eine große Nummer.
Ihn zur 2,5 stündigen Präsentation in New York zu bekommen, ist schon ein kleiner Fingerzeig.
Alex Spira war auch wesentlich in der klinische Phasen-Entwicklung von Tecentriq/ Pd-L1 von Roche beteiligt. Er ist im IO-Klinikbereich eine große Nummer.
Ihn zur 2,5 stündigen Präsentation in New York zu bekommen, ist schon ein kleiner Fingerzeig.
Antwort auf Beitrag Nr.: 59.774.202 von StefanR am 02.02.19 09:37:58Sehr interessant, Stefan.
Ich hab nun auch schon gelesen, dass es vielleicht um CX-2009 gehen wird, wobei es tatsächlich komisch ist, die ersten Daten zu dem Programm an einem Investorentag vorzustellen. Was dann am Ende auch das Thema sein wird, auf jeden Fall super, dass so ein Experte spricht.
Auch merkwürdig ist, dass die Börse nicht schon am Donnerstag auf die Ankündigung des Investorentags am Mittwoch reagiert hat. Gab es Donnerstag nach Börsenschluss oder Freitag vielleicht noch andere neue Informationen im Zusammenhang mit Cytmox? Gestern über 10 Prozent plus ist natürlich erfreulich.
Ich hab nun auch schon gelesen, dass es vielleicht um CX-2009 gehen wird, wobei es tatsächlich komisch ist, die ersten Daten zu dem Programm an einem Investorentag vorzustellen. Was dann am Ende auch das Thema sein wird, auf jeden Fall super, dass so ein Experte spricht.
Auch merkwürdig ist, dass die Börse nicht schon am Donnerstag auf die Ankündigung des Investorentags am Mittwoch reagiert hat. Gab es Donnerstag nach Börsenschluss oder Freitag vielleicht noch andere neue Informationen im Zusammenhang mit Cytmox? Gestern über 10 Prozent plus ist natürlich erfreulich.
Piper hatte sich die Tage mit einer neuen Analyse gemeldet,
einige der anderen Firmen legten auch zu, evt. könnte dies auch mit ein Grund sein und natürlich charttechnisch Auspruch.

einige der anderen Firmen legten auch zu, evt. könnte dies auch mit ein Grund sein und natürlich charttechnisch Auspruch.

Meinerseits ein paar Anmerkungen zu den letzten Entwicklungen.
Ich wollte noch eine Auswertung bzgl. Thymoma u. ex Thymoma der klin. Studien des CX-072 PD-L1 erstellen. Hier sind aber doch zu viele Unbekannte bzgl. Nebenwirkungen bei Pembro (Kollektiv n=25 im relevanten ≥ 3mg/kg Dosisbereich) im Spiel, um das aussagekräftig zu gestalten.
Nun stelle ich trotzdem mal meine bisherigen Spielereien ein, inkl. Wirksamkeitsvergleich mit Pembro bei Thymoma.
Ein Nebenwirkungsvergleich mit Pembro konnte ich nicht erstellen, da mir die exakten Pembro-Daten fehlen. Die Nebenwirkungen im relevanten Dosisbereich des CX-072 ex Thymoma sehen natürlich hervorragend aus ;-). Mal abwarten, wie sich die Werte (Nebenwirkungen u. Ansprechraten) bei längerer Behandlungsdauer u. nicht PD-L1 negativ entwickeln.
Der IND bzgl. CX-188 ist durch ("The IND for CX-188 has been cleared by the FDA."), siehe https://cytomx.com/pipeline/ unter CX-188.
Bei der sonst so defensiven Kommunikation, muten einige der ausgeschriebenen Stellen bei CTMX https://cytomx.com/culture-and-careers/job-listings/ etwas seltsam an.
z.B.: Vice President, Commercial Market Strategy,
The Vice President, Commercial will support the commercialization of CytomX’s assets worldwide. Key near-term responsibilities will relate to market analysis to meaningfully contribute to the development strategy. As we move closer to registration, key responsibilities will include supporting the activities that anticipate marketing and sales in preparation for regulatory approval and launch of our lead Probody candidates.
Die automatisierten Aktienverkäufe der Vorstände scheinen mit Beginn 2019 auch beendet.
Leider wurden sich die klinischen Studien kaum verändert / aktualisiert, außer der BMS Probody-IPI.
BMS sollte trotz der Übernahme von Celgene an der CTMX-Kooperation weiterarbeiten, da Nivo gegenüber Mercks Keytruda langsam ins Hintertreffen gerät.
Neue Patente bzgl. CD71 https://patents.justia.com/assignee/cytomx-therapeutics-inc
Ich bin ob der o.g. Punkte doch vorsichtig optimistisch, auch wenn das noch keine wirklich messbaren Erfolge sind.
Ich wollte noch eine Auswertung bzgl. Thymoma u. ex Thymoma der klin. Studien des CX-072 PD-L1 erstellen. Hier sind aber doch zu viele Unbekannte bzgl. Nebenwirkungen bei Pembro (Kollektiv n=25 im relevanten ≥ 3mg/kg Dosisbereich) im Spiel, um das aussagekräftig zu gestalten.
Nun stelle ich trotzdem mal meine bisherigen Spielereien ein, inkl. Wirksamkeitsvergleich mit Pembro bei Thymoma.
Wirksamkeit:
Collective ≥ 3mg/kg Pat.-total CR+PR No SD No PD No IE No CR+PR % SD % PD % IE % DCR %
ESMO A1+A2 2018-08 excl. Thym. 12 2 4 5 1 16.7 33.3 41.7 8.3 50.0
ESMO A1+A2 2018-08 Thym. 6 1 4 0 1 16.7 66.7 0.0 16.7 83.3
Thym. Pembro - Giaccone et al. 23 5 9 7 2 21.7 39.1 30.4 8.7 60.9
Thym. Pembro - Giaccone et al. 40 9 20 11 0 22.5 50.0 27.5 0.0 72.5
Thym. Pembro - Cho et al. 33 8 17 8 0 24.2 51.5 24.2 0.0 75.8
I.E. = nicht auswertbar
Nebenwirkungen:
Collective ≥ 3mg/kg Pat.-total TRAE Gr3/4 No TRAE Gr3/4 % IrAE Gr3/4 No IrAE Gr3/4 %
ESMO A1+A2 2018-08 excl. Thym. 19 1 5.3 1 5.3
ESMO A1+A2 2018-08 Thym. 6 2 33.3 2 33.3
Ein Nebenwirkungsvergleich mit Pembro konnte ich nicht erstellen, da mir die exakten Pembro-Daten fehlen. Die Nebenwirkungen im relevanten Dosisbereich des CX-072 ex Thymoma sehen natürlich hervorragend aus ;-). Mal abwarten, wie sich die Werte (Nebenwirkungen u. Ansprechraten) bei längerer Behandlungsdauer u. nicht PD-L1 negativ entwickeln.
Der IND bzgl. CX-188 ist durch ("The IND for CX-188 has been cleared by the FDA."), siehe https://cytomx.com/pipeline/ unter CX-188.
Bei der sonst so defensiven Kommunikation, muten einige der ausgeschriebenen Stellen bei CTMX https://cytomx.com/culture-and-careers/job-listings/ etwas seltsam an.
z.B.: Vice President, Commercial Market Strategy,
The Vice President, Commercial will support the commercialization of CytomX’s assets worldwide. Key near-term responsibilities will relate to market analysis to meaningfully contribute to the development strategy. As we move closer to registration, key responsibilities will include supporting the activities that anticipate marketing and sales in preparation for regulatory approval and launch of our lead Probody candidates.
Die automatisierten Aktienverkäufe der Vorstände scheinen mit Beginn 2019 auch beendet.
Leider wurden sich die klinischen Studien kaum verändert / aktualisiert, außer der BMS Probody-IPI.
BMS sollte trotz der Übernahme von Celgene an der CTMX-Kooperation weiterarbeiten, da Nivo gegenüber Mercks Keytruda langsam ins Hintertreffen gerät.
Neue Patente bzgl. CD71 https://patents.justia.com/assignee/cytomx-therapeutics-inc
Ich bin ob der o.g. Punkte doch vorsichtig optimistisch, auch wenn das noch keine wirklich messbaren Erfolge sind.
Antwort auf Beitrag Nr.: 59.779.896 von Nase_weis_nix am 03.02.19 13:21:08vor Beitrag erstellen sollte ich besser Korrekturlesen - soll lauten:
.... Hier sind aber doch zu viele Unbekannte bzgl. Nebenwirkungen bei Pembro u. CX-072 (Kollektiv n=25 im relevanten ≥ 3mg/kg Dosisbereich) im Spiel, um das aussagekräftig zu gestalten.
streiche "sich"
... Leider wurden die klinischen Studien kaum verändert / aktualisiert, außer der BMS Probody-IPI.
Cytomx wird nicht von vielen Anlegern verfolgt und in den amerikanischen Biotech-Foren eher vernachlässigt. Die teils fachlich kompetenten Schreiber nehmen sich Cytomx überwiegend oberflächlich vor und kritisieren die bisherigen Ergebnisse als irrelevant gegenüber den Standards. Die klinische Pipeline wird als zu früh angesehen. Erst wenn ein klarer Wirksamkeitsnachweis bei guten Nebenwirkungen erbracht wird, kann sich das ändern.
Als Investor sollte man jedoch versuchen, vorab die Puzzlestücke zu suchen und zu verbinden. Das ermöglicht gewöhnlicherweise Erfolge abseits der Herde / des Mainstreams.
Die CX-2009 Dosiseskalation könnte bereits den Durchbruch (proof-of-concept) bei der breiten Investorenschar bedeuten. Sollte die Behandlung auch noch hinreichend wirksam sein, würde das m.e. zur Neubewertung führen.
Der letzte Kursanstieg könnte damit zusammenhängen, dass einige Anleger im Vorfeld des angekündigten Research and Development Day positive Indizien erkennen und beginnen, sich entsprechend zu positionieren.
.... Hier sind aber doch zu viele Unbekannte bzgl. Nebenwirkungen bei Pembro u. CX-072 (Kollektiv n=25 im relevanten ≥ 3mg/kg Dosisbereich) im Spiel, um das aussagekräftig zu gestalten.
streiche "sich"
... Leider wurden die klinischen Studien kaum verändert / aktualisiert, außer der BMS Probody-IPI.
Cytomx wird nicht von vielen Anlegern verfolgt und in den amerikanischen Biotech-Foren eher vernachlässigt. Die teils fachlich kompetenten Schreiber nehmen sich Cytomx überwiegend oberflächlich vor und kritisieren die bisherigen Ergebnisse als irrelevant gegenüber den Standards. Die klinische Pipeline wird als zu früh angesehen. Erst wenn ein klarer Wirksamkeitsnachweis bei guten Nebenwirkungen erbracht wird, kann sich das ändern.
Als Investor sollte man jedoch versuchen, vorab die Puzzlestücke zu suchen und zu verbinden. Das ermöglicht gewöhnlicherweise Erfolge abseits der Herde / des Mainstreams.
Die CX-2009 Dosiseskalation könnte bereits den Durchbruch (proof-of-concept) bei der breiten Investorenschar bedeuten. Sollte die Behandlung auch noch hinreichend wirksam sein, würde das m.e. zur Neubewertung führen.
Der letzte Kursanstieg könnte damit zusammenhängen, dass einige Anleger im Vorfeld des angekündigten Research and Development Day positive Indizien erkennen und beginnen, sich entsprechend zu positionieren.
Der Vollständigkeithalber hier die Pressemitteilung vom Dienstag 05.02.
CytomX Therapeutics Announces Senior Management Appointments
February 5, 2019 at 8:00 AM EST
Leadership Team Further Strengthened with Additions of Nick Galli, J.D., as SVP, Chief Business Officer and Leslie Robbins, J.D. as SVP, Intellectual Property
SOUTH SAN FRANCISCO, Calif., Feb. 05, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced the appointments of Nick Galli, J.D., as senior vice president, chief business officer and Leslie Robbins, J.D., as senior vice president, intellectual property.
“The additions Nick and Leslie to our leadership team reflect our ongoing commitment to partnership formation and aggressive protection of our intellectual property as core pillars of our corporate strategy,” said Sean McCarthy, D.Phil., president, chief executive officer and chairman of CytomX. “Nick’s proven track record in transformational business development and Leslie’s broad and deep IP experience across discovery, development and commercial stages of biologic drug development will be great assets as we seek to maximize the utility of our Probody technology for patients.”
Nick Galli, J.D.
Mr. Galli brings more than 15 years of transactions experience, most of which has been focused in the biotechnology industry. Most recently, Mr. Galli held the position of vice president, business development at Denali Therapeutics where he led the execution of more than twenty collaborations, including strategic partnerships with Sanofi-Genzyme, Takeda, Genentech and F-star. Prior to Denali, Mr. Galli was senior director, transactions at Johnson & Johnson Innovation Center. Prior to this, Mr. Galli held roles of increasing responsibility at Genentech within the business development and transactional law groups. Mr. Galli began his career as a corporate attorney at the law offices of Skadden, Arps, Slate, Meagher & Flom and practiced in the technology transactions group at Wilson Sonsini Goodrich & Rosati. Mr. Galli received his B.A. degree from Princeton University and his J.D. from the Georgetown University Law Center.
“CytomX has the potential to change the treatment paradigm in cancer. I am pleased to be joining a company with a strong track record of clinical development execution and look forward to helping build upon their current portfolio of partnerships,” said Mr. Galli.
Leslie Robbins, J.D.
Ms. Robbins has over 25 years of legal and intellectual property strategic experience within the biotechnology and pharmaceutical industries. Ms. Robbins joins CytomX from Coherus BioSciences where she held the role of vice president, intellectual property and was responsible for, among other things, the execution of legal strategies in support of the biosimilar platform. Prior to this, she held senior intellectual property counsel roles at Onyx Pharmaceuticals (acquired by Amgen) where she provided strategy and advice on intellectual property related matters related to KYPROLIS® and Elan Pharmaceuticals where she oversaw all intellectual property matters related to TYSABRI®, the company’s humanized antibody product. Ms. Robbins began her career at Chiron Corporation and later joined the law firm of Burns, Doane, Swecker & Mathis where she prepared and prosecuted U.S. and foreign patent applications in the biotechnology and pharmaceutical fields. Ms. Robbins received her B.A. degree in microbiology and immunology from the University of California, Berkeley and her J.D. from the Illinois Institute of Technology’s Chicago-Kent College of Law.
“I am excited to be a part of a pioneering company committed to improving the lives of cancer patients. I look forward to sharing my experiences in assisting companies as they evolve from development to commercial stage as we advance the Probody technology,” said Ms. Robbins.
Wenn man das liest, dann scheint Cytomx neue Partnerschaften zu suchen und ihre Patente weiter absichern und verteidigen zu wollen. Ich hoffe allerdings die Absicherung der Patente ist schon zur Genüge passiert.
CytomX Therapeutics Announces Senior Management Appointments
February 5, 2019 at 8:00 AM EST
Leadership Team Further Strengthened with Additions of Nick Galli, J.D., as SVP, Chief Business Officer and Leslie Robbins, J.D. as SVP, Intellectual Property
SOUTH SAN FRANCISCO, Calif., Feb. 05, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced the appointments of Nick Galli, J.D., as senior vice president, chief business officer and Leslie Robbins, J.D., as senior vice president, intellectual property.
“The additions Nick and Leslie to our leadership team reflect our ongoing commitment to partnership formation and aggressive protection of our intellectual property as core pillars of our corporate strategy,” said Sean McCarthy, D.Phil., president, chief executive officer and chairman of CytomX. “Nick’s proven track record in transformational business development and Leslie’s broad and deep IP experience across discovery, development and commercial stages of biologic drug development will be great assets as we seek to maximize the utility of our Probody technology for patients.”
Nick Galli, J.D.
Mr. Galli brings more than 15 years of transactions experience, most of which has been focused in the biotechnology industry. Most recently, Mr. Galli held the position of vice president, business development at Denali Therapeutics where he led the execution of more than twenty collaborations, including strategic partnerships with Sanofi-Genzyme, Takeda, Genentech and F-star. Prior to Denali, Mr. Galli was senior director, transactions at Johnson & Johnson Innovation Center. Prior to this, Mr. Galli held roles of increasing responsibility at Genentech within the business development and transactional law groups. Mr. Galli began his career as a corporate attorney at the law offices of Skadden, Arps, Slate, Meagher & Flom and practiced in the technology transactions group at Wilson Sonsini Goodrich & Rosati. Mr. Galli received his B.A. degree from Princeton University and his J.D. from the Georgetown University Law Center.
“CytomX has the potential to change the treatment paradigm in cancer. I am pleased to be joining a company with a strong track record of clinical development execution and look forward to helping build upon their current portfolio of partnerships,” said Mr. Galli.
Leslie Robbins, J.D.
Ms. Robbins has over 25 years of legal and intellectual property strategic experience within the biotechnology and pharmaceutical industries. Ms. Robbins joins CytomX from Coherus BioSciences where she held the role of vice president, intellectual property and was responsible for, among other things, the execution of legal strategies in support of the biosimilar platform. Prior to this, she held senior intellectual property counsel roles at Onyx Pharmaceuticals (acquired by Amgen) where she provided strategy and advice on intellectual property related matters related to KYPROLIS® and Elan Pharmaceuticals where she oversaw all intellectual property matters related to TYSABRI®, the company’s humanized antibody product. Ms. Robbins began her career at Chiron Corporation and later joined the law firm of Burns, Doane, Swecker & Mathis where she prepared and prosecuted U.S. and foreign patent applications in the biotechnology and pharmaceutical fields. Ms. Robbins received her B.A. degree in microbiology and immunology from the University of California, Berkeley and her J.D. from the Illinois Institute of Technology’s Chicago-Kent College of Law.
“I am excited to be a part of a pioneering company committed to improving the lives of cancer patients. I look forward to sharing my experiences in assisting companies as they evolve from development to commercial stage as we advance the Probody technology,” said Ms. Robbins.
Wenn man das liest, dann scheint Cytomx neue Partnerschaften zu suchen und ihre Patente weiter absichern und verteidigen zu wollen. Ich hoffe allerdings die Absicherung der Patente ist schon zur Genüge passiert.
Führungskräfte
CytomX Therapeutics gibt die Einstellung von Führungskräften bekannt.https://seekingalpha.com/news/3429577-cytomx-therapeutics-an…
5. Februar 2019 9:38 AM ET|Über uns: CytomX Therapeutics (CTMX)|By: Mamta Mayani, SA Nachrichtenredakteurin
CytomX Therapeutics (CTMX +3,1%) ernennt Nick Galli, J.D., zum Senior VP, Chief Business Officer und Leslie Robbins, J.D., zum Senior VP, Intellectual Property.
Herr Galli war zuletzt als Vice President Business Development bei Denali Therapeutics tätig.
Frau Robbins kommt von Coherus BioSciences zu CytomX, wo sie die Rolle des Vice President für geistiges Eigentum innehatte.
Jetzt lies: BCBSA gibt zusätzliche positive Deckungsrichtlinien für die Therapie von Inspire Medical heraus "
Gruss RS" target="_blank" rel="nofollow ugc noopener">[https://seekingalpha.com/news/3429577-cytomx-therapeutics-an…
5. Februar 2019 9:38 AM ET|Über uns: CytomX Therapeutics (CTMX)|By: Mamta Mayani, SA Nachrichtenredakteurin
CytomX Therapeutics (CTMX +3,1%) ernennt Nick Galli, J.D., zum Senior VP, Chief Business Officer und Leslie Robbins, J.D., zum Senior VP, Intellectual Property.
Herr Galli war zuletzt als Vice President Business Development bei Denali Therapeutics tätig.
Frau Robbins kommt von Coherus BioSciences zu CytomX, wo sie die Rolle des Vice President für geistiges Eigentum innehatte.
Jetzt lies: BCBSA gibt zusätzliche positive Deckungsrichtlinien für die Therapie von Inspire Medical heraus "
Gruss RS
Führungskräfte
CytomX Therapeutics gibt die Einstellung von Führungskräften bekannt.5. Februar 2019 9:38 AM ET|Über uns: CytomX Therapeutics (CTMX)|By: Mamta Mayani, SA Nachrichtenredakteurin
CytomX Therapeutics (CTMX +3,1%) ernennt Nick Galli, J.D., zum Senior VP, Chief Business Officer und Leslie Robbins, J.D., zum Senior VP, Intellectual Property.
Herr Galli war zuletzt als Vice President Business Development bei Denali Therapeutics tätig.
Frau Robbins kommt von Coherus BioSciences zu CytomX, wo sie die Rolle des Vice President für geistiges Eigentum innehatte.
Jetzt lies: BCBSA gibt zusätzliche positive Deckungsrichtlinien für die Therapie von Inspire Medical heraus "
Gruss RS
R&D war dann ja eher ein Reinfall :-)
Antwort auf Beitrag Nr.: 59.967.304 von riverstar_de am 26.02.19 15:47:49
tja BMS hat 3 Projekte gecancelt, CX-188 auf HOLD.
Ich glaube ja nicht, das die Firma außer die Chefs glücklich zu machen, irgendetwas tolles zustande bringen wird. Immer wenn Daten kommen, geht es massivst abwärts.
Zitat von riverstar_de: R&D war dann ja eher ein Reinfall :-)
tja BMS hat 3 Projekte gecancelt, CX-188 auf HOLD.
Ich glaube ja nicht, das die Firma außer die Chefs glücklich zu machen, irgendetwas tolles zustande bringen wird. Immer wenn Daten kommen, geht es massivst abwärts.
tja BMS hat 3 Projekte gecancelt, CX-188 auf HOLD.
link dazu?
link dazu?
http://ir.cytomx.com/news-releases/news-release-details/cyto…
"CytomX today announced that due to a recent program and portfolio prioritization, the company has decided to indefinitely postpone the clinical trials of CX-188, a PD-1 Probody. The Company may elect to initiate clinical trials of CX-188 in the future.
Bristol-Myers Squibb (BMS) Collaboration Update
As part of our strategic oncology collaboration, BMS has advanced BMS-986249, a CTLA-4 Probody therapeutic, into an ongoing Phase 1/2 clinical trial. BMS has stated that they anticipate preliminary data from this trial in 2019.
In January 2019, BMS provided CytomX notification of termination for three collaboration discovery targets due to portfolio reprioritization. The termination of these targets does not affect other ongoing collaboration discovery and development activities that include BMS-986249."
"CytomX today announced that due to a recent program and portfolio prioritization, the company has decided to indefinitely postpone the clinical trials of CX-188, a PD-1 Probody. The Company may elect to initiate clinical trials of CX-188 in the future.
Bristol-Myers Squibb (BMS) Collaboration Update
As part of our strategic oncology collaboration, BMS has advanced BMS-986249, a CTLA-4 Probody therapeutic, into an ongoing Phase 1/2 clinical trial. BMS has stated that they anticipate preliminary data from this trial in 2019.
In January 2019, BMS provided CytomX notification of termination for three collaboration discovery targets due to portfolio reprioritization. The termination of these targets does not affect other ongoing collaboration discovery and development activities that include BMS-986249."
Wau da geht es mächtig runter,
vielleicht hat die Entscheidung von BMY auch mit dem Kauf von Celgene zu tun hier wird wohl einiges neu gemischt...
vielleicht hat die Entscheidung von BMY auch mit dem Kauf von Celgene zu tun hier wird wohl einiges neu gemischt...
Antwort auf Beitrag Nr.: 59.970.889 von schnappi am 26.02.19 21:24:17Die Ergebnisse von CX072 und CX2009 sind doch gut, wie erwartet. PoC...
Offensichtlich sieht der Markt jedoch einen wesentlich größeren Wert in der BMS Partnerschaft und der Cx188 Pipeline. Schade nun ist das jüngst aufgeholte, komplett wieder hin...
Gruß
JM
Offensichtlich sieht der Markt jedoch einen wesentlich größeren Wert in der BMS Partnerschaft und der Cx188 Pipeline. Schade nun ist das jüngst aufgeholte, komplett wieder hin...
Gruß
JM
Antwort auf Beitrag Nr.: 59.971.672 von Jerry_Maguire am 26.02.19 22:56:17Erstmal scheint der POC der Maskierungstechnologie u. Umsetzung von Theorie in Praxis erbracht, indem CX-2009 funktioniert. Die Investorengemeinde will aber deutlich positive Ergebnisse, am Besten mit einem aufgezeigten Pfad zur Zulassung. Dieser fehlt aber bislang bei CX-2009.
CX-2009 funktioniert "weitgehend Nebenwirkungsfrei" bis kleiner 4 mg/kg (AIBW). Nur leider sehen wir hier wohl noch keine hinreichende Wirksamkeit. Bei Dosierung größer gleich 4 mg/kg beginnen zusehends wirkstoffbedingte Nebenwirkungen einzusetzen. Des Weiteren wird wohl kein Studienteilnehmer weiterhin dosiert. Wohl aus Gründen nicht dauerhafter Wirksamkeit (Tumorprogression nach zeitweisem Ansprechen) sowie Nebenwirkungen.
Daher gab es im R&D-Transkript bereits die Anmerkung die CX-2009 Dosis vor der Erweiterungskohorte weiter zu optimieren und später evtl. mit CX-072 zu kombinieren, da CX-2009 Monotherapie wohl nicht ausreichend ist.
Man könnte schlussfolgern, dass hier entweder Zielmolekül oder maximales Dosisfenster der Maskierung nicht passend sind.
Dass 3 präklinische CTMX-Partnerprogramme bei BMS / BMY eingestellt wurden, ist auch nicht gerade hilfreich.
Das alles stellt aber nicht die gesamte Maskierungstechnologie in Frage, jedoch erscheint es mal wieder so, dass neue Technologien zu Beginn nicht immer reibungslos in die Praxis umgesetzt werden können. Hier müssen Cytomx und wir Lehrgeld bezahlen.
Cytomx handelt m.e. frühzeitig strategisch richtig, indem es CX-188 zurückstellt (siehe Anmerkung zu Verpartnerung CX-072 u. 188) und sich nicht mit vielen kostenintensiven parallelen Entwicklungen belastet.
Ich würde aktuell bei CTMX eher abwarten, bzw. aufgrund des günstigen Kurses zukaufen (Nettocash ca. 400 Mio USD zu 12-2018).
CX-2009 funktioniert "weitgehend Nebenwirkungsfrei" bis kleiner 4 mg/kg (AIBW). Nur leider sehen wir hier wohl noch keine hinreichende Wirksamkeit. Bei Dosierung größer gleich 4 mg/kg beginnen zusehends wirkstoffbedingte Nebenwirkungen einzusetzen. Des Weiteren wird wohl kein Studienteilnehmer weiterhin dosiert. Wohl aus Gründen nicht dauerhafter Wirksamkeit (Tumorprogression nach zeitweisem Ansprechen) sowie Nebenwirkungen.
Daher gab es im R&D-Transkript bereits die Anmerkung die CX-2009 Dosis vor der Erweiterungskohorte weiter zu optimieren und später evtl. mit CX-072 zu kombinieren, da CX-2009 Monotherapie wohl nicht ausreichend ist.
Man könnte schlussfolgern, dass hier entweder Zielmolekül oder maximales Dosisfenster der Maskierung nicht passend sind.
Dass 3 präklinische CTMX-Partnerprogramme bei BMS / BMY eingestellt wurden, ist auch nicht gerade hilfreich.
Das alles stellt aber nicht die gesamte Maskierungstechnologie in Frage, jedoch erscheint es mal wieder so, dass neue Technologien zu Beginn nicht immer reibungslos in die Praxis umgesetzt werden können. Hier müssen Cytomx und wir Lehrgeld bezahlen.
Cytomx handelt m.e. frühzeitig strategisch richtig, indem es CX-188 zurückstellt (siehe Anmerkung zu Verpartnerung CX-072 u. 188) und sich nicht mit vielen kostenintensiven parallelen Entwicklungen belastet.
Ich würde aktuell bei CTMX eher abwarten, bzw. aufgrund des günstigen Kurses zukaufen (Nettocash ca. 400 Mio USD zu 12-2018).
Antwort auf Beitrag Nr.: 59.970.889 von schnappi am 26.02.19 21:24:17
das wird gern angebracht, auch von John Carroll, aber wenn die Ergebnisse gut oder super gewesen wären, hätte BMY sicher nichts eingestellt.
Zitat von schnappi: Wau da geht es mächtig runter,
vielleicht hat die Entscheidung von BMY auch mit dem Kauf von Celgene zu tun hier wird wohl einiges neu gemischt...
das wird gern angebracht, auch von John Carroll, aber wenn die Ergebnisse gut oder super gewesen wären, hätte BMY sicher nichts eingestellt.
Antwort auf Beitrag Nr.: 59.972.212 von Nase_weis_nix am 27.02.19 05:47:24Sehe ich größtenteils ähnlich wie Du, Nase.
Man muss auch immer vorsichtig mit der rosaroten Brille sein (z.B. Ville7 u. Joschka Schröder mit Kursziel 1000 USD bei Funktionieren der Maskierungstechnologie). Ein solches Szenario wird sicherlich niemals eintreten, denn dafür ist die Wirklichkeit, insbesondere bei der Studie am Mensch, einfach viel zu komplex.
Sicherlich noch ein spannender Wert aber die Luft bzw. Fantasie (welche diesen Wert ausgemacht hat) ist hier erstmal deutlich raus. Die Daten sehen bislang einfach nicht nach "home run Data" aus, sondern eher bescheiden. Da bringt es wenig, auf eine spannende Technologie zu verweisen, welche die NW in den Griff bekommen möchte. Denn dies ist bislang nicht passiert.
Man muss auch immer vorsichtig mit der rosaroten Brille sein (z.B. Ville7 u. Joschka Schröder mit Kursziel 1000 USD bei Funktionieren der Maskierungstechnologie). Ein solches Szenario wird sicherlich niemals eintreten, denn dafür ist die Wirklichkeit, insbesondere bei der Studie am Mensch, einfach viel zu komplex.
Sicherlich noch ein spannender Wert aber die Luft bzw. Fantasie (welche diesen Wert ausgemacht hat) ist hier erstmal deutlich raus. Die Daten sehen bislang einfach nicht nach "home run Data" aus, sondern eher bescheiden. Da bringt es wenig, auf eine spannende Technologie zu verweisen, welche die NW in den Griff bekommen möchte. Denn dies ist bislang nicht passiert.
Grundsätzlich lässt sich aus der Theorie und der Präklinik leider nur bedingt eine Vorhersage für Ergebnisse im Menschen treffen. Das ist die Krux mit der Biologie! Die ist eben doch ein wenig komplexer.
CTMX ist sicher nicht am Ende (und auch kein schlechtes Investment) aber das ist m.E. schon ein herber Rückschlag.
Etwas merkwürdig finde ich, dass man die Neuigkeiten bzgl. der Pipeline im Rahmen eines Analysten Tages verkündet. Das sollte doch so was wie eine Werbeveranstaltung sein!?
CTMX ist sicher nicht am Ende (und auch kein schlechtes Investment) aber das ist m.E. schon ein herber Rückschlag.
Etwas merkwürdig finde ich, dass man die Neuigkeiten bzgl. der Pipeline im Rahmen eines Analysten Tages verkündet. Das sollte doch so was wie eine Werbeveranstaltung sein!?
Antwort auf Beitrag Nr.: 59.972.974 von biopadawan am 27.02.19 08:21:16@Nase_weiß_nix kannst du mal bitte den Link zum Transcript posten. Ich finde nur die Wiederholung des Calls.
Hier mal ein Beitrag, der auch nicht so negativ ist
https://www.bizjournals.com/sanfrancisco/news/2019/02/26/bri…
Wie man einne solchen Tag macht und dann soll da alles schlecht sein, verstehe ich auch nicht. Vielleicht interpretiert der Markt das zu negativ. Minus 30 Prozent deutet ja auf ein totales Scheitern hin.
Hier mal ein Beitrag, der auch nicht so negativ ist
https://www.bizjournals.com/sanfrancisco/news/2019/02/26/bri…
Wie man einne solchen Tag macht und dann soll da alles schlecht sein, verstehe ich auch nicht. Vielleicht interpretiert der Markt das zu negativ. Minus 30 Prozent deutet ja auf ein totales Scheitern hin.
Antwort auf Beitrag Nr.: 59.972.998 von kmastra am 27.02.19 08:23:24
:-), den Gedanken hatten wohlviele, das es da eher gute Nachrichten gibt, um so größer die Enttäuschung
Zitat von kmastra: Grundsätzlich lässt sich aus der Theorie und der Präklinik leider nur bedingt eine Vorhersage für Ergebnisse im Menschen treffen. Das ist die Krux mit der Biologie! Die ist eben doch ein wenig komplexer.
CTMX ist sicher nicht am Ende (und auch kein schlechtes Investment) aber das ist m.E. schon ein herber Rückschlag.
Etwas merkwürdig finde ich, dass man die Neuigkeiten bzgl. der Pipeline im Rahmen eines Analysten Tages verkündet. Das sollte doch so was wie eine Werbeveranstaltung sein!?
:-), den Gedanken hatten wohlviele, das es da eher gute Nachrichten gibt, um so größer die Enttäuschung
Antwort auf Beitrag Nr.: 59.972.998 von kmastra am 27.02.19 08:23:24Sollte es heute zu einer Erholung kommen werde ich verkaufen und die Firma erstmal weiter beobachten.
iCH ÜBERLEGE MIR AUCH VERLUSTE ZU REALISIEREN.
Wie wird das hier von anderen gesehen ?
Wie wird das hier von anderen gesehen ?
Antwort auf Beitrag Nr.: 59.973.508 von riverstar_de am 27.02.19 09:00:14Stimmt! Da werden sich wohl auch ein paar Trader böse verspekuliert haben. Ich habe nur eine kleine Position in CTMX, die ich auch halten werde. Ich sehe ein POC bei anderen Plattformanbietern viel eher (ZYME, XNCR, Morphosys...). Von daher habe ich da auch größere Positionen.
Antwort auf Beitrag Nr.: 59.973.643 von schnappi am 27.02.19 09:10:49Ein solch drastischer Einbruch, wird wohl zunächst keine Anschlußkäufe nach sich ziehen. Ein Ausstieg jetzt auf dem Niveau ist mMn nicht sinnvoll. Dieser Peak nach unten bedeutet wohl Ausstieg eines größeren Investors. Am Ende steht dies vermutlich in direktem Zusammenhang mit dem Ende der BMS Koop betreffender Pipelines.
Fakt ist das die Marktkapitalisierung nun wieder unter dem Cashbestand liegt, womit man fundamental die Idee der Maskierung, die Infrastruktur von CTX und die bisherigen Ergebnisse quasi zum Nulltarif bekommt. Denke wir liegen da jetzt auf einem Kursniveau welches sich länger halten wird. Ein Ausstieg jetzt auf dem Niveau ist mMn nicht sinnvoll. Potential nach oben wird sich über nächste hoffentlich kluge Schritte ergeben.
Gruß
JM
Fakt ist das die Marktkapitalisierung nun wieder unter dem Cashbestand liegt, womit man fundamental die Idee der Maskierung, die Infrastruktur von CTX und die bisherigen Ergebnisse quasi zum Nulltarif bekommt. Denke wir liegen da jetzt auf einem Kursniveau welches sich länger halten wird. Ein Ausstieg jetzt auf dem Niveau ist mMn nicht sinnvoll. Potential nach oben wird sich über nächste hoffentlich kluge Schritte ergeben.
Gruß
JM
Es wurde doch gesagt, dass BMS aufgrund des Celgene Deals das Portfolio angepasst hat. Daten zu den 3 gestoppten Programmen die in jungem Stadium waren wurden bisher noch nicht veröffentlicht. Daher kann man darüber nur spekulieren. Mit BMS laufen noch weitere 9 Programme. Mit Amgen und Abbvie hat man Deals. Mit Immunogen hat man eine Kooperation. Man hat gerade ein Unternehmen gekauft, das vor paar Jahren noch 500 Mio wert war. Man hat cash.
Schön, dass nun auch der generelle PoC der Maskierungstechnologie für die PDCs mit 2009 gelungen ist. Und schade, dass man gleich ordentlich Lehrgeld bezahlen muss. Wenn das DM4-Nebenwirkungsprofil (Target-unabhängig) tatsächlich so erwartet wurde (O-Ton), stellt sich die Frage, warum man erst jetzt im Follow-on entsprechende Prophylaxe betreibt. Vermutlich wurde bereits bei geringeren und unproblematischen Dosierungen Wirksamkeit erwartet. Der Erwerb der Agensys-Technologie erscheint angesichts der DM4-Probleme nun natürlich wohl begründet zu sein. Mal sehen, was der Technologielieferant Immunogen in seinem eigenen PDC-Projekt beobachtet, zumindest kann er aus 2009 lernen. Sollten auch die Prophylaxe-Maßnahmen bei 2009 keine deutlichen Verbesserungen zeigen, kann man hier meinetwegen gern den Stecker ziehen und das Cash schonen.
Denn bei den fortgeschrittenen PDCs bleibt ja noch 2029. Mit MMAE statt DM4 als Payload könnte diese Sache anders ausgehen, zumal 2029 in der Präklinik für AbbVie wohl extrem überzeugend aussah. Kann ich aber letztlich nicht beurteilen, ob MMAE in diesem Falle vorteilhaft ist. Ich hoffe jedoch, dass AbbVie kraft ihrer Kompetenz ggf. schon frühzeitig auf prophylaktische Maßnahmen gesetzt haben, sofern notwendig.
Die Konzentration auf 072 ist richtig und wichtig, gern auch zu Lasten von 188. Denn hier scheint man die Ziele wohl erreichen bzw. die Erwartungen erfüllen zu können. Und das ist eben nicht den x-ten PD-L1 Antikörper zu entwickeln, sondern den ersten maskierten, der seine Vorteile vor allem in der Kombi ausspielt. Sollte BMS mit dem aCTLA-4-Projekt Erfolg haben, wäre dies langfristig natürlich der ideale Kombinationspartner. Kurz- und mittelfristig ist die dringendste Aufgabe für CytomX, Klarheit zu schaffen, welcher Weg für 072 Richtung Zulassungsantrag beschritten werden soll. Ist das die laufende Ipi-Kombi oder TNBC-Mono oder noch etwas anderes? Denn der Marktfokus wird nun ganz klar auf 072 liegen, dafür wurde in der Präsentation im Zusammenhang mit diesem Projekt zu oft von „Value creation“ gesprochen, da muss nun auch was kommen.
Dass BMS mit CytomX nun kürzertritt, muss nicht gleich das Ende bedeuten. Leider hat man bei der CytomX-Kommunikation stets das Gefühl, nicht wirklich alles mitgeteilt zu bekommen. Aber bis zum Beweis des Gegenteils gehe ich mal davon aus, dass hier wirklich Pipeline-Streamlining wegen Celgene angesagt ist. Wichtig ist erstmal, dass es mit dem Ipi-Pb vorangeht.
Das Fazit führt im Grunde wieder zum ersten Satz: Es funktioniert, man kann mit dieser Technologie Ziele ansteuern, die konventionellen Antikörpern verschlossen sind, sonst wäre bei CD166 schon längst Schluss gewesen. Aber auf dem Wege zu einem möglichen Erfolg sind offenbar noch eine Menge Probleme zu lösen, und es gilt für das Unternehmen nun in erster Linie, begrenzte Ressourcen intelligent und zielgerichtet einzusetzen.
Und wer sich fragt, ob dieses Unternehmen jemals etwas zustande bringt, kann sich überlegen, wie die auf Seite 95 der Präsentation abgebildete Frau diese Frage beantworten würde. Das ist doch immerhin schon mal etwas…
Denn bei den fortgeschrittenen PDCs bleibt ja noch 2029. Mit MMAE statt DM4 als Payload könnte diese Sache anders ausgehen, zumal 2029 in der Präklinik für AbbVie wohl extrem überzeugend aussah. Kann ich aber letztlich nicht beurteilen, ob MMAE in diesem Falle vorteilhaft ist. Ich hoffe jedoch, dass AbbVie kraft ihrer Kompetenz ggf. schon frühzeitig auf prophylaktische Maßnahmen gesetzt haben, sofern notwendig.
Die Konzentration auf 072 ist richtig und wichtig, gern auch zu Lasten von 188. Denn hier scheint man die Ziele wohl erreichen bzw. die Erwartungen erfüllen zu können. Und das ist eben nicht den x-ten PD-L1 Antikörper zu entwickeln, sondern den ersten maskierten, der seine Vorteile vor allem in der Kombi ausspielt. Sollte BMS mit dem aCTLA-4-Projekt Erfolg haben, wäre dies langfristig natürlich der ideale Kombinationspartner. Kurz- und mittelfristig ist die dringendste Aufgabe für CytomX, Klarheit zu schaffen, welcher Weg für 072 Richtung Zulassungsantrag beschritten werden soll. Ist das die laufende Ipi-Kombi oder TNBC-Mono oder noch etwas anderes? Denn der Marktfokus wird nun ganz klar auf 072 liegen, dafür wurde in der Präsentation im Zusammenhang mit diesem Projekt zu oft von „Value creation“ gesprochen, da muss nun auch was kommen.
Dass BMS mit CytomX nun kürzertritt, muss nicht gleich das Ende bedeuten. Leider hat man bei der CytomX-Kommunikation stets das Gefühl, nicht wirklich alles mitgeteilt zu bekommen. Aber bis zum Beweis des Gegenteils gehe ich mal davon aus, dass hier wirklich Pipeline-Streamlining wegen Celgene angesagt ist. Wichtig ist erstmal, dass es mit dem Ipi-Pb vorangeht.
Das Fazit führt im Grunde wieder zum ersten Satz: Es funktioniert, man kann mit dieser Technologie Ziele ansteuern, die konventionellen Antikörpern verschlossen sind, sonst wäre bei CD166 schon längst Schluss gewesen. Aber auf dem Wege zu einem möglichen Erfolg sind offenbar noch eine Menge Probleme zu lösen, und es gilt für das Unternehmen nun in erster Linie, begrenzte Ressourcen intelligent und zielgerichtet einzusetzen.
Und wer sich fragt, ob dieses Unternehmen jemals etwas zustande bringt, kann sich überlegen, wie die auf Seite 95 der Präsentation abgebildete Frau diese Frage beantworten würde. Das ist doch immerhin schon mal etwas…
Antwort auf Beitrag Nr.: 59.976.967 von BReal am 27.02.19 15:04:35Bilder überzeugen mehr als alle Statistiken
Immunogen wird präklinische Daten auf der AACR präsentieren. Heute abend werden die Abstracts veröffentlicht. Da bin ich sehr gespannt.
Wollte Cytomx dort nicht auch noch neuere Daten präsentieren?
Wollte Cytomx dort nicht auch noch neuere Daten präsentieren?
Antwort auf Beitrag Nr.: 59.979.556 von hinz12 am 27.02.19 19:13:39Dazu findet sich keine Ankündigung bei CytomX.
Gruß
JM
Gruß
JM
Hier der Abstract vom Inmmunogen auf der AACR
Abstract
Epithelial Cell Adhesion Molecule (EpCAM) is a glycosylated, 40-kDa type I transmembrane protein that plays a role in cell adhesion and cell signaling. EpCAM is an attractive target for antibody drug conjugate (ADC) development due to its overexpression on a variety of tumors of epithelial origin, including lung, colon, breast, ovarian, prostate and pancreatic cancers. In addition, EpCAM is enriched on tumor-initiating cells (TICs), which are often resistant to conventional cancer therapies. As such, EpCAM-targeted therapies may lead to more durable responses. However, EpCAM is also expressed on a variety of normal epithelia, thus limiting its utility as an ADC target due to potential toxicity. We aim to overcome this limitation by developing an EpCAM-targeting Probody™ drug conjugate (PDC). A Probody therapeutic is an antibody engineered with a mask that blocks the antigen binding site. Probody therapeutics can be selectively activated by tumor associated proteases releasing an active antibody with restored antigen binding activity. Therefore, an EpCAM-targeting PDC could have the anti-tumor potency of an ADC, while limiting binding to healthy tissues and minimizing toxicities.
Here, we describe the development of EpCAM-targeted PDCs, based on a novel human/cynomolgus cross-reactive anti-EpCAM antibody. Probody molecules were successfully conjugated to either the maytansine-derived microtubule disruptor, DM4, linked via a hindered disulfide hydrophilic linker (sulfo-SPDB) or the ultra-potent DNA alkylating payload, DGN549. The antigen binding and in vitro cytotoxicity of intact PDCs were dramatically reduced compared to the corresponding ADC, but could be restored following in vitro proteolytic activation. Furthermore, EpCAM-targeting PDCs displayed compelling and specific anti-tumor activity in xenograft mouse models. In addition, the tolerability and pharmacokinetics (PK) of a selection of the EpCAM PDCs were compared to the EpCAM-targeting ADC in cynomolgus monkeys. EpCAM-targeting PDCs were better tolerated than the corresponding EpCAM-targeting ADC even at higher dose levels and displayed longer half-lives and greater exposure. Therefore, EpCAM PDCs showed greatly improved tolerability and PK profiles compared to the EpCAM ADC.
The studies presented herein support an anti-EpCAM PDC as a promising novel therapeutic to target a wide range of EpCAM-expressing cancers with the potential to overcome the associated on-target toxicities. PROBODY is a trademark of CytomX Therapeutics, Inc.
https://www.abstractsonline.com/pp8/#!/6812/presentation/292…
Klingt vielversprechend. Mal sehen, ob Immunogen die Phase 1 dieses Jahr noch startet.
Abstract
Epithelial Cell Adhesion Molecule (EpCAM) is a glycosylated, 40-kDa type I transmembrane protein that plays a role in cell adhesion and cell signaling. EpCAM is an attractive target for antibody drug conjugate (ADC) development due to its overexpression on a variety of tumors of epithelial origin, including lung, colon, breast, ovarian, prostate and pancreatic cancers. In addition, EpCAM is enriched on tumor-initiating cells (TICs), which are often resistant to conventional cancer therapies. As such, EpCAM-targeted therapies may lead to more durable responses. However, EpCAM is also expressed on a variety of normal epithelia, thus limiting its utility as an ADC target due to potential toxicity. We aim to overcome this limitation by developing an EpCAM-targeting Probody™ drug conjugate (PDC). A Probody therapeutic is an antibody engineered with a mask that blocks the antigen binding site. Probody therapeutics can be selectively activated by tumor associated proteases releasing an active antibody with restored antigen binding activity. Therefore, an EpCAM-targeting PDC could have the anti-tumor potency of an ADC, while limiting binding to healthy tissues and minimizing toxicities.
Here, we describe the development of EpCAM-targeted PDCs, based on a novel human/cynomolgus cross-reactive anti-EpCAM antibody. Probody molecules were successfully conjugated to either the maytansine-derived microtubule disruptor, DM4, linked via a hindered disulfide hydrophilic linker (sulfo-SPDB) or the ultra-potent DNA alkylating payload, DGN549. The antigen binding and in vitro cytotoxicity of intact PDCs were dramatically reduced compared to the corresponding ADC, but could be restored following in vitro proteolytic activation. Furthermore, EpCAM-targeting PDCs displayed compelling and specific anti-tumor activity in xenograft mouse models. In addition, the tolerability and pharmacokinetics (PK) of a selection of the EpCAM PDCs were compared to the EpCAM-targeting ADC in cynomolgus monkeys. EpCAM-targeting PDCs were better tolerated than the corresponding EpCAM-targeting ADC even at higher dose levels and displayed longer half-lives and greater exposure. Therefore, EpCAM PDCs showed greatly improved tolerability and PK profiles compared to the EpCAM ADC.
The studies presented herein support an anti-EpCAM PDC as a promising novel therapeutic to target a wide range of EpCAM-expressing cancers with the potential to overcome the associated on-target toxicities. PROBODY is a trademark of CytomX Therapeutics, Inc.
https://www.abstractsonline.com/pp8/#!/6812/presentation/292…
Klingt vielversprechend. Mal sehen, ob Immunogen die Phase 1 dieses Jahr noch startet.
In der gestrigen Telko zu den Jahreszahlen wurden einige der Themen, zu denen ich vorher schrieb, in der Q&A-Session angesprochen. Mit den Antworten kann ich im Grunde gut leben.
Zum Thema 2009-Dosiseskalation ohne Prophylaxe:
“Going into this dose escalation as we began to realize that we could dose escalate beyond six mgs per kg and as we kept going, we made a very affirmative decision in collaboration with our Safety Review Committee to dose escalate initially without ocular prophylaxis so that we could get a clear sense of the overall profile of the drug from a safety and efficacy standpoint.
That was a very affirmative decision that we took early on in the program and we took that decision in the full expectation that once we learned about the safety and efficacy of the drug at these upper doses, we would then implement like most likely implement ocular prophylaxis, if needed depending upon what dose we got to which is exactly what we've done. And so the toxicity that we've certainly paid the most attention to and that we have a really good, I believe a really good handle on moving forward is ocular toxicity.
The others are do you really think about it. You look at the safety table, it's still really early days in understanding what their incidence is, what their severity is because the patient numbers are still small, we need to learn more. So we're really quite focused on the ocular tox at this point. We think we've got a handle on it. We're going to need to learn more about some of the other -- about the integrated safety profile as we move forward and there's much still to be learned for sure.”
Zum Thema BMS-Kooperation (Celgene wird nicht erwähnt):
“In conjunction with our broad R&D update yesterday, we announced that BMS has de-prioritized three collaboration targets. This reflects the natural ebb and flow of a long-term multi-target discovery stage biotech pharma partnership. The collaboration remains in full force in effect and we look forward to continuing to make progress on existing collaboration programs and future targets that BMS may select.”
Zum Thema 188:
I mean as I said it's a funny thing actually because we've had several discussions with investors over the last year where we've been asked, why you're doing both and it looks like CX-072 is working fine. We don't quite understand why you're doing CX-188. And so I have to say we were rather surprised by some of the feedback yesterday and really a little taken aback by some of the comments in the biotech press which I think got the wrong end of the stick by a long margin. So yes, I could see if I could see a situation develop as I said yesterday, where in a potential partnership, a partner may have interest in that molecule as well.
But for now, we're really thrilled with where we are with CX-072, it's a couple of years ahead in terms of the clinical program, it's performing just as we designed it to and from a capital allocation standpoint, it just makes all the sense in the world to put PDL-1 on the shelf for the time being.
Zum Thema “Bewusstsein, dem Markt demnächst Entwicklungspfade für die Projekte aufzeigen zu müssen”:
“And as I said in my introductory remarks really for both of the lead programs, we're at a point in time right now where as I said we're making that transition from the platform, proof-of-concept last year to 2019 where the development program supporting the product profiles is going to take more shape. But we'll have more to say about that as the year goes on. We're just not quite ready to do that just yet. So hang in there, it's all coming.”
Zum Thema 2009-Dosiseskalation ohne Prophylaxe:
“Going into this dose escalation as we began to realize that we could dose escalate beyond six mgs per kg and as we kept going, we made a very affirmative decision in collaboration with our Safety Review Committee to dose escalate initially without ocular prophylaxis so that we could get a clear sense of the overall profile of the drug from a safety and efficacy standpoint.
That was a very affirmative decision that we took early on in the program and we took that decision in the full expectation that once we learned about the safety and efficacy of the drug at these upper doses, we would then implement like most likely implement ocular prophylaxis, if needed depending upon what dose we got to which is exactly what we've done. And so the toxicity that we've certainly paid the most attention to and that we have a really good, I believe a really good handle on moving forward is ocular toxicity.
The others are do you really think about it. You look at the safety table, it's still really early days in understanding what their incidence is, what their severity is because the patient numbers are still small, we need to learn more. So we're really quite focused on the ocular tox at this point. We think we've got a handle on it. We're going to need to learn more about some of the other -- about the integrated safety profile as we move forward and there's much still to be learned for sure.”
Zum Thema BMS-Kooperation (Celgene wird nicht erwähnt):
“In conjunction with our broad R&D update yesterday, we announced that BMS has de-prioritized three collaboration targets. This reflects the natural ebb and flow of a long-term multi-target discovery stage biotech pharma partnership. The collaboration remains in full force in effect and we look forward to continuing to make progress on existing collaboration programs and future targets that BMS may select.”
Zum Thema 188:
I mean as I said it's a funny thing actually because we've had several discussions with investors over the last year where we've been asked, why you're doing both and it looks like CX-072 is working fine. We don't quite understand why you're doing CX-188. And so I have to say we were rather surprised by some of the feedback yesterday and really a little taken aback by some of the comments in the biotech press which I think got the wrong end of the stick by a long margin. So yes, I could see if I could see a situation develop as I said yesterday, where in a potential partnership, a partner may have interest in that molecule as well.
But for now, we're really thrilled with where we are with CX-072, it's a couple of years ahead in terms of the clinical program, it's performing just as we designed it to and from a capital allocation standpoint, it just makes all the sense in the world to put PDL-1 on the shelf for the time being.
Zum Thema “Bewusstsein, dem Markt demnächst Entwicklungspfade für die Projekte aufzeigen zu müssen”:
“And as I said in my introductory remarks really for both of the lead programs, we're at a point in time right now where as I said we're making that transition from the platform, proof-of-concept last year to 2019 where the development program supporting the product profiles is going to take more shape. But we'll have more to say about that as the year goes on. We're just not quite ready to do that just yet. So hang in there, it's all coming.”
Antwort auf Beitrag Nr.: 59.973.643 von schnappi am 27.02.19 09:10:49Nachdem ich nun mal in Ruhe alles durchgelesen habe bleibe ich doch investiert ...
Antwort auf Beitrag Nr.: 59.984.860 von schnappi am 28.02.19 11:30:35Die Technologie bzw die Forschung an sich ist ja nicht schlecht ! Denke da Is noch Potential vorhanden ! Eig geht es ja nur um den Ausstieg des Investors! In geraumer Zeit wird sich auch da wieder was tun !
Habe nach längere Recherche und auch den sehr informativen Beiträgen hier ein weiteres Aktienpacket gekauft um mein Bestand zu verbilligen. Ich spekuliere mittelfristig auf eine Erholung bzw. zunächst eine Bodenbildung auf aktuellem Niveau, welches etwa dem 52W Tief entspricht.
Unterm Strich hat sich langfristig doch nichts geändert. Die Einstellung der CX-188 pipeline finde ich strategisch richtig. Der Focus sollte auf der Beantragung Freigabe CX-72 und weitere Entwicklung CX2009 und CX2029 liegen. Der Cashbestand mit ist weiter hervorragend und entspricht etwa 56 % der MK. Das finde ich in Ordnung für eine Unternehmung wie CTX.
Gruß
JM
Unterm Strich hat sich langfristig doch nichts geändert. Die Einstellung der CX-188 pipeline finde ich strategisch richtig. Der Focus sollte auf der Beantragung Freigabe CX-72 und weitere Entwicklung CX2009 und CX2029 liegen. Der Cashbestand mit ist weiter hervorragend und entspricht etwa 56 % der MK. Das finde ich in Ordnung für eine Unternehmung wie CTX.
Gruß
JM
Ich habe mal eine Kauforder bei $9.50 gelegt.

Weiter akkumuliert zu 11,50$...MK knapp über Cashbasis, die Korrekturen an den US-Märkten sind dermaßen oversold z.Zt.
By the way...weiterhin sehr informative und herausragende Beiträge hier insb. von Nase_weis_nix und BReal, danke schön👍
Präsentationen auf der Jahrestagung
Titel: Vorläufige Ergebnisse von PROCLAIM-CX-2009, einer ersten Studie zur Dosisfindung des Probody-Wirkstoffkonjugats CX-2009 bei Patienten mit fortgeschrittenen soliden Tumoren beim Menschen
https://www.marketscreener.com/CYTOMX-THERAPEUTICS-INC-24239…
Datum und Uhrzeit: Dienstag, 2. April, 2019 8:00 - 12: 00:00 Uhr
Ort: Ausstellungshalle B, Posterabschnitt 23; Plakatwand 12
Abstract Number: 3202
Abwarten, Gruss RS
Antwort auf Beitrag Nr.: 59.987.398 von abgemeldet-577022 am 28.02.19 16:00:39
Ich habe den Auftrag storniert. Das wird noch ein Stück fallen.
Zitat von Fidor: Ich habe mal eine Kauforder bei $9.50 gelegt.
Ich habe den Auftrag storniert. Das wird noch ein Stück fallen.
Unklar ist doch, welchen Weg man gehen will, um eine Zulassung zu bekommen?
Antwort auf Beitrag Nr.: 59.987.704 von Gustl24 am 28.02.19 16:27:01
Kleinere Enttäuschungen gehen mit Kursverlusten einher...größere Enttäuschungen führen zu einer Totalrasur des Kurses siehe heute Immunogen.
Zitat von Gustl24: Weiter akkumuliert zu 11,50$...MK knapp über Cashbasis, die Korrekturen an den US-Märkten sind dermaßen oversold z.Zt.
Kleinere Enttäuschungen gehen mit Kursverlusten einher...größere Enttäuschungen führen zu einer Totalrasur des Kurses siehe heute Immunogen.
Antwort auf Beitrag Nr.: 59.575.691 von BReal am 07.01.19 15:58:34
Ich kann mir nicht helfen, aber irgendwie sehe ich den Agensys-Erwerb immer mehr als Anti-DM4-Entscheidung. Auch wenn das bedauerliche Scheitern von Immunogen mit Mirvetuximab heute wohl nicht an Safety-Issues lag.
Zitat von BReal: Was heißt das genau, "aquired... technology"?
Die gesamte Technologie wurde exklusiv übernommen? Oder hat man sie lediglich lizenziert, wie bislang von Immunogen?
Im Worst Case könnte das im letzteren Fall bedeuten, dass die Payloads von Immunogen in den bislang gestartet PDC-Studien nicht so tolle Ergebnisse gebracht haben und nun auf eine andere Technologie gesetzt wird.
Ich kann mir nicht helfen, aber irgendwie sehe ich den Agensys-Erwerb immer mehr als Anti-DM4-Entscheidung. Auch wenn das bedauerliche Scheitern von Immunogen mit Mirvetuximab heute wohl nicht an Safety-Issues lag.
Antwort auf Beitrag Nr.: 60.000.814 von Gustl24 am 01.03.19 20:48:26
verstehe das nicht, der Kursverlust von IMGN ist ja nun auch kaum größer als der von CTMX, nur das bei CTMX nicht gleich alles an einem Tag kam.
Hier fehlen wahrscheinlich in naher Zukunft die catalysts für kurzfristig höhere Kurse. 2020 wieder?
Zitat von Gustl24:Zitat von Gustl24: Weiter akkumuliert zu 11,50$...MK knapp über Cashbasis, die Korrekturen an den US-Märkten sind dermaßen oversold z.Zt.
Kleinere Enttäuschungen gehen mit Kursverlusten einher...größere Enttäuschungen führen zu einer Totalrasur des Kurses siehe heute Immunogen.
verstehe das nicht, der Kursverlust von IMGN ist ja nun auch kaum größer als der von CTMX, nur das bei CTMX nicht gleich alles an einem Tag kam.
Hier fehlen wahrscheinlich in naher Zukunft die catalysts für kurzfristig höhere Kurse. 2020 wieder?
Antwort auf Beitrag Nr.: 60.011.723 von riverstar_de am 04.03.19 08:12:20Momentan besteht absolute Unsicherheit, das mag die Börse nicht. Daher finde ich die Bewertung (70m EV) in diesem frühem Stadium absolut angemessen, weil keiner weiss wo die Reise hingehen wird.
Die NW bei CX-2009 können target- oder payloadbezogen sein, das muss eruiert werden. Positiv ist, dass es eine Wirksamkeit gab und überhaupt so hoch dosiert werden konnte. Das spricht für die Technologie. CX-2029 könnte demnach mit anderer payload besser funktionieren, das wird sich zeigen. Derzeit gibt es also noch "Hoffnung".
Hoffnung besteht auch noch durch den Ipi Probody von BMY. Ich könnte mir aber vorstellen, dass - bei diesen Preisen - CTMX im Falle von positiven Studienergebnissen sofort geschluckt wird. Schauen wir mal.
Die NW bei CX-2009 können target- oder payloadbezogen sein, das muss eruiert werden. Positiv ist, dass es eine Wirksamkeit gab und überhaupt so hoch dosiert werden konnte. Das spricht für die Technologie. CX-2029 könnte demnach mit anderer payload besser funktionieren, das wird sich zeigen. Derzeit gibt es also noch "Hoffnung".
Hoffnung besteht auch noch durch den Ipi Probody von BMY. Ich könnte mir aber vorstellen, dass - bei diesen Preisen - CTMX im Falle von positiven Studienergebnissen sofort geschluckt wird. Schauen wir mal.
Antwort auf Beitrag Nr.: 60.012.935 von biopadawan am 04.03.19 10:38:39
Ich sehe die 70 Mio ev eher als absolut unterbewertet. Bms hat derzeit 9 Programme am laufen. Abbvie und Amgen haben auch weitere Programme am laufen. Und cytomx hat noch viele Programme in der preclinic. Also ich sehe das hier eher so als steigt jemand mit Gewalt aus oder jemand bereitet eine Übernahme vor. Habe ich zuletzt bei vielen Biotech Werten gesehen, dass sie erst runtergeprugelt wurden und dann übernommen.
Zitat von biopadawan: Momentan besteht absolute Unsicherheit, das mag die Börse nicht. Daher finde ich die Bewertung (70m EV) in diesem frühem Stadium absolut angemessen, weil keiner weiss wo die Reise hingehen wird.
Die NW bei CX-2009 können target- oder payloadbezogen sein, das muss eruiert werden. Positiv ist, dass es eine Wirksamkeit gab und überhaupt so hoch dosiert werden konnte. Das spricht für die Technologie. CX-2029 könnte demnach mit anderer payload besser funktionieren, das wird sich zeigen. Derzeit gibt es also noch "Hoffnung".
Hoffnung besteht auch noch durch den Ipi Probody von BMY. Ich könnte mir aber vorstellen, dass - bei diesen Preisen - CTMX im Falle von positiven Studienergebnissen sofort geschluckt wird. Schauen wir mal.
Ich sehe die 70 Mio ev eher als absolut unterbewertet. Bms hat derzeit 9 Programme am laufen. Abbvie und Amgen haben auch weitere Programme am laufen. Und cytomx hat noch viele Programme in der preclinic. Also ich sehe das hier eher so als steigt jemand mit Gewalt aus oder jemand bereitet eine Übernahme vor. Habe ich zuletzt bei vielen Biotech Werten gesehen, dass sie erst runtergeprugelt wurden und dann übernommen.
Antwort auf Beitrag Nr.: 60.014.405 von 1Fuchs am 04.03.19 14:02:29Dem kann ich mich nur anschliessen.
Fast -40% für erwartbare Daten bei CX072 und CX2009, eine Zurückstellung eines PD-1 Programms, was noch nicht mal in der Klinik war und Fortführung von BMS-986249 (man hatte ja den Eindruck, BMS wäre ausgestiegen, wenn man die Beiträge insbesonder bei Twitter liest).
Die waren bei CTMX selbst über den kräftigen Kurssturz überrascht. Okay beim R&D Tag hätte ich mir auch etwas mehr, insbesondere zur Kooperation mit Amgen gewünscht, aber ansonsten... doch nichts weltbewegendes. Tee drinken
Fast -40% für erwartbare Daten bei CX072 und CX2009, eine Zurückstellung eines PD-1 Programms, was noch nicht mal in der Klinik war und Fortführung von BMS-986249 (man hatte ja den Eindruck, BMS wäre ausgestiegen, wenn man die Beiträge insbesonder bei Twitter liest).
Die waren bei CTMX selbst über den kräftigen Kurssturz überrascht. Okay beim R&D Tag hätte ich mir auch etwas mehr, insbesondere zur Kooperation mit Amgen gewünscht, aber ansonsten... doch nichts weltbewegendes. Tee drinken

Antwort auf Beitrag Nr.: 60.016.199 von McNay am 04.03.19 16:52:49Unfassbare Entwicklung des Aktienkurs. Market Cap bei 470 Mio. Da kann man den Laden kaufen, Konten leer räumen und Assets verkaufen und macht schon Gewinn. Das soll mal einer verstehen.
Gruß
JM
Gruß
JM
Biotech Aktien verhalten sich wie Biotech Aktien. Es gibt gute und schlechte Zyklen, dazwischen Ergebnisse. Im Moment sehe ich keinen Zyklus nach oben. Ein paar Monate warten dann wieder mitmachen.
Schade das Ville nicht mehr hier ist.
Anbei ein guter sachlicher Beitrag:
https://www.biospace.com/article/cytomx-stock-plunges-as-bri…
Der Abverkauf der letzten Woche wird seinen Grund haben. Irgendjemand will raus. Aktuelle MK 450 Euro bei Cash von 436 Mio Stand 31.12.18. Das ist sehr kurios. BMS hatte letztes Jahr noch 200 Mio Upfront bezahlt. Den Laden kann man derzeit für 500 Mio komplett übernehmen incl. BMS, Amgen, Abbvie, Immunogen Deals, etliche Cytomx Programme und 400 Mio Cash. Man hat eine breite Pipeline die größer wird. Ja die kosten werden auch höher. Die BMS Kooperation ist weiterhin voll im Gange. Nach dem Celgene Deal wurde das Portfolio angepasst. Ist nichts außergewöhnliches. Man könnte es auch positiv sehen, dass BMS weiherhin auf Cytomx setzt in 9 von ehemals 12 Programmen. Sollten diese Programme nicht zufriedenstellend laufen hätte BMS die Kooperation komplett beendet. Ich denke hier wird derzeit bewusst versucht den Kurs zu drücken und günstige Shares abzugreifen, denn im Einkauf liegt auch der Gewinn.
https://www.biospace.com/article/cytomx-stock-plunges-as-bri…
Der Abverkauf der letzten Woche wird seinen Grund haben. Irgendjemand will raus. Aktuelle MK 450 Euro bei Cash von 436 Mio Stand 31.12.18. Das ist sehr kurios. BMS hatte letztes Jahr noch 200 Mio Upfront bezahlt. Den Laden kann man derzeit für 500 Mio komplett übernehmen incl. BMS, Amgen, Abbvie, Immunogen Deals, etliche Cytomx Programme und 400 Mio Cash. Man hat eine breite Pipeline die größer wird. Ja die kosten werden auch höher. Die BMS Kooperation ist weiterhin voll im Gange. Nach dem Celgene Deal wurde das Portfolio angepasst. Ist nichts außergewöhnliches. Man könnte es auch positiv sehen, dass BMS weiherhin auf Cytomx setzt in 9 von ehemals 12 Programmen. Sollten diese Programme nicht zufriedenstellend laufen hätte BMS die Kooperation komplett beendet. Ich denke hier wird derzeit bewusst versucht den Kurs zu drücken und günstige Shares abzugreifen, denn im Einkauf liegt auch der Gewinn.
M.E. kommt es nicht derzeit nicht auf die Höhe des Cash an, sondern wie wahrscheinlich es ist, ob die technologie in angemessener Zeit zum Erfolg führt. wenn man die letztere Frage für sich postiv beantwortet, ist die Sache klar: CYTOMX ist ein Schnäppchen. Ich kann die Frage leider nicht beantworten oder auch dazu etwas beutragen. Vielleicht diskutiert ihr mal das intensiver.
Indiziell bestehen ja noch eine vielzahl von Partnerschaften, was dafür spricht, das die Technologie unverändert funktionieren kann.
Indiziell bestehen ja noch eine vielzahl von Partnerschaften, was dafür spricht, das die Technologie unverändert funktionieren kann.
Antwort auf Beitrag Nr.: 60.059.000 von 007coolinvestor am 09.03.19 14:08:58Ich hatte hier bereits im Verlauf mal eine Übersicht über die Verteilung des Aktien Free Float von Cytom X gegeben. So sind nur wenige Aktien wirklich frei gehandelt. Der größere Teil befindet sich in der Hand weniger institutioneller und öffentlicher Anleger. Wenn so ein großer nun raus gegangen ist, ist ein massives Überangebot im Markt. Sprich massiver Verfall.
Desweiteren ist neben dem PoC mMn entschiedend das CTX eine Weg aufzeigt, wie für die möglicherweise funktionierenden Pipelines ein Genehmigungsverfahren eingeleitet wird. Dazu kamen im Call doch einige Fragen. CTX ist hier sehr unkonkret geblieben. So bleibt der Eindruck dass dies erst weiter weitet Ferne geschehen wird. So ein lasches: Wait for it, its all coming ist eben nicht sehr überzeugend.
Gruß
JM
Desweiteren ist neben dem PoC mMn entschiedend das CTX eine Weg aufzeigt, wie für die möglicherweise funktionierenden Pipelines ein Genehmigungsverfahren eingeleitet wird. Dazu kamen im Call doch einige Fragen. CTX ist hier sehr unkonkret geblieben. So bleibt der Eindruck dass dies erst weiter weitet Ferne geschehen wird. So ein lasches: Wait for it, its all coming ist eben nicht sehr überzeugend.
Gruß
JM
"...Yet there is an "over-focus" on Bristol-Myers Squibb's decision to shed the three projects, CytomX Chairman, President and CEO Sean McCarthy told the San Francisco Business Times. The collaboration still consists of nine other targets, he said, including the ongoing Phase I/II study that will produce preliminary data this year..."
Es ist sehr ruhig geworden hier seit der BMS Meldung und gewissen Statements (s.o.) vor einigen Wochen ...Auch die Insider Trading Aktivitäten sind seit Monaten nahezu gegen null gegangen. Offenbar haben auch die Vorstände wenig Lust ihre Optionen/Aktien zu "Ramschpreisen" anzudienen
Es braucht wohl etwas Zeit hier wieder eine gewisse Euphorie zu wecken...ich habe wieder zugekauft und warte.
Es ist sehr ruhig geworden hier seit der BMS Meldung und gewissen Statements (s.o.) vor einigen Wochen ...Auch die Insider Trading Aktivitäten sind seit Monaten nahezu gegen null gegangen. Offenbar haben auch die Vorstände wenig Lust ihre Optionen/Aktien zu "Ramschpreisen" anzudienen

Es braucht wohl etwas Zeit hier wieder eine gewisse Euphorie zu wecken...ich habe wieder zugekauft und warte.
Hier das Poster was Immunogen auf der AACR präsentiert hat.
https://www.immunogen.com/wp-content/uploads/2019/04/AACR-20…
"An EpCAM-targeting PDC represents a promising therapeuticcandidateto target a wide range of EpCAM-expressing tumors."
Der EpCAM PDC wird wohl dieses oder nächstes Jahr in die Phase 1 kommen. Das gibt dann wieder eine schöne Zahlung. Die Pipeline und die Firma lebt noch :-)
Die Pipeline wird zurzeit vollkommen unterbewertet. Das wird sich ändern.
https://www.immunogen.com/wp-content/uploads/2019/04/AACR-20…
"An EpCAM-targeting PDC represents a promising therapeuticcandidateto target a wide range of EpCAM-expressing tumors."
Der EpCAM PDC wird wohl dieses oder nächstes Jahr in die Phase 1 kommen. Das gibt dann wieder eine schöne Zahlung. Die Pipeline und die Firma lebt noch :-)
Die Pipeline wird zurzeit vollkommen unterbewertet. Das wird sich ändern.
Antwort auf Beitrag Nr.: 60.292.479 von hinz12 am 05.04.19 21:58:50Es gibt ja noch eine Reihe von Präsentationen auf dem AACR- alle auf der CytomX Website abrufbar

aus ARIVA Forum 21.04.2019
Zusammenarbeit zwischen AbbVie und Cytomx
https://www.ariva.de/news/abbvie-and-cytomx-announce-strateg…
Gruss RS
Zusammenarbeit zwischen AbbVie und Cytomx
https://www.ariva.de/news/abbvie-and-cytomx-announce-strateg…
Gruss RS
Antwort auf Beitrag Nr.: 60.403.623 von Rastelly am 23.04.19 13:59:52bei mir geht dein link auf die meldung von 2016
was wolltest du uns damit sagen?
was wolltest du uns damit sagen?
Antwort auf Beitrag Nr.: 60.481.223 von LeoF am 03.05.19 16:21:20@LeoF
sorry, das ist etwas durcheinander gekommen,
Gruss RS
sorry, das ist etwas durcheinander gekommen,
Gruss RS
CytomX Therapeutics, Inc. (NASDAQ:CTMX) Q1 2019 Earnings Conference Call May 9, 2019 5:00 PM ET
Company Participants
Christopher Keenan - VP of IR & Corporate Communications
Sean McCarthy - Chairman, CEO & President
Robin Knifsend - VP, Finance
Conference Call Participants
Jackson Harvey - Nomura Securities
Alec Stranahan - Bank of America Merrill Lynch
Waleed Abdel-Naby - SunTrust
Mohit Bansal - Citigroup
Boris Peaker - Cowen and Company
Joseph Catanzaro - Piper Jaffray Companies
Ashiq Mubarack - Wedbush Securities
Biren Amin - Jefferies
Operator
Good day, ladies and gentlemen, and welcome to the CytomX Therapeutics First Quarter 2019 Financial Conference Call. [Operator Instructions]. As a reminder, this call may be recorded. I would now like to introduce your host for today's conference, Mr. Christopher Keenan, Vice President of Investor Relations. Chris, you may begin.
Christopher Keenan
Thank you, Liz. Good afternoon, joining me today are CytomX President, Chief Executive Officer and Chairman, Dr. Sean McCarthy; and CytomX's Vice President of Finance, Robin Knifsend. Before we begin, I would like to remind you that we'll be making forward-looking statements during the call. Because forward-looking statements relate to the future, they are subject to inherent uncertainties and risks that are difficult to predict and many of which are outside of our control.
Important risks and uncertainties are set forth in our most recent public filings with the SEC at sec.gov, including our Form 10-Q filed today. We undertake no obligation to update any forward-looking statements whether as a result of new information, future developments or otherwise.
A webcast of this call will be available on the Investor Relations page at CytomX's website at cytomx.com.
I would now like to turn the call over to Sean.
Sean McCarthy
Thanks, Chris, and good afternoon, everyone. I'm very pleased to be here with you today to briefly review another very productive quarter for CytomX. At CytomX, we are reinventing therapeutic antibodies for the treatments of cancer. We see a major opportunity to more effectively target therapeutic antibodies into diseased tissue, generating new classes of differentiated anticancer therapies as these are best-in-class molecules against validated targets or for first-in-class molecules against novel targets that we believe our technology can uniquely address. Our innovative approach to antibody localization into diseased tissue is called the Probody platform. Probodies are fully recombinant antibody prodrugs comprised of a therapeutic antibody, a linker and a mask designed in a way that the antibody can't see its target until the mask is removed.
Mask removal occurs specifically and selectively within cancer tissue as a function of disease-associated proteases, which clip off the mask in the tumor allowing the underlying antibody to bind target and elicit its biological effect.
Probody therapeutics are designed to offer localized target binding in diseased tissue while maintaining potency, reducing side effects and enabling new targets of mechanisms to be translated into novel product opportunities. We see this as a really big idea backed by decades of research by our deep knowledge of the biology of the tumor microenvironment, innovative protein engineering and a robust intellectual property portfolio. We are the leader in this emerging field of therapeutic antibody localization with four clinical stage programs, strong partnerships and recent clinical proof-of-concept.
The first quarter saw excellent progress by the CytomX team in developing our differentiated technology platform and our lead product candidates as we continue to build on the first Probody clinical data we presented for our lead program, the anti-PD-L1 probody, CX-072, at ASCO last year. Since then, we presented additional clinical and translational data, including from our second program, CX-2009, at ESMO, SITC, at our R&D Day in February and most recently at AACR.
It's been an exciting year for us, and we've learned a tremendous amount about how our unique antibody technology functions in cancer patients having checked key boxes to support proof-of-concept for the Probody platform.
We've demonstrated encouraging antitumor activity and safety profiles for both of our lead wholly owned programs, and we are now intensely focused on the development of next steps for the further development and advancement of these assets.
I'd like to take the opportunity here to briefly recap what we've disclosed to-date about the clinical performance of these two lead molecules. Our most advanced program CX-072 is a PD-L1 targeting probody for which we have presented increasingly matured Phase I data for monotherapy and in combination with the anti-CTLA-4 antibody, ipilimumab, also known of course as Yervoy.
Our vision for CX-072 is for the probody to become a differentiated centerpiece of combination anticancer therapy by enabling safer, more effective combinations. We also see opportunities for CX-072 to potentially expand beyond the existing market to settings where conventional PD pathway agents are not currently employed. Data presented on CX-072 as monotherapy at our Q1 R&D Day showed that CX-072 continues to demonstrate a favorable safety profile as well as durable anticancer activity in heavily pretreated patients with tumor types not typically expected to respond to PD pathway inhibitors.
Data from the completed dose escalation phase of PROCLAIM-CX-072 showed that of 24 efficacy evaluable patients, all with generally weakly immunogenic tumors and treated with doses greater than or equal to 3 mg/kg of CX-072, 12 or 50% of patients demonstrated tumor shrinkage, including 4 partial responses. CX-072 was generally well tolerated with maximum tolerated dose not reached.
Preliminary results from dose escalation informed our ongoing monotherapy dose expansion cohorts studying the dose of 10 mg/kg of CX-072 in multiple tumor types. As reported during our Q1 R&D Day, CX-072 is showing activity in several tumor types at this dose and updated data from these expansion cohorts will be presented in a poster and also as part of a poster discussion session at ASCO 2019.
Turning now to CX-072 in combination with ipilimumab. As reported previously from our dose escalation phase, we've defined the maximum tolerated dose of this combination as 10 mg/kg of CX-072 and 3 mg/kg of ipi, which is the full label dose of ipilimumab. Our preliminary efficacy data is encouraging with antitumor activity, including complete and durable responses seen in advanced stage cancer patients, again, with tumors not generally regarded to be responsive to PD pathway inhibitors. As of our most recently reported data cutoff, of 19 patients evaluable for efficacy, 4 or 21% experienced confirmed responses, including one complete response.
Furthermore, among the 27 patients treated with the 072 plus ipi combination of 3 mg -- with ipi at 3 mg/kg or above, the combination was generally well tolerated with 7 or 26% of patients reporting a Grade 3/4 treatment-related adverse event and this compares very well to historical controls, which, of course, have shown incidence of Grade 3/4 TRAEs in excess of 50%, typically for the combination of a PD inhibitor and ipi at full dose. So these data suggest that the combination of CX-072 plus ipilimumab could allow for the safe and effective treatment of patients in multiple indications with full dose and schedule of ipi with the goal of reaching longer and more durable responses.
Based on these important clinical data for CX-072, we are excited about the prospects of the program to make a difference to cancer patients, and we're busy developing our next steps for this unique asset and we'll be laying out our plans in the near future.
Now I would like to turn to CX-2009, a potentially first-in-class probody drug conjugate targeting a unique and broadly expressed tumor antigen CD166. Now because probody therapeutics are designed to minimize binding of drug to normal tissues, we're in a very unique position to address a new class of targets with attractive molecular features that were previously thought undruggable because of their high expression on normal tissues. CD166 is an example of this kind of target. The target is highly and homogeneously expressed in multiple solid tumor types and might be considered an attractive target for a conventional antibody drug conjugate were it not for the fact that is also present on most normal epithelial tissues.
We think it's a great target for a probody drug conjugate, however, since probodies allow us to more selectively target tumor tissue This is a really exciting program since it combines probody technology with drug conjugate technology with the goal of making a transformative difference for patients across a wide range of cancer types. During Q1 ,we presented preliminary clinical data from the Phase I dose escalation portion of the ongoing PROCLAIM clinical trial of CX-2009 monotherapy in a subset of CD166 expressing cancer types, including certain patients that were selected for high-level expression of CD166.
The intent and design of this Phase I dose escalation trial was firstly, of course, to evaluate the safety of this very novel drug candidate, safety being a particularly critical question given the widespread expression of CD166 on normal tissues. We also wanted to understand as much as we could in Phase I about the contribution of the drug conjugate payload to the overall safety profile of the molecule in order to give us the maximum information with which to design our Phase II strategy. And lastly, we were looking for any initial signs of anticancer activity in a late stage, very heavily pretreated patient population that is, of course, typical for such highly experimental Phase I studies.
We've been very encouraged with the preliminary data for CX-2009 that we've shared previously. At the time of data cutoff for our AACR presentation, 71 patients across all doses were evaluable for efficacy. Of the 39 patients who received greater than or equal to 4 mg/kg of CX-2009 and had at least 1 post-baseline on-study tumor assessment, 38% of these patients achieved tumor shrinkage, including 7 unconfirmed partial responses observed in breast cancer, ovarian cancer and also in head and neck cancer. In addition, 74% of patients achieved stable disease or better at the time of their first on-treatment scan. This single-agent activity is the first validation of CD166 as an anticancer target, and we believe holds much promise. CX-2009 was generally well tolerated. The maximum tolerated dose was not reached at the highest dose level tested at 10 mg/kg, the most common treatment-related adverse events were Grade 1 and Grade 2 and they included nausea, fatigue and decreased appetite. The most common Grade 3/4 treatment-related adverse event was keratitis.
And so it's worth taking a moment or two to just reflect on the safety profile given just how broadly expressed this target is on normal tissue. We believe these data are strong evidence that probody masking technology can really allow us to target first-in-class tumor antigens regardless of their broad normal tissue expression, and we see this actually as an important advance in the field of antibody therapeutics generally. The keratitis that we observed principally at high doses of CX-2009 is a well-established side effect of DM4, the drug conjugate payload that we're employing in this drug candidate.
We are now engaged in further dose refinement, while taking steps to manage keratitis with ocular prophylaxis, which has been shown to be affected by others. This ongoing work will enable us to finalize our strategy for Phase II studies, which we'll be communicating in due course. Taken together, we are very pleased with how our wholly owned CX-072 and CX-2009 programs have progressed to date, and we look forward to providing a more detailed road map for these two assets in the coming months.
I'd like to comment briefly now on our pharma alliances. Firstly on our BMS alliance. This partnership was entered into in 2014 and was expanded in 2017. In total, the alliance provides BMS with access to up to 12 discovery targets from the CytomX platform. To date, CytomX has received a total of $287 million in upfront and milestone payments from BMS.
The lead program in the alliance is the anti-CTLA-4 Probody, BMS-986249, which is based on ipilimumab and continues to progress through a Phase I/II clinical trial being run by BMS. Our shared vision with BMS is that the CTLA-4 Probody has the potential to be a safer, more effective version of Yervoy allowing the full realization of CTLA-4 as a powerful and highly validated cancer immunotherapy target. Additional research work continues under this alliance, and we look forward to additional targets that BMS may select in the future.
Now I'd like to return to the drug conjugate space for just a moment where our alliances with AbbVie and ImmunoGen also continue to advance. In collaboration with AbbVie, CytomX is advancing a second clinical stage probody drug conjugate, CX-2029 directed against CD71, which is also known as the transferrin receptor. This program has the potential to turn CD71 a widely expressed receptor on normal tissues into a druggable target. CytomX continues to enroll patients in PROCLAIM-CX-2029, a Phase I/II clinical trial evaluating this molecule as monotherapy in patients with solid tumors or with lymphomas.
With ImmunoGen, we continue to make progress on our probody drug conjugate targeting the highly expressed tumor antigen, EpCAM. And last but certainly not least with regard to our collaborations, research work continues on multiple targets in our broad alliance with Amgen focused on T-cell engaging bispecific probodies. The goal of this research is to use probody technology to more effectively target T-cell engaging bispecifics into sold tumors, an area where toxicity is proven to be a real challenge for the field due to the very high potency of these agents. The leading edge of this alliance is an EGFR-CD3 probody bispecific.
With these updates on the company, I'll now turn the call over to Robin for a brief review of financial highlights from Q1.
Robin Knifsend
Thank you, Sean. I would like to review selective financial highlights for the first quarter. We ended the first quarter with cash, cash equivalents and investments totaling $396.6 million compared to $436.1 million as of December 31, 2018. Our strong balance sheet allows us to fund operations well into 2021 assuming no new collaborations or financings. Research and development expenses were $36.4 million for the quarter compared to $22.5 million in 2018. The increase in research and development expenses was primarily attributable to additional cost related to our maturing pipeline, personnel-related expenses and a $5 million charge for acquired technical know-how related to drug conjugate and bispecific technologies.
General and administrative expenses increased by $2.3 million for the quarter compared to the corresponding period in 2018 and was largely attributed to personnel-related expenses.
Revenue during the first quarter of 2019 were $29.5 million compared to $14.2 million in the corresponding period in 2018. This increase was largely attributable to the acceleration of revenue from upfront payments relating to certain targets within the BMS alliance.
With that, I'll turn the call back over to Sean.
Sean McCarthy
Great. Thanks, Robin. So now I would like to just briefly wrap up. From this recap of Q1 today, I hope you can see how across our wholly owned and partner pipeline we have a broad range of opportunities with very unique product candidates, enabled by our technology. And in addition to our pipeline progress during Q1, we also made several important additions to the senior organization, including Nick Galli as Chief Business Officer and Leslie Robbins as SVP, Intellectual Property. The additions of Nick and Leslie to our leadership team reflect our ongoing commitment to partnership formation and aggressive protection of our intellectual property as core pillars of our corporate strategy. Nick's proven track record in transformational business development and Leslie's broad and deep IP experience across discovery, development and commercial stages of biologic drug development will be great assets as we seek to maximize utility of our probody technology for patients.
I'm also delighted to welcome Elaine Jones back to our Board of Directors. Elaine recently retired from Pfizer after many years leading investments for their corporate venture fund. Elaine worked closely with CytomX in our earlier formative years. She is an accomplished life science industry leader whose broad experience across health care sectors and deep prior experience with CytomX will be a tremendous benefit as we continue to advance our innovative probody platform and clinical portfolio.
In conclusion, CytomX continue to make terrific progress during Q1. We further strengthened our leadership in the field of therapeutic antibody targeting with our Probody platform, we significantly advanced our clinical stage pipeline, moved our partnerships forward, and we further built our team.
We've finished Q1 with a strong balance sheet, and we look forward to a very productive 2019. On particular note, our lead wholly owned programs, CX-072 and CX-2009, are taking great shape, and we expect to provide detailed updates on next steps for the programs in the coming months.
So with that, I'll hand back to Chris for Q&A.
Christopher Keenan
Liz, you can open up the call for questions.
Question-and-Answer Session
Operator
[Operator Instructions]. Our first question comes from line of Christopher Marai with Nomura.
Jackson Harvey
This is Jackson Harvey on for Christopher Marai. My first question is on CX-072 ASCO data. I realize you're going to update us on Part D. But I'm just curious, will this be in the same tumor types as you presented at R&D Day or will it be additional tumor types?
Sean McCarthy
It will be largely in the same tumor types with the potential for a little bit of additional information as well.
Jackson Harvey
Got it. Also I have to ask if BMS has given you any indication of whether they maybe sharing data at ASCO as well?
Sean McCarthy
They have not.
Jackson Harvey
Okay. And my final question is on CX 2009. Can you share some more details on the dose refinement, what you might be looking for or the status of that, and also, the protocol for the ocular prophylaxis?
Sean McCarthy
Sure. Well, with regards to dose refinement, I think as we've reported previously, the mTPI cohort that we're enrolling, as of the last update, we were enrolling patients at the dose of 8 milligrams per kilogram. The way that particular component of the study is structured, it allows us to either further escalate or deescalate depending upon what we see at that dose. And so one of the advantages, of course, of doing this particular mTPI structure is that it gives us additional information on toxicity and overall therapeutic window over an extended period of doses as opposed to the simple -- the more typical 3-week DLT period within standard dose escalation. So there is a lot of information that we capture in the mTPI. We may only end up doing that at 8 mg/kg, we may end up at additional doses, we'll have to see how it goes, but the point, of course, is as you quite rightly point out is to dose range to allow us to select the optimal dose for Phase II.
Operator
Our next question comes from line of Ying Huang with Bank of America Merrill Lynch.
Alec Stranahan
This is Alec on for Ying. My first one is on the Agensys acquisition. How do you see the conjugate linker-toxin and the CD3 bispecifics contributing to your current or future pipeline? Just trying to get a sense of how you view the assets you got from Astellas?
Sean McCarthy
Yes, certainly great question. So as you all know, for the first two probody drug conjugates that we put into the clinic, we made a very deliberate decision to use linker-payload constructs that were well understood and well presented from a clinical standpoint. And that's very important because as you can see from our interpretation of our 2009 data as we look to tease apart the safety data and attribute toxicity to either payload or potentially later target, we know exactly what we're looking for from the payload. That's an extraordinary helpful in really figuring out a reasonably complex Phase I data set for CX-2009. We -- and that's the DM4 payload. The payload for the 2029 CD71 PDC is MMAE, so we expect that to be a similar kind of situation.
With the third, the fourth, the fifth, just keep on going PDC that we put into the clinic over the next several years, I think we will now be in a position to take a little bit more risk on payload and maybe bring some novel payloads forward and we've got quite interested in this chemistry that we've acquired from Agensys, which we think has a lot of potential, is less proven in the clinic, but we would -- what we are evaluating is potentially putting molecules into the clinic with those payloads, which, of course, we now would own outright, but also not come with any downstream economic burden to any kind of partner.
With regard to CD3, there is a lot of work going on in the field right now. So I'm sure you know to answer the question what is the optimal CD-3 arm for CD-3 bispecifics and that can vary in terms of affinity, avidity, cross-reactivity, you name it. And so we are just interested in building a big of a portfolio of CD-3 molecules as we can so that we can build large lead series to put into preclinical studies before we select molecules to put into the clinic, so that was just a somewhat opportunistic acquisition that's given us just another tool in the tool kit, if you like, for making CD-3 bispecifics.
Alec Stranahan
Great. That's really helpful. And then in terms of the overall cost of bringing this asset in-house, most of the expenses that hit R&D accounted for this quarter, I guess, what I'm trying to get at is, should we see R&D expense go down to normal level next quarter and onward?
Sean McCarthy
Yes, that's a onetime charge that you're seeing, that we're taking $5 million this quarter.
Operator
Our next question comes from line of Peter Lawson with SunTrust.
Waleed Abdel-Naby
This is Waleed on for Peter. A question on CX-072 combo study with vemurafenib. Can you give us an update on how the enrollment is progressing for that study and perhaps when we can potentially see some initial data?
Sean McCarthy
Yes, study continues, and we are -- we haven't yet decided exactly where we'll present data, but we are still actively considering sharing preliminary data from that arm before the end of the year.
Waleed Abdel-Naby
Great. And just do you have any additional perhaps clarity on when we may expect the expansion phase to begin for CX-2009?
Sean McCarthy
Well, we are certainly optimistic that we'll have that underway second half of this year. It really does depend, of course, on the ongoing dose optimization work we are doing and to some extent, as you can appreciate, as I commented earlier in the mTPI cohort, how much dose refinement we elect to do there. But we would -- we're certainly shooting together up and running second half of this year.
Operator
Our next question comes from the line of Geoff Meacham with Barclays.
Unidentified Analyst
This is Olivia Barone [ph] for Geoff. Just two quick ones from me. The first is, one, have there been any further developments in terms of CX-188 from a potential partnership perspective? Whether that's in the form of conversation with companies that have shown maybe initial interest on their part or maybe a more active approach on your end? Or should we be thinking about that as more of a downward event if at all? And then just one on 072, recognizing it's still very early days, but can you give us a sense of what your internal discussions have been around registrational studies down the road and also maybe if you could help us better understand how you're thinking about the Zelboraf combination as far as pipeline prioritization goes?
Sean McCarthy
Hi Olivia. Thanks for the questions. I'll see if I can answer. With regards to partnerships, on 188, I would kind of take a step back and say that if we think about the 072 program and our PD program as a whole, which would include PD-1 plus PD-L1, obviously, we have some interest in time in potentially forming a partnership there, but we can't comment on any specifics in terms of any ongoing discussions as I'm sure you will appreciate. With regard to 072 registrational strategy, the strategy is to really play out the monotherapy expansions and again, we'll have additional data at ASCO, as I mentioned, where we're looking at this dose of 10 mg/kg in multiple tumor types to really get a fingerprint of how this monotherapy looks, best we can in the kinds of patients that we can enroll into these types of studies today. And then at that point, look at the data and evaluate the potential for moving into a full stage registrational study for the monotherapy in one or other of those indications.
It, of course, will depend upon what we see. If we see robust enough data in any of those indications to drive into a single-arm registrational study, that would be one option, moving into potentially randomized studies could be another option. We're just going have to see what the data delivers for us around the middle of the year.
With regard to the Zelboraf combination, we continue to think that's an interesting experiment. We've been committed to that combination. It has taken some time to enroll. I would say the same thing. Let's see what the data tells us. The field has evolved a lot since we initiated that study. There is no question about it.
So again, I don't want to make a specific comment on portfolio strategy, but it's not lost on us how much the field has evolved externally since we started our study and that may well read on decisions that we make in the future, but let's see what the data shows.
Operator
Our next question comes from line of Mohit Bansal with Citigroup.
Mohit Bansal
Just wanted to understand, so the three programs which you're still under collaboration, how are you thinking about the future for those programs? Do you think there will be any partnership opportunity there as well?
Sean McCarthy
You're talking about the three targets for which research was stopped?
Mohit Bansal
Yes.
Sean McCarthy
Yes, well, see I mean, the targets will come back to us, which is great. I would say that, as you well know, all question of target selection in immunooncology has gone through kind of a transformation over the last 3, 4 years, and targets that we viewed as attractive a few years ago by leaders in the field such as BMS are viewed differently in many cases today for lots of different reasons it. And so those targets do come back to us, but we are not commenting at this stage on whether we plan to advance them or not. We certainly could, but we also have a ton of other stuff going on that we are excited about in our pipeline.
Mohit Bansal
Got it. And then coming back to the PDC target, CD166 as well as 71, could you help us understand how, when you decide that this is the target we need to go after? What the process is? I mean, I understand that it has to be a target on cancer tissues. But I mean, like how do we make sure that this is the right target before actually getting into clinic?
Sean McCarthy
Well, that's a big question for the field isn't it, Mohit? But I'll give you my answer. No, to be serious, with regards to the PDCs, the way we've thought about this for the last two years is as follows: that it's a triage process. So we start with the most highly expressed antigens. We then look for the most highly expressed antigens across multiple tumor types. We then make antibodies to them, we conjugate them to payloads, we do in vitro assays to look at the ability of those conjugates to kill cells. Also as we move forward looking at the internalization properties of those antigens, which, of course, are vital for ADCs and PDCs to work, we then take them in vivo, we run a handful of in vivo models to look at the breadth of activity. And as we did this, several years ago, CD166 and CD71, kind of jumped out fairly quickly at us from the first triage that we did as very attractive and opportunistic targets and even benchmarked against other ADC targets. So that's what even our process. We continue to run through additional targets where we are looking for, as I said, continue to work on the third, the fourth, the fifth PDC. We're following a very similar triage process. So that's been our strategy, but, of course, you never know until you get to the clinic.
Mohit Bansal
Got it. And then last one, I mean, you did comment on -- a little bit on Amgen collaboration. So when can we see more from that side in terms of now they are getting to clinics or something like that?
Sean McCarthy
Yes, no guidance there at this point, Mohit. It continues to be research. What I can tell you is that we're very well positioned with Amgen given that, they're obviously very, very strong in this field at the molecular biological level. We have -- we're pooling resources in terms of our molecular toolkits to -- including CD3 molecules, this was just assessed to build a wide range of different formats and molecules to evaluate in preclinical studies and it just takes time. So that's what all I can say at this point. But we are on the right track, the research is first class, the relationship with those guys is terrific and our decision to partner with each other, I think, has been very well received by both companies.
Operator
Our next question comes from the line of Boris Peaker with Cowen.
Boris Peaker
Great. So my first question is on 072. I'm just curious what biomarkers are you monitoring in these patients and have you observed any correlation between biomarker responders versus nonresponders?
Sean McCarthy
Boris, good question, important question. We continue to look at PD-1 status. We're not -- in the Part D in the expansions, we're not biopsying patients prospectively. So -- we did that as you know in the A2 arm, where we collected a good deal of translational data, including immune cell infiltrates, PD-L1 status, we looked at cytokine mRNA expression so on and so forth. In the -- the monotherapy expansions are really aimed principally at getting the efficacy fingerprint. So there's not going to be as much translational data so that's what all I can say at this point.
Boris Peaker
Right. And for 2009, I'm just curious for the CD166 space in general, is there any competitive developments that you or we should be paying attention as investors, anything we expect at ASCO, outside of your programs?
Sean McCarthy
Nothing that we're aware of at this point.
Boris Peaker
Right. And lastly, any -- I mean, you have seen a couple of partnered programs. Any time line for potentially when we see results from those, any partner program?
Sean McCarthy
Well, ImmunoGen has presented some quite beautiful data on the EpCAM probody drug conjugate preclinically. That data looks very strong. With regards to clinical data, it's too early to tell and that's what all we can say at this stage.
Operator
Our next question comes from the line of Joe Catanzaro with Piper Jaffray.
Joseph Catanzaro
Just two quick ones for me. Maybe the first one with regards to 072-ipi combo. How are you thinking about the indications in the expansion cohort of that trial? Did your plans have sort of [indiscernible] you've done a dose 072 and picked these checkpoint refractory-type tumors or pick indications were nivo-ipi has demonstrated clear activity or perhaps a mixture of both?
Sean McCarthy
Joe, great question. A very, very topical question at CytomX at this exact point in time as I'm sure, you can appreciate. We will be guiding on this as the year progresses. And the only thing I would say is that, we are -- we're gearing up to do -- we want to make sure that the next step for this combination is a meaningful next step that will really show us what this combination can do. So I would just ask you to stay tuned.
Joseph Catanzaro
Okay. Fair enough. And then my second one. So It sounds like you could potentially get another look at 2009 data in 2019. Should we expect that to just be additional follow-up for the A2 patients or could we potentially see data from the dose ranging portion of the study that's ongoing?
Sean McCarthy
Well, I think the -- obviously, for us the main objective of the dose ranging work is to pick our dose for Phase II so once we -- which obviously we're going to want to communicate as soon as we can to you guys. To the degree that we'll be in a position to actually share the underlying data and whether we decide to do that at a medical conference this year or next year or at a more ad hoc basis, we're just going to have to wait and see. But for us, we're really focused on getting to a data set that will allow us to pick the dose and then move on. So we'll have to see.
Operator
Our next question comes from the line of Robert Driscoll with Wedbush Securities.
Ashiq Mubarack
This is Ashiq Mubarack on for Robert. Just a couple quick ones. I guess regarding CX-2009, how confident are you in the ocular profile being dose responses, especially in this mTPI cohort, any commentary there? And then just a quick second one on revenues associated with the Bristol-Myers collaboration. Any modeling thoughts for us for the next couple quarters?
Sean McCarthy
Got it. So with regards to 2009 and ocular prophylaxis, I mean, we -- I think there's pretty good evidence from others and I think in our data as well that ocular toxicity for the DM4 payload is dose dependent. And in our study, we definitely pushed the envelope with the dose escalation. We were able to get to doses that were significantly higher than we had originally thought when we designed this Phase I study. We're not entirely clear why that is, whether it relates to some property of the probody or not. But to the effort, 9 mg/kg and 10 mg/kg doses was a little bit unexpected for us frankly, and not surprising those doses, we see fairly significant ocular toxicity all the more so because we weren't actively prophylaxing patients in the early stages of dose escalation, so -- watching through most of dose escalation. The literature evidence and the work that ImmunoGen has done and is reported has shown I think pretty clearly that steroidal eyedrops given appropriately with a high degree of compliance can actually be very effective in mitigating this type of toxicity.
And we're using a somewhat similar regimen, but a further modified regimen based on consultation with our own consultants. So we're going to have to wait and see. We're optimistic. But it's going to also be a function, of course, of the dose that we actually end up picking for Phase II as well. So we'll know more as the year progresses. Second question on BMS revenues. We don't have any additional guidance at this point on revenue from BMS or actually from any of the other collaborations at this stage.
Operator
Our next question comes from the line of Biren Amin with Jefferies.
Biren Amin
Sean, maybe I can just start on 2009. When can we expect, I guess, an announcement on which tumor types you would go after with the Phase B portion of the study? And I guess, what would you consider in terms of just factors in evaluating which tumor types? I think you looked at seven tumors in the Phase I portion.
Sean McCarthy
Yes. Hi Biren. Well, let's just recap what we know so far as I mentioned in my comments. We -- as we said at ASCO, we've seen evidence of activity for 2009 in a number of tumor types, which we know expressed target [indiscernible] breast cancer, ovarian cancer and head and neck. We've also seen, as you can see in the waterfall plot from the poster presentation at AACR, some activity in lung cancer as well.
It's still early days, of course, but our vision for the program has always been that it has the potential to be active in most tumor types and that does seem to be the case. What we're working to right now is for the expansion phase as we move into expansions in Phase II. Should we take a laser shot in one indication? Should we move into more than one indication? We haven't made that decision yet.
So as I said earlier on, I'm very much hopeful that we'll get through the dose ranging work in the coming months and be in a position second half of the year to pick dose and indication -- maybe there will be more than one indication and hopeful that will happen second half of the year, but that does require that we don't spend too long in dose refinement in the coming months. So a little bit of a moving target, but I think we have a lot of opportunity here.
Operator
I'm showing no further questions in queue at this time. I'd like to turn the call back to Dr. Sean McCarthy for closing remarks.
Sean McCarthy
Well, thanks, everyone, for your time, I very much appreciate it. It's been another strong quarter for CytomX. We're super excited about where we are as a company and very much look forward to providing additional updates as the year progresses. So enjoy the rest of your day or evening.
Operator
Ladies and gentlemen, thank you for your participation in today's conference. This concludes the program, you may now disconnect. Everyone, have a great day.
Company Participants
Christopher Keenan - VP of IR & Corporate Communications
Sean McCarthy - Chairman, CEO & President
Robin Knifsend - VP, Finance
Conference Call Participants
Jackson Harvey - Nomura Securities
Alec Stranahan - Bank of America Merrill Lynch
Waleed Abdel-Naby - SunTrust
Mohit Bansal - Citigroup
Boris Peaker - Cowen and Company
Joseph Catanzaro - Piper Jaffray Companies
Ashiq Mubarack - Wedbush Securities
Biren Amin - Jefferies
Operator
Good day, ladies and gentlemen, and welcome to the CytomX Therapeutics First Quarter 2019 Financial Conference Call. [Operator Instructions]. As a reminder, this call may be recorded. I would now like to introduce your host for today's conference, Mr. Christopher Keenan, Vice President of Investor Relations. Chris, you may begin.
Christopher Keenan
Thank you, Liz. Good afternoon, joining me today are CytomX President, Chief Executive Officer and Chairman, Dr. Sean McCarthy; and CytomX's Vice President of Finance, Robin Knifsend. Before we begin, I would like to remind you that we'll be making forward-looking statements during the call. Because forward-looking statements relate to the future, they are subject to inherent uncertainties and risks that are difficult to predict and many of which are outside of our control.
Important risks and uncertainties are set forth in our most recent public filings with the SEC at sec.gov, including our Form 10-Q filed today. We undertake no obligation to update any forward-looking statements whether as a result of new information, future developments or otherwise.
A webcast of this call will be available on the Investor Relations page at CytomX's website at cytomx.com.
I would now like to turn the call over to Sean.
Sean McCarthy
Thanks, Chris, and good afternoon, everyone. I'm very pleased to be here with you today to briefly review another very productive quarter for CytomX. At CytomX, we are reinventing therapeutic antibodies for the treatments of cancer. We see a major opportunity to more effectively target therapeutic antibodies into diseased tissue, generating new classes of differentiated anticancer therapies as these are best-in-class molecules against validated targets or for first-in-class molecules against novel targets that we believe our technology can uniquely address. Our innovative approach to antibody localization into diseased tissue is called the Probody platform. Probodies are fully recombinant antibody prodrugs comprised of a therapeutic antibody, a linker and a mask designed in a way that the antibody can't see its target until the mask is removed.
Mask removal occurs specifically and selectively within cancer tissue as a function of disease-associated proteases, which clip off the mask in the tumor allowing the underlying antibody to bind target and elicit its biological effect.
Probody therapeutics are designed to offer localized target binding in diseased tissue while maintaining potency, reducing side effects and enabling new targets of mechanisms to be translated into novel product opportunities. We see this as a really big idea backed by decades of research by our deep knowledge of the biology of the tumor microenvironment, innovative protein engineering and a robust intellectual property portfolio. We are the leader in this emerging field of therapeutic antibody localization with four clinical stage programs, strong partnerships and recent clinical proof-of-concept.
The first quarter saw excellent progress by the CytomX team in developing our differentiated technology platform and our lead product candidates as we continue to build on the first Probody clinical data we presented for our lead program, the anti-PD-L1 probody, CX-072, at ASCO last year. Since then, we presented additional clinical and translational data, including from our second program, CX-2009, at ESMO, SITC, at our R&D Day in February and most recently at AACR.
It's been an exciting year for us, and we've learned a tremendous amount about how our unique antibody technology functions in cancer patients having checked key boxes to support proof-of-concept for the Probody platform.
We've demonstrated encouraging antitumor activity and safety profiles for both of our lead wholly owned programs, and we are now intensely focused on the development of next steps for the further development and advancement of these assets.
I'd like to take the opportunity here to briefly recap what we've disclosed to-date about the clinical performance of these two lead molecules. Our most advanced program CX-072 is a PD-L1 targeting probody for which we have presented increasingly matured Phase I data for monotherapy and in combination with the anti-CTLA-4 antibody, ipilimumab, also known of course as Yervoy.
Our vision for CX-072 is for the probody to become a differentiated centerpiece of combination anticancer therapy by enabling safer, more effective combinations. We also see opportunities for CX-072 to potentially expand beyond the existing market to settings where conventional PD pathway agents are not currently employed. Data presented on CX-072 as monotherapy at our Q1 R&D Day showed that CX-072 continues to demonstrate a favorable safety profile as well as durable anticancer activity in heavily pretreated patients with tumor types not typically expected to respond to PD pathway inhibitors.
Data from the completed dose escalation phase of PROCLAIM-CX-072 showed that of 24 efficacy evaluable patients, all with generally weakly immunogenic tumors and treated with doses greater than or equal to 3 mg/kg of CX-072, 12 or 50% of patients demonstrated tumor shrinkage, including 4 partial responses. CX-072 was generally well tolerated with maximum tolerated dose not reached.
Preliminary results from dose escalation informed our ongoing monotherapy dose expansion cohorts studying the dose of 10 mg/kg of CX-072 in multiple tumor types. As reported during our Q1 R&D Day, CX-072 is showing activity in several tumor types at this dose and updated data from these expansion cohorts will be presented in a poster and also as part of a poster discussion session at ASCO 2019.
Turning now to CX-072 in combination with ipilimumab. As reported previously from our dose escalation phase, we've defined the maximum tolerated dose of this combination as 10 mg/kg of CX-072 and 3 mg/kg of ipi, which is the full label dose of ipilimumab. Our preliminary efficacy data is encouraging with antitumor activity, including complete and durable responses seen in advanced stage cancer patients, again, with tumors not generally regarded to be responsive to PD pathway inhibitors. As of our most recently reported data cutoff, of 19 patients evaluable for efficacy, 4 or 21% experienced confirmed responses, including one complete response.
Furthermore, among the 27 patients treated with the 072 plus ipi combination of 3 mg -- with ipi at 3 mg/kg or above, the combination was generally well tolerated with 7 or 26% of patients reporting a Grade 3/4 treatment-related adverse event and this compares very well to historical controls, which, of course, have shown incidence of Grade 3/4 TRAEs in excess of 50%, typically for the combination of a PD inhibitor and ipi at full dose. So these data suggest that the combination of CX-072 plus ipilimumab could allow for the safe and effective treatment of patients in multiple indications with full dose and schedule of ipi with the goal of reaching longer and more durable responses.
Based on these important clinical data for CX-072, we are excited about the prospects of the program to make a difference to cancer patients, and we're busy developing our next steps for this unique asset and we'll be laying out our plans in the near future.
Now I would like to turn to CX-2009, a potentially first-in-class probody drug conjugate targeting a unique and broadly expressed tumor antigen CD166. Now because probody therapeutics are designed to minimize binding of drug to normal tissues, we're in a very unique position to address a new class of targets with attractive molecular features that were previously thought undruggable because of their high expression on normal tissues. CD166 is an example of this kind of target. The target is highly and homogeneously expressed in multiple solid tumor types and might be considered an attractive target for a conventional antibody drug conjugate were it not for the fact that is also present on most normal epithelial tissues.
We think it's a great target for a probody drug conjugate, however, since probodies allow us to more selectively target tumor tissue This is a really exciting program since it combines probody technology with drug conjugate technology with the goal of making a transformative difference for patients across a wide range of cancer types. During Q1 ,we presented preliminary clinical data from the Phase I dose escalation portion of the ongoing PROCLAIM clinical trial of CX-2009 monotherapy in a subset of CD166 expressing cancer types, including certain patients that were selected for high-level expression of CD166.
The intent and design of this Phase I dose escalation trial was firstly, of course, to evaluate the safety of this very novel drug candidate, safety being a particularly critical question given the widespread expression of CD166 on normal tissues. We also wanted to understand as much as we could in Phase I about the contribution of the drug conjugate payload to the overall safety profile of the molecule in order to give us the maximum information with which to design our Phase II strategy. And lastly, we were looking for any initial signs of anticancer activity in a late stage, very heavily pretreated patient population that is, of course, typical for such highly experimental Phase I studies.
We've been very encouraged with the preliminary data for CX-2009 that we've shared previously. At the time of data cutoff for our AACR presentation, 71 patients across all doses were evaluable for efficacy. Of the 39 patients who received greater than or equal to 4 mg/kg of CX-2009 and had at least 1 post-baseline on-study tumor assessment, 38% of these patients achieved tumor shrinkage, including 7 unconfirmed partial responses observed in breast cancer, ovarian cancer and also in head and neck cancer. In addition, 74% of patients achieved stable disease or better at the time of their first on-treatment scan. This single-agent activity is the first validation of CD166 as an anticancer target, and we believe holds much promise. CX-2009 was generally well tolerated. The maximum tolerated dose was not reached at the highest dose level tested at 10 mg/kg, the most common treatment-related adverse events were Grade 1 and Grade 2 and they included nausea, fatigue and decreased appetite. The most common Grade 3/4 treatment-related adverse event was keratitis.
And so it's worth taking a moment or two to just reflect on the safety profile given just how broadly expressed this target is on normal tissue. We believe these data are strong evidence that probody masking technology can really allow us to target first-in-class tumor antigens regardless of their broad normal tissue expression, and we see this actually as an important advance in the field of antibody therapeutics generally. The keratitis that we observed principally at high doses of CX-2009 is a well-established side effect of DM4, the drug conjugate payload that we're employing in this drug candidate.
We are now engaged in further dose refinement, while taking steps to manage keratitis with ocular prophylaxis, which has been shown to be affected by others. This ongoing work will enable us to finalize our strategy for Phase II studies, which we'll be communicating in due course. Taken together, we are very pleased with how our wholly owned CX-072 and CX-2009 programs have progressed to date, and we look forward to providing a more detailed road map for these two assets in the coming months.
I'd like to comment briefly now on our pharma alliances. Firstly on our BMS alliance. This partnership was entered into in 2014 and was expanded in 2017. In total, the alliance provides BMS with access to up to 12 discovery targets from the CytomX platform. To date, CytomX has received a total of $287 million in upfront and milestone payments from BMS.
The lead program in the alliance is the anti-CTLA-4 Probody, BMS-986249, which is based on ipilimumab and continues to progress through a Phase I/II clinical trial being run by BMS. Our shared vision with BMS is that the CTLA-4 Probody has the potential to be a safer, more effective version of Yervoy allowing the full realization of CTLA-4 as a powerful and highly validated cancer immunotherapy target. Additional research work continues under this alliance, and we look forward to additional targets that BMS may select in the future.
Now I'd like to return to the drug conjugate space for just a moment where our alliances with AbbVie and ImmunoGen also continue to advance. In collaboration with AbbVie, CytomX is advancing a second clinical stage probody drug conjugate, CX-2029 directed against CD71, which is also known as the transferrin receptor. This program has the potential to turn CD71 a widely expressed receptor on normal tissues into a druggable target. CytomX continues to enroll patients in PROCLAIM-CX-2029, a Phase I/II clinical trial evaluating this molecule as monotherapy in patients with solid tumors or with lymphomas.
With ImmunoGen, we continue to make progress on our probody drug conjugate targeting the highly expressed tumor antigen, EpCAM. And last but certainly not least with regard to our collaborations, research work continues on multiple targets in our broad alliance with Amgen focused on T-cell engaging bispecific probodies. The goal of this research is to use probody technology to more effectively target T-cell engaging bispecifics into sold tumors, an area where toxicity is proven to be a real challenge for the field due to the very high potency of these agents. The leading edge of this alliance is an EGFR-CD3 probody bispecific.
With these updates on the company, I'll now turn the call over to Robin for a brief review of financial highlights from Q1.
Robin Knifsend
Thank you, Sean. I would like to review selective financial highlights for the first quarter. We ended the first quarter with cash, cash equivalents and investments totaling $396.6 million compared to $436.1 million as of December 31, 2018. Our strong balance sheet allows us to fund operations well into 2021 assuming no new collaborations or financings. Research and development expenses were $36.4 million for the quarter compared to $22.5 million in 2018. The increase in research and development expenses was primarily attributable to additional cost related to our maturing pipeline, personnel-related expenses and a $5 million charge for acquired technical know-how related to drug conjugate and bispecific technologies.
General and administrative expenses increased by $2.3 million for the quarter compared to the corresponding period in 2018 and was largely attributed to personnel-related expenses.
Revenue during the first quarter of 2019 were $29.5 million compared to $14.2 million in the corresponding period in 2018. This increase was largely attributable to the acceleration of revenue from upfront payments relating to certain targets within the BMS alliance.
With that, I'll turn the call back over to Sean.
Sean McCarthy
Great. Thanks, Robin. So now I would like to just briefly wrap up. From this recap of Q1 today, I hope you can see how across our wholly owned and partner pipeline we have a broad range of opportunities with very unique product candidates, enabled by our technology. And in addition to our pipeline progress during Q1, we also made several important additions to the senior organization, including Nick Galli as Chief Business Officer and Leslie Robbins as SVP, Intellectual Property. The additions of Nick and Leslie to our leadership team reflect our ongoing commitment to partnership formation and aggressive protection of our intellectual property as core pillars of our corporate strategy. Nick's proven track record in transformational business development and Leslie's broad and deep IP experience across discovery, development and commercial stages of biologic drug development will be great assets as we seek to maximize utility of our probody technology for patients.
I'm also delighted to welcome Elaine Jones back to our Board of Directors. Elaine recently retired from Pfizer after many years leading investments for their corporate venture fund. Elaine worked closely with CytomX in our earlier formative years. She is an accomplished life science industry leader whose broad experience across health care sectors and deep prior experience with CytomX will be a tremendous benefit as we continue to advance our innovative probody platform and clinical portfolio.
In conclusion, CytomX continue to make terrific progress during Q1. We further strengthened our leadership in the field of therapeutic antibody targeting with our Probody platform, we significantly advanced our clinical stage pipeline, moved our partnerships forward, and we further built our team.
We've finished Q1 with a strong balance sheet, and we look forward to a very productive 2019. On particular note, our lead wholly owned programs, CX-072 and CX-2009, are taking great shape, and we expect to provide detailed updates on next steps for the programs in the coming months.
So with that, I'll hand back to Chris for Q&A.
Christopher Keenan
Liz, you can open up the call for questions.
Question-and-Answer Session
Operator
[Operator Instructions]. Our first question comes from line of Christopher Marai with Nomura.
Jackson Harvey
This is Jackson Harvey on for Christopher Marai. My first question is on CX-072 ASCO data. I realize you're going to update us on Part D. But I'm just curious, will this be in the same tumor types as you presented at R&D Day or will it be additional tumor types?
Sean McCarthy
It will be largely in the same tumor types with the potential for a little bit of additional information as well.
Jackson Harvey
Got it. Also I have to ask if BMS has given you any indication of whether they maybe sharing data at ASCO as well?
Sean McCarthy
They have not.
Jackson Harvey
Okay. And my final question is on CX 2009. Can you share some more details on the dose refinement, what you might be looking for or the status of that, and also, the protocol for the ocular prophylaxis?
Sean McCarthy
Sure. Well, with regards to dose refinement, I think as we've reported previously, the mTPI cohort that we're enrolling, as of the last update, we were enrolling patients at the dose of 8 milligrams per kilogram. The way that particular component of the study is structured, it allows us to either further escalate or deescalate depending upon what we see at that dose. And so one of the advantages, of course, of doing this particular mTPI structure is that it gives us additional information on toxicity and overall therapeutic window over an extended period of doses as opposed to the simple -- the more typical 3-week DLT period within standard dose escalation. So there is a lot of information that we capture in the mTPI. We may only end up doing that at 8 mg/kg, we may end up at additional doses, we'll have to see how it goes, but the point, of course, is as you quite rightly point out is to dose range to allow us to select the optimal dose for Phase II.
Operator
Our next question comes from line of Ying Huang with Bank of America Merrill Lynch.
Alec Stranahan
This is Alec on for Ying. My first one is on the Agensys acquisition. How do you see the conjugate linker-toxin and the CD3 bispecifics contributing to your current or future pipeline? Just trying to get a sense of how you view the assets you got from Astellas?
Sean McCarthy
Yes, certainly great question. So as you all know, for the first two probody drug conjugates that we put into the clinic, we made a very deliberate decision to use linker-payload constructs that were well understood and well presented from a clinical standpoint. And that's very important because as you can see from our interpretation of our 2009 data as we look to tease apart the safety data and attribute toxicity to either payload or potentially later target, we know exactly what we're looking for from the payload. That's an extraordinary helpful in really figuring out a reasonably complex Phase I data set for CX-2009. We -- and that's the DM4 payload. The payload for the 2029 CD71 PDC is MMAE, so we expect that to be a similar kind of situation.
With the third, the fourth, the fifth, just keep on going PDC that we put into the clinic over the next several years, I think we will now be in a position to take a little bit more risk on payload and maybe bring some novel payloads forward and we've got quite interested in this chemistry that we've acquired from Agensys, which we think has a lot of potential, is less proven in the clinic, but we would -- what we are evaluating is potentially putting molecules into the clinic with those payloads, which, of course, we now would own outright, but also not come with any downstream economic burden to any kind of partner.
With regard to CD3, there is a lot of work going on in the field right now. So I'm sure you know to answer the question what is the optimal CD-3 arm for CD-3 bispecifics and that can vary in terms of affinity, avidity, cross-reactivity, you name it. And so we are just interested in building a big of a portfolio of CD-3 molecules as we can so that we can build large lead series to put into preclinical studies before we select molecules to put into the clinic, so that was just a somewhat opportunistic acquisition that's given us just another tool in the tool kit, if you like, for making CD-3 bispecifics.
Alec Stranahan
Great. That's really helpful. And then in terms of the overall cost of bringing this asset in-house, most of the expenses that hit R&D accounted for this quarter, I guess, what I'm trying to get at is, should we see R&D expense go down to normal level next quarter and onward?
Sean McCarthy
Yes, that's a onetime charge that you're seeing, that we're taking $5 million this quarter.
Operator
Our next question comes from line of Peter Lawson with SunTrust.
Waleed Abdel-Naby
This is Waleed on for Peter. A question on CX-072 combo study with vemurafenib. Can you give us an update on how the enrollment is progressing for that study and perhaps when we can potentially see some initial data?
Sean McCarthy
Yes, study continues, and we are -- we haven't yet decided exactly where we'll present data, but we are still actively considering sharing preliminary data from that arm before the end of the year.
Waleed Abdel-Naby
Great. And just do you have any additional perhaps clarity on when we may expect the expansion phase to begin for CX-2009?
Sean McCarthy
Well, we are certainly optimistic that we'll have that underway second half of this year. It really does depend, of course, on the ongoing dose optimization work we are doing and to some extent, as you can appreciate, as I commented earlier in the mTPI cohort, how much dose refinement we elect to do there. But we would -- we're certainly shooting together up and running second half of this year.
Operator
Our next question comes from the line of Geoff Meacham with Barclays.
Unidentified Analyst
This is Olivia Barone [ph] for Geoff. Just two quick ones from me. The first is, one, have there been any further developments in terms of CX-188 from a potential partnership perspective? Whether that's in the form of conversation with companies that have shown maybe initial interest on their part or maybe a more active approach on your end? Or should we be thinking about that as more of a downward event if at all? And then just one on 072, recognizing it's still very early days, but can you give us a sense of what your internal discussions have been around registrational studies down the road and also maybe if you could help us better understand how you're thinking about the Zelboraf combination as far as pipeline prioritization goes?
Sean McCarthy
Hi Olivia. Thanks for the questions. I'll see if I can answer. With regards to partnerships, on 188, I would kind of take a step back and say that if we think about the 072 program and our PD program as a whole, which would include PD-1 plus PD-L1, obviously, we have some interest in time in potentially forming a partnership there, but we can't comment on any specifics in terms of any ongoing discussions as I'm sure you will appreciate. With regard to 072 registrational strategy, the strategy is to really play out the monotherapy expansions and again, we'll have additional data at ASCO, as I mentioned, where we're looking at this dose of 10 mg/kg in multiple tumor types to really get a fingerprint of how this monotherapy looks, best we can in the kinds of patients that we can enroll into these types of studies today. And then at that point, look at the data and evaluate the potential for moving into a full stage registrational study for the monotherapy in one or other of those indications.
It, of course, will depend upon what we see. If we see robust enough data in any of those indications to drive into a single-arm registrational study, that would be one option, moving into potentially randomized studies could be another option. We're just going have to see what the data delivers for us around the middle of the year.
With regard to the Zelboraf combination, we continue to think that's an interesting experiment. We've been committed to that combination. It has taken some time to enroll. I would say the same thing. Let's see what the data tells us. The field has evolved a lot since we initiated that study. There is no question about it.
So again, I don't want to make a specific comment on portfolio strategy, but it's not lost on us how much the field has evolved externally since we started our study and that may well read on decisions that we make in the future, but let's see what the data shows.
Operator
Our next question comes from line of Mohit Bansal with Citigroup.
Mohit Bansal
Just wanted to understand, so the three programs which you're still under collaboration, how are you thinking about the future for those programs? Do you think there will be any partnership opportunity there as well?
Sean McCarthy
You're talking about the three targets for which research was stopped?
Mohit Bansal
Yes.
Sean McCarthy
Yes, well, see I mean, the targets will come back to us, which is great. I would say that, as you well know, all question of target selection in immunooncology has gone through kind of a transformation over the last 3, 4 years, and targets that we viewed as attractive a few years ago by leaders in the field such as BMS are viewed differently in many cases today for lots of different reasons it. And so those targets do come back to us, but we are not commenting at this stage on whether we plan to advance them or not. We certainly could, but we also have a ton of other stuff going on that we are excited about in our pipeline.
Mohit Bansal
Got it. And then coming back to the PDC target, CD166 as well as 71, could you help us understand how, when you decide that this is the target we need to go after? What the process is? I mean, I understand that it has to be a target on cancer tissues. But I mean, like how do we make sure that this is the right target before actually getting into clinic?
Sean McCarthy
Well, that's a big question for the field isn't it, Mohit? But I'll give you my answer. No, to be serious, with regards to the PDCs, the way we've thought about this for the last two years is as follows: that it's a triage process. So we start with the most highly expressed antigens. We then look for the most highly expressed antigens across multiple tumor types. We then make antibodies to them, we conjugate them to payloads, we do in vitro assays to look at the ability of those conjugates to kill cells. Also as we move forward looking at the internalization properties of those antigens, which, of course, are vital for ADCs and PDCs to work, we then take them in vivo, we run a handful of in vivo models to look at the breadth of activity. And as we did this, several years ago, CD166 and CD71, kind of jumped out fairly quickly at us from the first triage that we did as very attractive and opportunistic targets and even benchmarked against other ADC targets. So that's what even our process. We continue to run through additional targets where we are looking for, as I said, continue to work on the third, the fourth, the fifth PDC. We're following a very similar triage process. So that's been our strategy, but, of course, you never know until you get to the clinic.
Mohit Bansal
Got it. And then last one, I mean, you did comment on -- a little bit on Amgen collaboration. So when can we see more from that side in terms of now they are getting to clinics or something like that?
Sean McCarthy
Yes, no guidance there at this point, Mohit. It continues to be research. What I can tell you is that we're very well positioned with Amgen given that, they're obviously very, very strong in this field at the molecular biological level. We have -- we're pooling resources in terms of our molecular toolkits to -- including CD3 molecules, this was just assessed to build a wide range of different formats and molecules to evaluate in preclinical studies and it just takes time. So that's what all I can say at this point. But we are on the right track, the research is first class, the relationship with those guys is terrific and our decision to partner with each other, I think, has been very well received by both companies.
Operator
Our next question comes from the line of Boris Peaker with Cowen.
Boris Peaker
Great. So my first question is on 072. I'm just curious what biomarkers are you monitoring in these patients and have you observed any correlation between biomarker responders versus nonresponders?
Sean McCarthy
Boris, good question, important question. We continue to look at PD-1 status. We're not -- in the Part D in the expansions, we're not biopsying patients prospectively. So -- we did that as you know in the A2 arm, where we collected a good deal of translational data, including immune cell infiltrates, PD-L1 status, we looked at cytokine mRNA expression so on and so forth. In the -- the monotherapy expansions are really aimed principally at getting the efficacy fingerprint. So there's not going to be as much translational data so that's what all I can say at this point.
Boris Peaker
Right. And for 2009, I'm just curious for the CD166 space in general, is there any competitive developments that you or we should be paying attention as investors, anything we expect at ASCO, outside of your programs?
Sean McCarthy
Nothing that we're aware of at this point.
Boris Peaker
Right. And lastly, any -- I mean, you have seen a couple of partnered programs. Any time line for potentially when we see results from those, any partner program?
Sean McCarthy
Well, ImmunoGen has presented some quite beautiful data on the EpCAM probody drug conjugate preclinically. That data looks very strong. With regards to clinical data, it's too early to tell and that's what all we can say at this stage.
Operator
Our next question comes from the line of Joe Catanzaro with Piper Jaffray.
Joseph Catanzaro
Just two quick ones for me. Maybe the first one with regards to 072-ipi combo. How are you thinking about the indications in the expansion cohort of that trial? Did your plans have sort of [indiscernible] you've done a dose 072 and picked these checkpoint refractory-type tumors or pick indications were nivo-ipi has demonstrated clear activity or perhaps a mixture of both?
Sean McCarthy
Joe, great question. A very, very topical question at CytomX at this exact point in time as I'm sure, you can appreciate. We will be guiding on this as the year progresses. And the only thing I would say is that, we are -- we're gearing up to do -- we want to make sure that the next step for this combination is a meaningful next step that will really show us what this combination can do. So I would just ask you to stay tuned.
Joseph Catanzaro
Okay. Fair enough. And then my second one. So It sounds like you could potentially get another look at 2009 data in 2019. Should we expect that to just be additional follow-up for the A2 patients or could we potentially see data from the dose ranging portion of the study that's ongoing?
Sean McCarthy
Well, I think the -- obviously, for us the main objective of the dose ranging work is to pick our dose for Phase II so once we -- which obviously we're going to want to communicate as soon as we can to you guys. To the degree that we'll be in a position to actually share the underlying data and whether we decide to do that at a medical conference this year or next year or at a more ad hoc basis, we're just going to have to wait and see. But for us, we're really focused on getting to a data set that will allow us to pick the dose and then move on. So we'll have to see.
Operator
Our next question comes from the line of Robert Driscoll with Wedbush Securities.
Ashiq Mubarack
This is Ashiq Mubarack on for Robert. Just a couple quick ones. I guess regarding CX-2009, how confident are you in the ocular profile being dose responses, especially in this mTPI cohort, any commentary there? And then just a quick second one on revenues associated with the Bristol-Myers collaboration. Any modeling thoughts for us for the next couple quarters?
Sean McCarthy
Got it. So with regards to 2009 and ocular prophylaxis, I mean, we -- I think there's pretty good evidence from others and I think in our data as well that ocular toxicity for the DM4 payload is dose dependent. And in our study, we definitely pushed the envelope with the dose escalation. We were able to get to doses that were significantly higher than we had originally thought when we designed this Phase I study. We're not entirely clear why that is, whether it relates to some property of the probody or not. But to the effort, 9 mg/kg and 10 mg/kg doses was a little bit unexpected for us frankly, and not surprising those doses, we see fairly significant ocular toxicity all the more so because we weren't actively prophylaxing patients in the early stages of dose escalation, so -- watching through most of dose escalation. The literature evidence and the work that ImmunoGen has done and is reported has shown I think pretty clearly that steroidal eyedrops given appropriately with a high degree of compliance can actually be very effective in mitigating this type of toxicity.
And we're using a somewhat similar regimen, but a further modified regimen based on consultation with our own consultants. So we're going to have to wait and see. We're optimistic. But it's going to also be a function, of course, of the dose that we actually end up picking for Phase II as well. So we'll know more as the year progresses. Second question on BMS revenues. We don't have any additional guidance at this point on revenue from BMS or actually from any of the other collaborations at this stage.
Operator
Our next question comes from the line of Biren Amin with Jefferies.
Biren Amin
Sean, maybe I can just start on 2009. When can we expect, I guess, an announcement on which tumor types you would go after with the Phase B portion of the study? And I guess, what would you consider in terms of just factors in evaluating which tumor types? I think you looked at seven tumors in the Phase I portion.
Sean McCarthy
Yes. Hi Biren. Well, let's just recap what we know so far as I mentioned in my comments. We -- as we said at ASCO, we've seen evidence of activity for 2009 in a number of tumor types, which we know expressed target [indiscernible] breast cancer, ovarian cancer and head and neck. We've also seen, as you can see in the waterfall plot from the poster presentation at AACR, some activity in lung cancer as well.
It's still early days, of course, but our vision for the program has always been that it has the potential to be active in most tumor types and that does seem to be the case. What we're working to right now is for the expansion phase as we move into expansions in Phase II. Should we take a laser shot in one indication? Should we move into more than one indication? We haven't made that decision yet.
So as I said earlier on, I'm very much hopeful that we'll get through the dose ranging work in the coming months and be in a position second half of the year to pick dose and indication -- maybe there will be more than one indication and hopeful that will happen second half of the year, but that does require that we don't spend too long in dose refinement in the coming months. So a little bit of a moving target, but I think we have a lot of opportunity here.
Operator
I'm showing no further questions in queue at this time. I'd like to turn the call back to Dr. Sean McCarthy for closing remarks.
Sean McCarthy
Well, thanks, everyone, for your time, I very much appreciate it. It's been another strong quarter for CytomX. We're super excited about where we are as a company and very much look forward to providing additional updates as the year progresses. So enjoy the rest of your day or evening.
Operator
Ladies and gentlemen, thank you for your participation in today's conference. This concludes the program, you may now disconnect. Everyone, have a great day.
http://www.abstract.asco.org/239/AbstView_239_258869.html
HOFFE IHR LEBT NOCH .... SO STILL WIE ES HIER IST !
CX-072, a PD-L1 Probody therapeutic, as monotherapy in patients with advanced solid tumors: Preliminary results of PROCLAIM-CX-072.
Sub-category:
New Targets and New Technologies (IO)
Category:
Developmental Immunotherapy and Tumor Immunobiology
Meeting:
2019 ASCO Annual Meeting
Abstract No:
2513
Poster Board Number:
Poster Discussion Session (Board #157)
Citation:
J Clin Oncol 37, 2019 (suppl; abstr 2513)
Author(s): Aung Naing, Fiona C. Thistlethwaite, Alexander I. Spira, Javier Garcia-Corbacho, Manreet Randhawa, Ferry Eskens, Bert O'Neil, Javier Lavernia, Nataliya Volodymyrivna Uboha, Omid Hamid, Anthony B. El-Khoueiry, Beverly A. Benson, William Garner, Vanessa Jessica Huels, Hendrik-Tobias Arkenau, Patricia LoRusso; MD Anderson Cancer Center, Houston, TX; The Christie NHS Foundation Trust and The University of Manchester, Manchester, United Kingdom; Virginia Cancer Specialists, Fairfax, VA; Hospital Clinic Barcelona, Barcelona, Spain; Beatson West of Scotland Cancer Centre, Glasgow, United Kingdom; Erasmus University Medical Center, Rotterdam, Netherlands; Indiana University Melvin and Bren Simon Cancer Center, Indianapolis, IN; Instituto Valenciano de Oncología, Valencia, Spain; University of Wisconsin, Carbone Cancer Center, Madison, WI; The Angeles Clinic and Research Institute, Los Angeles, CA; USC Norris Comprehensive Cancer Center, Los Angeles, CA; CytomX Therapeutics, Inc, South San Francisco, CA; Sarah Cannon Research Institute UK Limited, London, United Kingdom; Yale University School of Medicine, Yale Cancer Center, New Haven, CT
Abstract Disclosures
Abstract:
Background: Anti-programmed cell death ligand 1 (PD-L1) immunotherapies have improved survival in many cancers, but immune-related adverse events (irAEs) have been observed, especially in combination therapy. CX-072 is an investigational Probody therapeutic directed against PD-L1, designed to be preferentially activated in the tumor microenvironment and to reduce irAEs. Methods: This is an ongoing phase 1/2a study (PROCLAIM-CX-072; NCT03013491) evaluating CX-072 in patients (pts) with metastatic or unresectable solid tumors with no further standard curative treatment options and with no prior anti-PD1, PD-L1 or anti-CTLA4 treatment. Pts were unselected for PD-L1 expression. We report preliminary results from expansion cohorts in anal squamous cell carcinoma (SCCA), cutaneous squamous cell carcinoma (cSCC), small bowel adenocarcinoma (SBA), triple-negative breast cancer with skin lesions (TNBC), or undifferentiated pleomorphic sarcoma (UPS). Pts were treated with CX-072 monotherapy 10 mg/kg intravenously every 14 days. Results: As of 30 Nov 2018, 51 pts received CX-072 10 mg/kg monotherapy: SCCA (n = 9), cSCC (n = 5), SBA (n = 9), TNBC (n = 9), and UPS (n = 19). Median age was 63 y (range, 32-80), 67% were female, and pts had a median of 3 prior regimens (range, 1-12). Median treatment duration was 1.8 mo (range, 0.3-14.7). A grade 3/4 treatment-related adverse event (AE) was observed in 1 pt (2%; gr 3 generalized rash). No grade 3/4 irAEs were observed. Two pts discontinued treatment due to AEs: nausea (pt with SCCA) and sepsis (pt with SBA), neither treatment-related. Partial responses (confirmed and unconfirmed) were observed in cSCC (n = 1), TNBC (n = 2), and UPS (n = 1) (Table). Conclusions: CX-072 10 mg/kg monotherapy demonstrated anticancer activity in heavily pretreated pts with advanced solid tumors, including responses in cSCC, TNBC with skin lesions, and UPS, with a safety profile that compares favorably to historical controls. Clinical trial information: NCT03013491
Best Available Response
(efficacy evaluable* pts), n SCCA
(n = 3) cSCC
(n = 3) SBA
(n = 4) TNBC
(n = 2) UPS
(n = 16)
Confirmed or unconfirmed partial response 0 1 0 2 1
Stable disease 1 1 2 0 3
Progressive disease 2 1 2 0 12
*Required postbaseline assessment.
HOFFE IHR LEBT NOCH .... SO STILL WIE ES HIER IST !
CX-072, a PD-L1 Probody therapeutic, as monotherapy in patients with advanced solid tumors: Preliminary results of PROCLAIM-CX-072.
Sub-category:
New Targets and New Technologies (IO)
Category:
Developmental Immunotherapy and Tumor Immunobiology
Meeting:
2019 ASCO Annual Meeting
Abstract No:
2513
Poster Board Number:
Poster Discussion Session (Board #157)
Citation:
J Clin Oncol 37, 2019 (suppl; abstr 2513)
Author(s): Aung Naing, Fiona C. Thistlethwaite, Alexander I. Spira, Javier Garcia-Corbacho, Manreet Randhawa, Ferry Eskens, Bert O'Neil, Javier Lavernia, Nataliya Volodymyrivna Uboha, Omid Hamid, Anthony B. El-Khoueiry, Beverly A. Benson, William Garner, Vanessa Jessica Huels, Hendrik-Tobias Arkenau, Patricia LoRusso; MD Anderson Cancer Center, Houston, TX; The Christie NHS Foundation Trust and The University of Manchester, Manchester, United Kingdom; Virginia Cancer Specialists, Fairfax, VA; Hospital Clinic Barcelona, Barcelona, Spain; Beatson West of Scotland Cancer Centre, Glasgow, United Kingdom; Erasmus University Medical Center, Rotterdam, Netherlands; Indiana University Melvin and Bren Simon Cancer Center, Indianapolis, IN; Instituto Valenciano de Oncología, Valencia, Spain; University of Wisconsin, Carbone Cancer Center, Madison, WI; The Angeles Clinic and Research Institute, Los Angeles, CA; USC Norris Comprehensive Cancer Center, Los Angeles, CA; CytomX Therapeutics, Inc, South San Francisco, CA; Sarah Cannon Research Institute UK Limited, London, United Kingdom; Yale University School of Medicine, Yale Cancer Center, New Haven, CT
Abstract Disclosures
Abstract:
Background: Anti-programmed cell death ligand 1 (PD-L1) immunotherapies have improved survival in many cancers, but immune-related adverse events (irAEs) have been observed, especially in combination therapy. CX-072 is an investigational Probody therapeutic directed against PD-L1, designed to be preferentially activated in the tumor microenvironment and to reduce irAEs. Methods: This is an ongoing phase 1/2a study (PROCLAIM-CX-072; NCT03013491) evaluating CX-072 in patients (pts) with metastatic or unresectable solid tumors with no further standard curative treatment options and with no prior anti-PD1, PD-L1 or anti-CTLA4 treatment. Pts were unselected for PD-L1 expression. We report preliminary results from expansion cohorts in anal squamous cell carcinoma (SCCA), cutaneous squamous cell carcinoma (cSCC), small bowel adenocarcinoma (SBA), triple-negative breast cancer with skin lesions (TNBC), or undifferentiated pleomorphic sarcoma (UPS). Pts were treated with CX-072 monotherapy 10 mg/kg intravenously every 14 days. Results: As of 30 Nov 2018, 51 pts received CX-072 10 mg/kg monotherapy: SCCA (n = 9), cSCC (n = 5), SBA (n = 9), TNBC (n = 9), and UPS (n = 19). Median age was 63 y (range, 32-80), 67% were female, and pts had a median of 3 prior regimens (range, 1-12). Median treatment duration was 1.8 mo (range, 0.3-14.7). A grade 3/4 treatment-related adverse event (AE) was observed in 1 pt (2%; gr 3 generalized rash). No grade 3/4 irAEs were observed. Two pts discontinued treatment due to AEs: nausea (pt with SCCA) and sepsis (pt with SBA), neither treatment-related. Partial responses (confirmed and unconfirmed) were observed in cSCC (n = 1), TNBC (n = 2), and UPS (n = 1) (Table). Conclusions: CX-072 10 mg/kg monotherapy demonstrated anticancer activity in heavily pretreated pts with advanced solid tumors, including responses in cSCC, TNBC with skin lesions, and UPS, with a safety profile that compares favorably to historical controls. Clinical trial information: NCT03013491
Best Available Response
(efficacy evaluable* pts), n SCCA
(n = 3) cSCC
(n = 3) SBA
(n = 4) TNBC
(n = 2) UPS
(n = 16)
Confirmed or unconfirmed partial response 0 1 0 2 1
Stable disease 1 1 2 0 3
Progressive disease 2 1 2 0 12
*Required postbaseline assessment.
katastrophaler aktienverlauf in den letzten 12 Monaten. schade, dass ich nicht zumindest einen teilverkauf gemacht habe. augen zu und durch ;-)
CytomX Therapeutics Provides Update on Anti-PD-L1 Probody CX-072 at 2019 ASCO Annual Meeting
Sat June 1, 2019 9:00 AM|GlobeNewswire|About: CTMX
- Monotherapy Expansion Cohorts Show Clinical Activity Across Multiple Cancer Types -
- Differentiated Safety Profile Continues to Emerge -
SOUTH SAN FRANCISCO, Calif., June 01, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today presented additional results from PROCLAIM-072, an ongoing Phase 1/2 trial evaluating CX-072, a Probody therapeutic targeting PD-L1. Data from the ongoing CX-072 monotherapy expansion cohorts (Part D) were presented this morning in a poster and will be presented this afternoon in a poster discussion at the 2019 Annual Meeting of the American Society of Clinical Oncology (ASCO) in Chicago, Illinois.
“The breadth of anti-cancer activity of CX-072 monotherapy has continued to come into focus as these initial expansion cohorts have advanced,” said Sean McCarthy D.Phil., president, chief executive officer and chairman of CytomX Therapeutics. “Furthermore, the differentiated safety profile that is emerging for this unique agent is consistent with our vision for CX-072 to become a foundation for safer and potentially more effective combination therapies.”
CX-072, a PD-L1 Probody Therapeutic, as Monotherapy in Patients with Advanced Solid Tumors: Preliminary Results of PROCLAIM-CX-072
Session: Developmental Immunotherapy and Tumor Immunobiology (Poster #157)
Presenter: Aung Naing, M.D., FACP, The University of Texas MD Anderson Cancer Center
The PROCLAIM-CX-072 monotherapy Part D phase is examining safety and efficacy of CX-072 at 10 mg/kg every 2 weeks in multiple selected tumor types. Data was reported in patients with triple negative breast cancer (TNBC), anal squamous cell carcinoma (SCC), cutaneous squamous cell carcinoma (cSCC), undifferentiated pleomorphic sarcoma (UPS), and small bowel adenocarcinoma (SBA).
CX-072 Demonstrates Durable Anti-Tumor Activity
As of an April 5, 2019 data cutoff, 72 patients were enrolled and treated across the five reported cohorts. Among the 65 patients evaluable for efficacy, confirmed partial responses were observed in two patients with TNBC, one in a cSCC patient, and one in a UPS patient. A partial response, unconfirmed at the time of data cutoff, was subsequently confirmed in an anal SCC patient. These data resulted in disease control rates of 53% (8/15) in TNBC, 58% (7/12) in anal SCC, 67% (4/6) in cSCC, 25% (5/20) in UPS, and 17% (2/12) in SBA. Decreases in target lesion size were observed in the first 8 to 16 weeks of treatment. Responding patients remained on CX-072 for up to 72 weeks. Patients enrolled were generally heavily pretreated with a median number of three prior regimens before receiving CX-072.
CX-072 Monotherapy Well Tolerated
As of the data cutoff, CX-072 monotherapy was generally well tolerated with a favorable overall safety profile. Of the 72 patients evaluable for safety, 6% of patients experienced a grade ≥3 treatment related adverse event (TRAE), and 3% experienced grade ≥3 immune related adverse events (irAEs) with no (0%) TRAEs leading to treatment discontinuation.
https://seekingalpha.com/pr/17530993-cytomx-therapeutics-pro…
A copy of this poster is available in the Scientific Publications section of the CytomX website at www.CytomX.com.
This poster will be reviewed this afternoon as part of the Developmental Immunotherapy and Tumor Immunobiology Poster Discussion Session.
Presenter: David B. Page, M.D., Providence Cancer Center
Date/Time: Saturday, June 1, 1:15 – 2:45 p.m.
Location: McCormick Place, Hall D1
Sat June 1, 2019 9:00 AM|GlobeNewswire|About: CTMX
- Monotherapy Expansion Cohorts Show Clinical Activity Across Multiple Cancer Types -
- Differentiated Safety Profile Continues to Emerge -
SOUTH SAN FRANCISCO, Calif., June 01, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today presented additional results from PROCLAIM-072, an ongoing Phase 1/2 trial evaluating CX-072, a Probody therapeutic targeting PD-L1. Data from the ongoing CX-072 monotherapy expansion cohorts (Part D) were presented this morning in a poster and will be presented this afternoon in a poster discussion at the 2019 Annual Meeting of the American Society of Clinical Oncology (ASCO) in Chicago, Illinois.
“The breadth of anti-cancer activity of CX-072 monotherapy has continued to come into focus as these initial expansion cohorts have advanced,” said Sean McCarthy D.Phil., president, chief executive officer and chairman of CytomX Therapeutics. “Furthermore, the differentiated safety profile that is emerging for this unique agent is consistent with our vision for CX-072 to become a foundation for safer and potentially more effective combination therapies.”
CX-072, a PD-L1 Probody Therapeutic, as Monotherapy in Patients with Advanced Solid Tumors: Preliminary Results of PROCLAIM-CX-072
Session: Developmental Immunotherapy and Tumor Immunobiology (Poster #157)
Presenter: Aung Naing, M.D., FACP, The University of Texas MD Anderson Cancer Center
The PROCLAIM-CX-072 monotherapy Part D phase is examining safety and efficacy of CX-072 at 10 mg/kg every 2 weeks in multiple selected tumor types. Data was reported in patients with triple negative breast cancer (TNBC), anal squamous cell carcinoma (SCC), cutaneous squamous cell carcinoma (cSCC), undifferentiated pleomorphic sarcoma (UPS), and small bowel adenocarcinoma (SBA).
CX-072 Demonstrates Durable Anti-Tumor Activity
As of an April 5, 2019 data cutoff, 72 patients were enrolled and treated across the five reported cohorts. Among the 65 patients evaluable for efficacy, confirmed partial responses were observed in two patients with TNBC, one in a cSCC patient, and one in a UPS patient. A partial response, unconfirmed at the time of data cutoff, was subsequently confirmed in an anal SCC patient. These data resulted in disease control rates of 53% (8/15) in TNBC, 58% (7/12) in anal SCC, 67% (4/6) in cSCC, 25% (5/20) in UPS, and 17% (2/12) in SBA. Decreases in target lesion size were observed in the first 8 to 16 weeks of treatment. Responding patients remained on CX-072 for up to 72 weeks. Patients enrolled were generally heavily pretreated with a median number of three prior regimens before receiving CX-072.
CX-072 Monotherapy Well Tolerated
As of the data cutoff, CX-072 monotherapy was generally well tolerated with a favorable overall safety profile. Of the 72 patients evaluable for safety, 6% of patients experienced a grade ≥3 treatment related adverse event (TRAE), and 3% experienced grade ≥3 immune related adverse events (irAEs) with no (0%) TRAEs leading to treatment discontinuation.
https://seekingalpha.com/pr/17530993-cytomx-therapeutics-pro…
A copy of this poster is available in the Scientific Publications section of the CytomX website at www.CytomX.com.
This poster will be reviewed this afternoon as part of the Developmental Immunotherapy and Tumor Immunobiology Poster Discussion Session.
Presenter: David B. Page, M.D., Providence Cancer Center
Date/Time: Saturday, June 1, 1:15 – 2:45 p.m.
Location: McCormick Place, Hall D1
Mit dem Studien-Update zu BMS-986249 gibt es endlich mal wieder was eindeutig Positives für CTMX, nachdem es zuletzt nicht so gut lief. Nachfolgend ein paar Stichpunkte.
Zuerst einmal die negativen Punkte, welche hier (größten)-teils schon genannt wurden:
Ich sehe die Strategie von CTMX (inkl. der Vorstände) inzwischen etwas kritischer.
So wurde CX-188 in die Klinik gebracht und anschliessend aus Strategiegründen gestoppt. Hierdurch haben sie maximal Geld verbraten u. erst später nachgedacht. Warum das Ganze?
Da der IND für CX-188 eines der Ziele der Vorstände war, konnten sie hierfür den vollen Gehaltsbonus kassieren.
CAR-T Probody Partnerschaft mit MD Anderson Cancer Center wurde beendet u. es gibt auch keine Infos zu Fortschritten / Entwicklungsplänen.
Der kurzfristige Abgang des CFO Ray Debanjan ist für mich relevant, da er vor seiner CFO-Tätigkeit etliche gewinnbringende Deals eingefädelt und sich gleichermaßen technisch versiert geäußert und an Diskussionen beteiligt hat. Diese Kombination hat sicherlich einige lukrative Partnerschaften ermöglicht.
BMS stellte 3 von 4 Entwicklungsprojekten der ersten Partnerschaft ein. Das 4. ist der klinische Probody-Ipilimumab (BMS-986249).
Der Status der verbleibenden 8 Projekte der erweiterten Partnerschaft bleibt, gemäß der neuen Vereinbarung unter Verschluss. Hier werden wir wohl länger nichts erfahren, außer dass der NF-Probody-Ipi weiterhin verfolgt wird.
Lt. CTMX-Geschäftsbericht (GJ 2018, S.80) kommt der AMGN EGFR-CD3-TCB-Probody nicht richtig voran, weil immer wieder Kandidaten (die letzten beiden) verworfen wurden. Ist also mit neuen Molekül-Kandidaten noch im lead-optimization-Stadium und nicht im IND-enabling. Das bedeutet ca. 2 Jahre Verschiebung. Die genauen Gründe werden nicht benannt.
Beim CX-072 (Probody PD-L1) sind die bisher veröffentlichten Ergebnisse noch nicht durchschlagend. In den genannten Indikationen ist entweder die Wirksamkeit nicht so hoch (z.B. cSCC im Vergleich mit Libtayo) oder die Nebenwirkungen relevanter (z.B. TNBC). Eigentlich erhofften wir uns gleichwertige Wirksamkeit, kombiniert mit perfekter Verträglichkeit. Wir haben aber weder das Eine noch das Andere. Bleiben also die Kombitherapien, da selbst nicht so gängige PD-1 / -L1 Indikationen von der mannigfaltigen Konkurrenz abgegrast werden. Nahezu jeder mittlere Pharma- / Bio-Konzern hat inzwischen seinen eigenen PD-1 / -L1 in klinischen Studien.
Bzgl. Vemurafenib-Kombi gibt es bislang keine Updates und die IPI-Kombi zeigt auch noch keinen klaren Weg zur Zulassung.
Beim CX-2009 (CD-166 Probody) waren die Nebenwirkungen im therapeutisch relevanten Dosis-Bereich doch sehr hoch, wenn auch dem DM4-Toxin geschuldet. Behandlungsdauer war daher bislang kurz und die Therapieerfolge nicht durchlagend. Ob hier mit prophylaktischen Augentropfen eine längere, nebenwirkungsärmere Behandlungsdauer erreicht werden kann, ist unklar. Weg zur Zulassung ebenso unklar.
CX-2029 (CD-71 Probody) erhöht kaum, bzw. sehr langsam die Zahl der rekrutierenden Kliniken. Gibt es hier evtl. Probleme mit der Dosierung, bzw. Nebenwirkungen?
IMGN entlässt über 70% seiner Mitarbeiter und stoppt fast alle Entwicklungsaktivitäten inkl. EPCAM-PDC (siehe Meldung).
CTMX stellt viele neue Mitarbeiter ein; neue Partnerschaften oder Entwicklungsprojekte werden aber nicht vermeldet.
Cash-Abflüsse sind inzwischen bei 40-50 Mio USD pro Quartal.
Der Kurs ist also nicht grundlos so niedrig.
Zum Positiven:
Von AMGEN wurde ein Entwicklungsprojekt zur Aufrüstung mit Maskierungstechnologie übernommen.
Von Agensys (von Astellas 2018 abgewickelt) wurden zuerst Mitarbeiter und anschliessend ADC- u. Bispezifik-Technologie für 5 Mio USD übernommen. Evtl. haben die Ex-Mitarbeiter hier eine interessante Kaufgelegenheit gesehen.
Während des R&D-Tages wurden Verbindungen zu Macrogenics (Spezialist für FC-Optimierung u. Bispezifische Antikörper) erwähnt. Es gab aber bislang keine offizielle Meldung zu Kooperationsvereinbarungen.
Die Vereinbarungen mit UCSB wurden geändert. USCB erhält eine Abschlagzahlung von 1 Mio USD, 150 tsd Aktien u. 750 tsd USD pro Jahr bis 2031, um Lizenzzahlungen auf aktuelle und zukünftige Projekte zu reduzieren. Die Einstellung der 3 BMS-Entwicklungsprojekte war zu diesem Zeitpunkt bereits bekannt.
Die Vorstände verkaufen in 2019 keine Aktien mehr. Der Kurs wird wohl als zu günstig angesehen. Lloyd Rowland (General Counsel) kaufte 9000 Aktien zu 10,33 USD.
CX-2009 ist hoch dosierbar und eigentlich der POC der Probody-Technologie. Das Zielmolekül ist evtl. aber nicht das Beste. Evtl. gute PD-L1-Kombi.
Beim CX-072 (ASCO 2019 Part D) sind Therapie-Abbruchraten und Nebenwirkungen über das gesamte 10 mg/kg Patientenkollektiv (in nicht PD-L1 selektierten Patienten) insgesamt gut.
Im Vergleich zu Libtayo niedrige cSCC-Ansprechraten könnten am zu kleinen Kollektiv (n=6) liegen (statistische Ungenauigkeit). TNBC-Ansprechraten (Response, bzw. DCR) sehen gut aus.
CX-072 könnte für Kombi-Therapien doch noch relevant werden.
CX-2029 erhöht zumindest langsam die rekrutierenden Studienzentren (inzwischen 7).
Im Gegensatz zu CD166 könnte CD71 ein besseres Zielmolekül zu sein.
Siehe https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6337236/
Beim BMS-986249 gab es am 27.06. ein Studienupdate (https://clinicaltrials.gov/ct2/history/NCT03369223?A=13&B=14…). Es wurde still und heimlich eine Phase 2 Studie angehängt und die Teilnehmerzahl von 300 auf 375 erhöht.
Der IPI-Probody tritt nun in Nivo-Kombi gegen IPI-Nivo-Kombi und Nivo-Mono an.
BMS hat wohl gute Daten vorliegen, welche das Ganze rechtfertigen.
Das Patientenkollektiv des NF-IPI wurde hingegen geschrumpft und die rekrutierenden Studienzentren kommen kaum voran.
Damit sollte der Probody-IPI die interne BMS-Konkurrnz überholt haben.
Da CTMX bei ca. 350 Mio USD Nettocashposition (geschätzt Q2-2019) aktuell nur ca. 500 Mio USD Marktkapitalisierung aufweist, ist das Unternehmen nach wie vor sehr günstig bewertet. CTMX könnte mit bereits einem erfolgreichen Entwicklungsprojekt der Durchbruch gelingen und deutlich höher bewertet werden.
Zuerst einmal die negativen Punkte, welche hier (größten)-teils schon genannt wurden:
Ich sehe die Strategie von CTMX (inkl. der Vorstände) inzwischen etwas kritischer.
So wurde CX-188 in die Klinik gebracht und anschliessend aus Strategiegründen gestoppt. Hierdurch haben sie maximal Geld verbraten u. erst später nachgedacht. Warum das Ganze?
Da der IND für CX-188 eines der Ziele der Vorstände war, konnten sie hierfür den vollen Gehaltsbonus kassieren.
CAR-T Probody Partnerschaft mit MD Anderson Cancer Center wurde beendet u. es gibt auch keine Infos zu Fortschritten / Entwicklungsplänen.
Der kurzfristige Abgang des CFO Ray Debanjan ist für mich relevant, da er vor seiner CFO-Tätigkeit etliche gewinnbringende Deals eingefädelt und sich gleichermaßen technisch versiert geäußert und an Diskussionen beteiligt hat. Diese Kombination hat sicherlich einige lukrative Partnerschaften ermöglicht.
BMS stellte 3 von 4 Entwicklungsprojekten der ersten Partnerschaft ein. Das 4. ist der klinische Probody-Ipilimumab (BMS-986249).
Der Status der verbleibenden 8 Projekte der erweiterten Partnerschaft bleibt, gemäß der neuen Vereinbarung unter Verschluss. Hier werden wir wohl länger nichts erfahren, außer dass der NF-Probody-Ipi weiterhin verfolgt wird.
Lt. CTMX-Geschäftsbericht (GJ 2018, S.80) kommt der AMGN EGFR-CD3-TCB-Probody nicht richtig voran, weil immer wieder Kandidaten (die letzten beiden) verworfen wurden. Ist also mit neuen Molekül-Kandidaten noch im lead-optimization-Stadium und nicht im IND-enabling. Das bedeutet ca. 2 Jahre Verschiebung. Die genauen Gründe werden nicht benannt.
Beim CX-072 (Probody PD-L1) sind die bisher veröffentlichten Ergebnisse noch nicht durchschlagend. In den genannten Indikationen ist entweder die Wirksamkeit nicht so hoch (z.B. cSCC im Vergleich mit Libtayo) oder die Nebenwirkungen relevanter (z.B. TNBC). Eigentlich erhofften wir uns gleichwertige Wirksamkeit, kombiniert mit perfekter Verträglichkeit. Wir haben aber weder das Eine noch das Andere. Bleiben also die Kombitherapien, da selbst nicht so gängige PD-1 / -L1 Indikationen von der mannigfaltigen Konkurrenz abgegrast werden. Nahezu jeder mittlere Pharma- / Bio-Konzern hat inzwischen seinen eigenen PD-1 / -L1 in klinischen Studien.
Bzgl. Vemurafenib-Kombi gibt es bislang keine Updates und die IPI-Kombi zeigt auch noch keinen klaren Weg zur Zulassung.
Beim CX-2009 (CD-166 Probody) waren die Nebenwirkungen im therapeutisch relevanten Dosis-Bereich doch sehr hoch, wenn auch dem DM4-Toxin geschuldet. Behandlungsdauer war daher bislang kurz und die Therapieerfolge nicht durchlagend. Ob hier mit prophylaktischen Augentropfen eine längere, nebenwirkungsärmere Behandlungsdauer erreicht werden kann, ist unklar. Weg zur Zulassung ebenso unklar.
CX-2029 (CD-71 Probody) erhöht kaum, bzw. sehr langsam die Zahl der rekrutierenden Kliniken. Gibt es hier evtl. Probleme mit der Dosierung, bzw. Nebenwirkungen?
IMGN entlässt über 70% seiner Mitarbeiter und stoppt fast alle Entwicklungsaktivitäten inkl. EPCAM-PDC (siehe Meldung).
CTMX stellt viele neue Mitarbeiter ein; neue Partnerschaften oder Entwicklungsprojekte werden aber nicht vermeldet.
Cash-Abflüsse sind inzwischen bei 40-50 Mio USD pro Quartal.
Der Kurs ist also nicht grundlos so niedrig.
Zum Positiven:
Von AMGEN wurde ein Entwicklungsprojekt zur Aufrüstung mit Maskierungstechnologie übernommen.
Von Agensys (von Astellas 2018 abgewickelt) wurden zuerst Mitarbeiter und anschliessend ADC- u. Bispezifik-Technologie für 5 Mio USD übernommen. Evtl. haben die Ex-Mitarbeiter hier eine interessante Kaufgelegenheit gesehen.
Während des R&D-Tages wurden Verbindungen zu Macrogenics (Spezialist für FC-Optimierung u. Bispezifische Antikörper) erwähnt. Es gab aber bislang keine offizielle Meldung zu Kooperationsvereinbarungen.
Die Vereinbarungen mit UCSB wurden geändert. USCB erhält eine Abschlagzahlung von 1 Mio USD, 150 tsd Aktien u. 750 tsd USD pro Jahr bis 2031, um Lizenzzahlungen auf aktuelle und zukünftige Projekte zu reduzieren. Die Einstellung der 3 BMS-Entwicklungsprojekte war zu diesem Zeitpunkt bereits bekannt.
Die Vorstände verkaufen in 2019 keine Aktien mehr. Der Kurs wird wohl als zu günstig angesehen. Lloyd Rowland (General Counsel) kaufte 9000 Aktien zu 10,33 USD.
CX-2009 ist hoch dosierbar und eigentlich der POC der Probody-Technologie. Das Zielmolekül ist evtl. aber nicht das Beste. Evtl. gute PD-L1-Kombi.
Beim CX-072 (ASCO 2019 Part D) sind Therapie-Abbruchraten und Nebenwirkungen über das gesamte 10 mg/kg Patientenkollektiv (in nicht PD-L1 selektierten Patienten) insgesamt gut.
Im Vergleich zu Libtayo niedrige cSCC-Ansprechraten könnten am zu kleinen Kollektiv (n=6) liegen (statistische Ungenauigkeit). TNBC-Ansprechraten (Response, bzw. DCR) sehen gut aus.
CX-072 könnte für Kombi-Therapien doch noch relevant werden.
CX-2029 erhöht zumindest langsam die rekrutierenden Studienzentren (inzwischen 7).
Im Gegensatz zu CD166 könnte CD71 ein besseres Zielmolekül zu sein.
Siehe https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6337236/
Beim BMS-986249 gab es am 27.06. ein Studienupdate (https://clinicaltrials.gov/ct2/history/NCT03369223?A=13&B=14…). Es wurde still und heimlich eine Phase 2 Studie angehängt und die Teilnehmerzahl von 300 auf 375 erhöht.
Der IPI-Probody tritt nun in Nivo-Kombi gegen IPI-Nivo-Kombi und Nivo-Mono an.
BMS hat wohl gute Daten vorliegen, welche das Ganze rechtfertigen.
Das Patientenkollektiv des NF-IPI wurde hingegen geschrumpft und die rekrutierenden Studienzentren kommen kaum voran.
Damit sollte der Probody-IPI die interne BMS-Konkurrnz überholt haben.
Da CTMX bei ca. 350 Mio USD Nettocashposition (geschätzt Q2-2019) aktuell nur ca. 500 Mio USD Marktkapitalisierung aufweist, ist das Unternehmen nach wie vor sehr günstig bewertet. CTMX könnte mit bereits einem erfolgreichen Entwicklungsprojekt der Durchbruch gelingen und deutlich höher bewertet werden.
Antwort auf Beitrag Nr.: 60.925.000 von Nase_weis_nix am 01.07.19 05:36:50
Seit ein paar Tage ist ja eine Phase II Studie für Kombi-Therapien zu CX-072 zu finden: https://clinicaltrials.gov/ct2/show/NCT03993379
Zitat von Nase_weis_nix: CX-072 könnte für Kombi-Therapien doch noch relevant werden.
Seit ein paar Tage ist ja eine Phase II Studie für Kombi-Therapien zu CX-072 zu finden: https://clinicaltrials.gov/ct2/show/NCT03993379
Antwort auf Beitrag Nr.: 60.927.682 von fme_wo am 01.07.19 12:57:45Vielen Dank, Nase_weis_nix und fme_wo.
Interessant an der neuen 072-PII finde ich,
- dass das Kombipräparat nicht namentlich genannt wird, es also möglicherweise ein anderes als die bekannten bisherigen zwei sein könnte,
- dass es in einem der Arme auch First-Line erprobt wird,
- und dass so etwas wie diese Kombi bis dato gar nicht auf der öffentlichen Agenda stand. Unter "next steps" in Bezug auf Kombis wurde stets nur Ipi genannt. Möglicherweise gibt es hier demnächst eine kleine Überraschung.
Interessant an der neuen 072-PII finde ich,
- dass das Kombipräparat nicht namentlich genannt wird, es also möglicherweise ein anderes als die bekannten bisherigen zwei sein könnte,
- dass es in einem der Arme auch First-Line erprobt wird,
- und dass so etwas wie diese Kombi bis dato gar nicht auf der öffentlichen Agenda stand. Unter "next steps" in Bezug auf Kombis wurde stets nur Ipi genannt. Möglicherweise gibt es hier demnächst eine kleine Überraschung.
Antwort auf Beitrag Nr.: 60.928.210 von BReal am 01.07.19 14:05:19Das Kombi-Präparat der P2 scheint doch -wie eigentlich zu erwarten - Ipilimumab zu sein, zumindest wird sein Name unter Key Words erwähnt. Von daher doch keine Überraschung.
Ein sehr wichtiger Schritt für cytomx,
der zweite pdc mit abbvie
CytomX Therapeutics Announces Second Target Selection and Program Initiation with AbbVie Under Ongoing, Multi-Program Strategic Oncology Collaboration
July 9, 2019 at 8:00 AM EDT
-Triggers $10 Million Milestone Payment to CytomX-
SOUTH SAN FRANCISCO, Calif., July 09, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced the second target selection by its partner AbbVie under the companies’ 2016 Discovery Collaboration and Licensing Agreement to discover and develop Probody drug conjugates (“PDC”). The target selection triggers a $10 million payment to CytomX from AbbVie. This is the second of two research targets available to AbbVie under the agreement. The companies are also advancing a clinical-stage asset, CX-2029, under a global co-development and licensing agreement.
“The initiation of this additional program with AbbVie and the associated milestone payment reflects the growing strength of clinical proof of concept CytomX has achieved in support of the Probody platform. It also further underscores the potential of our unique technology to make meaningful differences for cancer patients. We are excited to start this new program with our AbbVie colleagues,” said Sean McCarthy D.Phil., president, chief executive officer and chairman of CytomX Therapeutics.
der zweite pdc mit abbvie
CytomX Therapeutics Announces Second Target Selection and Program Initiation with AbbVie Under Ongoing, Multi-Program Strategic Oncology Collaboration
July 9, 2019 at 8:00 AM EDT
-Triggers $10 Million Milestone Payment to CytomX-
SOUTH SAN FRANCISCO, Calif., July 09, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody™ therapeutic technology platform, today announced the second target selection by its partner AbbVie under the companies’ 2016 Discovery Collaboration and Licensing Agreement to discover and develop Probody drug conjugates (“PDC”). The target selection triggers a $10 million payment to CytomX from AbbVie. This is the second of two research targets available to AbbVie under the agreement. The companies are also advancing a clinical-stage asset, CX-2029, under a global co-development and licensing agreement.
“The initiation of this additional program with AbbVie and the associated milestone payment reflects the growing strength of clinical proof of concept CytomX has achieved in support of the Probody platform. It also further underscores the potential of our unique technology to make meaningful differences for cancer patients. We are excited to start this new program with our AbbVie colleagues,” said Sean McCarthy D.Phil., president, chief executive officer and chairman of CytomX Therapeutics.
Antwort auf Beitrag Nr.: 60.986.030 von StefanR am 09.07.19 15:48:27Nach langer Abstinenz bin ich mal wieder mit einer kleinen Position mit dabei. Die heutige Meldung zeigt zumindest, dass in der Technologie doch mehr steckt als ich vom Bauch her (Ich bin allerdings totaler medizinischer Laie!) in letzter Zeit erwartet hätte. Allerdings hätte ich mir einen anderen neuen Lizenznehmer gewünscht. Bei Abbvie denke ich immer die sind so verzweifelt auf der Suche nach gutem Ersatz für Humira, dass die alles probieren, auch Minimalchancen. Ist sicher Quatsch, drum habe ich auch wieder eine CTMX-Position im Depot in der Glückslos-Ecke. Wäre ja zu schade nicht dabei zu sein, wenn diese Technologie doch an irgendeiner Stelle durchschlägt und sich ein wenigstens ein Teil der früheren Euphorie von JoschkaSchröder materialisieren würde.
Antwort auf Beitrag Nr.: 60.986.030 von StefanR am 09.07.19 15:48:27@Stefan
und hier der Link dazu:
https://seekingalpha.com/news/3476436-abbvie-selects-second-…
Vielleicht der weg zur Treppe - nach Norden ?
Gruss RS
und hier der Link dazu:
https://seekingalpha.com/news/3476436-abbvie-selects-second-…
Vielleicht der weg zur Treppe - nach Norden ?
Gruss RS
Antwort auf Beitrag Nr.: 60.986.642 von werthaltig am 09.07.19 16:38:22@ werthaltig
Wäre ja zu schade nicht dabei zu sein, wenn diese Technologie doch an irgendeiner Stelle durchschlägt und sich ein wenigstens ein Teil der früheren Euphorie von JoschkaSchröder materialisieren würde.
Die Hoffnung stirbt nicht, diese lebt weiter!
Na dann sehe Dir einfach einmal ZYME an, auch von Joschka.
https://www.stockwatch.com/News/Item.aspx?bid=Z-C%3aZYME-277…
Gruss RS
Wäre ja zu schade nicht dabei zu sein, wenn diese Technologie doch an irgendeiner Stelle durchschlägt und sich ein wenigstens ein Teil der früheren Euphorie von JoschkaSchröder materialisieren würde.
Die Hoffnung stirbt nicht, diese lebt weiter!
Na dann sehe Dir einfach einmal ZYME an, auch von Joschka.
https://www.stockwatch.com/News/Item.aspx?bid=Z-C%3aZYME-277…

Gruss RS

Antwort auf Beitrag Nr.: 60.986.030 von StefanR am 09.07.19 15:48:27Verhalten positive Reaktion des Aktienkurs, Cytomx präsentiert Q2 Balance sheet und ein Business update. Guter Stand bei Cash und Cash Equivalents in Relation zur MCap.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
Noch mal ein paar Worte zu den Quartalszahlen und dem Call.
Sehr interessant ist, dass BMS mit BMS-986249 demnächst eine Phase 2 Studie startet. Cytomx bekommt dafür 10 Mio. Dollar. Die Studie hat 5 Arme und rekurtiert 375 Patienten.
https://clinicaltrials.gov/ct2/show/NCT03369223
BMS scheint also sehr zufrieden zu sein mit dem was sie in der Phase 1 gesehen haben.
Allerdings sind es nur noch Kombinationsstudien. BMS-986249 wird nicht mehr alleine weiterverfolgt.
Die Arme sind die folgenden:
2A: BMS-986249 in combination with nivolumab followed by nivolumab monotherapy
2B: BMS-986249 in combination with nivolumab followed by nivolumab monotherapy (hier muss entweder die Dosis und/oder die Frequenz der Gabe eine andere sein)
2C: BMS-986249 in combination with nivolumab (diese Kombi gab es auch in Phase 1)
2D: Ipilimumab (Yeroy) in combination with nivolumab followed by nivolumab monotherapy
2E: Nivolumab (Opdivo) monotherapy
Die Börse nimmt diese positive Entwicklung irgendwie nicht wahr. Auch das 2. Programm was AbbVie starten will, ist ja eine positive Entwicklung.
In naher Zukunft werden weitere Schritte für CX-072 bekannt gegeben. Es bleibt spannend. Vielleicht springt die Aktie ja auch irgendwann mal wieder an. Verdient hätte sie es.
Sehr interessant ist, dass BMS mit BMS-986249 demnächst eine Phase 2 Studie startet. Cytomx bekommt dafür 10 Mio. Dollar. Die Studie hat 5 Arme und rekurtiert 375 Patienten.
https://clinicaltrials.gov/ct2/show/NCT03369223
BMS scheint also sehr zufrieden zu sein mit dem was sie in der Phase 1 gesehen haben.
Allerdings sind es nur noch Kombinationsstudien. BMS-986249 wird nicht mehr alleine weiterverfolgt.
Die Arme sind die folgenden:
2A: BMS-986249 in combination with nivolumab followed by nivolumab monotherapy
2B: BMS-986249 in combination with nivolumab followed by nivolumab monotherapy (hier muss entweder die Dosis und/oder die Frequenz der Gabe eine andere sein)
2C: BMS-986249 in combination with nivolumab (diese Kombi gab es auch in Phase 1)
2D: Ipilimumab (Yeroy) in combination with nivolumab followed by nivolumab monotherapy
2E: Nivolumab (Opdivo) monotherapy
Die Börse nimmt diese positive Entwicklung irgendwie nicht wahr. Auch das 2. Programm was AbbVie starten will, ist ja eine positive Entwicklung.
In naher Zukunft werden weitere Schritte für CX-072 bekannt gegeben. Es bleibt spannend. Vielleicht springt die Aktie ja auch irgendwann mal wieder an. Verdient hätte sie es.
https://seekingalpha.com/article/4285361-take-cytomx-therape…
Our Take On CytomX Therapeutics
Aug. 13, 2019 10:01 PM ET|
1 comment |
About: CytomX Therapeutics, Inc. (CTMX)
Summary
Today, we take an in-depth look at a small developmental concern called CytomX Therapeutics.
Despite receiving over $400 million in upfront/milestone payments with two wholly owned assets in the clinic, the market is assigning a value of less than $200 million to its franchise.
With multiple shots on goal and some insider buying earlier in the year, CytomX merited a deeper dive.
Verdict
Factoring another quarter of cash burn and the $10 million from AbbVie, CytomX holds ~$8 a share in cash, meaning that the market values its pipeline and Probody platform at just over $100 million. Although the CX-072 mono data is not earth-shattering, its safety profile in combination with Yervoy adds validity to the Probody platform. And the early data on CX-2009 is encouraging. The $400+ million shelled out by four major drug companies - really five - to date for its Probody technology suggests that CytomX’s multiple shots on goal might be underappreciated and undervalued.
I was really hoping to like this name given it has so many traits I like to see before recommending a developmental concern for investment. However, even with the positives outlined above, I have several reservations, in no particular order.
1. Pfizer has already bailed on CTMX, and I get the sense that BMY (now that it is dealing with Celgene (CELG)) will bail if results from its Phase 1/2 trial fall short. ImmunoGen has already abandoned one target, and the other hasn't gotten out of the preclinic yet. Amgen's target isn't in the clinic. Only AbbVie seems committed, although I'm not confident that the CX-2029 Phase 1/2 trial will yield anything stellar anytime soon.
2. It's not that the platform isn't novel, it's just that it seems to be targeting functions that occur in healthy tissue, which means it is not attacking the triggering mechanism (root cause) to cells going rouge and becoming cancerous, but rather, completion functions post going rouge. Not that this method can't work, but it just doesn't seem like the right approach.
3. The data in the CX-072 trial is small, tepid, and confusing. It appears as if there is little focus: let's just have a trial and throw a lot of stuff at the wall, and even though none of it appears to be sticking, we can fall back on: a) heavily pretreated patients on death's doorstep; and b) the fact that it's just dose escalation. I know that's the nature of early-stage studies, but there just isn't anything to hang one's hat on here.
4. CX-2009 looks marginally encouraging based on the preliminary data, but the ocular toxicity could be an issue. Steroidal drops is management's explanation. We'll see if that proves to be the case.
5. The one insider buy is against dozens and dozens of insider sells since 2015.
Given these concerns, I am passing on making any Buy recommendation on this name at the moment. For those that are comfortable taking a flyer with a "watch item" position given the company does have positive attributes, I offer up this as a comprehensive starting point for your own due diligence.
It is forbidden to kill; therefore all murderers are punished unless they kill in large numbers and to the sound of trumpets.”
- Voltaire
Our Take On CytomX Therapeutics
Aug. 13, 2019 10:01 PM ET|
1 comment |
About: CytomX Therapeutics, Inc. (CTMX)
Summary
Today, we take an in-depth look at a small developmental concern called CytomX Therapeutics.
Despite receiving over $400 million in upfront/milestone payments with two wholly owned assets in the clinic, the market is assigning a value of less than $200 million to its franchise.
With multiple shots on goal and some insider buying earlier in the year, CytomX merited a deeper dive.
Verdict
Factoring another quarter of cash burn and the $10 million from AbbVie, CytomX holds ~$8 a share in cash, meaning that the market values its pipeline and Probody platform at just over $100 million. Although the CX-072 mono data is not earth-shattering, its safety profile in combination with Yervoy adds validity to the Probody platform. And the early data on CX-2009 is encouraging. The $400+ million shelled out by four major drug companies - really five - to date for its Probody technology suggests that CytomX’s multiple shots on goal might be underappreciated and undervalued.
I was really hoping to like this name given it has so many traits I like to see before recommending a developmental concern for investment. However, even with the positives outlined above, I have several reservations, in no particular order.
1. Pfizer has already bailed on CTMX, and I get the sense that BMY (now that it is dealing with Celgene (CELG)) will bail if results from its Phase 1/2 trial fall short. ImmunoGen has already abandoned one target, and the other hasn't gotten out of the preclinic yet. Amgen's target isn't in the clinic. Only AbbVie seems committed, although I'm not confident that the CX-2029 Phase 1/2 trial will yield anything stellar anytime soon.
2. It's not that the platform isn't novel, it's just that it seems to be targeting functions that occur in healthy tissue, which means it is not attacking the triggering mechanism (root cause) to cells going rouge and becoming cancerous, but rather, completion functions post going rouge. Not that this method can't work, but it just doesn't seem like the right approach.
3. The data in the CX-072 trial is small, tepid, and confusing. It appears as if there is little focus: let's just have a trial and throw a lot of stuff at the wall, and even though none of it appears to be sticking, we can fall back on: a) heavily pretreated patients on death's doorstep; and b) the fact that it's just dose escalation. I know that's the nature of early-stage studies, but there just isn't anything to hang one's hat on here.
4. CX-2009 looks marginally encouraging based on the preliminary data, but the ocular toxicity could be an issue. Steroidal drops is management's explanation. We'll see if that proves to be the case.
5. The one insider buy is against dozens and dozens of insider sells since 2015.
Given these concerns, I am passing on making any Buy recommendation on this name at the moment. For those that are comfortable taking a flyer with a "watch item" position given the company does have positive attributes, I offer up this as a comprehensive starting point for your own due diligence.
It is forbidden to kill; therefore all murderers are punished unless they kill in large numbers and to the sound of trumpets.”
- Voltaire
Antwort auf Beitrag Nr.: 61.247.658 von 007coolinvestor am 14.08.19 04:27:56
die 5 genannten Punkte sind nicht gerade ermutigend. Schade.
Zitat von 007coolinvestor: https://seekingalpha.com/article/4285361-take-cytomx-therape…
Our Take On CytomX Therapeutics
Aug. 13, 2019 10:01 PM ET|
1 comment |
About: CytomX Therapeutics, Inc. (CTMX)
Summary
Today, we take an in-depth look at a small developmental concern called CytomX Therapeutics.
Despite receiving over $400 million in upfront/milestone payments with two wholly owned assets in the clinic, the market is assigning a value of less than $200 million to its franchise.
With multiple shots on goal and some insider buying earlier in the year, CytomX merited a deeper dive.
Verdict
Factoring another quarter of cash burn and the $10 million from AbbVie, CytomX holds ~$8 a share in cash, meaning that the market values its pipeline and Probody platform at just over $100 million. Although the CX-072 mono data is not earth-shattering, its safety profile in combination with Yervoy adds validity to the Probody platform. And the early data on CX-2009 is encouraging. The $400+ million shelled out by four major drug companies - really five - to date for its Probody technology suggests that CytomX’s multiple shots on goal might be underappreciated and undervalued.
I was really hoping to like this name given it has so many traits I like to see before recommending a developmental concern for investment. However, even with the positives outlined above, I have several reservations, in no particular order.
1. Pfizer has already bailed on CTMX, and I get the sense that BMY (now that it is dealing with Celgene (CELG)) will bail if results from its Phase 1/2 trial fall short. ImmunoGen has already abandoned one target, and the other hasn't gotten out of the preclinic yet. Amgen's target isn't in the clinic. Only AbbVie seems committed, although I'm not confident that the CX-2029 Phase 1/2 trial will yield anything stellar anytime soon.
2. It's not that the platform isn't novel, it's just that it seems to be targeting functions that occur in healthy tissue, which means it is not attacking the triggering mechanism (root cause) to cells going rouge and becoming cancerous, but rather, completion functions post going rouge. Not that this method can't work, but it just doesn't seem like the right approach.
3. The data in the CX-072 trial is small, tepid, and confusing. It appears as if there is little focus: let's just have a trial and throw a lot of stuff at the wall, and even though none of it appears to be sticking, we can fall back on: a) heavily pretreated patients on death's doorstep; and b) the fact that it's just dose escalation. I know that's the nature of early-stage studies, but there just isn't anything to hang one's hat on here.
4. CX-2009 looks marginally encouraging based on the preliminary data, but the ocular toxicity could be an issue. Steroidal drops is management's explanation. We'll see if that proves to be the case.
5. The one insider buy is against dozens and dozens of insider sells since 2015.
Given these concerns, I am passing on making any Buy recommendation on this name at the moment. For those that are comfortable taking a flyer with a "watch item" position given the company does have positive attributes, I offer up this as a comprehensive starting point for your own due diligence.
It is forbidden to kill; therefore all murderers are punished unless they kill in large numbers and to the sound of trumpets.”
- Voltaire
die 5 genannten Punkte sind nicht gerade ermutigend. Schade.
Antwort auf Beitrag Nr.: 61.248.582 von riverstar_de am 14.08.19 08:47:05Rachel W. Humphrey (CMO) hat nun auch rechtzeitig das Weite gesucht.
User wie Ville und Joschka Schröder hatten ja ursprünglich von einer Ver100-fachung des Kurses geträumt.
Positive Beiträge sind hier mittlerweile Mangelware. Möglicherweise gehen bald die Lichter aus.
User wie Ville und Joschka Schröder hatten ja ursprünglich von einer Ver100-fachung des Kurses geträumt.
Positive Beiträge sind hier mittlerweile Mangelware. Möglicherweise gehen bald die Lichter aus.
Antwort auf Beitrag Nr.: 61.324.804 von biopadawan am 23.08.19 10:00:09Habe das mit Rachel W. Humphrey auch gelesen. Auch schlechter Stil keine Pressemitteilungen rauszugeben.
Viel positives kommt tatsächlich nicht. Ich überlege, wie das passt mit dem baldigen Phase 2 Start von BMS und dem 2. Target von AbbVie. Das sind ja mal gute Meldungen. Trotzdem habe ich ein komisches Gefühl.
Wie sieht das denn der Rest?
Viel positives kommt tatsächlich nicht. Ich überlege, wie das passt mit dem baldigen Phase 2 Start von BMS und dem 2. Target von AbbVie. Das sind ja mal gute Meldungen. Trotzdem habe ich ein komisches Gefühl.
Wie sieht das denn der Rest?
Antwort auf Beitrag Nr.: 61.324.804 von biopadawan am 23.08.19 10:00:09
Stimmt, die Meldung war ja gestern Abend mit Fr. Humphrey. Das ist schon mal eine klare Aussage und lässt nichts Gutes erahnen.!
Interessant wäre natürlich mal gewesen, was Joschka über die Firma jetzt denkt und wie er seine zu optimistische Einschätzung jetzt sieht.
Zitat von biopadawan: Rachel W. Humphrey (CMO) hat nun auch rechtzeitig das Weite gesucht.
User wie Ville und Joschka Schröder hatten ja ursprünglich von einer Ver100-fachung des Kurses geträumt.
Positive Beiträge sind hier mittlerweile Mangelware. Möglicherweise gehen bald die Lichter aus.
Stimmt, die Meldung war ja gestern Abend mit Fr. Humphrey. Das ist schon mal eine klare Aussage und lässt nichts Gutes erahnen.!
Interessant wäre natürlich mal gewesen, was Joschka über die Firma jetzt denkt und wie er seine zu optimistische Einschätzung jetzt sieht.
Antwort auf Beitrag Nr.: 61.325.077 von hinz12 am 23.08.19 10:26:41Aus dem 8-K:
"On August 19, 2019, it was determined that Rachel W. Humphrey, M.D., Senior Vice President and Chief Medical Officer of CytomX Therapeutics, Inc. (the “Company”), would leave her position and employment with the Company, effective August 19, 2019."
Am 19. August wurde mit sofortiger Wirkung die Beendigung des Arbeits-/Vertragsverhältnisses beschlossen. Normalerweise ist da etwas rechtlich Relevantes vorgefallen, was zu diesem Schritt geführt hat. Über die Gründe kann man nur mutmaßen.
Ein paar Vorschläge / Mutmaßungen, mehr oder weniger ernst gemeint:
- einige / auffällig viele der klinischen CTMX-Leute sind letztlich zu CRSP (CRISPR) nach Boston gewechselt
- zu gute "Vernetzung" in andere konkurrierende Unternehmen mittels der "Checkpoints"
- sie hatte ihren Lebensmittelpunkt an der Ostküste u. vertragliche Sondervereinbarungen über Reisekostenerstattung
- sie hatte die Aufgabe den Übergang zur GMP konformen massenproduktionstauglichen Aufreinigung der Wirkstoffe einzuleiten
- sie hatte die Verantwortung über sämtliche klinische Studien u. Ausarbeitung der Strategien
Positiv ist es bestimmt nicht und im besten Fall sind frisierte Reisekostenabrechnungen schuld, aber besser ein handlungsfähiges Unternehmen, als ein "weiter so", bzw. "kicking the can down the road".
PS
Brian Irving (ex CTMX) ist übrigens im Juni 2019 von FPRX weiter zum direkten Konkurrenten Amunix gegangen.
"On August 19, 2019, it was determined that Rachel W. Humphrey, M.D., Senior Vice President and Chief Medical Officer of CytomX Therapeutics, Inc. (the “Company”), would leave her position and employment with the Company, effective August 19, 2019."
Am 19. August wurde mit sofortiger Wirkung die Beendigung des Arbeits-/Vertragsverhältnisses beschlossen. Normalerweise ist da etwas rechtlich Relevantes vorgefallen, was zu diesem Schritt geführt hat. Über die Gründe kann man nur mutmaßen.
Ein paar Vorschläge / Mutmaßungen, mehr oder weniger ernst gemeint:
- einige / auffällig viele der klinischen CTMX-Leute sind letztlich zu CRSP (CRISPR) nach Boston gewechselt
- zu gute "Vernetzung" in andere konkurrierende Unternehmen mittels der "Checkpoints"
- sie hatte ihren Lebensmittelpunkt an der Ostküste u. vertragliche Sondervereinbarungen über Reisekostenerstattung
- sie hatte die Aufgabe den Übergang zur GMP konformen massenproduktionstauglichen Aufreinigung der Wirkstoffe einzuleiten
- sie hatte die Verantwortung über sämtliche klinische Studien u. Ausarbeitung der Strategien
Positiv ist es bestimmt nicht und im besten Fall sind frisierte Reisekostenabrechnungen schuld, aber besser ein handlungsfähiges Unternehmen, als ein "weiter so", bzw. "kicking the can down the road".
PS
Brian Irving (ex CTMX) ist übrigens im Juni 2019 von FPRX weiter zum direkten Konkurrenten Amunix gegangen.
Antwort auf Beitrag Nr.: 61.327.153 von Nase_weis_nix am 23.08.19 13:56:24Interessante Spekulationen zum Abgang des CMO. Der Markt scheint eher negative Vorzeichen darin zu erkennen. Langsam bin ich angesichts der Entwicklung des Aktienwertes doch beunruhigt. Bei der Aktuellen MCap scheint man den Pipelines nur nich wenig Werte <100Mio beizumessen. Die antizipierten Marktwerte z. Bsp des noch immer aussichtsreichen CX2009 wie präsentiert, sind wohl in weite Ferne gerückt. Es wird wirklich Zeit für positive Signale.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 61.327.153 von Nase_weis_nix am 23.08.19 13:56:24Update
CMO-Abgang
Am 19. August wurde mit sofortiger Wirkung die Beendigung des Arbeits-/Vertragsverhältnisses beschlossen. Normalerweise ist da etwas rechtlich Relevantes vorgefallen, was zu diesem Schritt geführt hat. Über die Gründe kann man nur mutmaßen. Ein paar Vorschläge / Mutmaßungen, mehr oder weniger ernst gemeint: ...
... meine Spekulationen scheinen weitgehend falsch zu sein, sonst hätte sie wohl keinen Beratervertrag bekommen.
http://ir.cytomx.com/node/9296/html
On August 28, 2019, CytomX Therapeutics, Inc. (the “Company”) entered into a consulting arrangement with Rachel W. Humphrey, M.D., former Senior Vice President and Chief Medical Officer of the Company, pursuant to which she will serve as a special advisor to the Company at a rate of $500 per hour for a period up to June 30, 2020. In addition, the Company and Dr. Humphrey entered into a Separation Agreement on August 28, 2019 which provides that Dr. Humphrey will receive severance benefits consistent with the terms of her Amended and Restated Severance and Change of Control Agreement dated as of March 25, 2019 ...
Konkurrenz / Amunix
PS Brian Irving (ex CTMX) ist übrigens im Juni 2019 von FPRX weiter zum direkten Konkurrenten Amunix gegangen.
... korrekterweise Bryan Irving. Bereits vorher ist ein weiterer langjähriger CTMX-Mitarbeiter (Daniel Hostetter) zu Amunix gewechselt. https://www.linkedin.com/in/daniel-hostetter-81314a1/?locale…
Mal sehen, ob Amunix die Qualität der Produktion ihrer unregelmäßig strukturiert erweiterten Moleküle (XTENylation = Weiterentwicklung von PEGylation) mit Protease Activated T Cell Engager = XPAT im Griff hat. Nektar Therapeutics hat sich bei NKTR-214 (PEGylation) zuletzt nicht gerade mit Ruhm bekleckert. https://finance.yahoo.com/news/why-nektar-therapeutics-stock…
Des Weiteren könnte die Proteasen-Aktivierung evtl. patentrechtlich anfechtbar sein, da bislang hauptsächlich durch Internalisierung die Abspaltung erfolgte. In den Amunix erteilten Patenten sind jedoch regelmäßig Proteasen-Aktivierung aufgeführt.
Ansonsten erscheint der Ansatz aussichtsreich, da die Halbwertszeit der Moleküle sehr lange ist. Im Gegensatz zur CTMX-Technologie sollten sich kaum ADA (Anti-Drug-Antibodies) bilden.
https://www.amunix.com/technology/overview/
HER2- u. EGFR-XPAT sind lt. Pipeline die fortgeschrittensten Projekte (präklinisch).
Immunogen-Partnerschaft
Immunogen will seine präklinischen Aktivitäten am EpCAM PDC herunterfahren und diesen auslizensieren, siehe letzte Frage & Antwort beim Webcast vom 27.06.2019 http://investor.immunogen.com/events
CTMX-Bewertung
CTMX ist weiterhin ungewöhnlich günstig bewertet. Da müsste fast Alles scheitern, damit diese Bewertung gerechtfertigt ist.
367 Mio USD - effektives Vermögen (Cash u. Äquivalent)
028 Mio USD - effektive Schulden (ohne Rückstellungen, Umsatzabgrenzungen)
339 Mio USD - Nettovermögen
380 Mio USD - Marktkapitalisierung bei Kurs von 8,37 USD bei 45,4 Mio Aktien
==================================================
031 Mio USD - Netto-Unternehmenswert
Wandlungspreise der ca. 10 Mio an Management u. Mitarbeiter ausgegebenen Optionen liegt bei ca. 12,93 USD, davon z.Zt. 5,4 Mio zu 9,61 USD ausübbar.
PS
Bin gerade am Erhöhen meines CTMX-Bestandes.
CMO-Abgang
Am 19. August wurde mit sofortiger Wirkung die Beendigung des Arbeits-/Vertragsverhältnisses beschlossen. Normalerweise ist da etwas rechtlich Relevantes vorgefallen, was zu diesem Schritt geführt hat. Über die Gründe kann man nur mutmaßen. Ein paar Vorschläge / Mutmaßungen, mehr oder weniger ernst gemeint: ...
... meine Spekulationen scheinen weitgehend falsch zu sein, sonst hätte sie wohl keinen Beratervertrag bekommen.
http://ir.cytomx.com/node/9296/html
On August 28, 2019, CytomX Therapeutics, Inc. (the “Company”) entered into a consulting arrangement with Rachel W. Humphrey, M.D., former Senior Vice President and Chief Medical Officer of the Company, pursuant to which she will serve as a special advisor to the Company at a rate of $500 per hour for a period up to June 30, 2020. In addition, the Company and Dr. Humphrey entered into a Separation Agreement on August 28, 2019 which provides that Dr. Humphrey will receive severance benefits consistent with the terms of her Amended and Restated Severance and Change of Control Agreement dated as of March 25, 2019 ...
Konkurrenz / Amunix
PS Brian Irving (ex CTMX) ist übrigens im Juni 2019 von FPRX weiter zum direkten Konkurrenten Amunix gegangen.
... korrekterweise Bryan Irving. Bereits vorher ist ein weiterer langjähriger CTMX-Mitarbeiter (Daniel Hostetter) zu Amunix gewechselt. https://www.linkedin.com/in/daniel-hostetter-81314a1/?locale…
Mal sehen, ob Amunix die Qualität der Produktion ihrer unregelmäßig strukturiert erweiterten Moleküle (XTENylation = Weiterentwicklung von PEGylation) mit Protease Activated T Cell Engager = XPAT im Griff hat. Nektar Therapeutics hat sich bei NKTR-214 (PEGylation) zuletzt nicht gerade mit Ruhm bekleckert. https://finance.yahoo.com/news/why-nektar-therapeutics-stock…
Des Weiteren könnte die Proteasen-Aktivierung evtl. patentrechtlich anfechtbar sein, da bislang hauptsächlich durch Internalisierung die Abspaltung erfolgte. In den Amunix erteilten Patenten sind jedoch regelmäßig Proteasen-Aktivierung aufgeführt.
Ansonsten erscheint der Ansatz aussichtsreich, da die Halbwertszeit der Moleküle sehr lange ist. Im Gegensatz zur CTMX-Technologie sollten sich kaum ADA (Anti-Drug-Antibodies) bilden.
https://www.amunix.com/technology/overview/
HER2- u. EGFR-XPAT sind lt. Pipeline die fortgeschrittensten Projekte (präklinisch).
Immunogen-Partnerschaft
Immunogen will seine präklinischen Aktivitäten am EpCAM PDC herunterfahren und diesen auslizensieren, siehe letzte Frage & Antwort beim Webcast vom 27.06.2019 http://investor.immunogen.com/events
CTMX-Bewertung
CTMX ist weiterhin ungewöhnlich günstig bewertet. Da müsste fast Alles scheitern, damit diese Bewertung gerechtfertigt ist.
367 Mio USD - effektives Vermögen (Cash u. Äquivalent)
028 Mio USD - effektive Schulden (ohne Rückstellungen, Umsatzabgrenzungen)
339 Mio USD - Nettovermögen
380 Mio USD - Marktkapitalisierung bei Kurs von 8,37 USD bei 45,4 Mio Aktien
==================================================
031 Mio USD - Netto-Unternehmenswert
Wandlungspreise der ca. 10 Mio an Management u. Mitarbeiter ausgegebenen Optionen liegt bei ca. 12,93 USD, davon z.Zt. 5,4 Mio zu 9,61 USD ausübbar.
PS
Bin gerade am Erhöhen meines CTMX-Bestandes.
Antwort auf Beitrag Nr.: 61.422.056 von Nase_weis_nix am 05.09.19 20:06:49
041 Mio USD - Netto-Unternehmenswert!
Ich sollte meine Excel-Tabellen korrekt abtippen ;-)
Zitat von Nase_weis_nix: Update
CMO-Abgang
......
031 Mio USD - Netto-Unternehmenswert
.....
041 Mio USD - Netto-Unternehmenswert!
Ich sollte meine Excel-Tabellen korrekt abtippen ;-)
Das Unternehmen hat im 2019 eine turbulente Zeit hinter sich. Daten Read-outs, bei denen diskutiert wird, ob sie nun positiv resp. hoffnungsvoll oder negativ sind. Partner, welche die Zusammenarbeit für einen Teil ihrer Wirkstoffe storniert haben. Unerwartete Fluktuationen im Management. Dazu noch allgemein negative Stimmung und Unsicherheit an den Märkten. Alles Punkte, die der Markt gnadenlos abgestraft hat.
Es ist also Zeit, hier einzusteigen
Warum?
- Der Kurs ist nahe dem Allzeit Tief und die MK entspricht nicht mehr viel mehr als dem Cash-Bestand des Unternehmens. Trotz dem Fehlen von regelmässigem Umsatz sind aufgrund früherer Milestone- und anderweitigen Zahlungen über 300Mio USD in der Kasse.
- Die Cash Burn Rate ist allerdings auch stattlich mit 100-150Mio USD pro Jahr. Trotzdem wird man auch ohne weiteren Umsatz zumindest bis weit ins 2021 finanziert sein.
- Aus diesem Grund sind auch lediglich 45Mio Aktien im Umlauf, d.h. der Kurs kann auf veränderte Einschätzungen ihrer Plattform / Pipeline heftig reagieren. Und die aktuelle Bewertung ihrer Pipeline ist momentan bekanntlich nahe null, da die MK nicht weit über dem Cash Bestand bewertet ist.
- CytomX ist nicht von einem einzelnen Wirkstoff oder einer Studie oder einem Partner abhängig. Man besitzt Technologie, die in der Onkologie auf viele verschiedene Arten verwendet werden kann. Es gibt also keinen "Alles oder Nichts" Zock auf den Erfolg einer einzelnen klinischen Studie.
Natürlich gibt es wie immer Risiken. Wenn weitere Studien mehr Fragen aufwerfen als beantworten, wird man am Markt wohl beginnen, an der Umsetzbarkeit ihrer Plattform-Technologie zu zweifeln. Wenn weitere Partner ihre Zusammenarbeit beenden, wird das Unsicherheit generieren. Wenn gegen Ende 2020 immer noch kein regelmässiger Umsatz in Sicht ist, wird man sich Fragen, wie man die hohe Cash Burn Rate dann im 2021 finanzieren soll, usw. ... in den aktuell unsicheren Zeiten kann sich ein Aktienkurs dann auch mal ins "irrationale Nirvana" verabschieden, wobei ich schon davon ausgehe, dass zumindest der Cash Bestand momentan so etwas wie der Boden darstellen sollte.
Ich habe hier aber nicht investiert im Sinne von "Long über Jahre hinaus". Ich sehe es zumindest im Moment eher als "Trade", eine Wette, dass der Newsflow den Kurs in den nächsten 6 Monaten wieder aus dem Tief heraus auf ca. 11-13 USD bringen kann. Das sind ca. 30-50% Aufwärtspotential ohne dass sich sensationelles Ereignen muss. Trotzdem habe ich den Geld-Einsatz hier limitiert, um mein Risiko zu begrenzen.
Sollte der Newsflow in der Zeit unerwartet positives zu berichten haben, dann öffnen sich natürlich weitere Perspektiven. Das ist allerdings zur Zeit pure Spekulation und nicht der Antrieb für mein Investment.
Es ist also Zeit, hier einzusteigen

Warum?
- Der Kurs ist nahe dem Allzeit Tief und die MK entspricht nicht mehr viel mehr als dem Cash-Bestand des Unternehmens. Trotz dem Fehlen von regelmässigem Umsatz sind aufgrund früherer Milestone- und anderweitigen Zahlungen über 300Mio USD in der Kasse.
- Die Cash Burn Rate ist allerdings auch stattlich mit 100-150Mio USD pro Jahr. Trotzdem wird man auch ohne weiteren Umsatz zumindest bis weit ins 2021 finanziert sein.
- Aus diesem Grund sind auch lediglich 45Mio Aktien im Umlauf, d.h. der Kurs kann auf veränderte Einschätzungen ihrer Plattform / Pipeline heftig reagieren. Und die aktuelle Bewertung ihrer Pipeline ist momentan bekanntlich nahe null, da die MK nicht weit über dem Cash Bestand bewertet ist.
- CytomX ist nicht von einem einzelnen Wirkstoff oder einer Studie oder einem Partner abhängig. Man besitzt Technologie, die in der Onkologie auf viele verschiedene Arten verwendet werden kann. Es gibt also keinen "Alles oder Nichts" Zock auf den Erfolg einer einzelnen klinischen Studie.
Natürlich gibt es wie immer Risiken. Wenn weitere Studien mehr Fragen aufwerfen als beantworten, wird man am Markt wohl beginnen, an der Umsetzbarkeit ihrer Plattform-Technologie zu zweifeln. Wenn weitere Partner ihre Zusammenarbeit beenden, wird das Unsicherheit generieren. Wenn gegen Ende 2020 immer noch kein regelmässiger Umsatz in Sicht ist, wird man sich Fragen, wie man die hohe Cash Burn Rate dann im 2021 finanzieren soll, usw. ... in den aktuell unsicheren Zeiten kann sich ein Aktienkurs dann auch mal ins "irrationale Nirvana" verabschieden, wobei ich schon davon ausgehe, dass zumindest der Cash Bestand momentan so etwas wie der Boden darstellen sollte.
Ich habe hier aber nicht investiert im Sinne von "Long über Jahre hinaus". Ich sehe es zumindest im Moment eher als "Trade", eine Wette, dass der Newsflow den Kurs in den nächsten 6 Monaten wieder aus dem Tief heraus auf ca. 11-13 USD bringen kann. Das sind ca. 30-50% Aufwärtspotential ohne dass sich sensationelles Ereignen muss. Trotzdem habe ich den Geld-Einsatz hier limitiert, um mein Risiko zu begrenzen.
Sollte der Newsflow in der Zeit unerwartet positives zu berichten haben, dann öffnen sich natürlich weitere Perspektiven. Das ist allerdings zur Zeit pure Spekulation und nicht der Antrieb für mein Investment.
Mit CX 072 sind sie nun seid Mitte September in P2 auf Recruiting.
https://www.clinicaltrials.gov/ct2/show/NCT03993379?term=CX-…
https://www.clinicaltrials.gov/ct2/show/NCT03993379?term=CX-…
Kursverlauf Ohne gute news (und die kommen derzeit eher nicht) wohl eher gegen 5.
Antwort auf Beitrag Nr.: 61.576.899 von biopadawan am 26.09.19 18:05:34Dann würde die Marktkapitalisierung fast unter den Wert des Cashbestandes sinken. Das wäre ziemlich übel.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 61.577.412 von Jerry_Maguire am 26.09.19 18:59:11Im Grunde sind wir an dem Punkt. Letzter gemeldeter Cashbestand war 348.9 Mio. Die MK liegt aktuell drunter oder ziemlich genau in dem Bereich. Der Markt scheint zunehmend davon auszugehen, dass hier die Lichter ausgehen. Sollte von dieser Firma doch noch irgendwas Brauchbares kommen, sind die Chancen für den Kurs natürlich andererseits gewaltig. Ein echter Zock, eigentlich nicht so meine Anlagestrategie. Ich hab noch ein paar Stücke, die behalte ich erstmal.
Die ganze Geschichte hier zeigt ein Stück weit auch wieder, dass Fachwissen nicht vor völligen Fehleinschätzungen schützt. Joschka hat sehr lesenswerte Beiträge geschrieben und oft gut argumentiert, trotzdem ist ja die Liste der Fehleinschätzungen auch zB bei Produkten von Morphosys lang. Diversifizierung bleibt im Biotech-Bereich am wichtigsten, um sein Kapital zu schützen. Das zumindest kann man hier lernen.
glaubt da noch irgendwer an den Laden?
Antwort auf Beitrag Nr.: 61.648.422 von ciel34 am 08.10.19 17:29:42Nun es sollte zu den beiden Pipelines CX 72 und CX 2009 in H2 2019 noch Updates kommen. Viel Zeit ist nicht mehr. Einigermaßen merkwürdig, dass so gar nichts kommt. An sich hat CTX eine Technologie die sich in vielen verschiedenen Bereichen einsetzen lässt und deshalb an sich breites Marktinteresse da sein müsste. Das der Kurs so dermaßen absackt und quasi keinerlei IR Statements kommen, lässt nichts Gutes ahnen. Bleibt also nur zu spekulieren, eventuell sind Teile der Ergebnisse der Studienlage schon durchgesickert an die Institutionellen. Fakt ist das diese fehlenden Newsfeed gnadenlos abgestraft wird.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 61.650.195 von Jerry_Maguire am 08.10.19 19:46:36Wäre irgendetwas positives an dem Laden hätte BMY doch schon zugeschlagen bei den Preisen
Antwort auf Beitrag Nr.: 61.650.930 von biopadawan am 08.10.19 20:51:36Nun vielleicht machen sie das schon oder zumindest irgendwer anders. Heute wurde ein 250 T Aktienpacket gekauft. In den letzten 7 Tagen wurden insgesamt 3 ebenso hohe Volumen gekauft. Irgendjemand deckt sich ein zu den Kursen.
Gruß
JM
Gruß
JM
tja. sie fällt allerdings wie ein stein. ich bezahl im moment lehrgeld. gsd nicht meine einzige aktie....
Antwort auf Beitrag Nr.: 61.659.567 von ciel34 am 09.10.19 19:38:14Bei den Bios geht es doch schon eine Weile so ...

Habe nur noch eine Hand voll Biotech Ctmx ist auch dabei bin nun 20% im Minus. Die Zukunft wird es zeigen ob dies Kurse zum kaufen waren
Habe nur noch eine Hand voll Biotech Ctmx ist auch dabei bin nun 20% im Minus. Die Zukunft wird es zeigen ob dies Kurse zum kaufen waren

Na, schau ma mal, obs in dem tempo dann auch wieder raufgeht 

Bin bei ca. 9.50 USD wieder raus, nachdem der Kurs bei 10 USD abgeprallt ist. Allerdings nicht in "weiser Voraussicht" des Absturzes sondern weil ich Kapital für ein anderes Investment gebraucht habe und Prioritäten setzen musste. War somit auch Glück dabei für mich. Sorry, dass ich das nicht früher mitgeteilt hatte.
Bei den aktuellen rund 7 USD bietet sich aus meiner Sicht aber wieder eine neue Trading Chance. Gab auch News bez. einem neuen Chief Development Officer und weiterer Newsflow kann erwartet werden:
https://seekingalpha.com/pr/17661085-cytomx-therapeutics-ann…
Werde selbst aber momentan nicht mehr wieder einsteigen, da ich mich aktuell auf andere Sachen fokussiere. Viel Erfolg allerseits.
Bei den aktuellen rund 7 USD bietet sich aus meiner Sicht aber wieder eine neue Trading Chance. Gab auch News bez. einem neuen Chief Development Officer und weiterer Newsflow kann erwartet werden:
https://seekingalpha.com/pr/17661085-cytomx-therapeutics-ann…
Werde selbst aber momentan nicht mehr wieder einsteigen, da ich mich aktuell auf andere Sachen fokussiere. Viel Erfolg allerseits.
Antwort auf Beitrag Nr.: 61.694.938 von wandstrasse-ch am 15.10.19 13:48:10Na solche Beiträge sind ja immer die Besten. Rein bei ... und raus bei ... vor x Wochen. Glück gehabt... Achso, ist klar. Trading bei einem Wert mit so wenig Handelsvolumen, da braucht man nicht mehr weiter lesen.
Etwas Insight zum neuen Personal:
https://www.globenewswire.com/news-release/2019/10/14/192913…
Immerhin hat John McCarthy verstanden, das CTX Investoren aetwas Bewegung hin zum nächsten Level, d.h. Marktzulassung sehen wollen. Bisher hatte man ja den Eindruck, CTX forschen lieber in ihren Laboren still und leise vor sich hin.
Gruß
JM
Etwas Insight zum neuen Personal:
https://www.globenewswire.com/news-release/2019/10/14/192913…
Immerhin hat John McCarthy verstanden, das CTX Investoren aetwas Bewegung hin zum nächsten Level, d.h. Marktzulassung sehen wollen. Bisher hatte man ja den Eindruck, CTX forschen lieber in ihren Laboren still und leise vor sich hin.
Gruß
JM
Antwort auf Beitrag Nr.: 61.716.536 von Jerry_Maguire am 18.10.19 10:28:57
Jo, war mir schon klar, dass da so ein Schlaumeier mit dem Kommentar kommen wird. Ich versuche, so transparent wie möglich zu sein mit dem, was ich im Forum schreibe. Dass ich hier mit dem Trading Gedanken einsteige, habe ich in meinem Posting vom 7.9.19 klar und wortwörtlich so dargelegt. Ziel war eigentlich der Durchbruch durch den 10 USD Widerstand bis nach 11-13 USD, wie ebenso explizit beschrieben im entsprechenden Posting.
Leider, oder eben in dem Falle zum Glück, musste ich nach ein paar Wochen mangels freiem Kapital Prioritäten setzen. Da der Kurs bei 10USD abgeprallt war aber trotzdem noch im Plus war, hat es sich angeboten, diese Position aufzulösen. Normalerweise hätte ich das zeitnah beschrieben, was ich aber leider verpasst habe und erst diese Woche realisiert hatte. Hätte nun auch einfach meine Klappe halten können, so hätte ich mir deinen sinnlosen Kommentar erspart, aber was solls ... die einen schätzen Transparenz, die anderen kommen halt nur ins Forum um ihren Frust abzulassen.
Zitat von Jerry_Maguire: Na solche Beiträge sind ja immer die Besten. Rein bei ... und raus bei ... vor x Wochen. Glück gehabt... Achso, ist klar. Trading bei einem Wert mit so wenig Handelsvolumen, da braucht man nicht mehr weiter lesen.
Jo, war mir schon klar, dass da so ein Schlaumeier mit dem Kommentar kommen wird. Ich versuche, so transparent wie möglich zu sein mit dem, was ich im Forum schreibe. Dass ich hier mit dem Trading Gedanken einsteige, habe ich in meinem Posting vom 7.9.19 klar und wortwörtlich so dargelegt. Ziel war eigentlich der Durchbruch durch den 10 USD Widerstand bis nach 11-13 USD, wie ebenso explizit beschrieben im entsprechenden Posting.
Leider, oder eben in dem Falle zum Glück, musste ich nach ein paar Wochen mangels freiem Kapital Prioritäten setzen. Da der Kurs bei 10USD abgeprallt war aber trotzdem noch im Plus war, hat es sich angeboten, diese Position aufzulösen. Normalerweise hätte ich das zeitnah beschrieben, was ich aber leider verpasst habe und erst diese Woche realisiert hatte. Hätte nun auch einfach meine Klappe halten können, so hätte ich mir deinen sinnlosen Kommentar erspart, aber was solls ... die einen schätzen Transparenz, die anderen kommen halt nur ins Forum um ihren Frust abzulassen.
Der neuen CDO Amy C Peterson wurden Aktionoptionen über 400.000 Aktien zum Wert von 7,16 USD (Notierung zum 15.10.) als Antrittsprämie zugesichert. Man kann ja von Insiderkäufen halten und darüber spekulieren wie man will. Einigermaßen interessant könnte es trotzdem werden, wann sie diese einlöst. Als CDO dürfte sie tiefe Einblicke in den Stand der Entwicklung haben und mit ihrer Erfahrung auch den kommerziellen Erfolg besser einschätzen können. Daher würde ich dem dann hohe Bedeutung zuordnen.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
Antwort auf Beitrag Nr.: 61.742.833 von Jerry_Maguire am 22.10.19 12:59:06Muss much korrigieren. Im entsprechenden SEC filing ist zu lesen, dass es für Peterson eine automatisierte Ausschüttung in 25% Chargen zum jeweils 15.10. eines Jahres beginnend ab 2020 kommen wird.
Gruß
JM
Gruß
JM
Cytom X bringt Q3 Bericht am 7.11.19 5:00 pm ET (22:00 MEZ). Login für den Webcast 15 min vor Beginn.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
Antwort auf Beitrag Nr.: 61.756.931 von Jerry_Maguire am 24.10.19 14:13:29
mein iPad meldet mir immer öfter: CTMX reached a new All time Low. LOL. Einziges Trauerspiel.
Zitat von Jerry_Maguire: Cytom X bringt Q3 Bericht am 7.11.19 5:00 pm ET (22:00 MEZ). Login für den Webcast 15 min vor Beginn.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
mein iPad meldet mir immer öfter: CTMX reached a new All time Low. LOL. Einziges Trauerspiel.
Antwort auf Beitrag Nr.: 61.759.844 von riverstar_de am 24.10.19 19:59:46Es wird munter der Rest des Cashs verbrannt. Vermutlich bald insolvent der Laden. , zumindest nach Ansicht der Börse. Von der Führungsriege hört man auch nix mehr.
Die Zahlen sind raus.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
CytomX Therapeutics Announces Third Quarter 2019 Financial Results and Provides Business Update
November 7, 2019 at 4:09 PM EST
SOUTH SAN FRANCISCO, Calif., Nov. 07, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody therapeutic technology platform, today reported third quarter 2019 financial results.
As of September 30, 2019, CytomX had cash, cash equivalents and short-term investments of $325.7 million.
“The CytomX clinical pipeline made excellent progress in Q3 as we continued to advance multiple Probody therapeutic programs across the portfolio,” said Sean McCarthy, D.Phil., president, chief executive officer and chairman of CytomX Therapeutics. “The initiation of a Phase 2 trial of our anti-PD-L1 Probody CX-072 in combination with ipilimumab in patients with relapsed refractory melanoma marks our ongoing evolution into a product-focused company seeking to realize the full potential of our novel technology platform. Our first in class Probody Drug Conjugate programs, CX-2009 and CX-2029, also continued to move forward and our pipeline overall is positioned for significant data updates in 2020.”
Business Highlights and Recent Developments
CX-072 Anti-PD-L1 Probody Therapeutic Clinical Program
- In October, CytomX announced the initiation of the PROCLAIM (Probody Clinical Assessment In Man) CX-072-002 Phase 2 study evaluating the efficacy and tolerability of the anti-PD-L1 Probody CX-072, in combination with the anti-CTLA-4 antibody, ipilimumab, in patients with relapsed or refractory melanoma. The study utilizes a Simon Two-Stage design with approximately 40 patients being enrolled into Stage 1. CytomX anticipates initial data from Stage 1 in 2020. Additional information on this trial is available at ClinicalTrials.gov using the identifier NCT03993379.
- The Company also announced in October updated clinical data from the Phase 1 PROCLAIM-CX-072-001 dose-finding study of CX-072 in combination with ipilimumab. With enrollment complete, 27 evaluable patients had received ipilimumab (3, 6 or 10 mg/kg) combined with CX-072 (0.3, 1, 3 or 10 mg/kg), with the study achieving a disease control rate (stable disease or better) of 37%. 5 patients achieved confirmed objective responses by RECIST v1.1, including one complete response, for an overall response rate (ORR) of 19% in this heavily pretreated patient population. The median duration of response was 14.6 months (1.9 - 21.2 months) with 4 of the 5 responders still on treatment as of the latest data snapshot. Of the 27 patients treated across all doses, Grade 3/4 treatment related adverse events (TRAEs) were reported in 9 (33%) patients. Grade 3/4 immune-related adverse events (irAEs) were reported in 3 (15%) patients.
- Enrollment within the monotherapy cohorts of the PROCLAIM-CX-072-001 study is complete with evaluation of the activity and tolerability of CX-072 monotherapy continuing with ongoing treatment in select cohorts. Additional information on this trial is available at ClinicalTrials.gov using the identifier NCT03013491.
CX-2009 Anti-CD166 Probody Drug Conjugate Clinical Program
CytomX anticipates announcing next steps for the PROCLAIM-CX-2009 clinical program by the end of 2019.
BMS-986249 Anti-CTLA-4 Probody Therapeutic Clinical Program
- Bristol-Myers Squibb (BMS) is conducting a Phase 1/2a dose escalation clinical study evaluating BMS-986249 alone and in combination with OPDIVO® (nivolumab) in advanced solid tumors.
- BMS is preparing to initiate the Phase 2 portion of this clinical trial, upon which CytomX is entitled to a $10 million milestone payment. Additional information on this trial is available at ClinicalTrials.gov using the Identifier NCT03369223.
CX-2029 Anti-CD71 Probody Drug Conjugate Clinical Program
- CytomX continued enrollment of patients in the PROCLAIM-CX-2029 Phase 1/2 study, which is partnered with AbbVie, evaluating CX-2029 as monotherapy in patients with solid tumors or lymphomas. Additional information on this trial is available at ClinicalTrials.gov using the Identifier NCT003543813.
Additional Corporate Highlights
- In October, the Company announced the appointment of Amy C. Peterson, M.D., as executive vice president and chief development officer. In this new role, Dr. Peterson will have oversight of a multi-disciplinary team focused on advancing all aspects of CytomX’s clinical development activities.
- In July, the Company announced that its partner AbbVie selected a second target under the companies’ 2016 Discovery Collaboration and Licensing Agreement to discover and develop Probody drug conjugates. The target selection triggered a $10 million payment to CytomX from AbbVie.
Third Quarter 2019 Financial Results
Cash, cash equivalents and short-term investments totaled $325.7 million as of September 30, 2019, compared to $436.1 million as of December 31, 2018.
Revenue was $10.7 million for the three months ended September 30, 2019, compared to $12.5 million for the three months ended September 30, 2018. The decrease in revenue of $1.8 million for the three months ended September 30, 2019 compared to the corresponding period in 2018 was primarily due to a $1.7 million decrease in revenue recognition under the CD71 Agreement with AbbVie due to ongoing dose escalation.
Research and development expenses increased $0.4 million during the three months ended September 30, 2019 compared to the corresponding period in 2018. The increase was attributable to an increase of $1.3 million in personnel-related expenses primarily due to an increase in headcount; an increase of $0.7 million in consulting expenses resulting from increased clinical trial activities and an increase of $0.8 million in the allocation of information technology and facilities related expenses driven partly from an increase in headcount; which amounts were offset by a decrease of $2.4 million in laboratory contracts and services and laboratory supplies as a result of timing of manufacturing activities as well as reduced costs relating to CX-188 which is not presently being advanced.
General and administrative expenses increased by $0.3 million during the three months ended September 30, 2019 compared to the corresponding period in 2018. The increase was attributable to an increase of $0.4 million in consulting expenses primarily related to IT, software implementation and finance services; an increase of $0.5 million in dues and subscriptions primarily related to software and other IT services; an increase of $0.2 million in building maintenance charges; which amounts were partially offset by a decrease of $0.8 million of information technology and facilities-related expenses allocated to the general and administrative functions.
--------------------------------------------
Dazu gibs noch das Transcript des Earnings Calls (kostenloser Login erforderlich)
https://seekingalpha.com/article/4304096-cytomx-therapeutics…
--------------------------------------------
Hat irgendwer eine Meinung zu den Programmen? Joschka fehlt hier echt. Wie toll wäre mal eine fundierte Meinung.
Cytomx scheint weiter optimistisch, aber der Markt teilt diese Meinung irgendwie nicht. Es wurde auch nach einer Verpartnerung von CX-072 gefragt. Die Antwort war, dass sie dafür zu gegebener Zeit offen sind. Mir wäre sofort am liebsten. Das Risiko sollte mal ein wenig gesenkt werden. Da wäre mir weniger Upsidepotential recht.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
CytomX Therapeutics Announces Third Quarter 2019 Financial Results and Provides Business Update
November 7, 2019 at 4:09 PM EST
SOUTH SAN FRANCISCO, Calif., Nov. 07, 2019 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (Nasdaq: CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody therapeutic technology platform, today reported third quarter 2019 financial results.
As of September 30, 2019, CytomX had cash, cash equivalents and short-term investments of $325.7 million.
“The CytomX clinical pipeline made excellent progress in Q3 as we continued to advance multiple Probody therapeutic programs across the portfolio,” said Sean McCarthy, D.Phil., president, chief executive officer and chairman of CytomX Therapeutics. “The initiation of a Phase 2 trial of our anti-PD-L1 Probody CX-072 in combination with ipilimumab in patients with relapsed refractory melanoma marks our ongoing evolution into a product-focused company seeking to realize the full potential of our novel technology platform. Our first in class Probody Drug Conjugate programs, CX-2009 and CX-2029, also continued to move forward and our pipeline overall is positioned for significant data updates in 2020.”
Business Highlights and Recent Developments
CX-072 Anti-PD-L1 Probody Therapeutic Clinical Program
- In October, CytomX announced the initiation of the PROCLAIM (Probody Clinical Assessment In Man) CX-072-002 Phase 2 study evaluating the efficacy and tolerability of the anti-PD-L1 Probody CX-072, in combination with the anti-CTLA-4 antibody, ipilimumab, in patients with relapsed or refractory melanoma. The study utilizes a Simon Two-Stage design with approximately 40 patients being enrolled into Stage 1. CytomX anticipates initial data from Stage 1 in 2020. Additional information on this trial is available at ClinicalTrials.gov using the identifier NCT03993379.
- The Company also announced in October updated clinical data from the Phase 1 PROCLAIM-CX-072-001 dose-finding study of CX-072 in combination with ipilimumab. With enrollment complete, 27 evaluable patients had received ipilimumab (3, 6 or 10 mg/kg) combined with CX-072 (0.3, 1, 3 or 10 mg/kg), with the study achieving a disease control rate (stable disease or better) of 37%. 5 patients achieved confirmed objective responses by RECIST v1.1, including one complete response, for an overall response rate (ORR) of 19% in this heavily pretreated patient population. The median duration of response was 14.6 months (1.9 - 21.2 months) with 4 of the 5 responders still on treatment as of the latest data snapshot. Of the 27 patients treated across all doses, Grade 3/4 treatment related adverse events (TRAEs) were reported in 9 (33%) patients. Grade 3/4 immune-related adverse events (irAEs) were reported in 3 (15%) patients.
- Enrollment within the monotherapy cohorts of the PROCLAIM-CX-072-001 study is complete with evaluation of the activity and tolerability of CX-072 monotherapy continuing with ongoing treatment in select cohorts. Additional information on this trial is available at ClinicalTrials.gov using the identifier NCT03013491.
CX-2009 Anti-CD166 Probody Drug Conjugate Clinical Program
CytomX anticipates announcing next steps for the PROCLAIM-CX-2009 clinical program by the end of 2019.
BMS-986249 Anti-CTLA-4 Probody Therapeutic Clinical Program
- Bristol-Myers Squibb (BMS) is conducting a Phase 1/2a dose escalation clinical study evaluating BMS-986249 alone and in combination with OPDIVO® (nivolumab) in advanced solid tumors.
- BMS is preparing to initiate the Phase 2 portion of this clinical trial, upon which CytomX is entitled to a $10 million milestone payment. Additional information on this trial is available at ClinicalTrials.gov using the Identifier NCT03369223.
CX-2029 Anti-CD71 Probody Drug Conjugate Clinical Program
- CytomX continued enrollment of patients in the PROCLAIM-CX-2029 Phase 1/2 study, which is partnered with AbbVie, evaluating CX-2029 as monotherapy in patients with solid tumors or lymphomas. Additional information on this trial is available at ClinicalTrials.gov using the Identifier NCT003543813.
Additional Corporate Highlights
- In October, the Company announced the appointment of Amy C. Peterson, M.D., as executive vice president and chief development officer. In this new role, Dr. Peterson will have oversight of a multi-disciplinary team focused on advancing all aspects of CytomX’s clinical development activities.
- In July, the Company announced that its partner AbbVie selected a second target under the companies’ 2016 Discovery Collaboration and Licensing Agreement to discover and develop Probody drug conjugates. The target selection triggered a $10 million payment to CytomX from AbbVie.
Third Quarter 2019 Financial Results
Cash, cash equivalents and short-term investments totaled $325.7 million as of September 30, 2019, compared to $436.1 million as of December 31, 2018.
Revenue was $10.7 million for the three months ended September 30, 2019, compared to $12.5 million for the three months ended September 30, 2018. The decrease in revenue of $1.8 million for the three months ended September 30, 2019 compared to the corresponding period in 2018 was primarily due to a $1.7 million decrease in revenue recognition under the CD71 Agreement with AbbVie due to ongoing dose escalation.
Research and development expenses increased $0.4 million during the three months ended September 30, 2019 compared to the corresponding period in 2018. The increase was attributable to an increase of $1.3 million in personnel-related expenses primarily due to an increase in headcount; an increase of $0.7 million in consulting expenses resulting from increased clinical trial activities and an increase of $0.8 million in the allocation of information technology and facilities related expenses driven partly from an increase in headcount; which amounts were offset by a decrease of $2.4 million in laboratory contracts and services and laboratory supplies as a result of timing of manufacturing activities as well as reduced costs relating to CX-188 which is not presently being advanced.
General and administrative expenses increased by $0.3 million during the three months ended September 30, 2019 compared to the corresponding period in 2018. The increase was attributable to an increase of $0.4 million in consulting expenses primarily related to IT, software implementation and finance services; an increase of $0.5 million in dues and subscriptions primarily related to software and other IT services; an increase of $0.2 million in building maintenance charges; which amounts were partially offset by a decrease of $0.8 million of information technology and facilities-related expenses allocated to the general and administrative functions.
--------------------------------------------
Dazu gibs noch das Transcript des Earnings Calls (kostenloser Login erforderlich)
https://seekingalpha.com/article/4304096-cytomx-therapeutics…
--------------------------------------------
Hat irgendwer eine Meinung zu den Programmen? Joschka fehlt hier echt. Wie toll wäre mal eine fundierte Meinung.
Cytomx scheint weiter optimistisch, aber der Markt teilt diese Meinung irgendwie nicht. Es wurde auch nach einer Verpartnerung von CX-072 gefragt. Die Antwort war, dass sie dafür zu gegebener Zeit offen sind. Mir wäre sofort am liebsten. Das Risiko sollte mal ein wenig gesenkt werden. Da wäre mir weniger Upsidepotential recht.
Credit Suisse
CytomX Therapeutics (NASDAQ:CTMX) downgraded to Neutral with an $8 (34% upside) price target at Wedbush. Shares down a fraction premarket.
CytomX Therapeutics (NASDAQ:CTMX) downgraded to Neutral with an $8 (34% upside) price target at Wedbush. Shares down a fraction premarket.
Nach einem erneut drastischen Einbruch wird es wohl mal Zeit etwas tiefer in die Zahlen und Fakten zu schauen.
CX 72
Die Ergebnisse der CX72 Phase 1 Studie in Kombination mit Ipilimumab mit 27 Patienten sehen vielversprechend aus. Behandlungsbezogene Nebenwirkungen TRAEs (33%) und immunabwehrbedingte Nebenwirkungen irAE (15%) sind für eine Therapie in massiv vorbehandelten Patienten im gut tolerierten Bereich. Bei einer durchschnittlichen Behandlungsdauer von 14,6 Monaten wurde bei 5 Patienten einen volles Ansprechen auf die Therapie (ORR 19%) und bei 37% (5+5 Patienten) ein teilweises Ansprechen (Stabilisierung) erreicht. Die Phase 2 (Simon 2 Stufen Plan mit 40 Patienten) wurde gestartet. Zieltermin mit ersten Ergebnissen ist 01/2021. Die Patientensuche (300 Teilnehmer!) für die Studie zur Monotherapie mit CX 72 ist abgeschlossen. Grundsätzlich ergibt sich ein positives Bild hinsichtlich eines klinischen Erfolges der Therapien mit CX-72. Der Hauptgrund für den fehlenden Enthusiasmus bei Investoren dürfte sein, dass man sich nach wie vor stark zurück hält, bezüglich einer antizipierten Vorgehensweise und Prognosen Richtung Markteinführung. Außerdem zieht sich die Terminkette immer länger als angekündigt.
CX2009
Schweigen im Walde. Nächste Schritte werden für Ende 2019 angekündigt. Dies wurde bereits auch früher schon so angekündigt und ist wohl auch ein Hauptgrund für den neueren Rückgang des Investorenvertrauens in Q3. Ein Update zur Terminkette, hätte sicher geholfen. Es wird wohl hoffentlich ein Handlungsschwerpunkt der neuen CDO und VP C. Peterson, M.D sein.
BMS-986249 (Kooperation mit Bristol Myers Squibb)
Die Einschränkung der Kooperation mit BMS ausgehend von Seiten BMS war die Hauptursache für einen massiven Einbruch des Aktienwertes in 3/19 größer 20%. Bei der noch bestehenden Kooperation wird eine Dosiseskalation des Anti CTLA-4 Probody Therapeutikum als Monotherapie als auch in Kombination mit Nivolumab durchgeführt mit Ziel der Behandlung von Tumoren im fortgeschrittenen Stadium. Ein sehr vielversprechende Therapie, führt diese zum Erfolg. Weder von Seite BMS noch CTMX gibt es einen Status. Die Dosiseskulation sei abgeschlossen und ist in Auswertung. Die Phase 2 einer klinischen Studie sei in Vorbereitung was eine Meilensteinzahlung von 10 Mio USD von BMS > CTX triggern würde. Das Zieldatum für das Ende der Klinikstudie ist der 30.10.2022.
CX2029
In Kooperation mit AbbVie wird eine Monotherapie Studie zur Behandlung (150 Patienten) durchgeführt. Ziel ist die Behandlung von Tumoren (Hals, Nacken, Lunge, Bauchspeicheldrüse) und einer speziellen Form des Blutkrebs. Es gibt keinen Statusupdate. Das Ende der Klinikstudie soll 12/2020 sein.
Finanzen
Grundlegend muss man bei einem Unternehmen wie CTX das Verhältnis von Operating Expensen zu Cash und Cash Äquivalents bewerten. Da es keine Einnahmen aus Verkauf oder Dergleichen gibt, ist die Haupteinnahme Zahlungen aus Kooperationen, Lizenzeinnahmen usw. Mein Vergleichszeitraum ist das Balancesheet 3 Quartale endend 09/2018 gegen 3Q endend 09/2019. Einen Quartalsvergleich halte ich bei CTX für nicht zielführend. Es ergibt sich ein wenig überraschendes Bild.
Die laufenden Kosten (R&D, GA) sind im vergleichszeitraum um 22%/22 MioUSD gestiegen. Positiv ist anzumerken das dies überwiegend auf der R&D Seite geschah. Für ein R&D Unternehmen erst mal alles plausibel. Die GA Kosten sind dagegen nur moderat durch Personalkosten und Beratungskosten (R&D, IT, Facility) gestiegen. Kosten konnten darüber hinaus bei der Anmietung und Nutzung von Laboren gespart werden (Auch d. Ende CX-188).
Auf der Asset Seite wurde um 18,5% abgebaut hauptsächlich im Cashbestand -83 MioUSD und kurzfristig verkaufbarer Werte (-27 MioUSD). Interessanterweise findet sich eine Position über Lizenz? Einnahmen von +26 MioUSD die die Reduzierung der Cash and Äquivalente kompensiert. Was das ist, kann ich nur spekulieren. Die Anzahl ausgegebener Aktien hat sich nicht geändert. Das ist gut., keine Verwässerung. Die Summe aller Aktiva beläuft sich zum Abschluss 09/19 auf 372,5 Mio USD. Die Zahlen waren zum Zeitpunkt des Calls noch nicht testiert.
Fazit
Unterm Strich finden sich keine Überraschungen in G/V, Passiva oder Aktiva. Negativ gesagt lebt man von früheren Zahlungen. Die Cashburnrate ist nicht unerheblich, werden keine weiteren Einnahmen erzeugt und die Kosten verbleiben auf aktuellem Niveau wäre in 3,7 Jahren Schluss. Es dauert also noch etwas ‚bis die Lichter‘ ausgehen. Positiv anzumerken ist, dass dies nach allen antizipierten Zeiträumen erwarteter Ergebnisse der einzelnen Pipelines liegt. Die aktuelle Marktkapitalisierung liegt bei etwa 241 Mio USD gegenüber Cash und Cashäquivalents von 372,5 Mio USD. Das heißt wiederrum, dass man mit Kauf einer CTX Aktie derzeit eine erhebliche fundamentale Aufwertung der Aktie erhält. Ich wüsste nicht das ich sowas schon mal irgendwo anders gefunden habe. Jedoch heißt das auch, dass der Markt derzeit CTX quasi keine Erfolgsaussichten keiner einzigen Pipeline attestiert. Aus den vorliegenden Studienergebnisse bei CX71 zeichnet sich aber ein anderes Bild. Die aktuellen Einstellungen auf HR Seite und die Stellen die gesucht werden (sofern keine Dummies) zeigen jedoch das CTX in der Phase der Klinikstudien ergebnisorientiert voranschreiten will. Warum bricht der Kurs nur ein? CTX ist sehr schwach was sein Investor Relation angeht. Auch fällt es schwer ein klaren Weg aufzuzeigen wie man die klinischen Erfolge zu kommerziellem Erfolg führen will. Der Status der aktuellen Studien lässt eine Erfolgswahrscheinlichkeit der Pipelines selbst bei bestem medizinischen Fachwissen schwer abschätzen. All das mögen institutionelle Investoren nicht. CTX ist ein langfristig orientiertes Investment mit erheblichem Aufwärtspotential. Demgegenüber steht ein Risiko des Totalausfalls eines kommerziellen Erfolgs aller Studien oder deren Teilergebnisse. Das wiederum ist eher wenig wahrscheinlich. Ich werde meine bestehende Position weiter verbilligen.
(Die Ausführungen stellen keine Kaufempfehlung dar und erheben keinen Anspruch auf Vollständigkeit)
CX 72
Die Ergebnisse der CX72 Phase 1 Studie in Kombination mit Ipilimumab mit 27 Patienten sehen vielversprechend aus. Behandlungsbezogene Nebenwirkungen TRAEs (33%) und immunabwehrbedingte Nebenwirkungen irAE (15%) sind für eine Therapie in massiv vorbehandelten Patienten im gut tolerierten Bereich. Bei einer durchschnittlichen Behandlungsdauer von 14,6 Monaten wurde bei 5 Patienten einen volles Ansprechen auf die Therapie (ORR 19%) und bei 37% (5+5 Patienten) ein teilweises Ansprechen (Stabilisierung) erreicht. Die Phase 2 (Simon 2 Stufen Plan mit 40 Patienten) wurde gestartet. Zieltermin mit ersten Ergebnissen ist 01/2021. Die Patientensuche (300 Teilnehmer!) für die Studie zur Monotherapie mit CX 72 ist abgeschlossen. Grundsätzlich ergibt sich ein positives Bild hinsichtlich eines klinischen Erfolges der Therapien mit CX-72. Der Hauptgrund für den fehlenden Enthusiasmus bei Investoren dürfte sein, dass man sich nach wie vor stark zurück hält, bezüglich einer antizipierten Vorgehensweise und Prognosen Richtung Markteinführung. Außerdem zieht sich die Terminkette immer länger als angekündigt.
CX2009
Schweigen im Walde. Nächste Schritte werden für Ende 2019 angekündigt. Dies wurde bereits auch früher schon so angekündigt und ist wohl auch ein Hauptgrund für den neueren Rückgang des Investorenvertrauens in Q3. Ein Update zur Terminkette, hätte sicher geholfen. Es wird wohl hoffentlich ein Handlungsschwerpunkt der neuen CDO und VP C. Peterson, M.D sein.
BMS-986249 (Kooperation mit Bristol Myers Squibb)
Die Einschränkung der Kooperation mit BMS ausgehend von Seiten BMS war die Hauptursache für einen massiven Einbruch des Aktienwertes in 3/19 größer 20%. Bei der noch bestehenden Kooperation wird eine Dosiseskalation des Anti CTLA-4 Probody Therapeutikum als Monotherapie als auch in Kombination mit Nivolumab durchgeführt mit Ziel der Behandlung von Tumoren im fortgeschrittenen Stadium. Ein sehr vielversprechende Therapie, führt diese zum Erfolg. Weder von Seite BMS noch CTMX gibt es einen Status. Die Dosiseskulation sei abgeschlossen und ist in Auswertung. Die Phase 2 einer klinischen Studie sei in Vorbereitung was eine Meilensteinzahlung von 10 Mio USD von BMS > CTX triggern würde. Das Zieldatum für das Ende der Klinikstudie ist der 30.10.2022.
CX2029
In Kooperation mit AbbVie wird eine Monotherapie Studie zur Behandlung (150 Patienten) durchgeführt. Ziel ist die Behandlung von Tumoren (Hals, Nacken, Lunge, Bauchspeicheldrüse) und einer speziellen Form des Blutkrebs. Es gibt keinen Statusupdate. Das Ende der Klinikstudie soll 12/2020 sein.
Finanzen
Grundlegend muss man bei einem Unternehmen wie CTX das Verhältnis von Operating Expensen zu Cash und Cash Äquivalents bewerten. Da es keine Einnahmen aus Verkauf oder Dergleichen gibt, ist die Haupteinnahme Zahlungen aus Kooperationen, Lizenzeinnahmen usw. Mein Vergleichszeitraum ist das Balancesheet 3 Quartale endend 09/2018 gegen 3Q endend 09/2019. Einen Quartalsvergleich halte ich bei CTX für nicht zielführend. Es ergibt sich ein wenig überraschendes Bild.
Die laufenden Kosten (R&D, GA) sind im vergleichszeitraum um 22%/22 MioUSD gestiegen. Positiv ist anzumerken das dies überwiegend auf der R&D Seite geschah. Für ein R&D Unternehmen erst mal alles plausibel. Die GA Kosten sind dagegen nur moderat durch Personalkosten und Beratungskosten (R&D, IT, Facility) gestiegen. Kosten konnten darüber hinaus bei der Anmietung und Nutzung von Laboren gespart werden (Auch d. Ende CX-188).
Auf der Asset Seite wurde um 18,5% abgebaut hauptsächlich im Cashbestand -83 MioUSD und kurzfristig verkaufbarer Werte (-27 MioUSD). Interessanterweise findet sich eine Position über Lizenz? Einnahmen von +26 MioUSD die die Reduzierung der Cash and Äquivalente kompensiert. Was das ist, kann ich nur spekulieren. Die Anzahl ausgegebener Aktien hat sich nicht geändert. Das ist gut., keine Verwässerung. Die Summe aller Aktiva beläuft sich zum Abschluss 09/19 auf 372,5 Mio USD. Die Zahlen waren zum Zeitpunkt des Calls noch nicht testiert.
Fazit
Unterm Strich finden sich keine Überraschungen in G/V, Passiva oder Aktiva. Negativ gesagt lebt man von früheren Zahlungen. Die Cashburnrate ist nicht unerheblich, werden keine weiteren Einnahmen erzeugt und die Kosten verbleiben auf aktuellem Niveau wäre in 3,7 Jahren Schluss. Es dauert also noch etwas ‚bis die Lichter‘ ausgehen. Positiv anzumerken ist, dass dies nach allen antizipierten Zeiträumen erwarteter Ergebnisse der einzelnen Pipelines liegt. Die aktuelle Marktkapitalisierung liegt bei etwa 241 Mio USD gegenüber Cash und Cashäquivalents von 372,5 Mio USD. Das heißt wiederrum, dass man mit Kauf einer CTX Aktie derzeit eine erhebliche fundamentale Aufwertung der Aktie erhält. Ich wüsste nicht das ich sowas schon mal irgendwo anders gefunden habe. Jedoch heißt das auch, dass der Markt derzeit CTX quasi keine Erfolgsaussichten keiner einzigen Pipeline attestiert. Aus den vorliegenden Studienergebnisse bei CX71 zeichnet sich aber ein anderes Bild. Die aktuellen Einstellungen auf HR Seite und die Stellen die gesucht werden (sofern keine Dummies) zeigen jedoch das CTX in der Phase der Klinikstudien ergebnisorientiert voranschreiten will. Warum bricht der Kurs nur ein? CTX ist sehr schwach was sein Investor Relation angeht. Auch fällt es schwer ein klaren Weg aufzuzeigen wie man die klinischen Erfolge zu kommerziellem Erfolg führen will. Der Status der aktuellen Studien lässt eine Erfolgswahrscheinlichkeit der Pipelines selbst bei bestem medizinischen Fachwissen schwer abschätzen. All das mögen institutionelle Investoren nicht. CTX ist ein langfristig orientiertes Investment mit erheblichem Aufwärtspotential. Demgegenüber steht ein Risiko des Totalausfalls eines kommerziellen Erfolgs aller Studien oder deren Teilergebnisse. Das wiederum ist eher wenig wahrscheinlich. Ich werde meine bestehende Position weiter verbilligen.
(Die Ausführungen stellen keine Kaufempfehlung dar und erheben keinen Anspruch auf Vollständigkeit)
Mal eine Positive Kurseinschätzung von 16 $
CytomX Therapeutics (NASDAQ:CTMX) is up 3.7% after hours following an initiation at Buy by Guggenheim.
The firm set its price target to $16, implying 209% upside from today's close of $5.18.
Sell-side analysts are Bullish on the stock on average, while it has a Quant Rating of Very Bearish.
CytomX Therapeutics (NASDAQ:CTMX) is up 3.7% after hours following an initiation at Buy by Guggenheim.
The firm set its price target to $16, implying 209% upside from today's close of $5.18.
Sell-side analysts are Bullish on the stock on average, while it has a Quant Rating of Very Bearish.
Normalerweise gebe ich nicht viel auf Analystenmeinungen. Aber das ist aus Sicht des Sentiment sehr sehr gut. Guggenheim als 275 Mrd verwaltende Investmentgesellschaft hat Gewicht. Das dürfte auch den 20% Up Spike heute erklären. Ist wird Zeit das Cytom X etwas Analysten Coverage bekommt. Möglich das wir die nächsten Tage eine Erholungsralley sehen. Schön wäre wenn CTX IR mal aufwacht.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 61.976.636 von Jerry_Maguire am 20.11.19 21:39:43
Zumindest die neue Präsentation von gestern in London hat einen Sprung nach vorn gemacht, wie ich finde. Sie ist informativer und geht mehr auf den "path to market" ein, wie ja nun schon oft gefordert. Vielleicht wurden auf der Tonspur auch ein paar interessante Dinge gesagt, das weiß ich allerdings nicht. Schwer zu sagen, ob es gestern allein der Guggenheim-Effekt war oder auch der Londonauftritt gut ankam und seinen Teil dazu beigetragen hat. Auf dem ausgebombten Kursniveau kann natürlich auch allein ein charttechnischer Effekt das ganze befeuert haben.
Zitat von Jerry_Maguire: Schön wäre wenn CTX IR mal aufwacht
Zumindest die neue Präsentation von gestern in London hat einen Sprung nach vorn gemacht, wie ich finde. Sie ist informativer und geht mehr auf den "path to market" ein, wie ja nun schon oft gefordert. Vielleicht wurden auf der Tonspur auch ein paar interessante Dinge gesagt, das weiß ich allerdings nicht. Schwer zu sagen, ob es gestern allein der Guggenheim-Effekt war oder auch der Londonauftritt gut ankam und seinen Teil dazu beigetragen hat. Auf dem ausgebombten Kursniveau kann natürlich auch allein ein charttechnischer Effekt das ganze befeuert haben.
Antwort auf Beitrag Nr.: 61.978.061 von BReal am 21.11.19 07:39:18vom letzten gehe ich auch aus. Allerdings kann so etwas dann auch noch eine Weile weitergehen und man muss sich vom heutigen Tag nicht verunsichern lassen.
Einen ähnlichen ewigen Abwärtstrend hatten wir bis vor kurzem bei Clovis, dann ging es von 3 auf fast 4 Dollar und nach einem kurzen Rückgang sind wir jetzt fast bei 8 - immer wieder 10 und mehr Prozent am Tag. Leider war ich da etwas spät dran, eigentlich hatte ich mit Clovis schon abgeschlossen - aber es ist auch nur ein Hinweis, was so ein ausgebombter Chart für Folgen haben kann....(nicht muss).
Einen ähnlichen ewigen Abwärtstrend hatten wir bis vor kurzem bei Clovis, dann ging es von 3 auf fast 4 Dollar und nach einem kurzen Rückgang sind wir jetzt fast bei 8 - immer wieder 10 und mehr Prozent am Tag. Leider war ich da etwas spät dran, eigentlich hatte ich mit Clovis schon abgeschlossen - aber es ist auch nur ein Hinweis, was so ein ausgebombter Chart für Folgen haben kann....(nicht muss).
Schön wäre wenn CTX IR mal aufwacht
Natürlich, es könnte aber auch in ein fallendes Messer gegriffen werden!
Also einen mentalen Stopp einsetzen.
Wir kommen von der Spitze von 35 US $ !!
In der Hoffnung, Gruss RS😎
Natürlich, es könnte aber auch in ein fallendes Messer gegriffen werden!
Also einen mentalen Stopp einsetzen.
Wir kommen von der Spitze von 35 US $ !!

In der Hoffnung, Gruss RS😎
Kann noch jemand was zu der Wahrscheinlcihkeit der realisierung der einzelnen Entwicklungen eine kurze Einschätzung abgeben. Davon hängt letztenendes die Produktentwicklung ab.
Mein Eindruck nach längerer Beobachtung von CytomX: viel zu früh ist der Eindruck entstanden/wurde der Eindruck geschürt, dass da bald marktreife Produkte sichtbar würden. Die Firma war bis vor ein paar Monaten noch vor allem eine Forschungseinrichtung, die mit der probody Technologie experimentiert hat. Der Blick auf den Markt und die Sicht der Investoren war kaum entwickelt. CytomX stellt die ersten Forschungsergebnisse so dar, dass sie da erst die Technologie grundsätzlich validiert hätten ohne die Wirksamkeit besonders im Auge zu haben. Ich glaube ihnen die Zufriedenheit mit den Ergebnissen.
Eventuell durch den Zugang von Elaine V. Jones hat sich der Focus langsam verändert. Den Abgang der alten Forschungsdirektorin Rachel Humphrey seh ich eher als ein positives Zeichen in Richtung einer Neuausrichtung: von Technologieerforschung zu Produktentwicklung.
Ärgerlich unterirdisch ist die Arbeit der IR Abteilung. Mein Vertrauen wird erschüttert, wenn relevante Meldungen, wie der Teilrückzug von oder der Abgang der Forschungschefin versteckt werden statt aktiv kommuniziert. Dass 2018 vom Führungspersonal viele Aktien verkauft und 2019 erst einmal Aktien gekauft wurden hat mein Vertrauen auch nicht erhöht.
Der Abverkauf unter 6$ kommt mir überzogen vor und könnte in diesem Ausmaß wesentlich auch Portfeuillebereinigungen geschuldet sein.
Auf Twitter hat der User „German Biotech“ (JoschkaSchröder?) darauf hingewiesen, dass die ADA bei probodies problematisch aussehen. Ich bitte Fachkundige das zu beurteilen.
Eventuell durch den Zugang von Elaine V. Jones hat sich der Focus langsam verändert. Den Abgang der alten Forschungsdirektorin Rachel Humphrey seh ich eher als ein positives Zeichen in Richtung einer Neuausrichtung: von Technologieerforschung zu Produktentwicklung.
Ärgerlich unterirdisch ist die Arbeit der IR Abteilung. Mein Vertrauen wird erschüttert, wenn relevante Meldungen, wie der Teilrückzug von oder der Abgang der Forschungschefin versteckt werden statt aktiv kommuniziert. Dass 2018 vom Führungspersonal viele Aktien verkauft und 2019 erst einmal Aktien gekauft wurden hat mein Vertrauen auch nicht erhöht.
Der Abverkauf unter 6$ kommt mir überzogen vor und könnte in diesem Ausmaß wesentlich auch Portfeuillebereinigungen geschuldet sein.
Auf Twitter hat der User „German Biotech“ (JoschkaSchröder?) darauf hingewiesen, dass die ADA bei probodies problematisch aussehen. Ich bitte Fachkundige das zu beurteilen.
Antwort auf Beitrag Nr.: 61.990.343 von 007coolinvestor am 22.11.19 12:23:00siehe JM, 18.11: sehr solide Argumentation, besser kann man es aus der Ferne kaum wissen.
Antwort auf Beitrag Nr.: 61.995.557 von mahu am 22.11.19 21:47:53Sollte heissen: "Mein Vertrauen wird erschüttert, wenn relevante Meldungen, wie der Teilrückzug von BMS oder der Abgang der Forschungschefin versteckt werden statt aktiv kommuniziert."
Ich denke man kann im Allgemeinen sagen, das Cytom X einfach kein professionelles IR hat. Hier wird nichts versteckt, es wird einfach nicht aktiv für bzw. mit dem Investor gearbeitet. Zu Joschka Schröder kann man denken was man will. Meiner Meinung nach hat er hier sicher sehr kurzfristig einen Trend mit geschürt. Sein Verschwinden spricht ja für sich selbst. Seine Analysen habe ich aber sehr gerne gelesen. Fachlich fehlt das etwas, aber sein Link zur fundamentalen Seite war mir immer etwas zu euphorisch.
Im gestrigen Webcast der Jeffrey Piper Health Care Conference hat Sean McCarthy referiert. Im Einzelnen gab es nichts weltbewegend Neues. Zusammenfassend wurde wieder ein sehr positives Bild über die Fortschritte im Speziellen bei CX-072 gezeichnet. Was mir neu war, dass es unter den Teilnehmer der ersten Dosiseskalation einen mit vollständigem Ansprechen (Darmkrebs) auf die Kombinationstherapie mit Ibu gibt. Sehr wenig gab es zur BMS-986249 Pipeline, es scheint als gibt es hier eine Art Informationssperre. Gerade der Fortschritt mit Partner BMS wäre ja interessant.
Ein interessanten Wink gab es, zur neuen CDO Amy C. Pederson wurde gesagt, das Sie und ihr Team sich auf die Auswahl von Wirkstoffen zur neuen Kombinationstherapie konzentrieren wird. Vor allem hoch toxische Wirkstoffe wären interessant für eine Therapie in Kombination mit Maskierung durch CX-072. Das klingt schon sehr danach, das man sich auf die Markteinführung von Kombinationstherapien konzentrieren will.
Gruß
JM
Im gestrigen Webcast der Jeffrey Piper Health Care Conference hat Sean McCarthy referiert. Im Einzelnen gab es nichts weltbewegend Neues. Zusammenfassend wurde wieder ein sehr positives Bild über die Fortschritte im Speziellen bei CX-072 gezeichnet. Was mir neu war, dass es unter den Teilnehmer der ersten Dosiseskalation einen mit vollständigem Ansprechen (Darmkrebs) auf die Kombinationstherapie mit Ibu gibt. Sehr wenig gab es zur BMS-986249 Pipeline, es scheint als gibt es hier eine Art Informationssperre. Gerade der Fortschritt mit Partner BMS wäre ja interessant.
Ein interessanten Wink gab es, zur neuen CDO Amy C. Pederson wurde gesagt, das Sie und ihr Team sich auf die Auswahl von Wirkstoffen zur neuen Kombinationstherapie konzentrieren wird. Vor allem hoch toxische Wirkstoffe wären interessant für eine Therapie in Kombination mit Maskierung durch CX-072. Das klingt schon sehr danach, das man sich auf die Markteinführung von Kombinationstherapien konzentrieren will.
Gruß
JM
Ist und bleibt eine Wette auf die Zukunft. Abgang von J. Schöder schade. Alternativen wo man nachlesen kann? Als Laie?
Im Vorfeld der heutigen Cytomx ESMO Präsentation in Genf durch Beiyao Zheng, VP Biometrics bereits ein deutliches Plus. Man kann damit rechnen das es heute einen deutlich grünen Tagesabschluß gibt. Damit wäre ein Auswärts Trendkanal eröffnet.
Gruß
JM
Gruß
JM
Ein Filing wurde heute veröffentlicht, dass die Wellington Management Company eine der größten Investmemtfonds (939 Mrd USD verwaltetes Vermögen) seit Dezember 2019 mehr als 5% des Aktienumlaufs von CTX besitzt.
Interessant dürfte sein, dass der Fond damit seinen Bestand zum Ende 2019 massiv ausgebaut hat. Leider reagiert der Kurs nicht besonders positiv.
Gruß
JM
Interessant dürfte sein, dass der Fond damit seinen Bestand zum Ende 2019 massiv ausgebaut hat. Leider reagiert der Kurs nicht besonders positiv.
Gruß
JM
And here comes:
Alison L. Hannah, M.D. as Chief Medical Officer
eine Frau mit wirklich beeindruckender Vitae und am wichtigsten für CTMX, Erfahrung in der Markteinführung verschiedener (Pfizer) Anti Krebs Therapien (talazoparib, enzalutamide, defibrotide, carfilzomib, sunitinib, toceranib, irinotecan and filgrastim). Ein klares Signal an die Investoren, auch die Unsicherheit nach dem einigermaßen misterösen Abgang von Rachel Humpfhrey. Die Pressemitteiling ist von Montag den 03.02.2020:
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Eine Reaktion folgt offensichtlich erst heute nach einem aufgreifenden Artikel in der Fierce Biotech:
https://www.fiercebiotech.com/biotech/after-losing-its-cmo-l…
Ein zweistelliges Plus wird wohl zur Eröffnung zu erwarten sein.
Gruß
JM
und
Alison L. Hannah, M.D. as Chief Medical Officer
eine Frau mit wirklich beeindruckender Vitae und am wichtigsten für CTMX, Erfahrung in der Markteinführung verschiedener (Pfizer) Anti Krebs Therapien (talazoparib, enzalutamide, defibrotide, carfilzomib, sunitinib, toceranib, irinotecan and filgrastim). Ein klares Signal an die Investoren, auch die Unsicherheit nach dem einigermaßen misterösen Abgang von Rachel Humpfhrey. Die Pressemitteiling ist von Montag den 03.02.2020:
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Eine Reaktion folgt offensichtlich erst heute nach einem aufgreifenden Artikel in der Fierce Biotech:
https://www.fiercebiotech.com/biotech/after-losing-its-cmo-l…
Ein zweistelliges Plus wird wohl zur Eröffnung zu erwarten sein.
Gruß
JM
und
Blackrock Inc. hat seinen Bestand bei CytomX zum Ende des Jahres 2019 ebenso erhöht und besitzt nun 8,8% des Freefloat. Das ist in sofern ein gutes Zeichen, als Blackrock als sehr konventionell agierender Vermögensverwalter (Überwiegend in DAX30 investiert) gilt. Aufgrund der namhaften institutiinellen Anleger die sich mittlerweile bei CTMX versammelt haben, bin ich wieder sicher das hier doch ein sehr gutes Chance Risikoverhältnis besteht. Ich baue meinen Bestand weiter aus.
Gruß
JM
Gruß
JM
heute geht es aber kräftig runter.....
Seit dem Abgang von Debanjan Ray hat sich offensichtlich die Öffentlichkeitsarbeit bei Cytomx verschlechtert. ... und das bei den vielen neuen Mitarbeitern, welche eigentlich arbeitsteilig vorgehen sollten ...
BMS hat die klinische Testung in Ph.I des anti-CTLA-4 NFProbody bereits offiziell am 13.01. mittels ihrer J.P. Morgan Präsentationsfolien auf Seite 20 https://www.bms.com/investors/events-and-presentations.html vermeldet.
Cytomx sollte darüber zeitnah informiert worden sein, fand es aber nicht nötig, das ebenso zeitnah weiter zu kommunizieren, sondern erst am 24.02. http://ir.cytomx.com/news-releases/news-release-details/bris….
Gleichermaßen hat Immunogen am 14.02. darüber informiert, dass ihr zum Verkauf stehendes Entwicklungsprojekt EpCAM-PDC bereits im Q4-2019 für ca. 7.5 Mio USD upfront zzgl. milestones & royalties an Cytomx verkauft wurde. http://investor.immunogen.com/news-releases/news-release-det…
Auch das war Cytomx keine Meldung wert.
Ich verstehe noch nicht so recht, weshalb Cytomx sich einen großen Wasserkopf zulegt, aber keine Fortschritte kommuniziert, bzw. bei der internen Pipeline (Anti CD71-PDC, Terminverschiebung EGFR-CD3-TCB, ...) scheinbar auch nicht vorankommt.
Evtl. ist man doch auf größere Probleme bzgl. Herstellung, Wirksamkeit und Nebenwirkungen gestoßen (Einkauf Bispezifische CD3-Linker u. Toxintechnologie, mangelnde Erträge beim Hochfahren der Produktion, unzureichende Stabilität in der Zirkulation bei Patienten bei langer Halbwertszeit, ADA´s, ...)?
Andererseits ist man sehr großzügig in der Genehmigung immenser Stückzahlen niedrig bepreister Optionen an das Management, insbesondere an den CEO (0,5 Mio Stk zu 7.13 USD). Solange sich kein Erfolg abzeichnet, sollte auch das Management zurückhaltender agieren.
Just my two cents ...
BMS hat die klinische Testung in Ph.I des anti-CTLA-4 NFProbody bereits offiziell am 13.01. mittels ihrer J.P. Morgan Präsentationsfolien auf Seite 20 https://www.bms.com/investors/events-and-presentations.html vermeldet.
Cytomx sollte darüber zeitnah informiert worden sein, fand es aber nicht nötig, das ebenso zeitnah weiter zu kommunizieren, sondern erst am 24.02. http://ir.cytomx.com/news-releases/news-release-details/bris….
Gleichermaßen hat Immunogen am 14.02. darüber informiert, dass ihr zum Verkauf stehendes Entwicklungsprojekt EpCAM-PDC bereits im Q4-2019 für ca. 7.5 Mio USD upfront zzgl. milestones & royalties an Cytomx verkauft wurde. http://investor.immunogen.com/news-releases/news-release-det…
Auch das war Cytomx keine Meldung wert.
Ich verstehe noch nicht so recht, weshalb Cytomx sich einen großen Wasserkopf zulegt, aber keine Fortschritte kommuniziert, bzw. bei der internen Pipeline (Anti CD71-PDC, Terminverschiebung EGFR-CD3-TCB, ...) scheinbar auch nicht vorankommt.
Evtl. ist man doch auf größere Probleme bzgl. Herstellung, Wirksamkeit und Nebenwirkungen gestoßen (Einkauf Bispezifische CD3-Linker u. Toxintechnologie, mangelnde Erträge beim Hochfahren der Produktion, unzureichende Stabilität in der Zirkulation bei Patienten bei langer Halbwertszeit, ADA´s, ...)?
Andererseits ist man sehr großzügig in der Genehmigung immenser Stückzahlen niedrig bepreister Optionen an das Management, insbesondere an den CEO (0,5 Mio Stk zu 7.13 USD). Solange sich kein Erfolg abzeichnet, sollte auch das Management zurückhaltender agieren.
Just my two cents ...
Ich habe die letzten Wochen den Rutsch genutzt um meine bestehende Position zu verbillligen. Hat trotzdem schön weh getan die letzten Tage. Gestern ein ordentlicher Sprung nach oben. Grund dürfte die angekündigte Partnerschaft mit Astellas Pharma INc. sein.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Mit einer Initialzahlung von 80 Mio USD und weiteren klinischen als auch kommerziellen Meilsteilenzahlung an CTX bis zu 1,6 Mrd USD wird ein eindeutiges Signal zur angestrebten Markteinführung einer Therapie gesetzt. Cytom X übernimmt den Teil der F&E, während Astellas den Teil der Markteinführung und Finanzierung klinischer Studien übernehmen soll. Das Ziel ist die Entwicklung einer T-Zellen Rezeptor ansprechenden bispezifischen TCR-CD3 Antikörpertherapie. Es wird spannend mehr über den Ansatz und die angestrebte Genexpression zu erfahren.
Gruß
JM
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Mit einer Initialzahlung von 80 Mio USD und weiteren klinischen als auch kommerziellen Meilsteilenzahlung an CTX bis zu 1,6 Mrd USD wird ein eindeutiges Signal zur angestrebten Markteinführung einer Therapie gesetzt. Cytom X übernimmt den Teil der F&E, während Astellas den Teil der Markteinführung und Finanzierung klinischer Studien übernehmen soll. Das Ziel ist die Entwicklung einer T-Zellen Rezeptor ansprechenden bispezifischen TCR-CD3 Antikörpertherapie. Es wird spannend mehr über den Ansatz und die angestrebte Genexpression zu erfahren.
Gruß
JM
CTMX.......CytomX Therapeutics, Inc
Der nächste Durchbrauch / Ausbruchversuch aus dem Abwärtstrend, heute + 32, 8 % ???
The Daily Biotech Pulse: Meilenstein-Pharma-Flunks-Spätstudie, CytomX schlägt Krebsmedikamentenkollaboration zu, BARDA-Zuschuss für den COVID-19-Test von GenMark
https://finviz.com/quote.ashx?t=CTMX
CytomX Therapeutics Inc (NASDAQ: CTMX ) und ASTELLAS PHARMA / ADR (OTC: ALPMY ) haben eine strategische Kooperationsvereinbarung für die Forschung und Entwicklung neuartiger bispezifischer Antikörper gegen CD3- und Tumorzelloberflächenantigene zur Behandlung von Krebs unter Verwendung des Probody-Therapeutikums von CytomX bekannt gegeben Technologieplattform sowie ihre proprietären bispezifischen Formate und CD3-Modelle.
Im Rahmen der Vereinbarung wird CytomX für Forschungs- und Entdeckungsaktivitäten bis zur Auswahl klinischer Kandidaten verantwortlich sein, während Astellas die Aktivitäten finanzieren wird. Astellas wird dann die Verantwortung für die präklinische und klinische Entwicklung sowie die Finanzierung übernehmen.
Gruss RS
Der nächste Durchbrauch / Ausbruchversuch aus dem Abwärtstrend, heute + 32, 8 % ???
The Daily Biotech Pulse: Meilenstein-Pharma-Flunks-Spätstudie, CytomX schlägt Krebsmedikamentenkollaboration zu, BARDA-Zuschuss für den COVID-19-Test von GenMark
https://finviz.com/quote.ashx?t=CTMX
CytomX Therapeutics Inc (NASDAQ: CTMX ) und ASTELLAS PHARMA / ADR (OTC: ALPMY ) haben eine strategische Kooperationsvereinbarung für die Forschung und Entwicklung neuartiger bispezifischer Antikörper gegen CD3- und Tumorzelloberflächenantigene zur Behandlung von Krebs unter Verwendung des Probody-Therapeutikums von CytomX bekannt gegeben Technologieplattform sowie ihre proprietären bispezifischen Formate und CD3-Modelle.
Im Rahmen der Vereinbarung wird CytomX für Forschungs- und Entdeckungsaktivitäten bis zur Auswahl klinischer Kandidaten verantwortlich sein, während Astellas die Aktivitäten finanzieren wird. Astellas wird dann die Verantwortung für die präklinische und klinische Entwicklung sowie die Finanzierung übernehmen.
Gruss RS
Erneuter Anstieg im zweistelligen Prozentbereich
Im Spätmarkt konnte die CytomX Aktie gestern einen Anstieg an der NYSE von 18% verzeichnen nachdem im Confcall gestern bekannt gegeben worde, dass eine weitere Meilensteinzahlung über 40 Mio USD seitens AbbVie im Rahmen der CX2029 Pipeline getriggert wurde.Mit den good news wurden die bad news verpackt. Es wurde bekannt gegeben, dass die CX072-002 Kombinationsstudie (NCT03993379) CX-072 mit Yervoy (ipilimumab) gestoppt wird. Als Grund für diese strategische Entscheidung wird eine Neubewertung der kommerziellen und klinischen Landschaft und konkurrierender Entwicklungen angegeben. Ausserdem wurde in Folge der COVID19 Pandemie beschlossen die Patientensuche im Rahmen der laufenden CX2009 Studie zunächst zu pausieren.
Wie zu erwarten werden die eigenen Pipelines gegenüber den partnerschaftlich betriebenen Studien depriorisiert. Fokus liegt neben dem nun schrittweise erfolgten Proof of Konzept auf der Kommerzialisierung von Therapien.
Gruß
JM
Vergessen. Noch der entsprechende press release:
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
Der Zug rollt nun auch ohne wesentliche Nachrichten los. Also bis auf die die nur Insidern bekannt sind. Es scheint als würden die vergangenen Nachrichten zumindest taktisch sehr klug lanciert. Allerdings traue ich das dem CTX IR Team nicht zu, haben sie doch bisher eher desaströse Arbeit geliefert. In diesem steilen Aufwärtstrend könnte der Kurs nun einem inneren Wert der Aktie (Cashbestand, zu erwartenden Zahlungen, Technologie KnowHow) entgegenlaufen, der meiner Einschätzung bei entsprechend angenommener Marktkapitalisierung nach ohne Probleme im Bereich 12-15 € liegen könnte.
Gruß
JM
Gruß
JM
Nach dem heute 7 Abstracts für die ASCO 2020 vom 29.-30.05. veröffentlicht wurden, reagiert der Markt nachbörslich mit einem satten Plus von 25%. Inhaltlich bin ich noch nicht komplett durch, aber man kann ein vollständiges Update zu allen Pipelines erwarten. Damit etabliert sich ein sehr steiler Aufwärtstrend und es dürfte dann spätestens Ende Mai zu weiteren Zukäufen kommen, der wie bereits geschrieben im Bereich 12-15€ ein Zwischenhoch finden könnte.
Hier noch der Pressrelease dazu:
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
Hier noch der Pressrelease dazu:
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Gruß
JM
CytomX Therapeutics Announces First Quarter 2020 Financial Results and Provides Business Update
Thu May 7, 2020 4:10 PM|GlobeNewswire|About: CTMX
GlobeNewswire
SOUTH SAN FRANCISCO, Calif., May 07, 2020 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody® therapeutic technology platform, today reported first quarter 2020 financial results and provides a business update.
“The first quarter of 2020 presented unique challenges as we navigated the early stages of the COVID-19 pandemic, but through a strategic pipeline reprioritization and excellent progress with new and existing research and development partnerships, we entered the second quarter well positioned for the remainder of the year and beyond,” said Sean McCarthy, D.Phil., president, chief executive officer and chairman of CytomX Therapeutics. “Our continued achievements reflect our long-term strategic vision for CytomX and include the progression of multiple wholly-owned and partnered programs into or towards Phase 2 clinical trials alongside a major new collaboration with Astellas that further validates our Probody platform. Our intensified focus on the application of Probody technology to undruggable targets is aimed at making the biggest difference for patients with cancer.”
First Quarter Business Highlights and Recent Developments
COVID 19 Pandemic and Business Continuity
CytomX is committed to ensuring the health, safety and well-being of its clinical study participants, staff at our study sites and our employees. CytomX continues to closely monitor the COVID-19 pandemic situation and is following local, state, and federal guidelines, including, with respect to the conduct of our worldwide clinical trials, emerging Health Authority guidance and IRB/Ethics Committee recommendations.
STRATEGIC REPRIORITIZATION OF WHOLLY OWNED CLINICAL PIPELINE INCREASES FOCUS ON UNDRUGGABLE TARGETS AND FIRST-IN-CLASS DRUG DEVELOPMENT
PROCLAIM-CX-2009-001
CytomX made the decision in March 2020 to temporarily pause new patient enrollment and new site activation in the PROCLAIM-CX-2009-001 study evaluating the CD166-targeting Probody drug conjugate CX-2009. This study includes the Phase 2 expansion study evaluating CX-2009 as monotherapy in patients with hormone receptor (ER, PR) positive, HER2 negative breast cancer. This decision followed the assessment of the evolving COVID-19 pandemic, and the emerging challenges for clinical trial execution within our studies and across the industry. CytomX intends to resume the CX-2009 clinical program as soon as practicable.
PROCLAIM-CX-072-002
CytomX also made the strategic decision in March 2020 to terminate the PROCLAIM-CX-072-002 study evaluating the anti-PD-L1 Probody CX-072 in combination with ipilimumab in melanoma. This follows a re-evaluation of the evolving clinical, competitive, and commercial landscapes in immuno-oncology, taken together with impact of the COVID-19 pandemic.
This strategic decision allows CytomX to focus its resources on its potential first-in-class assets, CX-2009 and CX-2029, to the future evaluation of a combination of CX-072 and CX-2009, and to the generation of additional clinical candidates for advancement to IND filing and clinical trials.
SIGNIFICANT PROGRESS WITHIN NEW AND EXISTING STRATEGIC COLLABORATIONS
Astellas Collaboration – Newly Formed Alliance Expands Research and Development in the Field of T-Cell Engaging Bispecifics
CytomX announced a strategic collaboration with Astellas Pharma Inc. focusing on the discovery, development, and commercialization of novel CD3 targeting T-cell engaging bispecific antibodies for the treatment of cancer. Astellas paid CytomX an upfront cash payment of $80 million, that was received in April, with CytomX eligible to receive future preclinical, clinical, and commercial milestones of over $1.6 billion. CytomX is also eligible to receive tiered royalties on global net sales that range from high-single digits to mid-teens.
AbbVie Collaboration - Phase 2 Expansion Stage Study Advances CX-2029, A First-in-Class Anti-CD71 Probody Drug Conjugate
CytomX announced a $40 million milestone payment, to be received by CytomX from AbbVie in the second quarter, through the achievement of pre-specified criteria for the dose escalation phase of the ongoing Phase 1/2 clinical trial, PROCLAIM-CX-2029. CytomX and AbbVie are finalizing plans for the advancement of CX-2029 to Phase 2 expansion cohorts in select tumor types. Additional information is available at ClinicalTrials.gov using the Identifier NCT003543813.
Bristol Myers Squibb Collaboration - Advancement of ipilimumab Probody into Randomized Phase 2 Study
Bristol Myers Squibb initiated a Phase 2 randomized cohort expansion in its ongoing first-in-human Phase 1/2a trial of the anti-CTLA-4 Probody BMS-986249, a Probody version of the anti-CTLA-4 antibody Yervoy® (ipilimumab), in combination with Opdivo® (nivolumab) in patients with metastatic melanoma. This advancement triggered a milestone payment of $10 million that was received by CytomX in April. Additional information is available at ClinicalTrials.gov using the Identifier NCT03369223.
Amgen Collaboration - Advancement of Lead T-Cell Bispecific Candidate into IND Enabling Studies
CytomX, in partnership with Amgen, has recently advanced CX-904, a lead T-cell engaging bispecific Probody candidate against Epidermal Growth Factor Receptor (EGFR) and CD3, into IND-enabling studies. CytomX is responsible for the IND filing, targeted for late 2021, and for early clinical development
ASCO 2020 PRESENTATIONS TO HIGHLIGHT MULTIPLE PROBODY CLINICAL-STAGE PROGRAMS
CytomX and its partners announced presentations at the American Society of Clinical Oncology’s (ASCO) ASCO20 Virtual Scientific Program
CytomX and its partner AbbVie will present data from Phase 1 dose escalation study of the PROCLAIM-CX-2029 Phase 1/2 study of the anti CD71 Probody CX-2029
Bristol Myers Squibb will present data from the Phase 1 dose escalation study of the Phase 1/2a trial of the anti-CTLA-4 Probody BMS-986249
CytomX will present updated data from the Phase 1 dose escalation and dose ranging studies of the PROCLAIM-CX-2009 Phase 1/2 study of the anti CD166 Probody CX-2009
CytomX will present updated data from the Phase 1 dose escalation study, monotherapy expansion studies and combination with ipilimumab studies of PROCLAIM-CX-072 Phase 1/2 study of the anti PD-L1 Probody CX-072
Executive Appointments
Announced the appointments of Carlos Campoy, as senior vice president and chief financial officer and Alison Hannah, M.D., as senior vice president and chief medical officer.
First Quarter 2020 Financial Results
Cash, cash equivalents and short-term investments totaled $247.9 million as of March 31, 2020, compared to $296.1 million as of December 31, 2019.
Revenue was $49.6 million for the three months ended March 31, 2020, compared to $29.5 million for the three months ended March 31, 2019. The net increase in revenue of $20.1 million was primarily due to an increase in revenue of $26.6 million relating to the partial revenue recognition of the $40 million milestone earned from AbbVie associated with the PROCLAIM-CX-2029 project in the first quarter of 2020, an increase of $10 million relating to the milestone earned from Bristol Myers Squibb associated with the initiation of the Phase 2 randomized cohort expansion in the first quarter of 2020, partially offset by a decrease in revenue of $17.4 million relating to the accelerated recognition of revenue in the first quarter of 2019 due to reprioritization within our alliance with Bristol Myers Squibb.
Research and development expenses increased by $6.4 million during the three months ended March 31, 2020 compared to the corresponding period in 2019. The increase was largely attributed to $9.1 million of sublicense fees paid to the University of California, Santa Barbara associated with the milestones and upfront payments earned in the first quarter of 2020 and a $3.0 million license fee to ImmunoGen associated with the first dosing of a patient in the CX-2009 Phase 2 clinical trial during the first quarter of 2020. These increases were partially offset by a $5.0 million decrease associated with the acquisition of technical know-how related to drug conjugate linker-toxin and CD3-based bispecific technologies during the first quarter of 2019.
General and administrative expenses were essentially flat during the three months ended March 31, 2020 compared to the corresponding period in 2019.
Teleconference Scheduled Today at 5:00 p.m. ET
Conference Call/Webcast Information
CytomX management will host a conference call today at 5:00 p.m. ET. Interested parties may access the live audio webcast of the teleconference through the “Investor & News” section of CytomX's website at http://ir.cytomx.com or by dialing 1-877-809-6037 (U.S. and Canada) or 1-615-247-0221 (International) and using the passcode 6282129. An archive of the webcast will be available on the CytomX website from May 7, 2020, until May 14, 2020.
About CytomX Therapeutics
CytomX is a clinical-stage, oncology-focused biopharmaceutical company with a vision of transforming lives with safer, more effective therapies. We are developing a novel class of investigational antibody therapeutics, based on our Probody® technology platform, for the treatment of cancer.
Probody therapeutics are designed to remain inactive until they are activated by proteases in the tumor microenvironment. As a result, Probody therapeutics are intended to bind selectively to tumors and decrease binding to healthy tissue, to minimize toxicity and potentially create safer, more effective therapies. As leaders in the field, our innovative technology is designed to turn previously undruggable targets into druggable targets and to enable more effective combination therapies. CytomX and its partners, comprised of leading biotechnology and pharmaceutical companies, have developed a robust pipeline of potential first-in-class therapeutic candidates against novel, difficult to drug targets and potential best-in-class immunotherapeutic candidates against clinically validated targets. The CytomX clinical stage pipeline includes first-in-class product candidates against previously undruggable targets, including a CD166-targeting Probody drug conjugate wholly owned by CytomX (CX-2009) and a CD71-targeting Probody drug conjugate partnered with AbbVie (CX-2029). CD166 and CD71 are among cancer targets that are considered to be inaccessible to conventional antibody drug conjugates due to their presence on many healthy tissues. The CytomX clinical stage pipeline also includes cancer immunotherapeutic candidates against validated targets such as the CTLA-4-targeting Probody therapeutics, and BMS-986249 and BMS-986288, partnered with Bristol Myers Squibb. CytomX has strategic drug discovery and development collaborations with AbbVie, Amgen, Astellas and Bristol Myers Squibb. For additional information about CytomX Therapeutics, visit www.cytomx.com and follow us on LinkedIn and Twitter.
CytomX Therapeutics Forward-Looking Statements
This press release includes forward-looking statements. Such forward-looking statements involve known and unknown risks, uncertainties and other important factors that are difficult to predict, may be beyond our control, and may cause the actual results, performance or achievements to be materially different from any future results, performance or achievements expressed or implied in such statements. Accordingly, you should not rely on any of these forward-looking statements, including those relating to the potential benefits, safety and efficacy or progress of CytomX’s or any of its collaborative partners’ product candidates , the potential benefits or applications of CytomX’s Probody platform technology, CytomX’s ability to develop and advance product candidates into and successfully complete clinical trials, including the ongoing and planned clinical trials of CX-2009 and CX-2029, and the expected timing of the announcement of clinical trial data. Risks and uncertainties that contribute to the uncertain nature of the forward-looking statements include: the unproven nature of CytomX’s novel Probody Platform technology; CytomX’s clinical trial product candidates are in the initial stages of clinical development and its other product candidates are currently in preclinical development, and the process by which preclinical and clinical development could potentially lead to an approved product is long and subject to significant risks and uncertainties, including the risk that the COVID-19 worldwide pandemic may continue to negatively impact the business, research and clinical operations of CytomX or its partners, including the development of preclinical drug candidates due to delays in and disruption of research activities, and the development of clinical drug candidates, due to delays in or disruption of clinical trials, including impacts on the enrollment of patients in clinical trials or other clinical trial disruptions; the possibility that the results of early clinical trials may not be predictive of future results; the possibility that CytomX’s clinical trials will not be successful; the possibility that current pre-clinical research may not result in additional product candidates; CytomX’s dependence on the success of CX-2009, CX-2029, BMS-986249 and BMS-986288; CytomX’s reliance on third parties for the manufacture of the company’s product candidates; and possible regulatory developments in the United States and foreign countries. Additional applicable risks and uncertainties include those relating to our preclinical research and development, clinical development, and other risks identified under the heading "Risk Factors" included in CytomX’s Quarterly Report on Form 10-Q filed with the SEC on May 7, 2020. The forward-looking statements contained in this press release are based on information currently available to CytomX and speak only as of the date on which they are made. CytomX does not undertake and specifically disclaims any obligation to update any forward-looking statements, whether as a result of any new information, future events, changed circumstances or otherwise.
PROBODY is a U.S. registered trademark of CytomX Therapeutics.
Yervoy and Opdivo are registered trademarks of Bristol Myers Squibb.
CYTOMX THERAPEUTICS, INC.
CONDENSED STATEMENTS OF OPERATIONS AND COMPREHENSIVE INCOME (LOSS)
(in thousands, except share and per share data)
(unaudited)
Three Months Ended
March 31,
2020 2019
Revenues $ 49,593 $ 29,485
Operating expenses:
Research and development 42,814 36,376
General and administrative 9,572 9,674
Total operating expenses 52,386 46,050
Loss from operations (2,793 ) (16,565 )
Interest income 1,075 2,496
Other income (expense) 12 (61 )
Loss before income taxes (1,706 ) (14,130 )
Benefit from income taxes (13,911 ) (6 )
Net income (loss) $ 12,205 $ (14,124 )
Net income (loss) per share
Basic $ 0.27 $ (0.31 )
Diluted $ 0.26 $ (0.31 )
Shares used to compute net income (loss) per share
Basic 45,723,955 45,122,456
Diluted 47,044,774 45,122,456
Other comprehensive income:
Unrealized gain on short-term investments, net of tax $ 279 $ 155
Impact of adoption of new accounting pronouncement — 11
Comprehensive income (loss) $ 12,484 $ (13,958 )
CYTOMX THERAPEUTICS, INC.
CONDENSED BALANCE SHEETS
(in thousands, except share and per share data)
March 31, December 31,
2020 2019
(unaudited) (1)
Assets
Current assets:
Cash and cash equivalents $ 143,286 $ 188,425
Short-term investments 104,636 107,720
Accounts receivable 130,010 13
Income tax receivable 13,061 —
Prepaid expenses and other current assets 9,073 7,177
Total current assets 400,066 303,335
Property and equipment, net 7,393 7,372
Intangible assets, net 1,276 1,312
Goodwill 949 949
Restricted cash 917 917
Operating lease right-of-use asset 24,682 25,382
Other assets 1,379 2,015
Total assets $ 436,662 $ 341,282
Liabilities and Stockholders' Equity
Current liabilities:
Accounts payable $ 3,782 $ 4,158
Accrued liabilities 28,353 30,051
Deferred revenue, current portion 73,866 51,381
Total current liabilities 106,001 85,590
Deferred revenue, net of current portion 236,789 178,858
Operating lease liabilities - long term 24,105 24,871
Other long-term liabilities — 850
Total liabilities 366,895 290,169
Commitments and contingencies
Stockholders' equity:
Convertible preferred stock, $0.00001 par value; 10,000,000 shares authorized; and no shares issued and outstanding at March 31, 2020 and December 31, 2019. — —
Common stock, $0.00001 par value; 75,000,000 shares authorized; 45,918,616 and 45,523,088 shares issued and outstanding at March 31, 2020 and December 31, 2019, respectively
1 1
Additional paid-in capital 474,455 468,285
Accumulated other comprehensive income 336 57
Accumulated deficit (405,025 ) (417,230 )
Total stockholders' equity 69,767 51,113
Total liabilities and stockholders' equity $ 436,662 $ 341,282
(1) The condensed balance sheet as of December 31, 2019 was derived from the audited financial statements included in the Company's Annual Report on Form 10-K for the year ended December 31, 2019.
Investor and Media Contact:
Christopher Keenan
VP, Investor Relations and Corporate Communications
ckeenan@cytomx.com
650-383-0823
https://ml.globenewswire.com/media/c252869d-a4c1-4e56-88e8-d…
Source: CytomX Therapeutics Inc. 2020 GlobeNewswire, Inc.
Thu May 7, 2020 4:10 PM|GlobeNewswire|About: CTMX
GlobeNewswire
SOUTH SAN FRANCISCO, Calif., May 07, 2020 (GLOBE NEWSWIRE) -- CytomX Therapeutics, Inc. (CTMX), a clinical-stage oncology-focused biopharmaceutical company pioneering a novel class of investigational antibody therapeutics based on its Probody® therapeutic technology platform, today reported first quarter 2020 financial results and provides a business update.
“The first quarter of 2020 presented unique challenges as we navigated the early stages of the COVID-19 pandemic, but through a strategic pipeline reprioritization and excellent progress with new and existing research and development partnerships, we entered the second quarter well positioned for the remainder of the year and beyond,” said Sean McCarthy, D.Phil., president, chief executive officer and chairman of CytomX Therapeutics. “Our continued achievements reflect our long-term strategic vision for CytomX and include the progression of multiple wholly-owned and partnered programs into or towards Phase 2 clinical trials alongside a major new collaboration with Astellas that further validates our Probody platform. Our intensified focus on the application of Probody technology to undruggable targets is aimed at making the biggest difference for patients with cancer.”
First Quarter Business Highlights and Recent Developments
COVID 19 Pandemic and Business Continuity
CytomX is committed to ensuring the health, safety and well-being of its clinical study participants, staff at our study sites and our employees. CytomX continues to closely monitor the COVID-19 pandemic situation and is following local, state, and federal guidelines, including, with respect to the conduct of our worldwide clinical trials, emerging Health Authority guidance and IRB/Ethics Committee recommendations.
STRATEGIC REPRIORITIZATION OF WHOLLY OWNED CLINICAL PIPELINE INCREASES FOCUS ON UNDRUGGABLE TARGETS AND FIRST-IN-CLASS DRUG DEVELOPMENT
PROCLAIM-CX-2009-001
CytomX made the decision in March 2020 to temporarily pause new patient enrollment and new site activation in the PROCLAIM-CX-2009-001 study evaluating the CD166-targeting Probody drug conjugate CX-2009. This study includes the Phase 2 expansion study evaluating CX-2009 as monotherapy in patients with hormone receptor (ER, PR) positive, HER2 negative breast cancer. This decision followed the assessment of the evolving COVID-19 pandemic, and the emerging challenges for clinical trial execution within our studies and across the industry. CytomX intends to resume the CX-2009 clinical program as soon as practicable.
PROCLAIM-CX-072-002
CytomX also made the strategic decision in March 2020 to terminate the PROCLAIM-CX-072-002 study evaluating the anti-PD-L1 Probody CX-072 in combination with ipilimumab in melanoma. This follows a re-evaluation of the evolving clinical, competitive, and commercial landscapes in immuno-oncology, taken together with impact of the COVID-19 pandemic.
This strategic decision allows CytomX to focus its resources on its potential first-in-class assets, CX-2009 and CX-2029, to the future evaluation of a combination of CX-072 and CX-2009, and to the generation of additional clinical candidates for advancement to IND filing and clinical trials.
SIGNIFICANT PROGRESS WITHIN NEW AND EXISTING STRATEGIC COLLABORATIONS
Astellas Collaboration – Newly Formed Alliance Expands Research and Development in the Field of T-Cell Engaging Bispecifics
CytomX announced a strategic collaboration with Astellas Pharma Inc. focusing on the discovery, development, and commercialization of novel CD3 targeting T-cell engaging bispecific antibodies for the treatment of cancer. Astellas paid CytomX an upfront cash payment of $80 million, that was received in April, with CytomX eligible to receive future preclinical, clinical, and commercial milestones of over $1.6 billion. CytomX is also eligible to receive tiered royalties on global net sales that range from high-single digits to mid-teens.
AbbVie Collaboration - Phase 2 Expansion Stage Study Advances CX-2029, A First-in-Class Anti-CD71 Probody Drug Conjugate
CytomX announced a $40 million milestone payment, to be received by CytomX from AbbVie in the second quarter, through the achievement of pre-specified criteria for the dose escalation phase of the ongoing Phase 1/2 clinical trial, PROCLAIM-CX-2029. CytomX and AbbVie are finalizing plans for the advancement of CX-2029 to Phase 2 expansion cohorts in select tumor types. Additional information is available at ClinicalTrials.gov using the Identifier NCT003543813.
Bristol Myers Squibb Collaboration - Advancement of ipilimumab Probody into Randomized Phase 2 Study
Bristol Myers Squibb initiated a Phase 2 randomized cohort expansion in its ongoing first-in-human Phase 1/2a trial of the anti-CTLA-4 Probody BMS-986249, a Probody version of the anti-CTLA-4 antibody Yervoy® (ipilimumab), in combination with Opdivo® (nivolumab) in patients with metastatic melanoma. This advancement triggered a milestone payment of $10 million that was received by CytomX in April. Additional information is available at ClinicalTrials.gov using the Identifier NCT03369223.
Amgen Collaboration - Advancement of Lead T-Cell Bispecific Candidate into IND Enabling Studies
CytomX, in partnership with Amgen, has recently advanced CX-904, a lead T-cell engaging bispecific Probody candidate against Epidermal Growth Factor Receptor (EGFR) and CD3, into IND-enabling studies. CytomX is responsible for the IND filing, targeted for late 2021, and for early clinical development
ASCO 2020 PRESENTATIONS TO HIGHLIGHT MULTIPLE PROBODY CLINICAL-STAGE PROGRAMS
CytomX and its partners announced presentations at the American Society of Clinical Oncology’s (ASCO) ASCO20 Virtual Scientific Program
CytomX and its partner AbbVie will present data from Phase 1 dose escalation study of the PROCLAIM-CX-2029 Phase 1/2 study of the anti CD71 Probody CX-2029
Bristol Myers Squibb will present data from the Phase 1 dose escalation study of the Phase 1/2a trial of the anti-CTLA-4 Probody BMS-986249
CytomX will present updated data from the Phase 1 dose escalation and dose ranging studies of the PROCLAIM-CX-2009 Phase 1/2 study of the anti CD166 Probody CX-2009
CytomX will present updated data from the Phase 1 dose escalation study, monotherapy expansion studies and combination with ipilimumab studies of PROCLAIM-CX-072 Phase 1/2 study of the anti PD-L1 Probody CX-072
Executive Appointments
Announced the appointments of Carlos Campoy, as senior vice president and chief financial officer and Alison Hannah, M.D., as senior vice president and chief medical officer.
First Quarter 2020 Financial Results
Cash, cash equivalents and short-term investments totaled $247.9 million as of March 31, 2020, compared to $296.1 million as of December 31, 2019.
Revenue was $49.6 million for the three months ended March 31, 2020, compared to $29.5 million for the three months ended March 31, 2019. The net increase in revenue of $20.1 million was primarily due to an increase in revenue of $26.6 million relating to the partial revenue recognition of the $40 million milestone earned from AbbVie associated with the PROCLAIM-CX-2029 project in the first quarter of 2020, an increase of $10 million relating to the milestone earned from Bristol Myers Squibb associated with the initiation of the Phase 2 randomized cohort expansion in the first quarter of 2020, partially offset by a decrease in revenue of $17.4 million relating to the accelerated recognition of revenue in the first quarter of 2019 due to reprioritization within our alliance with Bristol Myers Squibb.
Research and development expenses increased by $6.4 million during the three months ended March 31, 2020 compared to the corresponding period in 2019. The increase was largely attributed to $9.1 million of sublicense fees paid to the University of California, Santa Barbara associated with the milestones and upfront payments earned in the first quarter of 2020 and a $3.0 million license fee to ImmunoGen associated with the first dosing of a patient in the CX-2009 Phase 2 clinical trial during the first quarter of 2020. These increases were partially offset by a $5.0 million decrease associated with the acquisition of technical know-how related to drug conjugate linker-toxin and CD3-based bispecific technologies during the first quarter of 2019.
General and administrative expenses were essentially flat during the three months ended March 31, 2020 compared to the corresponding period in 2019.
Teleconference Scheduled Today at 5:00 p.m. ET
Conference Call/Webcast Information
CytomX management will host a conference call today at 5:00 p.m. ET. Interested parties may access the live audio webcast of the teleconference through the “Investor & News” section of CytomX's website at http://ir.cytomx.com or by dialing 1-877-809-6037 (U.S. and Canada) or 1-615-247-0221 (International) and using the passcode 6282129. An archive of the webcast will be available on the CytomX website from May 7, 2020, until May 14, 2020.
About CytomX Therapeutics
CytomX is a clinical-stage, oncology-focused biopharmaceutical company with a vision of transforming lives with safer, more effective therapies. We are developing a novel class of investigational antibody therapeutics, based on our Probody® technology platform, for the treatment of cancer.
Probody therapeutics are designed to remain inactive until they are activated by proteases in the tumor microenvironment. As a result, Probody therapeutics are intended to bind selectively to tumors and decrease binding to healthy tissue, to minimize toxicity and potentially create safer, more effective therapies. As leaders in the field, our innovative technology is designed to turn previously undruggable targets into druggable targets and to enable more effective combination therapies. CytomX and its partners, comprised of leading biotechnology and pharmaceutical companies, have developed a robust pipeline of potential first-in-class therapeutic candidates against novel, difficult to drug targets and potential best-in-class immunotherapeutic candidates against clinically validated targets. The CytomX clinical stage pipeline includes first-in-class product candidates against previously undruggable targets, including a CD166-targeting Probody drug conjugate wholly owned by CytomX (CX-2009) and a CD71-targeting Probody drug conjugate partnered with AbbVie (CX-2029). CD166 and CD71 are among cancer targets that are considered to be inaccessible to conventional antibody drug conjugates due to their presence on many healthy tissues. The CytomX clinical stage pipeline also includes cancer immunotherapeutic candidates against validated targets such as the CTLA-4-targeting Probody therapeutics, and BMS-986249 and BMS-986288, partnered with Bristol Myers Squibb. CytomX has strategic drug discovery and development collaborations with AbbVie, Amgen, Astellas and Bristol Myers Squibb. For additional information about CytomX Therapeutics, visit www.cytomx.com and follow us on LinkedIn and Twitter.
CytomX Therapeutics Forward-Looking Statements
This press release includes forward-looking statements. Such forward-looking statements involve known and unknown risks, uncertainties and other important factors that are difficult to predict, may be beyond our control, and may cause the actual results, performance or achievements to be materially different from any future results, performance or achievements expressed or implied in such statements. Accordingly, you should not rely on any of these forward-looking statements, including those relating to the potential benefits, safety and efficacy or progress of CytomX’s or any of its collaborative partners’ product candidates , the potential benefits or applications of CytomX’s Probody platform technology, CytomX’s ability to develop and advance product candidates into and successfully complete clinical trials, including the ongoing and planned clinical trials of CX-2009 and CX-2029, and the expected timing of the announcement of clinical trial data. Risks and uncertainties that contribute to the uncertain nature of the forward-looking statements include: the unproven nature of CytomX’s novel Probody Platform technology; CytomX’s clinical trial product candidates are in the initial stages of clinical development and its other product candidates are currently in preclinical development, and the process by which preclinical and clinical development could potentially lead to an approved product is long and subject to significant risks and uncertainties, including the risk that the COVID-19 worldwide pandemic may continue to negatively impact the business, research and clinical operations of CytomX or its partners, including the development of preclinical drug candidates due to delays in and disruption of research activities, and the development of clinical drug candidates, due to delays in or disruption of clinical trials, including impacts on the enrollment of patients in clinical trials or other clinical trial disruptions; the possibility that the results of early clinical trials may not be predictive of future results; the possibility that CytomX’s clinical trials will not be successful; the possibility that current pre-clinical research may not result in additional product candidates; CytomX’s dependence on the success of CX-2009, CX-2029, BMS-986249 and BMS-986288; CytomX’s reliance on third parties for the manufacture of the company’s product candidates; and possible regulatory developments in the United States and foreign countries. Additional applicable risks and uncertainties include those relating to our preclinical research and development, clinical development, and other risks identified under the heading "Risk Factors" included in CytomX’s Quarterly Report on Form 10-Q filed with the SEC on May 7, 2020. The forward-looking statements contained in this press release are based on information currently available to CytomX and speak only as of the date on which they are made. CytomX does not undertake and specifically disclaims any obligation to update any forward-looking statements, whether as a result of any new information, future events, changed circumstances or otherwise.
PROBODY is a U.S. registered trademark of CytomX Therapeutics.
Yervoy and Opdivo are registered trademarks of Bristol Myers Squibb.
CYTOMX THERAPEUTICS, INC.
CONDENSED STATEMENTS OF OPERATIONS AND COMPREHENSIVE INCOME (LOSS)
(in thousands, except share and per share data)
(unaudited)
Three Months Ended
March 31,
2020 2019
Revenues $ 49,593 $ 29,485
Operating expenses:
Research and development 42,814 36,376
General and administrative 9,572 9,674
Total operating expenses 52,386 46,050
Loss from operations (2,793 ) (16,565 )
Interest income 1,075 2,496
Other income (expense) 12 (61 )
Loss before income taxes (1,706 ) (14,130 )
Benefit from income taxes (13,911 ) (6 )
Net income (loss) $ 12,205 $ (14,124 )
Net income (loss) per share
Basic $ 0.27 $ (0.31 )
Diluted $ 0.26 $ (0.31 )
Shares used to compute net income (loss) per share
Basic 45,723,955 45,122,456
Diluted 47,044,774 45,122,456
Other comprehensive income:
Unrealized gain on short-term investments, net of tax $ 279 $ 155
Impact of adoption of new accounting pronouncement — 11
Comprehensive income (loss) $ 12,484 $ (13,958 )
CYTOMX THERAPEUTICS, INC.
CONDENSED BALANCE SHEETS
(in thousands, except share and per share data)
March 31, December 31,
2020 2019
(unaudited) (1)
Assets
Current assets:
Cash and cash equivalents $ 143,286 $ 188,425
Short-term investments 104,636 107,720
Accounts receivable 130,010 13
Income tax receivable 13,061 —
Prepaid expenses and other current assets 9,073 7,177
Total current assets 400,066 303,335
Property and equipment, net 7,393 7,372
Intangible assets, net 1,276 1,312
Goodwill 949 949
Restricted cash 917 917
Operating lease right-of-use asset 24,682 25,382
Other assets 1,379 2,015
Total assets $ 436,662 $ 341,282
Liabilities and Stockholders' Equity
Current liabilities:
Accounts payable $ 3,782 $ 4,158
Accrued liabilities 28,353 30,051
Deferred revenue, current portion 73,866 51,381
Total current liabilities 106,001 85,590
Deferred revenue, net of current portion 236,789 178,858
Operating lease liabilities - long term 24,105 24,871
Other long-term liabilities — 850
Total liabilities 366,895 290,169
Commitments and contingencies
Stockholders' equity:
Convertible preferred stock, $0.00001 par value; 10,000,000 shares authorized; and no shares issued and outstanding at March 31, 2020 and December 31, 2019. — —
Common stock, $0.00001 par value; 75,000,000 shares authorized; 45,918,616 and 45,523,088 shares issued and outstanding at March 31, 2020 and December 31, 2019, respectively
1 1
Additional paid-in capital 474,455 468,285
Accumulated other comprehensive income 336 57
Accumulated deficit (405,025 ) (417,230 )
Total stockholders' equity 69,767 51,113
Total liabilities and stockholders' equity $ 436,662 $ 341,282
(1) The condensed balance sheet as of December 31, 2019 was derived from the audited financial statements included in the Company's Annual Report on Form 10-K for the year ended December 31, 2019.
Investor and Media Contact:
Christopher Keenan
VP, Investor Relations and Corporate Communications
ckeenan@cytomx.com
650-383-0823
https://ml.globenewswire.com/media/c252869d-a4c1-4e56-88e8-d…
Source: CytomX Therapeutics Inc. 2020 GlobeNewswire, Inc.
CytomX EPS of $0.26
May 7, 2020 4:23 PM ET|About: CytomX Therapeutics, Inc. (CTMX)|By: Pranav Ghumatkar, SA News Editor
CytomX (NASDAQ:CTMX): Q1 EPS of $0.26 may not be comparable to consensus of -$0.40.
Revenue of $49.59M (+68.2% Y/Y) beats by $28.61M.
May 7, 2020 4:23 PM ET|About: CytomX Therapeutics, Inc. (CTMX)|By: Pranav Ghumatkar, SA News Editor
CytomX (NASDAQ:CTMX): Q1 EPS of $0.26 may not be comparable to consensus of -$0.40.
Revenue of $49.59M (+68.2% Y/Y) beats by $28.61M.
Bin mittlerweile, wie wahrscheinlich so manch anderer, wieder deutlich im plus. stehe an der seitenlinie und freue mich, dass es so stark nach oben geht.
bin fachlich ein laie, hab aber durch mitlesen seit vielen jahren invests in biotec aktien, fast immer zum finaziellen vorteil gehalten (evote und vor allem morphosys sehr lange)
alles gute den anderen investierten, bleibt gesund.
bin fachlich ein laie, hab aber durch mitlesen seit vielen jahren invests in biotec aktien, fast immer zum finaziellen vorteil gehalten (evote und vor allem morphosys sehr lange)
alles gute den anderen investierten, bleibt gesund.
Antwort auf Beitrag Nr.: 63.508.451 von Jerry_Maguire am 29.04.20 23:26:50ich muss mich wirklich mal bei Dir (vor allem aber nicht allein) bedanken. Ich hatte zeitweise massive Zweifel an diesem (kleinen) Investment und bin bei solchen Werten, die ich eher als eine Art "Los" ansehe, auch immer bereit, diese raus zu werfen.
Aber zu Cytomex bin ich durch Euch immer so gut informiert gewesen, dass ich dran geblieben bin und das hat sich inzwischen wirklich gelohnt.
Eine ganze Weile stand die Aktie ungefähr gleich zu clovis - zum Glück habe ich nicht getauscht.
Aber zu Cytomex bin ich durch Euch immer so gut informiert gewesen, dass ich dran geblieben bin und das hat sich inzwischen wirklich gelohnt.
Eine ganze Weile stand die Aktie ungefähr gleich zu clovis - zum Glück habe ich nicht getauscht.
Antwort auf Beitrag Nr.: 63.617.562 von xylophon am 09.05.20 12:31:29
Der Markt reagiert am Freitag in der Spätbörse nochmal massiv positiv auf den Quartalsbericht. Obwohl viel Neues ist wirklich mMn gar nicht dabei. Zusammengefasst ist der Cashbestand gesunken, OPEX sind leicht gestiegen, der Umsatz auch im Wesentlichen durch die AbbVie Meilensteinzahlung. Es wird ein positiver Ausblick auf Updates zu allen partnerschaftlichen Pipelines gegeben. Ich vermisse noch die ASCO abstracts.
Es könnte noch bis nach der ASCO 2020 bei der kleinen Rallye bleiben. CytomX dürfte für 2020 eine interessante Position sein.
Gruß
JM
Starkes Momentum bei CutomX
Ja eine sehr erfreuliche Entwicklung. Durch die Verbilligung meiner Position bin ich überdurchschnittlich investiert und kann auch entsprechend stark davon profitierten. Es wird nun spannend in welchem Bereich sich das Zwischenhoch ausbildet. Auch durch den sinkenden EUR-USD Kurs könnte es sich eher im oberen von mir angestrebten Bereich bei 15 EUR befinden. Ab hier werde ich meine Position hedgen. Das sich das Momentum so stark ausprägt ist gut, in den vergangenen Tagen wurden große Aktienpakete gekauft. Vielleicht steckt mehr dahinter. Hier könnte man viel spekulierenDer Markt reagiert am Freitag in der Spätbörse nochmal massiv positiv auf den Quartalsbericht. Obwohl viel Neues ist wirklich mMn gar nicht dabei. Zusammengefasst ist der Cashbestand gesunken, OPEX sind leicht gestiegen, der Umsatz auch im Wesentlichen durch die AbbVie Meilensteinzahlung. Es wird ein positiver Ausblick auf Updates zu allen partnerschaftlichen Pipelines gegeben. Ich vermisse noch die ASCO abstracts.
Es könnte noch bis nach der ASCO 2020 bei der kleinen Rallye bleiben. CytomX dürfte für 2020 eine interessante Position sein.
Gruß
JM
Was war das denn gestern für ein Desaster bei der ASCO? Da scheint ja einiges an Porzellan zerschlagen worden zu sein. Was sind denn die genauen Gründe für den -30% Absturz?
Antwort auf Beitrag Nr.: 63.673.435 von Yamu am 14.05.20 09:12:06Die ASCO findet vom 29.05.-01.06.2020 statt. Gestern wurden die Abstracts detaillierter veröffentlicht (~5 pm ET, d.h. 23:00 Uhr CET). Der Absturz erfolgte nachbörslich. Da schaut man als Europäer natürlich mit seinem SL in die Röhre. Offensichtlich haben die Abstracts inhaltlich die Erwartungen einiger institutioneller Anleger nicht erfüllt?
Hier der Link zu den Abstracts:
https://meetinglibrary.asco.org/browse-meetings/2020%20ASCO%…
Denkbar ist das hier auf eine Erneuerung/Erweiterung der Kooperation mit BMS spekuliert wurde. Da bleibt nur abwarten und die Abstracts genauer scannen.
Gruß
JM
Hier der Link zu den Abstracts:
https://meetinglibrary.asco.org/browse-meetings/2020%20ASCO%…
Denkbar ist das hier auf eine Erneuerung/Erweiterung der Kooperation mit BMS spekuliert wurde. Da bleibt nur abwarten und die Abstracts genauer scannen.
Gruß
JM
Antwort auf Beitrag Nr.: 63.674.281 von Jerry_Maguire am 14.05.20 09:53:07Danke dir. Ich habe bis jetzt nur ein paar Kommentare zu den Abstracts auf Twitter gefunden, die allerdings ganz schön ernüchternd sind. Ich denke es liegt an den Ergebnissen und nicht an der Kooperation mit BMS.
Mir fehlt bei dieser Aktie allerdings die Zeit, mich inhaltlich damit näher zu beschäftigen, so wie ich das bei anderen tue. Ich habe 2016 eine kleinere Position gekauft, als Joschka sie hier vorgestellt hat. Mittlerweile hatte ich sie fast schon als Totalverlst verbucht und war ganz erstaunt wie sie in den letzten Wochen zurückgekommen ist. Und jetzt aber leider das...
Aber wie dem auch sei, das Ding bleibt einfach bei mir im Depot liegen, vielleicht kommt sie ja noch mal ordentlich zurück.
Mir fehlt bei dieser Aktie allerdings die Zeit, mich inhaltlich damit näher zu beschäftigen, so wie ich das bei anderen tue. Ich habe 2016 eine kleinere Position gekauft, als Joschka sie hier vorgestellt hat. Mittlerweile hatte ich sie fast schon als Totalverlst verbucht und war ganz erstaunt wie sie in den letzten Wochen zurückgekommen ist. Und jetzt aber leider das...
Aber wie dem auch sei, das Ding bleibt einfach bei mir im Depot liegen, vielleicht kommt sie ja noch mal ordentlich zurück.
Antwort auf Beitrag Nr.: 63.675.961 von Yamu am 14.05.20 11:19:59Ging mir genauso. Ich schmeisse sie heute raus
habe ich eben auch gemacht, zumal auch andere Aktien gefallen sind, denen ich längerfristig mehr zutraue bzw. ich mich sicherer fühle.
Kleiner Gewinn ist trotzdem übrig geblieben.....wenn sich die Lage beruhigt hat, würde ich ggf. zurückkaufen.
Kleiner Gewinn ist trotzdem übrig geblieben.....wenn sich die Lage beruhigt hat, würde ich ggf. zurückkaufen.
Also nach dem ich die Abstracts gelesen und etwas recherchiert habe, komme ich zu 4 Aussagen:
1. Der Datenschnitt der Abstracts ist 5 Monate vor dem Datenschnitt der zu erwartenden ASCO Präsentation. D.h. es fehlen 5 Monate Studien. Warum Abstracts so eingereicht werden ist mir nicht klar.
2. Die Ergebnisse der Phase 2 Studie mit CX-072 in Patienten mit festem Tumor zeigt eine Ansprechrate von 8,8% (n=10/114) all partials. 37 Patienten 41,2% (n=47/114) zeigen eine Stagnieren des Tumorwachstum. Bei der Kombitherapie von CX-072 mit Bristol Myers Squibb's Ibilimuab, ist die Ansprechrate höher bei 18.5% (n=5/27), eine Tumorstopp konnte bei 10 Patienten beobachtet werden.37% (n=10/27)
3. In der Phase 1/2 Studie (Dosiseskalation) von CX-2009 konnte ab 4 mg/kg 3x/Woche ein Ansprechen registriert werden.
Ab 8 mg/kg 3x/Woche wurden kritische TRAE beobachtet, ein kleines Dosisfenster also.
1. Der Datenschnitt der Abstracts ist 5 Monate vor dem Datenschnitt der zu erwartenden ASCO Präsentation. D.h. es fehlen 5 Monate Studien. Warum Abstracts so eingereicht werden ist mir nicht klar.
2. Die Ergebnisse der Phase 2 Studie mit CX-072 in Patienten mit festem Tumor zeigt eine Ansprechrate von 8,8% (n=10/114) all partials. 37 Patienten 41,2% (n=47/114) zeigen eine Stagnieren des Tumorwachstum. Bei der Kombitherapie von CX-072 mit Bristol Myers Squibb's Ibilimuab, ist die Ansprechrate höher bei 18.5% (n=5/27), eine Tumorstopp konnte bei 10 Patienten beobachtet werden.37% (n=10/27)
3. In der Phase 1/2 Studie (Dosiseskalation) von CX-2009 konnte ab 4 mg/kg 3x/Woche ein Ansprechen registriert werden.
Ab 8 mg/kg 3x/Woche wurden kritische TRAE beobachtet, ein kleines Dosisfenster also.
4. In der Phase 1/2 Studie zu CX2029 (Dosiseskalation, 34 Pat), 0,1-0,98 mg/kg/Woche wurden bei 88% Infusionsbedingte Nebenwirkung festgestellt bei weniger als 10% schwere TRAE Grade 3+ festgestellt.
Was sagt das nun? Ich meine die Ergebnisse sind nicht überwältigend. Vor allem die CX72 bzw. Kombinationstherapie erscheinen enttäuschend. Jedoch es fehlen 5 Monate. Es wird sehr spannend was zur ASCO an zusätzlichen Daten aus den 5 Monaten präsentiert wird.
Man könnte sich verabschieden, es ist sehr spekulativ. Ich werde meine Position ausbauen, da ich mit einem starken Rebound rechne, weil ich von weiteren positiven Studienergebnissen ausgehe.
Gruß
JM
Was sagt das nun? Ich meine die Ergebnisse sind nicht überwältigend. Vor allem die CX72 bzw. Kombinationstherapie erscheinen enttäuschend. Jedoch es fehlen 5 Monate. Es wird sehr spannend was zur ASCO an zusätzlichen Daten aus den 5 Monaten präsentiert wird.
Man könnte sich verabschieden, es ist sehr spekulativ. Ich werde meine Position ausbauen, da ich mit einem starken Rebound rechne, weil ich von weiteren positiven Studienergebnissen ausgehe.
Gruß
JM
Antwort auf Beitrag Nr.: 63.685.099 von Jerry_Maguire am 14.05.20 20:18:15ich werde die Aktie auch weiter beobachten und gebe viel auf Deine Expertise.....aber in solchen heftigen Situationen bin ich lieber erst mal draußen.
Am 12.05.20 hat Sean McCarthy seine Aktienbestand um 36000 Aktien zu einem Kurs von 15USD reduziert. Er hält weiterhin 84306 Aktien. Ein automatisierter Verkauf ist es wohl nicht.
Sieht man es positiv: Er hat nur etwa 1/3 seines Bestand abgegeben und rechnet eigentlich mit höheren Kursen.
Sieht man es negativ: Er glaubt nich an langfristigen Forschungserfolg und die Partnerschaften vin CytomX.
Gruß
JM
Sieht man es positiv: Er hat nur etwa 1/3 seines Bestand abgegeben und rechnet eigentlich mit höheren Kursen.
Sieht man es negativ: Er glaubt nich an langfristigen Forschungserfolg und die Partnerschaften vin CytomX.
Gruß
JM
Im Webcast der Bank of America ging Sean McCarthy etwas auf die zu erwartenden Daten ein. Hier Link zu Präsentation und Webcast:
http://ir.cytomx.com/static-files/e57a22b4-04cf-4f54-a7bc-c7…
https://www.veracast.com/webcasts/bofa/healthcare2020/id2448…
Eine kurze Zusammenfassung mit Fokus auf das was auf der ASCO zusätzlich zum Abstractinhalt präsentiert wird.
CX2029 (Kooperation mit Abbvie)
Asco update:
- Datenschnitt 04/2020
- therapeutische Dosis kann erreicht werden
- zusätzliche Patientendaten mit höher Dosierung als 0,1 mg/kg (vermutlich bis 0,9 mg/kg)
- Beschreibung der getesteten Dosislevel und Gruppen
- Interpretation des Dosisansprechen und Ausblick wie eine Phase 2 Studie aussehen kann
BMS-986249 Kombo mit Nivolumab/Nivolumab +/- Ipilimumab (Kooperation mit Bristool Meyer)
- höhere Dosen mit Probody in Kombination Nivolumab/Nivolumab +/- Ipilimumab z.Bsp 20mg/kg in Kombi
- sehr gutes Sicherheitsprofil bei nur 9% der Patienten Grade 3/4 TRAE (Behandlungsbezogene Wechselwirkungen)
- in der Kombi mit dem CTL4 Probody höherer Dosierungen möglich
CX-072
Asco update:
- Datenschnitt 04/2020 aus 50 Patienten speziell Update zu Langzeitdaten multiple Tumortypen aus Phase 2
Die Ergebnisse mit Probody BMS-986249 sehen sehr vielversprechend aus. Zu CX2029 kann man noch auf die zusätzlichen Daten hoffen, zieht man in Betracht das CD177 bisher nicht therapeutisch angesprochen werden kann, ist auch dies ein Erfolg. Hier kann man von einem Proof of Concept PROCLAIM sprechen. Die von der Investgemeinde bemängelten Erfolge beziehen sich wohl hauptsächlich auf CX072. Entsprechend sind jedoch die angestrebten Entwicklungen:
CX-904 Kooperation mit Amgen
- Wandlung immunonkologisch 'kalter Tumore' (fortgeschritten, wuchernd, nicht therapierbar) in 'heiße Tumore' (Öffnung für therapierbarkeit)
- Entwicklung eines bispezifischen Probody zum Ansprechen EGFR (Transmembranrezeptor, ansprechen gegen unkontrolliertes Zellwachstum) and CD3 Rezepter (Aktivierung T-Zellen)
Probody für CD3-TCB Kooperation mit Astellas/Amgen
- Entwicklung eins bispezifischen Probody zum Ansprechen des CD3 Rezeptor und von Antigegenen auf Tumorzelloberfläche
Nun der Markt hat immer recht. Ein derart starkes abrutschen der Aktie kann ich nicht ganz nachvollziehen. Sean hat wohl mit seinen Verkaufsaktivitäten jedoch auch nicht gerade Vertrauen erweckt.
Gruß
JM
http://ir.cytomx.com/static-files/e57a22b4-04cf-4f54-a7bc-c7…
https://www.veracast.com/webcasts/bofa/healthcare2020/id2448…
Eine kurze Zusammenfassung mit Fokus auf das was auf der ASCO zusätzlich zum Abstractinhalt präsentiert wird.
CX2029 (Kooperation mit Abbvie)
Asco update:
- Datenschnitt 04/2020
- therapeutische Dosis kann erreicht werden
- zusätzliche Patientendaten mit höher Dosierung als 0,1 mg/kg (vermutlich bis 0,9 mg/kg)
- Beschreibung der getesteten Dosislevel und Gruppen
- Interpretation des Dosisansprechen und Ausblick wie eine Phase 2 Studie aussehen kann
BMS-986249 Kombo mit Nivolumab/Nivolumab +/- Ipilimumab (Kooperation mit Bristool Meyer)
- höhere Dosen mit Probody in Kombination Nivolumab/Nivolumab +/- Ipilimumab z.Bsp 20mg/kg in Kombi
- sehr gutes Sicherheitsprofil bei nur 9% der Patienten Grade 3/4 TRAE (Behandlungsbezogene Wechselwirkungen)
- in der Kombi mit dem CTL4 Probody höherer Dosierungen möglich
CX-072
Asco update:
- Datenschnitt 04/2020 aus 50 Patienten speziell Update zu Langzeitdaten multiple Tumortypen aus Phase 2
Die Ergebnisse mit Probody BMS-986249 sehen sehr vielversprechend aus. Zu CX2029 kann man noch auf die zusätzlichen Daten hoffen, zieht man in Betracht das CD177 bisher nicht therapeutisch angesprochen werden kann, ist auch dies ein Erfolg. Hier kann man von einem Proof of Concept PROCLAIM sprechen. Die von der Investgemeinde bemängelten Erfolge beziehen sich wohl hauptsächlich auf CX072. Entsprechend sind jedoch die angestrebten Entwicklungen:
CX-904 Kooperation mit Amgen
- Wandlung immunonkologisch 'kalter Tumore' (fortgeschritten, wuchernd, nicht therapierbar) in 'heiße Tumore' (Öffnung für therapierbarkeit)
- Entwicklung eines bispezifischen Probody zum Ansprechen EGFR (Transmembranrezeptor, ansprechen gegen unkontrolliertes Zellwachstum) and CD3 Rezepter (Aktivierung T-Zellen)
Probody für CD3-TCB Kooperation mit Astellas/Amgen
- Entwicklung eins bispezifischen Probody zum Ansprechen des CD3 Rezeptor und von Antigegenen auf Tumorzelloberfläche
Nun der Markt hat immer recht. Ein derart starkes abrutschen der Aktie kann ich nicht ganz nachvollziehen. Sean hat wohl mit seinen Verkaufsaktivitäten jedoch auch nicht gerade Vertrauen erweckt.
Gruß
JM
Antwort auf Beitrag Nr.: 63.689.728 von Jerry_Maguire am 15.05.20 09:30:27Danke Jerry für deine sehr guten Beiträge hier!
So richtig nachvollziehen kann ich die Kritik am Verkauf vom CEO nicht. Laut der Mitteilung erfolgt es im Rahmen seines Tradingplans. Da hat er überhaupt keinen Einfluss auf den Zeitpunkt. Steht in der Fußnote.
http://ir.cytomx.com/static-files/320d0d6f-4fc9-4f43-9f33-a8…
1. The sale was effected pursuant to the Reporting Person's Rule 10b5-1 trading plan.
----------------
CX-072 ist alleine durch und wird nur in Kombination getestet. Der erste Kombotrial mit CX-2009 ist schon angekündigt.
CytomX also made the strategic decision in March 2020 to terminate the PROCLAIM-CX-072-002 study evaluatingthe anti-PD-L1 Probody CX-072 in combination with ipilimumab in melanoma. This follows a re-evaluation of theevolving clinical, competitive, and commercial landscapes in immuno-oncology, taken together with impact of theCOVID-19 pandemic.
This strategic decision allows CytomX to focus its resources on its potential first-in-class assets, CX-2009 and CX-2029, to the future evaluation of a combination of CX-072 and CX-2009, and to the generation ofadditional clinical candidates for advancement to IND filing and clinical trials.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Ein wenig Hoffnung hab ich auch noch, dass das hier alles ein gutes Ende nimmt. So ganz schlecht die Partner ja nicht und die machen das nicht alles aus Langeweile.
So richtig nachvollziehen kann ich die Kritik am Verkauf vom CEO nicht. Laut der Mitteilung erfolgt es im Rahmen seines Tradingplans. Da hat er überhaupt keinen Einfluss auf den Zeitpunkt. Steht in der Fußnote.
http://ir.cytomx.com/static-files/320d0d6f-4fc9-4f43-9f33-a8…
1. The sale was effected pursuant to the Reporting Person's Rule 10b5-1 trading plan.
----------------
CX-072 ist alleine durch und wird nur in Kombination getestet. Der erste Kombotrial mit CX-2009 ist schon angekündigt.
CytomX also made the strategic decision in March 2020 to terminate the PROCLAIM-CX-072-002 study evaluatingthe anti-PD-L1 Probody CX-072 in combination with ipilimumab in melanoma. This follows a re-evaluation of theevolving clinical, competitive, and commercial landscapes in immuno-oncology, taken together with impact of theCOVID-19 pandemic.
This strategic decision allows CytomX to focus its resources on its potential first-in-class assets, CX-2009 and CX-2029, to the future evaluation of a combination of CX-072 and CX-2009, and to the generation ofadditional clinical candidates for advancement to IND filing and clinical trials.
http://ir.cytomx.com/news-releases/news-release-details/cyto…
Ein wenig Hoffnung hab ich auch noch, dass das hier alles ein gutes Ende nimmt. So ganz schlecht die Partner ja nicht und die machen das nicht alles aus Langeweile.
CytomX Therapeutics (CTMX) Presents At Goldman Sachs Global Healthcare Conference - Slideshow
Jun. 11, 2020 1:24 PM ET |
About: CytomX Therapeutics, Inc. (CTMX)
https://seekingalpha.com/article/4353350-cytomx-therapeutics…
Jun. 11, 2020 1:24 PM ET |
About: CytomX Therapeutics, Inc. (CTMX)
https://seekingalpha.com/article/4353350-cytomx-therapeutics…
Keine News?
CytomX Therapeutics präsentiert auf dem San Antonio Breast Cancer Symposium 2020 Updates zu CX-2009
http://www.globenewswire.com/news-release/2020/12/03/2139096…
http://www.globenewswire.com/news-release/2020/12/03/2139096…
Hallo zusammen, wie steht es um CytomX? Und glauibt ihr, dass die Firma vom momentanen Sektorboom noch profitieren dürfte und einen verspäteten Satz macht a la Sangamo?
Nun haben wir bei Cytomx einen ganz großen Player mit an Board.
Point72 Asset Management ist eine 1992 von Steven A. Cohen gegründete Investmentgesellschaft.
Er ist Multi-Milliardär. Auf der Forbes-Liste 2017 wird sein Vermögen mit ca. 13 Milliarden US-Dollar angegeben, womit er Platz 92 auf der Liste der reichsten Menschen der Welt belegt.
https://www.sec.gov/Archives/edgar/data/1501989/000089914021…
Point72 Asset Management ist eine 1992 von Steven A. Cohen gegründete Investmentgesellschaft.
Er ist Multi-Milliardär. Auf der Forbes-Liste 2017 wird sein Vermögen mit ca. 13 Milliarden US-Dollar angegeben, womit er Platz 92 auf der Liste der reichsten Menschen der Welt belegt.
https://www.sec.gov/Archives/edgar/data/1501989/000089914021…
Bin hiermal mit einer kleinen Zocker-Position dabei... bei fast negativem EV kann mir hier sicherlich nicht viel falsch machen... sollte irgendwann einen schönen run-up auf die Daten in Q4 geben..
Vielleicht auch etwas für @bcgk ?
Vielleicht auch etwas für @bcgk ?
Und natürlich danke @StellaVella für den Tip!
Antwort auf Beitrag Nr.: 66.667.658 von lorbas95 am 28.01.21 15:09:02Vielen Dank, ich habe heute morgen bereits mit StellaVella Konversation und DD betrieben.
MMn absolute Perle, die er da ausgegraben hat. Später etwas mehr von mir.
MMn absolute Perle, die er da ausgegraben hat. Später etwas mehr von mir.
Antwort auf Beitrag Nr.: 66.667.679 von lorbas95 am 28.01.21 15:09:35
Hallo zusammen, bin auch dabei 😉👍
Zitat von lorbas95: Und natürlich danke @StellaVella für den Tip!
Hallo zusammen, bin auch dabei 😉👍
Antwort auf Beitrag Nr.: 66.668.012 von bcgk am 28.01.21 15:18:07* Steven Cohen ganz frisch Ankerinvestor mit 5,5 Mio Aktien
https://www.gurufocus.com/news/1342365/steven-cohen-snaps-up…
* nur 50m ausstehende Aktien und damit eine MK von nur gut $360m
* letzte KE vor wenigen Tagen zu $7 abgeschlossen --> mehr Cash als MK derzeit
* sehr interessante Probody Technologie in der Krebsbekämpfung
Ein ähnliches Konzept (lt. Stella aber weniger raffiniert) hat Immunomedics praktiziert (Übernahme durch Gilead für $21b)
Dazu riecht der Chart nach Ausbruch. Gefällt mir außerordentlich gut.
Vielen Dank @StellaVella.
https://www.gurufocus.com/news/1342365/steven-cohen-snaps-up…
* nur 50m ausstehende Aktien und damit eine MK von nur gut $360m
* letzte KE vor wenigen Tagen zu $7 abgeschlossen --> mehr Cash als MK derzeit
* sehr interessante Probody Technologie in der Krebsbekämpfung
Ein ähnliches Konzept (lt. Stella aber weniger raffiniert) hat Immunomedics praktiziert (Übernahme durch Gilead für $21b)
Dazu riecht der Chart nach Ausbruch. Gefällt mir außerordentlich gut.
Vielen Dank @StellaVella.
Antwort auf Beitrag Nr.: 66.669.380 von bcgk am 28.01.21 15:49:48@bcgk definitiv ein interessanter pick:
Biotech Value Fund mit 4.626.411 Aktien und
Perceptive Advisors mit 3.253.923 Aktien hier ebenfalls dabei. Bin gespannt, ob die bei der KE auch noch erhöht haben.
Sonst noch Blackrock mit 4mio Aktien und Vanguard mit 2,7mio Aktien dabei.
Biotech Value Fund mit 4.626.411 Aktien und
Perceptive Advisors mit 3.253.923 Aktien hier ebenfalls dabei. Bin gespannt, ob die bei der KE auch noch erhöht haben.
Sonst noch Blackrock mit 4mio Aktien und Vanguard mit 2,7mio Aktien dabei.
Antwort auf Beitrag Nr.: 66.670.643 von ChrisTIan87 am 28.01.21 16:20:20RA Capital Healthcare Funds und Black Rock haben 3,5Mio bzw. 3,8 Mio Stücke gekauft.
Nachbörslich geht's auf $7.37.
Nachbörslich geht's auf $7.37.
Antwort auf Beitrag Nr.: 66.710.708 von bcgk am 29.01.21 23:17:34Das sind wirklich gute News!
Darf ich fragen was dein Kursziel für CTMX ist?
Darf ich fragen was dein Kursziel für CTMX ist?
Mein Kursziel wäre so bei 100-300 $
345 $ wären die 21 Milliarden vom Gilead Deal!
345 $ wären die 21 Milliarden vom Gilead Deal!
Antwort auf Beitrag Nr.: 66.711.134 von aliasmexx am 30.01.21 00:03:53Mein Ziel ist hier vorrangig die Entwicklung der Pipeline und die Beweisführung, dass die Technologie funktioniert. Der Kurs reagiert dann von alleine. Wir haben hier aber enorm viel Luft nach oben, das steht für mich außer Frage.
Antwort auf Beitrag Nr.: 66.712.001 von bcgk am 30.01.21 07:53:00
Kennst DU Dich in dem Bereich aus, um auf der Grundlage der bekannten Daten den möglichen Erfolg beurteilen zu können ? Ansonsten ist das nur ein interessanter Lottoschein, mit Blick auf die neuen großen Anteilseigner.
Zitat von bcgk: Mein Ziel ist hier vorrangig die Entwicklung der Pipeline und die Beweisführung, dass die Technologie funktioniert. Der Kurs reagiert dann von alleine. Wir haben hier aber enorm viel Luft nach oben, das steht für mich außer Frage.
Kennst DU Dich in dem Bereich aus, um auf der Grundlage der bekannten Daten den möglichen Erfolg beurteilen zu können ? Ansonsten ist das nur ein interessanter Lottoschein, mit Blick auf die neuen großen Anteilseigner.
Antwort auf Beitrag Nr.: 66.713.957 von 007coolinvestor am 30.01.21 11:24:49Die bisherigen Ergebnisse sind doch äußerst vielversprechend. Und die Technologie ebenfalls.
Ich zitiere mal einen echten Experten der Materie:
Von der Technologie her sind das modifizierte Antikörper, die an Checkpoints binden. Der Kniff ist, dass die eigentliche Bindungsstelle der Antikörper mit einem Stück Protein maskiert ist. Die Maske wird dann in der unmittelbaren Umgebung des Tumors abgetrennt, durch Proteasen (d.h. Enzyme, die Proteine zerschneiden können) in der Mikroumgebung des Tumors, wodurch die Antikörper dann scharf geschalten werden und sich an den Tumor binden. Das erkennt dann wiederrum das Immunsystem und zerstört den Tumor.
Der Vorteil liegt in der geringeren Tox der Antikörper, da sie im Rest des Körpers durch die Maske nicht binden können.
Sehr interessante Technologie - gefällt mir. Ähnlich wie bei Immunomedics, die ja kürzlich von Gilead für mehrere Milliarden geschluckt wurden, aber noch raffinierter..
Der Laden ist extrem seriös geführt, man hat Cash satt und die MK ist noch (!) sehr überschaubar. Ich glaube daran, dass Unternehmen wie CytomX früher oder später aufgekauft werden und das ganz sicher für mehrere Milliarden Dollar.
Daher aus meiner Sicht kein Lottoschein, sondern seriöses Investieren auf Basis von gewonnen Erkenntnissen zum Mechanism of Action.
Ich zitiere mal einen echten Experten der Materie:
Von der Technologie her sind das modifizierte Antikörper, die an Checkpoints binden. Der Kniff ist, dass die eigentliche Bindungsstelle der Antikörper mit einem Stück Protein maskiert ist. Die Maske wird dann in der unmittelbaren Umgebung des Tumors abgetrennt, durch Proteasen (d.h. Enzyme, die Proteine zerschneiden können) in der Mikroumgebung des Tumors, wodurch die Antikörper dann scharf geschalten werden und sich an den Tumor binden. Das erkennt dann wiederrum das Immunsystem und zerstört den Tumor.
Der Vorteil liegt in der geringeren Tox der Antikörper, da sie im Rest des Körpers durch die Maske nicht binden können.
Sehr interessante Technologie - gefällt mir. Ähnlich wie bei Immunomedics, die ja kürzlich von Gilead für mehrere Milliarden geschluckt wurden, aber noch raffinierter..
Der Laden ist extrem seriös geführt, man hat Cash satt und die MK ist noch (!) sehr überschaubar. Ich glaube daran, dass Unternehmen wie CytomX früher oder später aufgekauft werden und das ganz sicher für mehrere Milliarden Dollar.
Daher aus meiner Sicht kein Lottoschein, sondern seriöses Investieren auf Basis von gewonnen Erkenntnissen zum Mechanism of Action.
Antwort auf Beitrag Nr.: 66.714.485 von bcgk am 30.01.21 12:07:07Technisch ist das so, aber wenn ich die bisherigen Ergebnisse richtig verstanden habe, nimmt die Wirksamkeit mit der fehlenden (gestreuten) Toxis ab. Meiner Wahrnehmung nach steht die Technologie nach derzeitiger Datenlage auf der Kippe, die aber immer noch gelingen kann.
Vielleicht gibt es hier noch einen Fachmann der dazu etwas sagen kann.
Vielleicht gibt es hier noch einen Fachmann der dazu etwas sagen kann.
Antwort auf Beitrag Nr.: 66.714.623 von 007coolinvestor am 30.01.21 12:16:29
Nicht ganz, so wie ich die Technologie verstehe, sorgt das Entfernen der Maske durch die Proteasen für die zielgenaue Aktivierung der Antikörper und die selektive Freisetzung der cytotoxischen Payload direkt an der Tumorzelle bei gleichzeitiger Bindung an den Checkpoint, d.h. Enttarnung der Tumorzelle gg. dem Immunsystem. Die bessere Selektivität verhindert die Freisetzung der Payload an anderen Stellen im Körper und führt daher zu einer geringeren Toxizität der Therapie, was wiederum dazu führt, dass man die Dosis der Antikörper wesentlich höher gestalten kann als zB bei Immunomedics, was zu einer stärkeren Wirkung führen sollte... viel hilft viel.
Zitat von 007coolinvestor: Technisch ist das so, aber wenn ich die bisherigen Ergebnisse richtig verstanden habe, nimmt die Wirksamkeit mit der fehlenden (gestreuten) Toxis ab. Meiner Wahrnehmung nach steht die Technologie nach derzeitiger Datenlage auf der Kippe, die aber immer noch gelingen kann.
Vielleicht gibt es hier noch einen Fachmann der dazu etwas sagen kann.
Nicht ganz, so wie ich die Technologie verstehe, sorgt das Entfernen der Maske durch die Proteasen für die zielgenaue Aktivierung der Antikörper und die selektive Freisetzung der cytotoxischen Payload direkt an der Tumorzelle bei gleichzeitiger Bindung an den Checkpoint, d.h. Enttarnung der Tumorzelle gg. dem Immunsystem. Die bessere Selektivität verhindert die Freisetzung der Payload an anderen Stellen im Körper und führt daher zu einer geringeren Toxizität der Therapie, was wiederum dazu führt, dass man die Dosis der Antikörper wesentlich höher gestalten kann als zB bei Immunomedics, was zu einer stärkeren Wirkung führen sollte... viel hilft viel.
Antwort auf Beitrag Nr.: 66.714.623 von 007coolinvestor am 30.01.21 12:16:29Ich sehe CTMX auch als Hochrisiko-Invest.
Ich war hier zu Zeiten investiert als Joschka Schröder(mittlerweile abgemeldet) hier begeisterte Berichte schrieb und bin dann irgendwann vor 2-3 Jahren mit ordentlichem Verlust ausgestiegen. Nix gegen den User! Das war kein billiger pusher, sondern ein echter Kenner und Mediziner...mit vielleicht etwas zu viel Euphorie für CTMX. Der User ist (meines Wissens) auch heute noch auf Twitter aktiv [German Biotech]....scheint dort aber (mit wenigen Tweets zu CTMX) eher skeptisch eingestellt zu sein.
Die Technologie ist offenbar (wie so viele Krebstherapien) anfangs sehr hoffnungsvoll, in der Praxis bleiben dann leider (wie so oft) nicht viele von den anfänglichen Hoffnungen zurück. Man soll sich auch nicht von den Geldflüssen blenden lassen. Als ich investiert war gab es immer wieder fette upfront-payments.. z. Bsp. Bristol Myers Squibb mit stolzen 200 Mio. und auch diverse milestone-payments von ebenfalls namhaften playern wie z. Bsp. Abbvie, Pfizer etc.
Vieles hat sich mittlerweile leider zerschlagen, Pfizer die Zusammenarbeit gar beendet.
Positiv: Der Chart könnte, wenn man so will, nach einer gewissen Bodenbildung aussehen...aber das kann auch gewaltig täuschen.
Ich war hier zu Zeiten investiert als Joschka Schröder(mittlerweile abgemeldet) hier begeisterte Berichte schrieb und bin dann irgendwann vor 2-3 Jahren mit ordentlichem Verlust ausgestiegen. Nix gegen den User! Das war kein billiger pusher, sondern ein echter Kenner und Mediziner...mit vielleicht etwas zu viel Euphorie für CTMX. Der User ist (meines Wissens) auch heute noch auf Twitter aktiv [German Biotech]....scheint dort aber (mit wenigen Tweets zu CTMX) eher skeptisch eingestellt zu sein.
Die Technologie ist offenbar (wie so viele Krebstherapien) anfangs sehr hoffnungsvoll, in der Praxis bleiben dann leider (wie so oft) nicht viele von den anfänglichen Hoffnungen zurück. Man soll sich auch nicht von den Geldflüssen blenden lassen. Als ich investiert war gab es immer wieder fette upfront-payments.. z. Bsp. Bristol Myers Squibb mit stolzen 200 Mio. und auch diverse milestone-payments von ebenfalls namhaften playern wie z. Bsp. Abbvie, Pfizer etc.
Vieles hat sich mittlerweile leider zerschlagen, Pfizer die Zusammenarbeit gar beendet.
Positiv: Der Chart könnte, wenn man so will, nach einer gewissen Bodenbildung aussehen...aber das kann auch gewaltig täuschen.
Zitat von 007coolinvestor: Technisch ist das so, aber wenn ich die bisherigen Ergebnisse richtig verstanden habe, nimmt die Wirksamkeit mit der fehlenden (gestreuten) Toxis ab. Meiner Wahrnehmung nach steht die Technologie nach derzeitiger Datenlage auf der Kippe, die aber immer noch gelingen kann.
Vielleicht gibt es hier noch einen Fachmann der dazu etwas sagen kann.
Antwort auf Beitrag Nr.: 66.715.349 von werthaltig am 30.01.21 13:16:43Ehemalige Invests aus einem frustrierten Blickwinle zu betrachten ist mMn verständlich. Da hapert es dann ein wenig mit der Objektivität. Selbiges Problem könnte man natürlich auch Investierten unterstellen.
Habe gestern noch mit einem gut befreundeten Biotechanalysten bei Sal Oppenheimer gesprochen. Der bestätigt StellaVellas Aussagen, was ganz klar für ihn spricht.
Ich hoffe natürlich, dass niemand sein Haus auf CytomX setzt. In einem Biotechdepot mit mittlerweile ca. 30 Positionen, nimmt Cytomx allerdings bei mir eine leicht überdurchschnittliche Positiongröße ein.
Und gerade im Cancerbereich kann eine gewisse Diversität nicht schaden. Bei NK gibt es auch Kritiker, die nehme ich aber aufgrund besseren Wissens (meine subjektive Haltung) auch nicht ernster als nötig.
Habe gestern noch mit einem gut befreundeten Biotechanalysten bei Sal Oppenheimer gesprochen. Der bestätigt StellaVellas Aussagen, was ganz klar für ihn spricht.
Ich hoffe natürlich, dass niemand sein Haus auf CytomX setzt. In einem Biotechdepot mit mittlerweile ca. 30 Positionen, nimmt Cytomx allerdings bei mir eine leicht überdurchschnittliche Positiongröße ein.
Und gerade im Cancerbereich kann eine gewisse Diversität nicht schaden. Bei NK gibt es auch Kritiker, die nehme ich aber aufgrund besseren Wissens (meine subjektive Haltung) auch nicht ernster als nötig.
Antwort auf Beitrag Nr.: 66.715.349 von werthaltig am 30.01.21 13:16:43Klar, ist ein riskantes Invest. Das sollte jedem bewusst sein. Die aktuelle Finanzsituation gibt dem Unternehmen aber jede Menge Pulver, um die Studien voranzutreiben, d.h. aktuell ist Chance:Risiko nicht schlecht. Vom MOA her plausibel, mit Potential und wenn es denn mal eine erfolgreiche P3 gibt, ein Buyout-Kandidat.
Antwort auf Beitrag Nr.: 66.715.499 von bcgk am 30.01.21 13:28:17@bcgk
Ich bin definitiv NIE frustriert was meine Rohrkrepierer angeht und kaufe hemmungslos für $20, was ich zuvor zu $10 geschmissen habe, wenn die Lage (aus meiner Sicht) dafür spricht. Ich hatte zum Bsp. CTSO schon mal zu $5 mit Verlust verkauft, nur um es später wieder für $7 zu kaufen.
Darum beobachte ich auch meine ehemaligen Fehlschüsse...wie zum Bsp. CTMX. Der Vorteil: Man kennt die Basics und muss nicht bei Adam&Eva anfangen zu recherchieren.
Mein Fazit ist hier halt im Moment aufgrund der Gemengelage negativ. Bei Dir und Deinem Analystenprofi positiv. So muss das auch sein, sonst würde ja alle die selben Aktien kaufen.☺
Ich bin definitiv NIE frustriert was meine Rohrkrepierer angeht und kaufe hemmungslos für $20, was ich zuvor zu $10 geschmissen habe, wenn die Lage (aus meiner Sicht) dafür spricht. Ich hatte zum Bsp. CTSO schon mal zu $5 mit Verlust verkauft, nur um es später wieder für $7 zu kaufen.
Darum beobachte ich auch meine ehemaligen Fehlschüsse...wie zum Bsp. CTMX. Der Vorteil: Man kennt die Basics und muss nicht bei Adam&Eva anfangen zu recherchieren.
Mein Fazit ist hier halt im Moment aufgrund der Gemengelage negativ. Bei Dir und Deinem Analystenprofi positiv. So muss das auch sein, sonst würde ja alle die selben Aktien kaufen.☺
Antwort auf Beitrag Nr.: 66.715.658 von werthaltig am 30.01.21 13:41:10Wenn ich fragen darf (ernst gemeint): was genau siehst Du bei CytomX als kritisch, zum aktuellen Zeitpunkt? Was stört Dich? Wie bcgk richtig erwähnt hat, bin ich sicherlich auch nicht ganz unvoreingenommen bzw aktuell der Firma positiv gg. eingestellt und eine unabhängige Perspektive interessiert mich
Antwort auf Beitrag Nr.: 66.715.658 von werthaltig am 30.01.21 13:41:10Ich habe das gar nicht auf dich gemünzt. Ich schätze dich sehr und bin einer deiner Follower.
Antwort auf Beitrag Nr.: 66.714.719 von StellaVella am 30.01.21 12:22:55Ich habe nicht von der Technologie gesprochen sondern von den Studienergebnissen. Wenn ich die richtig (und der Kapitalmarkt) verstanden habe, waren die ehr durchwachsen und lassen keinen klaren Schluss zu, was ja noch nichts heißt. Erhöhtes Risiko das die Technologie nicht das liefert was Sie in der Theorie soll sehe ich damit schon. - Ich bin aber kein Insider. Die Datenlage hat für eine Experten sicher konkretere Aussagekraft als für mich.
[
Nicht ganz, so wie ich die Technologie verstehe, sorgt das Entfernen der Maske durch die Proteasen für die zielgenaue Aktivierung der Antikörper und die selektive Freisetzung der cytotoxischen Payload direkt an der Tumorzelle bei gleichzeitiger Bindung an den Checkpoint, d.h. Enttarnung der Tumorzelle gg. dem Immunsystem. Die bessere Selektivität verhindert die Freisetzung der Payload an anderen Stellen im Körper und führt daher zu einer geringeren Toxizität der Therapie, was wiederum dazu führt, dass man die Dosis der Antikörper wesentlich höher gestalten kann als zB bei Immunomedics, was zu einer stärkeren Wirkung führen sollte... viel hilft viel.[/quote]
[
Nicht ganz, so wie ich die Technologie verstehe, sorgt das Entfernen der Maske durch die Proteasen für die zielgenaue Aktivierung der Antikörper und die selektive Freisetzung der cytotoxischen Payload direkt an der Tumorzelle bei gleichzeitiger Bindung an den Checkpoint, d.h. Enttarnung der Tumorzelle gg. dem Immunsystem. Die bessere Selektivität verhindert die Freisetzung der Payload an anderen Stellen im Körper und führt daher zu einer geringeren Toxizität der Therapie, was wiederum dazu führt, dass man die Dosis der Antikörper wesentlich höher gestalten kann als zB bei Immunomedics, was zu einer stärkeren Wirkung führen sollte... viel hilft viel.[/quote]
Antwort auf Beitrag Nr.: 66.716.369 von 007coolinvestor am 30.01.21 14:35:18Danke für die schnelle Antwort. Ich finde die Studienresultate der P1-Studien bisher recht überzeugend und vielversprechend, gemäß der letzten Firmen-Präsentationen.
Die Teilnehmer waren mehrfach vortherapiert, hatten in der Regel Metastasen etc. Vor dem Hintergrund ist eine partial response bzw. stable disease über einen längeren Zeitraum durchaus beeindruckend, bei einer P1. Des weiteren sind auch die verabreichten Dosen der Cytotoxine bei den ADC-Studien bemerkenswert - die lagen teilw. bei einem Vielfachen der lethalen Dosis.
Interessant sind für mich auch die Targets der ADC. CD166 und CD71 sind normalerweise kein gutes Target für ADC, da sie in vielen Geweben vorkommen. Die beobachtete relativ geringe Tox/SAE/TEAE ist für mich überraschend.
Lassen wir uns mal überraschen, was die P2 bringen. Immerhin hat man zahlreiche Shots-on-target
Die Teilnehmer waren mehrfach vortherapiert, hatten in der Regel Metastasen etc. Vor dem Hintergrund ist eine partial response bzw. stable disease über einen längeren Zeitraum durchaus beeindruckend, bei einer P1. Des weiteren sind auch die verabreichten Dosen der Cytotoxine bei den ADC-Studien bemerkenswert - die lagen teilw. bei einem Vielfachen der lethalen Dosis.
Interessant sind für mich auch die Targets der ADC. CD166 und CD71 sind normalerweise kein gutes Target für ADC, da sie in vielen Geweben vorkommen. Die beobachtete relativ geringe Tox/SAE/TEAE ist für mich überraschend.
Lassen wir uns mal überraschen, was die P2 bringen. Immerhin hat man zahlreiche Shots-on-target
Antwort auf Beitrag Nr.: 66.716.996 von StellaVella am 30.01.21 15:37:13Ja, also ich denke, dass man in der Tat die Phase 2-Ergebnisse abwarten muss, um ein klares Signal zu bekommen. Zum jetzigen Zeitpunkt ist einfach die auf dem Papier interessante Technologie, das negative EV und die Fonds-Beteiligung (d.h. das außerordentlich gute CRV) Hauptargument für ein Investment. Solche Gelegenheiten sollte man immer ergreifen, zumindest mit einer kleinen Position. Minimales downside, extrem großes Upside.
Man kann sich gut vorstellen, dass bis zum Readout in Q4 die Aktie einfach 100% zulegt in Antizipation der Ergebnisse...
Allerdings: wenn man sich bei $30m cash-burn pro Quartal und $320m Cash-Reserven auf nem historisch niedrigen Level nochmal $100m per Kapitalerhöhung sichert, zeugt das von einem geringen Vertrauen des managements in diese Readouts...
Man kann sich gut vorstellen, dass bis zum Readout in Q4 die Aktie einfach 100% zulegt in Antizipation der Ergebnisse...
Allerdings: wenn man sich bei $30m cash-burn pro Quartal und $320m Cash-Reserven auf nem historisch niedrigen Level nochmal $100m per Kapitalerhöhung sichert, zeugt das von einem geringen Vertrauen des managements in diese Readouts...
Hier mal eine Unternehmenspräsentation wo ersichtlich ist was alles in der Pipeline ist.
https://ir.cytomx.com/static-files/1074f8bb-23d9-4dc9-8fdf-e…
https://ir.cytomx.com/static-files/1074f8bb-23d9-4dc9-8fdf-e…
Antwort auf Beitrag Nr.: 66.719.708 von lorbas95 am 30.01.21 19:30:35die KE ist allerdings ungewöhnlich. Fast so, als ob man den Stock Price bewusst gedrückt hat, um jemandem einen besseren Einstieg zu ermöglichen.
@bckg Blackrock war vorher schon mit 4Mio Aktien dabei. Das Filing ist ihr reguläres Dezember 2020 Filing und zeigt einen leichten Verkauf.
Bei der jeztigen KE sind defintiv Point72 und RA Capital dazu gekommen. Könnte mir gut vorstellen, dass nächste Woche aber noch etwas folgt. Ich glaub bis zu 10 Tage haben die Unternehmen Zeit.
Ein Aufstocken von Perceptive und BVF würde mich sehr freuen.
Zur KE: Der Kurs ist wegen vmtl. tax loss zum Jahresende ordentlich gesunken und dann recht schnell vor der JPM Healtcare Konferenz auf altem Niveau um 7,5$ gewesen. Danach gab es einen kleinen Run mit anschließender KE. Könnte mir gut vorstellen, dass jemand auf der Konferenz Interesse bekundet hat und einsteigen wollte (Point72).
Die Firma selbst hätte erstmal keine KE notwendig gehabt, da neben dem Cash ja auch Meilensteinzahlungen fließen sollten und man durchaus einige Zeit finanziert ist.
Am 14.01. gab es ja auch ein Trial Update Seitens BMS:
https://clinicaltrials.gov/ct2/show/NCT03369223
Die Anzahl der Patienten ist um +50 erhöht worden, einige Studienarme haben die Rekrutierung beendet und es sind Phase 2B Arme neu aufgenommen worden, in:
Advanced hepatocellular carcinoma (HCC)
Metastatic castration-resistant prostate cancer (CRPC)
Unresectable locally advanced or metastatic triple-negative breast cancer (TNBC)
Ich vermute, dass hier zeitnah (vmtl. auf einer der Konferenzen, ASCO, AACR...) etwas positives zu berichten ist.
Bei der jeztigen KE sind defintiv Point72 und RA Capital dazu gekommen. Könnte mir gut vorstellen, dass nächste Woche aber noch etwas folgt. Ich glaub bis zu 10 Tage haben die Unternehmen Zeit.
Ein Aufstocken von Perceptive und BVF würde mich sehr freuen.
Zur KE: Der Kurs ist wegen vmtl. tax loss zum Jahresende ordentlich gesunken und dann recht schnell vor der JPM Healtcare Konferenz auf altem Niveau um 7,5$ gewesen. Danach gab es einen kleinen Run mit anschließender KE. Könnte mir gut vorstellen, dass jemand auf der Konferenz Interesse bekundet hat und einsteigen wollte (Point72).
Die Firma selbst hätte erstmal keine KE notwendig gehabt, da neben dem Cash ja auch Meilensteinzahlungen fließen sollten und man durchaus einige Zeit finanziert ist.
Am 14.01. gab es ja auch ein Trial Update Seitens BMS:
https://clinicaltrials.gov/ct2/show/NCT03369223
Die Anzahl der Patienten ist um +50 erhöht worden, einige Studienarme haben die Rekrutierung beendet und es sind Phase 2B Arme neu aufgenommen worden, in:
Advanced hepatocellular carcinoma (HCC)
Metastatic castration-resistant prostate cancer (CRPC)
Unresectable locally advanced or metastatic triple-negative breast cancer (TNBC)
Ich vermute, dass hier zeitnah (vmtl. auf einer der Konferenzen, ASCO, AACR...) etwas positives zu berichten ist.
Im pre hat gerade jemand 11.500 Stk. gekauft 😳
Also keine Spielgeld Position würde ich mal sagen, es kommt langsam bewegen rein. 😊
https://www.nasdaq.com/market-activity/stocks/ctmx/pre-marke…
Also keine Spielgeld Position würde ich mal sagen, es kommt langsam bewegen rein. 😊
https://www.nasdaq.com/market-activity/stocks/ctmx/pre-marke…
Antwort auf Beitrag Nr.: 66.730.192 von ChrisTIan87 am 31.01.21 18:29:07Vielen Dank für deine profunde Einschätzung. Ich fühle mich pudelwohl und je mehr ich lese desto stärker festigt sich dieser Zustand.
Hallo Zusammen,
als schon lange investierter bei CTMX bin ich wieder etwas hellhörig geworden. Der wiedereinstieg von Cohens P72 (haben ihre Anteile in 2020 fast vollständig zurück gefahren), lässt vermuten das etwas im Busch ist. Hier mal meine Pro Cons für einen Einstieg aus der Beobachtung der letzten 2 Jahre:
Pro:
- das Proof of Concept der Technologie ist bestätigt, ein enormes Potential nicht nur in der Krebstherapie
- die Recruiting Strategie von CTX deutet darauf das klinische Studien ausgeweitet werden, vor allem im BOD wurden im Hinblick auf Erreichen der Klinikreife sehr erfahrene Leute eingestellt
- Gemessen an Assets, Cashbestand, EVA, keinen Krediten ist die Aktie derzeit dramatisch unterbewertet, schneller sprunghafter Anstieg in Bereiche bis 16 USD bei der nun beobachten Zunahme von Analystenmeinungen halte ich ohne Probleme für möglich
- ein Boden wurde bei 5,5 USD ist gebildet und mehrfach getestet
- Die Anteilserhöhung von Insties wie Blackrock, P72 wird den Kurs treiben
- die KE ist unnötig gewesen sollte wohl eine starke Nachfrage nach einem günstigen Einstieg bedienen, aktuell scheint P72 seinen Bestand sogar aus dem Freefloat weiter auszubauen, lässt auf hohen Nachfrgedruck in 2021 schließen
- Sehr hohe Potentiale bei den TCBs wie CX 904 zeigt auch der Einstieg von Astellas mit 80 MioUSD upfront payment
- CD3 TCBS böten eine derart breite Anwendungsmöglichkeit, dass man bei Erfolg von einer Gelddruckmaschine sprechen kann
Negativ:
- Nach dem Rücksetzer in 04/2020 gab es eine Reihe von Klagedrohungen wegen fehlender Transparenz bei der Präsentation von Ergebnissen (Toxizität, TRAEs), keine war erfolgreich
- Auf vormals erfolgreich erscheinen Pipelines wie CX072 oder CX72/CX2009 Kombis (zeigten wenige aber ausgeprägte TRAE), wird in den letzten Präsentationen (JP Morgan Healthcare aus 01/2021) gar nicht eingegangen, das erscheint mir im Hinblick auf die o.a. Klagedrohungen zumindest merkwürdig
- Zu Kooperation mit Astellas bei CD3-TCBs hört man gar nichts, zumindest Ergebnisse pre klinischer Studien müssten doch schon vorliegen
- Informationslage zu BMS-986288 und ...249 ist auch dünn, unklar wo BMS hier steht
- Es ist auffällig das in Präsentationen weniger auf das Marktpotential (möglicher Profit) eingegangen wir als früher
- Der Rückstau in den Studien wegen Covid 19 könnte neue Ergebnisse verzögern
- Nach wie vor ist das IR von CTX grottig dafür aber die Neigung des BOD persönliche Boni zu vergeben erstaunlich.
Ich habe meine Position beim letzten Rücksetzer massiv ausgebaut. So nah am Boden kann man meiner Einschätzung nach wenig falsch machen. Das Aufwärtspotential ist enorm, das Abwärtspotential vertretbar. Keine Handlungsempfehlung
Gruß
JM
als schon lange investierter bei CTMX bin ich wieder etwas hellhörig geworden. Der wiedereinstieg von Cohens P72 (haben ihre Anteile in 2020 fast vollständig zurück gefahren), lässt vermuten das etwas im Busch ist. Hier mal meine Pro Cons für einen Einstieg aus der Beobachtung der letzten 2 Jahre:
Pro:
- das Proof of Concept der Technologie ist bestätigt, ein enormes Potential nicht nur in der Krebstherapie
- die Recruiting Strategie von CTX deutet darauf das klinische Studien ausgeweitet werden, vor allem im BOD wurden im Hinblick auf Erreichen der Klinikreife sehr erfahrene Leute eingestellt
- Gemessen an Assets, Cashbestand, EVA, keinen Krediten ist die Aktie derzeit dramatisch unterbewertet, schneller sprunghafter Anstieg in Bereiche bis 16 USD bei der nun beobachten Zunahme von Analystenmeinungen halte ich ohne Probleme für möglich
- ein Boden wurde bei 5,5 USD ist gebildet und mehrfach getestet
- Die Anteilserhöhung von Insties wie Blackrock, P72 wird den Kurs treiben
- die KE ist unnötig gewesen sollte wohl eine starke Nachfrage nach einem günstigen Einstieg bedienen, aktuell scheint P72 seinen Bestand sogar aus dem Freefloat weiter auszubauen, lässt auf hohen Nachfrgedruck in 2021 schließen
- Sehr hohe Potentiale bei den TCBs wie CX 904 zeigt auch der Einstieg von Astellas mit 80 MioUSD upfront payment
- CD3 TCBS böten eine derart breite Anwendungsmöglichkeit, dass man bei Erfolg von einer Gelddruckmaschine sprechen kann
Negativ:
- Nach dem Rücksetzer in 04/2020 gab es eine Reihe von Klagedrohungen wegen fehlender Transparenz bei der Präsentation von Ergebnissen (Toxizität, TRAEs), keine war erfolgreich
- Auf vormals erfolgreich erscheinen Pipelines wie CX072 oder CX72/CX2009 Kombis (zeigten wenige aber ausgeprägte TRAE), wird in den letzten Präsentationen (JP Morgan Healthcare aus 01/2021) gar nicht eingegangen, das erscheint mir im Hinblick auf die o.a. Klagedrohungen zumindest merkwürdig
- Zu Kooperation mit Astellas bei CD3-TCBs hört man gar nichts, zumindest Ergebnisse pre klinischer Studien müssten doch schon vorliegen
- Informationslage zu BMS-986288 und ...249 ist auch dünn, unklar wo BMS hier steht
- Es ist auffällig das in Präsentationen weniger auf das Marktpotential (möglicher Profit) eingegangen wir als früher
- Der Rückstau in den Studien wegen Covid 19 könnte neue Ergebnisse verzögern
- Nach wie vor ist das IR von CTX grottig dafür aber die Neigung des BOD persönliche Boni zu vergeben erstaunlich.
Ich habe meine Position beim letzten Rücksetzer massiv ausgebaut. So nah am Boden kann man meiner Einschätzung nach wenig falsch machen. Das Aufwärtspotential ist enorm, das Abwärtspotential vertretbar. Keine Handlungsempfehlung
Gruß
JM
na dann: ich habe bei 7 ebenso wieder ordentlich zugelangt, schau ma mal.
Zusätzliche Aktienkauf voll gezogen....
https://ir.cytomx.com/news-releases/news-release-details/upd…
https://ir.cytomx.com/news-releases/news-release-details/upd…
Antwort auf Beitrag Nr.: 66.720.407 von StellaVella am 30.01.21 20:24:03
Ich habe die durch erfolgte KE aktuell noch günstigen Kurse zum Einstieg genutzt, das Timing erscheint mir gerade außerordentlich gut. Natürlich habe ich das Tief verpasst, bin aber mit meinen $7,58 sehr zufrieden. CTMX habe ich schon lange im Auge gehabt, das Potential wurde vom Threaderöffner gut beschrieben und es gibt auch in letzter Zeit hier viele gute Beiträge (Danke!) sodass ich selbst hier zu den klinischen Aussichten gar nicht viel schreiben möchte und das lieber den Experten an Bord überlasse.
Zitat von StellaVella: die KE ist allerdings ungewöhnlich. Fast so, als ob man den Stock Price bewusst gedrückt hat, um jemandem einen besseren Einstieg zu ermöglichen.
Ich habe die durch erfolgte KE aktuell noch günstigen Kurse zum Einstieg genutzt, das Timing erscheint mir gerade außerordentlich gut. Natürlich habe ich das Tief verpasst, bin aber mit meinen $7,58 sehr zufrieden. CTMX habe ich schon lange im Auge gehabt, das Potential wurde vom Threaderöffner gut beschrieben und es gibt auch in letzter Zeit hier viele gute Beiträge (Danke!) sodass ich selbst hier zu den klinischen Aussichten gar nicht viel schreiben möchte und das lieber den Experten an Bord überlasse.
Ist und bleibt ein risikoreiches Invest. Jerry_Maguire hats, glaub ich, gut zusammengefasst. Ich meinerseits bin froh wieder substanzreiche Postings (ebenfalls danke!) lesen zu dürfen. Ich bin da viel zu sehr Laie.
Ende 2021 und weiteren Ergebnissen aus Studien werden wir wesentlich klarer sehen, ob sich das ganze ausgezahlt hat...
Ende 2021 und weiteren Ergebnissen aus Studien werden wir wesentlich klarer sehen, ob sich das ganze ausgezahlt hat...
Antwort auf Beitrag Nr.: 66.800.572 von ciel34 am 03.02.21 16:40:36Ja, es gibt hier natürlich Risiken, aber man hat immerhin 4 P2 Studien und die Milestones können sich wirklich sehen lassen. Es kommt auch weiter Nachschub in die Pipeline. Worst Case fällt man hier knapp unter Cash Level, aber genau da stehen wir gerade! Mit 30m burn rate im Quartal steigt das Risiko natürlich im Zeitverlauf. Im Moment kann es eigentlich nur in eine Richtung gehen.
$80M upfront from Astellas
➢ $40M CX-2029 milestone from AbbVie
➢ $10M anti-CTLA-4 milestone from BMS
Da wird noch einiges mehr kommen wenn man es bis zur Zulassung schafft und zeigt schon mal im Ansatz in welche Richtung es hier mit Umsätzen / Royalties gehen könnte. Definitiv Blockbuster Potential bei der breiten Anwendungsmöglichkeit. Dazu optimal finanziert, somit mittelfristig wenig Verwässerungsrisiko und die Pipeline gibts so gut wie geschenkt da die Mcap etwa dem Cash entspricht.
$80M upfront from Astellas
➢ $40M CX-2029 milestone from AbbVie
➢ $10M anti-CTLA-4 milestone from BMS
Da wird noch einiges mehr kommen wenn man es bis zur Zulassung schafft und zeigt schon mal im Ansatz in welche Richtung es hier mit Umsätzen / Royalties gehen könnte. Definitiv Blockbuster Potential bei der breiten Anwendungsmöglichkeit. Dazu optimal finanziert, somit mittelfristig wenig Verwässerungsrisiko und die Pipeline gibts so gut wie geschenkt da die Mcap etwa dem Cash entspricht.
Antwort auf Beitrag Nr.: 66.824.062 von DWL33 am 04.02.21 18:05:59Wird ein Bombeninvestment, bin gespannt, ob es an an meinen Liebling NK heranschnuppern kann.
Der Chart sieht richtig gut, Ausbruch könnte bevorstehen, die 200er wurde genommen.
Der Chart sieht richtig gut, Ausbruch könnte bevorstehen, die 200er wurde genommen.

Antwort auf Beitrag Nr.: 66.852.856 von bcgk am 05.02.21 22:52:23200er wurde locker einkassiert, jetzt gehts um die $8.50. Die müssen überwunden werden.
Antwort auf Beitrag Nr.: 66.885.395 von bcgk am 08.02.21 17:27:12
Würde sagen, läuft auch.
Zitat von bcgk: 200er wurde locker einkassiert, jetzt gehts um die $8.50. Die müssen überwunden werden.
Würde sagen, läuft auch.
CTMX hatte in der Vergangenheit immer wieder drastische heftige Anstiege im zweistelligen Prozentbereich. Nun kann man an der Börse leider nicht von Vergangenheit auf Zukunft schließen. Der Freefloat jedoch ist relativ gering, weshakb selbst kleine Handelsmengen große Kursbewegung verursachen. Könnte mir vorstellen das CTMX bis 11. Februar (McCarthy spricht auf Gugenheim Healthcare Talks 2021) in Bereich 12-20USD hoch marschiert. Aber wenn die Ergebnisse dann nicht gefallen, dann back to black.
Grüße
JM
Grüße
JM
CTMX hatte in der Vergangenheit immer wieder drastische heftige Anstiege im zweistelligen Prozentbereich. Der Freefloat ist relativ gering, weshalb selbst kleine Handelsmengen große Kursbewegung verursachen. Könnte mir vorstellen das CTMX bis 11. Februar (McCarthy spricht bei Gugenheim Healthcare Talks 2021) CTMX locker bis 12-16 USD durch marschiert. Aber wenn die Ergebnisse nicht gefallen dann gute Nacht.
Grüße
JM
Grüße
JM
Charttechnisch sieht das sehr gut aus, denke auch dass es hier zügig an das Hoch bei $15 laufen kann. Auch fundamental halte ich das für vertretbar.
Antwort auf Beitrag Nr.: 66.885.395 von bcgk am 08.02.21 17:27:12
8.50 geknackt, Re-Test bestanden und wieder hoch. Bilderbuch!!!
Zitat von bcgk: 200er wurde locker einkassiert, jetzt gehts um die $8.50. Die müssen überwunden werden.
8.50 geknackt, Re-Test bestanden und wieder hoch. Bilderbuch!!!
Doppelpost löschen lassen.
CTMX hatte in der Vergangenheit immer wieder drastische heftige Anstiege im zweistelligen Prozentbereich. Nun kann man an der Börse leider nicht von Vergangenheit auf Zukunft schließen. Der Freefloat jedoch ist relativ gering, weshalb selbst kleine Handelsmengen große Kursbewegung verursachen. Könnte mir vorstellen das CTMX bis 11. Februar (McCarthy spricht auf Gugenheim Healthcare Talks 2021) in Bereich 12-16USD hoch marschiert. Aber wenn die Ergebnisse dann nicht gefallen, dann back to black.
Grüße
JM
CTMX hatte in der Vergangenheit immer wieder drastische heftige Anstiege im zweistelligen Prozentbereich. Nun kann man an der Börse leider nicht von Vergangenheit auf Zukunft schließen. Der Freefloat jedoch ist relativ gering, weshalb selbst kleine Handelsmengen große Kursbewegung verursachen. Könnte mir vorstellen das CTMX bis 11. Februar (McCarthy spricht auf Gugenheim Healthcare Talks 2021) in Bereich 12-16USD hoch marschiert. Aber wenn die Ergebnisse dann nicht gefallen, dann back to black.
Grüße
JM
bin vorgestern bei 8,9 dollar mit kleinem verlust raus. viel glück allen investierten.
Antwort auf Beitrag Nr.: 67.179.744 von ciel34 am 24.02.21 16:09:54https://ir.cytomx.com/news-releases/news-release-details/cyt…
Bin hier im Zuge meiner aktuellen Verkaufsstrategie mit der Hälfte mit rund 25% Rendite raus. Es dürfte jetzt erstmal ruhiger werden, im Spätsommer kann man dann wieder etwas genauer hinsehen und ggf. aufstocken.
Bin hier im Zuge meiner aktuellen Verkaufsstrategie mit der Hälfte mit rund 25% Rendite raus. Es dürfte jetzt erstmal ruhiger werden, im Spätsommer kann man dann wieder etwas genauer hinsehen und ggf. aufstocken.
Nutze hier die Dips um meine Position zu erweitern. In den letzten Wochen hat sich ein schöner Range zwischen 6 USD und 9 USD gebildet. Unterstützung mehrfach getestet bei 5.6 USD. Aber es stimmt wohl, bis Ende Frühjahr wird wohl nicht viel Neues kommen. Daher schön zu sehen wie stabil der Kurs bleibt trotz der hohen Vola im Markt.
Gruß
JM
Gruß
JM
Jeffries Analyst Matthew Andrews wechselt von hold auf buy rating. PT 14USD. Der gleiche Analyst hatte 2017-19 mit Steigerung der PT von 12 bis 25 USD recht nah die danach sich ergebende Kurse getroffen.
Wie geplant hat sich CTMX nun in einen Aufwärtstrend begeben, startend ab dem sich ausgebildeten Unterstützung bei 6,5 USD, könnte die Aktie bis Spätsommer bis in den Bereich 12-15USD hoch laufen. Erfreulich in diesem sich drehenden Marktumfeld. Die Cashdecke von CTMX dürfte auch Value Investoren nicht abhalten, im Gegensatz zu teils stark verschuldeten Growth Werten.
Gruß
JM
Wie geplant hat sich CTMX nun in einen Aufwärtstrend begeben, startend ab dem sich ausgebildeten Unterstützung bei 6,5 USD, könnte die Aktie bis Spätsommer bis in den Bereich 12-15USD hoch laufen. Erfreulich in diesem sich drehenden Marktumfeld. Die Cashdecke von CTMX dürfte auch Value Investoren nicht abhalten, im Gegensatz zu teils stark verschuldeten Growth Werten.
Gruß
JM
Antwort auf Beitrag Nr.: 67.570.218 von Jerry_Maguire am 23.03.21 17:24:35
JP Morgan hat sich dem angeschlossen:
https://thefly.com/landingPageNews.php?id=3273847&headline=C…
Zitat von Jerry_Maguire: Jeffries Analyst Matthew Andrews wechselt von hold auf buy rating. PT 14USD. Der gleiche Analyst hatte 2017-19 mit Steigerung der PT von 12 bis 25 USD recht nah die danach sich ergebende Kurse getroffen.
Wie geplant hat sich CTMX nun in einen Aufwärtstrend begeben, startend ab dem sich ausgebildeten Unterstützung bei 6,5 USD, könnte die Aktie bis Spätsommer bis in den Bereich 12-15USD hoch laufen. Erfreulich in diesem sich drehenden Marktumfeld. Die Cashdecke von CTMX dürfte auch Value Investoren nicht abhalten, im Gegensatz zu teils stark verschuldeten Growth Werten.
Gruß
JM
JP Morgan hat sich dem angeschlossen:
https://thefly.com/landingPageNews.php?id=3273847&headline=C…
Mir ist es trotz intensiver Recherche bis jetzt noch nicht gelungen eine Zusammenfassung des gestrigen CytomX Virtual Investor Event zu finden oder auch den Webcast zu finden. Wenn ich mir den Kurs so anschaue, scheint nicht viel dabei Verwertbares gesagt worden zu sein. Es sollte der Status der ADCs CX2009 und CX2029 Phase 2 Studien präsentiert werden.
Gruß
JM
Gruß
JM
Eine überarbeitet (03/21) Corporate Profile Präsentation gibt es:
https://ir.cytomx.com/static-files/71f8984c-b076-4f48-beae-9…
Gruß
JM
https://ir.cytomx.com/static-files/71f8984c-b076-4f48-beae-9…
Gruß
JM
Wir dürften uns auf NC Niveau bewegen.
Antwort auf Beitrag Nr.: 67.785.143 von Hitman2 am 12.04.21 20:33:53NC=net cash?
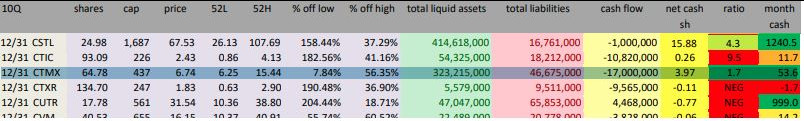
Danach gab es im Januar aber noch die Emission die nochmal 80 Mio USD? gebracht hatte. Daher nicht ganz präzise. Aber ja in dem Biotech Massaker hat CTMX auch gelitten. Aber steht aber im Vergleich zu anderen Biotech Titeln noch ganz gut da.
Spätestens bei 6,3 USD dürfte ein Boden sein.
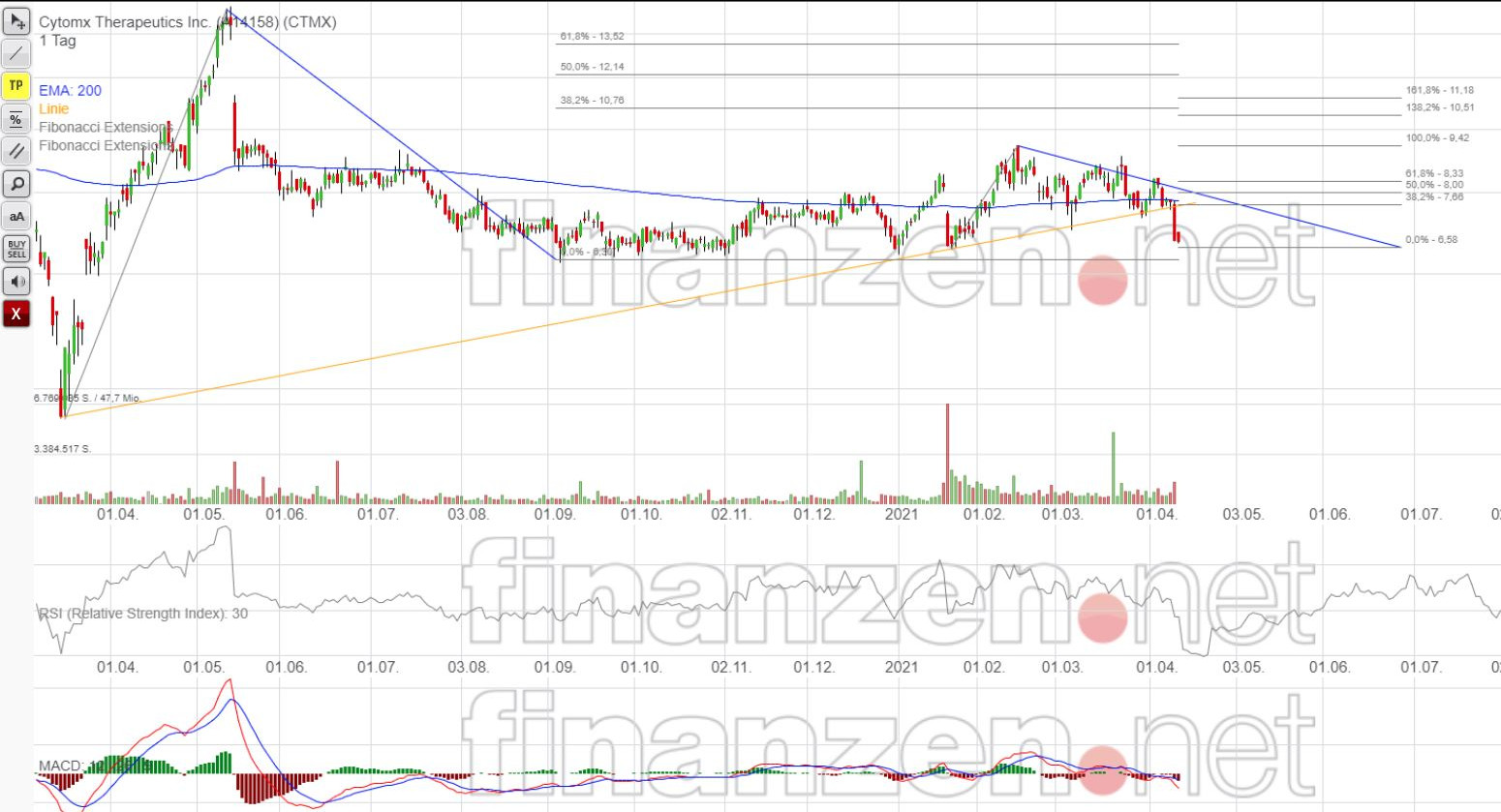
Gruß
JM

Danach gab es im Januar aber noch die Emission die nochmal 80 Mio USD? gebracht hatte. Daher nicht ganz präzise. Aber ja in dem Biotech Massaker hat CTMX auch gelitten. Aber steht aber im Vergleich zu anderen Biotech Titeln noch ganz gut da.
Spätestens bei 6,3 USD dürfte ein Boden sein.

Gruß
JM
Morningstar per Tageskerze gestern. Chartbild und Stochastik sehr hohe Wahrscheinlichkeit das der CytomX Kurs sich innerhalb diese Woche wieder bis oberhalb 7,5 USD+ zurück finden könnte. Oberhalb dieser Marke taucht der Kurs dann wieder in einen 12 Monate Aufwärtstrend ein. Gestrige Bewegung mit leicht überdurchnittlichem Volumen. CTMX ist zwar eine relativ Volumen schwache (AVG 1 MIO pd) Aktie aber beginnend mit dem Einstieg von Point 72 Anfang des Jahres hat sich das INteresse und Volumen schon vergrößert. Point72 hat sich für 7 USD eingekauft. Ich rechne immer noch damit das wir dieses Jahr trotz Biotech Massaker noch eine ordentliche Aufwärtsbewegung hier erleben werden.
Gruß
JM
Gruß
JM
Antwort auf Beitrag Nr.: 67.798.223 von Jerry_Maguire am 13.04.21 17:28:1377,8% der Aktien von Cytomx sind in der Hand von Institutionellen Investoren und Hedgefunds. In Anbetracht der Rotationen im Markt ist es imo ein einigermaßen starkes Signal, das CYTOMX ohne irgendwelche Nachrichten wie prognostiziert schnell wieder oberhalb der 7,5 USD notiert. Heute bereits wieder bis 8,35 USD wenn auch nur mit 30% des durchschnittlichen Intraday Volumens in diesem Jahr. Geschuldet wohl einer schwachen Erholung im Biotech Sektor.
Will das nicht zu inflationär verteilen, mach es aber:
Der Insider mit dem 275 T Aktienpacket bonus hat hier mit 6,74 USD Ausführungspreis die besseren Optionen:
https://ir.cytomx.com/news-releases/news-release-details/cyt…
Gruß
JM
Will das nicht zu inflationär verteilen, mach es aber:

Der Insider mit dem 275 T Aktienpacket bonus hat hier mit 6,74 USD Ausführungspreis die besseren Optionen:
https://ir.cytomx.com/news-releases/news-release-details/cyt…
Gruß
JM
Noch eine recht gute, wenn auch kurze Lageerfassung von Mara Goldstein, Canto Fitzgerald vom 8.4:
https://www.streetinsider.com/Analyst+Comments/CytomX+Therap…
Ausgehend von einem Key Opinion Leader event, ich nehme an es handelt sich um das CytomX Virtual Investor Event vom 7.4., wird zusammenfassend von unzureichender Datenlage gesprochen um abschließend die Ausprägung der TRAE für CX2009 abzuschätzen. Die Datenlage wird allgemein für CX2029 noch als unzureichend gesehen, um den therapeutischen Erfolg voll abzuschätzen. Da man immer mehr auf Brustkrebs abzielt dürften hier nicht nur Investoren gespannt auf Ergebnisse in Q4/2021 warten.
Gruß
JM
https://www.streetinsider.com/Analyst+Comments/CytomX+Therap…
Ausgehend von einem Key Opinion Leader event, ich nehme an es handelt sich um das CytomX Virtual Investor Event vom 7.4., wird zusammenfassend von unzureichender Datenlage gesprochen um abschließend die Ausprägung der TRAE für CX2009 abzuschätzen. Die Datenlage wird allgemein für CX2029 noch als unzureichend gesehen, um den therapeutischen Erfolg voll abzuschätzen. Da man immer mehr auf Brustkrebs abzielt dürften hier nicht nur Investoren gespannt auf Ergebnisse in Q4/2021 warten.
Gruß
JM
Schönes Reversal bei CTMX bis knapp unter 8,96 USD gestern. Technisch wäre noch bis 9,39 bzw. 10,49 USD Luft. Allerdings muss man wohl im heute zu erwartenden Umfeld hier mit Rücksetzern rechnen.
Zu dem angesprochenen Hervorheben der TRAE bei den beiden Pipelines von CX2009, CX2029 auf dem KOL von dem man an verschiedenen Stellen liest, habe ich mir noch Folgendes gedacht. CTMX hat nach dem drastischen Absturz von 14 USD nach dem ASCO Meeting 2020 Mitte/Ende 2020 eine erfolglose Welle von Klageversuchen erlebt. Der Vorwurf lautete seitens der Klageschriften, dass die TRAE nicht in vollem Umfang dargestellt wurden und damit Investoren getäuscht werden sollten. Imo war das relativ haltlos, da das Management tatsächlich zwar eine eher positive Darstellung der Datenlaage vorgenommen hat, aber nicht notwendige Details aktiv unterschlagen hat. Nun scheint man daher die Level der TRAE der verschiedenen Pipelines aktiver hervor zu kehren auf diesen Events. Das kann natürlich den Kurs unnötig belasten. Fundamental (Cash+Assets) dürfte der Kurs tatsächlich sogar noch oberhalb des Analystenkonsens bei 14-16 USD liegen. Gerade im Bezug auf die Bispezifischen Antikörper die in Kooperation mit Astellas entwickelt werden sollen, ergab eine Patenrecherche doch einige Bewegung mit großem Potential. Dazu später mal mehr.
Gruß
JM
Gruß
JM
Zu dem angesprochenen Hervorheben der TRAE bei den beiden Pipelines von CX2009, CX2029 auf dem KOL von dem man an verschiedenen Stellen liest, habe ich mir noch Folgendes gedacht. CTMX hat nach dem drastischen Absturz von 14 USD nach dem ASCO Meeting 2020 Mitte/Ende 2020 eine erfolglose Welle von Klageversuchen erlebt. Der Vorwurf lautete seitens der Klageschriften, dass die TRAE nicht in vollem Umfang dargestellt wurden und damit Investoren getäuscht werden sollten. Imo war das relativ haltlos, da das Management tatsächlich zwar eine eher positive Darstellung der Datenlaage vorgenommen hat, aber nicht notwendige Details aktiv unterschlagen hat. Nun scheint man daher die Level der TRAE der verschiedenen Pipelines aktiver hervor zu kehren auf diesen Events. Das kann natürlich den Kurs unnötig belasten. Fundamental (Cash+Assets) dürfte der Kurs tatsächlich sogar noch oberhalb des Analystenkonsens bei 14-16 USD liegen. Gerade im Bezug auf die Bispezifischen Antikörper die in Kooperation mit Astellas entwickelt werden sollen, ergab eine Patenrecherche doch einige Bewegung mit großem Potential. Dazu später mal mehr.
Gruß
JM
Gruß
JM
Mal schauen wie es diese Woche weitergeht. Vielleicht Richtung 10 USD.
Sieht gut aus heute.
Antwort auf Beitrag Nr.: 67.952.258 von Hitman2 am 26.04.21 17:37:42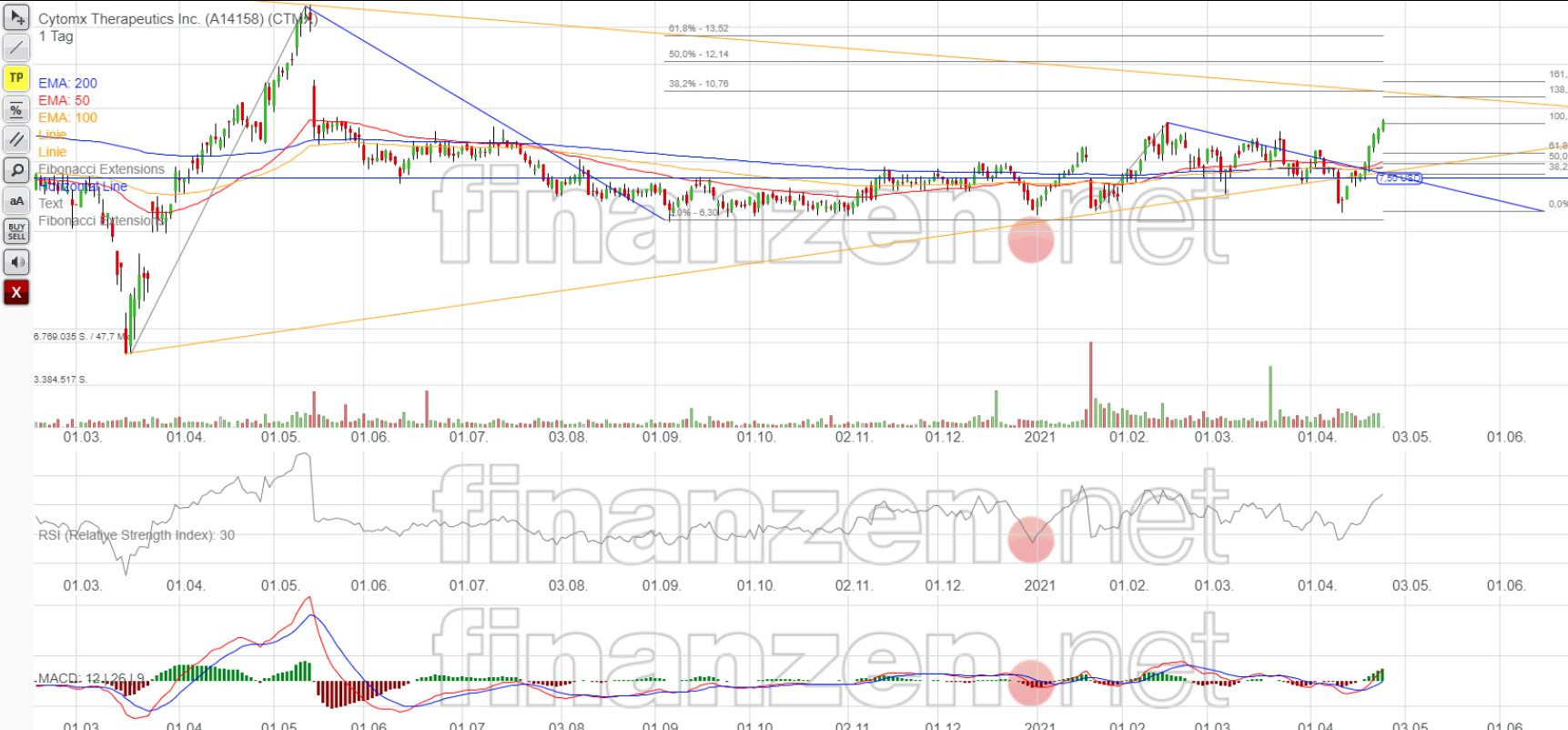
Schon ein schöner Upmove, wie vermutet mit großem Momentum nach kreuzen der Aufwärtstrendlinie. 6 Aufwärts Tageskerzen in Folge. Leider mit etwas unterdurchschnittlichem Volumen. Die Aktie nun auf dem Niveau vom 16.2. angekommen. Wahrscheinlicher ist es, dass es in eine Seitwärtsbewegung übergeht. Insgesamt ist Healthcare einer der wenigen Sektoen die im S&P auch in den letzten Tagen grün waren.
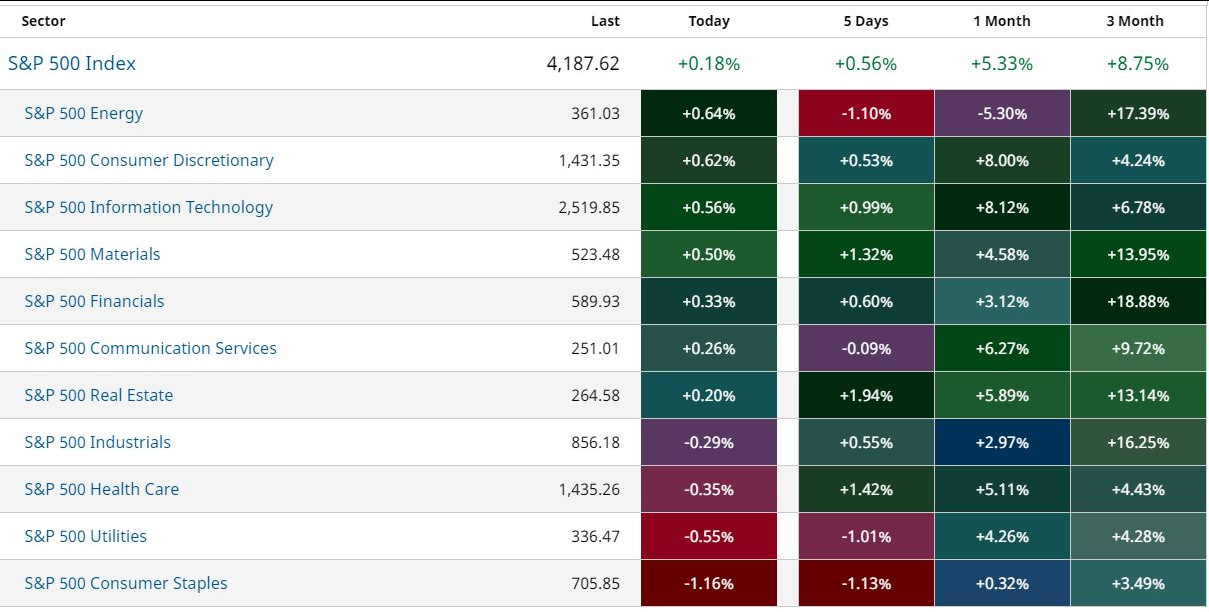
Schön wäre es wenn sich die CytomX Aktie in den nächsten Handelstagen über das Niveau des 138er Fibo Extension und damit den Abwärtstrend bei 10,49 USD schwingen kann. Dies wäre ein klar bullisches Signal und würde wohl doch einige große Fische in den Tümpel locken.
Gruß
JM
Keine Investempfehlung. Beitrag dient der Unterhaltung.

Schon ein schöner Upmove, wie vermutet mit großem Momentum nach kreuzen der Aufwärtstrendlinie. 6 Aufwärts Tageskerzen in Folge. Leider mit etwas unterdurchschnittlichem Volumen. Die Aktie nun auf dem Niveau vom 16.2. angekommen. Wahrscheinlicher ist es, dass es in eine Seitwärtsbewegung übergeht. Insgesamt ist Healthcare einer der wenigen Sektoen die im S&P auch in den letzten Tagen grün waren.
Schön wäre es wenn sich die CytomX Aktie in den nächsten Handelstagen über das Niveau des 138er Fibo Extension und damit den Abwärtstrend bei 10,49 USD schwingen kann. Dies wäre ein klar bullisches Signal und würde wohl doch einige große Fische in den Tümpel locken.
Gruß
JM
Keine Investempfehlung. Beitrag dient der Unterhaltung.
Gestern seitwärts und heute vielleicht ein neuer Anlauf auf die 10 USD.
Antwort auf Beitrag Nr.: 67.974.527 von Hitman2 am 28.04.21 11:42:33Sehr wahrscheinlich. Vorbörslich bereits bei 9,70. Gestern gab es bei dieser Marke volumenstarke Abverkäufe, die am Ende zu einem kleinen Indtraday Selloff geführt haben. Am Abend auch noch mal paar größere Volumen bei 9,5 USD rausgehauen. Wenn das sich nachhaltig über 9,70 halte ich es für möglich, dass wir die 10 USD diese Woche noch sehen.
Gruß
JM
Gruß
JM
Wundert mich das hier anscheinend keiner invsetiert ist.
Antwort auf Beitrag Nr.: 67.980.242 von Hitman2 am 28.04.21 18:56:24
ein paar Leute schon 😉
Zitat von Hitman2: Wundert mich das hier anscheinend keiner invsetiert ist.
ein paar Leute schon 😉
Wow, jetzt sind die 10$ erreicht. Bin eher zufällig auf diese Aktie gestoßen. Healthcare ist ohnehin ein spannender Markt.
Ich würde sagen es läuft. Das mittlere Kursziel der Analysten liegt soweit ich es weiss bei 13,28 USD
Mal sehen. Wenig Volumen heute. Das ganze ohne irgendwelche News oder Events. Wichtig den SL nun eng nachzuziehen. Wobei ich an sich darauf spekuliere, das wir uns bis in den Frühsommer den Analysten Estimates annähern werden.
Grüße
JM
Grüße
JM
Antwort auf Beitrag Nr.: 67.981.457 von Hitman2 am 28.04.21 20:21:45Hier ist etwas, das Sie vielleicht interessieren könnte: - https://de.investing.com/news/stock-market-news/2-gesundheit…
Antwort auf Beitrag Nr.: 67.981.994 von bullish1969 am 28.04.21 21:11:35Danke, klingt gut. Mal sehen was der Kurs bis zum Wochenende macht.
Am 6 Mai gibt es die Finanzzahlen für das erste Quartal 2021
Antwort auf Beitrag Nr.: 67.995.707 von Hitman2 am 29.04.21 20:53:38Die Entwicklung der Pipeline dürfte wichtiger sein.
Antwort auf Beitrag Nr.: 67.996.979 von tupper am 29.04.21 22:43:44Bis Ende des Jahres dürften wir einige News zu der Pipeline erfahren.
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Kopie aus fremden Medien- bitte nachlesen unter 9.5. Nutzungsbedingungen: "Wie zitiere ich richtig"
Antwort auf Beitrag Nr.: 68.095.334 von 007coolinvestor am 07.05.21 07:52:04Bei den Finanzzahlen gab es wie zu erwarten wenig bemerkenswertes. Die Cashburnrate könnte man erwähnen. Müsste man ausgehend von Cashbestand Ende 12/2020 plus 108 Mio USD Kapitalerhöhung also 424,1 Mio USD einen Verbrauch von Cash von 30,3 Mio USD in einem Quartal hoch finden ? Annualisiert wären das immerhin 121,2 Mio USD. Jedoch berücksichtigt dies nicht die noch anstehenden Meilensteinzahlungen. Also akzeptabel. Umsatz generell gesunken. Aber wie hier bereits erwähnt werden die Ergebnisse der pipelines wichtiger sein. EInen kleinen Hinweis gab es das die Kooperation mit Astellas auf gutem Weg ist. Hier könnte dann in 07/2021 eine größere Meilensteinzahlung anstehen. Fundamental hat sich imo nicht viel geändert.
Charttechnisch ist es nicht schön, aber immerhin noch der Aufwärtstrend intakt. Ausgehend von einem Zwischenhoch bei 10 USD gab es eine Abverkaufswelle bis gestern Tagestief 8,10 USD. Ein Boden könnte sich beim 50% Retracement bei 7,96 USD finden. EMA 200/100/50 liegen relativ dicht zusammen. Positiv wäre wenn spätestens bei 7,90 USD wieder ein Rebound und Bewegung nach oben statt findet. Möglich wäre jedoch auch dass ein Gap aus Januar zwischen 7,96 und 7,5 noch geschlossen werden will, ich halte es jedoch für Wahrscheinlich, dass sich vorher bereits Käufer finden werden. Bemerkenswert im Vergleich zu den vergangenen Jahren ist das stark zunehmende Handelsvolumen, wie gestern bei im Schnitt 1,05 Mio gehandelten Aktien.
Gruß
JM

Charttechnisch ist es nicht schön, aber immerhin noch der Aufwärtstrend intakt. Ausgehend von einem Zwischenhoch bei 10 USD gab es eine Abverkaufswelle bis gestern Tagestief 8,10 USD. Ein Boden könnte sich beim 50% Retracement bei 7,96 USD finden. EMA 200/100/50 liegen relativ dicht zusammen. Positiv wäre wenn spätestens bei 7,90 USD wieder ein Rebound und Bewegung nach oben statt findet. Möglich wäre jedoch auch dass ein Gap aus Januar zwischen 7,96 und 7,5 noch geschlossen werden will, ich halte es jedoch für Wahrscheinlich, dass sich vorher bereits Käufer finden werden. Bemerkenswert im Vergleich zu den vergangenen Jahren ist das stark zunehmende Handelsvolumen, wie gestern bei im Schnitt 1,05 Mio gehandelten Aktien.
Gruß
JM
Antwort auf Beitrag Nr.: 68.098.196 von Jerry_Maguire am 07.05.21 10:35:26Das sieht doch eigentlich alles ganz gut aus, hier braucht man wahrscheinlich etwas Geduld.
 Nach der großen Abverkaufswelle bei Biotech hat auch CTMX etwas herbe Rücksetzer gezeigt. Charttechnisch ist jedoch alles noch im grünen Bereich. Das durchschnittliche Handelsvolumen hat sich in den letzten Wochen auf knapp 1,1 Mio pro Tag verdoppelt. (letztes Jahr gleicher Zeitraum 520 Tausend) Warum ist es interessant? Der Chart kann besser technisch analysiert werden, wobei natürlich immer fundamentale Daten wie Ergebnisse zu den Pipelines überwiegend Einfluss haben werden.
Nach der großen Abverkaufswelle bei Biotech hat auch CTMX etwas herbe Rücksetzer gezeigt. Charttechnisch ist jedoch alles noch im grünen Bereich. Das durchschnittliche Handelsvolumen hat sich in den letzten Wochen auf knapp 1,1 Mio pro Tag verdoppelt. (letztes Jahr gleicher Zeitraum 520 Tausend) Warum ist es interessant? Der Chart kann besser technisch analysiert werden, wobei natürlich immer fundamentale Daten wie Ergebnisse zu den Pipelines überwiegend Einfluss haben werden.
Mit einer langen weißen (grünen) Kerze hat sich der Kurs am 11.5. wieder über den EMA 200 geschwungen. Der Anstieg ist relativ flach aber immerhin. Damit scheint sich der dieser 200 Tage MIttelwert nun als neue Unterstützung darzustellen. D.h. bei rund 7,93 USD bieten sich gute EInstiegsmöglichkeiten für die Ziele ab Sommer um 14-16 USD. Eine größere UNterstützung (SL) liegt bei 7,5 USD.
Gruß
JM
Antwort auf Beitrag Nr.: 68.218.219 von Jerry_Maguire am 17.05.21 18:00:41Ich bin auch postiv gestimmt das wir im Sommer Kurse um die 14 USD sehen werden.👍
CytomX Therapeutics präsentiert sich auf der Jefferies Virtual Healthcare Conference
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://seekingalpha.com/news/3701213-iterum-keeps-rising-ev…
CytomX cut to underweight citing better opportunities elsewhere in coverage
Noting the better upside potential of its stocks rated overweight and equal weight, Barclays analysts Peter Lawson and Mitchell Kapoor have downgraded CytomX Therapeutics (NASDAQ:CTMX) to underweight from equal weight.
The price target lowered by $2.00 to $7.00 per share implies a downside of ~14.5%, and CytomX has lost ~3.5% in the pre-market so far.
Despite the positive views on the company’s therapeutics based conditionally activated antibody-drug conjugate (ADC), and their upcoming data readouts in Q4 2021, “we believe catalysts from our OW and EW rated stocks are better de-risked and could drive better upside,” analysts wrote.
CytomX’s anticipated milestones for Q4 2021 include initial data reads from praluzatamab ravtansine (CX-2009) and CX-2029 both of which are in Phase 2 studies targeting late-stage cancers.
CytomX cut to underweight citing better opportunities elsewhere in coverage
Noting the better upside potential of its stocks rated overweight and equal weight, Barclays analysts Peter Lawson and Mitchell Kapoor have downgraded CytomX Therapeutics (NASDAQ:CTMX) to underweight from equal weight.
The price target lowered by $2.00 to $7.00 per share implies a downside of ~14.5%, and CytomX has lost ~3.5% in the pre-market so far.
Despite the positive views on the company’s therapeutics based conditionally activated antibody-drug conjugate (ADC), and their upcoming data readouts in Q4 2021, “we believe catalysts from our OW and EW rated stocks are better de-risked and could drive better upside,” analysts wrote.
CytomX’s anticipated milestones for Q4 2021 include initial data reads from praluzatamab ravtansine (CX-2009) and CX-2029 both of which are in Phase 2 studies targeting late-stage cancers.
Ich halte von Meinungen der Analysten nicht das geringste. Die meisten liegen größtenteils sowieso daneben und habe eine geringe Trefferquote. Allein die Aussage in dem Text das Ihre Aktien einen besseren Aufwärtstrend haben gibt mir zu denken. Ich mach auch mal den Analyst und gehe spätestens Ende des Jahres davon aus das wir bei 14 USD stehen.
heute wieder rein bei 7,62 euro. war zu verlockend, schau ma mal.
20% Minus vom Hoch, das ist im Moment schon heftig.
Antwort auf Beitrag Nr.: 68.340.734 von ciel34 am 28.05.21 20:50:29Nabend,
CTMX die letzten Tage stark unter Druck und damit charttechnisch auch stark angeschlagen. Wichtige Unterstützungen bei 7,7 und 7 USD wurden unterlaufen. Aktuell notiert CTMX mit 6,86 schon sehr nah an seinem 52 Wochen Tief bei 6,25 USD. Fundamental gibt es nicht viel neues. Am 3.6. kommt die Präsentation auf der Jeffreys HC Conference. Aber auch hier erwarte ich nichts Bahnbrechendes. Als Grund könnte man noch eine Herabstufung durch Barclay mit Ziel 7USD finden. Das ist es aber nicht alleine. CTMX ist das Ziel von Shortsellern geworden. In den letzten 22 Handelstagen ist die Short % Float auf heute 12,3 % (6,73 Mio leer verkaufte Aktien) angestiegen. Das ist schon recht ordentlich für einen Small Cap. Wiederrum wird es aber dazu führen, dass nach der Abwärtsbewegung nun ein relativ sprunghafter Anstieg demnächst folgen wird, spätestens wenn Anschlusskäufer die Shortseller in die Deckungskäufe zwingen. Natürlich kann man vom aktuellen Niveau recht zuverlässig darauf spekulieren, da CTMX mit seinem aktuellen Marketcap von 445 Mio USD nur noch 110 Mio USD unter seinem Cash Bestand notiert. In Anbetracht der zu erwartenden Meilensteinzahlung und der verschiedenen Pipelines, fragt man sich wer die Herren von Barclays bezahlt hat CTMX auf Talfahrt zu schicken. Eine Analyse ist es jedenfalls nicht, was die beiden da gemacht haben.
Gruß
JM
CTMX die letzten Tage stark unter Druck und damit charttechnisch auch stark angeschlagen. Wichtige Unterstützungen bei 7,7 und 7 USD wurden unterlaufen. Aktuell notiert CTMX mit 6,86 schon sehr nah an seinem 52 Wochen Tief bei 6,25 USD. Fundamental gibt es nicht viel neues. Am 3.6. kommt die Präsentation auf der Jeffreys HC Conference. Aber auch hier erwarte ich nichts Bahnbrechendes. Als Grund könnte man noch eine Herabstufung durch Barclay mit Ziel 7USD finden. Das ist es aber nicht alleine. CTMX ist das Ziel von Shortsellern geworden. In den letzten 22 Handelstagen ist die Short % Float auf heute 12,3 % (6,73 Mio leer verkaufte Aktien) angestiegen. Das ist schon recht ordentlich für einen Small Cap. Wiederrum wird es aber dazu führen, dass nach der Abwärtsbewegung nun ein relativ sprunghafter Anstieg demnächst folgen wird, spätestens wenn Anschlusskäufer die Shortseller in die Deckungskäufe zwingen. Natürlich kann man vom aktuellen Niveau recht zuverlässig darauf spekulieren, da CTMX mit seinem aktuellen Marketcap von 445 Mio USD nur noch 110 Mio USD unter seinem Cash Bestand notiert. In Anbetracht der zu erwartenden Meilensteinzahlung und der verschiedenen Pipelines, fragt man sich wer die Herren von Barclays bezahlt hat CTMX auf Talfahrt zu schicken. Eine Analyse ist es jedenfalls nicht, was die beiden da gemacht haben.
Gruß
JM
Antwort auf Beitrag Nr.: 68.373.794 von Jerry_Maguire am 01.06.21 23:03:02Natürlich muss es heißen ... mit seinem 445 Mio USD nur 110 Mio USD über seinem Cashbestand notiert.
Gruß
JM
Gruß
JM
Was man den Herren von Barclays bezahlt hat das habe ich mich auch schon gefragt. Die Analysten liegen in den meisten Fällen sowieso daneben und Ihre Trefferquote ist minimal, leider beeinflusst das die Kurse trotzdem.
Gestern nachgekauft zu 6.9 USD. Wieder eine ordentliche Portion Aktien. Schau ma mal...
Sehe ich das richtig das noch ein Gap zwischen 5,1 und 5,95 USD offen ist?
https://seekingalpha.com/article/4434506-checking-in-on-cyto…
Checking In On CytomX Therapeutics
Jun. 13, 2021 5:01 AM ETCytomX Therapeutics, Inc. (CTMX)
Summary
Today, we revisit CytomX Therapeutics for our first in-depth look at this small oncology name since August of 2019.
The company is well funded at the moment, has strategic partnerships and a few 'shots on goal'.
A full investment analysis and recommendation follows in the paragraphs below.
I do much more than just articles at The Biotech Forum: Members get access to model portfolios, regular updates, a chat room, and more. Learn More »
Set iv fluid intravenous drop saline drip hospital room,Medical Concept,treatment emergency and injection drug infusion care chemotherapy, concept.blue light background,selective focus stock photo
Amornrat Phuchom/iStock via Getty Images
It's easy finding reasons why other folks should be patient.”― George Eliot, Adam Bede
Today, we revisit a small oncology concern for the first time in over two and a half years. Given the time elapsed since out last in-depth look at this developmental firm, it was time for a new deep dive. A full analysis follows.
Company Overview:
CytomX Therapeutics (CTMX) is a San Francisco, California-based clinical-stage oncology-oriented biopharmaceutical company that IPO’d in 2015. The company’s pipeline is based around their Probody therapeutic design. Probody therapeutics seek to manipulate the tumor microenvironment to better localize treatment and limit the effect on healthy tissue. The therapies are designed to take advantage of high levels of protease activity in the tumor microenvironment, and masked target-binding regions limit activity in healthy tissue. When the therapeutics encounter active proteases near a tumor, they remove their masks and bind to the tumor targets, ultimately turning the disease against itself.
Overall, this new therapeutic design can create or widen the therapeutic window, enable new combinations previously not possible due to toxicities, and expand the universe of drug targets. The pipeline of Probody therapeutics consists of 9 product candidates; however, the overall pipeline is in the early innings of development. The company’s two lead product candidates are CX-2009 and CX-2029. CytomX Therapeutics currently has a market capitalization of approximately $450 million and trades for just north of $7.00 a share.
Pipeline:
Source: January Presentation
CX-2009:
CX-2009 is a Probody drug conjugate that is conjugated with DM4, targeting CD166. CD166 is a molecule widely and highly expressed on solid tumor cells and in HER2 non-amplified breast cancer. Nearly 80% of breast cancer is HER2 non-amplified. CD166 was previously considered undruggable due to its expression on normal tissues. The drug is being tested as a monotherapy in ER/PR positive, HER2 negative breast cancer, and also as a combination therapy in triple-negative breast cancer. Breast cancer is the 2nd leading cause of cancer deaths in women. It’s estimated that breast cancer is 30% of all cancer in females with roughly 276,000 new cases a year in the United States. Furthermore, approximately 42,000 women die each year in the United States. In updated Phase 1 trial results, announced at ASCO in 2020, the drug demonstrated durable clinical activity in HER2 negative breast cancer.
Source: January Presentation
Clinical activity for the program continues to progress. CytomX began enrolling patients with human epidermal growth factor receptor 2 HER2-non-amplified breast cancer into a Phase 2 multi-cohort study evaluating CX-2009 as monotherapy, and as a combination treatment paired with CX-072, a conditionally activated anti-PD-L1 antibody, in patients with triple-negative breast cancer. Initial data from the CX-2009 Phase 2 study should be available in the fourth quarter of 2021.
Source: January Presentation
CX-2029:
CX-2029 is a PDC directed against CD71. CD71 is a transferrin receptor that is highly expressed on a number of solid and hematologic tumors, as well as many normal tissues. The drug is being co-developed with AbbVie (ABBV). Traditionally, CD71 hasn’t been a keen target given its expression on normal tissues and for potentially causing toxicities. The company presented data from their initial Phase 1 trial at ASCO 2020 that validated CD71 as a first-in-class oncology target with positive clinical activity observed. Currently, CytomX is advancing CX-2029 into 4 dose-expansion cohorts in patients with head and neck cancer, squamous non-small cell lung cancer, esophageal carcinoma, and diffuse large B cell lymphoma.
Source: January Presentation
On the clinical front, patient enrollment continues in the Phase 2 expansion study evaluating CX-2029 as a single agent in four cohorts: squamous non-small cell lung cancer, head and neck squamous cell carcinoma, esophageal and gastroesophageal junction cancers, and diffuse large B-cell lymphoma. Initial data from the CX-2029 Phase 2 expansion study is projected to be available in the fourth quarter of 2021; however, not all cohorts are expected to be ready by the end of 2021. Some of the cohorts, likely from the squamous lung and head and neck cohorts, should be available this year, but initial data from the additional cohorts are anticipated in 2022.
Analyst Commentary & Balance Sheet:
As of March 31st, 2021, CytomX Therapeutics had cash and cash equivalents of roughly $330 million. Additionally, the company had short-term investments of $64 million. Research and development expenses for Q1 were $22.3 million, compared to $42.8 million in Q1 of 2020. General and administrative expenses for Q1 of 2021 were $9.2 million, compared to $9.5 million in 2020. The company generated $15.9 million in revenue for the quarter ending March 31st, 2021, compared to $49.5 million in the same quarter of 2020. The lower revenue was the result of decreased revenue from AbbVie primarily related to the $40 million milestone payment earned in March 2020 associated with the CX-2029 project and a $10 million decrease in revenue from Bristol Myers Squibb for a milestone payment earned from the CTLA-4 program.
The decrease was partially offset by Astellas, which is from recognizing the upfront payment that is a part of their collaboration and license agreement. Overall, the company had a net loss of $15.5 million for the first quarter, compared to a net loss of $12.2 million in Q1 of 2020. The most recent capital raise came on January 20th, 2021. The company announced the pricing of a $100 million public offering of common stock that consisted of 14,285,714 shares at a price per share of $7.
This stock has mixed views on Wall Street. Over the past several months, JPMorgan ($14 price target) Jefferies and Mizuho Securities ($16 price target) have either upgraded or initiated the stock as a Buy. Two weeks ago, Barclays downgraded CTMX to a Hold with a $7 price target, however.
Verdict:
The company has made some progress since we last looked at it. That said pipeline development has moved slowly and analyst price targets are down slightly since we last revisited it. The company has more than ample cash on hand and a few shots on goal. I obviously like the strategic partnerships the company enjoys with larger players.
Initial data from the praluzatamab ravtansine (CX-2009) Phase 2 study in the fourth quarter of 2021.
Initial data from the CX-2029 Phase 2 expansion study in the fourth quarter of 2021.
IND submission for CX-904 in late 2021
There are some milestones but no major catalysts on the horizon in 2021 (summary above). Given that we are still years away from potential commercialization, CTMX can't be considered for a large holding. Given the cash balance of the firm, I would kind of like this name for a covered call candidate. Unfortunately, while options are available against this equity, the lack of liquidity makes this strategy non-viable. Therefore, we are passing on any investment recommendation on CTMX at this time.
Time doesn't wait for anyone, but you always have to wait for time.”― anonymous
Bret Jensen is the Founder of and authors articles for the Biotech Forum, Busted IPO Forum, and Insiders Forum
Live Chat on The Biotech Forum has been dominated by discussion of lucrative buy-write or covered call opportunities on selected biotech stocks over the past several months. To see what I and the other season biotech investors are targeting as trading ideas real-time, just join our community at The Biotech Forum by clicking HERE.
This article was written by
Bret Jensen profile picture.
Bret Jensen
45.05K Followers
Author of
The Biotech Forum
Finding tomorrow's big winners in the lucrative biotech sector
http://www.bretjenseninvests.com
Specializing in biotech stocks, Small Caps, managing optimized portfolios
Contributor Since 2009
Checking In On CytomX Therapeutics
Jun. 13, 2021 5:01 AM ETCytomX Therapeutics, Inc. (CTMX)
Summary
Today, we revisit CytomX Therapeutics for our first in-depth look at this small oncology name since August of 2019.
The company is well funded at the moment, has strategic partnerships and a few 'shots on goal'.
A full investment analysis and recommendation follows in the paragraphs below.
I do much more than just articles at The Biotech Forum: Members get access to model portfolios, regular updates, a chat room, and more. Learn More »
Set iv fluid intravenous drop saline drip hospital room,Medical Concept,treatment emergency and injection drug infusion care chemotherapy, concept.blue light background,selective focus stock photo
Amornrat Phuchom/iStock via Getty Images
It's easy finding reasons why other folks should be patient.”― George Eliot, Adam Bede
Today, we revisit a small oncology concern for the first time in over two and a half years. Given the time elapsed since out last in-depth look at this developmental firm, it was time for a new deep dive. A full analysis follows.
Company Overview:
CytomX Therapeutics (CTMX) is a San Francisco, California-based clinical-stage oncology-oriented biopharmaceutical company that IPO’d in 2015. The company’s pipeline is based around their Probody therapeutic design. Probody therapeutics seek to manipulate the tumor microenvironment to better localize treatment and limit the effect on healthy tissue. The therapies are designed to take advantage of high levels of protease activity in the tumor microenvironment, and masked target-binding regions limit activity in healthy tissue. When the therapeutics encounter active proteases near a tumor, they remove their masks and bind to the tumor targets, ultimately turning the disease against itself.
Overall, this new therapeutic design can create or widen the therapeutic window, enable new combinations previously not possible due to toxicities, and expand the universe of drug targets. The pipeline of Probody therapeutics consists of 9 product candidates; however, the overall pipeline is in the early innings of development. The company’s two lead product candidates are CX-2009 and CX-2029. CytomX Therapeutics currently has a market capitalization of approximately $450 million and trades for just north of $7.00 a share.
Pipeline:
Source: January Presentation
CX-2009:
CX-2009 is a Probody drug conjugate that is conjugated with DM4, targeting CD166. CD166 is a molecule widely and highly expressed on solid tumor cells and in HER2 non-amplified breast cancer. Nearly 80% of breast cancer is HER2 non-amplified. CD166 was previously considered undruggable due to its expression on normal tissues. The drug is being tested as a monotherapy in ER/PR positive, HER2 negative breast cancer, and also as a combination therapy in triple-negative breast cancer. Breast cancer is the 2nd leading cause of cancer deaths in women. It’s estimated that breast cancer is 30% of all cancer in females with roughly 276,000 new cases a year in the United States. Furthermore, approximately 42,000 women die each year in the United States. In updated Phase 1 trial results, announced at ASCO in 2020, the drug demonstrated durable clinical activity in HER2 negative breast cancer.
Source: January Presentation
Clinical activity for the program continues to progress. CytomX began enrolling patients with human epidermal growth factor receptor 2 HER2-non-amplified breast cancer into a Phase 2 multi-cohort study evaluating CX-2009 as monotherapy, and as a combination treatment paired with CX-072, a conditionally activated anti-PD-L1 antibody, in patients with triple-negative breast cancer. Initial data from the CX-2009 Phase 2 study should be available in the fourth quarter of 2021.
Source: January Presentation
CX-2029:
CX-2029 is a PDC directed against CD71. CD71 is a transferrin receptor that is highly expressed on a number of solid and hematologic tumors, as well as many normal tissues. The drug is being co-developed with AbbVie (ABBV). Traditionally, CD71 hasn’t been a keen target given its expression on normal tissues and for potentially causing toxicities. The company presented data from their initial Phase 1 trial at ASCO 2020 that validated CD71 as a first-in-class oncology target with positive clinical activity observed. Currently, CytomX is advancing CX-2029 into 4 dose-expansion cohorts in patients with head and neck cancer, squamous non-small cell lung cancer, esophageal carcinoma, and diffuse large B cell lymphoma.
Source: January Presentation
On the clinical front, patient enrollment continues in the Phase 2 expansion study evaluating CX-2029 as a single agent in four cohorts: squamous non-small cell lung cancer, head and neck squamous cell carcinoma, esophageal and gastroesophageal junction cancers, and diffuse large B-cell lymphoma. Initial data from the CX-2029 Phase 2 expansion study is projected to be available in the fourth quarter of 2021; however, not all cohorts are expected to be ready by the end of 2021. Some of the cohorts, likely from the squamous lung and head and neck cohorts, should be available this year, but initial data from the additional cohorts are anticipated in 2022.
Analyst Commentary & Balance Sheet:
As of March 31st, 2021, CytomX Therapeutics had cash and cash equivalents of roughly $330 million. Additionally, the company had short-term investments of $64 million. Research and development expenses for Q1 were $22.3 million, compared to $42.8 million in Q1 of 2020. General and administrative expenses for Q1 of 2021 were $9.2 million, compared to $9.5 million in 2020. The company generated $15.9 million in revenue for the quarter ending March 31st, 2021, compared to $49.5 million in the same quarter of 2020. The lower revenue was the result of decreased revenue from AbbVie primarily related to the $40 million milestone payment earned in March 2020 associated with the CX-2029 project and a $10 million decrease in revenue from Bristol Myers Squibb for a milestone payment earned from the CTLA-4 program.
The decrease was partially offset by Astellas, which is from recognizing the upfront payment that is a part of their collaboration and license agreement. Overall, the company had a net loss of $15.5 million for the first quarter, compared to a net loss of $12.2 million in Q1 of 2020. The most recent capital raise came on January 20th, 2021. The company announced the pricing of a $100 million public offering of common stock that consisted of 14,285,714 shares at a price per share of $7.
This stock has mixed views on Wall Street. Over the past several months, JPMorgan ($14 price target) Jefferies and Mizuho Securities ($16 price target) have either upgraded or initiated the stock as a Buy. Two weeks ago, Barclays downgraded CTMX to a Hold with a $7 price target, however.
Verdict:
The company has made some progress since we last looked at it. That said pipeline development has moved slowly and analyst price targets are down slightly since we last revisited it. The company has more than ample cash on hand and a few shots on goal. I obviously like the strategic partnerships the company enjoys with larger players.
Initial data from the praluzatamab ravtansine (CX-2009) Phase 2 study in the fourth quarter of 2021.
Initial data from the CX-2029 Phase 2 expansion study in the fourth quarter of 2021.
IND submission for CX-904 in late 2021
There are some milestones but no major catalysts on the horizon in 2021 (summary above). Given that we are still years away from potential commercialization, CTMX can't be considered for a large holding. Given the cash balance of the firm, I would kind of like this name for a covered call candidate. Unfortunately, while options are available against this equity, the lack of liquidity makes this strategy non-viable. Therefore, we are passing on any investment recommendation on CTMX at this time.
Time doesn't wait for anyone, but you always have to wait for time.”― anonymous
Bret Jensen is the Founder of and authors articles for the Biotech Forum, Busted IPO Forum, and Insiders Forum
Live Chat on The Biotech Forum has been dominated by discussion of lucrative buy-write or covered call opportunities on selected biotech stocks over the past several months. To see what I and the other season biotech investors are targeting as trading ideas real-time, just join our community at The Biotech Forum by clicking HERE.
This article was written by
Bret Jensen profile picture.
Bret Jensen
45.05K Followers
Author of
The Biotech Forum
Finding tomorrow's big winners in the lucrative biotech sector
http://www.bretjenseninvests.com
Specializing in biotech stocks, Small Caps, managing optimized portfolios
Contributor Since 2009
CytomX Therapeutics Announces Publication of First-in-Human Data for CX-2029 in Clinical Cancer Research
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://ir.cytomx.com/news-releases/news-release-details/cyt…
CytomX
Der Kurs kommt nicht richtig in Schwung. Wie ist Eure Einschätzung wie wird sich der Kurs die nächsten Monate entwickeln?
Wenn das hier so weiter geht sehen wir ein neues 52 Wochen tief.
Vor dem 4. Quartal wird sich wahrscheinlich nichts mehr tun, da vorher keine News zu erwarten sind.
Antwort auf Beitrag Nr.: 68.618.158 von Urbi am 25.06.21 20:05:42
CytomX
Da muss ich Dir recht geben, vor dem 4 Quartal wir sich der Kurs wahrscheinlich nicht groß bewegen. Schönes Wochenende
Na da wollten jetzt aber noch viele raus an der Nasdaq kurz vor Schluss! Mal gespannt, was nächste Woche passiert. Kurs sollte nächste Woche schleunigst nach Norden gehen, sonst sieht es charttechnisch sehr schlecht aus.
Ein ganz mieses Ende heute. Der tiefste Stand jemals müsste 4,95USD gewesen sein.
6,25 USD ist das 52 Wochen tief, wenn wir darunter gehen dürfte es noch weiter abwärts gehen.
52 Wochentief geknackt🙈 wenn das so weiter geht sehen wir bald ein neues Allzeittief.
Neue Kursziele der Analysten.
https://www.americanbankingnews.com/2021/07/06/hc-wainwright…
https://www.americanbankingnews.com/2021/07/06/hc-wainwright…
Heißer turnaround Kandidat
Antwort auf Beitrag Nr.: 68.800.880 von nionus am 16.07.21 18:45:43Dann hoffen wir mal, fragt sich nur wann.
Und immer weiter abwärts, wann kommt die Wende?
Antwort auf Beitrag Nr.: 68.886.420 von Hitman2 am 27.07.21 17:25:06
Verkaufen Insider ?
Zitat von Hitman2: Und immer weiter abwärts, wann kommt die Wende?
Verkaufen Insider ?
CytomX Therapeutics präsentiert sich auf den kommenden Investorenkonferenzen im August.
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://ir.cytomx.com/news-releases/news-release-details/cyt…
Pressemitteilung von heute.
https://ir.cytomx.com/press-releases/
https://ir.cytomx.com/press-releases/
Die Mitteilung scheint nicht gut anzukommen.
ytomX Therapeutics, Inc. (CTMX) CEO Sean McCarthy on Q2 2021 Results - Earnings Call Transcript
Aug. 08, 2021 10:26 AM ETCytomX Therapeutics, Inc. (CTMX)
Q2: 2021-08-05 Earnings Summary
EPS of -$0.30 misses by $0.00 | Revenue of $16.29M (-1.93% Y/Y) misses by $673.11K
CytomX Therapeutics, Inc. (CTMX) Q2 2021 Earnings Conference Call August 5, 2021 5:00 PM ET
Company Participants
Chau Cheng - Vice President Investor Relations & Corporate Communications
Sean McCarthy - President, Chief Executive Officer & Chairman
Amy Peterson - Chief Development Officer
Carlos Campoy - Chief Financial Officer
Conference Call Participants
Anupam Rama - JP Morgan
Roger Song - Jefferies
Joe Catanzaro - Piper Sandler
Cynthia Chen - Cowen
Paul Jeng - Guggenheim
Peter Lawson - Barclays
Operator
Good afternoon, ladies and gentlemen. Thank you for standing by. Welcome to the CytomX Therapeutics' Second Quarter 2021 Financial Results Call. Please be advised that today's call is being recorded.
I would now like to hand the conference over to your host today, Chau Cheng, CytomX's Vice President Investor Relations and Corporate Communications. Please go ahead.
Chau Cheng
Thank you, Suzanne. Good afternoon and thank you for joining us. With me today are Dr. Sean McCarthy, CytomX's President, Chief Executive Officer and Chairman; Dr. Amy Peterson, Chief Development Officer; and Carlos Campoy, Chief Financial Officer.
Earlier today, we issued a press release that includes a summary of our first quarter 2021 financial results and highlights the important progress we made during the quarter. We encourage everyone to read today's press release and the associated materials, which have been filed with the SEC. Additionally, the press release and the recording of this call can be found under the Investors and News section of our website at cytomx.com.
During today's call, we will be making forward-looking statements. Because forward-looking statements relate to the future, they are subject to inherent uncertainties and risks, including the uncertainties surrounding the COVID-19 pandemic that are difficult to predict and many of which are outside of our control.
Important risks and uncertainties are set forth in our most recent public filings with the SEC at sec.gov, including our Form 10-Q filed today. We undertake no obligation to update any forward-looking statements, whether as a result of new information, future developments or otherwise.
With that, I'd like to turn the call now over to Sean.
Sean McCarthy
Thank you, Chau, and good afternoon, everyone. Thanks for joining us today for an update on recent progress and developments within our clinical and preclinical programs and operations. At CytomX, we continue to dedicate ourselves to working towards making a meaningful difference in cancer treatment by being different and thinking differently.
We have pioneered an entirely new way to design therapeutic antibodies and other biologic modalities and we have used our technology to purposefully go after high potential targets that were previously considered undruggable in order to stand out from the crowd and build long-term value. We are exploiting an Achilles heel of tumor biology to combat cancer in new and unique ways.
Our technology the Probody platform is a conditional activation strategy that uses protease-dependent peptide market. Given that proteases are activated in the tumor microenvironment but tightly controlled in normal tissues, our strategy is designed to reduce antibody binding in normal tissues while maximizing target binding in cancer.
During the second quarter, we continued to advance our broad pipeline of Probody therapeutics across multiple modalities and cancer types, including our two conditionally activated antibody drug conjugates or ADCs praluzatamab ravtansine, also known as CX-2009 and CX-2029, both of which are currently in Phase 2 clinical investigations encompassing multiple tumor types.
Let me begin with CX-2029, our CD71-directed conditionally-activated ADC, for which we recently published results from a Phase 1 first-in-human study in patients with advanced solid tumors. This important work by CytomX, in collaboration with our partner AbbVie, has demonstrated for the first time that CD71 can be successfully targeted with a drug conjugated antibody using our technology.
Why CD71? Well, CD71 or the transferrin receptor has been a very attractive but elusive oncology target for ADC development. It's highly expressed on the vast majority of tumors since all growing and dividing cells need iron for many metabolic processes.
And CD71 is an extremely efficient transport system fully internalizing antibodies within minutes of binding. However, CD71 was previously deemed undruggable with conventional ADCs, because it's also highly expressed in and vital to normal tissue growth and development.
As we have now published in clinical cancer research, in Phase 1 dose escalation CX-2029 was generally well tolerated and produced encouraging anti-cancer activity, notably in patients with squamous non-small cell lung and head and neck cancers, a first for an ADC against this high potential target.
These two cancer types are now part of an ongoing four cohort Phase 2 expansion study. We dosed the first patients in the expansion phase in November 2020 and then we will give you an update in a few moments on where things stand.
Moving on to praluzatamab ravtansine, our wholly-owned first in class conditionally activated ADC, directed toward another novel oncology target CD166. CD166 also known as activated leukocyte chelates molecule or ALCAM is a transmembrane lipoprotein that has been reported to play a role in multiple aspects of tumor biology including angiogenesis and invasiveness.
CD166 is highly expressed on the cell surface of many cancer types and as such, has attractive molecular properties as an ADC target. However, developing a conventional ADC against CD166 is precluded by its widespread presence on healthy tissues.
Our pioneering Phase 1 clinical work on CD166 has shown that praluzatamab can achieve clinically meaningful outcomes in patients with different cancer types, including but not limited to HER2-nonamplified breast cancer.
These results support our current three-arm Phase II study in breast cancer and we're excited about the potential for this asset in this indication, and more broadly, in other CD166-expressing cancers, where substantial unmet need remains. Amy will also provide you with more details of the design and status of the praluzatamab Phase 2 study shortly.
Turning now briefly to our work in immuno-oncology, and our partner clinical programs with Bristol Myers Squibb aimed at broadening the therapeutic window, and therefore, the clinical utility of anti-CTLA-4 immunotherapy. BMS-986249 and BMS-986288 discovered using the CytomX platform are Probody versions of different forms of the anti-CTLA-4 therapeutic category ipilimumab.
BMS-986249 having successfully completed dose escalation is currently being evaluated in a randomized Phase 2 study in combination with the anti PD-1 antibody nivolumab in patients with metastatic melanoma. Importantly, the control arm in this study is nivo plus ipilimumab rather than nivo monotherapy, representing the current standard of care based on five-year follow-up from CheckMate 067, which showed a significant increase in overall survival with this combination in melanoma over nivo monotherapy.
BMS-986249 is also being studied in combination with nivo in three additional advanced settings. It has a cellular carcinoma, castration-resistant prostate cancer and triple-negative breast cancer. BMS-986288 a Probody version of a non-fucosylated ipilimumab with increased Treg depletion properties continues to be evaluated in a Phase 1 study in advanced solid cancers as monotherapy and in combination with nivo.
Switching now to our research and preclinical programs in the field of conditionally activated T cell bispecific antibodies, we see a major opportunity here to improve the therapeutic window of this modality using our platform, and we're pursuing multiple projects with our partners Amgen and Astellas.
CX-904 is a conditionally activated T cell engaging bispecific directed against EGFR on tumor cells and CD3 on T cells. And this is in IND-enabling studies. We recently submitted a pre-IND meeting request to the FDA, and we expect written responses to our questions from the regulatory agency in the third quarter of this year. We will continue to discuss the program with our partner Amgen and we're working towards the filing of an IND for CX-904 in late 2021.
Q2 was also highly productive for CytomX in terms of publication of our work in peer-reviewed journals. A total of five manuscripts were recently published covering our work that ranges from Phase 1 investigation of CX-2029, as I already mentioned, to multiple publications describing our clinical work, with pacmilimab or CX-072 our wholly-owned conditionally activated antibody against PD-L1.
Of particular note, our recent collaborative work with Dr. Elisabeth de Vries of the University Medical Centre Groningen in the Netherlands has investigated the biodistribution of pacmilimab in cancer patients using clinical imaging. This study has shed important light on the molecular performance of the Probody platform in cancer patients, including the direct demonstration of activation and binding of pacmilimab to primary and metastatic tumors.
Another recent publication of particular note is our landmark preclinical study of a Probody immuno-oncology agonist in the proceedings of the National Academy of Sciences. As you will recall, we introduced earlier this year our advancement of our conditional activation technology into the cytokine space. This recent PLS paper takes things even further, as the first published application of the CytomX platform to agonist antibodies in immuno-oncology, emphasizing the versatility of our platform.
Specifically, together with our collaborators we have shown in this publication that an anti-CD137 Probody retains potent antitumor activity, with significantly reduced liver toxicity compared to an unmasked antibody, when assessed in the same mass model system. This is exactly, what our platform is designed to do. The paper also includes extensive characterization of Probody activation by tumor-specific.
Taken together these publications underscore the immense progress we've made across our pipeline and platform, with our first generations of Probody therapeutics, a field that CytomX has defined and continues to lead and we continue to innovate on the core platform and across many therapeutic modalities.
Let me now hand the call over to Amy for additional detail and updates on our new clinical programs.
Amy Peterson
Thanks, Sean. I'll start with a quick recap of the design for our Phase 2 studies of CX-2029 and praluzatamab. For CX-2029 in collaboration with AbbVie, we continue to enroll patients into the expansion phase of the Phase 1/2 study designed to evaluate the CD71-directed, conditionally activated ADC in four different cohorts: squamous non-small cell lung cancer, head and neck squamous cell carcinoma, esophageal and gastroesophageal junctional cancer and disease like B-cell lymphoma. Each cohort aims to enroll up to 25 efficacy evaluable patients and we continue to expect initial data from the expansion phase of the study in the fourth quarter of this year.
Switching to CX-2009 or praluzatamab ravtansine, we are evaluating the CD166 directed conditionally activated ADC as monotherapy in patients with HER2 non-amplified breast cancer, which includes hormone receptor positive Arm A, and triple-negative breast cancer Arm B. We are also evaluating the combination with our proprietary anti-PD-L1 therapeutic pacmilimab in patients with triple-negative disease in Arm C. The goal is to reach 40 efficacy evaluable patients in each of these arms. And the primary endpoint of this study is overall response rate according to resist.
Secondary endpoints include duration of response and clinical benefit rate at 24 weeks, the latter being particularly an important metric for the hormone receptor positive subtype as a reasonable surrogate to support progression-free survival endpoints in future studies. Enrollment is ongoing. However, our accrual rate for our fourth quarter 2021 initial data readout has been slower than expected, due primarily to the widespread effect of the COVID-19 pandemic on site activation and on patient enrollment.
The praluzatamab Phase II study is a new trial, requiring de novo site activation and this has proven particularly challenging in the current environment. As such we now anticipate initial data from this study in 2022. Notwithstanding the COVID-19 challenges we continue to implement ways to help improve the pace of patient enrollment including opening additional sites in the US, Europe and Asia as well as partnering with patient advocacy groups to encourage enrollment from underrepresented population, given the fact that triple-negative breast cancer is more prevalent in minority women.
We are excited about the opportunity for praluzatamab in breast cancer and I would like to take a few moments to look ahead to where this unique drug candidate has the potential to fit into the treatment landscape. Recall that historically breast cancer has been divided into three major subtypes and treatments have been developed accordingly.
ER/PR positive, which is responsive to just hormonal therapy; HER2-amplified, which is responsive to HER2-targeted therapies; and triple-negative breast cancer, named not for what it is but rather what it is not and is therefore heterogeneous grouping.
Before turning the call over to Carlos to review our financials, I want to point out that in our Phase II study effectively, we are evaluating praluzatamab in HER2 non-amplified breast cancer, an emerging classification that combines hormone receptor positive with triple-negative breast cancer and represents approximately 80% of all breast cancer and includes those that express both low and no levels of HER2 by IHC. It's also important to note that CD166 expression is found across all of these subclassifications of breast cancer and thus CX-2009 represents a significant opportunity.
Carlos Campoy
Thank you, Amy. With $366 million in cash, cash equivalents and investments, as of June 30 2021, CytomX remains well capitalized to support our bold clinical and research agenda that will drive the growth of the company well into 2023. Revenue was $16 million for the second quarter of 2021, relatively flat when compared to the corresponding period in 2020.
R&D expenses increased $2 million to $26 million, during the three months ended in June 30 2021, compared to the corresponding period in 2020. The increase was driven mainly by planning of manufacturing and translational science activities. G&A expenses were $9 million for Q2 2021, essentially flat compared to the second quarter of 2020.
With that I'll turn the call back to Sean.
Sean McCarthy
Thanks, Carlos and thanks to everyone for joining us today. To briefly recap, CytomX continued to make broad progress in Q2 across our pipeline and platform. We currently have four novel Probody assets in Phase II studies, across nine cancer types with readout starting at the end of this year with CX-2029.
We also continue to develop our core technology across multiple biologic modalities, as we advance new clinical candidates into development. Our recently published work highlights the scope and scale of our R&D efforts, as we drive our pipeline forward and invest in our technology for the long term.
With that let's open up the call for questions. I'll turn it back to the operator.
Question-and-Answer Session
Operator
[Operator Instructions] Our first question comes from the line of Anupam Rama from JPMorgan. Your line is now open.
Anupam Rama
Hey, guys. Thanks so much for taking the question. For CX-2029, can you remind us the size and scope of the data we'll be getting here in 4Q? And remind us, if this is going to be at a medical meeting, or should we be thinking about more of a top line press release webcast-type scenario? Thanks so much.
Sean McCarthy
Hey, Anupam. How are you? Good to hear from you. So we're guiding to initial data from the expansion phase by the end of the year. We haven't pinpointed any particular venue or methods through which we would communicate that data. As Amy mentioned, there are four cohorts in this expansion phase, the head and neck, the lung, the esophageal and the DLBCL. We are anticipating initial data from at least one of these cohorts by the end of this year. We're on track. And as I said, we haven't guided exactly where that would be.
Anupam Rama
Thanks for taking my question.
Operator
Our next question comes from the line of Roger Song from Jefferies. Your line is now open.
Roger Song
Great, thank you. Very similarly the question for that CX-2009. So what should we expect in the initial readout, because I remember last quarter, you say the initial data from the Arm 1 and B -- A and B and that should we also expect to Arm A and B as the initial data. Also you broadly guide to 2022, can we have some granularity in terms of first half or second half of 2022, when should we be expecting the data?
Sean McCarthy
Yeah. Hi, Roger. Thanks for the question. So yes, so just again just to recap Arm A is hormone receptor positive, Arm B is triple-negative just like monotherapy, Arm C is the combination with our proprietary PD-L1 Probody pacmilimab. So the revised guidance remains for Arms A and B in 2022. Arm C, it's like at this point, we're not going to be more specific than that. I think given the evolution of the macro environment and just the uncertainties around COVID, we're going to keep that guidance pretty broad right now. We do have though, I can say through 2009, we are making progress, we do have more than 20 sites open for the study, so we have the team has made a lot of progress, we need to make more and every day is a new day in the current world.
In terms of Arm C, the combination with pacmilimab, we're pretty consistent with the guidance that that would be slower than Arms A and B, given that we're screening for both CD166 and PD-L1 that's going to be a smaller patient population. We'll have to see how that develops. We'll provide additional guidance as time moves on the timing of Arm C.
Roger Song
Yeah, I understood. Yeah everyday is a new day. So maybe just another question from me is the earlier pipeline program during something like the cytokines derivative program, which is very exciting, just any updates from that?
Sean McCarthy
Roger, could you repeat which program. I didn't quite get it?
Roger Song
Yeah. Just any update for your cytokine derivative program and any other kind of earlier program?
Sean McCarthy
Yeah, you bet. And as I mentioned in my remarks, we're really excited about where we are on the platform. The work that we've done much of which we've now published in peer-reviewed form is demonstrating the utility of the Probody approach across multiple biologic modalities now extending in our most recent work to cytokines and into immune agonist antibodies with the PNAS paper on CD137. So we presented some work earlier this year on interferon alpha-2b, a really unique approach to marketing that cytokine, which I think there's general agreement that there is enormous potential for focusing or harnessing the clinical activity of that particular biology, if we can increase therapeutic window. Our preclinical data supports that we have open therapeutic window when moving that asset further into preclinical development.
We're still in lead optimization, I would like to say, but certainly moving it forward. And we continue to look at bispecifics and we'll continue to apply the platform to drug conjugates to get undruggable targets, so a lot of potential. I also mentioned on the call, our EGFR CD3 program, which is really a big idea in bispecifics, we know from work that is previously published by Micromet some years ago that EGFR in CD3 bispecific form is a very difficult target to address. We're bringing our masking technologies there, so attempts to open a therapeutic window. And as I mentioned, we're working toward getting that IND on file by the end of this year.
Roger Song
Got it. Thank you for all the other comment. Thank you.
Sean McCarthy
You are welcome.
Operator
Our next question comes from the line of Joe Catanzaro from Piper Sandler. Your line is now open.
Joe Catanzaro
Great, thanks so much for taking my questions here. So, I mean, you had mentioned that for CX-2009, it was a new study that required new site initiations, so it sounds like in contrast 2029, the Phase II cohorts just rolled over from the Phase I and didn't require new site initiations, can you confirm that and is that the case for all expansion cohorts or did some tumor types, i.e. DLBCL requires some new sites to open up and enroll patients. Thanks.
Amy Peterson
Sure. Thanks, Joe for the question. Yeah. To confirm the 2029 study was designed as a Phase 1/2 study with expansion continuing at sites that were open, which allowed us to continue enrollment. As you point out, there are interesting novel cohorts and we did look at activating new sites to help boost enrollment, but the continuation of enrollment was allowed primarily due to the continuation of the study at the already open activated sites.
Joe Catanzaro
Okay, got it. That's helpful. And then I think you guys had previously guided toward data potentially by the end of the year from both the lung cancer and head and neck, but it sounds like, may be you backtrack a little, if I heard correctly that we could expect at least one cohort worth of data of the four?
Sean McCarthy
Yeah, I wouldn't describe that as much as a backtrack, Joe. I think we're generally on track with prior guidance.
Joe Catanzaro
Okay, got it. That's helpful. Thanks for taking my question.
Sean McCarthy
You bet.
Operator
Our next question comes from the line of Boris Peaker from Cowen. Your line is now open.
Cynthia Chen
Hi thanks. This is Cynthia on for Boris. For CX-2009 are you still seeing around 50% of patients triple-negative patients expressing CD166 at a high level? And then just speaking through for Arm C, are you getting a sense of how many triple-negative patients express both CD166 and PD-L1?
Sean McCarthy
Yes, great question. We continue to evaluate target expression across these arms in the Phase 2 study. Nothing to really comment on right now but that continues to be an important component of the study as we continue to learn and we'll continue to learn about the relationship between CD166 expression and response and the CD166 expression across these different patient populations. So, it continues to be very much work in progress.
Cynthia Chen
All right, great. Thank you.
Operator
Our next question comes from the line of Etzer Darout from Guggenheim. Your line is now open.
Paul Jeng
Great. Thanks for taking the question. This is Paul on for Etzer. Just one from us. for your EpCAM program the CX-2043. Have the supply chain issues you sort of discussed last quarter have been resolved? And is there any update to your IND plan for this program? Thanks.
Sean McCarthy
Yes. Thanks for the question. And I actually neglected to mention EpCAM while I was doing my recap of our early pipeline earlier on in response to Roger's question. Yes, so we've made progress there. And just to recap the challenge that we ran into was relating to the DM-21 payload which is a next-gen maytansinoid. We've made a lot of progress there.
We're still looking at what that time line is going to be. So, there's no formally-updated guidance but we are making progress with the program and with EpCAM generally as a target which we continue to be highly interested in.
Paul Jeng
Great. Thanks so much.
Operator
Our next question comes from the line of Peter Lawson from Barclays. Your line is now open.
Peter Lawson
Thanks. Just on I guess the CD71 data, I'm just trying to piece it together. So, I think last time you got you were suggesting that the head neck and the lung would be at the end of the year. Is that still the case? And then DLBCL kind of next year? Is that the right order? And do we get kind of data sets year-end for at neck and lung.
Sean McCarthy
Yes. So, the -- again those four cohorts of head and neck lung, esophageal and DLBCL. The first two were obviously selected based on data that we saw in the Phase 1 dose escalation activity that we saw in Phase 1 and obvious choices for Phase 2 expansions. And I would say, yes, generally, on track for those two cohorts to present updates by the end of the year and with the others following thereafter.
Peter Lawson
Got you. And the venue for that would be more of a press release than a conference?
Sean McCarthy
We haven't disclosed the strategy at this point Peter. We'll provide further information as we go further through the year.
Peter Lawson
Got you. And the breast cancer delayed like triple-negative and HR-positive HER2-negative was that predominantly driven by these kind of new site inactivations or was there anything else that we should be thinking about?
Sean McCarthy
Yes, it's really a COVID thing. And as I said we've got a pretty decent number of sites open. A lot of those have come on fairly recently. The team is really working all hours to get this -- to bring this study in. We're excited about this asset. We want to see this data as much as anybody else. But it's a tough operating environment right now to get new sites initiated.
I think you'll be hearing that from others. And that's -- we're certainly seeing a lot of enthusiasm from our investigators. I'll take you back to our analyst event earlier this year where you heard Sara Tolaney talk about the potential of praluzatamab ravtansine. And so yes, this is an operational challenge and we've just got to keep powering through.
Peter Lawson
Got you, okay. Thanks for the update.
Sean McCarthy
You're welcome.
Operator
At this time, I would like to hand the conference back over to Chau Cheng for his closing remarks.
Chau Cheng
So, on behalf of the executive team, I'd like to thank you all very much for joining us this afternoon. We look forward to updating you in the future on our ongoing progress.
Operator
Ladies and gentlemen, this concludes today's conference call. Thank you for participating. You may now disconnect and have a great day.
Aug. 08, 2021 10:26 AM ETCytomX Therapeutics, Inc. (CTMX)
Q2: 2021-08-05 Earnings Summary
EPS of -$0.30 misses by $0.00 | Revenue of $16.29M (-1.93% Y/Y) misses by $673.11K
CytomX Therapeutics, Inc. (CTMX) Q2 2021 Earnings Conference Call August 5, 2021 5:00 PM ET
Company Participants
Chau Cheng - Vice President Investor Relations & Corporate Communications
Sean McCarthy - President, Chief Executive Officer & Chairman
Amy Peterson - Chief Development Officer
Carlos Campoy - Chief Financial Officer
Conference Call Participants
Anupam Rama - JP Morgan
Roger Song - Jefferies
Joe Catanzaro - Piper Sandler
Cynthia Chen - Cowen
Paul Jeng - Guggenheim
Peter Lawson - Barclays
Operator
Good afternoon, ladies and gentlemen. Thank you for standing by. Welcome to the CytomX Therapeutics' Second Quarter 2021 Financial Results Call. Please be advised that today's call is being recorded.
I would now like to hand the conference over to your host today, Chau Cheng, CytomX's Vice President Investor Relations and Corporate Communications. Please go ahead.
Chau Cheng
Thank you, Suzanne. Good afternoon and thank you for joining us. With me today are Dr. Sean McCarthy, CytomX's President, Chief Executive Officer and Chairman; Dr. Amy Peterson, Chief Development Officer; and Carlos Campoy, Chief Financial Officer.
Earlier today, we issued a press release that includes a summary of our first quarter 2021 financial results and highlights the important progress we made during the quarter. We encourage everyone to read today's press release and the associated materials, which have been filed with the SEC. Additionally, the press release and the recording of this call can be found under the Investors and News section of our website at cytomx.com.
During today's call, we will be making forward-looking statements. Because forward-looking statements relate to the future, they are subject to inherent uncertainties and risks, including the uncertainties surrounding the COVID-19 pandemic that are difficult to predict and many of which are outside of our control.
Important risks and uncertainties are set forth in our most recent public filings with the SEC at sec.gov, including our Form 10-Q filed today. We undertake no obligation to update any forward-looking statements, whether as a result of new information, future developments or otherwise.
With that, I'd like to turn the call now over to Sean.
Sean McCarthy
Thank you, Chau, and good afternoon, everyone. Thanks for joining us today for an update on recent progress and developments within our clinical and preclinical programs and operations. At CytomX, we continue to dedicate ourselves to working towards making a meaningful difference in cancer treatment by being different and thinking differently.
We have pioneered an entirely new way to design therapeutic antibodies and other biologic modalities and we have used our technology to purposefully go after high potential targets that were previously considered undruggable in order to stand out from the crowd and build long-term value. We are exploiting an Achilles heel of tumor biology to combat cancer in new and unique ways.
Our technology the Probody platform is a conditional activation strategy that uses protease-dependent peptide market. Given that proteases are activated in the tumor microenvironment but tightly controlled in normal tissues, our strategy is designed to reduce antibody binding in normal tissues while maximizing target binding in cancer.
During the second quarter, we continued to advance our broad pipeline of Probody therapeutics across multiple modalities and cancer types, including our two conditionally activated antibody drug conjugates or ADCs praluzatamab ravtansine, also known as CX-2009 and CX-2029, both of which are currently in Phase 2 clinical investigations encompassing multiple tumor types.
Let me begin with CX-2029, our CD71-directed conditionally-activated ADC, for which we recently published results from a Phase 1 first-in-human study in patients with advanced solid tumors. This important work by CytomX, in collaboration with our partner AbbVie, has demonstrated for the first time that CD71 can be successfully targeted with a drug conjugated antibody using our technology.
Why CD71? Well, CD71 or the transferrin receptor has been a very attractive but elusive oncology target for ADC development. It's highly expressed on the vast majority of tumors since all growing and dividing cells need iron for many metabolic processes.
And CD71 is an extremely efficient transport system fully internalizing antibodies within minutes of binding. However, CD71 was previously deemed undruggable with conventional ADCs, because it's also highly expressed in and vital to normal tissue growth and development.
As we have now published in clinical cancer research, in Phase 1 dose escalation CX-2029 was generally well tolerated and produced encouraging anti-cancer activity, notably in patients with squamous non-small cell lung and head and neck cancers, a first for an ADC against this high potential target.
These two cancer types are now part of an ongoing four cohort Phase 2 expansion study. We dosed the first patients in the expansion phase in November 2020 and then we will give you an update in a few moments on where things stand.
Moving on to praluzatamab ravtansine, our wholly-owned first in class conditionally activated ADC, directed toward another novel oncology target CD166. CD166 also known as activated leukocyte chelates molecule or ALCAM is a transmembrane lipoprotein that has been reported to play a role in multiple aspects of tumor biology including angiogenesis and invasiveness.
CD166 is highly expressed on the cell surface of many cancer types and as such, has attractive molecular properties as an ADC target. However, developing a conventional ADC against CD166 is precluded by its widespread presence on healthy tissues.
Our pioneering Phase 1 clinical work on CD166 has shown that praluzatamab can achieve clinically meaningful outcomes in patients with different cancer types, including but not limited to HER2-nonamplified breast cancer.
These results support our current three-arm Phase II study in breast cancer and we're excited about the potential for this asset in this indication, and more broadly, in other CD166-expressing cancers, where substantial unmet need remains. Amy will also provide you with more details of the design and status of the praluzatamab Phase 2 study shortly.
Turning now briefly to our work in immuno-oncology, and our partner clinical programs with Bristol Myers Squibb aimed at broadening the therapeutic window, and therefore, the clinical utility of anti-CTLA-4 immunotherapy. BMS-986249 and BMS-986288 discovered using the CytomX platform are Probody versions of different forms of the anti-CTLA-4 therapeutic category ipilimumab.
BMS-986249 having successfully completed dose escalation is currently being evaluated in a randomized Phase 2 study in combination with the anti PD-1 antibody nivolumab in patients with metastatic melanoma. Importantly, the control arm in this study is nivo plus ipilimumab rather than nivo monotherapy, representing the current standard of care based on five-year follow-up from CheckMate 067, which showed a significant increase in overall survival with this combination in melanoma over nivo monotherapy.
BMS-986249 is also being studied in combination with nivo in three additional advanced settings. It has a cellular carcinoma, castration-resistant prostate cancer and triple-negative breast cancer. BMS-986288 a Probody version of a non-fucosylated ipilimumab with increased Treg depletion properties continues to be evaluated in a Phase 1 study in advanced solid cancers as monotherapy and in combination with nivo.
Switching now to our research and preclinical programs in the field of conditionally activated T cell bispecific antibodies, we see a major opportunity here to improve the therapeutic window of this modality using our platform, and we're pursuing multiple projects with our partners Amgen and Astellas.
CX-904 is a conditionally activated T cell engaging bispecific directed against EGFR on tumor cells and CD3 on T cells. And this is in IND-enabling studies. We recently submitted a pre-IND meeting request to the FDA, and we expect written responses to our questions from the regulatory agency in the third quarter of this year. We will continue to discuss the program with our partner Amgen and we're working towards the filing of an IND for CX-904 in late 2021.
Q2 was also highly productive for CytomX in terms of publication of our work in peer-reviewed journals. A total of five manuscripts were recently published covering our work that ranges from Phase 1 investigation of CX-2029, as I already mentioned, to multiple publications describing our clinical work, with pacmilimab or CX-072 our wholly-owned conditionally activated antibody against PD-L1.
Of particular note, our recent collaborative work with Dr. Elisabeth de Vries of the University Medical Centre Groningen in the Netherlands has investigated the biodistribution of pacmilimab in cancer patients using clinical imaging. This study has shed important light on the molecular performance of the Probody platform in cancer patients, including the direct demonstration of activation and binding of pacmilimab to primary and metastatic tumors.
Another recent publication of particular note is our landmark preclinical study of a Probody immuno-oncology agonist in the proceedings of the National Academy of Sciences. As you will recall, we introduced earlier this year our advancement of our conditional activation technology into the cytokine space. This recent PLS paper takes things even further, as the first published application of the CytomX platform to agonist antibodies in immuno-oncology, emphasizing the versatility of our platform.
Specifically, together with our collaborators we have shown in this publication that an anti-CD137 Probody retains potent antitumor activity, with significantly reduced liver toxicity compared to an unmasked antibody, when assessed in the same mass model system. This is exactly, what our platform is designed to do. The paper also includes extensive characterization of Probody activation by tumor-specific.
Taken together these publications underscore the immense progress we've made across our pipeline and platform, with our first generations of Probody therapeutics, a field that CytomX has defined and continues to lead and we continue to innovate on the core platform and across many therapeutic modalities.
Let me now hand the call over to Amy for additional detail and updates on our new clinical programs.
Amy Peterson
Thanks, Sean. I'll start with a quick recap of the design for our Phase 2 studies of CX-2029 and praluzatamab. For CX-2029 in collaboration with AbbVie, we continue to enroll patients into the expansion phase of the Phase 1/2 study designed to evaluate the CD71-directed, conditionally activated ADC in four different cohorts: squamous non-small cell lung cancer, head and neck squamous cell carcinoma, esophageal and gastroesophageal junctional cancer and disease like B-cell lymphoma. Each cohort aims to enroll up to 25 efficacy evaluable patients and we continue to expect initial data from the expansion phase of the study in the fourth quarter of this year.
Switching to CX-2009 or praluzatamab ravtansine, we are evaluating the CD166 directed conditionally activated ADC as monotherapy in patients with HER2 non-amplified breast cancer, which includes hormone receptor positive Arm A, and triple-negative breast cancer Arm B. We are also evaluating the combination with our proprietary anti-PD-L1 therapeutic pacmilimab in patients with triple-negative disease in Arm C. The goal is to reach 40 efficacy evaluable patients in each of these arms. And the primary endpoint of this study is overall response rate according to resist.
Secondary endpoints include duration of response and clinical benefit rate at 24 weeks, the latter being particularly an important metric for the hormone receptor positive subtype as a reasonable surrogate to support progression-free survival endpoints in future studies. Enrollment is ongoing. However, our accrual rate for our fourth quarter 2021 initial data readout has been slower than expected, due primarily to the widespread effect of the COVID-19 pandemic on site activation and on patient enrollment.
The praluzatamab Phase II study is a new trial, requiring de novo site activation and this has proven particularly challenging in the current environment. As such we now anticipate initial data from this study in 2022. Notwithstanding the COVID-19 challenges we continue to implement ways to help improve the pace of patient enrollment including opening additional sites in the US, Europe and Asia as well as partnering with patient advocacy groups to encourage enrollment from underrepresented population, given the fact that triple-negative breast cancer is more prevalent in minority women.
We are excited about the opportunity for praluzatamab in breast cancer and I would like to take a few moments to look ahead to where this unique drug candidate has the potential to fit into the treatment landscape. Recall that historically breast cancer has been divided into three major subtypes and treatments have been developed accordingly.
ER/PR positive, which is responsive to just hormonal therapy; HER2-amplified, which is responsive to HER2-targeted therapies; and triple-negative breast cancer, named not for what it is but rather what it is not and is therefore heterogeneous grouping.
Before turning the call over to Carlos to review our financials, I want to point out that in our Phase II study effectively, we are evaluating praluzatamab in HER2 non-amplified breast cancer, an emerging classification that combines hormone receptor positive with triple-negative breast cancer and represents approximately 80% of all breast cancer and includes those that express both low and no levels of HER2 by IHC. It's also important to note that CD166 expression is found across all of these subclassifications of breast cancer and thus CX-2009 represents a significant opportunity.
Carlos Campoy
Thank you, Amy. With $366 million in cash, cash equivalents and investments, as of June 30 2021, CytomX remains well capitalized to support our bold clinical and research agenda that will drive the growth of the company well into 2023. Revenue was $16 million for the second quarter of 2021, relatively flat when compared to the corresponding period in 2020.
R&D expenses increased $2 million to $26 million, during the three months ended in June 30 2021, compared to the corresponding period in 2020. The increase was driven mainly by planning of manufacturing and translational science activities. G&A expenses were $9 million for Q2 2021, essentially flat compared to the second quarter of 2020.
With that I'll turn the call back to Sean.
Sean McCarthy
Thanks, Carlos and thanks to everyone for joining us today. To briefly recap, CytomX continued to make broad progress in Q2 across our pipeline and platform. We currently have four novel Probody assets in Phase II studies, across nine cancer types with readout starting at the end of this year with CX-2029.
We also continue to develop our core technology across multiple biologic modalities, as we advance new clinical candidates into development. Our recently published work highlights the scope and scale of our R&D efforts, as we drive our pipeline forward and invest in our technology for the long term.
With that let's open up the call for questions. I'll turn it back to the operator.
Question-and-Answer Session
Operator
[Operator Instructions] Our first question comes from the line of Anupam Rama from JPMorgan. Your line is now open.
Anupam Rama
Hey, guys. Thanks so much for taking the question. For CX-2029, can you remind us the size and scope of the data we'll be getting here in 4Q? And remind us, if this is going to be at a medical meeting, or should we be thinking about more of a top line press release webcast-type scenario? Thanks so much.
Sean McCarthy
Hey, Anupam. How are you? Good to hear from you. So we're guiding to initial data from the expansion phase by the end of the year. We haven't pinpointed any particular venue or methods through which we would communicate that data. As Amy mentioned, there are four cohorts in this expansion phase, the head and neck, the lung, the esophageal and the DLBCL. We are anticipating initial data from at least one of these cohorts by the end of this year. We're on track. And as I said, we haven't guided exactly where that would be.
Anupam Rama
Thanks for taking my question.
Operator
Our next question comes from the line of Roger Song from Jefferies. Your line is now open.
Roger Song
Great, thank you. Very similarly the question for that CX-2009. So what should we expect in the initial readout, because I remember last quarter, you say the initial data from the Arm 1 and B -- A and B and that should we also expect to Arm A and B as the initial data. Also you broadly guide to 2022, can we have some granularity in terms of first half or second half of 2022, when should we be expecting the data?
Sean McCarthy
Yeah. Hi, Roger. Thanks for the question. So yes, so just again just to recap Arm A is hormone receptor positive, Arm B is triple-negative just like monotherapy, Arm C is the combination with our proprietary PD-L1 Probody pacmilimab. So the revised guidance remains for Arms A and B in 2022. Arm C, it's like at this point, we're not going to be more specific than that. I think given the evolution of the macro environment and just the uncertainties around COVID, we're going to keep that guidance pretty broad right now. We do have though, I can say through 2009, we are making progress, we do have more than 20 sites open for the study, so we have the team has made a lot of progress, we need to make more and every day is a new day in the current world.
In terms of Arm C, the combination with pacmilimab, we're pretty consistent with the guidance that that would be slower than Arms A and B, given that we're screening for both CD166 and PD-L1 that's going to be a smaller patient population. We'll have to see how that develops. We'll provide additional guidance as time moves on the timing of Arm C.
Roger Song
Yeah, I understood. Yeah everyday is a new day. So maybe just another question from me is the earlier pipeline program during something like the cytokines derivative program, which is very exciting, just any updates from that?
Sean McCarthy
Roger, could you repeat which program. I didn't quite get it?
Roger Song
Yeah. Just any update for your cytokine derivative program and any other kind of earlier program?
Sean McCarthy
Yeah, you bet. And as I mentioned in my remarks, we're really excited about where we are on the platform. The work that we've done much of which we've now published in peer-reviewed form is demonstrating the utility of the Probody approach across multiple biologic modalities now extending in our most recent work to cytokines and into immune agonist antibodies with the PNAS paper on CD137. So we presented some work earlier this year on interferon alpha-2b, a really unique approach to marketing that cytokine, which I think there's general agreement that there is enormous potential for focusing or harnessing the clinical activity of that particular biology, if we can increase therapeutic window. Our preclinical data supports that we have open therapeutic window when moving that asset further into preclinical development.
We're still in lead optimization, I would like to say, but certainly moving it forward. And we continue to look at bispecifics and we'll continue to apply the platform to drug conjugates to get undruggable targets, so a lot of potential. I also mentioned on the call, our EGFR CD3 program, which is really a big idea in bispecifics, we know from work that is previously published by Micromet some years ago that EGFR in CD3 bispecific form is a very difficult target to address. We're bringing our masking technologies there, so attempts to open a therapeutic window. And as I mentioned, we're working toward getting that IND on file by the end of this year.
Roger Song
Got it. Thank you for all the other comment. Thank you.
Sean McCarthy
You are welcome.
Operator
Our next question comes from the line of Joe Catanzaro from Piper Sandler. Your line is now open.
Joe Catanzaro
Great, thanks so much for taking my questions here. So, I mean, you had mentioned that for CX-2009, it was a new study that required new site initiations, so it sounds like in contrast 2029, the Phase II cohorts just rolled over from the Phase I and didn't require new site initiations, can you confirm that and is that the case for all expansion cohorts or did some tumor types, i.e. DLBCL requires some new sites to open up and enroll patients. Thanks.
Amy Peterson
Sure. Thanks, Joe for the question. Yeah. To confirm the 2029 study was designed as a Phase 1/2 study with expansion continuing at sites that were open, which allowed us to continue enrollment. As you point out, there are interesting novel cohorts and we did look at activating new sites to help boost enrollment, but the continuation of enrollment was allowed primarily due to the continuation of the study at the already open activated sites.
Joe Catanzaro
Okay, got it. That's helpful. And then I think you guys had previously guided toward data potentially by the end of the year from both the lung cancer and head and neck, but it sounds like, may be you backtrack a little, if I heard correctly that we could expect at least one cohort worth of data of the four?
Sean McCarthy
Yeah, I wouldn't describe that as much as a backtrack, Joe. I think we're generally on track with prior guidance.
Joe Catanzaro
Okay, got it. That's helpful. Thanks for taking my question.
Sean McCarthy
You bet.
Operator
Our next question comes from the line of Boris Peaker from Cowen. Your line is now open.
Cynthia Chen
Hi thanks. This is Cynthia on for Boris. For CX-2009 are you still seeing around 50% of patients triple-negative patients expressing CD166 at a high level? And then just speaking through for Arm C, are you getting a sense of how many triple-negative patients express both CD166 and PD-L1?
Sean McCarthy
Yes, great question. We continue to evaluate target expression across these arms in the Phase 2 study. Nothing to really comment on right now but that continues to be an important component of the study as we continue to learn and we'll continue to learn about the relationship between CD166 expression and response and the CD166 expression across these different patient populations. So, it continues to be very much work in progress.
Cynthia Chen
All right, great. Thank you.
Operator
Our next question comes from the line of Etzer Darout from Guggenheim. Your line is now open.
Paul Jeng
Great. Thanks for taking the question. This is Paul on for Etzer. Just one from us. for your EpCAM program the CX-2043. Have the supply chain issues you sort of discussed last quarter have been resolved? And is there any update to your IND plan for this program? Thanks.
Sean McCarthy
Yes. Thanks for the question. And I actually neglected to mention EpCAM while I was doing my recap of our early pipeline earlier on in response to Roger's question. Yes, so we've made progress there. And just to recap the challenge that we ran into was relating to the DM-21 payload which is a next-gen maytansinoid. We've made a lot of progress there.
We're still looking at what that time line is going to be. So, there's no formally-updated guidance but we are making progress with the program and with EpCAM generally as a target which we continue to be highly interested in.
Paul Jeng
Great. Thanks so much.
Operator
Our next question comes from the line of Peter Lawson from Barclays. Your line is now open.
Peter Lawson
Thanks. Just on I guess the CD71 data, I'm just trying to piece it together. So, I think last time you got you were suggesting that the head neck and the lung would be at the end of the year. Is that still the case? And then DLBCL kind of next year? Is that the right order? And do we get kind of data sets year-end for at neck and lung.
Sean McCarthy
Yes. So, the -- again those four cohorts of head and neck lung, esophageal and DLBCL. The first two were obviously selected based on data that we saw in the Phase 1 dose escalation activity that we saw in Phase 1 and obvious choices for Phase 2 expansions. And I would say, yes, generally, on track for those two cohorts to present updates by the end of the year and with the others following thereafter.
Peter Lawson
Got you. And the venue for that would be more of a press release than a conference?
Sean McCarthy
We haven't disclosed the strategy at this point Peter. We'll provide further information as we go further through the year.
Peter Lawson
Got you. And the breast cancer delayed like triple-negative and HR-positive HER2-negative was that predominantly driven by these kind of new site inactivations or was there anything else that we should be thinking about?
Sean McCarthy
Yes, it's really a COVID thing. And as I said we've got a pretty decent number of sites open. A lot of those have come on fairly recently. The team is really working all hours to get this -- to bring this study in. We're excited about this asset. We want to see this data as much as anybody else. But it's a tough operating environment right now to get new sites initiated.
I think you'll be hearing that from others. And that's -- we're certainly seeing a lot of enthusiasm from our investigators. I'll take you back to our analyst event earlier this year where you heard Sara Tolaney talk about the potential of praluzatamab ravtansine. And so yes, this is an operational challenge and we've just got to keep powering through.
Peter Lawson
Got you, okay. Thanks for the update.
Sean McCarthy
You're welcome.
Operator
At this time, I would like to hand the conference back over to Chau Cheng for his closing remarks.
Chau Cheng
So, on behalf of the executive team, I'd like to thank you all very much for joining us this afternoon. We look forward to updating you in the future on our ongoing progress.
Operator
Ladies and gentlemen, this concludes today's conference call. Thank you for participating. You may now disconnect and have a great day.
Kannst du das nächste mal bitte einen Link schicken, anstatt einen ganzen Roman hier reinzukopieren? Danke
Bei 5,10 USD müsste noch ein Gap liegen.
2021 Wedbush PacGrow Healthcare Virtual Conference
Date: Tuesday, August 10, 2021
Panel Discussion: 1:10 p.m. ET
Date: Tuesday, August 10, 2021
Panel Discussion: 1:10 p.m. ET
Bin heute mit einer ersten Position zu 4,92 USD eingestiegen. Die Pipeline ist beeindruckend und aktuell wird die Firma unter Cash gehandelt. Kaum vorstellbar, dass diese Aktie so stark gefallen ist.
Ich habe nichts negatives gefunden. Time will tell.
Ich habe nichts negatives gefunden. Time will tell.
Ist da um 4,80/4,90 eine Bodenbildung in Sicht?
Wenn mich nicht alles täuscht ist das heute mit 4,72 USD ein neues Allzeittief gewesen. Ohne brauchbare News wird der Kurs meiner Meinung nach sich nicht groß bewegen. Ich hoffe mal das es nicht noch weiter nach unten geht.
Falsch, neues 52 Wochentief. Das Allzeittief liegt bei 3,60 USD.
Antwort auf Beitrag Nr.: 69.333.718 von 007coolinvestor am 15.09.21 16:29:23Das klingt doch nicht schlecht, jetzt müsste nur noch der Kurs anziehen.
Kurs notiert immer noch im Bereich des Cashbestandes. Das erschließt sich mir nicht.
Habe eine mittelschwere Order mit Limit $5 platziert.
Habe eine mittelschwere Order mit Limit $5 platziert.
Antwort auf Beitrag Nr.: 69.476.227 von bcgk am 01.10.21 12:05:15Ich habe auch nochmal zugegriffen, mE. überwiegt hier die Chance klar gegenüber dem Risiko.
Selbst heute keine Erholung. Die Aktie ist derzeit grottenschlecht, da beißt die Maus keinen Faden ab.
versteh die kursentwicklung auch ned, mischkurs mit mhehrmalihem nachlaufen bei knappen 6 euro bei mir. längeres halten kein problem für mich. na, schau ma mal.
So langsam bewegt sich was. Einstieg bei $4.90.wqr erstmal eine gute Entscheidung, rechne aber mit Kursen jenseits der $15 bei guten P2 Daten.
Das sieht im Moment ganz gut aus, mal schauen wie es die nächsten Tage läuft.
Am kommenden Donnerstag nach Börsenschluss gibt es Quartalszahlen.
Ich bin mal gespannt auf die Zahlen. Im 4.Quartal müssten auch Updates zu Ihrer Pipline kommen.
Updates zur Pipeline werden entscheidend sein - das kann dauern, auch bis 2023 rein, z.b. bei cx2009 siehe hier: https://www.clinicaltrials.gov/ct2/show/NCT04596150
Initial Data zu beiden P2 Studien (CX2009 und CX2029) kommen noch in Q4.
Unter Cash war das einer der klarsten Käufe im XBI.
Unter Cash war das einer der klarsten Käufe im XBI.
Ich bin mal gespannt was der Kurs heute macht.
Allen Investierten ein schönes Wochenende
Allen Investierten ein schönes Wochenende
Antwort auf Beitrag Nr.: 69.742.087 von Hitman2 am 29.10.21 11:15:33
Gewinne der der letzten Tagen konnten verteidigt werden. Gutes Zeichen.
Zitat von Hitman2: Ich bin mal gespannt was der Kurs heute macht.
Allen Investierten ein schönes Wochenende
Gewinne der der letzten Tagen konnten verteidigt werden. Gutes Zeichen.
Antwort auf Beitrag Nr.: 69.751.180 von bcgk am 30.10.21 08:56:14 Danke für die Antwort, mal sehen wie es diese Woche weiter geht.
Danke für die Antwort, mal sehen wie es diese Woche weiter geht.
 Danke für die Antwort, mal sehen wie es diese Woche weiter geht.
Danke für die Antwort, mal sehen wie es diese Woche weiter geht.
Ich hoffe auf positive Zahlen und ein Unternehmensupdate das den Kurs beflügelt.
Antwort auf Beitrag Nr.: 69.765.399 von Hitman2 am 01.11.21 14:12:21
XBI 3% im Plus und CTMX im Minus.
Zitat von Hitman2: Ich hoffe auf positive Zahlen und ein Unternehmensupdate das den Kurs beflügelt.
XBI 3% im Plus und CTMX im Minus.

Der Abwärtstrend wurde beim Überschreiten der $5-Marke im September nach oben verlassen, was ein bullisches Signal war. Aus einer Seitwärtsbewegung oberhalb des Kanals ist nun ein Aufwärtstrend entstanden. Gestern hat man eine wichtige Marke erobern können.
Wie der Chart aber zeigt, wartet im Bereich zwischen $6.5 und $6.6 eine veritable Widerstandszone. Wenn diese überwunden werden kann, wiederholt sich das Spiel bei $8.
Es braucht Volumen und guten Daten. Ersteres folgt hoffentlich Zweiterem.
Disclaimer: Kauf zu $4.9
Ich bin mal hier rüber gehüpft vom HDP Thread aus auf Hinweis von bcgk. Ich kenne mich hier noch nicht so gut aus. Prinzipiell scheinen die Indikationen ja sehr vielversprechend vom Marktpotenzial. Allerdings ist das Risiko in der Krebsforschung besonders hoch. Gibt es für die einzelnen Medikamente Biomarker? Das würde die Erfolgschancen drastisch erhöhen...
Antwort auf Beitrag Nr.: 69.809.145 von Lynvestor am 04.11.21 17:26:40Was aus meiner Sicht für CTMX spricht:
Bis vor kurzem notierte man unter Cash, die MK von gut 300m damals bizarr niedrig und die Pipeline ist durch verschiedene Big Pharma Partner zumindest teilvalidiert.
Der User @StellaVella hat hier mal etwas zum MOA geschrieben, das ist sehr hilfreich, um den relativ bahnbrechenden Ansatz des Unternehmens zu verstehen.
Bis vor kurzem notierte man unter Cash, die MK von gut 300m damals bizarr niedrig und die Pipeline ist durch verschiedene Big Pharma Partner zumindest teilvalidiert.
Der User @StellaVella hat hier mal etwas zum MOA geschrieben, das ist sehr hilfreich, um den relativ bahnbrechenden Ansatz des Unternehmens zu verstehen.
Antwort auf Beitrag Nr.: 69.809.145 von Lynvestor am 04.11.21 17:26:40
hier mal ein guter Übersichtsartikel zu CTMX:
https://seekingalpha.com/article/4453507-cytomx-solving-a-cr…
Zitat von Lynvestor: Ich bin mal hier rüber gehüpft vom HDP Thread aus auf Hinweis von bcgk. Ich kenne mich hier noch nicht so gut aus. Prinzipiell scheinen die Indikationen ja sehr vielversprechend vom Marktpotenzial. Allerdings ist das Risiko in der Krebsforschung besonders hoch. Gibt es für die einzelnen Medikamente Biomarker? Das würde die Erfolgschancen drastisch erhöhen...
hier mal ein guter Übersichtsartikel zu CTMX:
https://seekingalpha.com/article/4453507-cytomx-solving-a-cr…
Antwort auf Beitrag Nr.: 69.810.225 von StellaVella am 04.11.21 18:47:34
Supi sehr nett. Ich schau es mir am Wochenende Mal an. Vielleicht kann ich auch was beitragen...
Zitat von StellaVella:Zitat von Lynvestor: Ich bin mal hier rüber gehüpft vom HDP Thread aus auf Hinweis von bcgk. Ich kenne mich hier noch nicht so gut aus. Prinzipiell scheinen die Indikationen ja sehr vielversprechend vom Marktpotenzial. Allerdings ist das Risiko in der Krebsforschung besonders hoch. Gibt es für die einzelnen Medikamente Biomarker? Das würde die Erfolgschancen drastisch erhöhen...
hier mal ein guter Übersichtsartikel zu CTMX:
https://seekingalpha.com/article/4453507-cytomx-solving-a-cr…
Supi sehr nett. Ich schau es mir am Wochenende Mal an. Vielleicht kann ich auch was beitragen...
Quartalsbericht ist raus.
336m Cash zum 30. September
Aber was mir gar nicht gefällt.....
Initial data release from Phase 2 study of CX-2029 remains on track for fourth quarter 2021-
-Initial data release from Phase 2 study of praluzatamab ravtansine (CX-2009) expected in 2022-
CX-2009 war sich bislang auch für Q4/2021 angekündigt. Kürzlich habe ich dann Q1/2022 gelesen und nun nur noch "in 2022". Nicht mal mehr H1.
Scheint entweder eine Menge schiefgegangen zu sein oder es gibt schwere Verzögerungen.
336m Cash zum 30. September
Aber was mir gar nicht gefällt.....
Initial data release from Phase 2 study of CX-2029 remains on track for fourth quarter 2021-
-Initial data release from Phase 2 study of praluzatamab ravtansine (CX-2009) expected in 2022-
CX-2009 war sich bislang auch für Q4/2021 angekündigt. Kürzlich habe ich dann Q1/2022 gelesen und nun nur noch "in 2022". Nicht mal mehr H1.
Scheint entweder eine Menge schiefgegangen zu sein oder es gibt schwere Verzögerungen.
Mal übersetzt :
"Mit intensivem Fokus auf die Ausführung hat das CytomX-Team im vergangenen Quartal erhebliche Fortschritte bei der Einleitung der klinischen Standorte und der Patientenrekrutierung erzielt. Infolgedessen bleiben wir auf kursiert, bis zum Jahresende erste Daten aus unserer laufenden Phase-2-Erweiterungsstudie zur Evaluierung von CX-2029 bei definierten Krebsarten bekannt zu geben", sagte Sean McCarthy, D.Phil., President, Chief Executive Officer und Chairman von CytomX Therapeutics. "Wir bleiben auch auf Kurs für erste Daten aus dem klinischen Phase-2-Brustkrebsprogramm Praluzatamab Ravtansin im Jahr 2022. Darüber hinaus erweitern wir die Reichweite unserer vielseitigen Plattform mit der erwarteten IND-Einreichung unseres ersten bedingt aktivierten bispezifischen T-Zell-Antikörpers CX-904 im vierten Quartal und mit der Präsentation unserer aufstrebenden Wirkstoffforschungsarbeiten auf dem Gebiet der bedingten Zytokine auf der SITC 2021", fügte Dr. McCarthy hinzu.
"Mit intensivem Fokus auf die Ausführung hat das CytomX-Team im vergangenen Quartal erhebliche Fortschritte bei der Einleitung der klinischen Standorte und der Patientenrekrutierung erzielt. Infolgedessen bleiben wir auf kursiert, bis zum Jahresende erste Daten aus unserer laufenden Phase-2-Erweiterungsstudie zur Evaluierung von CX-2029 bei definierten Krebsarten bekannt zu geben", sagte Sean McCarthy, D.Phil., President, Chief Executive Officer und Chairman von CytomX Therapeutics. "Wir bleiben auch auf Kurs für erste Daten aus dem klinischen Phase-2-Brustkrebsprogramm Praluzatamab Ravtansin im Jahr 2022. Darüber hinaus erweitern wir die Reichweite unserer vielseitigen Plattform mit der erwarteten IND-Einreichung unseres ersten bedingt aktivierten bispezifischen T-Zell-Antikörpers CX-904 im vierten Quartal und mit der Präsentation unserer aufstrebenden Wirkstoffforschungsarbeiten auf dem Gebiet der bedingten Zytokine auf der SITC 2021", fügte Dr. McCarthy hinzu.
Geschäftshighlights des dritten Quartals und jüngste Entwicklungen
Die Aktivierung des klinischen Standorts und die Patientenrekrutierung für die laufende Phase-2-Studie mit CytomXs hundertprozentigem bedingtem Antikörper-Wirkstoff-Konjugat (ADC), Praluzatamab Ravtansin (CX-2009), machten erhebliche Fortschritte, einschließlich der Eröffnung weiterer Standorte in den USA, Europa und Asien sowie der Partnerschaft mit Patientenvertretungsgruppen, um die Aufnahme von unterrepräsentierten Bevölkerungsgruppen zu fördern. Praluzatamab Ravtansin wird derzeit in einer Phase-2-Studie als Monotherapie bei Patientinnen mit humanem epidermalem Wachstumsfaktorrezeptor 2-nicht amplifiziertem Brustkrebs und in Kombination mit Pacmilimab (CX-072) bei Patientinnen mit dreifach negativem Brustkrebs untersucht. Erste Daten aus dieser Studie sind für 2022 auf Kurs.
Die Aktivierung des klinischen Standorts und die Patientenrekrutierung für die laufende Phase-2-Studie mit CytomXs hundertprozentigem bedingtem Antikörper-Wirkstoff-Konjugat (ADC), Praluzatamab Ravtansin (CX-2009), machten erhebliche Fortschritte, einschließlich der Eröffnung weiterer Standorte in den USA, Europa und Asien sowie der Partnerschaft mit Patientenvertretungsgruppen, um die Aufnahme von unterrepräsentierten Bevölkerungsgruppen zu fördern. Praluzatamab Ravtansin wird derzeit in einer Phase-2-Studie als Monotherapie bei Patientinnen mit humanem epidermalem Wachstumsfaktorrezeptor 2-nicht amplifiziertem Brustkrebs und in Kombination mit Pacmilimab (CX-072) bei Patientinnen mit dreifach negativem Brustkrebs untersucht. Erste Daten aus dieser Studie sind für 2022 auf Kurs.
Die Patientenrekrutierung in die Expansionskohorten wurde für die Phase-2-Studie mit CX-2029 fortgesetzt, in der der CD71-gerichtete bedingt aktivierte ADC, der von CytomX und AbbVie gemeinsam entwickelt wurde, in vier Krebsindikationen untersucht wurde: Plattenepithelkarzinom, Plattenepithelkarzinom des Kopfes und Halses, Ösophagus- und gastroösophageale Verbindungskrebs und diffuses großzelliges B-Zell-Lymphom. Erste Daten aus dieser Studie sind für das vierte Quartal 2021 auf Kurs.
BMS-986249, eine Probody-Version von Ipilimumab, wurde weiterhin von Bristol Myers Squibb, dem Kooperationspartner von CytomX, in Kombination mit Nivolumab, dem Anti-PD-1-Antikörper, über vier verschiedene fortgeschrittene Malignome untersucht: Melanom, hepatozelluläres Karzinom, kastrationsresistenter Prostatakrebs und dreifach negativer Brustkrebs. Bristol Myers Squibb evaluiert auch BMS-986288, eine Probody-Version von nicht fucosyliertem Ipilimumab, als Monotherapie oder in Kombination mit Nivolumab in einer Phase-1-Studie.
CytomX geht davon aus, Ende 2021 einen Antrag auf ein neues Prüfpräparat für CX-904 bei der US-amerikanischen Food and Drug Administration einzureichen. CX-904 ist ein bedingt aktivierter T-Zell-bindender bispezifischer Antikörperkandidat gegen den epidermalen Wachstumsfaktorrezeptor auf Tumorzellen und CD3 auf T-Zellen und ist Partner von Amgen.
Ein CytomX-Abstract, das die Fortschritte des Unternehmens auf dem Gebiet der bedingt aktiven Zytokine hervorhebt, wurde für die Posterpräsentation auf der 36. Jahrestagung der Society for Immunotherapy of Cancer (SITC) (SITC) angenommen, die vom 12. bis 14. November 2021 im Walter E. Washington Convention Center, Washington, DC, stattfinden wird. Diese Präsentation beschreibt die präklinische Charakterisierung und den verbesserten therapeutischen Index eines maskierten Interferon alpha-2b (IFN-a2b), das cytomX-proprietäre bedingte Aktivierungstechnologien nutzt.
Ein CytomX-Abstract, das die Fortschritte des Unternehmens auf dem Gebiet der bedingt aktiven Zytokine hervorhebt, wurde für die Posterpräsentation auf der 36. Jahrestagung der Society for Immunotherapy of Cancer (SITC) (SITC) angenommen, die vom 12. bis 14. November 2021 im Walter E. Washington Convention Center, Washington, DC, stattfinden wird. Diese Präsentation beschreibt die präklinische Charakterisierung und den verbesserten therapeutischen Index eines maskierten Interferon alpha-2b (IFN-a2b), das cytomX-proprietäre bedingte Aktivierungstechnologien nutzt.
CytomX veröffentlichte eine präklinische Studie in Cancer Immunology Research, die zeigte, dass die systemische Verabreichung von bedingt aktivierten antiprogrammierten Zelltodliganden 1 (Anti-PD-L1) und antiprogrammierten Zelltodprotein 1 (Anti-PD-1) Antikörpern gegen tumortragende Mäuse eine Antitumoraktivität auslöste, die der herkömmlicher PD-1 / PD-L1-zielgerichteter Antikörper ähnelt, jedoch mit reduzierter systemischer immunvermittelter Toxizität. Diese Daten liefern weitere präklinische Gründe zur Unterstützung der laufenden Entwicklung von Pacmilimab (CX-072), das sich derzeit in einer Phase-2-Studie in Kombination mit Praluzatamab Ravtansin bei Patienten mit TNBC befindet. Der präklinische Artikel kann unter https://cancerimmunolres.aacrjournals.org/content/canimm/ear… abgerufen werden.
CytomX hat Alan Ashworth, Ph.D., FRS, einen weltbekannten Experten in der Krebsforschung und weltweit führenden Anbieter von Krebstherapien, in seinen Vorstand berufen.
CytomX hat Alan Ashworth, Ph.D., FRS, einen weltbekannten Experten in der Krebsforschung und weltweit führenden Anbieter von Krebstherapien, in seinen Vorstand berufen.
😂so ist alles gewesen.
Antwort auf Beitrag Nr.: 69.816.822 von Hitman2 am 05.11.21 10:42:40
Das ist ein Toller Link, dessen Inhalt ich direkt nochmals einkopiere !
CytomX Therapeutics (CTMX) Receives a Buy from Mizuho Securities Mizuho Securities analyst Mara Goldstein assigned a Buy rating to CytomX Therapeutics (CTMX – Research Report) today and set a price target of $16.00. The company’s shares closed last Thursday at $5.98.
According to TipRanks.com, Goldstein is a 5-star analyst with an average return of 17.3% and a 43.6% success rate. Goldstein covers the Healthcare sector, focusing on stocks such as Adaptimmune Therapeutics, Iovance Biotherapeutics, and Neoleukin Therapeutics.
The word on The Street in general, suggests a Strong Buy analyst consensus rating for CytomX Therapeutics with a $13.33 average price target.
Zitat von Hitman2: https://www.tipranks.com/news/blurbs/cytomx-therapeutics-ctmx-receives-a-buy-from-mizuho-securities
Das ist ein Toller Link, dessen Inhalt ich direkt nochmals einkopiere !
CytomX Therapeutics (CTMX) Receives a Buy from Mizuho Securities Mizuho Securities analyst Mara Goldstein assigned a Buy rating to CytomX Therapeutics (CTMX – Research Report) today and set a price target of $16.00. The company’s shares closed last Thursday at $5.98.
According to TipRanks.com, Goldstein is a 5-star analyst with an average return of 17.3% and a 43.6% success rate. Goldstein covers the Healthcare sector, focusing on stocks such as Adaptimmune Therapeutics, Iovance Biotherapeutics, and Neoleukin Therapeutics.
The word on The Street in general, suggests a Strong Buy analyst consensus rating for CytomX Therapeutics with a $13.33 average price target.
Mit 16 USD wäre ich erstmal zufrieden.😂
Antwort auf Beitrag Nr.: 69.819.534 von Hitman2 am 05.11.21 13:30:48
Ist auch mein erstes Kursziel. Wäre aber immer noch nur eine Milliarde Marktkapitalisierung.
Zitat von Hitman2: Mit 16 USD wäre ich erstmal zufrieden.😂
Ist auch mein erstes Kursziel. Wäre aber immer noch nur eine Milliarde Marktkapitalisierung.
Antwort auf Beitrag Nr.: 69.827.586 von bcgk am 05.11.21 22:26:14Mal schauen wie es nächste Woche weitergeht, ich hoffe weiter Richtung Norden. Dir noch ein schönes Wochenende.
Ich habe mir die Cytomx mal etwas genauer angesehen, aber mein Eindruck ist immer noch eher oberflächlich. Sehr beruhigend ist das Cashpolster von 330 Mio. $. Meiner Erfahrung nach dürfte man nicht sehr darunter fallen, wenn die Pipeline nicht völlig aussichtlos ist. Das heißt die Absicherung nach unten ist ganz gut für nen Biotech. Negativ ist aus meiner Sicht der relativ hohe Cashburn mit 100 Mio. $ pro Jahr. Die Gehälter empfinde ich als noch etwas üppiger als im eh schon sehr hohen Schnitt. Gut finde ich, dass man kürzlich in 2 Indikationen Fehlschläge hatte. Der Markt preist das häufig zu negativ ein. Gut ist auch, dass man etwas diversifiziert ist. Schwierig ist, dass man nur Phase II Assets im Bereich Onkologie hat. Glücklicherweise scheinen Biomarker vorzuliegen, so dass die Erfolgswahrscheinlichkeit der Phase II immerhin bei etwa 40 % liegt.
Ich habe mir mal die Indikation TNBC rausgesucht und das Marktpotenzial für das Asset untersucht. Das liegt nach meiner Berechnung aktuell bei etwa 60 Mio$. Spannend wird das natürlich, wenn die Phase II den Endpoint trifft, wirksam und hier besonders wichtig auch verträglich ist. Bei einem positiven Ergebnis einer Phase II Studie dürfte die Aktie sofort ein Aufwärtspotenzial von 100 Mio. $ haben. Generell ist der Markt im Bereich TNBC schwer umkaempft. Da gibt es viele, die mitspielen wollen. Meine Zahlen beruhen natürlich auf Schätzungen. Wenn ich alles ganz grob zusammenrechne komme ich mit Cash auf einen fairen Marktwert von etwa 600 Mio$ für Cytomx nach jetzigem Stand. 1 Milliarde finde ich nach aktuellem Datenstand eine Spur zu optimisitisch, aber auf jeden Fall im Rahmen der Unsicherheiten. Mit einem klinischen Erfolg Erfolg und ein bißchen Übertreibung kann das mittelfristig durchaus zu erreichen sein.
Ach so und zur Mara: Ihre Erfolgsquote ist unter 50%. Von der Statisitik her sollte man Ihren Empfehlungen also eher nicht glauben, sprich Cytomx verkaufen.
Ich habe mir mal die Indikation TNBC rausgesucht und das Marktpotenzial für das Asset untersucht. Das liegt nach meiner Berechnung aktuell bei etwa 60 Mio$. Spannend wird das natürlich, wenn die Phase II den Endpoint trifft, wirksam und hier besonders wichtig auch verträglich ist. Bei einem positiven Ergebnis einer Phase II Studie dürfte die Aktie sofort ein Aufwärtspotenzial von 100 Mio. $ haben. Generell ist der Markt im Bereich TNBC schwer umkaempft. Da gibt es viele, die mitspielen wollen. Meine Zahlen beruhen natürlich auf Schätzungen. Wenn ich alles ganz grob zusammenrechne komme ich mit Cash auf einen fairen Marktwert von etwa 600 Mio$ für Cytomx nach jetzigem Stand. 1 Milliarde finde ich nach aktuellem Datenstand eine Spur zu optimisitisch, aber auf jeden Fall im Rahmen der Unsicherheiten. Mit einem klinischen Erfolg Erfolg und ein bißchen Übertreibung kann das mittelfristig durchaus zu erreichen sein.
Ach so und zur Mara: Ihre Erfolgsquote ist unter 50%. Von der Statisitik her sollte man Ihren Empfehlungen also eher nicht glauben, sprich Cytomx verkaufen.
Antwort auf Beitrag Nr.: 69.836.294 von Lynvestor am 07.11.21 14:10:33Danke für Deine ausführliche Einschätzung.👍🏻
Antwort auf Beitrag Nr.: 69.809.145 von Lynvestor am 04.11.21 17:26:40
Guckst Du noch oder hast du schon?
Zitat von Lynvestor: Ich bin mal hier rüber gehüpft vom HDP Thread aus auf Hinweis von bcgk.
Guckst Du noch oder hast du schon?

Antwort auf Beitrag Nr.: 69.837.776 von bcgk am 07.11.21 18:49:18
Ich gucke noch. Ich hoffe, dass es nochmal runtergeht. Ich bin eher so der Schnaeppchenjaeger. Ich denke bei 5 $ war es ein sehr guter Kauf .
.

Ich gucke noch. Ich hoffe, dass es nochmal runtergeht. Ich bin eher so der Schnaeppchenjaeger. Ich denke bei 5 $ war es ein sehr guter Kauf
 .
.
$6.84
Das läuft gerade sehr geschmeidig
Das läuft gerade sehr geschmeidig

Antwort auf Beitrag Nr.: 69.846.965 von bcgk am 08.11.21 17:07:45 Auf gehts Richtung 16 USD.
Auf gehts Richtung 16 USD.
 Auf gehts Richtung 16 USD.
Auf gehts Richtung 16 USD.
Schade die 7 USD haben heute nicht gehalten, morgen auf ein neues.
Einfach mal den Langfristchart anschauen und sehen, wo die AKtie 2017 und 2018 stand ohne ansatzweise dieselbe Validierung wie heute.
Bekommen wir gute P2 Daten und initiiert man P3 Studien, geht das hier richtig ab. Super kleiner Float mit nur 65m Aktien. Das poppt.
Bekommen wir gute P2 Daten und initiiert man P3 Studien, geht das hier richtig ab. Super kleiner Float mit nur 65m Aktien. Das poppt.
Antwort auf Beitrag Nr.: 69.859.937 von bcgk am 09.11.21 15:11:05Lass die Rakete starten. Ein schönes Weihnachtsgeschenk wäre nicht schlecht.😂😂😂😂
CytomX nimmt an zwei Konferenzen teil.
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://ir.cytomx.com/news-releases/news-release-details/cyt…
Was meint Ihr erwartet uns auf den Konferenzen was überraschendes?
Antwort auf Beitrag Nr.: 69.903.464 von Hitman2 am 12.11.21 17:38:46Nö, ich warte auf Initial Data zu CX-2029 und dann im kommenden Jahr auf CX-2009. Es braucht einfach dringend eine Neubewertung. Cash plus 20% ist einfach vollkommen lächerlich.
Wo werden die Daten zuerst veröffentlicht?
Wenn die Daten veröffentlicht werden stelle ich hier einen Link ein. Der Termin steht aber nicht fest.
BTIG Research mit neuem Kursziel von 16 USD.
https://247wallst.com/investing/2021/11/15/mondays-top-analy…
https://247wallst.com/investing/2021/11/15/mondays-top-analy…
Antwort auf Beitrag Nr.: 69.921.854 von Hitman2 am 15.11.21 15:38:56Derzeit einfach bockstark. Outperformt den XBI jeden einzelnen Tag (seit meinem Einstieg). So ein Timing gelingt mir leider zu selten 

Antwort auf Beitrag Nr.: 69.936.365 von bcgk am 16.11.21 18:39:49Läuft im Moment in die richtige Richtung. Mal schauen wie es die nächsten Tage weiter geht. Bis 16USD ist noch ein langer Weg.😂
Antwort auf Beitrag Nr.: 69.938.027 von Hitman2 am 16.11.21 20:52:19Ja, das Momentum kann auch wieder ganz schnell verschwinden. Ein 50% Move wird gerne auch mal konsolidiert. Die Aktie bleibt aber außerordentlich günstig, solange die Studien gute Ergebnisse bringen sollten.
Wenn der gesamte Sektor sich mal wieder veräppeln sollte, müsste CTMX aber den angepeilten $16 deutlich näher kommen.
Wenn der gesamte Sektor sich mal wieder veräppeln sollte, müsste CTMX aber den angepeilten $16 deutlich näher kommen.
Antwort auf Beitrag Nr.: 69.942.137 von bcgk am 17.11.21 10:49:45Der Sektor macht im Moment nicht wirklich Freude.
Antwort auf Beitrag Nr.: 69.942.416 von Hitman2 am 17.11.21 11:07:38Erster Angriff auf $7.50 ist kläglich gescheitert.
Der Sektor ist im Moment echt zum 🤮. Dafür hat sich CytomX heute doch noch ganz wacker geschlagen.
Hab heute das erste Drittel mit 50% vor Steuern verkauft.
Gab es News oder macht einer Kasse?
Antwort auf Beitrag Nr.: 70.135.490 von Hitman2 am 06.12.21 17:10:19Nachdem ich hier zu ~ $6.8 raus bin, habe ich soeben wieder angefangen mich einzukaufen.
Das sieht nach Komplettabsturz aus. Fehlen nur noch negative Daten zu 2029 dann wird es bitter.
https://seekingalpha.com/article/4475240-cytomx-ctmx-stock-p…
CytomX: Pullbacks Are Opportunities
Dec. 14, 2021 5:17 PM ETCytomX Therapeutics, Inc. (CTMX)
Summary
CTMX went up 50% since my September coverage but is down to 25% now.
They had exciting news about a patent dispute and will present two key misstated datasets in the next 2-3 months.
Any pullback here is an opportunity.
CytomX: Pullbacks Are Opportunities
Dec. 14, 2021 5:17 PM ETCytomX Therapeutics, Inc. (CTMX)
Summary
CTMX went up 50% since my September coverage but is down to 25% now.
They had exciting news about a patent dispute and will present two key misstated datasets in the next 2-3 months.
Any pullback here is an opportunity.
Mal gespannt wie die Daten ausfallen.
Die Daten scheinen nachbörslich nicht gut anzukommen.
Antwort auf Beitrag Nr.: 70.136.444 von bcgk am 06.12.21 18:10:07
Deine Aktie würde ich nicht mal mit der Kneifzange anfassen.
Zitat von bcgk: habe ich soeben wieder angefangen mich einzukaufen
Deine Aktie würde ich nicht mal mit der Kneifzange anfassen.
Was sagt Ihr zu den Daten?
Antwort auf Beitrag Nr.: 70.286.295 von Hitman2 am 21.12.21 11:42:53
Gute Theorie. Funktioniert praktisch nicht.
Zitat von Hitman2: Was sagt Ihr zu den Daten?
Gute Theorie. Funktioniert praktisch nicht.
Mal schauen ob es bei den knapp 20% Minus bleibt oder ob es noch weiter in den Keller geht.
insgesamt recht enttäuschende Daten. Ich bin hier raus
Antwort auf Beitrag Nr.: 70.287.189 von StellaVella am 21.12.21 12:47:33
Ja, war aber bereits bei dem Kursverlauf abzusehen bzw zu befürchten. Konnte man von unter 5 auf über 7 aber gut traden, eine Aktie weniger, die man beobachten muss.
Zitat von StellaVella: insgesamt recht enttäuschende Daten. Ich bin hier raus
Ja, war aber bereits bei dem Kursverlauf abzusehen bzw zu befürchten. Konnte man von unter 5 auf über 7 aber gut traden, eine Aktie weniger, die man beobachten muss.
Antwort auf Beitrag Nr.: 70.288.251 von bcgk am 21.12.21 14:18:46
Gelegentlich muss man auch das Unternehmen verstehen. Das Unternehmen ist, nachdem die Technologie gescheitert ist, quasi wertlos ! - Na gut Bitcoin ist auch wertlos, aber da glauben zumindest noch ein paar Marktteilnehmer dan.
Zitat von bcgk:Zitat von StellaVella: insgesamt recht enttäuschende Daten. Ich bin hier raus
Ja, war aber bereits bei dem Kursverlauf abzusehen bzw zu befürchten. Konnte man von unter 5 auf über 7 aber gut traden, eine Aktie weniger, die man beobachten muss.
Gelegentlich muss man auch das Unternehmen verstehen. Das Unternehmen ist, nachdem die Technologie gescheitert ist, quasi wertlos ! - Na gut Bitcoin ist auch wertlos, aber da glauben zumindest noch ein paar Marktteilnehmer dan.
Wir dürften jetzt auf NC Niveau liegen.
Antwort auf Beitrag Nr.: 70.290.323 von Hitman2 am 21.12.21 18:17:11
Irrelevant. Die Technologie hat versagt. Damit ist das Unternehmen quasi wertlos.
Zitat von Hitman2: Wir dürften jetzt auf NC Niveau liegen.
Irrelevant. Die Technologie hat versagt. Damit ist das Unternehmen quasi wertlos.
Der Cashbestand dürfte noch bei knapp 300 Millionen liegen. Können dann noch ein paar Jahre Geld verbrennen.
Zu Zeiten von Joschka, Ville und Pathfinder war ich hier oft investiert- irgendwie hat es sich schon lange abgezeichnet was heute Realität ist…
Puh. Letzte Woche komplett alles verkauft 👌😅
Hatte hier mal eine wirklich große Position. Den Großteil schon im Februar abgeladen, dann nochmal vor paar Wochen über $7. Hätte jetzt aber auch nicht mit so einem großen Abschlag gerechnet
Hatte hier mal eine wirklich große Position. Den Großteil schon im Februar abgeladen, dann nochmal vor paar Wochen über $7. Hätte jetzt aber auch nicht mit so einem großen Abschlag gerechnet
Na wenigstens ein Analyst ist noch positiv gestimmt.
https://www.marketbeat.com/instant-alerts/nasdaq-ctmx-a-buy-…
https://www.marketbeat.com/instant-alerts/nasdaq-ctmx-a-buy-…
Der muss noch abladen

Ich wünsche allen ein schönes Weihnachtsfest.🎅🎄🎁
hier war eher wichtig rechtzeitig rauszugehen oder die bandbreite von 5 bis 7 zu nutzen um verluste zu minimieren/gewinne zu machen. denke da kommt nichts großartiges mehr. viel glück den investierten, ich bin vor einiger zeit mit einem kleinen gewinn raus.
Antwort auf Beitrag Nr.: 70.136.444 von bcgk am 06.12.21 18:10:07Yep, als ich sah dass bcgk diese Aktie kauft:
da rannte ich weg, so schnell wie möglich, um nicht nur annähernd auf den Gedanken zu kommen mir das Schrott-Papier ins Depot zu holen.
bcgk ist als Kontraindikator bei solchen Aktien sehr zuverlässig.
Zitat von bcgk: habe ich soeben wieder angefangen mich einzukaufen
da rannte ich weg, so schnell wie möglich, um nicht nur annähernd auf den Gedanken zu kommen mir das Schrott-Papier ins Depot zu holen.
bcgk ist als Kontraindikator bei solchen Aktien sehr zuverlässig.
Antwort auf Beitrag Nr.: 70.319.810 von Malecon am 26.12.21 13:30:59genau, da hätte man doch besser in Metacrine investiert

Ich wünsche allen einen guten Rutsch ins neue Jahr.🥂
Wie schätzt Ihr die Aussichten für 2022 ein???
Neue Präsentation.
https://ir.cytomx.com/static-files/f62ef51f-c28f-42ed-87ba-2…
https://ir.cytomx.com/static-files/f62ef51f-c28f-42ed-87ba-2…
Antwort auf Beitrag Nr.: 70.390.246 von Hitman2 am 04.01.22 15:29:02 Bitte löschen, die Präsi ist alt.
Bitte löschen, die Präsi ist alt.
 Bitte löschen, die Präsi ist alt.
Bitte löschen, die Präsi ist alt.
Ein SEC Filing von gestern.
https://ir.cytomx.com/financial-information/sec-filings
https://ir.cytomx.com/financial-information/sec-filings
CytomX Therapeutics präsentiert auf der 40. jährlichen J.P. Morgan Healthcare Konferenz, erwartet Ihr Neuigkeiten?
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://ir.cytomx.com/news-releases/news-release-details/cyt…
Die Infos zu der J.P. Morgan Healthcare Conference.
https://ir.cytomx.com/static-files/b4940438-8ed7-4757-a34f-0…
https://ir.cytomx.com/static-files/b4940438-8ed7-4757-a34f-0…
Ist der Laden noch zu retten?
CytomX Therapeutics gibt FDA-Freigabe der experimentellen neuen Arzneimittelanwendung für CX-904 zur Behandlung fortgeschrittener solider Tumoren bekannt.
https://ir.cytomx.com/news-releases/news-release-details/cyt…
https://ir.cytomx.com/news-releases/news-release-details/cyt…
Was haltet Ihr von dem Kursziel von 7 USD das Barclays gestern mitteilte?
https://www.marketbeat.com/instant-alerts/nasdaq-ctmx-a-buy-…
https://www.marketbeat.com/instant-alerts/nasdaq-ctmx-a-buy-…
Attraktive Lücke nach oben vs. absteigende Dreieckformation - wer setzt sich durch?

🤔

🤔
Antwort auf Beitrag Nr.: 70.569.269 von Malecon am 19.01.22 22:41:42finger weg, wennsd ruhig schlafen willst.
Die 7 USD kommen wohl erst Ende 2022😎
immer nur Inducement Grants
CytomX Therapeutics
CytomX Therapeutics präsentiert auf der 42. jährlichen Gesundheitskonferenz von Cowenhttps://ir.cytomx.com/news-releases/news-release-details/cyt…
CytomX
Heute mal wieder ein neues 52 Wochentief markiert. Das sieht im Moment nicht gut aus, wie ist Eure Meinung dazu? CytomX
Hat jemand eine Erklärung für den Absturz?
Antwort auf Beitrag Nr.: 71.175.283 von Hitman2 am 23.03.22 15:05:14Etwas recherchiert ob ich in die Ausbildung der ATL einen erneuten Einstieg wage. Seit Mitte März sackt die Aktie aus ihrem langfristigen Abwärtstrendkanal bei etwa 3,20 USD nach unten ab. Ursache wäre wohl nun auch das 424B5 filing vom 03.04.2022: Verwässerung und Aktienumlauf wird erhöht. Außerdem wurde das Sell Target für den Aktienumlauf erhöht. Könnte sein das nun durch Jefferies LLC Aktien in den Markt gedrückt werden. Außerdem insgesamt das Makroumfeld (Kapitalmarktzinsen steigen, machen solche Titel eher wieder uninteressant) plus die wohl höher erwartete indikative ORR von 18,8% von CX2009 gemeldet in 12/2021 belasten.
Die Marktkapitalisierung von rund 177 Mio USD liegt nun ziemlich weit unterhalb des Cashbestandes 305,23 Mio USD. Ein Swingtrade könnte die Verbreitung des Überblick über den Status der Cytokin Probody Therapie aus den präklinischen Studien auf der AACR ab 08.04.2022 wert sein. Insgesamt ist es um die Cytokin Therapie Pipelines ziemlich ruhig. Insbesondere die inhaltliche Kooperation mit Astellas Pharma lässt sich kaum recherchieren. Die indikative ORR von CX2009 war imo auf Ziel allerdings mit ausgeprägten TRAE Level 2,3 vor allem Blutarmut. Langfristig wird es hier wieder ab Ende des Jahres mit zusätzlichen Daten zu CX2009 bzw. 2024 mit den zu erwartenden Daten der BMS Kooperationspipelines BMS-986249 interessant.
Mit meiner letzten Position bin ich rot ausgestoppt wurden. Spannend bleibt CytomX vielleicht auch weil Instis wie Point72 AM, Vanguard und Blackrock nach dem Absacker im Dezember ihre Positionen zum Teil noch ausgebaut haben und andere massiv eingestiegen sind. Das muss nach den anstehenden Berichten 03/22 anschauen wer hier gerade abverkauft. Allerdings ist und bleibt es ein hochspekulativer Titel. Eine Bodenbildung steht noch aus.
Gruß
JM
Die Marktkapitalisierung von rund 177 Mio USD liegt nun ziemlich weit unterhalb des Cashbestandes 305,23 Mio USD. Ein Swingtrade könnte die Verbreitung des Überblick über den Status der Cytokin Probody Therapie aus den präklinischen Studien auf der AACR ab 08.04.2022 wert sein. Insgesamt ist es um die Cytokin Therapie Pipelines ziemlich ruhig. Insbesondere die inhaltliche Kooperation mit Astellas Pharma lässt sich kaum recherchieren. Die indikative ORR von CX2009 war imo auf Ziel allerdings mit ausgeprägten TRAE Level 2,3 vor allem Blutarmut. Langfristig wird es hier wieder ab Ende des Jahres mit zusätzlichen Daten zu CX2009 bzw. 2024 mit den zu erwartenden Daten der BMS Kooperationspipelines BMS-986249 interessant.
Mit meiner letzten Position bin ich rot ausgestoppt wurden. Spannend bleibt CytomX vielleicht auch weil Instis wie Point72 AM, Vanguard und Blackrock nach dem Absacker im Dezember ihre Positionen zum Teil noch ausgebaut haben und andere massiv eingestiegen sind. Das muss nach den anstehenden Berichten 03/22 anschauen wer hier gerade abverkauft. Allerdings ist und bleibt es ein hochspekulativer Titel. Eine Bodenbildung steht noch aus.
Gruß
JM
Antwort auf Beitrag Nr.: 71.209.083 von Jerry_Maguire am 28.03.22 10:38:02Vielen Dank für Deine ausführliche Antwort. 👍 Ich wünsche Dir einen guten Start in die neue Woche.
👍 Ich wünsche Dir einen guten Start in die neue Woche.
 👍 Ich wünsche Dir einen guten Start in die neue Woche.
👍 Ich wünsche Dir einen guten Start in die neue Woche.
Erstaunlich das bei dem Preis keiner der Großen den Laden übernimmt.
Antwort auf Beitrag Nr.: 71.175.283 von Hitman2 am 23.03.22 15:05:14wieso Erklärung für Absturz bist du ein Greenhorn?
Wenn Du hier auf Schlaumeier machst dann erkläre einem Greenhorn doch mal den Absturz.
Antwort auf Beitrag Nr.: 71.363.410 von Hitman2 am 14.04.22 21:54:07erkläre doch mal zuerst nach welchen Kriterien du Aktien aussuchst?
CytomX
CytomX Therapeutics to Present at Jefferies 2022 Global Healthcare Conferencehttps://ir.cytomx.com/news-releases/news-release-details/cyt…
CytomX
CytomX Therapeutics präsentiert auf den kommenden virtuellen Investorenkonferenzen im Augusthttps://ir.cytomx.com/press-releases
CytomX
CytomX Therapeutics meldet Finanzergebnisse für das dritte Quartal 2022 und liefert Geschäftsaktualisierunghttps://ir.cytomx.com/press-releases/
Bei der Pipeline und geringen Marketcap. konnte ich nicht widerstehen, plus der Deal von gestern mit Regeneron.
https://cytomx.com/pipeline/#advancing-pipeline
https://cytomx.com/pipeline/#advancing-pipeline
Ich wünsche allen einen guten Start ins neue Jahr.
Hallo hitman2,
auch Dir ein gutes und erfolgreiches Neues Jahr.
Ende der Woche gibt es ein Business Update. Auf stocktwits wird spekuliert, dass ctmx den Produktkandidaten 2209 in Zusammenarbeit mit Abbvie nicht weiter entwickeln wird. Wie siehst du das?
Beste Grüße, blitzableiter
auch Dir ein gutes und erfolgreiches Neues Jahr.
Ende der Woche gibt es ein Business Update. Auf stocktwits wird spekuliert, dass ctmx den Produktkandidaten 2209 in Zusammenarbeit mit Abbvie nicht weiter entwickeln wird. Wie siehst du das?
Beste Grüße, blitzableiter
Hallo Blitzableiter
Danke. Das Update kommt am 5.1.22 und am 11.1.22 ist man dann auf der J.P. Morgan Healthcare Conference. Gute Frage, also am 5.1 mitzuteilen das 2209 gescheiert ist und dann an der Conference teilzunehmen macht aus meiner Sicht keinen Sinn. Der Kurs ist sowieso ein Witz, der ganze Deal mit Regeneron ist meiner Meinung nach nicht eingepreist. Sollte 2209 eingestellt werden kann ich mir nicht vorstellen das das den Kurs groß beeinflusst.
Das Update kommt am 5.1.22 und am 11.1.22 ist man dann auf der J.P. Morgan Healthcare Conference. Gute Frage, also am 5.1 mitzuteilen das 2209 gescheiert ist und dann an der Conference teilzunehmen macht aus meiner Sicht keinen Sinn. Der Kurs ist sowieso ein Witz, der ganze Deal mit Regeneron ist meiner Meinung nach nicht eingepreist. Sollte 2209 eingestellt werden kann ich mir nicht vorstellen das das den Kurs groß beeinflusst.Mal schauen was passiert.
Das mit Abbvie ist nicht 2209 sondern müsste 2029 sein.
Ja, war ein Zahlendreher meinerseits.
Hier die entsprechende Pressemitteilung.
https://finance.yahoo.com/news/cytomx-therapeutics-outline-2…
Was erwartest du bzgl. 2029. Ein Update war eigentlich für Dezember 2022 vorgesehen. Warum wurde das in den Januar verschoben? Die Pipeline ist ja sehr breit und es gibt eine neue Kooperation mit Regeneron. Sollte 2029 nicht weiter verfolgt werden gibt es noch genügend andere vielversprechende Kandidaten.
Hier die entsprechende Pressemitteilung.
https://finance.yahoo.com/news/cytomx-therapeutics-outline-2…
Was erwartest du bzgl. 2029. Ein Update war eigentlich für Dezember 2022 vorgesehen. Warum wurde das in den Januar verschoben? Die Pipeline ist ja sehr breit und es gibt eine neue Kooperation mit Regeneron. Sollte 2029 nicht weiter verfolgt werden gibt es noch genügend andere vielversprechende Kandidaten.
Antwort auf Beitrag Nr.: 73.008.572 von Blitzableiter am 02.01.23 18:28:38Ich könnte mir auch vorstellen das man 2029 aus Kostengründen einstellt. Meiner Meinung nach dürfte das den Kurs aber nicht groß beeinflussen. Wenn ich richtig gerrechnet habe liegt der Netcash bei ca. 2,60 USD, also noch richtig Luft nach oben.
CytomX
Mal gespannt was das Update uns morgen bringt.
Ich bin gestern +/- Null raus, ist mir zu heiß. Lieber wieder einsteigen, wenn klare Verhältnisse vorliegen. Drücke Dir die Daumen!
Danke.👍 Ich bin ganz entspannt und lass mich überraschen was passiert.
Da haste alles richtig gemacht, Glückwunsch! Und ich habe eine gute Chance verpasst! So ist Börse😎
Sehr schöner Deal mit einem sehr namhaften Partner. Der Vorstand scheint richtig was drauf zu haben 😁
Antwort auf Beitrag Nr.: 73.034.489 von Blitzableiter am 05.01.23 22:41:03
CytomnX
Danke. Ich werde nicht verkaufen und alles mit einem Stop absichern. Mit den zwei fetten Deals nächste Woche auf die J.P. Morgan Healthcare Conference und die Tage vielleicht noch positive Analystenstimmen da müssten Meiner Meinung nach 4-5 USD drin sein. Allen ein schönes Wochenende. CytomX
J.P. Morgan Healthcare Conferencehttps://ir.cytomx.com/static-files/12589aca-4c4d-4b30-8713-8…
CytomX
CytomX vor Neubewertung: „Gewaltiges Momentum“https://www.wallstreet-online.de/nachricht/16425134-cytomx-n…
Wie sagt man so schön "Totgesagte leben länger"...
Antwort auf Beitrag Nr.: 73.076.015 von nionus am 12.01.23 13:16:32Sieht ganz so aus. Mal schauen was der Ami heute so macht, es bleibt spannend. Netcash dürfte bei ca. 3USD liegen.
Hallo hitman2,
Bin gestern in USA zu $2,65 wieder eingestiegen. Ich habe zwar einen schönen Kursanstieg verpasst, sehe aber noch deutliches Potential nach oben. Die Pipeline und verschiedenen Kooperationen sind schon beeindruckend. Und ganz wichtig: Das Management ist Top.
Was ich bei CTMX verpasst habe, konnte ich bei drei anderen Biotechwerten kompensieren, denen ich auch sehr viel zutraue. Wenn du willst, kannst du dir die Werte einmal anschauen:
Fortress Biotech
Briacell Therapeutics
Syros
Ein weiterer Kandidat in den ich demnächst einsteigen werde ist Purple Biotech.
Bin gestern in USA zu $2,65 wieder eingestiegen. Ich habe zwar einen schönen Kursanstieg verpasst, sehe aber noch deutliches Potential nach oben. Die Pipeline und verschiedenen Kooperationen sind schon beeindruckend. Und ganz wichtig: Das Management ist Top.
Was ich bei CTMX verpasst habe, konnte ich bei drei anderen Biotechwerten kompensieren, denen ich auch sehr viel zutraue. Wenn du willst, kannst du dir die Werte einmal anschauen:
Fortress Biotech
Briacell Therapeutics
Syros
Ein weiterer Kandidat in den ich demnächst einsteigen werde ist Purple Biotech.
Hi Blitzableiter,
ich sehe auch noch deutliches Potential nach oben, der Ami hat es heute noch nicht auf den Zettel was das für eine Perle ist.
Im Juni 2020 standen wir mal bei knapp 8 USD. Danke, ich schaue mir die Werte die Tage mal an.
ich sehe auch noch deutliches Potential nach oben, der Ami hat es heute noch nicht auf den Zettel was das für eine Perle ist.
Im Juni 2020 standen wir mal bei knapp 8 USD. Danke, ich schaue mir die Werte die Tage mal an.
Mal gespannt wie es diese Woche läuft.
CytomX
B. Riley Securities’ 3rd Annual Oncology Conferencehttps://ir.cytomx.com/events/event-details/b-riley-securitie…
CytomX
CytomX Therapeutics gibt Meilenstein in der Probody® T-Cell-Engage mit der bispezifischen (TCB) Zusammenarbeit mit Astellas bekannthttps://ir.cytomx.com/press-releases
oh oh das sieht nicht gut aus......
falls die knete weg ist kann es hier zur inso kommen.
Hä das musst du uns mal erklären. Vorallem im Bezug auf die Nachricht.
Unfassbar, der NC liegt bei 2,90 USD und der Kurs dümpelt bei 1,70 USD rum und das nach den ganzen Deals.
CytomX
Heute nach Börsenschluss müssten die Zahlen kommen. Fisch alles verkauft
Hat wieder schöne 10% mit euch verdient. Was für schlechte zahlen
Oh mein gott.CytomX Therapeutics (CTMX) came out with a quarterly loss of $0.42 per share versus the Zacks Consensus Estimate of a loss of $0.21. This compares to loss of $0.40 per share a year ago. These figures are adjusted for non-recurring items.
This quarterly report represents an earnings surprise of -100%. A quarter ago, it was expected that this biopharmaceutical company would post a loss of $0.32 per share when it actually produced a loss of $0.35, delivering a surprise of -9.38%.
Da gehn die kleinen sharedeal
Lemminge auf die barikaden. LoolDer grossmwister gestern alle an euch trottel verscherbelt.
CytomX
Das Programm mit Abbvie wurde eingestellt das dürfte für den Kursrückgang nachbörslich verantwortlich sein. Die bude hat fertig
Zahlen für FY22Umsatz 53 Mio. $
Verlust 99 Mio. $
Cash 194 Mio. $
MK 118 Mio. $
- CytomX to evaluate future development opportunities for CX-2029 (conditionally activated CD71-directed ADC) and pursue additional strategies for CD71 targeting following AbbVie’s decision not to advance the program into additional clinical studies
ir.cytomx.com/news-releases/...ear-2022-financial-results-and
Negatives Eigenkapital.
Schornstein alle verarscht. Spro, bolt,mainz usw alle raketen am arsch.
Antwort auf Beitrag Nr.: 73.565.502 von sw1975 am 28.03.23 11:50:48


 Du kennst garantiert die Pipeline nicht und mit welchen Partnern man zusammenarbeitet und das da genug Geld in die Kasse kommt. Dann schau Dir mal die letzten Deals an bevor Du irgendwelchen Müll schreibst.
Du kennst garantiert die Pipeline nicht und mit welchen Partnern man zusammenarbeitet und das da genug Geld in die Kasse kommt. Dann schau Dir mal die letzten Deals an bevor Du irgendwelchen Müll schreibst.
CytomX
Die Bude hat fertig. 


 Du kennst garantiert die Pipeline nicht und mit welchen Partnern man zusammenarbeitet und das da genug Geld in die Kasse kommt. Dann schau Dir mal die letzten Deals an bevor Du irgendwelchen Müll schreibst.
Du kennst garantiert die Pipeline nicht und mit welchen Partnern man zusammenarbeitet und das da genug Geld in die Kasse kommt. Dann schau Dir mal die letzten Deals an bevor Du irgendwelchen Müll schreibst. hier mal eine aussage von einem experten
Ob Meilensteine jemals zur Auszahlung kommen steht in den Sternen. Dazu müssten die Programme zur Zulassung gebracht werden und Umsätze generieren. Davon ist CMTX meiner Meinung nach meilenweit entfernt. Bis auf ein paar Partnerschaften mit Vorabzahlungen im niedrigen zweistelligen Bereich, konnte ich hier noch keinen technologischen Durchbruch erkennen, im Gegenteil, es gab schon einige Flops und BMY hat sich bei BMS-986249 (ipilimumab-Probody) zurückgezogen. Zusätzlich hat AbbVie von die Entwicklung der Anti-CD71 PDC CX-2029 beendet.das war wieder mal ne nullnummer von sharedeal
Antwort auf Beitrag Nr.: 73.585.704 von sw1975 am 30.03.23 18:26:20



 hier mal eine aussage von einem experten 🙈
hier mal eine aussage von einem experten 🙈




 hier mal eine aussage von einem experten 🙈
hier mal eine aussage von einem experten 🙈
Antwort auf Beitrag Nr.: 73.585.704 von sw1975 am 30.03.23 18:26:20Experten? Der war gut 🤣
Ist ja klar, dass Meilensteinzahlungen nicht immer und fast nie vollständig gezahlt werden, sonst würden die hunderte Millionen/ Milliarden auch im Chart zu sehen sein.
CytomX
Die Pipeline wurde angepasst: BMS-986288 jetzt auch in Phase 2 CytomX
Mal schauen ob wir heute das GAP schließen, müsste bei 1,70 USD sein.
Das Gap müsste geschlossen sein.
CytomX
Corporate Presentation April 2023https://ir.cytomx.com/static-files/b06ffdf6-e689-4648-b7d1-c…
das letzte unternehmen
was von sharedeal gepusht wurde und als jahrhundwertchance dargrstellt wurde war heat.haben auch im krebsbereich geforscht.mittlerweile pleite.wird hier auch so kommen.immerhin immer noch mit 100 mio bewertet.die 200 mio auf dem konto wird von der pipline aufgefressen.
Heat ist Pleite? Die wurden in Nighthawk umbenannt. Die Aktien wurden 1:1 getauscht. Ich gebe Dir Recht der Laden steht im Moment ziemlich schlecht da und den dürfte, wenn nicht ein Wunder passiert die Kohle ausgehen. Das hat aber nichts mit CytomX zutun.
scheint jetzt zu drehn
laut update auf der webseite werden noch 4 katalyst für dieses jahr erwartet.das könnte spannend werden da der kurs grade meiner meinung nach ziemlich tief steht.grund ist die gesammtarktlage.könnte eine gute chance sein da die pushertruppe bei guten daten wieder aktiv wird.hab mich mal eingedeckt um 1,3 euro. Ein- und Ausstiegskurs sind Alles
Die Ansätze und Recherchen des Clubs sindschon prima, war auch dabei und einigermaßen noch gut raus gekommen.
Ein- und Ausstiegskurs und sind jedoch ASMBlles,
da sind einige auch schon gehörig auf die Fresse gefallen
Mittlerweile viel EIgen DD und enspannt...
die 5 bigpharma die hier beim ctmx
mitmischen sind ja kein betrug.vieles noch in phase 1 aber immer wieder werden hier erfolgsmeldungen kommen und meilensteinzahlungen auslösen.von daher ist das level derzeit sehr interessant.derzeitige MK 70 mio euro das ist echt ein witz.jede gute meldung wird zur kursexplosion führen.ob die dann nachhaltig ist muss jeder selber einschätzen.2 sachen sind in der endphase und für dieses jahr gibts noch daten. ich rechne in den nächsten 8 wochen mit guten news.mal sehn wie weit es geht dann.

chart hat ja jetzt gedreht wie man sieht und das auch noch gegen den allgemeinen markttrend.das ist ein gutes zeichen für mich.denke wir sehn bald kurse über 2 euro.
Antwort auf Beitrag Nr.: 74.671.087 von sw1975 am 21.10.23 18:06:19An der Technologie vob ctmx gibt es Zweifel. ... Viel Spass beim Zocken mit einem Halbtoten.
Gestern noch mal fett gemacht
die position.biotechindex sollte jetzt bald mal drehn.kurs hier sollte langsam wieder richtung 1.8 gehn.mit daten wird es über 2 euro schiessen.dies ist jetzt die chance unten fett einzusteigen. CytomX
Was haltet Ihr von der Pipeline? Beitrag zu dieser Diskussion schreiben
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,72 | |
| -0,82 | |
| +1,11 | |
| -0,51 | |
| +0,46 | |
| +3,75 | |
| +0,67 | |
| -0,97 | |
| -3,22 | |
| +1,61 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 233 | ||
| 108 | ||
| 97 | ||
| 87 | ||
| 62 | ||
| 38 | ||
| 36 | ||
| 36 | ||
| 33 | ||
| 32 |
CytomX - ein bahnbrechender Ansatz in der Tumortherapie





















